Разделяй и властвуй
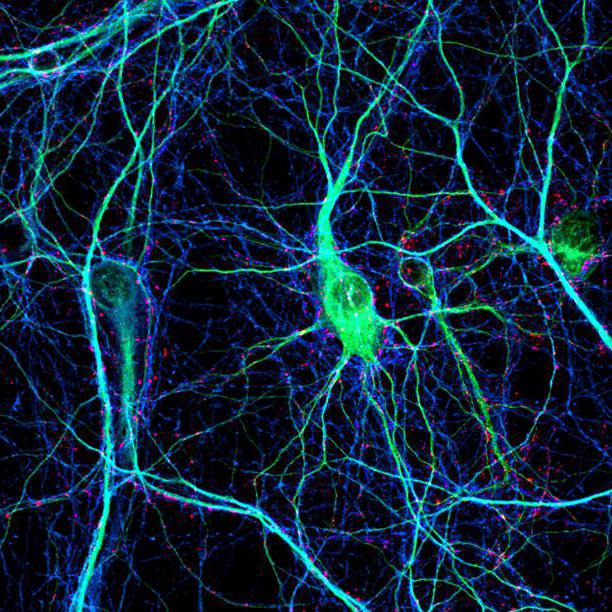
Импульсы плывут туда, куда ведут аксоны. Каждый аксон тонкой ниточкой выходит из тела своего нейрона, прокладывая линию связи от одного к другому. Когда мы говорим о соединении двух нейронов, может показаться, что аксон — это просто провод между нейронами, игрушечная телеграфная линия, две консервные банки на веревке. Но аксон — это не выделенная линия, передающая персональное сообщение одного нейрона единственному приватному адресату.
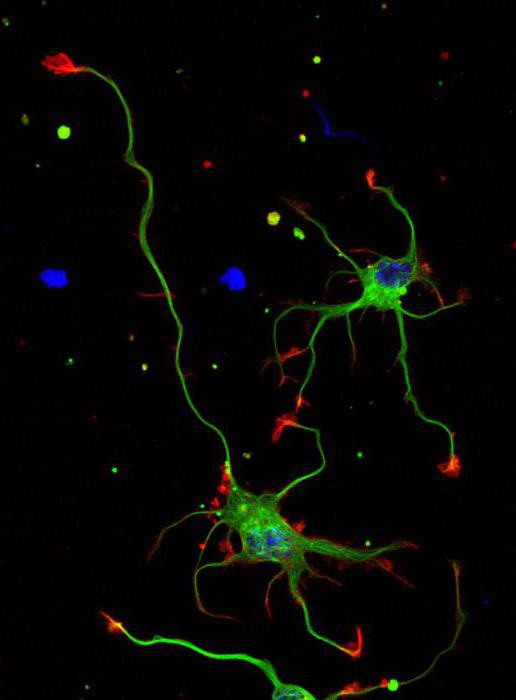
Аксон — извилистая структура, которая многократно раздваивается, яростно ветвится, извивается, скручиваясь и изворачиваясь. Аксон простой клетки, по которому мы несемся, следуя за нашим импульсом, впереди извивается и поворачивает, как быстрая река, разделяясь на протоки больше ста раз. От него отходят ветки, но расположены они неравномерно: одни находятся рядом с телом клетки, другие ответвляются в слоях, расположенных выше и ниже, некоторые — где-то вдалеке от нас. И он такой не один — большинство нейронов в коре головного мозга испускают извилистые заросли аксонов, покрывающих объем, который многократно превосходит размеры родительского нейрона вместе с его дендритным деревом. Поднимаясь над простой клеткой, мы видим возвышающиеся стволы ветвящихся аксонов пирамидальных нейронов третьего слоя. Они делятся сотни раз, одна длинная ветвь каскадом спускается мимо нас, а затем снова и снова расщепляется под нами в пространстве пятого слоя. У нас едва хватает времени осознать эту картину, как наш импульс налетает на первую развилку.
При каждом ветвлении импульс копируется, клонируется, отправляется в каждую новую ветвь, чтобы множество копий сообщения неслись по аксону всё дальше и дальше. Сотни разветвлений на пути вниз. Таким образом из одного импульса, исходящего из тела нейрона, создаются сотни клонов. А те в свою очередь вызывают высвобождение молекул нейромедиаторов в синаптических промежутках на конце каждой из ветвей, потому что соединения между нашим аксоном и дендритами других нейронов разбросаны по всей его длине. Периодически мы пролетаем мимо этих соединений, расположенных через каждые пять микрометров, упакованных настолько плотно, насколько позволяет размер их молекулярного механизма, и каждый готов к сбросу своего молекулярного заряда, чтобы вызвать всплеск напряжения на другой стороне. Мы проходим и через длинные отрезки аксона без единого разветвления, без связей с другими нейронами, часто до странности прямые, — это «магистрали» аксона, предназначенные для передачи импульса в другие зоны коры головного мозга, где вновь будет взрыв ветвления и извивов.
Достигнув конца аксона, наш импульс с помощью клонов успел вступить в контакт с тысячами других нейронов. По другую сторону большинства синаптических промежутков находится другой нейрон.
Таким образом бóльшая часть из примерно 7000 возбуждающих входов одного коркового нейрона принимает сигналы от разных аксонов, исходящих из разных нейронов.
Это означает, что каждый возбуждающий нейрон коры головного мозга через аксон осуществляет соединения примерно с 7000 различными нейронами, что возможно именно благодаря ветвлению и извилистости аксона, когда он изгибается и разделяется после каждого синаптического контакта, чтобы достичь новой цели.
Путем клонирования аксон одного нейрона передает импульс возбуждения тысячам принимающих его нейронов коры головного мозга. Знание, что это за получатели и где именно они расположены, может многое сказать нам о назначении этого нейрона. Чтобы разобраться, какое сообщение несет наш импульс, нам нужно знать две вещи о нейроне, который его отправил. Во-первых, на что реагирует этот нейрон, что в первую очередь вызвало его возбуждение — и мы знаем из предыдущей главы, что это был легион импульсов из сетчатки. Во-вторых, нам нужно понять, куда он отправляет этот импульс, кому тот передается. Ведь аксон может доставлять импульсы в любую область головного мозга. Он может разослать их адресатам по соседству, чтобы возбудить больше однотипных нейронов, то есть усилить и прояснить сообщение. Или, наоборот, унести свое сообщение очень далеко, через всю кору головного мозга, и попасть в дальние области, чтобы там объединиться с другими информационными импульсами, создавая всё более сложные представления и вычисления. Или на другую сторону, пересекая границу между полушариями, чтобы мозг работал слаженно.
По соседству
Первые адресаты нашего импульса — другие простые клетки. Здесь, на месте первого промежуточного пункта назначения, в толще коры головного мозга, в четвертом слое первичной зрительной области, нас окружают такие же простые нейроны. Аксон нашей клетки отходит от нее, извиваясь и многократно разветвляясь, каждая ветка переплетена с дендритными деревьями других простых клеток. И если мы проследим за каждым клонированным импульсом, бегущим к кончикам ветвей аксона и прыгающим через синаптические промежутки, то обнаружим, что многие простые клетки на другой стороне синапсов поразительно похожи на ту, которую мы только что покинули. Они реагируют на одни и те же вещи.
Вопреки своему названию простые клетки представляют собой эклектичное сборище. С одной стороны, они отображают упорядоченную карту видимого мира, исходящую от сетчатки, то есть соседние простые клетки реагируют на сигналы от соответствующих соседних участков окружающего мира.
С другой, десятки информационных каналов, исходящих из сетчатки, поступают в простые клетки, которые нас сейчас окружают. Тридцать с лишним каналов, свой для каждой отдельной зоны видимого пространства — для середины, левого и правого, верхнего и нижнего и т. п. Таким образом наборы простых клеток, сгруппированных вместе, озабочены разными вещами в одном и том же месте наблюдаемого мира: некоторые ждут сообщения о вертикальной линии, другие — о горизонтальной, третьи — под углом 120°; четвертые — 41,3°; некоторые — о краях, созданных пятном света сверху и темной областью снизу, другие — наоборот. И так для каждой возможной комбинации.
Получается, если бы наша простая клетка протянула свой аксон случайным образом, импульс с равной вероятностью попал бы на вход любой из этих эклектичных групп. Но это не так. Исследователи из лаборатории Томаса Мрсич-Флогеля в Университетском колледже Лондона в серии чрезвычайно остроумных экспериментов отслеживали локальные места назначения одиночных импульсов в этой первичной зоне зрительной области.
Они одновременно записывали сигналы сотен нейронов из зрительной коры головного мозга мышей, которые сидели в кинотеатре для мышей и смотрели слайд-шоу и фильмы, чтобы на основе этой активности определить, что из происходящего в пространстве видимого мира и где именно вызывает реакцию каждого нейрона. Узнав, что вызывает возбуждение каждого нейрона — настройку нейрона, — ученые в лаборатории Мрсич-Флогеля собирались установить, какие связи существуют между ними. Они перешли на тонкую и сложную технику регистрации каждого скачка напряжения от горстки нейронов, максимум четырех одновременно. Аккуратно подведя электроды непосредственно к мембране тела каждого нейрона, микроскопической точке в десятки раз меньше толщины человеческого волоса, они начали искать убедительные доказательства прямого соединения между этими нейронами, вызывая генерацию импульса одним из этих нейронов и проверяя наличие последующего скачка напряжения в остальных. Нет скачка — нет связи. Наличие точно регистрируемых всплесков в нейроне Берта после того, как стимулировано возбуждение с отправкой импульса нейроном Алеф, является чертовски убедительным доказательством того, что нейрон Алеф напрямую соединяется с нейроном Берта.
Обнаружив связь, Мрсич-Флогель и его команда могли вернуться к своим записям сотен сигналов мозга мышей, наслаждающихся фильмом, и спросить: на что эти нейроны реагируют в видимом мире?
Сложная работа с простым выводом: вероятность найти связь между двумя нейронами со сходной настройкой весьма велика. Нейроны, которые реагируют на очень похожие вещи в очень похожих местах в видимом мире, тоже, скорее всего, соединены друг с другом. И не просто соединены, а сильной связью. Потому что выяснилось, что сила сигнала между двумя одинаково настроенными нейронами, измеряемая амплитудой всплеска напряжения, также намного больше, чем можно было бы предсказать (рис. 4.1).
Наш импульс отправлен из простой клетки, которая реагирует на края под углом 30° в правом верхнем углу вашего поля зрения, где оказался кончик крышки коробки с печеньем. Эта радостная новость поступила к ней по множеству каналов, выходящих из сетчатки. Локальные ветви ее аксона разослали клоны нашего импульса соседним простым клеткам со сходной реакцией, с настройкой на 30-градусные края в правом верхнем углу видимого мира. И эти нейроны в ответ сделают то же самое, послав один из своих клонированных импульсов обратно тому нейрону, который мы только что покинули.
Работа лаборатории Мрсич-Флогеля продемонстрировала, как мы вместе с нашим импульсом оказались в нейронах, реагирующих на схожие вещи в видимом мире, но не объяснила, почему так происходит. Однако это довольно просто. Как вы помните, чтобы инициировать один исходящий импульс, требуется легион входящих. Итак, если мы хотим, чтобы остальная часть мозга узнала о 30-градусных верхних правых краях, имеет смысл отправить как можно больше импульсов с одним и тем же сообщением, уговорить соседние нейроны посылать свои импульсы, которые присоединятся к нашему в предстоящем путешествии по коре головного мозга.
В этом четвертом слое коры головного мозга нас окружают не только простые клетки. Вокруг много других нейронов, которые реагируют на более сложные комбинации информации, исходящей от глаза; их остроумно назвали «сложными клетками».
Сложные клетки посылают импульсы, когда получают сигнал о том, на что настроены, — о комбинациях светлых и темных пятен. Причем каждая пара светлых и темных пятен находится под определенным углом.
Звучит знакомо? Действительно, простейшее объяснение того, как работает зрение, состоит в том, что сложные ячейки создаются путем объединения входных данных простых ячеек. Каждая простая ячейка является детектором признаков для одного типа границ, а сложная ячейка объединяет выходы нескольких таких детекторов в комбинацию границ. Поэтому клоны нашего импульса также поступают на входы сложных клеток, расположенных вокруг нас, неся сообщение об одной из простых особенностей мира, которые сложная клетка будет суммировать с другими сигналами.
Читайте также
Игра на нервах: как музыка действует на мозг
Эта аккуратная картинка пригодится для понимания принципов, но она не совсем точна. И простые, и сложные нейроны принадлежат континууму нервных клеток различной функциональности. Некоторые нейроны совсем примитивны — они реагируют только на один вид границы, расположенной под одним углом; другие — чрезвычайно сложные, вычисляющие результаты комбинаций простых. Но большинство находятся где-то посередине. Тем не менее все сказанное выше верно для любой клетки зрительной зоны; они с большей вероятностью будут связаны с другими нейронами, имеющими аналогичные настройки на аналогичные изображения в ближайшем окружении в видимом мире.
Axons are very thin nerve fibers that carry nerve impulses away from a neuron (nerve cell) to another neuron. A neuron is responsible for receiving sensory input, sending motor commands to your muscles, and transforming and relaying the electrical signals throughout these processes. Every neuron has one axon that connects it with other neurons or with muscle or gland cells.
Axons come in all lengths, with some spanning the entire length of your body from your spinal cord to your toes. Axons are generally thinner than a piece of human hair.
koto_feja / Getty Images
Structure
Every nerve has axons. The larger the diameter of the axon, the more quickly it can transmit messages. In the innermost part of the nerve are axons that can be typically found inside a myelin sheath.
Myelin is a fatty protective substance that acts as insulation for axons, helping to send signals over long distances. For this reason, myelin is mostly found in neurons that connect different brain regions, rather than in the neurons whose axons remain in the local region.
Function
Axons help with the cable transmission between neurons. They form side branches called axon collaterals so they can send messages to several neurons at once.
These branches split into smaller extensions known as axon terminal branches, or nerve terminals. Each terminal holds a synapse where neurotransmitters send their messages and where messages are received.
Simply put, axons allow nerve cells to send electrical and chemical messages to other nerve, gland, and muscle cells using this internal communication process.
Axon vs. Dendrite
Dendrite is another part of a neuron. It is where a neuron receives input from another cell. Axons and dendrites are both made of fibrous root-resembling materials, but they differ in several ways:
- Length: Axons are generally much longer than dendrites.
- Cell location: Axons are found at the specialized location on a cell body called the axon hillock. Dendrites are seen as branching away from the cell body into what’s called dendritic trees due to their appearance.
- Function: The two work together. Axons help messages move through your body systems, and dendrites receive and process those messages from the axons.
- Quantity: A neuron may have just one axon, while it may have more than one set of dendrites.
Types
A nerve contains bundles of nerve fibers, either axons or dendrites, surrounded by connective tissue. Different types of nerves contain different types of fibers.
Sensory Fibers
Sensory fibers pass impulses or messages from sensors to the brain and toward the central nervous system. These fibers are responsible for sensations like interpreting touch, pressure, temperature, and pain.
Motor Fibers
Motor fibers are behind why you tense your shoulders in response to a potential threat. They send messages to your muscles and glands in response to stimuli, including damage or physical traumas like accidents.
Damage
Acute axon damage is serious and life changing. Severe and diffuse axonal injuries can explain why people with head injury may be limited by a vegetative state. Axonal tears have been linked to lesions responsible for loss of consciousness in people who experience mild head injuries or concussions. Axon damage can result in axon degeneration (loss) and can eventually kill the underlying nerve.
What Causes Head Trauma?
Head trauma can occur from different types of injury, including:
- Physical impact from an event like a motor-vehicle accident or falling from a height
- Injury from an assault or sport injury hemorrhage, contusion, or hematoma
- Scattered brain bruising (contusion)
- Internal bleeding outside of the blood vessel (hematoma)
Axon loss is an early sign of neurodegenerative diseases like:
- Alzheimer’s disease and other memory disorders
- Huntington’s disease
- Parkinson’s disease
- Amyotrophic lateral sclerosis (ALS)
Demyelination
When the fatty myelin sheath begins to thin, a process known as demyelination, the axon’s ability to send signals may become impaired. Some disease states can cause this myelin breakdown.
While the sheath can technically repair itself, damage can be severe enough to kill the underlying nerve fiber. These nerve fibers in the central nervous system cannot fully regenerate.
A demyelinated axon transmits impulses up to 10 times slower than a normal myelinated axon, and a complete stop of the transmission is also possible.
Conditions that can cause demyelination include:
- Multiple sclerosis (MS): MS occurs when the immune system attacks myelin in the brain and spinal cord.
- Acute disseminated encephalomyelitis (ADEM): This is characterized by a brief but widespread attack of inflammation in the brain and spinal cord that damages myelin.
Frequently Asked Questions
What is the axon hillock?
In the nervous system, the axon hillock is a specialized location on a cell body (soma) where the neuron connects to an axon. It controls the firing of neurons.
What are axon terminals?
Axon terminals are located at the end of an axon. This is where messages from neurotransmitters are sent and received.
How does myelin “insulate” an axon?
Myelin insulates an axon by surrounding the thin fiber with a layer of fatty substance protection. This layer is located between the axon and its covering (the endoneurium).
Summary
An axon is a thin fiber that extends from a neuron, or nerve cell, and is responsible for transmitting electrical signals to help with sensory perception and movement. Each axon is surrounded by a myelin sheath, a fatty layer that insulates the axon and helps it transmit signals over long distances.
Verywell Health uses only high-quality sources, including peer-reviewed studies, to support the facts within our articles. Read our editorial process to learn more about how we fact-check and keep our content accurate, reliable, and trustworthy.
-
Du F, Cooper AJ, Thida T, Shinn AK, Cohen BM, Ongür D. Myelin and axon abnormalities in schizophrenia measured with magnetic resonance imaging techniques. Biol Psychiatry. 2013;74(6):451-457. doi:10.1016/j.biopsych.2013.03.003
-
The University of Queensland. Axons: the cable transmission of neurons.
-
National Cancer Institute. The peripheral nervous system.
-
Guedan-Duran A, Jemni-Damer N, Orueta-Zenarruzabeitia I, et al. Biomimetic approaches for separated regeneration of sensory and motor fibers in amputee people: necessary conditions for functional integration of sensory-motor prostheses with the peripheral nerves. Front Bioeng Biotechnol. 2020 Nov 3;8:584823. doi:10.3389/fbioe.2020.584823
-
Medana IM, Esiri MM. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 2003 Mar;126(Pt 3):515-530. doi:10.1093/brain/awg061
-
UCLA Health. Cerebral contusion and intracerebral hematoma.
-
Ding C, Hammarlund M. Mechanisms of injury-induced axon degeneration. Curr Opin Neurobiol. 2019 Aug;57:171-178. doi:10.1016/j.conb.2019.03.006
-
Adamczyk B, Adamczyk-Sowa M. New insights into the role of oxidative stress mechanisms in the pathophysiology and treatment of multiple sclerosis. Oxid Med Cell Longev. 2016 Oct 18;1973834. doi:10.1155/2016/1973834
-
Haines JD, Inglese M, Casaccia P. Axonal damage in multiple sclerosis. Mt Sinai J Med. 2011;78(2):231-243. doi:10.1002/msj.20246
By Michelle Pugle
Michelle Pugle, BA, MA, is an expert health writer with nearly a decade of contributing accurate and accessible health news and information to authority websites and print magazines. Her work focuses on lifestyle management, chronic illness, and mental health. Michelle is the author of Ana, Mia & Me: A Memoir From an Anorexic Teen Mind.
Thanks for your feedback!
| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
Нервная система состоит из нейронов (специфических клеток, имеющих отростки) и нейроглии (она заполняет пространство между нервными клетками в ЦНС). Главное отличие между ними заключается в направлении передачи нервного импульса. Дендриты – это принимающие ответвления, по ним сигнал идет к телу нейрона. Передающие клетки – аксоны – проводят сигнал от сомы к принимающим. Это могут быть не только отростки нейрона, но и мышцы.
Отличия аксонов и дендритов
Какова же разница между ними? Рассмотрим.
- Дендрит нейрона короче передающего отростка.
- Аксон всего один, принимающих ответвлений может быть много.
- Дендриты сильно ветвятся, а передающие отростки начинают разделяться ближе к концу, образуя синапс.
- Дендриты истончаются по мере удаления от тела нейрона, толщина аксонов практически неизменна по всей длине.
- Аксоны покрыты миелиновой оболочкой, состоящей из липидных и белковых клеток. Она выполняет роль изолятора и защищает отросток.
Поскольку нервный сигнал передается в виде электрического импульса, клеткам необходима изоляция. Её функции выполняет миелиновая оболочка. Она имеет мельчайшие разрывы, способствующие более быстрой передаче сигнала. Дендриты – это безоболочечные отростки.
Определение
Мозговое вещество – высокоорганизованная структура, образованная нервными клетками, от которых отходят аксоны. Из нервных клеток состоит мозговая ткань. Аксон в переводе с греческого означает «ось» – это такой отросток, элемент мозгового вещества, который обеспечивает взаимодействие между клетками разного типа (нейроны, клетки иннервируемых органов), что ассоциируется с тонким, четким управлением работой органов и систем. Функции ткани ЦНС:
- Воспринимает раздражения, преобразуя их в импульсы.
- Поддерживает передачу импульсов от управляющих отделов мозга к исполнительным органам.
- Формирует ответную реакцию на раздражающее воздействие.
- Обеспечивает взаимодействие в работе систем и органов, поддерживает интеграцию структурных единиц организма.
- Обеспечивает взаимосвязь организма с внешней средой.
Согласно определению в биологии, аксон (англ. axon) – удлиненный отросток, по которому идут импульсы от тела нейрона к другим нервным клеткам и структурным элементам всех тканей организма. Мозговая ткань в период внутриутробного развития образуется из нервной пластины. Края пластинки прогибаются, что приводит к формированию валиков и желобка. В результате смыкания краев валиков возникает нервная трубка – основа ЦНС.
Дифференциация клеток, образующих трубку, приводит к появлению нейробластов и спонгиобластов. Первые служат основой для формирования нейронов, вторые – для образования нейроглии. Нейроны (анат.) – основные структурные элементы мозгового вещества. Они характеризуются отсутствием функции деления, что приводит к постепенному уменьшению их численности. Тело нейрона состоит из ядра и цитоплазмы. В зависимости от типа нейронов меняется геометрическая форма тела, которая бывает круглая, овальная, пирамидальная и другая.
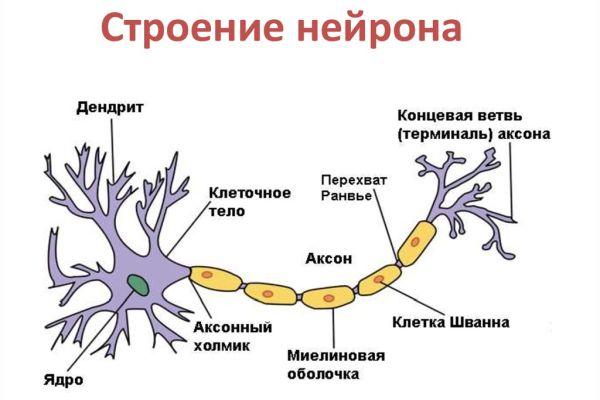
Цитоскелет, состоящий из микротрубочек и нейрофибриллов, обеспечивает опорную и трофическую функцию. Цитоскелет поддерживает форму нейрона, обеспечивает транспорт веществ и органелл. От тела ответвляются отростки – единичный аксон и множественные дендриты. Аксон нейрона почти не ветвится, иногда образует коллатеральные (обходные) сегменты. Концевые сегменты (окончания) разветвляются, называются терминали.
Терминали взаимосвязаны с окончаниями других нейронов и с клетками, образующими паренхиму (ткань) рабочих органов – мышц, желез. Количество дендритов варьируется от 1 до нескольких. Тонкие ответвления дендритов оканчиваются небольшими шипами, где сосредоточены терминали аксональных отростков многих тысяч других клеток. Дендриты воспринимают раздражения или потенциалы действия от других клеток и передают их по волокнам к телу своего нейрона.
Рост аксона зависит от особенностей строения и жизнедеятельности нейрона, который поддерживает функцию питания отростка. К примеру, если перерезать аксональный ствол, сегмент, связанный с телом, остается жизнеспособным и продолжает деятельность, участок, утративший связь с телом, отмирает. Аксоны образуют нервы, что предполагает сложную структурно-морфологическую организацию ЦНС.
Синапс
Место, в котором происходит контакт между ответвлениями нейронов или между аксоном и принимающей клеткой (например, мышечной), называется синапсом. В нем может участвовать всего по одному ответвлению от каждой клетки, но чаще всего контакт происходит между несколькими отростками. Каждый вырост аксона может контактировать с отдельным дендритом.
Сигнал в синапсе может передаваться двумя способами:
- Электрическим. Это происходит только в случае, когда ширина синаптической щели не превышает 2 нм. Благодаря такому маленькому разрыву импульс проходит через него, не задерживаясь.
- Химическим. Аксоны и дендриты вступают в контакт благодаря разнице потенциалов в мембране передающего отростка. С одной ее стороны частицы имеют положительный заряд, с другой – отрицательный. Это обусловлено разной концентрацией ионов калия и натрия. Первые находятся внутри мембраны, вторые – снаружи.
При прохождении заряда увеличивается проницаемость мембраны, и натрий входит в аксон, а калий выходит из него, восстанавливая потенциал.
Сразу после контакта отросток становится невосприимчивым к сигналам, через 1 мс способен к передаче сильных импульсов, через 10 мс возвращается в исходное состояние.
Дендриты – это принимающая сторона, передающая импульс от аксона телу нервной клетки.
Особенности, характерные для типичных дендритов и аксонов
⇐ ПредыдущаяСтр 3 из 14Следующая ⇒
| Дендриты | Аксоны |
| От тела нейрона отходит несколько дендритов | У нейрона имеется только один аксон |
| Длина редко превышает 700 мкм | Длина может достигать 1 м |
| По мере удаления от тела клетки диаметр быстро уменьшается | Диаметр сохраняется на значительном расстоянии |
| Образовавшиеся в результате деления ветви локализуются возле тела | Терминали располагаются далеко от тела клетки |
| Имеются шипики | Шипики отсутствуют |
| Не содержат синаптических пузырьков | Содержат в большом числе синаптические пузырьки |
| Содержат рибосомы | Рибосомы могут обнаруживаться в незначительном числе |
| Лишены миелиновой оболочки | Часто окружены миелиновой оболочкой |
Терминали дендритов чувствительных нейронов образуют чувствительные окончания. Основной функцией дендритов является получение информации от других нейронов. Дендриты проводят информацию к телу клетки, а затем к аксонному холмику.
Аксон. Аксоны образуют нервные волокна, по которым передается информация от нейрона к нейрону или к эффекторному органу. Совокупность аксонов образует нервы.
Общепринято подразделение аксонов на три категории: А, В и С. Волокна группы А и В являются миелинизированными, а С – лишены миелиновой оболочки. Диаметр волокон группы А, которые составляют большинство коммуникаций центральной нервной системы, варьирует от 1 до 16 мкм, а скорость проведения импульсов равна их диаметру, умноженному на 6. Волокна типа А подразделяются на Аa, Аb, Аl, Аs. Волокна Аb, Аl, Аs имеют меньший диаметр, чем волокна Аa, меньшую скорость проведения и более длительный потенциал действия. Волокна Аb и Аs являются преимущественно чувствительными волокнами, которые проводят возбуждение от различных рецепторов в ЦНС. Волокна Аl – это волокна, которые проводят возбуждение от клеток спинного мозга к интрафузальным мышечным волокнам. В-волокна являются характерными для преганглионарных аксонов вегетативной нервной системы. Скорость проведения 3-18 м/с, диаметр 1-3 мкм, продолжительность потенциала действия 1-2 мс, нет фазы следовой деполяризации, а есть длительная фаза гиперполяризации (более 100 мс). Диаметр С-волокон от 0,3 до 1,3 мкм, и скорость проведения импульсов в них несколько меньше величины диаметра, умноженного на 2, и равняется 0,5-3 м/с. Длительность потенциала действия этих волокон составляет 2 мс, отрицательный следовой потенциал равняется 50-80 мс, а положительный следовой потенциал – 300-1000 мс. Большинство С-волокон являются постганглионарными волокнами вегетативной нервной системы. В миелинизированных аксонах скорость проведения импульсов выше, чем в немиелизированных.
Аксон содержит аксоплазму. У крупных нервных клеток ей принадлежит около 99% всей цитоплазмы нейрона. Цитоплазма аксонов содержит микротрубочки, нейрофиламенты, митохондрии, агранулярный эндоплазматический ретикулум, везикулы и мультивезикулярные тела. В разных частях аксона существенно меняются количественные отношения между этими элементами.
У аксонов, как миелинизированных, так и немиелизированных, есть оболочка – аксолемма.
В зоне синаптического контакта мембрана получает ряд дополнительных цитоплазматических соединений: плотные выступы, ленты, субсинаптическая сеть и др.
Начальный участок аксона (от его начала до того места, где наступает сужение до диаметра аксона) носит название аксонного холмика. От этого места и появления миелиновой оболочки простирается начальный сегмент аксона. В немиелинизированных волокнах эта часть волокна определяется с трудом, а некоторые авторы считают, что начальный сегмент присущ только тем аксонам, которые покрыты миелиновой оболочкой. Он отсутствует, например, у клеток Пуркинье в мозжечке.
В месте перехода аксонного холмика в начальный сегмент аксона под аксолеммой появляется характерный электронноплотный слой, состоящий из гранул и фибрилл, толщиной 15 нм. Этот слой не связан с плазматической мембраной, а отделен от нее промежутками до 8 нм.
В начальном сегменте по сравнению с телом клетки резко уменьшается количество рибосом. Остальные компоненты цитоплазмы начального сегмента – нейрофиламенты, митохондрии, везикулы – переходят из аксонного холмика сюда, не изменяясь ни по внешнему виду, ни по взаиморасположению. На начальном сегменте аксона описаны аксо-аксональные синапсы.
Часть аксона, покрытая миелиновой оболочкой, обладает только ей присущими функциональными свойствами, которые связаны с проведением нервных импульсов с большой скоростью и без декремента (затухания) на значительные расстояния. Миелин является продуктом жизнедеятельности нейроглии. Проксимальной границей у миелинизированного аксона служит начало миелиновой оболочки, а дистальной – утрата ее. Далее следуют более или менее длинные терминальные отделы аксона. В этой части аксона отсутствует гранулярный эндоплазматический ретикулум и очень редко встречаются рибосомы. Как в центральных отделах нервной системы, так и на периферии аксоны окружены отростками глиальных клеток.
Миелинизированная оболочка имеет сложное строение. Ее толщина варьирует от долей до 10 мкм и более. Каждая из концентрически расположенных пластинок состоит из двух наружных плотных слоев, образующих главную плотную линию, и двух светлых бимолекулярных слоев липидов, разделенных промежуточной осмиофильной линией. Промежуточная линия аксонов периферической нервной системы представляет собой соединение наружных поверхностей плазматических мембран шванновской клетки. Каждый аксон сопровождается большим числом шванновских клеток. Место, где шванновские клетки граничат между собой, лишено миелина и называется перехватом Ранвье. Между длиной межперехватного участка и скоростью проведения нервных импульсов есть прямая зависимость.
Перехваты Ранвье составляют сложную структуру миелинизированных волокон и играют важную функциональную роль в проведении нервного возбуждения.
Протяженность перехвата Ранвье миелинизированных аксонов периферических нервов находится в пределах 0,4-0,8 мкм, в центральной нервной системе перехват Ранвье достигает 14 мкм. Длина перехватов довольно легко изменяется под действием различных веществ. В области перехватов, помимо отсутствия миелиновой оболочки, наблюдаются значительные изменения структуры нервного волокна. Диаметр крупных аксонов, например, уменьшается наполовину, мелкие аксоны изменяются меньше. Аксолемма имеет обычно неправильные контуры, и под ней лежит слой электронноплотного вещества. В перехвате Ранвье могут быть синаптические контакты как с прилежащими к аксону дендритами (аксо-дендритические), так и с другими аксонами.
Коллатерали аксонов. С помощью коллатералей происходит распространение нервных импульсов на большее или меньшее число последующих нейронов.
Аксоны могут делиться дихотомически, как, например, у зернистых клеток мозжечка. Очень часто встречается магистральный тип ветвления аксонов (пирамидные клетки коры мозга, корзинчатые клетки мозжечка). Коллатерали пирамидных нейронов могут быть возвратными, косоидущими и горизонтальными. Горизонтальные ответвления пирамид простираются иногда на 1-2 мм, объединяя пирамидные и звездчатые нейроны своего слоя. От горизонтально распространяющегося (в поперечном направлении к длинной оси извилины мозга) аксона корзинчатой клетки образуются многочисленные коллатерали, которые заканчиваются сплетениями на телах крупных пирамидных клеток. Подобные аппараты, так же как и окончания на клетках Реншоу в спинном мозге, являются субстратом для осуществления процессов торможения.
Коллатерали аксонов могут служить источником образования замкнутых нейронных цепей. Так, в коре больших полушарий все пирамидные нейроны имеют коллатерали, которые принимают участие во внутрикорковых связях. За счет существования коллатералей обеспечивается в процессе ретроградной дегенерации сохранность нейрона в том случае, если повреждается основная ветвь его аксона.
Терминали аксонов. К терминалям относятся дистальные участки аксонов. Они лишены миелиновой оболочки. Протяженность терминалей значительно варьирует. На светооптическом уровне показано, что терминали могут быть либо одиночными и иметь форму булавы, сетевидной пластинки, колечка, либо множественными и походить на кисть, чашевидную, моховидную структуру. Размер всех этих образований изменяется от 0,5 до 5 мкм и более.
Тонкие разветвления аксонов в местах контакта с другими нервными элементами нередко имеют веретеновидные или бусинковидные расширения. Как показали электронно-микроскопические исследования, именно в этих участках имеются синаптические соединения. Одна и та же терминаль дает возможность одному аксону устанавливать контакт с множеством нейронов (например, параллельные волокна в коре головного мозга) (рис. 1.2).
Функции нервных волокон
Распространение возбуждения в нервных волокнах.Изменения мембранного потенциала, вызываемые электрическим током, подразделяются на пассивные и активные.
Пассивные, или электротонические, изменения мембранного потенциала определяются физическими (электрическими) параметрами как самой мембраны, так и всей клетки (волокна) в целом.
Пассивные сдвиги мембранного потенциала возникают при действии на возбудимые образования электрического тока любой силы, формы или направления. Однако если при гиперполяризующем (анодном) и слабом деполяризующем (катодном) токах пассивные изменения потенциала могут наблюдаться в чистом (неосложненном) виде, то при близких к порогу и сверхпороговых деполяризующих стимулах они сопровождаются активными сдвигами потенциала: локальным ответом и потенциалом действия, связанными с изменениями ионной проницаемости мембраны.
Пассивные свойства мембраны и всего волокна в целом в значительной мере определяют условия возникновения и распространения возбуждения в нервном волокне.
Исследования показывают, что в однородно поляризуемом, однородном участке нервного волокна изменения мембранного потенциала при приложении прямоугольного толчка гиперполяризующего или слабого деполяризующего тока нарастают по экспоненте:
,
где RC = τ
– постоянная времени мембраны, т.е. время, в течение которого потенциал нарастает до 63% от своей конечной величины. При выключении тока потенциал возвращается к исходному уровню по экспоненте с той же постоянной времени
τ
. Такие изменения мембранного потенциала принято называть пассивными или электротоническими, в отличие от активных, связанных с повышением или снижением ионных проводимостей мембраны.
Подобные изменения наблюдаются на сферических клетках (на соме). Описание цилиндрической клетки, в частности аксона, более сложно. В этом случае уже нельзя считать внутренний проводник эквипотенциальным по всей длине. Внешний проводник можно считать эквипотенциальным за счет увеличения объема внеклеточной жидкости. Потенциал на такой мембране зависит не только от времени включения тока, но и от расстояния х
по отношению к месту приложения тока:
,
где а
– радиус волокна,
R
– удельное сопротивление аксоплазмы,
CМ
и
RМ
– емкость и сопротивление на единицу площади мембраны. Левая часть уравнения описывает плотность тока через каждую точку мембраны, которая равна сумме плотностей емкостного ()и омического () токов, стоящих в правой части уравнения.
Через длительное время (намного большего постоянной времени t = RМ CМ
) после включения импульса емкость мембраны полностью зарядится и емкостный ток станет равным нулю. Уравнение примет вид:
.
Его решение:
,
где V0
– потенциал в начале кабеля (
х
= 0),
l
– постоянная длины волокна.
Постоянная длины характеризует крутизну затухания потенциала вдоль волокна. Чем больше l
, тем дальше по волокну проходит сигнал. Скорость электротонического распространения пропорциональна удвоенной величине константы длины волокна
l
и обратно пропорциональна постоянной времени
t = RМ CМ
. Величина
l
может быть выражена через сопротивление мембраны
RМ
, сопротивление внутренней среды – аксоплазмы
Ri
и диаметра волокна
d
:
.
Кабельные свойства нервных волокон оказывают существенное влияние не только на развитие электротонических потенциалов, но и на характер активных ответов – величину порога, амплитуду, крутизну нарастания и длительность потенциала действия.
В настоящее время можно считать строго доказанным, что проведение потенциала действия (ПД) вдоль нервного волокна осуществляется с помощью локальных токов, возникающих между возбужденным и покоящимся участками мембраны. Локальный ток изменяет величину мембранного потенциала покоя в покоящемся участке до критического уровня деполяризации, что и является причиной возникновения потенциала действия.
Многочисленными исследованиями было показано, что скорость проведения пропорциональна постоянной длины волокна l
и обратно пропорциональна постоянной времени мембраны
t
(Чайлохян Л.М., 1962). Поскольку в безмякотных нервных волокнах
l
пропорциональна квадратному корню из диаметра волокна
,
скорость проведения при прочих равных условиях также пропорциональна корню квадратному из диаметра волокна.
В миелинизированных нервных волокнах проведение происходит сальтаторно – от перехвата Ранвье к перехвату Ранвье. Длина межперехватного участка примерно пропорциональна диаметру волокна, поэтому скорость проведения в этих волокнах пропорциональна не корню квадратному из диаметра волокна, а просто его диаметру.
Принято считать, что скорость проведения зависит от величины так называемого фактора безопасности (гарантийности) Ф
, т.е. отношения амплитуды распространяющегося ПД к пороговому потенциалу. Пороговый потенциал – это та величина, на которую нужно изменить мембранный потенциал, чтобы достичь критического уровня деполяризации.
,
где Vs
– амплитуда ПД,
Vt
– пороговый потенциал.
При Ф = Vt
распространения возбуждения нет. Для аксона краба это отношение равно 7.
Было показано, что пороговый потенциал Vt
находится в тесной зависимости от чувствительности системы натриевой проницаемости мембраны к деполяризации. Чем выше эта чувствительность, т.е. чем на большую величину повышается
PNa
и, соответственно, натриевый входящий ток
INa
при данном сдвиге потенциала, тем ниже порог, и наоборот. Изменение состояния системы калиевой проницаемости на величину порогового потенциала практически не оказывает влияния. Точно так же очень мало влияет на пороговый потенциал проводимость токов «утечки». При постоянном потенциале покоя фактор безопасности должен возрастать при воздействиях на нервное волокно, которые повышают чувствительность натриевой системы к деполяризации, например, снижение концентрации ионов кальция в окружающей среде. Значительное снижение фактора безопасности вызывают агенты, усиливающие исходную инактивацию натриевой системы или уменьшающие натриевую проводимость, поскольку в этом случае амплитуда потенциала действия падает, а пороговый потенциал растет. Такие изменения проведения возбуждения наблюдал Тасаки (1957) и другие исследователи при воздействии на нервное волокно анестетиков и наркотиков в малых концентрациях, недостаточных для полного подавления потенциала действия.
Сложное влияние на фактор безопасности оказывает уровень потенциала покоя. Кратковременная подпороговая деполяризация мембраны, не изменяющая существенным образом критического потенциала и амплитуды потенциала действия, повышает фактор безопасности, так как Vt = Eo – Ek
. При сильной же деполяризации амплитуда спайка падает, критический потенциал растет, поэтому фактор безопасности уменьшается.
Наряду с фактором безопасности существенное влияние на скорость проведения возбуждения оказывает крутизна восходящей фазы распространяющегося потенциала действия. Крутизна этой фазы зависит как от пассивных, так и активных свойств мембраны.
Примерно 1/3 восходящей фазы распространяющегося ПД связана с пассивной деполяризацией мембраны нервного волокна током локальной цепи. Скорость же этой деполяризации при данной силе локального тока определяется постоянной времени мембраны t = RM CM
. Чем эта величина меньше, тем быстрее нарастает деполяризация и, следовательно, круче поднимается спайк. Инактивация натриевой системы, или снижение проницаемости для натрия (активные свойства мембраны), резко уменьшает крутизну восходящей фазы. Таким образом, при большинстве воздействий изменения скорости нарастания восходящей фазы ПД по своему направлению совпадают с изменениями фактора безопасности.
Согласно теории локальных токов, амплитуда распространяющегося потенциала действия Vs
, в отличие от мембранного спайка, зависит не только от ЭДС возбужденной мембраны
Е
, но и от соотношения входных сопротивлений возбужденного
R1
и невозбужденного (сопротивление нагрузки
R2
) участков волокна:
. (1)
Чем отношение выше, тем в большей мере амплитуда распространяющегося ПД приближается к величине Е
, тем, следовательно, выше фактор безопасности, и наоборот. Из чего вытекает, что снижение сопротивления мембраны (повышение ее ионной проводимости) при критической деполяризации не только ведет к возникновению спайка, но и способствует увеличению фактора безопасности, а значит, и скорости проведения.
Из формулы (1) ясно, что при проведении возбуждения по геометрически неоднородным возбудимым проводникам амплитуда распространяющегося спайка должна существенно зависеть от того, насколько близко находится возбужденный в данный момент участок волокна к месту его ветвления или расширения.
При расширении нервного волокна, например, в месте перехода его в тело клетки или в области ветвления аксона, суммарная площадь сечения волокон и общая площадь их мембраны увеличивается, а следовательно, R2
падает. Уменьшение
R2
снижает фактор безопасности и, соответственно, скорость проведения. При некоторых условиях уменьшение
R2
может привести к полному блокированию нервного импульса.
Расчеты показали, что потенциал действия легко проходит трехкратное расширение, с трудом пятикратное и полностью блокируется при шестикратном. Причиной развития блока является резкое снижение амплитуды распространяющегося ПД вблизи области расширения волокна.
Трофическая функция нервных волокон.Трофической функцией обладают афферентные и эфферентные волокна.
Афферентные нервы обладают двумя нейротрофическими, неимпульсными функциями. Можно различить прямое морфогенетическое и трофическое влияние на периферические органы и регуляторную функцию с обратной связью, зависящую, вероятно, от внутриаксональных центростремительных импульсов. Нейротрофическое морфогенетическое влияние доказано наличием: а) зависимости структуры вкусовых почек от вкусовых нервов; б) стимулирования регенерации конечности у амфибий чувствительными нервами посредством специфического, стимулирующего рост вещества немедиаторной природы; в) дифференцировки и поддержания рецепторов. После деафферентации в некоторых органах развиваются трофические нарушения. Первичный «трофический» нейрон для мышцы – это нейрон моторный. Нельзя забывать также, что во всех нервах проходят эфферентные адренергические волокна, вкоторых нейросекреты (катехоламины) транспортируются аксоплазматическим током к периферическим органам.
Аксональный транспорт.Описаны две системы аксонального транспорта – медленный, со скоростью 1-3 мм/день, и быстрый, со скоростью примерно 400 мм/день.
Аксональный транспорт поддерживает непрерывность аксона и синаптических мембран и восстанавливает белки, гликопротеины, ферменты и другие вещества, исчезающие в ходе локального расщепления, экзоцитоза в синаптическую щель и ретроградной миграции к нейрону. Все это происходит благодаря быстрому транспорту, на который не оказывают влияния процессы возбуждения. Транспорт продолжается после блокады потенциалов действия и не повышается при усиленной активности нерва. Аксональный транспорт осуществляется в обоих направлениях; центростремительный ток контролирует, по-видимому, синтез белков в нейроне и играет также роль «сигнала» для хроматолиза после аксотомии. Различные вещества, ферменты, передатчики и макромолекулы передвигаются в аксоне с разной скоростью.
Аксоплазматический транспорт можно зарегистрировать по накоплению веществ после нарушения непрерывности аксона и по наблюдению за продвижением меченых соединений после введения их в нейрон.
Белки, синтезируемые в теле клетки, синаптические медиаторные вещества и низкомолекулярные факторы спускаются по аксону к нервной терминали вместе с клеточными органеллами, в частности митохондриями. Для большинства веществ и органелл обнаружен ретроградный транспорт (по аксону к телу клетки): вирус полиомиелита, вирус герпеса, столбнячный токсин, а также ферменты – пероксидаза хрена, которая широко используется в нейроанатомии в качестве маркиратора. Ретроградный транспорт, видимо, является главным фактором регуляции синтеза белка в клетке. После перерезки аксона через несколько дней в соме начинается хроматолиз, что свидетельствует о нарушении синтеза белка. Быстрый аксонный транспорт зависит от достаточного снабжения метаболической энергии. Возможность транспорта создают микротрубочки диаметром 25 мкм, состоящие из белка тубулина, и некоторые нейрофибриллы, состоящие из белка актина, образующие транспортные нити. Транспортные нити скользят вдоль микротрубочек. При этом они взаимодействуют с выступами микротрубочек, происходит расщепление АТФ, которое и обеспечивает энергию для транспорта. Более медленно транспортируются крупные белки. Но считают, что сам транспортный механизм не является более медленным, однако вещества время от времени попадают в клеточные компартменты, которые не участвуют в транспорте. Медленный ток имеет, по-видимому, также отношение к аксональному росту. Аксоплазматический ток прекращается колхицином, что объясняется влиянием этого вещества на микротрубочки.
Физиология синапсов
Синапс (от греч. synapsis) обозначает соединение, связь – это специализированная зона контакта между нейронами или нейронами и другими возбудимыми образованиями, обеспечивающая передачу возбуждения с сохранением, изменением или исчезновением ее информационного значения. Данный термин был предложен Ч. Шеррингтоном (1897) для обозначения функционального контакта между нейронами. Справедливости ради нужно отметить, что еще в 60-х годах XIX столетия И.М. Сеченов подчеркивал, что вне межклеточной связи нельзя объяснить происхождение даже самых простых рефлексов.
Синапсы различают: 1) по их местоположению; 2) по способу передачи сигналов.
1) По местоположению выделяют синапсы центральные и периферические. Центральные синапсы – это синапсы, которые осуществляют контакт между нейронами в центральной нервной системе. К ним относятся аксо-аксональные синапсы, аксо-дендритические, аксо-соматические, дендро-дендритические (обнаружены гистологически; функциональное значение не вполне ясно). Центральные синапсы классифицируют также по знаку их действия – возбуждающие и тормозные. Кроме того, распространено деление синапсов по тому медиатору (передатчику), который осуществляет посредничество: адренергические синапсы, холинергические синапсы и др.
К периферическим синапсам относят нервно-мышечные, синапсы вегетативных ганглиев (синапсы, образованные преганглионарными и постганглионарными волокнами).
2) По способу передачи синапсы классифицируются как химические и электрические.
Для всех этих образований характерно наличие пресинаптической мембраны, синаптической щели (10-50 нм), постсинаптической мембраны. Пресинаптическая мембрана является мембраной пресинаптического окончания отростка нейрона (чаще всего аксона).
У человека и высших позвоночных животных наибольшее распространение получили химические синапсы. Химические синапсы в пресинаптическом окончании содержат везикулы с медиатором, химическим передатчиком. Ширина синаптической щели в среднем составляет 20 нм. На постсинаптической мембране содержатся рецепторы к данному медиатору, ферменты, разрушающие данный медиатор. Таким образом, постсинаптическая мембрана является рецепторной частью синапса, ею может быть специфически дифференцированный участок дендрита, тела нейрона и его аксона.
В электрическом синапсе не вырабатывается медиатор. Синаптическая щель несколько меньше, чем у химического синапса (2-4 нм). В синаптической щели между пре- и постсинаптической мембранами имеются белковые мостики-каналы шириной 1-2 нм, где движутся ионы и небольшие молекулы. Это способствует более низкому, чем у пресинаптической мембраны, сопротивлению постсинаптической мембраны. Поэтому возбуждение от пресинаптической мембраны к постсинаптической мембране в электрических синапсах передается электрическим путем, т.е. осуществляется эфаптическая передача. В отличие от химических синапсов, электрические синапсы отличаются большей скоростью проведения возбуждения, высокой надежностью передачи, возможностью двустороннего проведения.
Электрические синапсы обнаружены у крыс в вестибулярном ядре продолговатого мозга, в структурах дыхательного центра продолговатого мозга (при этом обсуждается их роль в механизмах автоматического ритмогенеза дыхания); у кошки электрические синапсы обнаружены между нейронами нижних олив, в структурах таламуса, между фоторецепторами сетчатки и горизонтальными клетками у рыб и др.
Но все-таки наибольшее распространение в процессе эволюции получили химические синапсы. Это обусловлено рядом свойств этих образований, которые имеют большое значение в организации деятельности нервной системы (рис. 1.4).
Рис. 1.4.
Синапс (рисунок взят из книги: Мозг / под ред. П.В. Симонова. М.: Мир, 1984)
⇐ Предыдущая3Следующая ⇒
Рекомендуемые страницы:
Функционирование нервной системы
Нормальное функционирование нервной системы зависит от передачи импульса и химических процессов в синапсе. Не менее важную роль играет создание нервных связей. Способность к обучению присутствует у людей именно благодаря возможности организма формировать новые соединения между нейронами.
Любое новое действие на стадии изучения требует постоянного контроля со стороны мозга. По мере его освоения образуются новые нейронные связи, со временем действие начинает выполняться автоматически (например, умение ходить).
Дендриты – это передающие волокна, составляющие примерно треть всей нервной ткани организма. Благодаря их взаимодействию с аксонами люди имеют возможность обучаться.
Аксон – это тонкое волокно который простирается от нейрона или нервной клетки и отвечает за передачу электрических сигналов, помогающих сенсорному восприятию и движению. Каждый аксон окружен миелиновой оболочкой, жировым слоем, который изолирует аксон и помогает ему передавать сигналы на большие расстояния.
Точно так же За что отвечают аксоны? аксон, также называемый нервным волокном, часть нервной клетки (нейрона), которая проводит нервные импульсы от тела клетки.
Куда идут аксоны? Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе..
Кроме того, какой длины могут быть аксоны?
В зависимости от типа нейрона аксоны сильно различаются по длине — многие из них всего миллиметр или около того, но самые длинные из них, такие как те, которые идут от головного мозга вниз по спинному мозгу, могут простираться на более метра.
Как растут аксоны?
Во время развития центральной нервной системы (ЦНС) нейроны поляризуются и быстро расширяют свои аксоны, чтобы собрать нейронные цепи. Конус роста ведет аксон к цели и стимулирует рост аксона.
Что находится на конце каждого аксона? Концевые ветви аксона называются телодендриями. Вздутый конец телодендрона известен как терминальный аксон который присоединяется к дендрону или телу клетки другого нейрона, образуя синаптическую связь.
Что происходит при повреждении аксонов? При повреждении аксона лазером он посылает сигналы окружающим тканям для «очистки», вызывая высвобождение белков, которые ускоряют дегенерацию аксона.. Если предотвратить появление таких молекул, это может замедлить прогресс и степень повреждения нервов.
Какой длины могут быть аксоны? Аксоны являются первичными линиями передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут расширяться до метра и более в то время как другие простираются всего на один миллиметр.
Как выглядит аксон?
Аксон выглядит так длинный хвост и передает сообщения из ячейки. Дендриты выглядят как ветви дерева и принимают сообщения для клетки.
Как нейроны отправляют сообщения? Нейроны общаются через синапс
Информация от одного нейрона поступает к другому через небольшую щель, называемую синапсом (SIN-aps). В синапсе электрические сигналы преобразуются в химические, чтобы пройти через щель. Оказавшись на другой стороне, сигнал снова становится электрическим.
Какие 3 типа нейронов?
Что касается спинного мозга, мы можем сказать, что существует три типа нейронов: сенсорные, моторные и интернейроны.
- Сенсорные нейроны. …
- Моторные нейроны. …
- Интернейроны. …
- Нейроны в головном мозге.
Какого цвета аксон? Цвет. Мы используем черно-белый в качестве основных цветов нашего бренда, чтобы создать уверенную и последовательную эстетику во всем бренде. Наш вторичный цвет, желтый аксон, связан с общественной безопасностью.
Почему аксоны такие длинные?
Аксоны должны быть длинными. чтобы добраться до каждой части вашего тела из центральных регулирующих мест в головном мозге и позвоночнике. Итак, представьте, что вы хотите пошевелить большим пальцем ноги. Ваш мозг пошлет сообщение через ряд нервных клеток вплоть до окончания спинного мозга.
Сколько миль аксонов в мозгу?
Примерно 86 миллиардов нейронов человеческого мозга, вероятно, связаны чем-то вроде 850,000 км аксонов и дендритов.
Можно ли вырастить новые аксоны? Это критический, хотя и оставшийся без ответа вопрос в исследованиях роста и регенерации аксонов. Эмбриональные нейроны ЦНС могут довольно легко регенерировать свои аксоны, но они теряют способность к регенерации с возрастом. (Шваб и Бартольди, 1996; Фосетт, 1997).
Как я могу улучшить свой аксон? Поэтому необходимо разработать стратегии улучшения регенерации аксонов в центральной нервной системе, чтобы обеспечить заживление. Миелинобразующие клетки являются ключевыми в процессе регенерации аксонов. Многие аксоны покрыты миелином, который служит защитным слоем, а также обеспечивает быструю и эффективную передачу сигнала.
Насколько растут аксоны в месяц?
Аксональные отростки растут от проксимальной к дистальной культе со скоростью примерно 1-2 мм/день (или примерно 1 дюйм/месяц).
Какое химическое вещество высвобождается из окончания аксона? Медиаторы упакованы в синаптические везикулы, которые группируются под терминальной мембраной аксона на пресинаптической стороне синапса. Аксональные окончания специализируются на высвобождении нейротрансмиттеров пресинаптической клетки.
Как аксоны передают информацию?
Аксоны соединяются с другими клетками тела, включая другие нейроны, мышечные клетки и органы. Эти соединения происходят в соединениях, известных как синапсы. Синапсы позволяют электрические и химические сообщения, которые должны передаваться от нейрона к другим клеткам тела.
Какие аксоны наиболее чувствительны к лекарствам? Центральные аксоны готовятся к миелинизации высокочувствительны [скорректированы] к ишемическому повреждению.
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
- Электрофизиология
- Ганглиозное возвышение
- Гигантская аксональная нейропатия
- Нейронное отслеживание
- Пионерный аксон
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »


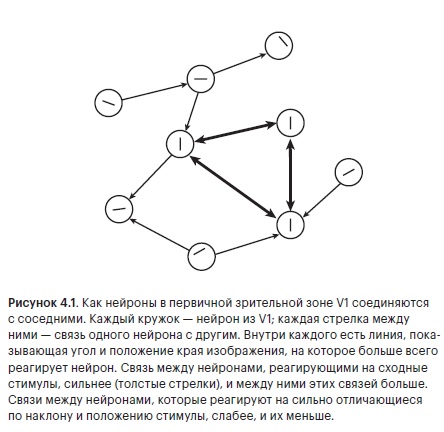
:max_bytes(150000):strip_icc()/ProfilePicPugle-bc0d33cfdbbc46e08595e6ff62d19ffd.jpg)