
ДАП, зачастую, ведет к коме, в результате которой человек может перейти в вегетативное состояние.
Диффузия головного мозга чаще происходит с молодыми людьми, которые попадают в дорожно-транспортные происшествия, становятся жертвами драк и избиений с повреждением головного мозга, а также детьми, у которых и кома намного глубже, и неврологические нарушения грубее.
Вариант этой ЧМТ был впервые описан в 1956 за рубежом, а само название появилось в 1982 году. Состояние при ДАП тяжелое, протекающее в длительной коме, которая сразу возникает после травмы и характеризуется длительным течением.
Аксоны, поврежденные или разорванные в результате ЧМТ, и мелкие кровоизлияния равномерно распределяются по церебральным структурам, при этом нарушается иннервация всех зависимых органов. Самые распространенные места повреждений:
- ствол мозга;
- белое вещество;
- мозольное тело;
- волокна перивентрикулярные.
Диффузная травма головного мозга – это всегда серьезнейшее состояние с перспективой перехода в вегетативное состояние, нередок и смертельный исход.
Причины и морфология ДАП
Самые распространенные причины ЧМТ при ДАП:
- сильный ушиб о лобовые стекла в ДТП;
- падение;
- удар тяжелым предметом;
- синдром сотрясения у детей, при котором мозг подвергается сильному ушибу впоследствии резкой тряски, а также избиения, падения.
Синдром ДАП является результатом ушибов, вызванных угловым ускорением головы. При этом может и не быть прямого столкновения с объектом травмы.
Вследствие этого у некоторых пациентов не наблюдается переломов черепа и других видимых ранений, что несколько затрудняет диагностику. Статистика говорит о том, что именно повреждение по косой ведет к повреждению аксонов и возникновению ДАП.
Морфологически для этой травмы характерны три следующих очага повреждения:
- головной мозг;
- мозольное тело;
- стволовой мозг и диффузно распределенные разрывы.
Первые два очаговых признака – макроскопические, которые располагаются в виде гематомы до пяти мм, выглядящие как надорванная ткань с окровавленными краями. Через несколько дней после ЧМТ, очаг пигментируется и затем рубцуется. Рана в мозолистом теле может разрешиться образованием сосудистой кисты.
Аксональные нарушения при травме
Особенности клинической картины
Кома при диффузном повреждении головного мозга продолжается до трех недель и проявляется следующими симптомами:
- рефлекс зрачка нарушается;
- происходит паралич взгляда;
- дыхательный ритм меняется;
- повышается тонус мышц;
- появляется парез ног и рук;
- диагностируется гипертония;
- появляется фебрильная или субфебрильная температура и другие вегетативные расстройства.
Когда пациент с ДАП выходит из комы, он оказывается в вегетативном состоянии со следующими симптомами:
- глаза открываются на раздражители или самостоятельно;
- взгляд не сконцентрирован и не следует за движущимися предметами.
Вегетативное состояние, сопровождающееся нарушением рефлексов и симптомами разъединения функций мозговых полушарий, может продолжаться, в среднем, от нескольких дней до нескольких лет. Чем больше нахождение в нем, тем скорее появляются такие признаки полиневропатии, как:
- ослабление кистей рук;
- хаотическое движение мышц;
- расстройства нейротрофики;
- учащение пульса;
- отеки;
- тахипноэ и др.
После выхода из вегетативного состояния личность выпадает. Основные признаки нарушений после выхода:
- экстрапирамидные расстройства;
- расстройства психики, проявляющиеся отсутствием интереса к окружающей пациента действительности, агрессия, амнезия, слабоумие.
Степени поражения
Диффузное аксональное повреждение головного мозга бывает трех степеней тяжести:
- легкой – продолжительность комы от 6 до 24 часов, ЧМТ незначительна;
- средней– кома больше 24 часов, но черепно-мозговая травма умеренная;
- тяжелой – длительная кома, поражения значительные, происходит сдавливание мозга.
Тяжелая степень характеризуется массовым повреждением аксонов, которое приводят к кровоизлияниям в мозг. ДАП при этом может приводить к коме, продолжающейся годами и летальному исходу.
Начальное состояние мозга после выхода из такой комы восстановить не представляется возможным, единицы вернулись к более-менее нормальной жизни после таких повреждений.
Постановка диагноза
Диагноз диффузное поражение головного мозга ставится после компьютерной томографии, результаты которой в остром периоде отличаются увеличением объема мозговых полушарий, уменьшением или сдавливанием боковых расстояний и основания мозга. В белом веществе, стволе и мозолистом теле находятся мелкие кровоизлияния.
При обследовании наблюдается молниеносное развитие признаков ДАП и дегенерации.
ЭЭГ при синдроме ДАП выявляет изменения в подкорке и стволе мозга, диэнцефальный синдром. В анализе крови отмечается резкое повышение серотонина, значительное уменьшение дофамина и скачок адреналина, что предполагает терапию, направленную на снижение симпатико-адреналиновых симптомов.
В результате КТ определяют повышено внутричерепное давление или, наоборот, понижено либо отсутствует. В таком случае подключают датчик. Если на КТ отток ликвора в норме, то и внутричерепное давление будет в норме.

Поддержка состояния пострадавшего
После диффузной травмы головного мозга нередко диагностируются субдуральные ликворные скопления над большими полушариями мозга, которые в дальнейшем рассасываются, удалять хирургически их не надо.
Аксональное повреждение головного мозга чаще всего лечится консервативно. Нейрохирургическая операция проводится при сочетании разрывов и повреждений аксонов с очаговыми повреждениями, усиливающими сдавливание и провоцирующими гидроцефальный синдром.
В коме пациента подключают к ИВЛ, кормят парентерально и вводят следующие лекарства:
- для установления правильного кислотно-щелочного и водно-электролитного баланса;
- ноотропные и вазоактивные;
- устраняющие гипертензию или гипотонию;
- антибиотики для исключения сопутствующих инфекций.
Для возобновления психэмоциональной сферы вводят прием психостимуляторов.
После выхода из комы:
- вводят ноотропы и сосудистые лекарства для нормализации и улучшения состояния ЦНС, ноотропы также важны для последующей реабилитации;
- назначают препараты для улучшения метаболизма и биостимуляторы;
- проводят лечебную физкультуру для профилактики парезов;
- пациент занимается с логопедом.
Гормональные препараты при ДАП не назначают по ненадобности. После операции, если она все же состоялась (произошло сдавление головного мозга при сопутствующих травмах), вводят препараты, препятствующие образованию отеков, сосудистые средства, ноотропы, антихолинэстеразные, психотропные (во избежание развития агрессии и депрессии) и нейромедиаторы.
В период восстановления проводится такая же терапия, как и после выхода из комы.
Исход тяжелой травмы и ее последствия
Прогноз и последствия диффузного аксонального повреждения зависит от степени поражения аксонов головного мозга и тяжести вторичных признаков, таких как повышенное внутричерепное давление, гипергидроз, разбухание мозговых оболочек, психические нарушения, развитие слабоумия и т. д.
Исход также зависит от того как помогают лечебные методы, направленные на ликвидацию последствий ДАП – вторичные повреждения и осложнения.
Прогноз предполагает, что чем больше человек находился в коматозном состоянии, тем более риск развития неблагоприятных поражений, вплоть до летального исхода. Шансов на восстановление будет также минимум.

Но, к сожалению, чаще у выживших людей последующее течение синдрома ДАП может идти по двум сценариям:
- выход из коматозного состояния;
- переход в вегетативное состояние.
При первом варианте глаза больного открываются, и происходит слежение за предметами и фиксация взгляда на объекте. Это может иметь как спонтанный выход, так и направляемый организованными раздражителями, звуком и болевыми манипуляциями.
Затем пациент восстанавливает сознание, выполняет обращенные к нему просьбы, словесный багаж расширяется, он начинает общаться. Неврологические патологии при этом медленно регрессируют.
У больных, которые вышли из вегетативного состояния, развиваются экстрапирамидальные симптомы, сопровождающиеся психическими нарушениями (слабоумие, лабильность настроения, аспонтанность, спутанность сознания). При втором варианте летальный исход через определенное время неизбежен из-за истощения нейромедиаторов и соматических осложнений.
Современные исследования подтверждают регенерацию аксонов у детей и молодых людей, у которых мозг еще не завершил формирование. Происходит восстановление неврологических и психических процессов. При продолжительной коме оно проблематично, инвалидизация гарантирована.
Узнать больше о заболеваниях на букву «Д»:
Дебильность,
Двухволновый вирусный менингоэнцефалит,
Деменция с тельцами Леви,
Депрессивный невроз,
Дермальный синус,
Детский церебральный паралич,
Джексоновская эпилепсия,
Диастематомиелия (дипломиелия),
Дискогенная миелопатия,
Дистрофическая миотония Россолимо-Штейнерта-Куршмана,
Диабетическая энцефалопатия,
Дисциркуляторная энцефалопатия,
Диффузное аксональное повреждение головного мозга,
Доброкачественная роландическая эпилепсия.

Диагностирует состояние невролог при помощи стандартной и функциональной магнитно-резонансной томографии. Избавиться от состояния комы возможно в первую очередь с помощью искусственной вентиляции легких, а также интенсивной терапии. Обычно после выхода из комы врачи назначают ряд препаратов разной направленности для полного восстановления организма. К ним относятся ноотропные, сосудистые и метаболические препараты.
Еще одно обязательное требование, которое должен соблюдать пациент — это лечебные упражнения. Другими словами, физкультура, воздействие на психику и восстановление полноценной речи благодаря помощи логопедов и специальных упражнений.
Общие сведения
Впервые среди черепно-мозговых травм диффузное аксональное повреждение мозга было признано отдельным видом заболевания с 1956 года. Официальное название, которое оно сохранило до сегодняшнего момента, появилось только в 1982 году. Состояние, испытываемое человеком в процессе нахождения в коме, имеет специальное название — коматозное.
Рассеянно расположенные разрывы аксонов и мелкие очаги кровоизлияния среди церебральных структур — это морфологический субстрат коматозного состояния.
Существует разделение ДАП на несколько видов, в зависимости от тяжести:
- Легкая степень. Кома длится в промежуток 6-24 часа.
- Умеренная степень. Кома длится около суток. Отсутствуют стволовые повреждения, или есть их незначительное наличие.
- Тяжелая степень. Для нее свойственно длительное время нахождения в коме, при котором возможны децеребрация и декортикация.
Вне зависимости от степени ДАП данное заболевание несет с собой большую угрозу для человека, которая грозит вегетативным состоянием или, в худшем из случаев, летальным исходом. Поэтому совершенно очевидно, что многие области науки и медицины, такие как неврология и травматология, заинтересованы в постановке наиболее эффективных способов лечения.
Причины и морфология
У многих больных отсутствуют перелом черепа или какие-либо другие визуальные повреждения в связи с тем, что такая травма не всегда сопровождается непосредственным контактом головы с твердым предметом.

Самые подвижные полушария, как показала статистика, проявляются в ротации, в то время как фиксированные стволовые отделы подвергаются перекручиванию. Достаточно частое явление при таких травмах — взаимное смещение отдельных слоев или частей̆ головного мозга. К частичному или полному разрыву мелких сосудов и аксонов может привести даже незначительное смещение церебральных структур.
Выделяют три основном симптома диффузного аксонального повреждения:
- очаг травмы в мозолистом теле;
- очаг в стволе мозга;
- диффузные аксональные разрывы.
Очаг повреждения в мозолистом теле, также, как и очаг в стволе мозга сначала выглядят микроскопическими травмами и проявляются в кровоизлиянии, размер которого̆ равен примерно 5 мм. Нередко встречаются случаи, когда такие очаги выглядят как надрывы ткани, у которой̆ края пропитаны кровью.
Через некоторое время (около 2-3 дней̆) такие места превращаются в пигментированные участки, цвет которых напоминает ржавчину, а затем из них сформировываются болезненные рубцы. Кроме того, очаги в мозолистом теле могут сопровождаться таким явлением, как образование кисты.
Главным вопросом является выявление диффузных аксональных повреждений, которое проводится путем специальных микроскопических исследований тканей̆ мозга. К таким исследованиям относят иммуно-гистохимическим методом и путем импрегнации серебром.
Такие исследования позволяют увидеть множественные аксональные шары, которые располагаются в местах разрыва нервных волокон. Все последующие изменения будут выражаться в макрофагальной̆ реакции с появлением реактивных микроглиоцитов и астроцитов.
ДАП сильно отличается от простого ушиба головного мозга, его отличие заключается в отсутствии сегментоядерных элементов. Через 2-4 недели к симптомам болезни прибавятся фрагментация и демиелинизация поврежденных аксонов.
Симптомы
Особенностью ДАП, которая отличает его от всех других видов черепно-мозговых травм, является моментальный переход в кому. В основном она имеет продолжительный, умеренно-спокойный или глубокий характер. Она наступает сразу после получения травмы.
Если рассматривать статистику по взрослым людям, то случаи умеренной комы 63% против 37% глубокой. У детей же показания разнятся гораздо меньше: 43% к 57%. Что касается среднего количества времени, которое человек проводит в коме, то оно составляет от 3 до 13 суток.
К стволовым симптомам относятся:
- нарушение дыхательного процесса и его ритма;
- анизокория;
- разное месторасположение зрачков относительно горизонтали и уменьшение;
- полное отсутствие фотореакции и рефлексов роговицы.
В области неврологии к симптомам комы относятся:
- изменчивый и непостоянный нистагм;
- отсутствие реакции мышц затылка;
- раздражение мозговых оболочек, то есть симптом Кернига.
Вегетативные симптомы имеют множество разных проявлений, самые частые из них гиперсаливация, гипергидроз и артериальная гипертензия.
ДАП характеризуется также значительными расстройствами в двигательных функциях. Самое частое их проявление — это пирамидно-экстрапирамидный тетрасиндром. Это вызвано тем, что в основном руки пациентов лежат в положении, имеющим название «лапки кенгуру» — руки со свисающими кистями приложены к телу больного и согнуты в локтях.
Неудивительно, что сухожильные рефлексы снижаются, а затем и вовсе могут исчезнуть, несмотря на то, что в начале они завышены. Также для комы свойственны стопные знаки, носящие патологический характер. Расстройства в динамике тела и мышечного тонус у каждого пациента могут сильно отличаться: от генерализованной гипотонии до горметонии. В процессе комы они часто меняются и не отличаются стабильностью. Для мышечного тонуса характерен асимметричный и диссоциативный характер.
Варианты исходов
Если пациенту удается выжить при диффузном аксональном повреждении, то его болезнь может развиваться только в двух разных направлениях:
- Выход из комы. В этом случае выход из болезни сопровождается открыванием глаз, однако, при этом присутствует слежение и фиксация взора. Это явление может происходить как спонтанно, так и благодаря посторонним факторам, звуковым или болевым раздражителям. Со временем состояние пациента нормализуется, восстанавливается сознание, а также постепенно становится возможным выполнение каких-либо простых инструкций и действий, развивается словесный контакт. Кроме того, такие процессы обязательно сопровождаются медленным регрессом неврологических проявлений.
- Переход в вегетативное состояние. Нахождение в длительной̆ коме приводит к переходу в вегетативное состояние. Продолжительность может составлять от 1-2 дней̆ до нескольких месяцев. Такое положение имеет стойкий̆ и транзиторный̆ характер. О вегетативном состоянии можно судить по открытию глаз без слежения и какой-либо фиксации взора. При этом проявляются вариабельные, изменяющиеся очаговые симптомы — разобщение стволовых и полушарных структур. При продолжительном и стойком вегетативном состоянии начинают проявляться вегето-висцеральные нарушения, такие как тахикардия, гипертермия, гиперемия лица. Чаще всего появление таких симптомов обусловлено поражением соматических органов и интеркуррентными инфекциями. Также при вегетативном состоянии развиваются нейротрофические расстройства, в основном пролежни.
Диагностика
Существует ряд признаков, по которым специалистам удается определять диффузное аксональное повреждение у пациентов:
- механизм полученной̆ черепно-мозговой̆ травмы с угловым ускорением падения;
- наступление комы сразу после травмы;
- характерные особенности клинических симптомов;
- отсутствие застойных изменений дисков зрительных нервов.
Несмотря на перечисленные признаки, врачи испытывают большие трудности при определении данной̆ болезни.
Кроме того, нередко болезнь сопровождается скоплением жидкости над лобными долями. Наибольшую сложность представляет диагностика легких и средних степеней̆ диффузных аксональных повреждений, при которых, как правило, отсутствуют какие-либо видимые патологии: микроскопические признаки, не наблюдаются, отек мозга, а также геморрагии незначительны.
Если МРТ головного мозга не отличается от картины здорового человека, специалисты руководствуются типичной̆ томографической динамикой̆, то есть регресс геморрагий и отека с тенденцией̆ к расширению желудочков, после чего следует вентрикуломегалия, а также нарастание диффузной̆ атрофии церебральных структур.
Лечение
Основные методы лечения, в которых нуждаются пациенты с диффузным аксональным повреждением — это постоянная искусственная вентиляция легких, пути питания, которые не подразумевают использование кишечно-желудочного тракта, и интенсивная терапия. Ее целью является поддержка и восстановление гомеостаза, устранение отека мозга, а также всех основных систем и функций организма. Естественно такая терапия должна предотвращать появление любых инфекционных болезней. Существуют случаи сильного осложнения в работе моторных функций. Тогда врачи прибегают к использованию наркоза.
Первое, что необходимо сделать после выхода из состояния комы — это ускоренное уменьшение отклонений, связанных с психическим и эмоциональным здоровьем. Этого можно достичь с помощью психостимулотерапии.

Восстановление центральной нервной системы происходит с помощью принятия предназначенных для этого препаратов: ноотропных и сосудистых.
К первым относятся пирацетам, ницерголин, кортексин и гамма-аминомасляная кислота, ко вторым — циннаризин и винпоцетин. Если у пациента есть определенные особенности протекания восстановительного периода, то ему в лечение добавляют нейромедиаторы (левадоп и пирибедил) и антихолинэстеразные средства (галантамин и неостигмин).
Что касается противопоказаний, то категорически не рекомендуются хирургические процедуры. Врачи допускают вмешательство хирургического лечения только при наличии опасности сдавливания головного мозга. Такая угроза может возникнуть в связи с внутричерепными травмами, например, очаги размозжения, внутричерепные или субдуральные гематомы, вдавленные переломы черепа.
Прогноз
Последствия после диффузного аксонального повреждения и окончательный исход зависят в первую очередь от степени тяжести болезни. На основе многих исследований в последнее время большую популярность приобрела теория о том, что существует регенерация аксонов у детей, подростков, пострадавших молодого возраста. Такое предположение связано с нередким частичным восстановлением неврологических и психических функций у представителей более молодого возраста.

Резидуальными остаточными явлениями после перенесения диффузного аксонального повреждения являются:
- парезы;
- параличи;
- мнестические нарушения;
- психические расстройства;
- нарушения речи;
- бульбарный синдром;
- экстрапирамидные расстройства.
Выход из вегетативного состояния, как правило, сопровождается экстрапирамидной симптоматикой, которая выражается в вторичном паркинсонизме и мелкой гиперкинезы. Последнее сопровождается выраженными нарушениями психики.
К сожалению, в связи с истощением нейромедиаторных реакций и возникновением осложнений соматического характера, стойкое вегетативное состояние практически всегда приводит к летальному исходу.
Автор: Кокунин Алексей, врач-рентгенолог, эксперт MRT-v-MSK
Диффузное аксональное повреждение головного мозга
Диффузное аксональное повреждение головного мозга — вариант тяжелой черепно-мозговой травмы, основным субстратом которого выступают диффузные разрывы или надрывы аксонов. Клинически с первых минут травмы наблюдается кома с симптомами стволового поражения, которая может перейти в вегетативное состояние. Диагностика осуществляется по травматическому анамнезу, особенностям клиники и томографическим данным. Лечение комы заключается в проведении ИВЛ и интенсивной терапии, после выхода из комы применяют сосудистые, ноотропные, метаболические препараты, лечебную физкультуру, психостимуляцию, логопедическую коррекцию.
Общие сведения
Диффузное аксональное повреждение мозга как отдельный вид тяжелой ЧМТ было описано в 1956 г., термин предложен в 1982 г. Диффузное аксональное повреждение (ДАП) характеризуется продолжительным коматозным состоянием, возникающим с момента ЧМТ. Его морфологическим субстратом выступают обусловленные травмой диффузно распространенные по церебральным структурам разрывы аксонов и мелкоочаговые кровоизлияния. Наиболее типичными зонами повреждения являются мозговой ствол, белое вещество полушарий, мозолистое тело и перивентрикулярные области. ДАП распространено преимущественно среди лиц молодого возраста и детей. В детском возрасте сопровождается более грубыми неврологическими нарушениями и более глубокой комой.
Отдельные авторы предлагают разделение ДАП по степени тяжести. Легкой степени соответствует длительность комы 6-24 ч, умеренной — кома дольше суток, но без грубых стволовых проявлений. Тяжелое диффузное аксональное повреждение характеризуется продолжительной комой с симптомами декортикации и децеребрации. В любом случае ДАП — это серьезное состояние с высоким риском перехода в вегетативное состояние и летального исхода. В связи с этим его эффективное лечение остается актуальной проблематикой практической травматологии и неврологии.
Диффузное аксональное повреждение головного мозга
Причины и морфология диффузного аксонального повреждения
ДАП возникает вследствие травм, обусловленных угловым ускорением головы. При этом может не быть прямого контакта головы с твердым предметом. Поэтому у ряда пациентов с ДАП отсутствуют переломы черепа и другие визуальные повреждения. Наблюдения показали, что ускорение в сагиттальной плоскости вызывает в основном сосудистые повреждения с образованием кровоизлияний в веществе мозга, а ускорения в косой и боковой плоскостях — травмирование аксонов.
Причинами ДАП выступают преимущественно автомобильные травмы, падения с высоты (кататравмы) и баротравмы. Именно при таких травмах происходит угловое ускорение головы. При этом более подвижные полушария мозга подвергаются ротации, а более фиксированные стволовые отделы — перекручиванию. Кроме того, возможно взаимное смещение отдельных слоев или частей головного мозга. Даже небольшое смещение церебральных структур способно привести к частичному или полному разрыву аксонов, а также мелких сосудов.
Морфологически для ДАП патогномоничны 3 признака: очаг повреждения в мозолистом теле, очаг в стволе мозга и диффузные аксональные разрывы. Первые 2 признака являются макроскопическими и вначале имеют вид обычного кровоизлияния (гематомы) размером до 5 мм. Иногда они выглядят как надрыв ткани, края которого пропитаны кровью. Спустя несколько дней после ЧМТ очаги повреждения трансформируются в пигментированные в цвет ржавчины участки, а затем на их месте формируются рубцы. Очаги повреждения в мозолистом теле могут разрешаться с образованием небольших кист.
Выявление аксональных повреждений возможно только путем специальных микроскопических исследований тканей мозга (иммуно-гистохимическим методом и путем импрегнации серебром), которые дают возможность увидеть множественные аксональные шары, расположенные в местах разрывов нервных волокон. Дальнейшие изменения характеризуются макрофагальной реакцией с появлением реактивных микроглиоцитов и астроцитов. Отсутствие сегментоядерных элементов резко отличает картину ДАП от изменений, происходящих при ушибе головного мозга. Спустя 2-3 недели наблюдается фрагментация и демиелинизация поврежденных аксонов. Причем процесс демиелинизации имеет тенденцию к распространению по проводящим путям, и чем более длительно протекает кома и вегетативное состояние, тем он более распространен.
Симптомы диффузного аксонального повреждения
Отличительной особенностью ДАП, в сравнении с клиникой других ЧМТ, выступает длительная умеренная или глубокая кома, возникающая сразу после получения травмы. У взрослых соотношение случаев умеренной комы к глубокой составляет 63% к 37%, у детей — 43% к 57%. Средняя длительность комы варьирует от 3 до 13 суток.
Типичными для комы при ДАП являются позно-тонические реакции диффузного характера, провоцируемые различными раздражителями, периодическое моторное возбуждение на фоне адинамии. Характерна стволовая симптоматика: снижение или полное выпадение фотореакции и корнеальных рефлексов, анизокория, различное расположение зрачков по горизонтали, расстройство дыхательного ритма и частоты дыхания. Кроме этого, в неврологическом статусе зачастую выявляется вариабельный спонтанный нистагм, ригидность мышц затылка и симптом Кернига, вегетативные симптомы (гипергидроз, артериальная гипертензия, гиперсаливация и пр.).
Двигательные расстройства обычно представлены грубым пирамидно-экстрапирамидным тетрасиндромом. У большинства пострадавших руки со свисающими кистями приведены к туловищу и согнуты в локтях (т. н. «лапки кенгуру»). Сухожильные рефлексы вначале повышены, затем снижаются или полностью выпадают. Зачастую имеют место патологические стопные знаки. Нарушения мышечного тонуса варьируют от генерализованной гипотонии до горметонии, склонны изменяться, часто имеют асимметричный или диссоциативный характер.
Варианты исходов диффузного аксонального повреждения
У выживших пациентов дальнейшее течение ДАП может идти в 2-х направлениях: выход из комы и переход в вегетативное состояние. В первом случае начинает происходить открывание глаз, сопровождающееся слежением и фиксацией взора. Оно может быть как спонтанным, так и спровоцированным различными раздражителями (звуковыми, болевыми). Постепенно происходит восстановление сознания, становится возможным исполнение простых инструкций, расширяется словесный контакт. Этот процесс сопровождается медленным регрессом неврологических проявлений.
Длительная кома в большинстве случаев приводит к переходу в вегетативное состояние, которое может иметь стойкий или транзиторный характер и продолжаться от 1-2 дней до нескольких месяцев. О наступлении вегетативного состояния говорит открывание глаз, не сопровождающееся фиксацией взора и слежением. Появляются признаки разобщения полушарных и стволовых структур — вариабельные, необычные, изменяющиеся очаговые симптомы. При стойких вегетативных состояниях развиваются нейротрофические расстройства (в т. ч. пролежни) и вегето-висцеральные нарушения (тахикардия, гипертермия, гиперемия лица, тахипноэ и др.). Существенную роль в возникновении последних играет появляющееся как осложнение поражение соматических органов (полиорганная недостаточность) и интеркуррентные инфекции (пневмония, пиелонефрит, сепсис).
Диагностика диффузного аксонального повреждения
В пользу ДАП свидетельствует механизм полученной ЧМТ с угловым ускорением головы, наступление комы сразу после травмы и характерные особенности ее клиники. Отличительным признаком является также отсутствие застойных изменений дисков зрительных нервов при офтальмоскопии пациентов с ДАП даже в случае продолжительной комы. Однако диагностировать ДАП клинически неврологу и травматологу достаточно сложно.
Достоверно выставить диагноз «Диффузное аксональное повреждение» позволяет наличие на МРТ или КТ головного мозга патогномоничных макроскопических признаков. На КТ и МРТ головного мозга в остром периоде определяется отек головного мозга с уменьшением желудочков и субарахноидальных пространств; зачастую над лобными долями визуализируется скопление жидкости. Более трудной является диагностика легких и средних степеней ДАП, при которых макроскопические признаки обычно отсутствуют, отек мозга и геморрагии выражены незначительно, а в некоторых случаях томографическая картина существенно не отличается от нормы. В такой ситуации опираются на типичную томографическую динамику — регресс геморрагий и отека с тенденцией к расширению желудочков, последующая вентрикуломегалия и нарастание диффузной атрофии церебральных структур.
Лечение диффузного аксонального повреждения
Пациентам с ДАП в состоянии комы необходимы длительная ИВЛ, парентеральное питание и интенсивная терапия, направленная на поддержание гомеостаза и основных систем организма, купирование отека мозга, предупреждение инфекционных осложнений. В случае эпизода выраженного моторного возбуждения иногда приходится прибегать к лечебному использованию наркоза. После выхода из комы целесообразно раннее начало психостимулотерапии для скорейшего регресса психоэмоциональных расстройств, ЛФК для восстановления двигательной активности и профилактики контрактур суставов, логопедической коррекции нарушений речи. С целью улучшения функционирования ЦНС назначают ноотропные (ницерголин, пирацетам, кортексин, гамма-аминомасляная к-та) и сосудистые (винпоцетин, циннаризин) препараты. При наличии показаний в схему лечения включают антихолинэстеразные (неостигмин, галантамин) средства и нейромедиаторы (левадопу, пирибедил).
Хирургическое лечение не показано. Оно проводится только при наличии сопутствующих внутричерепных повреждений (субдуральных или внутримозговых гематом, очагов размозжения, вдавленных переломов черепа и т. п.), опасных развитием сдавления головного мозга.
Прогноз диффузного аксонального повреждения
Исход ДАП зависит от степени его тяжести. Последнее время высказано предположение о возможной регенерации аксонов у детей и пострадавших молодого возраста, в пользу чего свидетельствует происходящее со временем частичное восстановление неврологических и психических функций у перенесших ДАП. Однако, чем более длительно протекает кома и чем более грубой неврологической симптоматикой она сопровождается, тем больше вероятность выраженной инвалидизации в случае выживания пострадавшего. Диффузное аксональное повреждение с комой длительностью не более 7 суток заканчивается хорошим восстановлением или умеренной инвалидизацией. ДАП с комой дольше 8 суток, как правило, приводит к грубой инвалидизации или переходу в вегетативное состояние.
Резидуальными остаточными явлениями после перенесенного ДАП выступают парезы и параличи, мнестические нарушения, психические расстройства, нарушения речи, бульбарный синдром, экстрапирамидные расстройства. У пациентов, вышедших из вегетативного состояния, преобладает экстрапирамидная симптоматика: вторичный паркинсонизм и мелкие гиперкинезы, сопровождающаяся выраженными нарушениями психики (деменцией, аффективными расстройствами, амнестической спутанностью, аспонтанностью). Стойкое вегетативное состояние приводит к летальному исходу вследствие истощения нейромедиаторных реакций и возникновения осложнений соматического характера.
Диффузное аксональное повреждение головного мозга — лечение в Москве
From Wikipedia, the free encyclopedia
| Diffuse axonal injury | |
|---|---|
 |
|
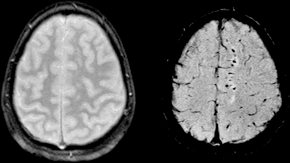
| Two MRI images of a patient with diffuse axonal injury resulting from trauma, at 1.5 tesla field strength. Left: conventional gradient recalled echo (GRE). Right: Susceptibility weighted image (SWI). | |
| Specialty | Neurology |
Diffuse axonal injury (DAI) is a brain injury in which scattered lesions occur over a widespread area in white matter tracts as well as grey matter.[1][2][3][4][5][6][7] DAI is one of the most common and devastating types of traumatic brain injury[8] and is a major cause of unconsciousness and persistent vegetative state after severe head trauma.[9] It occurs in about half of all cases of severe head trauma and may be the primary damage that occurs in concussion. The outcome is frequently coma, with over 90% of patients with severe DAI never regaining consciousness.[9] Those who awaken from the coma often remain significantly impaired.[10]
DAI can occur across the spectrum of traumatic brain injury (TBI) severity, wherein the burden of injury increases from mild to severe.[11][12] Concussion may be a milder type of diffuse axonal injury.[12][13]
Mechanism[edit]
DAI is the result of traumatic shearing forces that occur when the head is rapidly accelerated or decelerated, as may occur in car accidents, falls, and assaults.[14] Vehicle accidents are the most frequent cause of DAI; it can also occur as the result of child abuse[15] such as in shaken baby syndrome.[16]
Immediate disconnection of axons may be observed in severe brain injury, but the major damage of DAI is delayed secondary axon disconnections, slowly developed over an extended time course.[2] Tracts of axons, which appear white due to myelination, are referred to as white matter. Lesions in both grey and white matter are found in postmortem brains in CT and MRI exams.[9]
Besides mechanical breakage of the axonal cytoskeleton, DAI pathology also includes secondary physiological changes, such as interrupted axonal transport, progressive swelling and degeneration.[17] Recent studies have linked these changes to twisting and misalignment of broken axon microtubules, as well as tau protein and amyloid precursor protein (APP) deposition.[17][18]
Characteristics[edit]
Lesions typically are found in the white matter of brains injured by DAI; these lesions vary in size from about 1–15 mm and are distributed in a characteristic pattern.[9] DAI most commonly affects white matter in areas including the brain stem, the corpus callosum, and the cerebral hemispheres.
The lobes of the brain most likely to be injured are the frontal and temporal lobes.[19] Other common locations for DAI include the white matter in the cerebral cortex, the superior cerebral peduncles,[16] basal ganglia, thalamus, and deep hemispheric nuclei.[clarification needed][20] These areas may be more easily damaged because of the difference in density between them and the other regions of the brain.[20]
Histological characteristics[edit]
DAI is characterized by axonal separation, in which the axon is torn at the site of stretch and the part distal to the tear degrades by a process known as Wallerian degeneration. While it was once thought that the main cause of axonal separation was tearing due to mechanical forces during the trauma event, it is now understood that axons are not typically torn upon impact; rather, secondary biochemical cascades, which occur in response to the primary injury (which occurs as the result of mechanical forces at the moment of trauma) and take place hours to days after the initial injury, are largely responsible for the damage to axons.[21][22][23]
Though the processes involved in secondary brain injury are still poorly understood, it is now accepted that stretching of axons during injury causes physical disruption to and proteolytic degradation of the cytoskeleton.[24] It also opens sodium channels in the axolemma, which causes voltage-gated calcium channels to open and Ca2+ to flow into the cell.[24] The intracellular presence of Ca2+ triggers several different pathways, including activating phospholipases and proteolytic enzymes damaging mitochondria and the cytoskeleton, and activating secondary messengers, which can lead to separation of the axon and death of the cell.[21]
Cytoskeleton disruption[edit]
Immunoreactive axonal profiles are observed as either granular (B, G, H) or more elongated, fusiform (F) swellings in the corpus callosum and the brain stem (H) at 24h post traumatic brain injury. Example of APP immunoreactive neurons (arrow heads) observed in the cortex underneath the impact site (E, G). No APP staining was observed in healthy control animals (D).[23]
Axons are normally elastic, but when rapidly stretched they become brittle, and the axonal cytoskeleton can be broken. Misalignment of cytoskeletal elements after stretch injury can lead to tearing of the axon and death of the neuron. Axonal transport continues up to the point of the break in the cytoskeleton, but no further, leading to a buildup of transport products and local swelling at that point.[25] When this swelling becomes large enough, it can tear the axon at the site of the cytoskeleton break, causing it to draw back toward the cell body and form a bulb.[11] This bulb is called a «retraction ball», the histological hallmark of diffuse axonal injury.[9]
When the axon is torn, Wallerian degeneration, in which the part of the axon distal to the break degrades, takes place within one to two days after injury.[26] The axolemma disintegrates,[26] myelin breaks down and begins to detach from the cell in an anterograde direction (from the body of the cell toward the end of the axon),[27] and nearby cells begin phagocytic activity, engulfing the cellular debris.[28]
Calcium influx[edit]
While sometimes only the cytoskeleton is disturbed, frequently disruption of the axolemma occurs as well, causing the influx of Ca2+ ions into the cell and unleashing a variety of degradational processes.[26][29] An increase in Ca2+ and Na+ levels and a drop in K+ levels are found within the axon immediately after injury.[21][26] Possible routes of Ca2+ entry include sodium channels, pores formed in the membrane during stretch, and failure of ATP-dependent transporters due to mechanical blockage or lack of available metabolic energy.[21] High levels of intracellular Ca2+, the major cause of post-injury cell damage,[30] destroy mitochondria,[11] and trigger phospholipases and proteolytic enzymes that damage Na+ channels and degrade or alter the cytoskeleton and the axoplasm.[31][26] Excess Ca2+ can also lead to damage to the blood–brain barrier and swelling of the brain.[30]
One of the proteins activated by the presence of calcium in the cell is calpain, a Ca2+-dependent non-lysosomal protease.[31] About 15 minutes to half an hour after the onset of injury, a process called calpain-mediated spectrin proteolysis, or CMSP, begins to occur.[32] Calpain breaks down a molecule called spectrin, which holds the membrane onto the cytoskeleton, causing the formation of blebs and the breakdown of the cytoskeleton and the membrane, and ultimately the death of the cell.[31][32] Other molecules that can be degraded by calpains are microtubule subunits, microtubule-associated proteins, and neurofilaments.[31]
Generally occurring one to six hours into the process of post-stretch injury, the presence of calcium in the cell initiates the caspase cascade, a process in cell injury that usually leads to apoptosis, or «programmed cell death».[32]
Mitochondria, dendrites, and parts of the cytoskeleton damaged in the injury have a limited ability to heal and regenerate, a process which occurs over two or more weeks.[33] After the injury, astrocytes can shrink, causing parts of the brain to atrophy.[9]
Diagnosis[edit]
Diffuse axonal injury after a motorcycle accident. MRI after 3 days: on T1-weighted images the injury is barely visible. On the FLAIR, DWI and T2*-weighted images a small bleed is identifiable.
DAI is difficult to detect since it does not show up well on CT scans or with other macroscopic imaging techniques, though it shows up microscopically.[9] However, there are characteristics typical of DAI that may or may not show up on a CT scan. Diffuse injury has more microscopic injury than macroscopic injury and is difficult to detect with CT and MRI, but its presence can be inferred when small bleeds are visible in the corpus callosum or the cerebral cortex.[34] MRI is more useful than CT for detecting characteristics of diffuse axonal injury in the subacute and chronic time frames.[35] Newer studies such as Diffusion Tensor Imaging are able to demonstrate the degree of white matter fiber tract injury even when the standard MRI is negative. Since axonal damage in DAI is largely a result of secondary biochemical cascades, it has a delayed onset, so a person with DAI who initially appears well may deteriorate later. Thus injury is frequently more severe than is realized, and medical professionals should suspect DAI in any patients whose CT scans appear normal but who have symptoms like unconsciousness.[9]
MRI is more sensitive than CT scans, but is still liable to false negatives because DAI is identified by looking for signs of edema, which may not always be present.[33]
DAI is classified into grades based on severity of the injury. In Grade I, widespread axonal damage is present but no focal abnormalities are seen. In Grade II, damage found in Grade I is present in addition to focal abnormalities, especially in the corpus callosum. Grade III damage encompasses both Grades I and II plus rostral brain stem injury and often tears in the tissue.[36]
Treatment[edit]
DAI currently lacks specific treatment beyond that for any type of head injury, which includes stabilizing the patient and trying to limit increases in intracranial pressure (ICP).
History[edit]
The idea of DAI first came about as a result of studies by Sabina Strich on lesions of the white matter of individuals who had sustained head trauma years before.[37] Strich first proposed the idea in 1956, calling it diffuse degeneration of white matter; however, the more concise term «diffuse axonal injury» came to be preferred.[38] Strich was researching the relationship between dementia and head trauma[37] and asserted in 1956 that DAI played an integral role in the eventual development of dementia due to head trauma.[15] The term DAI was introduced in the early 1980s.[39]
Notable examples[edit]
- Top Gear presenter Richard Hammond sustained a DAI as a result of the Vampire dragster crash in 2006.
- Champ Car World Series driver Roberto Guerrero suffered a DAI as a result of a crash during testing at the Indianapolis Motor Speedway in 1987.[40]
- Formula 1 driver Jules Bianchi suffered a DAI as a result of an accident at the 2014 Japanese Grand Prix[41] and died, without regaining consciousness, 9 months later on 17 July 2015.[42]
- Actor and audiobook narrator Frank Muller, who read Stephen King’s The Dark Tower, suffered a DAI in 2001 due to a motorcycle accident. He died in 2008.[43]
- NASCAR driver Adam Petty, grandson of seven time Cup Series champion Richard Petty, sustained a diffuse axonal injury secondary to a fatal basilar skull fracture in May 2000 at New Hampshire Motor Speedway during practice for the upcoming race.
See also[edit]
- Brain injury
- Axoplasmic transport
References[edit]
- ^ Strich SJ (August 1956). «Diffuse degeneration of the cerebral white matter in severe dementia following head injury». Journal of Neurology, Neurosurgery, and Psychiatry. 19 (3): 163–85. doi:10.1136/jnnp.19.3.163. PMC 497203. PMID 13357957.
- ^ a b Povlishock JT, Becker DP, Cheng CL, Vaughan GW (May 1983). «Axonal change in minor head injury». Journal of Neuropathology and Experimental Neurology. 42 (3): 225–42. doi:10.1097/00005072-198305000-00002. PMID 6188807. S2CID 24260379.
- ^ Adams JH (March 1982). «Diffuse axonal injury in non-missile head injury». Injury. 13 (5): 444–5. doi:10.1016/0020-1383(82)90105-X. PMID 7085064.
- ^ Christman CW, Grady MS, Walker SA, Holloway KL, Povlishock JT (April 1994). «Ultrastructural studies of diffuse axonal injury in humans». Journal of Neurotrauma. 11 (2): 173–86. doi:10.1089/neu.1994.11.173. PMID 7523685.
- ^ Povlishock JT, Christman CW (August 1995). «The pathobiology of traumatically induced axonal injury in animals and humans: a review of current thoughts». Journal of Neurotrauma. 12 (4): 555–64. doi:10.1089/neu.1995.12.555. PMID 8683606.
- ^ Vascak M, Jin X, Jacobs KM, Povlishock JT (May 2018). «Mild Traumatic Brain Injury Induces Structural and Functional Disconnection of Local Neocortical Inhibitory Networks via Parvalbumin Interneuron Diffuse Axonal Injury». Cerebral Cortex. 28 (5): 1625–1644. doi:10.1093/cercor/bhx058. PMC 5907353. PMID 28334184.
- ^ Smith DH, Hicks R, Povlishock JT (March 2013). «Therapy development for diffuse axonal injury». Journal of Neurotrauma. 30 (5): 307–23. doi:10.1089/neu.2012.2825. PMC 3627407. PMID 23252624.
- ^ Povlishock JT, Katz DI (January 2005). «Update of neuropathology and neurological recovery after traumatic brain injury». The Journal of Head Trauma Rehabilitation. 20 (1): 76–94. doi:10.1097/00001199-200501000-00008. PMID 15668572. S2CID 1094129.
- ^ a b c d e f g h Wasserman J. and Koenigsberg R.A. (2007). Diffuse axonal injury. Emedicine.com. Retrieved on 2008-01-26.
- ^ Vinas F.C. and Pilitsis J. (2006). Penetrating head trauma. Emedicine.com. Retrieved on 2008-01-14.
- ^ a b c Smith DH, Meaney DF (December 2000). «Axonal damage in traumatic brain injury». The Neuroscientist. 6 (6): 483–95. doi:10.1177/107385840000600611. S2CID 86550146.
- ^ a b Blumbergs PC, Scott G, Manavis J, Wainwright H, Simpson DA, McLean AJ (August 1995). «Topography of axonal injury as defined by amyloid precursor protein and the sector scoring method in mild and severe closed head injury». Journal of Neurotrauma. 12 (4): 565–72. doi:10.1089/neu.1995.12.565. PMID 8683607.
- ^ Bazarian JJ, Blyth B, Cimpello L (February 2006). «Bench to bedside: evidence for brain injury after concussion—looking beyond the computed tomography scan». Academic Emergency Medicine. 13 (2): 199–214. doi:10.1197/j.aem.2005.07.031. PMID 16436787.
- ^ Gennarelli TA (1993). «Mechanisms of brain injury». The Journal of Emergency Medicine. 11 Suppl 1: 5–11. PMID 8445204.
- ^ a b
Hardman JM, Manoukian A (May 2002). «Pathology of head trauma». Neuroimaging Clinics of North America. 12 (2): 175–87, vii. doi:10.1016/S1052-5149(02)00009-6. PMID 12391630. - ^ a b Smith D. and Greenwald B. 2003.Management and staging of traumatic brain injury. Emedicine.com. Retrieved through web archive on 17 January 2008.
- ^ a b Johnson VE, Stewart W, Smith DH (August 2013). «Axonal pathology in traumatic brain injury». Experimental Neurology. Special Issue: Axonal degeneration. 246: 35–43. doi:10.1016/j.expneurol.2012.01.013. PMC 3979341. PMID 22285252.
- ^ Tang-Schomer MD, Patel AR, Baas PW, Smith DH (May 2010). «Mechanical breaking of microtubules in axons during dynamic stretch injury underlies delayed elasticity, microtubule disassembly, and axon degeneration». FASEB Journal. 24 (5): 1401–10. doi:10.1096/fj.09-142844. PMC 2879950. PMID 20019243.
- ^ Boon R, de Montfor GJ (2002). «Brain injury». Learning Discoveries Psychological Services. Archived from the original on 2006-09-03. Retrieved 17 January 2008.
- ^ a b Singh J, Stock A (September 25, 2006). «Head Trauma». Emedicine.com. Retrieved 2008-01-17.
- ^ a b c d Wolf JA, Stys PK, Lusardi T, Meaney D, Smith DH (2001). «Traumatic axonal injury induces calcium influx modulated by tetrodotoxin-sensitive sodium channels». Journal of Neuroscience. 21 (6): 1923–1930. doi:10.1523/JNEUROSCI.21-06-01923.2001. PMC 6762603. PMID 11245677.
- ^ Arundine M, Aarts M, Lau A, Tymianski M (September 2004). «Vulnerability of central neurons to secondary insults after in vitro mechanical stretch». Journal of Neuroscience. 24 (37): 8106–23. doi:10.1523/JNEUROSCI.1362-04.2004. PMC 6729801. PMID 15371512.
- ^ a b Mouzon B, Chaytow H, Crynen G, Bachmeier C, Stewart J, Mullan M, Stewart W, Crawford F (December 2012). «Repetitive mild traumatic brain injury in a mouse model produces learning and memory deficits accompanied by histological changes» (PDF). Journal of Neurotrauma. 29 (18): 2761–2173. doi:10.1089/neu.2012.2498. PMID 22900595.
- ^ a b Iwata A, Stys PK, Wolf JA, Chen XH, Taylor AG, Meaney DF, Smith DH (2004). «Traumatic axonal injury induces proteolytic cleavage of the voltage-gated sodium channels modulated by tetrodotoxin and protease inhibitors». The Journal of Neuroscience. 24 (19): 4605–4613. doi:10.1523/JNEUROSCI.0515-03.2004. PMC 6729402. PMID 15140932.
- ^ Staal JA, Dickson TC, Chung RS, Vickers JC (2007). «Cyclosporin-A treatment attenuates delayed cytoskeletal alterations and secondary axotomy following mild axonal stretch injury». Developmental Neurobiology. 67 (14): 1831–1842. doi:10.1002/dneu.20552. PMID 17702000. S2CID 19415197.
- ^ a b c d e LoPachin RM, Lehning EJ (1997). «Mechanism of calcium entry during axon injury and degeneration». Toxicology and Applied Pharmacology. 143 (2): 233–244. doi:10.1006/taap.1997.8106. PMID 9144441.
- ^ Cowie RJ, Stanton GB (2005). «Axoplasmic transport and neuronal responses to injury». Howard University College of Medicine. Archived from the original on 2005-10-29. Retrieved 2008-01-17.
- ^ Hughes PM, Wells GM, Perry VH, Brown MC, Miller KM (2002). «Comparison of matrix metalloproteinase expression during wallerian degeneration in the central and peripheral nervous systems». Neuroscience. 113 (2): 273–287. doi:10.1016/s0306-4522(02)00183-5. PMID 12127085. S2CID 37213275.
- ^ Povlishock JT, Pettus EH (1996). «Traumatically induced axonal damage: Evidence for enduring changes in axolemmal permeability with associated cytoskeletal change». Acta Neurochirurgica. 66: 81–86. doi:10.1007/978-3-7091-9465-2_15. ISBN 978-3-7091-9467-6. PMID 8780803.
- ^ a b Zhou F, Xiang Z, Feng WX, Zhen LX (2001). «Neuronal free Ca2+ and BBB permeability and ultrastructure in head injury with secondary insult». Journal of Clinical Neuroscience. 8 (6): 561–563. doi:10.1054/jocn.2001.0980. PMID 11683606. S2CID 43789581.
- ^ a b c d Castillo MR, Babson JR (1998). «Ca2+-dependent mechanisms of cell injury in cultured cortical neurons». Neuroscience. 86 (4): 1133–1144. doi:10.1016/s0306-4522(98)00070-0. PMID 9697120. S2CID 54228571.
- ^ a b c Büki A, Okonkwo DO, Wang KK, Povlishock JT (April 2000). «Cytochrome c release and caspase activation in traumatic axonal injury». primary. The Journal of Neuroscience. 20 (8): 2825–34. doi:10.1523/JNEUROSCI.20-08-02825.2000. PMC 6772193. PMID 10751434.
- ^ a b Corbo J, Tripathi P (2004). «Delayed presentation of diffuse axonal injury: A case report». Trauma. 44 (1): 57–60. doi:10.1016/j.annemergmed.2003.11.010. PMID 15226709.
- ^
Crooks CY, Zumsteg JM, Bell KR (November 2007). «Traumatic brain injury: a review of practice management and recent advances». Physical Medicine and Rehabilitation Clinics of North America. 18 (4): 681–710, vi. doi:10.1016/j.pmr.2007.06.005. PMID 17967360. - ^ Maas AI, Stocchetti N, Bullock R (August 2008). «Moderate and severe traumatic brain injury in adults». The Lancet. Neurology. 7 (8): 728–41. doi:10.1016/S1474-4422(08)70164-9. PMID 18635021. S2CID 14071224.
- ^ Lees-Haley PR, Green P, Rohling ML, Fox DD, Allen LM (August 2003). «The lesion(s) in traumatic brain injury: implications for clinical neuropsychology». Archives of Clinical Neuropsychology. 18 (6): 585–94. doi:10.1016/S0887-6177(02)00155-5. PMID 14591433.
- ^ a b
Pearce JM (2007). «Observations on concussion. A review». European Neurology. 59 (3–4): 113–9. doi:10.1159/000111872. PMID 18057896. S2CID 10245120. - ^
Gennarelli GA, Graham DI (2005). «Neuropathology». In Silver JM, McAllister TW, Yudofsky SC (eds.). Textbook Of Traumatic Brain Injury. Washington, DC: American Psychiatric Association. p. 34. ISBN 978-1-58562-105-7. Retrieved 2008-06-10. - ^ Granacher RP (2007). Traumatic Brain Injury: Methods for Clinical & Forensic Neuropsychiatric Assessment, Second Edition. Boca Raton: CRC. pp. 26–32. ISBN 978-0-8493-8138-6. Retrieved 2008-07-06.
- ^ «The story of Roberto Guerrero».
- ^ «Jules Bianchi: Family confirms Formula One driver sustained traumatic brain injury in Japanese GP crash». Retrieved 8 October 2014.
- ^ «F1 driver Jules Bianchi dies from crash injuries». BBC Sport. BBC. 2015-07-18. Retrieved 18 July 2015.
- ^ «Frank Muller, The Fight of his Life». 2006. Retrieved December 14, 2017.
External links[edit]
- Diffuse Axonal Injury MRI and CT Images
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ефимов А.А.
1
Савенкова Е.Н.
1
Алексеев Ю.Д.
1
Райкова К.А.
1
Коротина О.С.
1
Корсак В.О.
1
1 ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
Диффузное аксональное повреждение (ДАП) головного мозга остается предметом исследования с позиций разных специальностей и не теряет своей актуальности, как вариант тяжелой формы черепно-мозговой травмы. Проблема судебно-медицинской диагностики ДАП в настоящее время требует обобщения и анализа теоретических данных для их практического применения и выработки алгоритма постановки диагноза этой сложной патологии. Несоответствие тяжести состояния пострадавшего и морфологических проявлений при отсутствии стандартизированных критериев судебно-медицинской верификации диктует необходимость дальнейшего изучения данного вопроса. В обзоре представлены современные сведения о механизме, патоморфологической и клинической картине, а также существующих методах судебно-медицинской диагностики ДАП. Проанализирована возможность использования различных веществ в качестве индикаторов повреждения головного мозга (таких как β-APP белки, белок S-100, нейрон-специфическая енолаза, глиальный фибриллярный кислый протеин, альфа-II-спектрин, расщепленный тау-белок). Представленные данные научных работ свидетельствуют о необходимости комплексного применения различных методов исследования (анализ клинической картины, морфологических, гистологических изменений и биомаркеров) в случаях с подозрением на ДАП. Это позволит повысить обоснованность судебно-медицинской диагностики данной патологии в случаях тяжелых черепно-мозговых травм.
диффузное аксональное повреждение
черепно-мозговая травма
судебно-медицинская экспертная оценка дап
1. Арефьева Е.Г., Гатин Д.В., Мошнегуц С.В., Рохленко О.В., Ушаков А.В., Шалякин К.Л. Диффузное аксональное повреждение: кт-картина и клинические наблюдения// Медицинская визуализация. 2012. № 1. С. 45-50.
2. Арушанян М.Ю. Диффузное аксональное повреждение головного мозга // Евразийское Научное Объединение. 2019. № 6-3 (52). С. 173-176.
3. Лихтерман Л.Б. Диффузное аксональное повреждение головного мозга // Неврология и ревматология. Приложение к журналу ConsiliumMedicum. 2016. № 1. С. 44-51.
4. Храпов Ю.В., Поройский С.В. Роль биомаркеров повреждения вещества головного мозга в диагностике, оценке эффективности лечения и прогнозировании исходов тяжелой черепно-мозговой травмы. // Волгоградский научно-медицинский журнал. 2013. № 3(39). C. 10–20.
5. SenuakovaO.V., GalanineV.E., KrylovA.S., PetraikinA.V., AkhadovT.A., SidorinS.V. Diffuseaxonalinjurylesionsegmentationusingcontouringalgorithm. In: ProceedingsofGraphiCon. 2011. P 84–87.
6. Vieira R.М., Paiva, W.S., Oliveira D. V., Teixeira M. J., Andrade A. F. Diffuse Axonal Injury: Epidemiology.Outcome and Associated Risk Factors. Frontiers in Neurology. 2016. vol. 7.no. 178. Р. 1-12.
7. Xie Y., Tao X. White matter lesion segmentation using machine learning and weakly labeled MR images. In: Proceeding of SPIE. 2011.no. 7962. P. 132-141.
8. Петряйкин А.В., Ахадов Т.А., Сенюкова О.В., Крылов А.С. Алгоритм идентификации очагов диффузно-аксонального повреждения у больных с черепно-мозговой травмой //Нейроимиджинг и магнитоэнцефалография: фундаментальные исследования и клиническая практика: сборник трудов международного симпозиума. М., 2012. С 92–94.
9. Сафронова Е.С. Диффузное аксональное повреждение мозга — современные представления о патогенетических механизмах и перспективах фармакотерапии // Забайкальский медицинский вестник. 2013. № 1. С. 206-213.
10. Сафронова Е.С., Юнцев С.В., Белозерцев Ю.А. Поиск противосудорожных средств с многофакторным нейропротекторным действием для терапии диффузной аксональной травмы мозга // Вестник Забайкальского государственного университета. 2013. № 4. С. 59-65.
11. Сафронова Е.С., Белозерцев Ю.А., Юнцов С.В. Нейропротекторные свойства снотворных средств при диффузном аксональном повреждении мозга // Сибирский медицинский журнал (Иркутск). 2016. Т. 145. № 6. С. 19-22.
12. Колударова Е.М., Тучик Е.С. Аспекты посмертной диагностики диффузного аксонального повреждения мозга // Вестник судебной медицины. 2019. Т. 8. № 3. С. 44-49.
13. Chen X.H., Siman R., Iwata A., Meaney D.F., Trojanowski J.Q., Smith D.H. Long-term accumulation of amyloid-beta, beta-secretase, presenilin-1, and caspase-3 in damaged axons following brain trauma. Am. J. Pathol. 2004. vol. 165.no. 2. P. 357-371.
14. Netto C.B., Conte S., Leite M.C., Pires C., Martins T.L., Vidal P., Benfato M.S., Giugliani R., Gonçalves C.A. Serum S100B protein is increased in fasting rats. Arch. Med. Res. 2006. vol. 37. no. 5. P. 683–686.
15. Hostiuc S., Pirici D., Negoi I., Ion D.A., Ceausu M. Detection of diffuse axonal injury in forensic pathology. Romanian Journal of Legal Medicine. 2014. vol. 22. no. 3. P. 145-152.
16. Adams J.H., Graham D.I., Murray L.S., Scott G. Diffuse axonal injury due to nonmissile head injury in humans: an analysis of 45 cases. Ann. Neurol. 1982. vol. 12. no. 6. P. 557-563.
17. Strich S.J. Diffuse degeneration of the cerebral white matter in severe dementia following head injury. J. Neurol.NeurosurgPsychiat. 1956. vol. 19. no. 69. P. 163-185.
18. Holbourn A.H. Mechanics of Head Injury. Lancet. 1943. vol. 2. no. 242. P. 438-441.
19. Pudenz R.H., SheldenC.H. Craniel trauma and brain movement. J. Neurosurg. 1946. vol. 3. P. 487-505.
20. Пашинян Г.А., Касумова С.Ю., Добровольский Г.Ф., Ромодановский П.О. Патоморфология и экспертная оценка повреждений головного мозга при черепно-мозговой травме. Москва, Ижевск.: Изд-во «Экспертиза». 1994. 134 с.
21. Gennarelli T.A., Thibault L.E., Adams J.H., Graham D.I., Thompson C.J., Marcincin R.P. Diffuse axonal injury and traumatic coma in the primate Ann. Neurol. 1982. vol. 12. no. 6. P. 564-574.
22. Povlishock J.T., Christman C.W., The Pathobiology of Traumatically Induced Axonal Injury in Animals and Humans: A Review of Current Thoughts. Journal of neurotrauma. 1995. vol. 12. no. 4. P. 555-564.
23. Dolinak D., Matshes E.W., Lew E.O. Forensic Pathology: Principles and Practice (1stedn). USA: Elsevier Academic Press. 2005. P. 442-446.
24. Adams J.H., Doyle D., Graham D.I., Lawrence A.E., McLellan D.R.. Diffuse axonal injury in head injuries caused by a fall. Lancet. 1984. vol. 324. no.8417. P. 1420-1422.
25. Graham D.I., Clark J.C., Adams J.H., Gennarelli T.A. Diffuse axonal injury caused by assault. J.Clin.Pathol. 1992. vol. 45. no. 9. P. 840–841.
26. Niess C, Grauel U, Toennes S.W., Bratzke H. Incidence of axonal injury in human brain tissue. ActaNeuropathol. 2002. vol. 104. no. 1. P. 79-84.
27. Shkrum M.J., Ramsay D.A. Forensic Pathology of Trauma: Common Problems for the Pathologists. (1stedn). Totowa New Jersey: Humana Press. 2007. P. 558-565.
28. Ромодановский П.О. Некоторые аспекты диффузного аксонального повреждения мозга при травме головы // Судебно-медицинская экспертиза. 2013. №3. С. 18-20.
29. Davceva N., Basheska N., Balazic J.DiffuseAxonalInjury – ADistinctClinicopathologicalEntity in Closed Head Injuries. J. Forensic Med Pathol. 2015. vol. 36. no. 3. P. 127-133.
30. Peerless S.J., Rewcastle N.B. Shear Injuries of the Brain. The Canadian Medical Association. 1967. vol. 96. no. 10. P. 577-582.
31. Kaur B., Rutty G.N., Timperley W.R. The possible role of hypoxia in the formation of axonal bulbs. J. Clin. Pathol. 1999. vol. 52. no. 3. P. 203–209.
32. Papa L., Robinson G. Use of biomarkers for diagnosis and management of traumatic brain injury patients.Expert Opinion on Medical Diagnostics. 2008. vol. 2. no. 8. P. 937-945.
33. Frati A.,Cerretani D., Fiaschi A.I.,Frati P., Gatto V.,Russa R.,Pesce A., Pinchi E., Santurro A., Fraschetti F.,Fineschi V. Diffuse Axonal Injury and Oxidative Stress: A Comprehensive Review. Int. J. Mol. Sci. 2017. vol. 18. no. 2. P. 1-20.
34. Lambri M., Djurovic V., Kibble M., Cairns N., Al-Sarraj S. Specificity and sensitivity of beta APP in head injury. Clin. Neuropathol. 2001. vol. 20. № 6. P. 263–271.
35. Reichard R.R., Smith C., Graham D.I. The significance of beta-APP immunoreactivity in forensic practice. Neuropathol. Appl. Neurobiol. 2005. vol. 31. no. 3. P. 304–313.
36. Beaudeux J., Dequen L., Foglietti M.Pathophysiologic aspects of S-100beta protein: a new biological marker of brain pathology. Ann. de biologie Clinique. 1999. vol. 57. no. 3. P. 261-272.
37. Isgro A., Bottoni P., Scatena R. NeuronSpecific Enolase as a Biomarker: Biochemical and Clinical Aspects. Adv. Exp. Med. Biol. 2015. vol. 867. P. 125-143.
38. Thelin E.P., Nelson D.W., Bellander B.M. Utilityofneuron-specificenolaseintraumaticbraininjury;relationstoS100Blevels,outcome,andextracranialinjuryseverity.CriticalCare.2016.vol. 20.no. 1. P. 1-15.
39. Papa L., Lewis L.M., Falk J.L., Zhang Z., Silvestri S., Giordano P., Brophy G.M., Demery J.A., Dixit N.K., Ferguson I., Liu M.C., Mo J., Akinyi L., Schmid K., Mondello S., Robertson C.S., Tortella F.C., Hayes R.L., Wang K.K. Elevated levels of serum glial fibrillary acidic protein breakdown products in mild and moderate traumatic brain injury are associated with intracranial lesions and neurosurgical intervention. Annals of Emergency Medicine. 2012. vol. 59. no. 6. P. 471-483.
40. Краснов А.В. Астроцитарные белки головного мозга: структура, функции, клиническое значение // Неврологический журнал. 2012. №17. С. 37-42.
41. Mondello S., Robicsek S.A., Gabrielli A., Brophy G. M., Papa L., Tepas J., Robertson G., Buki A., Scharf D., Mo J., Akinyi L., Muller U., Wang K.K.W., Hayes R. L. αII-spectrin breakdown products (SBDPs): diagnosis and outcome in severe traumatic brain injury patients. Journal of Neurotrauma. 2011. vol. 27. no. 7. P. 1203-1213.
42. Yokobori S., Hosein K., Burks S., Sharma I., Gajavelli S., Bullock R. Biomarkers for the Clinical Differential Diagnosis in Traumatic Brain Injury-A Systematic Review. CNS Neuroscience & Therapeutics. 2013. vol. 19.no. 8. Р. 556-565.
Диффузное аксональное повреждение (ДАП) как отдельная группа тяжелой черепно-мозговой травмы (ЧМТ) на протяжении многих лет привлекает внимание исследователей разных клинических специальностей [1-3]. Причиной этому отчасти служит отсутствие специфических критериев диагностики данной патологии, лабораторных маркеров этого патологического процесса. Меняется и подход к оценке тяжести и диагностики ДАП, использование шкалы комы Глазго и компьютерной томографии головного мозга в последнее время получили широкое внедрение в клиническую практику [4-6]. Появились работы по созданию алгоритмов формирования общей картины повреждений вещества головного мозга при ДАП с использованием программного обеспечения и вычислительной техники [7; 8]. Ведутся поиски различных вариантов фармакотерапии этой тяжелой формы травматического повреждения вещества головного мозга [9-11]. Несоответствие скудных морфологических проявлений и тяжести клинического состояния осложняет использование этого вида ЧМТ в практике судебно-медицинского эксперта, несмотря на достаточно изученный механизм травмы, приводящий к разрыву аксонов [12]. Пациентам с субдуральными, эпидуральными гематомами и другими формами ЧМТ диагноз ДАП не выставляется, несмотря на возможное повреждение аксональных трактов в этих случаях.
В настоящее время значительное количество работ, посвященных поиску различных биомаркеров-индикаторовДАП,в большинстве своем выполнены на животных,поэтомуих результаты при экстраполяции для применения в клинической практике необходимо интерпретировать с осторожностью [13; 14].
Следует отметить, что основная масса публикаций зарубежных и отечественных научных работ по этой тематике приходится на конец XX – начало XXI века. Были изучены клинические проявления ДАП, механизм травмы, макро- и микроскопическая картина при разных степенях тяжести и на различных сроках после получения травмы, начались исследования биомаркеров, позволяющих диагностировать травму головы, в том числе и повреждения аксонов. В последнее десятилетие интенсивность исследований по проблеме ДАП существенно снизилась. Появляющиеся единичные, в основном зарубежные, публикации, посвященные выявлению маркеров – индикаторов повреждения белого вещества головного мозга, служат целям клинической диагностики ДАП.
Чаще всего ДАП встречается при дорожно-транспортных происшествиях [15]. Поэтому в разрезе судебно-медицинских экспертных исследований проблема ДАП остается не до конца решенной. И принципиальным является не диагностика ДАП как основной или единственной составляющей черепно-мозговой травмы в рамках вопроса о причине смерти, а необходимость верифицировать ДАП при травме головы с переломами черепа, внутричерепными гематомами, ушибами мозга. К сожалению, в экспертной практике при наличии указанных тяжелых ЧМТ этому вопросу уделяется недостаточное внимание, при том что решение этого вопроса позволит экспертам более детально раскрыть механизм повреждений мозгового вещества и конкретизировать условия и этапытравмирования, что часто является ключевым при производстве таких экспертиз.Условия образования ДАП при различных механизмах травмы головы, скудность морфологической картины повреждения мозговой ткани при выраженной тяжести клинического течения посттравматического периода практически с момента травмы определяют необходимость в проведении углубленного анализа сведений и взглядов на ДАП с судебно-медицинских позиций для выработки алгоритма постановки диагноза при данной патологии.
Цель исследования: провести анализ зарубежных и отечественных публикацийпо проблеме диагностики ДАП в контексте возможности комплексного использования различных методик и биомаркеровв судебно-медицинских экспертных целях.
Материал и методы исследования.При подготовке публикации авторы использовали интернет-ресурсы: научная электронная библиотека (elibrary), SciVerse (ScienceDirect), Scopus, PubMed, GoogleScholar, BioMedSearch и Discover. Поиск публикаций осуществлялся по ключевым словам: диффузное аксональное повреждение, механизм ДАП, клиника ДАП, патоморфологическая картина при ДАП, гистологическая картина при ДАП, биомаркеры ДАП, diffuseaxonalinjury, themechanismoftheDAI, theDAIsymptoms, pathomorphologicalchangesintheDAI, histologicalchangesintheDAI, theDAIbiomarkers.После подборки научных публикаций описательным методом проводили обобщение и анализ информации о механизмах возникновения, диагностических критериях, клинических формах, вариантах течения, морфологической картине и биомаркерах ДАП.
Результаты исследования и их обсуждение.Термин «диффузное аксональное повреждение» был предложен в 1982 годуJ.H.Adamsс соавт. [16]. Они же описали характерные изменения в головном мозге при ДАП в виде местных повреждений, расположенных в мозолистом теле и (или) в дорсолатеральных квадрантах ростральных отделов мозга, а также диффузные изменения аксонов.
Однако первые описания дегенерации белого вещества головного мозга появились еще в 1940-х годах. Пионером в исследовании и описании этой патологии былаSabinaStrich [17], которая в 1956 году подробно описала морфологическую картину ЧМТ погибших после длительного пребывания в посттравматическом вегетативном состоянии с грубыми неврологическими нарушениями. Макроскопические признаки ЧМТ отсутствовали (за исключением одного пострадавшего с переломом костей черепа), что не соответствовало тяжести состояния, однако в ходе гистологического исследования была выявлена диффузная дегенерация белого вещества головного мозга, причиной которойявилось первичное физическое повреждение аксонов в момент травмы. Свои выводы S.Strich основывала на теоретических и экспериментальных работах A. Holbourn [18] и R.Pudenz, C.Shelden [19].
A.Holbourn, используя желатиновую модель головного мозга, воспроизводил вращательные движения в различных плоскостях (сагиттальной, вертикальной, горизонтальной). Он пришел к выводу, что формирующиеся в результате ускорения вращения«сдвиговые деформации»являются ведущим фактором, который вызывает разрыв синапсов, нервных волокон и кровеносных сосудов головного мозга. Важную рольвозникновения этого феномена авторотводитнесжимаемостии низкой ригидности вещества головного мозга при высокой ригидности черепа.
R.Pudenz,C.Sheldenзаменяли у приматов часть костей черепа прозрачной пластинкой инаносили удары с помощью специального аппарата на основе сжатого воздуха. В ходе исследования было установлено, что в момент удара мозг совершает вращательные и скользящие движения, направление которых зависит от точкиприложения силы. Движения мозговых полушарий наблюдались преимущественно в сагиттальной плоскости. Было отмечено, что удары в лобно-затылочном направленииприводят к смещению мозговых структур в сагиттальной плоскости, а на перемещение мозга при травматическом воздействии существенно влияла подвижность головы. Максимальные изменения отмечались при нефиксированной голове.
В то же времяГ.А.Пашинянс соавторами в монографии «Патоморфология и экспертная оценка повреждений головного мозга при черепно-мозговой травме» [20] утверждали, что повреждение чаще всего затрагивает плоскости между тканями различной плотности (соединение серого и белого вещества) и центр вращения мозга (ростральный отдел ствола). Локализация повреждения аксонов в стволе объясняется, прежде всего, тем, что головной мозг не фиксирован, поэтому при травматическом воздействии происходит некоторое его смещение. В свою очередь спинной мозг фиксирован корешками, что делает его устойчивым при вращении. На границе головного и спинного мозга располагается ствол, и это объясняет его преимущественное повреждение.
T.Gennarelliс соавт. [21] установили, что движение головы во фронтальной плоскости чаще приводит к серьезным аксональным повреждениям, тогда как движение ее в сагиттальной плоскости приводит к мягкому, в крайнем случае умеренному повреждению аксонов.
Несмотря на то что все вышеуказанные исследователи говорили о мгновенном разрыве аксонов под воздействием травмы, более поздниеработыJ. Povlishockс соавт. [22], как с участием экспериментальных животных, так и с использованием данных, полученных при аутопсии потерпевших с ЧМТ, показали, что патогенез травматически индуцированного аксонального повреждения является более сложным, чем первоначально предполагалось. Во многих случаях наблюдался каскад интрааксональных изменений, приводящий к прогрессивному набуханию аксонов и последующему разрыву в период с 12 до 24 часов.D.Dolinak с соавт.[23] с помощью гистохимического и других гистологических методов выяснили, что в момент травмы аксоны не рассекаются. Растяжение аксона приводит к его функциональному повреждению, которое заключается в травме микротрубочек и структуры нейрофиламентов. Цепь химических реакций в функционально поврежденном аксоне приводит к его постепенному отеку и разъединению. В частности, увеличивается проницаемость аксолеммы, и приток кальция запускает кальций-зависимые протеазы. Этот процесс еще сильнее повреждает аксон, что приводит к накоплению аксонального содержимого в месте разрушения. Сначала это приводит к набуханию (аксональные утолщения), а затем к полному разъединению и формированию аксональных шаров.
Наибольшие предпосылки для реализации указанных механизмов имеются при высокоскоростных дорожно-транспортных происшествиях, что определяет значимость изучения ДАП для реконструкции событий при проведении судебно-медицинских экспертиз. Однако имеются данные, свидетельствующие об ином механизме получения данного повреждения: в результате падения с большой высоты; повреждения, полученные при разбойном нападении [24; 25]. C. Niessс соавт.[26] приводят случай повреждения аксонов в результате передозировки наркотическими препаратами, когда при вскрытии была диагностирована субдуральная гематома, при отсутствии переломов костей черепа. В этом случае, по мнению авторов,причиной повреждения аксонов явилась гипоксия при действии на дыхательный центр наркотических веществ. Хотя эти данные представляются весьма сомнительными, так как авторы не приводят сведения катамнеза, исключающие травму, однако исследования, опровергающие указанный механизм образования повреждений аксонов,отсутствуют.
M.J. Shkrum, D.A.Ramsay [27] считают нехарактерным обнаружение контактных повреждений при ДАП, но отмечают, что в некоторых случаяхвстречаются повреждения волосистой части головы, трещиныкостей черепа, субдуральные и субарахноидальные кровоизлияния или ушиб коры головного мозга. По мнению авторов, для ДАП более характерны очаговые кровоизлияния, расположенные в глубоких отделах белого вещества головного мозга (мозолистое тело, внутренняя капсула, верхние ножки мозжечка).При тяжелой степени ДАП взаимное движение между различными участками мозга приводит к разрыву аксонов вместе с мелкими кровеносными сосудами что, в свою очередь, ведет к множественным петехиальным кровоизлияниям в головном мозге, преимущественно локализующимся в белом веществе лобной доли. Это явление носит название «диффузный васкулярный ушиб», отражает тяжесть диффузной травмы мозга и имеет короткий период выживаемости (от нескольких минут до нескольких часов).
Изменение патоморфологической картиныв головном мозгев зависимости от срока, прошедшего после получения травмы, нашло отражение в работе П.О.Ромодановского [28]. Так, при смерти в течение первыхтрех суток отмечается набухание мозга, мелкоочаговые и очаговые кровоизлияния в мозолистом теле, базальных ядрах, семиовальном центре, реже в стволе. При смерти спустя 1 неделю после травмы появляются признаки давности геморрагий в глубинные отделы.Спустя месяц обнаруживаютсябурые кисты в области первичного повреждения белого вещества. А при сроке более 3 месяцев обнаруживаются признаки атрофии мозга, вентрикуломегалии, расширение субарахноидальных пространств.
Для гистологической верификации ДАП автор предлагает комплекс методов окраски, которыми следует пользоваться с учетом сроков посттравматического периода. Основными из них являются методики, позволяющие обнаружить изменения осевых цилиндров (импрегнация серебром по Бильшовскому или Глису), миелиновых оболочек (импрегнация осмием по Марки для выявления ранней демиелинизации, окраска по Шпильмейеру для обнаружения поздней демиелинизации).
N.Davceva с соавт.[29] выделяют два основных признака, на основании которых можно поставить диагноз ДАП. Первый — это наличие диффузного повреждения аксонов белого вещества, и второй — широкая распространенность данного повреждения таким образом, что хотя бы одна поврежденная область располагается выше и одна ниже Tentorium cerebelli, обращая особое внимание на аксональные тракты (мозолистое тело, внутренняя капсула).
Исследования, проведенные S.J.Peerless, N.B.Rewcastle [30], показали, что для ДАП характерным является обнаружение поврежденных аксонов – аксональных утолщений или аксональных шаров – при микроскопическом исследовании. Аксональные утолщения обусловлены удлинением аксонов без разрыва и характеризуются участками утолщения аксонов, разделенными истонченными участками. Аксональные шары (шары Марки, терминальные, ретрагированные шары) встречаются в ранние сроки, после травмы (впервые их можно увидеть в течение двух часов после травмы, а максимального развития они достигают спустя 4 часа). Механизм их возникновения авторы объясняютвытеканием аксоплазмы из обоих концов поврежденного участка нервного волокна при разрыве с формированием булавовидных утолщений. На дистальном сегменте аксональные шары регистрируются лишь в течение 5-7 дней, тогда как на проксимальном сегменте регулярно встречаются в течение многих месяцев и даже лет после травмы, в том случае, если тело клетки выживает. Однако,по мнению B.Kaur с соавт.[31], аксональные шары не являются строго специфичными для травматического генеза повреждения аксонов. Их появление возможно, например, при гипоксии и отсутствии травмы головы.
В работе Г.А. Пашиняна с соавт. [20] отмечается, что с 5-го дня после травмы определялись участки ранней дегенерации белого вещества в областях первичных повреждений. Со второй недели выявлялись выраженные дегенеративные изменения в зонах повреждений и начальные признаки вторичной посттравматической дегенерации с образованием зернистых шаров. При сроке более двух недель появлялись выраженные дегенеративные изменения нервной ткани как в зонах повреждения белого вещества, так и на отдалении. При сроке более месяца в зонах первичных повреждений определялась демиелинизация аксональных структур. При переживании травмы более 3 месяцев наблюдалась диффузная вторичная дегенерация нервной ткани, спинного мозга и в периферической нервной системе.
Помимо вышеуказанных, высокоинформативным методом диагностики (прижизненным и посмертным) является определение биомаркеров повреждения головного мозга. Исходя из анализа исследований, посвященных биомаркерам, проведенного L.Papa, G. Robinson[32], можно сделать вывод, что специфических маркеров ДАП до сих пор не найдено, а результаты многочисленных исследований противоречивы. Но, несмотря на это, исследователи утверждают, что простота использования, точная ранняя диагностика как прижизненно, так и посмертно диктует необходимость в продолжении исследований в отношении биомаркеров повреждения мозга.
X.H.Chen с соавт. [13] и A. Fratiс соавт. [33] предлагают «золотым стандартом» диагностики ДАП считать выявление β-APP белков. Предшественники бета-амилоида(amyloidprecursorprotein, АРР) — это трансмембранные белки, в больших количествах локализующиеся в синаптических мембранах.Их функция пока остается неизвестной. В результате их протеолиза образуются амилоид-β1–40 и амилоид-β1–42. После ЧМТ продукты протеолизаAPP и активированная капсаза-3, а также другие протеолитические ферменты обнаруживаются в аксонах и теле нейрона. Иммуногистохимическим (ИГХ) методом, с помощью антител к β-APP, идентифицируют пораженные аксоны уже через 2-3 часа после травмы. Они остаются видимыми при ИГХ-исследовании длительное время -до 6 месяцев. Следует отметить, что,по данным M. Lambriс соавт. [34] и R. Reichardс соавт.[35], имеются определенные морфологические закономерности распределения иммунореактивных аксонов, позволяющие на микроскопическом уровне отличить травматическое повреждение аксонов от других видов повреждения (гипоксия и т.д.).
J. Beaudeux с соавт. [36] описывает другой примербиомаркера повреждения мозга — белок S-100. Это кальций-связывающий белок, секретируемый преимущественно глиальными клетками. Структурное повреждение этих клеток вызывает утечку этого белка во внеклеточное пространство, затем в спинномозговую жидкость и его дальнейшее поступление в кровоток. Таким образом, повышение концентрации белка S-100 было предложено в качестве индекса повреждения ткани головного мозга.В настоящее времяобсуждается возможность синтеза данного белка другими тканями (например, адипоцитами) [14].
Были обнаружены предиктивные способности нейрон-специфической енолазы – внутриклеточного фермента центральной нервной системы, локализующегося в клетках нейроэктодермального происхождения. Это делает его высокоспецифичным маркером повреждения таких клеток. Однако чаще его используют в диагностике различных злокачественных новообразований [37].
E. Thelinс соавт.[38] обратили внимание, что изменение концентрации белка S-100 было лучшим предиктором травмы головного мозга по сравнению с изменением концентрации нейрон-специфической енолазы. Несмотря на это, оба биомаркера обладают предиктивной способностью независимо друг от друга; способности нейрон-специфической енолазы ограничены при наличии белка S-100, т.к. между ними имеется высокая зависимость. Более того, нейрон-специфическая енолаза в большей степени коррелирует с мультитравмой, однако эффект экстрацеребральной травмы, по-видимому, ограничен первыми 48 часами. Из вышесказанного можно сделать вывод, что хотя оба биомаркера независимо коррелируют с ЧМТ, белокS-100 является более точным предиктором травмы головного мозга и, возможно, более клинически полезным биомаркером, чем нейрон-специфическая енолаза.
В качестве биомаркера повреждения L.Papaс соавт. [39] в своих исследованиях рассматривают глиальный фибриллярный кислый протеин (GFAP). GFAP – это член семейства белков цитоскелета, промежуточный филамент в зрелых астроцитах. Появление его в сыворотке крови является предиктором поражения различных структур мозгового вещества. Помимо этого, стабильно высокий уровень GFAP в течение 2 дней после травмы значительно повышает риск летального исхода у пациентов.
Еще одним предиктором повреждения ткани мозга является альфа-II-спектрин. Альфа-II-спектрин – это компонент цитоскелета нейронов коры головного мозга, субстрат для кальций-активируемых цистеиновыхпротеиназ (калпаин, капсаза-3). Обнаруживается также в пресинаптических окончаниях или в субаксолемномкомпартменте аксонов. Протеиназы являются основными факторами, вызывающими некротические и апоптотические процессы в клетках при ишемии и травме головного мозга, соответственно. Они активируются после травмы и расщепляют спектрин, в результате в цереброспинальной жидкости и тканях мозга значительно повышается концентрация спектрина и продуктов его распада (SBDPs145 – производное калпаина, SBDPs120 – производное каспазы-3). Средняя концентрация SBDPs145 достигает своего пика рано (в течение 6часов после травмы) и снижается медленно (в течение 7 дней). SBDPs120 показывает устойчивый подъем, который сохраняется в течение как минимум 7 дней, тогда как пик концентрации приходится на 5-е сутки. На 2-3-е сутки после ЧМТ уровень альфа-II-спектрина достигает максимума [40; 41].
Рассматривается возможность применения расщепленного тау-белка (MAP-tau) в качестве биомаркера повреждения мозга.Он представляет собой фосфопротеин, ассоциированный с микротрубочками. Чаще всего встречается в нейронах ЦНС, локализуется в аксональном компартменте. В результате повреждения аксонов MAP-tau подвергается протеолизу и получает доступ к спинномозговой жидкости и сыворотке крови. В течение первых 24 часов уровень MAP-tau достигает своего пика, затем постепенно снижается в течение 7 суток [42].
Другие потенциальные биомаркеры при ЧМТ: убиквинтин С-терминальная гидролаза L1 (ubiquitin C-terminalhydrolase, UCH-1), воспалительные цитокины и др., изучены недостаточно и не являются диагностически значимыми.
Заключение
Таким образом, проведенный анализ публикаций результатов исследований ДАП показал отсутствие сформированного, научнообоснованного алгоритма применения клинико-морфологических критериев судебно-медицинской диагностики данной патологии в случаях тяжелой черепно-мозговой травмы. Это свидетельствует о необходимости проведения исследований для поиска комплексного решения данного вопроса с применением различныхметодов исследования (анализ клинической картины, морфологических, гистологических изменений и биомаркеров) в случаях с подозрением на ДАП в судебно-медицинской практике.
Библиографическая ссылка
Ефимов А.А., Савенкова Е.Н., Алексеев Ю.Д., Райкова К.А., Коротина О.С., Корсак В.О. ДИФФУЗНОЕ АКСОНАЛЬНОЕ ПОВРЕЖДЕНИЕ МОЗГА С СУДЕБНО-МЕДИЦИНСКИХ ПОЗИЦИЙ // Современные проблемы науки и образования. – 2020. – № 5.
;
URL: https://science-education.ru/ru/article/view?id=30140 (дата обращения: 04.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Diffuse Axonal Injury
C. Benson, in Encyclopedia of the Neurological Sciences (Second Edition), 2014
Abstract
Diffuse axonal injury (DAI) can be defined as widespread traumatic injury to axons in the cerebral cortex, corpus callosum, and brainstem. It is the leading cause of morbidity and mortality in patients with traumatic brain injury. With rapid acceleration–deceleration of the head, shearing forces cause mechanical axonal damage. This triggers a biochemical cascade resulting in further disruption of the axons. Patients most often present in coma from the time of impact, and survivors are usually severely disabled. Therapeutic interventions to prevent secondary axonal injury remain largely experimental. Prevention strategies remain critical to reduce the morbidity and mortality resulting from DAI.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123851574003262
Traumatic Brain Injury and Rationale for a Neuropsychological Diagnosis of Diffuse Axonal Injury
Amanda R. Rabinowitz, Douglas H. Smith, in Genes, Environment and Alzheimer’s Disease, 2016
Abstract
Diffuse axonal injury (DAI) has been a diagnosis of exclusion in traumatic brain injury (TBI) patients lacking positive findings on standard clinical neuroimaging. The absence of a reliable clinical diagnosis of DAI has hindered the development of effective TBI therapies. Research suggests that DAI may underlie many TBI symptoms, including cognitive dysfunction, and is probably the pathological substrate of cognitive dysfunction following mild TBI. Furthermore, evidence suggests that DAI initiates neurodegenerative processes that may contribute to the development of dementia. Cognitive findings could serve as the basis of a clinical DAI diagnosis. We review the literature on cognitive, behavioral, and neuropathological effects of TBI, and propose a paradigm shift in the neuropsychological approach to this disorder.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128028513000097
Traumatic Brain Injury in Children
Jason T. Lerner, Christopher C. Giza, in Swaiman’s Pediatric Neurology (Sixth Edition), 2017
Diffuse Axonal Injury
Diffuse axonal injury (DAI) is thought to result from shearing and rotational forces on white-matter fiber tracts and is most commonly seen after a high-impact injury.
Clinically, the patient with DAI has a prolonged period of unresponsiveness or coma that is not explained by a mass lesion or diffuse hypoxia. Gradually, the patient recovers some movement and can initially appear to be posturing or restless. Because of brainstem involvement, autonomic symptoms may be prominent.
DAI is rarely seen on CT, and then only if hemorrhage is present. Magnetic resonance imaging (MRI) is much more sensitive in detecting DAI, which can be seen as hypointensity on T2*-weighted gradient recall echo (GRE) imaging. MRI using susceptibility-weighted imaging (SWI) has more clearly demonstrated and allowed quantification of hemorrhagic DAI lesions. In general, patients with DAI will have lasting neurologic impairments, with good outcome at 3 months ranging from 65% of mild DAI patients to only 15% of severely injured.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323371018001028
Coma
Ala Nozari MD, PhD, … Lee H. Schwamm MD, FAHA, in Critical Care Secrets (Fifth Edition), 2013
9 What is diffuse axonal injury (DAI), and how is it diagnosed and graded?
DAI is a term that arose in the pre–magnetic resonance imaging (MRI) era and is commonly cited as the cause of coma in patients with traumatic brain injury (TBI) in the absence of space-occupying lesions or apparent structural injuries. It can, nevertheless, also be present with subdural or epidural hematomas. DAI is a primary lesion of rotational acceleration-deceleration head injury. In its severe form, hemorrhagic foci occur in the corpus callosum and dorsolateral and rostral brainstem with microscopic evidence of diffuse injury to axons (axonal retraction balls, microglial stars, and a generation of white matter fiber tracts). It can be clinically diagnosed after TBI when coma lasts >6 hours in the absence of intracranial mass, increased ICP, or cerebral ischemia. MRI is more sensitive than CT for detecting characteristics of DAI, and newer studies such as diffusion tensor imaging can demonstrate the degree of white matter fiber tract injury.
- ▪
-
DAI is graded as mild when coma lasts up to 24 hours and is followed by mild to moderate memory impairment and disabilities.
- ▪
-
Coma lasts >24 hours in moderate DAI and is followed by confusion and long-lasting amnesia, with memory, behavioral, and cognitive deficits.
- ▪
-
In severe DAI, coma lasts for months, and the patient has flexor and extensor posturing, dysautonomia, cognitive impairment, and memory, speech, and sensory motor deficits.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323085007000746
Neuroimaging Part I
Sandra Rincon, … Thomas Ptak, in Handbook of Clinical Neurology, 2016
Diffuse axonal injury
DAI results from the differential motion that occurs between gray matter and white matter during rapid rotational acceleration or deceleration due to their differences in density. This type of injury results from axonal stretching, which occurs when the overlying cortex moves at a different speed than the white matter. DAI is the injury responsible for coma and poor outcome in most patients with significant closed head injury (Grossman and Yousem, 2003). Clinically, a patient with DAI will lose consciousness at the moment of impact. Depending on the severity of the injury, a patient may remain in a persistent vegetative state.
DAI occurs at characteristic locations in the brain. Typical locations include the gray–white matter junction, especially in the frontotemporal regions, splenium and posterior body of the corpus callosum, and brainstem, especially the dorsolateral midbrain and upper pons (Fig. 22.30).
Fig. 22.30. (A, B) Axial noncontrast computed tomography images show diffuse axonal injury (DAI) involving the gray–white matter junction bilaterally as well as the splenium of the corpus callosum. There are also bilateral heterogeneous subdural hematomas, with subdural hemorrhage extending along the falx.
In a patient with nonhemorrhagic DAI, the initial noncontrast CT may be normal (50–80%) (Osborn, 2005), or, the CT may demonstrate multiple small hypodense foci corresponding to edema at the sites of shear injury, with or without associated hemorrhage. These lesions are usually ovoid with the long axis parallel to the axonal direction. As these lesions evolve over time, they become more conspicuous. DAI should be suspected when the patient’s clinical findings are significantly discrepant from the imaging findings.
MRI is the modality of choice for assessing suspected DAI. Thirty percent of patients with a negative CT will have a positive MRI (Osborn, 2005). The SWI (or GRE) sequence is exquisitely sensitive to blood products and may demonstrate small regions of susceptibility artifact at the gray–white matter junction, in the corpus callosum or the brainstem, corresponding to DAI (Fig. 22.31). Some lesions may be entirely nonhemorrhagic and these lesions will be visible as regions of FLAIR hyperintense signal. On DWI, shear injury may appear as foci of restricted diffusion (Fig. 22.32).
Fig. 22.31. Axial susceptibility-weighted image shows multiple foci of susceptibility effect at the gray–white matter junction of both frontal lobes, representing diffuse axonal injury.
Fig. 22.32. (A–D) Axial diffusion-weighted images show foci of restricted diffusion in the splenium of the corpus callosum and at the gray–white matter junction in the frontal lobes bilaterally, consistent with diffuse axonal injury.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444534859000222
Head Trauma: Pediatric and Adult – Clinical Aspects
P. Marks, in Encyclopedia of Forensic and Legal Medicine (Second Edition), 2016
Primary Damage
Scalp wounds – The scalp is very vascular and it should be noted that wounds may bleed profusely and this can result in massive external blood loss. Scalp wounds are important as they may indicate the site of injury. Their size and location should be recorded carefully. They may overlie a depressed fracture of the skull, thereby making the injury compound.
Skull fractures – Skull fractures are present in 3% of people admitted to an accident and emergency department. Many studies in adults have shown that the more severe a head injury, the more likely it is to be associated with a fracture. Thus, 65% of patients who are admitted to neurosurgical departments have skull fractures and 80% of fatal head injuries will have evidence of a fracture. Fractures occur in 62% of patients with severe head injuries and extend into the skull base in 77% of those patients. Isolated fractures of the skull base occur in 5% of patients who have sustained a severe head injury. By definition, a depressed fracture is said to have occurred if the fragments of the inner table of the skull are depressed by at least the thickness of the diploe. A patient who sustains a head injury that is associated with a skull fracture has a greater chance of having an intracranial hematoma than one who has not sustained a skull fracture.
A depressed fracture is compound if there is an overlying scalp laceration. Such injuries are said to be ‘penetrating’ if there is in addition a breach in the dura mater. It should be remembered that basal skull fractures involving the paranasal air sinuses or middle ear cleft are technically compound and such injuries may be associated with cerebrospinal fluid (CSF) rhinorrhea and otorrhea, respectively. Fractures of the middle cranial fossa can be associated with CSF rhinorrhea rather than otorrhea, if CSF passes through the eustachian tube into the nasopharynx.
Contusions and lacerations of the brain – contusions represent areas of focal brain damage and are essentially areas of bruising of the brain. Contusions occur when the brain impacts against the bony protuberances that make up the skull base and, to a lesser extent, areas within the skull vault (Figure 2). A number of studies have shown that no matter where the point of impact is on the skull, contusions tend to predominate in the frontal and temporal lobes. A contusion typically involves the crest of a gyrus, which will appear hemorrhagic and swollen on macroscopic examination. Old contusions in head-injury survivors appear as shrunken, yellowish-brown areas known as ‘plaques jaunes.’ The significance of contusions is their capacity to excite cerebral edema in the adjacent brain and by doing so cause a rise in intracranial pressure (Figure 3). A coup contusion occurs at the site of impact, whereas a contrecoup contusion occurs at a point diametrically opposite to the point of impact. Typically with contusions, the leptomeninges remain intact but if they are torn, a laceration of the brain will occur. An area of confluent contusions in which the leptomeninges have been torn and bleeding has occurred into the subdural space is often referred to as a ‘burst lobe.’ Given the known predominance of contusions in the frontal and temporal lobes of the brain, burst frontal and temporal lobes tend to predominate.
Figure 2. This man fell downstairs one night after coming back from a bar and was found dead the next morning. This coronal section shows frontal and temporal contusions.
Figure 3. This computed tomography head scan shows bilateral frontal contusions. Note the edema surrounding the contusions as well as effacement of the normal sulcal pattern and basal cisterns.
Various attempts have been made to classify contusions, some of which are useful in interpreting the pattern of injury, but others tend to be obfuscating or noncontributory. Useful concepts include fracture contusions that occur at the site of a fracture, and herniation contusions that occur along the medial aspect of the temporal lobes or on the cerebellar tonsils. One of the more confusing terms that may be encountered is the ‘gliding contusion,’ which occurs as a result of rotational injury and typically involves the superior surfaces of the cerebral hemispheres. The distinction between a gliding contusion and DAI can sometimes be difficult to make.
DAI – Sabina Strich, who was working in Oxford in the 1950s, was the first to describe the pathological features of what is now referred to as DAI. This term was coined by Hume Adams in Glasgow and is now universally accepted. Sabina Strich studied a cohort of patients who had sustained severe head injuries, many of whom had remained in a persistent vegetative state until death or were certainly severely disabled. At autopsy, she observed a characteristic concatenation of macroscopic and microscopic lesions, the precise appearances of which depended upon the interval between the injury and death. Lesions of DAI injury typically occur in two stereotyped anatomical sites:
- 1.
-
within the corpus callosum, typically to one side of the midline and extending over a variable anteroposterior distance (Figure 4)
Figure 4. This young woman was involved in a high-speed road traffic accident. She lost consciousness at the scene and never regained it. At autopsy she had typical features of diffuse axonal injury. Note the typical area of hemorrhage within the corpus callosum.
- 2.
-
within the dorsolateral quadrant of the rostral brainstem, typically in the vicinity of the superior cerebellar peduncles (Figure 5). If a head-injured patient who has sustained a DAI survives for only a few days, lesions in the anatomical locations described above usually have a hemorrhagic appearance, but with the passage of time all that may be visible macroscopically is a shrunken area of scarring. As is implicit in the name, DAI is ‘diffuse’ and will not merely be confined to the dorsolateral quadrant of the brainstem and the corpus callosum.
Figure 5. An area of hemorrhage is seen in the midbrain that is typical of diffuse axonal injury. This young motorcyclist remained in a persistent vegetative state after a head injury.
Microscopically, evidence of diffuse damage may be noted throughout the brain. Histologically, the appearances of DAI again vary according to the length of survival following head injury. If death occurs within a few days of injury, the characteristic appearance of retraction balls will be seen in silver-stained preparations (Figure 6). These balls represent an extravasation of axoplasm from torn axons. If the patient survives for 2–4 weeks, microglia will infiltrate the areas involved, forming what is often referred to as microglial stars. Astrocytes and lipid-filled macrophages will also be seen amongst these clusters of microglia. In patients who survive for a prolonged time, stains for myelin will show demyelination of the involved tracts. In severe cases of DAI, ventricular dilatation is often pronounced due to loss of adjacent white matter. Patients who have sustained diffuse axonal injuries form a distinct clinicopathological group. They tend to be unconscious from the time of impact and remain so and have a low incidence of skull fracture, contusion, and intracerebral hematoma. Moreover, the likelihood that such patients will have raised intracranial pressure is significantly lower than in those who sustain contusional injuries.
Figure 6. This photomicrograph shows a section through the corpus callosum stained with a silver preparation. Retraction ball formation is well demonstrated. Original magnification is ×400.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128000342001993
Brain
Ann K. Kim MD, … Laurie A. Loevner MD, in Radiology Secrets Plus (Third Edition), 2011
16 What are the imaging manifestations of diffuse axonal injury?
Diffuse axonal injury is commonly associated with coma, immediate cognitive decline, and poor outcome in patients with significant closed head injury. The stress induced by rotational acceleration/deceleration movement of the head causes differential motion to occur between the neuronal body and axon, which is the area of greatest density difference in the brain. This motion causes axon disruption and formation of retraction balls. The sites most commonly involved include the body and splenium of the corpus callosum, brainstem, superior cerebellar peduncle, internal capsule, and gray-white junction of the cerebrum. On CT, diffuse axonal injury may not be initially detected. On follow-up MRI, rounded or elliptic T2 hyperintense foci are seen in characteristic locations, and they are commonly hemorrhagic.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323067942000481
Pediatric Neurology Part II
Karen Maria Barlow, in Handbook of Clinical Neurology, 2013
Diffuse axonal injury and traumatic axonal injury
Diffuse axonal injury (DAI) is a term originally used to describe the injuries seen as a result of shearing forces that occur with rotational acceleration–deceleration injuries. These are most commonly seen in motor vehicle accidents and inflicted TBI. In addition to direct trauma, axons are also damaged by the secondary biochemical cascades occurring over hours to days. Pathological studies of DAI have revealed microscopic features corresponding to wallerian-type axonal degeneration, which most prominently affects the corpus callosum, subcortical white matter, and dorsolateral aspect of the upper brainstem. As magnetic resonance imaging (MRI) techniques have improved, it is recognized that many similar radiological features can also be seen with milder injuries but with a much reduced burden of injury and the term “traumatic axonal injury” (TAI) has been used for these more limited injuries.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444529107000118
Neuroimaging Part II
Thierry A.G.M. Huisman, Andrea Poretti, in Handbook of Clinical Neurology, 2016
Diffuse axonal injury
DAI is histologically characterized by widespread damage to the axons in several brain regions, including the brainstem, parasagittal white matter, corpus callosum, and at the gray–white-matter junctions of the cerebral hemispheres (Figs 62.3C and 62.8). DAI follows severe head injury when sudden acceleration and deceleration forces, possibly combined with rotational forces, are present. The rotational forces experienced during head trauma can result in forces of different magnitude acting at the interface between tissues of different densities, typically at the white–gray-matter junction or in areas where multiple fiber tracts are crossing, like the dorsal brainstem or the corpus callosum. Hemorrhagic and nonhemorrhagic shear injuries associated with DAI occur in up to 40% of children with TBI (Blackman et al., 2003). Compared to older children and adults, infants are more susceptible to this kind of injury, because of their relatively large heads, weaker neck musculature, increased CSF spaces, and higher compliance of the calvarium (Fig. 62.3C). In children under 1 year of age, axonal damage can be confined to the craniocervical junction (Graham, 2001). SWI has been shown to be the most sensitive sequence for the identification of these diffuse lesions (Figs 62.3C and 62.8). DWI/DTI may also be helpful to evaluate the extent and degree of white-matter tract injury/disruption. Furthermore, DWI/DTI can depict nonhemorrhagic shear injuries with high sensitivity.
Fig. 62.8. Axial T2-weighted (top row) and axial susceptibility-weighted imaging (SWI: lower row) magnetic resonance images of a 15-year-old boy who suffered from closed head injury due to a motor vehicle accident. The T2-weighted images appear unremarkable; the SWI images show multiple SWI-hypointense shear injuries throughout both cerebral hemispheres compatible with extensive diffuse axonal injury. A small chronic focal defect is seen in the left occipital lobe.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444534866000624
Multiple Sclerosis and Related Disorders
Esther Sánchez Aliaga, Frederik Barkhof, in Handbook of Clinical Neurology, 2014
Diffuse axonal injury
Diffuse axonal injury is a primary traumatic lesion of the CNS characterized by axonal tearing which appears on MRI as T2-hyperintense lesions. These lesions are commonly located in the deep white matter of the superior frontal gyrus, gray–white-matter interface, predominantly from the frontal and temporal lobes, basal ganglia, corpus callosum, and pons (Adams et al., 1989) and, thus, resemble the distribution of MS plaques (Fig. 13.14). The clinical setting, the presence of hemorrhagic lesions (best visualized on GRE sequences), and other findings related to trauma (e.g., cortical contusions, superficial hemosiderosis, and old fractures) generally lead to the correct diagnosis.
Fig. 13.14. Diffuse axonal injury (DAI). Fluid attenuated inversion recovery (FLAIR) images, upper row, demonstrate multiple focal hyperintense lesions dorsal in the brainstem (A), splenium of the corpus callosum, right thalamus (B), and corticosubcortical junction (E), resembling MS lesions. Bottom row, gradient echo images show the presence of multiple small foci of low signal, consistent with microhemorrhages. In the context of moderate/severe head trauma these lesions are consistent with DAI.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444520012000121
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »
















