Полуколичественное определение в крови аутоантител класса IgG, взаимодействующих с антигенами нейронов (белок NF200), глиальных клеток (GFAP), нервных волокон (ОБМ) и рецепторами нейромедиаторов.
«ЭЛИ-Тесты» позволяют на основании оценки состава крови заметить патологии еще на том этапе развития, когда отсутствуют внешние симптомы и человек чувствует себя здоровым. Данный тест позволяет оценить состояние центральной и периферической нервной системы по маркерам-антителам. Исследование особенно значимо, когда человек находится в группе риска (наследственная предрасположенность) к тяжелым патологиям нервной системы, таким заболеваниям как инсульт, боковой (латеральный) амиотрофический склероз. Определяется 12 видов аутоантител.
Синонимы русские
ЭЛИ-Н-Тест-12, ЭЛИ-НейроТест-12, состояние нервной системы, нейронный тест, нейротест, биомаркеры нервной системы.
Синонимы английские
Analysis of the nervous system, evaluation of 12 antigens.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Определяемые аутоантитела:
|
Функционально-клинические характеристики антител (АТ) |
АТ к антигену |
|
АТ-маркеры дегенеративных процессов в аксонах |
NF200 |
|
АТ-маркеры глиоза |
GFAP |
|
АТ-маркеры нарушений эмоционального статуса, ассоциированные с ВПЧ-инфекцией |
S100 |
|
АТ-маркеры нарушений миелиновой оболочки аксонов |
ОБМ |
|
АТ-маркеры нарушений нейромышечных контактов |
(V)-Ca-канал |
|
АТ-маркеры миастенических синдромов и нарушений механизмов обучения и памяти |
Н-Холино-Рц |
|
АТ-маркеры нарушений процессов регуляции торможения/возбуждения в ЦНС |
Глутамат-Рц |
|
ГАМК-Рц |
|
|
АТ-маркеры нарушений мотивационно-волевой сферы |
Дофамин-Рц |
|
АТ-маркеры нарушений эмоциональной сферы |
Серотонин-Рц |
|
АТ-маркеры нарушений эмоционально-мотивационной сферы |
Опиантные Рц |
|
B-Эндорфин |
Естественные аутоантитела (ауто-АТ) класса IgG разной антигенной (органной, тканевой) специфичности постоянно синтезируются в организме любого здорового человека и участвуют в клиренсе организма от продуктов обмена, а также в регуляции функций клеток разных типов. Развитие любой болезни сопровождается патологической активацией гибели (апоптоз, некроз) клеток определенных органов и увеличением выброса соответствующих антигенов и/или изменением синтеза и секреции определенных макромолекул. Это влечет за собой вторичные изменения продукции ауто-АТ соответствующей специфичности. Избирательное повышение или снижение иммунореактивности (сывороточного уровня) отдельных ауто-АТ может указывать на изменения, затрагивающие определенные органы и ткани. Стойкие изменения в содержании ауто-АТ могут предшествовать клинической манифестации патологии (в некоторых случаях за месяцы и годы до развития заболевания), что позволяет использовать их в прогностических целях. Для одновременной оценки содержания множества ауто-АТ используются методы группы «ЭЛИ-Тест». Они не заменяют другие методы обследования, но позволяют подойти к их назначению наиболее обоснованно и адресно, с учетом индивидуальных показаний.
Серьезные заболевания могут развиваться постепенно и в начале могут быть незаметными самому человеку и при врачебных обследованиях со стандартной диагностикой. Однако в это время клетки того органа или систем, которые будут затронуты болезнью, уже начинают изменять состав продуктов обмена, выделяемых в кровяное русло и затем появляются определенные аутоантитела для утилизации этих секретируемых продуктов. По определению в крови таких биомаркеров можно выявить уже существующую угрозу того или иного заболевания.
Функциональную деятельность организма осуществляет нервная система, которая объединяет центральный (спинной и головной мозг) и периферический (нервные волокна, поддерживающие двигательную активность тела) отделы. Для раннего диагностирования патологических процессов, которые уже без видимых проявлений развиваются в нервной системе, используют «ЭЛИ-Н-ТЕСТ». Он позволяет оценить по маркерам-антителам состояние центральной и периферической нервной системы. Исследование особенно значимо, когда человек находится в группе риска (наследственная предрасположенность) к таким заболеваниям как инсульт, боковой (латеральный) амиотрофический склероз. Определяется 12 видов аутоантител.
Для чего используется исследование?
Позволяет диагностировать на ранних этапах:
- дегенерацию нервных волокон;
- аномально активное разрастание клеток астроглии (глиоз);
- патологический процесс в нервных волокнах, например при демиелинизации;
- риск развития бокового (амиотрофического)склероза, синдрома Ламберта – Итона или мозжечковой атаксии;
- неспецифические инфекции и вызванное ими воспаление.
Когда назначается исследование?
- Первичный скрининг состояния организма (наиболее обоснованное и адресное назначение других методов обследования, с учетом индивидуальных показаний).
- Уточнение диагноза в сложных случаях.
- Целесообразность начала применения фармакологического лечения, а также его назначения в минимально необходимой дозировке.
- Опережающий мониторинг изменений состояния больного под влиянием лечения, т.е. объективная оценка эффективности назначенного лечения и его достаточности.
Что означают результаты?
|
Значение |
Интервал (для АТ-маркеров) |
|
Норма |
от — 15 % до 10 % |
Интерпретация результатов
|
NF-200 |
Специфический белок аксонов. |
|
GFAP |
Специфический белок филаментов астроцитов. |
|
S100 |
Белок S100 – регулятор дифференцировки и морфогенеза многих типов клеток (в том числе нервных клеток плода). |
|
ОБМ |
Общий белок миелина — специфический антиген миелиновых оболочек аксонов. Процессы патологических |
|
(V)-Ca-канал |
Вольтажзависимый Са-канал. |
|
н-Холино-Рц |
н-Холино-Рц (никотиновые ацетилхолиновые рецепторы); глутамат-Рц (глутаматные рецепторы); ГАМК-Рц (ГАМК-рецепторы); дофамин-Рц (дофаминовые рецепторы); серотонин-Рц (серотониновые рецепторы). |
|
Глутамат-Рц |
|
|
ГАМК-Рц |
|
|
Дофамин-Рц |
|
|
Серотонин-Рц |
|
|
Опиатные-Рц |
Опиатные-Рц (опиатные рецепторы) и B-Эндорфин. |
|
B-Эндорфин |
Повышенные уровни специфических ауто-АТ
Столбики гистограммы, обращенные в положительную область от уровня индивидуальной средней иммунореактивности (обозначен нулевым уровнем на гистограмме).
- При нормальном состоянии органов и систем отмечаются лишь небольшие динамические колебания сывороточных концентраций органоспецифических ауто-АТ в пределах «зеленой зоны» вокруг индивидуальной средней.
- Важную прогностическую и клиническую значимость имеют столбики гистограммы, выходящие в зону за пределами оптимальных значений (+10 %) и особенно превышающие значение + 15 %. Умеренное повышение ауто-АТ определенной органной специфичности, (градиентный цветовой переход на графике от зеленого к красному) говорит о наличии в затронутом органе патологического процесса относительно небольшой интенсивности, который может развиться в клинически выраженную симптоматику при длительном сохранении изменений.
- Высокий титр ауто-АТ соответствующей специфичности (столбики достигают «красной зоны») говорит об активном патологическом процессе повышенной интенсивности.
Пониженые уровни специфических ауто-АТ
Столбики гистограммы, направленные в отрицательную область от уровня индивидуальной средней иммунореактивности. Уровни ауто-АТ, выходящие в зону за пределами оптимальных
Значений (-15 %) и особенно опускающиеся ниже — 20 %, сопровождают развитие патологии и обычно указывают на:
- избыточный выброс антигена (например, при интенсивном распаде ткани рак, туберкулез и т.д.);
- избыток антиидиотипических антител (при длительном, хроническом, постепенно затухающим патологическом процессе);
- нефизиологическое снижение (индивидуальные особенности реагирования иммунной системы) синтеза и секреции ауто-АТ.
Изменения гистограммы во времени (динамика)
Динамические изменения отражают интенсивность и выраженность патологического процесса, включая изменения объема очага поражения.
Отсутствие изменений на гистограмме при подтвержденной патологии органа
Указывает на транзиторное или постоянное прекращение патологического процесса к моменту исследования.
Также рекомендуется
- Антитела к кардиолипину, IgG и IgM
- Антитела к β2-гликопротеину I, IgG и IgM
- Иммуноблот антифосфолипидных антител
- Иммуноблот антинуклеарных антител
- Фенотипирование лимфоцитов (основные субпопуляции) — CD3, CD4, CD8, CD19, CD56
Кто назначает исследование?
Невролог, психиатр.
Литература
- A Manual of Laboratory and Diagnostic Tests, 9th Edition, by Frances Fischbach, Marshall B. Dunning III. Wolters Kluwer Health, 2015. Page 606-607.
- Henry’s Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (Author), Matthew R. Pincus MD PhD (Author). St. Louis, Missouri : Elsevier, 2016. Pages 995, 1003-1004.
- Клиническая лабораторная диагностика: национальное руководство: в 2 т. – T. II / Под ред. В. В. Долгова, В. В. Меньшикова. – М.: ГЭОТАР-Медиа, 2012. С. 82-84, 99.
- Инструкция по применению набора реагентов для полуколичественного определения в сыворотке крови обследуемых пациентов панели аутоантител-маркеров состояния иммунной системы «ЭЛИ-Вакцина-ТЕСТ».
ЭЛИ-Н-Тест-12
Алексеев Андрей Викторович
Врач клинической лабораторной диагностики,
Срок исполнения
(рабочие дни):
до 10 дн.
* Взятие биоматериала оплачивается отдельно
Анализ крови ЭЛИ-Н-Тест

Нервная система человека является функциональной совокупностью взаимосвязанных нейронов, которые обеспечивают связь организма с внешней средой и регуляцию деятельности всех органов и систем. Ее структуру составляют центральный (в состав которого входит головной и мозг) и периферический (состоящий из нервных волокон, обеспечивающих двигательную активность человеческого тела) отделы. Нарушение их деятельности негативно сказывается на работе всего организма. Для диагностирования патологических процессов, протекающих в нервной системе, на ранних стадиях развития практикующие специалисты используют «ЭЛИ-Н-Тест-12», который представляет собой лабораторное исследование, позволяющее определить сывороточную концентрацию аутоиммунных антител к антигенам:
- NF-200.
- GFAP (специфического протеина филаментов астроцитов).
- S100 (регулятора клеточных функций).
- ОБМ (специфического белка миелиновых оболочек аксонов).
- Вольтаж-зависимого Са-канала.
- Холинорецепторов.
- Глутаматных рецепторов.
- ГАМК-рецепторов.
- Дофаминовых рецепторов.
- Серотониновых рецепторов.
- Опиатных mu-рецепторов.
- В-Эндорфина.
Суть анализа крови ЭЛИ-Н-Тест
Основное предназначение нервной системы человека – выполнение фундаментальных функций. Она способна контролировать деятельность абсолютно всех систем и органов. Тесно взаимодействуя с эндокринной системой, нервная система не только создаёт синхронное регулирование всех систем в организме, но и оказывает ответное воздействие на адаптацию к условиям внешней, внутренней среды.
Кроме того, нервной системе свойственна интегративная функция, базирующаяся на коммутации регуляторных систем, двигательной активности и чувствительности. Её систематическая диагностика является обязательным критерием полноценной жизни.
Комплексная лабораторная диагностика 12 антигенов ЭЛИ-Н направлена на оценку деятельности нервной системы двенадцатью антителами-маркерами с целью обнаружения задолго до возникновения первых признаков болезни различных патологий, а также предрасположенности к ним.
Тест оценки нервной системы показан пациентам с затруднённой постановкой диагноза, в случаях, когда требуется оценить риск возникновения определённых заболеваний (например, у людей с наследственной предрасположенностью к тем или иным патологиям), либо когда необходимо проанализировать динамику терапии и определить её эффективность.
Специфика антител ЭЛИ-Н-Тест

GFAP – белок внутриклеточных нитевидных образований астроцитов. Повышение титра антител к нему говорит об аномальной активной фазе глиоза (разрастании клеток астроглии).
S100 – кальций-зависимый регуляторный белок, принимающий участие в большинстве клеточных процессов, таких как регуляция программирования клеточной гибели, трофический показатель СТ-ергических нейронов и пр. Увеличение антител к нему происходит преимущественно посредством видоизменений эмоционального самочувствия. Нередко основанием роста антител к специфическому белку S100 согласно концепции феномена молекулярной мимикрии является папилломавирус.
ОБМ – одна из разновидностей белка оболочки мякотного нервного волокна аксонов. Повышение антител к данному белку свидетельствует о наличии патологий в нервных волокнах, в т. ч. демиелинизирующих заболеваний.
Вольтажзависимый кальциевый канал входит в группу специфических антигенов. Повышение титра антител к нему часто является предпосылкой развития миастенического синдрома Ламберта-Итона (МСЛИ), латерального амиотрофического склероза (ЛАС), мозжечковой атаксии.
Аномальный рост концентрации антител к соединяющему домену дофаминовых, серотониновых, глутаматных нейромедиаторов, а также рецепторов гамма-аминомасляной кислоты (ГАМК) с лигандом встречается довольно часто, и подтверждает наличие изменений в конкретных механизмах нейронов. Данный тест способствует проведению недифференцированного анализа содержания в сыворотке крови антител к А- и В-ГАМК, дофаминовым Д1 и Д5, глутаматным AMPA, NMDA, серотониновым 5-Н1 и 5-Н7, н-холинорецепторам.
Излишек антител к beta2-гликопротеину, ДНК подтверждает нехарактерную иммуноактивацию, преимущественно совокупную с нестандартным воспалительно-инфекционным процессом.
Что показывает тест?
С помощью ЭЛИ-Н-Тест-12 врач может не только составить полную картину работы нервной системы, но и подобрать / скорректировать индивидуальный план лечения, выявить пациентов группы риска на фоне наследственной предрасположенности к таким заболеваниям как деменция, болезнь Альцгеймера, инсульт.
В ходе лабораторного теста на состояние ЦНС сыворотка крови исследуется на наличие в ней маркеров-антител к двенадцати антигенам ЦНС. Выявление маркеров свидетельствует о возможных патологических процессах в организме. К примеру, переизбыток антител к NF-200 является сигналом гибели нервных волокон, а их недостаток к beta2-гликопротеину, ДНК – признаком развития воспалительного процесса, вызванного инфекцией.
Когда делают анализ
Показаниями для проведения иммунологического исследования крови ЭЛИ-Н-Тест являются:
- скрининг структурно-функционального состояния нервной системы пациента;
- прогнозирование возможности возникновения тяжелых нервных расстройств у лиц с генетической предрасположенностью;
- постановка точного диагноза при общетерапевтических заболеваниях;
- объективное оценивание успешности назначенного лечения.
Подготовка и метод исследования
Анализ проводят с помощью метода ИФА, основанного на иммунной реакции. Для его выполнения используют образец венозной крови, который отбирают из локтевой вены в лабораторных условиях в утренние часы, натощак. Накануне процедуры пациенту необходимо воздержаться от:
- пищевой нагрузки;
- чрезмерного физического и психоэмоционального напряжения;
- употребления алкогольных напитков;
- применения лекарственных препаратов, которые искажают итоговые данные исследования.
Расшифровка анализа
В норме параметры интервалов для маркерных аутоиммунных антител варьируют в пределах от -15 до 10%.
На основании итоговых данных тестов квалифицированный специалист проводит оценивание аутомаркеров – увеличение их концентрации указывает на изменение функционирования взаимосвязанных нервных структур пациента.
Расшифровка результатов выполняется после диагностики уровня 12 специфических антител, отражающих функциональную деятельность нервной системы. Состояние иммунной системы оценивается на основании анализа отклонений от референсных показателей. С учётом расхождения полученных результатов исследования с нормами подтверждается / опровергается тот или иной диагноз.
Изменения иммунореактивности в сторону повышения концентрации специфических аутоантител более 20 % в сравнении с индивидуальными средними нормами являются показателем потенциального индикатора патологических процессов в определённом органе.
Рост титра протеида аксонов характерный для заболеваний, при которых нервным импульсам свойственно проникать к иннервируемым органам.
Нарушение нормативных значений миелина в нейронах свойственно патологическим изменениям, отвечающим за поток нервных импульсов.

Рост титра антител, связывающих домен с лигандом, характерный для состояний, связанных с неправильным обменом серотонина, холина, глутамата, гамма-аминомасляной кислоты, дофамина.
Прохождение исследования даёт возможность вовремя обнаружить изоморфные и функциональные патологии нервной системы. Диагностика нужна не столь для профилактических мер и подбора методов лечения, сколько для постановки окончательного диагноза.
Результаты исследования ЭЛИ-Н-Тест-12 дают возможность специалистам диагностического центра разработать профилактическую программу заболеваний нервной системы либо подобрать схему индивидуального лечения. Пройти обследование у врача можно по предварительной записи.
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Московский научно-практический центр дерматовенерологии и косметологии, Московский областной клинический кожно-венерологический диспансер, Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского, Москва, Россия
Устьянцев Ю.Ю.
ГУ Центральная поликлиника ФТС России, Москва
Шульгина И.Г.
Московский научно-практический центр дерматовенерологии и косметологии Департамента здравоохранения Москвы
Жиангерова О.В.
Медицинский исследовательский центр «Иммункулюс», Москва
Изучение уровня аутоантител к антигенам нервной системы у больных сифилисом
Авторы:
Лосева О.К., Устьянцев Ю.Ю., Шульгина И.Г., Жиангерова О.В.
Как цитировать:
Лосева О.К., Устьянцев Ю.Ю., Шульгина И.Г., Жиангерова О.В. Изучение уровня аутоантител к антигенам нервной системы у больных сифилисом. Клиническая дерматология и венерология.
2013;11(5):17‑22.
Loseva OK, Ust’iantsev IuIu, Shul’gina IG, Zhiangerova OV. Study of the level of autoantibodies to nervous system antigens in syphilitic patients. Klinicheskaya Dermatologiya i Venerologiya. 2013;11(5):17‑22. (In Russ.)

Естественные аутоантитела (ауто-АТ), направленные к антигенам собственного организма, синтезируются в организме человека в течение всей жизни. Сывороточное содержание ауто-АТ конкретной специфичности, участвующих в клиренсе организма от продуктов собственной жизнедеятельности, примерно одинаково у разных здоровых лиц, но заметно меняется при развитии хронических заболеваний задолго до их клинической манифестации. Долговременные изменения сывороточного содержания многих ауто-АТ, весьма специфичные для каждой патологии, связаны со стойкими изменениями активности апоптоза специализированных клеток органов и тканей и/или уровней экспрессии определенных антигенов в тех или иных группах клеток. Выявление таких изменений дает шансы на максимально раннее обнаружение формирующихся патологических изменений на начальных стадиях, т.е. в период полной обратимости [1, 2]. Для определения отдельных ауто-АТ разработаны разные варианты ЭЛИ-тестов. Выявление начальных изменений нервной системы может быть осуществлено с помощью метода ЭЛИ-нейро-тест [3].
В последние годы на фоне снижения общей заболеваемости сифилисом меняется ее структура с увеличением доли скрытых и поздних форм, в том числе кардиоваскулярного и нейросифилиса. Ранняя диагностика подобной патологии позволяет повысить эффективность лечения больных.
Цель исследования — с помощью ЭЛИ-нейро-теста выявить патологические изменения нервной системы у больных нейросифилисом и пациентов с серорезистентностью.
Материал и методы
Материалом исследования служила сыворотка крови больных нейросифилисом (1-я группа, 10 человек), получивших специфическое лечение, и пациентов с серорезистентностью (2-я группа, 12). Методы — серологическое обследование с помощью нетрепонемных тестов (НТТ) и трепонемных тестов (ТТ), ликворологическое обследование, определение иммунного статуса, ЭЛИ-нейро-тест.
Результаты
1-я группа. 10 больных (7 мужчин, 3 женщины) поздним нейросифилисом в возрасте 36—64 лет (средний возраст 48,5 года). Поздний менинговаскулярный сифилис диагностирован у 8 человек, атрофия зрительных нервов, табес — у 1, асимптомный менингит — у 1. Больных этой группы обследовали в разные сроки после специфического лечения (от 3 мес до 5 лет). Длительность заболевания до лечения можно было проследить только у 2 больных (12 и 17 лет), у остальных она осталась неизвестной (неведомый сифилис). При исследовании на ЭЛИ-нейро-тест чаще всего (не менее чем у 1/3 пациентов) отмечалось повышение следующих показателей: 5HT-R, β2-GPI, ds-DNA, GFAP, S-100.
Значение показателей ЭЛИ-Н-теста:
— 5HT-R — указание на патологию серотониновых рецепторов, что может быть связано с нарушениями эмоциональной сферы;
— β2-GP1 — кофактор, необходимый для взаимодействия антифосфолипидных антител с фосфолипидами, наблюдается при антифосфолипидном синдроме (АФЛС);
— ds-DNA — указывает на присутствие аутоиммунного компонента патологического процесса;
— S-100 — является кальцийзависимым регулятором многих клеточных функций, в частности, трофическим фактором серотонинергических нейронов, регулятором апоптоза;
— GFAP — специфический белок филаментов астроцитов. Рост антител к нему сопровождает аномально активную пролиферацию клеток астроглии — глиоз, что может являться исходом травм и воспалительных процессов в центральной нервной системе.
Клинический пример 1
Больной Л., 1968 г.р., госпитализирован в неврологическое отделение по скорой медицинской помощи 01.10.10 с жалобами на слабость в левых конечностях, головокружение. Ухудшение состояния возникло с 24.09.10, когда появились головокружение, головная боль в затылочной области, шаткость при ходьбе, с 27.09.10 — неловкость в левых конечностях. В анамнезе — артериальная гипертония (артериальное давление до 180/100 мм рт.ст.). Сифилис в анамнезе отрицает.
Неврологический статус при поступлении: сознание сохранено, менингеальных знаков нет. Центральный парез VII и XII пары черепно-мозговых нервов (ЧМН) слева. Горизонтальный мелкоразмашистый нистагм при взгляде влево. Левосторонний гемипарез до плегии в руке, в ноге — до 1,5 балла. Сухожильные рефлексы S>D. Симптом Бабинского слева.
Серологические реакции крови: РМП 4+¼; РИФ 200/abs 4+/4+; РИБТ 60%. Ликвор от 12.10.10: РИФц 4+; РИБТ 60%; цитоз — 243/3; белок — 0,034 г/л; лимфоциты — 72%; нейтрофилы — 27%; макр. — 1%.
Компьютерная томография (КТ) головного мозга от 30.09.10. КТ-признаки перенесенных инфарктов в бассейне основной артерии, левой задней мозговой артерии. В правой и левой половине моста и четверохолмия — зоны глиозной трансформации размером (5—12)×15×15 мм. В базальных ядрах обоих полушарий головного мозга – единичные микрокальцинаты. Заключение: КТ-признаки перенесенных инфарктов в бассейне основной — левой задней мозговой артерии.
Терапевт: гипертоническая болезнь III степени, атеросклероз аорты, сосудов сердца, головного мозга.
Дерматовенеролог: поздний менинговаскулярный нейросифилис (от 14.10.10).
Получил с 27.09.10 по 09.11.10 два курса лечения цефтриаксоном по 2,0 г ежедневно 20 сут, в ноябре—декабре 2011 г. — третий дополнительный курс цефтриаксона в связи с сохранявшейся патологией в ликворе (РСК 4+4+4+, т. 1:5, белок — 0,619 г/л).
Ликвор после окончания лечения (22.11.11): МРП отрицательная, РСКка 4+4+4+ титр ½; РСКта 4+4+4+; цитоз — 16/3; белок — 0,503; РИБТ 48%.
Эли-нейро-тест от 13.03.12: значительное повышение NF200, умеренное GFAP, V-Ca-chan. Последний показатель — аутоАТ к вольтажзависимым кальциевым каналам — характеризует нарушения нервно-мышечной проводимости.
Серология крови через 7 мес (от 08.10.12): РПР 2+; РПГА 4+ 1/2560; ИФА (IgG) обн. КП=14,7. Иммунный статус: гиперплазия популяции NK-клеток. Поликлональная активация В-лимфоцитов.
Комментарий. Пациент с типичной клинической картиной позднего менинговаскулярного нейросифилиса (ишемический инсульт), своевременная диагностика, адекватное лечение. Хорошая клиническая динамика; медленная, но определенная тенденция к санации ликвора. Эли-нейро-тест продемонстрировал: 1) существенное повышение уровня антител к белку аксонов NF-200, как указание на дегенеративные изменения аксонов, т.е. периферических нервных волокон, что совпадает с клиническим статусом (сохранение остаточных явлений правостороннего гемипареза); 2) умеренное повышение ауто-АТ к GFAP, что свидетельствует об активной пролиферации астроглии (глиоз), закономерно наблюдающейся после перенесенных повреждений нервной ткани (в данном случае ишемического инсульта), и совпадает с данными КТ («зоны глиозной трансформации»); 3) умеренное повышение ауто-АТ к белку вольтажзависимых кальциевых каналов, указывающее на нарушение нервно-мышечной проводимости.
Клинический пример 2
Больной К., 1976 г.р., в 1998 г. получил лечение по поводу первичного сифилиса 3 инъекциями экстенциллина, дополнительное лечение доксициклином и клафораном.
В августе 2010 г. в течение 3 сут — кратковременная простреливающая боль в правой височно-теменной области. С сентября 2010 г. — постепенное снижение зрения на правый глаз. В октябре—ноябре 2010 г. — различает только пальцы перед глазами. Обследовался в диагностическом центре с диагнозом «частичная атрофия зрительных нервов». Направлен в НИИ нейрохирургии им. Н.Н. Бурденко.
Магнитно-резонансная томография (МРТ) головного мозга: очаговых изменений нет.
Ультразвуковое исследование: кальцификаты в области дисков зрительных нервов — друзы. Зрительные вызванные потенциалы (ЗВП): снижение проводимости правого зрительного нерва, слева — норма.
С 11.05.11 по 20.05.11 находился в НИИ глазных болезней РАМН. Диагноз: частичная атрофия зрительных нервов. Миопия слабой степени. Острота зрения: OD=0,1; OS=0,6.
С 26.05.11 по 22.06.11 лечился в неврологическом отделении НИИ неврологии РАМН, где впервые исследованы серологические тесты на сифилис и поставлен этиологический диагноз.
Неврологический статус: горизонтальный нистагм. Конвергенция ослаблена. Вялая фотореакция справа. Сухожильные рефлексы с рук повышены, коленные и ахилловы снижены.
Серореакции крови: РМП 4+ титр ¼; РПГА 4+; ИФА (IgM + IgG) положительный; РИФ 4+/4+; РИБТ 61%.
Люмбальная пункция от 31.05.11: цитоз — 39/3, белок — 0,592 г/л, реакции Панди и Нонне—Апельта отрицательные; лимфоциты — 28, нейтрофилы — 11 (изм.), РИФ 4+, РИБТ 65%, ИХЛ 4+.
Консультация нейроофтальмолога: частичная атрофия зрительного нерва, связанная с хроническим нарушением кровоснабжения зрительных нервов и сетчатки на фоне специфического васкулита.
ЗВП: нарушения проведения зрительной афферентации с признаками демиелинизирующе аксонального поражения с обеих сторон, умеренно выраженное при стимуляции левого глаза (в большей степени при исследовании макулярного зрения), грубое на прехиазмальном уровне справа. По данным ЗВП, на вспышку имеется частичная сохранность афферентации по правому зрительному нерву.
Диагноз от 01.06.11: поздний нейросифилис (специфический арахноидит оптико-хиазмальной области, атрофия зрительных нервов).
Начато специфическое лечение пенициллина натриевой солью в повышающихся разовых дозах, которое продолжено в ГКБ №14. В общей сложности получил 2 курса пенициллинотерапии длительностью 28 и 14 сут. Закончил лечение 08.07.11.
22.09.11 — отмечает ухудшение зрения.
10.11.11 направлен в ГКБ №14 на контрольную пункцию. Ликвор: цитоз 2,0·106/л, белок — 0,539 г/л, РМП 3+, РИФц 4+, РИБТ отрицательная, КСР: РСКта 4+4+3+, РСКка 4+4+4+. Реакции Панди и Нонне—Апельта положительные.
Серология крови от 10.11.11: РПР 4+ ¼, РПГА 4+, ИФА обнар., РИФ 4+/4+, РИБТ 57%.
С 24.11.11 по 13.12.11 — дополнительный курс лечения цефтриаксоном по 2,0 г в сутки в течение 21 дня.
ЭЛИ-нейро-тест от 24.02.12: значительное повышение уровня ауто-АТ к вольтажзависимым кальциевым каналам, остальные показатели — в пределах нормы.
Зрение продолжает ухудшаться, госпитализация в неврологическое отделение МОНИКИ с 29.02.12 по 20.03.12.
Неврологический статус. Острота зрения OD=0,01; OS=0,3-1,0=0,6. Фотореакции: прямая и содружественная OD-абс., OS-низкие. Реакция при конвергенции и аккомодации сохранена. Коленные и ахилловы рефлексы резко снижены. Снижена вибрационная чувствительность в нижних конечностях.
Ликвор от 05.03.12: цитоз — 3/3, белок — 0,354 г/л, VDRL 3+ титр ½, РПГА 4+ титр 1:2560, ИФА 4+ КП=15,7, РИФц 4+.
ЗВП от 07.03.12: значительное нарушение функций зрительных путей с обеих сторон, более грубые изменения — при стимуляции правого глаза.
МРТ от 12.03.12: на полученных изображениях головного мозга выявляется единичный мелкокалиберный очаг в субкортикальных отделах белого вещества, в проекции островка, без перифокальных изменений, размером до 4 мм. Заключение: МР-картина единичного очага в веществе головного мозга.
Лечение: пенициллин по 10 млн ЕД внутривенно капельно 2 раза в сутки в течение 14 дней.
18.10.12 — контрольное ликворологическое обследование в МОНИКИ: цитоз — 4/3, белок — 0,47 г/л, реакция Панди 1+, VDRL 3+ т. 1:2, ИФА (IgG) обн., КП=15,7, РИФц 4+, РПГА 4+, т. 1:5120.
Исследование иммунного статуса 26.10.12: поликлональная активация В-лимфоцитов, повышение уровня общего IgE. Серореакции крови от 18.02.13: МРП 1+, РПГА 4+, ИФА (IgG) обн., КП=14,9.
Комментарий. Молодой пациент с неуклонно прогрессирующей первичной атрофией зрительных нервов сифилитического генеза. Первичный сифилис в анамнезе за 12 лет до дебюта патологии зрения. Лечение первичного сифилиса адекватное — дюрантным препаратом пенициллина, не проникающим в ликвор. Этиологическая диагностика атрофии зрительных нервов и начало специфической терапии запоздалые — через 9 мес после появления первых симптомов снижения зрения (своевременное начало лечения позволило бы надеяться на то, что прогрессирование процесса остановится). На протяжении всего периода лечения и наблюдения — постепенное присоединение к потере зрения других симптомов спинной сухотки — синдрома Аргайла—Робертсона и угасания коленных и ахилловых рефлексов. Специфическое лечение по поводу атрофии зрительных нервов – адекватное и усиленное, с проведением дополнительных курсов, однако на фоне прогрессирования процесса. Через 1,5 года лечения ликвор в значительной мере санировался, но кардиолипиновый тест остается положительным. При постановке ЭЛИ-нейро-теста — значительное повышение только одного показателя — уровня ауто-АТ к вольтажзависимым кальциевым каналам. Можно предположить, что это объясняется нарушениями синаптической трансмиссии, в частности, в зрительном анализаторе.
2-я группа. 12 пациентов (7 женщин, 5 мужчин) с серорезистентностью в возрасте 32—60 лет (средний возраст 43,2 года). Длительность серорезистентности после лечения по поводу ранних форм сифилиса составила 3—17 лет. В этой группе при исследовании ЭЛИ-нейро-теста наиболее часто (не реже чем в 1/3 случаев) встречалось повышение ауто-АТ по следующим показателям: S-100, GFAP, V-Ca-chan, NF200, Ach-Rc и MBP. Первые три совпадали с соответствующими показателями при нейросифилисе (объяснены ранее). Значения остальных трех:
— NF200 — специфический белок аксонов. Рост антител к нему сопровождает процессы дегенерации нервных волокон;
— Ach-Rc (ацетилхолиновые рецепторы) — участвуют в регуляции вегетативных функций, а также когнитивных функций, памяти;
— MBP — основной белок миелина, главная функция — быстрое проведение нервного импульса по аксонам, которые он окружает.
Повышение уровня ауто-АТ у пациентов с серорезистентностью, как правило, не достигало достоверного уровня, а находилось в пределах пограничных изменений.
Клинический пример 3
Больная К., 1964 г.р., в 1995 г. получила лечение по поводу вторичного (свежего) сифилиса тремя инъекциями экстенциллина по 2,4 млн ЕД 1 раз в неделю. При клинико-серологическом контроле в течение 1,5 года выявлено снижение степени позитивности серологических реакций. В мае 2009 г. перенесла левостороннюю бронхопневмонию. При вассерманизации в стационаре — РМП 3+, РПГА 3+ (21.05.09). При обследовании 04.06.09: РПР 4+, т. 1:32, РПГА 4+, т. 1 : 10240, ИФА (IgM) отр., ИФА (IgG) 4+, РИФ 4+/4+. Обследованы муж и дочь, оба здоровы. Ликвор от 01.07.09: цитоз — 8 кл/мкл, белок — 0,1 г/л, РМП отр., РПГА 1+, т. 1:80. Неврологический статус без патологии. Нейросифилис исключен.
Лечение: цефтриаксон по 1,0 г внутримышечно ежедневно в течение 20 сут. В связи с повышением титров серологических тестов в марте—апреле 2010 г. получила 2 курса внутривенных инфузий пенициллина по 10 млн ЕД на вливание, 2 раза в сутки в течение 20 дней.
Серореакции от 20.10.10: РПР 4+, т. 1:32; РПГА 4+, т. 1:20480.
Серореакции от 29.04.11: РПР 4+, т. 1:32; РПГА 4+, т. 1:40960.
Серореакции от 19.03.12: РПР 4+, т. 1:8; РПГА 4+, т. 1:20480.
ЭЛИ-тест от 06.02.13: повышение S-100 (достоверное), β2-GP1 (пограничное), снижение уровня ауто-АТ к V-Ca-chan (пограничное).
Комментарий. Адекватное лечение в отдаленном прошлом (17 лет назад) по поводу ранней формы сифилиса (вторичного) дюрантным препаратом пенициллина. Серорезистентность. Сохраняются достаточно высокие титры в НТТ и очень высокие — в РПГА. В ЭЛИ-тесте значимое повышение ауто-АТ к белку S-100 (трофический фактор серотонинергических нейронов), что может быть связано с изменениями эмоционального статуса, а также быть косвенным признаком присутствия в организме ВПЧ-инфекции (антитела к ВПЧ у больной выявлены, проведено лечение без эффекта); пограничное повышение ауто-АТ к β2-гликопротеину (может быть при АФЛС); снижение до пограничных значений ауто-АТ к белкам вольтажзависимых кальциевых каналов, свидетельствующее о нарушении нервно-мышечной проводимости. Сниженные уровни ауто-АТ наблюдаются при большой давности заболевания и, как правило, необратимости процесса.
Клинический пример 4
Больная И., 1979 г.р., в ноябре 2009 г. в медицинском центре по поводу скрытого раннего сифилиса получила лечение (последовательно) бициллином, ретарпеном и цефтриаксоном. С мая 2010 г. проходила КСК в КВД. РПР оставалась слабоположительной (2+) с низким титром (1:2). В связи с этим в январе—феврале 2011 г. получила 2 курса дополнительного лечения цефтриаксоном по 2,0 г ежедневно внутримышечно в течение 20 сут. Серореакции оставались положительными без особой динамики (03.04.12: РПР 3+. т. 1:2, РПГА 4+, т. 1:1280, ИФА (IgG) обнаруж). ЭЛИ-нейро-тест от 14.04.12: выявлено слабовыраженное повышение показателя NF200 (характерен для процессов дегенерации аксонов), незначительное повышение GFAP (характеризует процесс глиоза) и пограничное повышение МВР (свидетельствует о повреждении миелиновых оболочек). В мае—июне 2012 г. пациентке назначено лечение цефтриаксоном по 2,0 г ежедневно в течение 20 дней. Серореакции после лечения (04.09.12: РПР 3+, т. 1:2, РПГА 4+, т. 1:1280). Сопутствующие заболевания (диагностированы до первоначального лечения по поводу сифилиса): артериальная гипертензия I степени, начальные проявления недостаточности кровоснабжения головного мозга с вегетососудистыми проявлениями (эпизодические повышения артериального давления до 150/90 мм рт.ст.). В анамнезе также «панические атаки», с детства — повышенная нервная возбудимость.
Комментарий. Серорезистентность у молодой женщины с вегетососудистой дистонией. Неадекватное первоначальное лечение, три дополнительных курса без эффекта. Изменения в ЭЛИ-нейро-тесте имеются, но носят маловыраженный характер.
Выводы
При сравнительном исследовании ЭЛИ-нейро-теста в двух группах пациентов (больных нейросифилисом и пациентов с серорезистентностью) выявлены повышенные уровни аутоантител к разным белкам нервной системы. У больных нейросифилисом они носили более выраженный характер (достоверные изменения), у пациентов с серорезистентностью были, как правило, выражены незначительно (пограничные изменения).
У больных нейросифилисом отмечался параллелизм изменений аутоантител с клиническими симптомами.
Изменения уровня ауто-АТ у больных нейросифилисом фиксировались после специфического лечения, что указывает на необходимость активной симптоматической и реабилитационной терапии таких больных.
Повышение уровня аутоантител у больных с серорезистентностью носит прогностический характер и указывает на необходимость подробного наблюдения за состоянием центральной нервной системы у этих пациентов, включая клинические проявления (наблюдение невролога) и ликворологическое обследование.
Исследование ЭЛИ-нейро-теста может служить дополнительным методом мониторинга состояния нервной системы у больных с нейросифилисом и серорезистентностью.
ВВЕДЕНИЕ
Хотя иммунный компонент патогенеза психических заболеваний эндогенного круга (шизофрении, шизоаффективного психоза) установлен, роль и участие иммунных механизмов в развитии заболеваний остаются недостаточно ясными. Дальнейшее расширение наших знаний возможно в связи с появлением новых технологий, позволяющих более дифференцированно выявлять иммунометаболические аномалии, свойственные различным, в том числе психическим, болезням. К таким технологиям относятся методы ИФА «ЭЛИ-Тест» (разработчик — медицинский исследовательский центр «Иммункулус»).
Эти технологии базируются на относительно новых взглядах на роль иммунной системы, которая заключается в поддержании постоянства молекулярного состава организма и гомеостатической регуляции самых разных молекулярно-клеточных процессов в изменяющихся условиях внешней и внутренней среды.
Рассматриваемые сложные функции иммунной системы обеспечиваются всепроникающей мультикомпонентной системой естественных аутоантител (ауто-АТ), живо откликающейся количественными изменениями на различные функционально-метаболические перестройки в обособленных популяциях клеток, органах и организме в целом[1]. Множество естественных ауто-АТ, специфичных для самых разных аутоантигенов, постоянно синтезируются и присутствуют в сыворотке крови и иных биологических средах каждого здорового человека. Совокупность ауто-АТ, направленных к различным мембранным, цитоплазматическим и ядерным антигенам клеток организма и межклеточного матрикса, а также секреторным продуктам клеток, формирует динамический «иммунологический гомункулус», или «иммункулус»[1].
Иммункулус организован по голографическому принципу, где каждая часть целого отражает это целое. Поэтому содержание ауто-АТ одной и той же антигенной специфичности у индивида практически одинаково в разных участках кровотока. По изменениям в содержании ауто-АТ определенной органоспецифичности оказывается возможным получать информацию о состоянии популяций специализированных клеток разной анатомической локализации, о повреждениях различных органов, об изменениях экспрессии/продукции/секреции определенных рецепторов, биорегуляторов, дифференцировочных антигенов и т. д., причем диагностическое и/или прогностическое значение заключения, основанного на одновременном определении уровней ауто-АТ разной специфичности, существенно повышается.
Это диктует необходимость давать мультикомпонентную оценку содержания ауто-АТ, что позволяет проводить системный анализ для уточнения роли и участия патоиммунных механизмов в развитии психических заболеваний. Ранее такой анализ (на основании «ЭЛИ-Нейро-Теста» из 12 ауто-АТ) был нами проведен у больных шизофренией и позволил выявить множественные аномалии уровней ауто-АТ к антигенам нервной ткани при этом заболевании[2].
Так, у больных шизофренией найдены аномалии профилей ауто-АТ к глиальному фибриллярному кислому белку (glial fibrillary acidic protein, GFAP), основному белку миелина (myelin basic protein, MBP), специфическому белку аксонов NF-200, отражающие деструктивные и воспалительные процессы в тканях нервной системы[2].
Аналогичный анализ является актуальным в исследованиях природы шизоаффективного психоза. Кроме того, для понимания основ этиопатогенеза данных заболеваний необходимо установление причины выявленных аномалий. В связи с накопленными в настоящее время данными о значимости вирусов группы герпеса в патогенезе эндогенных психозов[3–6] целесообразно изучение их сопряженности с иммунометаболическими аномалиями, в частности при шизоаффективном психозе.
Цель исследования — мультипараметрическая оценка иммунохимических аномалий (отклонений содержания ауто-АТ), отражающих состояние микроструктур нервной системы, при шизоаффективном психозе и установление их возможной связи с герпетической инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ
Были обследованы 56 больных (24 мужчины, 32 женщины) шизоаффективным психозом (F-25 по МКБ-10, шизоаффективная приступообразная шизофрения по отечественной классификации), проходивших стационарное лечение по поводу острых психотических состояний в клинике «Психическое здоровье» (руководитель — профессор В.Л. Минутко, г. Москва) в 2018–2019 гг. Ведущими синдромами были аффективно-параноидный (n = 42, 75%) и аффективно-бредовой (n = 14, 25%). Аффект у 37 (66,1%) пациентов был смешанным, у 15 (26,8%) — депрессивным и у 4 (7,1%) — маниакальным. Возраст больных варьировал от 17 до 50 лет (в среднем 29,4 ± 8,6 года). Средняя продолжительность болезни с момента манифестных проявлений составляла 5,1 ± 4,8 года.
В контрольную группу вошли 100 психически здоровых людей (43 мужчины и 57 женщин), проходивших профилактическое обследование в МИЦ «Иммункулус». Их средний возраст — 32,9 ± 9 лет (р > 0,05 при сравнении с основной группой).
Иммунохимическое обследование проводили при поступлении больных в стационар — до начала лечения. Профили иммунореактивности естественных регуляторных ауто-АТ, наиболее информативно отражающих количественные изменения (содержание) их отдельных вариантов[1], оценивали в сыворотке крови с помощью тест-наборов «ЭЛИ-Н-Комплекс-12» (МИЦ «Иммункулус», г. Москва) согласно инструкции производителя. При этом c помощью твердофазного ИФА определяли изменения содержания ауто-АТ класса G, взаимодействующих с антигенами микроструктур нервной ткани, а также отражающих общую реактивность иммунной системы (всего 12 ауто-АТ — см. таблицу).
Таблица
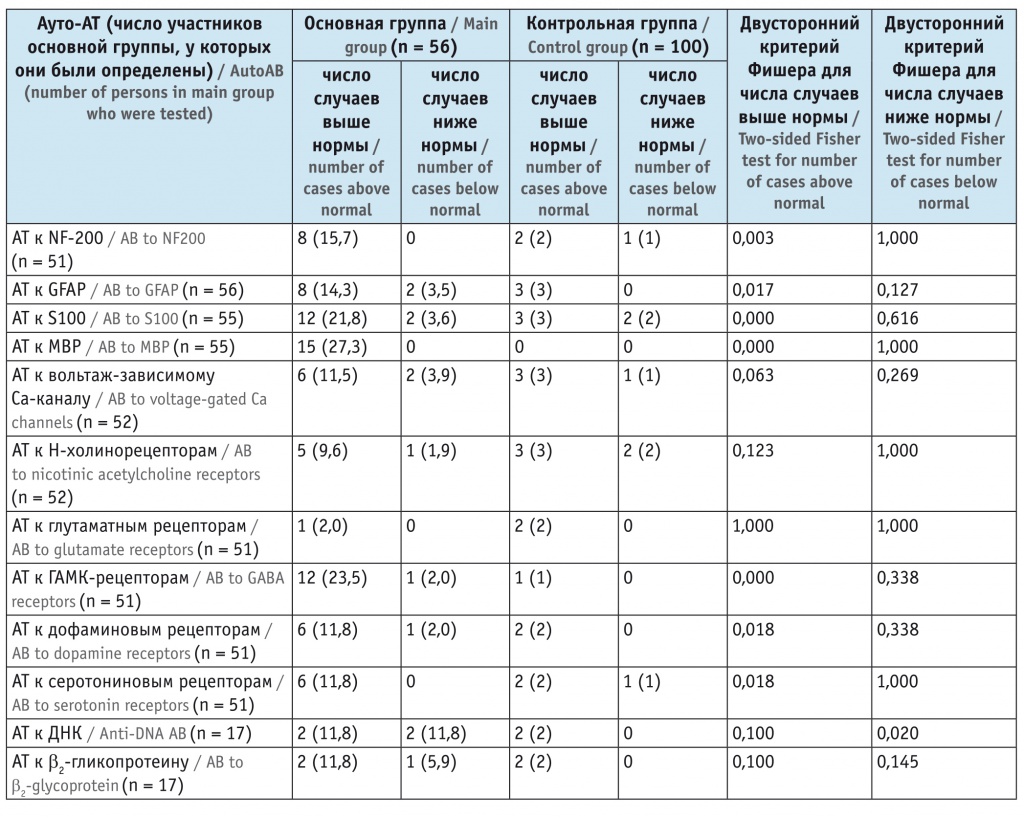
Частота выявления аномальных показателей сывороточных аутоантител (ауто-АТ) у обследованных больных шизоаффективным психозом и в контрольной группе здоровых лиц, n (%)
В зависимости от амплитуды пиков индивидуальных ауто-АТ разной антигенной специфичности их иммунореактивность оценивали как нормальную при амплитуде пика, не выходящей за физиологически допустимый разброс (у здоровых лиц уровни АТ колеблются от –20 до +10 относительных единиц, отн. ед.), сниженную (менее –20 отн. ед.) или повышенную (более +10 отн. ед.). Следует заметить, что с помощью технологии «ЭЛИ-Тест» не проводится оценка абсолютного содержания ауто-АТ в сыворотке крови обследуемого. Результаты «ЭЛИ-тестов» демонстрируют более информативные нарушения, такие как соотношение ауто-АТ, определяемое у пациента по отношению к нормальным показателям (относительное содержание ауто-АТ).
Уровни IgM и IgG к герпес-вирусам: вирусу простого герпеса 1-го типа (ВПГ-1), ВПГ-2, ВПГ-6, цитомегаловирусу (ЦМВ), вирусу Эпштейна — Барр (ЭБВ) — в сыворотке крови определяли методом твердофазного ИФА.
Статистическая обработка данных проводилась в программе Statistica 6.0 для Windows (StatSoft, США). Для статистической обработки использованы вычисления двустороннего (точного) критерия Фишера и коэффициента ранговой корреляции Спирмена при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Аномалии профилей сывороточной иммунореактивности, обусловленные исследованными ауто-АТ, обнаружены у большинства пациентов основной группы (94,6%) и только у 3% обследованных контрольной группы. Превалирующим был рост амплитуды пиков (10,6% от общего количества показателей без учета пограничных значений), реже встречалось их аномальное снижение (1,5%), что существенно отличалось от соответствующих показателей контрольной группы (2,5% и 0,7% соответственно). В данном исследовании анализируется аномальное увеличение уровней ауто-АТ (см. таблицу). Повышенные значения отражают активные патологические процессы относительно небольшой давности, аномальное же снижение пиков иммунореактивности характерно для патологических процессов большей давности и тяжести.
Как видно из таблицы, рост амплитуды пиков ауто-АТ к MBP, являющемуся специфическим белком миелиновых оболочек аксонов, выявлялся наиболее часто и только в основной группе. Рост уровней АТ к MBP может указывать на демиелинизирующие процессы в нервных волокнах[1]. Эти данные подтверждаются и обнаруженным у 15,7% больных повышением уровней ауто-АТ к специфическому белку аксонов NF-200 (против 2% лиц контрольной группы, p = 0,003). Рост содержания ауто-АТ к MBP и NF-200 с высокой долей вероятности указывает на дегенеративные изменения в аксонах, включая их миелиновые оболочки (демиелинизацию)[1].
У 23,5% больных выявлялось повышение содержания ауто-АТ к ГАМК-рецепторам. Аналогичные аномалии обнаруживались только у 1% участников контрольной группы (p = 0,000). Они могут указывать на изменения в ГАМКергической системе нейронов.
У 21,8% пациентов основной группы и лишь у 3% в контрольной группе (р = 0,000) отмечалось повышение содержания ауто-АТ к белкам группы S100 — кальций-зависимым регуляторам целого ряда клеточных ролей, обеспечивающих функциональный гомеостаз клеток мозга путем сопряжения и интеграции разноплановых метаболических процессов[7]. Увеличение содержания ауто-АТ к такому представителю белков группы S100, как S-100В, по-видимому, отражает деструктивные изменения нервной ткани и ее вовлеченность в воспалительную реакцию, часто связанную с вирусной инфекцией (за счет сходства эпитопов белков S100 с эпитопами некоторых вирусов, например ВПЧ).
Кроме того, поскольку S100-белки во внеклеточном секторе проявляют свойства цитокинов и взаимодействуют с RAGE-рецепторами[8], которые экспрессируются в нервной системе не только нейронами, микроглией и астроцитами, но и клетками сосудистой стенки, можно предположить вовлеченность в воспалительную реакцию и сосудистой сети.
Рост уровней ауто-АТ к S-100В может свидетельствовать о патологических процессах в астроцитарной глие (их активации)[9]. Это положение подтверждается анализом уровней ауто-АТ к белку GFAP у изученных пациентов. В 14,3% случаев (против 3% в контрольной группе) отмечалось повышение уровня ауто-АТ к этому белку, что может указывать на пролиферативные процессы в астроцитарной глие (глиоз)[1], спектр проявлений которых варьирует при эндогенных психических расстройствах от обратимой активации до формирования глиального рубца[10].
Как известно, процессы активации астроцитарной глии запускаются в тканях мозга в ответ на повреждение нейронов различного, в том числе инфекционно-воспалительного, генеза. Можно также предположить, что длительное повышение содержания ауто-АТ к GFAP будет сопряжено с дистрофическими процессами в астроцитах. Увеличение концентрации ауто-АТ может свидетельствовать и о нарушении барьерной функции гематоэнцефалического барьера (ГЭБ)[11].
Остальные отклонения в уровнях ауто-АТ встречались реже. Так, рост содержания ауто-АТ к дофаминовым, серотониновым и Н-холинорецепторам наблюдался у 11,8%, 11,8% и 9,6% пациентов основной группы соответственно (в контрольной группе — у 2%, 2% и 3% участников соответственно). Отмеченные аномалии могут говорить об изменениях в соответствующих системах нейронов.
Повышение уровня ауто-АТ к вольтаж-зависимому кальциевому каналу (VGCC) (идентифицирован в мембране нейронов, эндокринных и мышечных клеток) установлено у 11,5% больных основной и у 3% лиц контрольной группы. Аномалии содержания ауто-АТ к антигенам VGCC могут указывать на широкий спектр расстройств с нарушениями водно-электролитного баланса и энергетического метаболизма нейронов, на изменение соотношений между возбуждающими и тормозными процессами в нервной системе, на нарушение функций межнейронных и нервно-мышечных контактов[12] и эндокринный дисбаланс[13], а также на вовлечение в патологические процессы спинного мозга и мозжечка[14].
Увеличение уровней ауто-АТ к двуспиральной ДНК и β2-гликопротеину в основной группе, возможно, говорит о взаимосвязи описанных изменений в нервной системе этих пациентов с неспецифической иммунной активацией (системным воспалением, включая воспаление в сосудистой сети). Чаще всего такие отклонения в содержании ауто-АТ бывают обусловлены активно реплицирующимися внутриклеточными инфектами (обычно вирусными)[1].
Рост уровней ауто-АТ к β2-гликопротеину может отражать интенсификацию их взаимодействия с белково-фосфолипидными комплексами клеточных мембран, а также процессы, связанные с возможным повреждением эндотелия сосудистых стенок (васкулопатия) и повышением свертываемости крови (антифосфолипидный синдром)[1]. Указанные процессы у пациентов с повышенным содержанием ауто-АТ к β2-гликопротеину, таким образом, могут иметь распространенный характер. Есть вероятность, что увеличение уровней ауто-АТ к β2-гликопротеину индуцировано инфекционным процессом[1].
Следует отметить, что, помимо пациентов с повышенным содержанием ауто-АТ к β2-гликопротеину, с той же частотой (11,8%) выявлялись больные с пограничными (между нормальным и повышенным) уровнями.
Показатели специфического (противогерпетического) иммунитета исследованы у 25 из 56 больных. Рост содержания тех или иных противогерпетических АТ отмечался во всех случаях. Наиболее часто встречалось повышение уровня IgG к ВПГ-1 (84% случаев), IgG к капсидному (86,7%) и ядерному (71,4%) антигенам ЭБВ, IgG к ЦМВ (54,2%). Повышение уровня IgG к тому или иному вирусу в настоящее время рассматривается как признак присутствия вируса в организме[15], в связи с чем полученные результаты говорят об инфицированности больных герпесом.
Как показали результаты корреляционного анализа, содержание ауто-АТ к MBP коррелирует с уровнем IgM к ЦМВ (r = 0,34) и IgG к капсидному антигену ЭБВ (r = 0,55), ауто-АТ к NF-200 — с содержанием IgM к ВПГ-1 (r = –0,33) и к ЭБВ (r = –0,68), ауто-АТ к GFAP — с содержанием IgM к ВПГ-2 (r = –0,31). Уровни ауто-АТ к дофаминовым рецепторам коррелировали с содержанием IgG к капсидному (r = –0,6) и к ядерному антигенам ЭБВ (r = –0,49), ауто-АТ к глутаматным рецепторам — с содержанием IgM к ЭБВ (r = –0,5) и IgG к ВПГ-6 (r = –0,51) (p < 0,05 для всех корреляций).
Таким образом, проведенное исследование выявило у обследованных больных шизоаффективным психозом аномалии профилей ауто-АТ (преимущественно повышение уровней), которые могут отражать деструктивные и воспалительные процессы в тканях центральной и периферической нервной системы (MBP, S-100, NF-200, GFAP), а также нарушение проницаемости ГЭБ.
Деструктивные процессы в нервной системе обнаруживались у больных эндогенными психическими заболеваниями (шизофренией) ранее и с помощью других методов исследования. В частности, некоторые катамнестические МРТ-исследования[16, 17] показали прогрессирующую редукцию структур мозга у таких пациентов.
Найденные иммунохимические признаки, предполагающие процессы демиелинизации у исследованных больных шизоаффективным психозом (повышение уровней ауто-АТ к МBP и NF-200), подтверждают данные посмертных патоморфологических исследований[18] о том, что поражение миелиновых оболочек нервов характерно для эндогенных психических заболеваний (шизофрении).
Полученные нами результаты становятся также важным подтверждением данных многочисленных исследований, в ходе которых при эндогенных психических заболеваниях найдены биохимические маркеры воспалительных реакций в периферической крови и спинномозговой жидкости[19–21], в мозговой ткани (посмертный материал)[22, 23]. В некоторых из них воспалительный процесс рассматривается в качестве основного патогенетического фактора[24] и ставятся вопросы о необходимости изучения его связи с микробиотой[25].
Обнаруженные патологические процессы, связанные с активацией астроцитарной глии (повышенные уровни ауто-АТ к белкам GFAP и S-100В), подтверждают соответствующие данные патоморфологов[10]. Следует отметить, что традиционно подчеркивалась ареактивность глии при эндогенных психических заболеваниях (шизофрении), и это в свое время явилось отправной точкой для квалификации структурных аномалий мозга при данном заболевании в качестве аномалий развития. Однако впоследствии были установлены изменения ультраструктуры астроцитов и экспрессии их маркеров, что свидетельствует об активном вовлечении этих клеток в патологический процесс[10].
Кроме того, патоморфологические данные говорят о том, что дисфункция астроцитов при шизофрении прогрессирует по мере увеличения длительности заболевания[26]. Высказано также предположение, что патологические процессы в астроцитах при этом заболевании связаны с иммунными изменениями, что подтверждается результатами настоящего исследования. Как известно и отмечено ранее, процессы активации астроцитарной глии запускаются в тканях мозга в ответ на повреждение нейронов различного, в том числе инфекционно-воспалительного, генеза.
Повышение уровней ауто-АТ к белку S-100 у обследованных больных, а в ряде случаев и к двуспиральной ДНК и β2-гликопротеину, может свидетельствовать о вовлечении в патологический процесс сосудистой сети, что подтверждают сведения, полученные с использованием МР-ангиографии, морфометрических исследований на посмертном материале и в ходе биохимических исследований. Они говорят о патологии в системе мозговых коллекторов, крупных сосудов и капиллярной сети (расширении периваскулярных пространств, периваскулярных кистах, очагах дистрофии в белом веществе мозга)[27], о повреждении эндотелия капилляров и неспецифических изменениях их ультраструктуры[23, 28] при эндогенных психозах (шизофрении).
Следует также отметить, что с учетом изменений в содержании ауто-АТ к MBP, NF-200, VGCC психиатрическая симптоматика (в частности, связанная с расстройствами мышечного тонуса) может иметь как центральный, так и периферический генез.
Как известно, аномально избыточная продукция ауто-АТ, будучи в большинстве случаев вторичным явлением, отражает первичные аномалии со стороны соответствующих антигенов (например, при развитии локальных воспалительных процессов, аномалиях экспрессии и секреции соответствующих продуктов). При этом повышенная продукция ауто-АТ направлена на активацию клиренса и утилизацию избытка таких продуктов и является саногенной.
Существенно реже наблюдается первичная аутоиммунная патология, для которой характерно не обусловленное нуждами организма патогенное повышение продукции определенных ауто-АТ, выступающих инструментами иммунометаболических нарушений разной степени выраженности, вплоть до аутодеструктивных реакций[1].
Таким образом, аномалии профилей сывороточной иммунореактивности, обусловленной теми или иными ауто-АТ, чаще всего отражают избыточное поступление соответствующих антигенов в межклеточные пространства, например при патологической активации их продукции и/или избыточной гибели клеток, их продуцирующих. Имеются данные о том, что повышенные уровни ауто-АТ к антигенам тех или иных органов и систем могут быть связаны с наличием вирусного (внутриклеточного) инфекционного процесса. Так, избыток ауто-АТ к двуспиральной ДНК чаще всего обусловлен активацией процессов апоптоза, вызванной активно реплицирующимися внутриклеточными инфектами (обычно вирусными)[1]. Патологическое увеличение продукции ауто-АТ к белкам S100 могут вызывать многие варианты вирусов папилломы (по механизмам молекулярной мимикрии).
По данным иммунологических исследований[1, 29], аутоиммунным процессам, сопровождающимся выраженной органной деструкцией, предшествуют десятилетиями протекающие инфекционно-воспалительные повреждения, часто вызываемые вирусами герпеса. Результаты проведенной работы, выявившие корреляции уровней изученных ауто-АТ с содержанием АТ к вирусам группы герпеса, могут рассматриваться как подтверждающие эти сведения.
В целом наши результаты поддерживают вирусную концепцию этиологии демиелинизирующих заболеваний, основанную на данных о наличии общих антигенных детерминант между энцефалитогенной областью MBP и некоторыми вирусами (ЭБВ, ЦМВ, ВПГ, корью, краснухой)[30].
Они также подтверждают наши прежние данные об этиопатогенетической роли герпетической инфекции при эндогенных психических заболеваниях (шизофрении, шизоаффективном психозе)[3–6, 27].
ЗАКЛЮЧЕНИЕ
Аномально избыточная продукция аутоантител (ауто-АТ), выявленная у большинства изученных пациентов, представляется вторичным явлением при развитии локальных, а у некоторых пациентов (случаи с повышением уровней ауто-АТ к двуспиральной ДНК и β2-гликопротеину) и распространенных инфекционно-воспалительных процессов, сопряженных с вирусами группы герпеса. В свою очередь, эти процессы выступают в качестве триггера стойких аутодеструктивных реакций в нервной ткани.
Вышесказанное диктует необходимость проведения тщательного соматического обследования пациентов с последующей санацией выявленных очагов инфекции и купированием воспалительных проявлений наряду с использованием комплексных подходов, направленных на коррекцию состояния сосудов, иммунных и метаболических нарушений.
Поступила: 14.10.2019
Принята к публикации: 30.11.2019
Периодически, приблизительно в 15-20% случаев, по данным «нейронного теста» (аутоантитела к аутоантигенам аксонов и миелиновой оболочки — общий белок миелина) мы выявляем у больных с психическими расстройствами и, в частности, страдающих зависимостью от психоактивных веществ, патологию аксонов, которую можно рассматривать либо как следствие воспалительного процесса, либо демиелинизирующих процессов или аксонопатию метаболического характера.
Патология аксонов, вероятно, может включать в себя: их утрату, пересечение, нарушенный аксональный транспорт, повреждение оболочки, дистального или проксимального отделов этих отростков нейронов. «Незащищенные аксоны» вследствие повреждения или утраты миелиновой оболочки становятся более уязвимыми и восприимчивыми к их дальнейшему повреждению.
В психиатрии мы чаще всего встречаемся с хроническим поражением аксонов, в неврологии, например, при рассеянном склерозе — с острым. Маркерами острого повреждения аксонов считаются: дефосфолирование нейрофиламентов, нарушение аксонального транспорта, экспрессия специфических кальциевых каналов и пересечение аксонов.
Нарушение аксонального транспорта («поперечное повреждение аксонов») можно обнаружить при помощи белков, транспортирующихся по аксонам. Белки аккумулируются в поперечных срезах или в зонах нарушенного транспорта. Одним из таких белков является амилоидный белок предшественник, который синтезируется в нейронах и транспортируется на периферию вдоль аксонального цитоскелета. Некоторые исследователи полагают, что повреждение аксонов происходит при атаке на миелиновую оболочку, что аксонотоксичные компоненты присутствуют среди медиаторов воспаления, повреждающих миелиновый — олигодендроцитарный комплекс. Возможно, аксоны утрачивают трофическую поддержку, получаемую от олигодендроцитов. Скорее всего, основными мишенями аутоиммунного ответа при некоторых психических расстройствах являются олигодендроциты и миелиновые оболочки.
Олигодендроциты более восприимчивы к повреждению вследствие влияния большого числа иммунологических или токсических эффекторов, включая цитокины (TNF-альфа), реактивные виды кислорода или азота, медиаторов возбуждения (глутамат), компонентов комплимента, протеолитических и липолитических энзимов и др. агентов. Целостность аксонов в первую очередь зависит от взаимодействия аксонов и олигодендроцитов, которые являются миелинобразующими клетками и доставляющими к аксону «трофические сигналы выживания». Заключительная фаза разрушения цитоскелета аксонов заключается в притоке в него ионов Ca2+, активирующих широкий спектр протеиназ, например, кальпаина, что и приводит к деинтеграции аксона (этот процесс можно предотвратить с помощью блокады входа в аксон Na+ или Ca+).
Подготовка к исследованию
Специальной подготовки к исследованию не требуется. Взятие крови проводится натощак или не ранее, чем через 4 часа после необильного приема пищи. Допустимо пить чистую не минеральную и не газированную воду. Чай, кофе, сок запрещаются.
Описание
Лабораторное исследование, направленное на оценку специфических (маркерных) антител, к специфическим антигенам, увеличение которых может свидетельствовать о развитии патологии центральной и периферической нервной системы. Особенностью данного теста является то, что проводится ранняя диагностика заболевания, еще за долгие годы до манифестации клинических появлений, что очень важно в случае наследственной предрасположенности к заболеваниям нервной системы.
Белок NF-200 является специфическим белком аксонов; дегенерация нервных волокон сопровождаются ростом антител к данному белку.
Белок GFAP является специфическим белком филаментов астроцитов; рост антител нему сопровождает аномально активную пролиферацию клеток астроглии (глиоз).
Белок S100 является Са-зависимым регулятором множества клеточных функций (регуляция апоптоза, трофический фактор серотонинергических нейронов и др.); повышение АТ к нему в большинстве случаев сопровождается изменениями эмоционального статуса. Частой причиной роста АТ к S100 является папилломавирусная инфекция (по механизмам молекулярной мимикрии).
Белок ОБМ является специфическим белком миелиновых оболочек аксонов; рост антител нему сопровождает процессы патологических изменений в нервных волокнах, в том числе, при демиелинизирующих процессах.
Вольтажзависимый Са-канал является специфическим антигеном; повышение АТ к нему характерно для бокового амиотрофического склероза, мозжечковой атаксии, синдрома Ламберта-Итона.
Аномальное повышение АТ к лиганд-связывающему сайту рецепторов нейромедиаторов (Глутаматные рецепторы, Дофаминовые рецепторы, ГАМК-рецепторы, Серотониновые рецепторы) часто указывает на изменения в соответствующих системах нейронов.
Важно: с помощью ЭЛИ-Н-Теста производится недифференцированная оценка сывороточного содержания АТ к разным изоформам соответствующих рецепторов (А- и В-ГАМК-рецепторы; Глутаматные NMDA- и AMPA-рецепторы; Д1…Д5 дофаминовые рецепторы; 5-Н1…5-Н7 рецепторы серотонина, Холинорецепторы).
Избыток антител к ДНК и beta2-Гликопротеину указывает на неспецифическую иммуноактивацию, связанную (по большей части) в неспецифическим инфекционно-воспалительным процессом.
К результату исследования прилагается развернутое пояснение по каждому измеренному параметру , а также интерпретация по прилагаемой гистограмме для ЭЛИ-тестов. Окончательное заключение и индивидуальные рекомендации проводятся врачом, владеющим методикой работы с ЭЛИ-тестами, на основании данных анамнеза и объективного обследования.
Показания к назначению
Заболевания нервной системы и подозрение на них.
Интерферирующие факторы
Имммуномодуляторы, иммуносупрессанты, иммуностимуляторы, антибактериальные проепараты, химиотерапия, вакцинация, лучевая терапия
Причины отклонения показателей от нормы (повышенные значения)
Подъем относительного содержания (иммунореактивности) тех или иных специфических аутоантител выше 20% от индивидуального среднего уровня следует рассматривать как возможный индикатор нарушений в соответствующем органе.
Причины отклонения показателей от нормы (сниженные значения)
нет
Метод:
Твердофазный гетерогенный неконкурентный вариант ИФА;
Анализатор:
Не используется;