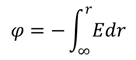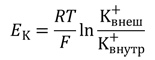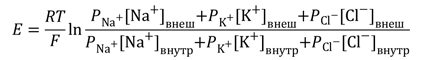1. Биологическая мембрана
Лекция № 1 (часть третья)
Тема:
Биологическая
мембрана
Медицинский факультет
Специальности:
060101.65 – Лечебное дело
060103.65 – Педиатрия
2012 / 2013 учебный год
3, 10 сентября 2012 г.
2. Литература основная
Физиология человека
Под редакцией
В.М.Покровского,
Г.Ф.Коротько
Медицина, 2003 (2007) г.
С. 39 – 45
3. Литература основная
Физиология человека
В двух томах . Том I.
Под редакцией
В. М. Покровского,
Г. Ф. Коротько
• Медицина, 1997 (1998, 2000, 2001) г.
С. 28 – 34
4. Вопрос 1
Понятие «биомембрана»
5.
• МЕМБРА́НА, -ы, ж. от лат. membrana —
кожица, перепонка.
6. Биомембрана —
Биомембрана • морфо-функциональное образование,
отграничивающее содержимое клетки
живых организмов от внешней для неё
среды и жидкостные компартменты
внутри клетки,
• имеющее общий план строения и
• сходные функции.
7. Биомембрана
• ввел понятие Дж. Робертсон в 1963 г.
8. Понятие «элементарная биологическая мембрана»
Принцип построения всех
биологических мембран
одинаков, независимо от
того, какой клетки
(растительной или животной)
или клеточной органелле она
принадлежит.
9. Биологическая мембрана
Структура, имеющая общий план
строения – бислой фосфолипидов и
включённые в него белки
Структура, отделяющая клетку от
внешней среды и формирующая
внутриклеточные органеллы
(мембранные).
Структура обеспечивающая
взаимодействие клетки и органелл с
окружающей их средой.
10. Вопрос 2
Эволюция
представлений о
биомембране
11.
• Роберт Гук (Robert
Hooke; Роберт Хук,
18 июля 1635,
остров Уайт — 3
марта 1703, Лондон)
12. Первое изображение живых клеток: рисунок из «Микрографии» Гука (1665)
13.
14.
15.
16.
– 1855 год. К. фон Негели обнаружил, что
неповрежденные клетки изменяют свой объем
при изменении осмотического давления
окружающей среды.
17. Карл Вильгельм фон Негели
• нем. Carl Wilhelm
von Nageli;
• 1817—1891
• Выдающийся
ботаник XIX века.
18. Вильгельм Пфеффер
• нем. Wilhelm Friedrich
Philipp Pfeffer
• 1845 — 1920
• немецкий химик,
ботаник, занимался
физиологией растений.
• С 1908 года
иностранный членкорреспондент
Петербургской АН (с
1917 РАН).
19.
20. Вопрос 3
Жидкостно-мозаичная
концептуальная модель
биомембраны
Сингера-Николсона
(1972 г.)
21.
22. «Бутербродная» модель биомембраны
23.
24. Изображение элементов биомембраны
25. Изображение элементов биомембраны
26. Изображение элементов биомембраны
• E-пространства (Exstracellular Space), P-пространство
(Protoplasm, цитозоль); Ef – Е-поверхность (E face),
Eh – Е-монослой (половина) (E half),
Pf –
P-поверхность (P face),
Ph – P-монослой (половина)
(P half).
27. Вопрос 4
Предметные модели
биомембраны
28. Предметные модели биомембраны
• Подробнее –
Учебник том I, С.28-34.
29. Предметные модели биологических мембран
Физические
• Плоские
• Сферические (липосомы)
Биологические
• «тени» эритроцитов
• Гигантский аксон кальмара
30.
31. Плоская бислойная липидная мембрана по P.Mueller (1962)
32. Липосома
33. Не путайте липосому с мицеллой!!!
34. Вопрос 5
Мембранные липиды
35. Мембранные липиды
• Фосфолипиды
• Сфинголипиды
• Стероиды
36.
37.
38. Вопрос 6
Мембранные белки
39. Топологическая классификация мембранных белков
1. монотопические
2, 3 -политопические
40. Различные категории монотопических белков.
1 – белки, связанные с
интегральными белками
(сукцинатдегидрогеназа);
2 – белки, присоединенные к
полярным «головкам» липидного
слоя за счёт электростатического
взаимодействия (прямого или
кальций-опосредованного).
(протеинкиназа С);
3 – белки, вязанные с мембраной
амфипатической альфа-спиралью,
параллельной плоскости мембраны,
4 — белки, «заякоренные» в
мембране с помощью короткого
гидрофобного концевого домена
(цитохром b5);
5 – белки «заякоренные» в
мембране за счет жирнокислотного
радикала, ковалентно
присоединенного к белковой
молекуле (G-белок).
41. Биохимическая классификация
По биохимической классификации
мембранные белки делятся на
• интегральные и
• периферические.
42. Интегральные мембранные белки
• прочно встроены в мембрану и могут
быть извлечены из липидного
окружения только с помощью
детергентов или неполярных
растворителей.
• По отношению к липидному бислою
интегральные белки могут быть
трансмембранными политопическими
или интегральными монотопическими.
43. Периферические мембранные белки
• являются монотопическими белками.
• Они либо связаны слабыми связями с
липидной мембраной, либо ассоциируют с
интегральными белками за счёт
гидрофобных, электростатических или других
нековалентных сил.
• в отличие от интегральных белков они
диссоциируют от мембраны при обработке
соответствующим водным раствором. Эта
диссоциация не требует разрушения
мембраны.
44. Транспорт веществ через мембрану: общие вопросы
Вопрос 7
Транспорт веществ через
мембрану: общие вопросы
45. Характеризуя тот или иной вид транспорта мы должны выяснить три основных момента:
• меняется ли архитектоника мембраны?
• происходит ли непосредственно при
этом процессе гидролиз АТФ?
• сопряжён ли транспорт вещества с
транспортом других веществ?
46. В зависимости от характера ответов выделяют следующие виды транспорта:
• с изменением архитектоники мембраны
и без изменения архитектоники
мембраны.
• активный и пассивный
• унипорт и котранспорт
47. Транспорт веществ с изменением архитектоники мембраны
Вопрос 8
Транспорт веществ с
изменением
архитектоники
мембраны
48. НАПРАВЛЕНИЯ ТРАНСПОРТА
• ЭНДОЦИТОЗ
• ЭКЗОЦИТОЗ
• ТРАНСЦИТОЗ
49. Формы опустошения везикул и освобождение медиатора
а — типичный экзоцитоз
(«kiss and stay»
б — кратковременный
поцелуй («kiss and
run»)
в – через медиатофор
или канал
50. Опустошение везикул и освобождение медиатора в зависимости от концентрации кальция
51.
52. Транспорт веществ с изменением архитектоники мембраны
53. Транспорт веществ с изменением архитектоники мембраны
54.
55.
56.
57.
58.
59. Пассивный транспорт веществ через мембрану
Вопрос 9
Пассивный транспорт
веществ через
мембрану
60. Пассивный транспорт веществ через мембрану
• Осуществляется по градиенту
концентрации без затраты энергии АТФ.
• Различают простую и облегчённую
диффузию.
61. Пассивный транспорт веществ через мембрану
• Напомним, диффузия (diffusio лат. –
разлитие) — это самопроизвольное
перемещение молекул (частиц) из
области с более высокой в область с
более низкой концентрацией.
• В основе её — хаотичное тепловое
движение данных молекул (частиц).
62.
63. Простая диффузия
64. Простую диффузию описывает закон Фика
где dm/dt – плотность потока вещества,
-D — коэффициент диффузии,
S – диффузионная поверхность,
dC – градиент концентрации,
dx – толщина мембраны
65. Различают облегчённую диффузию с подвижным и с фиксированным переносчиком
66. Кинетика облегченной диффузии подчиняется правилу Михаэлиса-Ментен
67. ТРАНСПОРТ
• пассивный –
диффузия,
по градиенту
• активный –
с переносчиком
против
градиента
• облегченная
диффузия –
с переносчиком
68. Активный транспорт веществ через мембрану
Вопрос 10
Активный транспорт
веществ через
мембрану
69. Активный транспорт ионов через мембрану
70.
71. Сопряжённый транспорт веществ через мембрану
Вопрос 11
Сопряжённый транспорт
веществ через
мембрану
72.
73.
74.
75. Виды котранспорта
Пассивный
Активный (первично)
Вторичноактивный
Третичноактивный, …
76. Вопрос 12
Функции
биомембраны
77.
78. Вопрос 13
Сигнальная система
G-белка в
биологической
мембране
79. Лауреаты Нобелевской премии по физиологии и медицине 1994 года.
Альфред Гилман
(Alfred G. Gilman),
родился в 1941 г.
Мартин Родбелл
(Martin Rodbell),
1925-1998
80. Мультимолекулярная система: рецептор – G-белок — фермент — вторичный посредник — … — эффектор
Мультимолекулярная система: рецептор – G-белок фермент — вторичный посредник — … — эффектор
1.
2.
3.
4.
5.
6.
Взаимодействие медиатора и рецептора
Активация рецептором
G-белка
Активация альфа-субединицей фермента
Образование второго посредника
Влияние на ионный канал
Влияние на транскрипцию или трансляцию
81. Мультимолекулярная система: рецептор – G-белок — фермент — вторичный посредник — … — эффектор
Мультимолекулярная система: рецептор – G-белок фермент — вторичный посредник — … — эффектор
1.
2.
3.
4.
5.
6.
Взаимодействие медиатора и рецептора
Активация рецептором
G-белка
Активация альфа-субединицей фермента
Образование второго посредника
Влияние на ионный канал
Влияние на транскрипцию или трансляцию
82. Структура G-белка
Альфа-субъединица изображена с
полостью, символизирующей сайт
связывания ГДФ или ГТФ
83. Цикл активации G-белка под действием G-белок-связанного рецептора
84. Влияние бета-гамма-субъединиц G‑белка на ионные каналы
Влияние бета-гамма-субъединиц
G-белка на ионные каналы
85. Влияние бета-гамма-субъединиц G‑белка на ионные каналы
Влияние бета-гамма-субъединиц
G-белка на ионные каналы
86. Прямая активация калиевого канала субъединицами G-белка
Ацетилхолин взаимодействует с М-холинорецептором, что приводит к
диссоциации G-белка, его + субъединицы напрямую активируют
калиевый канал, переводя его в открытое состояние
87. Прямая активация калиевого канала субъединицами G-белка
Ацетилхолин взаимодействует с Мхолинорецептором, что приводит к
диссоциации G-белка, его + субъединицы
напрямую активируют калиевый канал,
переводя его в открытое состояние
88.
Прямое ингибирование Са-канала субъединицами
G-белка
Активация предсинаптических адренорецепторов (ауторецепторов) приводит к диссоциации
G-белка и последующему ингибированию (закрытию) кальциевых каналов, т.е. снижению
уровня освобождение медиатора (норадреналина)
89. Прямое ингибирование Са-канала субъединицами G-белка
90. Модуляция потенциал-зависимых кальциевых каналов норадреналином
НА + -адренорецептор → G-белок→ субъединица → аденилатциклаза
→ образование сАМР → активация протеинкиназы А →
фосфорилирование Са-канала→ снижение порога активации Саканалов миокард
91. Регуляция экспрессии белков путем активации метаботропных рецепторов
92.
Виды ионных каналов
Два принципиальных свойства ионных каналов:
(1) Ионная селективность – через канал может проходить только
один вид ионов
(2) Состояния: закрыты, открыты, инактивированы
потенциалмеханохемочувствительные
чувствительные
чувствительные
внеклеточные внутриклеточные
+++
+++
out
—
—
in
закрыты
открыты
+
+
out
—
—
in
Мембранный потенциал
Молекула связывается с каналом Растяжение
Подборка по базе: План-конспект Основные требования законодательства РФ по охране , Тема № 1 Основные принципы правового регулирования трудовых отно, Тема Основные требования законодательства РФ о труде и охране тр, Тема 1.1 Философия как наука, ее основные категории, понятия и ф, Тема 1.7.3 Основные положения.docx, Индивидуальное практическое задание. Введение в коучинг. Основны, ПЗ № 23 Текстовый редактор назначение, основные функции.docx, развитие персонала как элемент инновационного управления организ, Лекция 6 Основные теории межкультурной коммуникации Э.Хирш.pdf, Антигены, основные свойства. Антигены гистосовместимости. Процес
Физиология возбудимых тканей: общие вопросы. Физиология биологических мембран.
- Раздражение и возбуждение как основные типы реакции тканей на раздражение.
Основным свойством живых клеток является раздражимость, т.е способность реагировать изменение обмена веществ в ответ на раздражитель
Возбудимость – свойство клеток отвечать на раздражение возбуждением.
К возбудимым относят мышечные (возбуждение проявляется сокращением), нервные(возбуждение проявляется генерацией электрического импульса) и некоторые секреторные клетки (возбуждение проявляется выбросом в межклеточное пространство биологически активных веществ)
Одним из важных свойств живых клеток является электрическая возбудимость, т.е. способность возбуждаться в ответ на действие электрического тока. Высокая чувствительность возбудимых тканей на действие электрического тока была экспериментально продемонстрирована опытом Гальвани на нервно-мышечном препарате задних лапок лягушки.
Первый опыт Гальвани: одна пластинка меди или цинка к мышце ,вторая – к нерву. Мышца сокращалась
Но, Вольта на основе анализа опыта с лягушкой сделал вывод, что ток возник не в живых клетках, а в месте контакта пластинки с электролитом, поскольку тканевые жидкости представляют собой раствор солей. На основе своих заключений он создает «вольтов столб», который представляет собой чередующиеся цинковые и серебренные пластинки, между которыми бумага, смоченная солевым раствором.
Второй опыт Гальвани: для доказательства своей точки зрения проводит опыт без металлических пластинок, набрасывал на мышцу дистальный отрезок нерва, который ее иннервирует, наблюдалось сокращение.
Окончательное существование электрический явлений в живых клетках было получено в опыте «вторичного тетануса», Маттеуччи: один нервно-мышечный препарат возбуждался током, а биотоки сокращающейся мышцы раздражали второй препарат.
- Понятия «ткани», «возбудимые ткани».
Ткани – совокупность клеток, объединенных общим строением, происхождением и функциями.
Возбудимые ткани – ткани, состоящие из возбудимых клеток.
К возбудимым относят мышечные (возбуждение проявляется сокращением), нервные(возбуждение проявляется генерацией электрического импульса) и некоторые секреторные клетки (возбуждение проявляется выбросом в межклеточное пространство биологически активных веществ)
- Свойства возбудимых тканей.
Возбудимость – способность ткани отвечать на раздражение изменением ряда своих свойств. Показатель возбудимости – порог раздражения. Это минимальное по силе раздражение, способное вызвать видимую ответную реакцию ткани.
Проводимость – способность тк ани проводить возбуждение по всей своей длине. Показатель проводимости – скорость проведения возбуждения. Проводимость напрямую зависит от возбудимости ткани: чем выше возбудимость, тем выше проводимость, так как быстрее возбуждается расположенный рядом участок ткани.
Рефрактерность – способность ткани терять или снижать возбудимость в процессе возбуждения. При этом в ходе ответной реакции ткань перестает воспринимать раздражитель. Рефрактерность бывает абсолютной (нет ответа ни на какой раздражитель) и относительной (возбудимость восстанавливается, и ткань отвечает на подпороговый или сверхпороговый раздражитель). Показатель рефрактерности (рефрактерный период) — время, в течение которого возбудимость ткани снижена. Рефрактерный период тем короче, чем выше возбудимость ткани
Лабильность – способность возбудимой ткани реагировать на раздражение с определенной скоростью. Лабильность характеризуется максимальным числом волн возбуждения, возникающих в ткани в единицу времени (1 с) в точном соответствии с ритмом наносимых раздражений без явления трансформации. Лабильность определяется продолжительностью рефрактерного периода (чем короче рефрактерный период, тем больше лабильность).
Для мышечной ткани характерна также сократимость. Сократимость – способность мышцы отвечать сокращением на раздражение.
- Понятие «биологическая мембрана».
- Структура, имеющая общий план строения – бислой фосфолипидов и включённые в него белки
- Структура, отделяющая клетку от внешней среды и формирующая внутриклеточные органеллы (мембранные).
- Структура обеспечивающая взаимодействие клетки и органелл с окружающей их средой
- Общий план строения биологической мембраны. Жидкостно-мозаичная модель биологической мембраны (Сингера-Николсона, 1972).
Одним из основных компонентов клетки является клеточная мембрана (плазмолемма, плазматическая мембрана), которая состоит из бислоя (двойного слоя) липидов, белков и углеводов. Липиды имеют полярные “головки” и неполярные хвосты. В двойном слое гидрофобные “хвосты” липидных молекул обращены друг к другу, а гидрофильные “головки” направлены кнаружи, образуя гидрофильные поверхности. Толщина 6-12 нм. (описанное выше и есть жидкостно-мозаичная модель биологической мембраны Сингера-Николсона, 1972).
По своему расположению относительно липидного бислоя мембранные белки подразделяются
на:
- периферические– непосредственно связаны с поверхностью мембраны и обычно находятся вне билипидногослоя;
- полуинтегральные– погружены в билипидный слой частично;
- интегральные– полностью погружены в билипидный слой, большинство – трансмембранные, пронизывают мембрану насквозь.
Многие мембранные белки соединены с углеводами, образуя гликопротеины. Углеводы, соединенные с липидами образуют гликолипиды. Гликоли-пиды и гликопротеиды располагаются только в наружном слое мембраны.
Гликокаликс – молекулы углеводов (гликопротеины и гликолипиды). Обеспечивают избирательность транспорта веществ через плазмолемму, рецепторная и маркерная/информационная/ функции. С помощью него клетки распознают друг друга и вступают в различные взаимодействия.
Клеточная мембрана играет важную роль: отделяет клеточное содержимое от внешней среды; регулирует обмен между клеткой и средой; делит клетки на отсеки, или компартменты; выполняет рецепторную функцию; на мембране протекают некоторые химические реакции. Клеточные мембраны обладают избирательной проницаемостью. Это свойство определяет различные пути поступления питательных веществ в клетку.
Функции клеточных мембран:
- Барьерная
- Регуляторная
- Контактная – организация зон контакта между клетками с образованием тканевой структуры
- Преобразование внешних стимулов/раздражителей? неэлектрической природы в электрические сигналы
- Высвобождение нейромедиаторов в синапсический окончаниях
- Синапс – место контакта нейронов друг с другом. Бывают химические (передача импульсов с помощью в-в нейромедиаторов – дофамин, адреналин и т.д.) и электрические
Возбудимые клетки связаны между собой зонами специфических и неспецифических контактов. Зоны неспецифического контакта представлены неизмененными участками прилежащих друг к другу клеточных мембран соседних клеток, между которыми находится межклеточная жидкость. Зоны специфического контакта представлены щелевыми, плотными контактами и десмосомами.
Щелевые контакты – область межклеточного обмена ионами (натрий, калий) и малыми молекулами с молекулярной массой до 500. Состоит из белковых каналов, связывающих цитоплазму соседних клеток. При таком контакте между клетками есть пространство шириной 2-4 нм, которое позволяет специфическим белкам образовывать каналы. Функция щелевых контактов нарушается при увеличении внутриклеточной концентрации кальция или протонов водорода. Щелевые и плотные контакты – передача возбуждения между клетками.
Десмосомы обеспечивают механическую связь между клетками. Участок между двумя соседними клетками, где на их мембранах и между ними находятся на расстоянии 20нм плотные скопления белков. Функция: поддерживать плотное соединения клеток в местах, подверженных сильному растяжению (напр., в коже)
Плотный контакт образуется тех случаях, когда плазмалеммы практически соприкасаются, т.е. между ними нет межклеточной жидкости. Такой контакт идет полосой по всей окружности клетки, так соединены, например эпителиальные клетки внутренней поверхности пищеварительного тракта
- Предметные модели биологических мембран.
- Физические модельные мембраны (плоские, сферические).
- Биологические модельные мембраны (тени эритроцитов, аксон кальмара).
- Транспорт веществ через мембрану. Характеристика транспорта.
Существует два механизма перемещения веществ через мембрану – посредством простой диффузии и специфических белков переносчиков, встроенных в мембрану и представляющих собой трансмембранные интегральные белки (облегченная диффузия и активный транспорт – первично активный, вторично активный).
Величину потока веществ через систему транспорта определяют три фактора:
- Степень насыщения специфических мест связывания переносчика, которая зависит от двух моментов – концентрации вещества и сродства переносчика веществу
- Число переносчиков – чем их больше, тем больше поток при любой насыщенности
- Скорость, с которой происходят конформационные изменения в транспортном белке
- Транспорт веществ с изменением и без изменения архитектоники мембраны.
К транспорту веществ с изменением архитектоники (структуры) мембраны относят эндоцитоз и экзоцитоз.
Эндоцитоз – способность клетки активно поглощать питательные вещества в виде мелких пузырьков (пиноцитоз) или твердых частиц (фагоцитоз).
- Пассивный транспорт веществ через мембрану. Уравнение Фика.
Пассивный транспорт веществ происходит без использования энергии по градиенту концентрации (из области, где их концентрация выше, в область, где их концентрация ниже). Пассивный транспорт осуществляется путем диффузии и осмоса.
Диффузия – это процесс, в ходе которого молекулы (или ионы) переходят через мембрану из области с высокой концентрацией в область низкой концентрации в результате броуновского движения (теплового движения атомов и молекул).
Различают простую и облегченную диффузию веществ через клеточную мембрану.
Посредством простой диффузии без помощи специального переносчика:
Во-первых, осуществляется транспорт непосредственно через липидный бислой. В этом случаи попадание веществ в клетку осуществляется путем растворения их в липидах клеточной мембраны.
Во-вторых, вещества перемещаются через ионные каналы клеточной мембраны, соединяющих цитоплазму клеток с внешней средой.
В-третьих, осуществляется движение молекул воды через мембрану. Осмос – диффузия воды через мембрану из менее концентрированного в более концентрированный раствор.

- Ионные каналы, классификация, свойства.
Ионы натрия, калия ,кальция и хлора проникают в клетку и выходят наружу через специальные, наполненные жидкостью, каналы. Размер каналов довольно мал (0,5-0,7 нм). Именно ионные каналы обеспечивают селективность (избирательность) и проводимость мембраны.
- Облегчённая диффузия.
При облегченной диффузии специальные мембранные белки-переносчики временно соединяются с молекулой вещества и проводят его через мембрану. Энергия для такой диффузия все так же не требуется.
- Активный транспорт через мембрану.
Активный транспорт – перенесение веществ против градиента концентрации (из области низкой концентрации вещества в область с высокой концентрацией) с использованием энергии. Он осуществляется с помощью белков-переносчиков, образующих так называемые ионные насосы для переноса ионов в сторону более высокого биохимического потенциала
- Сопряжённый транспорт (симпорт, антипорт; пассивный, активный, вторично-активный котранспорт).
Первично активный транспорт – прямое потребление АТФ
Пример, Na/K насос. Для нормального функционирования клетка должна поддерживать определенное содержание инонов калия и натрия в цитоплазме и во внешней среде. Концентрация калия в клетке должна быть выше, чем за ее пределами, натрия же в клетке должно быть меньше, чем за ее пределами. Выкачивание натрия из клекти и закачка калия в клетку.
Цикл работы натрий-калиевого насоса:
- Присоединение натрия с внутренней стороны мембраны
- Фосфолирование белка насоса
- Высвобождение натрия во внеклеточное пространство
- Присоединение калия с внешней стороны мембраны
- Дефосфолирирование белка насоса
- Высвобождение калия внутрь клетки
За один цикл работы насос выкачивает из клетки 3натрияя и закачивает 2 калия.
Вторично активный транспорт – использование градиента концентрации ионов относительно мембраны как истоничка энергии
Антипорт: одно вещество из области низкой концентрации в область высокой, второе – наоборот клетки, второе в клетку. Движение вещества из клетки.
Симпорт – оба вещества из области высокой концентрации в область низкой (по градиенту). Движение вещества в клетку
Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K+) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na+ и K+), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na+ и K+).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Так куда же деваются из клетки положительно заряженные частицы? Напомню, что это покинувшие клетку и скопившиеся снаружи ионы натрия — Na+ — и калия — K+.
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
- вначале она обменивает «свой» натрий на «чужой» калий (да-да, одни положительные ионы на другие, такие же положительные);
- потом из неё происходит утечка этих «наменянных» положительных ионов калия, вместе с которыми из клетки утекают положительные заряды.
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na+ на K+
В мембране нервной клетки постоянно работают белковые насосы-обменники (аденозинтрифосфатазы, или Na+/K+-АТФазы), встроенные в мембрану. Они меняют «собственный» натрий клетки на наружный «чужой» калий.
Но ведь при обмене одного положительного заряда (Na+) на другой такой же положительный заряд (K+) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
- любовь клетки к калию (поэтому клетка насильно затаскивает его к себе);
- любовь калия к свободе (поэтому калий покидает захватившую его клетку).
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
- Дефицит натрия (Na+) в клетке.
- Избыток калия (K+) в клетке.
- Появление на мембране слабого электрического потенциала (−10 мВ).
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K+ из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
К+-каналы утечки постоянно открыты при нормальных значениях мембранного потенциала покоя и проявляют взрывы активности при сдвигах мембранного потенциала, которые длятся несколько минут и наблюдаются при всех значениях потенциала. Усиление К+-токов утечки ведёт к гиперполяризации мембраны, тогда как их подавление — к деполяризации. …Однако, существование канального механизма, ответственного за токи утечки, долгое время оставалось под вопросом. Только сейчас стало ясно, что калиевая утечка — это ток через специальные калиевые каналы.
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K+) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, F — постоянная Фарадея, К+внеш и K+внутр — концентрации ионов К+ снаружи и внутри клетки, соответственно. По формуле видно, что для расчёта потенциала между собой сравниваются концентрации ионов одного вида — K+.
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
- −10 мВ, которые получаются от «несимметричной» работы мембранного насоса-обменника (ведь он больше выкачивает из клетки положительных зарядов (Na+), чем закачивает обратно с калием).
- Вторая часть — это всё время утекающий из клетки калий, уносящий положительные заряды. Его вклад — основной: −60 мВ. В сумме это и дает искомые −70 мВ.
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Схема работы Na+/K+-АТФазы наглядно иллюстрирует «несимметричный» обмен Na+ на K+: выкачивание избыточного «плюса» в каждом цикле работы фермента приводит к отрицательному заряжению внутренней поверхности мембраны. Чего в этом ролике не сказано, так это того, что АТФаза ответственна за менее чем 20% потенциала покоя (−10 мВ): оставшаяся «отрицательность» (−60 мВ) появляется за счет выхода из клетки через «калиевые каналы утечки» ионов K+, стремящихся выровнять свою концентрацию внутри клетки и вне нее.
- Jacqueline Fischer-Lougheed, Jian-Hui Liu, Estelle Espinos, David Mordasini, Charles R. Bader, et. al.. (2001). Human Myoblast Fusion Requires Expression of Functional Inward Rectifier Kir2.1 Channels. J Cell Biol. 153, 677-686;
- Liu J.H., Bijlenga P., Fischer-Lougheed J. et al. (1998). Role of an inward rectifier K+ current and of hyperpolarization in human myoblast fusion. J. Physiol. 510, 467–476;
- Sarah Sundelacruz, Michael Levin, David L. Kaplan. (2008). Membrane Potential Controls Adipogenic and Osteogenic Differentiation of Mesenchymal Stem Cells. PLoS ONE. 3, e3737;
- Павловская М.В. и Мамыкин А.И. Электростатика. Диэлектрики и проводники в электрическом поле. Постоянный ток / Электронное пособие по общему курсу физики. СПб: Санкт-Петербургский государственный электротехнический университет;
- Ноздрачёв А.Д., Баженов Ю.И., Баранникова И.А., Батуев А.С. и др. Начала физиологии: Учебник для вузов / Под ред. акад. А.Д. Ноздрачёва. СПб: Лань, 2001. — 1088 с.;
- Макаров А.М. и Лунева Л.А. Основы электромагнетизма / Физика в техническом университете. Т. 3;
- Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология). Казань: Арт-кафе, 2010. — 271 с.;
- Родина Т.Г. Сенсорный анализ продовольственных товаров. Учебник для студентов вузов. М.: Академия, 2004. — 208 с.;
- Кольман Я. и Рем К.-Г. Наглядная биохимия. М.: Мир, 2004. — 469 с.;
- Шульговский В.В. Основы нейрофизиологии: Учебное пособие для студентов вузов. М.: Аспект Пресс, 2000. — 277 с..
Аннотация
При выполнении транспортной функции эритроциты изменяют свои микромеханические свойства,
связанные с мембранной вязкоэластичностью. Имеется ряд свидетельств, что это происходит
под влиянием сигнальных молекул, к которым относятся и газотрансмиттеры: оксид азота
(NO) и сульфид водорода (H2S). Целью данного исследования было изучение микрореологических изменений человеческих
эритроцитов под влиянием доноров и стимуляторов эндогенного образования газотрансмиттеров.
Регистрировали деформируемость (по индексу удлинения эритроцитов – ИУЭ) и показатели
агрегации (ПАЭ) отмытых эритроцитов после их инкубации с нитропруссидом натрия (НПН),
донором H2S – гидросульфидом натрия (NaHS), ингибитором активности растворимой гуанилатциклазы
– 1H-[1,2,4]-oxadiazolo[4,3-a]quinoxalin-l-one (ODQ), субстратом NO-синтазы L-аргинином и ингибитором ее активности N-Nitroarginine methyl ester (L-NAME), с блокатором ATP-чувствительных калиевых каналов – глибенкламидом (ГлК). Кроме того, готовили восстановленные тени эритроцитов, инкубировали с названными
выше соединениями и оценивали изменение их деформируемости. После инкубации эритроцитов
с НПН и NaHS наблюдался прирост ИУЭ на 8–11% (p < 0.01) и снижение ПАЭ на 11–26% (p < 0.01). L-аргинин и НПН оказывали сходные с микрореологические эффекты, которые устранялись
L-NAME или ODQ. ГлК вызывал увеличение ИУЭ эритроцитов на 8% (p < 0.05); эффекты ГлК и NaHS не были аддитивными. Инкубация восстановленных теней
эритроцитов с НПН, L-аргинином и NaHS сопровождалась умеренным, статистически значимым приростом эластичности
мембран (p < 0.05). Результаты исследования позволяют заключить, что доноры и стимуляторы образования
газотрансмиттеров NO и H2S умеренно повышают деформируемость эритроцитов и заметно снижают их агрегацию. Эксперименты
с тенями эритроцитов свидетельствуют о существовании независимого от cGMP прямого
действия газотрансмиттеров на вязкоэластичные свойства мембраны этих клеток.
Ключевые слова: эритроциты, деформируемость, агрегация, газотрансмиттеры, нитропруссид натрия, гидросульфид натрия, растворимая гуанилатциклаза, ${text{К
}}_{{{text{А
Т
Р
}}}}^{ + }$-каналы
ВВЕДЕНИЕ
В последние десятилетия возник повышенный интерес к новому классу сигнальных молекул,
известных как газотрансмиттеры: оксид азота (NO), монооксид углерода (СО) и сульфид
водорода (H2S) [1, 2]. Имеются многочисленные работы, в которых сообщается о важной роли газотрансмиттеров
в регуляции функций организма [3, 4], в том числе клеток крови [5, 6]. Известно, что эритроциты при выполнении кислород-транспортной функции должны реализовать
свои микрореологические свойства – деформируемость и агрегацию [7, 8]. Было показано, что эти клеточные характеристики положительно изменяются под влиянием
донора NO нитропруссида натрия (НПН) или при добавлении субстрата эндотелиальной NO-синтазы
(eNOS) L-аргинина – увеличивается деформируемость и уменьшается агрегация эритроцитов [9–11]. Что касается других газотрансмиттеров, то имеются только данные о снижающем агрегацию
тромбоцитов эффекте сероводорода [5, 12]. Важно заметить, что у зрелых эритроцитов возможна количественная регистрирация
изменений микромеханических свойств мембраны. Кроме того, в эритроцитах имеются активные
элементы молекулярных сигнальных каскадов [13, 14], в том числе G-белки, аденилатциклаза, гуанилатциклаза, cAMP и cGMP, мембранные
ионные каналы, несколько видов фосфодиэстераз, протеинкиназы и фосфатазы [15]. Это как раз те молекулярные мишени, на которые могут действовать газотрансмиттеры
[16, 17]. Таким образом, на модели микрореологического поведения эритроцитов можно изучить
сигнальные механизмы влияния газотрансмиттеров. Цель настоящей работы состояла в изучении
влияния доноров NO и H2S, а также стимулятора эндогенного образования оксида азота L-аргинина на микрореологические свойства эритроцитов.
МАТЕРИАЛЫ И МЕТОДЫ
Образцы цельной крови (9 мл) здоровых доноров (n = 20) получали венопункцией в гепаринизированные вакуумные пробирки (пробирки содержат
12–30 МЕ сухого гепарина на 1 мл крови). Проведение исследования одобрено местным
этическим комитетом университета (протокол № 4 от 19.07.2018 г.). Получено информированное
согласие всех субъектов в соответствии с рекомендациями Хельсинкской декларации (Хельсинкская
декларация WMA об этике. Принципы медицинских исследований с участием людей, с поправками,
внесенными 64-й Генеральной Ассамблеей WMA, Форталеза, Бразилия, октябрь 2013 г.).
Эритроциты отделяли от плазмы центрифугированием (15 мин, 3000 об/мин), трижды отмывали
в изотоническом растворе хлорида натрия и ресуспендировали в буферном растворе (138
мМ NaCl, 3 мМ KCl, 1 мМ K2SO4, 7.5 мМ Na2HPO4, 1 мМ MgSO4, 5 мМ глюкозы, pH 7.4). Поскольку эндотелиальная NO-синтаза (eNOS) является кальций-зависимым
ферментом, то в среду инкубации эритроцитов добавляли CaCl2 до его конечной концентрации 150 мкМ. Осмолярность составляла 300 мОсм/л (определяли
на осмометре Fogel ОМ-801, Германия). В опытах с исследованием агрегации эритроцитов,
для ее стимулирования, добавляли к буферному раствору относительно высокомолекулярный
декстран-200 (10% ХАЕС-стерил, компания Fresenius Kabi, Германия) в соотношении 7
: 3 по объему. При этом осмолярность полученной смеси не изменялась. Суспензию эритроцитов
делили на несколько аликвот и клетки инкубировали в течение 30 мин при 37°С с каждым
из перечисленных ниже соединений:
1) с донором NO – нитропруссидом натрия (НПН, в концентрациях 20, 100 и 200 мкМ);
2) с ингибитором активности растворимой гуанилатциклазы (р-ГЦ) – 1H- [1, 2, 4]- oxadiazolo[4,3-a]quinoxalin-l-one (ODQ, 0.5 мкМ);
3) с субстратом эндотелиальной NO-синтазы (eNOS) L-аргинином (20, 100 и 200 мкМ);
4) с ингибитором активности NOS N-Nitroarginine methyl ester (L-NAME, концентрация 200 мкМ);
5) с донором H2S – гидросульфидом натрия (NaHS, в концентрациях 20, 100 и 200 мкМ);
6) с блокатором ATP-чувствительных калиевых каналов – глибенкламидом (ГлК), в концентрации
50 мкМ).
В каждом опыте в качестве контроля использовали суспензию эритроцитов, инкубируемых
в течение 30 мин при 37°С в буферном растворе без добавления указанных выше препаратов.
В опыте и в контроле проводилось по 20 параллельных измерений. Все препараты и соединения
получены от фирмы Sigma-Aldrich (США). Их растворяли в дистиллированной воде. Все
эксперименты проводили в течение 4 ч после взятия крови. Тени эритроцитов готовили
по методу Доджа [18]. Эритроциты разрушали осмотическим шоком. Для этого к 1 мл клеток добавляли 7 мл
охлажденной дистиллированной воды (при температуре 4°С) с последующей двукратной отмывкой
в фосфатном буфере. Затем концентрат теней инкубировали в фосфатном буфере с добавлением
30% декстрана-200 (соотношение буфера и декстрана 7 : 3 по объему). Суспензию восстановленных
теней эритроцитов делили на несколько аликвот, добавляли соответствующие препараты
и после инкубации в течение 30 мин при 37°С регистрировали деформируемость теней в
проточной микрокамере.
Исследование деформируемости и агрегации. Степень агрегации эритроцитов определяли с помощью агрегометра Myrenne M1 (Германия),
который дает возможность получить четыре индекса агрегации при низких (3 с–1) и высоких (600 с–1) скоростях сдвига через 5 и 10 мин перемешивания (индексы агрегации: М5, М10, М15 и М110 соответственно). Кроме того, процесс агрегации и форму клеток контролировали с помощью
прямой микроскопии. Поскольку все четыре индекса агрегации, которые регистрируются
агрегометром Myrenne M1, изменялись однонаправлено и примерно одинаково, то для анализа
использовали только индексы М5 и М10, которые регистрируются при низкой скорости сдвига. В таблицах и тексте они обозначены
как показатели агрегации эритроцитов (ПАЭ1 и ПАЭ2).
Для оценки мембранной вязкоэластичности эритроцитов определяли индекс удлинения эритроцитов
и их восстановленных теней (ИУЭ) в проточной микрокамере, где создавали постоянное
течение суспензии эритроцитов (Hct = 0.5%). В микрокамеру подавали давление, которое
создавало напряжение сдвига 0.98 Н/м2 к и вытягивало клетки (или их восстановленные тени), прикрепленные ко дну камеры
(рис. 1). Адгезия клеток происходила спонтанно. На основе измерения длины (L) и ширины (W) вытянутых потоком клеток рассчитывали индекс их удлинения (ИУЭ) как показатель деформируемости
эритроцитов: ИУЭ = L/W (отн. ед.).
Рис. 1.
Интактные недеформированные эритроциты (а); эритроциты, деформированные (вытянутые) строго дозированным напряжением сдвига
потока в микрокамере (б); восстановленные тени эритроцитов до приложения напряжения сдвига (в); тени эритроцитов, деформированные в микрокамере (г). Изображение получено с использованием объектива 40× и цифрового окуляра DCM-500.
Статистическая обработка. Статистическую обработку результатов проводили с использованием программы Statistica
6.0. Проверку выборочного распределения проводили с помощью теста Шапиро–Уилка. Значимость
различий определяли с помощью t-критерия Стьюдента. Гипотезу о взаимосвязи данных проверяли с помощью корреляции
Спирмена. За уровень статистически значимых различий принимали изменения при p < 0.05 и p < 0.01. Данные в таблицах и тексте представлены как М ± m (среднее ± стандартная ошибка среднего).
РЕЗУЛЬТАТЫ
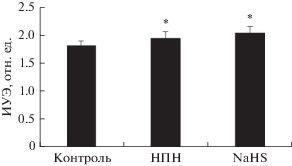
Изменение микрореологии эритроцитов после их инкубации с донором NO нитропруссидом
натрия (НПН) и субстратом NO-синтазы L-аргинином. Оценка изменений микрореологических показателей эритроцитов после их инкубации с
НПН выявила заметные изменения деформируемости и агрегации эритроцитов при всех трех
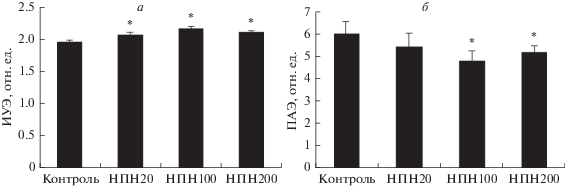
выбранных концентрациях (рис. 2). При концентрации НПН 100 мкМ в суспензионной среде сдвиги были несколько более
выраженными. Это касалось обеих микрореологических характеристик. Ингибитор р-ГЦ ODQ
полностью устранял прирост ИУЭ и уменьшение ПАЭ2 под действием донора NO (табл. 1). Достоверного эффекта на вызванное НПН снижение ПАЭ1 выявлено не было.
Рис. 2.
Изменение деформируемости (а) и агрегации эритроцитов (б) после их инкубации с нитропруссидом натрия (НПН) в разных концентрациях. ИУЭ – индекс
удлинения эритроцитов как показатель их деформируемости; ПАЭ – показатель агрегации
эритроцитов; концентрации НПН составляли 20, 100 и 200 мкМ (НПН20, НПН100 и НПН200
соответственно). * Отличие от контроля статистически значимо (p < 0.05).
Таблица 1.
Изменение микрореологических характеристик эритроцитов после их инкубации с нитропруссидом
натрия, ODQ по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатели, отн. ед. | Контроль | НПН | ODQ | ODQ + НПН |
|---|---|---|---|---|
| ИУЭ | 2.03 ± 0.01 | 2.21 ± 0.02* | 1.91 ± 0.01 | 1.98 ± 0.03 |
| ПАЭ1 | 5.04 ± 0.70 | 4.46 ± 0.80* | 4.93 ± 0.95 | 4.65 ± 0.63 |
| ПАЭ2 | 12.71 ± 1.51 | 8.65 ± 1.11** | 11.90 ± 1.07 | 12.55 ± 0.98* |
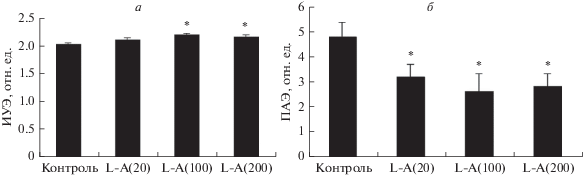
L-Аргинин в разных концентрациях (20, 100 и 200 мкМ) вызывал относительно небольшие,
но статистически значимые изменения деформируемости эритроцитов (рис. 3а). Наиболее эффективной оказалась концентрация 100 мкМ. Анализ изменений деформируемости
эритроцитов под влиянием инкубации с L-аргинином выявил увеличение этой микрореологической характеристики на 8% (р < 0.01; табл. 2). Ингибитор активности NOS, L-NAME, незначительно снижал величину ИУЭ (на 3%) относительно контрольных проб, тогда
как после инкубации клеток с L-аргинином снижение составило 10% (р < 0.01). Таким образом, после преинкубации эритроцитов с L-NAME L-аргинин не влиял на деформируемость эритроцитов (табл. 2). Стимулирование образования оксида азота NO-синтазой эритроцитов при добавлении
L-аргинина приводило к снижению агрегации эритроцитов, и, напротив, ингибирование активности
этого фермента с помощью L-NAME практически полностью устраняло данный эффект (табл. 2, рис. 3б).
Рис. 3.
Дозозависимое влияние L-аргинина (L-A) на деформируемость (а) и агрегацию эритроцитов (б). В скобках указаны концентрации аргинина (мкМ). *Отличие от контроля статистически
значимо (p < 0.05).
Таблица 2.
Изменение микрореологических характеристик эритроцитов после их инкубации с L-аргинином (100 мкМ) и L-NAME (200 мкМ) по отдельности и при их одновременном добавлении (M ± m, n = 20)
| Показатель, отн. ед. | Контроль | L-Аргинин (L—А) | L-NAME | L-NAME + L-А |
|---|---|---|---|---|
| ИУЭ | 2.01 ± 0.03 | 2.17 ± 0.02** | 1.95 ± 0.04*** | 1.98 ± 0.04 |
| ПАЭ1 | 4.05 ± 0.36 | 3.01 ± 0.31* | 4.40 ± 0.62 | 4.30 ± 0.56 |
| ПАЭ2 | 12.35 ± 1.25 | 9.80 ± 0.92** | 11.3 ± 0.58 | 14.80 ± 0.79 |
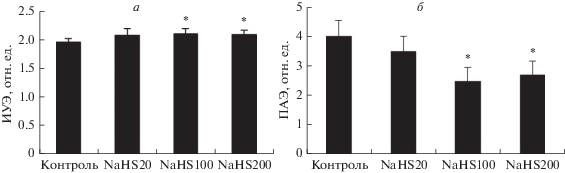
Изменение микрореологии эритроцитов после их инкубации с донором сероводорода – гидросульфидом
натрия (NaHS) и глибенкламидом – блокатором ATP-зависимых К+-каналов. Установлено, что при инкубации эритроцитов с гидросульфидом натрия (20, 100 и 200
мкМ) их деформируемость и агрегация изменялись дозозависимым образом. Так, агрегация
эритроцитов под влиянием этого донора H2S снижалась на 32 и 38% при концентрации препарата 200 и 100 мкМ соответственно (рис. 4б). Существенно меньшее (~11%), но также значимое изменение деформируемости наблюдалось
при 100–200 мкМ NaHS (рис. 4а).
Рис. 4.
Изменение деформируемости (а) и агрегации эритроцитов (б) после их инкубации с гидросульфидом натрия (NaHS) в концентрациях 20, 100 или 200
мкМ. *Отличие от контроля статистически значимо (p < 0.05).
В качестве молекулярной мишени для действия на клетки H2S как газотрансмиттера рассматривают ATP-зависимые К+-каналы (${text{К
}}_{{{text{А
Т
Р
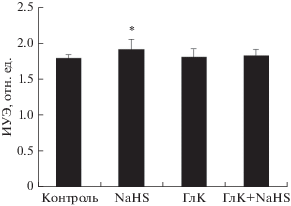
}}}}^{ + }$-каналы) [20]. Они блокируются ГлК [21]. В наших опытах ГлК на 7% повышал ИУЭ (р < 0.05), но не вызывал значимого изменения показателя агрегации клеток (табл. 3). Добавление NaHS после предварительной инкубации эритроцитов с ГлК не изменяло деформируемость
клеток, однако этот показатель был на 8% выше значений в контроле (р < 0.05; табл. 3). ГлК не оказывал заметного влияния на агрегацию эритроцитов и не устранял антиагрегационный
эффект NaHS.
Таблица 3.
Изменение микрореологии эритроцитов, полученных от здоровых лиц, после инкубации с
гидросульфидом натрия (NaHS) и глибенкламидом (ГлК) по отдельности и при их одновременном
добавлении (M ± m, n = 20)
| Показатель | Контроль | NaHS, 100 мкМ | ГлК, 50 мкМ | ГлК + NaHS |
|---|---|---|---|---|
| ПАЭ1 | 4.16 ± 0.24 | 2.61 ± 0.28* | 4.24 ± 0.57 | 2.92 ± 0.44* |
| ПАЭ2 | 11.56 ± 1.45 | 8.38 ± 0.78* | 9.82 ± 1.04 | 7.67 ± 0.94* |
| ИУЭ | 2.05 ± 0.04 | 2.27 ± 0.03* | 2.21 ± 0.01* | 2.23 ± 0.02* |
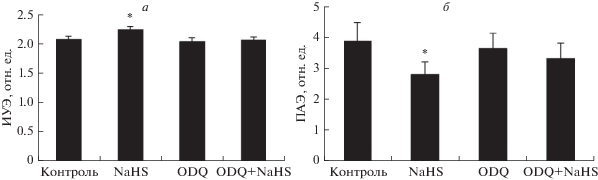
Ингибитор р-ГЦ ODQ полностью блокировал прирост деформируемости и значительно ограничивал
снижение ПАЭ под влиянием NaHS (рис. 5). Таким образом, полученные данные свидетельствуют о том, что ингибирование активности
р-ГЦ в интактных эритроцитах устраняет положительные микрореологические эффекты двух
доноров газотрансмиттеров и субстрата NO-синтазы L-аргинина.
Рис. 5.
Изменения деформируемости (а) и агрегации эритроцитов (б) под влиянием донора сульфида водорода у интактных клеток и после ингибирования растворимой
гуанилатциклазы с помощью ODQ. *Отличие от контроля статистически значимо (р < 0.05).
Изменение деформируемости восстановленных теней эритроцитов при инкубации с донором
NO – нитропруссидом натрия и донором H2S – гидросульфидом натрия. При инкубации восстановленных теней эритроцитов с НПН эластичность их мембран (на
основе расчета индекса удлинения) возросла на 6% (от 1.86 ± 0.02 до 1.98 ± ± 0.03 отн.
ед.; р < 0.05). Донор сероводорода NaHS более существенно влиял на мембраны теней эритроцитов
(рис. 6). В этом случае прирост индекса удлинения составлял 12% (от 1.86 ± 0.02 до 2.08 ±
0.04 отн. ед.; р < 0.01).
Рис. 6.
Изменение деформируемости (ИУЭ) восстановленных теней эритроцитов после их инкубации
с донорами газотрансмиттеров: нитропруссидом натрия (НПН, 100 мкМ) и гидросульфидом
натрия (NaHS, 100 мкМ).
Если восстановленные тени эритроцитов предварительно инкубировать с ГлК, а затем добавить
в среду инкубации донор H2S, то умеренный положительный эффект донора устраняется (рис. 7). Эластичность мембран теней эритроцитов под влиянием NaHS возрастала на 10% (р < 0.05), тогда как в условиях их преинкубации с ГлК NaHS практически не изменял ИУЭ
(1.76 ± 0.02 – контроль; 1.94 ± 0.03 – NaHS и 1.80 ± 0.04 отн. ед. – ГлК + NaHS).
Рис. 7.
Изменение эластичности мембран восстановленных теней эритроцитов под влиянием гидросульфида
натрия (NaHS, 100 мкМ), глибенкламида (ГлК, 50 мкМ) и их сочетания (ГлК + NaHS).
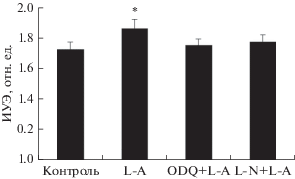
Когда тени эритроцитов инкубировали с L-аргинином, то наблюдали значимый прирост их эластичности на 8%: от 1.72 ± 0.02 до
1.86 ± ± 0.02 отн. ед. (р < 0.05; рис. 8). Это увеличение деформируемости теней эритроцитов практически полностью устранялось
при их прединкубации с ODQ или L-NAME. В процессе приготовления теней происходит вымывание внутриклеточного содержимого
эритроцитов, включая р-ГЦ и ее субстрат GTP. Это говорит о том, что действие оксида
азота на эластичность мембраны эритроцитов не обусловлено образованием cGMP, а происходит
по другому механизму, каковым может быть нитрозилирование белков мембраны. Эффект
ODQ в таком случае обусловлен не подавлением активности р-ГЦ, а его побочным действием.
Показано, что ODQ ингибирует гем-содержащие ферменты – синтазу оксида азота и цитохромы
Р-450, катализирующие образование NO из НПН [24].
Рис. 8.
Изменение эластичности мембран восстановленных теней эритроцитов под влиянием L-аргинина (L-А, 100 мкМ), его сочетанного воздействия с ODQ, в концентрации 0.5 мкМ)
и с L-NAME (L-N, в концентрации 200 мкМ).
ОБСУЖДЕНИЕ
Результаты исследования показали, что донор NO НПН существенно влияет на микрореологию
эритроцитов, повышая эластичность их мембран и уменьшая агрегацию. В качестве основной
молекулярной мишени для NO в клетках рассматривают р-ГЦ [24–27]. В наших опытах ингибирование активности р-ГЦ с помощью соединения ODQ [9] приводило к практически полному отсутствию влияния НПН на деформируемость эритроцитов.
Важно отметить, что в восстановленных тенях эритроцитов цитоплазма заменена буферным
раствором, следовательно, можно полагать, что р-ГЦ в них отсутствует. Вместе с тем
наблюдаемый значимый прирост деформируемости теней под влиянием НПН ставит вопрос
об альтернативной молекулярной мишени для NO. Известно, что этот газотрансмиттер может
активировать cGMP-независимый регуляторный механизм [28, 29]. Например, показано, что NO модифицирует ATP-чувствительные К+-каналы [30], и это сочетается с увеличением деформируемости эритроцитов [31]. Кроме того, возможно нитрозилирование и транснитрозилирование белков мембраны и
цитоскелета эритроцитов [29]. В наших опытах инкубация эритроцитов с ГлК, блокатором $К
_{{{text{А
Т
Р
}}}}^{ + }$-каналов, статистически значимо (p < 0.01) повышала деформируемость клеток. В действии ГлК и гидросульфида натрия на
микрореологию эритроцитов не было аддитивности. Опыты на восстановленных тенях эритроцитов
в условиях ингибирования NO-синтазы под действием L-NAME продемонстрировали устранение эффекта L-аргинина. При этом эффект L-аргинина на деформируемость теней эритроцитов не может быть объяснен последующей
активацией р-ГЦ. Следовательно, можно предполагать, что положительные микрореологические
эффекты NO в эритроцитах реализуются с помощью более чем одного молекулярного сигнального
пути.
Донор другого газотрансмиттера – сульфида водорода, NaHS, подобно НПН влиял на деформируемость
интактных эритроцитов и на их восстановленные тени. Анализ действия NaHS показал,
что изменение эластичности мембран эритроцитов, вероятно, связано с активацией $К
_{{{text{А
Т
Р
}}}}^{ + }$-каналов [31], поскольку их блокирование ГлК полностью устраняло эффект NaHS на модели деформационного
поведения теней эритроцитов. Интересно заметить, что сигнальный механизм действия
H2S на клетки может быть связан с сульфгидрацией, которая способствует полимеризации
актина, не влияя при этом на его деполимеризацию [25]. Следовательно, в эритроцитах этот процесс может модифицировать белки цитоскелета
и изменять эластичность мембраны и деформируемость клетки в целом [32].
В наших экспериментах ингибирование р-ГЦ с помощью ODQ практически полностью устраняло
положительное влияние донора NO на деформируемость эритроцитов. В отношении агрегации
эритроцитов этот эффект не был таким выраженным. Следовательно, можно полагать, что
эти два клеточных свойства регулируются включением разных сигнальных путей. Известно,
что активация р-ГЦ повышает уровень cGMP [33]. Далее этот второй мессенджер модулирует ионные каналы мембраны или cGMP-зависимую
протеинкиназу для регуляции физиологических функций, включая вазодилатацию, агрегацию
тромбоцитов [34, 36]. Такое разнообразие эффектов cGMP может объяснить разные ответы клеток на ингибирование
ее активности. Известно, что изменение агрегации эритроцитов связано с метаболизмом
Са2+ [35]. В свою очередь, стимулирование гуанилатциклазного сигнального пути приводит к ингибированию
входа Са2+ в клетки [29]. Сходные изменения агрегационных ответов на НПН и NaHS эритроцитов после преинкубации
соответственно с ODQ и ГлК могут быть связаны с активацией Ca2+/кальмодулин-зависимых механизмов клеточной регуляции [20, 25]. Кроме того, хотя H2S и NO модулируют независимые сигнальные пути, однако имеется ряд свидетельств о существовании
перекрестного взаимодействия между этими двумя газотрансмиттерами [25, 37–39].
Таким образом, данные, полученные в этом исследовании, свидетельствуют о заметном
положительном влиянии доноров газотрансмиттеров на микрореологические свойства эритроцитов
и их восстановленных теней, однако точные молекулярные сигнальные пути выяснены не
до конца.
Исследование поддержано грантом РФФИ №18-015-00475-а.
Список литературы
-
Северина И.С. 1998. Растворимая форма гуанилатциклазы в молекулярном механизме физиологических
эффектов. Биохимия. 63, 939–997. -
Olas B. 2015. Gasomediators (NO, CO, and H2S) and their role in hemostasis and thrombosis. Clin. Chim. Acta. 445, 115–121.
-
Balligand J.L., Cannon P.J. 1997. Nitric oxide synthases and cardiac muscle. Autocrine
and paracrine influences. Arterioscler. Thromb. Vasc. Biol. 17, 1846–1858. -
Wallace J.L., Ianaro A., Flannigan K.L., Cirino G. 2015. Gaseous mediators in resolution
of inflammation. Semin. Immunol. 27, 227–33. -
Северина И.С. 1995. Растворимая форма гуанилатциклазы в молекулярном механизме физиологических
эффектов оксида азота и в регуляции процесса агрегации тромбоцитов. Бюл. эксперим. биол. и мед. 3, 230–235. -
Truss N.J., Warner T.D. 2011. Gasotransmitters and platelets. Pharmacol. Ther. 132, 196–203.
-
Chen K., Popel A.S. 2009. Nitric oxide production pathways in erythrocytes and plasma.
Biorheology. 46, 107–119. -
Muravyov A.V., Tikhomirova I.A. 2013. Role molecular signaling pathways in changes
of red blood cell deformability. Clin. Hemorheol. Microcirc. 53, 45–59. -
Bor-Kucukatay M., Wenby R.B., Meiselman H.J., Baskurt O.K. 2003. Effects of nitric
oxide on red blood cell deformability. Am. J. Physiol. Heart Circ. Physiol. 284, 1577–1584. -
Uyuklu M., Meiselman H.J., Baskurt O.K. 2009. Role of hemoglobin oxygenation in the
modulation of red blood cell mechanical properties by nitric oxide. Nitric Oxide. 21, 20–26. -
Mozar A., Connes P., Collins B., Hardy-Dessources M.D., Romana M., Lemonne N., Bloch
W., Grau M. 2016. Red blood cell nitric oxide synthase modulates red blood cell deformability
in sickle cell anemia. Clin. Hemorheol. Microcirc. 64, 47–53. -
Gao L., Cheng C., Sparatore A., Zhang H., Wang C. 2015. Hydrogen sulfide inhibits
human platelet aggregation in vitro in part by interfering gap junction channels:
effects of ACS14, a hydrogen sulfide-releasing aspirin. Heart Lung Circ. 24, 77–85. -
Minetti G., Ciana A., Balduini C. 2004. Differential sorting of tyrosine kinases and
phosphotyrosine phosphatases acting on band 3 during vesiculation of human erythrocytes.
Biochem. J. 377, 489–497. -
Saldanha C., Silva A.S., Gonçalves S., Martins-Silva J. 2007. Modulation of erythrocyte
hemorheological properties by band 3 phosphorylation and dephosphorylation. Clin. Hemorheol. Microcirc. 36, 183–194. -
Brunati M., Bordin L., Clari G., Moret V. 1996. The Lyn-catalyzed Tyr phosphorylation
of the transmembrane band 3 protein of human erythrocytes. Eur. J. Biochem. 240, 394–399. -
Petrov V., Lijnen P. 1996. Regulation of human erythrocyte Na+/H+ exchange by soluble
and particulate guanylate cyclase. Am. J. Physiol. 271, 1556–1564. -
Sélley E., Kun S., Szijártó I.A. 2014. Exenatide induces aortic vasodilation increasing
hydrogen sulphide, carbon monoxide and nitric oxide production. Cardiovascular Diabetol. 13, 69. -
Dodge J., Mitchell C., Hanahan D. 1963. The preparation and chemical characteristics
of hemoglobin free ghosts of erythrocytes. Arch. Biochem. Biophys. 100, 119–130. -
Пятакова Н.В., Северина И.С. 2012. Растворимая гуанилатциклаза в молекулярном механизме
действия лекарственных средств. Биомед. химия. 58, 32–42. -
Monjok E.M., Kulkarni K.H., Kouamou G.M. McKoy C.A. 2008. Inhibitory action of hydrogen
sulfide on muscarinic receptor induced contraction of isolated porcine irides. Exp. Eye Res. 87, 612–616. -
Green B.D., Hand K.V., Dougan J.E., McDonnell B.M., Cassidy R.S., Grieve D.J. 2008.
GLP-1 and related peptides cause concentration-dependent relaxation of rat aorta through
a pathway involving KATP and cAMP. Arch. Biochem. Biophys. 478, 136–142. -
Lucas K.A., Pitary G.M., Park J. 2000. Guanylyl cyclase and signaling by cyclic GMP.
Pharmocol. Rev. 52, 375–413. -
Taqatqeh F., Mergia E., Neitz A., Eysel U.T., Koesling D., MittmannTh. 2009. More
than a Retrograde Messenger: Nitric Oxide Needs Two cGMP Pathways to Induce Hippocampal
Long-Term Potentiation. J. Neurosci. 29. 9344–9350. -
Feelisch M., Kotsonis P., Siebe J., Clement B., Schmidt H.H. 1999. The soluble guanylyl
cyclase inhibitor 1H-[1,2,4]oxadiazolo[4,3,-a] quinoxalin-1-one is a nonselective
heme protein inhibitor of nitric oxide synthase and other cytochrome P-450 enzymes
involved in nitric oxide donor bioactivation. Mol. Pharmacol. 56(2). 243–253 -
Гусакова С.В., Смаглий Л.В., Бирулина Ю.Г., Ковалев И.В., Носарев А.В., Петрова И.В.,
Реутов В.П. 2017. Молекулярные механизмы действия газотрансмиттеров NO, CO и H2S в гладкомышечных клетках и влияние NO-генерирующих соединений (нитратов и нитритов)
на среднюю продолжительность жизни. Усп. физ. наук. 48 (1), 24–52 -
Mustafa A.K., Gadalla M.M., Snyder S.H. 2009. Signaling by gasotransmitters. Sci. Signal. 2(68), re2.
-
Korhonen R., Lahti A., Kankaanranta H., Moilanen E. 2005. Nitric oxide production
and signaling in inflammation. Curr. Drug Targets Inflamm. Allergy. 4, 471–479. -
Капилевич Л.В., Носарев А.В., Ковалев И.В., Дьякова Е.Ю., Баскаков М.Б. 2003. Роль
циклических нуклеотидов в регуляции тонуса легочных артерий кролика. Бюл. эксперим. биол. и мед. 6, 714–717. -
Cohen R.I., Wilson D., Liu S.F. 2006. Nitric oxide modifies the sarcoplasmic reticular
calcium release channel in endotoxemia by both guanosine-3′,5′ (cyclic) phosphate-dependent
and independent pathways. Crit. Care Med. 34, 173–181. -
Irwin C., Roberts W., Naseem K.M. 2009. Nitric oxide inhibits platelet adhesion to
collagen through cGMP-dependent and independent mechanisms: the potential role for
S-nitrosylation. Platelets. 20, 478–486. -
Ishibashi Y., Duncker D.J., Zhang J., Bache R.J. 1998. ATP-sensitive K+ channels,
adenosine, and nitric oxide-mediated mechanisms account for coronary vasodilation
during exercise. Circ. Res. 82, 346–359. -
Starzyk D., Korbut R., Gryglewski R.J. 1999. Effects of nitric oxide and prostacycline
on deformability and aggregability of red blood cells of rats ex vivo and in vitro. J. Physiol. Pharmacol. 50. 629–637. -
Derbyshire E.R., Marletta M.A. 2012. Structure and regulation of soluble guanylate
cyclase. Annu. Rev. Biochem. 81, 533–539. -
Wobst J., Rumpf P.M., Dang T.A., Segura-Puimedon M., Erdmann J., Schunkert H. 2015.
Molecular variants of soluble guanylyl cyclase affecting cardiovascular risk. Circ. J. 79, 463–469. -
Muravyov A.V., Mikhailova S.G., Tikhomirova I.A. 2015. Role of Intracellular Signaling
Systems in Regulation of Erythrocyte Microrheology. Biochemistry (Moscow) Suppl. Ser. A: Membrane and Cell Biol. 9, 178–184. -
Boo Y.C., Jo H. 2003. Flow-dependent regulation of endothelial nitric oxide synthase:
role of protein kinases. Am. J. Physiol. Cell Physiol. 285, C499–508. -
Wang R. 2004. Signal Transduction and the Gasotransmitters. NO, CO and H2S in Biology and Medicine. Totowa: Humana Press, 377 p.
-
Coletta C., Papapetropoulos A., Erdelyi K., Olah G., Módis K., Panopoulos P., Asimakopoulou
A., Gerö D., Sharina I., Martin E., Szabo C. 2012. Hydrogen sulfide and nitric oxide
are mutually dependent in the regulation of angiogenesis and endothelium-dependent
vasorelaxation. Proc. Natl. Acad. Sci. USA. 109, 9161–9166. -
Giuffrè A., Vicente J.B. 2018. Hydrogen Sulfide Biochemistry and Interplay with Other
Gaseous Mediators in Mammalian Physiology. Oxid. Med. Cell Longev. 2018. 6290931. eCollection 2018.https://doi.org/10.1155/2018/6290931
Дополнительные материалы отсутствуют.