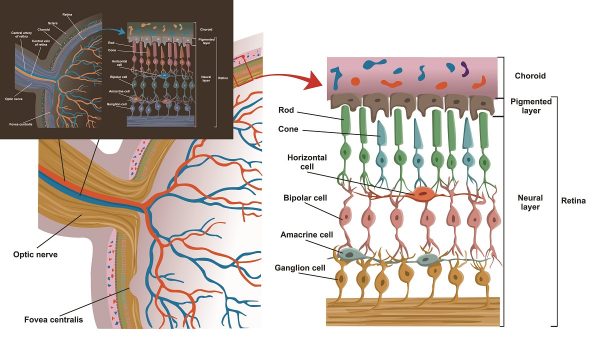
Орган зрения является самым важным из всех органов чувств человека, ведь около 80% информации о внешнем мире человек получает через зрительный анализатор.
Строение глаза человека достаточно сложно и многогранно, ведь на самом деле глаз представляет собой целую вселенную, состоящую из множества элементов, направленных на решение своих функциональных задач.
В первую очередь, стоит отметить, что глазной аппарат – система оптическая, которая отвечает за восприятие, точную обработку и передачу зрительной информации. И именно на выполнение подобной цели направлена согласованная работа всех составляющих частей глазного яблока.
Орган зрения (зрительный анализатор) состоит из 4-х частей:
- Периферической или воспринимающей части, включающей в себя:
- защитный аппарат глазного яблока (верхнее и нижнее веки, глазница);
- придаточный аппарат глаза (слезная железа, ее протоки, конъюнктива);
- глазодвигательный аппарат, состоящий из мышц.
- глазное яблоко.
- Проводящих путей – зрительного нерва, зрительного перекреста и зрительного тракта.
- Подкорковых центров.
- Высших зрительных центров, расположенных в затылочных долях коры больших полушарий.
Периферическая часть:
Защитный аппарат глаза
• Глазница является костным вместилищем для глаза. Она имеет форму усеченной четырехгранной пирамиды, обращенной вершиной в сторону черепа под углом 45%.Глубина ее – около 4-5см.,размеры 4*3.5см. Кроме глаза она содержит жировое тело, зрительный нерв, мышцы и сосуды глаза.
• Веки (верхнее и нижнее) защищают глазное яблоко от попадания различных предметов. Они смыкаются даже при движении воздуха и при малейшем прикосновении к роговице. При помощи мигательных движений век с поверхности глазного яблока убираются мелкие частицы пыли, и равномерно распределяется слезная жидкость. Свободные края век плотно прилегают друг к другу при их смыкании. По краю век растут ресницы. Они также защищают глаз от попадания в него мелких предметов и пыли. Кожа век тонкая, легко собирающаяся в складки. Под кожей век находятся мышцы: круговая мышца глаза, с помощью которой веки смыкаются, и мышца, поднимающая верхнее веко. С внутренней стороны веки покрыты конъюнктивой.
Придаточный аппарат глаза
Конъюнктива. Она представляет собой тонкую (0.1 мм), слизистую ткань, которая в виде нежной оболочки покрывает заднюю поверхность век и, образовав своды конъюнктивального мешка, переходит на переднюю поверхность глаза. Оканчивается она у лимба. При закрытых веках между листками конъюнктивы образуется щелевидная полость, напоминающая мешок. Когда веки открыты, объем его заметно уменьшается. Основная функция конъюнктивы – защитная.
Слезный аппарат глаза
Состоит из слезной железы, слезных точек, канальцев, слезного мешка и носослезного протока. Слезная железа, расположена в верхненаружной стенке глазницы. Она выделяет слезы, которые по выводным каналам попадают на поверхность глаза, стекает в нижний конъюнктивальный свод. Затем через верхнюю и нижнюю слезные точки, которые находятся во внутреннем углу глаза на ребрах век, по слезным канальцам попадают в слезный мешок (находится между внутренним углом глаза и крылом носа), откуда по носослезному каналу попадает в нос.
Слеза – прозрачная жидкость со слабощелочной средой и сложным биохимическим составом, большую часть которой составляет вода. В норме в день выделяется не более 1 мл. Она выполняет ряд важных функций: защитную, оптическую и питательную.
Мышечный аппарат глаза
Шесть глазодвигательных мышц делятся на две косых: верхнюю и нижнюю; четыре прямых: верхнюю, нижнюю, латеральную, медиальную. А также мышца, поднимающая верхнее веко и круговая мышца глаза. При помощи этих мышц глазное яблоко может вращаться во все стороны, подниматься верхнее веко, а также зажмуриваться глаз.
Глазное яблоко
Глаз располагается в глазнице и окружен мягкими тканями (жировая клетчатка, мышцы, нервы и др.). Спереди он покрыт конъюнктивой и прикрыт веками. Глазное яблоко состоит из трех оболочек: наружной, средней и внутренней, ограничивающих внутреннее пространство глаза на переднюю и заднюю камеры глаза, а также пространство, заполненное стекловидным телом — стекловидная камера.
- Наружная (фиброзная) оболочка – состоит из непрозрачной части – склеры и прозрачной части – роговицы. Место перехода роговицы в склеру называется лимб.
- Склера — непрозрачная внешняя оболочка глазного яблока, переходящая в передней части глазного яблока в прозрачную роговицу. К склере крепятся 6 глазодвигательных мышц. В ней находится небольшое количество нервных окончаний и сосудов.
- Роговица — это прозрачная часть (1/5) фиброзной оболочки. Место ее перехода в склеру называется лимбом. Форма роговицы эллипсоидная, вертикальный диаметр – 11 мм, горизонтальный – 12 мм. Толщина роговицы около 1 мм. Прозрачность роговицы объясняется уникальностью ее строения, в ней все клетки расположены в строгом оптическом порядке и в ней отсутствуют кровеносные сосуды.
Роговица состоит из 5-ти слоев:
- передний эпителий;
- боуменова оболочка;
- строма;
- десцеметова оболочка;
- задний эпителий (эндотелий).
Роговица богата нервными окончаниями, поэтому она очень чувствительна. Роговица не только пропускает, но и преломляет световые лучи, она имеет большую преломляющую силу.
Сосудистая оболочка — это средняя оболочка глаза, состоящая в основном из сосудов разных калибров.
Она подразделяется на три части:
- Радужка – передняя часть;
- Ресничное (цилиарное) тело — средняя часть;
- Хориоидея – задняя часть.
Радужка — по форме похожа на круг с отверстием внутри (зрачком). Радужка состоит из мышц, при сокращении и расслаблении которых размеры зрачка меняются. Она входит в сосудистую оболочку глаза. Радужка отвечает за цвет глаз (если он голубой — значит, в ней мало пигментных клеток, если карий — много). Выполняет ту же функцию, что диафрагма в фотоаппарате, регулируя светопоток.
- Передняя камера глаза — это пространство между роговицей и радужкой. Она заполнена внутриглазной жидкостью.
- Зрачок — отверстие в радужке. Его размеры обычно зависят от уровня освещенности. Чем больше света, тем меньше зрачок.
- Хрусталик — «естественная линза» глаза. Он прозрачен, эластичен — может менять свою форму, почти мгновенно «наводя фокус», за счет чего человек видит хорошо и вблизи, и вдали. Располагается в капсуле, удерживается ресничным пояском. Хрусталик, как и роговица, входит в оптическую систему глаза.
Ресничное (цилиарное) тело — это средняя утолщенная часть сосудистой оболочки, имеющая форму циркулярного валика, состоящая в основном из двух функционально разных частей:1 — сосудистой, состоящей в основном из сосудов, и 2- цилиарной мышцы. Сосудистая часть впереди несет на себе около 70 тонких отростков. Основной функцией отростков является выработка внутриглазной жидкости, заполняющей глаз. От отростков отходят тонкие цинновы-связки, на которых подвешивается хрусталик. Цилиарная мышца делится на 3 порции: наружную меридиональную, среднюю радиальную и внутреннюю циркулярную. Сокращаясь и расслабляясь, они участвуют в процессе аккомодации.
Хориоидея — это задняя часть сосудистой оболочки, состоящая из артерий, вен и капилляров. Основной ее функцией является питание сетчатки и транспорта крови к ресничному телу и радужке. Она придает красный цвет глазному дну за счет содержащейся в ней крови.
Стекловидное тело — задний отдел глаза занимает стекловидное тело, заключенное в камеру. Оно представляет собой прозрачную студенистую массу (типа геля), объемом 4 мл. Основу геля составляет вода (98%) и гиалуроновая кислота. В стекловидном теле происходит постоянный ток жидкости. Функция стекловидного тела: преломление световых лучей, поддержание формы и тонуса глаза, а так же питание сетчатки.
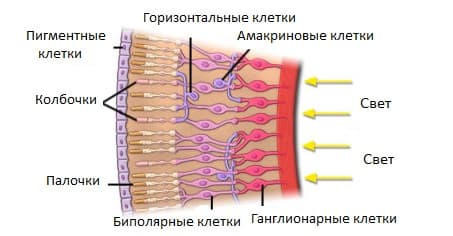
Внутренняя сетчатая оболочка (сетчатка)
Сетчатка является первым отделом зрительного анализатора. В сетчатке свет преобразуется в нервные импульсы, которые по нервным волокнам передаются в мозг. Там они анализируются, и человек воспринимает изображение. Сетчатка состоит из 10-ти следующих вглубь глазного яблока слоёв:
- пигментного;
- фотосенсорного;
- наружной пограничной мембраны;
- наружного ядерного слоя;
- наружного сетчатого слоя;
- внутреннего ядерного слоя;
- внутреннего сетчатого слоя;
- слой ганглиозных клеток;
- слоя волокон зрительного нерва;
- внутренней пограничной мембраны.
Наружный слой сетчатки – пигментный. Он поглощает свет, уменьшая его рассеивание внутри глаза. В следующем слое находятся отростки клеток сетчатки – палочек и колбочек. Отростки содержат зрительные пигменты – родопсин (палочки) и йодопсин (колбочки). Оптически активную часть сетчатки можно увидеть при обследовании глаза. Она называется глазное дно. На глазном дне можно рассмотреть сосуды, диск зрительного нерва (место выхода глазного нерва из глаза), а так же желтое пятно. Желтое пятно (макула) – это центральная часть сетчатки, где сосредоточено максимальное количество колбочек, отвечающих за цветовое зрение, и обладающая наибольшей зрительной способностью.
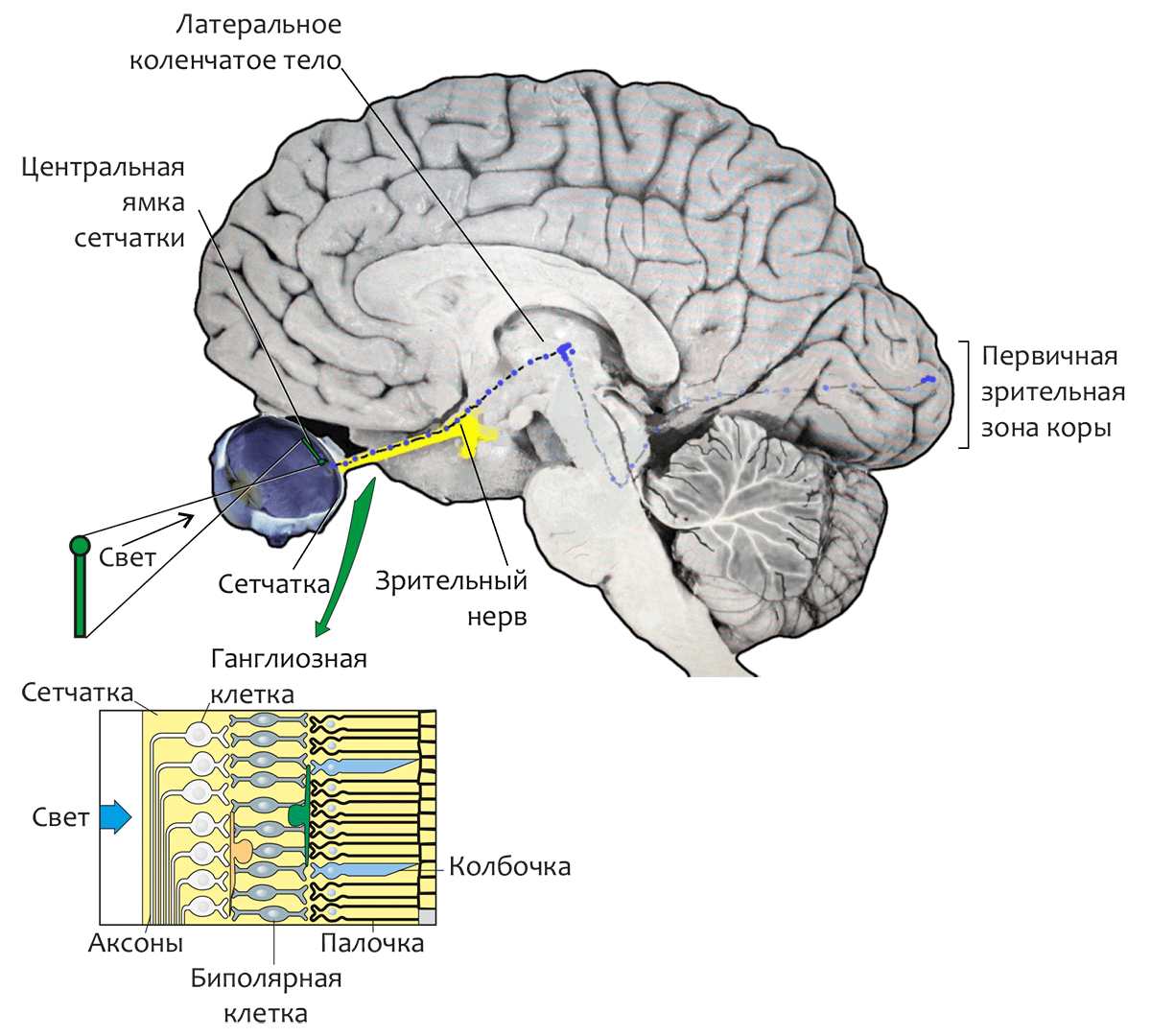
Проводящие пути
Зрительный нерв (II пара черепных нервов) устремляется в мозг. Зрительные нервы от каждого глаза у основания мозга образуют частичный перекрест (хиазма). Волокна, иннервирующие медиальную поверхность сетчатки, переходит на противоположную сторону.
Частичный перекрест обеспечивает каждое полушарие большого мозга информацией от обоих глаз.
После перекреста зрительные нервы называют зрительными трактами. Они проецируются в ряд мозговых структур (подкорковых центров).
Подкорковые центры
- Таламический подкорковый зрительный центр — латеральное коленчатое тело (ЛКТ). Отсюда сигналы поступают в первичную проекционную область зрительной (затылочной) коры (поле 17 по Бродману), для которой характерна ретинотопия (сигналы от соседних участков сетчатки попадают в соседние участки коры).
- Среднемозговой подкорковый центр зрения – верхние холмы четверохолмия. От них через верхние ручки к ЛКТ таламуса и далее в зрительную кору (координационные рефлексы с участием зрительной сенсорной системы).
Высшие зрительные центры, расположенные в затылочных долях коры больших полушарий.
Слаженная работа всех отделов глаза позволяет нам видеть вдаль и вблизи, днем и в сумерках, воспринимать многообразие цветов, ориентироваться в пространстве.
Сетчатка состоит из десяти слоев, содержащих нейроны, кровеносные сосуды и другие структуры. Уникальность строения сетчатки обеспечивает функционирование зрительного анализатора.
Сетчатка имеет две основные функции: центральное и периферическое зрение. Их осуществление обеспечивается специальными рецепторами – палочками и колбочками. Данные рецепторы трансформируют световые лучи в нервные импульсы, которые далее по зрительному тракту передаются в ЦНС. Благодаря центральному зрению человек может четко видеть объекты, расположенные перед ним на различном расстоянии, читать и выполнять работы на близком расстоянии. Благодаря периферическому зрению человек ориентируется в пространстве. Наличие колбочек трех видов, которые воспринимают различной длины световые волны, обеспечивает восприятие цветов, оттенков.
Строение сетчатки
Сетчатка имеет оптическую область, являющуюся светочувствительной. Данная область распространяется до зубчатой линии. Также имеются нефункциональные зоны: ресничная и радужковая, которые содержат лишь два слоя клеток. В ходе эмбрионального развития сетчатка формируется из той же части нервной трубки, которая дает начало центральной нервной системе. Именно поэтому ее характеризуют как вынесенную на периферию часть мозга.
Слои сетчатки:
- внутренняя пограничная мембрана;
- волокна зрительного нерва;
- ганглиозные клетки;
- внутренний плексиформный слой;
- внутренний нуклеарный;
- наружный плексиформный;
- наружный нуклеарный;
- наружная пограничная мембрана;
- слой палочек и колбочек;
- пигментный эпителий.
Основной функцией сетчатки является восприятие света. Это обеспечивается благодаря наличию рецепторов двух типов:
- палочки – около 100-120 миллионов;
- колбочки – около 7 миллионов.
Свое название рецепторы получили благодаря форме.
Существует три вида колбочек, которые содержат по одному пигменту – красный, зеленый, сине-голубой. Именно благодаря этим рецепторам человек различает цвет.
Палочки имеют в составе пигмент родопсин, поглощающий красные лучи спектра. В ночное время преимущественно функционируют палочки, днем – колбочки, в сумерках все фоторецепторы на определенном уровне активны.
Фоторецепторы в различных областях сетчатки распределены неравномерно. Центральная зона сетчатки (фовеа) – это область наибольшей плотности колбочек. Плотность расположения колбочек к периферическим отделам уменьшается. В то же время центральная область не содержит палочек, их наибольшая плотность вокруг центральной зоны, а к периферии плотность несколько уменьшается.
Зрение представляет собой очень сложный процесс, являющийся результатом сочетания возникающих в фоторецепторах реакций под воздействием световых лучей, передачи нервных импульсов в биполярные, ганглиозные нервные клетки, по волокнам зрительного нерва, а также обработки полученной информации в коре головного мозга.
Чем меньше фоторецепторов соединено с последующей за ними биполярной клеткой и далее с ганглиозной клеткой, тем выше зрительная разрешающая способность. В центральной зоне сетчатки (фовеа) одна колбочка соединяется с двумя ганглиозными клетками, в отличие от этого в периферических зонах множество рецепторных клеток соединены с небольшим количеством биполярных клеток, малым количеством ганглиозных клеток, передающих импульсы по аксонам в головной мозг. Следовательно, область макулы, где концентрация колбочек высокая, характеризуется качественным зрением, при этом палочки периферических отделов обеспечивают периферическое зрение, менее четкое.
Сетчатка содержит два типа нервных клеток:
- горизонтальные – располагаются в наружном плексиформном слое;
- амакриновые – находятся во внутреннем плексиформном слое.
Эти два типа нейронов обеспечивают взаимосвязь между всеми нервными клетками сетчатки.
В медиальной половине сетчатки (ближе к носу) приблизительно в 4 миллиметрах от центральной зоны расположен диск зрительного нерва. Эта область полностью лишена светочувствительных рецепторов, поэтому в месте ее проекции в поле зрения определяется слепая зона.
Сетчатка имеет разную толщину на различных участках. Наиболее тонкая часть сетчатки находится в центральной зоне – фовеа, которая обеспечивает наиболее четкое зрение, самая толстая часть – в зоне диска зрительного нерва.
Сетчатка прилежит к сосудистой оболочке и прочно крепится к ней только вдоль зубчатой линии, по периферии макулярной области и вокруг зрительного нерва. Все остальные области характеризуются рыхлым соединением сетчатки и сосудистой оболочки, и в этих зонах наиболее вероятна отслойка сетчатки.
Трофика сетчатки обеспечивается за счет двух источников: внутренние шесть слоев получают питание из системы центральной артерии сетчатки, наружные четыре – непосредственно из сосудистой оболочки (ее хориокапиллярного слоя). Сетчатка не имеет чувствительных нервных окончаний, поэтому патологические процессы сетчатки не сопровождаются болью.
Видео о строении сетчатки глаза

Диагностика патологии сетчатки
Для исследования функционального состояния сетчатки и ее структуры применяются следующие методы:
- визометрия (исследование остроты зрения);
- диагностика цветоощущения, цветовых порогов;
- более тонкой методикой исследования макулярной области является определение контрастной чувствительности;
- периметрия – исследование полей зрения с целью выявления выпадений;
- офтальмоскопия;
- электрофизиологические диагностические методы;
- с целью определения структурных изменений сетчатки применяется оптическая когерентная томография (ОКТ);
- диагностика сосудистых изменений проводится путем флюоресцентной ангиографии;
- для регистрации изменений глазного дна с целью их контроля в динамике используется фотографирование глазного дна.
Симптомы поражения сетчатки
При повреждении сетчатки основным симптомом является снижение остроты зрения. Локализация очага поражения в центральной зоне сетчатки характеризуется существенным снижением зрения, возможна полная его потеря. Поражение периферических отделов может протекать без ухудшения зрения, что усложняет своевременную диагностику. Длительно такие заболевания могут протекать бессимптомно, часто выявляются только при диагностике периферического зрения. Обширное поражение периферического отдела сетчатки сопровождается выпадением участка поля зрения, снижением ориентировки при плохой освещенности (гемералопия), изменением цветовосприятия. Отслойка сетчатки характеризуется появлением вспышек и молний в глазу, искажений зрения. Частой жалобой также является появление черных точек, пелены перед глазами.
Болезни сетчатки
Заболевания сетчатки могут иметь врожденный или приобретенный характер.
Врожденные заболевания:
- колобома сетчатки;
- миелиновые волокна сетчатки;
- альбинотическое глазное дно.
Приобретенные заболевания сетчатки:
- воспалительные процессы (ретиниты);
- ретиношизис;
- отслойка сетчатки;
- патология кровотока в сосудах сетчатки;
- берлиновское помутнение сетчатки (вследствие травмы);
- ретинопатия – повреждение сетчатки при общих заболеваниях (артериальной гипертензии, сахарном диабете, заболеваниях крови);
- очаговая пигментация сетчатки;
- кровоизлияния (интраретинальные, преретинальные, субретинальные);
- опухоли сетчатки;
- факоматозы.
Зрение — одно из наиболее удивительных чувств, которым природа наградила человека. С помощью зрения мы получаем огромное количество информации об окружающем мире, можем наслаждаться красотами природы и великими произведениями искусства. За восприятие электромагнитного излучения «видимого диапазона», лежащее в основе зрения, отвечает рецептор белковой природы, содержащийся в фоторецепторной мембране «дисков» клеток сетчатки глаза, — родопсин.
Введение
Родопсин — светочувствительный пигмент (хромопротеин) фоторецепторных клеток сетчатки глаза позвоночных — является в настоящее время одним из наиболее изученных мембранных белков. Сетчатка глаза (рис. 1) преобразует свет в нервные сигналы, определяя чувствительность зрения в различных диапазонах освещенности — от звездной ночи до солнечного полдня. Сетчатка образована двумя главными типами зрительных клеток — палочками (около 120 млн. клеток на сетчатку человека) и колбочками (около 7 млн. клеток). Колбочки, сконцентрированные преимущественно в центральной области сетчатки (называемой центральной ямкой), функционируют только при ярком свете и отвечают за цветовое зрение и чувствительность к мелким деталям, а более многочисленные палочки ответственны за зрение в условиях слабой освещенности и отключаются при ярком освещении. (Это является причиной того, что ночью невозможно уверенно различить цвета предметов. Ночью, как известно, «все кошки серы».)
Рисунок 1. Структурные элементы зрительной системы человека. В увеличенном фрагменте сетчатки показано относительное расположение трёх её слоёв. Задний слой сетчатки состоит из длинных и узких клеток фоторецепторов — палочек и колбочек. Средний слой содержит нейроны трёх типов: биполярные, горизонтальные (соединяющие рецепторы и биполярные клетки сравнительно длинными связями, параллельными сетчаточным слоям) и амакриновые клетки. В переднем слое находятся ганглиозные клетки, аксоны которых проходят по поверхности сетчатки, собираясь в пучок, и покидают глаз, образуя зрительный нерв.
[1], рисунок адаптирован
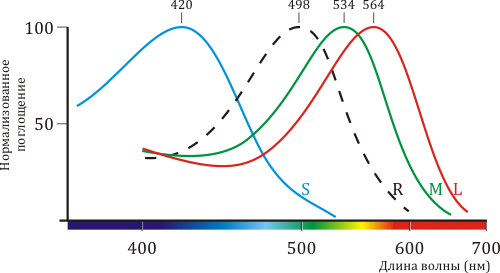
Мембраны колбочек содержат три типа рецепторов-опсинов, отвечающих за восприятие света с различными длинами волн, — синего, зеленого и красного пигментов. Аминокислотная последовательность, структура и механизм работы этих белков очень близки к таковым для родопсина, однако тонкие различия в белковом окружении светочувствительного кофактора (ретиналя) приводят к тому, что их спектральные характеристики различаются (рис. 2). В этой статье речь пойдет главным образом о зрительном родопсине, содержащемся в светочувствительных мембранах клеток-палочек.
Рисунок 2. Спектральные характеристики родопсина и трёх других типов опсинов. Цветное зрение приматов трихроматично, то есть определяется тремя типами клеток-«колбочек», содержащих каждая свой тип светочувствительного пигмента, по аминокислотной последовательности и структуре очень схожего с родопсином. На рисунке приведены нормализованные спектры поглощения «синего» (β), «зелено-голубого» (γ) и «жёлто-зеленого» (ρ) пигментов из S-, M- и L-колбочек, соответственно. Также показан спектр родопсина из клеток-«палочек» (обозначен пунктиром).
[2], рисунок адаптирован
История изучения родопсина
Открытие родопсина
Пурпурная окраска клеток-палочек была открыта Генрихом Мюллером (Heinrich Müller) в 1851 году, который приписал её гемоглобину. В 1876 году Франц Болл (Franz Boll) заметил, что сетчатка лягушки чувствительна к свету и после освещения меняет свою окраску на жёлтую с последующим обесцвечиванием. Болл также продемонстрировал, что сетчатка приобретает изначальную окраску после некоторого времени, проведенного животным в темноте. Вилли Кюхне (Willy Kühne), продолживший работы Болла, определил, что пигмент, отвечающий за окраску сетчатки — это белок наружных сегментов палочек (НСП), названный им «зрительным пурпуром» (родопсином).
Кюхне выделил родопсин из клеток пигментного эпителия сетчатки, сравнил спектроскопические свойства этого белка и препарата сетчатки, постулировал, что жёлтый и бесцветный продукты, образующиеся под действием света, химически различны и заключил, что генерация сетчаткой электрических импульсов является следствием реакции на свет. Работы Кюхне легли в основу современного понимания молекулярных механизмов зрения.
Ретиналь — светочувствительный кофактор
Джордж Уолд (George Wald) и его коллеги по Гарвардскому университету впервые открыли, что родопсин состоит из двух компонентов — бесцветного белка, называемого опсином или жёлтым пигментом и 11-цис-ретиналя, ковалентно связанного хромофора каротиноидной природы, акцептирующего свет.
В 1933 году Уолд выделил из препарата сетчатки вещество, первоначально идентифицированное как витамин А, что объяснило феномен «куриной слепоты» у пациентов с авитаминозом по этому каротиноиду (к тому времени еще мало было известно о биохимической роли витаминов). Позже оказалось, что кофактором является ретиналь — соответствующий витамину А (ацетату ретинола) альдегид. Уолд и коллеги продемонстрировали, что ретиналь, добавленный в темноте к обесцвеченному родопсину, способен восстанавливать «свежий» пигмент, причём этим действием обладает только 11-цис-изомер. В 1967 году Уолд получил Нобелевскую премию по физиологии и медицине «за исследования в области физиологии и биохимии зрения», а также за открытие биохимической роли витамина А.
На пути к пространственной структуре родопсина
Полная аминокислотная последовательность родопсина была определена в 1982 году в Институте биоорганической химии АН СССР Ю. А. Овчинниковым и сотр. [3] и несколько позже подтверждена анализом структурного гена родопсина Д. Хоггнесом и Дж. Натансом в США. Было показано, что в последовательности родопсина длиной 348 аминокислотных остатков присутствует семь протяжённых участков, состоящих из неполярных аминокислотных остатков, образующих трансмембранные (ТМ) α-спирали, соединенные вне- и внутриклеточными участками-«петлями». При этом N-конец находится во внеклеточной области, а C-конец — в цитоплазматической. Такая топология рецептора была подтверждена ограниченным протеолизом белка в составе нативной мембраны, обработкой моноклональными антителами и химической модификацией проникающими и непроникающими агентами. Также было установлено место прикрепления кофактора: ретиналь связывается альдиминной связью с остатком ЛИЗ-296, находящимся в седьмой (последней) ТМ α-спирали.
Пространственная структура родопсина долго не поддавалась изучению «прямыми» методами (такими как рентгеноструктурный анализ (РСА) и спектроскопия ядерного магнитного резонанса (ЯМР)). В то время как атомная структура другого мембранного белка со схожей семиспиральной топологией — бактериородопсина — была определена Гендерсоном и сотр. еще в 1990-м году [4], структура зрительного родопсина высокого разрешения оставалась неизвестной до 2000 года. Подробнее об этой структуре написано в главе «Структура родопсина».
Родопсин принадлежит к обширному семейству G-белоксопряжённых рецепторов (GPCR-рецепторов), названному так за механизм трансмембранной передачи сигнала, основанный на взаимодействии с внутриклеточными примембранными G-белками. Появление его пространственной структуры, полученной с высоким экспериментальным разрешением, является очень важным событием для биологии и медицины, поскольку родопсин как «родоначальник» семейства А GPCR-рецепторов является своего рода «моделью» структуры и функций множества других рецепторов, чрезвычайно интересных с фундаментальной и практической (фармакологической) точек зрения.
Молекулярная основа зрения
Строение фоторецепторных клеток
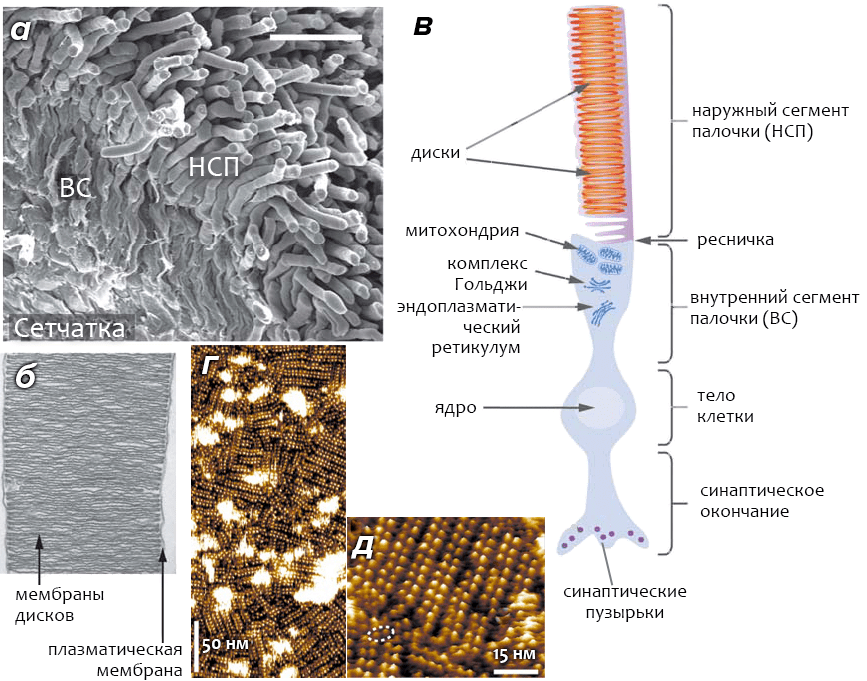
Клетки-«палочки» сетчатки (также известные как фоторецепторные клетки) — это высокоспециализированные нейроны, способные реагировать на свет. Особая часть клетки, называемая наружным сегменом палочки (НСП, см. рис. 3а), содержит 1000–2000 мембранных органелл, называемых дисками. Диски уложены в «стопки» (подобно блинам) и располагаются внутри общей с остальными частями клетки плазматической мембраны (рис. 3б). Диски как бы «отпочковываются» от плазматической мембраны, при этом их внутренняя область гомологична внеклеточному пространству (рис. 3в). Наружные сегменты колбочек имеют принципиальное отличие от НСП, заключающееся в том, что диски колбочек представляют собой складки плазматической мембраны (а не самостоятельные органеллы), и их внутреннее пространство сообщается с внеклеточной средой.
Рисунок 3. Строение сетчатки и зрительной клетки-фоторецептора — «палочки». а — Сканирующая электронная микрофотография сетчатки мыши. Палочки составляют ~70% из всех (6,4×106) клеток сетчатки, на долю колбочек приходится ~2%. Наружные сегменты палочек (НСП) содержат «диски», мембрана которых обогащена родопсином, а внутренние сегменты (ВС) отвечают за обеспечение клетки энергией и питательными веществами. б — Электронная микрофотография НСП, выделенного из сетчатки мыши. Молярное соотношение между родопсином и фосфолипидами мембраны «дисков» — ~1:60; доля других белков в мембране невелика, и их роль в процессе зрения пока остаётся невыясненной. в — Схематичное изображение клетки-палочки. Под действием света проницаемость мембраны НСП для ионов падает, что приводит к гиперполяризации и возникновению нервного импульса. г, д — Квазитопографическое изображение поверхности родопсин-содержащей мембраны диска, полученное с помощью атомно-силовой микроскопии в разном масштабе. Пунктирным овалом обведен димер родопсина, «выбившийся» из рядов, образуемых другими димерами. Считается, что активной формой рецептора, способной к реакции на свет, является именно димер.
а и б — [5], в — [6]
Основной белковый компонент (>90%) фоторецепторных мембран — родопсин, занимающий ~50% площади поверхности мембраны дисков (родопсин также присутствует в небольших количествах в плазматической мембране клетки). Мембрана дисков состоит из фосфолипидов (40% фосфатидилхолина, 38% фосфатидилэтаноламина, 13% фосфатидилсерина) и холестерина. Высокая доля ненасыщенных жирных кислот (~80%) делает фоторецепторную мембрану чрезвычайно жидкой, что имеет важное значения для функционирования родопсина.
В фоторецепторной мембране молекулы родопсина образуют димеры (см. главу «Взаимодействие родопсина с G–белком трансдуцином»), располагающиеся рядами (рис. 3г–д). Среднее число молекул родопсина на один диск — ~8×104, что в расчете на целую сетчатку даёт около 1014–1015 молекул фоторецептора.
Биохимический каскад зрения
В плазматической мембране НСП позвоночных, не сообщающейся с мембранами дисков, расположены специальные каналы, специфичные для катионов Na+ и Ca2+ и зависящие от циклического гуанозинмонофосфата (цГМФ). В темноте часть этих каналов открыта и названные катионы могут свободно диффундировать из внеклеточного пространства в цитозоль. Этот «темновой ток» ионов, открытый в 1970 году Вильямом Хейгинсом, вызывает деполяризацию плазматической мембраны НСП — «темновая» трансмембранная разность потенциалов НСП составляет ~50 мВ вместо обычных для нервной клетки 70 мВ. Как и «обычные» нейроны, палочки вырабатывают медиатор в ответ на деполяризацию, и таким образом получается, что в темноте фоторецепторы постоянно возбуждены и вырабатывают нервный импульс.
В результате поглощения кванта света молекулой родопсина инициируется цепь биохимических событий, следствием которой является закрытие катионных (Na+/Ca2+) каналов, уменьшение темнового тока и гиперполяризация плазматической мембраны (увеличение положительного заряда на внешней поверхности клетки). Свет, повышая разность потенциалов на мембране рецепторной клетки (гиперполяризуя её), уменьшает выделение медиатора, фактически «выключая» рецепторы. При этом эффективность биохимического каскада настолько высока (коэффициент усиления 105–106), что один-единственный (!) фотон может привести к гиперполяризации и быть зарегистрирован в зрительной коре мозга.
Поглощение родопсином кванта света приводит к ряду его фотохимических превращений, первым этапом которых является фотоизомеризация 11-цис-ретиналя в полностью транс-форму (подробнее об этом и других фотопревращениях родопсина см. в главе «Фотоцикл родопсина»). Изомеризация ретиналя, протекающая за очень короткое время в 200 фс, — единственный светозависимый процесс в зрительном цикле; остальные процессы сопряжены с конформационными перестройками в молекуле родопсина и являются следствием этого первичного акта поглощения света. Наибольшую важность для биохимических реакций, приводящих к возникновению фоторецепторного ответа, представляет один из интермедиатов фотолиза — метародопсин II (максимум на спектре поглощения λmax=380 нм), который содержит полностью транс-ретиналь и характеризуется значительными конформационными перестройками по сравнению с «темновой» формой родопсина.
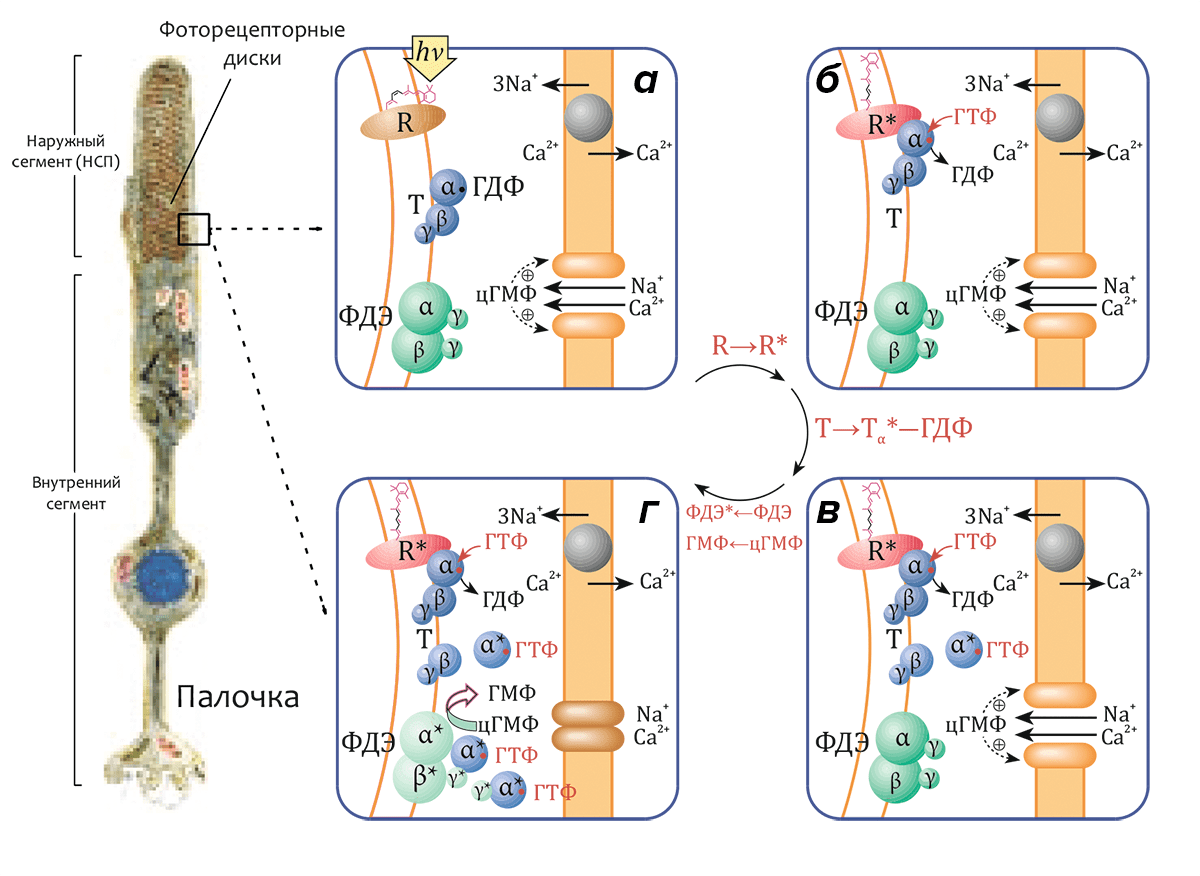
Метародопсин II (R*, «световая» или «активированная» форма родопсина R) способен связывать особый G-белок, называемый трансдуцином, передающий возбуждение, сконцентрированное на молекуле трансмембранного рецептора, в жидкую фазу цитоплазмы. Трансдуцин (Т) относится к семейству гетеротримерных G-белков и состоит из трех субъединиц (Тα, Тβ и Тγ с массами 40, 37 и 8 кДа соответственно), в первой из которых (Тα) находится сайт связывания гуанидиновых нуклеотидов ГДФ и ГТФ. В темноте (рис. 4а) Тα-субъединица содержит связанную молекулу ГДФ и образует комплекс с субъединицами Тβ и Тγ (функционирующими как димер Тβγ). Комплекс (Тα–ГДФ)–Тβγ имеет высокое сродство к метародопсину II (R*), и после реакции с ним молекула связанного ГДФ обменивается на ГТФ (рис. 4б). Комплекс R*–(Тα–ГТФ)–Тβγ быстро диссоциирует на R*, активный компонент Тα–ГТФ и димер Тβγ. Освобождённая молекула R* способна катализировать распад еще сотен или даже тысяч трансдуциновых комплексов (рис. 4в), что является первым этапом усиления сигнала в процессе передачи зрительного сигнала (см. также видео).
Активный комплекс Тα–ГТФ, в свою очередь, активирует следующий белок зрительного каскада — гетеротетрамерную фосфодиэстеразу (ФДЭ) циклического ГМФ (цГМФ). Активация этого белка, локализованного на поверхности мембран дисков, приводит к расщеплению эффекторной молекулы — до трех тысяч молекул цГМФ на одну молекулу активного фермента (рис. 4г) — и инактивации цГМФ-зависимых катионных каналов, приводящей к гиперполяризации плазматической мембраны.
Рисунок 4. Схема активации зрительного каскада. а — В «темновом» состоянии родопсин неактивен (R). α-субъединица трансдуцина (Т) находится в комплексе с ГДФ (Тα–ГДФ) и связана с димером β- и γ-субъединиц (Тβγ). цГМФ-диэстераза (ФДЭ) — гетеротетрамер, состоящий из двух гомологичных каталитических α- и β-субъединиц (ФДЭαβ) и двух идентичных γ-субъединиц, являющихся внутримолекулярными ингибиторами фермента, также неактивна. Гуанилатциклаза поддерживает высокий уровень цГМФ в цитоплазме. цГМФ-зависимые катионные каналы в плазматической мембране открыты, и катионы Na+ и Ca2+ могут диффундировать из внеклеточного пространства в цитозоль. Внутриклеточная концентрация Ca2+ поддерживается на постоянном уровне находящимся в плазматической мембране Na+/Ca2+,K+-катионообменником. б — В результате поглощения кванта света родопсин переходит в активное состояние (R→R*). Активный R* связывается с трансдуцином и индуцирует обмен связанного с Тα ГДФ на ГТФ (см. видео). в — Комплекс R*–(Тα–ГТФ)–Тβγ диссоциирует на R*, Тβγ и активный комплекс Тα*–ГТФ, после чего R* способен активировать другую молекулу трансдуцина. г — Тα*–ГТФ активирует ФДЭ (ФДЭαβ*), которая гидролизует множество молекул цГМФ. Снижение внутриклеточной концентрации цГМФ приводит к закрытию цГМФ-зависимых каналов, что влечет за собой гиперполяризацию плазматической мембраны. Слева приведено схематическое изображение палочки сетчатки.
[1], рисунок адаптирован
Электрофизиологический эффект фоторецепторной клетки на световой стимул длится в течение сотен миллисекунд, а затем прекращается благодаря специальным механизмам, «выключающим» фосфодиэстеразный каскад и восстанавливающим «темновое» состояние. «Активированная» форма родопсина (R*) трижды фосфорилирована в C-конце (см. главу «Трансмембранная топология»), и имеет сродство к цитоплазматическому белку аррестину, который блокирует взаимодействие с трансдуцином и участвует в десенсибилизации и деградации рецептора. Подробнее об этом механизме см. в статье В.М. Липкина в «Соросовском образовательном журнале» [1].
Фотоцикл родопсина
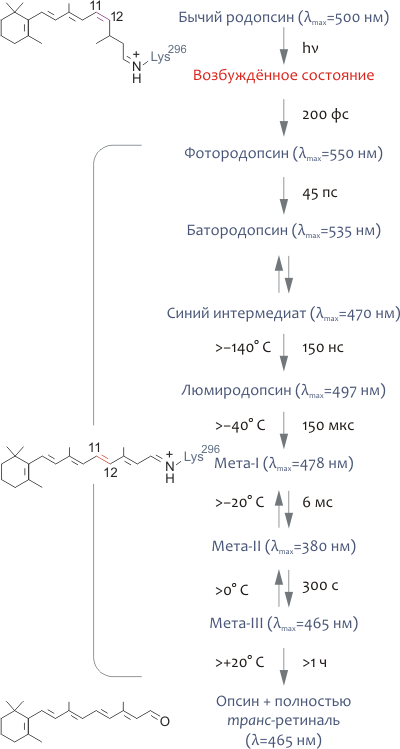
При поглощении фотона молекула родопсина меняет цвет, что связано с фотоизомеризацией 11-цис-ретиналя в полностью транс-форму и смещением максимума спектра поглощения рецептора с 498 нм до 380 нм (рис. 5). В конце концов, Шиффово основание гидролизуется и полностью транс-ретиналь выделяется в цитоплазматическую среду. Изменение спектральных характеристик родопсина, следующее за поглощением кванта света, объясняется конформационными перестройками, вызванными изомеризацией ретиналя. В большом количестве спектроскопических экспериментов с охлаждением родопсина до очень низких температур был выделен ряд промежуточных его состояний (рис. 5), что позволило охарактеризовать последовательность фотопревращений родопсина следующим образом:
- Ещё до начала каких-либо структурных перестроек родопсина энергия света аккумулируется молекулой хромофора в сильно искажённой полностью транс-форме, расположенной в том же белковом сайте связывания, где находится 11-цис-ретиналь в темноте. «Напряжённая» конформация изомеризованного хромофора трансформирует свою энергию в дальнейшие конформационные изменения родопсина.
- Фотоизомеризация хромофора чрезвычайно быстра и занимает всего 200 фс.
- Состояние мета-I (рис. 5) является переходным и довольно быстро превращается в мета II, являющееся «главным действующим лицом» биохимического каскада зрения.
- Фотоинтермедиат мета-II — физиологически и биохимически наиболее важное промежуточное состояние родопсина, поскольку именно оно ответственно за взаимодействие с примембранными белками, среди которых можно назвать и трансдуцин.
- Опсин спонтанно рекомбинирует с 11-цис-ретиналем, возвращаясь в «темновую» форму родопсина. В отличие от опсина, родопсину не свойственна «базальная» активность (т.е., в «темновой» форме он не имеет сродства к G-белку (трансдуцину)). Это обстоятельство определяет очень низкий активационный порог для клеток-«палочек» (или, что то же, высокую чувствительность).
Рисунок 5. Фотоцикл родопсина. Поглощение кванта света с длиной волны, близкой к 500 нм, приводит к чрезвычайно быстрой (200 фс) изомеризации ковалентно связанного хромофора 11-цис-ретиналя в полностью транс-форму. Как следствие, родопсин претерпевает ряд быстрых конформационных перестроек, различимых спектроскопически, и в результате превращается в сравнительно долгоживущий метародопсин-II, или мета-II, существующий в равновесии с мета-I формой. В итоге фотопревращений родопсина, полностью транс-ретиналь выделяется в цитоплазму, восстанавливается до полностью транс-ретинола (при участии ряда ретинол дегидрогеназ) и конвертируется обратно в 11-цис-ретиналь в клетках пигментного эпителия под действием специальных ферментов (так называемый ретиноидный цикл). «Восстановленный» хромофор может спонтанно рекомбинировать с опсином, превращаясь в «темновую» форму родопсина. На рисунке справа от стрелок указаны характерные времена того или иного превращения, а слева — максимальные температуры, при которых фотоинтермедиат удавалось наблюдать in vitro. В скобках указаны максимумы соответствующих спектров поглощения.
[8], рисунок модифицирован
В бόльших подробностях с фотопревращениями родопсина можно ознакомиться в [7].
Структура родопсина
Трансмембранная топология
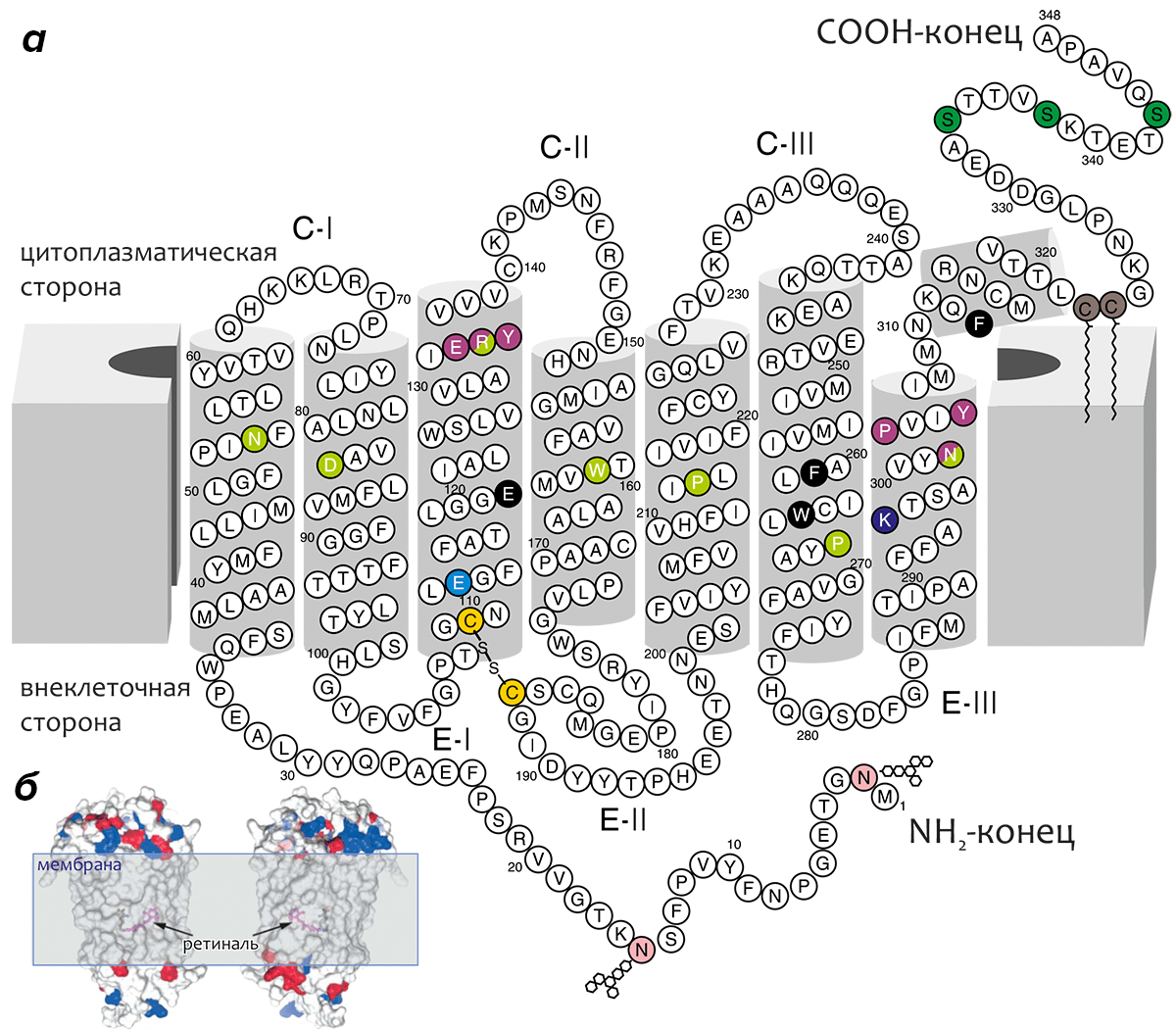
Родопсин — интегральный мембранный белок цилиндрической формы (размеры ~75×35×45 Å), трансмембранная (ТМ) часть которого образована «пучком» α-спиралей, уложенных по циклическому принципу в направлении против часовой стрелки (при виде с внеклеточной стороны) и примерно ортогональных плоскости мембраны, причем спираль ТМ3 расположена практически в центре «пучка» (рис. 6). Геометрия многих спиралей отклоняется от «идеальной» (т.е., содержит «изломы»); сильнее всего искажена спираль ТМ6 за счет влияния остатка ПРО-267 (одного из наиболее консервативных во всем семействе GPCR-рецепторов, «родоначальником» подсемейства А которых является родопсин).
Рисунок 6. Трансмембранная топология родопсина. а — «Двумерная» модель родопсина, объясняющая способ его упаковки в мембране. C-I–CIII и E-I–EIII — цитоплазматические и внеклеточные петлевые участки, соответственно. Трансмембранный домен образован α-спиралями (серые цилиндры), геометрия многих из которых отклоняется от «идеальной». Стабильность ТМ-пучка усиливается консервативной во многих GPCR-рецепторах дисульфидной связью между остатками цистеина в ТМ3 и E-II (показаны золотым). Хромофор — 11-цис-ретиналь — не изображён на рисунке; он присоединяется к остатку ЛИЗ-296 в ТМ7 (показан фиолетовым) через протонированное Шиффово основание. Положительный заряд этой альдиминной связи нейтрализуется остатком глутаминовой кислоты ГЛЮ-113 (показан голубым). Остатки аспарагина АСН-2 и АСН-15 (показаны розовым) гликозилированы ГЛЮ-N-Ац-(β1,4)-ГЛЮ-N-Ац-(β1,4)-МАН (ГЛЮ — глюкоза, МАН — манноза); МЕТ-1 ацетилирован. Два остатка цистеина в примембранной спирали 8 (показаны коричневым) пальмитоилированы. Три остатка серина в C-конце рецептора, фосфорилирующиеся в процессе фотоактивации родопсина, показаны темно-зеленым. Эти остатки в фосфорилированной форме отвечают за взаимодействие с белком аррестином, отвечающим за инактивацию и десенсибилизацию родопсина. Два консервативных мотива, важных для активации рецептора и взаимодействия с трансдуцином, (D/E)RY в ТМ3 и NPxxY в ТМ7, показаны малиновым. Наиболее консервативные во всем семействе GPCR-рецепторов остатки для каждой ТМ-спирали показаны салатовым. Некоторые другие функционально важные остатки выведены на черном фоне. Схема ТМ топологии родопсина предложена Харгрэйвом [9] и Овчинниковым [3], [10]. б — Расположение родопсина в мембране (изображён в виде молекулярной поверхности, окрашенной в соответствии с зарядом остатка: отрицательный — красный, положительный — синий). (Положение вне- и внутриклеточного пространства то же, что и в а, масштаб другой.) Положение хромофора показано с помощью удаления некоторых спиралей из структуры. Молекула родопсина показана с двух противоположных сторон.
Длина аминокислотной последовательности родопсина — 348 остатков, масса белка — около 38 кДа, а длина ТМ спиралей варьирует от 20 до 33 остатков. ТМ домен белка составляет ~65% его общей массы, а размеры вне- и внутриклеточных областей примерно равны. Хромофор (ретиналь) связывается в ТМ области белка, ковалентно присоединяясь к остатку ЛИЗ-296.
Внеклеточный домен родопсина образован N-концевым участком, а также «петлями» E-I–E-III, и содержит два сайта гликозилирования по остаткам аспарагина. N-конец и внеклеточная петля II (E-II) содержат пары β-структурных «шпилек» β1–β2 и β3–β4, причём последние связаны консервативной дисульфидной связью со спиралью ТМ3, как бы «накрывая» сайт связывания ретиналя «крышкой». Цитоплазматический домен образован петлями C-I–C-III и C-концевым участком молекулы. В состав С-конца входит примембранная амфифильная спираль 8, «заякоренная» в мембране двумя остатками пальмитоиловой кислоты, присоединёнными к остаткам цистеина в этой спирали. В C-конце также находится три остатка серина, по которым предположительно происходит фосфорилирование рецептора, связанное с его активацией (рис. 6).
Многочисленные мутагенетические эксперименты позволили выяснить роль некоторых консервативных остатков, находящихся в ТМ области родопсина. Так, консервативный мотив (D/E)R(Y/W), находящийся в цитоплазматическом конце ТМ3, регулирует конформационные перестройки, сопровождающие активацию рецептора. Остаток глутаминовой или аспарагиновой кислоты (ГЛЮ-134 в родопсине) образует солевой мостик с консервативным остатком аргинина, способствуя «удержанию» рецептора в неактивной конформации (мутация кислотной функции этого остатка приводит к получению постоянно активных форм родопсина, не зависящих от влияния света). Протонирование ГЛЮ-134, происходящее при образовании первичного фотоинтермедиата родопсина, приводит к дальнейшим конформационным перестройкам и возникновению мета-II состояния (см. главу «Фотоцикл родопсина»). Другой консервативный мотив, находящийся в цитоплазматическом конце ТМ7 — NPxxY (NPVIY в родопсине, тут “x” обозначает любой остаток) — связывают с образованием комплекса с G-белком трансдуцином.
В целом, практически любой заряженный или полярный остаток, находящийся в ТМ домене, играет свою важную для функционирования и/или создания «архитектуры» рецептора роль. Многие полярные остатки образуют «сети» водородных связей, в которых иногда участвуют молекулы воды, связанные в ТМ домене. Эти системы довольно слабых связей также важны для функционирования такой точно настроенной молекулярной структуры, как рецептор. Причём, полярные остатки ТМ домена, как правило, заглублены в белковое окружение, а «боковую» поверхность рецептора, взаимодействующую с неполярной областью бислойной мембраны, образуют незаряженные и неполярные гидрофобные остатки (рис. 6б).
Пространственная структура
Пространственная структура родопсина была впервые определена в 2000 году с помощью метода рентгеновской кристаллографии [11], и в последствии несколько раз уточнялась. До сих пор она остаётся единственной трехмерной структурой GPCR-рецептора, экспериментально полученной с высоким разрешением. Структуры других белков этого семейства до сих пор неизвестны, поскольку эти рецепторы очень сложно выделить в необходимом для метода РСА количестве и подобрать условия, в которых белок будет образовывать кристалл, дающий чёткую дифракционную картину. Методу спектроскопии ЯМР такие большие и сложно устроенные мембранные белки пока что недоступны.
В десятилетие, прошедшее с момента получения структуры бактериородопсина (белка со схожим устройством) [4] до появления структуры фоторецептора с высоким разрешением, с помощью метода криоэлектронной микроскопии была получена структура родопсина низкого разрешения [12]. На основе этой структуры с учётом вариабельности аминокислотной последовательности родопсина в различных организмах был предложен «шаблон» расположения Cα-атомов этого рецептора и других рецепторов семейства GPCR [13]. Эти модели показали отличное (по сравнению с бактериородопсином) расположение ТМ спирали 3 (ТМ3) по отношению к другим спиралям, но другие особенности строения родопсина оставались до недавнего времени неизвестными.
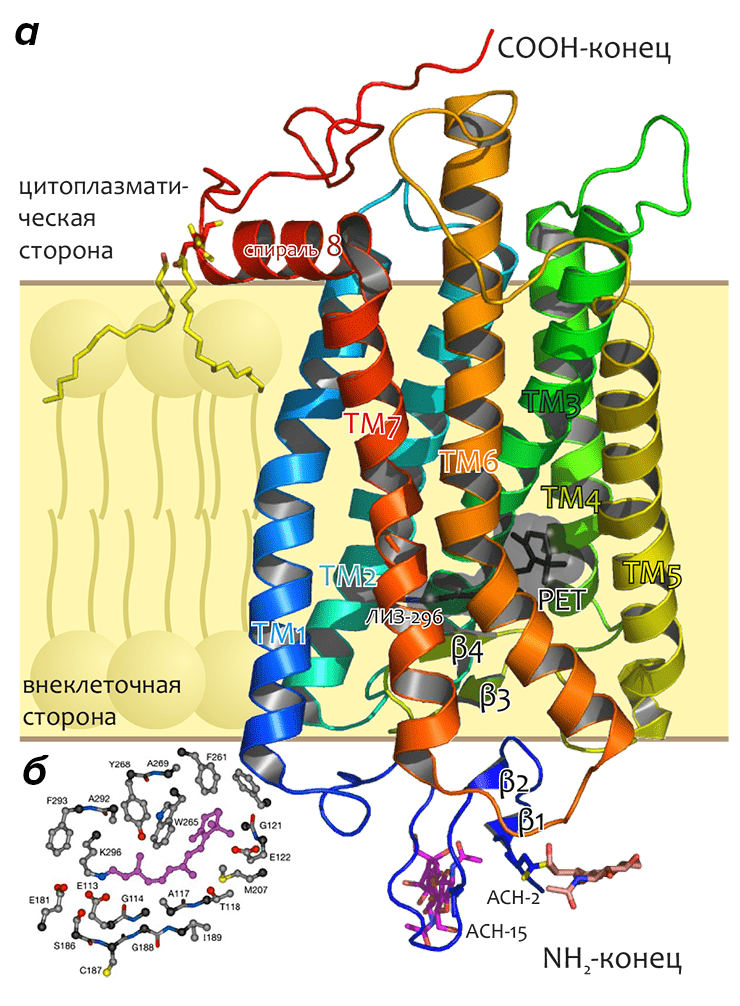
Структура родопсина (рис. 7) демонстрирует немного отличающуюся от таковой в бактериородопсине упаковку спиралей: они расположены под бóльшими углами к нормали к мембране, во многих случаях сильнее искажены. Кроме того, ТМ3 почти полностью окружена остальными спиралями, в то время как в бактериородопсине спирали расположены почти точно по эллипсу, в направлении против часовой стрелки при виде с внеклеточной стороны (в родопсине это направление укладки сохраняется).
Рисунок 7. Пространственная структура зрительного родопсина. а — Молекула изображена в виде ленты, обозначающей расположение основной цепи белка. N— и C-концы, а также ТМ спирали подписаны. Показаны боковые цепи двух остатков аспарагина, модифицированные молекулами углеводов, двух остатков цистеина, модифицированных пальмитоиловой кислотой, «заякоривающей» примембранную амфифильную спираль 8 в мембране, а также остатка лизина-296, образующего ковалентную связь с хромофором (структура ретиналя (РЕТ) показана черным цветом внутри полупрозрачной ван-дер-ваальсовой поверхности). Положение мембраны схематично показано жёлтым слоем. Рисунок построен на основе структуры 1U19 из Брукхейвенского банка данных белковых структур (доступны также другие структуры родопсина: 1F88, 1GZM, 1HZX, 1L9H). б — Схематическое изображение остатков, формирующих сайт связывания ретиналя в родопсине (показаны боковые цепи остатков, расположенных не далее, чем на 5 Å от хромофора).
Структурные исследования родопсина помогли установить роль молекул воды, находящихся в ТМ домене рецептора и определить конформации вне- и внутриклеточных петель родопсина. Основываясь на этих исследованиях, были предложены возможные механизмы активации белка и участия функционально важных групп и микродоменов в ТМ передаче сигнала и конформационных перестройках, связанных с поглощением света. Подробнее об этом можно почитать в недавнем обзоре Кристофа Пальцевского (Krzysztof Palczewski) [14], одного из наиболее активных участников упомянутых исследований.
Димеризация родопсина в мембране
С помощью атомно-силовой микроскопии нативных дисковых мембран показано (и подтверждено биохимическими методами), что родопсин образует димеры и даже олигомеры более высокого порядка, выстраивающиеся в «ряды» димеров с вкраплениями олигомеров (см. главу «Строение фоторецепторных клеток», [5], [6]). В настоящее время появляются свидетельства того, что именно димеры родопсина (и других GPCR-рецепторов) являются функционально активными формами [15], но механизм их димеризации и роль этого процесса в работе рецептора пока еще недостаточно хорошо изучены.
Взаимодействие родопсина с G–белком трансдуцином
Взаимодействие активированной формы родопсина с G-белком трансдуцином является ключевым биохимическим аспектом в зрительном процессе (см. главу «Биохимический каскад зрения»). Точный механизм этого процесса неизвестен, поскольку отсутствует структурная информация высокого разрешения об активированной форме родопсина, однако показано, что во взаимодействии с G-белком существенную роль может играть димеризация рецепторов.
Предположительно, с G-белком взаимодействует димер рецептора, одна молекула в составе которого «активирована» и взаимодействует с трансдуцином, а другая может быть неактивной (или даже быть другим GPCR-рецептором) и G-белок не активирует. По данным атомно-силовой микроскопии [6], димер образуется с участием спиралей ТМ4 и ТМ5. Конформационные перестройки, сопровождающие активацию родопсина, приводят к тому, что цитоплазматическая часть рецептора, находящаяся вблизи консервативных мотивов, участвующих в активации родопсина ([D/E]RY в ТМ3 и NPxxY в ТМ7), меняет свое строение. Солевой мостик, связывающий остатки ГЛЮ-134 и АРГ-135, разрушается (что связано с протонированием ГЛЮ-134 и депротонированием Шиффова основания ретиналя в ЛИЗ-296), и петлевые цитоплазматические участки родопсина приобретают сродство к трансдуцину. Схематически предполагаемый процесс взаимодействия родопсина с трансдуцином показан ниже в видео, основанном на биохимических данных и кристаллографических структурах родопсина и субъединиц трансдуцина.
Видео. Возможный механизм взаимодействия родопсина («темновая» форма — синий, «активированная» — жёлтый) с трансдуцином (Tα — оранжевый, Tβ — красный, Tγ — зелёный). Молекула ГТФ показана фиолетовым, ГДФ — светло-фиолетовым. Анимация основана на данных атомно-силовой микроскопии [5] и молекулярного моделирования с использованием индивидуальных кристаллографических структур родопсина и трансдуцина [15].
Перспективы исследования родопсина
Структурные исследования родопсина продолжаются, и среди вопросов, ждущих своего разрешения, можно назвать следующие:
- Какие структурные превращения сопровождают активацию родопсина и придают ему способность взаимодействовать с белками-партнерами (такими как трансдуцин, белки-киназы и аррестин)?
- Каковы пространственные структуры комплексов активированного состояния родопсина и трансдуцина, а также мономера или димера фосфорилированного активированного родопсина и аррестина?
- Какую роль играет димеризация GPCR-рецепторов в трансмембранной передаче импульсов и десенсибилизации рецепторов?
- Каким образом «отработанная» молекула полностью транс-ретиналя высвобождается из сайта связывания в родопсине, и как 11-цис-ретиналь встраивается обратно?
- Каков механизм клеточного «созревания» и деградации родопсина?
Дальнейшее исследование родопсина имеет не только фундаментальное значение и может быть использовано не только для лечения или предотвращения биохимических нарушений зрения. Родопсин — самый разносторонне исследованный белок из семейства GPCR-рецепторов, и закономерности, полученные для него, могут быть использованы для изучения структуры и функциональных особенностей других рецепторов этого семейства. С дисфункцией этих белков связано огромное количество заболеваний [16], и изучение их структуры и, главное, механизма взаимодействия с лигандами, может открыть новые возможности для дизайна новых лекарственных веществ [17] — эффективных и безопасных.
- Липкин В.М. (2001). Зрительная система. Механизмы передачи и усиления зрительного сигнала в сетчатке глаза. Соросовский образовательный журнал. 9, 2–8;
- Википедия: Color vision (англ.);
- Овчинников Ю.А., Абдулаев Н.Г., Фейгина М.Ю., Артамонов И.Д., Богачук А.С. (1983). Зрительный родопсин: Полная аминокислотная последовательность и топология в мембране. Биоорганическая химия. 10, 1331–1340;
- R. Henderson, J.M. Baldwin, T.A. Ceska, F. Zemlin, E. Beckmann, K.H. Downing. (1990). Model for the structure of bacteriorhodopsin based on high-resolution electron cryo-microscopy. Journal of Molecular Biology. 213, 899-929;
- Y. Liang, D. Fotiadis, T. Maeda, A. Maeda, A. Modzelewska, et. al.. (2004). Rhodopsin Signaling and Organization in Heterozygote Rhodopsin Knockout Mice. Journal of Biological Chemistry. 279, 48189-48196;
- Dimitrios Fotiadis, Yan Liang, Slawomir Filipek, David A. Saperstein, Andreas Engel, Krzysztof Palczewski. (2003). Atomic-force microscopy: Rhodopsin dimers in native disc membranes. Nature. 421, 127-128;
- Рубин А.Б. Фотопревращения бактериородопсина и родопсина // Биофизика, т.2. М.: Наука, 2004;
- Y. Shichida, H. Imai. (1998). Visual pigment: G-protein-coupled receptor for light signals. Cellular and Molecular Life Sciences (CMLS). 54, 1299-1315;
- Hargrave P.A., McDowell J.H., Curtis D.R., Wang J.K., Juszczak E., Fong S.L. et al. (1983). The structure of bovine rhodopsin. Biophys. Struct. Mech. 9, 235–244;
- Овчинников Ю.А. Зрительный родопсин // Биоорганическая химия. М.: Просвещение, 1987;
- Palczewski K., Kumasaka T., Hori T., Behnke C.A., Motoshima H., Fox B.A. et al. (2000). Crystal structure of rhodopsin: a G-protein-coupled receptor. Science. 289, 739–745;
- Schertler G.F. and Hargrave P.A. (1995). Projection structure of frog rhodopsin in two crystal forms. Proc. Natl. Acad. Sci. USA. 92, 11578–11582;
- Joyce M Baldwin, Gebhard F.X Schertler, Vinzenz M Unger. (1997). An alpha-carbon template for the transmembrane helices in the rhodopsin family of G-protein-coupled receptors. Journal of Molecular Biology. 272, 144-164;
- Krzysztof Palczewski. (2006). G Protein–Coupled Receptor Rhodopsin. Annu. Rev. Biochem.. 75, 743-767;
- Paul S.-H. Park, Slawomir Filipek, James W. Wells, Krzysztof Palczewski. (2004). Oligomerization of G Protein-Coupled Receptors: Past, Present, and Future†. Biochemistry. 43, 15643-15656;
- Torsten Schöneberg, Angela Schulz, Heike Biebermann, Thomas Hermsdorf, Holger Römpler, Katrin Sangkuhl. (2004). Mutant G-protein-coupled receptors as a cause of human diseases. Pharmacology & Therapeutics. 104, 173-206;
- Драг-дизайн: как в современном мире создаются новые лекарства.
Строение сетчатки глаза — структура и функции
Сетчатка — функциональная единица центральной нервной системы, обеспечивающая преобразование светового сигнала в нервный импульс. Строение сетчатки представляет собой многослойную ткань. Которая состоит из шести типов нейрональных клеток (два типа фоторецепторов: колбочки и палочки; горизонтальные, биполярные, амакриновые и ганглиозные клетки). А также, трех типов глиальных (мюллеровы, глиальные, астроциты и микроглиальные). Наличие внутреннего и внешнего гемато-ретинальных барьеров и внутриретинальных соединений обусловливает тонкость регуляции обменов с кровообращением и внутри самой сетчатки. Центральная зона (макула) узкоспециализированная зона обеспечения остроты зрения, имеет специфические анатомические особенности.
Общая анатомия
Сетчатка выстилает заднюю часть глаза. Это тонкая прозрачная оболочка. Толщиной менее 500 мкм. Она выявляет васкуляризацию пигментов и васкуляризацию сосудистой оболочки, лежащую в основе розово-оранжевого цвета глазного дна. Головка зрительного нерва видна макроскопически в виде розоватого диска. Вокруг которого выходят ретинальные артерии и вены, называемые зрительным сосочком.
Макула представляет собой область задней части, центр которой аваскулярен. Ее можно различить при осмотре глазного дна по оранжевой окраске из-за присутствия пигментов ксантофилла. Расположена височно по отношению к диску зрительного нерва. Ямка в центре макулы, состоящая только из колбочек, обеспечивает остроту зрения. Простирается от зубчатой мышцы спереди до зрительного нерва на заднем полюсе глазного яблока.
Плоская часть является областью, в которую вводятся инструменты для витреоретинальной хирургии. В это место выполняются интравитреальные инъекции. Поперечный диаметр взрослого эмметропического глаза составляет около 22 мм. Она покрывает примерно 15-16 мм внутреннего диаметра глаза и 72 % поверхности глазной сферы. Склера, белая оболочка, обеспечивающая жесткость глазного яблока, имеет толщину менее миллиметра.
Васкуляризация сетчатки: сосуды и сосудистой оболочки
Сетчатка васкуляризируется двумя различными сосудистыми системами, не имеющими анатомических связей в физиологических условиях: ретинальной капиллярной сетью, обеспечивающей непосредственную неоваскуляризацию слоев, и хориоидальной сетью, обеспечивающей васкуляризацию косвенно, так как в наружной части нет капилляров. Центральная артерия отходит главным образом от внутренней сонной артерии, следует внутриневрально и выходит на диск зрительного нерва, где делится на четыре конечные ветви: височную и носовую, верхнюю и нижнюю. Конечные артерии делятся на коллатеральные артерии, которые различаются на терминальные артерии, что также имеют коллатерали. И так далее дихотомически, пока не сформируется решетчатая сеть, покрывающая каждую из артерий, квадрант внутренней сетчатки. Капилляры отходят от этих коллатеральных сосудов и организованы в поверхностные, промежуточные и глубокие сплетения.
Артерии и вены
Артерии и вены располагаются в волоконно-оптическом слое. Капилляры имеют диаметр 5-6 мкм и образованы эндотелиальными с плотным соединением, расположенными на толстой базальной мембране. Их окружают перициты и микроглии. Типы глиальных различаются в поверхностных и глубоких сосудистых сплетениях: в то время как в поверхностных и промежуточных сосудистых сплетениях глио-нейроваскулярная связь опосредована астроцитами и мюллеровскими глиальными, в глубоком сплетении отсутствуют периваскулярные астроциты и только мюллеровские глиальные могут обеспечивать, в частности, через калиевые каналы. Таким образом, в случае отказа мюллеровских глиальных глубокая капиллярная сеть более чувствительна к потере регуляции в ответ на активность фоторецепторов.
Хориоидальная сосудистая система доставляет питательные вещества и кислород к наружной сетчатке и, в частности, к фоторецепторам опосредованно, так как наружная не имеет питающей капиллярной сети. Хориоидальная сосудистая сеть происходит от ветвей глазной артерии, которая сама является ветвью внутренней сонной артерии. Сосудистая оболочка представляет собой ткань толщиной от 300 до 500 мкм у человека, ограниченную мембраной Бруха спереди и спаянную со склерой сзади.
Она состоит из пигментированных (меланоцитов), тучных клеток, микроглии и сосудов. Хориоидальный кровоток является одним из важнейших в организме. Сосуды хориокапилляров, организованные в функциональные дольки, орошаемые независимыми артериолами, образованы слоем эндотелиальных с плотными соединениями, содержащими большие диафрагмальные фенестрации (от 60 до 90 нм), открытие которых зависит от роста эндотелия сосудов, таким образом регулируя прохождение белков и макромолекул. Этот белковый градиент между сетчаткой и сосудистой оболочкой необходим для прикрепления и для состояния прозрачности, необходимого для передачи фотонов. Сосудистая оболочка богато иннервирована парасимпатическими, симпатическими и тройничными чувствительными нервными волокнами, которые регулируют хориоидальный кровоток.
Микроскопическая анатомия
Классически существует десять слоев сетчатки:
- слой клеток пигментного эпителия;
- наружный и внутренний сегменты фоторецепторов;
- наружная пограничная мембрана, место соединения мюллеровских с сегментами фоторецепторов и фоторецепторов между ними системами адгезионных и плотных контактов;
- фоторецепторных ядер или наружный ядерный;
- наружный плексиформный, образованный синапсами между биполярными клетками и фоторецепторами и с горизонтальными. Последние модулируют нервное сообщение, передаваемое по прямому пути;
- внутренний ядерный, представляющий собой слой ядер горизонтальных, биполярных, амакриновых и клеток Мюллера. Наружная часть содержит тела горизонтальных клеток, центральная часть — ядра биполярных и Мюллера, а самая внутренняя часть — амакриновые;
- плексиформный (зернистый), состоящий из дендритов ганглиозных и аксонов биполярных клеток;
- ганглиозных клеток;
- нервных волокон. Состоящий из аксонов ганглиозных, окруженных глиальными отростками, образующими зрительный нерв, связанный с головным мозгом;
- внутренняя пограничная мембрана, представляющая собой мембранное расширение, состоящее из ножек мюллеровских и их базальной мембраны.
Пигментный эпителий
Монослой пигментного эпителия (ПЭС) является основным компонентом не только из-за его физических и функциональных свойств в качестве внешнего гематоретинального барьера и его оптических свойств, но особенно из-за его многочисленных метаболических активностей. Представляет собой прилегающий эпителий с плотным соединением, сильно поляризованный, содержащий множество ионных и водных каналов на его базолатеральной и апикальной поверхностях, обеспечивающий избирательный транспорт между нейросетчаткой и хориоидальной сосудистой сетью. Необходим для зрения из-за его метаболической активности в ретиноидном цикле, а также из-за фагоцитоза и рециркуляции «использованных» внешних сегментов фоторецепторов. Содержит пигменты, образованные в основном из зерен меланина и липофуксина. Эти зерна особенно реагируют на фотоны с короткими длинами волн, которые вызывают выработку активных форм кислорода, способных вызвать окислительный стресс.
Фоторецепторы
Фоторецепторы представляют собой сильно поляризованные нейроны. Внешний сегмент фоторецептора составляет светочувствительную часть. Он образован складками плазматической мембраны, образующими стопку дисков, которые обновляются и фагоцитируются ПЭС. Внутренний сегмент содержит метаболический аппарат и соединен с внешним сегментом соединительными ресничками. Область, в которой расположены митохондрии, можно визуализировать с помощью оптической когерентной томографии. Внешняя пограничная мембрана соответствует соединительным комплексам между фоторецепторами и мюллеровскими. Содержит ядра фоторецепторов. Внешний плексиформный слой соответствует синапсам, установленным между фоторецепторами и биполярными и горизонтальными клетками, которые образуют более толстый слой волокон Генле, в макулярной области (50 мкм), где располагаются Мюллера. Эти различные структуры, образующие внешнюю часть, можно исследовать с помощью оптической когерентной томографии. Они являются маркерами целостности и зрительной функции.
Ганглиозные клетки и волоконно-оптический слой
Ганглиозные представляют собой клетки размером 10–20 мкм. Эти клетки через свои дендриты образуют синапсы с биполярными и амакриновыми во внутреннем плексиформном слое. Аксоны ганглиозных сходятся в сосочке, образуя зрительный нерв. Они образуют переплетенные волокна с отростками из мюллеровых клеток. Волокна конвергируют на уровне зрительного нерва с радиальной ориентацией. За исключением макулярных волокон, которые образуют прямолинейную межпапилломакулярную сеть.
Глиальные клетки
Глия, как и нейрональная глия в центральной нервной системе, играет несколько ролей в гомеостазе нейронов: транспорт питательных веществ, гидроионная регуляция, иммуномодуляция, продукция нейротрофических факторов. В основной физиологической ситуации астроциты и микроглия располагаются во внутренних слоях.
Астроциты располагаются также вокруг сосудов, под внутренней пограничной мембраной, и очень многочисленны у выхода диска зрительного нерва. Ядра Мюллера находятся в средней части внутреннего ядерного слоя, но их цитоплазматические отростки простираются от внутренней пограничной мембраны до сегментов фоторецепторов. Не исключено, что их отростки могут противостоять микроворсинкам пигментного эпителия.
Клетки Мюллера являются основными позвоночных. Они представляют собой анатомическую связь между нейронами и отделами, с которыми они обмениваются молекулами, а именно сосудами, стекловидным телом и субретинальным пространством. Они наделены множеством различных ионных каналов, рецепторов лигандов, трансмембранных транспортных молекул и ферментов. В частности, экспрессируют глутаминсинтетазу, которая превращает интернализованные молекулы глутамата в глутамин. Они отвечают за поддержание гомеостаза внеклеточной среды (ионы, вода, нейротрансмиттеры и рН). Одной из их основных характеристик является высокая проводимость их плазматической мембраны по отношению к калию. Они участвуют в метаболизме глюкозы, обеспечивая нейроны лактатом и пируватом для их окислительного метаболизма, а также в устранении метаболических отходов.
Астроциты бывают двух типов. С одной стороны, клетки вдвое длиннее своей ширины располагаются вдоль волоконно-оптических пучков, без контакта с сосудами. С другой стороны, другая популяция звездчатых астроглиальных пересекает слой оптического волокна и устанавливает неспециализированные контакты с сосудами. В физиологических условиях микроглии располагаются исключительно вокруг сосудов.
Макула человека
Макула человека составляет менее 5% от общей поверхности сетчатки. Это небольшая специализированная область, расположенная в центре зрительной оси. Она обеспечивает фотопическое и цветовое зрение, а также остроту.
В этой области все слои смещаются, оставляя в центре макулы центральную зону. Ямку, образованную исключительно колбочками и определенными мюллеровскими глиальными, структура и функция которых отличны от других мюллеровских. На крыше ямки мог быть другой тип глиальных, вероятно, астроцитарного типа, функцию которого еще предстоит определить. В этой области находится наибольшая плотность колбочек, которая обеспечивает остроту зрения, цветовое и фотопическое зрение. Макула развивается после рождения. Она достигает своей анатомо-функциональной зрелости примерно к 10-12 годам. Только у приматов и человека имеется одно пятно. Тогда как у других животных его нет, за исключением хищных птиц, у которых их два.
Вывод
Строение сетчатки отражает ее функциональную сложность и исключительную топографическую специализацию. Многие структурные анализы с использованием специальных методов по-прежнему необходимы. С одной стороны, для определения морфологии нормальной сетчатки человека. С другой стороны, для оценки функциональных физиологических изменений. Использование методов визуализации, а также идентификация специфических маркеров различных типов клеток остаются необходимыми для более точного морфологического анализа.
Таким образом, неинвазивные методы визуализации, такие как оптическая когерентная томография в спектральной области (SD-OCT), в сочетании или без ангиографии без красителей (OCT-A) или аналогичная адаптивная оптика, можно получить изображения в поперечных срезах (или «анфас») и даже визуализировать определенные клетки. Эти методы используются в рутинной практике для диагностических целей и принятия терапевтических решений. В настоящее время разрабатываются другие методы визуализации с очень высоким разрешением. Такие как фазово-контрастная микроскопия с транссклеральным освещением, позволит еще точнее исследовать нормальную и патологическую сетчатку.