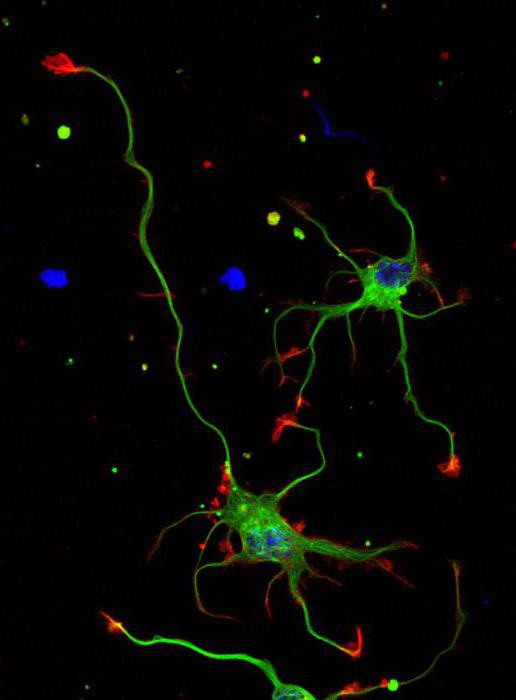
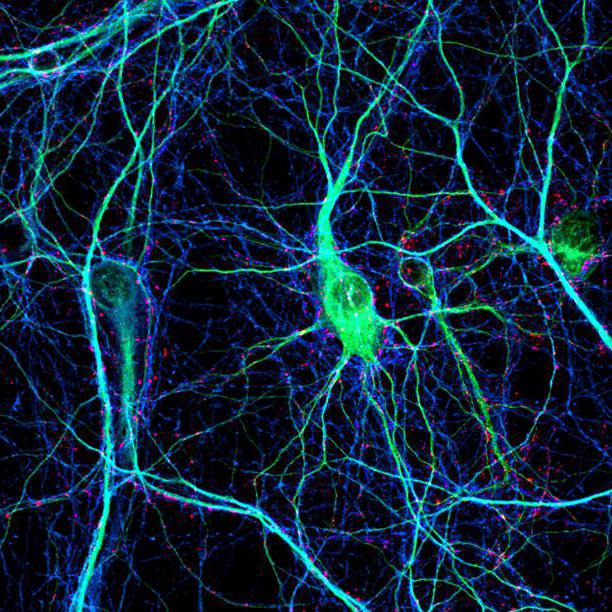
Axons are very thin nerve fibers that carry nerve impulses away from a neuron (nerve cell) to another neuron. A neuron is responsible for receiving sensory input, sending motor commands to your muscles, and transforming and relaying the electrical signals throughout these processes. Every neuron has one axon that connects it with other neurons or with muscle or gland cells.
Axons come in all lengths, with some spanning the entire length of your body from your spinal cord to your toes. Axons are generally thinner than a piece of human hair.
koto_feja / Getty Images
Structure
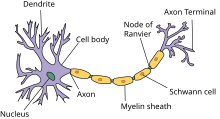
Every nerve has axons. The larger the diameter of the axon, the more quickly it can transmit messages. In the innermost part of the nerve are axons that can be typically found inside a myelin sheath.
Myelin is a fatty protective substance that acts as insulation for axons, helping to send signals over long distances. For this reason, myelin is mostly found in neurons that connect different brain regions, rather than in the neurons whose axons remain in the local region.
Function
Axons help with the cable transmission between neurons. They form side branches called axon collaterals so they can send messages to several neurons at once.
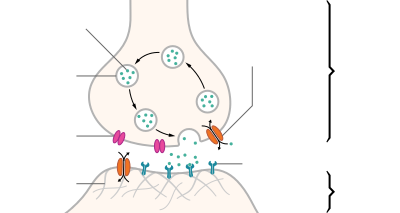
These branches split into smaller extensions known as axon terminal branches, or nerve terminals. Each terminal holds a synapse where neurotransmitters send their messages and where messages are received.
Simply put, axons allow nerve cells to send electrical and chemical messages to other nerve, gland, and muscle cells using this internal communication process.
Axon vs. Dendrite
Dendrite is another part of a neuron. It is where a neuron receives input from another cell. Axons and dendrites are both made of fibrous root-resembling materials, but they differ in several ways:
- Length: Axons are generally much longer than dendrites.
- Cell location: Axons are found at the specialized location on a cell body called the axon hillock. Dendrites are seen as branching away from the cell body into what’s called dendritic trees due to their appearance.
- Function: The two work together. Axons help messages move through your body systems, and dendrites receive and process those messages from the axons.
- Quantity: A neuron may have just one axon, while it may have more than one set of dendrites.
Types
A nerve contains bundles of nerve fibers, either axons or dendrites, surrounded by connective tissue. Different types of nerves contain different types of fibers.
Sensory Fibers
Sensory fibers pass impulses or messages from sensors to the brain and toward the central nervous system. These fibers are responsible for sensations like interpreting touch, pressure, temperature, and pain.
Motor Fibers
Motor fibers are behind why you tense your shoulders in response to a potential threat. They send messages to your muscles and glands in response to stimuli, including damage or physical traumas like accidents.
Damage
Acute axon damage is serious and life changing. Severe and diffuse axonal injuries can explain why people with head injury may be limited by a vegetative state. Axonal tears have been linked to lesions responsible for loss of consciousness in people who experience mild head injuries or concussions. Axon damage can result in axon degeneration (loss) and can eventually kill the underlying nerve.
What Causes Head Trauma?
Head trauma can occur from different types of injury, including:
- Physical impact from an event like a motor-vehicle accident or falling from a height
- Injury from an assault or sport injury hemorrhage, contusion, or hematoma
- Scattered brain bruising (contusion)
- Internal bleeding outside of the blood vessel (hematoma)
Axon loss is an early sign of neurodegenerative diseases like:
- Alzheimer’s disease and other memory disorders
- Huntington’s disease
- Parkinson’s disease
- Amyotrophic lateral sclerosis (ALS)
Demyelination
When the fatty myelin sheath begins to thin, a process known as demyelination, the axon’s ability to send signals may become impaired. Some disease states can cause this myelin breakdown.
While the sheath can technically repair itself, damage can be severe enough to kill the underlying nerve fiber. These nerve fibers in the central nervous system cannot fully regenerate.
A demyelinated axon transmits impulses up to 10 times slower than a normal myelinated axon, and a complete stop of the transmission is also possible.
Conditions that can cause demyelination include:
- Multiple sclerosis (MS): MS occurs when the immune system attacks myelin in the brain and spinal cord.
- Acute disseminated encephalomyelitis (ADEM): This is characterized by a brief but widespread attack of inflammation in the brain and spinal cord that damages myelin.
Frequently Asked Questions
What is the axon hillock?
In the nervous system, the axon hillock is a specialized location on a cell body (soma) where the neuron connects to an axon. It controls the firing of neurons.
What are axon terminals?
Axon terminals are located at the end of an axon. This is where messages from neurotransmitters are sent and received.
How does myelin “insulate” an axon?
Myelin insulates an axon by surrounding the thin fiber with a layer of fatty substance protection. This layer is located between the axon and its covering (the endoneurium).
Summary
An axon is a thin fiber that extends from a neuron, or nerve cell, and is responsible for transmitting electrical signals to help with sensory perception and movement. Each axon is surrounded by a myelin sheath, a fatty layer that insulates the axon and helps it transmit signals over long distances.
Verywell Health uses only high-quality sources, including peer-reviewed studies, to support the facts within our articles. Read our editorial process to learn more about how we fact-check and keep our content accurate, reliable, and trustworthy.
-
Du F, Cooper AJ, Thida T, Shinn AK, Cohen BM, Ongür D. Myelin and axon abnormalities in schizophrenia measured with magnetic resonance imaging techniques. Biol Psychiatry. 2013;74(6):451-457. doi:10.1016/j.biopsych.2013.03.003
-
The University of Queensland. Axons: the cable transmission of neurons.
-
National Cancer Institute. The peripheral nervous system.
-
Guedan-Duran A, Jemni-Damer N, Orueta-Zenarruzabeitia I, et al. Biomimetic approaches for separated regeneration of sensory and motor fibers in amputee people: necessary conditions for functional integration of sensory-motor prostheses with the peripheral nerves. Front Bioeng Biotechnol. 2020 Nov 3;8:584823. doi:10.3389/fbioe.2020.584823
-
Medana IM, Esiri MM. Axonal damage: a key predictor of outcome in human CNS diseases. Brain. 2003 Mar;126(Pt 3):515-530. doi:10.1093/brain/awg061
-
UCLA Health. Cerebral contusion and intracerebral hematoma.
-
Ding C, Hammarlund M. Mechanisms of injury-induced axon degeneration. Curr Opin Neurobiol. 2019 Aug;57:171-178. doi:10.1016/j.conb.2019.03.006
-
Adamczyk B, Adamczyk-Sowa M. New insights into the role of oxidative stress mechanisms in the pathophysiology and treatment of multiple sclerosis. Oxid Med Cell Longev. 2016 Oct 18;1973834. doi:10.1155/2016/1973834
-
Haines JD, Inglese M, Casaccia P. Axonal damage in multiple sclerosis. Mt Sinai J Med. 2011;78(2):231-243. doi:10.1002/msj.20246
By Michelle Pugle
Michelle Pugle, BA, MA, is an expert health writer with nearly a decade of contributing accurate and accessible health news and information to authority websites and print magazines. Her work focuses on lifestyle management, chronic illness, and mental health. Michelle is the author of Ana, Mia & Me: A Memoir From an Anorexic Teen Mind.
Thanks for your feedback!
Добавил:
Вуз:
Предмет:
Файл:
Прищепа И.Н., Ефременко И.И. Нейрофизиология
Скачиваний:
315
Добавлен:
19.10.2020
Размер:
4.23 Mб
Скачать
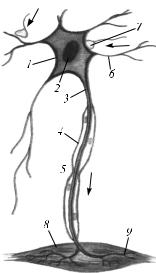
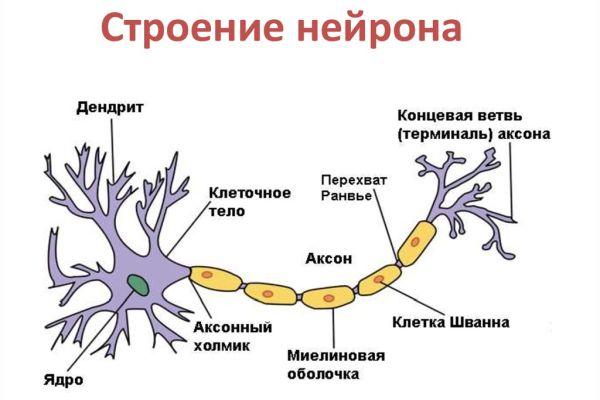
1 – тело; 2 – ядро; 3 – аксон; 4 – миелиновая оболочка; 5 – перехват Ранвье; 6 – дендрит; 7 – синапс; 8 – попереч-
принимать, обрабатывать, кодировать, передавать и хранить информацию, реагировать на раздражения, устанавливать контакты с другими нейронами и клетками органов. Уникальными особенностями нейронов являются способность генерировать электрические разряды и наличие специализированных окончаний – синапсов, служащих для передачи информации.
Нейрон состоит из клеточного тела (сомы) и отростков, обеспечивающих проведение нервных импульсов. Это дендриты, приносящие импульсы к телу нейрона, и аксоны, несущие импульсы от тела нейрона. Функционально в нейроне выделяют три части – воспринимающую, интегративную и передающую. К воспринимающей части относятся дендриты и перикарион, к интегративной – сома и аксонный холмик, а к передающей – аксонный холмик и аксон (рис. 15).
Общее число нейронов в нервной системе человека превышает 100 млрд клеток. При этом на одном нейроне может
|
быть до 10 000 синапсов. |
||||
|
К рождению нейроны утрачи- |
||||
|
вают способность к делению, по- |
||||
|
этому |
в |
течение постнатальной |
||
|
жизни их количество не увеличи- |
||||
|
вается, а, напротив, в силу есте- |
||||
|
ственной убыли клеток посте- |
||||
|
пенно снижается. |
||||
|
Гибель нейронов в физиоло- |
||||
|
гических |
условиях |
у |
взрослого |
|
|
человека сравнительно невелика |
||||
|
и осуществляется |
механизмом |
|||
|
апоптоза. |
Избыточной потере |
|||
|
нейронов препятствует их отно- |
||||
|
сительно |
высокая устойчивость |
|||
|
к развитию апоптоза. Гибель ней- |
||||
|
ронов |
значительно |
ускоряется |
||
|
в старости, приводя к потере 20– |
||||
|
40% клеток в некоторых участках |
||||
|
головного мозга. |
||||
|
Общая морфологическая ха- |
Рис. 15. Нейрон: |
|||
|
рактеристика тела |
нейрона. |
Собственно нервные клетки, или нейроциты, без отростков – это клетки различной формы и раз-
но-полосатое мышечное волокно; 9 – окончание мотонейрона
121
меров. Длина отростков нервных клеток варьирует от десятых долей миллиметра до 1,5 м.
Сома нейрона имеет клеточную мембрану и содержит ядро, рибосомы, лизосомы, вещество Ниссля, аппарат Гольджи, митохондрии, микротрубочки и другие внутриклеточные органеллы.
Плазмолемма окружает цитоплазму нейрона. Благодаря ей все нейроны имеют мембранный потенциал, кратковременное изменение которого представляет собой потенциал действия, получивший название нервного импульса. Мембрана нейрона содержит набор ионных каналов (натриевых, калиевых, хлорных, кальциевых), ионных насосов (Na+/K+-насос, Сl–-насос, Са2+-насос) и набор многочисленных белков-рецеп- торов, способных улавливать в области синапса наличие различных медиаторов (ацетилхолина, норадреналина, адреналина, дофамина, серотонина, АТФ, ГАМК, глицина, пептидов и других веществ).
Ядро расположено в центре клетки, оно крупное, сферической формы, с одним, а иногда и 2–3 крупными ядрышками. Ядро нейрона окружено двухслойной мембраной, через поры которой происходит обмен между нуклеоплазмой и цитоплазмой. Ядро содержит генетический материал, который обеспечивает дифференцировку и конечную форму клетки. Ядро регулирует синтез белков нейрона в течение всей его жизни. Ядрышко содержит большое количество РНК. Около ядрышка
внейронах у лиц женского пола часто выявляется тельце Барра – крупная глыбка хроматина, содержащая конденсированную Х-хромосому. Она особенно заметна в клетках коры полушарий большого мозга и симпатических нервных узлов.
Необходимые питательные вещества и соли доставляются
внервную клетку в виде водных растворов. Продукты метаболизма также удаляются из нейрона в виде водных растворов.
Белки нейронов служат для пластических и информационных целей. В ядре нейрона содержится ДНК, в цитоплазме преобладает РНК. Интенсивность обмена белков в ядре выше, чем в цитоплазме. Скорость обновления белков в филогенетически более новых структурах нервной системы выше, чем
вболее старых. Наибольшая скорость обмена белков – в сером веществе коры большого мозга, меньше – в мозжечке, наименьшая – в спинном мозге.
Липиды нейронов служат энергетическим и пластическим материалом, обеспечивают высокое электрическое сопротив-
122
ление миелиновой оболочки. Обмен липидов в нервной клетке происходит медленно. Возбуждение нейрона приводит к уменьшению количества липидов. Обычно после длительной умственной работы, при утомлении количество фосфолипидов в клетке уменьшается.
Углеводы являются основным источником ресинтеза АТФ, т.е. основным источником энергии нейронов. Глюкоза, поступая в нервную клетку, превращается в гликоген. При необходимости гликоген под влиянием ферментов гликогенолиза, находящихся в нейроне, вновь превращается в глюкозу. Вследствие того, что запасы гликогена при работе нейрона не обеспечивают полностью его энергетические траты, источником энергии для нервной клетки служит глюкоза крови.
Глюкоза расщепляется в нейроне преимущественно аэробным путем, чем и объясняется высокая чувствительность нервных клеток к недостатку кислорода. Увеличение в крови адреналина, а также активная деятельность организма приводят к увеличению потребления углеводов. При наркозе потребление углеводов снижается.
Неорганические вещества в нейроне представлены катионами К+, Na+, Mg2+, Ca2+, а также анионами Сl– и НСО3–. Кроме того, в нейроне имеются различные микроэлементы (например, медь и марганец), которые участвуют в регуляции активности ферментов. Количество микроэлементов в нейроне зависит от его функционального состояния. Так, при рефлекторном возбуждении содержание меди и марганца в нейроне резко снижается.
Обмен энергии в нейроне в состоянии покоя и возбуждения различен. Об этом свидетельствует значение дыхательного коэффициента нейронов. При возбуждении нейрона потребление кислорода в нем возрастает в 2 раза. После возбуждения количество нуклеиновых кислот в цитоплазме нейронов
иногда уменьшается в 5 раз.
Морфологические особенности дендритов. Отростки, по которым к телу нервной клетки поступает возбуждение от рецепторов, называются дендритами. Они дихотомически ветвятся, при этом их ветви расходятся под острыми углами, так что имеется несколько порядков ветвления. У типичного двигательного нейрона спинного мозга обычно насчитывается от 5 до 15 крупных дендритов, у отдельных нейронов их может быть до 1500. Установлено, что примерно 80–90% поверхности нейрона приходится на долю дендритов, поэтому
123
для приема импульсов потенциально доступна значительная часть поверхности клетки. Необходимость такого ветвления обусловлена тем, что нейрон как информационная структура должен иметь большое количество входов. У нейрона может быть до 1500 входов информации и один выход.
Дендриты проводят импульсы к телу нейрона, получая сигналы от других нейронов через многочисленные межнейронные контакты (аксодендритические синапсы), расположенные на них в области цитоплазматических выпячиваний – дендритных шипиков. Шипики представляют собой лабильные структуры, которые разрушаются и образуются вновь; их число резко падает при старении, а также при снижении функциональной активности нейронов. Если данный шипик (или группа шипиков) длительное время перестает получать информацию, то эти шипики исчезают.
Чем сложнее в эволюционном отношении функция нервной системы, тем больше шипиков на дендритах нейронов. Больше всего шипиков содержится на пирамидных нейронах двигательной зоны коры большого мозга – здесь на каждом нейроне их число достигает нескольких тысяч. Шипики занимают до 43% поверхности мембраны сомы и дендритов, за их счет значительно возрастает воспринимающая поверхность
нейрона.
Морфологические особенности аксонов. Аксон – это центральный, или осевой, отросток нейрона, по которому нервный импульс направляется к другой нервной клетке или к рабочему органу. Аксон всегда один. Место выхода аксона из тела нейрона называется аксонным холмиком или начальным сегментом. Именно в этом участке происходит возбуждение нейрона, т.е. генерация потенциалов действия, так как эта часть нейрона обладает наибольшей возбудимостью.
Длина аксона у человека варьирует от 1 мм до 1,5 м. Чем больше диаметр аксона, тем выше скорость распространения возбуждения по нему.
Аксоны всех афферентных и эфферентных нейронов, проходя в белом веществе спинного и головного мозга, миелинизированы с участием клеток нейроглии. Однако начальный участок аксона, лежащий в сером веществе, лишен миелина. Именно поэтому начальная часть аксона несколько тоньше, чем дистальная часть, покрытая миелином. Плазматическая мембрана миелинизированного аксона лежит непосредственно под миелиновой оболочкой, окружающей аксон.
124
Аксон, заключенный в глиальную оболочку, называется нервным волокном. Совокупность нервных волокон образует нервные пучки, которые, в свою очередь, формируют нервный ствол, или нерв. Дендрит, одетый в глиальную оболочку, также называется нервным волокном.
Все аксоны покрыты глиальной оболочкой, однако эта оболочка устроена по-разному: в одних случаях она содержит миелин, а в других – нет. В связи с этим все нервные волокна подразделяются на два вида – миелинизированные (мякотные) волокна и немиелинизированные (безмякотные) волокна. Оба вида нервных волокон состоят из центрально лежащего отростка нейрона – аксона. В составе нервного волокна он получает название осевого цилиндра. Цилиндр окружен оболочкой, которая образована совокупностью клеток олигодендроглии. В периферической нервной системе эти клетки называ-
ются шванновскими клетками.
Немиелинизированные нервные волокна у взрослого располагаются преимущественно в составе вегетативной нервной системы и характеризуются сравнительно низкой скоростью
проведения нервных импульсов (0,5–2 м/с).
Миелинизированные нервные волокна – это большая часть всех нервных волокон. Они встречаются в ЦНС и периферической нервной системе и характеризуются высокой скоростью проведения нервных импульсов (5–120 м/с). Совокупность миелинизированных волокон образует белое вещество ЦНС. Миелиновые волокна обычно толще безмиелинизированных и содержат осевые цилиндры большего диаметра.
В миелинизированном волокне осевой цилиндр также окружается глиальными клетками, но эти клетки вырабатывают миелин, который и окружает плазмолемму аксона. Таким образом, в миелинизированных волокнах осевой цилиндр непосредственно окружен особой миелиновой оболочкой, вокруг которой располагается тонкий слой нейролеммы. Нейролемма представляет собой цитоплазму и ядро шванновской клетки. Снаружи волокно также покрыто базальной мембраной.
Миелиновая оболочка на 80% состоит из липидов, обладающих высоким омическим сопротивлением, и на 20% – из белка.
По длине волокна миелиновая оболочка имеет прерывистый ход, благодаря чему формируются узловые перехваты, или перехваты Ранвье.
125
Узловые перехваты повторяются по ходу миелинизированного волокна с определенными интервалами. Длина участков между узловыми перехватами зависит от толщины нервного волокна: чем оно толще, тем длиннее расстояние между перехватами. В области узлового перехвата аксон часто расширяется, а в его плазмолемме присутствуют многочисленные натриевые каналы (которые отсутствуют вне перехватов под миелиновой оболочкой).
Классификация нейронов
Чаще всего классификация нейронов осуществляется по трем признакам – морфологическому, функциональному
и биохимическому.
Морфологическая классификация учитывает количество отростков у нейронов и подразделяет все нейроны на три
типа – униполярные, биполярные и мультиполярные.
Униполярные нейроны (одноотростчатые) имеют один отросток. Униполярные нейроны отмечаются у человека в период раннего эмбрионального развития, а в постнатальном онтогенезе они встречаются в мезэнцефалическом ядре тройничного нерва (обеспечивают проприоцептивную чувстви-
тельность жевательных мышц).
Биполярные нейроны (двухотростчатые) имеют два отростка – аксон и дендрит, обычно отходящие от противоположных полюсов клетки. В нервной системе человека биполярные нейроны встречаются в основном в периферических частях зрительной, слуховой и обонятельной систем, например биполярные клетки сетчатки глаза, спирального и вестибулярного ганглиев. Биполярные нейроны дендритом связаны
срецептором, аксоном – с нейроном следующего уровня организации соответствующей сенсорной системы.
Однако чаще в ЦНС человека и других животных встречается разновидность биполярных нейронов – псевдоуниполярные нейроны. У них оба клеточных отростка (аксон и дендрит) отходят от тела клетки в виде единого выроста, который далее Т-образно делится на дендрит и аксон: первый идет
спериферии от рецепторов, второй направляется в ЦНС. Эти клетки встречаются в сенсорных спинальных и краниальных ганглиях. Они обеспечивают восприятие болевой, темпера-
турной, тактильной, проприоцептивной, барорецептивной и вибрационной сигнализации.
126
Мультиполярные нейроны имеют один аксон и более двух дендритов. Они широко распространены в нервной системе человека и представляют разновидности веретенообразных, звездчатых, корзинчатых, грушевидных и пирамидных клеток.
С точки зрения локализации нейроны можно разделить на нейроны ЦНС, находящиеся в спинном (спинальные нейроны) и головном (бульбарные, мезенцефальные, церебеллярные, гипоталамические, таламические, корковые) мозге, а также за пределами ЦНС, входящие в состав периферической нервной системы (нейроны вегетативных ганглиев), а также нейроны, составляющие основу метасимпатического отдела
вегетативной нервной системы.
Функциональная классификация разделяет нейроны по характеру выполняемой ими функции (в соответствии с их местом в рефлекторной дуге) на три типа: афферентные (чув-
ствительные), эфферентные (двигательные) и вставочные.
Афферентные нейроны (чувствительные, рецепторные,
центростремительные) являются ложноуниполярными нервными клетками. Тела этих нейронов располагаются не в ЦНС, а в спинномозговых ганглиях или чувствительных узлах че- репно-мозговых нервов. Один из отростков, отходящий от тела нервной клетки, следует на периферию к тому или иному органу и заканчивается там сенсорным рецептором, который способен трансформировать энергию внешнего стимула (раздражения) в нервный импульс. Второй отросток направляется в ЦНС (спинной мозг) в составе задних корешков спинномозговых нервов или соответствующих чувствительных волокон черепно-мозговых нервов. Афферентные нейроны имеют небольшие размеры и хорошо разветвленный на периферии дендрит. Функции афферентных нейронов тесно связаны с функциями сенсорных рецепторов и поэтому генерируют нервные импульсы под влиянием изменений внешней или внутренней среды.
Часть нейронов, принимающих участие в обработке сенсорной информации, делят в зависимости от чувствительности к действию раздражителей на моносенсорные, бисенсорные и полисенсорные:
• моносенсорные нейроны располагаются чаще в первичных проекционных зонах коры и реагируют только на сигналы своей сенсорности. Например, значительная часть нейронов первичной зоны зрительной области коры полушарий голов-
127
ного мозга реагирует только на световое раздражение сетчатки глаза;
• бисенсорные нейроны чаще располагаются во вторичных зонах коры какого-либо анализатора и могут реагировать на сигналы как своей, так и другой сенсорности. Например, нейроны вторичной зоны зрительной области коры больших полушарий головного мозга реагируют на зрительные и слуховые раздражения;
• полисенсорные нейроны – это чаще всего нейроны ассоциативных зон мозга; они способны реагировать на раздражение слуховой, зрительной, кожной и других рецептивных
систем.
Эфферентные нейроны (двигательные, моторные, секреторные, центробежные) предназначены для передачи инфор-
мации от ЦНС на периферию, к рабочим органам. Например, эфферентные нейроны двигательной зоны коры большого мозга – пирамидные клетки – посылают импульсы к α-мо- тонейронам передних рогов спинного мозга, т.е. они являются эфферентными для этого отдела коры большого мозга. В свою очередь, α-мотонейроны спинного мозга являются эфферентными для его передних рогов и посылают сигналы к мышцам.
По строению эфферентные нейроны – это мультиполярные нейроны, тела которых находятся в сером веществе ЦНС (или на периферии в вегетативных узлах различных порядков). Аксоны этих нейронов продолжаются в виде соматических или вегетативных волокон периферических нервов к соответствующим рабочим органам, в том числе к скелетным и гладким мышцам, многочисленным железам. Основной особенностью эфферентных нейронов является наличие длинного аксона, обладающего большой скоростью проведения возбуждения.
Эфферентные нейроны связывают между собой разные отделы коры больших полушарий и обеспечивают внутриполушарные и межполушарные отношения. Все нисходящие пути спинного мозга (пирамидные и экстрапирамидные) образованы аксонами эфферентных нейронов соответствующих отделов ЦНС. Нейроны автономной нервной системы, например ядер блуждающего нерва, боковых рогов спинного мозга, так-
же относятся к эфферентным нейронам.
Вставочные нейроны (интернейроны, контактные, ассоциативные, кондукторные) осуществляют передачу нервного
импульса с афферентного на эфферентный нейрон. Суть этого
128
процесса состоит в передаче полученного афферентным нейроном сигнала эфферентному нейрону для исполнения в виде ответной реакции организма.
Вставочные нейроны располагаются в пределах серого вещества ЦНС. По своему строению это мультиполярные нейроны. На их долю приходится 97–99% от общего числа нейронов ЦНС. Область влияния вставочных нейронов определяется их строением, в том числе длиной аксона и числом коллатералей.
Одни вставочные нейроны получают активацию от нейронов других центров и затем распространяют эту информацию
|
на нейроны своего центра. Другие получают |
активацию |
|
от коллатералей эфферентных нейронов своего |
же центра |
и затем передают эту информацию назад в свой же центр, образуя обратные связи.
Вставочные нейроны по своей функции могут быть возбуждающими или тормозными. При этом возбуждающие нейроны способны не только передавать информацию с одного нейрона на другой, но и модифицировать передачу возбуждения, усиливать ее эффективность. Например, в коре большого мозга имеются «медленные» пирамидные нейроны, которые
влияют на активность «быстрых» пирамидных нейронов.
Биохимическая классификация нейронов основана на химических особенностях нейромедиаторов, используемых нейронами в синаптической передаче нервных импульсов. Выделяют много различных групп нейронов: холинергические (медиатор – ацетилхолин), адренергические (медиатор – норадреналин), серотонинергические (медиатор – серотонин), дофаминергические (медиатор – дофамин), ГАМК-ергические (медиатор – γ-аминомасляная кислота – ГАМК), пуринергические (медиатор – АТФ и его производные), пептидергические (медиаторы – субстанция Р, энкефалины, эндорфины, вазоактивный интестинальный пептид, холецистокинин, нейротензин, бомбезин и другие нейропептиды). В некоторых нейронах терминали содержат одновременно два типа нейромедиатора, а также нейромодуляторы.
Нарушение выработки некоторых медиаторов в отдельных структурах мозга связывают с патогенезом ряда нервно-пси- хических заболеваний. Так, содержание дофамина снижено при паркинсонизме и повышено при шизофрении, снижение уровня норадреналина и серотонина типично для депрессивных состояний, а их повышение – для маниакальных.
129
Физиология нейрона
Функции нейрона как целого образования – это обеспечение информационных процессов в центральной нервной системе, в том числе с помощью веществ-передатчиков (нейромедиаторов). Нейроны как специализированные клетки осуществляют прием, кодирование, обработку, хранение и передачу информации. Нейроны формируют регулирующие команды для различных внутренних органов и для скелетных мышц, а также обеспечивают реализацию всех форм психической деятельности – от элементарных до самых сложных, включая мышление и речь. Все это обеспечивается за счет способности нейрона генерировать электрические разряды и передавать информацию с помощью синапсов. Однако реализация всех функций нейрона возможна лишь при совместной работе нейронов. Поэтому решающим моментом в деятельности нейрона является его способность к генерации потенциалов действия, а также восприятия потенциалов действия и медиаторов от других нейронов и передачи необходимой информации другим нейронам. Реализация информационной функции происходит с участием всех отделов нейрона – дендритов, перикариона и аксона. При этом дендриты вместе с перикарионом специализируются на восприятии информации, аксоны – на передаче информации, а перикарион – на принятии решения. Тело нейрона помимо информационной выполняет трофическую функцию относительно своих отростков и их синапсов.
Сфункциональной точки зрения нейрон может находиться
втрех основных состояниях: покоя; активности, или возбуждения; торможения.
В состоянии покоя нейрон имеет стабильный уровень мембранного потенциала. В любой момент нейрон готов возбудиться, т.е. генерировать потенциал действия, либо перейти
всостояние торможения.
В состоянии активности, при возбуждении, нейрон генерирует потенциал действия или чаще группу потенциалов действия. Частота следования потенциалов действия внутри данной серии потенциала действия, длительность этой серии, а также интервалы между последовательными сериями – все эти показатели широко варьируют и являются составляющей кода нейронов. Важную роль в регуляции частоты импульсации имеют ионы Са2+ и К+.
130
Нервная система состоит из нейронов (специфических клеток, имеющих отростки) и нейроглии (она заполняет пространство между нервными клетками в ЦНС). Главное отличие между ними заключается в направлении передачи нервного импульса. Дендриты – это принимающие ответвления, по ним сигнал идет к телу нейрона. Передающие клетки – аксоны – проводят сигнал от сомы к принимающим. Это могут быть не только отростки нейрона, но и мышцы.
Отличия аксонов и дендритов
Какова же разница между ними? Рассмотрим.
- Дендрит нейрона короче передающего отростка.
- Аксон всего один, принимающих ответвлений может быть много.
- Дендриты сильно ветвятся, а передающие отростки начинают разделяться ближе к концу, образуя синапс.
- Дендриты истончаются по мере удаления от тела нейрона, толщина аксонов практически неизменна по всей длине.
- Аксоны покрыты миелиновой оболочкой, состоящей из липидных и белковых клеток. Она выполняет роль изолятора и защищает отросток.
Поскольку нервный сигнал передается в виде электрического импульса, клеткам необходима изоляция. Её функции выполняет миелиновая оболочка. Она имеет мельчайшие разрывы, способствующие более быстрой передаче сигнала. Дендриты – это безоболочечные отростки.
Определение
Мозговое вещество – высокоорганизованная структура, образованная нервными клетками, от которых отходят аксоны. Из нервных клеток состоит мозговая ткань. Аксон в переводе с греческого означает «ось» – это такой отросток, элемент мозгового вещества, который обеспечивает взаимодействие между клетками разного типа (нейроны, клетки иннервируемых органов), что ассоциируется с тонким, четким управлением работой органов и систем. Функции ткани ЦНС:
- Воспринимает раздражения, преобразуя их в импульсы.
- Поддерживает передачу импульсов от управляющих отделов мозга к исполнительным органам.
- Формирует ответную реакцию на раздражающее воздействие.
- Обеспечивает взаимодействие в работе систем и органов, поддерживает интеграцию структурных единиц организма.
- Обеспечивает взаимосвязь организма с внешней средой.
Согласно определению в биологии, аксон (англ. axon) – удлиненный отросток, по которому идут импульсы от тела нейрона к другим нервным клеткам и структурным элементам всех тканей организма. Мозговая ткань в период внутриутробного развития образуется из нервной пластины. Края пластинки прогибаются, что приводит к формированию валиков и желобка. В результате смыкания краев валиков возникает нервная трубка – основа ЦНС.
Дифференциация клеток, образующих трубку, приводит к появлению нейробластов и спонгиобластов. Первые служат основой для формирования нейронов, вторые – для образования нейроглии. Нейроны (анат.) – основные структурные элементы мозгового вещества. Они характеризуются отсутствием функции деления, что приводит к постепенному уменьшению их численности. Тело нейрона состоит из ядра и цитоплазмы. В зависимости от типа нейронов меняется геометрическая форма тела, которая бывает круглая, овальная, пирамидальная и другая.
Цитоскелет, состоящий из микротрубочек и нейрофибриллов, обеспечивает опорную и трофическую функцию. Цитоскелет поддерживает форму нейрона, обеспечивает транспорт веществ и органелл. От тела ответвляются отростки – единичный аксон и множественные дендриты. Аксон нейрона почти не ветвится, иногда образует коллатеральные (обходные) сегменты. Концевые сегменты (окончания) разветвляются, называются терминали.
Терминали взаимосвязаны с окончаниями других нейронов и с клетками, образующими паренхиму (ткань) рабочих органов – мышц, желез. Количество дендритов варьируется от 1 до нескольких. Тонкие ответвления дендритов оканчиваются небольшими шипами, где сосредоточены терминали аксональных отростков многих тысяч других клеток. Дендриты воспринимают раздражения или потенциалы действия от других клеток и передают их по волокнам к телу своего нейрона.
Рост аксона зависит от особенностей строения и жизнедеятельности нейрона, который поддерживает функцию питания отростка. К примеру, если перерезать аксональный ствол, сегмент, связанный с телом, остается жизнеспособным и продолжает деятельность, участок, утративший связь с телом, отмирает. Аксоны образуют нервы, что предполагает сложную структурно-морфологическую организацию ЦНС.
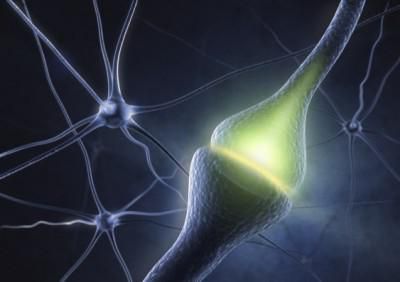
Синапс
Место, в котором происходит контакт между ответвлениями нейронов или между аксоном и принимающей клеткой (например, мышечной), называется синапсом. В нем может участвовать всего по одному ответвлению от каждой клетки, но чаще всего контакт происходит между несколькими отростками. Каждый вырост аксона может контактировать с отдельным дендритом.
Сигнал в синапсе может передаваться двумя способами:
- Электрическим. Это происходит только в случае, когда ширина синаптической щели не превышает 2 нм. Благодаря такому маленькому разрыву импульс проходит через него, не задерживаясь.
- Химическим. Аксоны и дендриты вступают в контакт благодаря разнице потенциалов в мембране передающего отростка. С одной ее стороны частицы имеют положительный заряд, с другой – отрицательный. Это обусловлено разной концентрацией ионов калия и натрия. Первые находятся внутри мембраны, вторые – снаружи.
При прохождении заряда увеличивается проницаемость мембраны, и натрий входит в аксон, а калий выходит из него, восстанавливая потенциал.
Сразу после контакта отросток становится невосприимчивым к сигналам, через 1 мс способен к передаче сильных импульсов, через 10 мс возвращается в исходное состояние.
Дендриты – это принимающая сторона, передающая импульс от аксона телу нервной клетки.
Особенности, характерные для типичных дендритов и аксонов
⇐ ПредыдущаяСтр 3 из 14Следующая ⇒
| Дендриты | Аксоны |
| От тела нейрона отходит несколько дендритов | У нейрона имеется только один аксон |
| Длина редко превышает 700 мкм | Длина может достигать 1 м |
| По мере удаления от тела клетки диаметр быстро уменьшается | Диаметр сохраняется на значительном расстоянии |
| Образовавшиеся в результате деления ветви локализуются возле тела | Терминали располагаются далеко от тела клетки |
| Имеются шипики | Шипики отсутствуют |
| Не содержат синаптических пузырьков | Содержат в большом числе синаптические пузырьки |
| Содержат рибосомы | Рибосомы могут обнаруживаться в незначительном числе |
| Лишены миелиновой оболочки | Часто окружены миелиновой оболочкой |
Терминали дендритов чувствительных нейронов образуют чувствительные окончания. Основной функцией дендритов является получение информации от других нейронов. Дендриты проводят информацию к телу клетки, а затем к аксонному холмику.
Аксон. Аксоны образуют нервные волокна, по которым передается информация от нейрона к нейрону или к эффекторному органу. Совокупность аксонов образует нервы.
Общепринято подразделение аксонов на три категории: А, В и С. Волокна группы А и В являются миелинизированными, а С – лишены миелиновой оболочки. Диаметр волокон группы А, которые составляют большинство коммуникаций центральной нервной системы, варьирует от 1 до 16 мкм, а скорость проведения импульсов равна их диаметру, умноженному на 6. Волокна типа А подразделяются на Аa, Аb, Аl, Аs. Волокна Аb, Аl, Аs имеют меньший диаметр, чем волокна Аa, меньшую скорость проведения и более длительный потенциал действия. Волокна Аb и Аs являются преимущественно чувствительными волокнами, которые проводят возбуждение от различных рецепторов в ЦНС. Волокна Аl – это волокна, которые проводят возбуждение от клеток спинного мозга к интрафузальным мышечным волокнам. В-волокна являются характерными для преганглионарных аксонов вегетативной нервной системы. Скорость проведения 3-18 м/с, диаметр 1-3 мкм, продолжительность потенциала действия 1-2 мс, нет фазы следовой деполяризации, а есть длительная фаза гиперполяризации (более 100 мс). Диаметр С-волокон от 0,3 до 1,3 мкм, и скорость проведения импульсов в них несколько меньше величины диаметра, умноженного на 2, и равняется 0,5-3 м/с. Длительность потенциала действия этих волокон составляет 2 мс, отрицательный следовой потенциал равняется 50-80 мс, а положительный следовой потенциал – 300-1000 мс. Большинство С-волокон являются постганглионарными волокнами вегетативной нервной системы. В миелинизированных аксонах скорость проведения импульсов выше, чем в немиелизированных.
Аксон содержит аксоплазму. У крупных нервных клеток ей принадлежит около 99% всей цитоплазмы нейрона. Цитоплазма аксонов содержит микротрубочки, нейрофиламенты, митохондрии, агранулярный эндоплазматический ретикулум, везикулы и мультивезикулярные тела. В разных частях аксона существенно меняются количественные отношения между этими элементами.
У аксонов, как миелинизированных, так и немиелизированных, есть оболочка – аксолемма.
В зоне синаптического контакта мембрана получает ряд дополнительных цитоплазматических соединений: плотные выступы, ленты, субсинаптическая сеть и др.
Начальный участок аксона (от его начала до того места, где наступает сужение до диаметра аксона) носит название аксонного холмика. От этого места и появления миелиновой оболочки простирается начальный сегмент аксона. В немиелинизированных волокнах эта часть волокна определяется с трудом, а некоторые авторы считают, что начальный сегмент присущ только тем аксонам, которые покрыты миелиновой оболочкой. Он отсутствует, например, у клеток Пуркинье в мозжечке.
В месте перехода аксонного холмика в начальный сегмент аксона под аксолеммой появляется характерный электронноплотный слой, состоящий из гранул и фибрилл, толщиной 15 нм. Этот слой не связан с плазматической мембраной, а отделен от нее промежутками до 8 нм.
В начальном сегменте по сравнению с телом клетки резко уменьшается количество рибосом. Остальные компоненты цитоплазмы начального сегмента – нейрофиламенты, митохондрии, везикулы – переходят из аксонного холмика сюда, не изменяясь ни по внешнему виду, ни по взаиморасположению. На начальном сегменте аксона описаны аксо-аксональные синапсы.
Часть аксона, покрытая миелиновой оболочкой, обладает только ей присущими функциональными свойствами, которые связаны с проведением нервных импульсов с большой скоростью и без декремента (затухания) на значительные расстояния. Миелин является продуктом жизнедеятельности нейроглии. Проксимальной границей у миелинизированного аксона служит начало миелиновой оболочки, а дистальной – утрата ее. Далее следуют более или менее длинные терминальные отделы аксона. В этой части аксона отсутствует гранулярный эндоплазматический ретикулум и очень редко встречаются рибосомы. Как в центральных отделах нервной системы, так и на периферии аксоны окружены отростками глиальных клеток.
Миелинизированная оболочка имеет сложное строение. Ее толщина варьирует от долей до 10 мкм и более. Каждая из концентрически расположенных пластинок состоит из двух наружных плотных слоев, образующих главную плотную линию, и двух светлых бимолекулярных слоев липидов, разделенных промежуточной осмиофильной линией. Промежуточная линия аксонов периферической нервной системы представляет собой соединение наружных поверхностей плазматических мембран шванновской клетки. Каждый аксон сопровождается большим числом шванновских клеток. Место, где шванновские клетки граничат между собой, лишено миелина и называется перехватом Ранвье. Между длиной межперехватного участка и скоростью проведения нервных импульсов есть прямая зависимость.
Перехваты Ранвье составляют сложную структуру миелинизированных волокон и играют важную функциональную роль в проведении нервного возбуждения.
Протяженность перехвата Ранвье миелинизированных аксонов периферических нервов находится в пределах 0,4-0,8 мкм, в центральной нервной системе перехват Ранвье достигает 14 мкм. Длина перехватов довольно легко изменяется под действием различных веществ. В области перехватов, помимо отсутствия миелиновой оболочки, наблюдаются значительные изменения структуры нервного волокна. Диаметр крупных аксонов, например, уменьшается наполовину, мелкие аксоны изменяются меньше. Аксолемма имеет обычно неправильные контуры, и под ней лежит слой электронноплотного вещества. В перехвате Ранвье могут быть синаптические контакты как с прилежащими к аксону дендритами (аксо-дендритические), так и с другими аксонами.
Коллатерали аксонов. С помощью коллатералей происходит распространение нервных импульсов на большее или меньшее число последующих нейронов.
Аксоны могут делиться дихотомически, как, например, у зернистых клеток мозжечка. Очень часто встречается магистральный тип ветвления аксонов (пирамидные клетки коры мозга, корзинчатые клетки мозжечка). Коллатерали пирамидных нейронов могут быть возвратными, косоидущими и горизонтальными. Горизонтальные ответвления пирамид простираются иногда на 1-2 мм, объединяя пирамидные и звездчатые нейроны своего слоя. От горизонтально распространяющегося (в поперечном направлении к длинной оси извилины мозга) аксона корзинчатой клетки образуются многочисленные коллатерали, которые заканчиваются сплетениями на телах крупных пирамидных клеток. Подобные аппараты, так же как и окончания на клетках Реншоу в спинном мозге, являются субстратом для осуществления процессов торможения.
Коллатерали аксонов могут служить источником образования замкнутых нейронных цепей. Так, в коре больших полушарий все пирамидные нейроны имеют коллатерали, которые принимают участие во внутрикорковых связях. За счет существования коллатералей обеспечивается в процессе ретроградной дегенерации сохранность нейрона в том случае, если повреждается основная ветвь его аксона.
Терминали аксонов. К терминалям относятся дистальные участки аксонов. Они лишены миелиновой оболочки. Протяженность терминалей значительно варьирует. На светооптическом уровне показано, что терминали могут быть либо одиночными и иметь форму булавы, сетевидной пластинки, колечка, либо множественными и походить на кисть, чашевидную, моховидную структуру. Размер всех этих образований изменяется от 0,5 до 5 мкм и более.
Тонкие разветвления аксонов в местах контакта с другими нервными элементами нередко имеют веретеновидные или бусинковидные расширения. Как показали электронно-микроскопические исследования, именно в этих участках имеются синаптические соединения. Одна и та же терминаль дает возможность одному аксону устанавливать контакт с множеством нейронов (например, параллельные волокна в коре головного мозга) (рис. 1.2).
Функции нервных волокон
Распространение возбуждения в нервных волокнах.Изменения мембранного потенциала, вызываемые электрическим током, подразделяются на пассивные и активные.
Пассивные, или электротонические, изменения мембранного потенциала определяются физическими (электрическими) параметрами как самой мембраны, так и всей клетки (волокна) в целом.
Пассивные сдвиги мембранного потенциала возникают при действии на возбудимые образования электрического тока любой силы, формы или направления. Однако если при гиперполяризующем (анодном) и слабом деполяризующем (катодном) токах пассивные изменения потенциала могут наблюдаться в чистом (неосложненном) виде, то при близких к порогу и сверхпороговых деполяризующих стимулах они сопровождаются активными сдвигами потенциала: локальным ответом и потенциалом действия, связанными с изменениями ионной проницаемости мембраны.
Пассивные свойства мембраны и всего волокна в целом в значительной мере определяют условия возникновения и распространения возбуждения в нервном волокне.
Исследования показывают, что в однородно поляризуемом, однородном участке нервного волокна изменения мембранного потенциала при приложении прямоугольного толчка гиперполяризующего или слабого деполяризующего тока нарастают по экспоненте:
,
где RC = τ
– постоянная времени мембраны, т.е. время, в течение которого потенциал нарастает до 63% от своей конечной величины. При выключении тока потенциал возвращается к исходному уровню по экспоненте с той же постоянной времени
τ
. Такие изменения мембранного потенциала принято называть пассивными или электротоническими, в отличие от активных, связанных с повышением или снижением ионных проводимостей мембраны.
Подобные изменения наблюдаются на сферических клетках (на соме). Описание цилиндрической клетки, в частности аксона, более сложно. В этом случае уже нельзя считать внутренний проводник эквипотенциальным по всей длине. Внешний проводник можно считать эквипотенциальным за счет увеличения объема внеклеточной жидкости. Потенциал на такой мембране зависит не только от времени включения тока, но и от расстояния х
по отношению к месту приложения тока:
,
где а
– радиус волокна,
R
– удельное сопротивление аксоплазмы,
CМ
и
RМ
– емкость и сопротивление на единицу площади мембраны. Левая часть уравнения описывает плотность тока через каждую точку мембраны, которая равна сумме плотностей емкостного ()и омического () токов, стоящих в правой части уравнения.
Через длительное время (намного большего постоянной времени t = RМ CМ
) после включения импульса емкость мембраны полностью зарядится и емкостный ток станет равным нулю. Уравнение примет вид:
.
Его решение:
,
где V0
– потенциал в начале кабеля (
х
= 0),
l
– постоянная длины волокна.
Постоянная длины характеризует крутизну затухания потенциала вдоль волокна. Чем больше l
, тем дальше по волокну проходит сигнал. Скорость электротонического распространения пропорциональна удвоенной величине константы длины волокна
l
и обратно пропорциональна постоянной времени
t = RМ CМ
. Величина
l
может быть выражена через сопротивление мембраны
RМ
, сопротивление внутренней среды – аксоплазмы
Ri
и диаметра волокна
d
:
.
Кабельные свойства нервных волокон оказывают существенное влияние не только на развитие электротонических потенциалов, но и на характер активных ответов – величину порога, амплитуду, крутизну нарастания и длительность потенциала действия.
В настоящее время можно считать строго доказанным, что проведение потенциала действия (ПД) вдоль нервного волокна осуществляется с помощью локальных токов, возникающих между возбужденным и покоящимся участками мембраны. Локальный ток изменяет величину мембранного потенциала покоя в покоящемся участке до критического уровня деполяризации, что и является причиной возникновения потенциала действия.
Многочисленными исследованиями было показано, что скорость проведения пропорциональна постоянной длины волокна l
и обратно пропорциональна постоянной времени мембраны
t
(Чайлохян Л.М., 1962). Поскольку в безмякотных нервных волокнах
l
пропорциональна квадратному корню из диаметра волокна
,
скорость проведения при прочих равных условиях также пропорциональна корню квадратному из диаметра волокна.
В миелинизированных нервных волокнах проведение происходит сальтаторно – от перехвата Ранвье к перехвату Ранвье. Длина межперехватного участка примерно пропорциональна диаметру волокна, поэтому скорость проведения в этих волокнах пропорциональна не корню квадратному из диаметра волокна, а просто его диаметру.
Принято считать, что скорость проведения зависит от величины так называемого фактора безопасности (гарантийности) Ф
, т.е. отношения амплитуды распространяющегося ПД к пороговому потенциалу. Пороговый потенциал – это та величина, на которую нужно изменить мембранный потенциал, чтобы достичь критического уровня деполяризации.
,
где Vs
– амплитуда ПД,
Vt
– пороговый потенциал.
При Ф = Vt
распространения возбуждения нет. Для аксона краба это отношение равно 7.
Было показано, что пороговый потенциал Vt
находится в тесной зависимости от чувствительности системы натриевой проницаемости мембраны к деполяризации. Чем выше эта чувствительность, т.е. чем на большую величину повышается
PNa
и, соответственно, натриевый входящий ток
INa
при данном сдвиге потенциала, тем ниже порог, и наоборот. Изменение состояния системы калиевой проницаемости на величину порогового потенциала практически не оказывает влияния. Точно так же очень мало влияет на пороговый потенциал проводимость токов «утечки». При постоянном потенциале покоя фактор безопасности должен возрастать при воздействиях на нервное волокно, которые повышают чувствительность натриевой системы к деполяризации, например, снижение концентрации ионов кальция в окружающей среде. Значительное снижение фактора безопасности вызывают агенты, усиливающие исходную инактивацию натриевой системы или уменьшающие натриевую проводимость, поскольку в этом случае амплитуда потенциала действия падает, а пороговый потенциал растет. Такие изменения проведения возбуждения наблюдал Тасаки (1957) и другие исследователи при воздействии на нервное волокно анестетиков и наркотиков в малых концентрациях, недостаточных для полного подавления потенциала действия.
Сложное влияние на фактор безопасности оказывает уровень потенциала покоя. Кратковременная подпороговая деполяризация мембраны, не изменяющая существенным образом критического потенциала и амплитуды потенциала действия, повышает фактор безопасности, так как Vt = Eo – Ek
. При сильной же деполяризации амплитуда спайка падает, критический потенциал растет, поэтому фактор безопасности уменьшается.
Наряду с фактором безопасности существенное влияние на скорость проведения возбуждения оказывает крутизна восходящей фазы распространяющегося потенциала действия. Крутизна этой фазы зависит как от пассивных, так и активных свойств мембраны.
Примерно 1/3 восходящей фазы распространяющегося ПД связана с пассивной деполяризацией мембраны нервного волокна током локальной цепи. Скорость же этой деполяризации при данной силе локального тока определяется постоянной времени мембраны t = RM CM
. Чем эта величина меньше, тем быстрее нарастает деполяризация и, следовательно, круче поднимается спайк. Инактивация натриевой системы, или снижение проницаемости для натрия (активные свойства мембраны), резко уменьшает крутизну восходящей фазы. Таким образом, при большинстве воздействий изменения скорости нарастания восходящей фазы ПД по своему направлению совпадают с изменениями фактора безопасности.
Согласно теории локальных токов, амплитуда распространяющегося потенциала действия Vs
, в отличие от мембранного спайка, зависит не только от ЭДС возбужденной мембраны
Е
, но и от соотношения входных сопротивлений возбужденного
R1
и невозбужденного (сопротивление нагрузки
R2
) участков волокна:
. (1)
Чем отношение выше, тем в большей мере амплитуда распространяющегося ПД приближается к величине Е
, тем, следовательно, выше фактор безопасности, и наоборот. Из чего вытекает, что снижение сопротивления мембраны (повышение ее ионной проводимости) при критической деполяризации не только ведет к возникновению спайка, но и способствует увеличению фактора безопасности, а значит, и скорости проведения.
Из формулы (1) ясно, что при проведении возбуждения по геометрически неоднородным возбудимым проводникам амплитуда распространяющегося спайка должна существенно зависеть от того, насколько близко находится возбужденный в данный момент участок волокна к месту его ветвления или расширения.
При расширении нервного волокна, например, в месте перехода его в тело клетки или в области ветвления аксона, суммарная площадь сечения волокон и общая площадь их мембраны увеличивается, а следовательно, R2
падает. Уменьшение
R2
снижает фактор безопасности и, соответственно, скорость проведения. При некоторых условиях уменьшение
R2
может привести к полному блокированию нервного импульса.
Расчеты показали, что потенциал действия легко проходит трехкратное расширение, с трудом пятикратное и полностью блокируется при шестикратном. Причиной развития блока является резкое снижение амплитуды распространяющегося ПД вблизи области расширения волокна.
Трофическая функция нервных волокон.Трофической функцией обладают афферентные и эфферентные волокна.
Афферентные нервы обладают двумя нейротрофическими, неимпульсными функциями. Можно различить прямое морфогенетическое и трофическое влияние на периферические органы и регуляторную функцию с обратной связью, зависящую, вероятно, от внутриаксональных центростремительных импульсов. Нейротрофическое морфогенетическое влияние доказано наличием: а) зависимости структуры вкусовых почек от вкусовых нервов; б) стимулирования регенерации конечности у амфибий чувствительными нервами посредством специфического, стимулирующего рост вещества немедиаторной природы; в) дифференцировки и поддержания рецепторов. После деафферентации в некоторых органах развиваются трофические нарушения. Первичный «трофический» нейрон для мышцы – это нейрон моторный. Нельзя забывать также, что во всех нервах проходят эфферентные адренергические волокна, вкоторых нейросекреты (катехоламины) транспортируются аксоплазматическим током к периферическим органам.
Аксональный транспорт.Описаны две системы аксонального транспорта – медленный, со скоростью 1-3 мм/день, и быстрый, со скоростью примерно 400 мм/день.
Аксональный транспорт поддерживает непрерывность аксона и синаптических мембран и восстанавливает белки, гликопротеины, ферменты и другие вещества, исчезающие в ходе локального расщепления, экзоцитоза в синаптическую щель и ретроградной миграции к нейрону. Все это происходит благодаря быстрому транспорту, на который не оказывают влияния процессы возбуждения. Транспорт продолжается после блокады потенциалов действия и не повышается при усиленной активности нерва. Аксональный транспорт осуществляется в обоих направлениях; центростремительный ток контролирует, по-видимому, синтез белков в нейроне и играет также роль «сигнала» для хроматолиза после аксотомии. Различные вещества, ферменты, передатчики и макромолекулы передвигаются в аксоне с разной скоростью.
Аксоплазматический транспорт можно зарегистрировать по накоплению веществ после нарушения непрерывности аксона и по наблюдению за продвижением меченых соединений после введения их в нейрон.
Белки, синтезируемые в теле клетки, синаптические медиаторные вещества и низкомолекулярные факторы спускаются по аксону к нервной терминали вместе с клеточными органеллами, в частности митохондриями. Для большинства веществ и органелл обнаружен ретроградный транспорт (по аксону к телу клетки): вирус полиомиелита, вирус герпеса, столбнячный токсин, а также ферменты – пероксидаза хрена, которая широко используется в нейроанатомии в качестве маркиратора. Ретроградный транспорт, видимо, является главным фактором регуляции синтеза белка в клетке. После перерезки аксона через несколько дней в соме начинается хроматолиз, что свидетельствует о нарушении синтеза белка. Быстрый аксонный транспорт зависит от достаточного снабжения метаболической энергии. Возможность транспорта создают микротрубочки диаметром 25 мкм, состоящие из белка тубулина, и некоторые нейрофибриллы, состоящие из белка актина, образующие транспортные нити. Транспортные нити скользят вдоль микротрубочек. При этом они взаимодействуют с выступами микротрубочек, происходит расщепление АТФ, которое и обеспечивает энергию для транспорта. Более медленно транспортируются крупные белки. Но считают, что сам транспортный механизм не является более медленным, однако вещества время от времени попадают в клеточные компартменты, которые не участвуют в транспорте. Медленный ток имеет, по-видимому, также отношение к аксональному росту. Аксоплазматический ток прекращается колхицином, что объясняется влиянием этого вещества на микротрубочки.
Физиология синапсов
Синапс (от греч. synapsis) обозначает соединение, связь – это специализированная зона контакта между нейронами или нейронами и другими возбудимыми образованиями, обеспечивающая передачу возбуждения с сохранением, изменением или исчезновением ее информационного значения. Данный термин был предложен Ч. Шеррингтоном (1897) для обозначения функционального контакта между нейронами. Справедливости ради нужно отметить, что еще в 60-х годах XIX столетия И.М. Сеченов подчеркивал, что вне межклеточной связи нельзя объяснить происхождение даже самых простых рефлексов.
Синапсы различают: 1) по их местоположению; 2) по способу передачи сигналов.
1) По местоположению выделяют синапсы центральные и периферические. Центральные синапсы – это синапсы, которые осуществляют контакт между нейронами в центральной нервной системе. К ним относятся аксо-аксональные синапсы, аксо-дендритические, аксо-соматические, дендро-дендритические (обнаружены гистологически; функциональное значение не вполне ясно). Центральные синапсы классифицируют также по знаку их действия – возбуждающие и тормозные. Кроме того, распространено деление синапсов по тому медиатору (передатчику), который осуществляет посредничество: адренергические синапсы, холинергические синапсы и др.
К периферическим синапсам относят нервно-мышечные, синапсы вегетативных ганглиев (синапсы, образованные преганглионарными и постганглионарными волокнами).
2) По способу передачи синапсы классифицируются как химические и электрические.
Для всех этих образований характерно наличие пресинаптической мембраны, синаптической щели (10-50 нм), постсинаптической мембраны. Пресинаптическая мембрана является мембраной пресинаптического окончания отростка нейрона (чаще всего аксона).
У человека и высших позвоночных животных наибольшее распространение получили химические синапсы. Химические синапсы в пресинаптическом окончании содержат везикулы с медиатором, химическим передатчиком. Ширина синаптической щели в среднем составляет 20 нм. На постсинаптической мембране содержатся рецепторы к данному медиатору, ферменты, разрушающие данный медиатор. Таким образом, постсинаптическая мембрана является рецепторной частью синапса, ею может быть специфически дифференцированный участок дендрита, тела нейрона и его аксона.
В электрическом синапсе не вырабатывается медиатор. Синаптическая щель несколько меньше, чем у химического синапса (2-4 нм). В синаптической щели между пре- и постсинаптической мембранами имеются белковые мостики-каналы шириной 1-2 нм, где движутся ионы и небольшие молекулы. Это способствует более низкому, чем у пресинаптической мембраны, сопротивлению постсинаптической мембраны. Поэтому возбуждение от пресинаптической мембраны к постсинаптической мембране в электрических синапсах передается электрическим путем, т.е. осуществляется эфаптическая передача. В отличие от химических синапсов, электрические синапсы отличаются большей скоростью проведения возбуждения, высокой надежностью передачи, возможностью двустороннего проведения.
Электрические синапсы обнаружены у крыс в вестибулярном ядре продолговатого мозга, в структурах дыхательного центра продолговатого мозга (при этом обсуждается их роль в механизмах автоматического ритмогенеза дыхания); у кошки электрические синапсы обнаружены между нейронами нижних олив, в структурах таламуса, между фоторецепторами сетчатки и горизонтальными клетками у рыб и др.
Но все-таки наибольшее распространение в процессе эволюции получили химические синапсы. Это обусловлено рядом свойств этих образований, которые имеют большое значение в организации деятельности нервной системы (рис. 1.4).
Рис. 1.4.
Синапс (рисунок взят из книги: Мозг / под ред. П.В. Симонова. М.: Мир, 1984)
⇐ Предыдущая3Следующая ⇒
Рекомендуемые страницы:
Функционирование нервной системы
Нормальное функционирование нервной системы зависит от передачи импульса и химических процессов в синапсе. Не менее важную роль играет создание нервных связей. Способность к обучению присутствует у людей именно благодаря возможности организма формировать новые соединения между нейронами.
Любое новое действие на стадии изучения требует постоянного контроля со стороны мозга. По мере его освоения образуются новые нейронные связи, со временем действие начинает выполняться автоматически (например, умение ходить).
Дендриты – это передающие волокна, составляющие примерно треть всей нервной ткани организма. Благодаря их взаимодействию с аксонами люди имеют возможность обучаться.
| Axon | |
|---|---|
An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
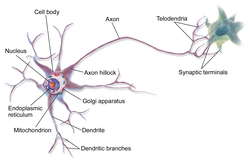
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»

:max_bytes(150000):strip_icc()/ProfilePicPugle-bc0d33cfdbbc46e08595e6ff62d19ffd.jpg)