Аксональный транспорт
Аксональный
транспорт (аксоток)
— это перемещение веществ от тела
нейрона в отростки (антероградный
аксоток)
и в обратном направлении (ретроградный
аксоток).
Различают медленный
аксональный
ток веществ (1-5 мм в сутки) и быстрый
(до
1-5 м в сутки). Обе транспортные системы
присутствуют как в аксонах, так и в
дендритах. Аксональный транспорт
обеспечивает единство нейрона. Он
создаёт постоянную связь между телом
нейрона (трофическим центром) и
отростками. Основные синтетические
процессы идут в перикарионе. Здесь
сосредоточены необходимые для этого
органеллы. В отростках синтетические
процессы протекают слабо.
Антероградная
быстрая система транспортирует
к нервным окончаниям белки и органеллы,
необходимые для синаптических функций
(митохондрии, фрагменты мембран,
пузырьки, белки-ферменты, участвующие
в обмене нейромедиаторов, а также
предшественники нейромедиаторов).
Ретроградная
система возвращает
в перикарион использованные и поврежденные
мембраны и белки для деградации в
лизосомах и обновления, приносит
информацию о состоянии периферии,
факторы роста нервов. Медленный
транспорт —
это антероградная система, проводящая
белки и другие вещества для обновления
аксоппазмы зрелых нейронов и обеспечения
роста отростков при их развитии и
регенерации.
Ретроградный
транспорт может
иметь значение в патологии. За счёт него
нейротропные вирусы (герпеса, бешенства,
полиомиелита) могут перемещаться с
периферии в центральную нервную
систему.
Нейроглия
Глиоциты
выполняют в нервной ткани вспомогательные
функции: опорную, разграничительную,
трофическую, секреторную
и
защитную. Они поддерживают постоянно
среды вокруг нейронов. Клетки нейроглии
делятся на 2 группы: макроглию и микроглию.
Клетки макроглии бывают трех типов.
Эпендимоциты.
Выстилают каналы и желудочки единого
и головного мозга, по которым циркулирует
спинномозговая жидкость (ликвор). Эти
клетки напоминают однослойный
призматический
эпителий.
На апикальных концах эпендимоцитов
расположены реснички, помогающие
движению спинномозговой жидкости. Через
апикальные концы эпендимоциты могут
выделять биологически активные вещества,
которые с лидером разносятся по всему
мозгу. От базальных концов эпендимоцитов
отходят отростки, которые могут идти
через весь мозг. В желудочках мозга
находятся сосудистые
сплетения. Они
покрыты специализированными эпендимоцитами,
участвующими в образований ликвора.
Астроциты.
Различают протоплазматические
и
волокнистые
астроциты.
Протоплазматические
астроциты имеют
короткие толстые отростки. Они расположены
в сером веществе мозга, выполняют
разграничительную и трофическую
функции. Волокнистые
астроциты находятся
в белом веществе, имеют многочисленные
тонкие длинные отростки, которые
оплетают кровеносные сосуды мозга,
образуя периваскулярные глиальные
пограничные мембраны. Их отростки также
изолируют синапсы. Таким образом, они
изолируют нейроны и кровеносные сосуды
и участвуют в образовании
гемато-энцефалического барьера,
обеспечивают обмен веществ между кровью
и нейронами. Они также участвуют в
образовании оболочек мозга и выполняют
опорную функцию (образуют каркас мозга).
Олигодендроциты
имеют мало отростков, окружают нейроны,
выполняя трофическую (участие в питании
нейронов) и разграничительную Функции.
Олигодендроциты, расположенные вокруг
тел нейронов, называются мантийными
глиоцитами. Олигодендроциты,
расположенные в периферической нервной
системе и образующие оболочки вокруг
отростков нейронов, называют
леммоцитами
(шванновскими клетками).
Микроглия
(глиальные макрофаги). Образуйся из
костномозговых предшественников
моноцитов. Покоящиеся микроглиоциты
имеют короткие ветвящиеся отростки.
Под действием микроорганизмов и продуктов
распада нервной ткани они активируются,
теряют отростки, округляются и превращаются
в «зернистые шары» (реактивная микроглия).
При этом они, как макрофаги, уничтожают
разрушенные нервные и глиальные клетки.
Источники
развития
— нервная
трубка, нервный гребень (ганглиозные
пластинки) и
плакоды.
Нервная трубка образуется
в результате смыкания краёв нервного
желобка, развивающегося из эктодермы.
Нервные
гребни расположены
между нервной трубкой и эктодермой Они
образуются в результате выселения
клеток из утолщенных краев нервного
желобка — нервных
валиков. Плакоды представляют
собой эктодермы по бокам нервной трубки
на головном конце зародыша. Нейробласты
нервной
трубки дают начало нервным клеткам, а
глиобласты — глиальным клеткам головного
и спинного мозга. Из клеток нервного
гребня происходят нейроны и нейроглия
всех нервных ганглиев, а из плакод —
рецепторные (нейросенсорные) клетки
органа обоняния, нейроны слухового
и вестибулярного ганглиев. Клетки
микроглии образуются из промоноцитов
красного костного мозга.
В
ходе эмбриогенеза до 85% образующихся
нейронов гибнет в результате апоптоза
(генетически запрограммированной
смерти). Погибают дефектные нейроны (с
повреждённой ДНК), нейроны, которые
не нашли свои «клетки-мишени» или
оказались избыточными, «лишними».
Соседние файлы в папке Конспекты
- #
- #
- #
- #
From Wikipedia, the free encyclopedia
Axonal transport, also called axoplasmic transport or axoplasmic flow, is a cellular process responsible for movement of mitochondria, lipids, synaptic vesicles, proteins, and other organelles to and from a neuron’s cell body, through the cytoplasm of its axon called the axoplasm.[1] Since some axons are on the order of meters long, neurons cannot rely on diffusion to carry products of the nucleus and organelles to the end of their axons. Axonal transport is also responsible for moving molecules destined for degradation from the axon back to the cell body, where they are broken down by lysosomes.[2]
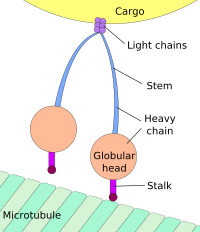
Dynein, a motor protein responsible for retrograde axonal transport, carries vesicles and other cellular products toward the cell bodies of neurons. Its light chains bind the cargo, and its globular head regions bind the microtubule, «inching» along it.
Movement toward the cell body is called retrograde transport and movement toward the synapse is called anterograde transport.[3][4]
Mechanism[edit]
The vast majority of axonal proteins are synthesized in the neuronal cell body and transported along axons. Some mRNA translation has been demonstrated within axons.[5][6] Axonal transport occurs throughout the life of a neuron and is essential to its growth and survival. Microtubules (made of tubulin) run along the length of the axon and provide the main cytoskeletal «tracks» for transportation. Kinesin and dynein are motor proteins that move cargoes in the anterograde (forwards from the soma to the axon tip) and retrograde (backwards to the soma (cell body)) directions, respectively. Motor proteins bind and transport several different cargoes including mitochondria, cytoskeletal polymers, autophagosomes, and synaptic vesicles containing neurotransmitters.
Axonal transport can be fast or slow, and anterograde (away from the cell body) or retrograde (conveys materials from axon to cell body).
Fast and slow transport[edit]
Vesicular cargoes move relatively fast (50–400 mm/day) whereas transport of soluble (cytosolic) and cytoskeletal proteins takes much longer (moving at less than 8 mm/day).[7] The basic mechanism of fast axonal transport has been understood for decades but the mechanism of slow axonal transport is only recently becoming clear, as a result of advanced imaging techniques.[8] Fluorescent labeling techniques (e.g. fluorescence microscopy) have enabled direct visualization of transport in living neurons. (See also: Anterograde tracing.)
Recent studies have revealed that the movement of cytoskeletal «slow» cargoes is actually rapid but unlike fast cargoes, they pause frequently, making the overall transit rate much slower. The mechanism is known as the «Stop and Go» model of slow axonal transport, and has been extensively validated for the transport of the cytoskeletal protein neurofilament.[9] The movement of soluble (cytosolic) cargoes is more complex, but appears to have a similar basis where soluble proteins organize into multi-protein complexes that are then conveyed by transient interactions with more rapidly moving cargoes moving in fast axonal transport.[10][11][12] An analogy is the difference in transport rates between local and express subway trains. Though both types of train travel at similar velocities between stations, the local train takes much longer to reach the end of the line because it stops at every station whereas the express makes only a few stops on the way.
Anterograde transport[edit]
Anterograde (also called «orthograde») transport is movement of molecules/organelles outward, from the cell body (also called soma) to the synapse or cell membrane.
The anterograde movement of individual cargoes (in transport vesicles) of both fast and slow components along the microtubule[4] is mediated by kinesins.[2] Several kinesins have been implicated in slow transport,[8] though the mechanism for generating the «pauses» in the transit of slow component cargoes is still unknown.
There are two classes of slow anterograde transport: slow component a (SCa) that carries mainly microtubules and neurofilaments at 0.1-1 millimeters per day, and slow component b (SCb) that carries over 200 diverse proteins and actin at a rate of up to 6 millimeters per day.[8] The slow component b, which also carries actin, are transported at a rate of 2-3 millimeters per day in retinal cell axons.
During reactivation from latency, the herpes simplex virus (HSV) enters its lytic cycle, and uses anterograde transport mechanisms to migrate from dorsal root ganglia neurons to the skin or mucosa that it subsequently affects.[13]
A cargo-receptor for anterograde transport motors, the kinesins, has been identified as the amyloid precursor protein (APP), the parent protein that produces the senile plaques found in Alzheimer’s disease.[14] A 15-amino acid peptide in the cytoplasmic carboxyl terminus of APP binds with high affinity to conventional kinesin-1 and mediates transport of exogenous cargo in the giant axon of the squid.[15]
Manganese, a contrast agent for T1-weighted MRI, travels by anterograde transport after stereotaxic injection into the brain of experimental animals and thereby reveals circuitry by whole brain MR imaging in living animals, as pioneered by Robia Pautler, Elaine Bearer and Russ Jacobs. Studies in kinesin-light chain-1 knockout mice revealed that Mn2+ travels by kinesin-based transport in the optic nerve and in the brain. Transport in both hippocampal projections and in the optic nerve also depends on APP.[16] Transport from hippocampus to forebrain is decreased in aging and destination is altered by the presence of Alzheimer’s disease plaques.[17]
Retrograde transport[edit]
Retrograde transport shuttles molecules/organelles away from axon termini toward the cell body. Retrograde axonal transport is mediated by cytoplasmic dynein, and is used for example to send chemical messages and endocytosis products headed to endolysosomes from the axon back to the cell.[2] Operating at average in vivo speeds of approximately 2 μm/sec,[18][19] fast retrograde transport can cover 10-20 centimeters per day.[2]
Fast retrograde transport returns used synaptic vesicles and other materials to the soma and informs the soma of conditions at the axon terminals. Retrograde transport carries survival signals from the synapse back to the cell body, such as the TRK, the nerve growth factor receptor.[20] Some pathogens exploit this process to invade the nervous system. They enter the distal tips on an axon and travel to the soma by retrograde transport. Examples include tetanus toxin and the herpes simplex, rabies, and polio viruses. In such infections, the delay between infection and the onset of symptoms corresponds to the time needed for the pathogens to reach the somata.[21] Herpes simplex virus travels both ways in axons depending on its life cycle, with retrograde transport dominating polarity for incoming capsids.[22]
Consequences of interruption[edit]
Whenever axonal transport is inhibited or interrupted, normal physiology becomes pathophysiology, and an accumulation of axoplasm, called an axonal spheroid, may result. Because axonal transport can be disrupted in a multitude of ways, axonal spheroids can be seen in many different classes of diseases, including genetic, traumatic, ischemic, infectious, toxic, degenerative and specific white matter diseases called leukoencephalopathies. Several rare neurodegenerative diseases are linked to genetic mutations in the motor proteins, kinesin and dynein, and in those cases, it is likely that axonal transport is a key player in mediating pathology.[23][24] Dysfunctional axonal transport is also linked to sporadic (common) forms of neurodegenerative diseases such as Alzheimer’s and Parkinson’s.[8] This is mainly due to numerous observations that large axonal accumulations are invariably seen in affected neurons, and that genes known to play a role in the familial forms of these diseases also have purported roles in normal axonal transport. However, there is little direct evidence for involvement of axonal transport in the latter diseases, and other mechanisms (such as direct synaptotoxicity) may be more relevant.
Arrest of axoplasmic flow at the edge of ischemic areas in vascular retinopathies leads to swelling of nerve fibres, which give rise to soft exudates or cotton-wool patches.
Since the axon depends on axoplasmic transport for vital proteins and materials, injury, such as diffuse axonal injury, which interrupts the transport, will cause the distal axon to degenerate in a process called Wallerian degeneration. Cancer drugs that interfere with cancerous growth by altering microtubules (which are necessary for cell division) damage nerves because the microtubules are necessary for axonal transport.
Infection[edit]
The rabies virus reaches the central nervous system by retrograde axoplasmic flow.[25] The tetanus neurotoxin is internalised at the neuromuscular junction through binding the nidogen proteins and is retrogradely transported towards the soma in signaling endosomes.[26] Neurotropic viruses, such the herpesviruses, travel inside axons using cellular transport machinery, as has been shown in work by Elaine Bearer’s group.[27][28] Other infectious agents are also suspected of using axonal transport.[29] Such infections are now thought to contribute to Alzheimer’s disease and other neurodegenerative neurological disorders.[30][31]
See also[edit]
- Intraflagellar transport
References[edit]
- ^ Sabry J, O’Connor TP, Kirschner MW (June 1995). «Axonal transport of tubulin in Ti1 pioneer neurons in situ». Neuron. 14 (6): 1247–56. doi:10.1016/0896-6273(95)90271-6. PMID 7541635.
- ^ a b c d Oztas E (2003). «Neuronal Tracing» (PDF). Neuroanatomy. 2: 2–5. Archived (PDF) from the original on 2005-10-25.
- ^ Karp G, van der Geer P (2005). Cell and molecular biology: concepts and experiments (4th ed.). John Wiley. p. 344. ISBN 978-0-471-46580-5.
- ^ a b Bear MF, Connors BW, Paradso MA (2007). Neuroscience : exploring the brain (3rd ed.). Lippincott Williams & Wilkins. p. 41. ISBN 978-0-7817-6003-4.
- ^ Giustetto M, Hegde AN, Si K, Casadio A, Inokuchi K, Pei W, Kandel ER, Schwartz JH (November 2003). «Axonal transport of eukaryotic translation elongation factor 1alpha mRNA couples transcription in the nucleus to long-term facilitation at the synapse». Proceedings of the National Academy of Sciences of the United States of America. 100 (23): 13680–5. Bibcode:2003PNAS..10013680G. doi:10.1073/pnas.1835674100. PMC 263873. PMID 14578450.
- ^ Si K, Giustetto Si K, Giustetto M, Etkin A, Hsu R, Janisiewicz AM, Miniaci MC, Kim JH, Zhu H, Kandel ER (December 2003). «A neuronal isoform of CPEB regulates local protein synthesis and stabilizes synapse-specific long-term facilitation in aplysia». Cell. 115 (7): 893–904. doi:10.1016/s0092-8674(03)01021-3. PMID 14697206. S2CID 15552012.
- ^ Maday, Sandra; Twelvetrees, Alison E.; Moughamian, Armen J.; Holzbaur, Erika L.F. (October 2014). «Axonal Transport: Cargo-Specific Mechanisms of Motility and Regulation». Neuron. 84 (2): 292–309. doi:10.1016/j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^ a b c d Roy S, Zhang B, Lee VM, Trojanowski JQ (January 2005). «Axonal transport defects: a common theme in neurodegenerative diseases». Acta Neuropathologica. 109 (1): 5–13. doi:10.1007/s00401-004-0952-x. PMID 15645263. S2CID 11635065.
- ^ Brown A (March 2003). «Axonal transport of membranous and nonmembranous cargoes: a unified perspective». The Journal of Cell Biology. 160 (6): 817–21. doi:10.1083/jcb.200212017. PMC 2173776. PMID 12642609.
- ^ Scott DA, Das U, Tang Y, Roy S (May 2011). «Mechanistic logic underlying the axonal transport of cytosolic proteins». Neuron. 70 (3): 441–54. doi:10.1016/j.neuron.2011.03.022. PMC 3096075. PMID 21555071.
- ^ Roy S, Winton MJ, Black MM, Trojanowski JQ, Lee VM (March 2007). «Rapid and intermittent cotransport of slow component-b proteins». The Journal of Neuroscience. 27 (12): 3131–8. doi:10.1523/JNEUROSCI.4999-06.2007. PMC 6672457. PMID 17376974.
- ^ Kuznetsov AV (2011). «Analytical solution of equations describing slow axonal transport based on the stop-and-go hypothesis». Central European Journal of Physics. 9 (3): 662–673. Bibcode:2011CEJPh…9..662K. doi:10.2478/s11534-010-0066-0.
- ^ Holland DJ, Miranda-Saksena M, Boadle RA, Armati P, Cunningham AL (October 1999). «Anterograde transport of herpes simplex virus proteins in axons of peripheral human fetal neurons: an immunoelectron microscopy study». Journal of Virology. 73 (10): 8503–11. doi:10.1128/JVI.73.10.8503-8511.1999. PMC 112870. PMID 10482603.
- ^ Satpute-Krishnan P, DeGiorgis JA, Conley MP, Jang M, Bearer EL (October 2006). «A peptide zipcode sufficient for anterograde transport within amyloid precursor protein». Proceedings of the National Academy of Sciences of the United States of America. 103 (44): 16532–7. Bibcode:2006PNAS..10316532S. doi:10.1073/pnas.0607527103. PMC 1621108. PMID 17062754.
- ^ Seamster PE, Loewenberg M, Pascal J, Chauviere A, Gonzales A, Cristini V, Bearer EL (October 2012). «Quantitative measurements and modeling of cargo-motor interactions during fast transport in the living axon». Physical Biology. 9 (5): 055005. Bibcode:2012PhBio…9e5005S. doi:10.1088/1478-3975/9/5/055005. PMC 3625656. PMID 23011729.
- ^ Gallagher JJ, Zhang X, Ziomek GJ, Jacobs RE, Bearer EL (April 2012). «Deficits in axonal transport in hippocampal-based circuitry and the visual pathway in APP knock-out animals witnessed by manganese enhanced MRI». NeuroImage. 60 (3): 1856–66. doi:10.1016/j.neuroimage.2012.01.132. PMC 3328142. PMID 22500926.
- ^ Bearer EL, Manifold-Wheeler BC, Medina CS, Gonzales AG, Chaves FL, Jacobs RE (October 2018). «Alterations of functional circuitry in aging brain and the impact of mutated APP expression». Neurobiology of Aging. 70: 276–290. doi:10.1016/j.neurobiolaging.2018.06.018. PMC 6159914. PMID 30055413.
- ^ Gibbs KL, Kalmar B, Sleigh JN, Greensmith L, Schiavo G (January 2016). «In vivo imaging of axonal transport in murine motor and sensory neurons». Journal of Neuroscience Methods. 257: 26–33. doi:10.1016/j.jneumeth.2015.09.018. PMC 4666412. PMID 26424507.
- ^ Sleigh J, Schiavo G (2016). «Older but not slower: aging does not alter axonal transport dynamics of signalling endosomes in vivo». Matters. 2 (6). doi:10.19185/matters.201605000018.
- ^ Cui B, Wu C, Chen L, Ramirez A, Bearer EL, Li WP, Mobley WC, Chu S (August 2007). «One at a time, live tracking of NGF axonal transport using quantum dots». Proceedings of the National Academy of Sciences of the United States of America. 104 (34): 13666–71. Bibcode:2007PNAS..10413666C. doi:10.1073/pnas.0706192104. PMC 1959439. PMID 17698956.
- ^ Saladin, Kenneth. Anatomy and Physiology: The Unity of Form and Function. Sixth. New York : McGraw-Hill, 2010. 445. Print.
- ^ Bearer EL, Breakefield XO, Schuback D, Reese TS, LaVail JH (July 2000). «Retrograde axonal transport of herpes simplex virus: evidence for a single mechanism and a role for tegument». Proceedings of the National Academy of Sciences of the United States of America. 97 (14): 8146–50. Bibcode:2000PNAS…97.8146B. doi:10.1073/pnas.97.14.8146. PMC 16684. PMID 10884436.
- ^ Maday S, Twelvetrees AE, Moughamian AJ, Holzbaur EL (October 2014). «Axonal transport: cargo-specific mechanisms of motility and regulation». Neuron. 84 (2): 292–309. doi:10.1016/j.neuron.2014.10.019. PMC 4269290. PMID 25374356.
- ^ Sleigh JN, Rossor AM, Fellows AD, Tosolini AP, Schiavo G (December 2019). «Axonal transport and neurological disease». Nat Rev Neurol. 15 (12): 691–703. doi:10.1038/s41582-019-0257-2. PMID 31558780. S2CID 203437348.
- ^ Mitrabhakdi E, Shuangshoti S, Wannakrairot P, Lewis RA, Susuki K, Laothamatas J, Hemachudha T (November 2005). «Difference in neuropathogenetic mechanisms in human furious and paralytic rabies». Journal of the Neurological Sciences. 238 (1–2): 3–10. doi:10.1016/j.jns.2005.05.004. PMID 16226769. S2CID 25509462.
- ^ Bercsenyi K, Schmieg N, Bryson JB, Wallace M, Caccin P, Golding M, Zanotti G, Greensmith L, Nischt R, Schiavo G (November 2014). «Tetanus toxin entry. Nidogens are therapeutic targets for the prevention of tetanus» (PDF). Science. 346 (6213): 1118–23. doi:10.1126/science.1258138. PMID 25430769. S2CID 206560426.
{{cite journal}}: CS1 maint: url-status (link) - ^ Satpute-Krishnan P, DeGiorgis JA, Bearer EL (December 2003). «Fast anterograde transport of herpes simplex virus: role for the amyloid precursor protein of alzheimer’s disease». Aging Cell. 2 (6): 305–18. doi:10.1046/j.1474-9728.2003.00069.x. PMC 3622731. PMID 14677633.
- ^ Cheng SB, Ferland P, Webster P, Bearer EL (March 2011). «Herpes simplex virus dances with amyloid precursor protein while exiting the cell». PLOS ONE. 6 (3): e17966. Bibcode:2011PLoSO…617966C. doi:10.1371/journal.pone.0017966. PMC 3069030. PMID 21483850.
- ^ Bearer EL, Satpute-Krishnan P (September 2002). «The role of the cytoskeleton in the life cycle of viruses and intracellular bacteria: tracks, motors, and polymerization machines». Current Drug Targets. Infectious Disorders. 2 (3): 247–64. doi:10.2174/1568005023342407. PMC 3616324. PMID 12462128.
- ^ Itzhaki RF, Lathe R, Balin BJ, Ball MJ, Bearer EL, Braak H, et al. (2016). «Microbes and Alzheimer’s Disease». Journal of Alzheimer’s Disease. 51 (4): 979–84. doi:10.3233/JAD-160152. PMC 5457904. PMID 26967229.
- ^ «No place like asphalt for these hardy microbes». New Scientist. 206 (2757): 15. 2010. doi:10.1016/s0262-4079(10)60991-8.
Активный транспорт органелл, белков и РНК по аксону уже давно интересует научный мир, ведь жизнедеятельность всего аксона, что может достигать длины одного метра, зависит от процессов, происходящих в соме нейрона. В 1976 году Гриффином и коллегами было показано, что мембранные органеллы движутся по направлению к дистальному концу аксона «быстро» (до 40 см в день), а белки цитоскелета и некоторые другие — медленно (< 8 мм в день).
Транспорт из сомы был назван «антероградным», а в обратном направлении — «ретроградным», а эти термины используются и по сей день. Первый необходим для транспорта новосинтезированных белков, нейромедиаторов и т. д. к пресинаптической мембране, а второй же важен, например, для реакции на повреждение дистальных отделов аксона.
Микротрубочки — структуры из белка тубулина, обладающие полярностью («+» конец, постоянно удлиняющийся, направлен к концу аксона, а «-», более стабильный — в соме). В процессах транспорта они играют роль «рельс», по которым «ездят» белковые моторы. С ними тесно связаны белки, ассоциированные с микротрубочками (MAP), каноническая роль которых — контроль за полимеризацией и стабилизацией микротрубочек, но они также выполняют и регуляторную роль, модулируя связывание с моторами.
Моторные белки делятся на два больших класса: кинезины и динеины. Первые представляют собой огромное суперсемейство; более всего богата разнообразием его представителей именно нервная система: в мозге экспрессируется 38 генов кинезинов из 45 всех найденных. Кинезины делят на 14 семейств, соответственно структурному и функциональному сходству, из которых кинезины 1, 2 и 3 участвуют в аксональном транспорте.
Кинезины первого семейства обеспечивают быстрый транспорт широкого круга карго, включая органеллы, белки и РНК. Представители второго перемещают N-кадгерин, холин-ацетилтрансферазу и бета-катенин, а также фодрин-положительных предшественников плазмалеммы, а кинезины-3 — предшественников синаптических везикул. Отметим, что все кинезины обеспечивают сугубо антероградный транспорт.
Кинезин-1 (или просто кинезин) — гетеротетрамер, состоящий из двух тяжелых цепей (KHC) и двух легких (KLC). Каждая тяжелая цепь имеет составе глобулярный моторный домен, связывающий АТФ и контактирующий с микротрубочками, за которым следует «шейка», участвующая в димеризации, и «хвост», что служит для связывания с карго.
Семейство динеинов устроено много проще: конкретно моторную субъединицу кодирует один-единственный ген, хотя и есть вариации в других субъединицах. Динеины, в отличие от кинезинов, в зависимости от контекста и структуры, обеспечивают оба вида транспорта, как антероградный, к плюс-концу, так и ретроградный. Для большинства действий, выполняемых этими белками, требуется специфический активатор, динактин — высококонсервативный мультибелковый комплекс.
Кинезины и динеины несколько различаются по свойствам: помимо уже указанных отличий в направлении движения, первые «сильнее» — развивают силу до 5 пиконьютонов, вторые же — до 1 пН; динеины способны к «командной работе», так как могут перемещаться в разные стороны, и для эффективного движения требуется совместная деятельность нескольких белков, чего не скажешь о кинезинах.
Как показали опыты, карго в процессе движения связывается с различными типами моторных белков, к примеру, выяснилось, что даже аутофагосомы, движущиеся строго в одном направлении, связываются как с кинезинами, так и динеинами; другими словами, противодействующими друг другу моторами.
Предложено три модели взаимодействия белков: первая проста — кинезины и динеины соперничают друг с другом, и кто окажется сильнее, в ту сторону движение и пойдет; исходя из второй, мы скажем, что моторные белки работают по очереди, а процесс строго регулируется внешними стимулами. Точка зрения авторов третьей модели находится посередине между двумя предыдущими и заключается в том, что хоть процесс взаимодействия и контролируется, но работают одновременно оба типа моторов, а эффект зависит от того, какой из них будет ингибирован сильнее. И всё больше доказательств получает именно последняя, и в настоящий момент, несмотря на множество белых пятен в нашем понимании процессов транспорта, сомнений не вызывают четыре положения:
- Двигатели остаются стабильно связанными с грузом во время транспортировки, даже когда они неактивны;
- Для эффективного перемещения даже крупных (> 1 мкм) органелл вдоль микротрубочки необходим лишь небольшой набор двигателей. Эти двигатели функционируют группами, при этом возможно даже противодействие внутри этих групп;
- Двигатели регулируются механизмами, которые могут включать в себя Rab-специфическую регуляцию, регуляцию киназами, фосфатазами и адаптерными белками (scaffolding proteins);
- Мутации в моторах, адаптерах, или регуляторах могут приводить к нейродегенерации или гибели нейронов (таблица), что согласуется с существенной ролью аксонального транспорта в поддержании гомеостаза нейронов.
Транспорт предшественников синаптических везикул (synaptic vesicle precursors, SVP) и везикул с плотным ядром (dense core vesicles, DCV), содержащих нейропептиды и нейротрофины, регулируется и осуществляется по-разному.
SVP транспортируются кинезинами третьего семейства, а именно KIF1A; было показано, что у мышей с нокаутом по соответствующему гену не происходит нормального развития синапсов. Адаптерами для них служат белки липрин-α и DENN/MADD, обладающие специфичностью к SVP и к кинезинам-3. Антероградный транспорт DCV происходит по тому же механизму, при этом регуляция осуществляется с помощью циклин-зависимой киназы 5, что активирует кинезины, обеспечивая однонаправленный транспорт.
В то же время, DCV, содержащие BDNF (нейротрофический фактор мозга), должны быть способны двигаться в обоих направлениях, в зависимости от контекста. Куда пойдет везикула решается с помощью ковалентных модификаций белка хантингтина (huntingtin, гентингтин). Дефосфорилированный, он увеличивает активность динеина, происходит ретроградный транспорт, а если же серин в 421 положении фосфорилируется, активируется кинезин-1, и везикула начинает быстро двигаться к пресинаптической терминали.
Транспорт различных сигнальных молекул, синтезируемых тканями, иннервирующихся конкретным нервом, начинается с их связывания с рецепторами на пресинаптической мембране, а затем они движутся по направлению к соме нейрона. К примеру, нейротрофины связываются со своими рецепторами (TrkA, B, C, p75), происходит их эндоцитоз, потом образуются так называемые сигнальные эндосомы, транспортируемые посредством динеин-динактиновых комплексов в тело нейрона.
Митохондрии, «энергетические станции», а также депо кальция клетки, тоже движутся в обоих направлениях, в зависимости от контекста. При повышении концентрации кальция, что наблюдается в местах повышенной синаптической активности, митохондрии перестают двигаться, в свою очередь положительно модулируя высвобождение SVP, обеспечивая тем самым стабильность амплитуд возбуждающего постсинаптического потенциала.
Ионы кальция связываются с митохондриальной Rho-ГТФ-азой (MIRO), связанной с адаптерными белками кинезинов-1 TRAK1 и 2, в результате чего ингибируется активность ассоциированной с ней моторной единицы кинезина-1. Белок синтафиллин, тоже реагирующий на повышение концентрации кальция, взаимодействует как с кинезином-1, так и с микротрубочками, что приводит к аналогичному эффекту. В то же время синтабулин, FEZ1 и некоторые другие белки повышают подвижность митохондрий; но работают ли они независимо, связаны ли с комплексом MIRO/TRAK, пока неизвестно.
Описанные карго движутся «быстро», но огромное число синтезированных сомой белков — нейрофиламентов и пр. транспортируется медленным способом. Очень медленным: расстояние в 1 м некоторые белки проходят больше чем за три месяца, а темп такой в силу того факта, что короткие «перебежки» чередуются с длительными паузами, хотя в движении и участвуют такие мощные моторы, как кинезин-1.
Источники:
- Maday S. et al. Axonal transport: cargo-specific mechanisms of motility and regulation //Neuron. – 2014. – Т. 84. – №. 2. – С. 292-309.
- Lawrence C. J. et al. A standardized kinesin nomenclature //The Journal of cell biology. – 2004. – Т. 167. – №. 1. – С. 19-22.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Axonal transport proteins: What they are and how they relate to depressive behaviors
Arezo Nahavandi, Soraya Mehrabi, in The Neuroscience of Depression, 2021
Abstract
Axonal transport system is a fundamental platform, necessary for viability of neurons, because of their long extended branches. Disturbed axonal transport will shut down the transport system and neural tissue will collapse rapidly, exactly the same as a town with lack of any transport system in its roads. The most important axonal transport proteins are: kinesin, dynein, and myosin with different types of family member.
Axonal transport plays role in nearly all physiologic activities in nervous system, from the most basal needs, such as mitochondrial distribution up to highly specialized functions like neurogenesis, synaptogenesis, and plasticity. Impairment of different subtypes of axonal transport proteins result in different neuroinflammatory and neurodegenerative diseases. In rat model of depressive-like behavior, impairment of kinesin-1 and dynein has been confirmed. Various factors play role in pathogenesis of MDD, including: biogenic monoamines, genetics, stress, environmental situations, neurodegeneration, synaptic transmission, synaptogenesis, axonal guidance, neurogenesis, glucocorticoids, and their receptors, which are all linked to axonal transport system and axonal transport proteins. More studies are necessary to clear the role axonal transport proteins more widely and excisely in MDD.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128179352000180
Metals
Luigi Manzo MD, in Neurobiology of Disease, 2007
A. Neurons and Their Processes
Axonal transport processes represent important targets for certain toxic metals. Lead, manganese, and inorganic mercury accumulate in neurons after retrograde axonal transport from the periphery to neuronal somata. Studies in rats have demonstrated that cadmium is transported from the olfactory primary sensory neurons to the olfactory bulb. Retrograde transport of cadmium from the olfactory epithelium to the bulb could be a mechanism by which cadmium induces anosmia in humans.
Thallium and arsenic are examples of metals that perturb axonal transport mechanisms and interrupt normal intra-axonal flow of materials along central and peripheral nervous system fibers. These processes may have an important role in the mechanisms underlying thallium-and arsenic-induced peripheral neuropathy, as illustrated later.
Axonal transport is also affected in methylmercury and cisplatin toxicity, but the peripheral nerve alterations caused by these metals seem to involve somal synthesis and processing rather than distal axons [2].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780120885923500724
Mechanisms of Memory
Gabriel S. Stephens, … Jeannie Chin, in Learning and Memory: A Comprehensive Reference (Second Edition), 2017
4.04.3.1.2 Vesicle Transport
Axonal transport of neurotransmitter-containing vesicles, neurosecretory granules, mitochondria, and other neuronal components are necessary for presynaptic homeostasis and function. Axonal transport is impaired in many neurodegenerative diseases, including AD (reviewed in Millecamps and Julien, 2013).
Tau regulates the speed of axonal transport by inhibiting the activity of the molecular transport “motors” kinesin and dynein, which move vesicular cargo and organelles through the axon on microtubule filaments (Dixit et al., 2008). Many mouse models of AD and human patients exhibit hyperphosphorylated tau (see section Tau). Increased levels of hyperphosphorylated tau impairs axonal transport, resulting in cytoskeletal abnormalities that impair anterograde transport of ER, mitochondria, and vesicles to the presynaptic compartment (Ebneth et al., 1998; Shahpasand et al., 2012).
Aβ also impairs axonal transport (Pigino et al., 2009). Cultured hippocampal neurons exposed to Aβ exhibit impaired vesicular and mitochondrial transport to the presynaptic compartment (Decker et al., 2010; Rui et al., 2006). These transport deficits appear to be mediated by increases in the activity of GSK-3β, which decreases kinesin-mediated axonal transport in vitro, and in vivo in a PS1 mouse model (Decker et al., 2010; Pigino et al., 2003). Aβ-induced increases in GSK-3β activity depend on tau, but do not depend on tau’s microtubule binding or Fyn interactions and instead depend on neuronal activity, suggesting that axonal transport problems arise instead from aberrant neuronal activity in the context of AD (Kanaan et al., 2012; Vossel et al., 2015).
Increases in GSK-3β activity and expression impair LTP and spatial memory, both of which can be rescued with GSK-3β inhibitors (Hernandez et al., 2002; Hooper et al., 2007; Hu et al., 2009; Zhu et al., 2007). LTP deficits occur alongside reductions in presynaptic glutamate release and a reduction in synapsin I clustering/expression, implying that fewer vesicles may be available at the presynaptic compartment due to reduced axonal transport (Zhu et al., 2007). These results suggest that deficient axonal transport and aberrant GSK-3β activity may decrease presynaptic efficiency and reduce memory-related mechanisms of plasticity (see also section Glycogen Synthase Kinase 3β).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128093245211267
Cytoplasmic Dynein Dysfunction and Neurodegenerative Disease
Armen J. Moughamian, Erika L.F. Holzbaur, in Dyneins, 2012
23.6.2 Huntington’s Disease
Axonal transport deficits have also been noted in models of HD [75]. The disease-associated protein huntingtin binds directly to dynein and also associates with both dynactin and kinesin-1 [43]. The phosphorylation state of huntingtin affects its association with kinesin, leading to a model in which huntingtin acts as switch for bidirectional transport [76] and thus affects the efficiency of delivery and/or uptake of the essential neurotrophic factor BDNF [77]. Expression of mutant huntingtin in patients with HD may disrupt this regulation, leading to defects in axonal transport [44].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123820044100238
Viral Vector Axonal Uptake and Retrograde Transport: Mechanisms and Applications
Qingshan Teng, … Nicholas M. Boulis, in Gene Therapy of the Central Nervous System, 2006
VIII. CONCLUSION
Axonal transport is a physiological process involving material transfer between cell body and the axonal terminal of neurons. Depending upon the direction of the material flow, axonal transport is divided into anterograde and retrograde axonal transport. Retrograde axonal transport is not only used to transfer physiological materials back to the cell body from the periphery, but also is an important pathway for some neurotropic viruses to invade the CNS. Taking advantage of the retrograde transport property of the neurotropic viruses, genetically modified neurotropic and non-neurotropic viral vectors could be used to target a specific projection neuronal population from a peripheral site. These molecular trojan horses possess the ability to ferry therapeutic DNA molecules into a specific cell population in a non-invasive fashion. Gene delivery via retrograde transport pathway could serve as an important therapeutic option for the treatment of pain, neuropathy, spasticity, and neurodegenerative diseases including ALS, Alzheimer’s disease and Parkinson’s disease.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123976321500216
Advances in our Understanding of Neurodegeneration
Kurt A. Jellinger, in Oxidative Stress and Neurodegenerative Disorders, 2007
Axonal transport in AD and tauopathies
Axonal transport is impaired in AD and other tauopathies (10,224,224a), probably early in their pathogenesis (201). Defects in APP, from which Aβ peptides are generated by proteolytic processing, travels via fast axonal transport and in vesicular complexes containing presenilin and BACE. It acts as a receptor for the anterograde motor kinesin, and misregulation of APP, either directly from APP mutation, as in familial AD – e.g. mutations in presenilin – can transduce into misregulation of fast axonal transport leading to neurodegeneration (223). On the other hand, tau is a microtubule-binding protein that, after its hyperphosphorylation and segregation into tangles, is unable to bind microtubuli, causing their destabilization and, thereby, disrupting axonal transport. Mice expressing human ApoE4, a gene whose allelic state is associated with an increased risk for AD, exhibit defects in axonal transport (225), and bind to JIP 1/2, a protein mediating the binding of APP to kinesin, also leading to defects in fast axonal transport. Phosphorylation of neurofilament heavy chains (NFHs) also shows neurofilament axonal transport, and this is due to increased pausing of neurofilament movement (226). Mice expressing the human tau mutation R406W, which is pathogenic for familial dementia with parkinsonism linked to chromosome 17 (FTDP-17), show retarded transport leading to tau accumulation (227). Whether misregulation of axonal transport has a direct role in the pathogenesis of these disorders or is a secondary phenomenon in leading to axonal degeneration remains to be elucidated.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444528094501423
Peripheral nervous system toxicity biomarkers
T.V. Damodaran, in Biomarkers in Toxicology, 2014
Biomarkers of altered axonal transport
Axon transport mechanisms play a major role in transporting nutrients, organelles and other molecules towards the presynaptic terminals by a process called anterograde transport, while the retrograde transport is a process by which damaged organelles and recycled plasma membrane (packed in endocytotic vesicles) are transported back to the neuron cell body. There are many major human neurodegenerative pathological disorders, such as Alzheimer’s disease, Parkinson’s disease, and amyotrophic lateral sclerosis (ALS), that display axonal pathologies including abnormal accumulations of proteins and organelles, highlighting that disruption of axonal transport is an early and perhaps causative event in many of these diseases. Several studies on neurodegenerative disorders have shown that defects in axonal transport are early pathogenic events in a number of human neurodegenerative diseases (De Vos et al., 2008). Similarly, defective axonal transport has been shown to be involved in organophosphate-induced delayed neurotoxicity (OPIDN) (Damodaran et al., 2011).
Disruption to axonal transport can occur via a number of routes (De Vos et al., 2008). These disruptions include damage to (a) molecular motors, (b) microtubules, (c) cargoes (such as inhibiting their attachment to motors), and (d) mitochondria, which supply energy for molecular motors (De Vos et al., 2008). At cellular and tissue level axonal degeneration accompanied by synergistic neuronal and glial cell death pathways (e.g. apoptosis, necrosis, autophagy) have been implicated as major factors in neurotoxicity (Damodaran et al., 2011).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124046306000105
The Human Hypothalamus: Anterior Region
Atoossa Fahimi, … Ahmad Salehi, in Handbook of Clinical Neurology, 2021
Abnormal tracks
Axonal transport takes place on MTs that run the length of the axon, which can be up to 1 m long. These tubular polymers are composed of α- and β-tubulin heterodimers. As mentioned previously, abnormal phosphorylation of tau weakens its association with MTs, form insoluble aggregates that can fill the entire intracellular space of a neuron within neuronal soma and dendrites and compromises its stabilizing function (Chesser et al., 2013). Hyperphosphorylated tau proteins have a reduced affinity for MTs and can sequester normal tau protein into filaments and thereby promote destabilization and disassembly of MTs (Alonso et al., 1996). MT-binding properties of the tau protein can affect axonal formation, maintenance, and transport. A multitude of evidence suggests that the accumulation of normal or abnormal tau with or without disassembled MT leads to failed axonal transport and thus traffic jam (Butzlaff et al., 2015). Several drugs including colchicine and nocodazole that disrupt the polymerization of tubulin monomers have shown to lead to a significant delay in axonal transport in both directions (Melemedjian et al., 2014). Theoretically, abnormal tracks should lead to a bidirectional failure in axonal transport. For these reasons, similar to blocking the path, abnormal tracks might not be the primary cause of failed NGF-TrkA retrograde transport.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012819975600011X
Functions and dynamics of axonal mitochondria in development
Gianluca Gallo, in Factors Affecting Neurodevelopment, 2021
Key facts of axonal transport
- •
-
Axonal transport is bidirectional and mediated in the anterograde direction by members of the kinesin family of microtubule-associated motor proteins and in the retrograde direction by dynein, also a microtubule-associated motor protein.
- •
-
Axonal transport occurs at varied rates and is generally classified as ‘slow’ or ‘fast’ depending on the net displacement of the cargoes over prolonged time periods. However, recent data on the forms of transport suggest that slow transport are mediated by the same motor systems as fast transport, but the cargoes spend less time engaging the motor systems.
- •
-
Motor proteins associate with organelles through adaptor proteins.
- •
-
Motor adaptor proteins can regulate the activity or binding to microtubules of the motor proteins.
- •
-
Axonal transport can be regulated by extracellular signals.
- •
-
Axonal transport is required for neuronal morphogenesis.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128179864000067
Neuron
Maryann E. Martone, Mark H. Ellisman, in Encyclopedia of the Human Brain, 2002
IV.D.1 Axonal Transport
Axonal transport, the process by which protein complexes and membranous organelles are transported within axons, has been studied extensively. Axons are capable of bidirectional transport. Transport from the soma to the distal axon is known as anterograde transport, whereas transport from distal regions back to the soma is known as retrograde transport. Axonal transport is an energy-dependent process that involves microtubules and the microtubule-based motor proteins, the dyneins and kinesins. Several distinct components have been identified in axonal transport, which differ in their cargoes and the rate of transport. Small membrane-bound organelles such as clear-lumened vesicles and vesiculotubular structures are transported out of the cell soma in the fast component, capable of moving up to 100 mm/day. Larger membrane-bound structures such as multivesicular bodies carry materials back to the cell body and are also transported by a fast mechanism. Mitochondria move independently of the anterograde and retrograde flows, and the axoplasmic reticulum is stationary relative to fast transport. Cytoskeletal and cytoplasmic proteins are transported much more slowly, on the order of 1–10 mm/day.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0122272102002454
Аксонов транспорт , называемый также аксонный транспортом или axoplasmic потоком , является клеточным процессом , ответственным за движение митохондрий , липидов , синаптических везикул , белков и других органелл к и от нейрона «ы клетки тело , через цитоплазму его аксон называется аксоплазм . Поскольку некоторые аксоны имеют длину порядка метров, нейроны не могут полагаться на диффузию, чтобы переносить продукты ядра и органелл к концам своих аксонов. Аксональный транспорт также отвечает за перемещение молекул, предназначенных для деградации, от аксона обратно в тело клетки, где они расщепляются лизосомами .
Динеин , моторный белок, ответственный за ретроградный аксональный транспорт, переносит везикулы и другие клеточные продукты к телам нейронов. Его легкие цепи связывают груз, а его шаровидные области головы связывают микротрубочку , «двигаясь» вдоль нее.
Движение к телу клетки называется ретроградным транспортом, а движение к синапсу — антероградным транспортом.
Механизм
Подавляющее большинство аксональных белков синтезируется в теле нейрональных клеток и транспортируется по аксонам. Некоторая трансляция мРНК была продемонстрирована в аксонах. Транспорт аксонов происходит на протяжении всей жизни нейрона и необходим для его роста и выживания. Микротрубочки (состоящие из тубулина ) проходят по длине аксона и служат основными «дорожками» цитоскелета для транспортировки. Кинезин и динеин являются моторными белками, которые перемещают грузы в антероградном (вперед от сомы к кончику аксона) и ретроградном (назад к соме (тело клетки)) направлениях, соответственно. Моторные белки связывают и транспортируют несколько различных грузов, включая митохондрии , полимеры цитоскелета , аутофагосомы и синаптические везикулы, содержащие нейротрансмиттеры .
Транспорт аксонов может быть быстрым или медленным, а также антероградным (от тела клетки) или ретроградным (перенос материалов от аксона к телу клетки).
Быстрый и медленный транспорт
Везикулярные грузы перемещаются относительно быстро (50–400 мм / день), тогда как транспорт растворимых (цитозольных) и цитоскелетных белков занимает гораздо больше времени (перемещение менее 8 мм / день). Основной механизм быстрого аксонального транспорта был понят в течение десятилетий, но механизм медленного аксонального транспорта стал ясен только недавно, в результате передовых методов визуализации . Методы флуоресцентного мечения (например, флуоресцентная микроскопия ) сделали возможным прямую визуализацию транспорта в живых нейронах. (См. Также: Антероградное отслеживание .)
Недавние исследования показали, что движение цитоскелетных «медленных» грузов на самом деле происходит быстро, но в отличие от быстрых грузов, они часто останавливаются, что значительно снижает общую скорость транзита. Этот механизм известен как модель медленного аксонального транспорта «Stop and Go» и был широко подтвержден для транспорта нейрофиламента белка цитоскелета. Движение растворимых (цитозольных) грузов является более сложным, но, по-видимому, имеет аналогичную основу, когда растворимые белки организуются в мультибелковые комплексы, которые затем передаются посредством временных взаимодействий с более быстро движущимися грузами, перемещающимися в быстром аксональном транспорте. Аналогия — разница в расценках на проезд между местными и скоростными поездами метро. Хотя оба типа поездов движутся между станциями с одинаковой скоростью, пригородным поездом требуется гораздо больше времени, чтобы добраться до конца линии, потому что он останавливается на каждой станции, тогда как экспресс делает только несколько остановок в пути.
Антероградный транспорт
Антероградный (также называемый «ортоградным») перенос — это движение молекул / органелл наружу от тела клетки (также называемого сомой ) к синапсу или клеточной мембране .
Антероградное движение отдельных грузов (в транспортных пузырьках ) как быстрых, так и медленных компонентов вдоль микротрубочек опосредуется кинезинами . Некоторые кинезины участвуют в медленном транспорте, хотя механизм генерации «пауз» при прохождении медленных компонентных грузов все еще неизвестен.
Существует два класса медленного антероградного транспорта: медленный компонент a (SCa), который переносит в основном микротрубочки и нейрофиламенты на 0,1-1 мм в день, и медленный компонент b (SCb), который переносит более 200 различных белков и актин со скоростью до 6 миллиметров в день. Медленный компонент b, который также несет актин, транспортируется в аксонах клеток сетчатки со скоростью 2-3 миллиметра в день.
Во время латентной реактивации вирус простого герпеса (ВПГ) входит в свой литический цикл и использует механизмы антероградного транспорта для миграции от нейронов ганглиев задних корешков к коже или слизистой оболочке, на которые он впоследствии влияет.
Рецептор карго для моторов антероградного транспорта, кинезины, был идентифицирован как белок-предшественник амилоида (АРР), родительский белок, который продуцирует сенильные бляшки, обнаруживаемые при болезни Альцгеймера. Пептид из 15 аминокислот на карбоксильном конце цитоплазмы АРР связывается с высоким сродством с обычным кинезином-1 и опосредует транспорт экзогенного груза в гигантском аксоне кальмара.
Марганец, контрастный агент для T 1- взвешенной МРТ, перемещается антероградным транспортом после стереотаксической инъекции в мозг экспериментальных животных и, таким образом, выявляет схему с помощью МРТ всего мозга у живых животных, как это было впервые сделано Робией Паутлер, Элейн Беэр и Руссом Джейкобсом. Исследования на мышах с нокаутом легкой цепи кинезина-1 показали, что Mn 2+ перемещается посредством транспорта на основе кинезина в зрительном нерве и в головном мозге. Транспорт как в проекциях гиппокампа, так и в зрительном нерве также зависит от APP. Транспорт из гиппокампа в передний мозг уменьшается с возрастом, а место назначения изменяется из-за наличия бляшек болезни Альцгеймера.
Ретроградный транспорт
Ретроградный транспорт перемещает молекулы / органеллы от концов аксонов к телу клетки . Ретроградный аксональный транспорт опосредуется цитоплазматическим динеином и используется, например, для отправки химических сообщений и продуктов эндоцитоза, направляемых к эндолизосомам от аксона обратно в клетку. При работе со средней скоростью in vivo примерно 2 мкм / сек быстрый ретроградный транспорт может покрывать 10-20 сантиметров в день.
Быстрый ретроградный транспорт возвращает использованные синаптические пузырьки и другие материалы в сому и сообщает соме о состояниях на окончаниях аксонов. Ретроградный транспорт переносит сигналы выживания из синапса обратно в тело клетки, такие как TRK, рецептор фактора роста нервов. Некоторые патогены используют этот процесс для вторжения в нервную систему. Они входят в дистальные кончики аксона и перемещаются к соме ретроградным транспортом. Примеры включают столбнячный токсин и вирусы простого герпеса, бешенства и полиомиелита. При таких инфекциях задержка между заражением и появлением симптомов соответствует времени, необходимому для того, чтобы патогены достигли соматических клеток. Вирус простого герпеса перемещается по аксонам в обоих направлениях в зависимости от его жизненного цикла, при этом полярность ретроградного транспорта доминирует для поступающих капсидов.
Последствия прерывания
Когда аксональный транспорт ингибируется или прерывается, нормальная физиология становится патофизиологией , что может привести к накоплению аксоплазмы, называемой аксональным сфероидом . Поскольку аксональный транспорт может быть нарушен множеством способов, аксональные сфероиды можно увидеть при многих различных классах заболеваний, включая генетические, травматические, ишемические, инфекционные, токсические, дегенеративные и специфические заболевания белого вещества, называемые лейкоэнцефалопатиями . Несколько редких нейродегенеративных заболеваний связаны с генетическими мутациями в моторных белках, кинезине и динеине , и в этих случаях, вероятно, транспорт аксонов играет ключевую роль в опосредовании патологии. Дисфункциональный аксональный транспорт также связан со спорадическими (распространенными) формами нейродегенеративных заболеваний, таких как болезнь Альцгеймера и Паркинсона . Это в основном связано с многочисленными наблюдениями, что большие скопления аксонов неизменно наблюдаются в пораженных нейронах, и что гены, о которых известно, что они играют роль в семейных формах этих заболеваний, также предположительно играют роль в нормальном аксональном транспорте. Однако прямых доказательств участия аксонального транспорта в последних заболеваниях мало, и другие механизмы (такие как прямая синаптотоксичность) могут быть более актуальными.
Остановка аксоплазматического кровотока на краю ишемических участков при сосудистых ретинопатиях приводит к набуханию нервных волокон, что приводит к образованию мягкого экссудата или ватных пятен.
Поскольку аксон зависит от аксоплазматического транспорта жизненно важных белков и материалов, повреждение, такое как диффузное повреждение аксона , которое прерывает транспортировку, вызовет дегенерацию дистального отдела аксона в процессе, называемом валлеровской дегенерацией . Лекарства от рака, которые препятствуют развитию рака , изменяя микротрубочки (которые необходимы для деления клеток ), повреждают нервы, потому что микротрубочки необходимы для транспорта аксонов.
Инфекционное заболевание
Вирус бешенства достигает центральной нервной системы путем ретроградного axoplasmic потока. Столбнячный нейротоксин интернализуется в нервно-мышечном соединении посредством связывания белков нидогена и ретроградно транспортируется к соме в сигнальных эндосомах. Нейротропные вирусы, такие как герпесвирусы, перемещаются внутри аксонов с помощью клеточного транспортного механизма, как было показано в работе группы Элейн Беарэр. Другие инфекционные агенты также подозреваются в использовании аксонального транспорта. В настоящее время считается, что такие инфекции способствуют развитию болезни Альцгеймера и других нейродегенеративных неврологических расстройств.
Смотрите также
- Внутрилагеллярный транспорт
использованная литература
-
^
Sabry J, O’Connor Т.П., Киршнер МВт (июнь 1995). «Аксональный транспорт тубулина в пионерных нейронах Ti1 in situ» . Нейрон . 14 (6): 1247–56. DOI : 10.1016 / 0896-6273 (95) 90271-6 . PMID 7541635 . - ^ а б в г Озтас Э (2003). «Нейрональная трассировка» (PDF) . Нейроанатомия . 2 : 2–5. Архивировано (PDF) из оригинала 25 октября 2005 г.
- Перейти ↑ Karp G, van der Geer P (2005). Клеточная и молекулярная биология: концепции и эксперименты (4-е изд.). Джон Вили. п. 344 . ISBN 978-0-471-46580-5.
- ^ a b Медведь MF, Коннорс Б.В., Парадсо Массачусетс (2007). Неврология: исследование мозга (3-е изд.). Липпинкотт Уильямс и Уилкинс. п. 41 . ISBN 978-0-7817-6003-4.
- ^ Giustetto МЫ, Хедж А.Н., Si , К, Casadio А, Inokuchi К, Пейте Вт, Кандел Е. Р., Шварц Дж (ноябрь 2003 г.). «Аксональный транспорт мРНК фактора элонгации трансляции 1альфа эукариот связывает транскрипцию в ядре с долгосрочным облегчением в синапсе» . Труды Национальной академии наук Соединенных Штатов Америки . 100 (23): 13680–5. Bibcode : 2003PNAS..10013680G . DOI : 10.1073 / pnas.1835674100 . PMC 263873 . PMID 14578450 .
- ^ SiК, Giustetto Si , К, М Giustetto, Etkin А, R Хсу, Janisiewicz А.М., Miniaci МС, Ким И. Н., Чжу Н, Кандел ЭР (декабрь 2003 г.). «Нейрональная изоформа CPEB регулирует локальный синтез белка и стабилизирует синапс-специфическое долгосрочное облегчение при аплизии» . Cell . 115 (7): 893–904. DOI : 10.1016 / s0092-8674 (03) 01021-3 . PMID 14697206 . S2CID 15552012 .
- ^ Мадай, Сандра; Twelvetrees, Элисон Э .; Мугамян, Армен Дж .; Хольцбаур, Эрика Л.Ф. (октябрь 2014 г.). «Аксональный транспорт: специфические для груза механизмы движения и регуляции» . Нейрон . 84 (2): 292–309. DOI : 10.1016 / j.neuron.2014.10.019 . PMC 4269290 . PMID 25374356 .
- ^ a b c d Рой С., Чжан Б., Ли В.М., Трояновский JQ (январь 2005 г.). «Дефекты аксонального транспорта: общая тема нейродегенеративных заболеваний». Acta Neuropathologica . 109 (1): 5–13. DOI : 10.1007 / s00401-004-0952-х . PMID 15645263 . S2CID 11635065 .
- ↑ Brown A (март 2003 г.). «Аксональный транспорт мембранных и немембранозных грузов: единая перспектива» . Журнал клеточной биологии . 160 (6): 817–21. DOI : 10,1083 / jcb.200212017 . PMC 2173776 . PMID 12642609 .
- Перейти ↑ Scott DA, Das U, Tang Y, Roy S (май 2011 г.). «Механистическая логика, лежащая в основе аксонального транспорта цитозольных белков» . Нейрон . 70 (3): 441–54. DOI : 10.1016 / j.neuron.2011.03.022 . PMC 3096075 . PMID 21555071 .
- ^ Рой S, Уинтон MJ, Черный MM, Trojanowski JQ, Ли В.М. (март 2007). «Быстрый и прерывистый котранспорт медленных белков компонента-b» . Журнал неврологии . 27 (12): 3131–8. DOI : 10.1523 / JNEUROSCI.4999-06.2007 . PMC 6672457 . PMID 17376974 .
- ^ Кузнецов А.В. (2011). «Аналитическое решение уравнений, описывающих медленный аксональный транспорт на основе гипотезы остановки и движения» . Центральноевропейский физический журнал . 9 (3): 662–673. Bibcode : 2011CEJPh … 9..662K . DOI : 10.2478 / s11534-010-0066-0 .
- ^ Holland DJ, Miranda-Саксен M, Boadle RA, Арматьте P, Cunningham AL (октябрь 1999). «Антероградный транспорт белков вируса простого герпеса в аксонах периферических нейронов плода человека: исследование иммуноэлектронной микроскопии» . Журнал вирусологии . 73 (10): 8503–11. DOI : 10,1128 / JVI.73.10.8503-8511.1999 . PMC 112870 . PMID 10482603 .
- ^ Satpute-Кришнан P, DeGiorgis JA, Конли MP, Jang M, Знаменосец EL (октябрь 2006). «Пептидный почтовый индекс, достаточный для антероградного транспорта в пределах белка-предшественника амилоида» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (44): 16532–7. Bibcode : 2006PNAS..10316532S . DOI : 10.1073 / pnas.0607527103 . PMC 1621108 . PMID 17062754 .
- ^ Seamster ПЭ, Loewenberg М, Паскаль Дж, Chauviere А, Гонзэйлс А, Cristini В, Bearer ЭЛ (октябрь 2012 г.). «Количественные измерения и моделирование грузомоторных взаимодействий при быстрой транспортировке в живом аксоне» . Физическая биология . 9 (5): 055005. Bibcode : 2012PhBio … 9e5005S . DOI : 10.1088 / 1478-3975 / 9/5/055005 . PMC 3625656 . PMID 23011729 .
- ^ Gallagher JJ, Zhang X, Ziomek GJ, Jacobs RE, Знаменосец EL (апрель 2012). «Дефицит аксонального транспорта в цепи на основе гиппокампа и зрительный путь у животных с нокаутом APP, подтвержденный МРТ с усилением марганца» . NeuroImage . 60 (3): 1856–66. DOI : 10.1016 / j.neuroimage.2012.01.132 . PMC 3328142 . PMID 22500926 .
- ↑ Bearer EL, Manifold-Wheeler BC, Medina CS, Gonzales AG, Chaves FL, Jacobs RE (октябрь 2018 г.). «Изменения функциональной схемы в стареющем мозге и влияние мутировавшего выражения APP» . Нейробиология старения . 70 : 276–290. DOI : 10.1016 / j.neurobiolaging.2018.06.018 . PMC 6159914 . PMID 30055413 .
- ↑ Гиббс К.Л., Кальмар Б., Сани Дж. Н., Гринсмит Л., Скьяво Г. (январь 2016 г.). «Визуализация in vivo аксонального транспорта в моторных и сенсорных нейронах мышей» . Журнал методов неврологии . 257 : 26–33. DOI : 10.1016 / j.jneumeth.2015.09.018 . PMC 4666412 . PMID 26424507 .
- Перейти ↑ Sleigh J, Schiavo G (2016). «Старше, но не медленнее: старение не влияет на динамику аксонального транспорта сигнальных эндосом in vivo» . Имеет значение . 2 (6). DOI : 10,19185 / matters.201605000018 .
- Перейти ↑ Cui B, Wu C, Chen L, Ramirez A, Bearer EL, Li WP, Mobley WC, Chu S (август 2007 г.). «Одно за другим, отслеживание в реальном времени аксонального транспорта NGF с использованием квантовых точек» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (34): 13666–71. Bibcode : 2007PNAS..10413666C . DOI : 10.1073 / pnas.0706192104 . PMC 1959439 . PMID 17698956 .
- ^ Саладин, Кеннет. Анатомия и физиология: единство формы и функции. Шестое. Нью-Йорк: Макгроу-Хилл, 2010. 445. Печать.
- ^ Bearer EL, Breakefield XO, Schuback D, Риз TS, LaVail JH (июль 2000). «Ретроградный аксональный транспорт вируса простого герпеса: доказательства единственного механизма и роли тегумента» . Труды Национальной академии наук Соединенных Штатов Америки . 97 (14): 8146–50. Bibcode : 2000PNAS … 97.8146B . DOI : 10.1073 / pnas.97.14.8146 . PMC 16684 . PMID 10884436 .
- ^ Мадай S, Twelvetrees А.Е., Moughamian AJ, Holzbaur EL (октябрь 2014). «Аксональный транспорт: грузо-специфические механизмы движения и регуляции» . Нейрон . 84 (2): 292–309. DOI : 10.1016 / j.neuron.2014.10.019 . PMC 4269290 . PMID 25374356 .
- ^ Сани Ю.Н., Rossor А.М., Fellows А.Д., Tosolini А.П., Schiavo G (декабрь 2019). «Аксональный транспорт и неврологические заболевания» . Nat Rev Neurol . 15 (12): 691–703. DOI : 10.1038 / s41582-019-0257-2 . PMID 31558780 . S2CID 203437348 .
- ^ Mitrabhakdi Е, Shuangshoti S, Wannakrairot Р, Льюис Р., Susuki К, Laothamatas Дж, Hemachudha Т (ноябрь 2005 г.). «Различие нейропатогенетических механизмов при бешеном и паралитическом бешенстве человека». Журнал неврологических наук . 238 (1-2): 3-10. DOI : 10.1016 / j.jns.2005.05.004 . PMID 16226769 . S2CID 25509462 .
- ^ Bercsenyi K, Schmieg N, Bryson JB, Wallace M, Caccin P, Golding M, Zanotti G, Greensmith L, Nischt R, Schiavo G (ноябрь 2014 г.). «Поступление токсина столбняка. Нидогены являются терапевтическими мишенями для предотвращения столбняка» (PDF) . Наука . 346 (6213): 1118–23. DOI : 10.1126 / science.1258138 . PMID 25430769 . S2CID 206560426 .
- ^ Satpute-Кришнан P, DeGiorgis JA, Знаменосец EL (декабрь 2003). «Быстрый антероградный транспорт вируса простого герпеса: роль белка-предшественника амилоида болезни Альцгеймера» . Ячейка старения . 2 (6): 305–18. DOI : 10.1046 / j.1474-9728.2003.00069.x . PMC 3622731 . PMID 14677633 .
- ↑ Cheng SB, Ferland P, Webster P, Bearer EL (март 2011 г.). «Вирус простого герпеса танцует с белком-предшественником амилоида при выходе из клетки» . PLOS ONE . 6 (3): e17966. Bibcode : 2011PLoSO … 617966C . DOI : 10.1371 / journal.pone.0017966 . PMC 3069030 . PMID 21483850 .
- ^ Bearer EL, Satpute-Кришнан P (сентябрь 2002). «Роль цитоскелета в жизненном цикле вирусов и внутриклеточных бактерий: треки, двигатели и машины полимеризации» . Текущие цели в отношении лекарств. Инфекционные заболевания . 2 (3): 247–64. DOI : 10.2174 / 1568005023342407 . PMC 3616324 . PMID 12462128 .
- ^ Ицхаки РФ, токарный станок R, Балин Б.Дж., Болл М.Дж., предъявитель Э.Л., Браак Х. и др. (2016). «Микробы и болезнь Альцгеймера» . Журнал болезни Альцгеймера . 51 (4): 979–84. DOI : 10,3233 / JAD-160152 . PMC 5457904 . PMID 26967229 .
- ^ «Нет места лучше асфальта для этих выносливых микробов». Новый ученый . 206 (два тысячи семьсот пятьдесят семь): 15. 2010. DOI : 10.1016 / s0262-4079 (10) 60991-8 .