Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Нормальная миелинизация
Основа формирования нормальной миелинизации изложенное Барковичем – ее начало на 5 месяце эмбрионального периода и продолжение в течение всей жизни. Миелинизация начинается с черепных нервов, что имеет смысл, поскольку чувствительность необходима для выживания. Так же стоит учитывать, что миелинизация структур происходит в направлении снизу вверх, от задних структур к передним и от центра к периферии. Логично, что ствол мозга и мозжечок миелинизируются раньше полушарий, а базальные ядра и таламус – раньше белого вещества. Кроме того, задняя ножка внутренней капсулы миелинизируется раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов.
Профессор Серена Каунселл с коллегами описали миелинизацию у сильно недоношенных новорожденных и подтвердили миелинизацию червя мозжечка, вестибулярных ядер, ножек мозжечка, зубчатых ядер, медиального продольного пучка, медиальных коленчатых тел, субталамических ядер, нижних ядер оливы, вентролатеральных ядер таламуса, медиальной и латеральной петель, нижних холмов четверохолмия, а также клиновидного и тонкого пучков. Исследователи не обнаружили никаких новых сайтов миелинизации между 28 и 36 неделями, после чего снова появились новые миелиновые участки в задней ножке внутренней капсулы, лучистом венце и кортикоспинальных трактах предцентральной и постцентральной извилины.
Гистологические исследования демонстрируют миелинизацию при рождении в стволе мозга, белом веществе мозжечка и задней ножке внутренней капсулы с распространением на таламус и базальные ганглии.
Профессор Берд с коллегами проанализировали 60 пациентов и обнаружили значительные различия в скорости и начале появления изменений, связанных с миелинизацией. Исследователи изучали сайты-маркеры для определенных возрастов при определении нормального миелина. Так, при рождении наблюдалась миелинизация задней ножки внутренней капсулы, ножек мозжечка и лучистого венца вокруг центральной борозды. Исследователи снова последовательно подтвердили сроки миелинизации: в задней ножке раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов у всех субъектов.
Томас Паус (2001) описал 3 паттерна развития, наблюдаемые в отношении дифференциации серого-белого вещества в первые 12-24 месяца жизни.
- младенческий паттерн – менее чем за 6 месяцев; картина, противоположная картине взрослого мозга,
- изометрический паттерн (8-12 месяцев), в котором наблюдается плохая дифференциация между серым и белым веществом
- ранний взрослый паттерн (более 12 месяцев), в которых сигнал от серого вещества выше, чем от белого, на Т2-ВИ и ниже на Т1-ВИ.
Валик мозолистого тела миелинизируется примерно к 3 месяцу, тело – к 4-5 месяцу, а колено – к 6 месяцу. На протяжении развития (в первый год) наблюдаются изменения и в форме, и в толщине. У новорожденного утолщение начинается с колена (со 2-3 месяца), затем утолщается валик (с 5-6 месяца), достигая толщины колена к 7 месяцу. Мозолистое тело увеличивается до 12 месяца. На Т1-ВИ валик мозолистого тела имеет повышенную интенсивность сигнала в 4 месяца, когда как колено – в 5-6 месяцев.
Терминальные зоны миелинизации
Последней зоной миелинизации на МРТ является перитригональная зона. Эта область поддерживает постоянную гиперинтенсивность на T2-ВИ, но не интенсивнее серого вещества. Параццини с коллегами описали терминальные зоны миелинизации в лобно-теменных субкортикальных регионах. Было показано, что данная область характеризуется гиперинтенсивным сигналом на Т2-ВИ в течение первых 36-40 месяцев жизни. Что касается идиопатической задержки развития, Маричич с коллегами изучили 93 ребенка и не обнаружил определенных доказательств корреляции между идиопатической задержкой развития и задержкой при миелинизации на Т2-взвешенных изображениях.
Myelination
UELI SUTER, RUDOLF MARTINI, in Peripheral Neuropathy (Fourth Edition), 2005
Regulation of Myelin Genes
Myelination during development and after demyelination demands an extremely high synthesis rate of myelin proteins and lipids within a short period of time. To accomplish this precisely regulated task, the myelination process is guided by the coordinated expression of genes that encode myelin components.185 The principal control of the system is governed by transcription factors. Some of these are present ubiquitously in many cell types, including Schwann cells, whereas others are more specifically expressed. Together, these factors are responsible for the cell type–specific and differentiation stage–specific gene expression, including the regulation of myelination.197 In addition to the pivotal roles of transcription factors in orchestrating the myelination process, additional regulation at the posttranscriptional level by altering mRNA stability is likely, but this possibility has not yet been thoroughly explored experimentally in the PNS. Recent evidence suggests a particularly important role for the close interaction between neurons (axons) and the ensheathing Schwann cells in the regulatory network governing myelination.104,157 This finding may be part of the reason why the use of transcription factors by Schwann cells is quite different from that by oligodendrocytes, the myelinating counterpart in the CNS.197
Several parallel strategies have been employed to examine myelin gene regulation in the PNS. Major efforts have focused on the identification of transcription factors expressed by Schwann cells that might be master regulators of myelin gene expression, as has been found during muscle development (MyoD).20 This hunt has proved to be difficult, but some candidates have been identified. In particular, suppressed cyclic AMP (cAMP)–inducible POU protein (SCIP, Tst-1, Oct-6) plays a critical role in the regulation of PNS myelination because SCIP-deficient mice are characterized by severe congenital hypomyelination of peripheral nerves. However, the defect is transient and the nerves are close to normal at 3 months of age.81 Similarly, the zinc-finger family protein Egr2 (Krox20) appears to be required for the normal development of the myelinating Schwann cell phenotype. Transgenic mice carrying a null mutation in the egr2 gene display severe defects in Schwann cell development resulting in hyperproliferation and presumed differentiation arrest at the premyelination stage.186 Egr2 also regulates the expression of genes involved in PNS myelination.119 In line with these findings, different mutations affecting Egr2 are associated with CMT disease type 1, the Déjèrine-Sottas syndrome, and congenital hypomyelinating neuropathy (see Chapter 72).119,194
Additional transcription factors that may affect late steps in the differentiation of Schwann cells include Pax3, Krox24, and Brn5.157,199 Of particular importance is the transcription factor Sox10, which has been identified as a common transcriptional modulator for SCIP, Krox20, and Pax3. It was suggested that Sox10 is responsible for cell-type specificity by interacting with these transcription factors in developing and mature glia.87 Furthermore, a crucial role of Sox10 in early Schwann cell development has been demonstrated23,126 and reviewed by Lobsiger and colleagues.100 With regard to PNS myelination, Sox10 regulates MPZ (P0) and GJB1 (Cx32) gene expression.19,132 Mutations in each of these genes are responsible for distinct forms of CMT disease (see Chapter 71). Sox10 mutations are associated with Shah-Wardenburg syndrome (WS4), a neurocristopathy with intestinal aganglionosis, pigmentation defects, sensorineural deafness, and, in specific cases, alterations in myelination in the PNS and CNS.80,125,138 These Sox10 mutants are unable to activate the Cx32 promoter and, conversely, a specific mutation in the Cx32 promoter, previously described in a patient with CMT disease, impairs Sox10 function directly.19 This elegant series of studies provides a direct genetic link between the regulation of myelin gene expression by the transcription factors Egr2 and Sox10 and myelin deficiencies in inherited peripheral neuropathies. It suggests that factors involved in the regulation of myelin gene expression should be generally considered as candidates involved in the etiology of peripheral neuropathies. Furthermore, a general concept emerges that correct myelination, myelin maintenance, and axonal maintenance are crucially dependent on the correct expression levels of myelin proteins.13,104
Besides studying the role of transcription factors and their modulators, myelination-related, cell type–specific control can also be elucidated by the identification and characterization of cis-acting control elements of genes encoding myelin components.196 Transfection experiments in cultured Schwann cells have been used as a standard assay in this regard, followed by classic footprinting and bandshift assays to identify the sequences that are bound by transcription factors.24 However, there are limitations with this assay system because Schwann cells that have been kept in culture do not express myelin genes up to the rates that are observed in vivo during development and in regeneration. Co-culturing with neurons is required for myelination, but because of technical restrictions, this system is not well suited for gene transfer analysis. Transgenic mice, however, provide an excellent assay system to examine myelin gene regulation because numerous developmental and physiologic signals for correct interactions are present. Such a strategy has recently led to the identification of Schwann cell–specific enhancers that mediate axonal regulation in SCIP,106 MBP,59 Egr2,69 and PMP22103 genes. Initial results of studies with similar aims have been reported for the 2′,3′-cyclic nucleotide 3′-phosphodiesterase gene,30,73 the P0 gene,52 and the proteolipid protein gene.105 Apart from providing important insights into the molecular basis of the regulation of myelin genes, these studies have also generated important tools to target transgenic expression of genes of choice to Schwann cells.53,143 PMP22, the dosage-sensitive culprit gene of CMT disease type 1A and hereditary neuropathy with liability to pressure palsies, was reviewed by Suter and Snipes.176 Studies on PMP22 gene regulation during myelination may also provide the basis for future therapies.77,207
What are the signal transduction events that regulate Schwann cell myelination, and by which transcriptional effectors? Examination of the role of different signaling pathways in Schwann cell differentiation using Schwann cell–neuron co-cultures revealed that, at early stages, inhibition of phosphatidylinositol 3 (PI3)-kinase, but not myelin-associated protein (MAP) kinase, blocked Schwann cell elongation and subsequent myelination.113 After Schwann cells established a one-to-one relationship with axon segments, inhibition of PI3-kinase did not block myelin formation, but the myelin segments were shorter and the rate of myelin protein accumulation was decreased. PI3-kinase inhibition had no detectable effect on the maintenance of myelin sheaths in mature myelinated co-cultures. Interestingly, glial growth factor (GGF), a neuregulin-1 isoform, significantly inhibited myelination in the same system by preventing axonal segregation and ensheathment.208 Treatment of established myelinated cultures with GGF resulted in striking demyelination. The neuregulin receptors ErbB2 and ErbB3 are expressed on ensheathing and myelinating Schwann cells and are rapidly activated by GGF treatment. GGF treatment of myelinating cultures also induced phosphorylation of PI3-kinase, MAP kinase, and a 120-kDa protein. Thus neuronal mitogens, including neuregulins, may inhibit myelination during development, and activation of mitogen signaling pathways may contribute to the initial demyelination and subsequent Schwann cell proliferation observed in various pathologic conditions.
Surprisingly, functional information about the downstream transcriptional effectors mediating the events described above is still scarce.196 Several AP-1 (dimeric transcription factors of the Jun, Fos, and ATF family of basic leucine zipper proteins) binding sites have been found in putative regulatory regions of myelin genes. However, although c-Jun is expressed by Schwann cells, a direct functional role of AP-1 transcription factors in regulating PNS myelination remains unclear.174 Similarly, the transcription factor CREB (which becomes activated through phosphorylation) is found in Schwann cells, and a protein kinase A–dependent increase of CREB phosphorylation was observed after axonal stimulation and the elevation of cAMP, intracellular calcium, platelet-derived growth factor, or endothelins. Furthermore, β-neuregulin treatment causes sustained CREB phosphorylation, and this effect appears to be mainly dependent on the MAP kinase pathway.179 Although this is strong evidence for a function of CREB in the regulation of Schwann cells, a direct link to myelination has not yet been described. Such a link has been established for progesterone that promotes the myelination of sciatic nerves during regeneration after a cryolesion.86 Progesterone triggers a strong upregulation of Egr1 (Krox24), Egr2, Egr3, and FosB in cultured Schwann cells, most likely at the transcriptional level via the interaction of the hormone with its cognate receptor. Furthermore, neuroactive steroids are able to upregulate the mRNA levels of PMP22 and P0 and, thus, specific receptor ligands or antagonists may be promising candidates for therapeutic approaches in demyelinating inherited neuropathies.101,166
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721694917500223
Nervous System, Neuroembryology of
H.B Sarnat, L. Flores-Sarnat, in Encyclopedia of the Neurological Sciences (Second Edition), 2014
Myelination
Myelination of axons is not absolutely required for neuronal function, and many axons normally remain unmyelinated throughout life. Examples are many autonomic, especially sympathetic, nerves and more than half of the axons of the corpus callosum. Nevertheless, myelination greatly increases speed of conduction, and synaptic blocks may result from inadequate myelination. Myelin sheaths of axons are produced by oligodendrocytes, specialized glial cells derived from the neuroepithelium, in the CNS and by Schwann cells, derived from neural crest, in the peripheral nervous system (PNS). The transition from oligodendrocytes to Schwann cells forming continuous myelin sheaths can be seen at spinal and cranial nerve roots.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123851574010484
Epilepsy
Gregory L. Holmes, … Olivier Dulac, in Handbook of Clinical Neurology, 2012
Developmental changes in myelination
Myelination is an important developmental process that begins during the fifth fetal month with myelination of the cranial nerves, and continues throughout life. The major changes in myelination occur from 3 weeks to 1 year for all brain regions. Myelination appears to occur earliest in the posterior fossa, with the middle cerebellar peduncle identifiable by age 3 months. By the age of 1 year, all major white matter tracts including the corpus callosum, subcortical white matter, and the internal capsule are well defined. In contrast to the high rate of myelination in the first year, the changes between 1 and 2 years are more subtle, although changes in radial diffusivity on diffusion tensor imaging suggest a pruning process. The development of white matter begins from the center to the periphery and from the occipital to the frontal lobes (Gao et al., 2009).
During the first year of life, the magnetic resonance imaging (MRI) white matter signal on T2 changes from hyperintense to hypointense, and vice versa on T1 (Barkovich, 2000). Like other membranes, myelin is composed of a bilayer of lipids with several large proteins, most of which span the bilayer (including myelin basic protein and proteolipid protein). The outer lipid layers are composed mainly of cholesterol and glycolipids, whereas the inner portion of the lipid bilayer is composed mainly of phospholipids. It is thought that the high signal intensity seen on T1-weighted images with the maturation of white matter results from T1 shortening caused by the cholesterol, glycolipids, and possibly the proteins in the outer lipid layers of the membrane, whereas it is thought that the diminishing signal intensity seen on the T2-weighted images with maturation results from a decreased number of water molecules caused by development of the hydrophobic phospholipid inner layer (Svennerholm and Vanier, 1978; Svennerholm et al., 1978; Holland et al., 1986; Barkovich et al., 1988).
The changes in signal intensity in myelin with age may make interpretation of MRI scans in children with epilepsy difficult. Distinguishing leukoencephalopathies from normal age-dependent changes in myelination can be challenging. In addition, how well cortical dysplasias are seen on the MRI may be related to the degree of myelination. In some cortical dysplasias the lesion may be seen better on MRI before extensive myelination occurs (Eltze et al., 2005). However, in some cases cortical dysplasias may be more evident with increased myelination (Yoshida et al., 2008).
In addition to myelination affecting the clinical and EEG features of seizures, epilepsy and its causes may alter myelination. For example, delays in myelination have been seen in children with infantile spasms (Muroi et al., 1996; Natsume et al., 1996; Takano et al., 2007). Children with prenatally or perinatally acquired brain lesions appear to have more severe delays of myelination (Schropp et al., 1994). The mechanism by which seizures alter the rate of myelination is not known.
The myelination pattern may also have a significant role in when infantile spasms begin. Koo et al. (1993) reviewed 93 cases of infantile spasms with focal cerebral lesions confined to frontal, centrotemporoparietal, or occipital regions. The mean age of onset of infantile spasms was around 3 months in patients with occipital lesions, versus 6 months in those with centrotemporoparietal lesions, and 10 months in those with frontal lesions. It is therefore of considerable interest that myelination occurs in the occipital lobe and moves forward into the temporal, parietal, and frontal lobes. The age distribution pattern of spasm onset according to localization of cortical lesion was therefore closely correlated with that of the normal sequence of brain maturation, suggesting that myelination may be necessary for the seizures to occur.
With greater myelination of the frontal lobes there is a greater likelihood of seeing spike–wave discharges arising frontally. Lennox–Gastaut syndrome, with frontal predominantly slow spike–wave discharges, typically does not begin in the first year of life but may evolve from West syndrome as the brain myelinates more fully. Likewise, the development of epilepsy with myoclonic–astatic seizures is an age-related phenomenon, occurring in toddlers but not in infants (Doose, 1992).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444528988000070
Neurons and Their Properties
David L. Felten MD, PhD, … Mary Summo Maida PhD, in Netter’s Atlas of Neuroscience (Third Edition), 2016
1.16 Development of Myelination and Axon Ensheathment
Myelination requires a cooperative interaction between the neuron and its myelinating support cell. Unmyelinated peripheral axons are invested with a single layer of Schwann cell cytoplasm. When a peripheral axon at least 1 to 2 µm in diameter triggers myelination, a Schwann cell wraps many layers of tightly packed cell membrane around a single segment of that axon. In the CNS, an oligodendroglia cell extends several arms of cytoplasm, which then wrap multiple layers of tightly packed membrane around a single segment of each of several axons (or occasionally two autonomic preganglionic axons). Although myelination is a process that occurs most intensely during development, Schwann cells may remyelinate peripheral axons following injury, and oligodendroglial cells may proliferate and remyelinate injured or demyelinated central axons in diseases such as multiple sclerosis.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323265119000011
Structural Brain Development
J.B. Colby, … E.R. Sowell, in Neural Circuit Development and Function in the Brain, 2013
12.2.3 Myelination
Myelination of axonal projections by oligodendroglia is also a prominent component of early brain development. This process begins in utero, continues rapidly through the first 5 years of life, and remarkably extends – although at a slower rate – through young adulthood. Intracortical histological preparations by Kaes in 1907 were some of the first to demonstrate this prolonged trajectory of myelination, along with its striking regional variability in timing (Kaes, 1907; Kemper, 1994). His work not only demonstrated earlier trajectories in some areas (posterior temporal, precentral, and postcentral cortex) than others (superior parietal, anterior temporal, and anterior frontal cortex), but also showed that regions with a more protracted developmental trajectory have more pronounced changes during older age. This has helped to form the ‘first-in-last-out’ theory of aging (Davis et al., 2009), which suggests that higher-order cognitive manifestations (e.g., problem solving and logical reasoning) – some of the last to develop (Luna et al., 2004) – are some of the first to degenerate in old age. Furthermore, the visible spread of myelin outwards into the cortex results in an apparent cortical thinning, which suggests that normal developmental decreases in cortical thickness (discussed in Section 12.4.3) may be due, in part, to this progressive increase in myelin and not simply to regressive changes like synaptic pruning and cell loss (see Rubenstein and Rakic, 2013).
These initial observations in intracortical tissue were extended to the white matter in the pioneering work performed by Yakovlev and Lecours in the 1960s. They demonstrated that white matter myelination begins in utero during the second trimester of pregnancy and continues throughout young adulthood (Yakovlev and Lecours, 1967). Additionally, they extended the earlier observations of regional variations in the timing of myelination and described a general posterior-to-anterior trend in the timing of white matter myelination during development that has also been replicated in other samples (Kinney, 1988). Later independent research, targeting the hippocampal formation, has also noted striking increases in myelination, with a 95% increase observed in the extent of myelination relative to brain weight during the first two decades of life. Surprisingly, the authors noted that expanding myelination continued even through the fourth to sixth decades of life (Benes et al., 1994). Taken together, these observations suggest that structural white matter development, in the form of advancing myelination, proceeds in tune with overall cognitive development – with areas involved in lower-order sensory and motor function myelinating earlier than areas involved with higher-order executive function. This correlated timing implies there may be some relationship between advancing brain function and increased myelination; however, postmortem studies are limited from investigating this directly.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123972675000510
Essays on Developmental Biology, Part A
Carmen Birchmeier, David L.H. Bennett, in Current Topics in Developmental Biology, 2016
3 Entry into the Myelination Program
Myelination is essential for neuronal function, and deficits in myelination cause devastating disease (Nave & Trapp, 2008; Quarles, Macklin, & Morell, 2006; Suter & Scherer, 2003). Myelin electrically insulates axons and allows fast propagation of nerve impulses by saltatory conduction. The overall conduction velocity of the myelinated axon is determined by myelin and axonal thickness, internodal length, and myelin integrity (Court et al., 2004; Waxman, 1980). The overall organization of the myelin sheath is similar in the PNS and CNS, but substantial differences exist in development, assembly, and molecular composition of the myelin, or in the extrinsic signals and transcription factors that drive myelination (Brinkmann et al., 2008; Emery, 2013; Hornig et al., 2013; Quarles et al., 2006). We discuss here the molecular processes active during peripheral myelination.
Myelination is tightly controlled by axons. Only medium and large diameter axons are myelinated, and thin axons (smaller than 1 μm) are ensheathed by nonmyelinating Schwann cells and are organized in bundles (called Remak bundles; Hillarp & Olivecrona, 1946). Thin and thick myelinated axons have thin and thick myelin sheaths, respectively. This leads to the constant G-ratio (defined as ratio of axonal diameter to diameter of the myelinated fiber) of 0.67 (Donaldson & Hoke, 1905). Thus, the axon provides cues that determine its myelination fate and the thickness of its myelin sheath. Conversely, Schwann cell-derived signals allow neuronal survival by providing trophic signals and/or metabolic support (Riethmacher et al., 1997; Viader et al., 2013). Interactions between Schwann cells and axons also guide cell adhesion molecules and ion channels into distinct axonal domains, the nodes of Ranvier and internodes, a prerequisite for efficient saltatory conduction (Eshed-Eisenbach & Peles, 2013). Finally, intact myelin provides signals for radial axonal growth and enhances axonal transport, which is impaired in demyelinating diseases (de Waegh, Lee, & Brady, 1992; Kiryu-Seo, Ohno, Kidd, Komuro, & Trapp, 2010; Saxton & Hollenbeck, 2012; Watson, Nachtman, Kuncl, & Griffin, 1994).
The surface membrane of Schwann cells was estimated to increase during myelination up to several thousand-fold. Therefore, myelination is accompanied by the production of huge amounts of myelin proteins and lipids. The entry into the myelination program in Schwann cells is controlled on the transcriptional level by factors like Egr2 (Krox-20), Pou3f1 (Oct-6/Scip/Tst-1), and Pou3f2 (Brn2) that interact with Sox10 to drive expression of myelin genes (Bermingham et al., 1996; Finzsch et al., 2010; Jaegle et al., 2003; Topilko et al., 1994; see also Svaren & Meijer, 2008, and the references herein). In addition, lipid biosynthesis genes are coordinately regulated, and the Srebp/Scap transcription factors and the control of their expression play important roles in lipid production (Verheijen et al., 2009; Norrmen et al., 2014). Extrinsic signals that trigger entry into myelination are provided by Nrg1/ErbB2/3, GPR126, integrins, extracellular matrix components, and ADAM22/Lgi4 (Bermingham et al., 2006; Nave & Salzer, 2006; Ozkaynak et al., 2010; Raphael & Talbot, 2011; Taveggia, Feltri, & Wrabetz, 2010). Thus, the Nrg1/ErbB2/3 system that regulates expansion of the progenitor pool and migration in early Schwann cell development is unexpectedly reused for myelination. It was therefore discussed whether Nrg1 provides instructive or permissive signals during myelination (Lemke, 2006; Nave & Salzer, 2006).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0070215315001283
Oligodendrocyte Responses, Myelination, and Opioid Addiction Treatments
Carmen Sato-Bigbee, Susan E. Robinson, in Neuropathology of Drug Addictions and Substance Misuse, 2016
Applications to Other Addictions and Substance Abuse
- •
-
Defects in myelination and myelin structure have also been observed in adult individuals exposed to cocaine, cannabinoids, alcohol, and methamphetamines.
- •
-
Perinatal exposure to cocaine has been associated to delayed glial development and brain myelination.
- •
-
Altered glial development and delayed myelination were also observed in fetal alcohol syndrome.
- •
-
Imaging studies also suggested decreased myelination in the brain of children exposed in utero to methamphetamines.
- •
-
Studies in rodents suggested that activation of cannabinoid receptors in the developing brain may accelerate myelination.
- •
-
White matter density changes have been reported in adolescents using cannabinoids although the variability and restricted number of studied individuals preclude clear conclusions on the effects of these drugs on developmental myelination.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012800634400041X
Schwann Cells and Axon Relationship
R.D. Fields, in Encyclopedia of Neuroscience, 2009
Myelination
Myelination begins after Schwann cells exit the cell cycle. In the promyelinating stage, just before beginning to form myelin, Schwann cells begin to increase expression of several myelin proteins, including myelin-associated glycoprotein (MAG) and myelin protein zero. The latter is the most abundant protein in peripheral nerve, and it is responsible for maintaining the compact layers of myelin together. A different protein, proteolipid protein, performs this function in central nervous system myelin.
The process of myelination begins by a Schwann cell first engulfing several axon segments at once (Figure 1(a)). These are sorted out until the cell selects only one axon segment to wrap with myelin (Figure 1(b)). Formation of extracellular matrix is an essential early step in the process, and in cell culture, myelination will not commence until ascorbic acid is added to the medium to promote formation of the basal lamina (Figure 1, black arrows). Laminin-2 is a major component of basement membrane, and mutations in α2 laminin cause dysmyelination. β1 integrin is one of the laminin receptors on Schwann cells, and animals lacking this receptor fail to establish the one-to-one relation with axons. Dystroglycan, another laminin receptor on Schwann cells, is not vital for early stages of myelination, but it participates in organizing the Schwann cell structure at the node.
Figure 1. Schwann cell–axon relations during remyelination of regenerated axons in rat sciatic nerve. After axotomy, Schwann cells (SC) provide trophic factors and extracellular matrix components (ECM) to guide regenerating axons to form appropriate connections. (a) Early events in remyelination by SCs can be seen in sciatic nerve regenerating after being severed. Cellular processes extending from SCs (white arrows) sort out unmyelinated axons (ax) from larger diameter axons (AX). The small-diameter axons will become engulfed together in bundles inside nonmyelinating SCs and remain unmyelinated. A single SC will become associated with one segment of a large-diameter axon and begin synthesizing multiple layers of myelin membrane around a segment of the axon (M). This will provide rapid, saltatory impulse conduction by insulating the axon and organizing the fiber into internodal and nodal domains having distinct types of ion channels. Basal lamina, synthesized by SCs (double black arrows), is necessary for sorting out large-diameter axons and initiating myelination. (b) A large-diameter axon in the earliest stages of myelination is shown ensheathed by a single wrap of SC membrane. (c) Another myelinated axon shows a later stage in which compact myelin is formed by wrapping multiple layers of membrane around the axon and squeezing the cytoplasm out from between the stacks of insulating membrane. Scale bar = 500 nm.
The factors initiating myelination are not fully understood, nor is it clear why Schwann cells only myelinate large-diameter axons. Just before Schwann cells begin to myelinate, nuclear factor-kappa B (NF-κB) is upregulated, and its activation and translocation to the nucleus is necessary to regulate transcription of genes essential for myelination. A number of transcription factors are involved in initiating myelination, including Krox20/EGR2, NGFI-1-binding proteins, Oct6, and BRN2. As might be expected, cell adhesion molecules have an important role in axon–Schwann cell adhesion and myelination. The cell adhesion molecules L1 and NCAM are expressed on nonmyelinated axons, and they are downregulated during early myelination. MAG, a cell adhesion molecule that promotes association between axon and myelinating Schwann cells, is upregulated immediately after the initial layer of myelin is wrapped around the axon (Figure 1(b)). Synthesis of myelin proteins increases, and the mRNAs for myelin proteins, such as myelin basic protein (MBP), become concentrated at distal sites in Schwann cells to provide local synthesis of myelin membrane.
Wrapping the layers of myelin around axons and squeezing the cytoplasm out from between the leaflets requires extensive cell extension and motility, which are regulated by actin–myosin cytoskeletal dynamics (Figure 1(c)). The Rho kinase (ROCK) regulates actin–myosin mechanical transduction by activating Rho, and in the absence of ROCK activity, the single myelinating process of a Schwann cell splits abnormally to form many smaller internodes, with resulting deleterious consequences for nerve conduction.
Myelin is promoted by many growth factors, including glial-derived neurotrophic factor (GDNF), NRG-1, myelin basic protein (IGFs), brain-derived neurotrophic factor (BDNF), as well as the sex hormone progesterone and the extracellular matrix molecule laminin. Multiple intracellular signaling pathways are involved, notably PI3K-Akt and cAMP. Myelination by Schwann cells is blocked by Notch activation, the neurotrophin NT-3, as well as by extracellular ATP. The latter is released by axons firing bursts of action potentials. TGF-β also inhibits myelination. Neurotrophins such as nerve growth factor (NGF) promote neuronal survival, but NGF stimulates myelination by Schwann cells through an indirect effect on axons. Indirect signals from the axons must be involved because experiments have shown that Schwann cell myelination of types of axons that are not depend on NGF for survival is unaffected by experimental manipulation of NGF.
The thickness of the myelin layer is precisely regulated in proportion to the axon diameter. Axons of larger caliber have thicker myelin, but the ratio of axon diameter to total diameter of axons including the myelin sheath falls within a range of 0.6 to 0.7 (g-ratio), regardless of the diameter of a myelinated axon. How the Schwann cell maintains this strict proportionate myelin thickness to varying axon caliber is unknown, but the thickness can be altered experimentally. BDNF, p75 neurotrophin receptor, or neuregulin overexpression results in abnormally thick myelin. Conversely, if ErbB receptors in Schwann cells are eliminated after myelination has begun, the sheath does not develop to its normal thickness. Myelin on axons regenerated after injury is typically thinner than normal, however.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469006987
Purinergic Signaling
Philip G. Haydon, George J. Siegel, in Basic Neurochemistry (Eighth Edition), 2012
Myelination and importance of the axonal release of ATP
Myelination in both the peripheral and central nervous system is essential for the support of effective axonal propagation. It is perhaps not surprising therefore that there is an activity-dependent regulation of myelination. Neural activity can lead to a non-synaptic release of ATP (Fields & Ni, 2010). Moreover, this purinergic signal regulates the differentiation of Schwann cells and oligodendrocytes, the peripheral and central sources of myelin. Interestingly, the types of purinergic receptors expressed by Schwann cells and oligodendrocytes are different. Thus although Schwann cells express P2 receptors, they do not express P1 receptors, whereas in contrast, oligodendrocytes express all four P1 receptors. Concordant with this differential receptor expression, these cell types express differential responses to axonal activity. Activity-dependent release of ATP causes a P2 receptor-dependent inhibition of Schwann cell proliferation, differentiation and myelination (Stevens & Fields 2000). In contrast, the activity-dependent release of ATP stimulates a differentiation of oligodendrocytes that is mediated by P1 receptors (Stevens et al., 2002).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123749475000195
Pediatric Neurology Part III
Andreas Schulze, in Handbook of Clinical Neurology, 2013
GAMT
Delayed myelination and/or bilateral hyperintensity in the globus pallidus are common findings. The earliest changes were observed 17 months after onset of symptoms. In some patients, pallidal changes occur after retarded myelination has resolved. There is no correlation of MRI findings to either the duration or the severity of the disease. MRI abnormalities were observed in five out of eight patients (Schulze et al., 2003). In a series of 22 patients, six had abnormal bilateral signal intensity in pallidum, the remainder either had delay of myelination or were normal (Mercimek-Mahmutoglu et al., 2006b). Another series of seven patients revealed a normal MRI in four patients and abnormalities in three patients, one with pallidal changes, one with small corpus callosum and delayed myelination and pallidal changes, and one with 2 mm T2 hyperintensity in the pons (Dhar et al., 2009).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444595652000538
Когда мы думаем о мозге, то представляем себе сложные процессы высшей нервной деятельности — от сновидений до изучения иностранных языков. Однако за всеми этими глобальными вещами стоят обыкновенные клетки — нейроны. Благодаря построению сложных сетей они функционируют как огромный социум. И даже на самых ранних этапах развития клетки — предшественницы нервной ткани подчас отличаются «нестандартным поведением», которое в конечном счете обеспечивает сложную архитектуру связей мозга. Для того чтобы разобраться в этом, попробуем ответить на ряд вопросов.
Что такое нейроглия?
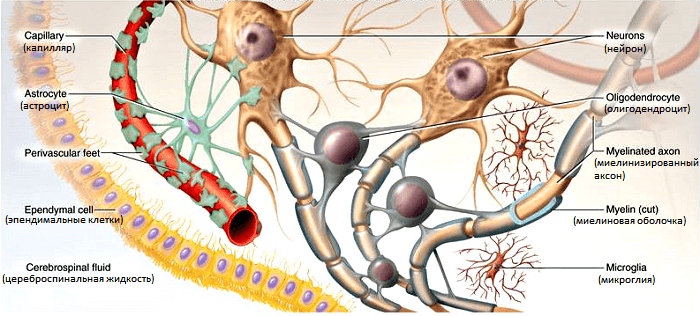
Большинству людей кажется очевидным, что вся сложная психическая деятельность обеспечивается исключительно нервными клетками, которые проводят импульсы, обусловливают эмоции и позволяют успешно взаимодействовать с окружающим миром. Однако правильная работа нейронов была бы невозможна без очень важного клеточного образования — нейроглии. Глиальные клетки формируют специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов. Среди этих клеток наиболее многочисленна группа олигодендроцитов. Они «изолируют» длинные отростки нейронов — аксоны — для того, чтобы проводить сигналы с высокой скоростью. Изолирующее покрытие, окружающее нервные волокна, называется миелин, а сам процесс изоляции — миелинизация. Олигодендроциты поддерживают быструю нервную проводимость и защищают целостность аксонов в процессе их жизнедеятельности.
Как обеспечивается изоляция нервных волокон?
Каждый из олигодендроцитов образует несколько отростков-«ножек», которые оборачивают часть длинных отростков нейронов (рис. 1). В результате один олигодендроцит оказывается связанным сразу с несколькими нервными клетками. Считается, что самую мощную миелиновую изоляцию в мозге получают наиболее активные аксоны — это позволяет им работать еще эффективнее.
Рисунок 1. Образование миелиновой оболочки в центральной нервной системе. Оболочка формируется из плоских выростов олигодендроцитов, многократно оборачивающих аксон наподобие изоляционной ленты.
Можно ли избирательно управлять процессом миелинизации?
Не все нейроны требуют конструирования вокруг аксонов изоляционных оболочек — ведь тогда все клетки нашей нервной системы работали бы в суперинтенсивном режиме. Следствием стала бы сверхвозбудимость и в конечном счете гибель организма. Получается, что в процессе формирования нервной системы клетки как-то понимают, где необходимо строить миелиновые оболочки, а где — нет? Действительно, миелинизация аксонов начинается уже на ранних этапах развития организма, и в этом помогают клетки — предшественницы олигодендроцитов (oligodendrocyte precursor cells, OPCs). Для формирования «правильной» структуры нервных волокон эти клетки мигрируют в организме зародыша на протяжении его эмбрионального развития.
Область первичной миграции клеток нейроглии — это субвентрикулярная зона головного мозга; именно здесь в специальных доменах формируются OPCs. Отсюда клетки-предшественницы способны мигрировать на большие расстояния, обеспечивая равномерное распределение вещества в центральной нервной системе. В процессе развития нервной системы наиболее важны перемещения OPCs, происходящие на ранних этапах эмбрионального развития: несмотря на то, что миграции клеток после рождения тоже возможны, способность к ним сильно ограничена.
Результаты нового исследования, проведенного учеными из Калифорнийского университета в Сан-Франциско и Калифорнийского университета в Сан-Диего, показали, что для развития нервной системы нужна физическая опора, помогающая клеткам мигрировать [1], [2]. Таким «субстратом» в организме млекопитающих служит кровеносная система. Получается, что роль сосудов не ограничивается транспортировкой газов и питательных веществ. Последние наблюдения доказывают, что именно кровеносная сеть способствует нормальному развитию головного и спинного мозга.
Для построения первичной структуры мозга клеткам-предшественницам важно правильно распознавать путь своей миграции. Мобильность ОРСs регулируется специальными клеточными механизмами, а также полярностью и внеклеточными сигналами [1]. Важным активатором является особый рецептор — Gpr124 (G protein-coupled receptor 124), а регулятором взаимодействия между клетками-предшественницами и сосудистым эндотелием выступает Wnt-сигналинг [3].
Как изучали процессы перемещения клеток-предшественниц?
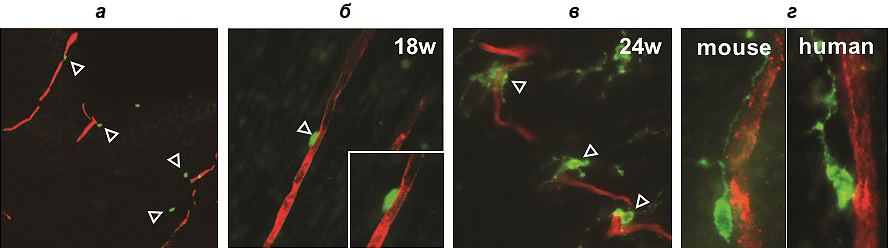
В первой серии экспериментов участвовали клетки мышиных зародышей. Оказалось, что в развивающемся переднем мозге мыши сначала «налаживается» сосудистая сеть, а уже затем появляются первые клетки — предшественницы олигодендроцитов. Для их дальнейшей миграции необходимо наладить контакт с поверхностью кровеносных сосудов, и это достигается благодаря «вторжению» эндотелиальных отростков в нейроэпителий (рис. 2).
Рисунок 2. Конфокальные изображения, показывающие ассоциацию OPCs с кровеносными сосудами. а — Первые OPCs (выделены зеленым цветом, обозначены стрелками) «прибывают» из зародышевого мозга для прикрепления к сосудам (помечены красным цветом). б — Контакт OPCs с кровеносными сосудами на 18 неделе эмбрионального развития. в — Контакт на 24 неделе. г — Сходная морфологическая ассоциация кровеносных сосудов с клетками-предшественницами в организме мыши (слева) и человека (справа).
Дополнительную серию экспериментов провели с образцами мозгового вещества человека и показали, что в процессе развития наблюдается сходная ассоциация клеток-предшественниц с сосудами. Это позволяет предположить общность такой картины формирования нейроглии для всех млекопитающих.
Визуализация живых ОРСs зародыша с помощью флуоресцентного маркера Olig2-GFP выявила две основных модели поведения этих клеток: «ползание» и «перепрыгивание». Клетки, непосредственно соприкасающиеся с поверхностью кровеносного сосуда, в процессе своей миграции постепенно «переползают» вдоль него. Если же необходимо создать связь с новым сосудом, ОРСs вынуждены «прыгать», не контактируя непосредственно с эндотелием — так перемещение происходит быстрее. Нужно отметить, что ассоциация мигрирующих ОРСs с сосудами не ограничена пределами головного мозга зародыша: исследователи обнаружили ее на более поздних стадиях развития и в спинном мозге.
Конечно, для установления глобальной роли сосудистой системы в перемещениях клеток нейроглии предстоит провести еще не один эксперимент. Однако обсуждаемое исследование впервые раскрыло принципы миграций предшественников олигодендроцитов в развивающейся нервной системе. Оно впервые показало, что нормальное развитие нервной системы напрямую связано с кровеносной системой зародыша. Сейчас можно принять за установленный факт следующее: именно сосуды определяют дальнейшие пути формирования нервной системы. Если у зародыша есть нарушения в строении кровеносной системы, то и нервная вряд ли избежит патологии.
Что дает нам исследование миграций OPCs?
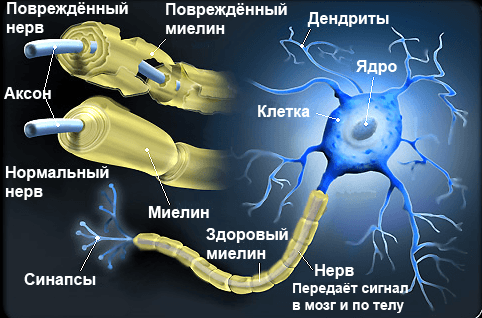
Несмотря на то, что способность к перемещениям клеток-предшественниц наиболее активно проявляется на ранних этапах эмбрионального развития, отклонения от нормы в этом периоде приводят к серьезным расстройствам организма во взрослом состоянии. Нарушение структуры миелиновых оболочек нейронов имеет решающее значение в патогенезе некоторых болезней человека — например, рассеянного склероза или гипоксических повреждений у новорожденных. Рассеянный склероз — это наиболее часто встречающееся неврологическое нарушение у молодых людей , а развивается оно вследствие повреждения миелиновой оболочки нервных клеток головного и спинного мозга аномальными иммунными клетками (рис. 3).
И поэтому способам лечения рассеянного склероза посвящено множество медицинских исследований, в том числе отечественных. Например, аутоиммунной нейродегенерацией — и именно с упором на рассеянный склероз — занимается лаборатория биокатализа ИБХ РАН «Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники» [4]. — Ред.
Рисунок 3. Демиелинизация нервных волокон — причина развития рассеянного склероза.
Без миелина нервные импульсы не передаются должным образом, что со временем приводит к постепенному расстройству таких жизненно важных функций, как способность ходить, держать предметы и даже видеть. Часть современных методик лечения демиелинизации направлена на замедление дальнейшего разрушения миелина, часть — на активацию стволовых клеток нервной системы взрослого человека, которые вновь синтезируют миелин [5]. Однако калифорнийское исследование может открыть новые перспективы лечения рассеянного склероза. Вполне возможно, что ранняя диагностика состояния кровеносной системы зародыша позволит выявить нарушения в нервной системе, а значит — осуществить лечебное вмешательство уже в эмбриональном периоде развития. Изучение распределения предшественников олигодендроцитов в областях возможных повреждений зародыша поможет раскрыть, как дисфункция нервной и кровеносной систем влияет на манифестацию и прогрессирование неврологических расстройств в послеродовом периоде развития человека.
- Tsai H.H., Niu J., Munji R., Davalos D., Chang J., Zhang H. et al. (2016). Oligodendrocyte precursors migrate along vasculature in the developing nervous system. Science. 351, 379–384;
- Dejana E. and Betsholtz C. (2016). Oligodendrocytes follow blood vessel trails in the brain. Science. 351, 341–342;
- Важнейшие стрелочники клеток организма: белки Wnt;
- Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники;
- Najm F.J., Madhavan M., Zaremba A., Shick E., Karl R.T., Factor D.C. et al. (2015). Drug-based modulation of endogenous stem cells promotes functional remyelination in vivo. Nature. 522, 216–220.
Нервная система выполняет важнейшие функции в организме. Она отвечает за все действия и мысли человека, формирует его личность. Но вся эта сложная работы была бы невозможна без одной составляющей — миелина.
Миелин – это вещество, образующее миелиновую (мякотную) оболочку, которая отвечает за электроизоляцию нервных волокон и скорость передачи электрического импульса.
Анатомия миелина в строении нерва
Главная клетка нервной системы – нейрон. Тело нейрона называется сома. Внутри нее находится ядро. Тело нейрона окружено короткими отростками, которые называются дендриты. Они отвечают за связь с другими нейронами. От сомы отходит один длинный отросток – аксон. Он несет импульс от нейрона к другим клеткам. Чаще всего на конце он соединяется с дендритами других нервных клеток.
Всю поверхность аксона покрывает миелиновая оболочка, которая представляет собой отросток клетки Шванна, лишенный цитоплазмы. По сути, это несколько слоев клеточной мембраны, обернутые вокруг аксона.
Шванновские клетки, обволакивающие аксон, разделяются перехватами Ранвье, в которых отсутствует миелин.
Функции
Основными функциями миелиновой оболочки являются:
- изоляция аксона;
- ускорение проведения импульса;
- экономия энергии за счет сохранения ионных потоков;
- опора нервного волокна;
- питание аксона.
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.
В спокойном состоянии внутрь нейрона попадают только ионы калия, а ионы натрия остаются снаружи. В момент возбуждения они начинаются меняться местами. Аксон положительно заряжается изнутри. Затем натрий перестает поступать через мембрану, а отток калия не прекращается.
Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Состав
Миелиновый слой состоит из двух слоев липидов и трех слоев белка. Липидов в нем гораздо больше (70-75%):
- фосфолипиды (до 50%);
- холестерин (25%);
- глактоцереброзид (20%) и др.
Большое содержание жиров обусловливает белый цвет миелиновой оболочки, благодаря чему нейроны, покрытые ей, называются «белым веществом».
Белковые слои тоньше липидных. Содержание белка в миелине – 25-30%:
- протеолипид (35-50%);
- основной белок миелина (30%);
- белки Вольфграма (20%).
Существуют простые и сложные белки нервной ткани.
Роль липидов в строении оболочки
Липиды играют ключевую роль в строении мякотной оболочки. Они являются структурным материалом нервной ткани и защищают аксон от потери энергии и ионных потоков. Молекулы липидов обладают способностью восстанавливать ткани мозга после повреждений. Липиды миелина отвечают за адаптацию зрелой нервной системы. Они выступают в роли рецепторов гормонов и осуществляют коммуникацию между клетками.
Роль белков
Немаловажное значение в строении миелинового слоя имеют молекулы белков. Они наряду с липидами выступают в роли строительного материала нервной ткани. Их главной задачей является транспортировка питательных веществ в аксон. Также они расшифровывают сигналы, поступающие в нервную клетку и ускоряют реакции в ней. Участие в обмене веществ – важная функция молекул белка миелиновой оболочки.
Дефекты миелинизации
Разрушение миелинового слоя нервной системы – очень серьезная патология, из-за которой происходит нарушение передачи нервного импульса. Она вызывает опасные заболевания, зачастую несовместимые с жизнью. Существуют два типа факторов, влияющие на возникновение демиелинизации:
- генетическая предрасположенность к разрушению миелина;
- воздействие на миелин внутренних или внешних факторов.
- Демиелизация делится на три вида:
- острая;
- ремиттирующая;
- острая монофазная.
Почему происходит разрушение
Наиболее частыми причинами разрушения мякотной оболочки являются:
- ревматические болезни;
- существенное преобладание белков и жиров в питании;
- генетическая предрасположенность;
- бактериальные инфекции;
- отравление тяжелыми металлами;
- опухоли и метастазы;
- продолжительные сильные стрессы;
- плохая экология;
- патологии иммунной системы;
- длительный прием нейролептиков.
Заболевания вследствие демиелинизации
Демиелинизирующие заболевания центральной нервной системы:
- Болезнь Канавана – генетическое заболевание, возникающее в раннем возрасте. Его характеризуют слепота, проблемы с глотанием и приемом пищи, нарушение моторики и развития. Также следствием этой болезни являются эпилепсия, макроцефалия и мышечная гипотония.
- Болезнь Бинсвангера. Чаще всего вызвана артериальной гипертонией. Больных ожидают расстройства мышления, слабоумие, а также нарушения ходьбы и функций тазовых органов.
- Рассеянный склероз. Может вызвать поражения нескольких частей ЦНС. Ему сопутствуют парезы, параличи, судороги и нарушение моторики. Также в качестве симптомов рассеянного склероза выступают поведенческие расстройства, ослабление лицевых мышц и голосовых связок, нарушение чувствительности. Зрение нарушается, меняется восприятие цвета и яркости. Рассеянный склероз также характеризуется расстройствами тазовых органов и дистрофией ствола мозга, мозжечка и черепных нервов.
- Болезнь Девика – демиелинизация в зрительном нерве и спинном мозге. Болезнь характеризуют нарушения координации, чувствительности и функций тазовых органов. Ее отличают серьезные нарушения зрения и даже слепота. В клинической картине также наблюдаются парезы, мышечная слабость и вегетативная дисфункция.
- Синдром осмотической демиелинизации. Возникает из-за недостатка натрия в клетках. Симптомами выступают судороги, нарушения личности, потери сознания вплоть до комы и смерти. Следствием заболевания являются отек головного мозга, инфаркт гипоталамуса и грыжа ствола мозга.
- Миелопатии – различные дистрофические изменения в спинном мозге. Их характеризуют мышечные нарушения, сенсорные расстройства и дисфункция тазовых органов.
- Лейкоэнцефалопатия – разрушение миелиновой оболочки в подкорке головного мозга. Больных мучают постоянная головная боль и эпилептические припадки. Также наблюдаются нарушения зрения, речи, координации и ходьбы. Снижается чувствительность, наблюдаются расстройства личности и сознания, прогрессирует слабоумие.
- Лейкодистрофия – генетическое нарушение метаболизма, вызывающее разрушение миелина. Течение болезни сопровождают мышечные и двигательные расстройства, параличи, нарушение зрения и слуха, прогрессирующее слабоумие.
Демиелинизирующие заболевания периферической нервной системы:
- Синдром Гийена-Барре – острая воспалительная демиелинизация. Она характеризуется мышечными и двигательными нарушениями, дыхательной недостаточностью, частичным или полным отсутствием сухожильных рефлексов. Больные страдают заболеваниями сердца, нарушением работы пищеварительной системы и тазовых органов. Парезы и нарушения чувствительности так же являются признаками этого синдрома.
- Невральная амиотрофия Шарко-Мари-Тута – наследственная патология миелиновой оболочки. Ее отличают нарушения чувствительности, дистрофия конечностей, деформация позвоночника и тремор.
Это лишь часть заболеваний, возникающих из-за разрушения миелинового слоя. Симптомы в большинстве случаев схожи. Точный диагноз можно поставить лишь после проведения компьютерной или магнитно-резонансной томографии. Немаловажную роль в постановке диагноза играет уровень квалификации врача.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
- Стимуляция олигодендроцитов. Это клетки, производящие миелин. В организме, пораженном демиелинизацией, они не работают. Искусственная стимуляция этих клеток поможет запустить процесс восстановления разрушенных участков миелиновой оболочки.
- Стимуляция стволовых клеток. Стволовые клетки могут превращаться в полноценную ткань. Есть вероятность, что они могут заполнять и мякотную оболочку.
- Регенерация гематоэнцефалического барьера. При демиелинизации этот барьер разрушается и позволяет лимфоцитам негативно влиять на миелин. Его восстановление защищает миелиновый слой от атаки иммунной системы.
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
В настоящее время широко известно, что оптимальное функционирование центральной нервной системы (ЦНС) зависит от синаптических связей и разнонаправленных взаимодействий между нейрональными и глиальными клетками. Одно из наиболее тесных глиально-нейрональных взаимодействий в ЦНС происходит между олигодендроцитами и нейронами посредством миелинизации. Миелиновая оболочка индуцирует компартментализацию аксонов с образованием перехватов Ранвье, т.е. специализированных доменов, которые увеличивают скорость проведения потенциалов действия. Скачкообразное распространение и скорость этих электрических импульсов зависят от калибра аксона, но в первую очередь от характеристик миелина, таких как количество и длина расстояний между узлами, а также ширина и плотность миелина. Следовательно, миелинизация позволяет точно настраивать и синхронизировать нейронные цепи и, как таковая, играет ключевую роль в поддержании надлежащей связи между структурами мозга для поддержки более высоких интеграционных процессов, таких как восприятие, память или познание. Кроме того, посредством миелинизации олигодендроциты также обеспечивают метаболическую поддержку аксонов, способствуя их структурной и функциональной целостности, что является требованием для гомеостаза мозга человека.
Миелинизация — это процесс развития нервной системы, который начинается в третьем триместре беременности и неуклонно увеличивается в детстве и раннем юношеском возрасте, пока не достигает медленно нарастающего плато во взрослой жизни. Этот процесс является адаптивным, при этом нейронная активность является одним из основных факторов, определяющих пластичность миелина. Более того, поскольку миелиновая оболочка представляет собой специализированную структуру, состоящую из нескольких слоев плазматической мембраны, из которой вытесняется большая часть цитоплазмы, ее состав обогащен липидами (примерно 70% ее содержания) и белками. Эти белки выполняют важные функциональные роли, такие как обеспечение закрепления между миелиновыми пластинками, прикрепление аксонов и миелина в паранодальных областях, передача сигналов и взаимодействие с элементами цитоскелета внутри олигодендроцитов.
Шизофрения и биполярное аффективное расстройство имеют несколько общих клинических и нейробиологических черт; в частности, это — дисфункция олигодендроглии и изменения трактов белого вещества (WM) могут лежать в основе отключения ( разъединения ) связей между областями мозга, связанными внешне , с определенными психопатологическими синдромами.
WM в основном состоит из сильно миелинизированных аксонов и глиальных клеток. Миелиновые покрытия аксонов между узлами ( перехваты Ранвье ) представляют собой дискретные мембранные оболочки, окружающие аксоны, образованные отростками олигодендроцитов. Миелиновая оболочка позволяет быстро и эффективно проводить нервные импульсы через перехваты Ранвье, улучшая общую функцию нейронных цепей. Быстрое и точно синхронизированное проведение нервных импульсов по волокнам, соединяющим отдаленные структуры мозга, имеет решающее значение для функций более высокого уровня, таких как познание, память, настроение и речь.
Несколько клеточных и субклеточных аномалий, связанных с миелином и олигодендроцитами, были обнаружены в посмертных образцах пациентов с шизофренией или биполярным расстройством, а методы нейровизуализации выявили устойчивые изменения на макромасштабном коннектомном уровне при обоих расстройствах.. .
Категория сообщения в блог:
У нервных клеток есть два вида отростков — небольшие и чрезвычайно разветвлённые дендриты, с помощью которых нейрон собирает импульсы от других нервных клеток, и очень длинные аксоны, которые отправляют импульсы дальше. Почти все аксоны в центральной нервной системе (то есть в головном и спинном мозге) покрыты миелином — светлой субстанцией, состоящей преимущественно из липидов. Миелинизированных нервных волокон также много в периферической нервной системе, то есть в нервах, которые выходят из головного и спинного мозга и идут к другим органам.
Олигодендроцит и миелиновая оболочка. Один олигодендроцит формирует миелиновую оболочку сразу на нескольких аксонах, но на каждом из них он создаёт только один сегмент оболочки (от одного перехвата Ранвье до другого). Иллюстрация: Holly Fischer/Wikimedia Commons/CC BY 3.0.
‹
›
Миелин одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Чтобы понять, как миелин ускоряет импульсы, нужно вспомнить, что любой импульс в нейроне — это перегруппировка ионов между наружной и внутренней стороной клеточной мембраны. Когда на каком-то участке мембраны открываются ионные каналы, то такие же ионные потоки сразу открываются на соседнем участке мембраны, потом — на участке чуть подальше и т. д. Электрические свойства мембраны последовательно меняются вдоль нейронного отростка — это и есть бегущий импульс. Миелин окутывает аксоны не всплошную с начала и до конца. В миелиновой обмотке есть пробелы, где мембрана не покрыта миелином, — перехваты Ранвье (названные так в честь открывшего их французского физиолога Луи Антуана Ранвье). И когда импульс распространяется по аксону, то перегруппировка ионов происходит как раз на перехватах Ранвье. То есть импульс не переползает медленно между участками, которые находятся вплотную друг к другу, а скачет от одного перехвата к другому. И если в аксоне без миелина импульс бежит со скоростью 0,5—10 м/с, то в таком же аксоне, но с миелином, скорость импульса достигает 150 м/с.
Скопления аксонов, обмотанных миелином, выглядят светлее, поэтому области в мозге, где преобладают аксонные «провода», называют белым веществом. (Скопления дендритов, которые обходятся без миелина, образуют серое вещество. Поскольку дендриты намного короче аксонов, они не передают импульсы на большие расстояния и скорость для них не так важна.) Нейроны не сами вырабатывают миелин, для того есть специальные клетки — олигодендроциты в центральной нервной системе и шванновские клетки в периферических нервах. И те и другие относятся к глие, или нейроглие — так называют совокупность различных клеток нервной системы, которые обслуживают нейроны, создавая им условия для работы. В последнее время появляется всё больше данных о том, что глиальные клетки не просто обслуживают нейроны, но напрямую вмешиваются в их работу (см. статью «Иммунные ”электрики” мозга», «Наука и жизнь» № 8, 2020 г.). Задача олигодендроцитов и шванновских клеток — сделать нейронам миелиновую обмотку. Олигодендроцит или шванновская клетка выпячивают собственную мембрану и обхватывают аксон, мембрана нарастает — и в итоге вокруг аксона получается слоистый липидный рулон. Глиальная клетка остаётся живой и поддерживает целостность миелиновой обмотки на том участке аксона, за который она отвечает.
Разрушение миелиновой оболочки приводит к неврологическим симптомам различного вида и различной степени тяжести. Есть много заболеваний, связанных с утратой миелина на аксонах, и рассеянный склероз среди них — самое известное. Это одна из аутоиммунных болезней, когда иммунитет по какой-то причине атакует собственные клетки и молекулы организма. При рассеянном склерозе срабатывают разные иммунные механизмы, в которых участвуют как иммунные клетки мозга, так и иммунные клетки, вошедшие в мозг из крови. Но, так или иначе, заканчивается всё тем, что миелиновая оболочка вокруг аксонов разрушается, а иногда разрушаются и сами аксоны. В очаг болезни приходят астроциты — так называется ещё одна разновидность глиальных клеток. Их задача — поддерживать и питать нейроны, а также залечивать повреждения; именно это они и делают, стараясь зарубцевать больной участок и формируя характерную бляшку. Стоит добавить, что обычно рассеянный склероз поражает центральную нервную систему; периферические нервы страдают от него редко.