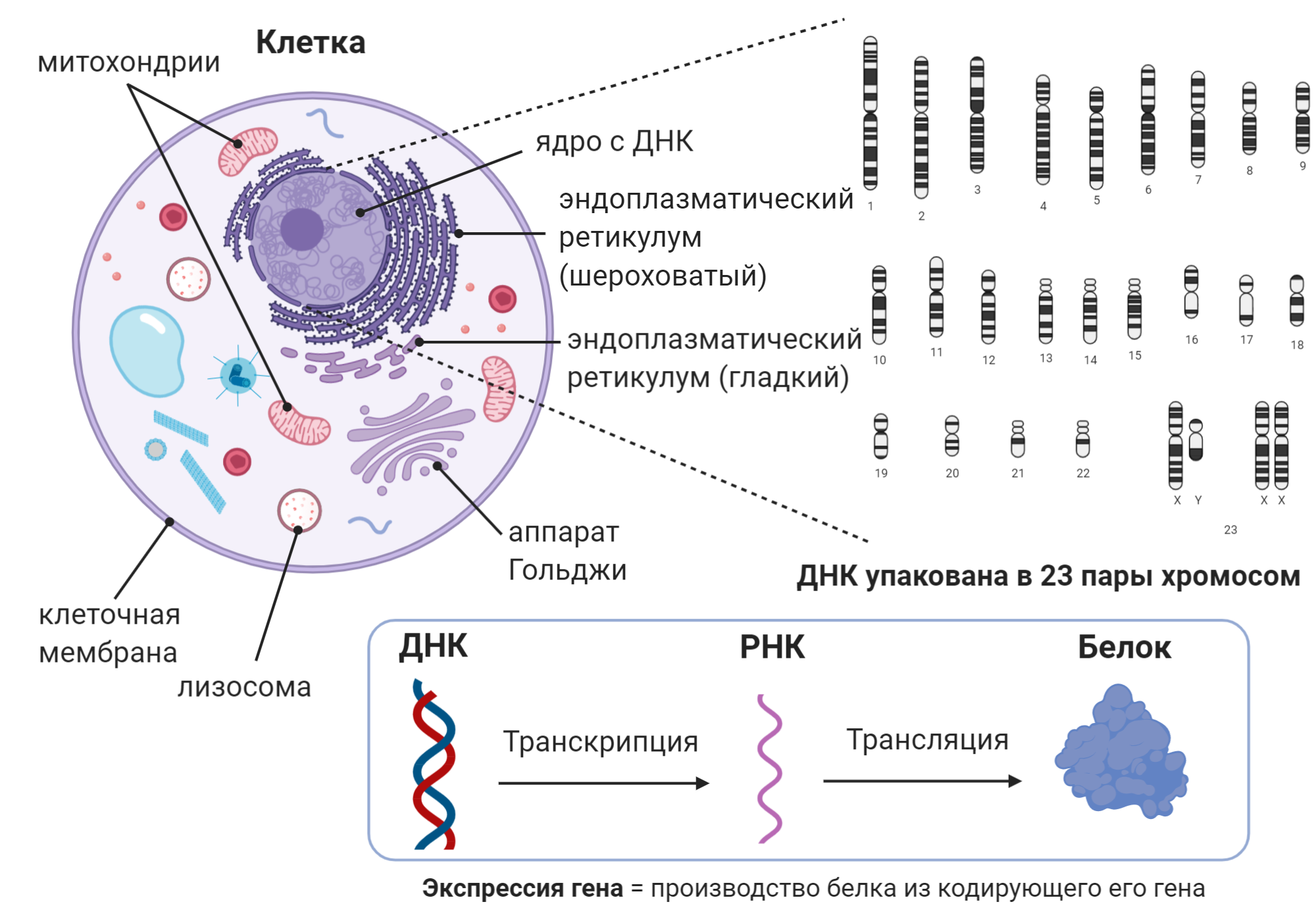
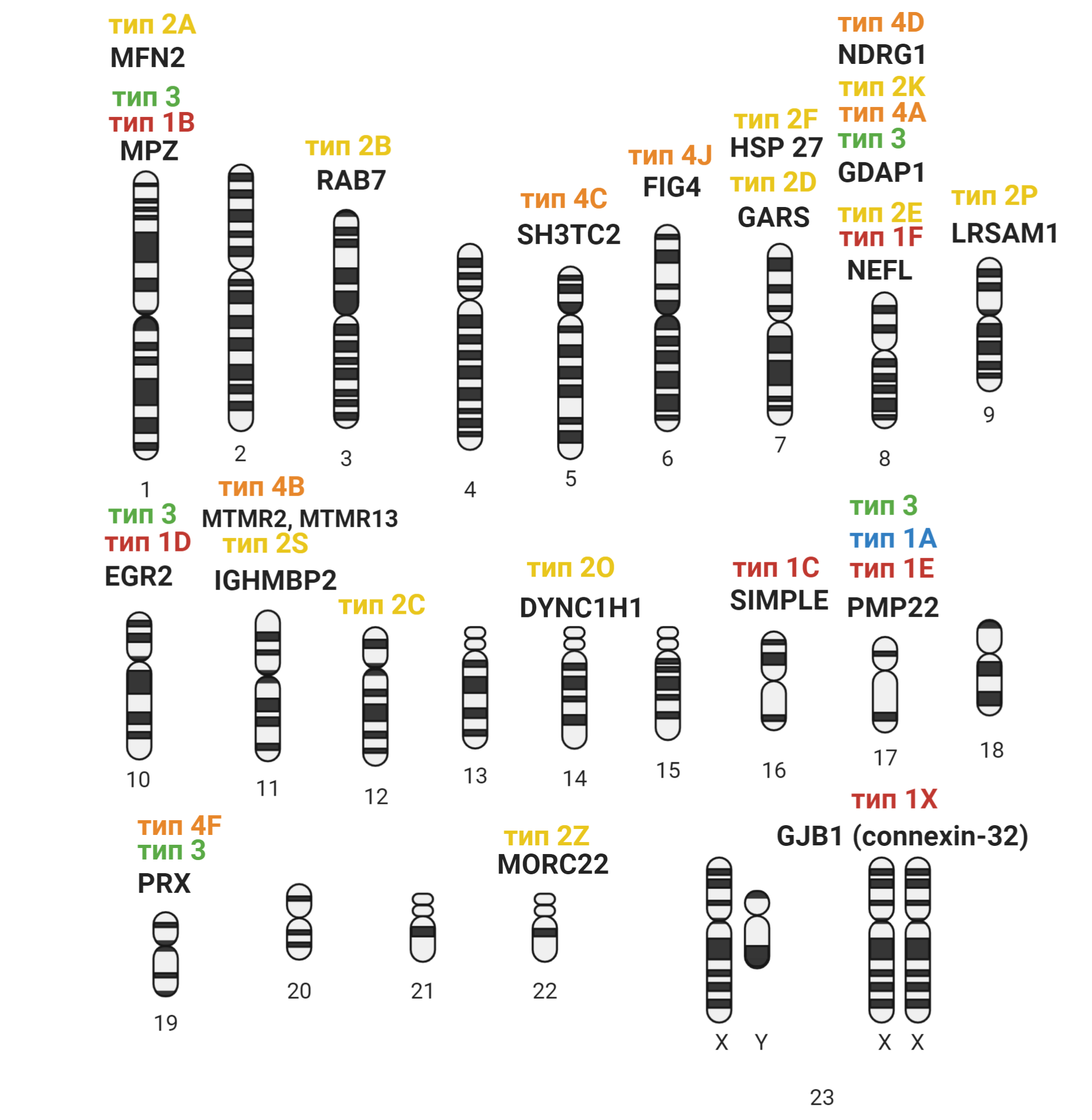
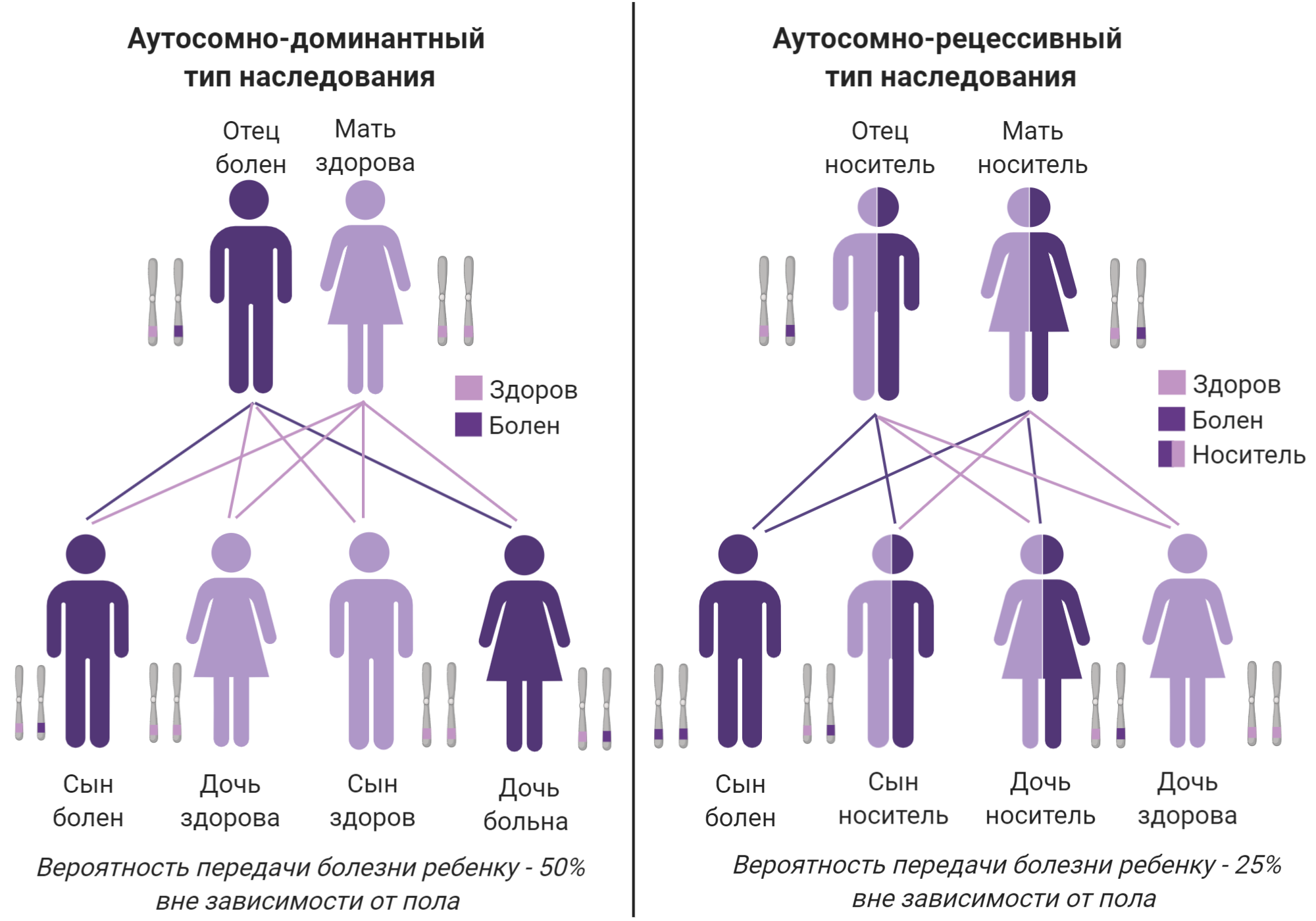
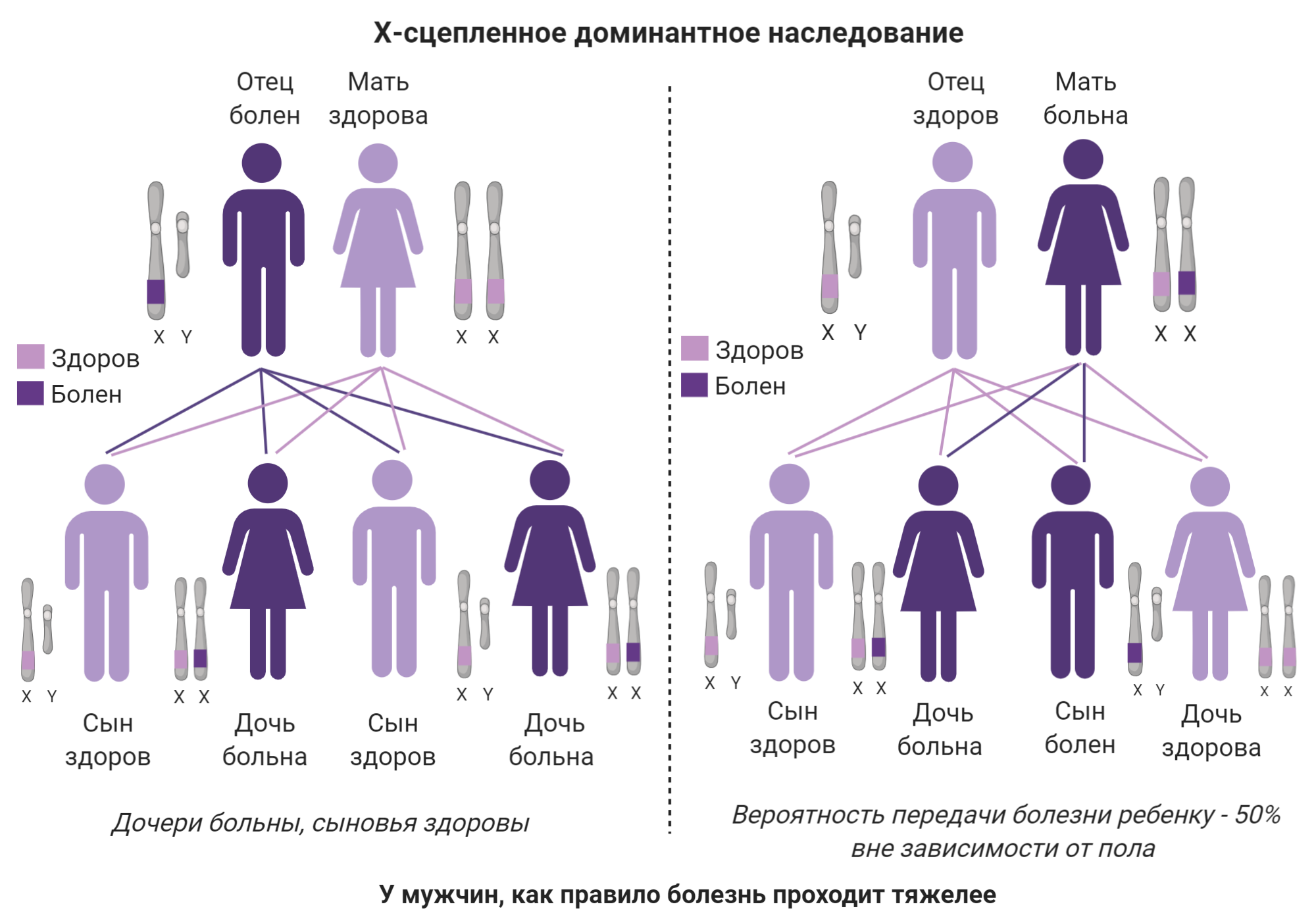
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
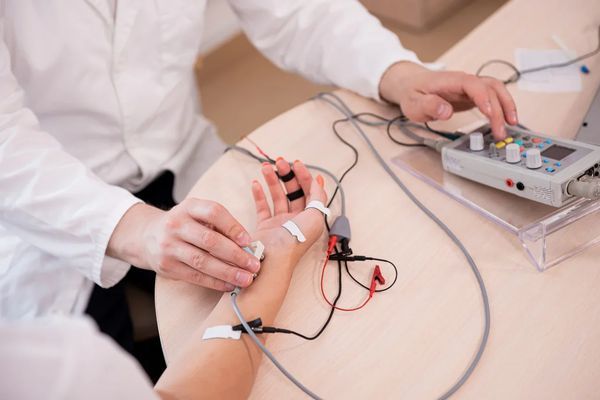
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Lindsey R. FISCHER, Jonathan D. GLASS, Departments of Neurology, and Pathology and Laboratory Medicine, Emory University School of Medicine, Atlanta, GA, USA
Резюме
Данные, полученные при исследовании бокового амиотрофического склероза у животных и людей, все больше подтверждают предположение о том, что дистальная дегенерация аксонов при этом заболевании начинается на исключительно ранних стадиях. Это происходит гораздо раньше появления первых признаков гибели двигательных нейронов и возникновения отчетливой симптоматики. Причина аксональной дегенерации в настоящее время не выяснена. Возможно, что сочетание нескольких процессов приводит к развитию данного состояния. Вовлечение местных повреждающих факторов и резкое уменьшение трофической поддержки по причине изменения метаболизма окружающих тканей являются обязательными компонентами при развитии данной патологии. Совершенно понятно, что аксон по своей природе не является простым придатком тела нейрона, его дегенерация и гибель подчиняются тем же законам и правилам. Эти данные подтверждаются рядом исследований, в которых использовались объекты с искусственно созданным состоянием амиотрофического латерального склероза. При анализе указанных данных, связанных с методами защиты двигательных нейронов от любых травмирующих факторов, было установлено, что они не привели к сколько-нибудь значимым изменениям симптоматики или удлинению времени нормального функционирования исследуемых нейронов. Аналогичные данные были получены при попытке использовать технологии по защите непосредственно аксона, исследуемой клетки. В настоящей статье приводится развернутый анализ состояний ранней аксональной дегенерации при боковом амиотрофическом склерозе и обсуждаются возможные механизмы развития данного состояния с акцентированием внимания на процессы оксидативного стресса. Обсуждается первичное значение аксональной дегенерации как возможного механизма развития данного заболевания двигательных нейронов. Кроме того, предлагаются к рассмотрению факторы, предупреждающие развитие аксональной дегенерации, как важный аспект терапии данного состояния.
Ключевые слова
боковой амиотрофический склероз, аксональная дегенерация, нейромышечная связь, супероксиддисмутаза, оксидантный стресс
Введение
Аксональная дегенерация является одним из основных клинических и патологических факторов развития бокового амиотрофического склероза (БАС). Аксональная дегенерация в основном заканчивается дисфункцией клетки или ее гибелью, связанной с валлеровской или подобной дегенерацией. Сейчас опубликовано множество работ, касающихся экспериментальных данных, которые говорят, что любая защита тел мотонейронов от внешних воздействий имеет исключительно малую эффективность по отношению к скорости развития симптомов БАС. Фактически даже генетические вмешательства, которые, казалось, могли бы полностью изменить скорость развития патологического состояния в мотонейронах спинного мозга, до сих пор не в состоянии предотвратить или замедлить ослабление и гибель животных в экспериментальной модели заболевания мотонейронов. Этот кажущийся парадокс может быть объяснен тем, что невозможно уберечь тела нейронов от патологических процессов, которые уже развились в их аксонах. Прямым следствием повреждения аксонов является дегенеративный процесс, развивающийся в мышечной ткани. Указанные факты еще раз подчеркивают выдвинутую не так давно идею о том, что дегенерация аксонов двигательных нейронов не является прямым следствием дегенерации и гибели тела родительского нейрона. Кроме того, подчеркивается, что даже незначительных изменений в аксональном метаболизме будет достаточно для формирования клинической картины. Именно поэтому предупреждение аксональной дегенерации является важным с терапевтической точки зрения. Успех в достижении этой цели даст возможность улучшить терапию БАС и других нейродегенеративных заболеваний.
Аксональная дегенерация при раннем БАС
Что общего между аксональной дегенерацией двигательных нейронов при моделировании БАС и аналогичными состояниями у человека?
Моделирование на животных
Развитие патологического процесса, сопровождающегося нейрональной дегенерацией, в настоящее время широко исследуется на животных при моделировании данной патологии. Важную роль занимают также исследования, проводимые на пациентах с нейродистрофической патологией и с невропатией двигательных нейронов спинного мозга в частности. В подавляющем большинстве случаев развитие нейродистрофии является первичным процессом, обусловливающим недостаточность функции нейронов и проявление симптомов заболевания. При этом даже весьма выраженные парезы сопровождаются неожиданно легкими изменениями двигательных нейронов. Данные явления некоторые авторы объясняют изменениями в генетическом аппарате клеток, обусловливающими выраженные изменения их функций с легкими морфологическими отклонениями. Аксональная дегенерация, несомненно, является следствием аналогичных патологических процессов, приводящих к гибели нейрона, что, в свою очередь, вызывает денервацию соответствующей мышцы. Данные, касающиеся экспериментальных моделей, на которых производился анализ описанных ситуаций, приведены ниже.
Для анализа наследственного БАС наиболее широко используется моделирование на мутантных линиях мышей по Cu,Zn-супероксиддисмутазе. Высокая степень копирования мутантной SOD1 вызывает появление слабости на 80–90-й день и гибель животного на 130–140-й день. Оригинальные исследования показывают, что начало развития клинической картины у таких животных совпадает по времени с началом частичной гибели мотонейронов спинного мозга. При этом сопутствующие физиологические и патофизиологические исследования выявляют начало денервации мышц задних конечностей задолго до появления характерных симптомов заболевания. Для установления пространственно-временных особенностей развития процессов, приводящих к гибели мотонейрона, было проведено количественное исследование патологических процессов от конечной до начальной точки их развития. Значительные явления мышечной дегенерации появились на 47-й день, задолго до появления первых симптомов заболевания. На момент появления первых клинических признаков (80-й день исследования) две трети аксонов вентральных корешков уже были подвергнуты дегенерации. До момента развития ярких симптомов заболевания не встречалось ни одного случая выявления гибели тел мотонейронов. Аналогичные данные были представлены и другими лабораториями, которые работают с мутантными линиями мышей различных подтипов.
В серии работ использовались животные со специфической миссенс-мутацией, сопровождающейся дефектом синтеза тубулина в нейронах, что приводило к прогрессирующей моторной невропатии. У таких животных развитие слабости происходило в течение первых трех недель жизни, и гибель животных происходила на шестой неделе. Гибель мотонейронов или даже развитие дегенерации дистальной части аксонов не отмечались на фазе развития явных патологических проявлений. В конечной стадии развития данной патологии гибель мотонейронов встречалась не более чем в 40 % всех случаев. Электрофизиологические исследования показали некоторые изменения структуры потенциала действия в моторных нейронах, иннервирующих мускулатуру головы и задних конечностей животного. При этом прослеживались временные зависимости нарастания указанных изменений. Причем самые выраженные изменения наблюдались задолго до тринадцатого дня исследования. Очевидные патологические изменения, свидетельствующие о денервации указанных мышц, наблюдались после пятнадцатого дня исследования. Таким образом, можно сделать вывод об исключительно малой корреляции между выраженностью патологического процесса и клиническими проявлениями у данных животных.
Группа животных с моделированной спинальной мышечной атрофией, вызванной искусственным удалением седьмого экзона гена Smn, характеризовалась ранней развивающейся моторной деградацией и гибелью животного в возрасте около четырех недель. Патоморфологический анализ данных животных выявил, что было потеряно только около 30 % поясничных двигательных нейронов за тридцатидневный период. Кроме того, 49 % аксонов передних рогов сегментов L4–L5 подверглись деструкции в первые пятнадцать дней. Данный показатель вырос до 78 % к тридцатому дню. Денервация закономерно сопровождалась выраженным накоплением фосфорилированных нейрофиламентов в нейромышечных синапсах. Во всех случаях не было обнаружено явлений терминального прорастания, что может быть связано с сопровождающимся дефектом аксонального роста и пластичности. Анализируя спинальный уровень у данных животных, можно с уверенностью заключить, что дистальные аксональные дефекты были гораздо более выраженными по сравнению с деструкцией, происходящей в спинном мозге.
Во всех моделях большая часть двигательных нейронов была морфологически интактна в момент появления первых клинических признаков. Именно этот факт дает возможность предложить потенциально эффективное направление по предотвращению ухудшения состояния. При этом использование данных принципов у человека с БАС может помочь сохранить тела двигательных нейронов и при дальнейшей реиннервации улучшить состояние пациента.
БАС у людей
Аксональная дегенерация длительное время считалась единственной особенностью БАС у людей. При этом электромиографические исследования были основными в диагностике данных состояний. Такие особенности миограммы, как спонтанная фибрилляция и фастикуляция потенциалов, были наиболее важными в диагностике. Реиннервация при данном заболевании направлена на поддержание нормальной функции мышечной системы. Такое явление закономерно при БАС. Однако реиннервация не в состоянии адекватно компенсировать начавшуюся денервацию, которая и вызывает внезапную слабость соответствующих мышц. Денервацию традиционно приписывали формирующейся дисфункции и гибели мотонейронов. Помимо этого, реиннервация считалась следствием прорастания аксона моторного нейрона, лежащего в непосредственной близости от погибшего. Данные предположения не могли быть проверены на людях до момента смерти пациента с БАС.
Эти предположения поддерживаются еще и гипотезами о том, что БАС у людей начинается с дистальной дегенерации аксонов двигательных нейронов. Bradley с соавт. использовали количественные методики морфометрии для демонстрации проксимально-дистального градиента аксональной патологии в периферических нервах у людей с БАС. В нашем случае имелась редкая возможность оценить клинические, а затем патоморфологические данные у пациента с БАС, который умер во время оперативных вмешательств, не имеющих отношения к основному заболеванию. Клинический диагноз был установлен и прослежена клиника в течение не менее полугода с момента появления первых симптомов. Аутопсия подтвердила значительную денервацию и изменения в процессах реиннервации, которые были показаны миографически. Однако в данном случае не удалось выявить признаков, свидетельствующих об изменениях в мотонейронах спинного мозга.
В клинической практике исследователи использовали технологию определения числа моторных единиц для выявления количественных параметров процессов денервации и реиннервации. Данная технология позволила предположить, что уровень прогрессирования БАС у людей прямо зависит от денервации и потери функционирующих моторных единиц у пациента. Эти данные были проверены на линии мутантных мышей по супероксиддисмутазе-1. Технология подсчета моторных единиц использовалась и в этом случае. в ходе исследования получена важнейшая информация об уменьшении числа моторных единиц за несколько месяцев до начала формирования клинической картины. Для расширения спектра исследования использовалась методика порогового трекинга, которая позволяет выявить изменения аксональной возбудимости, что дало возможность получить также незаменимую информацию, касающуюся особенностей электрофизиологических изменений у пациентов с БАС. Явления резкого повышения натриевого тока и уменьшения калиевой проводимости наблюдались в двух популяциях пациентов. Особенностью этого состояния было значительное его усугубление в дистальных отделах аксонов. Несомненно, что ни одно из этих исследований не позволяет полностью раскрыть особенности течения БАС у людей. Однако в сочетании с данными, полученными на животных, можно с уверенностью говорить о том, что такое состояние является патологией дистальных отделов аксонов.
Последние исследования дали информацию еще об одном факторе, который может играть важную роль в формировании БАС. Именно информация о генетических изменениях при данной патологии заставляет все больше обращать на нее внимание. Говоря о генетических факторах, клиницисты должны иначе посмотреть на происхождение БАС. Из известных 43 мутаций, которые приводят к изменению двигательных нейронов, 14 причастны к формированию амиотрофического латерального склероза. Все мутации, имеющие место при БАС, влияют на такие принципиально важные моменты нейрональной биологии, как изменение цитоскелета нейронов, повреждение и трансформация медиаторных везикул, критические изменения аксонального транспорта. К роме того, важную роль в формировании патологического процесса играют нарушения ферментативных систем. Некоторые другие мутации вовлекают не только нейроны. В таких случаях причиной аномальной работы нервной клетки является дефект шванновских клеток. Роль этого типа глии сложно переоценить. Непосредственное участие в нейрональной передаче информации, в частности по моторным нейронам, осуществляется именно с помощью этих клеток. Все многообразие нарушений обмена клеток спинного мозга и окружающих тканей обусловливает постепенное развитие аксональной дегенерации, приводящей к моторной невропатии. Несмотря на все то обилие информации о явлениях, сопутствующих БАС, мы не можем сейчас более или менее четко сформировать стройную схему развития данной патологии. В наших силах проводить дополнительные исследования и подвергать более глубокому анализу уже полученные материалы.
Вовлечение сенсорных аксонов
Аксональная патология не ограничивается формированием БАС в эфферентном отделе ЦНС. Изменения в аксонах вовлекают и чувствительную часть нервной системы. Симптомы нарушения афферентных нейронов менее заметны и приводят к не настолько выраженным состояниям. Однако те изменения, которые встречаются у пациентов с БАС, также требуют коррекции. По усредненным данным, пациенты с БАС имеют снижение количества миелинизированных волокон в крупных нервных стволах до 70 % от исходного уровня. При этом количество данных волокон дорсальных корешков сегмента L5 уменьшается на 27 %. Изменения в телах нейронов, находящихся в околопозвоночных ганглиях на уровне 3–5-го поясничных сегментов, приводят к 54 % уменьшению их размеров. При анализе скорости проведения по сенсорным волокнам у пациентов с БАС выявляется значительное ее уменьшение в сравнении с контрольными группами пациентов. Исследования на мутантных животных выявили характерную особенность, которая заключалась в практически одновременном снижении количества моторных и сенсорных волокон при формировании БАС.
При анализе спинальной мышечной атрофии, вызванной прогрессированием БАС, выявлено, что имеет место снижение скорости проведения по смешанным нервам. При этом степень снижения колебалась от умеренной до выраженной. Одновременно проведенная биопсия выявила выраженное истончение нервных волокон. Гистологический анализ нервно-мышечных соединений у мутантных животных с БАС показал, что синаптические бляшки на соматической мускулатуре умеренно истончены, а данные, касающиеся анализа сенсорных волокон, свидетельствовали о практически полном исчезновении чувствительных нервных окончаний в верхних слоях кожи. В ходе анализа культуры нейронов, полученной от данных мышей, выявлялось, что их дендриты были значительно короче по сравнению с нормальными клетками. Аксональный холмик имел невыраженную структуру, количество т-РНК и м-РНК резко снижено в дистальных отделах аксонов. Обобщая полученные результаты, можно говорить об аналогичных процессах, происходящих в моторных и сенсорных нейронах, с учетом того, что в последних степень выраженности изменений несколько ниже.
Дегенерация сенсорных волокон при БАС не является прямым доказательством того, что именно двигательные нейроны являются местом развития всех патологических процессов при этом состоянии. Понимание причин того, что дегенеративные процессы развиваются в моторных аксонах при БАС с огромной скоростью и при этом сенсорные волокна остаются относительно интактными, дает ключ к дальнейшим изысканиям. Обнаружение причин и механизмов этих различий является первым шагом к лечению БАС. Больший размер двигательных нейронов, увеличенная метаболическая нагрузка, анатомическая организация, контакт с мышцами и другие отличия в структуре и функции двигательных нейронов рассматривались как причины формирования этой патологии. По нашим данным, прямые сравнения между чувствительностью моторных и сенсорных нейронов к действию таких потенциальных триггеров заболевания, как оксидативный стресс и экспрессия мутантной супероксиддисмутазы, проведены не были.
Механизмы аксональной дегенерации
При анализе литературы, касающейся влияния мутантной супероксиддисмутазы на дегенеративные процессы в аксонах, четкого описания этих процессов найдено не было. Кроме того, первичное место повреждения нервной системы также неизвестно. Отмирание части аксона может являться прямым следствием влияния травмирующего фактора на его дистальные отделы. Изучается и возможность перехода патологического процесса с тела нейрона на отростки. Системный или локальный принцип формирования БАС также рассматривался при анализе причин аксональной дегенерации. В данном разделе будут описаны механизмы дегенерации, присущие именно аксонам, а также будет рассмотрена возможность дистантного формирования БАС за счет использования мутантной супероксиддисмутазы как триггера аксональной дегенерации.
Аксональная дегенерация не зависит от гибели клеток
Очевидным является то, что аксональная дегенерация не является пассивным процессом. Она может быть лишь проявлением неизвестных нам процессов, часть из которых запрограммированна на гибель клетки. Например, удаление или уменьшение количества факторов роста нервной ткани из культуры клеток вызывает гибель тел клеток и их отростков. В опыте с мутантной линией мышей проводилось удаление проапоптотического гена, что вызвало сохранение двигательных нейронов у мышей с БАС. Однако денервация и дегенерация аксонов проявились вне зависимости от данной манипуляции. Все представленное выше подтверждает предположение о том, что аксональная дегенерация может происходить независимо от молекулярных процессов, контролирующих гибель клетки.
Концепция аксональной независимости была пересмотрена после открытия явления медленной валлеровской дегенерации, которая вызвана особым видом спонтанной мутации. Отличительной чертой в данном случае является удлиненная продолжительность жизни пораженных аксонов. Суть данного состояния сводится к тому, что мутантный ген обусловливает синтез нового химерного белка, имеющего протективное действие против химических и антигенных факторов, вызывающих аксональную дегенерацию. Несмотря на достаточно высокую эффективность данного белка, он все же не способен предотвратить дегенерацию или гибель клетки. Само существование такого агента, как химерный белок, имеющего уникальные свойства, свидетельствует о регулируемом процессе дегенерации клеток. Кроме этого, подтверждается гипотеза о различных механизмах клеточной и аксональной гибели. Эти данные позволяют предположить, что именно поиск в указанном направлении поможет найти инструмент для контроля за дегенеративными процессами в нервной ткани.
Эксперименты, проводящиеся на мутантных мышах с изменением в генотипе, подразумевающем наличие валлеровской дегенерации и прогрессирующей моторной невропатии, дали неоценимо важную информацию о разнонаправленности процессов сохранения тел и отростков нейронов. Мыши контрольной группы показали раннее развитие аксональной дегенерации в моторных нервах на сороковой день жизни. Введение дополнительной мутации, связанной с валлеровской дегенерацией, дало очень важный результат — неожиданно выраженное сохранение двигательных нейронов не только до сорокового дня, но и исключительно медленное развитие дегенеративных изменений, продолжавшихся до двух месяцев. Кроме этого, получены данные о том, что именно состояние аксонов прямо влияет на сохранность тела нейрона. Аналогичным образом проводилось тестирование групп мышей с мутацией по супероксиддисмутазе. Однако, к сожалению, при таком подходе было выявлено лишь незначительное изменение прогрессирования дегенерации, причем замедление этого процесса отмечалось только на первых этапах работы. Дополнительное исследование, проведенное с учетом всех поставленных задач, дало возможность достоверно предполагать, что протективные свойства атипичного белка, образующегося при валлеровской дегенерации, действенны первые две недели развития процесса. В последующие несколько месяцев сам химерный белок начинает работать как фактор, усугубляющий течение аксональной дегенерации. С учетом этих особенностей исследуемого белка был сделан вывод о возможности частичной приостановки подобного процесса дегенеративных изменений аксонов мотонейронов, который стремительно наблюдается при прогрессирующей моторной невропатии. К сожалению, использование этого же белка не имеет смысла в лечении хронической или вялотекущей дегенерации нервной ткани. Механизм действия протективного фактора, образующегося при валлеровской дегенерации, на сегодня не известен, однако его терапевтические эффекты могут найти применение в лечении огромного спектра патологических состояний. Определение гена или совокупности генов, ответственных за синтез протективного фактора при медленно прогрессирующей валлеровской дегенерации, не привело к успеху. Сейчас возможно его получение только при изменении достаточно крупного участка ДНК животного.
Роль кальпаина в развитии аксональной дегенерации
Исследования молекулярного механизма аксональной дегенерации поддерживают идею о неапоптотической программе гибели, развивающейся в аксоне. Практически при всех состояниях, ведущих к дегенеративным изменениям нервной клетки, первичными проявлениями являются замедление аксонального транспорта, митохондриальная дисфункция, увеличение концентрации кальция в клетке, что в конечном итоге приводит к активации системы кальпаинов. Кальпаины представляют собой группу нейтральных протеаз, активируемых кальцием. Их роль в формировании различных патологических процессов достаточно полно описана. Моделирование патологических состояний, проводившееся на животных и отдельных клетках, четко демонстрирует дегенерацию белков цитоскелета и мембраны клетки, вызванную кальпаином. При моделировании ишемических, травматических, токсических и других состояний результаты в отношении роли кальпаиновой системы были аналогичными. Ингибирование кальпаинов при периферической невропатии приводит к заметному снижению травмирующего влияния этих ферментов на клеточные элементы как в эксперименте на животном, так и на культуре клеток. Ингибирование кальпаинов также приводит к сохранению цитоскелета в нервно-мышечном соединении в модели острой аутоиммунной нервно-мышечной дегенерации. Полученные данные о роли кальпаинов при развитии нейрональной дегенерации подтверждаются многими авторами. Кроме того, в значительной части случаев ингибиторы кальпаинов предупреждают или замедляют развитие патологических процессов в нервной клетке. Однако принципиальным отличием данных работ является то, что акцент делается именно на гибель тела нейрона. Изменения, проходившие в отростках этих клеток, во внимание не принимались. Как бы там ни было, применение ингибиторов кальпаинов при лечении аксональной дегенерации может действительно оказаться тем фактором, который будет играть решающую роль.
Чем обусловлена аксональная дегенерация при амиотрофическом латеральном склерозе?
Причина или несколько причин аксональной дегенерации при БАС у мутантной линии мышей по супероксиддисмутазе не выяснена. Некоторые ученые рассматривают ее токсическое действие на клеточные элементы. Механизмы токсического влияния включают в себя агрегацию мутантных протеинов, поломку митохондриальных систем и токсическое действие глутамата. Все перечисленные факторы в отдельности или ассоциированно с факторами, вызывающими запуск апоптоза, приводят к характерным изменениям в клетке. Каждый из этих процессов достаточно хорошо изучен в отдельности и применительно к спинальным мотонейронам. Однако комплексный анализ с учетом особенностей процессов, протекающих в дистальных отделах аксонов, не проводился.
Дефекты аксонального транспорта
Процесс ухудшения работы быстрого антероградного аксонального транспорта у мутантных мышей по супероксиддисмутазе и у людей с БАС достаточно глубоко изучен. Заметное снижение скорости антероградного транспорта по аксонам с накоплением нейрофиламентов в проксимальной части нейрона описано у мутантных мышей и людей с БАС. При этом в спинном мозге признаки такого явления появляются в среднем за полгода до первых клинических проявлений заболевания. Замедление ретроградного транспорта также замечено в моторных нейронах мутантных мышей с 13-го дня эмбрионального развития. Такие явления, как изменение скорости транспорта веществ по отросткам нейрона, могут быть прямой причиной нарушения ее функции, а также следствием и симптомом такого нарушения. Выяснение истинной роли изменения скорости аксонального транспорта в аксональной дистрофии еще предстоит выяснить. Недавно были идентифицированы мутации, проявляющиеся в изменении комплекса белковых молекул с динеин/динактином, которые являются характерными именно для пораженных двигательных нейронов у мышей и людей. Нормализуя аксональный транспорт, достаточно часто удавалось пролонгировать жизнедеятельность клетки. Указанные данные свидетельствуют о том, что активность и состоятельность аксонального транспорта является еще одним критическим звеном в цепи патогенеза аксонального амиотрофического склероза.
Оксидативный стресс
При описании БАС и некоторых других нейродегенеративных процессов традиционно указывается на роль оксидативного повреждения как фактора, обусловливающего старение клетки и/или организма. Абсолютно очевидно, что в трупных тканях оксидативный процесс в отношении белков, липидов и ДНК при БАС выражен исключительно сильно. Однако какова роль перекисного окисления в формировании ранних стадий заболевания, на сегодня не выяснено. Аналогично выявлена роль оксидативного повреждения клеток у линии мутантных мышей. Абсолютно очевидно повышение интенсивности перекисного окисления в клетках спинного мозга после месячного периода развития симптомов болезни. Информация, касающаяся интенсивности оксидативного повреждения клеток в период, предшествующий появлению яркой симптоматики, является весьма скудной. Исходя из того, что абсолютное большинство клеточных элементов, белков, частей цитоскелета и др. попадают в дистальные части аксонов за счет аксонального транспорта, логично предположить, что именно дистальная часть отростка нейрона содержит наиболее «старые» клеточные единицы. Эти части клетки в большей мере подвергались травмирующему действию перекисного окисления, вследствие чего резервы и «запас прочности» у таких элементов снижены, а это значит, что дегенерация и дисфункция этих компонентов наиболее вероятна.
Несомненно то, что нейромышечные соединения могут быть уязвимы для повреждения окислительными процессами, активными у животных с мутацией по супероксиддисмутазе. До тех пор, пока у них не развивается дистрофия двигательных нейронов, значительных симптомов заболевания не наблюдается. И только после развития выраженной моторной аксонопатии происходит резкое ускорение процессов старения и появление мышечной атрофии. Миографические исследования показывают спонтанную активность пораженных мышц, что свидетельствует о начавшейся денервации. Среди миографических симптомов данного состояния встречаются фибрилляции и сложные комплексные разряды. Анализируя материалы гистологического исследования, можно сказать о начинающейся денервации дистальных отделов конечностей на втором месяце заболевания, и к концу первого полугодия формируется комбинация атрофии мышечных волокон и их гипертрофии. Кроме того, среди характерных признаков наблюдается группирование мышечных волокон, что указывает на хроническую моторную невропатию.
Предложена гипотеза о том, что клиническое и патофизиологическое сходство между разными группами мутантных мышей, отличавшихся только степенью выраженности экспрессии генов, кодирующих супероксиддисмутазу, заключается лишь в выраженности симптомов. Главный смысл состоит в том, что оксидативный стресс играет основную роль в аксональной дегенерации, наблюдающейся у животных данных групп. Интенсивность оксидативного стресса может быть достаточной для формирования или запуска процессов аксональной патологии. Например, увеличение размера митохондрий в нейромышечном соединении становится заметным на 25-й день развития патологического процесса в нервной ткани. Это указывает на значительное повреждение митохондриальной структуры. Оксидативное повреждение митохондрий нарушает динамику электронов, тем самым угнетая синтез АТФ, вплоть до его остановки. Это является еще одним фактором, замедляющим аксональный энергозависимый транспорт. Недостаточность энергетического снабжения транспортных систем нейрона приводит к остановке двустороннего обмена между телом и отростками нейрона. Замедление транспорта является нормальным проявлением старения нервных клеток. Как было описано, включается «порочный круг», связанный с увеличением оксидативного влияния на органеллы. АТФ также является жизненно важным компонентом для работы Na+/K+-АТФазы. Дисфункция этого фермента влечет за собой накопление натрия в аксоне. Повышение концентрации данного иона приводит к реверсу натрий-кальциевого транспорта с входом и накоплением кальция в аксоне. Как было описано выше, кальций является прямым активатором кальпаиновой системы, что резко ускоряет дегенеративные процессы в аксональных структурах. Помимо повреждения митохондрий, оксидативный стресс влияет на жизнедеятельность других клеточных компонентов, содержащихся в аксоне. Накопление гиперфосфорилированных нейрофиламентов в дистальных отделах аксонов — типичное явление для пациентов с БАС. Этот феномен является типичным для состояний, связанных с повышением активности Cdk5, встречающимся при оксидативном стрессе. В дополнение к огромному количеству эффектов, к которым приводит оксидативный стресс, свободные радикалы резко снижают эффективность выделения медиаторов из пресинапса моторных терминалей. Эксперименты, модулирующие аналогичные состояния за счет применения ботулина, имели стандартный и закономерный результат, заключающийся в повреждении дистальных отделов моторных аксонов, и даже приводили к гибели двигательных нейронов.
Влияние свободных радикалов на компоненты клеток невероятно многообразно. Оно проявляется в изменении свойств белковых и липидных молекул, что вызывает различные дегенеративные процессы. Перекисное окисление мутантной супероксиддисмутазы, как известно, приводит к прекращению функционирования этого фермента. Действие перекисного окисления на убиквитин-карбокси-терминальную гидролазу аналогично ее полной элиминации из клетки. Вследствие этого возникает так называемая грациллярная аксональная дистрофия. Обращает на себя внимание то, что нейрофиламенты исключительно чувствительны к оксидативному повреждению. Экспозиция очищенных нейрофиламентов в супероксиддисмутазе и пероксиде водорода вызывает дозозависимую агрегацию указанных белков. Агрегированные нейрофиламенты за счет действия любого из возможных факторов перекисного окисления, в частности аскорбата трихлористого железа, становятся более чувствительными к действию кальпаинов. Это, в свою очередь, приводит к заметному увеличению скорости дегенерации. В клетках нейробластомы человека высокие дозы аскорбата вызывают дегенерацию нейрофиламентов, имеющую дозозависимый эффект, что впоследствии приводит к гибели клетки. В отличие от нейрофиламентов тубулин и актин не подвергаются агрегации в такой модели перекисного окисления. Это означает, что нейрофиламенты имеют практически уникальную чувствительность к оксидативному стрессу. Такая их особенность может быть связана с наличием специфических локусов, сопряженных с лизином и пролином. Эти части белковой молекулы теоретически становятся мишенью для модификации свободными радикалами, что приводит к альтерации и изменению вторичной структуры белка. В модели цитоскелета свободные радикалы приводят к таким критическим изменениям белковых структур, которые вызывают его деструкцию. Данные состояния могут быть предупреждены или уменьшены введением витаминов Е и С.
Особенности проявления аксональной дегенерации указывают на исключительную важность оксидативных процессов в ее формировании. Так, денервация моторных соединений у больных мышей происходит по определенной закономерности. Первыми дегенерируют нейроны и их отростки, имеющие малый и средний уровень резервов. Медленные моторные единицы в меньшей степени подвержены дегенерации. Кроме того, в них быстрее происходит регенерация и восстановление отростков. Общая картина развития нейромышечных заболеваний отражает естественные процессы старения. Единственное отличие — скорость развития этих состояний. Интересным фактом является то, что наиболее уязвимы для оксидативного стресса клетки, в которых уровень окислительного фосфорилирования не слишком высок. Обычно именно в таких клетках количество элементов антиоксидантной системы гораздо ниже. Соответственно склонность к дегенеративным процессам нервной ткани может быть диагностирована по количеству и активности антиоксидантов в данном организме. Еще одним интересным наблюдением является то, что клетки, находящиеся в непосредственной близости к поврежденным элементам, увеличиваются в объеме. Также проявляется увеличенное количество мышечных элементов, компенсаторно иннервируемое ими. Предполагаемой причиной развития дисбаланса между процессами перекисного окисления и антиоксидантной системой может быть слишком быстрая экспрессия мутантного гена, кодирующего синтез супероксиддисмутазы, сдвигающее равновесие систем в сторону перекисного окисления и оксидативного стресса.
Многочисленные антиоксиданты тестировались при выполнении данного исследования. Некоторые из них проявили значительную антиоксидантную активность. Как результат удалось пролонгировать выживаемость мутантных мышей до двух раз относительно контрольной группы. При этом назначение антиоксидантов проводилось в период скрытого, бессимптомного течения заболевания. Тестирование активности антиоксидантных систем организма на пациентах, по результатам метаанализа, не принесло статистически значимого результата. Вследствие того, что измерение степени оксидативного стресса на сегодняшний день не представляется возможным, не удается установить причину отсутствия результата назначение антиоксидантной терапии пациентам. Так, неэффективность лечения может быть связана и с повышением степени окислительных реакций, и с недостаточной эффективностью предлагаемой терапии. Даже если оксидативный процесс играет одну из основных ролей в запуске цепочки реакций, приводящих к аксональной дегенерации, мы не можем с помощью медикаментов предотвратить этот процесс. Таким образом, для разработки эффективной методики лечения оксидативных повреждений при БАС нам необходимо еще более глубокое исследование цепочки патологических процессов, приводящих к этим изменениям.
Роль других клеток
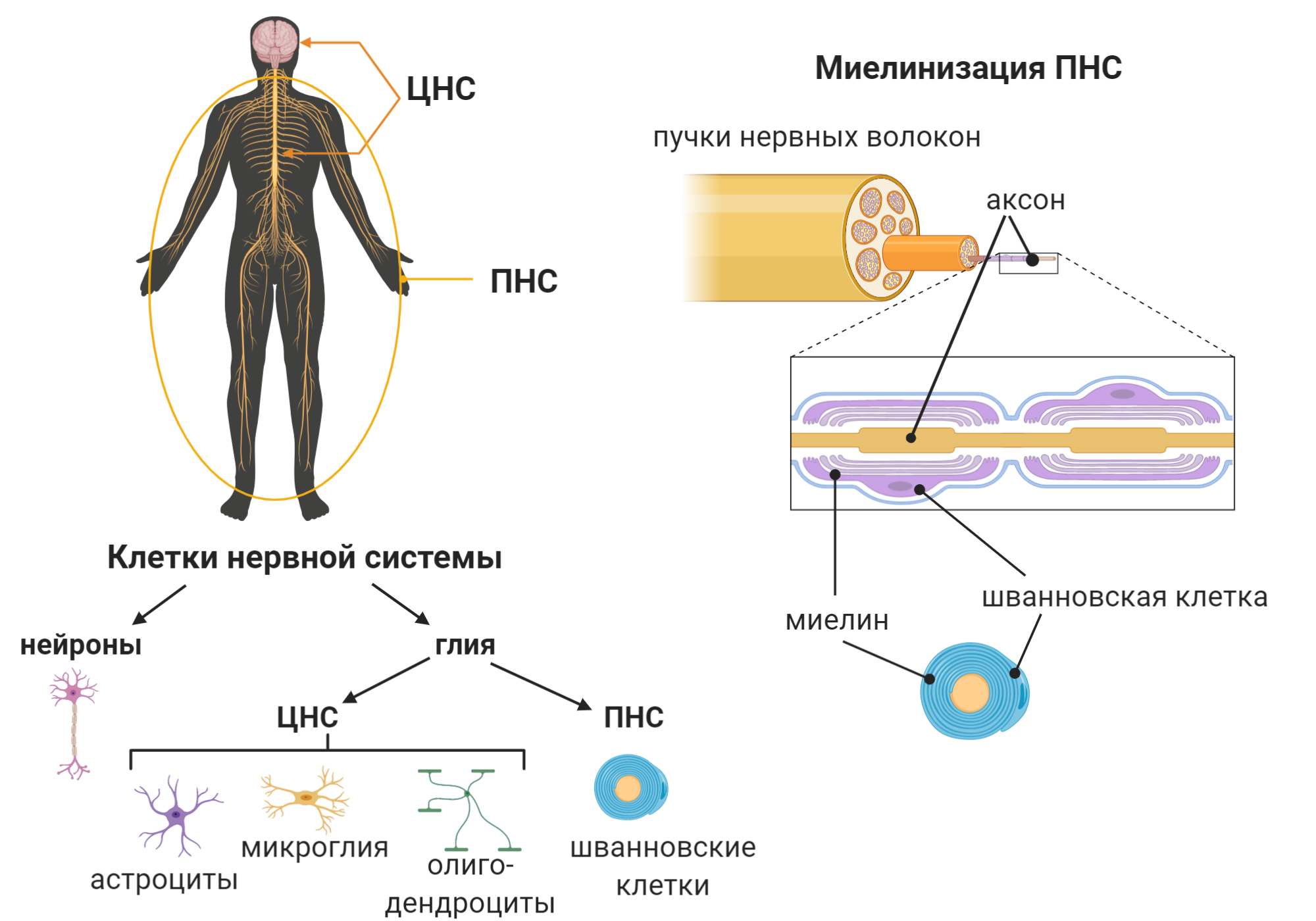
В предшествующих разделах обсуждались явления в нейроне и его частях, которые могут играть важную роль в аксональной дегенерации. Несмотря на несомненно важную роль процессов, происходящих непосредственно в самой клетке, однозначным является то, что дегенеративные изменения при БАС не проходят изолированно только в нейронах. Реакции глиальных клеток также являются достаточно важным прогностическим критерием и признаком степени изменений, уже произошедших в ЦНС. Менее известны феномены, происходящие в клетках, находящихся в непосредственной близости от дистальных участков аксонов. К таким клеточным элементам можно отнести шванновские, мышечные и даже иммунные клетки.
Шванновские клетки являются наиболее крупными глиальными клетками, находящимися в ЦНС. Они имеют контакт с аксонами нервных клеток на огромной площади. Эти участки превосходят места контактов нейронов с астроцитами в несколько десятков раз. Не следует упускать из виду то, что эти клетки являются еще и значительными источниками трофической поддержки и физической защиты нейронов. Таким образом, можно считать, что именно шванновские клетки и нейроглиальные союзы являются наиболее подходящими объектами исследования для выяснения природы гибели нейронов. Мутантная супероксиддисмутаза обнаруживается в шванновских клетках мышей мутантной линии в первые дни постнатального периода. В терминальных шванновских клетках в острый период дегенерации нейронов наблюдается резкое повышение аксонального фактора семафорина-3А. Этот факт означает попытки шванновских клеток противостоять травмирующим факторам за счет синтеза ингибиторов перекисного окисления, проявляющих свойства стимуляторов регенерации. Таким образом, эти клетки глии на некоторое время задерживают начинающуюся дисфункцию нейромышечного соединения и замедляют развитие симптомов БАС.
При аналогичном анализе скелетной мускулатуры в миоцитах также обнаруживается высокий уровень мутантной супероксиддисмутазы, которая аналогичным образом действует на нейромышечное соединение. Некоторые авторы считают, что роль миоцитов заключается в запуске патологических реакций, направленных на дегенерацию нейромышечного соединения. Именно мышечная часть этого образования является причиной данной патологии. Однако достоверных данных, подтверждающих эту теорию, получено не было. Увеличение синтеза фактора роста и ветвления дендритов у пациентов с БАС и у животных мутантных линий вызвало создание гипотезы о возможной роли миоцитов в ингибировании регенеративных процессов дистальных отделов аксонов. В подтверждение этой гипотезы можно привести следующие факты: при ингибировании рядом ферментов указанных факторов роста дендритов увеличение продолжительности жизни мутантных мышей составило порядка 25 дней.
Последние несколько исследований были направлены на выяснение действительной роли миоцитов в формировании дегенерации нейронов у мутантных мышей. Отделение миоцитов из нейромышечного соединения не показало достоверных изменений продолжительности жизни животных мутантных линий. Кроме того, результатом данной работы было лишь незначительное снижение мутантных белков в исследуемых нейронах. Необходимо проведение дополнительных серий экспериментов, которые уточнят роль мышечных клеток в патологии двигательных нейронов. Кроме того, необходимо определить дальнейшие направления исследования для выяснения возможности использования компонентов миоцитов в лечении БАС.
Заключение
В результате масштабных исследований получены очевидные данные, касающиеся патогенеза нейрональной дегенерации. Неоспорим тот факт, что процессы аксональной дегенерации и изменения, происходящие в теле нейрона, наблюдаются независимо друг от друга. Поэтому чрезвычайно важно помнить, что мероприятия, направленные на поддержание жизнедеятельности тела нейрона, не повлияют на клинические проявления БАС и продолжительность жизни. С другой стороны, были выявлены критические зоны развивающейся патологии. С точки зрения авторов именно на них должна быть направлена терапия при дегенеративных состояниях нейронов. Механизм развития аксональной дегенерации до настоящего времени остается неизвестным. Однако с уверенностью можно сказать, что одной из важных фаз развития данных состояний является оксидативный стресс. Множество связанных с ним факторов могут внезапно спровоцировать резкое увеличение реакций перекисного окисления, что вызовет процессы ускоренного старения и, как следствие, дегенерации нервной ткани. В дополнение можно сказать, что роль шванновских клеток в развитии дегенеративных процессов нельзя недооценивать. Это связано именно со свойством данных клеток стимулировать регенеративные процессы в нейронах. Дальнейшие исследования, несомненно, дадут новые факты, которые позволят с иной стороны подойти к рассмотрению патогенеза дегенеративных заболеваний нервной ткани, в частности, к амиотрофическому латеральному склерозу.
Литература
1. Glass J.D. Wallerian degeneration as a window to peripheral neuropathy // J. Neurol. Sci. 2004; 220: 123-124.
2. Gould T.W., Buss R.R., Vinsant S., Prevette D. et al. Complete dissociation of motor neuron death from motor dysfunction by Bax deletion in a mouse model of ALS // J. Neurosci. 2006; 26: 8774-8786.
3. Kostic V., Jackson-Lewis V., de Bilbao F., Dubois-Dauphin M., Przedborski S. Bcl-2: prolonging life in a transgenic mouse model of familial amyotrophic lateral sclerosis // Science 1997; 277: 559-562.
4. Li M., Ona V.O., Guegan C., Chen M., Jackson-Lewis V. et al. Functional role of caspase-1 and caspase-3 in an ALS transgenic mouse model // Science 2000; 288: 335-339.
5. Sagot Y., Dubois-Dauphin M., Tan S.A., de Bilbao F. et al. Bcl-2 overexpression prevents motoneuron cell body loss but not axonal degeneration in a mouse model of a neurodegenerative disease // J. Neurosci. 1995; 15: 7727-7733.
6. Klivenyi P., Ferrante R.J., Matthews R.T., Bogdanov M.B. et al. Neuroprotective effects of creatine in a transgenic animal model of amyotrophic lateral sclerosis // Nat. Med. 1999; 5: 347-350.
7. Chiu A.Y., Zhai P., Dal Canto M.C., Peters T.M. et al. Age-dependent penetrance of disease in a transgenic mouse model of familial amyotrophic lateral sclerosis // Mol. Cell. Neurosci. 1995; 6: 349-362.
8. Kennel P.F., Finiels F., Revah F., Mallet J. Neuromuscular function impairment is not caused by motor neuron loss in PALS mice: an electromyographic study // Neuroreport. 1996; 7: 1427-1431.
9. Frey D., Schneider C., Xu L., Borg J., Spooren W., Caroni P. Early and selective loss of neuromuscular synapse subtypes with low sprouting competence in motoneuron diseases // J. Neurosci. 2000; 20: 2534-2542.
10. Fischer L.R., Culver D.G., Tennant P., Davis A.A. et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man // Exp. Neurol. 2004; 185: 232-240.
11. Pun S., Santos A.F., Saxena S., Xu L., Caroni P. Selective vulnerability and pruning of phasic motoneuron axons in motoneuron disease alleviated by CNTF // Nat. Neurosci. 2006; 9: 408-419.
12. Schaefer A.M., Sanes J.R., Lichtman J.W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis // J. Comp. Neurol. 2005; 490: 209-219.
13. Bommel H., Xie G., Rossoll W., Wiese S., Jablonka S., Boehm T., Sendtner M. Missense mutation in the tubulin-specific chaperone E (Tbce) gene in the mouse mutant progressive motor neuronopathy, a model of human motoneuron disease // J. Cell. Biol. 2002; 159: 563-569.
14. Martin N., Jaubert J., Gounon P., Salido E., Haase G., Szatanik M., Guenet J.L. A missense mutation in Tbce causes progressive motor neuronopathy in mice // Nat. Genet. 2002; 32: 443-447.
15. Holtmann B., Zielasek J., Tokya K.V., Sendtner M. Comparative analysis of motoneuron loss and functional deficits in PMN mice: implications for human motoneuron disease // J. Neurol. Sci. 1999; 169: 140-147.
16. Sendtner M., Schmalbruch H., Stockli K.A. et al. Ciliary neurotrophic factor prevents degeneration of motor neurons in mouse mutant progressive motor neuronopathy // Nature 1992; 358: 502-504.
17. Cifuentes-Dias C., Nicole S., Velasco M.E. et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model // Hum. Mol. Genet. 2002; 11: 1439-1447.
18. Hansen S., Ballantyne J.P. A quantitative electrophysiological study of motor neuron disease // J. Neurol. Neurosurg. Psychiatry 1978; 41: 773-783.
19. Bradley W.G., Good P., Rasool C.G., Adelman L.S. Morphometric and biochemical studies of peripheral nerves in amyotrophic lateral sclerosis // Ann. Neurol. 1983; 14: 267-277.
20. Shefner J.M. Motor unit number estimation in human neurological diseases and animal models // Clin. Neurophysiol. 2001; 112: 955-964.
21. Armon C., Brandstater M.E. Motor unit number estimate-based rates of progression of ALS predict patient survival // Muscle Nerve 1999; 22: 1571-1575.
22. Yuen E.C., Olney R.K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis // Neurology 1997; 49: 573-578.
23. Shefner J.M., Cudkowicz M., Brown R.H. Jr. Motor unit number estimation predicts disease onset and survival in a transgenic mouse model of amyotrophic lateral sclerosis // Muscle Nerve 2006; 34: 603-607.
24.Aggarwal A., Nicholson G. Detection of pre-clinical motor neurone loss in SOD1 mutation carriers using motor unit number estimation // J. Neurol. Neurosurg. Psychiatry 2002; 73: 199-201.
25. Kanai K., Kuwabara S., Misawa S., Tamura N. et al. Altered axonal excitability properties in amyotrophic lateral sclerosis: impaired potassium channel function related to disease stage // Brain 2006; 129: 953-962.
26.Vucic S., Kiernan M.C. Axonal excitability properties in amyotrophic lateral sclerosis // Clin. Neurophysiol. 2006; 117: 1458-1466.
27. Nakata M., Kuwabara S., Kanai K., Misawa S. et al. Distal excitability changes in motor axons in amyotrophic lateral sclerosis // Clin. Neurophysiol. 2006; 117: 1444-1448.
28. Pasinelli P., Brown R.H. Molecular biology of amyotrophic lateral sclerosis: insights from genetics // Nat. Rev. Neurosci. 2006; 7: 710-723.
29. Heads T., Pollock M., Robertson A., Sutherland W.H.F., Allpress S. Sensory nerve pathology in amyotrophic lateral sclerosis // Acta Neuropathol. 1991; 82: 316-320.
30. Kawamura Y., Dyck P.J., Shimono M., Okazaki H., Tateishi J., Doi H. Morphometric comparison of the vulnerability of peripheral motor and sensory neurons in amyotrophic lateral sclerosis // J. Neuropathol. Exp. Neurol. 1981; 40: 667-675.
31. Shefner J.M., Tyler R., Krarup C. Abnormalities in the sensory action potential in patients with amyotrophic lateral sclerosis // Muscle Nerve 1991; 14: 1242-1246.
32. Theys P.A., Peelers E., Robberecht W. Evolution of motor and sensory deficits in amyotrophic lateral sclerosis estimated by neurophysiological techniques // J. Neurol. 1999; 246: 438-442.
33. Fischer L.R., Culver D., Davis A.A., Tennant P. et al. The WldS gene modestly prolongs survival in the SOD1-G93A fALS mouse // Neurobiol. Dis. 2005; 19: 293-300.
34. Anagnostou E., Miller S.P., Guiot M.C., Karpati G. et al. Type I spinal muscular atrophy can mimic sensory-motor axonal neuropathy // J. Child Neurol. 2005; 20: 147-150.
35. Rudnik-Schoneborn S., Goebel H.H., Schlote W. et al. Classical infantile spinal muscular atrophy with SMN deficiency causes sensory neuronopathy // Neurology 2003; 60: 983-987.
36. Jablonka S., Karle K., Sandner B., Andreassi C., von Au K., Sendtner M. Distinct and overlapping alterations in motor and sensory neurons in a mouse model of spinal muscular atrophy // Human Mol. Genet. 2006; 15: 511-518.
37. Finn J.T., Weil M., Archer F., Siman R., Srinivasan A., Raff M.C. Evidence that Wallerian degeneration and localized axon degeneration induced by local neurotrophin deprivation do not involve caspases // J. Neurosci. 2000; 20: 1333-1341.
38. Sagot Y., Vejsada R., Kato A. Clinical and molecular aspects of motoneurone diseases: animal models, neurotrophic factors and Bcl-2 oncoprotein // Trends Pharmacol. Sci. 1997; 18: 330-337.
39. Lunn E.R., Perry V.H., Brown M.C., Rosen H., Gordon S. Absence of Wallerian degeneration does not hinder regeneration in peripheral nerve // Eur. J. Neurosci. 1989; 1: 27-33.
40. Conforti L., Tarlton A., Mack T.G.A., Mi W. et al. A Ufd2/D4Colele chimeric protein and overexpression of Rbp7 in the slow Wallerian degeneration (Wld s ) mouse // Proc. Natl. Acad. Sci. USA 2000; 97: 11377-11382.
41. Wang M.S., Davis A.A., Culver D.G., Glass J.D. WldS mice are resistant to paclitaxel (taxol) neuropathy // Ann. Neurol. 2002; 52: 442-447.
42. Wang M.S., Fang G., Culver D.G., Davis A.A., Rich M.M., Glass J.D. The Wld s protein protects against axonal degeneration: a model of gene therapy for peripheral neuropathy // Ann. Neurol. 2001; 50: 773-779.
43. Wang M.S., Wu Y., Culver D.G., Glass J.D. The gene for slow Wallerian degeneration (Wld s ) is also protective against vincristine neuropathy // Neurobiol. Dis. 2001; 8: 155-161.
44.Ferri A., Sanes J.R., Coleman M.P., Cunningham J.M., Kato A.C. Inhibiting axon degeneration and synapse loss attenuates apoptosis and disease progression in a mouse model of motoneuron disease // Curr. Biol. 2003; 13: 669-673.
45. Samsam M., Mi W., Wessig C., Zielasek J. et al. The Wlds mutation delays robust loss of motor and sensory axons in a genetic model for myelin-related axonopathy // J. Neurosci. 2003; 23: 2833-2839.
46. Deckwerth T.L., Johnson J., Eugene M. Neurites can remain viable after destruction of the neuronal soma by programmed cell death (apoptosis) // Dev. Biol. 1994; 165: 63-72.
47. Adalbert R., Nogradi A., Szabo A., Coleman M.P. The slow Wallerian degeneration gene in vivo protects motor axons but not their cell bodies after avulsion and neonatal axotomy // Eur. J. Neurosci. 2006; 24: 2163-2168.
48. Coleman M. Axon degeneration mechanisms: commonality amid diversity // Nat. Rev. Neurosci. 2005; 6: 889-898.
49. Raff M.C., Whitmore A.V., Finn J.T. Axonal self-destruction and neurodegeneration // Science 2002; 296: 868-871.
50. Coleman M.P., Perry V.H. Axon pathology in neurological disease: a neglected therapeutic target // Trends Neurosci. 2002; 25: 532-537.
51. Vande Velde C., Garcia M.L., Yin X., Trapp B.D., Cleveland D.W. The neuroprotective factor Wlds does not attenuate mutant SODl-mediated motor neuron disease // Neuromolecular Med. 2004; 5: 193-203.
52. Crawford T.O., Hsieh S.T., Schryer B.L., Glass J.D. Prolonged axonal survival in transected nerves of C57BL/Ola mice is independent of age // J. Neurocytol. 1995; 24: 333-340.
53. Gillingwater T.H., Thomson D., Mack T.G.A. et al. Age-dependent synapse withdrawal at axotomised neuromuscular junctions in Wld s mutant and Ube4b/Nmnat transgenic mice // J. Physiol. 2002; 543: 739-755.
54.Araki T., Sasaki Y., Millbrandt J. Increased nuclear NAD biosynthesis and SIRT1 activation prevent axonal degeneration // Science 2004; 305: 1010-1013.
55. Wang J., Zhai Q., Chen Y., Lin E., Gu W., McBurney M.W., He Z. A local mechanism mediates NAD-dependent protection of axon degeneration // J. Cell. Biol. 2005; 170: 349-355.
56. Conforti L., Fang G., Beirowski B., Wang M.S. et al. NAD(+) and axon degeneration revisited: Nmnatl cannot substitute for Wld(S) to delay Wallerian degeneration // Cell Death Differ. 2007; 14: 116-127.
57. Bartus R., Elliott P., Hayward N. Calpain as a novel target for treating acute neurodegenerative disorders // Neurol. Res. 1995; 17: 249-258.
58. Wang M.S., Wu Y., Culver D., Glass J.D. Pathogenesis of axonal degeneration: parallels between Wallerian degeneration and vincris-tine neuropathy // J. Neuropathol. Exp. Neurol. 2000; 59: 599-606.
59. Wang M.S., Davis A.A., Culver D.G., Wang Q., Powers J.C., Glass J.D. Calpain inhibition protects against Taxol-induced sensory neuropathy // Brain 2004; 127: 671-679.
60. O’Hanlon G.M., Humphreys P.D., Goldman R.S. et al. Calpain inhibitors protect against axonal degeneration in a model of anti-ganglioside antibody-mediated motor nerve terminal injury // Brain 2003; 126: 2497-2509.
61. Adamec E., Mohan P., Vonsattel J.P., Nixon R.A. Calpain activation in neurodegenerative diseases: confocal immunofluorescence study with antibodies specifically recognizing the active form of calpain 2 // Acta Neuropathol. 2002; 104: 92-104.
62. Nixon R.A., Saito K.I., Grynspan F., Griffin W.R. et al. Calcium-activated neutral proteinase (calpain) system in aging and Alzheimer’s disease // Ann. NY Acad. Sci. 1994; 747: 77-91.
63. Kieran D., Greensmith L. Inhibition of cal-pains, by treatment with leupeptin, improves motoneuron survival and muscle function in models of motoneuron degeneration // Neuroscience 2004; 125: 427-439.
64. Li J., Nixon R.A., Messer A., Berman S., Bursztajn S. Altered gene expression for calpain/calpastatin system in motor neuron degeneration (Mnd) mutant mouse brain and spinal cord // Brain Res. Mol. Brain Res. 1998; 53: 174-186.
65. Brown J., Robert H. Superoxide dismutase in familial amyotrophic lateral sclerosis: models for gain of function // Curr. Opin. Neurobiol. 1995; 5: 841-846.
66. Cleveland D.W., Rothstein J.D. From Charcot to Lou Gehrig: deciphering selective motor neuron death in ALS // Nat. Rev. Neurosci. 2001; 2: 806-819.
67. Boillee S., Vande Velde C., Cleveland D.W. ALS: a disease of motor neurons and their nonneuronal neighbors // Neuron 2006; 52: 39-59.
68. Williamson T.L., Cleveland D.W. Slowing of axonal transport is a very early event in the toxicity of ALS-linked SOD1 mutants to motor neurons // Nat. Neurosci. 1999; 2: 50-56.
69. Zhang B., Tu P.H., Abtahian F., Trojanowski J.Q., Lee V.M.Y. Neurofilaments and orthograde transport are reduced in ventral root axons of transgenic mice that express human SOD1 with a G93A mutation // J. Cell. Biol. 1997; 139: 1307-1315.
70. Warita H., Itoyama Y., Abe K. Selective impairment of fast anterograde axonal transport in the peripheral nerves of asymptomatic transgenic mice with a G93A mutant SOD1 gene // Brain Res. 1999; 819: 120-131.
71. Sasaki S., Iwata M. Impairment of fast axonal transport in the proximal axons of anterior horn neurons in amyotrophic lateral sclerosis // Neurology 1996; 47: 535-540.
72. Murakami T., Nagano I., Hayashi T., Manabe Y. et al. Impaired retrograde axonal transport of adenovirus-mediated E. coli LacZ gene in the mice carrying mutant SOD1 gene // Neurosci. Lett. 2001; 308: 149-152.
73. Kieran D., Hafezparast M., Bohnert S. et al. A mutation in dynein rescues axonal transport defects and extends the life span of ALS mice // J. Cell. Biol. 2005; 169: 561-567.
74. Hafezparast M., Klocke R., Ruhrberg C. et al. Mutations in dynein link motor neuron degeneration to defects in retrograde transport // Science 2003; 300: 808-812.
75. LaMonte B., Wallace K.E., Holloway B.A. et al. Disruption of dynein/dynactin inhibits axonal transport in motor neurons causing late-onset progressive deterioration // Neuron 2002; 34: 715-727.
76. Puls I., Jonnakuty C., LaMonte B., Holzbaur E.L.F. et al. Mutant dynactin in motor neuron disease // Nat. Genet. 2003; 33: 455-456.
77. Balaban R.S., Nemoto S., Finkel T. Mitochondria, oxidants, and aging // Cell 2005; 120: 483-495.
78. Barber S.C., Mead R.J., Shaw P.J. Oxidative stress in ALS: a mechanism of neurodegeneration and a therapeutic target // Biochim. Biophys. Acta 2006; 1762: 1051-1067.
79. Hall E.D., Andrus P.K., Oostveen J.A., Fleck T.J., Gurney M.E. Relationship of oxygen radical-induced lipid peroxidative damage to disease onset and progression in a transgenic model of familial ALS // J. Neurosci. Res. 1998; 53: 66-77.
80. Shefner J.M., Reaume A.G., Flood D.G. et al. Mice lacking cytosolic copper/zinc superoxide dismutase display a distinctive motor axonopathy // Neurology 1999; 53: 1239-1246.
81. Muller P.L., Song W., Liu Y. et al. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy // Free Radic. Biol. Med. 2006; 40: 1993-2004.
82. Flood D.G., Reaume A.G., Gruner J.A., Hoffman E.K. et al. Hindlimb motor neurons require Cu/Zn superoxide dismutase for maintenance of neuromuscular junctions // Am. J. Pathol. 1999; 155: 663-672.
83. Echtay K.S., Roussel D., St-Pierre J., Jekabsons M.B. et al. Superoxide activates mitochondrial uncoupling proteins // Nature 2002; 415: 96-99.
84. Fernandez H.L., Hodges-Savola C.A. Axoplasmic transport of calcitonin gene-related peptide in rat peripheral nerve as a function.of age // Neurochem. Res. 1994; 19: 1369-1377.
85.Frolkis V.V., Tanin S.A., Gorban Y.N. Age-related changes in axonal transport // Exp. Gerontol. 1997; 32: 441-450.
86. Shea T.B., Zheng Y.L., Ortiz D., Pant H.C. Cyclin-dependent kinase 5 increases perikaryal neurofilament phosphorylation and inhibits neurofilament axonal transport in response to oxidative stress // J. Neurosci. Res. 2004; 76: 795-800.
87. Giniatullin A.R., Darios F., Shakirzyanova A., Davletov B., Giniatullin R. SNAP25 is a pre-synaptic target for the depressant action of reactive oxygen species on transmitter release // J. Neurochem. 2006; 98: 1789-1797.
88. Berliocchi L., Fava E., Leist M., Horvat V., Dinsdale D., Read D., Nicotera P. Botulinum neurotoxin C initiates two different programs for neurite degeneration and neuronal apoptosis // J. Cell Biol. 2005; 168: 607-618.
89. Hodgson E.K., Fridovich I. The interaction of bovine erythrocyte superoxide dismutase with hydrogen peroxide: inactivation of the enzyme // Biochemistry 1975; 14: 5294-5299.
90. Poon H.P., Hensley K., Thongboonkerd V., Merchant M.L. et al. Redox proteomics analysis of oxidatively modified proteins in G93A-SOD1 transgenic mice — a model of familial amyotrophic lateral sclerosis // Free Radic. Biol. Med. 2005; 39: 453-462.
91. Saigoh K., Wang Y.L., Suh J.G., Yamanishi T., Sakai Y. et al. Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice // Nat. Genet. 1999; 23: 47-51.
92. Kim N.H., Jeong M.S., Choi S.Y., Hoon Kang J. Oxidative modification of neurofilament-L by the Cu,Zn-superoxide dismutase and hydrogen peroxide system // Biochimie 2004; 86: 553-559.
93. Troncoso J.C., Costello A.C., Kim J.H., Johnson G.V. Metal-catalyzed oxidation of bovine neurofilaments in vitro // Free Radic. Biol. Med. 1995; 18: 891-899.
94. Cookson M.R., Thatcher N.M., Ince P.G., Shaw P.J. Selective loss of neurofilament proteins after exposure of differentiated human IMR-32 neuroblastoma cells to oxidative stress // Brain Res. 1996; 738: 162-166.
95. Gelinas S., Chapados C., Beauregard M., Gosselin I., Martinoli M.G. Effect of oxidative stress on stability and structure of neurofilament proteins // Biochem. Cell Biol. 2000; 78: 667-674.
96. Counterman A.E., D’Onofrio T.G., Andrews A.M., Weiss P.S. A physical model of axonal damage due to oxidative stress // Proc. Natl. Acad. Sci. USA 2005; 103: 5262-5266.
97. Gordon T., Hegedus J., Tarn S.L. Adaptive and maladaptive motor axonal sprouting in aging and motoneuron disease // Neurol. Res. 2004; 26: 174-185.
98. Luff A.R. Age-associated changes in the innervation of muscle fibers and changes in the mechanical properties of motor units // Ann. NY Acad. Sci. 1998; 854: 92-101.
99. Hollander J., Fiebig R., Gore M., Bejma J., Ookawara T., Ohno H., Ji L.L. Superoxide dismutase gene expression in skeletal muscle: fiber-specific adaptation to endurance training // Am. J. Physiol. 1999; 277: R856-R862.
100. Crow J.P., Calingasan N.Y., Chen J., Hill J.L., Beal M.F. Manganese porphyrin given at symptom onset markedly extends survival of ALS mice // Ann. Neurol. 2005; 58: 258-265.
101. Liu R., Li B., Flanagan S.W., Oberley L.W., Gozal D., Qiu M. Increased mitochondrial antioxidative activity or decreased oxygen free radical propagation prevent mutant SOD1-mediated motor neuron cell death and increase amyotrophic lateral sclerosis-like transgenic mouse survival // J. Neurochem. 2002; 80: 488-500.
102. Orrell R.W., Lane R.J., Ross M. Antioxidant treatment for amyotrophic lateral sclerosis/motor neuron disease // Cochrane Database Syst. Rev. 2005; 1: CD002829.
103. Lino M.M., Schneider C., Caroni P. Accumulation of SOD1 mutants in postnatal moto-neurons does not cause motoneuron pathology or motoneuron disease // J. Neurosci. 2002; 22: 4825-4832.
104. Pramatarova A., Laganiere J., Roussel J., Brisebois K., Rouleau G.A. Neuron-specific expression of mutant superoxide dismutase 1 in transgenic mice does not lead to motor impairment // J. Neurosci. 2001; 21: 3369-3374.
105. Boillee S., Yamanaka K., Lobsiger C.S., Copeland N.G. et al. Onset and progression in inherited ALS determined by motor neurons and microglia // Science 2006; 312: 1389-1392.
106. Clement A., Nguyen M., Roberts E., Garcia M. et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice // Science 2003; 302: 113-117.
107. Hall E.D., Oostveen J.A., Gurney M.E. Relationship of microglial and astrocytic activation to disease onset and progression in a transgenic model of familial ALS // Glia 1998; 23: 249-256.
108. Howland D.S., Liu J., She Y. et al. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS) // Proc. Natl. Acad. Sci. USA 2002; 99: 1604-1609.
109. Di Giorgio F.P., Carrasco M.A., Siao M.C., Maniatis T., Eggan K. Non-cell autonomous effect of glia on motor neurons in an embryonic stem cell-based ALS model // Nat. Neurosci. 2007; 10: 608-614.
110. Nagai M., Re D.B., Nagata T., Chalazonitis A. et al. Astrocytes expressing ALS-linked mutated SOD1 release factors selectively toxic to motor neurons // Nat. Neurosci. 2007; 10: 615-622.
111. De Winter F., Vo T., Stam F.J., Wisman L.A. et al. The expression of the chemorepellent Semaphorin 3A is selectively induced in terminal Schwann cells of a subset of neuromuscular synapses that display limited anatomical plasticity and enhanced vulnerability in motor neuron disease // Mol. Cell. Neurosci. 2006; 32: 102-117.
112. Turner B.J., Lopes E.C., Cheema S.S. Neuromuscular accumulation of mutant superoxide dismutase 1 aggregates in a transgenic mouse model of familial amyotrophic lateral sclerosis // Neurosci. Lett. 2003; 350: 132-136.
113. Taylor A.R., Gifondorwa D.J., Newbern J.M, Robin-son M.B. et al. Astrocyte and muscle-derived secreted factors differentially regulate motoneuron survival // J. Neurosci. 2007; 27: 634-644.
114. Dupuis L., Gonzalez de Aguilar J.L., di Scala F., Rene F., de Tapia M. et al. Nogo provides a molecular marker for diagnosis of amyotrophic lateral sclerosis // Neurobiol. Dis. 2002; 10: 358-365.
115. Jokic N., Gonzalez de Aguilar J.L., Dimou L. et al. The neurite outgrowth inhibitor Nogo-A promotes denervation in an amyotrophic lateral sclerosis model // EMBO Rep. 2006; 7: 1162-1167.
116. Miller T.M., Kim S.H., Yamanaka K. et al. Gene transfer demonstrates that muscle is not a primary target for non-cell-autonomous toxicity in familial amyotrophic lateral sclerosis // Proc. Natl. Acad. Sci. USA 2006; 103: 19546-19551.
117. Holzbaur E.L., Howland D.S., Weber N. et al. Myostatin inhibition slows muscle atrophy in rodent models of amyotrophic lateral sclerosis // Neurobiol. Dis. 2006; 23: 697-707.
118. Dobrowolny G., Giacinti C., Pelosi L., Nicoletti C. et al. Muscle expression of a local Igf-1 isoform protects motor neurons in an ALS mouse model // J. Cell. Biol. 2005; 168: 193-199.
119. Cifuentes-Diaz C., Frugier T., Tiziano F.D., Lacene E. et al. Deletion of murine SMN exon 7 directed to skeletal muscle leads to severe muscular dystrophy // J. Cell. Biol. 2001; 152: 1107-1114.
120. Rosen D., Siddique T., Patterson D., Figlewicz D., Sapp P. et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis // Nature 1993; 362: 59-62.
121. Ranta S., Zhang Y., Ross B., Lonka L., Takkunen E. et al. The neuronal ceroid lipofuscinoses in human EPMR and mnd mutant mice are associated with mutations in CLN8 // Nat. Genet. 1999; 23: 233-236.
122. Lefebvre S., Burglen L., Reboullet S., Clermont O. et al. Identification and characterization of a spinal muscular atrophy-determining gene // Cell 1995; 80: 155-165.
123. McWhorter M.L., Monani U.R., Burghes A.H., Beat-tie C.E. Knockdown of the survival motor neuron (Smn) protein in zebrafish causes defects in motor axon outgrowth and pathfinding // J. Cell. Biol. 2003; 162: 919-931.
124. Rich M.M., Wang X., Cope T.C., Pinter M.J. Reduced neuromuscular quantal content with normal synaptic release time course and depression in canine motor neuron disease // J. Neurophysiol. 2002; 88: 3305-3314.
125. La Spada A.R., Wilson E.M., Lubahn D.B., Harding A.E., Fischbeck K.H. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy // Nature 1991; 352: 77-79.
126. Katsuno M., Adachi H., Minamiyama M., Waza M. et al. Reversible disruption of dynactin 1-mediated retrograde axonal transport in polyglutamine-induced motor neuron degeneration // J. Neurosci. 2006; 26: 12106-12117.
127. Chambers D.M., Peters J., Abbott C.M. The lethal mutation of the mouse wasted (wst) is a deletion that abolishes expression of a tissue-specific isoform of translation elongation factor lalpha, encoded by the Eefla2 gene // Proc. Natl. Acad. Sci. USA 1998; 95: 4463-4468.
128. Newbery H.J., Gillingwater T.H., Dharmasaroja P. et al. Progressive loss of motor neuron function in wasted mice: effects of a spontaneous null mutation in the gene for the eEF1 A2 translation factor // J. Neuropathol. Exp. Neurol. 2005; 64: 295-303.
129. Schmitt-John T., Drepper C., Mussmann A., Hahn P. et al. Mutation of Vps54 causes motor neuron disease and defective spermiogenesis in the wobbler mouse // Nat. Genet. 2005; 37: 1213-1215.
130. Blondet B., Carpentier G., Ait-Ikhlef A., Murawsky M., Rieger F. Motoneuron morphological alterations before and after the onset of the disease in the wobbler mouse // Brain Res. 2002; 930: 53-57.
131. Oosthuyse B., Moons L., Storkebaum E., Beck H. et al. Deletion of the hypoxia-response element in the vascular endothelial growth factor promoter causes motor neuron degeneration // Nat. Genet. 2001; 28: 131-138.
132. Miura H., Oda K., Endo C., Yamazaki K., Shibasaki H., Kikuchi T. Progressive degeneration of motor nerve terminals in GAD mutant mouse with hereditary sensory axonopathy // Neuropathol. Appl. Neurobiol. 1993; 19: 41-51.
133. Liedtke W., Leman E.E., Fyffe R.E., Raine C.S., Schubart U.K. Stathmin-deficient mice develop an age-dependent axonopathy of the central and peripheral nervous systems // Am. J. Pathol. 2002; 160: 469-480.
134. Dewil M., dela Cruz V.F., Van Den Bosch L., Robberecht W. Inhibition of p38 mitogen activated protein kinase activation and mutant SOD1G93A -induced motor neuron death // Neurobiol. Dis. 2007; 26: 332-341.
135. Rouaux C., Panteleeva I., Rene F., Gonzalez de Aguilar J.L. et al. Sodium valproate exerts neuroprotective effects in vivo through CREB-binding protein-dependent mechanisms but does not improve survival in an amyotrophic lateral sclerosis mouse model // J. Neurosci. 2007; 27: 5535-5545.
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Аксональные полинейропатии: патогенез и лечение
Как цитировать:
Ковражкина Е.А. Аксональные полинейропатии: патогенез и лечение. Журнал неврологии и психиатрии им. С.С. Корсакова.
2013;113(6):22‑25.
Kovrazhkina EA. Axonal polyneuropathies: pathogenesis and treatment. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(6):22‑25. (In Russ.)

Полинейропатия (ПНП) — заболевание периферической нервной системы, развивающееся в результате диффузного поражения периферических нервов — их аксонов (аксональные полинейропатии), миелиновой оболочки (демиелинизирующие полинейропатии) либо тел нейронов (нейронопатии) [9]. В основе патогенеза полинейропатий аксонального типа лежит генерализованное повреждение осевых цилиндров периферических нервов.
Патогенез. Аксональная дегенерация (аксонопатия) — результат нарушения метаболизма нейрона вследствие недостаточной выработки энергии в митохондриях и/или нарушения аксонального транспорта. Миелиновая оболочка при аксонопатиях страдает вторично (вторичная демилинизация). Миелин может повреждаться в результате ишемии нервов (поражения vasa nevrorum), отложения токсичных для нерва веществ или иммунных комплексов в эндоневрии (что характерно, например, для сахарного диабета, особенно 1-го типа — с высокой гипергликемией и аутоиммунными нарушениями) [4]. Соответственно, среди причин аксонопатии периферических нервов указывают нарушения метаболизма, токсические влияния, ишемию нервных стволов, наследственную предрасположенность и аутоиммунные механизмы [5]. По этиологическому фактору подавляющее большинство аксональных ПНП составляют метаболические и токсические, среди которых первое место занимают диабетическая (до 50% среди пациентов с сахарным диабетом и до 90% поражений нервной системы при диабете [9, 12]) и алкогольная (до 50% среди больных алкоголизмом [2, 9]).
Причиной токсико-метаболических ПНП является экзо- и эндогенные интоксикации. Поступающие извне вещества или собственные его метаболиты, токсичные для периферических нервов, вызывают их повреждение. Тяжесть этого повреждения зависит от степени токсичности данного агента (выделяют острые метаболические ПНП, развивающиеся на фоне тяжелой общей интоксикации, например, ПНП при быстро нарастающих печеночной недостаточности или уремии, при отравлении фосфоорганическими веществами, мышьяком, свинцом, как нежелательный эффект лечения препаратами лития, цитостатиками), длительности его воздействия, собственных генетических особенностей метаболизма нервной ткани, немаловажную роль играет также аутоиммунный фактор [13].
Большинство часто встречающихся в клинике метаболических ПНП являются итогом длительного воздействия эндо- и экзогенного токсического агента (диабетическая, печеночная, уремическая, алкогольная, профессиональная, лекарственная). Результатом такой интоксикации является повреждение осевого цилиндра аксона. Клинически это проявляется не только нарушениями чувствительности и мышечной слабостью (что свойственно и для демиелинизирующих ПНП), но и мышечными гипотрофиями, выраженными трофическими нарушениями. Все эти признаки свидетельствуют о длительном страдании аксонов периферических нервов. При электронейромиографии (ЭНМГ) выявляется снижение (иногда — вплоть до полного отсутствия) амплитуды сенсорных потенциалов и М-ответов периферических нервов. У пациентов с ПНП аксонального типа зачастую в достаточной степени сохранены двигательные функции (отсутствуют выраженные парезы, больные сохраняют способность ходить, часто без дополнительной опоры), тогда как инвалидизирующими являются чувствительные (боли и парестезии) и трофические нарушения. Так, аксональная сенсомоторная ПНП является одним из важных патогенетических факторов развития синдрома диабетической стопы [3]. Аксональное повреждение нервов развивается медленно, исподволь, но при правильном лечении потенциально обратимо.
При массивном воздействии токсичного для периферической нервной системы агента, участии ишемического компонента (за счет страдания vasa nevrorum), аутоиммунных влияний развиваются ПНП аксонально-демиелинизирующего типа такие, например, как уремическая, свинцовая, амиодароновая, вызываемые воздействиями высокотоксичных для нервов веществами [9]. При наиболее распространенной диабетической ПНП, демиелинизирующий компонент максимально представлен при инсулинпотребном сахарном диабете (характеризующимся более высокой гипергликемией), а выраженность демиелинизации периферических нервов нарастает при резких повышениях уровня глюкозы крови [4, 7]. На представленность демиелинизирующего компонента при метаболических ПНП влияют наследственные факторы (генетически обусловленная миелинопатия, которая протекала бы субклинически без дополнительного воздействия токсического агента), аутоиммунное повреждение (например, миелинопатия более выражена при сахарном диабете 1-го типа, при котором иммунокомпетентные клетки повреждают ткань поджелудочной железы) [4, 14].
ПНП аксонально-демиелинизирующего типа протекают более тяжело, с выраженными парезами, сенситивной атаксией, нейропатическим болевым синдромом, но нередко, при своевременном устранении действия токсического фактора, быстро регрессируют. При очень тяжелом и упорном течении заболевания, учитывая роль аутоиммунного механизма в развитии данного типа метаболических ПНП, необходимо кратковременное назначение иммуномодулирующей терапии (чаще глюкокортикоидов, иногда цитостатиков) [9, 11].
Клиническое течение ПНП. Как уже было сказано, при длительном воздействии умеренно токсичного для нервов агента аксонопатия развивается медленно, что не всегда заметно. Преимущественное поражение бедно миелинизированых вегетативных и сенсорных волокон вызывает парестезии, повышенную холодовую чувствительность кистей и стоп, негрубые трофические нарушения. При ЭНМГ не всегда удается выявить характерные признаки сенсорной и моторной аксонопатии — снижение амплитуд сенсорных потенциалов и М-ответов — если исследуются крупные богато миелинизированные нервы, аксоны которых страдают позднее. Быстрее выявляются признаки вторичной миелинопатии, как клинические — присоединение нейропатических болей, парезов, так и миографические — снижение скорости распространения возбуждения (СРВ) по нервам.
При условии адекватной терапевтической стратегии — устранения действия повреждающего периферические нервы фактора, назначение препаратов, влияющих на метаболизм нервной ткани, — наступает ремиелинизация, что отражается и на ЭНМГ в виде нарастания СРВ, и клинически — в виде регресса парезов и нейропатических болей, улучшения чувствительности. Однако, если полинейропатия развивалась в условиях длительного действия токсического агента, поражение аксонов периферических нервов, снижение амплитуд сенсорных потенциалов и М-ответов на ЭНМГ сохраняется, поскольку осевые цилиндры нервов обладают гораздо меньшей способностью к регенерации, чем миелин.
Так, в проведенном исследовании [8], посвященном лечению алкогольной ПНП, ведущим ЭНМГ-признаком поражения периферических нервов у большинства пациентов имелось снижение СРВ. В условиях элиминации токсического фактора (в данном случае приема алкоголя) и лечения препаратом α-липоевой кислоты (берлитион в суточной дозе 600 мг), у пациентов быстро, в течение 1-го месяца, регрессировали ЭНМГ и клинические признаки миелинопатии — уменьшалась выраженность парезов и болевого синдрома (в баллах по визуальной аналоговой шкале с 5,2±1,0 до 2,6±0,5) достоверно (р<0,05) нарастала СРВ (по моторным волокнам n. tibialis с 36,93±1,12 до 42,22±0,8 м/с, по сенсорным волокнам n. suralis c 32,45±0,70 до 38,24±0,50 м/с), но признаки аксонопатии (снижение амплитуд сенсорных и моторных ответов периферических нервов, сенсорные выпадения по полиневритическому типу, трофические нарушения) сохранялись и после 6 нед лечения.
Таким образом, можно представить следующую схему развития и течения метаболических ПНП (см. таблицу): высокотоксичные, высококонцентрированные токсические агенты приводят к развитию полинейропатии аксонально-демиелинизирующего типа (в развитии которых также значительную роль играют наследственный, сосудистый, аутоиммунный факторы), длительно действующие эндо- и экзогенные яды приводят преимущественно к страданию аксонов с умеренно выраженным вторичным поражением миелина (так как постоянно идет процесс ремиелинизации) [7].
Лечение. Аксональное повреждение нервов как первичного, так и вторичного характера, обратимо за счет регенерации поврежденных аксонов и концевого спрутинга сохранившихся аксонов, однако этот процесс протекает медленно (месяцы), часто аксональная регенерация бывает неполной. Для регресса аксонопатии периферических нервов необходимо нивелировать воздействие токсического агента (коррекция метаболических и алиментарных нарушений, детоксикация, влияние на аутоиммунные механизмы), большое значение имеет также патогенетическая терапия, направленная на восстановление нарушенного метаболизма аксонов (митохондриальные нарушения, повреждения, вызванные окислительным стрессом).
Таким образом, в патогенетическом лечении аксональных ПНП, в зависимости от их нозологического и клинико-электрофизиологического варианта, должны присутствовать детоксикация и коррекция метаболических и алиментарных нарушений; сосудистая терапия (дезагреганты, венотоники, пентоксифиллин, вазопростан); препараты, воздействующие на универсальные механизмы поражения аксонов (витамины и витаминоподобные препараты); при необходимости — воздействие на аутоиммунные компоненты (глюкокортикоиды, плазмаферез). В некоторых случаях, когда представленность миелинопатии в структуре поражения периферических нервов велика и трудно отличить токсико-метаболическую полинейропатию от воспалительной (например, синдром Гийена-Барре у пациента с алкоголизмом или дебют хронической воспалительной демиелинизирующей ПНП у больного с сахарным диабетом) необходимо проводить пробную иммуномодулирующую терапию, ее быстрая эффективность позволит высказаться в пользу превалирования у пациента аутоиммуного механизма поражения периферических нервов [7, 11].
В лечении всех метаболических ПНП необходимо устранить (по возможности) поражающий периферические нервы яд и использовать препараты, улучшающие метаболизм нервной ткани периферических нервов. Последние необходимо применять в течение длительного времени, так как первым эффектом данных препаратов будет ускорение ремиелинизации, но для восстановления самих аксонов — а данные ПНП являются аксональными — требуется значительно большее количество времени.
α-липоевая (тиоктовая) кислота — витаминоподобное вещество, эндогенно образующееся в организме, как кофермент участвует в окислительном декарбоксилировании α-кетокислот. Основная функция эндогенной липоевой кислоты в организме — участие в аэробном метаболизме продукта гликолиза пирувата. Тиоктовая кислота является коферментом в окислительном декарбоксилировании пировиноградной кислоты до ацетил-КоА и α-кетоглутаровой до сукцинил-КоА в цикле Кребса. Облегчая превращение молочной кислоты в пировиноградную с последующим декарбоксилированием последней, α-липоевая способствует ликвидации метаболического ацидоза [6]. Тиоктовая кислота обладает сложным комплексным действием: гипогликемическим, липотропным, гепатопротекторным, антиатеросклеротическим, является мощным антиоксидантом. Липоевая кислота может существовать в окисленной (-S-S-) и восстановленной (SH-)-формах, благодаря чему реализуются ее коферментные и антиоксидантные функции. Восстановленная форма, дигидролипоевая кислота, служит донором электронов для восстановления других антиоксидантов (витамины С, Е и глутатион), осуществляет рецикл витамина Е при его истощении. Дигидролипоат повышает интра- и экстрацеллюлярный уровни глутатиона — эндогенного антиоксиданта.
Эффект экзогенно вводимой α-липоевой кислоты в отношении полиневритического синдрома впервые обнаружен при сахарном диабете. Обусловленная сахарным диабетом гипергликемия приводит к отложению глюкозы на матричных протеинах кровеносных сосудов и образованию конечных продуктов прогрессирующего гликозилирования, в результате чего уменьшается эндоневральный кровоток, возникает эндоневральная ишемия. α-липоевая кислота приводит к снижению уровня глюкозы в крови и повышению содержания гликогена в печени, обладает гипогликемическим действием. На фоне воздействия препарата уменьшается выраженность сенсорных симптомов полинейропатии — боли, жжения, ощущения онемения и «ползания мурашек» в конечностях.
Применение α-липоевой кислоты оказывает положительное влияние на универсальные механизмы аксонального повреждения, такие как повреждающее действие окислительного стресса и митохондриальная дисфункция — за счет антиоксидантного действия, повышения содержания глутатиона. Энергокорригирующее действие α-липоевой кислоты, тропное именно к аксонам нервов, способствует, в конечном итоге, быстрейшей регенерации аксонов [18].
Препарат не только редуцирует проявления окислительного стресса, но и оказывает влияние на сосудистый компонент поражения периферических нервов, нормализуя эндоневральный кровоток (что имеет большое значения, например, при дибетической микроангиопатии) [16, 17]. Комплексный механизм действия α-липоевой кислоты объясняет ее эффективность в отношении всех аксональных ПНП, патогенез которых связан с токсико-дисметаболическим и сосудистым факторами. Так, эффективность тиоктовой кислоты показана при уремической и алкогольной ПНП, при поражении периферических нервов, индуцированном цитостатиками [15]. Для регенерации аксонов периферических нервов на фоне токсико-метаболических влияний важны также детоксикационный и гепатопротекторный эффекты α-липоевой кислоты. Положительный эффект препарата отмечен в отношении заболеваний печени, печеночной комы, некоторых интоксикаций, в том числе алкогольной [6, 10].
При значительно выраженной аксонопатии, учитывая медленную скорость регенерации аксонов, необходимо длительное применение достаточно высоких доз α-липоевой кислоты. Обычно ее суточная доза составляет 600 мг. Предпочтительнее начинать лечение с внутривенного капельного введения препарата — 600 мг (24 мл раствора) в разведении на 200 мл физиологического раствора, длительность инфузии составляет от 2 до 4 нед в зависимости от тяжести ПНП. В особо тяжелых случаях препарат вводят внутривенно капельно в дозе 1200 мг в сутки. После переходят на пероральный прием α-липоевой кислоты — в таблетках по 600 мг не менее 2 месяцев [1].
В соответствии с такой клинической потребностью — необходимостью длительного приема достаточно высоких доз α-липоевой кислоты, учитывая потенциально обратимый, но медленный характер аксональной регенерации — разработаны и фармацевтические формы препарата. Например, берлитион 300 и берлитион 600, производимые в виде раствора для внутривенных вливаний по 12 и 24 мл соответственно (для начального этапа лечения ПНП), так и таблеток по 300 и 600 мг (для продолжения терапии).
Соблюдение всех условий патогенетического лечения ПНП — нормализация гликемии, прекращение поступления экзогенного яда, детоксикация, коррекция аутоиммунных нарушений, длительное применение препаратов, нормализующих аксональный метаболизм, способствует постепенной регенерации аксонов, уменьшению выраженности чувствительных и двигательных нарушений, болевого синдрома, парестезий, парезов. Для уточнения динамики различных видов метаболических ПНП на фоне подобного терапевтического подхода необходимы дальнейшие исследования.
Focal nerve fiber degeneration at central fascicular or subperineurial regions is characteristic of acute ischemic nerve damage (Fig. 31.2), indicating that the distribution and type of fiber pathology suggest ischemia.
From: Handbook of Clinical Neurology, 2014
Autophagy in the Degeneration of Optic Nerve and Spinal Cord Axons
Jan Christoph Koch, … Paul Lingor, in Autophagy: Cancer, Other Pathologies, Inflammation, Immunity, Infection, and Aging, 2016
Axonal Degeneration
Axonal degeneration is a prominent pathological feature in many neurological diseases (Lingor et al., 2012). In neurodegenerative diseases like Parkinson’s disease (PD) and amyotrophic lateral sclerosis (ALS), the axon and the presynaptic terminals are the first neuronal compartments to be affected, often preceding the death of the neuronal somata by years (Burke and O’Malley, 2013; Fischer and Glass, 2007). In neuroinflammatory diseases, like multiple sclerosis, the primary pathological immune response targets glia cells and myelin sheaths. During the course of the disease, however, disease progression and symptomatic burden are mainly driven by the concomitant axonal degeneration (Ferguson et al., 1997). In neurotraumatic diseases like spinal cord injury (SCI), axons are acutely lesioned at a defined location resulting in a complete block of neuronal signal transmission distal from the lesion site and severe functional deficits (Liu et al., 1997). When axons are lesioned within the central nervous system, the deficits are mostly irreversible due to their limited regenerative capacity (Liu et al., 2011). Therefore, a better understanding of the pathomechanisms of axonal degeneration and development of potential therapeutic approaches are crucial for the majority of all neurological diseases.
Different forms of axonal degeneration have been described based on the spatial relation to the lesion site (proximal vs distal) and the time scale (acute vs chronic) (Lingor et al., 2012). They represent active self-destructing cellular processes involving a determined cascade of various molecular players and need to be discriminated from apoptosis, which is the death of the whole neuron including soma and all neurites (Raff et al., 2002).
After a focal traumatic lesion of an axon, for example, in SCI or optic nerve crush, the adjacent 400–600 µm of the axon on both sides of the lesion undergo a rapid disintegration that is termed as acute axonal degeneration (Kerschensteiner et al., 2005; Knoferle et al., 2010). On the molecular level, the initial axonal injury leads to a rapid calcium influx into the axon and a consecutive transient rise of the intraaxonal calcium concentration within seconds after the lesion. Blocking this initial calcium influx with calcium channel inhibitors can almost completely prevent the following axonal degeneration (Knoferle et al., 2010). Downstream of calcium, the calcium-sensitive protease calpain is activated, modulating a multitude of intraaxonal molecular targets (Kerschensteiner et al., 2005; Vosler et al., 2008; and own unpublished observations). This molecular cascade leads to a condensation and misalignment of neurofilaments followed by a fragmentation of microtubules that becomes visible already at 30 min after lesion at the ultrastructural level (Knoferle et al., 2010). Later, local swellings (axonal bulbs) appear along the axon. They are most probably related to local impairments of axonal transport. Within 6 h after the lesion, the axon on the proximal and distal 400–600 µm from the lesion site disintegrates. A prominent ultrastructural and molecular feature of acute axonal degeneration is the rapid local activation of autophagy, including an increase in numbers of autophagosomes and microtubule-associated protein light chain 3 (LC3) isoform II (Knoferle et al., 2010; Koch et al., 2010; Ribas et al., 2015). These phenomena will be discussed in detail later.
After the fast disintegration of the adjacent parts of the lesioned axon during acute axonal degeneration, the rest of the axon remains morphologically stable within the following hours. At 24–72 h after lesion, the distal part of the axon undergoes Wallerian degeneration (Conforti et al., 2014). This progressive fragmentation morphologically resembles the fragmentation seen in acute axonal degeneration (Kerschensteiner et al., 2005). It proceeds directionally along the axon and finally leads to a complete removal of the distal part of the axon (Conforti et al., 2014). The molecular machinery behind Wallerian degeneration is intrinsic to the axon, although macrophages and glia cells assist in the final removal of the axon fragments. A key molecule in Wallerian degeneration is nicotinamide mononucleotide adenylyltransferase (NMNAT) which is neuroprotective under physiological conditions but is not transported anymore along the axon after lesion, resulting in the demise of the distal axon (Conforti et al., 2014).
In neurodegenerative diseases like PD and ALS, the axons degenerate more slowly over longer time-periods. A prominent form of axonal degeneration in these diseases is the “dying back degeneration” (Cavanagh, 1964), which starts with a synaptic dysfunction and is then followed by a degeneration of the whole axon in a distal-to-proximal direction (Cavanagh, 1964).
In chronic inflammatory diseases, focal axonal degeneration has been described recently (Nikic et al., 2011). It is characterized by a focal axonal swelling constituted of accumulated organelles and dysmorphic mitochondria accompanied by an impairment of axonal transport. In contrast to acute and chronic axonal degeneration, focal axonal degeneration may represent a transient feature induced by the local action of immune cells. Thus, the focal swelling can either completely resolve or progress to a Wallerian-like fragmentation of the axon.
Although these forms of axonal degeneration differ with regards to morphological criteria and time kinetics, they share some general molecular mechanisms. First of all, the elevation of the axoplasmic calcium concentration either via influx from the extracellular space or from intracellular calcium stores plays an important role (Stirling and Stys, 2010). Calcium activates a number of calcium-dependent proteases including calpain and calcineurin, which then cleave and degrade cytoplasmic proteins (Vosler et al., 2008). Another central pathomechanism of axonal degeneration is a dysfunction of mitochondria, which accumulate along the axon (Kilinc et al., 2009). This leads to an insufficient energy supply and increased levels of reactive oxygen species and calcium. Moreover, impaired axonal transport (Millecamps and Julien, 2013), excessive kinase activation, and pathological aggregation of proteins have been implied in axonal degeneration (Lingor et al., 2012). Finally, we and others have shown that autophagy plays a major role in axonal degeneration (Knoferle et al., 2010; Koch et al., 2014; Ribas et al., 2015; Wang et al., 2006; Yang et al., 2013). Below, we will discuss the effects of autophagy in axonal degeneration in detail for the optic nerve and the spinal cord.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128054215000100
Amyloidosis and Neuropathy
ROBERT A. KYLE, … PETER J. DYCK, in Peripheral Neuropathy (Fourth Edition), 2005
Pathology.
Axonal degeneration, sometimes with predominant involvement of the small myelinated and unmyelinated fibers, is seen. In the presence of peripheral neuropathy, amyloid deposits, usually in globular or diffuse form, are found infiltrating epineural and endoneurial connective tissue. In addition, epineurial and endoneurial blood vessel walls are frequently thickened by amyloid deposits. There is a gross loss of myelin fibers, which often show signs of active axonal degeneration. Electron microscopy often reveals a marked loss of unmyelinated fibers. Teased fiber studies show a predominance of axonal degeneration.
In a study by Sommer and Schroder,191 in four of five cases of AL with polyneuropathy, the amyloid deposits reacted with antisera to κ or λ light chains. Electron microscopy revealed bundles of immunogold-labeled amyloid fibrils in coated and uncoated single membrane-bound vesicles of endoneurial macrophages. Schwann cells did not contain intracellular amyloid, but their processes were entangled in amyloid fibrils and their basement membranes were sometimes fused with fibrillar masses. The authors concluded that the monoclonal light chains precipitated and formed amyloid fibrils in the presence of, and presumably with the assistance of, endoneurial cells. They postulated that inefficiency of phagocytosis was one of the major factors in developing amyloidosis.191
In summary, amyloid infiltrates the proximal dorsal root and sympathetic ganglia early in the course of the disease. Amyloid also infiltrates the peripheral nerves, where it deposits between nerve fibers and compresses and distorts the nerves. The vessel lumens are frequently compromised by amyloid deposition. The nerve fibers develop axonal degeneration and, to a lesser extent, segmental demyelination.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721694917501113
Peripheral Nervous System Toxicity Biomarkers
Tirupapuliyur V. Damodaran, in Biomarkers in Toxicology (Second Edition), 2019
Biomarkers of Axonal Injury
Axon degeneration is a hallmark consequence of chemical neurotoxicant exposure (e.g., acrylamide), mechanical trauma (e.g., nerve transection, spinal cord contusion), deficient perfusion (e.g., ischemia, hypoxia), and inherited neuropathies (e.g., infantile neuroaxonal dystrophy). Regardless of the initiating event, degeneration in the PNS and CNS progresses according to a characteristic sequence of morphological changes. These shared neuropathologic features suggest that subsequent degeneration, although induced by different injury modalities, might evolve via a common mechanism. Studies indicate that Ca2+ accumulation in injured axons has significant neuropathic implications and is a potentially unifying mechanistic event. It was proposed that diverse injury processes can lead to axon degeneration by an increase in intraaxonal Na+ in conjunction with a loss of K+ and axolemmal depolarization. A spontaneous mutation called WldS (slow Wallerian degeneration) showed us that Wallerian degeneration is not a passive disintegration of axon, when the axon is severed from the cell body, but an active process mediated by Nmnat protein (Mack et al., 2001). More recently, using a powerful forward genetics screen, a new pathway that involves Sarm protein has been found to prevent axonal degeneration after traumatic injury (Osterloh et al., 2012).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128146552000116
Tetraparesis, Hemiparesis, and Ataxia
Michael D. Lorenz BS, DVM, DACVIM, … Marc Kent DVM, BA, DACVIM, in Handbook of Veterinary Neurology (Fifth Edition), 2011
Central Axonopathy
Axonal degeneration results from disease within the neuronal cell body or within the axon itself. Lesion distributions are variable. Central axonopathy usually consists of bilateral and symmetrical degeneration of the axon and myelin and affects both sensory and motor tracts of the spinal cord, with the longest fibers being the most vulnerable.175 Breeds described include Jack Russell and smooth fox terriers,176-178 Scottish terrier,179 and Labrador retriever.180 Lesions typify diffuse loss of myelinated fibers in the cerebellar white matter and/or in the dorsal funiculi and pyramidal tracts in the spinal cord. Swollen axons may show neurofilament accumulations. In Brown Swiss cattle, at 5 months of age affected calves develop paraparesis and ataxia, and signs insidiously progress over months. Histopathology reveals diffuse axonal degeneration in the spinal cord, with spheroids (axonal swellings) present in some brainstem nuclei and in the cerebellar granular layer.181,182
Those that selectively involve long-tract axons in the CNS and PNS are described as in central-peripheral distal axonopathy. Central-peripheral axonopathy of young dogs have been described in the Ibizan hound,149 Alaskan husky,183 boxer,184-186 Pyrenean mountain dog,187 and New Zealand Huntaway.188 Canine degenerative myelopathy is a central-peripheral axonopathy of older-aged dogs (see Chapter 6).
Those limited to the PNS are neuropathies.149,189 Axonal degeneration or myelin degeneration may predominate. Sensorimotor neuropathy often shows degenerative changes in spinal ganglia or in the dorsal horn or ventral horn of the spinal cord.189,190
Multisystem neuronal degeneration involves axonopathy and neuronopathy throughout the CNS and may include neuropathy (see also Chapter 8). These have been described in the cairn terrier,191-193 cocker spaniel,194 golden retriever,195 and rottweiler.196
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781437706512100074
Medical Diagnosis & Therapy
Leonard A Levin, in Glaucoma (Second Edition), 2015
Axonal Degeneration
Axonal degeneration after retinal ganglion cell injury takes place in two directions. The degeneration towards the cell is called retrograde degeneration, and the one away from the cell (and the site of injury) is called Wallerian or orthograde degeneration. It is important to realize that the processes of death of the cell body and degeneration of the axon are independent.118 Axonal responses can be divided into those associated with how the axon locally responds to injury; and those associated with degeneration of the proximal and distal healthy axon as a result of the injury.
Mechanisms by which the axon degenerates after direct injury include excess accumulation of Ca++ ions, activation of calpains, loss of the membrane potential, and several other processes. In healthy fibers, ATP-dependent pumps support homeostasis of ionic gradients. When energy supply is limited, either due to inadequate delivery or excessive utilization, ion gradients break down, unleashing a variety of cascades leading to Ca++ overload, activation of destructive enzymes, and local axonal dissolution.119
Mechanisms for degeneration of the healthy remaining axon after injury are different, with most research focusing on Wallerian degeneration, i.e. loss of the distal segment. Neurons have a self-destruct program in their axon,118 parallel to the suicide program for apoptosis of the cell body. The program for Wallerian degeneration is initiated when the axon is injured. There is a naturally occurring mutation in mice, Wallerian degeneration slow (WldS), which blocks this axonal degeneration program.120 Interestingly, the WldS mutation does not itself prevent the calcium influx associated with early stages of axonal degeneration.121 Studies of experimental glaucoma in these mutant animals demonstrate loss of the RGC but preservation of the axon.122 This is the exact opposite of what occurs when the apoptosis program is blocked in glaucoma, where the cell body is preserved but the distal axons are lost.6,123 Together, these data prove that the retinal ganglion cell body death and axonal degeneration programs are distinct.124
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780702051937000613
In Vivo Visualization of Single Axons and Synaptic Remodeling in Normal and Pathological Conditions
Federico W. Grillo, … Vincenzo De Paola, in Axons and Brain Architecture, 2016
11.9 Degeneration
Axon degeneration is a characteristic event that occurs in many neurodegenerative conditions including glaucoma, stroke, traumatic brain injury, and motor neuropathies. Axonal degeneration occurs in at least three phases—an acute and rapid degeneration phase on both sides of the lesion (Kerschensteiner et al., 2005; Knoferle et al., 2010), followed by a period of quiescence/latency, then rapid cytoskeletal disassembly, fragmentation and granular degeneration of the axon distal to the injury site. This latter phase of distinct morphological and molecular changes is known as Wallerian degeneration (Coleman and Freeman, 2010). These phases of degeneration occur to variable extents in different regions and axonal populations within the nervous system, and can vary significantly according to the trauma paradigm. In the spinal cord, Thy1-GFP dorsal column axons injured by a fine needle undergo acute axonal degeneration occurring on both sides of the lesion up to several hundred micrometers from the lesion site, whereas in laser ablated membrane-bound GFP cortical neurons rapid axonal degeneration only occurs within a few micrometers either side of the lesion site (Canty et al., 2013b), before stabilization of the axon on both sides is achieved, albeit temporarily. In this latter paradigm, owing to the shorter distances involved, the fragmentation kinetics of the degenerating axons can be monitored in their entirety. Our unpublished observations indicate that the kinetics of fragmentation are quite unique compared to those described for in other regions of the CNS (Canty et al., submitted).
Diffuse axonal injury typically occurs following rapid acceleration/deceleration and is reproduced in experimental settings using impact acceleration models, inertial acceleration models, and fluid percussion models. Axons are stretched without undergoing immediate transection, and all models result in characteristic cytoskeletal rearrangements and eventual secondary axotomy depending on the severity of the trauma. Much of our understanding of secondary axotomy comes from in vitro models of injured cortical axons with direct transection (Chuckowree and Vickers, 2003; Dickson et al., 2000), mechanical stretching (Iwata et al., 2004), physical oscillation of neurons (Nakayama et al., 2001), and transient pressurized fluid deflection of axons (Chung et al., 2005). Directly observing such changes in in vivo models of diffuse axonal injury is more problematic with resulting vascular pathology often making the visualization of single axons difficult. Diffusion tensor imaging has been successfully used to detect white matter deterioration in both mild and moderate–severe closed-skull brain injury models in the mouse (Bennett et al., 2012). Changes in axial and mean diffusivity are observed which correlate with postmortem histological analysis—silver staining in mild injury, and APP accumulations in axonal swellings following moderate–severe injury. Similarly, computed topography and magnetic resonance imaging of human patients after head injury cannot show axonal pathology in any detail.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128013939000116
Plasma Membrane Repair
Héctor R. QuintáFrancisco J. Barrantes, in Current Topics in Membranes, 2019
2.4 The axolemma subjected to mechanical trauma
Axonal degeneration plays a key physiological role in nervous system growth. During development axonal degeneration is a requirement for rewiring temporary pathways and establishing new neuronal cell connections. In a “Darwinian” survival of the fittest-like process, neurons compete for activity or target (e.g., attractive trophic factor) cues. Growth cone collapse and F-actin depolymerization are two early events of axonal degeneration, as observed in an experimental model using embryonic dorsal root ganglion explants to recapitulate developmental axonal pruning triggered by trophic factor withdrawal. Nerve growth factor-deprived root ganglion neurons undergo a typical degenerative process which culminates in axonal fragmentation and detachment about 24 h after growth factor withdrawal (Unsain et al., 2018).
Axonal degeneration also occurs in disease. Traumatic brain injury (TBI) and spinal cord injury (SCI) are two pathological nosological entities generated by mechanical trauma in which the axonal shaft is affected by transection, stretch and/or compression (Nehrt, Hamann, Ouyang, & Shi, 2010; Ouyang et al., 2010; Quinta, Pasquini, Rabinovich, & Pasquini, 2014; Shi & Pryor, 2000). These injuries produce a breach in axolemmal integrity that alters the physiological homeostasis. Most noticeable is the disruption of the intracellular environment, due to the increase in permeability to ions and molecules associated with loss of membrane integrity.
Upon axonal injury the neuronal cells disclose mechanisms to self-protect from axonal growth-cone collapse (Quinta et al., 2016), promoting effective repair mechanisms. As stated by Sandoval-Guzman and Currie, regardless of the regenerative outcome, the initial detection and response to an injury is to restore barrier function and dispose of pathogens (Sandoval-Guzman & Currie, 2018). Axonal regeneration is not an exception to this rule and is triggered by sequential steps: the initial step is the sealing of the membrane breach to allow the re-formation of a growth-cone. However, this self-defense mechanism is not completely successful. The archetypal example of unsuccessful axonal repair is the failure of spinal cord axonal tracts to self-repair after SCI, leading to permanent, often complete loss of motor function. Although the mechanisms to seal the axolemma membrane after injury may not achieve a significant regeneration, they are able to limit damage and avoid the progression of degeneration.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S1063582319300316
Inflammation and Axon Degeneration
V. Hugh Perry M.A., D.Phil., in Multiple Sclerosis As A Neuronal Disease, 2005
1. Active Axon Degeneration
Axon degeneration accompanies an extraordinary diversity of injury to, and diseases of, the nervous system, and a favored model to study the mechanisms that underlie axon degeneration has been the study of degeneration of the distal segment of a transected axon, wallerian degeneration. The morphological events that appear in wallerian degeneration are found at the end stage of almost every form of axon degeneration, suggesting that there is a final common pathway in the degeneration process (Griffin et al., 1996). It was long thought that the axon degenerated as a consequence of separation from the cell body leading to a withering of the distal process, an essentially passive process (Finn et al., 2000). The degeneration of the axon was also linked in acute transection to an influx of calcium that activated calcium-activated proteases within the axoplasm, which in turn degraded the axon cytoskeletal elements (Schlaepfer and Hasler, 1979).
The serendipitous discovery of a strain of mouse carrying a mutation that dramatically slows wallerian degeneration (Lunn et al., 1989) has radically changed our views of how axons degenerate (Finn et al., 2000; Coleman and Perry, 2002). In wild-type mice, and indeed all mammals, the axon segment distal to an injury normally undergoes wallerian degeneration within a few days of transection. In the mutant Wlds mice the axons of both CNS and PNS neurons may survive for several weeks separated from the cell body (Fig. 3). This simple observation tells us that axon degeneration in wild-type axons must be an active autodestructive process akin to programmed-cell-death or apoptosis of the cell body of neurons and other cells. The mutation in these mice has now been identified, and the Wlds gene was found to be a chimeric protein formed from UbE4b, an ubiquitin ligase, and nicotinamide mononucleotide adenylyltransferase (Nmnat), an NAD synthesizing enzyme (Mack et al., 2001). The mechanism of action of this gene is not known, but it clearly implicates the ubiquitin-proteasome pathway in axon degeneration (see later).
Figure 3. The remarkable phenotype of the Wlds mouse (Lunn et al., 1989). Central panel (B) illustrates the appearance of the normal sciatic nerve in a 1-μm semithin section stained with toluidine blue. Panel (C) illustrates the appearance of the distal nerve of a wild-type mouse nerve undergoing wallerian degeneration 7 days after transection. Panel (A) shows the remarkable preservation of the distal axon segment 7 days after sciatic nerve transection in the Wlds mouse.
The programmed-cell-death-like process in axons shares some similarities with the apoptotic cascades described at the neuronal cell soma, but there are also notable differences. Transected neurites undergoing wallerian degeneration in vitro express phosphatidylserine residues on the plasma membrane as detected by Annexin V, undergo blebbing, and lose their mitochondrial potential before degeneration (Sievers et al., 2003). Manipulations that protect the cell bodies of some neurons from apoptosis, such as raising extracellular potassium or intracellular cyclic adenosine monophosphate, also protect transected neurites in vitro (Buckmaster et al, 1995). However, the degeneration of neurites in vitro is not protected by caspase inhibitors (Finn et al., 2000; Sievers et al, 2003), and axons in vivo are not protected by overexpression of Bcl-2 (Burne et al., 1996), although they are protected in Bax deficient mice (Dong et al 2003; J.W. McDonald, personal communication).
Thus, the “molecules of destruction” secreted by inflammatory cells in the MS lesion act on axons that contain the biochemical machinery that maintains the balance between life and death of the axon. These pathways act in an analogous fashion to, but distinct from, the pro-apoptic and anti-apoptotic pathways maintaining the balance between life and death of the cell soma. It is important to note that the protection of the axon in wallerian degeneration by the Wlds gene has now been shown to extend to protection of axons subjected to taxol toxicity (Wang et al. 2003), to protection of axons in a mouse model of motorneuron disease (Ferri et al., 2003), and protection of axons from the axon degeneration present in a dysmyelinating mutant, the Po knockout mouse (Samsam et al., 2003). A simple hypothesis is that secretory products of inflammatory cells, or contact with inflammatory cells, leads to local activation of these autodestruction pathways in the axon, and thus, a local axon transection.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127387611500183
White Matter Structure
Julia M. Edgar, Ian R. Griffiths, in Diffusion MRI (Second Edition), 2014
7.5.2 Axonal Degeneration
Axonal degeneration can be triggered by a range of diverse insults (Coleman, 2005). For example, it occurs in specific diseases such as multiple sclerosis, HSP, motor neuron disease, and Alzheimer’s disease. Degeneration may also result from focal damage, for example, as a direct consequence of spinal cord injury or secondary to stroke. The morphological changes that ensue are also varied. The degeneration that affects the axon distal to focal damage is known as Wallerian degeneration. Wallerian degeneration leads to secondary degeneration of the associated myelin. However, while the axon degenerates relatively quickly, leaving behind a myelin “wall,” myelin debris can persist for many months or even years. In contrast to Wallerian degeneration, which is thought to progress anterogradely from the lesion site, distal or length-dependent degeneration, which is characteristic of the spastic paraplegias and a number of peripheral neuropathies, appears to begin in the distal most portion of the axon (furthest from the cell body) and spreads retrogradely (towards the cell body). Focal axonal swellings or spheroids are encountered in several neurodegenerative disorders, including multiple sclerosis, motor neuron disease, spastic paraplegia, and Alzheimer’s disease. Whereas these may represent the endbulbs of fully transected axons, they do not necessarily lead to irreversible damage or indicate that their associated axons are severed (Edgar et al., 2004; Adalbert et al., 2009; Nikic et al., 2011).
For reasons that are not understood, smaller CNS axons are often preferentially vulnerable to degeneration. For example, smaller axons are damaged in multiple sclerosis and the small axons of the corticospinal tract are susceptible in HSP and ALS (Ganter et al., 1999; DeLuca et al., 2004b). The preferential vulnerability of small fibers is also seen in animal models of human disease, for example in the EAE model of multiple sclerosis (Papadopoulos et al., 2006) and in the Plp1 gene knockout mouse model of SPG2 (Griffiths et al., 1998) (see Section 7.4.2.1).
Axonal pathology in multiple sclerosis was reported over a century ago by Charcot (reviewed by Bjartmar et al., 2003). However, it was largely neglected until relatively recently when the prevalence of swollen and transected axons in multiple sclerosis lesions was demonstrated (Ferguson et al., 1997; Trapp et al., 1998). It is now generally accepted that the irreversible neurological disability seen in chronic multiple sclerosis is related to cumulative axonal degeneration (Bjartmar and Trapp, 2001). The extent of axonal degeneration in multiple sclerosis and in HSP has been examined in detail in the spinal cord. Utilizing the well-defined anatomy of this CNS region, DeLuca et al. (2004a) quantified axonal densities in formalin-fixed, paraffin-embedded post-mortem tissue from adult human males and females, at all levels of the posterior sensory tracts and in the crossed corticospinal tracts, in the lateral columns of the spinal cord. Sections 10 μm thick were stained with Palmgren silver to demonstrate axons. In multiple sclerosis tissue, average axon loss in the corticospinal tract ranged from 15 to 33%, depending on the level of the tract analyzed (DeLuca et al., 2004a). In a separate study by Bjartmar et al. (2000), axonal loss in demyelinated lesions within the spinal cord ranged from 45 to 84% (and see Section 7.5.1). In adult HSP patients, fiber numbers in the crossed corticospinal tracts were reduced by between 51 and 69%, depending on the spinal cord level that was examined (DeLuca et al., 2004b). Such large fiber losses, however, were associated with much smaller reductions in tract area, with corresponding decreases of 12 and 41%, respectively (DeLuca et al., 2004b), demonstrating that tract atrophy is not a good indicator of the extent of axonal degeneration. This was ascribed to the increased gliotic reaction (hypertrophy of astrocytes and increased microglial densities) and edema that accompanies axonal degeneration. In multiple sclerosis tissue, the extent of tract atrophy correlated with disease duration, being greater with increasing time from onset, probably reflecting the reduction in inflammation and edema in chronic multiple sclerosis lesions (DeLuca et al., 2004a).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012396460100007X
Metal Neuropathy
ANTHONY J. WINDEBANK, in Peripheral Neuropathy (Fourth Edition), 2005
Cellular Pathology
Axonal degeneration is the major feature of altered peripheral nerve morphology in human arsenic intoxication. There are no modern autopsy reports of changes in the nervous system related to arsenic poisoning. The best older report is that of Erlicki and Rybalkin, who described the changes in a patient who died from pneumonia during recovery from arsenic poisoning.57 The clinical features were typical of a moderately severe arsenic neuropathy. At autopsy in this case, pathologic changes were found in the spinal cord and peripheral nerves. Anterior horn cells were decreased in number both in particular groups of the ventral gray matter and diffusely. The remaining cells had lost angular contours, were rounded, and often lacked processes. Cytoplasm contained granular yellow or yellow-brown pigment. This may reflect the presence of lipofuscin, an abnormality occurring in spinal cords unaffected by specific diseases. Nuclei were ragged and sometimes pale. In the cervical and lumbar enlargements of the spinal cord, there was no marked abnormality except that posterior and anterior columns were markedly thinned and had decreased numbers of myelinated fibers. The radial and peroneal nerves were evaluated. The majority of myelinated fibers were abnormal, but the morphologic changes were not described in detail. In the authors’ opinion, some fibers had remained without degeneration, some were degenerating, and others were regenerating.
There are a number of reports concerning biopsies in patients with arsenic neuropathy36,52,74,96,111,124,158 in which histologic, morphometric, electron microscopic, and teased fiber changes are described in the sural nerve or a branch of the superficial peroneal nerve. The changes reported have been consistent with axonal degeneration. Chhuttani and colleagues36 and Heyman and associates96 reported increased endoneurial cellularity and interstitial fibrous tissue with some increase in the thickness of the perineurium. All authors reported a decrease in the number of myelinated fibers, and Dyck and colleagues demonstrated that this occurs equally across the range of all fiber diameters.52 Several authors have suggested that, in the case of a single dose of arsenic, all fibers are at the same stage of degeneration into linear rows of myelin ovoids. However, LeQuesne and McLeod have shown in two cases, each with a documented single exposure, that fibers at all stages of axonal degeneration may be seen in the biopsy specimen.124 Segmental demyelination is either absent or present at a very low frequency.72 Occasional onion bulbs are seen, which traditionally have been thought to indicate a chronic process involving repeated episodes of demyelination and remyelination. Ohta has pointed out that, at the electron microscope level, the core of these onion bulbs appears to be a degenerated axon and myelin debris, suggesting that they may represent a Schwann cell response to axonal degeneration.158 This study also mentioned that unmyelinated fibers showed little change. Quantitative studies of unmyelinated fibers have not been performed. In tissue culture, arsenic appears to specifically affect axonal structure rather than producing demyelination.222
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721694917501162

Поражение аксонов относят к группе полинейропатий. Заболевание считается медленно развивающимся дегенеративным процессом. Лечением аксонопатий занимается врач-невролог.
Как и все нарушения периферической нервной системы, заболевание проявляется нарушением движений и чувствительности, вегетативными симптомами. При адекватном лечении дегенерацию можно остановить, тем самым – улучшая прогноз для жизни.
Причины и патогенез заболевания
Поражение периферических нервных отростков может развиться вследствие следующих причин:
- Отравление химическими веществами. При длительном воздействии яда на организм происходит нарушение внутриклеточного метаболизма нейронов, в результате чего развивается дефицит необходимых питательных веществ и ткань подвергается дегенерации. К отравляющим веществам относят: метиловый спирт, угарный газ, мышьяк.
- Эндокринные нарушения. Вследствие гормонального дисбаланса обменные процессы в организме замедляются. Это отражается на всех функциях, в том числе – на передаче нервных импульсов по аксонам.
- Дефицит витаминов. Нехватка полезных веществ приводит к медленно прогрессирующему разрушению периферических отростков.
- Хроническая интоксикация этиловым спиртом. Аксонопатия часто развиваются у лиц, страдающих алкоголизмом в течение нескольких лет.

Механизм возникновения нарушений в аксонах рассматривается на клеточном уровне. В периферических отростках отсутствуют органеллы, продуцирующие белковые соединения (ЭПС, рибосомы). Поэтому, для функционирования периферических отделов питательные вещества поступают из тела клетки (нейрона). Они перемещаются к аксонам при помощи специальных систем транспорта. Под воздействием отравляющих веществ или гормональных изменений, поступление белков на периферию нарушается.
Патологическое состояние также может возникнуть из-за недостаточной выработки энергии в митохондриях, что приводит к нарушению антероградного транспорта фосфолипидов и гликопротеинов. Дегенерация особенно выражена в длинных аксонах. По этой причине основные симптомы заболевания ощущаются в дистальных отделах конечностей.
Поражение периферических отростков постепенно приводит к гибели всей клетки. При этом восстановить функции невозможно. Если же тело нейрона осталось сохранно, то возможен регресс патологии.
Факторы риска

В некоторых случаях кажется, что провоцирующий фактор отсутствовал, однако это не так.
Таким образом, развиваются подострый и хронический вариант аксонопатии. В этих случаях дегенерация происходит постепенно.
К факторам риска возникновения патологического процесса относятся:
- хроническая интоксикация, которая не всегда ощутима, — ей подвергаются люди, работающие на вредном производстве, длительно принимающие медикаменты, живущие в неблагоприятных условиях;
- наличие воспалительных неврологических болезней, вызванных инфекционными агентами;
- онкологические патологии;
- хронические болезни внутренних органов;
- злоупотребление алкоголем.
Типы патологического состояния
Существует 3 разновидности аксонопатии, которые отличаются по механизму развития, выраженности клинической картины и этиологическому фактору.
- Нарушение 1 типа относится к острым дегенеративным процессам, заболевание возникает при серьезных отравлениях организма.
- Подострый патологический процесс характеризует нарушение 2 типа, к которому приводят обменные нарушения. Зачастую, это – сахарный диабет, подагра и т. д.
- Дегенерация периферических отростков 3 типа развивается медленнее, чем другие варианты заболевания. Это тип заболевания часто наблюдается у людей с ослабленным иммунитетом и страдающих алкоголизмом.
Клинические проявления
Начальным симптомом аксонопатии является снижение чувствительности, которое возникает постепенно. Клиническая картина 
Выраженный дегенеративный процесс проявляется двигательными нарушениями. Пациента беспокоит слабость, хромота. В терминальной стадии заболевания развиваются периферические параличи и парезы. Сухожильные рефлексы ослабляются или вовсе не вызываются.
Дегенерации подвергаются аксоны нижних и верхних конечностей, черепно-мозговые нервы. Аксонопатия малоберцового нерва выражается следующей симптоматикой:
- страдает двигательная активность ноги – нарушается процесс сгибания и разгибания;
- отсутствует пронация и супинация;
- снижается сила в икроножных мышцах, вследствие этого происходит изменение походки.
Поражение глазодвигательного нерва приводит к косоглазию, птозу. Может наблюдаться снижение остроты зрения и сужение полей видимости.
Если в дегенеративный процесс вовлекается диафрагмальный нерв, то возникает характерный синдром Горнера, который характеризуется развитием птоза, миоза и энофтальма (западение глазного яблока).
При поражении блуждающего нерва нарушается иннервация внутренних органов, клинически это проявляется тахикардией, учащением ЧДД.
Методы диагностики и лечение
Диагностирует заболевание невропатолог при проведении специфического осмотра. Он выполняет исследование чувствительности, проверяют силы мышц и рефлексы. Для выяснения причин патологического состояния проводится лабораторная диагностика. Пациентам необходимо сдать общий и биохимический анализ крови. Оценивается содержание минеральных веществ: кальция, натрия и калия, глюкозы.

К специфической диагностике относится электронейромиография. Это исследование позволяет оценить распространенность поражения периферических отростков, а также определить, как проводится импульс.
При дегенеративных процессах лечение аксонопатии длительное. Помимо разработки мускулатуры с помощью ЛФК и массажа, показано применение медикаментозных средств.
К ним относят препараты из группы ноотропов, витамины группы В. Назначают медикаменты
Пирацетам — один из самых известных ноотропов
Фенотропил, Пирацетам, Нейромультивит, которые помогают восстановить метаболизм внутри клеток нервной системы. Также показаны препараты для улучшения кровообращения в головном мозге, с их помощью улучшается питание мозговой ткани — Церебролизин, Актовегин.
При гормональном дисбалансе необходимо лечить основное заболевание, которое привело к развитию аксонопатии. К осложнениям патологии относят параличи, слепоту, сердечно-сосудистые заболевания и ОНМК.
Профилактические мероприятия включают борьбу с провоцирующими факторами – интоксикационными воздействиями, алкоголизмом. При сахарном диабете необходимо поддерживать нормальный уровень глюкозы. Появление парестезии считается поводом для обращения к невропатологу.
Дата публикации 30 сентября 2022Обновлено 30 сентября 2022
Определение болезни. Причины заболевания
Периферическая нейропатия (Peripheral neuropathy) — это патология нервной системы, которая поражает нервы за пределами головного и спинного мозга: периферические нервы, спинномозговые корешки, спинномозговые нервы и сгруппированные из них сплетения, а также черепные нервы.
Распространённость периферической нейропатии
Существуют разные виды заболевания. Среди них более всего распространена диабетическая полинейропатия. Она возникает у 90 % пациентов, страдающих сахарным диабетом 2-го типа. В последующем у пациентов также развивается диабетическая стопа [5].
Алкогольная полинейропатия составляет 40 % от всех нейропатий и встречается у 10–50 % пациентов, злоупотребляющих алкоголем [5].
От нейропатии срединного нерва часто страдают офисные работники. Такая нейропатия медленно прогрессирует и долго остаётся незамеченной. При ней также развивается синдром запястного канала, при котором большой, указательный и средний пальцы кисти слабеют и немеют [11].
Причины периферической нейропатии
Причинами поражения периферической нервной системы могут быть:
- травма нерва — одна из самых благоприятных причин, и чем дальше травмированный нерв от головного и спинного мозга, тем выше шансы на восстановление, однако полный разрыв нерва можно устранить только с помощью своевременной операции, которая редко проходит успешно [11][12];
- тропные инфекции — те, чьи возбудители легче всего прикрепляются к нервам (например, опоясывающий лишай, грипп, корь, COVID-19, бруцеллёз, сифилис);
- наследственный фактор (например, атаксия Фридрейха);
- вакцины — некоторые препараты могут вызывать поствакцинальную нейропатию (случается редко) [13];
- лекарства (например, Изониазид и др.);
- алкоголь;
- работа на вредных производствах (например, с мышьяком, ртутью или свинцом).
Часто нейропатии становятся проявлением других болезней:
- дисметаболическая нейропатия — возникает при амилоидозе, гипотиреозе и сахарном диабете [4][5][8];
- паранеопластическая полинейропатия — при новообразованиях;
- полинейропатия при болезни соединительной ткани — сопровождает аутоиммунные нарушения, например васкулит, ревматоидный артрит, системную красную волчанку, склеродермию;
- моно- и полинейропатия при заболеваниях крови — развивается у пациентов с анемией или лейкозом.
Также встречаются компрессионно-ишемические нейропатии, например после сдавливания нерва в запястном канале.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы периферической нейропатии
Проявления болезни зависят от причины и количества поражённых волокон.
Симптомы мононейропатии
При поражении одного нерва, одного корешка или отдельного сплетения клиническая картина включает:
- слабость той мышцы, за которую отвечает повреждённый нерв, вплоть до плегии (полного отсутствия движений);
- снижение чувствительности;
- снижение мышечного тонуса и развитие мышечной атрофии;
- фасцикуляции, т. е. спонтанные сокращения мышцы при спокойном состоянии (развиваются не всегда);
- сухость и истончение кожи, ломкость ногтей, отёчность и депигментацию в той зоне, которую питает повреждённый нерв;
- боль над зоной поражения, отдающую в дальнюю зону иннервации, там же могут появиться «мурашки» (в зависимости от повреждённого волокна боли может не быть).
Симптомы множественной мононейропатии
При поражении нескольких одиночных нервов симптомы похожи на проявления обычной мононейропатии, только они появляются в разных нервных стволах, например одновременно поражается лучевой нерв левой и локтевой нерв правой руки.
Множественная мононейропатия часто встречается при гипотиреозе, васкулите и диабетической микроангиопатии, так как в начале этих болезней повреждаются сосуды, питающие нерв, после чего развивается ишемия и нейропатия.
Симптомы полинейропатии
Полинейропатию диагностируют при рассеянном и синхронном поражении периферических нервов. Часто оно начинается с длинных нервных волокон, поэтому симптомы нарастают от пальцев ног и рук вверх. Это проявляется:
- фасцикуляцией, крампи (судорогами в икроножных мышцах) и тремором, далее развивается мышечная слабость вплоть до парезов и атрофии;
- болью, повышением чувствительности, покалыванием, «мурашками» и атаксией (человек будто ходит по вате, появляется неуверенность при ходьбе, особенно в темноте);
- сухостью кожи, долго незаживающими ранками, постоянно холодными отекающими руками и ногами, которые приобретают синюшный оттенок.
Признаки поражения вегетативной нервной системы при полинейропатиях:
- нарушения сердечно-сосудистой системы — тахикардия в спокойном состоянии, ортостатическая гипотензия (давление резко снижается, когда человек встаёт на ноги);
- желудочно-кишечного тракта — ночная диарея, нарушение глотания, чувство переполнения желудка, изжога;
- мочеполовых органов — эректильная дисфункция, недержание или задержка мочи;
- трофических функций — повышенное потоотделение стоп или его отсутствие, отёки, безболезненные язвы [4][5][8][9].
Симптомы при поражении плечевого сплетения зависят от того, какой именно пучок пострадал:
- патология верхнего пучка сплетения (корешки С5–С6) — сопровождается слабостью мышц центральных отделов руки, пациент не может сгибать локоть, отводить и выворачивать плечо наружу, над дельтовидной мышцей и боковой поверхностью предплечья нарушается чувствительность, развивается вялый паралич двуглавой мышцы плеча (паралич Эрба — Дюшена);
- патология нижнего пучка сплетения (корешки С8–Th1) — проявляется слабостью кисти, невозможностью согнуть пальцы, нарушением чувствительности в области локтя, предплечья и кисти (паралич Дежерин — Клюмпке);
- патология пояснично-крестцового сплетения — характеризуется слабостью мышц таза и ног, из-за болей в пояснице, ягодице и тазобедренном суставе снижается чувствительность ноги, её рефлексы становятся более слабыми, также возможно развитие тазовых нарушений, но только при двустороннем поражении крестцового сплетения;
- патология нервных корешков (радикулопатия) — как правило, сопровождается снижением чувствительности, простреливающей или жгучей болью в спине, которая усиливается при натуживании и кашле, иногда выступает как осложнение васкулита или сахарного диабета.
Патогенез периферической нейропатии
Периферическая нервная система включает в себя спинномозговые корешки, периферические, черепные и спинномозговые нервы, из которых группируются спинномозговые сплетения.
Периферические нервы связывают центральную нервную систему со всеми органами и тканями организма. Они передают нервные импульсы и переносят макромолекулы из центральной нервной системы.
Нервный ствол формируется из совокупности нервных волокон, покрытых оболочками, которые изолируют один пучок от другого. Эти оболочки образованы из сетей мелких сосудов (vasa nervorum), которые питают нервное волокно и защищают от чужеродных белков. После повреждения оболочка определяет направление роста аксона и активно участвует в обмене веществ, чтобы ускорить восстановление нервных стволов.
Выделяют 3 типа повреждения нервных волокон:
- Валлеровское повреждение — травма с поперечным пересечением нерва. Регенерация начинается сразу после повреждения, но протекает медленно: с восстановления аксона и миелиновой оболочки. Чем дальше от центра был повреждён нерв, тем лучше прогноз, например если нерв повредиться дальше от ЦНС, то будет болеть только палец, а если ближе, то целая рука.
- Аксональная дегенерация — под влиянием токсических веществ аксону тяжелее переправлять различные вещества, а митохондриям выделять энергию. Далее нарушается миелиновая оболочка. Этот процесс можно прекратить, если устранить причину (например, при диабетической полинейропатии необходимо скорректировать уровень сахара в крови). Свободные радикалы и проблемы с тканевым дыханием также нарушают метаболизм в митохондриях.
- Демиелинизация — повреждение миелина, после которого импульсы медленнее движутся по нерву. Часто наблюдается при аутоиммунных заболеваниях, например при рассеянном склерозе, так как аутоиммунные реакции воздействуют на антигены миелина. Миелин также разрушается при наследственных болезнях или при миелинопатиях.
Также существуют другие механизмы повреждения:
- Дефицитарные полинейропатии — связаны с дефицитом витаминов группы В, которые участвуют в окислительно-восстановительных процессах организма. Могут быть следствием хронической патологии ЖКТ, при которой нарушается процесс всасывания (например, при неспецифическом язвенном колите, панкреатите, атрофическом гастрите и др.).
- Компрессионно-ишемические нейропатии — поражение периферического нерва в анатомических сужениях, где проходит нерв (например, отверстие в связке, костно-фиброзный канал и т. д.). Также возможно при длительном внешнем сдавливании нерва, например при определённых профессиях (работе с компьютерной мышкой) или привычных позах (например, сидеть нога на ногу).
- Синдром Гийена — Барре — острая воспалительная аутоиммунная полирадикулоневропатия. Возникает в результате воздействия провоцирующего фактора, обычно инфекции, поэтому за 1–6 недель до появления первых симптомов возникают признаки дыхательной или желудочно-кишечной болезни (грипп, герпес, корь, гепатит В и др.). Пусковым фактором также могут быть вакцины против гриппа, кори или краснухи. Встречаются разные формы, объединяющие черты демиелинизирующего и аксонального вариантов с соответствующими симптомами.
Классификация и стадии развития периферической нейропатии
По количеству вовлечённых нервных стволов различают:
- мононейропатию — поражение одного нерва;
- радикулопатию — поражение спиномозгового корешка;
- ганглионеврит — поражение ганглия (нервного узла);
- плексопатию — поражение сплетения;
- множественную мононейропатию — одновременное или последовательное асимметричное поражение отдельных нервов;
- полинейропатию — одновременное симметричное поражение разных нервов.
В зависимости от патологии нервного ствола можно выделить:
- аксонопатию — поражение отростков нервных клеток;
- миелинопатию — разрушение миелина;
- смешанные нейропатии [3][4][5][8].
Осложнения периферической нейропатии
Если не лечить мононевропатию, развивается мышечная слабость вплоть до атрофии мышц и плегии, когда пациент не может шевелить руками и становится инвалидом.
Осложнением диабетической полинейропатии является развитие диабетической стопы. Сначала стопы становятся менее чувствительными, и пациенты не обращают на это внимание, однако при малейшем повреждении раны заживают очень долго. Из-за сниженного иммунитета организм плохо реагирует на инфекции, что влечёт присоединение болезнетворной флоры и образование язвы. Рана нагнаивается и развивается гангрена, после чего стопу ампутируют [4][5].
Нарушение чувствительности искажает охранные реакции организма и замедляет рефлексы, из-за чего человек с полинейропатией может не чувствовать боль или изменение температуры, поэтому падения, травмы и ожоги относят к осложнениям.
Пациент также не замечает инфекционные воспалительные осложнения, в ходе которых развиваются незаживающие язвы не только на стопах.
Синдром Гийена — Барре может сопровождаться слабостью дыхательных мышц, что вызывает дыхательную недостаточность с возможным летальным исходом.
Если нейропатия возникла в детстве или подростковом возрасте, это может привести к недоразвитости ноги или руки.
Диагностика периферической нейропатии
В процессе диагностики важно выявить причину полинейропатии, так как от этого зависит тактика лечения. Для этого врач уточняет историю жизни пациента и этапы развития болезни, а также использует дополнительные методы обследования: исследования ликвора (при подозрении на синдром Гийена — Барре), электронейромиографию и общий анализ крови.
Сбор анамнеза и неврологический осмотр
В первую очередь врач проводит опрос пациента. Он уточняет:
- когда появились первые симптомы;
- что им предшествовало;
- менялась ли клиническая картина;
- присоединялась ли дополнительная симптоматика;
- как болезнь прогрессировала;
- где работал пациент;
- контактировал ли с токсичными химическими веществами.
Важно сообщить врачу о сопутствующих хронических болезнях (например, диабете или гипотиреозе). Это повлияет на прогноз и лечение симптомов со стороны периферической нервной системы.
После опроса врач определяет поверхностную и глубокую чувствительность, анализирует силу мышц и живость рефлексов. Если доктор замечает отклонения от нормы, он проводит специфические тесты, чтобы определить местоположение повреждённых нервов:
- поражение срединного нерва («кисть проповедника») — пациент не может собрать пальцы в кулак, противопоставить большой палец, согнуть большой и указательный пальцы;
- поражение лучевого нерва («свисающая кисть») — пациент не может разгибать пальцы и кисть с обращённой вниз ладонью;
- поражение локтевого нерва («когтеобразная кисть») — пальцы разогнуты в основных фалангах и согнуты в концевых, напоминая когти, большой палец не может удерживать предметы, развивается атрофия межкостных мышц кисти;
- поражение малоберцового нерва — ослабевают мышцы, разгибающие стопы и пальцы, снижается чувствительность по боковой поверхности голени и тыльной стороне стопы, стопа «свисает» и слегка повёрнута внутрь, пальцы немного согнуты;
- поражение большеберцового нерва — паралич мышц стопы и пальцев.
Инструментальная диагностика
Чтобы определить место повреждения, также используют тесты:
- Исследование с помощью монофиламента (моноволокна из пластика) — определяет тактильную чувствительность больших пальцев стоп, тыльной поверхности стопы и подошвы. Монофиламент держат перпендикулярно телу и в течение 1,5 секунд давят нитью на кожу. Оценка результатов теста простая: пациент либо чувствует, либо не чувствует прикосновения монофиламента.
- Исследование с нейротипс — определяет болевую чувствительность тыльной поверхности стоп и в области концевых фаланг больших пальцев с помощью укола тупой неврологической иглы.
- Исследование с помощью тип-терм — определяет температурную чувствительность с помощью специального термического цилиндра, один конец которого сделан из металла, а другой — из пластика. В норме прикосновение двух наконечников ощущается по-разному.
- Исследование с помощью камертона — определяет вибрационную чувствительность. Единственный способ, который позволяет установить диагноз на ранней стадии болезни. Порог вибрационной чувствительности оценивают с помощью неврологического градуированного камертона с частотой 128 Гц [13].
При периферической нейропатии также проводят электронейромиографию (ЭНМГ) и ультразвуковое исследование (УЗИ) нерва. ЭНМГ регистрирует электрические потенциалы, возникающие в мышцах при сокращении, и передаёт их на экран. В зависимости от показателей и сопутствующей клинической картины определяют очаг поражения. С помощью ЭНМГ также диагностируют характер двигательных нарушений и дифференцируют их между собой, уточняют уровень поражения нерва и выявляют стадию заболевания. Различают стимуляционную (электроды прикрепляют к коже) и игольчатую электромиографию (электроды вводят непосредственно в мышцу, после чего анализируют мышечное поражение) [14].
УЗИ оценивает анатомическую целостность нервного ствола, его структуру, чёткость контуров нерва и состояние окружающих тканей. С помощью УЗИ можно определить вид повреждения (полное или частичное), зону и степень сдавливания нервного ствола (отмечают уменьшение диаметра нерва), а также его причину.
В некоторых случаях проводят МРТ или КТ, например при подозрении на дискогенную радикулопатию пациент проходит МРТ.
Лабораторная диагностика
Пациент сдаёт общий анализ крови, а также, в зависимости от сопутствующих болезней, проверяет уровень глюкозы, гормонов щитовидной железы и т. д. [2][4][6][9] Например, при сахарном диабете может быть повышен уровень сахара в крови.
Дифференциальная диагностика
Периферическую нейропатию дифференцируют со следующими патологиями:
- злокачественными опухолями — диагноз устанавливают после сбора анамнеза и инструментального исследования (МРТ и КТ), которое исключает онкопроцесс;
- поражением спинного мозга — нарушаются сухожильные рефлексы, мышцы рук и ног слабеют, диагноз подтверждают с помощью МРТ;
- миастенией — это аутоиммунная болезнь, при которой пациент чувствует эпизодическую слабость в мышцах, диагноз подтверждает ЭНМГ и специфическая прозериновая проба (0,05%-й раствор Прозерина временно устраняет нарушение нервно-мышечной передачи, тем самым увеличивая амплитуду мышечных ответов);
- хронической окклюзией артерий ног — сопровождается утомлением и ноющими болями в икроножных мышцах при ходьбе, которые почти полностью проходят в спокойном состоянии (перемежающая хромота), диагноз исключают после ангиографии брюшной аорты и подвздошных артерий [7][8][9][10];
- боковым амиотрофическим склерозом (БАС) — обычно характеризуется слабостью в кистях и предплечьях, неловкостью при выполнении «тонких движений» пальцами и неконтролируемыми сокращениями мышц, реже — слабостью в верхних отделах рук и плечевом поясе; несмотря на схожесть БАС с полинейропатией, при неврологическом осмотре болезнь можно заподозрить благодаря патологическим рефлексам рук на фоне атрофии, обычно БАС развивается у людей старше 35 лет [11][12].
Лечение периферической нейропатии
Различают этиологическую, патогенетическую и симптоматическую терапию, при этом тактику лечения определяет только врач.
Этиологическая терапия
Направлена на причину болезни. Например, при токсической нейропатии необходимо исключить контакт с токсинами. Иногда применяют специфические антидоты:
- этилендиаминтетрауксусную кислоту (ЭДТА) и Пеницилламин при отравлении свинцом;
- Пеницилламин или Димеркапрол при отравлении ртутью;
- Унитиол, ЭДТА и Пеницилламин при отравлении мышьяком.
Лечение алкогольной полинейропатии основывается на исключении алкоголя и курса Тиамина (витамина В1).
Нейропатия на фоне гипотиреоза требует нормализации уровня тиреотропных гормонов с помощью заместительной гормонотерапии L-тироксином.
Постгерпетическая невралгия появляется после развития вируса герпеса, поэтому пациенту назначают противовирусную терапию: Ацикловир или Валацикловир в таблетках. При этом местные противогерпетические средства не эффективны.
При мононейропатиях исключают травмирующий фактор. Например, пациенту с нейропатией срединного нерва рекомендуют модифицировать рабочее место (подобрать компьютерную мышь с меньшей высотой подъёма кисти и перегиба в запястье) или отказаться от работы с мышкой. Важно временно снизить активность в суставе, которая усугубляет раздражение поражённого нерва [5].
Патогенетическая терапия
Направлена на устранение патологических процессов, возникших под воздействием различных причин, и включает в себя как приём препаратов, так и физиотерапию [5][7].
Медикаментозное лечение:
- Альфа-липоевая кислота (тиоктовая кислота) — внутренний антиоксидант, связывающий свободные радикалы. Назначают курсами с переходом от инъекционной формы на таблетированную. Показана при обменных нарушениях в комплексной терапии.
- Витамины группы В (В1, В6, В12) — улучшают обменные процессы в нейроэпителии и частично работают как антиоксидант. Обычно начинают терапию с инъекционных форм и далее переходят на таблетки.
- Препараты с уридинмонофосфатом — улучшают обменные процессы и регенерацию миелиновой оболочки в нервной ткани.
- Ингибитор холинэстеразы (с содержанием ипидакрина) — увеличивает содержание ацетилхолина и влияет на блокаду калиевых каналов в мембране клетки, что улучшает нервно-мышечную передачу.
- Препараты с содержанием пентоксифиллина (Трентал или Вазонит), никотиновая кислота — улучшают периферическое кровоснабжение.
Физиотерапия:
- Иглорефлексотерапия — метод лечебного воздействия на организм с помощью иглоукалывания биологически активных точек.
- Физиопроцедуры:
- Электрофорез — введение лекарств с помощью постоянного электрического тока. Эффект от процедуры отсроченный, так как в коже и тканях создаётся лекарственное «депо».
- Ультрафонофорез — введение лекарств осуществляется под воздействием ультразвука.
- Дарсонвализация — воздействие переменным импульсным высокочастотным током. Метод используют для обезболивания, снижения чувствительности нервных окончаний к болевым раздражителям, улучшения кровообращения и снабжения тканей кислородом.
- Электростимуляция — воздействие импульсного электрического тока, который поддерживает работу мышц и нервов, а также усиливает кровообращение и мышечный тонус.
- Диадинамотерапия — воздействие диадинамических импульсных электрических токов. Рекомендована при хронических нейропатических болях.
- Магнитотерапия (транскраниальная магнитная стимуляция) — применение статического или переменного магнитного поля. Оказывает противовоспалительный, обезболивающий и противоотёчный эффекты.
- Лечебная физкультура — назначают на раннем этапе восстановления.
Чтобы снизить нагрузку, при нейропатии срединного нерва пациент также носит ортез на лучезапястном суставе.
Симптоматическая терапия
Направлена на устранение симптомов, в первую очередь боли.
Чтобы снять болевой синдром, используют разные группы препаратов в зависимости от типа нейропатии, например нестероидные противовоспалительные средства, наркотические анальгетики, противосудорожные перепараты, антидепрессанты, транквилизаторы, а также пластыри с Лидокаином [1][5][7][10].
При мононейропатиях применяют лечебные блокады — введение в область нервов, сплетений и узлов анестетика, который прерывает передачу нервных импульсов от источника боли. В зависимости от симптомов и сопутствующих болезней блокады могут содержать один компонент либо быть многокомпонентными [1]. Блокаду используют при плексопатиях и радикулопатиях, которые сопровождаются сильной болью и ограничением движений рук или ног. Её также применяют, когда таблетки не приносят результата.
Пациент может получить больничный, если периферическая полинейропатия не позволяет заниматься привычными делами дома и на работе.
Прогноз. Профилактика
Прогноз при мононейропатии благоприятный, если нет сопутствующих болезней, тормозящих восстановление.
Полностью вылечить полинейропатию сложно, так как обычно она возникает на фоне хронической патологии, поэтому главная цель лечения заключается в том, чтобы избавлять пациента от симптомов так долго, насколько это возможно.
При наследственных поражениях периферической нервной системы прогноз часто неблагоприятный.
По результатам медико-социальной экспертизы (МСЭ) пациенту могут выдать справку об инвалидности. Показания для направления на МСЭ:
- парезы и паралич, стойкий болевой синдром, нарушение походки и координации движений (сенситивная атаксия), выраженные нарушения питания и работы внутренних органов, сосудов и различных желёз организма, существенно влияющей на жизнь пациента;
- длительная временная нетрудоспособность при плохом или сомнительном прогнозе в отношении восстановления двигательных и иных функций;
- прогрессирующее течение и рецидивы болезни с учётом её причин;
- невозможность вернуться к работе по специальности в связи с двигательным дефектом и/или противопоказанными условиями труда, которые не могут быть устранены по заключению врачебной комиссии.
При нейропатии освобождают от службы в армию, но при необходимости могут призвать [15].
Профилактика периферической нейропатии
Предупредить нейропатию, вызванную системной патологией, можно с помощью ежегодной диспансеризации, в течение которой врачи смогут выявить болезнь на раннем этапе [5]. Профилактика остальных форм нейропатии зависит от причин их появления.
Статья на конкурс «Био/Мол/Текст»: Болезнь Шарко—Мари—Тута (БШМТ или ШМТ) — самое распространенное наследственное заболевание нервной системы, о котором никто не знает. БШМТ сложно диагностировать и на данный момент невозможно вылечить. Моя статья расскажет, что это за заболевание, поведает о разнообразии его типов и симптомов и сообщит о разрабатываемых подходах для его лечения: от малых молекул до генной терапии. Для меня эта тема особенно важна, т.к. я сама страдаю от БШМТ и использую любую возможность информирования о ней. Надеюсь, эта статья поможет БШМТ пациентам более глубоко разобраться в своём заболевании, врачам — распознавать его симптомы и диагностировать, а всем остальным просто будет любопытно узнать о нём.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.
Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Удивительно, но, пожалуй, единственный верный способ узнать о болезни Шарко-Мари-Тута (БШМТ) на данный момент — получение такого диагноза после 3–10 лет скитаний по врачам [1]. Мне повезло, так как с момента возникновения симптомов до постановки диагноза прошло «всего» четыре года. В отличие от, например, рассеянного склероза [2], мало кто слышал о БШМТ. И это несмотря на то, что от последнего заболевания страдает бóльшее количество людей (2,6 миллионов [3] против 2,5 миллионов [4] людей во всем мире). О болезни Шарко-Мари-Тута нет новостных статей, практически невозможно найти информацию на русском о ее типах и разрабатываемых лекарствах. Такое удручающее состояние дел стало для меня мотивацией для запуска Инстаграм блога на русском языке, посвященного БШМТ, и написания этой статьи. В то же время БШМТ — самое часто встречаемое орфанное (редкое) заболевание, распространение которого варьируется в зависимости от методов оценки и которое ещё только предстоит выяснить во многих странах (рис. 1). БШМТ активно изучается, ведутся исследования по разработке терапий, в мире уже есть несколько ассоциаций, посвященных этой болезни, а в США даже специальные центры для пациентов с БШМТ.
Рисунок 1. БШМТ в числах
Сравнение БШМТ с рассеянным склерозом неслучайно: оба заболевания являются нейродегенеративными, прогрессирующими, часто проявляются неожиданно и в юношестве. Бóльшая часть случаев БШМТ представляет из себя демиелинизирующую форму. Это значит, что, как и в случае с рассеянным склерозом , страдает оболочка нейронов. Однако различия между ними существенны, самое важное из которых — очаг поражения: если при рассеянном склерозе страдает центральная нервная система (ЦНС), то при БШМТ — периферическая.
Узнать больше об этой болезни можно в статье «Рассеянный склероз: иммунная система против мозга» [2] из цикла «Аутоиммунные заболевания». — Ред.
Для того, чтобы разобраться с БШМТ, нам необходима некоторая база, включающая анатомию нервной системы, строение клетки и немного генетики. С этого и начнем. (Читатели, знающие молекулярную и клеточную биологию, могут спокойно пропустить следующий раздел.)
Клетки и их строение
Клетки нервной системы
Периферическая нервная система (ПНС) необходима нам для управления телом и передачи информации извне для обработки в мозге. С помощью ПНС мы заставляем наши мышцы и суставы двигаться, а также контролировать внутренние органы и устанавливать контакты с внешним миром. ПНС — это совокупность всех нервных волокон минус головной и спинной мозг, которые составляют ЦНС (рис. 2).
Нервная система в целом состоит из двух типов клеток: нейронов и глии (или глиальных клеток). Первые известны своей электрической активностью и общением с помощью специальных молекул — нейротрансмиттеров. Вторые считаются вспомогательными клетками, которые выполняют обширный спектр функций: от предоставления энергии нейронам до производства специальной оболочки нейронов — миелиновой оболочки. За производство миелина отвечают специальные глиальные клетки: олигодендроциты в ЦНС и шванновские клетки в ПНС (рис. 2). Миелин оборачивает нервные волокна (длинные отростки нейронов — аксоны ) и выполняет роль изоляционного материала: по такому же принципу устроены кабели и провода. Такая структура обеспечивает быстрое прохождение сигнала по аксону (проводу) за счёт отсутствия проводимости тока через изоляцию (миелин). Повреждение же миелина приводит к нарушению скорости прохождения сигнала от нейронов к мышцам и от рецепторов к нейронам. В результате наблюдается атрофия мышц и потеря чувствительности — важные симптомы демиелинизирующей формы БШМТ.
Рисунок 2. Клетки нервной системы и её миелинизация
Миелин
C эволюционной точки зрения миелин — достаточно новое изобретение, возникшее у позвоночных как адаптивная мера. Миелин дал начало развитию сложных нервных систем с быстрой проводимостью электрического сигнала [5]. Отсюда можем сделать вывод, что разного рода повреждения миелина нарушают проводимость нервных импульсов и угнетают ряд функций организма. Что представляет из себя миелин? Это видоизмененная клеточная мембрана, оборачивающая аксон или пучки аксонов в виде спирали. В ПНС количество таких компактных слоев, оборачивающих один аксон, может достигать ста. В отличие от обычных клеточных мембран [6], миелин по большей части состоит из жиров (70–85%), а белки составляют лишь 15–30% миелина [7]. Подробнее о миелине можно почитать в статье «Обёртка для аксона» [8].
Состав и организация миелина ЦНС и ПНС несколько различаются, но нас интересует миелинизация ПНС, так как БШМТ затрагивает именно её. Так, шванновские клетки находятся в очень интимных отношениях с нейронами — они буквально обнимают аксоны своей миелиновой оболочкой, и — в отличие от олигодендроцитов — не распыляются на десятки нейронов, а уделяют внимание лишь одному или нескольким.
Строение клеток
Помимо характерных черт нейронов и шванновских клеток нас также интересует общее строение клетки животных, а точнее её составляющие. В ядре клетки содержится генетическая информация в виде ДНК, которую удобно разделять на гены. На опредёленной стадии деления клетки ДНК упакована в хромосомы, которых у человека 23 пары: 22 аутосомные (неполовые) и 1 половая. Важным процессом является производство белков из ДНК через молекулу-посредник — РНК. Таким образом, гены являются инструкцией, в которой закодированы в том числе последовательности белков. Все эти три составляющие (ДНК — РНК — белок) можно воспринимать как набор букв, которые мы можем прочитать. Однако в контексте белков нас также интересует структура: они сворачиваются и образуют сложные трёхмерные молекулы — функциональные единицы клетки [9]. Помимо прочего, в эндоплазматическом ретикулуме происходит сворачивание белков, где они упаковываются в специальные шарики-везикулы и далее транспортируются к аппарату Гольджи. Здесь принимается решение о том, как белки будут использоваться: внутри клетки или за её пределами. Лизосомы необходимы для расщепления белков и других молекул — это клеточные инсинераторы (уничтожители), а митохондрии генерируют энергию и являются клеточными энергостанциями (рис. 3).
Рисунок 3. Строение клетки
Несмотря на то, что во всех клетках организма упакована одна и та же ДНК, по форме и функции клетки разных тканей и органов сильно отличаются. Более того, как мы уже упомянули, даже внутри нервной системы выделяют несколько типов клеток. Дело в том, что гены экспрессируются по-разному в разных клетках, то есть в каких-то клетках определённые гены активны, а в других — гены молчат. Таким образом, производство РНК и белков в клетках разных типов различается. В этом и есть фундаментальная причина, почему поломки (мутации) в каком-то гене приводят к заболеванию ПНС, а не, скажем, ЦНС: белок, который кодируется этим геном, не производится в ЦНС, соответственно и мутация «молчит». В случае с БШМТ заболевание вызвано мутациями в генах, экспрессируемых в шванновских клетках и/или нейронах. Разделение БШМТ на две формы, демиелинизирующую и аксональную, по-видимому, тоже связано с тем, в каких именно клетках экспрессируется белок, кодируемый поломанным геном. Демиелинизирующая форма обусловлена проблемами в генах, из которых будут произведены белки шванновских клеток (в частности, составляющие миелина). Аксональная же форма вызвана мутациями в генах, кодирующих белки нейронов. Однако не всё так просто.
Мутации, вызывающие БШМТ
БШМТ — наследственное заболевание. Это значит, что причина возникновения заболевания — поломка генов. Таким образом, БШМТ — общее название для целого спектра наследственных заболеваний периферической нервной системы, вызванных мутациями в разных генах. На данный момент известно уже >100 генов, мутации в которых вызывают БШМТ [10-12], а недавно было описано еще 30 мутаций, потенциально вовлеченных в развитие заболевания [13]. БШМТ-ассоциированные гены разбросаны по разным хромосомам; мутации в них послужили основанием для классификации БШМТ на подтипы (рис. 4). Вместе с тем, мутации лишь в четырёх генах ответственны за >90% всех случаев заболевания [14-15]. А 50–60% всех случаев БШМТ вызвано дупликацией (удвоением) части хромосомы 17, в которой находится ген PMP22 (этот тип известен как 1А) [16].
Рисунок 4. Подтипы БШМТ и гены, мутации в которых их вызывают, распределенные по разным хромосомам
Немного истории
Первые описания наследственного заболевания, при котором наблюдается прогрессирующая атрофия и слабость мышц конечностей, были задокументированы в середине 19 века Эйкхорстом [17]. Однако полноценное описание БШМТ появилось в 1886 году, когда невролог Шарко и его ученик Мари рапортовали о пяти случаях со следующими симптомами, появившимися у пациентов в возрасте от 3 до 15 лет: атрофия дистальных (дальних) мышц, полая стопа (с аномально высокой «аркой»), деформация пальцев рук и ног по типу «скручивания». Они считали, что повреждение спинного мозга — причина заболевания. В это же время физиолог Тут независимо описал пять случаев заболевания с теми же симптомами, указав на ПНС как возможную проблему. В итоге БШМТ получило свое название в честь этих трех нейрофизиологов (рис. 1).
Стоит заметить, что классификация наследственных невропатий, в частности БШМТ, никогда не отличалась простотой. Появились различные названия синдромов, схожих с БШМТ, в честь описавших их исследователей, что путает пациентов по сей день. Так, болезнь Дежерина-Сотта сейчас классифицируется как БШМТ тип 3, а термин «Руси-Леви » используется для описания определенного набора симптомов при БШМТ типа 1, в том числе тремор рук. Современная же классификация БШМТ была заложена Диком и Ламбертом в 1968 году, в которой были выделены две формы заболевания: тип 1, характеризующийся замедленной электрической проводимостью нервных волокон (демиелинизирующий тип), и тип 2, характеризующийся дегенерацией нейронов (аксональный тип). В 1980-х, наконец, была обнаружена связь БШМТ с генами, и был открыт тип 1B. А, когда стало ясно, что у большинства людей с БШМТ мутация не на хромосоме 1, а на хромосоме 17, был открыт тип 1А. В 1991 году было установлено, что изменение числа копий PMP22 — причина самого распространенного типа БШМТ (рис. 1).
Разбираемся в запутанном: классификация БШМТ
За последние 30 лет было открыто >100 генов, мутации в которых вызывают БШМТ. Классификация заболевания также изменилась. Помимо демиелинизирующей и аксональной формы, теперь выделяют ещё и промежуточную [18]. Для определения формы заболевания, как правило, используется электромиография (ЭМГ) — метод оценки скорости проводимости нервных волокон с помощью электродов. Результат такого исследования пациента записывается в виде кривой (электромиограмма) и расшифровывается врачом. Как уже было сказано, повреждение миелина ведёт к замедлению прохождения электрического импульса нейронов. Соответственно, снижение скорости импульса говорит о демиелинизирующем типе. Аксональный тип характеризуется сниженной амплитудой («силой») нервного импульса [19]. Промежуточный (смешанный) тип сочетает в себе снижение и скорости, и силы импульса, что, по всей видимости, обусловлено механизмом заболевания: мутации, приводящие к этой форме, затрагивают как нейроны, так и шванновские клетки [20]. Справедливее всего было бы все типы БШМТ назвать смешанными, так как в конечном счёте страдает как миелин, так и аксон. Различие лишь в том, что при аксональной форме аксон страдает в первую очередь, а при демиелинизирующей — во вторую. При этом именно дегенерацию аксона связывают с функциональными нарушениями у пациентов с БШМТ [21].
Сейчас условно принято разделять БШМТ на 4 типа в соответствии с клинической картиной (симптомами) и видом наследования (как мутация передается из поколения в поколение) [22-23]. (Таблица 1, рис. 5). Вид наследования заболевания важно знать для планирования семьи, а также для понимания разницы тяжести симптомов у членов одной семьи.
| Тип БШМТ | Тип наследования |
|---|---|
| Тип 1 демиелинизирующий | аутосомно-доминантный тип наследования |
| Тип 2 аксональный | |
| Тип 3 болезнь Дежерина-Сотта | исторический термин, выходит из употребления, в целом обозначает сложное течение болезни и появление симптомов в раннем возрасте |
| Тип 4 демиелинизирующий | аутосомно-рецессивный тип наследования |
| Тип 1X промежуточный | X-сцепленный доминантный тип наследования |
Рисунок 5а. Аутосомные типы наследования БШМТ
Рисунок 5b. Х-сцепленные типы наследования БШМТ
Иногда выделяют тип 5, промежуточные и X-сцепленные типы выносят отдельно, а тип 3 почти не используется [24]. Неудивительно, что разобраться в этой классификации сложно, но, пожалуй, самое важное — понимание необходимости генетического теста для определения подтипа БШМТ. От этого зависит подбор терапии в будущем, когда она будет доступна.
Подтипы определяют гены и вид мутации в них: один и тот же подтип может быть вызван разными мутациями в одном гене, а разные мутации в одном гене могут вызывать разные подтипы. Так, дупликация гена PMP22 вызывает тип 1A, а точечная мутация — тип 1E. В то же время, известно >200 точечных мутаций в гене MPZ, которые вызывают тип 1B. Казалось бы, такое неимоверное число генов и мутаций требует разработки множества терапий, а, учитывая времязатратность разработки лекарств, ситуация с БШМТ безнадежна. Однако ряд подходов может оказаться успешным сразу для нескольких типов. К тому же мутации лишь в следующих четырех генах ответственны за подавляющее большинство случаев БШМТ: PMP22, MPZ, GJB1, MFN2. Это диктует разработку терапий именно для типов, связанных с этими генами. Итак, переходим к более подробному описанию самых распространенных типов БШМТ и разрабатываемых терапий для них.
Терапевтические подходы согласно самым распространенным типам
Периферический миелиновый белок 22 (PMP22): дупликация — тип 1A, точечная мутация — тип 1Е
Тип 1а уникален: это самый распространенный тип [25], который, в отличие от других известных типов, вызван не точечной мутацией, а дупликацией. В связи с тем, что большинство людей с БШМТ страдают именно от типа 1А, исследования, посвящённые этому типу, преобладают. Лекарства для этого типа также на самой продвинутой стадии разработки. Мы уже много всего знаем об этом типе, а история попыток его лечения наполнена драмой, но, несомненно, увидит счастливый конец. Я тоже отношусь к «счастливчикам» с этим типом и, несомненно, наполнена оптимизмом касательно разрабатываемых лекарственных терапий.
При типе 1А мутации подвержен участок хромосомы 17 (обозначается как 17p11.2-p12), где находится ген PMP22. Было показано, что изменение числа копий именно PMP22 — причина развития заболевания, несмотря на то, что в этой части хромосомы 17 находятся еще несколько генов. Делеция (потеря) этого же участка хромосомы вызывает другое заболевание ПНС с похожими симптомами [26], . Дело в том, что при делении клетки могут происходить дупликации и делеции определенных участков ДНК из-за повторяющихся элементов вокруг, что и происходит с PMP22 (рис.6).
Известное под названием наследственной нейропатии с предрасположенностью к параличам от сдавления (ННППС).
Рисунок 6. Образование двух аномальных хромосом: с дупликацией и делецией PMP22
Такие нестабильные участки ДНК так и норовят мутировать подобно непоседливым детям, которые не могут усидеть на месте. Подобного рода мутации невозможно обнаружить с помощью методов секвенирования [27] (т.е. прочтения ДНК по буквам). Поэтому используется другой подход — количественная оценка определенных маркеров внутри этого участка хромосомы методом полимеразной цепной реакции (ПЦР) [28]. Как правило, если по возрасту возникновения симптомов (подростковый), самим симптомам и результатам ЭМГ понятно, что у пациента демиелинизирующая форма заболевания ПНС, то следующим шагом будет проведение ПЦР-теста на определение копий PMP22. Если это число в норме — нужно дальше продолжать поиск мутации, вызывающей заболевание. В моём случае врач-невролог направил меня именно на ПЦР-тест, так мутация и была обнаружена. Однако иногда врачи сразу направляют пациентов на секвенирование экзома (той части генома, которая кодирует белки), что излишне и не приведёт к обнаружению мутации-причины БШМТ типа 1А.
Интересно, что даже у пациентов с одним и тем же типом заболевание протекает по-разному. Это я наблюдаю и у своих подписчиков. На это есть несколько причин. В случае типа 1А одно из объяснений разнородности тяжести заболевания — число копий PMP22. Иногда у пациентов наблюдается не дупликация, а трипликация этого участка хромосомы, т.е. производство белка PMP22 ещё выше. Это может возникнуть в случае наследования дупликации от матери, на которое накладывается ещё одна реорганизация хромосомы [29]. В таком случае симптомы намного более выражены и могут проявиться в раннем возрасте [30]. Ещё одной причиной выступает разнородность последовательностей тех участков ДНК, которые кодируют молекулы-регуляторы PMP22. Не всегда ДНК кодирует белки, а РНК выступает промежуточным шагом в этом процессе. Есть такие РНК, которые не являются шаблоном для производства белков, а сами регулируют экспрессию генов [31]. Иногда даже одной разницы в «написании» таких участков, которые регулируют экспрессию PMP22 хватает для разнородности выраженности симптомов заболевания [32].
Чем же опасна эта мутация? Дупликация гена PMP22 приводит к повышенному производству соответствующих РНК и белка. Это белок мембраны Шванновских клеток, который составляет ≈2–5% миелина по весу [33]. Так же, как подъёмный кран необходим для построения высокоэтажки из блоков, PMP22 жизненно важен для формирования структуры миелина, состоящей из жиров и белков [33]. Повышенное количество PMP22 приводит к нарушению архитектуры миелина и образования так называемых «луковичных головок», окружающих аксоны [34] (рис.7).
Рисунок 7. Луковичные головки (нарушение миелина) (слева), здоровый миелин (справа)
иллюстрация адаптирована из [34]
Из-за повреждённой миелинизации нарушается проводимость нервного импульса к мышцам, поэтому становится сложно ими управлять. Сначала страдают ступни: нарушается походка, пациенты испытывают неудобство при ходьбе, подворачивания, иногда спазмы. Ввиду того, что нервный импульс не достигает мышц, они атрофируются, деформируется стопа. По мере прогрессирования заболевания могут также страдать руки: слабость в кистях, нарушение мелкой моторики, тремор, деформация кистей. Также наблюдаются отсутствие рефлексов и потеря чувствительности. Эти симптомы типа 1А известны как «классическая» симптоматика БШМТ, она характерна и для других типов [23]. Помимо стандартных симптомов, затрагивающих моторные функцию и чувствительность, БШМТ может нарушать целый ряд других функций, что может ускользать от внимания врачей. Сюда входят проблемы с дыханием и глотанием [35] (вероятно, из-за слабости мышц диафрагмы [36]), потеря слуха [37], нарушение некоторых функций внутренних органов [38] и даже нарушение ориентации в пространстве [39]. С возрастом ситуация ухудшается, особенно после 50 лет, что, вероятно, связано с добавлением дегенерации самих аксонов к уже присутствующей демиелинизации [40].
Ещё один, пожалуй, недооцененный симптом БШМТ в целом и типа 1А в частности — усталость [41]. Пациенты описывают это как отсутствие энергии, сопровождающееся волнами изнеможения [42]. Ни я, ни мои подписчики не являются исключением — мы все жутко устаем. Триггерами подобной усталости выступают стресс, физическая активность (в частности ходьба), продолжительная концентрация — в том числе для того, чтобы постоянно наблюдать за поверхностью и не споткнуться. Способов борьбы с усталостью при БШМТ фактически нет. Была показана некоторая эффективность приема лекарства модафинила [43] и интервальной велотренировки [44], но на маленьких группах людей: 4 и 8 человек соответственно. На данный момент неизвестно, что именно вызывает хроническую усталость при БШМТ. Хотя можно вынести некоторые предположения на этот счет.
В первую очередь дело, конечно, в энергии. Пациентам с БШМТ типа 1А требуется больше энергии, чем здоровым людям, для того, чтобы выполнять даже такую простую задачу как ходьба [45]. Кроме того, заболевание приводит к нарушению энергообмена: страдают митохондрии из-за пониженного производства необходимых для них белков, нарушается метаболизм белков и жиров, критически важных для синтеза миелина [46-47]. Эти процессы приводят к оксидативному стрессу и хроническому воспалению. Интересно, что подобные процессы наблюдаются у пациентов с типом 1А, несмотря на то, что мутация в гене, казалось бы, никак не связанном с функционированием митохондрий. Есть типы БШМТ, вызванные мутациями в генах, производящих белки, жизненно важные для митохондриальной функции. В этом случае молекулярные пути, вызывающие оксидативный стресс, более понятны [48].
Терапевтические подходы 1: боремся с последствиями
Под оксидативным стрессом имеется в виду неспособность организма справляться с так называемыми свободными радикалами [49]. Это в целом плохие парни, которые пытаются «отщипнуть» электроны от других молекул, делая их нестабильными. Свободные радикалы запускают воспалительный процесс, который, по-видимому, и вызывает усталость, ведь всем знакомо чувство изнеможения, скажем, при простуде. Однако, если в случае с простудой воспаление — это ответ на инфекцию, который пройдет, как только иммунная система справится с вирусом, то в случае БШМТ воспаление так и мучает пациентов. К тому же есть данные о нарушенном функционировании иммунной системы при БШМТ [50].
В связи с этим уже давно исследователи пытаются применить антиоксиданты [49] как возможную терапию для борьбы с БШМТ. Антиоксиданты — это хорошие парни, которые делятся своими электронами и нейтрализуют свободные радикалы. Уже было опробовано несколько антиоксидантов на животных моделях типа 1А, а некоторые даже на людях.
- Витамин C (аскорбиновая кислота). Ожидалось, что это будет первым лекарством для БШМТ. На него возлагали большие надежды, ведь в дополнение к антиоксидантному воздействию витамина Ц, была показана его способность снижать уровень PMP22 [51]. Он отлично сработал на животных [52]. По всему миру было запущено несколько клинических исследований для оценки эффективности витамина Ц на людях, но, увы, его ожидал провал [53], [54].
- Мелатонин — не только регулятор цикла сна-бодрствования, но и мощный антиоксидант, успешно снизивший воспаление у трёх детей с БШМТ типа 1А [55]. Это пилотное исследование обнадёживает, но необходимо дождаться результатов исследований на большем количестве пациентов.
- Куркумин примечателен не только своей способностью окрашивать куркуму в столь яркий жёлтый цвет, но и своими противовоспалительными и антиоксидантными свойствами. На крысах было показано, что куркумин (но не обычный, а специально разработанный, доставляемый в организм с помощью наночастиц) снижает оксидативный стресс и улучшает миелинизацию и моторные функции при типе 1А [56]. Вероятно, что наподобие витамина Ц куркумин ожидает фиаско при тестировании на людях. Хотя не исключено, что такая терапия увенчается успехом. В любом случае необходимо ждать исследований на людях.
Оксидативный стресс непосредственно связан с другим видом стресса — стрессом эндоплазматического ретикулума (ЭР)). ЭР — станция клетки, где белки сворачиваются, то есть приобретают необходимую для их нормального функционирования структуру. Действительно, при БШМТ типа 1А наблюдается повышенный стресс ЭР и нарушение сворачивания PMP22 [57]. В связи с этим ещё один разрабатываемый терапевтический подход для типа 1А — корректировка стресса ЭР, чем занимается компания InFlectis BioScience. Разработанная ими малая молекула под кодовым названием IFB-088 уже прошла испытания на здоровых добровольцах. Клинические исследования для оценки эффективности молекулы на пациентах с БШМТ начнутся в 2021 году.
Неправильно свернутые белки PMP22 могут образовывать токсичные скопления внутри клеток, что нарушает их функционирование. Следовательно, деградация таких скоплений — ещё один возможный терапевтический подход. Его можно осуществить путем стимуляции аутофагии [58] — естественного процесса, с помощью которого клетка избавляется от всего ненужного. На животных было опробовано два варианта такого подхода: интервальное голодание, когда животные получали еду через день [59], и применение лекарственного препарата рапамицина [60], [61]. В случае последнего миелинизация улучшилась, а моторные функции — нет.
Ещё одно, мягко говоря, неприятное последствие дупликации гена PMP22 — нарушение метаболизма жиров, которые так необходимы для нормального функционирования миелина [46]. Недостаточное их производство подтолкнуло исследователей к тестированию специальной диеты на модельных животных с БШМТ типом 1А. В результате добавления фосфолипидов в питание крыс, ученым удалось добиться улучшения состояния миелина, аксонов, мышц и моторной функции [47]. Будем ждать результатов воссоздания подобной диеты на пациентах с БШМТ 1А. Пока же пациентам с БШМТ целесообразно следовать общим рекомендациям правильного питания, которые я подробно рассматриваю на своём YouTube-канале.
Терапевтические подходы 2: искоренение проблемы
Несмотря на разнообразие разрабатываемых терапевтических подходов, упомянутых выше, самым многообещающим на данный момент выступает снижение экспрессии PMP22. Здесь опять же существует несколько вариантов решения проблемы: корректировка гена, воздействие на РНК или на белки-регуляторы и партнёры белка PMP22 рис. 8). Некоторые из них пока помогли только животным, а некоторые уже вышли на финишную прямую.
Рисунок 8. Терапевтические подходы для лечения БШМТ типа 1А путем искоренения проблемы
Пожалуй, самое очевидное решение проблемы — генное редактирование, ведь если проблема в мутации, то, починив её, мы сможем искоренить непосредственно причину заболевания. Действительно, совсем недавно на мышиной модели типа 1а был опробован метод генетического редактирования с помощью системы CRISPR/Cas9. Исследователям удалось успешно вырезать часть гена PMP22, снизив его экспрессию на ≈40% без внесения каких-либо нецелевых изменений в гены животных [62]. Для того, чтобы опробовать данный подход на людях, необходимо решить несколько проблем, включая эффективную доставку системы в шванновские клетки пациентов. Авторы работы предполагают, что этот терапевтический подход может оказаться эффективным при применении как в раннем возрасте, до начала демиелинизации, так и при уже начавшейся деградации миелина. Однако вопрос о том, сможет ли такая терапия откатить назад уже накопившиеся повреждения разного рода (описанные выше) у пациентов взрослого возраста, остаётся открытым.
Ещё один вариант снижения уровня PMP22 — воздействие на РНК, т.е. промежуточный шаг между производством белка PMP22 из одноименного гена. Такой подход известен как РНК-интерференция [63]. Наши клетки привыкли к тому, что РНК у них одноцепочечная, а, если они вдруг сталкиваются с тем, что РНК стала состоять из двух цепочек, то они избавляются от такой странной молекулы. Этот подход оказался успешным не только на мышах, но и на крысах. Исследователям удалось снизить производство PMP22 и улучшить моторные функции животных [64]. По всей видимости, воплощению данного подхода на людях мешает опять же проблема доставки терапии в клетки человека. Хорошая же новость состоит в том, что уже несколько фармкомпаний решают эту проблему, в том числе Ionis Pharmaceuticals [65] и DTx Pharma [66].
Были попытки регулировать уровень PMP22 с помощью манипуляций с белками, которые влияют на производство PMP22. Например, воздействуя на половой гормон прогестерон. Было показано, что прогестерон повышает уровень PMP22; соответственно, снизив активность первого, снизим и выработку второго. Такой подход, использующий блокатор рецептора прогестерона и не даёт тем самым прогестерону воздействовать на него, оказался удачным на животных [67-68]. Однако подобные лекарства показали токсичность для людей, поэтому ещё не было ни одного клинического исследования для оценки их эффективности на пациентах с БШМТ [69].
Ещё одна рассматриваемая мишень воздействия для снижения производства PMP22 — нейрегулин-1 — белок, регулирующий активность шванновских клеток. На грызунах был показан положительный эффект дополнительного применения нейрегулина-1 для улучшения состояния аксона [70]. Однако, как замечают авторы другой статьи, существует несколько вариантов нейрегулина-1, и некоторые из них производятся в повышенном количестве при БШМТ типе 1А [71]. Поэтому, прежде чем повышать уровень нейрегулина-1 у пациентов, необходимо разобраться, какие варианты нужно использовать и перспективный ли это подход вообще.
Другим путём пошли исследователи, которым в итоге удалось разработать лекарство, которое работает на людях. Вместо того, чтобы выбирать какую-то одну мишень, воздействие на которую приведет к снижению экспрессии PMP22, они решили проанализировать сигнальные пути, в которых участвует этот белок. Каждый белок в нашем организме общается с целым рядом других белков, создавая тем самым сети сигнальных путей наподобие тому, как люди взаимодействуют в социальных сетях. Проанализировав сигнальные пути PMP22, учёным удалось подобрать комбинацию из трёх уже одобренных для других заболеваний лекарств, которая бы воздействовала на белки-партнеры PMP22 и снижала бы его производство. После того, как были получены обнадеживающие результаты на грызунах [72], было проведено исследование на пациентах с БШМТ типом 1A, которое также увенчалось успехом, показав, что моторные функции пациентов улучшились [73]. Важно, что для достижения желаемого эффекта необходима комбинация из всех трёх препаратов — баклофена, налтрексона и сорбита [74].
Также есть основания полагать, что применение лекарства в детском возрасте, до развития симптомов, может отсрочить или даже предупредить проявление заболевания [75]. Pharnext — компания, разрабатывающая препарат, — уже провела часть финальной третьей фазы клинического исследования для оценки эффективности данного лекарства, известного под кодовым названием PXT3003. Заключительная часть этого исследования запланирована на 2021 год, и, очень вероятно, это будет самым первым лекарством для БШМТ, которое выйдет на рынок. Это, безусловно, будет прорывом, которого так ждут пациенты. Прорывом, достигнутым с помощью силы новых технологий, в том числе искусственного интеллекта, алгоритмы которого способны анализировать большое число молекул-участников клеточного общения и подбирать методы воздействия на них. О, этот дивный новый мир!
Различного рода генная терапия [76] тестируется пока только на животных. Здесь уже речь не о направленном воздействии на сам PMP22 (генное редактирование), а о доставке другого белка — нейротрофина-3 (НТ-3) — к демиелинизированному аксону. НТ-3 производится шванновскими клетками и способствует регенерации поврежденных аксонов. Предположение ученых состояло в том, что, снабдив дегенерирующие аксоны при БШМТ типе 1А дополнительным количеством белка НТ-3, возможно будет их восстановить. После успешного тестирования этого подхода на мышах, ученые запустили пилотное исследование с подкожными инъекциями НТ-3 на людях и даже получили положительные результаты. Однако, ввиду ряда проблем, назрела необходимость пересмотра подхода. Выходом стала доставка не белка, а гена НТ-3 с помощью вирусной «оболочки» [77] — отработанный метод доставки генетического материала в клетки. В декабре 2020 планируется запустить клиническое исследование для оценки эффективности одноразовой инъекции НТ-3 генной терапии пациентам с БШМТ типом 1А. Примечательно, что данный подход может оказаться успешным и для других типов БШМТ, ведь он направлен на восстановление аксона [78], который так или иначе страдает при всех типах заболевания. Это касается и типа 1Е, вызванного точечной мутацией в том же гене, что и при типе 1А — уже так знакомом нам PMP22.
Белок коннексин-32 (GJB1): тип 1Х
Тип 1X — второй по распространённости тип БШМТ, который составляет примерно 7% всех случаев. Этот тип интересен тем, что вызван мутациями в гене, расположенном на половой X-хромосоме (отсюда название). У женщин таких хромосом две, а у мужчин одна Х и одна Y-хромосома. Это обусловливает необычность его наследования по сравнению с другими известными типами и разницу в выраженности симптомов в зависимости от пола пациента. Как видно на рис. 5b, если болен отец, то все его сыновья будут здоровы. Такой гарантии нет при любом другом типе. Также симптомы у женщин с этим типом часто менее выражены, чем у мужчин [79] (вероятно, из-за инактивации той X-хромосомы, где находится мутированный ген). Ввиду того, что у женщин две X-хромосомы, одна из них случайным образом инактивируется, чтобы предупредить чрезмерное производство генов, на них расположенных. Однако, если инактивированной хромосомой стала та, которая содержит здоровый ген, тогда и симптомы будут более выраженными. У мужчин же нет бэкапа в виде второй X-хромосомы; соответственно, выраженность симптомов у мужчин более однородна и чаще сильнее, чем у женщин даже из той же семьи.
Этот тип вызван разными мутациями в гене GJBI (их известно уже >400), который кодирует белок коннексин-32. Коннексины — белки, которые располагаются в мембране клеток и образуют структуры, выполняющие роль молекулярных связок между клетками [80]. С помощью таких связок клетки общаются путём обмена малыми молекулами. Известен целый ряд коннексинов, но нас интересует именно коннексин-32: это важный соединительный элемент между слоями миелина и между аксоном и миелином. Важно, что этот белок производится не только в ПНС, но и в ЦНС, и даже в печени [81]. Есть также данные об участии коннексина-32 в функционировании митохондрий. Ввиду многофункциональности и экспрессии коннексина-32 в разных тканях, мутации в кодирующем его гене могут приводить к симптомам, не ограниченным ПНС. Так, у мышиной модели типа 1Х наблюдается дисфункция олигодендроцитов (помним, что они производят миелин в ЦНС), стресс ЭР и воспаление [82]. У некоторых людей также наблюдаются симптомы, связанные с нарушением ЦНС: глухота и нарушение когнитивных функций, часто эпизодически [83].
В числе терапевтических подходов, уже опробованных на животных моделях типа 1Х, — генная терапия [76]. Однако, в отличие от типа 1А, здесь речь идёт о доставке здоровой версии самого виновника заболевания — GJBI [84-85]. Такой подход сработал на животных не только до развития у них симптомов, но и после [84]. У мышей значительно улучшились моторные функции и миелинизация, а также снизилось воспаление. Следующий шаг — оптимизация доставки гена в клетки людей и запуск клинических исследований.
Нулевой миелиновый белок (MPZ, P0): тип 1В и тип 3
Тип 1В составляет 5–10% случаев БШМТ демиелинизирующей формы и вызван мутациями в гене MPZ. Этот ген кодирует белок, который составляет около 50% всех белков миелина в ПНС [85]. Трансмембранный белок MPZ производится исключительно шванновскими клетками и выступает важнейшим структурным белком миелина. В зависимости от того, где именно мутация, белок будет либо совсем не функционален, либо «наполовину». Разные точечные мутации в гене MPZ приводят к БШМТ 1В (уже известно ≈30 мутаций) (рис. 9), что обусловливает разнородность тяжести и возраста проявления симптомов. Около 5–10% людей с БШМТ 1 типа относятся к типу 1В [23].
Рисунок 9. Трансмембранный белок MPZ. Жёлтым цветом выделены мутации, связанные с БШМТ 1В. Сиреневым цветом выделены мутации, приводящие к БШМТ типа 3.
В целом внутри подтипа 1В выделяют две группы пациентов: одну с ранним проявлением заболевания и тяжелыми симптомами, включая задержку ходьбы, и другую — с более лёгкими симптомами, которые проявляются во взрослом периоде жизни. По симптомам тип 1В очень похож на тип 1А, а действительно хорошая новость состоит в том, что некоторые терапевтические подходы могут подойти для обоих типов.
Во-первых, уже знакомый нам антиоксидант куркумин, растворённый в кунжутном масле, показал успех на мышиной модели типа 1В [87]. Оказалось, что куркумин играет роль не только антиоксиданта, но и снижает стресс эндоплазматического ретикулума. Как мы уже обсудили ранее, неправильно свернутые белки вызывают стресс ЭР. Мутации в гене MPZ приводят к нарушению нормальной структуры произведенного белка, и, соответственно, снижая стресс ЭР, мы боремся со следствием заболевания. А уже упомянутая Inflectis BioScience планирует опробовать свою малую молекулу IFB-088 не только на пациентах с типом 1А, но и 1В.
Во-вторых, ещё один общий подход, вселяющий надежду для разных типов БШМТ, в том числе 1В, — подавление программы дегенерации аксона [88]. Дело в том, что при разного рода повреждении у аксонов запускается программа разрушения, которая характерна для разных типов БШМТ. Подавив эту программу путём воздействия на её белки-участники, теоретически можно остановить дегенерацию аксона при БШМТ. Исследователи рассматривают разные варианты воздействия на эту программу и уже опробовали несколько из них на мышиных моделях типа 1А и 1В. Такая терапия может оказаться успешной как вспомогательная для тех, которые направлены непосредственно на искоренение проблемы, т.е. соответствующий мутированный ген. А вот для аксональной формы (разных подтипов типа 2) БШМТ подобный подход обещает быть особенно успешным, ведь у таких пациентов в первую очередь страдает аксон.
Митофузин-2 (MFN2): тип 2А
Мы перешли на аксональные подтипы БШМТ. Терапии в разработке для этих подтипов не на таком продвинутом уровне, но радует, что хотя бы разработаны животные модели для разных подтипов типа 2. А это уже достижение и приближает исследователей к апробации терапий на животных. Опять же, уровень продвинутости подходов зависит от распространенности подтипа.
Тип 2А вызван мутациями в гене MFN2, который кодирует белок митофузин-2, и ответственен за 30% всех случаев типа 2. О функции этого белка легко догадаться из его названия: «мито» означает митохондрии, а «фузин» (от англ. fusion) — слияние. Соответственно, митофузин-2 необходим для важного процесса слияния митохондрий. С помощью разных белков, в том числе митофузина-2, расположенного в мембране митохондрий, энергетические станции наших клеток формируют динамичные сети, обеспечивая энергией разные участки клетки, где она нужна в тот или иной момент. В частности, таким образом митохондрии общаются с ЭР.
Митофузин-2 производится в разных клетках, но нейроны особенно чувствительны к дефектам этого белка. Для нормального функционирования нейронам жизненно важно вовремя получать энергию в той части клетки, которая активна. Мутации же в гене MFN2 могут нарушать функционирование белка, тем самым нарушая и формирование сетей митохондрий, и вызывая ЭР стресс нейронов. К тому же в нервной системе производство митофузина-1 (своего рода бэкапа митофуниза-2) ниже, чем в других тканях.
Было обнаружено уже более 100 мутаций в гене MFN2, которые вызывают БШМТ типа 2А. Опять же: выраженность симптомов и возраст их проявления варьируется у пациентов даже с одной и той же самой мутацией [89]. Дегенерация же аксонов наблюдается у всех пациентов, что обуслoвливает ожидаемую пользу подавления программы дегенерации аксонов, описанную выше.
Есть некоторые отрывочные данные о положительном эффекте использования антиоксиданта коэнзима Q10 [90], но необходимы более обширные исследования для каких-либо выводов.
Разработкой еще одного подхода занимается компания AcuraStem. В процессе скрининга молекул-кандидатов на клетках, взятых у пациентов с БШМТ типом 2А, исследователи обнаружили молекулу, которая способствует выживаемости нейронов. Сейчас же, наподобие Pharnext, компания проводит скрининг уже одобренных для других заболеваний компонентов, ожидая найти среди них те, которые сработают для типа 2А. Такой подход поможет сократить время разработки лекарств, ведь их безопасность уже показана [91].
Среди разрабатываемых терапевтических подходов для этого типа опять же генная терапия [76]. Здесь рассматривается несколько подходов: увеличение производства митофузина-1 или митофузина-2 [92], например, путем доставки здорового гена; комбинация подавления производства белка из мутированного гена (путём воздействия на РНК наподобие того, как это делается в случае типа 1А) и добавление здорового гена MFN2 [93]. Пока эти методы в процессе тестирования на животных.
Итак, мы рассмотрели терапевтические подходы для лечения самых распространённых типов БШМТ, направленные на борьбу с мутациями в четырёх генах. Похожие подходы, в частности генная терапия, находятся в разработке и для других подтипов БШМТ. Так, например, еще один аксональный тип 2E планируют лечить с помощью инактивации мутированного гена и доставки здорового его варианта [94]. Ген-виновник в этом случае известен как NEFL, он кодирует структурный белок нейронов — нейрофиламент.
БШМТ — заболевание ПНС и не затрагивает ЦНС. Так ли это?
Как мы уже упомянули, иногда генетические мутации, вызывающие БШМТ, затрагивают и ЦНС (например, в случае типа 1Х [95]). Как правило, это происходит из-за того, что ген-виновник производит неправильной белок как в ПНС (шванновскими клетками), так и в ЦНС (олигодердроцитами). Так, у некоторых пациентов с типом 1Х обнаруживаются структурные нарушения белого вещества (миелина) головного мозга, а среди симптомов, длящихся от нескольких часов до нескольких недель, могут быть нарушения зрения, слуха, координации, проблемы с речью, головокружение. Часто на это накладывается воспаление, вероятно, связанное с аутоиммунным ответом (когда иммунитет атакует собственный организм) [96]. В целом возникает картина рассеянного склероза [2], однако, важно понимать, что все эти симптомы вызваны БШМТ.
Помимо типа 1Х, некоторые нарушения миелина ЦНС были обнаружены у нескольких пациентов с типом 1А [97]. Хотя не исключено, что в этих случаях у пациентов присутствует и БШМТ, и рассеянный склероз. Однако разница в структуре мозга людей с этим типом БШМТ и здоровых людей всё же есть, несмотря на то, что белок PMP22 производится в ЦНС в ничтожном количестве. У таких пациентов наблюдается в целом меньший объем белого вещества в мозге, но повышенный объём серого вещества (нейронов) в регионах мозга, ответственных за координацию движений, походку и баланс [98]. Вероятно, таким образом происходит компенсация дефицита периферической нервной системы. Демиелинизация нейронов ЦНС также была обнаружена у пациентов с типом 1А [99].
Тип 2А также характеризуется вовлечённостью ЦНС: у пациентов с мутациями в гене MFN2 присутствуют повреждения как белого, так и серого вещества [100]. Напротив, при типе 4D (мутация в гене NDRG1, кодирующем белок, играющий важную роль в функционировании миелина) наблюдаются нарушения только белого вещества [101].
Поддерживающая терапия при БШМТ
Что же делать пациентам БШМТ в ожидании разработки лекарств и выхода их на рынок? Вариантов немного, но некоторые из них могут значительно улучшить качество жизни и приостановить прогрессирование болезни.
- Физиотерапия и физические упражнения разного характера, включая силовые тренировки, кардио и упражнения на гибкость [102].
- Вспомогательные средства, такие как ортезы для стабилизации голеностопа и стопы [103].
- Хирургические операции при значительных деформациях конечностей и позвоночника [104].
- Нет данных, подтверждающих эффективность и оценивающих безопасность следующих процедур у пациентов с БШМТ: санаторно-курортное лечение (грязи, ванны, массажи), электрофорезы, магнитная терапия, электростимуляция, методы нетрадиционной медицины. Однако, к сожалению, эти процедуры часто назначаются пациентам в России.
- Пациенты с БШМТ должны наблюдаться у мультидисциплинарной группы врачей, которая способна подобрать индивидуализированный подход к каждому пациенту.
Мировые активности, посвященные БШМТ
Пациенты с БШМТ могут поучаствовать в клинических исследованиях, если они были запущены в стране проживания, следить за деятельностью организаций, посвященных БШМТ, и даже просто установить приложение CMT&me, тем самым предоставляя важную для исследователей информацию о прогрессировании заболевания. К сожалению, приложение могут установить только граждане определённых стран Европы и США, но данные, собранные таким образом, несомненно, помогут лучше понять БШМТ, распространённость различных типов, симптомы и т.д. Несомненно, это поможет увидеть более полную картину БШМТ и обеспечит врачей во всем мире необходимыми знаниями для предоставления качественной помощи пациентам.
Следующие организации, созданные самими пациентами, собирают средства на поддержку исследований для разработки лекарств для БШМТ, информируют пациентов о новостях и организуют встречи, создавая БШМТ-сообщества:
- Charcot-Marie-Tooth Association (США) — пожалуй, самая глобальная БШМТ-организация.
- Hereditary Neuropathy Foundation (США)
- CMT Research Foundation (США)
- The European Charcot-Marie-Tooth Federation (Европа) — федерация нескольких европейских ассоциаций, посвященных БШМТ. Вступить могут как оформленные некоммерческие европейские организации (full member), так и ассоциации из других регионов (associate member).
- The Charcot Marie Tooth Association Australia Inc (Австралия).
- Есть некоторые менее масштабные ассоциации и сообщества, посвященные БШМТ в разных странах с рабочим языком страны. Например, в России «Мир без болезни Шарко-Мари-Тута — Генетика» или в Японии CMT友の会.
Заключение
БШМТ, несомненно, интереснейшее заболевание. Мы ещё только начинаем узнавать механизмы, симптомы и проявления разнообразных его типов. Однако за последние 10 лет прямо на моих глазах произошло необыкновенное: было открыто много новых подтипов БШМТ, были разработаны животные модели для самых (и не самых) распространенных из них, опробованы несколько терапевтических подходов, одно лекарство вышло на финишную прямую, а генная терапия, вероятно, в не столь далеком будущем избавит мир от БШМТ, чего так ждут пациенты по всему миру. Скорее всего, эффективная терапия для БШМТ будет подбираться под пациента и зависеть от нескольких факторов: типа, возраста, пола, степени прогрессии и особенностей генома. Будущее, несомненно, за персонализированной медициной [105], и даже, казалось бы, такое моногенное заболевание (когда виновник — один ген) как БШМТ, скажем, типа 1A, требует разного подхода ввиду вариативности симптомов и прогрессии заболевания пациентов.
Литература
- T. Ziemssen, S. Attarian, F. Thomas, A. Moore, D. Tanesse, et. al.. (2019). PRO47 PATIENT-REPORTED REAL-WORLD CARE STANDARDS FOR CHARCOT-MARIE-TOOTH DISEASE IN THE UK AND US ASSESSED USING A DIGITAL ‘BRING YOUR OWN DEVICE’ PLATFORM. Value in Health. 22, S344;
- Рассеянный склероз: иммунная система против мозга;
- Charcot-Marie-Tooth Disease Fact Sheet. (2020). National Institute of Neurological Disorders and Stroke;
- Prevalence and incidence of multiple sclerosis. (2020). Multiple Sclerosis Trust;
- James L. Salzer. (2015). Schwann Cell Myelination. Cold Spring Harb Perspect Biol. 7, a020529;
- Липидный фундамент жизни;
- Rasband, M. N. & Macklin, W. B. Chapter 10 — Myelin Structure and Biochemistry. In: Basic Neurochemistry (8th Edition) / ed. by Brady, S. T., Siegel, G. J., Albers, R. W. & Price, D. L. Academic Press, 2012. P. 180–199;
- Обёртка для аксона;
- Проблема фолдинга белка;
- Vincent Timmerman, Alleene Strickland, Stephan Züchner. (2014). Genetics of Charcot-Marie-Tooth (CMT) Disease within the Frame of the Human Genome Project Success. Genes. 5, 13-32;
- Marina Grandis, Michael E. Shy. (2005). Current therapy for Charcot-Marie-Tooth disease. Curr Treat Options Neurol. 7, 23-31;
- Akiko Yoshimura, Jun-Hui Yuan, Akihiro Hashiguchi, Masahiro Ando, Yujiro Higuchi, et. al.. (2019). Genetic profile and onset features of 1005 patients with Charcot-Marie-Tooth disease in Japan. J Neurol Neurosurg Psychiatry. 90, 195-202;
- Min Zhong, Qing Luo, Ting Ye, XiDan Zhu, Xiu Chen, JinBo Liu. (2020). Identification of Candidate Genes Associated with Charcot-Marie-Tooth Disease by Network and Pathway Analysis. BioMed Research International. 2020, 1-13;
- Christina DiVincenzo, Christopher D. Elzinga, Adam C. Medeiros, Izabela Karbassi, Jeremiah R. Jones, et. al.. (2014). The allelic spectrum of Charcot–Marie–Tooth disease in over 17,000 individuals with neuropathy. Mol Genet Genomic Med. 2, 522-529;
- Sinead M Murphy, Matilde Laura, Katherine Fawcett, Amelie Pandraud, Yo-Tsen Liu, et. al.. (2012). Charcot–Marie–Tooth disease: frequency of genetic subtypes and guidelines for genetic testing. J Neurol Neurosurg Psychiatry. 83, 706-710;
- James R Lupski. (1999). Charcot-Marie-Tooth Polyneuropathy: Duplication, Gene Dosage, and Genetic Heterogeneity. Pediatr Res. 45, 159-165;
- Mohamed Kazamel, Christopher J. Boes. (2015). Charcot Marie Tooth disease (CMT): historical perspectives and evolution. J Neurol. 262, 801-805;
- W. David Arnold, Michael Isfort, Jennifer Roggenbuck, J. Chad Hoyle. (2015). The genetics of Charcot–Marie–Tooth disease: current trends and future implications for diagnosis and management. TACG. 235;
- Tae Chung, Kalpana Prasad, Thomas E. Lloyd. (2014). Peripheral Neuropathy. Neuroimaging Clinics of North America. 24, 49-65;
- Garth Nicholson, Simon Myers. (2006). Intermediate forms of Charcot-Marie-Tooth neuropathy. Neuromol Med. 8, 123-130;
- K. M. Krajewski. (2000). Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A. Brain. 123, 1516-1527;
- Anita S.D. Saporta, Stephanie L. Sottile, Lindsey J. Miller, Shawna M.E. Feely, Carly E. Siskind, Michael E. Shy. (2011). Charcot-marie-tooth disease subtypes and genetic testing strategies. Ann Neurol.. 69, 22-33;
- Ágnes Patzkó, Michael E. Shy. (2011). Update on Charcot-Marie-Tooth Disease. Curr Neurol Neurosci Rep. 11, 78-88;
- Charcot-Marie-Tooth disease, X-linked recessive, type 3. MedGen;
- Ziemssen T., Attarian S., Thomas F.P., Moore A., Tanesse D., Paoli X. et al. (2019). Care standards for Charcot-Marie-Tooth disease in the UK and US: insights from a digital real-world observational study. Vitaccess;
- T. V. Asadchuk, N. V. Rumiantseva, I. V. Naumchik, S. A. Likhachev, I. V. Pleshko, et. al.. (2016). Molecular genetic diagnosis and clinical features of hereditary neuropathy with liability to pressure palsies. Z. nevrol. psikhiatr. im. S.S. Korsakova. 116, 64;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- 12 методов в картинках: полимеразная цепная реакция;
- Pengfei Liu, Violet Gelowani, Feng Zhang, Vivian E. Drory, Shay Ben-Shachar, et. al.. (2014). Mechanism, Prevalence, and More Severe Neuropathy Phenotype of the Charcot-Marie-Tooth Type 1A Triplication. The American Journal of Human Genetics. 94, 462-469;
- Sung Min Kim, Jinho Lee, Bo Ram Yoon, Ye Jin Kim, Byung-Ok Choi, Ki Wha Chung. (2015). Severe phenotypes in a Charcot–Marie–Tooth 1A patient with PMP22 triplication. J Hum Genet. 60, 103-106;
- Обо всех РНК на свете, больших и малых;
- Soo Hyun Nam, Sumaira Kanwal, Da Eun Nam, Min Hee Lee, Tae Hoon Kang, et. al.. (2018). Association of miR-149 polymorphism with onset age and severity in Charcot–Marie–Tooth disease type 1A. Neuromuscular Disorders. 28, 502-507;
- Kathleen F. Mittendorf, Justin T. Marinko, Cheri M. Hampton, Zunlong Ke, Arina Hadziselimovic, et. al.. (2017). Peripheral myelin protein 22 alters membrane architecture. Sci. Adv.. 3, e1700220;
- A. A. W. M. Gabre�ls-Festen, P. A. Bolhuis, J. E. Hoogendijk, L. J. Valentijn, E. J. H. M. Eshuis, F. J. M. Gabre�ls. (1995). Charcot-Marie-Tooth disease type 1A: morphological phenotype of the 17p duplication versus PMP22 point mutations. Acta Neuropathol. 90, 645-649;
- Респираторные нарушения при БШМТ. BioMindmap;
- Ослабление диафрагмы при БШМТ. BioMindmap;
- Нарушения слуха при БШМТ. BioMindmap;
- Rossella Cannarella, Giovanni Burgio, Enzo S. Vicari, Sandro La Vignera, Rosita A. Condorelli, Aldo E. Calogero. (2018). Urogenital dysfunction in male patients with Charcot-Marie-Tooth: a systematic review. The Aging Male. 1-5;
- A. Poretti, A. Palla, A. A. Tarnutzer, J. A. Petersen, K. P. Weber, et. al.. (2013). Vestibular impairment in patients with Charcot-Marie-Tooth disease. Neurology. 80, 2099-2105;
- S. Tozza, D. Bruzzese, C. Pisciotta, R. Iodice, M. Esposito, et. al.. (2018). Motor performance deterioration accelerates after 50 years of age in Charcot-Marie-Tooth type 1A patients. Eur J Neurol. 25, 301-306;
- Matthias Boentert, Rainer Dziewas, Anna Heidbreder, Svenja Happe, Ilka Kleffner, et. al.. (2010). Fatigue, reduced sleep quality and restless legs syndrome in Charcot-Marie-Tooth disease: a web-based survey. J Neurol. 257, 646-652;
- Gita M. Ramdharry, Anna Thornhill, Gill Mein, Mary M. Reilly, Jonathan F. Marsden. (2012). Exploring the experience of fatigue in people with Charcot–Marie–Tooth disease. Neuromuscular Disorders. 22, S208-S213;
- Gregory T. Carter, Jay J. Han, Angeli Mayadev, Michael D. Weiss. (2006). Modafinil Reduces Fatigue in Charcot-Marie-Tooth Disease Type 1A: A Case Series. Am J Hosp Palliat Care. 23, 412-416;
- Lhassan El Mhandi, Guillaume Y. Millet, Paul Calmels, Antoine Richard, Roger Oullion, et. al.. (2008). Benefits of interval-training on fatigue and functional capacities in Charcot–Marie–Tooth disease. Muscle Nerve. 37, 601-610;
- Federica Menotti, Francesco Felici, Antonello Damiani, Fortunato Mangiola, Roberto Vannicelli, Andrea Macaluso. (2011). Charcot-Marie-Tooth 1A patients with low level of impairment have a higher energy cost of walking than healthy individuals. Neuromuscular Disorders. 21, 52-57;
- Beatriz Soldevilla, Carmen Cuevas-Martín, Clara Ibáñez, Fulvio Santacatterina, María A. Alberti, et. al.. (2017). Plasma metabolome and skin proteins in Charcot-Marie-Tooth 1A patients. PLoS ONE. 12, e0178376;
- R. Fledrich, T. Abdelaal, L. Rasch, V. Bansal, V. Schütza, et. al.. (2018). Targeting myelin lipid metabolism as a potential therapeutic strategy in a model of CMT1A neuropathy. Nat Commun. 9;
- Carmen Espinós, Máximo Ibo Galindo, María Adelaida García-Gimeno, José Santiago Ibáñez-Cabellos, Dolores Martínez-Rubio, et. al.. (2020). Oxidative Stress, a Crossroad Between Rare Diseases and Neurodegeneration. Antioxidants. 9, 313;
- Сказка-комикс о великой битве между радикалами и антиоксидантами;
- Norito Kokubun. (2020). Charcot–Marie–Tooth disease and neuroinflammation. Clin Exp Neuroimmunol. 11, 109-116;
- Ferdinand Kaya, Sophie Belin, Patrice Bourgeois, Joelle Micaleff, Olivier Blin, Michel Fontés. (2007). Ascorbic acid inhibits PMP22 expression by reducing cAMP levels. Neuromuscular Disorders. 17, 248-253;
- Edith Passage, Jean Chrétien Norreel, Pauline Noack-Fraissignes, Véronique Sanguedolce, Josette Pizant, et. al.. (2004). Ascorbic acid treatment corrects the phenotype of a mouse model of Charcot-Marie-Tooth disease. Nat Med. 10, 396-401;
- Davide Pareyson, Mary M Reilly, Angelo Schenone, Gian Maria Fabrizi, Tiziana Cavallaro, et. al.. (2011). Ascorbic acid in Charcot–Marie–Tooth disease type 1A (CMT-TRIAAL and CMT-TRAUK): a double-blind randomised trial. The Lancet Neurology. 10, 320-328;
- Richard A. Lewis. (2013). High-Dosage Ascorbic Acid Treatment in Charcot-Marie-Tooth Disease Type 1A. JAMA Neurol. 70, 981;
- Mariam Chahbouni, María López, Antonio Molina-Carballo, Tomás de Haro, Antonio Muñoz-Hoyos, et. al.. (2017). Melatonin Treatment Reduces Oxidative Damage and Normalizes Plasma Pro-Inflammatory Cytokines in Patients Suffering from Charcot-Marie-Tooth Neuropathy: A Pilot Study in Three Children. Molecules. 22, 1728;
- Martial Caillaud, Zeina Msheik, Gautier M-A Ndong-Ntoutoume, Laetitia Vignaud, Laurence Richard, et. al.. (2020). Curcumin–cyclodextrin/cellulose nanocrystals improve the phenotype of Charcot-Marie-Tooth-1A transgenic rats through the reduction of oxidative stress. Free Radical Biology and Medicine. 161, 246-262;
- Justin T. Marinko, Bruce D. Carter, Charles R. Sanders. (2020). Direct relationship between increased expression and mistrafficking of the Charcot–Marie–Tooth–associated protein PMP22. J. Biol. Chem.. 295, 11963-11970;
- Аутофагия, протофагия и остальные;
- Irina Madorsky, Katherine Opalach, Amanda Waber, Jonathan D. Verrier, Chelsea Solmo, et. al.. (2009). Intermittent fasting alleviates the neuropathic phenotype in a mouse model of Charcot–Marie–Tooth disease. Neurobiology of Disease. 34, 146-154;
- S. Rangaraju, J. D. Verrier, I. Madorsky, J. Nicks, W. A. Dunn, L. Notterpek. (2010). Rapamycin Activates Autophagy and Improves Myelination in Explant Cultures from Neuropathic Mice. Journal of Neuroscience. 30, 11388-11397;
- Jessica Nicks, Sooyeon Lee, Andrew Harris, Darin J. Falk, Adrian G. Todd, et. al.. (2014). Rapamycin improves peripheral nerve myelination while it fails to benefit neuromuscular performance in neuropathic mice. Neurobiology of Disease. 70, 224-236;
- Ji-Su Lee, Jae Y Lee, Dong W Song, Hee S Bae, Hyun M Doo, et. al.. (2019). Targeted PMP22 TATA-box editing by CRISPR/Cas9 reduces demyelinating neuropathy of Charcot-Marie-Tooth disease type 1A in mice. Nucleic Acids Research;
- Есть ли смысл в антисенсах?;
- Hien Tran Zhao, Sagar Damle, Karli Ikeda-Lee, Steven Kuntz, Jian Li, et. al.. (2017). PMP22 antisense oligonucleotides reverse Charcot-Marie-Tooth disease type 1A features in rodent models. Journal of Clinical Investigation. 128, 359-368;
- Исследовательские проекты Ionis Pharmaceuticals. Charcot-Marie-Tooth Association;
- Partnership with DTx Pharma to optimize antisense oligonucleotides as a gene therapy for CMT1A. (2019). CMT Research Foundation;
- Michael W Sereda, Gerd Meyer zu Hörste, Ueli Suter, Naureen Uzma, Klaus-Armin Nave. (2003). Therapeutic administration of progesterone antagonist in a model of Charcot-Marie-Tooth disease (CMT-1A). Nat Med. 9, 1533-1537;
- Gerd Meyer zu Horste, Thomas Prukop, David Liebetanz, Wiebke Mobius, Klaus-Armin Nave, Michael W. Sereda. (2007). Antiprogesterone therapy uncouples axonal loss from demyelination in a transgenic rat model of CMT1A neuropathy. Ann Neurol.. 61, 61-72;
- Davide Pareyson, Giuseppe Piscosquito. (2014). An update on clinical trials in Charcot-Marie-Tooth Disease. Clinical Investigation. 4, 221-225;
- Robert Fledrich, Ruth M Stassart, Axel Klink, Lennart M Rasch, Thomas Prukop, et. al.. (2014). Soluble neuregulin-1 modulates disease pathogenesis in rodent models of Charcot-Marie-Tooth disease 1A. Nat Med. 20, 1055-1061;
- Benedetta Elena Fornasari, Giulia Ronchi, Davide Pascal, Davide Visigalli, Giovanna Capodivento, et. al.. (2018). Soluble Neuregulin1 is strongly up-regulated in the rat model of Charcot-Marie-Tooth 1A disease. Exp Biol Med (Maywood). 243, 370-374;
- Ilya Chumakov, Aude Milet, Nathalie Cholet, Gwenaël Primas, Aurélie Boucard, et. al.. (2014). Polytherapy with a combination of three repurposed drugs (PXT3003) down-regulates Pmp22 over-expression and improves myelination, axonal and functional parameters in models of CMT1A neuropathy. Orphanet J Rare Dis. 9;
- Shahram Attarian, Jean-Michel Vallat, Laurent Magy, Benoît Funalot, Pierre-Marie Gonnaud, et. al.. (2014). An exploratory randomised double-blind and placebo-controlled phase 2 study of a combination of baclofen, naltrexone and sorbitol (PXT3003) in patients with Charcot-Marie-Tooth disease type 1A. Orphanet J Rare Dis. 9;
- Thomas Prukop, Stephanie Wernick, Lydie Boussicault, David Ewers, Karoline Jäger, et. al.. (2020). Synergistic PXT3003 therapy uncouples neuromuscular function from dysmyelination in male Charcot–Marie–Tooth disease type 1A (CMT1A) rats. J Neurosci Res. 98, 1933-1952;
- Thomas Prukop, Jan Stenzel, Stephanie Wernick, Theresa Kungl, Magdalena Mroczek, et. al.. (2019). Early short-term PXT3003 combinational therapy delays disease onset in a transgenic rat model of Charcot-Marie-Tooth disease 1A (CMT1A). PLoS ONE. 14, e0209752;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Zarife Sahenk, Gloria Galloway, Kelly Reed Clark, Vinod Malik, Louise R Rodino-Klapac, et. al.. (2014). AAV1.NT-3 Gene Therapy for Charcot–Marie–Tooth Neuropathy. Molecular Therapy. 22, 511-521;
- Zarife Sahenk, Burcak Ozes. (2020). Gene therapy to promote regeneration in Charcot-Marie-Tooth disease. Brain Research. 1727, 146533;
- Francis B. Panosyan, Matilde Laura, Alexander M. Rossor, Chiara Pisciotta, Giuseppe Piscosquito, et. al.. (2017). Cross-sectional analysis of a large cohort with X-linked Charcot-Marie-Tooth disease (CMTX1). Neurology. 89, 927-935;
- Nunzio Vicario, Agata Zappalà, Giovanna Calabrese, Rosario Gulino, Carmela Parenti, et. al.. (2017). Connexins in the Central Nervous System: Physiological Traits and Neuroprotective Targets. Front. Physiol.. 8;
- Mario Bortolozzi. (2018). What’s the Function of Connexin 32 in the Peripheral Nervous System?. Front. Mol. Neurosci.. 11;
- Margarita Olympiou, Irene Sargiannidou, Kyriaki Markoullis, Christos Karaiskos, Alexia Kagiava, et. al.. (2016). Systemic inflammation disrupts oligodendrocyte gap junctions and induces ER stress in a model of CNS manifestations of X-linked Charcot-Marie-Tooth disease. acta neuropathol commun. 4;
- A Kagiava, J Richter, C Tryfonos, C Karaiskos, A J Heslegrave, et. al.. (2019). Gene replacement therapy after neuropathy onset provides therapeutic benefit in a model of CMT1X. Human Molecular Genetics. 28, 3528-3542;
- Irene Sargiannidou, Alexia Kagiava, Stavros Bashiardes, Jan Richter, Christina Christodoulou, et. al.. (2015). IntraneuralGJB1gene delivery improves nerve pathology in a model of X-linked Charcot-Marie-Tooth disease. Ann Neurol.. 78, 303-316;
- Wiszniewski, W., Szigeti, K. & Lupski, J. R. Chapter 126 — Hereditary Motor and Sensory Neuropathies. In: Emery and Rimoin’s Principles and Practice of Medical Genetics / ed. by Rimoin, D., Pyeritz, R. & Korf, B. Academic Press, 2013. P. 1–24;
- Laura E Warner, Max J Hilz, Stanley H Appel, James M Killian, Edwin H Kolodny, et. al.. (1996). Clinical Phenotypes of Different MPZ (P0) Mutations May Include Charcot–Marie–Tooth Type 1B, Dejerine–Sottas, and Congenital Hypomyelination. Neuron. 17, 451-460;
- Ágnes Patzkó, Yunhong Bai, Mario A. Saporta, István Katona, XingYao Wu, et. al.. (2012). Curcumin derivatives promote Schwann cell differentiation and improve neuropathy in R98C CMT1B mice. Brain. 135, 3551-3566;
- Kathryn R. Moss, Ahmet Höke. (2020). Targeting the programmed axon degeneration pathway as a potential therapeutic for Charcot-Marie-Tooth disease. Brain Research. 1727, 146539;
- Gerald W. Dorn. (2020). Mitofusin 2 Dysfunction and Disease in Mice and Men. Front. Physiol.. 11;
- Jonathan Morena, Anirudh Gupta, J. Chad Hoyle. (2019). Charcot-Marie-Tooth: From Molecules to Therapy. IJMS. 20, 3419;
- AcuraStem Achieves First Milestone. (2019). CMT Research Foundation;
- Yueqin Zhou, Sharon Carmona, A.K.M.G. Muhammad, Shaughn Bell, Jesse Landeros, et. al.. (2019). Restoring mitofusin balance prevents axonal degeneration in a Charcot-Marie-Tooth type 2A model. Journal of Clinical Investigation. 129, 1756-1771;
- Rizzo, F. et al. (2019). RNAi/gene therapy combined approach as therapeutic strategy for Charcot-Marie-Tooth 2A (S58.005). Neurology, 92;
- Guariglia S. (2020). CMT Research Foundation to Develop Precision Medicine Approach for Subtypes. Charcot-Marie-Tooth News;
- Majeed Al-Mateen, Alexa Kanwit Craig, Phillip F. Chance. (2014). The Central Nervous System Phenotype of X-Linked Charcot-Marie-Tooth Disease. J Child Neurol. 29, 342-348;
- Ying Wang, Fei Yin. (2016). A Review of X-linked Charcot-Marie-Tooth Disease. J Child Neurol. 31, 761-772;
- Christos Koros, Maria-Eleftheria Evangelopoulos, Costas Kilidireas, Elisabeth Andreadou. (2013). Central Nervous System Demyelination in a Charcot-Marie-Tooth Type 1A Patient. Case Reports in Neurological Medicine. 2013, 1-4;
- Giuseppe Pontillo, Raffaele Dubbioso, Sirio Cocozza, Stefano Tozza, Daniele Severi, et. al.. (2020). Brain Plasticity in Charcot-Marie-Tooth Type 1A Patients? A Combined Structural and Diffusion MRI Study. Front. Neurol.. 11;
- Xiajun Zhou, Beidi Zhang, Kai Qiao, Jiahong Lu, Xiangjun Chen, et. al.. (2020). Central nervous system impairment detected by somatosensory evoked potentials in patients with Charcot-Marie-Tooth disease type 1A. Journal of Clinical Neuroscience. 79, 191-196;
- K. W. Chung, B. C. Suh, S. Y. Cho, S. K. Choi, S. H. Kang, et. al.. (2010). Early-onset Charcot-Marie-Tooth patients with mitofusin 2 mutations and brain involvement. Journal of Neurology, Neurosurgery & Psychiatry. 81, 1203-1206;
- Andoni Echaniz-Laguna, Bertrand Degos, Céline Bonnet, Philippe Latour, Tarik Hamadouche, et. al.. (2007). NDRG1-linked Charcot-Marie-Tooth disease (CMT4D) with central nervous system involvement. Neuromuscular Disorders. 17, 163-168;
- Amy D. Sman, Daniel Hackett, Maria Fiatarone Singh, Ché Fornusek, Manoj P. Menezes, Joshua Burns. (2015). Systematic review of exercise for Charcot-Marie-Tooth disease. J Peripher Nerv Syst. 20, 347-362;
- Nicholas Johnson, Donald McCorquodale, Evan Pucillo. (2016). Management of Charcot–Marie–Tooth disease: improving long-term care with a multidisciplinary approach. JMDH. 7;
- Irene Carantini, Andrea Merlo, Donatella Esposito, Paolo Zerbinati, Luca Gaiani, Francesco Ferraro. (2020). Long‐term walking ability and patient satisfaction after lower limb functional surgery in patients affected by Charcot‐Marie‐Tooth disease: A retrospective study. J Peripher Nerv Syst. 25, 297-302;
- От медицины для всех — к медицине для каждого!;
- Гончарова С.И. и Шнайдер Н.А. (2013). Наследственная невропатия Шарко—Мари—Тута: возможности нефармакологического лечения. «Физиотерапия, бальнеология и реабилитация». 6, 13–19.




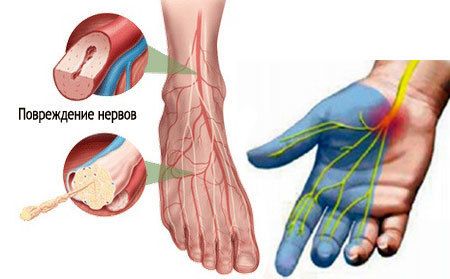
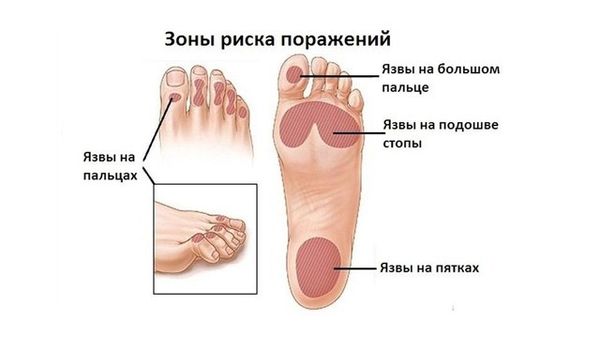
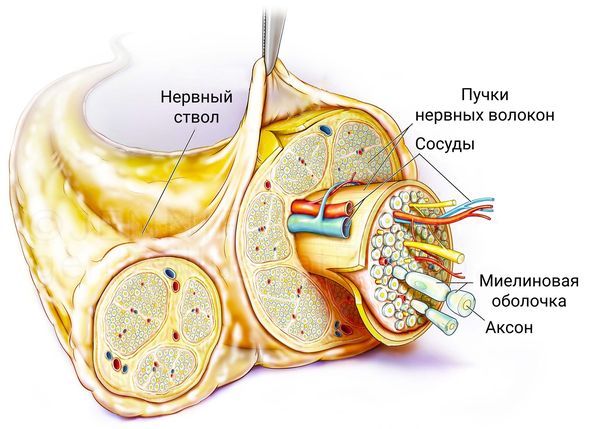
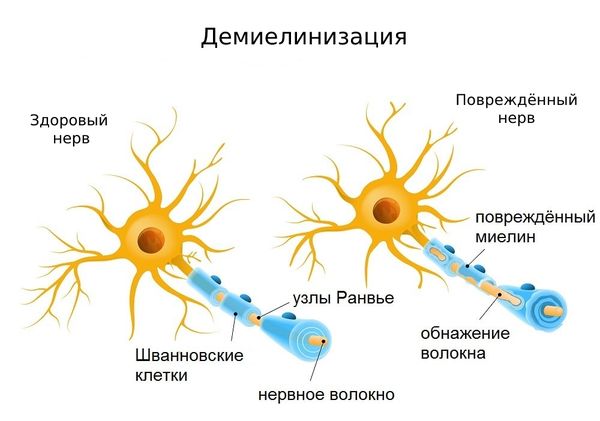
![Диабетическая стопа [16] Диабетическая стопа [16]](https://probolezny.ru/media/bolezny/perifericheskaya-nyayropatiya/diabeticheskaya-stopa-16_s_Xk5wOOg.jpeg)
![Когтеообразная кисть [17] Когтеообразная кисть [17]](https://probolezny.ru/media/bolezny/perifericheskaya-nyayropatiya/kogteoobraznaya-kist-17_s.jpeg)