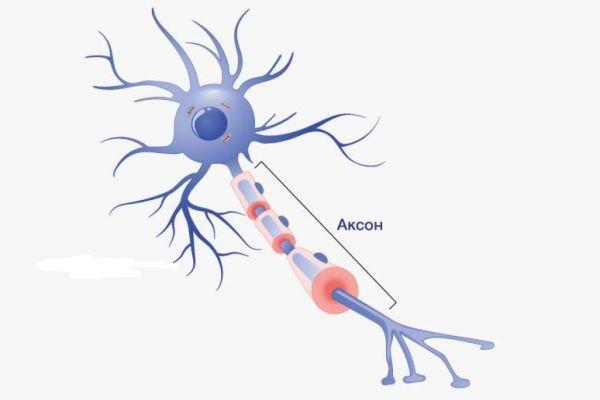
Аксон – это волокнистая ось, отходящая от тела нейрона, покрытая миелиновым слоем, обеспечивающая связь с другими нейронами и клетками рабочих органов. Представляет собой удлиненный осевой отросток, по которому передаются потенциалы действия (возбуждения), что делает его важнейшим структурным элементом ЦНС.
Определение
Мозговое вещество – высокоорганизованная структура, образованная нервными клетками, от которых отходят аксоны. Из нервных клеток состоит мозговая ткань. Аксон в переводе с греческого означает «ось» – это такой отросток, элемент мозгового вещества, который обеспечивает взаимодействие между клетками разного типа (нейроны, клетки иннервируемых органов), что ассоциируется с тонким, четким управлением работой органов и систем. Функции ткани ЦНС:
- Воспринимает раздражения, преобразуя их в импульсы.
- Поддерживает передачу импульсов от управляющих отделов мозга к исполнительным органам.
- Формирует ответную реакцию на раздражающее воздействие.
- Обеспечивает взаимодействие в работе систем и органов, поддерживает интеграцию структурных единиц организма.
- Обеспечивает взаимосвязь организма с внешней средой.
Согласно определению в биологии, аксон (англ. axon) – удлиненный отросток, по которому идут импульсы от тела нейрона к другим нервным клеткам и структурным элементам всех тканей организма. Мозговая ткань в период внутриутробного развития образуется из нервной пластины. Края пластинки прогибаются, что приводит к формированию валиков и желобка. В результате смыкания краев валиков возникает нервная трубка – основа ЦНС.
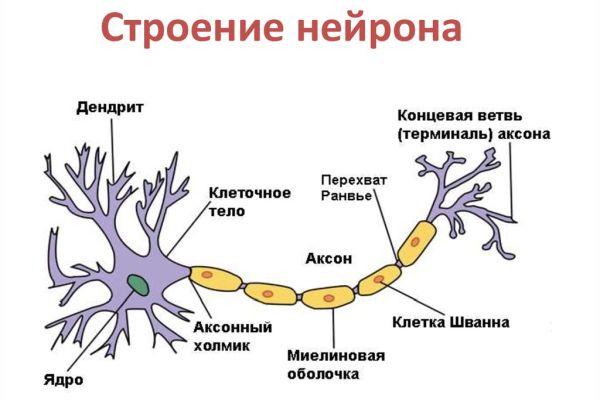
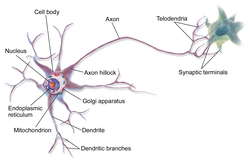
Дифференциация клеток, образующих трубку, приводит к появлению нейробластов и спонгиобластов. Первые служат основой для формирования нейронов, вторые – для образования нейроглии. Нейроны (анат.) – основные структурные элементы мозгового вещества. Они характеризуются отсутствием функции деления, что приводит к постепенному уменьшению их численности. Тело нейрона состоит из ядра и цитоплазмы. В зависимости от типа нейронов меняется геометрическая форма тела, которая бывает круглая, овальная, пирамидальная и другая.
Цитоскелет, состоящий из микротрубочек и нейрофибриллов, обеспечивает опорную и трофическую функцию. Цитоскелет поддерживает форму нейрона, обеспечивает транспорт веществ и органелл. От тела ответвляются отростки – единичный аксон и множественные дендриты. Аксон нейрона почти не ветвится, иногда образует коллатеральные (обходные) сегменты. Концевые сегменты (окончания) разветвляются, называются терминали.
Терминали взаимосвязаны с окончаниями других нейронов и с клетками, образующими паренхиму (ткань) рабочих органов – мышц, желез. Количество дендритов варьируется от 1 до нескольких. Тонкие ответвления дендритов оканчиваются небольшими шипами, где сосредоточены терминали аксональных отростков многих тысяч других клеток. Дендриты воспринимают раздражения или потенциалы действия от других клеток и передают их по волокнам к телу своего нейрона.
Рост аксона зависит от особенностей строения и жизнедеятельности нейрона, который поддерживает функцию питания отростка. К примеру, если перерезать аксональный ствол, сегмент, связанный с телом, остается жизнеспособным и продолжает деятельность, участок, утративший связь с телом, отмирает. Аксоны образуют нервы, что предполагает сложную структурно-морфологическую организацию ЦНС.
Строение
Аксон – это длинный отросток нейрона, который обеспечивает взаимодействие между нервными клетками. Согласно анатомии, аксон ответвляется от холмика, находящегося на теле. Холмик аксона представляет собой структуру, где постсинаптический потенциал преобразуется в биоэлектрический сигнал. Чтобы в холмике происходила генерация биоэлектрических сигналов, необходима согласованная деятельность каналов –натриевых, кальциевых, нескольких типов калиевых.
Длина аксона у человека существенно варьируется в зависимости от вида нейрона, от которого отходит аксональная ось. Минимальная длина – около 1 миллиметра, максимальная – около 1,5 метров. Длина более 1 метра наблюдается в случаях, когда отросток отходит от спинного мозга в область конечностей. Диаметр аксональной оси также неодинаковый у разных типов клеток, равен около 1-20 микрон. Импульсы проходят быстрее по аксональным осям большего диаметра.
Размеры аксонального отростка нередко достигают 99% от общего объема нервной клетки, в структуру которой он входит. Аксон состоит из протоплазмы (аксоплазмы), где находятся тончайшие волокна, белковые нити – нейрофибриллы, из чего образован ствол аксонального ответвления. Согласно одной из теорий, нейрофибриллы – проводники питательных веществ. Аксональная протоплазма также содержит митохондрии и микротрубочки, которые представляют собой самые крупные элементы цитоскелета.
Диаметр микротрубочек составляет около 24 нанометров. Они обеспечивают внутриклеточный транспорт веществ, в том числе поддерживают трофику аксональных отростков. Тело (перикарион) – источник протеинов и нейромедиаторов, распространяющихся по аксональной оси посредством микротрубочек, которые у аксона имеют направленную полярную ориентацию (в отличие от микротрубочек дендритов).
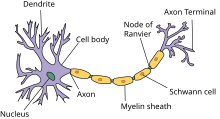
Положительно заряженные концы микротрубочек направлены к сегменту терминали, отрицательно заряженные концы – к телу. Строение аксона предполагает наличие оболочки. Аксон покрыт глиальным (миелиновым) слоем по всей длине, чем защищен от разрушающих внешних воздействий. Миелиновый слой в аксональных отростках периферического отдела сформирован клетками Шванна.
Миелиновая оболочка, покрывающая нервную ось, обеспечивает ее механическую прочность, электрохимическую изоляцию, трофику (питание). Миелиновый слой ускоряет проведение биоэлектрических сигналов. Нервы – пучки объединенных аксональных отростков, которые покрыты оболочкой из соединительной ткани и снабжены кровеносными сосудами.
Функции
Основная задача нейронов – переработка данных. С их помощью осуществляется получение, обработка, передача информации отделам нервной и других систем организма.
Если дендриты проводят сигналы по направлению к телу нервной клетки (перикариону), то аксональный отросток передает импульсы от перикариона к другим клеткам.
Основная функция аксонов – проведение импульсов в пределах нейрональной сети и к исполнительным органам. Аксональные ответвления относятся к первичным проводниковым путям в нервной системе. Вспомогательная функция – транспорт веществ. При помощи аксонального транспорта осуществляется движение белков, синтезированных в теле, нейромедиаторов, органелл. Многие вещества способны двигаться в обоих направлениях.
В периферических сегментах аксона в него могут проникать вирусы и токсичные вещества, которые перемещаясь к телу нервной клетки, повреждают ее. Аксональный транспорт зависит от количества энергии АТФ. Если энергетический уровень АТФ понижается больше, чем в 2 раза, происходит блокировка аксонального транспорта.
Функции аксона заключаются в передаче импульсов. При взаимодействии аксона с телом другого нейрона образуется аксосоматический контакт. Если аксон взаимодействует с дендритами других клеток возникает аксодендритический контакт. Взаимодействие с аксоном другой клетки приводит к образованию аксо-аксонального контакта, который редко происходит в нервной системе, поддерживает тормозные рефлекторные реакции.
Особенности регенерации нервной ткани
Нервные клетки почти полностью лишены способности к регенерации. Однако нервные клетки способны восстанавливать поврежденные или утраченные ответвления. Процесс регенерации аксона возможен, если тело сохраняет жизнеспособность, и на пути роста аксонального отростка отсутствуют препятствия. В ходе процесса регенерации отросток вновь прорастает к органу-мишени.
Восстановление нервной проводимости в мышцах с нарушенной иннервацией – один из критериев успешного лечения невропатий разного генеза. При невропатиях травматического генеза восстановление функций мышц происходит за счет регенерации ствола прерванного аксона и ремиелинизации отростка (восстановление миелиновой оболочки). Периферический отдел нервной системы обладает более высоким потенциалом регенерационных возможностей в сравнении с центральным отделом.
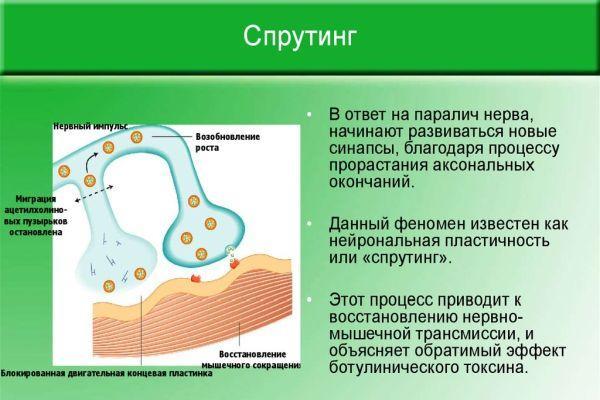
Восстановление иннервации в мышечной или кожной ткани происходит благодаря сохранившимся аксонам, которые начинают ускоренно разрастаться и ветвиться. Процесс ветвления аксонов в зоне перехватов Ранвье (периодические разрывы миелинового слоя) получил название «спрутинг». В результате происходит частичное или полное возобновление первичной иннервации.
В ходе экспериментов установлено, что близлежащие интактные (не вовлеченные в патологический процесс) аксоны выпускают нервные волокна, которые иннервируют участок мускулатуры или кожных покровов с нарушенной проводимостью нервных импульсов. Различают виды спрутинга – коллатеральный (обходной) и регенераторный (терминальный).
Регенераторный спрутинг начинается после устранения в нейронах ретроградных изменений, обусловленных аксонотомией (повреждением, рассечением нервной оси). Это связано с потребностью в продукции аппарата ядра нервной клетки, производящего протеины. Материал, необходимый для регенераторного спрутинга, продуцируется в теле и транспортируется по микротрубочкам по всей длине оси. Параллельно происходит процесс ремиелинизации осевого ствола.
Аксон – удлиненный отросток нервной клетки, обеспечивающий взаимодействие между структурными элементами мозговой ткани и связь ЦНС с исполнительными органами.
Просмотров: 2 342
Что такое дендрит — функции и морфология
Дендриты (dendrite) — многочисленные тонкие трубчатые или округлые выпячивания клеточного тела (перикариона) нервной клетки. Сам термин говорит о чрезвычайной разветвленности этих участков нейронов (от греч. δένδρον (dendron) — дерево).
В поверхностной структуре нейроцитов могут насчитываться от нуля до множества дендритов. Аксон чаще всего единственный. Поверхность дендритов не имеет миелиновой оболочки в отличие от аксонных отростков.
Цитоплазма содержит те же клеточные компоненты, что и само тело нервной клетки:
- эндоплазматический гранулярный ретикулум;
- скопления рибосом — полисомы (белоксинтезирующие органеллы);
- митохондрии (энергетические “станции” клетки, которые, используя глюкозу и кислород, синтезируют необходимые высокоэнергетические молекулы);
- аппарат Гольджи (отвечает за доставку внутренних секретов к внешнему слою клетки);
- нейротубулы (микротрубочки) и нейрофиламенты — главные компоненты цитоплазмы, тонкие опорные структуры, которые обеспечивают сохранение определенной формы.
Строение дендритных окончаний напрямую связано с их физиологическими функциями — получением информации от аксонов, дендритов, перикариона соседних нервных клеток посредством многочисленных межнейронных контактов на основе избирательной чувствительности к определенным сигналам.
Строение нейрона: аксоны и дендриты
Основные статьи: Дендрит,Аксон
Схема строения нейрона
Аксон— обычно длинный отросток нейрона, приспособленный для проведения возбуждения и информации от тела нейрона или от нейрона к исполнительному органу.Дендриты— как правило, короткие и сильно разветвлённые отростки нейрона, служащие главным местом образования влияющих на нейрон возбуждающих и тормозных синапсов (разные нейроны имеют различное соотношение длины аксона и дендритов), и которые передают возбуждение к телу нейрона. Нейрон может иметь несколько дендритов и обычно только один аксон. Один нейрон может иметь связи со многими (до 20-и тысяч) другими нейронами.
Дендриты делятся дихотомически, аксоны же дают коллатерали. В узлах ветвления обычно сосредоточены митохондрии.
Дендриты не имеют миелиновойоболочки, аксоны же могут её иметь. Местом генерации возбуждения у большинства нейронов является аксонный холмик — образование в месте отхождения аксона от тела. У всех нейронов эта зона называется триггерной.
Синапс
Основная статья: Синапс
Си́напс(греч.σύναψις, отσυνάπτειν— обнимать, обхватывать, пожимать руку) — место контакта между двумянейронамиили между нейроном и получающей сигналэффекторнойклеткой. Служит для передачинервного импульсамежду двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться.
Термин был введён в 1897 г. английским физиологом Чарльзом Шеррингтоном.
- Общая информация
- Аксоны нейрона
- Дендриты нейрона
- Тело
Важнейший элемент в нервной системе – нейронная клетка, или простой нейрон. Это специфическая единица нервной ткани, задействованная в передаче и первичной обработке информации, а так же, являющаяся главным структурным образованием в ЦНС. Как правило, клетки имеют универсальные принципы строения и включают в себя помимо тела, еще аксоны нейронов и дендриты.
Структура и типы
Внешняя поверхность дендритов покрыта тонкими выпячиваниями в виде мельчайших шипиков размером 2-3 мкм. Количество таких формирований на поверхности может варьировать от нуля до десятка тысяч. Формы самих микрошипиков многообразны, но самой часто встречаемой формой считается грибовидный шипик.
Количество шипиков на поверхности и их размеры могут быстро меняться. От этого зависит реакция нейрона на сигналы от других клеток.
На образование выпячиваний-шипиков, их форму и развитие влияют внутренние и внешние обстоятельства: возраст организма, активность синаптических связей, информационная загруженность нейронных цепей, образ жизни организма и многое другое.
Целостность и стабильность структуры шипиков могут подвергаться влиянию негативных факторов:
- патофизиологические факторы (например, нейродегенеративные процессы в нервной ткани, опосредованные тяжелой наследственностью);
- токсикологические агенты (при употреблении наркотиков, алкоголя, ядов различной природы).
Под воздействием этих негативных факторов во внутреннем строении микрошипиков происходят серьезные деструктивные превращения: разрушение цистерн шипикового аппарата, накопление мультивезикулярных тел (пропорционально степени разрушительных влияний).
После серии испытаний, проведенной с подопытными мышами, было доказано, что не столько сами дендриты, сколько дендритные шипики являются элементарными единицами хранения памяти и формирования синаптической пластичности.
Ветвление
Дендритные структуры образуются вследствие древовидного разветвления отростков нейронов. Этот процесс называется арборизацией. Количество точек (или узлов) ветвления обуславливает степень разветвленности и сложность окончаний дендрита. В цитоплазме узлов ветвления обычно сконцентрированы митохондрии, так как ветвление – энергозатратный физиологический процесс.
Структура дендритного дерева обуславливает физическую восприимчивую площадь, то есть количество входных импульсов, которые суммарно сможет принять и провести нейроцит.
Одно из главных предназначений дендритов состоит в наращивании контактной поверхности для синапсов (увеличении рецепторного поля).
Это позволяет клетке принимать и перенаправлять больший объем информации, которая поступает к телу нейрона. Степень разветвленности определяет то, как нейрон в итоге суммирует электрические сигналы, полученные от других клеток: чем больше и сложнее ветвление, тем более плотно нейроны прилегают друг к другу.
За счет разветвленного строения поверхность рецепторной мембраны нервной клетки увеличивается в 1000 и более раз.
Диаметр и длина
Дендритные окончания имеют разные размеры, но всегда характеризуются постепенным уменьшением диаметра претерминальных веточек. Длина обычно от нескольких мкм до 1 мм. Но, например, у некоторых чувствительных нейронов спинномозговых ганглиев дендриты очень длинные – до метра и более.
Строение дендрита
На основании изучения микроскопических препаратов нервных клеток установили, что большинство отростков имеют цилиндрическую форму. Их диаметр в среднем составляет 0,9 мкм. Длина дендритов варьирует в широких пределах. Например, звездчатые нейроны серого вещества коры головного мозга имеют короткие (не более 200 мкм) ветви дендритного дерева, тогда как отростки двигательного нейрона, входящего в передние рога спинного мозга, составляют порядка 2 мм.
Специальные образования — шипики, формирующиеся на ветвях нейроцитов, приводят к появлению большого числа синапсов – щелевидных мест контакта с аксоном, дендритом или сомой другого нейрона. Синапсы могут располагаться на теле дендрита и называются стволовыми или же непосредственно на его шипиках. Как мы уже знаем, дендриты – это разветвленные отростки нейроцитов, способные принимать возбуждение. Передача же биопотенциалов происходит в них с помощью молекул химических соединений — медиаторов, например, ГАМК или ацетилхолина. В мембране, покрывающей дендрит, обнаружены ионные каналы, избирательно пропускающие катионы кальция, натрия и калия, участвующие в прохождении нервных импульсов через нейрон.
Проведение нервного импульса
Рецепторная мембрана поверхности дендритов (как и тела нервной клетки) покрыта многочисленными синаптическими бляшками, которые передают возбуждение на восприимчивый участок поверхностной мембраны нейрона, где генерируется биоэлектрический потенциал.
Информация, закодированная в виде электрических импульсов, передается на электровозбудимую проводящую мембрану аксона. Таким образом формируются нейронные сети организма.
На что влияет разветвленность нервных отростков
Тело нейрона является универсальным передающим и одновременно принимающим биологическим объектом. Объем (прежде всего поступающей информации) прямо пропорционален количеству входящих нервных импульсов. Они определяются по степени ветвления дендритного дерева. Поэтому дендриты – это структуры нейроцита, играющие интегративную функцию.
Более того, отростки расширяют площадь контакта нервных клеток между собой. Дополнительное же образование синапсов в разы повышает эффективность работы всех отделов, как головного и спинного мозга, так и нервной системы в целом.
Дендритная кристаллизация
В случае увеличения температуры в сторону жидкой фазы, то есть при положительном градиенте температуры , образуются относительно плоские грани кристаллов. Пока кристаллы окружены жидкой фазой, они растут свободно и имеют почти правильную геометрическую форму, которая определяется анизотропией скорости роста. В результате взаимного столкновения граней соседних кристаллов на завершающей стадии кристаллизации их правильная форма искажается. Так образуются кристаллиты произвольной формы.
В металлах и сплавах вследствие интенсивного выделения скрытой теплоты кристаллизации на границе кристалла и сильно переохлажденного расплава возникает отрицательный градиент температуры, который меняет механизм роста кристаллов. Чем дальше от границы, тем больше является переохлаждение расплава. Поэтому любая выпуклость на поверхности зародыша попадает в зону большего переохлаждения и растет вглубь расплава быстрее, чем плоские участки поверхности, образуя вытянутую первичную ось кристалла.
Направление роста осей кристалла совпадает с направлением оси пирамиды, которую образуют плоскости густого упаковки атомов. Поэтому в кристаллах с кубической или тетрагональной решеткой оси кристаллитов перпендикулярны между собой, а с гексагональной — размещены под углом 60 °. Наконец, когда температуры осей кристалла и расплава между ними выравниваются, начинается медленнее кристаллизация в межосевому пространстве. Так из зародышей вырастают древовидные кристаллиты — дендриты (с греч. Δένδρον — дерево). Механизм такого роста называют дендритным.
Дендриты растут до момента столкновения с соседями на завершающей стадии кристаллизации, приобретая при этом нерегулярной формы и определенных размеров. Размер дендритных кристаллитов является важным фактором, определяющим свойства литых сплавов. Мелкодисперсная структура обеспечивает лучшие механические и технологические свойства по сравнению с грубодисперсной. В практике литейного производства для большинства отливок стремятся обеспечить мелкозернистую структуру, реализующих преимущественно модифицирования или из-за изменения температуры расплава или скорости охлаждения при кристаллизации.
( 1 оценка, среднее 5 из 5 )
| Axon | |
|---|---|
An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
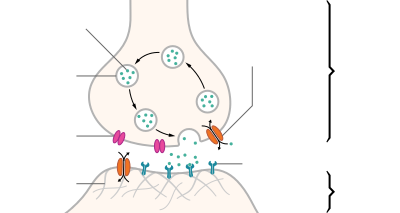
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
Рассмотрим более подробно строение
отростков нейрона и различия между
ними. Как уже было сказано, определяющее
отличие отростков — функциональное,
т.е. направление проведения нервного
импульса: по аксону он проводится от
тела клетки, по дендриту — к телу.
Существует и ряд анатомических различий,
однако они не абсолютны и возможен ряд
исключений из них. Тем не менее, для
типичных аксонов и дендритов характерны
следующие признаки:
-
Аксон один, а дендритов несколько (хотя
существуют нейроны и с одним дендритом). -
Дендрит короче аксона. Длина дендрита
обычно не более700 мкм, а аксон может
достигать длины 1 м. -
Дендрит плавно отходит от
тела нейрона и постепенно истончается.
Аксон, отходя от тела клетки, практически
не меняет диаметр на всем своем
протяжении. Диаметр различных аксонов
колеблется от 0,3 до 16 мкм. От их толщины
зависит скорость проведения нервного
импульса — чем аксон толще, тем скорость
больше. Участок, примыкающий к телу
нейрона (аксонный холмик), имеет большую
толщину, чем остальная часть аксона. -
Дендриты ветвятся на всем
своем протяжении под острым углом,
дихотомически (вильчато), ветвление
начинается от тела клетки. Аксон обычно
ветвится только на конце, образуя
контакты (синапсы) с другими клетками.
Конечные разветвления аксона называют
терминалами. В некоторых местах от
аксонов могут отходить под прямым углом
тонкие ответвления — коллатерали. -
Дендриты (по крайней мере,
в ЦНС) не имеют миелиновой оболочки,
аксоны часто окружены миелиновой
оболочкой (о миелиновой оболочке см.
ниже).
Кроме того, иногда на веточках
дендрита есть выросты
— шипики, являющиеся
характерной структурной особенностью
дендритов, особенно в коре больших
полушарий (рис. 6). Шипик состоит из двух
частей — тела и головки, размеры и форма
которых варьируют. Шипики значительно
увеличивают постсинаптическую поверхность
дендрита. Они являются лабильными
образованиями и при различных воздействиях
(или разных функциональных состояниях)
могут менять свою конфигурацию,
дегенерировать и вновь появляться. В
результате увеличивается либо уменьшается
число синапсов, меняется эффективность
передачи в них нервного сигнала и т.д.
Рис. 6. Шипик на
дендрите нейрона и контактирующие с
ним пресинаптические окончания. Стрелками
показано направление проведения
информации
Теперь, когда мы рассмотрели
строение дендритов и аксонов, следует
несколько детальнее изучить строение
синапса. Синапс, состоящий из одного
пре- и одного постсинаптического
окончаний, называют простым. Однако
большинство синапсов в ЦНС являются
сложными. В таких синапсах один аксон
может контактировать сразу с несколькими
дендритами благодаря нескольким
мембранным выростам на его окончании.
И наоборот, один дендрит за счет своих
шипиков может контактировать с несколькими
аксонами. Еще более сложную структуру
имеют синаптические гломерулы
(клубочки)— компактные
скопления окончаний нервных отростков
разных клеток, формирующие большое
количество взаимных синапсов. Обычно
гломерулы окружены оболочкой из глиальных
клеток. Особенно характерно присутствие
гломерул в тех зонах мозга, где происходит
наиболее сложная обработка сигналов —
в коре больших полушарий и мозжечка, в
таламусе.
Итак, нейрон состоит из тела
(сомы) и отростков. Как правило, один из
отростков существенно длиннее остальных.
Такой длинный отросток называют нервным
волокном. В ЦНС это
всегда аксон; в периферической нервной
системе это может быть как аксон, так и
дендрит. По волокнам проводятся нервные
импульсы, имеющие электрическую природу,
в связи с чем, каждое волокно нуждается
в изолирующей оболочке.
По типу такой оболочки все
волокна делятся на миелиновые
(мякотные) и безмиелиновые
(безмякотные).
Безмиелиновые нервные волокна покрыты
только оболочкой, образованной телом
шванновской (нейроглиальной) клетки.
Эти волокна имеют малый диаметр и
полностью либо частично погружены во
впячивание шванновской клетки. Одна
шванновская клетка может образовывать
оболочку вокруг нескольких аксонов
разного диаметра. Такие волокна называются
волокнами кабельного типа (рис. 7). Так
как длина аксона существенно больше
размеров шванновских клеток, оболочку
аксона образуют цепочки нейроглиальных
клеток. Скорость проведения нервного
импульса по таким волокнам — 0,5-2 м/с.
Многие нервные волокна
имеют миелиновую оболочку. Она также
образуется нейроглиальными клетками.
При формировании такой оболочки
олигодендроцит (в ЦНС) или шванновская
клетка (в периферической нервной системе)
обхватывает участок нервного волокна
(рис. 8). После этого образуется вырост
в виде язычка, который закручивается
вокруг волокна, образуя мембранные слои
(цитоплазма при этом из «язычка»
выдавливается). Таким образом, миелиновая
оболочка представляет собой двойные
слои клеточной мембраны и по своему
химическому составу является липопротеидом,
т.е. соединением липидов (жироподобных
веществ) и белков. Миелиновая оболочка
осуществляет электрическую
изоляцию нервного волокна наиболее
эффективно. Нервный импульс проводится
по такому волокну быстрее,
чем по лишенному миелина (скорость
проведения может достигать
120 м/с). Миелиновая оболочка начинается
немного
отступя от тела нейрона и заканчивается
примерно в 2
мкм от синапса. Она состоит из цилиндров
длиной 1,5-2
мм,
каждый из которых образован своей
глиальной клеткой.
Цилиндры разделяют перехваты Ранвье —
не покрытые
миелином участки волокна (их длина 0,5 —
2,5 мкм), играющие большую роль в быстром
проведении нервного импульса. В перехватах
от аксона могут отходить коллатерали.
Поверх миелиновой оболочки у мякотных
волокон есть еще
наружная оболочка — неврилемма,
образованная цитоплазмой и ядром
нейроглиальных клеток.
Рис. 7. Строение
нервных волокон:
А
—
миелиновое;
Б
—
безмиелиновая;
I
—
волокно;
2 —
миелиновый
слой; 3—
ядро
шванновской клетки; 4 —
микротрубочки;
5—Нейрофиламенты;
6 —
митохондрии;
7—соединительнотканная
оболочка
Рис.
8.
Строение миелиновой оболочки (А).
Образование
миелиновой оболочки шванновской клеткой
(Б): ‘
1
—
аксон;
2 —
слои
миелиновой оболочки; 3
— перехваты
Ранвье;
4
—
ядро
шванновской клетки. Стрелкой показано
направление
продвижения
выроста цитоплазматической мембраны
Миелин
имеет белый цвет. Именно это его свойство
позволило
разделить вещество нервной системы на
серое и белое. Тела
нейронов и их короткие отростки образуют
более темное серое
вещество, а
волокна — белое
вещество.
-
Классификация
нейронов
Нейроны очень
разнообразны по форме, величине,
количеству и способу отхождения от тела
отростков, химическому строению (имеется
в виду, в первую очередь, синтез тех или
иных нейромедиаторов) и т.д. (рис. 9). Тела
самых крупных нейронов достигают в
диаметре 100 — 120 мкм (гигантские пирамиды
Беца в коре больших полушарий), самых
мелких — 4-5 мкм (зернистые клетки коры
мозжечка). Приведем основные способы
классификации нервных клеток.
Рис.
9.
Различные типы нейронов:
А
—
псевдоуниполярный
нейрон спинномозгового ганглия;
Б
—
биполярный
нейрон сетчатки; В —
мотонейрон
спинного мозга;
Г
—
пирамидная
клетка коры больших полушарий (видно,
что дендриты покрыты
шипиками); Д —
клетка
Пуркинье мозжечка; I
—
тело
клетки;
2
—
дендрит;
3 —
аксон;
4 —
коллатерали
аксона
-
Функционально
нейроны подразделяются на чувствительные
(сенсорные), вставочные (переключательные,
интернейроны)
и исполнительные (двигательные или
мотонейроны и
др.). Сенсорные
нейроны —
это нервные клетки, воспринимающие
раздражения из внешней или внутренней
среды организма.
Интернейроны
(вставочные
нейроны) обеспечивают связь
между чувствительными и исполнительными
нейронами рефлекторных дугах. Общее
направление эволюции нервной системы
связано с увеличением числа интернейронов.
Из более
чем ста миллиардов нейронов человека
более 70% составляют
вставочные нейроны.
Исполнительные
нейроны,
управляющие сокращениями поперечно —
полосатых мышечных волокон, называют
двигательными
(мотонейронами). Они
образуют нервно-мышечные синапсы.
Исполнительные нейроны, называемые
вегетативными, управляют
работой внутренних органов, включая
гладкомышечные волокна, железистые
клетки и др.
2. По количеству отростков
нейроны делятся на униполярные,
псевдоуниполярные, биполярные и
мультиполярные.Большинство
нейронов нервной системы (и почти все
нейроны в ЦНС) — это мультиполярные
нейроны (см.
рис. 9, В — Д), они имеют
один аксон и несколько дендритов.
Биполярные
нейроны (см.
рис. 9, Б) имеют один аксон и один дендрит
и характерны для
периферических отделов анализаторных
систем. Униполярных
нейронов, имеющих только один отросток,
у человека практически
нет. Из тела псевдоуниполярного
нейрона (см.
рис.9,
А) выходит один отросток, который
практически сразу делится
на две ветви. Одна из них выполняет
функцию дендрита, а
другая — аксона. Такие нейроны находятся
в чувствительных спинномозговых
и черепных ганглиях. Их дендрит
морфологически
(по строению) похож на аксон: он гораздо
длиннее аксона и часто имеет миелиновую
оболочку.
3. По форме тела и характеру
ветвления отростков выделяют звездчатые,
пирамидные, веретеновидные, корзинчатые,
зернистые
и др. нейроны.
-
По длине аксона нейроны делят
на клетки типа Гольджи I и типа Гольджи
II (эта классификация разработана
итальянским ученым К.
Гольджи). Клетки Гольджи I
имеют длинный
аксон, выходящий за пределы области, в
которой находится
тело нейрона. Это, например, пирамидные
клетки коры
больших полушарий. У клеток Гольджи II
короткий и, как
правило, очень разветвленный аксон, не
выходящий за пределы
области, в которой находится тело
нейрона. Примером
таких нейронов могут быть корзинчатые
клетки коры мозжечка. -
Каждый нейрон синтезирует
только один основной нейромедиатор.
Для того чтобы определить нервную
клетку с этой
точки зрения к названию медиатора
добавляют окончание
«-ергический». Например, ацетилхолинергический
нейрон образует ацетилхолин,
глицинергический — глицин и т.д.
Соседние файлы в предмете Анатомия и физиология
- #
01.06.201515.58 Mб544ОТ НЕЙРОНА К МОЗГУ.doc
- #
- #
- #
- #
- #
Разделяй и властвуй
Импульсы плывут туда, куда ведут аксоны. Каждый аксон тонкой ниточкой выходит из тела своего нейрона, прокладывая линию связи от одного к другому. Когда мы говорим о соединении двух нейронов, может показаться, что аксон — это просто провод между нейронами, игрушечная телеграфная линия, две консервные банки на веревке. Но аксон — это не выделенная линия, передающая персональное сообщение одного нейрона единственному приватному адресату.
Аксон — извилистая структура, которая многократно раздваивается, яростно ветвится, извивается, скручиваясь и изворачиваясь. Аксон простой клетки, по которому мы несемся, следуя за нашим импульсом, впереди извивается и поворачивает, как быстрая река, разделяясь на протоки больше ста раз. От него отходят ветки, но расположены они неравномерно: одни находятся рядом с телом клетки, другие ответвляются в слоях, расположенных выше и ниже, некоторые — где-то вдалеке от нас. И он такой не один — большинство нейронов в коре головного мозга испускают извилистые заросли аксонов, покрывающих объем, который многократно превосходит размеры родительского нейрона вместе с его дендритным деревом. Поднимаясь над простой клеткой, мы видим возвышающиеся стволы ветвящихся аксонов пирамидальных нейронов третьего слоя. Они делятся сотни раз, одна длинная ветвь каскадом спускается мимо нас, а затем снова и снова расщепляется под нами в пространстве пятого слоя. У нас едва хватает времени осознать эту картину, как наш импульс налетает на первую развилку.
При каждом ветвлении импульс копируется, клонируется, отправляется в каждую новую ветвь, чтобы множество копий сообщения неслись по аксону всё дальше и дальше. Сотни разветвлений на пути вниз. Таким образом из одного импульса, исходящего из тела нейрона, создаются сотни клонов. А те в свою очередь вызывают высвобождение молекул нейромедиаторов в синаптических промежутках на конце каждой из ветвей, потому что соединения между нашим аксоном и дендритами других нейронов разбросаны по всей его длине. Периодически мы пролетаем мимо этих соединений, расположенных через каждые пять микрометров, упакованных настолько плотно, насколько позволяет размер их молекулярного механизма, и каждый готов к сбросу своего молекулярного заряда, чтобы вызвать всплеск напряжения на другой стороне. Мы проходим и через длинные отрезки аксона без единого разветвления, без связей с другими нейронами, часто до странности прямые, — это «магистрали» аксона, предназначенные для передачи импульса в другие зоны коры головного мозга, где вновь будет взрыв ветвления и извивов.
Достигнув конца аксона, наш импульс с помощью клонов успел вступить в контакт с тысячами других нейронов. По другую сторону большинства синаптических промежутков находится другой нейрон.
Таким образом бóльшая часть из примерно 7000 возбуждающих входов одного коркового нейрона принимает сигналы от разных аксонов, исходящих из разных нейронов.
Это означает, что каждый возбуждающий нейрон коры головного мозга через аксон осуществляет соединения примерно с 7000 различными нейронами, что возможно именно благодаря ветвлению и извилистости аксона, когда он изгибается и разделяется после каждого синаптического контакта, чтобы достичь новой цели.
Путем клонирования аксон одного нейрона передает импульс возбуждения тысячам принимающих его нейронов коры головного мозга. Знание, что это за получатели и где именно они расположены, может многое сказать нам о назначении этого нейрона. Чтобы разобраться, какое сообщение несет наш импульс, нам нужно знать две вещи о нейроне, который его отправил. Во-первых, на что реагирует этот нейрон, что в первую очередь вызвало его возбуждение — и мы знаем из предыдущей главы, что это был легион импульсов из сетчатки. Во-вторых, нам нужно понять, куда он отправляет этот импульс, кому тот передается. Ведь аксон может доставлять импульсы в любую область головного мозга. Он может разослать их адресатам по соседству, чтобы возбудить больше однотипных нейронов, то есть усилить и прояснить сообщение. Или, наоборот, унести свое сообщение очень далеко, через всю кору головного мозга, и попасть в дальние области, чтобы там объединиться с другими информационными импульсами, создавая всё более сложные представления и вычисления. Или на другую сторону, пересекая границу между полушариями, чтобы мозг работал слаженно.
По соседству
Первые адресаты нашего импульса — другие простые клетки. Здесь, на месте первого промежуточного пункта назначения, в толще коры головного мозга, в четвертом слое первичной зрительной области, нас окружают такие же простые нейроны. Аксон нашей клетки отходит от нее, извиваясь и многократно разветвляясь, каждая ветка переплетена с дендритными деревьями других простых клеток. И если мы проследим за каждым клонированным импульсом, бегущим к кончикам ветвей аксона и прыгающим через синаптические промежутки, то обнаружим, что многие простые клетки на другой стороне синапсов поразительно похожи на ту, которую мы только что покинули. Они реагируют на одни и те же вещи.
Вопреки своему названию простые клетки представляют собой эклектичное сборище. С одной стороны, они отображают упорядоченную карту видимого мира, исходящую от сетчатки, то есть соседние простые клетки реагируют на сигналы от соответствующих соседних участков окружающего мира.
С другой, десятки информационных каналов, исходящих из сетчатки, поступают в простые клетки, которые нас сейчас окружают. Тридцать с лишним каналов, свой для каждой отдельной зоны видимого пространства — для середины, левого и правого, верхнего и нижнего и т. п. Таким образом наборы простых клеток, сгруппированных вместе, озабочены разными вещами в одном и том же месте наблюдаемого мира: некоторые ждут сообщения о вертикальной линии, другие — о горизонтальной, третьи — под углом 120°; четвертые — 41,3°; некоторые — о краях, созданных пятном света сверху и темной областью снизу, другие — наоборот. И так для каждой возможной комбинации.
Получается, если бы наша простая клетка протянула свой аксон случайным образом, импульс с равной вероятностью попал бы на вход любой из этих эклектичных групп. Но это не так. Исследователи из лаборатории Томаса Мрсич-Флогеля в Университетском колледже Лондона в серии чрезвычайно остроумных экспериментов отслеживали локальные места назначения одиночных импульсов в этой первичной зоне зрительной области.
Они одновременно записывали сигналы сотен нейронов из зрительной коры головного мозга мышей, которые сидели в кинотеатре для мышей и смотрели слайд-шоу и фильмы, чтобы на основе этой активности определить, что из происходящего в пространстве видимого мира и где именно вызывает реакцию каждого нейрона. Узнав, что вызывает возбуждение каждого нейрона — настройку нейрона, — ученые в лаборатории Мрсич-Флогеля собирались установить, какие связи существуют между ними. Они перешли на тонкую и сложную технику регистрации каждого скачка напряжения от горстки нейронов, максимум четырех одновременно. Аккуратно подведя электроды непосредственно к мембране тела каждого нейрона, микроскопической точке в десятки раз меньше толщины человеческого волоса, они начали искать убедительные доказательства прямого соединения между этими нейронами, вызывая генерацию импульса одним из этих нейронов и проверяя наличие последующего скачка напряжения в остальных. Нет скачка — нет связи. Наличие точно регистрируемых всплесков в нейроне Берта после того, как стимулировано возбуждение с отправкой импульса нейроном Алеф, является чертовски убедительным доказательством того, что нейрон Алеф напрямую соединяется с нейроном Берта.
Обнаружив связь, Мрсич-Флогель и его команда могли вернуться к своим записям сотен сигналов мозга мышей, наслаждающихся фильмом, и спросить: на что эти нейроны реагируют в видимом мире?
Сложная работа с простым выводом: вероятность найти связь между двумя нейронами со сходной настройкой весьма велика. Нейроны, которые реагируют на очень похожие вещи в очень похожих местах в видимом мире, тоже, скорее всего, соединены друг с другом. И не просто соединены, а сильной связью. Потому что выяснилось, что сила сигнала между двумя одинаково настроенными нейронами, измеряемая амплитудой всплеска напряжения, также намного больше, чем можно было бы предсказать (рис. 4.1).
Наш импульс отправлен из простой клетки, которая реагирует на края под углом 30° в правом верхнем углу вашего поля зрения, где оказался кончик крышки коробки с печеньем. Эта радостная новость поступила к ней по множеству каналов, выходящих из сетчатки. Локальные ветви ее аксона разослали клоны нашего импульса соседним простым клеткам со сходной реакцией, с настройкой на 30-градусные края в правом верхнем углу видимого мира. И эти нейроны в ответ сделают то же самое, послав один из своих клонированных импульсов обратно тому нейрону, который мы только что покинули.
Работа лаборатории Мрсич-Флогеля продемонстрировала, как мы вместе с нашим импульсом оказались в нейронах, реагирующих на схожие вещи в видимом мире, но не объяснила, почему так происходит. Однако это довольно просто. Как вы помните, чтобы инициировать один исходящий импульс, требуется легион входящих. Итак, если мы хотим, чтобы остальная часть мозга узнала о 30-градусных верхних правых краях, имеет смысл отправить как можно больше импульсов с одним и тем же сообщением, уговорить соседние нейроны посылать свои импульсы, которые присоединятся к нашему в предстоящем путешествии по коре головного мозга.
В этом четвертом слое коры головного мозга нас окружают не только простые клетки. Вокруг много других нейронов, которые реагируют на более сложные комбинации информации, исходящей от глаза; их остроумно назвали «сложными клетками».
Сложные клетки посылают импульсы, когда получают сигнал о том, на что настроены, — о комбинациях светлых и темных пятен. Причем каждая пара светлых и темных пятен находится под определенным углом.
Звучит знакомо? Действительно, простейшее объяснение того, как работает зрение, состоит в том, что сложные ячейки создаются путем объединения входных данных простых ячеек. Каждая простая ячейка является детектором признаков для одного типа границ, а сложная ячейка объединяет выходы нескольких таких детекторов в комбинацию границ. Поэтому клоны нашего импульса также поступают на входы сложных клеток, расположенных вокруг нас, неся сообщение об одной из простых особенностей мира, которые сложная клетка будет суммировать с другими сигналами.
Читайте также
Игра на нервах: как музыка действует на мозг
Эта аккуратная картинка пригодится для понимания принципов, но она не совсем точна. И простые, и сложные нейроны принадлежат континууму нервных клеток различной функциональности. Некоторые нейроны совсем примитивны — они реагируют только на один вид границы, расположенной под одним углом; другие — чрезвычайно сложные, вычисляющие результаты комбинаций простых. Но большинство находятся где-то посередине. Тем не менее все сказанное выше верно для любой клетки зрительной зоны; они с большей вероятностью будут связаны с другими нейронами, имеющими аналогичные настройки на аналогичные изображения в ближайшем окружении в видимом мире.