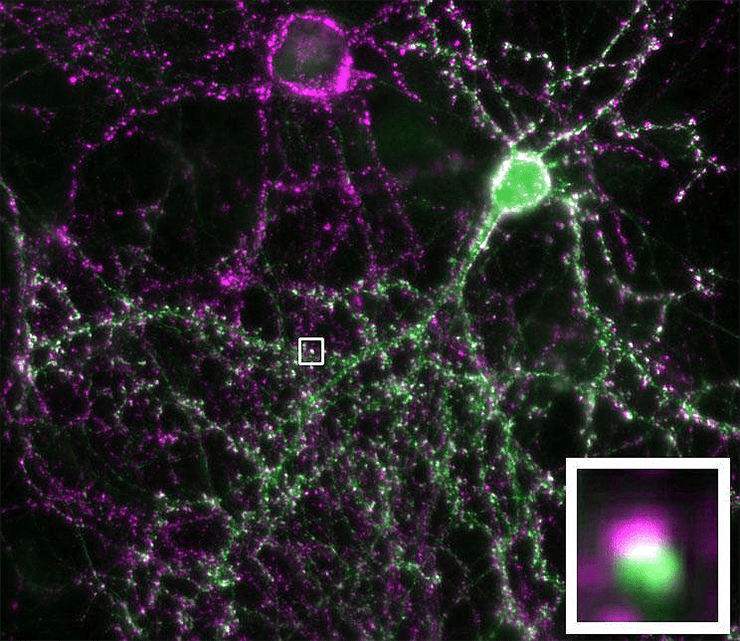
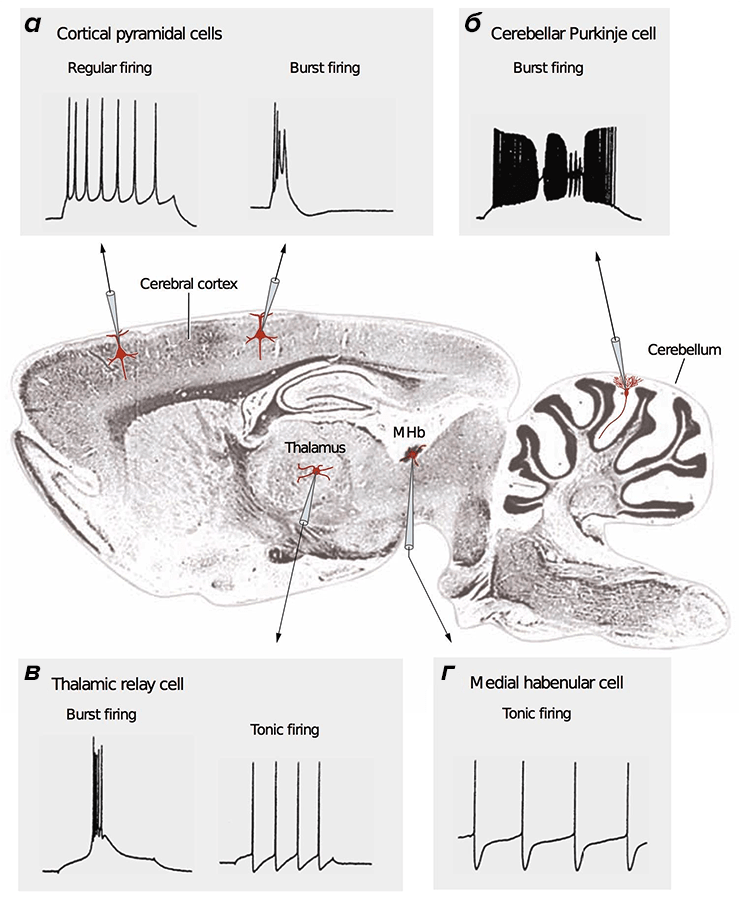
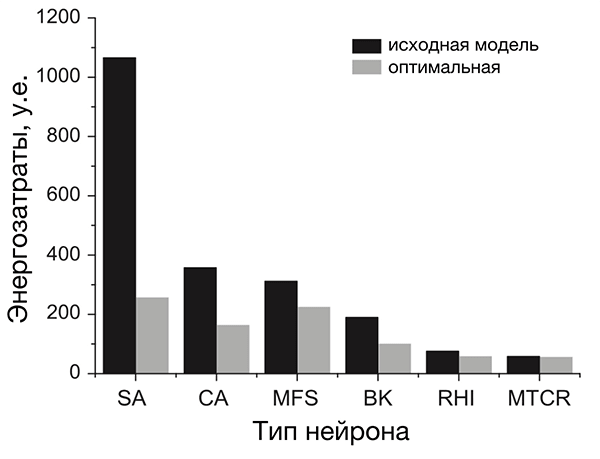
Пластика в общем смысле подразумевает податливость, гибкость. Глина по своим свойствам пластична; тело человека тоже пластично — мышцы накачиваются, связки тянутся, жировая ткань то накапливается, то сжигается.
Но как применить это понятие к мозгу? Как соотносятся абстрактное мышление и вполне материальный «грецкий орех» в нашем черепе? И наконец, существует ли какая-то особая зарядка для ума?
Из чего состоит мозг
Мозг состоит из нейронов — особых нервных клеток, уникальных по своему строению: с множеством коротких щупалец и одним длинным. Короткие — дендриты, длинный — аксон.
Дендриты связывают соседние нейроны, аксоны — разные части нервной системы, иногда очень отдаленные. Например, нейроны в голове могут дотянуться аксонами до поясницы, а нейроны поясницы – до пальцев ног.
Место физического контакта между отростками двух нейронов называется синапс. Это соединение неплотное, в нем есть щель. Сигнал от одной клетки к другой передается через ионы или специальные белки-посредники.
В мозге выделяют белое и серое вещества:
- Белое вещество состоит из аксонов. Его функция — доставлять сигналы по телу и согласовывать работу всей нервной системы.
- Тела нейронов и дендриты образуют серое вещество. На нем остановимся подробнее.
Роль серого вещества
Откровенно говоря, оно скорее серо-коричневое — бурый оттенок дают кровеносные сосуды, несущие питательные вещества к нейронам. Серое вещество отвечает за запоминание, эмоции, речь, движения, а также обработку данных от органов чувств.
Все наши представления о мире хранятся в виде связей между нейронами. Каждый новый факт запускает создание новых ассоциативных связей.
Чем больше ассоциаций образует одно воспоминание, тем оно крепче. Если вы что-то увидели, для этого «чего-то» образовались связи в зрительной области мозга. Если подключить уши, нос, тактильные ощущения, добавить радость, отчаяние или любое другое сильное чувство, тогда возникнет больше разнообразных ассоциаций — образ крепче осядет в голове и вспоминать его будет легче.
Что такое нейропластика мозга
Впервые это понятие использовал польский нейробиолог Ежи Конорский больше 70 лет назад. Если коротко, нейропластичность мозга — это способность образовывать новые ассоциативные связи. Причем не какие угодно, а те, что помогают нам приспособиться к меняющимся условиям.
Что такое нейропластика
Это понятие объединяет все идеи, технологии и подходы, которые позволяют стимулировать пластичность мозга и тем самым прокачивать его.
На нейропластичность влияют пять факторов:
- Количество нервных клеток
- Количество отростков на них
- Количество синапсов (напоминаем: это физические контакты между нейронами)
- Количество сигнальных белков в синапсах
- Количество церебральных кровеносных сосудов
С первыми четырьмя пунктами ясно: чем больше клеток, отростков, синапсов и синаптических белков, тем богаче «инфраструктура» для возникновения ассоциативных связей. По пятому пункту нужно небольшое пояснение.
Для эффективной работы нейронам нужна энергия, а для этого нужно хорошее кровоснабжение. Если его нет, то активность нервных клеток падает. Такое часто бывает после черепно-мозговых травм, нарушающих приток крови. Поэтому количество кровеносных сосудов — тоже один из ключевых факторов пластичности.

Обучение мозга: быстрые и медленные изменения
Растить новые дендриты, образовывать новые синапсы или плести сеть кровеносных сосудов — все эти анатомические изменения требуют времени. Они важны, на них можно влиять (чуть позже расскажем как), однако идут они фоном. Но внезапное улучшение «здесь и сейчас» вы вряд ли заметите. Другое дело — обучение с помощью синаптических белков.
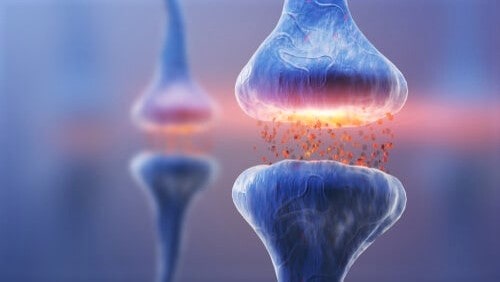
Если какая-то информация снова и снова активирует одну и ту же ассоциативную связь, значит, она важна. Для ее запоминания нужный контакт между нейронами усиливается: в синаптической щели становится больше белков-посредников, сигнал проходит быстрее.
Если эту информацию надо запомнить еще лучше, старые синаптические белки заменяются на новые, с более высоким уровнем активности. Такое быстрое обучение можно пройти за пару недель.
Зависимость нейропластичности от возраста
«Впитывает как губка; ловит на лету» — так чаще говорят о детях. Пожилым людям учиться явно сложнее, и этому есть биологическое объяснение.
Окна пластичности – периоды в жизни, когда мозг наиболее восприимчив к влиянию окружающего мира и легче создает нейронные связи.
В раннем возрасте есть критические периоды для разных функций: сначала зрение и слух, затем речь и моторные навыки, после – высшие когнитивные функции. В это время активны преимущественно возбуждающие нейроны. Потом развивается система торможения, и окно закрывается. Однако новейшие исследования показывают, что закрытие окна — не приговор.
Во-первых, у взрослых образуются новые нейроны. Про этот процесс пока можно сказать немного, он еще изучается, но открытия обнадеживают.
Во-вторых, создавать новые нейронные ассоциации можно и в пожилом возрасте, причем вплоть до восстановления всех моторных навыков с нуля. Об этом говорит опыт реабилитации пациентов после инсульта.
Спорт и нейропластичность мозга: тренировка в кресле
Кстати о моторных навыках. Пластичность касается не только высшей нервной деятельности, но и координации движений.

Есть даже такая интересная методика — мысленное воспроизведение движений. Доказано: прокручивая в голове очередной прием, спортсмен активирует те же нейронные цепи, что и при реальных движениях. Получается, что даже сидя в кресле после тренировки, вы можете развивать моторную память.
Правило 10 000 часов: важность повторений
Правило звучит так: каждый гений потратил не меньше 10 000 часов на тренировку навыков, прежде чем достичь успеха. Это три с половиной года ежедневных восьмичасовых тренировок. Но ведь не всем надо становиться гениями. Большинству достаточно просто держать свой мозг в тонусе. Для этого хватит и меньше 10 000 часов.
Когда нейроны образуют новые ассоциативные связи, они выделяют нейротрофины — особые белки, положительно влияющие на жизнеспособность, развитие и активность соседних нейронов. Получается положительная цепная реакция, в которой нервные клетки поддерживают друг друга.
Концентрация нейротрофинов с возрастом снижается. Но если регулярно нагружать мозг новыми впечатлениями и информацией, он будет более сфокусированным и управляемым.
Кстати, оценить эффективность мозга, заложенную от природы, и найти способы вывести работу когнитивных функций на максимум можно с помощью ДНК-теста MyNeuro. Он же поможет оценить генетический риск снижения когнитивных способностей с возрастом (подробнее об этом читайте в статье «Болезнь Альцгеймера» на нашем сайте.
Делаем мозг послушным
Доказано, что на факторы нейропластичности можно влиять, причем простыми и понятными средствами:
- Физические упражнения для мозга, особенно аэробные, способствуют созданию новых кровеносных сосудов.
- Когнитивные упражнения прокачки мозга форсируют ветвление дендритов и образование новых синапсов.
- Вдобавок, как мы уже говорили, любые упражнения для развития нейронных связей мозга включают ту самую цепную реакцию с нейрофинами, а значит, делают ум более гибким и подвижным.
Именно на этих принципах основана нейробика — комплекс физических и когнитивных упражнений, с помощью которых можно развивать мозг и поддерживать его активность. Важно задействовать все органы чувств: новый зрительный образ, музыка, незнакомый запах или вкус — нейронам нужно все.
Еще раз: нейробика включает только упражнения, а нейропластика — упражнения, технологии, препараты, даже диеты (например, MIND-диета).
В следующей статье из этого цикла мы подробно расскажем о нейробике. А если увидим интерес к этой теме, то напишем и третью часть про генетические основы нейропластичности.
В теле человека бессчетное количество клеток, каждая из которых имеет собственную функцию. Среди них самые загадочные – нейроны, отвечающие за любое совершаемое нами действие. Попробуем разобраться как работают нейроны и в чем их предназначение.
Что такое нейрон (нейронные связи)
В переводе с греческого нейрон, или как его еще называют неврон, означает «волокно», «нерв». Нейрон – это специфическая структура в нашем организме, которая отвечает за передачу внутри него любой информации, в быту называемая нервной клеткой.
Нейроны работают при помощи электрических сигналов и способствуют обработке мозгом поступающей информации для дальнейшей координации производимых телом действий.
Эти клетки являются составляющей частью нервной системы человека, предназначение которой состоит в том, чтобы собрать все сигналы, поступающие из вне или от собственного организма и принять решение о необходимости того или иного действия. Именно нейроны помогают справиться с такой задачей.
Каждый из нейронов имеет связь с огромным количеством таких же клеток, создаётся своеобразная «паутина», которая называется нейронной сетью. Посредством данной связи в организме передаются электрические и химические импульсы, приводящие всю нервную систему в состояние покоя либо, наоборот, возбуждения.
К примеру, человек столкнулся с неким значимым событием. Возникает электрохимический толчок (импульс) нейронов, приводящий к возбуждению неровной системы. У человека начинает чаще биться сердце, потеют руки или возникают другие физиологические реакции.
Мы рождаемся с заданным количеством нейронов, но связи между ними еще не сформированы. Нейронная сеть строится постепенно в результате поступающих из вне импульсов. Новые толчки формируют новые нейронные пути, именно по ним в течение жизни побежит аналогичная информация. Мозг воспринимает индивидуальный опыт каждого человека и реагирует на него. К примеру, ребенок, схватился за горячий утюг и отдернул руку. Так у него появилась новая нейронная связь.
Стабильная нейронная сеть выстраивается у ребенка уже к двум годам. Удивительно, но уже с этого возраста те клетки, которые не используются, начинают ослабевать. Но это никак не мешает развитию интеллекта. Наоборот, ребенок познает мир через уже устоявшиеся нейронные связи, а не анализирует бесцельно все вокруг.
Даже у такого малыша есть практический опыт, позволяющий отсекать ненужные действия и стремиться к полезным. Поэтому, например, так сложно отучить ребенка от груди — у него сформировалась крепкая нейронная связь между приложением к материнскому молоку и удовольствию, безопасности, спокойствию.
Познание нового опыта на протяжении всей жизни приводит к отмиранию ненужных нейронных связей и формированию новых и полезных. Этот процесс оптимизирует головной мозг наиболее эффективным для нас образом. Например, люди, проживающие в жарких странах, учатся жить в определенном климате, а северянам нужен совсем другой опыт для выживания.
Сколько нейронов в мозге
Нервные клетки в составе головного мозга занимают порядка 10 процентов, остальные 90 процентов это астроциты и глиальные клетки, но их задача заключается лишь в обслуживании нейронов.
Подсчитать «вручную» численность клеток в головном мозге также сложно, как узнать количество звезд на небе.
Тем не менее ученые придумали сразу несколько способов для определения количества нейронов у человека:
- Рассчитывается число нервных клеток на небольшой части мозга, а затем, количество умножается пропорционально полному объему. Исследователи исходят из постулата о том, что нейроны равномерно распределены в нашем мозге.
- Происходит растворение всех мозговых клеток. В результате получается жидкость, в составе которой можно увидеть клеточные ядра. Их можно посчитать. При этом служебные клетки, о которых мы сказали выше, не учитываются.
В результате описанных экспериментов установлено, что число нейронов в головном мозге человека — 85 миллиардов единиц. Ранее, на протяжении многих веков считалось, что нервных клеток больше, порядка 100 миллиардов.
Строение нейрона
На рисунке приведено строение нейрона. Он состоит из основного тела и ядра. От клеточного тела идет ответвление многочисленных волокон, которые именуются дендритами.
Мощные и длинные дендриты называются аксонами, которые в действительности намного длиннее, чем на картинке. Их протяженность варьируется от нескольких миллиметров до более метра.
Аксоны играют ведущую роль в передаче информации между нейронами и обеспечивают работу всей нервной системы.
Место соединения дендрита (аксона) с другим нейроном называется синапсом. Дендриты при наличии раздражителей могут разрастись настолько сильно, что станут улавливать импульсы от других клеток, что приводит к образованию новых синаптических связей.
Синаптические связи играют существенную роль в формировании личности человека. Так, личность с устоявшимся позитивным опытом будет смотреть на жизнь с любовью и надеждой, человек, у которого нейронные связи с негативным зарядом, станет со временем пессимистом.
Виды нейронов и нейронных связей
Нейроны можно обнаружить в различных органах человека, а не исключительно в головном мозге. Большое их количество расположено в рецепторах (глаза, уши, язык, пальцы рук – органы чувств). Совокупность нервных клеток, которые пронизывают наш организм составляет основу периферической нервной системы. Выделим основные виды нейронов.
| Вид нейронной клетки | За что отвечает |
|---|---|
| Аффекторные | Являются переносчиками информации от органов чувств в головной мозг. У этого вида нейронов самые длинные аксоны. Импульс из вне поступает по аксонам строго в определенный участок головного мозга, звук — в слуховой «отсек», запах – в «обонятельный» и т.д. |
| Промежуточные | Промежуточные нервные клетки обрабатывают сведения, поступившие от аффекторных нейронов и передают ее периферическим органам и мышцам. |
| Эффекторные | На заключительном этапе в дело вступают эфференты, которые доводят команду промежуточных нейронов до мышц и других органов тела. |
Слаженная работа нейронов трех типов выглядит так: человек «слышит» запах шашлыка, нейрон передает информацию в соответствующий раздел мозга, мозг передает сигнал желудку, который выделяет желудочный сок, человек принимает решение «хочу есть» и бежит покупать шашлык. Упрощенно так это действует.
Самыми загадочными являются промежуточные нейроны. С одной стороны, их работа обуславливает наличие рефлекса: дотронулся до электричества – отдернул руку, полетела пыль –зажмурился. Однако, пока не объяснимо как обмен между волокнами рождает идеи, образы, мысли?
Единственное, что установили ученые, это тот факт, что любой вид мыслительной деятельности (чтение книг, рисование, решение математических задач) сопровождается особой активностью (вспышкой) нервных клеток определенного участка головного мозга.
Есть особая разновидность нейронов, которые именуются зеркальными. Их особенность заключается в том, что они не только приходят в возбуждение от внешних сигналов, но и начинают «шевелиться», наблюдая за действиями своих собратьев – других нейронов.
Функции нейронов
Без нейронов невозможна работа организма человека. Мы увидели, что эти наноклетки отвечают буквально за каждое наше движение, любой поступок. Выполняемые ими функции до настоящего времени в полной мере не изучены и не определены.
Существует несколько классификаций функций нейронов. Мы остановимся на общепринятой в научном мире.
Функция распространения информации
Данная функция:
- является основной;
- изучена лучше остальных.
Суть ее в том, что нейронами обрабатываются и переносятся в головной мозг все импульсы, которые поступают из окружающего мира или собственного тела. Далее происходит их обработка, подобно тому, как работает поисковик в браузере.
По результатам сканирования сведений из вне, головной мозг в форме обратной связи передает обработанную информацию к органам чувств или мышцам.
Мы не подозреваем, что в нашем теле происходит ежесекундная доставка и переработка информации, не только в голове и на уровне периферической нервной системы.
До настоящего времени создать искусственный интеллект, который бы приблизился к работе нейронных сетей человека, не удалось. У каждого из 85 миллиардов нейронов имеется, как минимум, 10 тысяч обусловленных опытом связей, и все они работают на передачу и обработку информации.
Функция аккумуляции знаний (сохранения опыта)
Человек обладает памятью, возможностью понимать суть вещей, явлений и действий, которые он единожды или многократно повторял. За формирование памяти отвечают именно нейронные клетки, точнее нейротрансмиттеры, связующие звенья между соседними нейронами.
Таким образом, за память отвечает не какая-то отдельная часть мозга, а маленькие белковые мостики между клетками. Человек может потерять память, когда произошло крушение этих нервных связей.
Функция интеграции
Данная функция позволяет взаимодействовать между собой отдельным долям головного мозга. Как мы уже сказали, сигналы от разных органов чувств поступают в разные отделы мозга.
Нейроны посредством «вспышек» активности передают и принимают импульсы в разных частях мозга. Так происходит процесс появления мыслей, эмоций и чувств. Чем больше таких разноплановых связей, тем эффективнее человек мыслит. Если человек способен к размышлениям и аналитике в определенном направлении, то он будет хорошо соображать и в другом вопросе.
Функция производства белков
Нейроны – настолько полезные клетки, что не ограничиваются только передаточными функциями. Нервные клетки вырабатывают необходимые для жизни человека белки. Опять же ключевую роль в производстве белков имеют нейротрансмиттеры, которые отвечают за память.
Всего в невронах индуцируется порядка 80 белков, вот основные из них, влияющие на самочувствие человека:
- Серотонин – вещество, вызывающее радость и удовольствие.
- Допамин – ведущий источник бодрости и счастья для человека. Активизирует физическую активность, помогает проснуться, переизбыток может привести к состоянию эйфории.
- Норадреналин – это «плохой» гормон, вызывающий приступы ярости и гнева. Наряду с кортизолом его называют гормоном стресса.
- Глутамат – вещество, отвечающие за хранение памяти.
Прекращение выработки белков или их выпуск в недостаточном количестве способны привести к тяжелым заболеваниям.
Восстанавливаются ли нервные клетки
При нормальном состоянии организма нейроны могут жить и функционировать очень долго. К сожалению, случается так, что они начинают массово погибать. Причин разрушения нервных волокон может быть много, но до конца механизм их деструкции не изучен.
Установлено, что нервные клетки погибают из-за гипоксии (кислородное голодание). Нейронные сети рушатся при отдельных травмах головного мозга, человек теряет память или утрачивает способность к хранению информации. В этом случае сами нейроны сохранены, но теряется их передаточная функция.
Отсутствие допамина ведет к развитию болезни Паркинсона, а его переизбыток является причиной шизофрении. Почему прекращается выработка белка не известно, спусковой механизм не выявлен.
Гибель нервных клеток происходит при алкоголизации личности. Алкоголик со временем может совершенно деградировать и утратить вкус к жизни.
Формирование нервных клеток происходит при рождении. Долгое время ученые полагали, что со временем нейроны отмирают. Поэтому с возрастом человек утрачивает способность накапливать информацию, хуже соображает. Нарушение функции по выработке допамина и серотонина связывается с наличием практически у всех пожилых людей депрессивных состояний.
Гибель нейронов, действительно неизбежна, в год исчезает примерно 1 процент от их количества. Но есть и хорошие новости. Последние исследования показали, что в коре головного мозга есть особенный участок, именуемый гипокаммом. Именно в нем генерируются новые чистые нейроны. Подсчитано примерное количество генерируемых ежедневно нервных клеток – 1400.
В науке обозначилось новое понятие «нейропластичность», обозначающее возможность мозга регенерироваться и перестраиваться. Но есть одна тонкость: новые нейроны еще не имеют никакого опыта и наработанных связей. Поэтому с возрастом или после заболевания мозг нужно тренировать, как и все иные мышцы тела: получать новые знания, анализировать происходящие события и явления.
Подобно тому, как мы усиливаем бицепс при помощи гантели, активизировать процесс включения новых нервных клеток можно следующими способами:
- изучение новых сфер знаний, которые ранее были не нужны или не интересны. К примеру, математику можно начать изучать живопись, а юристу – основы физики.
- через постановку сложных задач и поиск их решения;
- составлением планов деятельности, которые включают в себя множество исходных данных.
Механизм возрождения прост. У нас имеются совершенно не задействованные новые клетки, которые нужно заставить работать, а сделать это можно лишь путем постановки новых задач и изучения неизвестных предметных сфер.
Вся информация взята из открытых источников.
Если вы считаете, что ваши авторские права нарушены, пожалуйста,
напишите в чате на этом сайте, приложив скан документа подтверждающего ваше право.
Мы убедимся в этом и сразу снимем публикацию.
Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Различные слои коры содержат различные типы нейронов. В начале кортикогенеза клетки нейронных предшественников способны продуцировать любой тип нейрона, но с развитием они становятся все более ограниченными в этом процессе типами нейронов, которые они могут производить. Создается впечатление, что в начале кортикогенеза клетки-предшественники могут принимать сигналы для продуцирования любой линии нервных клеток, но по мере развития в этих ранних типов клеток больше не нужны, «прародитель» теряет способность генерировать эти клетки, демонстрируя то, что называется «ограничением судьбы».
Как только «молодые» нейроны достигли своего (целевого) региона коры, они должны стать частью сетей обработки информации. Для того, чтобы интегрироваться в нейронные сети, нейронам необходимо развивать свои окончания (нейронные процессы :аксоны и дендриты), которые позволяют им общаться с другими нейронами. Аксоны являются основным средством отправки сигналов от нейрона, тогда как дендриты являются основными сайтами для приема сигналов от других нейронов. Каждая клетка ( нейрон) имеет много дендритов, которые образуют плотные «беседки» в непосредственной близости от клетки, и один аксон, который может простираться на некоторое расстояние от клетки. На кончике каждого аксона есть структура, называемая конусом роста. Конус роста — это место удлинения и расширения аксона. По мере расширения аксона конус роста формирует локальную среду для направляющих молекул, которые направляют аксон к своей цели. Некоторые сигналы привлекательны и сигнализируют движение к нужному источнику, другие отталкивают и направляют движение в другую сторону. Как только аксон достиг своей цели, соединения, называемые синапсами, формируются вместе с ячейкой-мишенью. Синапсы позволяют передавать электрохимическую информацию, которая является основным средством коммуникации в мозге.
Двумя наиболее важными трактами мозга являются те, которые передают сенсомоторную информацию: таламокортикальный (ТС) и кортикоталамический (СТ). TC путь передает сенсорную и моторную информацию от рецепторов сетчатки, улитки, мышц или кожи в сенсомоторные области неокортекса через основное подкорковое сенсомоторное реле — таламус ( зрительный бугор). Путь СТ завершает цикл обратной связи, передавая информацию от коры обратно в таламус. Эти основные пути начинают формироваться в более поздней части второго триместра беременности у человека и завершаются к GW 26. Когда аксоны TC прибывают в развивающуюся кору во время GW22, они не сразу образуют связи с нейронами в основном входном слое коры (слой 4). Скорее, они изначально устанавливают связи с нейронами более нижнего слоя. При отсутствии сигнальной нейронной связи нормальные закономерности связности между аксонами ТС и кортикальными нейронами 4 слоя не развиваются. Как только ТС и СТ-пути завершены, нейроны «подложки» убирают свои соединения, и сами клетки постепенно отмирают.
Категория сообщения в блог:
Dendrites (dendron=tree) are membranous tree-like projections arising from the body of the neuron, about 5–7 per neuron on average, and about 2μm in length.
From: The Biology of Thought, 2015
Dendrite development: vertebrates
Julie L. Lefebvre, Julie Marocha, in Cellular Migration and Formation of Axons and Dendrites (Second Edition), 2020
12.6.2 Dendrite self-avoidance
Dendrite self-avoidance produces a uniform distribution of branches within the neuron’s territory through competitive interactions among dendrites emanating from the same neuron, or “self” dendrites (Fig. 12.7). This process ensures efficient sampling of inputs by a given neuron. Otherwise, neurons receive fewer synapses and expend resources on dendrites devoid of connections. During development, self-dendrites contact and repel each other to prevent overlap but freely interact with dendrites belonging to homotypic but “non-self” neurons. Vertebrate neurons such as starburst amacrine cells and Purkinje cells exhibit dendrite spacing and behaviors (Fujishima et al., 2012) similar to self-avoiding mechanosensory dendrites in C. elegans and Drosophila (Fig. 12.8).
Figure 12.8. Dendrite self-/non-self-avoidance is mediated by the clustered protocadherins. (A) Retinal starburst amacrine cells develop radial dendritic arbors through self-avoidance, but overlap and form reciprocal connections with neighbors. This pattern requires dendrite self-/non-self-discrimination, which is mediated by unique combinations of clustered protocadherin molecules (cPcdhs) on neighboring cells. (B) Dendrite self-/non-self-discrimination model: Self-dendrites (dark red) bear the same cPcdh molecule (orange) and therefore recognize and self-avoid each other. Self-dendrites overlap with non-self-dendrites (blue) expressing different cPcdhs (magenta). (C) The clustered Protocadherin gene loci include the 3 Pcdh-alpha, -beta, and –gamma genes, which encode 14, 22, and 22 isoforms. Pcdha and Pcdhg mRNA transcripts are produced from splicing an alternate variable exon to 3 constant exons. One variable exon is transcribed upon promoter choice. Pcdha6 mRNA is shown as an example. The variable exon encodes the extracellular region, composed of 6 cadherin-like extracellular domains (EC), the transmembrane (TM) and juxtamembrane domains. The 3 constant exons encode the intracellular region (ICR), common in all Pcdh-αs or Pcdh-γs isoforms. (D) Subsets of cPcdh isoforms interact in cis to produce unique cPcdh combinations. Matching cPcdh combinations interact in trans to produce repulsion for self-avoidance, or adhesion in other contexts (Molumby et al., 2016). (E) Wild-type cerebellar Purkinje cell (PC on left, blue) exhibit dendrite self-avoidance (inset), whereas dendrites self-overlap in a Pcdh-gamma mutant PC (orange) (Lefebvre et al., 2012). (F) Similar to a wild-type starburst cell (black), self-avoidance is not affected in the absence of Pcdh-alpha (blue). Pcdh-gammas are essential for starburst dendrite self-avoidance, as demonstrated by branch crossings and clumps in Pcdhg mutant cells (orange). Dendritic morphology defects are more severe in double Pcdh-alpha/-gamma mutant starburst cells (green). Thus, cPcdhs from different clusters cooperate in complex, redundant ways to pattern starburst cells (Ing-Esteves et al., 2018).
How do dendrites recognize and repel self-dendrites? One strategy is the use of ligand–receptor pairs that signal in trans on apposing dendrites to induce contact-dependent repulsion. In starburst cells, the radial distribution and the nonoverlapping arrangement of distal dendrites require transmembrane ligand Sema6A and its receptor PlexA2 (Sun et al., 2013). In cerebellar Purkinje cells, the secreted Slit2 is proposed to anchor to the membrane and bind to its receptor Robo2 on apposing self-dendrites (Gibson et al., 2014).
Neurons that overlap extensively with homotypic neighbors, such as starburst cells, require a molecular system for dendrite self-/non-self-discrimination. Starburst cell dendrites not only overlap but fasciculate and form GABAergic synaptic connections with neighboring starburst cells. To achieve this pattern, starburst dendrites discriminate and selectively repel self-dendrites while interacting with non-self-dendrites (Fig. 12.8). The clustered protocadherins (cPcdhs) are a large family of cadherin-like cell surface molecules that mediate self-avoidance and self-/non-self-discrimination (Lefebvre et al., 2012). In mice, the Pcdh locus is organized into three gene clusters alpha (Pcdha), beta (Pcdhb), and gamma (Pcdhg) and encodes 58 isoforms (Wu and Maniatis, 1999). Single Purkinje cells and olfactory sensory neurons express random combinations of Pcdhα, Pcdhβ, and Pcdhγ isoforms (Kaneko et al., 2006; Mountoufaris et al., 2017). Thus, combinatorial expression of cPcdhs might endow each neuron a unique cPcdh identity, generating an extraordinary scale of recognition diversity sufficient for self-/non-self-discrimination. Pcdhγs are essential for dendrite self-avoidance in starburst cells and Purkinje cells (Lefebvre et al., 2012). In genetic manipulations that rendered all starburst cells to express an identical Pcdhγ isoform, self-avoidance was intact but neighboring starburst cells recognized each other as self and failed to form synapses (Lefebvre et al., 2012; Kostadinov and Sanes, 2015). Since GABAergic connections between starburst cells are critical for direction selectivity, the loss of Pcdhγ diversity perturbed the retinal responses to moving stimuli (Kostadinov and Sanes, 2015). Moreover, Pcdhγ and Pcdhα members interact with each other in complex and redundant ways, as illustrated by the severe effects of removing Pcdha and Pcdhg on dendrite self-avoidance (Fig. 12.8) (Ing-Esteves et al., 2018). In the cortex, Pcdhγs promote cortical dendritic branching and stabilization through homophilic and adhesive activities (Molumby et al., 2016). Thus, cPcdh isoform diversity is critical for organizing complex dendrite arrangements and circuit functions.
Regulation of dendrite self-avoidance by the cPcdhs parallels Drosophila Dscam1-mediated self-avoidance (Chapter 11; (Lefebvre et al., 2015)). Although the vertebrate Dscam genes do not undergo splicing diversity they mediate avoidance of homotypic dendrites by masking cell surface molecules such as cPcdhs and cadherins (Fuerst et al., 2008; Garrett et al., 2018). Intracellular signals that mediate dendrite self-avoidance remain to be elucidated. They could regulate self-avoidance receptor delivery, such as has been observed for LKB1-SIK-dependent trafficking of Robo2 to Purkinje dendrites (Kuwako and Okano, 2018), or regulate actin to modulate branch protrusion and retraction (Kawabata Galbraith et al., 2018).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128144077000122
Dendrite development: invertebrates
Wesley B. Grueber, Bing Ye, in Cellular Migration and Formation of Axons and Dendrites (Second Edition), 2020
11.1 Structure and anatomy of invertebrate dendrites
Dendrites are the input regions of neurons, and their morphologies determine how information is received and processed by individual neurons. Understanding how complex dendritic arbors develop their shapes presents an important and challenging problem, and one that is under investigation in both vertebrate and invertebrate systems. Invertebrate studies offer numerous fundamental insights that are the focus of this chapter. In particular, studies in model genetic systems have allowed researchers to identify and study genes that control morphogenesis cell autonomously within individual neurons, as well as to identify extrinsic signals that impact dendritic branching and targeting. Advancements in our understanding of dendrite development have followed close behind the development of new approaches for manipulating and studying dendrites.
Dendrites and axons can be defined in part by the distinct polarity of their microtubule cytoskeletons. Vertebrate dendrites and axons differ in the orientation of microtubule ends, with microtubules oriented plus-end distal in axons, and mixed plus-end distal, plus-end proximal polarity in dendrites (Baas et al., 1988). An implication of these findings, pointed out by Baas and colleagues, is that “organelle compartmentalization in the neuron is secondary to the generation of microtubule arrays of different polarity orientation in the axon and the dendrite. Thus, the establishment of these distinct microtubule arrays may provide a structural basis for many of the differences that distinguish the dendrite from the axon” (Baas et al., 1988). Indeed, it has been shown that these differences in microtubule polarity impact the trafficking machinery and the cargos carried to dendrites and axons, since kinesin and dynein trafficking complexes are primarily plus-end or minus-end directed, respectively.
In contrast to typical multipolar vertebrate neurons, invertebrate neurons are often unipolar, meaning that dendrites often, but not always, emerge from a proximal neurite that is continuous with the axon. As discussed below, there are several exceptions to this typical invertebrate neuron, so the differences between vertebrate and invertebrate dendrites are quantitative rather than qualitative (Grueber and Jan, 2004). The unipolar nature of insect neurons means that, by and large, dendritic and axonal compartments are not separated by a neuronal soma as is the case with most vertebrate neurons. Despite these differences, invertebrate dendrites and vertebrate dendrites appear to be homologous and likely derived from similar developmental programs (Sánchez-Soriano et al., 2005). Microtubule polarity likewise differs in the axons and dendrites of insects, but rather than the mixed dendritic microtubule arrangement observed in vertebrates, insect dendrites show almost exclusively minus-end directed microtubules, suggesting that a minus-end microtubule arrangement is the common evolutionarily conserved feature of all dendrites (Stone et al., 2008). These conserved aspects of dendrite biology indicate that knowledge gained in insect systems is likely to be generally applicable to processes that occur in vertebrates.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128144077000110
Neurons
Carl W. Cotman, James L. McGaugh, in Behavioral Neuroscience, 1980
B Dendrites
Dendrites contain the same organelles as the cell body with the exception of the nucleus. There is great variation in the form of the dendritic trees and the shape of the spines, but the internal structure is quite consistent among neurons. Figure 3-10 shows an electron micrograph of a large dendritic branch. Microtubules are extremely prominent in the cytoplasm of large dendrites and are arranged parallel to one another. On the other hand, few neurofilaments occur in dendrites. The mitochondria are usually longitudinally oriented and can reach lengths of 9 μm or more. Rough ER is prominent but appears to decrease as the dendrites extend away from the cell body. Smooth ER is a prominent feature of the dendrite and runs parallel to the microtubules and neurofilaments forming small bulges as it courses.
Fig. 3-10. Electron micrograph of a dendrite from a hippocampal pyramidal cell. The area outside the dendrite is shaded. Microtubules (T), neurofilament (NF), mitochondria (M), rough endoplasmic reticulum (R-ER), and smooth endoplasmic reticulum (S-ER) are seen.
It is believed that the smooth ER is continuous over long stretches of the dendrite and may provide a channel for the transport of materials. Most proteins are synthesized in the cell body, but some are clearly synthesized in proximal parts of dendrites, where masses of rough ER are found, and are transported distally by way of the cisterns of the smooth ER and along the surface of the microtubular system (Kiss, 1977). Proteins made in the cell body are also transported into the dendrite via the smooth ER.
Dendrites of most mammalian neurons are studded with small spines, upon which most dendritic synapses are located. A pyramidal neuron, for example, has some 4000 spines; these make up about 43% of the total recipient surface of the cell—soma plus dendrites (Mungai, 1967). Besides providing greatly expanded surface area for inputs, spines are also believed to aid in the receipt and integration of synaptic inputs over the dendritic tree.
Each spine consists of two parts, a narrow neck and an ovoid bulb. Most spines are about 2 μm in length, although they may come in widely assorted sizes and shapes depending on the cell type and the position of the spine on the cell. Their cytoplasm is filled with fine filaments and an occasional microtubule. In or near the base of the spine on neurons of the cerebral cortex or hippocampus is a unique fascinating structure called the spine apparatus. It looks much like Golgi apparatus consisting of two or three lamellae alternating with dense material (Fig. 3-11). No other neurons have it nor has it been seen in invertebrates or non-mammalian vertebrates. Its distinctiveness has aroused much curiosity and promoted a greal deal of speculation as to whether the spine apparatus might have something to do with learning. In actual fact, the role of the spine apparatus is still a mystery. A detailed discussion of the structure of synapses, which are the sites of transmission between neurons, and the nature of other specialized regions which serve as adhesive junctions between neurons will come later.
Fig. 3-11. Electron micrograph of a synaptic ending making contact with a dendritic spine. The spine (S) is the small branch extending from the main dendritic shaft (D). The spine forms a cup around a synaptic ending (E). Within the spine a spine apparatus (SA) is seen. The asymmetric synaptic junction of the type shown here (small arrow) is a type 1 junction.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121916503500088
Direction selectivity
Benjamin L. Murphy-Baum, … Gautam B. Awatramani, in Retinal Computation, 2021
Mechanisms of DS in the starburst amacrine cell
SAC dendrites are the first points in the visual system where DS is observed and are, therefore, critical in understanding the direction-selective computation. Their DS is dendrite specific, in which larger dendritic Ca2 + signals are measured in the distal dendrites during motion from the soma toward that particular dendritic tip (centrifugal motion; Euler et al., 2002; Morrie and Feller, 2018; Poleg-Polsky et al., 2018; Fig. 11.5). There are many ways that this directional asymmetry might arise, and researchers have identified both cell-autonomous and synaptic mechanisms that may contribute to SAC behavior (reviewed by Taylor and Smith, 2012; Vaney et al., 2012; Wei, 2018).
The cell-autonomous mechanisms—in which SAC dendrites are direction selective due to their membrane properties and morphology—are generally based on the pioneering work of Rall (1964). Rall provided a mathematical framework for understanding neurons’ electrical properties and showed that dendrites are sensitive to the spatiotemporal pattern of synaptic input that they receive. Applying the principles of Rall’s cable theory to the direction-selective circuit resulted in two general conclusions about SACs. First, their thin, tapering dendrites make it likely that there is significant electrical filtering between the soma and the distal dendrites, where synaptic output occurs (Miller and Bloomfield, 1983). Second, voltage attenuation across this variable resistance will be significantly stronger for signals propagating centripetally than centrifugally (Poznanski, 1992). Consequently, during centrifugal motion, the proximal excitatory inputs are low-pass filtered to produce slow, sustained depolarizations at the distal output sites. These filtered depolarizations sum effectively with the distal excitatory inputs that are subsequently activated as the stimulus moves toward the dendritic tips (Borg-Graham and Gryzwacz, 1992; Tukker et al., 2004; Fig. 11.7). Recently, Vlasits et al. (2016) used glutamate uncaging techniques to sequentially activate excitatory inputs along SAC dendrites, providing direct support for a cell-autonomous mechanism. However, this mechanism is only effective because the synaptic outputs are localized to the distal dendrites, whereas the synaptic inputs are located more proximally (Ding et al., 2016; Vlasits et al., 2016).
Fig. 11.7. Multiple mechanisms underlie SAC DS.
Top, a reduced SAC network model indicating the specific wiring of kinetically distinct bipolar cells and reciprocal inhibitory inputs from overlapping SACs. Bottom, the voltage response at distal SAC output sites evoked by different sequences of excitatory inputs, as indicated by their numerical order. The input kinetics are shaped presynaptically by different types of bipolar cells or postsynaptically by the filtering properties of the SAC dendrites. In either case, optimal temporal summation at the distal output sites will occur during centrifugal motion. In addition, excitation will arrive at the dendritic tips before reciprocal inhibition during centrifugal motion, whereas during centripetal motion, inhibition and excitation are expected to arrive together, thus cancelling each other.
The DS arising from passive models is modest compared with both the direction-selective Ca2 + signals experimentally measured in SAC dendrites and the direction-selective inhibition measured in DSGCs. Indeed, a variety of additional cell-autonomous mechanisms could act in concert to improve SAC DS (Vaney et al., 2012). Amplification by voltage-gated Ca2 + (Hausselt et al., 2007; Tukker et al., 2004) or TTX-insensitive Na+ channels (Oesch and Taylor, 2010), improved dendritic isolation through the activation of voltage-gated K+ channels (Ozaita et al., 2004), as well as gradients in dendritic voltage (Hausselt et al., 2007) and dendritic chloride (Enciso et al., 2010; Gavrikov et al., 2003, 2006) have all been implicated. All of these mechanisms could potentially serve to amplify differences in voltage caused by dendritic filtering mechanisms.
In addition to cell-intrinsic properties, both inhibitory and excitatory network mechanisms could contribute to DS in SAC dendrites. For example, SACs are known to cross-inhibit each other using GABAergic transmission, and this reciprocal inhibition has been shown to suppress responses to centripetal motion (Lee and Zhou, 2006; Münch and Werblin, 2006). An excitatory synaptic mechanism has also gained traction in recent years. In this model, proximal SAC dendrites receive input from distinct sets of sustained bipolar cells, while more distal dendrites receive input from transient bipolar cells (Ding et al., 2016; Fransen and Borghuis, 2017; Greene et al., 2016; Kim et al., 2014; but see Stincic et al., 2016). This arrangement promotes centrifugal responses in a manner similar to the original dendritic filtering mechanism that we discussed earlier (Fig. 11.7).
Owing to the multitude of parallel mechanisms contributing to SAC DS, determining the “core” mechanism appears to be a futile endeavor. Indeed, many of the previously mentioned mechanisms are sufficient for generating DS in SAC dendrites, but no single mechanism appears to be strictly necessary. For example, reciprocal SAC-SAC inhibition can generate DS (Lee and Zhou, 2006; Münch and Werblin, 2006), but blocking GABA receptors does not abolish DS in SACs (Chen et al., 2016; Euler et al., 2002; Hausselt et al., 2007; Oesch and Taylor, 2010; Poleg-Polsky et al., 2018). Similarly, bipolar cell mechanisms alone can generate SAC DS (Kim et al., 2014), but SAC output remains DS in the absence of bipolar cell input when SACs are directly stimulated using optogenetics (Sethuramanujam et al., 2016). Interestingly, under conditions in which both inhibitory and excitatory network mechanisms are blocked, SAC output is not direction selective (Hanson et al., 2019). At first pass, these findings would imply that the remaining dendritic filtering mechanisms are not important. However, it is likely that the dendritic filtering mechanisms were inadvertently compromised during the optogenetic stimulation used in this study. Thus, it appears that multiple mechanisms contribute to DS in parallel, making the computation more robust over a large variety of stimulus conditions (Chen and Wei, 2018; Vaney et al., 2012; Wei, 2018).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128198964000123
Neurons and neuroglia
J.L. Wilkinson OBE, MD, FRCS, in Neuroanatomy for Medical Students (Second Edition), 1992
Dendrites and axons
Dendrites are slender extensions from the soma which greatly increase its receptive field and contain the same organelles. They commonly have numerous branches whose configurations characterize neuron types (see Fig. 12.1), for example the Purkinje cells of the cerebellar cortex have a dendritic field arranged in one plane (see Fig. 7.6). Frequently their surface area is extended by synaptic dendritic spines.
A single axon, generally the longest neurite, usually arises from an axon hillock; this narrows into an initial segment, beyond which the diameter remains uniform. Axons thicker than 1 μm generally have a myelin sheath which commences after the initial segment and is interrupted at intervals by the nodes of Ranvier (see p. 35). In the central nervous system myelin sheaths are formed by neuroglia (oligodendrocytes), in peripheral nerves by neurolemmal cells of Schwann. At the nodes, the bare axolemma is exposed to ionic exchange, while the myelinated segments (internodes) are insulated; this arrangement is the structural basis for ‘saltatory conduction’, by which action potentials ‘jump’ from node to node. The speed of conduction is proportional to the thickness of the axon and its sheath. Slender axons are non-myelinated. Collateral branches arise at nodes, a recurrent collateral recurving towards the parent soma and synapsing with nearby neurons. The axon terminals have presynaptic expansions (boutons terminaux), or a row of many such swellings (boutons de passage). The axoplasm contains neuro tubules, neurofilaments, agranular (smooth) endoplasmic reticulum and mitochondria; RNA and ribosomes, concerned with protein synthesis, are usually absent from the axoplasm.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780750614474500062
Integration: Putting It All Together
Carl W. Cotman, James L. McGaugh, in Behavioral Neuroscience, 1980
Key Terms
- Active dendrites:
-
Dendrites which are excitable and generate small local “all or none” potentials; such potentials appear to be largely Ca2+–based.
- Amacrine cells:
-
Neurons which lack axons; they are in the retina and olfactory bulb.
- γ–Aminobutyric acid (GABA):
-
The major inhibitory transmitter in the mammalian brain. It is used by local circuit neurons and other neurons in many brain areas.
- Axon hillock:
-
Region of the cell body from which the axon arises. It is often the site where action potentials are initiated. The threshold for initiating an action potential is lowest at the axon hillock.
- Blood-brain barrier:
-
A term used to refer to the fact that certain substances in the body have restricted access to areas of the brain.
- Ca2+ spikes:
-
Action potentials based on regenerative Ca2+ currents instead of Na+ currents. Ca2+ spikes appear to exist in active dendrites.
- Dendritic spines:
-
Small, narrow-necked, bulbous protrusions of dendrites. Spines appear to maintain and protect conducting dendritic currents from local synaptic activity, and they appear to convert synapses into constant current-injecting devices.
- L-Dopa:
-
The precursor which is converted to dopamine by dopa decarboxylase. L-Dopa administration is used to alleviate the symptoms of Parkinson’s disease.
- Electrotonic conduction:
-
Conduction of localized, graded potentials that are determined by the passive electrical properties of cells. The measure of this passive decay is the space constant.
- Endorphin:
-
Any endogenous molecule that has opiate-like activity.
- Enkephalins:
-
Pentapeptides which possess opiate-like activity; their sequence is tyrosine-glycine–glycine-phenylalanine–X-OH, where X is either leucine (Leu-enkephalin) or methionine (Met-enkephalin). Enkephalins are a specific type of endorphin.
- Histofluorescence method:
-
A histochemical method of analysis used to reveal the presence of dopamine, norepinephrine or serotonin in tissue sections. Each different transmitter fluoresces with a distinct color.
- Huntington’s chorea:
-
A disease characterized by involuntary movement and mental deterioration. It is believed to be due to a loss of neurons in the cerebral cortex and basal ganglia.
- 6–Hydroxydopamine:
-
A compound which destroys catecholaminergic neurons.
- Immunohistochemical method:
-
A method of analysis which uses an antibody to a substance (such as a neurotransmitter-synthesizing enzyme) to “stain” it in tissue sections. The antibody reacts specifically with the substance (its antigen). The antibody, in turn, is usually identified by a secondary reaction which produces a fluorescent signal or otherwise readily identifiable reaction product.
- Locus coeruleus:
-
A region of the pons where one of the most important groups of noradrenergic cell bodies are found. These neurons project widely throughout the brain.
- D-Lysergic acid diethylamide (LSD):
-
A potent antagonist of serotonergic receptors.
- Meso-limbic system:
-
A dopaminergic projection which originates in a cell group in the mesencephalon (A10) and projects to the limbic system (frontal and limbic lobes, hypothalamus, septal region and several regions near the olfactory tract).
- Monoamine:
-
Any amine, R-NH2, that has one organic substituent (R) attached to the nitrogen group (e.g., dopamine, norepinephrine, serotonin).
- Naloxone:
-
A specific receptor antagonist for opiates and opiate-like compounds.
- Parkinson’s disease:
-
A chronic, progressive disease characterized by muscular rigidity, tremor and poverty of movement. It appears due, in part, to the degeneration of dopaminergic neurons in the substantia nigra.
- Passive dendrites:
-
Dendrites which do not generate action potentials; inexcitable dendrites. Currents spread by electrotonic conduction.
- Raphé nuclei:
-
A group of nuclei along the midline of the brain stem whose neurons are serotonergic; their projections are widespread.
- Rotational model:
-
Dopamine stimulation of the striatum produces rotation to the opposite side when the striatum is asymmetrically stimulated. The direction of rotation is always toward the least stimulated side.
- Septum:
-
An area of the brain rich in cholinergic neurons. These neurons project primarily to the hippocampus via the septohippocampal pathway.
- Spatiotemporal summation:
-
The process whereby all synaptic potentials impinging on a neuron’s dendrites are integrated over time and space.
- Substantia nigra:
-
The locus of a major cell group of dopaminergic neurons which form the nigrostriatal pathway and innervate the striatum.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121916503500118
Vision
Daniel Kerschensteiner, in The Senses: A Comprehensive Reference (Second Edition), 2020
1.12.4.1 Dendrite and Axon Lamination
Axons and dendrites are guided to their laminar targets by a combinatorial code of cell surface and secreted cues. No single cell type displays or organizes these cues; instead, order arises from a multitude of interactions between synaptic partners, competitors, and indifferents, each expressing a cell-type-specific set of cues and recognition molecules. As a result, the overall lamination pattern of the retina is robust to the ablation of individual cell types (Brown et al., 2001; Green et al., 2003; Günhan-Agar et al., 2000; Kay et al., 2004).
Different components of the combinatorial code define laminar targets at different resolutions. During early postnatal development, cells in the outer neuroblastic layer (i.e., the future ONL) of the mouse retina express class 5 transmembrane semaphorins (SEMA5A and SEMA5B), while cells in the inner neuroblastic layer (i.e., the future INL and GCL) express two plexin receptors (i.e., PLEXA1 and PLEXA3) (Matsuoka, Chivatakarn, et al., 2011a). Deletion of these semaphorins and plexins causes amacrine and ganglion cell dendrites to stray into the OPL and form additional synaptic layers within the INL, indicating that repulsive semaphorin-plexin interactions restrict neurites to the IPL. A similar phenotype is observed in mutants of the atypical cadherin Fat3, in which amacrine cells retain their multipolar migratory morphology and target dendrites to a novel plexus within the INL, in addition to the IPL (Deans et al., 2011). Synaptic partners divert processes to this novel plexus, highlighting the role of adhesive interactions in the stratification of circuits.
Adhesive interactions across the synaptic cleft (i.e., transsynaptic interactions) also help restrict neurites to the OPL. The leucine-rich repeat protein NGL2 on horizontal cell axons interacts transsynaptically with Netrin G2 (NTNG2) in rod axon terminals (or spherules) (Soto et al., 2012). In the absence of NGL2, horizontal cell axons stray into the ONL even when NGL2 is removed in mature circuits (Soto et al., 2012, 2018). Similarly, the auxiliary calcium channels subunit α2δ4 in rods interacts transsynaptically with mGluR6 receptors on rod bipolar cell dendrites, and rod spherules mislocalize to the ONL in α2δ4 knockout mice (Wang et al., 2017). A recent CRISPR-Cas9 screen revealed that WNT5 secretion from rod bipolar cells helps organize the OPL (Sarin et al., 2018). When Wnt5 or the genes encoding its receptors in rods, Ryk and Fzd4/5, are deleted, patches of duplicated OPL appear in the ONL (Sarin et al., 2018).
Within the OPL and IPL, circuits are organized in specific sublayers (Fig. 6). Rod spherules, rod bipolar cell dendrites, and horizontal cell axons target the outer part of the OPL; cone pedicles, cone bipolar cell dendrites, and horizontal cell dendrites target in the inner part of the OPL (Blanks et al., 1974; Olney, 1968). The IPL is partitioned into five sublaminae (S1S5) (Fig. 6). The outer two (S1S2) contain axons and dendrites that respond to light decrements (i.e., OFF stimuli); the inner three (S3S5) contain axons and dendrites that respond to light increments (i.e., ON stimuli) (Hoon et al., 2014; Sanes and Zipursky, 2010). Whereas the mechanisms of OPL sublamination have not received much attention (Tanabe et al., 2006), the cues that guide sublaminar targeting in the IPL have been studied extensively (Hoon et al., 2014; Sanes and Zipursky, 2010). Repulsive semaphorin-plexin interactions help divide the IPL into ON and OFF zones. SEMA6A and PLEXA4 show complementary expression in the ON and OFF zone of the IPL, respectively, and genetic deletion of either cue causes mistargeting of axons and dendrites between the two zones (Matsuoka, Nguyen-Ba-Charvet et al., 2011b). Starburst amacrine cells play a critical role in the direction-selective computation of the retina (Wei, 2018). ON and OFF starburst cells stratify their dendrites in two separate plexuses in the respective zones of the IPL. PLEXA2 is expressed in both ON and OFF starburst amacrine cells, whereas SEMA6A is expressed only in ON cells. In PlexA2 and Sema6A knockout mice, the division between the two starburst plexuses is blurred and dendrites of individual cells cross between them (Sun et al., 2013).
Interactions of cell adhesion molecules on the axons and dendrites of synaptic partners mediate targeting to specific sublaminae within the ON and OFF zones of the IPL. For example, homo- and heterophilic interactions of cadherins (CDH6, CDH8, CDH9, and CDH10) direct bipolar cell axons, starburst amacrine cell neurites, and ON-OFF direction-selective ganglion cell dendrites to sublaminae S2 and S4, where OFF and ON components of the circuit, respectively, assemble (Duan et al., 2014, 2018). In addition, ON-OFF direction-selective ganglion cells and ON starburst amacrine cells express the homophilic cell adhesion molecule Contactin 5 (CNTN5) (Peng et al., 2017). When CNTN5 is removed from starburst or ganglion cells, ON-OFF direction-selective ganglion cells lose their ON dendrites (Peng et al., 2017). The homophilic cell adhesion molecule Sidekick 2 (SDK2) appears to play a similar role in the assembly of the object-motion-sensitive circuit of the retina, whose neurites meet in S3 (Krishnaswamy et al., 2015).
As discussed above (see 1. Progenitor Proliferation and Neurogenesis), gene regulatory networks drive the differentiation of retinal neuron types, whose axons and dendrites target specific retinal layers through unique combinations of cues and recognition molecules on their cell surface. This raises the question: which gene regulatory networks control the cell-type-specific expression of cell surface molecules? The transcriptional regulator SATB1 is required for the expression of CNTN5 in ON-OFF direction-selective ganglion cells. ON-OFF direction-selective ganglion cells lose their ON dendrites in Satb1 knockout mice, as they do in Cntn5 mutants (Peng et al., 2017). The transcription factor TBR1 is expressed in four ganglion cell types whose dendrites stratify in the OFF zone of the IPL (Liu et al., 2018). In Tbr1 knockout mice, dendrites of the same cells mistarget, shifting either entirely to the ON zone or elaborating additional arbors there. Furthermore, ectopic expression of TBR1 can redirect dendrites from the ON to the OFF zone of the IPL (Liu et al., 2018). TBR1 appears to guide dendrites of the four ganglion cells to their shared laminar target through different cell surface effectors (Liu et al., 2018), indicating complexity in the translation of the gene regulatory into the cell surface code for laminar targeting.
In some instances, neurotransmitters act as secreted cues for lamination. Thus, bipolar cell dendrites and horizontal cell dendrites and axons send ectopic processes into the ONL, when glutamate release from photoreceptors is disrupted (Dick et al., 2003; Raven et al., 2008; Soto et al., 2012). Activity manipulations have varied effects on the stratification of ganglion cell dendrites, indicating that the function of neurotransmitters may depend on cell type, species, and the nature of the perturbation (Bleckert and Wong, 2011; Bodnarenko et al., 1995; Bodnarenko and Chalupa, 1993; Kerschensteiner et al., 2009; Soto et al., 2012; Tian and Copenhagen, 2003; Xu and Tian, 2007).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128093245241564
Vestibular System and Balance
Larry F. Hoffman, Michael G. Paulin, in The Senses: A Comprehensive Reference (Second Edition), 2020
6.17.3.1 The Circuit Between Hair Cell and Afferent Dendrite
The dendrites of vestibular afferent neurons receive synaptic input from hair cells within the vestibular epithelia. The cellular mechanisms of hair cell transduction and signal transmission to afferent dendrites are detailed elsewhere in this volume. Briefly, hair cells are responsible for transducing mechanical energy associated with adequate stimuli into electrical energy represented as transmembrane potential depolarization or hyperpolarization. This mediates conductance changes in voltage gated calcium channels to modulate neurotransmitter release. Vestibular hair cell synapses are characterized by a synaptic body or ribbon, structures associated with the capability for graded release of neurotransmitter depending upon the input stimulus (Matthews and Fuchs, 2010). The prevailing evidence indicates that glutamate is the principal neurotransmitter (Annoni et al., 1984; Dulon et al., 2009). The distributions of postsynaptic receptor subunits within the postsynaptic membranes of afferent dendrites have yet to be comprehensively investigated in vestibular epithelia, but the best evidence indicates they are of the heteromeric AMPA type (Annoni et al., 1984; Cochran and Correia, 1995; Sadeghi et al., 2014; Kirk et al., 2017). There is some evidence for the presence of NMDA receptors within vestibular epithelia (Cochran and Correia, 1995; Gensberger et al., 2016) but their role in afferent vestibular signaling remains unresolved. Furthermore, as will be discussed below, evidence exists for GABAergic neurotransmission by a subset of hair cells (Lopez and Meza, 1989; Lopez et al. 1990, 1992; Holstein et al., 2004a), whereby the responses appear to be mediated by GABAB receptors in afferent dendrites (Holstein et al., 2004b; Holman et al., 2019).
Within the vestibular epithelia of sauropsids (reptiles and birds) and mammals – the amniote vertebrates (discussed in more detail below) – are two principal hair cell phenotypes referred to as type I and type II (Wersäll, 1956; Wersäll et al., 1965). The type I hair cell is distinguished by its association with a specialization of the afferent dendrite, called the calyx, that completely encapsulates it (Fig. 2A). Evidence has been accumulating that, in addition to quantal neurotransmission mediated by hair cell neurotransmitter exocytosis, there is a non-quantal component of synaptic communication between the type I hair cell and its calyx (Yamashita and Ohmori, 1990; Holt et al., 2007; Songer and Eatock, 2013; Contini et al., 2017). This component of neurotransmission represents a direct resistive coupling the type I hair cell and dendrite, and is a product of the interplay of pre- and postsynaptic potassium channels and the accumulation of potassium in the intercellular space enclosed by the calyx (Contini et al., 2020; Spaiardi et al., 2020). In vertebrates lacking type I hair cells and calyces (i.e. the anamniote species), transmission between hair cells and afferent dendrites is believed to be strictly neurotransmitter mediated (Annoni et al., 1984; Holstein et al., 2004b).
Figure 2. Dendritic morphology in semicircular canal afferents in crista specimens from an amniote (mouse) and anamniote (bullfrog). Both dendritic arbors were located in the central zone of the horizontal cristae in mouse (A) and frog (B), and represent maximum intensity renderings from confocal microscopy image stacks. (A) Double calyceal dendrite immunostained with anti-calretinin (green), made translucent to visualize the encapsulated type I hair cells that were immunostained with anti-oncomodulin (red). (B) Dendrite labeled with Neurobiotin following extracellular injection into the vestibular nerve root. Following histochemical processing that included the incubation with streptavidin conjugated to Alexa Fluor-488, the specimen was imaged via confocal microscopy from which this maximum intensity rendering was produced.
Being the principal stimulus transducers within inner ear sensory epithelia, hair cells encode head kinematic state owing to the coupling of the vestibular epithelia to the head and the inertia of accessory structures associated with each epithelium. That is, the epithelia move with the head while the fluid and the accessory structures (i.e. cupule and otolithic membranes) within membranous labyrinth do not, resulting in relative displacement of the hair cell stereocilia. This leads to changes in the open probability of transduction channels tethered to stereocilia tip-links (see detailed descriptions elsewhere in this volume), leading to depolarization or hyperpolarization of the hair cell membrane potential. For the cristae epithelia, the relative endolymph flow is directed by the semicircular canals and is therefore directionally constrained, and together with the cupule impose limits on the degrees of freedom possible for the direction of stereocilia displacement.
However, this is not the case for the otolithic macule where relative movements of the overlying accessory structures (i.e. the otolithic membranes) are not constrained spatially as are the cupule of the semicircular canals. This enhanced kinematic freedom illuminates an important feature of hair cell biology whereby the highly organized morphologic arrangement of hair cell stereocilia result in the capability for graded depolarization as a function of the direction of stereocilia displacement. The morphological organization of stereocilia endows the hair cell with an optimal direction of stereocilia displacement. As discussed elsewhere in this volume, stereocilia displacements toward the kinocilium and optimally aligned stereocilia organization result in maximal hair cell depolarization for a given displacement (Shotwell et al., 1981). This would subsequently result in maximal transmitter release associated with this stimulus vector, termed the morphological polarization vector (MPV). Displacements orthogonal to a hair cell’s MPV would result in minimal (or, ideally, zero) change in hair cell membrane potential. Stereocilia displacements at angles between these directional boundaries result in hair cell polarization magnitudes proportional to the cosine of the angle made by the stimulus vector direction and the MPV (Shotwell et al., 1981). This cosine relationship also applies to stimulus directions aligned with hair cell MPV, where the angle between stimulus direction and MPV is 0, the cosine of 0° being 1, thereby corresponding to the response maximum. This represents the response factor corresponding to the maximal change in hair cell membrane potential. Alternatively, stimulus directions orthogonal to the MPV would be 90°, the cosine of which is 0, reflecting the finding of no change in hair cell membrane potential associated with stimuli in that direction (Shotwell et al., 1981). This trigonometric relationship is particularly relevant to translational or tilt head movements that result in stereocilia displacements associated with hair cells within the utricle. However, the broad distribution of hair cell MPVs across the macular epithelia (Lindeman, 1969b) have a profound impact on the coding of stimulus direction in the discharge of primary afferents, which are dependent upon the terminations of their dendritic fields (Loe et al., 1973; Fernandez and Goldberg, 1976b; Goldberg et al., 1990; Si et al., 1997). Afferents projecting from the utricle have been shown to exhibit physiologic polarization vectors that reflect the weighted influence of hair cell MPVs from which they project (Loe et al., 1973). As will be discussed in the context of the physiology of otolithic afferents, not all afferents exhibit an absence of discharge modulation to stimuli directed orthogonally to their physiologic polarization vector (Fernandez and Goldberg, 1976b).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128054086000208
The growth cone and the synapse
Richard E. Fine, in Receptors in the Evolution and Development of the Brain, 2019
Abstract
Each dendrite and axon has to wend its way through a jungle of cell bodies and other neuronal processes. Each nerve process has a growth cone at its end that determines the direction of growth. Every growth cone has a series of long, narrow protrusions called filopodia interspersed with ruffle-like folds called lamellipodia. When an attractive molecule binds to its receptor on one side of the growth cone; the activated receptor signals through release or synthesis of a second messenger. This signal produces neurite turning toward the attractive signal via an actin linked motile apparatus. Also new membrane is inserted at the growth cone tip. In contrast, when a repulsive signal is encountered, another second messenger is produced. This causes the cytoskeleton on the surface facing the repulsive signal to dissolve, turning the growth cone in a different direction. The presynaptic ending has small Glu or GABA containing synaptic vesicles. Also there are larger, dense core vesicles containing the neurotransmitters dopamine, norepinephrine, serotonin, or a neuropeptide. The active zone underlies the plasma membrane opposite the postsynaptic ending. Synaptic vesicles are anchored to the active zones by three integral membrane proteins called SNARES. When the presynaptic membrane is depolarized, Ca++ rushes in, triggering neurotransmitter release. The synaptic vesicle membranes are recycled to form new synaptic vesicles. The postsynaptic endings contain a high concentration of receptors specific for the released transmitter. The receptors are anchored to the plasma membrane by PDZ domain proteins. There are also electrical synapses formed between neurons and/or glia. These synapses are composed of repeating integral membrane proteins that fit together with identical proteins on the opposing membrane. These receptor-like proteins are hollow in the middle allowing fairly large molecules to pass from one cell to another.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128110126000042
Vision
H. Wässle, in The Senses: A Comprehensive Reference (Second Edition), 2020
1.11.4.4 Horizontal Cell Glutamate Receptors
Horizontal cell dendrites of the primate retina express GluR hot spots at two postsynaptic locations: at the invaginating processes opposed to the presynaptic ribbons and at desmosome like junctions between horizontal cell dendrites underneath the cone pedicle (Haverkamp et al., 2000). GluR2/3 and GluR4 clusters are found at the invaginating processes and at the desmosome like junctions of all cone pedicles and these AMPA receptor subunits appear to constitute the dominant GluR expressed by horizontal cells (Fig. 7A–C). However, at M/L-cones pedicles horizontal cell dendrites also express the kainate receptor subunit GluR6/7. Since expression of GluR6/7 by horizontal cells was not observed at S-cone pedicles, the preferred target of H2 horizontal cells, it appears that only H1 horizontal cells express the GluR6/7 subunit (Haverkamp et al., 2001). The two horizontal types of the primate retina, therefore, not only have different shapes and cone contacts, but they express also different GluRs: H1 cells receive signals from cones through AMPA (GluR2/3, GluR4) and kainate (GluR6/7) receptors, H2 cells only through AMPA (GluR2/3, GluR4) receptors. Examination of GluR currents in horizontal cells from cultures human retina using whole-cell recordings showed that horizontal cells possess both AMPA and kainate receptors (Shen et al., 2004). Unfortunately the cells were not classified into H1 and H2 horizontal cells.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128054086002682
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
[14], рисунок адаптирован
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
[20], рисунок адаптирован
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает… «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Литература
- Прожорливый мозг;
- SEYMOUR S. KETY. (1957). THE GENERAL METABOLISM OF THE BRAIN IN VIVO. Metabolism of the Nervous System. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al.. (1977). THE [14C]DEOXYGLUCOSE METHOD FOR THE MEASUREMENT OF LOCAL CEREBRAL GLUCOSE UTILIZATION: THEORY, PROCEDURE, AND NORMAL VALUES IN THE CONSCIOUS AND ANESTHETIZED ALBINO RAT. J Neurochem. 28, 897-916;
- Magistretti P.J. (2008). Brain energy metabolism. In Fundamental neuroscience // Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron. 86, 883-901;
- William B Levy, Robert A. Baxter. (1996). Energy Efficient Neural Codes. Neural Computation. 8, 531-543;
- Sharp P.E. and Green C. (1994). Spatial correlates of firing patterns of single cells in the subiculum of the freely moving rat. J. Neurosci. 14, 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergic interneurons: From cellular design to microcircuit function. Science. 345, 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Highly Energized Inhibitory Interneurons are a Central Element for Information Processing in Cortical Networks. J Cereb Blood Flow Metab. 34, 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 21, 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004). Interneurons of the neocortical inhibitory system. Nat Rev Neurosci. 5, 793-807;
- Как происходит выделение нейромедиатора;
- От живого мозга к искусственному интеллекту;
- Kandel E.R., Schwartz J.H., Jessell T.M., Siegelbaum S.A., Hudspeth A.J. Principles of neural science (5th Edition). NY: McGraw-Hill Education / Medical, 2012. — 1760 p.;
- 12 методов в картинках: нейробиология;
- Oliver Kann. (2016). The interneuron energy hypothesis: Implications for brain disease. Neurobiology of Disease. 90, 75-85;
- H. B. Barlow. (1969). Trigger Features, Adaptation and Economy of Impulses. Information Processing in The Nervous System. 209-230;
- Levy W.B. and Baxter R.A. (2002). Energy-efficient neuronal computation via quantal synaptic failures. J. Neurosci. 22, 4746–4755;
- Julia J. Harris, Renaud Jolivet, David Attwell. (2012). Synaptic Energy Use and Supply. Neuron. 75, 762-777;
- Biswa Sengupta, Martin Stemmler, Simon B. Laughlin, Jeremy E. Niven. (2010). Action Potential Energy Efficiency Varies Among Neuron Types in Vertebrates and Invertebrates. PLoS Comput Biol. 6, e1000840;
- Simon B. Laughlin, Rob R. de Ruyter van Steveninck, John C. Anderson. (1998). Unknown title.. Nat. Neurosci.. 1, 36-41;
- S Laughlin. (2001). Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology. 11, 475-480;
- J. E. Niven, S. B. Laughlin. (2008). Energy limitation as a selective pressure on the evolution of sensory systems. Journal of Experimental Biology. 211, 1792-1804;
- Jeremy E Niven. (2016). Neuronal energy consumption: biophysics, efficiency and evolution. Current Opinion in Neurobiology. 41, 129-135;
- Clare Howarth, Padraig Gleeson, David Attwell. (2012). Updated Energy Budgets for Neural Computation in the Neocortex and Cerebellum. J Cereb Blood Flow Metab. 32, 1222-1232;
- A. Hasenstaub, S. Otte, E. Callaway, T. J. Sejnowski. (2010). Metabolic cost as a unifying principle governing neuronal biophysics. Proceedings of the National Academy of Sciences. 107, 12329-12334;
- Abdelmalik Moujahid, Alicia D’Anjou, Manuel Graña. (2014). Energy demands of diverse spiking cells from the neocortex, hippocampus, and thalamus. Front. Comput. Neurosci.. 8;
- Bruce P. Bean. (2007). The action potential in mammalian central neurons. Nat Rev Neurosci. 8, 451-465;
- Izhikevich E.M. Dynamical systems in neuroscience: the geometry of excitability and bursting (computational neuroscience). The MIT Press, 2007. — 457 p.;
- Brett C. Carter, Bruce P. Bean. (2009). Sodium Entry during Action Potentials of Mammalian Neurons: Incomplete Inactivation and Reduced Metabolic Efficiency in Fast-Spiking Neurons. Neuron. 64, 898-909;
- Формирование мембранного потенциала покоя;
- Появление и эволюция клеточной мембраны;
- Липидный фундамент жизни;
- Alan Woodruff, Rafael Yuste. (2008). Of Mice and Men, and Chandeliers. PLoS Biol. 6, e243;
- György Buzsáki, Caroline Geisler, Darrell A. Henze, Xiao-Jing Wang. (2004). Interneuron Diversity series: Circuit complexity and axon wiring economy of cortical interneurons. Trends in Neurosciences. 27, 186-193;
- David Sterratt, Bruce Graham, Andrew Gillies, David Willshaw. (Unknown published date.). Introduction. Principles of Computational Modelling in Neuroscience. 1-12;
- B. C. Carter, B. P. Bean. (2011). Incomplete Inactivation and Rapid Recovery of Voltage-Dependent Sodium Channels During High-Frequency Firing in Cerebellar Purkinje Neurons. Journal of Neurophysiology. 105, 860-871;
- Камкин А.Г. и Каменский А.А. (2004). Фундаментальная и клиническая физиология. М.: «Академия», 2004. — 1073 с.;
- Hille B. (2001). Ion channels of excitable membranes. Sunderland: Sinauer Associates, 2001. — 814 p.;
- Brian D. Clark, Ethan M. Goldberg, Bernardo Rudy. (2009). Electrogenic Tuning of the Axon Initial Segment. Neuroscientist. 15, 651-668;
- Джаксон М.Б. Молекулярная и клеточная биофизика. М.: «БИНОМ», 2013. — 552 с.;
- Спокоен как GABA;
- P. Crotty. (2006). Metabolic Energy Cost of Action Potential Velocity. Journal of Neurophysiology. 96, 1237-1246;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Очень нервное возбуждение;
- György Buzsáki, Kai Kaila, Marcus Raichle. (2007). Inhibition and Brain Work. Neuron. 56, 771-783;
- David Attwell, Alasdair Gibb. (2005). Neuroenergetics and the kinetic design of excitatory synapses. Nat Rev Neurosci. 6, 841-849;
- Nace L. Golding, Donata Oertel. (2012). Synaptic integration in dendrites: exceptional need for speed. The Journal of Physiology. 590, 5563-5569;
- Ashish Raj, Yu-hsien Chen. (2011). The Wiring Economy Principle: Connectivity Determines Anatomy in the Human Brain. PLoS ONE. 6, e14832;
- B. L. Chen, D. H. Hall, D. B. Chklovskii. (2006). Wiring optimization can relate neuronal structure and function. Proceedings of the National Academy of Sciences. 103, 4723-4728;
- Dmitri B. Chklovskii, Thomas Schikorski, Charles F. Stevens. (2002). Wiring Optimization in Cortical Circuits. Neuron. 34, 341-347;
- Biswa Sengupta, Simon B. Laughlin, Jeremy E. Niven. (2013). Balanced Excitatory and Inhibitory Synaptic Currents Promote Efficient Coding and Metabolic Efficiency. PLoS Comput Biol. 9, e1003263;
- Болезнь Паркинсона: что изучать? как изучать?;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Болезнь Альцгеймера: ген, от которого я без ума;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска;
- Болезни и изменения клеточного метаболизма;
- Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?;
- Adelbert Ames. (2000). CNS energy metabolism as related to function. Brain Research Reviews. 34, 42-68.
13 Ноября 2013
Как помочь регенерации отростков нейронов
Найден ключ к восстановлению аксонов
NanoNewsNet по материалам Washington University School of Medicine: Scientists identify clue to regrowing nerve cells
Ученые из Школы медицины Вашингтонского университета в Сент-Луисе идентифицировали цепную реакцию, ответственную за восстановление поврежденных аксонов – открытие, способное оказать значительную помощь в разработке эффективных методов лечения повреждений нервов, приводящих к потере чувствительности или параличу. Статья об исследовании опубликована в журнале Cell (Cho et al., Injury-Induced HDAC5 Nuclear Export Is Essential for Axon Regeneration).
Кроме того, американские исследователи доказали, что одно из звеньев этой цепной реакции в нервных клетках как головного, так и спинного мозга потеряно. Выпадение этого звена – белка HDAC5 – может объяснить, почему эти клетки не проявляют способности к самостоятельному восстановлению потерянных отростков. Новое исследование дает основания предположить, что активация HDAC5 в центральной нервной системе может стать триггером регенерации отростков нервных клеток.
«Мы знали, что вклад в восстановление отростков этих нервных клеток, называемых аксонами, вносят несколько генов, но что активирует экспрессию этих генов, а значит, и процесс восстановления, до сих пор оставалось неизвестным», – говорит руководитель исследования Валерия Кавалли (Valeria Cavalli), PhD, доцент кафедры нейробиологии. «Наше открытие приближает нас к тому, что в один прекрасный день мы сможем разработать методы лечения, делающие регенерацию аксонов более эффективной».
Аксоны – отростки нервных клеток, отправляющие сообщения. Как правило, они намного длиннее и более подвержены повреждениям, чем дендриты, выполняющие другую функцию – получение сообщений.
В периферической нервной системе – сети нервных клеток вне головного и спинного мозга – регенерация поврежденных аксонов иногда происходит естественным путем, чего, к сожалению, нельзя сказать о центральной нервной системе, где поврежденные аксоны, как правило, не восстанавливаются.
Работая с выращенными в лаборатории клетками периферической нервной системы, Юнчеол Чо (Yongcheol Cho), PhD, научный сотрудник лаборатории доктора Кавалли, отсекал части аксонов. Как оказалось, это вызывает волну перемещения кальция вдоль оставшейся части аксона к телу клетки. Эта волна является первой ступенью каскада реакций, активизирующих механизмы регенерации отростка.
Для изучения реакции нервных клеток на повреждение их аксонов ученые Вашингтонского университета
выращивают их в виде «пятен», получающихся в результате обработки поверхности клетки специфическими антителами.
(Фото: Yongcheol Cho, PhD)
В клетках периферической нервной системы одним из наиболее важных звеньев этой цепной реакция является высвобождение из центрального компартмента клетки – ее ядра – белка HDAC5. Как установили исследователи, после выхода из ядра HDAC5 активирует ряд генов, вовлеченных в процесс регенерации. Кроме того, HDAC5 мигрирует к месту повреждения, где участвует в синтезе микротрубочек – жестких опорных структур, помогающих воссоздать архитектуру регенерирующего аксона.
Схема из статьи в Cell – ВМ
Когда исследователи модифицировали ген HDAC5 таким образом, что его белок не мог выходить из ядер периферических нервных клеток, аксоны в клеточных культурах не восстанавливались. В то же время обработка растущих в культуре аксонов препаратами, помогающими HDAC5 покинуть ядро, стимулировало регенерацию. Результаты этих экспериментов были воспроизведены и в опытах на животных.
Совсем другую картину ученые наблюдали при изучении той же цепной реакции в клетках центральной нервной системы: HDAC5 никогда не покидал ядра и не мигрировал к месту повреждения. По мнению исследователей, неспособность HDAC5 – важнейшего в этой «пьесе» действующего лица – к выходу из ядра может быть одной из главных причин отсутствия регенерации аксонов клеток центральной нервной системы.
«Результаты нашего исследования можно признать весьма обнадеживающими. Если нам удастся найти способы манипулирования этой системой в нейронах головного и спинного мозга, мы сможем помочь клеткам центральной нервной системы в восстановлении потерянных отростков», – подводит итог доктор Кавалли. «Именно над этим мы сейчас и работаем».
Портал «Вечная молодость» http://vechnayamolodost.ru
13.11.2013