Очень часто при описании нервной системы используются «электрические» термины: например, нервы сравниваются с проводами. Это потому, что по нервному волокну действительно перемещается электрический сигнал. Каждому из нас известно, что оголенный провод опасен, ведь он бьет током, и по этой причине люди пользуются изоляционными материалами, не проводящими электричество. Природе тоже не чужда техника безопасности, и нервные «провода» она обматывает своим собственным изолирующим материалом — миелином.
Сложная обёртка
Миелин окружает отростки нервных клеток, изолируя их от внешнего воздействия. Это необходимо для более надежной и быстрой передачи сигнала по нервной системе. Благодаря изоляции нервного волокна электрический сигнал не рассеивается и добирается до места назначения без помех. Скорость прохождения сигнала по миелиновым и безмиелиновым волокнам может отличаться на три порядка: от 70 до 140 м/с и от 0,3 до 0,5 м/с соответственно.
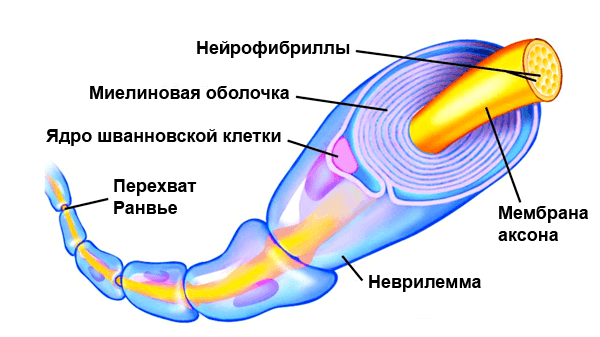
По сути миелин — это клеточная мембрана глиальных клеток, многократно обмотанная вокруг аксона. Сама мембрана на 70–75% состоит из липидов и на 25–30% — из белков. В периферической нервной системе донором мембран становятся шванновские клетки, а в центральной — олигодендроциты. Эти клетки бережно обматывают своими мембранами ценные каналы связи, чтобы обеспечить надежное взаимодействие нервной системы и периферических органов. Миелин покрывает нервное волокно не целиком: существуют промежутки между наслоениями миелина, называемые перехватами Ранвье (рис. 1). Есть прямая зависимость между расстоянием от одного промежутка до другого и скоростью распространения нервного импульса по волокну: чем больше расстояние между перехватами Ранвье, тем выше скорость передачи сигнала в нерве [1].
Рисунок 1. Нервное волокно, обернутое миелином. Видны ядра шванновских клеток (nucleus of Schwann cell) и перехваты Ранвье (nodes of Ranvier) — участки аксона, которые не покрыты миелиновой оболочкой.
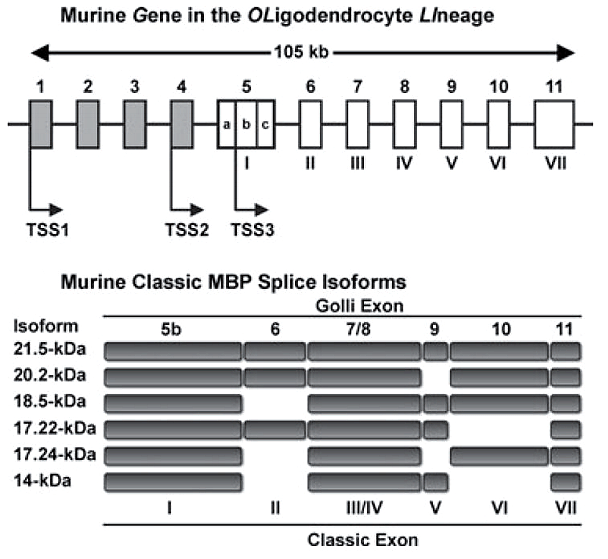
Если говорить о белках, входящих в состав миелина, то надо уточнить, что это не только простые белки. В миелине встречаются гликопротеины — белки, к которым присоединены короткие углеводные последовательности. Важной составляющей миелина является главный структурный белок миелина (myelin basic protein, MBP), впервые выделенный около 50 лет назад. MBP — это трансмембранный белок, который может многократно «прошивать» липидный слой клетки. Его различные изоформы (рис. 2) кодируются геном под названием Golli (gene in the oligodendrocyte lineage). Структурной основой миелина служит изоформа массой 18,5 килодальтон [2].
Рисунок 2. Различные изоформы основного белка миелина (MBP) создаются на основе одного и того же гена. Например, для синтеза изоформы массой 18,5 кДа используются все экзоны, кроме экзона II.
В состав миелина входят сложные липиды цереброзиды. Они представляют собой аминоспирт сфингозин, соединенный с жирной кислотой и остатком углевода. В синтезе липидов миелина принимают участие пероксисомы олигодендроцитов. Пероксисомы — это липидные пузырьки с различными ферментами (в общей сложности известно около 50 видов пероксисомных энзимов). Эти органеллы занимаются, в частности, β-окислением жирных кислот: жирных кислот с очень длинной цепью (very long chain fatty acids, VLCFA), некоторых эйкозаноидов и полиненасыщенных жирных кислот (ПНЖК, polyunsaturated fatty acids, PUFAs). Поскольку миелин может содержать до 70% липидов, пероксисомы крайне важны для нормального метаболизма этого вещества. Они используют N-ацетиласпартат, вырабатываемый нервной клеткой, для постоянного синтеза новых липидов миелина и поддержания его существования. Кроме этого, пероксисомы принимают участие в поддержании энергетического метаболизма аксонов [3].
Важная обёртка
Миелинизация (постепенная изоляция нервных волокон миелином) начинается у людей уже в эмбриональном периоде развития. Первыми этот путь проходят подкорковые структуры. В течение первого года жизни происходит миелинизация отделов периферической и центральной нервной системы, отвечающих за двигательную активность. Миелинизация участков головного мозга, регулирующих высшую нервную деятельность, заканчивается к 12–13 годам. Из этого видно, что миелинизация тесно связана со способностью отделов нервной системы осуществлять специфические для них функции. Вероятно, именно активная работа волокон до рождения запускает их миелинизацию.
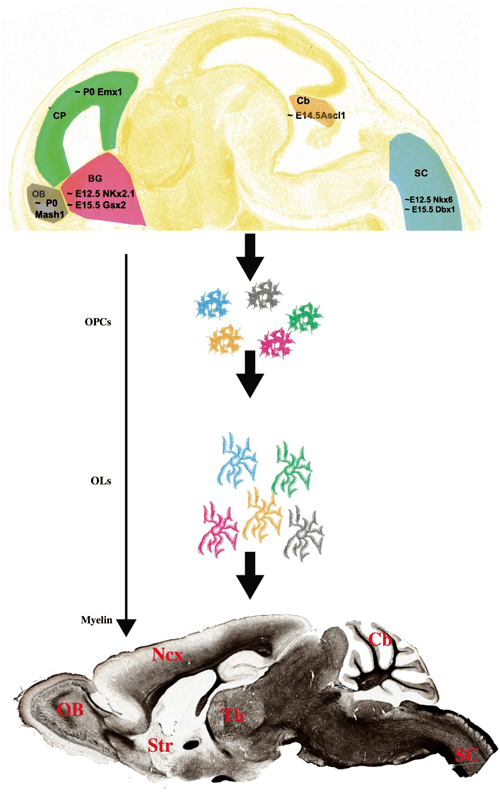
Дифференцировка клеток — предшественниц олигодендроцитов зависит от ряда факторов, связанных с работой нейронов. В частности, работающие отростки нейронов могут выделять белок нейролигин 3, который способствует пролиферации и дифференциации клеток-предшественниц [4]. В дальнейшем созревание олигодендроцитов происходит за счет ряда других факторов. В статье с характерным названием «Насколько велик миелинизирующий оркестр?» описывается происхождение олигодендроцитов в разных частях мозга [5]. Во-первых, в различных частях мозга олигодендроциты начинают созревать в разное время. Во-вторых, за их созревание отвечают разные клеточные факторы, что тоже зависит от региона нервной системы (рис. 3). У нас может возникнуть вопрос: а сходны ли между собой олигодендроциты, появившиеся с таким расхождением в стартовых данных? И насколько схож у них миелин? В целом, авторы статьи считают, что между популяциями олигодендроцитов из разных участков головного мозга действительно существуют различия, и обусловлены они во многом именно местом закладки клеток, воздействием на них окружающих нейронов. И всё же типы миелина, синтезируемые разными пулами олигодендроцитов, не имеют настолько больших отличий, чтобы они не были взаимозаменяемыми.
Рисунок 3. Различия во времени закладки олигодендроцитов в разных отделах головного мозга и в клеточных факторах, влияющих на их развитие.
Сам процесс миелинизации нервных волокон в центральной нервной системе происходит следующим образом (рис. 4). Олигодендроциты выпускают несколько отростков к аксонам разных нейронов. Входя с ними в контакт, отростки олигодендроцитов начинают оборачиваться вокруг них и расползаться по длине аксона. Количество оборотов постепенно увеличивается: в некоторых участках ЦНС их число доходит до 50. Мембраны олигодендроцитов становятся всё более тонкими, распространяясь по поверхности аксона и «выдавливая» из себя цитоплазму. Чем раньше слой миелина был обернут вокруг нервного окончания, тем более тонким он будет. Самый внутренний слой мембраны остается довольно толстым — для осуществления метаболической функции. Новые слои миелина наматываются поверх старых, перекрывая их так, как показано на рисунке 4 — не только сверху, но и увеличивая площадь аксона, покрытую миелином.
Рисунок 4. Миелинизация нервного волокна. Мембрана олигодендроцита наматывается на аксон, постепенно уплотняясь с каждым оборотом. Внутренний, прилегающий к аксону слой мембраны остается относительно толстым, что необходимо для выполнения метаболической функции. На разных частях рисунка (а-в) с разных ракурсов показано постепенное наматывание новых слоев миелина на аксон. Красным цветом выделен более толстый, метаболически активный слой, синим — новые уплотняющиеся слои. Внутренний слой миелина (inner tongue на части б) охватывается всё новыми и новыми слоями мембраны не только сверху, но и по бокам (в), вдоль аксона.
Миелинизация нервных волокон олигодендроцитами также значимо зависит от белка нейрегулина 1. Если он не воздействует на олигодендроциты, то в них запускается программа миелинизации, не учитывающая активность нервной клетки. Если же олигодендроциты получили сигнал от нейрегулина 1, то далее они начнут ориентироваться на работу аксона, и миелинизация будет зависеть от интенсивности выработки глутамата и активации им специфических NMDA-рецепторов на поверхности олигодендроцитов [6]. Нейрегулин 1 — ключевой фактор для запуска процессов миелинизации и в случае шванновских клеток [7].
Изменчивая обёртка
Миелин постоянно образуется и разрушается в человеческом организме. На синтез и распад миелина могут влиять факторы, связанные с особенностями внешней среды. Например, воспитание. С 1965 по 1989 год Румынией руководил Николае Чаушеску. Он установил жесткий контроль над репродуктивным здоровьем и институтом брака в своей стране: усложнил процедуру развода, запретил аборты и ввел ряд стимулов и льгот для женщин, имевших более пяти детей. Итогом этих мер стало ожидаемое повышение рождаемости. Вместе с рождаемостью увеличилось количество криминальных абортов, не добавивших здоровья румынкам, и возросло количество детей-отказников. Последние воспитывались в детских домах, где с ними не очень-то активно общался персонал. Румынские дети в полной мере ощутили на себе то, что называется социальной депривацией — лишение возможности полноценного общения с другими людьми. Если речь идет о маленьком ребенке, то следствиями социальной депривации станут нарушение формирования эмоциональных привязанностей и расстройство внимания. Когда режим Чаушеску пал, западным ученым предстояло в полной мере оценить результат социальной политики этого диктатора. Румынских детей, имеющих выраженные проблемы со вниманием и установкой социальных контактов, впоследствии стали называть детьми Чаушеску.
Кроме различий при выполнении нейропсихологических тестов, у детей Чаушеску по сравнению с детьми, не находившимися в таких условиях, отличалось даже строение головного мозга [8]. При оценке состояния белого вещества мозга ученые используют показатель фрактальной анизотропии. Он позволяет оценить плотность нервных волокон, диаметр аксонов и их миелинизацию. Чем больше фрактальная анизотропия, тем разнообразнее волокна, которые встречаются в этой области мозга. У детей Чаушеску отмечалось снижение фрактальной анизотропии в пучке белого вещества, соединяющего височную и лобную доли в левом полушарии, то есть связи в этом регионе были недостаточно сложными и разнообразными, с нарушениями миелинизации. Такое состояние связей мешает нормальному проведению сигналов между височной и лобной долями. В височной доле находятся центры эмоционального реагирования (миндалина, гиппокамп), а орбитофронтальная кора лобной доли также связана с эмоциями и принятием решений. Нарушение формирования связей между этими отделами мозга и проблемы в их работе в итоге приводили к тому, что выросшие в детдомах дети испытывали трудности в установлении нормальных отношений с другими людьми.
На миелинизацию также может влиять и состав еды, которую дают ребенку. При белково-энергетической недостаточности питания отмечается снижение образования миелина. Недостаток жирных кислот тоже отрицательно сказывается на синтезе этого ценного вещества, так как оно больше чем на 2/3 состоит из липидов. Дефицит железа, йода и витаминов группы В приводит к снижению образования миелина [9]. В основном эти данные были получены при изучении лабораторных животных, но история, к сожалению, дала людям возможность оценить влияние недостатка еды и на формирующийся мозг ребенка [10]. Голодная зима (голл. hongerwinter) 1944–1945 гг. в Нидерландах привела к тому, что родилось множество детей, чьи матери плохо питались. Оказалось, что в условиях голодания мозг этих детей формировался с нарушениями. В частности, наблюдалось большое количество нарушений именно в белом веществе, то есть возникали проблемы с формированием миелина. В итоге это приводило к разнообразным психическим расстройствам.
Поврежденная обёртка
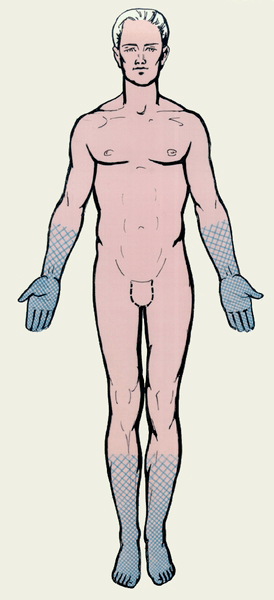
Рисунок 5. Нарушение чувствительности по полиневритическому типу. Название «носки — перчатки» связано с тем, что анатомические зоны, соответствующие поражению нервов, похожи на области, покрываемые этими предметами одежды.
Как мне кажется, для человеческого организма вполне подходит следующее правило: если есть орган, значит, к нему должна быть болезнь. В принципе, это правило можно расширить до молекулярных процессов: есть процесс — есть и болезни, связанные с нарушением этого процесса. В случае с миелином это демиелинизирующие заболевания. Их довольно много, но подробнее я расскажу о двух — синдроме Гийена-Барре и рассеянном склерозе. При этих расстройствах повреждение миелина приводит к нарушению адекватного проведения сигнала по нервам, что и обуславливает симптомы болезни.
Синдром Гийена-Барре (СГБ) — это заболевание периферической нервной системы, при котором происходит разрушение миелиновой оболочки, формируемой шванновскими клетками. СГБ является классическим аутоиммунным заболеванием. Как правило, ему предшествует инфекция (часто — вызванная микробом Campylobacter jejuni). Присутствие различных возбудителей в организме человека запускает аутоиммунное повреждение миелина нервных волокон T- и B-лимфоцитами. Клинически это проявляется мышечной слабостью, нарушением чувствительности по типу «носки — перчатки» (полиневритический тип) (рис. 5). В дальнейшем мышечная слабость может нарастать вплоть до полного паралича конечностей и поражения туловищной мускулатуры. Поражения чувствительной нервной системы также могут быть разнообразны: от снижения способности различать собственные движения (нарушение глубокой чувствительности) до выраженного болевого синдрома. При тяжелых формах СГБ главную опасность представляет потеря способности к самостоятельному дыханию, требующая подключения к аппарату искусственной вентиляции легких (ИВЛ). Для лечения СГБ в настоящее время используют плазмаферез (очистку плазмы от вредных антител) и внутривенные вливания препаратов человеческого иммуноглобулина для нормализации иммунного ответа. В большинстве случаев лечение приводит к стойкому выздоровлению.
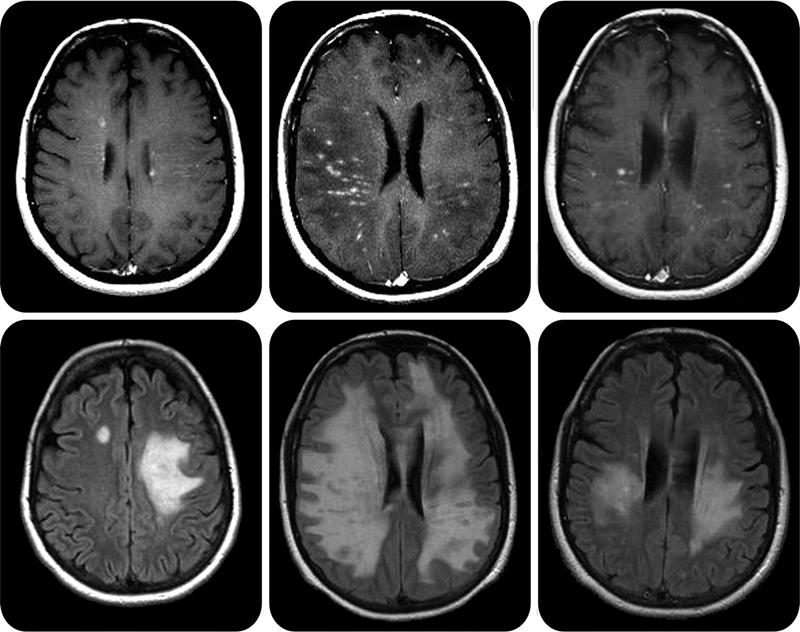
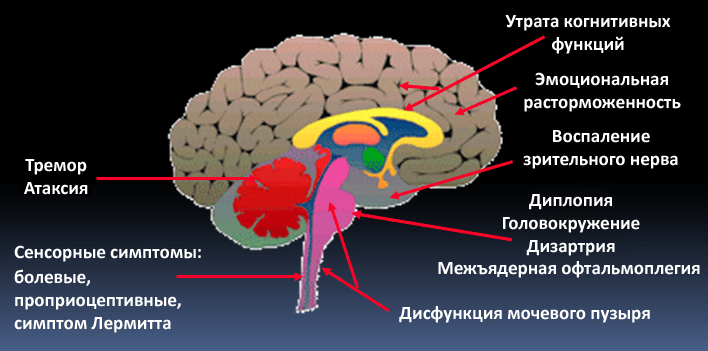
Рассеянный склероз (РС) заметно отличается от СГБ. Во-первых, это демиелинизирующее заболевание приводит к поражению центральной нервной системы, то есть затрагивает миелин, синтезируемый олигодендроцитами. Во-вторых, с причинами РС до сих пор много неясного: слишком большое разнообразие генетических и средовых факторов задействовано в патогенезе заболевания. Принципиальный момент в запуске РС — нарушение непроницаемости гематоэнцефалического барьера (ГЭБ) для иммунных клеток. В норме ткань мозга отгорожена от всего остального организма этим надежным фильтром, который не пропускает к ней множество веществ и клеток, в том числе иммунных. ГЭБ появляется уже в эмбриональном периоде развития, изолируя ткань мозга от формирующейся иммунной системы. В это время иммунная система человека «знакомится» со всеми существующими тканями, чтобы в дальнейшем, при взрослой жизни, не нападать на них. Мозг и ряд других органов остаются «не представленными» иммунной системе. При нарушении целостности ГЭБ иммунные клетки получают возможность для атаки незнакомых ей тканей мозга. В-третьих, РС отличается более тяжелыми симптомами, которые требуют других терапевтических подходов. Симптоматика зависит от того, где локализуются повреждения нервной системы (рис. 6 и 7). Это может быть шаткость походки, нарушения чувствительности, различные когнитивные симптомы. Для лечения РС используются высокие дозы глюкокортикоидов и цитостатики, а также препараты интерферона и специфические антитела (натализумаб). По-видимому, в дальнейшем будут развиваться новые методы лечения РС, основанные непосредственно на восстановлении миелиновой оболочки в поврежденных участках мозга. Ученые указывают на возможность трансплантации клеток — предшественниц олигодендроцитов или усиления их роста за счет введения инсулиноподобного фактора роста или тиреоидных гормонов [11]. Однако это еще впереди, а пока неврологам недоступны более «молекулярные» методы лечения.
Рисунок 6. Очаги поражения центральной нервной системы при рассеянном склерозе на МРТ выглядят как белые бляшки.
Рисунок 7. В зависимости от места поражения нервной системы при рассеянном склерозе может быть разная симптоматика: от тремора и атаксии при повреждении мозжечка до эмоциональных расстройств при локализации очагов в лобных долях.
- Wu L.M., Williams A., Delaney A., Sherman D.L., Brophy P.J. (2012). Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum. Curr. Biol. 22, 1957–1961;
- Harauz G. and Boggs J.M. (2013). Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms. J. Neurochem. 125, 334–361;
- Kassmann C.M. (2014). Myelin peroxisomes — essential organelles for the maintenance of white matter in the nervous system. Biochemie. 98, 111–118;
- Venkatesh H.S., Johung T.B., Caretti V., Noll A., Tang Y., Nagaraja S. et al. (2015). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell. 161, 803–816;
- Tomassy G.S. and Fossati V. (2014). How big is the myelinating orchestra? Cellular diversity within the oligodendrocyte lineage: facts and hypotheses. Front. Cell Neurosci. 8, 201;
- Michalski J.-P. and Kothary R. (2015). Oligodendrocytes in a nutshell. Front. Cell Neurosci. 9, 340;
- Salzer J.L. (2012). Axonal regulation of Schwann cell ensheathment and myelination. J. Peripher. Nerv. Syst. 17, 14–19;
- Eluvathingal T.J., Chugani H.T., Behen M.E., Juhász C., Muzik O., Maqbool M. et al. (2006). Abnormal brain connectivity in children after early severe socioemotional deprivation: a diffusion tensor imaging study. Pediatrics. 117, 2093–2100;
- Prado E.L. and Dewey K.G. (2014). Nutrition and brain development in early life. Nutr. Rev. 72, 267–284;
- Hulshoff Pol H.E., Hoek H.W., Susser E., Brown A.S., Dingemans A., Schnack H.G. et al. (2000). Prenatal exposure to famine and brain morphology in schizophrenia. Am. J. Psychiatry. 157, 1170–1172;
- Bhatt A., Fan L.W., Pang Y. (2014). Strategies for myelin regeneration: lessons learned from development. Neural. Regen. Res. 9, 1347–1350.
Рассмотрим более подробно строение
отростков нейрона и различия между
ними. Как уже было сказано, определяющее
отличие отростков — функциональное,
т.е. направление проведения нервного
импульса: по аксону он проводится от
тела клетки, по дендриту — к телу.
Существует и ряд анатомических различий,
однако они не абсолютны и возможен ряд
исключений из них. Тем не менее, для
типичных аксонов и дендритов характерны
следующие признаки:
-
Аксон один, а дендритов несколько (хотя
существуют нейроны и с одним дендритом). -
Дендрит короче аксона. Длина дендрита
обычно не более700 мкм, а аксон может
достигать длины 1 м. -
Дендрит плавно отходит от
тела нейрона и постепенно истончается.
Аксон, отходя от тела клетки, практически
не меняет диаметр на всем своем
протяжении. Диаметр различных аксонов
колеблется от 0,3 до 16 мкм. От их толщины
зависит скорость проведения нервного
импульса — чем аксон толще, тем скорость
больше. Участок, примыкающий к телу
нейрона (аксонный холмик), имеет большую
толщину, чем остальная часть аксона. -
Дендриты ветвятся на всем
своем протяжении под острым углом,
дихотомически (вильчато), ветвление
начинается от тела клетки. Аксон обычно
ветвится только на конце, образуя
контакты (синапсы) с другими клетками.
Конечные разветвления аксона называют
терминалами. В некоторых местах от
аксонов могут отходить под прямым углом
тонкие ответвления — коллатерали. -
Дендриты (по крайней мере,
в ЦНС) не имеют миелиновой оболочки,
аксоны часто окружены миелиновой
оболочкой (о миелиновой оболочке см.
ниже).
Кроме того, иногда на веточках
дендрита есть выросты
— шипики, являющиеся
характерной структурной особенностью
дендритов, особенно в коре больших
полушарий (рис. 6). Шипик состоит из двух
частей — тела и головки, размеры и форма
которых варьируют. Шипики значительно
увеличивают постсинаптическую поверхность
дендрита. Они являются лабильными
образованиями и при различных воздействиях
(или разных функциональных состояниях)
могут менять свою конфигурацию,
дегенерировать и вновь появляться. В
результате увеличивается либо уменьшается
число синапсов, меняется эффективность
передачи в них нервного сигнала и т.д.
Рис. 6. Шипик на
дендрите нейрона и контактирующие с
ним пресинаптические окончания. Стрелками
показано направление проведения
информации
Теперь, когда мы рассмотрели
строение дендритов и аксонов, следует
несколько детальнее изучить строение
синапса. Синапс, состоящий из одного
пре- и одного постсинаптического
окончаний, называют простым. Однако
большинство синапсов в ЦНС являются
сложными. В таких синапсах один аксон
может контактировать сразу с несколькими
дендритами благодаря нескольким
мембранным выростам на его окончании.
И наоборот, один дендрит за счет своих
шипиков может контактировать с несколькими
аксонами. Еще более сложную структуру
имеют синаптические гломерулы
(клубочки)— компактные
скопления окончаний нервных отростков
разных клеток, формирующие большое
количество взаимных синапсов. Обычно
гломерулы окружены оболочкой из глиальных
клеток. Особенно характерно присутствие
гломерул в тех зонах мозга, где происходит
наиболее сложная обработка сигналов —
в коре больших полушарий и мозжечка, в
таламусе.
Итак, нейрон состоит из тела
(сомы) и отростков. Как правило, один из
отростков существенно длиннее остальных.
Такой длинный отросток называют нервным
волокном. В ЦНС это
всегда аксон; в периферической нервной
системе это может быть как аксон, так и
дендрит. По волокнам проводятся нервные
импульсы, имеющие электрическую природу,
в связи с чем, каждое волокно нуждается
в изолирующей оболочке.
По типу такой оболочки все
волокна делятся на миелиновые
(мякотные) и безмиелиновые
(безмякотные).
Безмиелиновые нервные волокна покрыты
только оболочкой, образованной телом
шванновской (нейроглиальной) клетки.
Эти волокна имеют малый диаметр и
полностью либо частично погружены во
впячивание шванновской клетки. Одна
шванновская клетка может образовывать
оболочку вокруг нескольких аксонов
разного диаметра. Такие волокна называются
волокнами кабельного типа (рис. 7). Так
как длина аксона существенно больше
размеров шванновских клеток, оболочку
аксона образуют цепочки нейроглиальных
клеток. Скорость проведения нервного
импульса по таким волокнам — 0,5-2 м/с.
Многие нервные волокна
имеют миелиновую оболочку. Она также
образуется нейроглиальными клетками.
При формировании такой оболочки
олигодендроцит (в ЦНС) или шванновская
клетка (в периферической нервной системе)
обхватывает участок нервного волокна
(рис. 8). После этого образуется вырост
в виде язычка, который закручивается
вокруг волокна, образуя мембранные слои
(цитоплазма при этом из «язычка»
выдавливается). Таким образом, миелиновая
оболочка представляет собой двойные
слои клеточной мембраны и по своему
химическому составу является липопротеидом,
т.е. соединением липидов (жироподобных
веществ) и белков. Миелиновая оболочка
осуществляет электрическую
изоляцию нервного волокна наиболее
эффективно. Нервный импульс проводится
по такому волокну быстрее,
чем по лишенному миелина (скорость
проведения может достигать
120 м/с). Миелиновая оболочка начинается
немного
отступя от тела нейрона и заканчивается
примерно в 2
мкм от синапса. Она состоит из цилиндров
длиной 1,5-2
мм,
каждый из которых образован своей
глиальной клеткой.
Цилиндры разделяют перехваты Ранвье —
не покрытые
миелином участки волокна (их длина 0,5 —
2,5 мкм), играющие большую роль в быстром
проведении нервного импульса. В перехватах
от аксона могут отходить коллатерали.
Поверх миелиновой оболочки у мякотных
волокон есть еще
наружная оболочка — неврилемма,
образованная цитоплазмой и ядром
нейроглиальных клеток.
Рис. 7. Строение
нервных волокон:
А
—
миелиновое;
Б
—
безмиелиновая;
I
—
волокно;
2 —
миелиновый
слой; 3—
ядро
шванновской клетки; 4 —
микротрубочки;
5—Нейрофиламенты;
6 —
митохондрии;
7—соединительнотканная
оболочка
Рис.
8.
Строение миелиновой оболочки (А).
Образование
миелиновой оболочки шванновской клеткой
(Б): ‘
1
—
аксон;
2 —
слои
миелиновой оболочки; 3
— перехваты
Ранвье;
4
—
ядро
шванновской клетки. Стрелкой показано
направление
продвижения
выроста цитоплазматической мембраны
Миелин
имеет белый цвет. Именно это его свойство
позволило
разделить вещество нервной системы на
серое и белое. Тела
нейронов и их короткие отростки образуют
более темное серое
вещество, а
волокна — белое
вещество.
-
Классификация
нейронов
Нейроны очень
разнообразны по форме, величине,
количеству и способу отхождения от тела
отростков, химическому строению (имеется
в виду, в первую очередь, синтез тех или
иных нейромедиаторов) и т.д. (рис. 9). Тела
самых крупных нейронов достигают в
диаметре 100 — 120 мкм (гигантские пирамиды
Беца в коре больших полушарий), самых
мелких — 4-5 мкм (зернистые клетки коры
мозжечка). Приведем основные способы
классификации нервных клеток.
Рис.
9.
Различные типы нейронов:
А
—
псевдоуниполярный
нейрон спинномозгового ганглия;
Б
—
биполярный
нейрон сетчатки; В —
мотонейрон
спинного мозга;
Г
—
пирамидная
клетка коры больших полушарий (видно,
что дендриты покрыты
шипиками); Д —
клетка
Пуркинье мозжечка; I
—
тело
клетки;
2
—
дендрит;
3 —
аксон;
4 —
коллатерали
аксона
-
Функционально
нейроны подразделяются на чувствительные
(сенсорные), вставочные (переключательные,
интернейроны)
и исполнительные (двигательные или
мотонейроны и
др.). Сенсорные
нейроны —
это нервные клетки, воспринимающие
раздражения из внешней или внутренней
среды организма.
Интернейроны
(вставочные
нейроны) обеспечивают связь
между чувствительными и исполнительными
нейронами рефлекторных дугах. Общее
направление эволюции нервной системы
связано с увеличением числа интернейронов.
Из более
чем ста миллиардов нейронов человека
более 70% составляют
вставочные нейроны.
Исполнительные
нейроны,
управляющие сокращениями поперечно —
полосатых мышечных волокон, называют
двигательными
(мотонейронами). Они
образуют нервно-мышечные синапсы.
Исполнительные нейроны, называемые
вегетативными, управляют
работой внутренних органов, включая
гладкомышечные волокна, железистые
клетки и др.
2. По количеству отростков
нейроны делятся на униполярные,
псевдоуниполярные, биполярные и
мультиполярные.Большинство
нейронов нервной системы (и почти все
нейроны в ЦНС) — это мультиполярные
нейроны (см.
рис. 9, В — Д), они имеют
один аксон и несколько дендритов.
Биполярные
нейроны (см.
рис. 9, Б) имеют один аксон и один дендрит
и характерны для
периферических отделов анализаторных
систем. Униполярных
нейронов, имеющих только один отросток,
у человека практически
нет. Из тела псевдоуниполярного
нейрона (см.
рис.9,
А) выходит один отросток, который
практически сразу делится
на две ветви. Одна из них выполняет
функцию дендрита, а
другая — аксона. Такие нейроны находятся
в чувствительных спинномозговых
и черепных ганглиях. Их дендрит
морфологически
(по строению) похож на аксон: он гораздо
длиннее аксона и часто имеет миелиновую
оболочку.
3. По форме тела и характеру
ветвления отростков выделяют звездчатые,
пирамидные, веретеновидные, корзинчатые,
зернистые
и др. нейроны.
-
По длине аксона нейроны делят
на клетки типа Гольджи I и типа Гольджи
II (эта классификация разработана
итальянским ученым К.
Гольджи). Клетки Гольджи I
имеют длинный
аксон, выходящий за пределы области, в
которой находится
тело нейрона. Это, например, пирамидные
клетки коры
больших полушарий. У клеток Гольджи II
короткий и, как
правило, очень разветвленный аксон, не
выходящий за пределы
области, в которой находится тело
нейрона. Примером
таких нейронов могут быть корзинчатые
клетки коры мозжечка. -
Каждый нейрон синтезирует
только один основной нейромедиатор.
Для того чтобы определить нервную
клетку с этой
точки зрения к названию медиатора
добавляют окончание
«-ергический». Например, ацетилхолинергический
нейрон образует ацетилхолин,
глицинергический — глицин и т.д.
Соседние файлы в предмете Анатомия и физиология
- #
01.06.201515.58 Mб544ОТ НЕЙРОНА К МОЗГУ.doc
- #
- #
- #
- #
- #
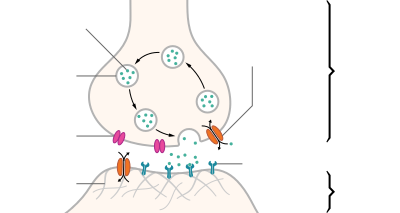
Нервное волокно это термин , используемый для описания расширения в нервной клетке , заключенной от глиальных клеток , например , в аксоне нервной клетки с его миелиновой оболочкой . В периферической нервной системе несколько нервных волокон обычно объединяются в нервы дополнительными соединительнотканными оболочками .
Миелинизация (миелинизация)
Рис. 1. Стадии миелинизации головного мозга по Полю Флексигу . Темные области становятся более ранними, светло-серые — более поздними, а белые — z. Иногда миелинизируется только в период полового созревания.
разработка
Миелинизации называются множественное обертывание нейритов из в нервную клетке наволакивания глиальных клеток , в результате чего аксон электрически изолированы таким образом , что более быстрое проведение возбуждения становится возможным с ремоделированием его междоузлий . Выступы нервных клеток сначала просто обволакиваются глиальными клетками, и только потом несколько раз становятся миелинизированными ( мозговыми ) нервными волокнами. Этот процесс онтогенетически протекает в определенной последовательности, которая часто также отражает последовательность этапов в истории развития нервной системы и мозга, как уже указывал Пауль Флехсиг (1847–1929). Например, двигательные связи миелинизируются раньше чувствительных, а основные связи миелинизируются перед дополнительными. Потому что некоторые соединения могут стать работоспособными только тогда, когда другие уже работают.
Однако формирование костномозговой оболочки не является обязательным условием для функционирования нервных клеток. Многочисленные нервные волокна остаются на всю жизнь без миелиновой оболочки ( немиелинизированные ), но при этом функционируют — например, в вегетативной нервной системе, в собственном аппарате спинного мозга, в ретикулярной формации головного мозга — даже в сетчатке и головном мозге. Продуманная костномозговая оболочка увеличивает скорость лески , что дает четкие различия только на больших расстояниях.
Более длинные аксоны миелинизированы, в первую очередь аксоны нервных связей, которые несут сенсорные или моторные связи тела в окружающей его среде ( оикотропные отношения соматических волокон). Потому что по отношению к другим живым существам скорость реакции на раздражитель играет роль, которая возрастает в соревновании. С другой стороны, сигнальные линии, которые опосредуют взаимоотношения тела как его собственного внутреннего мира ( идиотропная ссылка на висцеральные волокна) и которые влияют на функции его внутренностей, обычно не нуждаются в этом ускорении.
Отростки отростков нервных клеток окружены глиальными клетками, постоянные получают глиальное покрытие, а многие позже, на определенных этапах развития, также получают настоящую миелиновую оболочку или миелиновую оболочку . В ЦНС , она формируется олигодендроглии клеток , которые возникают из нейроэпителиальных клеток в нервной трубки . Снаружи, в нервных волокнах периферической нервной системы , эту задачу берут на себя шванновские клетки , глиальные клетки, которые возникают из нейроэктодермальных клеток нервного гребня .
гистология
Во время развития миелиновых оболочек ( миелогенез или созревание мозгового вещества ) шванновские клетки растут примерно в 50 раз вокруг отростка нервной клетки , в зависимости от типа нервной клетки, и несколько раз оборачивают ее двойными слоями своей клеточной мембраны. Одиночная шванновская клетка оборачивается только вокруг части аксона длиной до 2 мм, междоузлия , поэтому многие шванновские клетки выстраиваются рядом друг с другом вдоль цилиндра общей оси вокруг аксона.
С увеличением числа витков диаметр нервного волокна увеличивается при том же диаметре аксона. В зависимости от толщины миелиновой оболочки или количества ламел миелиновой оболочки различают миелинизированные нервные волокна в миелинизированных (сильно миелинизированных) и миелинизированных нервных волокнах. Так называемые сердцевинные нервные волокна (лучше: медуллярные шубы меньше ) не имеют медуллярные оболочек, но и в PNS они также обшиты глиальными клетками в чьей стороне складки они бегут. Однако эта однослойная оболочка настолько мало изолирует, что потенциалы действия должны передаваться непрерывно , поэтому возбуждение происходит значительно медленнее, чем с аксонами в миелиновой оболочке.
В случае соматических нервных волокон, которые афферентны или эфферентны к брюшной стенке и, таким образом, могут опосредовать быструю реакцию на изменения в окружающей среде, миелинизированные нервные волокна составляют наибольшую долю. Диаметр их аксонов составляет только половину поперечного сечения нервного волокна из-за толстого изоляционного слоя. Только это позволяет проводить так называемое скачкообразное возбуждение с многократным увеличением скорости нервной проводимости . Для этой цели между двумя шванновскими клетками остается небольшой промежуток, называемый Ranvierscher Schnürring или узел ( лат. Nodus ), и только в этой (узловой) области аксон оказывается настолько обнаженным, что здесь может создаваться потенциал действия, каждая из которых требует определенного воздействия. определенное количество времени. С другой стороны, сильно изолированный (межузловой) промежуток между двумя кольцами шнура теперь перекрывается исключительно быстрой электротонической передачей, так что потенциалы действия передаются только скачкообразно. При демиелинизирующих заболеваниях , например рассеянном склерозе , миелиновая оболочка вокруг аксонов центральных нейронов теряется на участках , в результате чего нарушается проводимость возбуждения, что может проявляться, среди прочего, в сенсорных нарушениях или параличе.
топография
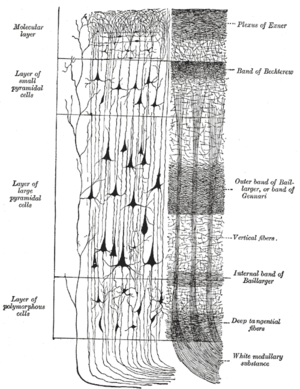
Рис. 3. Цито- и миело-архитектурная структура коры головного мозга или слоистая структура изокортекса :
пластинки II и III, а также пластинки IV и V суммированы на этой иллюстрации.
Как видно из рис. 1, знание стадий созревания мозга до полового созревания позволяет топографически описать и систематизировать мозг в смысле функциональной анатомии . Такие проблемы систематизации подразделения в проекционные центры и ассоциации центров в головном мозге. Ссылка сделана на соответствующие статьи.
О цито- и миелоархитектурной структуре коры головного мозга говорят, когда хотят описать взаимосвязь между клетками и мозговыми волокнами в определенном участке мозга (например, в коре головного мозга, см. Рис. 3). Создание соответствующих карт коры головного мозга, в которых структуры и функции были связаны друг с другом, восходит к Карлу Клейсту (1879–1960), Корбиниану Бродманну (1868–1918), Сесиль Фогт (1875–1962) и Оскару Фогту. (1870–1959) и Константину фон Экономо (1876–1931).
Пучки нервных волокон (периферические нервы)
Отдельные окруженные нервные волокна отделены друг от друга очень тонкими соединительнотканными пластинками, так называемым эндоневрием . Он состоит из ретикулярных волокон и базальной мембраны.
Несколько таких волокон сгруппированы вместе так называемым периневрием и образуют пучки волокон ( пучки ), которые состоят из коллагеновой соединительной ткани .
Эпиневрий в конечном счете , обволакивает весь периферический нерв (то есть несколько пучков нервных волокон) и фиксирует его в окружающих тканях.
Это покрытие из соединительной ткани придает нервам большую эластичность (через эластичные волокна ), защищает от давления и служит питанием для шванновских клеток , поскольку кровеносные сосуды проходят в этих ламеллах соединительной ткани .
Качество волокна
Снабжение органов или частей тела нервными волокнами и передача ими раздражителей называется иннервацией . Нервные волокна или целые нервы можно классифицировать по разным критериям:
- по направлению проведения возбуждения: афферентное (в сторону ЦНС ) и эфферентное (в сторону от ЦНС)
- в зависимости от степени миелинизации и, следовательно, скорости проводимости
- в соответствии с их эффектом
По их первичному эффекту различают три качества волокна: чувствительное, моторное, вегетативное.
Чувствительные нервные волокна
Чувствительные волокна передают ощущения, регистрируемые рецепторами тела, в центральную нервную систему. По направлению проведения возбуждения также говорят об афферентных волокнах. В немецкоязычных регионах сенсорные волокна часто отличаются от чувствительных . Сенсорные волокна проводят возбуждение от определенных органов чувств ( глаз , ушей , вкуса ). Однако это разграничение является довольно искусственным, потому что чувствительные волокна также имеют специализированные нервные окончания. В английском языке эта дифференциация не проводится, и чувствительные, и сенсорные относятся к термину сенсорный .
Особая форма являются viscero- чувствительны ( работа внутренних органов «внутренность») волокна , которые передают ощущение от внутренних органов. Но их обычно причисляют к вегетативным волокнам.
Двигательные нервные волокна
Моторные волокна иннервируют скелетные мышцы . Там возбуждение передается на мышечное волокно через моторную концевую пластину , которая стимулирует сокращение . Иногда ветвисто-двигательные нервы отделяются от двигательных нервов . Эти иннервируют скелетные мышцы, которые возникают из жаберных дуг . По направлению линии возбуждения это эфферентные волокна. Чисто моторных нервов нет; в нервах, относящихся к «моторным», афферентные волокна всегда исходят от рецепторов в мышцах ( мышечное веретено , орган сухожилия Гольджи ), которые регистрируют текущий тонус мышцы.
Висцеромоторные нервы иннервируют гладкую мускулатуру кишечника и кровеносных сосудов и являются частью вегетативных волокон.
Вегетативные нервные волокна
В нервных трактах в вегетативной (вегетативной) нервной системе , которые называются вегетативными волокна . Их также можно разделить на парасимпатические или симпатические, а также на кишечные в зависимости от их принадлежности к соответствующей системе . Различие проводится в зависимости от их основной функции или направления руководства.
- висцеральный афферент или висцеральный чувствительный
- висцероэфферентные : висцеромоторные (гладкие мышцы) или секреторные ( железы )
Классификация по линейной скорости по Эрлангеру / Гассеру
| Тип / класс волокна (по Эрлангеру / Гассеру ) | Скорость линии | диаметр | эфферент на: | афферент / (классификация по Ллойду / Ханту): |
|---|---|---|---|---|
| Aα | 70-120 м / с | 10-20 мкм | Скелетная мышца ( экстрафузальная ) | Скелетная мышца: мышечное веретено (Ia), орган сухожилия Гольджи (Ib) |
| Aβ | 30-70 м / с | 7-15 мкм | Рецепторы кожи (прикосновение, давление, вибрация) (II) | |
| Aγ | 15-30 м / с | 4-8 мкм | Скелетная мышца ( интрафузальная ) | |
| Aδ | 12-30 м / с | 2-5 мкм | Рецепторы кожи (температура, быстрая боль) (III) | |
| Б. | 3-15 м / с | 1-3 мкм | преганглионарные висцероэфференты | |
| С. | 0,5-2 м / с | 0,1-1,5 мкм | постганглионарные внутренние органы | медленная боль, терморецепторы (IV) |
Смотри тоже
- Тельца Рено
веб ссылки
- Myelin Projekt Deutschland eV с информацией о заболеваниях и исследованиях
Индивидуальные доказательства
- ↑ Пол Флехсиг : Анатомия головного и спинного мозга человека на миелогенетической основе . Тиме, Лейпциг, 1920.
- ↑ Ульрих Велш : Учебник по гистологии Соботты. Цитология, гистология, микроскопическая анатомия . 2-е, полностью переработанное издание. Elsevier, Urban & Fischer, Мюнхен и др., 2006 г., ISBN 3-437-44430-1 , стр. 186-188 .
- ^ Альфред Беннингхофф и др.: Учебник анатомии человека. Том 3: Нервная система, кожа и органы чувств. Урбан и Шварценберг, Мюнхен, 1964, стр. 234: Тонкая структура коры головного мозга и ее функциональное значение.
- ^ Роберт Ф. Шмидт , Флориан Ланг, Манфред Хекманн: Physiologie des Menschen. с патофизиологией . Издание 31-е, переработанное и дополненное. SpringerMedizin Verlag, Heidelberg 2010, ISBN 978-3-642-01650-9 , стр. 72 .
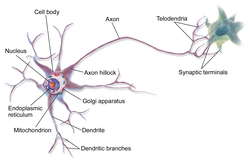
| Axon | |
|---|---|
An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
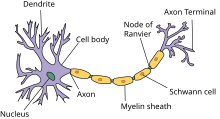
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»