Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
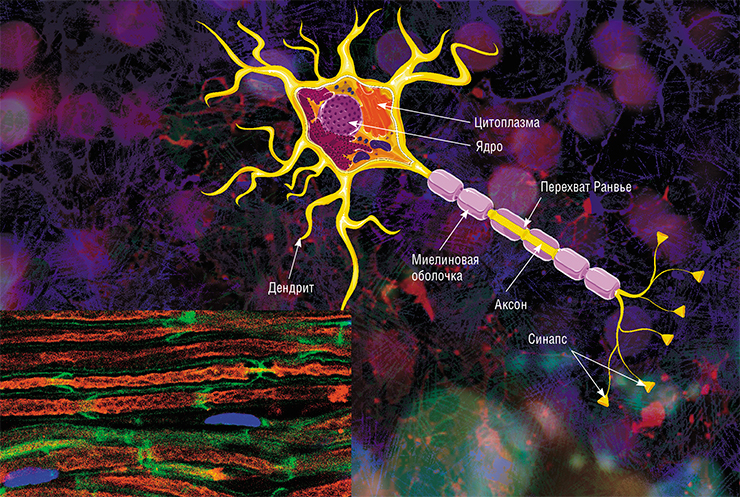
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
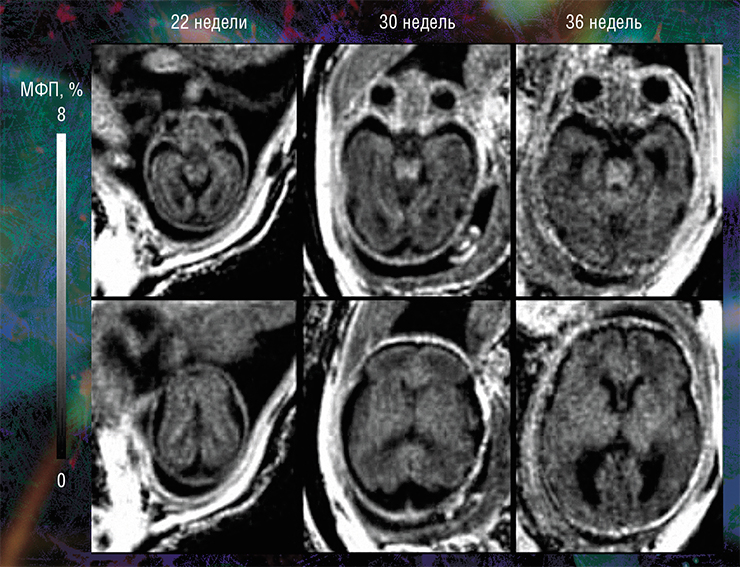
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
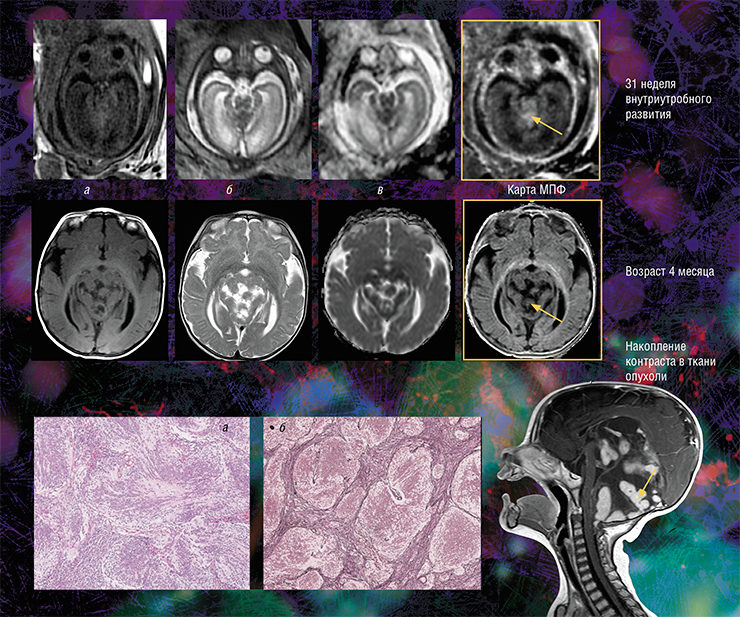
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
: 30 окт 2020 , Братство кольца , том 88,
№3
МИЕЛИНовая защита нейрона: все начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
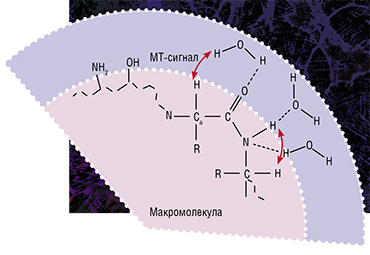
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Литература
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)
: 30 окт 2020 , Братство кольца , том 88,
№3
Нервная система выполняет важнейшие функции в организме. Она отвечает за все действия и мысли человека, формирует его личность. Но вся эта сложная работы была бы невозможна без одной составляющей — миелина.
Миелин – это вещество, образующее миелиновую (мякотную) оболочку, которая отвечает за электроизоляцию нервных волокон и скорость передачи электрического импульса.
Анатомия миелина в строении нерва
Главная клетка нервной системы – нейрон. Тело нейрона называется сома. Внутри нее находится ядро. Тело нейрона окружено короткими отростками, которые называются дендриты. Они отвечают за связь с другими нейронами. От сомы отходит один длинный отросток – аксон. Он несет импульс от нейрона к другим клеткам. Чаще всего на конце он соединяется с дендритами других нервных клеток.
Всю поверхность аксона покрывает миелиновая оболочка, которая представляет собой отросток клетки Шванна, лишенный цитоплазмы. По сути, это несколько слоев клеточной мембраны, обернутые вокруг аксона.
Шванновские клетки, обволакивающие аксон, разделяются перехватами Ранвье, в которых отсутствует миелин.
Функции
Основными функциями миелиновой оболочки являются:
- изоляция аксона;
- ускорение проведения импульса;
- экономия энергии за счет сохранения ионных потоков;
- опора нервного волокна;
- питание аксона.
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.
В спокойном состоянии внутрь нейрона попадают только ионы калия, а ионы натрия остаются снаружи. В момент возбуждения они начинаются меняться местами. Аксон положительно заряжается изнутри. Затем натрий перестает поступать через мембрану, а отток калия не прекращается.
Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Состав
Миелиновый слой состоит из двух слоев липидов и трех слоев белка. Липидов в нем гораздо больше (70-75%):
- фосфолипиды (до 50%);
- холестерин (25%);
- глактоцереброзид (20%) и др.
Большое содержание жиров обусловливает белый цвет миелиновой оболочки, благодаря чему нейроны, покрытые ей, называются «белым веществом».
Белковые слои тоньше липидных. Содержание белка в миелине – 25-30%:
- протеолипид (35-50%);
- основной белок миелина (30%);
- белки Вольфграма (20%).
Существуют простые и сложные белки нервной ткани.
Роль липидов в строении оболочки
Липиды играют ключевую роль в строении мякотной оболочки. Они являются структурным материалом нервной ткани и защищают аксон от потери энергии и ионных потоков. Молекулы липидов обладают способностью восстанавливать ткани мозга после повреждений. Липиды миелина отвечают за адаптацию зрелой нервной системы. Они выступают в роли рецепторов гормонов и осуществляют коммуникацию между клетками.
Роль белков
Немаловажное значение в строении миелинового слоя имеют молекулы белков. Они наряду с липидами выступают в роли строительного материала нервной ткани. Их главной задачей является транспортировка питательных веществ в аксон. Также они расшифровывают сигналы, поступающие в нервную клетку и ускоряют реакции в ней. Участие в обмене веществ – важная функция молекул белка миелиновой оболочки.
Дефекты миелинизации
Разрушение миелинового слоя нервной системы – очень серьезная патология, из-за которой происходит нарушение передачи нервного импульса. Она вызывает опасные заболевания, зачастую несовместимые с жизнью. Существуют два типа факторов, влияющие на возникновение демиелинизации:
- генетическая предрасположенность к разрушению миелина;
- воздействие на миелин внутренних или внешних факторов.
- Демиелизация делится на три вида:
- острая;
- ремиттирующая;
- острая монофазная.
Почему происходит разрушение
Наиболее частыми причинами разрушения мякотной оболочки являются:
- ревматические болезни;
- существенное преобладание белков и жиров в питании;
- генетическая предрасположенность;
- бактериальные инфекции;
- отравление тяжелыми металлами;
- опухоли и метастазы;
- продолжительные сильные стрессы;
- плохая экология;
- патологии иммунной системы;
- длительный прием нейролептиков.
Заболевания вследствие демиелинизации
Демиелинизирующие заболевания центральной нервной системы:
- Болезнь Канавана – генетическое заболевание, возникающее в раннем возрасте. Его характеризуют слепота, проблемы с глотанием и приемом пищи, нарушение моторики и развития. Также следствием этой болезни являются эпилепсия, макроцефалия и мышечная гипотония.
- Болезнь Бинсвангера. Чаще всего вызвана артериальной гипертонией. Больных ожидают расстройства мышления, слабоумие, а также нарушения ходьбы и функций тазовых органов.
- Рассеянный склероз. Может вызвать поражения нескольких частей ЦНС. Ему сопутствуют парезы, параличи, судороги и нарушение моторики. Также в качестве симптомов рассеянного склероза выступают поведенческие расстройства, ослабление лицевых мышц и голосовых связок, нарушение чувствительности. Зрение нарушается, меняется восприятие цвета и яркости. Рассеянный склероз также характеризуется расстройствами тазовых органов и дистрофией ствола мозга, мозжечка и черепных нервов.
- Болезнь Девика – демиелинизация в зрительном нерве и спинном мозге. Болезнь характеризуют нарушения координации, чувствительности и функций тазовых органов. Ее отличают серьезные нарушения зрения и даже слепота. В клинической картине также наблюдаются парезы, мышечная слабость и вегетативная дисфункция.
- Синдром осмотической демиелинизации. Возникает из-за недостатка натрия в клетках. Симптомами выступают судороги, нарушения личности, потери сознания вплоть до комы и смерти. Следствием заболевания являются отек головного мозга, инфаркт гипоталамуса и грыжа ствола мозга.
- Миелопатии – различные дистрофические изменения в спинном мозге. Их характеризуют мышечные нарушения, сенсорные расстройства и дисфункция тазовых органов.
- Лейкоэнцефалопатия – разрушение миелиновой оболочки в подкорке головного мозга. Больных мучают постоянная головная боль и эпилептические припадки. Также наблюдаются нарушения зрения, речи, координации и ходьбы. Снижается чувствительность, наблюдаются расстройства личности и сознания, прогрессирует слабоумие.
- Лейкодистрофия – генетическое нарушение метаболизма, вызывающее разрушение миелина. Течение болезни сопровождают мышечные и двигательные расстройства, параличи, нарушение зрения и слуха, прогрессирующее слабоумие.
Демиелинизирующие заболевания периферической нервной системы:
- Синдром Гийена-Барре – острая воспалительная демиелинизация. Она характеризуется мышечными и двигательными нарушениями, дыхательной недостаточностью, частичным или полным отсутствием сухожильных рефлексов. Больные страдают заболеваниями сердца, нарушением работы пищеварительной системы и тазовых органов. Парезы и нарушения чувствительности так же являются признаками этого синдрома.
- Невральная амиотрофия Шарко-Мари-Тута – наследственная патология миелиновой оболочки. Ее отличают нарушения чувствительности, дистрофия конечностей, деформация позвоночника и тремор.
Это лишь часть заболеваний, возникающих из-за разрушения миелинового слоя. Симптомы в большинстве случаев схожи. Точный диагноз можно поставить лишь после проведения компьютерной или магнитно-резонансной томографии. Немаловажную роль в постановке диагноза играет уровень квалификации врача.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
- Стимуляция олигодендроцитов. Это клетки, производящие миелин. В организме, пораженном демиелинизацией, они не работают. Искусственная стимуляция этих клеток поможет запустить процесс восстановления разрушенных участков миелиновой оболочки.
- Стимуляция стволовых клеток. Стволовые клетки могут превращаться в полноценную ткань. Есть вероятность, что они могут заполнять и мякотную оболочку.
- Регенерация гематоэнцефалического барьера. При демиелинизации этот барьер разрушается и позволяет лимфоцитам негативно влиять на миелин. Его восстановление защищает миелиновый слой от атаки иммунной системы.
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
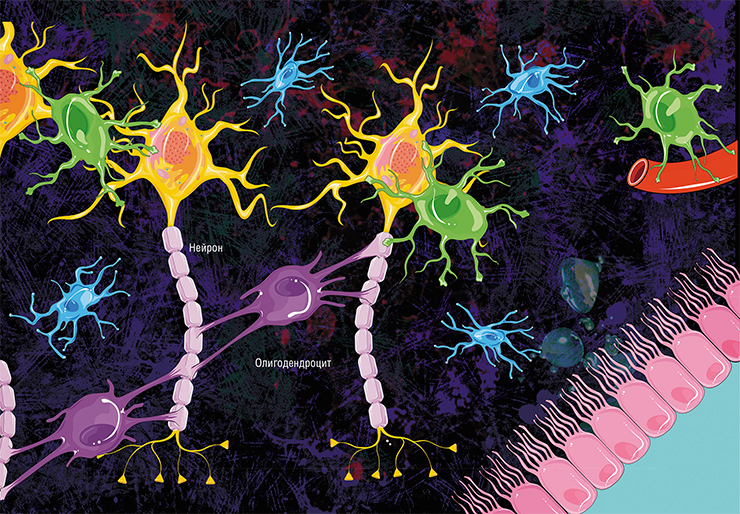
У нервных клеток есть два вида отростков — небольшие и чрезвычайно разветвлённые дендриты, с помощью которых нейрон собирает импульсы от других нервных клеток, и очень длинные аксоны, которые отправляют импульсы дальше. Почти все аксоны в центральной нервной системе (то есть в головном и спинном мозге) покрыты миелином — светлой субстанцией, состоящей преимущественно из липидов. Миелинизированных нервных волокон также много в периферической нервной системе, то есть в нервах, которые выходят из головного и спинного мозга и идут к другим органам.
Олигодендроцит и миелиновая оболочка. Один олигодендроцит формирует миелиновую оболочку сразу на нескольких аксонах, но на каждом из них он создаёт только один сегмент оболочки (от одного перехвата Ранвье до другого). Иллюстрация: Holly Fischer/Wikimedia Commons/CC BY 3.0.
‹
›
Миелин одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Чтобы понять, как миелин ускоряет импульсы, нужно вспомнить, что любой импульс в нейроне — это перегруппировка ионов между наружной и внутренней стороной клеточной мембраны. Когда на каком-то участке мембраны открываются ионные каналы, то такие же ионные потоки сразу открываются на соседнем участке мембраны, потом — на участке чуть подальше и т. д. Электрические свойства мембраны последовательно меняются вдоль нейронного отростка — это и есть бегущий импульс. Миелин окутывает аксоны не всплошную с начала и до конца. В миелиновой обмотке есть пробелы, где мембрана не покрыта миелином, — перехваты Ранвье (названные так в честь открывшего их французского физиолога Луи Антуана Ранвье). И когда импульс распространяется по аксону, то перегруппировка ионов происходит как раз на перехватах Ранвье. То есть импульс не переползает медленно между участками, которые находятся вплотную друг к другу, а скачет от одного перехвата к другому. И если в аксоне без миелина импульс бежит со скоростью 0,5—10 м/с, то в таком же аксоне, но с миелином, скорость импульса достигает 150 м/с.
Скопления аксонов, обмотанных миелином, выглядят светлее, поэтому области в мозге, где преобладают аксонные «провода», называют белым веществом. (Скопления дендритов, которые обходятся без миелина, образуют серое вещество. Поскольку дендриты намного короче аксонов, они не передают импульсы на большие расстояния и скорость для них не так важна.) Нейроны не сами вырабатывают миелин, для того есть специальные клетки — олигодендроциты в центральной нервной системе и шванновские клетки в периферических нервах. И те и другие относятся к глие, или нейроглие — так называют совокупность различных клеток нервной системы, которые обслуживают нейроны, создавая им условия для работы. В последнее время появляется всё больше данных о том, что глиальные клетки не просто обслуживают нейроны, но напрямую вмешиваются в их работу (см. статью «Иммунные ”электрики” мозга», «Наука и жизнь» № 8, 2020 г.). Задача олигодендроцитов и шванновских клеток — сделать нейронам миелиновую обмотку. Олигодендроцит или шванновская клетка выпячивают собственную мембрану и обхватывают аксон, мембрана нарастает — и в итоге вокруг аксона получается слоистый липидный рулон. Глиальная клетка остаётся живой и поддерживает целостность миелиновой обмотки на том участке аксона, за который она отвечает.
Разрушение миелиновой оболочки приводит к неврологическим симптомам различного вида и различной степени тяжести. Есть много заболеваний, связанных с утратой миелина на аксонах, и рассеянный склероз среди них — самое известное. Это одна из аутоиммунных болезней, когда иммунитет по какой-то причине атакует собственные клетки и молекулы организма. При рассеянном склерозе срабатывают разные иммунные механизмы, в которых участвуют как иммунные клетки мозга, так и иммунные клетки, вошедшие в мозг из крови. Но, так или иначе, заканчивается всё тем, что миелиновая оболочка вокруг аксонов разрушается, а иногда разрушаются и сами аксоны. В очаг болезни приходят астроциты — так называется ещё одна разновидность глиальных клеток. Их задача — поддерживать и питать нейроны, а также залечивать повреждения; именно это они и делают, стараясь зарубцевать больной участок и формируя характерную бляшку. Стоит добавить, что обычно рассеянный склероз поражает центральную нервную систему; периферические нервы страдают от него редко.
Очень часто при описании нервной системы используются «электрические» термины: например, нервы сравниваются с проводами. Это потому, что по нервному волокну действительно перемещается электрический сигнал. Каждому из нас известно, что оголенный провод опасен, ведь он бьет током, и по этой причине люди пользуются изоляционными материалами, не проводящими электричество. Природе тоже не чужда техника безопасности, и нервные «провода» она обматывает своим собственным изолирующим материалом — миелином.
Сложная обёртка
Миелин окружает отростки нервных клеток, изолируя их от внешнего воздействия. Это необходимо для более надежной и быстрой передачи сигнала по нервной системе. Благодаря изоляции нервного волокна электрический сигнал не рассеивается и добирается до места назначения без помех. Скорость прохождения сигнала по миелиновым и безмиелиновым волокнам может отличаться на три порядка: от 70 до 140 м/с и от 0,3 до 0,5 м/с соответственно.
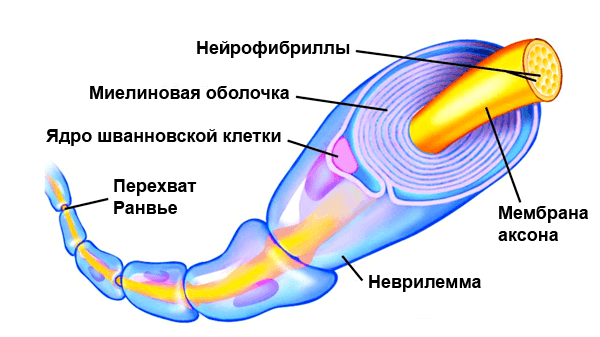
По сути миелин — это клеточная мембрана глиальных клеток, многократно обмотанная вокруг аксона. Сама мембрана на 70–75% состоит из липидов и на 25–30% — из белков. В периферической нервной системе донором мембран становятся шванновские клетки, а в центральной — олигодендроциты. Эти клетки бережно обматывают своими мембранами ценные каналы связи, чтобы обеспечить надежное взаимодействие нервной системы и периферических органов. Миелин покрывает нервное волокно не целиком: существуют промежутки между наслоениями миелина, называемые перехватами Ранвье (рис. 1). Есть прямая зависимость между расстоянием от одного промежутка до другого и скоростью распространения нервного импульса по волокну: чем больше расстояние между перехватами Ранвье, тем выше скорость передачи сигнала в нерве [1].
Рисунок 1. Нервное волокно, обернутое миелином. Видны ядра шванновских клеток (nucleus of Schwann cell) и перехваты Ранвье (nodes of Ranvier) — участки аксона, которые не покрыты миелиновой оболочкой.
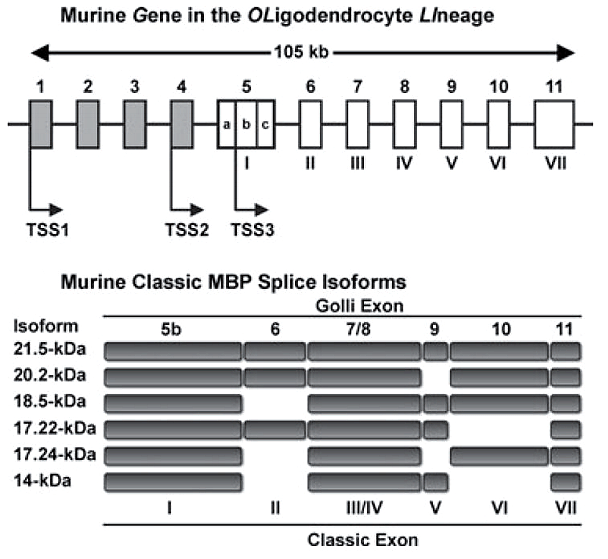
Если говорить о белках, входящих в состав миелина, то надо уточнить, что это не только простые белки. В миелине встречаются гликопротеины — белки, к которым присоединены короткие углеводные последовательности. Важной составляющей миелина является главный структурный белок миелина (myelin basic protein, MBP), впервые выделенный около 50 лет назад. MBP — это трансмембранный белок, который может многократно «прошивать» липидный слой клетки. Его различные изоформы (рис. 2) кодируются геном под названием Golli (gene in the oligodendrocyte lineage). Структурной основой миелина служит изоформа массой 18,5 килодальтон [2].
Рисунок 2. Различные изоформы основного белка миелина (MBP) создаются на основе одного и того же гена. Например, для синтеза изоформы массой 18,5 кДа используются все экзоны, кроме экзона II.
В состав миелина входят сложные липиды цереброзиды. Они представляют собой аминоспирт сфингозин, соединенный с жирной кислотой и остатком углевода. В синтезе липидов миелина принимают участие пероксисомы олигодендроцитов. Пероксисомы — это липидные пузырьки с различными ферментами (в общей сложности известно около 50 видов пероксисомных энзимов). Эти органеллы занимаются, в частности, β-окислением жирных кислот: жирных кислот с очень длинной цепью (very long chain fatty acids, VLCFA), некоторых эйкозаноидов и полиненасыщенных жирных кислот (ПНЖК, polyunsaturated fatty acids, PUFAs). Поскольку миелин может содержать до 70% липидов, пероксисомы крайне важны для нормального метаболизма этого вещества. Они используют N-ацетиласпартат, вырабатываемый нервной клеткой, для постоянного синтеза новых липидов миелина и поддержания его существования. Кроме этого, пероксисомы принимают участие в поддержании энергетического метаболизма аксонов [3].
Важная обёртка
Миелинизация (постепенная изоляция нервных волокон миелином) начинается у людей уже в эмбриональном периоде развития. Первыми этот путь проходят подкорковые структуры. В течение первого года жизни происходит миелинизация отделов периферической и центральной нервной системы, отвечающих за двигательную активность. Миелинизация участков головного мозга, регулирующих высшую нервную деятельность, заканчивается к 12–13 годам. Из этого видно, что миелинизация тесно связана со способностью отделов нервной системы осуществлять специфические для них функции. Вероятно, именно активная работа волокон до рождения запускает их миелинизацию.
Дифференцировка клеток — предшественниц олигодендроцитов зависит от ряда факторов, связанных с работой нейронов. В частности, работающие отростки нейронов могут выделять белок нейролигин 3, который способствует пролиферации и дифференциации клеток-предшественниц [4]. В дальнейшем созревание олигодендроцитов происходит за счет ряда других факторов. В статье с характерным названием «Насколько велик миелинизирующий оркестр?» описывается происхождение олигодендроцитов в разных частях мозга [5]. Во-первых, в различных частях мозга олигодендроциты начинают созревать в разное время. Во-вторых, за их созревание отвечают разные клеточные факторы, что тоже зависит от региона нервной системы (рис. 3). У нас может возникнуть вопрос: а сходны ли между собой олигодендроциты, появившиеся с таким расхождением в стартовых данных? И насколько схож у них миелин? В целом, авторы статьи считают, что между популяциями олигодендроцитов из разных участков головного мозга действительно существуют различия, и обусловлены они во многом именно местом закладки клеток, воздействием на них окружающих нейронов. И всё же типы миелина, синтезируемые разными пулами олигодендроцитов, не имеют настолько больших отличий, чтобы они не были взаимозаменяемыми.
Рисунок 3. Различия во времени закладки олигодендроцитов в разных отделах головного мозга и в клеточных факторах, влияющих на их развитие.
Сам процесс миелинизации нервных волокон в центральной нервной системе происходит следующим образом (рис. 4). Олигодендроциты выпускают несколько отростков к аксонам разных нейронов. Входя с ними в контакт, отростки олигодендроцитов начинают оборачиваться вокруг них и расползаться по длине аксона. Количество оборотов постепенно увеличивается: в некоторых участках ЦНС их число доходит до 50. Мембраны олигодендроцитов становятся всё более тонкими, распространяясь по поверхности аксона и «выдавливая» из себя цитоплазму. Чем раньше слой миелина был обернут вокруг нервного окончания, тем более тонким он будет. Самый внутренний слой мембраны остается довольно толстым — для осуществления метаболической функции. Новые слои миелина наматываются поверх старых, перекрывая их так, как показано на рисунке 4 — не только сверху, но и увеличивая площадь аксона, покрытую миелином.
Рисунок 4. Миелинизация нервного волокна. Мембрана олигодендроцита наматывается на аксон, постепенно уплотняясь с каждым оборотом. Внутренний, прилегающий к аксону слой мембраны остается относительно толстым, что необходимо для выполнения метаболической функции. На разных частях рисунка (а-в) с разных ракурсов показано постепенное наматывание новых слоев миелина на аксон. Красным цветом выделен более толстый, метаболически активный слой, синим — новые уплотняющиеся слои. Внутренний слой миелина (inner tongue на части б) охватывается всё новыми и новыми слоями мембраны не только сверху, но и по бокам (в), вдоль аксона.
Миелинизация нервных волокон олигодендроцитами также значимо зависит от белка нейрегулина 1. Если он не воздействует на олигодендроциты, то в них запускается программа миелинизации, не учитывающая активность нервной клетки. Если же олигодендроциты получили сигнал от нейрегулина 1, то далее они начнут ориентироваться на работу аксона, и миелинизация будет зависеть от интенсивности выработки глутамата и активации им специфических NMDA-рецепторов на поверхности олигодендроцитов [6]. Нейрегулин 1 — ключевой фактор для запуска процессов миелинизации и в случае шванновских клеток [7].
Изменчивая обёртка
Миелин постоянно образуется и разрушается в человеческом организме. На синтез и распад миелина могут влиять факторы, связанные с особенностями внешней среды. Например, воспитание. С 1965 по 1989 год Румынией руководил Николае Чаушеску. Он установил жесткий контроль над репродуктивным здоровьем и институтом брака в своей стране: усложнил процедуру развода, запретил аборты и ввел ряд стимулов и льгот для женщин, имевших более пяти детей. Итогом этих мер стало ожидаемое повышение рождаемости. Вместе с рождаемостью увеличилось количество криминальных абортов, не добавивших здоровья румынкам, и возросло количество детей-отказников. Последние воспитывались в детских домах, где с ними не очень-то активно общался персонал. Румынские дети в полной мере ощутили на себе то, что называется социальной депривацией — лишение возможности полноценного общения с другими людьми. Если речь идет о маленьком ребенке, то следствиями социальной депривации станут нарушение формирования эмоциональных привязанностей и расстройство внимания. Когда режим Чаушеску пал, западным ученым предстояло в полной мере оценить результат социальной политики этого диктатора. Румынских детей, имеющих выраженные проблемы со вниманием и установкой социальных контактов, впоследствии стали называть детьми Чаушеску.
Кроме различий при выполнении нейропсихологических тестов, у детей Чаушеску по сравнению с детьми, не находившимися в таких условиях, отличалось даже строение головного мозга [8]. При оценке состояния белого вещества мозга ученые используют показатель фрактальной анизотропии. Он позволяет оценить плотность нервных волокон, диаметр аксонов и их миелинизацию. Чем больше фрактальная анизотропия, тем разнообразнее волокна, которые встречаются в этой области мозга. У детей Чаушеску отмечалось снижение фрактальной анизотропии в пучке белого вещества, соединяющего височную и лобную доли в левом полушарии, то есть связи в этом регионе были недостаточно сложными и разнообразными, с нарушениями миелинизации. Такое состояние связей мешает нормальному проведению сигналов между височной и лобной долями. В височной доле находятся центры эмоционального реагирования (миндалина, гиппокамп), а орбитофронтальная кора лобной доли также связана с эмоциями и принятием решений. Нарушение формирования связей между этими отделами мозга и проблемы в их работе в итоге приводили к тому, что выросшие в детдомах дети испытывали трудности в установлении нормальных отношений с другими людьми.
На миелинизацию также может влиять и состав еды, которую дают ребенку. При белково-энергетической недостаточности питания отмечается снижение образования миелина. Недостаток жирных кислот тоже отрицательно сказывается на синтезе этого ценного вещества, так как оно больше чем на 2/3 состоит из липидов. Дефицит железа, йода и витаминов группы В приводит к снижению образования миелина [9]. В основном эти данные были получены при изучении лабораторных животных, но история, к сожалению, дала людям возможность оценить влияние недостатка еды и на формирующийся мозг ребенка [10]. Голодная зима (голл. hongerwinter) 1944–1945 гг. в Нидерландах привела к тому, что родилось множество детей, чьи матери плохо питались. Оказалось, что в условиях голодания мозг этих детей формировался с нарушениями. В частности, наблюдалось большое количество нарушений именно в белом веществе, то есть возникали проблемы с формированием миелина. В итоге это приводило к разнообразным психическим расстройствам.
Поврежденная обёртка
Рисунок 5. Нарушение чувствительности по полиневритическому типу. Название «носки — перчатки» связано с тем, что анатомические зоны, соответствующие поражению нервов, похожи на области, покрываемые этими предметами одежды.
Как мне кажется, для человеческого организма вполне подходит следующее правило: если есть орган, значит, к нему должна быть болезнь. В принципе, это правило можно расширить до молекулярных процессов: есть процесс — есть и болезни, связанные с нарушением этого процесса. В случае с миелином это демиелинизирующие заболевания. Их довольно много, но подробнее я расскажу о двух — синдроме Гийена-Барре и рассеянном склерозе. При этих расстройствах повреждение миелина приводит к нарушению адекватного проведения сигнала по нервам, что и обуславливает симптомы болезни.
Синдром Гийена-Барре (СГБ) — это заболевание периферической нервной системы, при котором происходит разрушение миелиновой оболочки, формируемой шванновскими клетками. СГБ является классическим аутоиммунным заболеванием. Как правило, ему предшествует инфекция (часто — вызванная микробом Campylobacter jejuni). Присутствие различных возбудителей в организме человека запускает аутоиммунное повреждение миелина нервных волокон T- и B-лимфоцитами. Клинически это проявляется мышечной слабостью, нарушением чувствительности по типу «носки — перчатки» (полиневритический тип) (рис. 5). В дальнейшем мышечная слабость может нарастать вплоть до полного паралича конечностей и поражения туловищной мускулатуры. Поражения чувствительной нервной системы также могут быть разнообразны: от снижения способности различать собственные движения (нарушение глубокой чувствительности) до выраженного болевого синдрома. При тяжелых формах СГБ главную опасность представляет потеря способности к самостоятельному дыханию, требующая подключения к аппарату искусственной вентиляции легких (ИВЛ). Для лечения СГБ в настоящее время используют плазмаферез (очистку плазмы от вредных антител) и внутривенные вливания препаратов человеческого иммуноглобулина для нормализации иммунного ответа. В большинстве случаев лечение приводит к стойкому выздоровлению.
Рассеянный склероз (РС) заметно отличается от СГБ. Во-первых, это демиелинизирующее заболевание приводит к поражению центральной нервной системы, то есть затрагивает миелин, синтезируемый олигодендроцитами. Во-вторых, с причинами РС до сих пор много неясного: слишком большое разнообразие генетических и средовых факторов задействовано в патогенезе заболевания. Принципиальный момент в запуске РС — нарушение непроницаемости гематоэнцефалического барьера (ГЭБ) для иммунных клеток. В норме ткань мозга отгорожена от всего остального организма этим надежным фильтром, который не пропускает к ней множество веществ и клеток, в том числе иммунных. ГЭБ появляется уже в эмбриональном периоде развития, изолируя ткань мозга от формирующейся иммунной системы. В это время иммунная система человека «знакомится» со всеми существующими тканями, чтобы в дальнейшем, при взрослой жизни, не нападать на них. Мозг и ряд других органов остаются «не представленными» иммунной системе. При нарушении целостности ГЭБ иммунные клетки получают возможность для атаки незнакомых ей тканей мозга. В-третьих, РС отличается более тяжелыми симптомами, которые требуют других терапевтических подходов. Симптоматика зависит от того, где локализуются повреждения нервной системы (рис. 6 и 7). Это может быть шаткость походки, нарушения чувствительности, различные когнитивные симптомы. Для лечения РС используются высокие дозы глюкокортикоидов и цитостатики, а также препараты интерферона и специфические антитела (натализумаб). По-видимому, в дальнейшем будут развиваться новые методы лечения РС, основанные непосредственно на восстановлении миелиновой оболочки в поврежденных участках мозга. Ученые указывают на возможность трансплантации клеток — предшественниц олигодендроцитов или усиления их роста за счет введения инсулиноподобного фактора роста или тиреоидных гормонов [11]. Однако это еще впереди, а пока неврологам недоступны более «молекулярные» методы лечения.
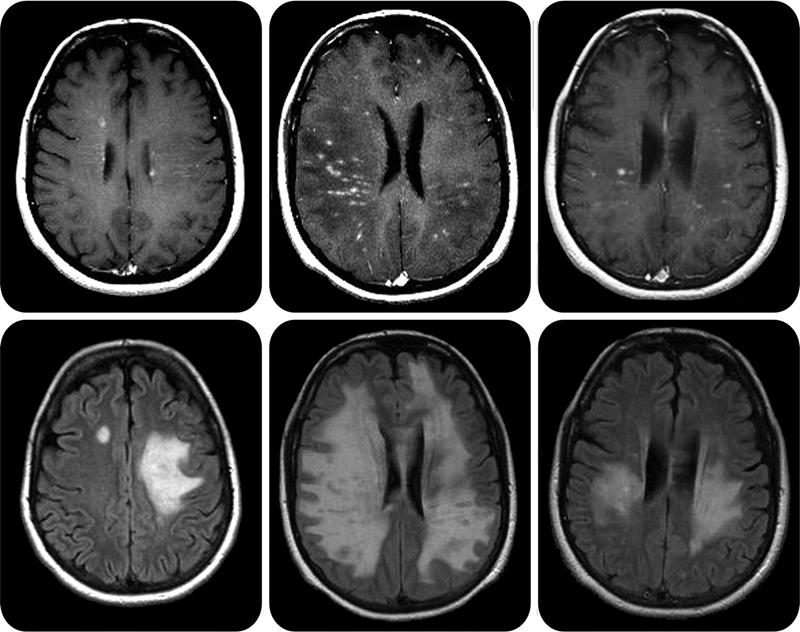
Рисунок 6. Очаги поражения центральной нервной системы при рассеянном склерозе на МРТ выглядят как белые бляшки.
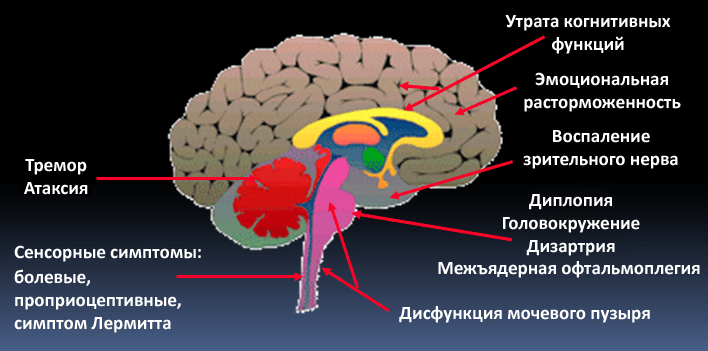
Рисунок 7. В зависимости от места поражения нервной системы при рассеянном склерозе может быть разная симптоматика: от тремора и атаксии при повреждении мозжечка до эмоциональных расстройств при локализации очагов в лобных долях.
- Wu L.M., Williams A., Delaney A., Sherman D.L., Brophy P.J. (2012). Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum. Curr. Biol. 22, 1957–1961;
- Harauz G. and Boggs J.M. (2013). Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms. J. Neurochem. 125, 334–361;
- Kassmann C.M. (2014). Myelin peroxisomes — essential organelles for the maintenance of white matter in the nervous system. Biochemie. 98, 111–118;
- Venkatesh H.S., Johung T.B., Caretti V., Noll A., Tang Y., Nagaraja S. et al. (2015). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell. 161, 803–816;
- Tomassy G.S. and Fossati V. (2014). How big is the myelinating orchestra? Cellular diversity within the oligodendrocyte lineage: facts and hypotheses. Front. Cell Neurosci. 8, 201;
- Michalski J.-P. and Kothary R. (2015). Oligodendrocytes in a nutshell. Front. Cell Neurosci. 9, 340;
- Salzer J.L. (2012). Axonal regulation of Schwann cell ensheathment and myelination. J. Peripher. Nerv. Syst. 17, 14–19;
- Eluvathingal T.J., Chugani H.T., Behen M.E., Juhász C., Muzik O., Maqbool M. et al. (2006). Abnormal brain connectivity in children after early severe socioemotional deprivation: a diffusion tensor imaging study. Pediatrics. 117, 2093–2100;
- Prado E.L. and Dewey K.G. (2014). Nutrition and brain development in early life. Nutr. Rev. 72, 267–284;
- Hulshoff Pol H.E., Hoek H.W., Susser E., Brown A.S., Dingemans A., Schnack H.G. et al. (2000). Prenatal exposure to famine and brain morphology in schizophrenia. Am. J. Psychiatry. 157, 1170–1172;
- Bhatt A., Fan L.W., Pang Y. (2014). Strategies for myelin regeneration: lessons learned from development. Neural. Regen. Res. 9, 1347–1350.
Нормальная миелинизация
Основа формирования нормальной миелинизации изложенное Барковичем – ее начало на 5 месяце эмбрионального периода и продолжение в течение всей жизни. Миелинизация начинается с черепных нервов, что имеет смысл, поскольку чувствительность необходима для выживания. Так же стоит учитывать, что миелинизация структур происходит в направлении снизу вверх, от задних структур к передним и от центра к периферии. Логично, что ствол мозга и мозжечок миелинизируются раньше полушарий, а базальные ядра и таламус – раньше белого вещества. Кроме того, задняя ножка внутренней капсулы миелинизируется раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов.
Профессор Серена Каунселл с коллегами описали миелинизацию у сильно недоношенных новорожденных и подтвердили миелинизацию червя мозжечка, вестибулярных ядер, ножек мозжечка, зубчатых ядер, медиального продольного пучка, медиальных коленчатых тел, субталамических ядер, нижних ядер оливы, вентролатеральных ядер таламуса, медиальной и латеральной петель, нижних холмов четверохолмия, а также клиновидного и тонкого пучков. Исследователи не обнаружили никаких новых сайтов миелинизации между 28 и 36 неделями, после чего снова появились новые миелиновые участки в задней ножке внутренней капсулы, лучистом венце и кортикоспинальных трактах предцентральной и постцентральной извилины.
Гистологические исследования демонстрируют миелинизацию при рождении в стволе мозга, белом веществе мозжечка и задней ножке внутренней капсулы с распространением на таламус и базальные ганглии.
Профессор Берд с коллегами проанализировали 60 пациентов и обнаружили значительные различия в скорости и начале появления изменений, связанных с миелинизацией. Исследователи изучали сайты-маркеры для определенных возрастов при определении нормального миелина. Так, при рождении наблюдалась миелинизация задней ножки внутренней капсулы, ножек мозжечка и лучистого венца вокруг центральной борозды. Исследователи снова последовательно подтвердили сроки миелинизации: в задней ножке раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов у всех субъектов.
Томас Паус (2001) описал 3 паттерна развития, наблюдаемые в отношении дифференциации серого-белого вещества в первые 12-24 месяца жизни.
- младенческий паттерн – менее чем за 6 месяцев; картина, противоположная картине взрослого мозга,
- изометрический паттерн (8-12 месяцев), в котором наблюдается плохая дифференциация между серым и белым веществом
- ранний взрослый паттерн (более 12 месяцев), в которых сигнал от серого вещества выше, чем от белого, на Т2-ВИ и ниже на Т1-ВИ.
Валик мозолистого тела миелинизируется примерно к 3 месяцу, тело – к 4-5 месяцу, а колено – к 6 месяцу. На протяжении развития (в первый год) наблюдаются изменения и в форме, и в толщине. У новорожденного утолщение начинается с колена (со 2-3 месяца), затем утолщается валик (с 5-6 месяца), достигая толщины колена к 7 месяцу. Мозолистое тело увеличивается до 12 месяца. На Т1-ВИ валик мозолистого тела имеет повышенную интенсивность сигнала в 4 месяца, когда как колено – в 5-6 месяцев.
Терминальные зоны миелинизации
Последней зоной миелинизации на МРТ является перитригональная зона. Эта область поддерживает постоянную гиперинтенсивность на T2-ВИ, но не интенсивнее серого вещества. Параццини с коллегами описали терминальные зоны миелинизации в лобно-теменных субкортикальных регионах. Было показано, что данная область характеризуется гиперинтенсивным сигналом на Т2-ВИ в течение первых 36-40 месяцев жизни. Что касается идиопатической задержки развития, Маричич с коллегами изучили 93 ребенка и не обнаружил определенных доказательств корреляции между идиопатической задержкой развития и задержкой при миелинизации на Т2-взвешенных изображениях.
Damage to the myelin sheath—that is, separation of the myelin lamellae (intramyelinic edema), or selective loss of myelin (demyelination)—result in a decrease of nerve impulse velocity.
From: Reference Module in Biomedical Sciences, 2018
Myelin: Molecular Architecture of CNS and PNS Myelin Sheath☆
S.S. Scherer, E.J. Arroyo, in Reference Module in Biomedical Sciences, 2014
The Function of Myelin Sheaths
A myelin sheath is a multilamellar spiral of cell membrane that originates as the extension of the inner mesaxon around an axon which is typically larger than 1 μm in diameter (Figure 1). Myelinated axons are completely covered by myelin sheaths (internodes) except at nodes of Ranvier, the small gaps (less than 1 μm in length) directly exposed to the extracellular milieu. Myelin sheaths reduce current across the intermodal membrane by lowering the internodal capacitance, increasing internodal resistance, and increasing current flow at the node of Ranvier, thus facilitating saltatory conduction, one of the fundamental adaptations of vertebrates.
Figure 1. Ultrastructure of a myelinated fiber in the PNS. (a) This electron micrograph shows an axon, its myelin sheath (m), basal lamina (arrowheads), as well as the inner (i) and outer (o) mesaxons (from a 4-day-old mouse). (b) This electron micrograph shows that the compact myelin sheath is composed of alternating major dense (arrows) and intraperiod lines. Note the ‘double nature’ of the intraperiod line.
From SS Scherer (1997) Molecular genetics of demyelination: New wrinkles on an old membrane. Neuron 18: 13–16, with permission of Elsevier.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383046766
Dialogues: Communication Between Axons and Myelinating Glia
Robert M. Gould Ph.D., Scott T. Brady Ph.D., in Multiple Sclerosis As A Neuronal Disease, 2005
VI. Axonal Diameter, Myelin Sheath Thickness, and Internode Lengths
Myelin sheath thickness and internodal length vary with axonal caliber (Fraher, 1978; Friede and Miyagishi, 1972). An important feature of myelination in both the CNS and PNS is the matching of axon diameter, myelin sheath thickness, and nodal length because this matching is required to optimize nerve conduction properties (Rushton, 1951; Waxman, 1997). The specific combination of axon diameter, myelin sheath thickness, and internodal length is established during development and maturation of a myelinated fiber. A given myelinated axon will exhibit remarkable consistency in diameter, sheath thickness, and internodal distance as long as the axon is unbranched and the type of MG responsible is unchanged. Neighboring axons with comparable diameters will have comparable sheath thicknesses and internodal lengths (Friede and Miyagishi, 1972). The specific values of these parameters are established during development and maturation of an axon population. However, when axons are denuded and subsequently remyelinated or when regenerating axons become myelinated, the values are typically reduced relative to the original ones (Blakemore, 1974).
Although the matching of axon caliber to myelin sheath thickness has long been recognized (Elder et al., 2001; Friede and Miyagishi, 1972), the molecular mechanisms that regulate the interrelationships between axon caliber, myelin sheath thickness, and internodal length are still poorly understood. Recent studies begin to dissect this pathway in the PNS. Mice lacking erbB2 receptor form unusually thin myelin sheaths (Garratt et al., 2000a, 2000b). This focused attention on the possibility of axonal expression of neuregulins, the ligands for erbB receptors (Falls, 2003a, 2003b). Subsequent studies showed that axonal expression of a specific neuregulin, (neuregulin-1 type III with an N-terminal cysteine-rich domain) plays a key role in the relationship between myelin sheath thickness and axon caliber. Neuregulin-1 type III, is expressed in myelinated axons and its receptors, erbB2 and erbB3, are expressed in SC and in myelin (Michailov et al., 2004). As with reduced erbB2 receptor (Garratt et al., 2000b), lowering levels of neuregulin-1 type III, but not other nrg-1 family members, leads to hypomyelination. To show that the effect was on the ligand and not the receptor, overexpression of ligand, but not receptor, resulted in hypermyelinated axons. Interestingly, internodal length was unaffected by altered nrg-1 or altered erbB2 receptor, suggesting that other mechanisms were involved in controlling internodal length. Such studies pave the way for future analyses of the underlying signaling mechanisms.
Signals generated through axonal neuregulins and myelin erbB receptors regulate myelination in the PNS. However, control of myelin sheath thickness by axons in the CNS is a more complex event. In the CNS, individual OL extend multiple processes that simultaneously myelinate axons with different calibers and sheaths of different thicknesses (Elder et al., 2001; Friedrich and Mugnaini, 1983; Waxman and Sims, 1984). Control of myelin sheath thickness must be locally controlled at the level of the axon-glia interface. It is not currently known whether neuregulin/erbB interactions or other yet-to-be-uncovered mechanisms are involved.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127387611500031
Infiltration and Nerve Block Anesthesia
In Wounds and Lacerations (Third Edition), 2005
Differential Blockade
Myelin sheath coverings of nerve fibers within axons vary in diameter and thickness. Fibers that carry stimuli from pain receptors in the skin have no myelin sheath and have the smallest diameter. The sensations of pressure and touch and motor impulses are transmitted by larger, myelinated fibers. The thin pain fibers are blocked more rapidly and easily by local anesthetic solutions. This fact is significant in wound care because a solution of 1% lidocaine might block pain stimuli only and not the sensation of touch and pressure. An overly anxious patient may react to touch and pressure as if it were pain. A higher concentration of lidocaine or mepivacaine (e.g., 2%) abolishes all awareness of stimuli and allows for unimpeded repair. Adding epinephrine to these solutions achieves the same effect.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323023078500106
Neuropathology
Romana Höftberger, Hans Lassmann, in Handbook of Clinical Neurology, 2018
Myelin sheath
Myelin sheaths are formed and maintained by oligodendrocytes (Dhaunchak and Nave, 2007). Myelin assembly and long-term preservation require a number of proteins that are either expressed in the myelin or at the axonal membrane. MOG is localized on the outermost surface of the myelin sheath. The protein belongs to the immunoglobulin superfamily and might serve as cell adhesion molecule, a regulator of microtubule stability, and a mediator of interactions between myelin and the immune system (Johns and Bernard, 1999). Structural myelin proteins such as proteolipid protein and myelin basic protein are necessary for exact membrane-to-membrane spacing, whereas 2’3’-cyclic nucleotide 3’phosphodiesterase (CNP) and MAG are expressed at the periphery of the oligodendrocytes and the latter plays a role in linking the innermost periaxonal loop of oligodendrocytes with the axon (Lappe-Siefke et al., 2003). At the node of Ranvier axoglial proteins like contactin1 and neurofascin155/186 form glioaxonal junctions to keep sodium channels in the nodal region, which is critical for the efficient saltatory conduction of the action potential (Sherman et al., 2005).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128023952000195
Novel Therapies for Multiple Sclerosis
Emily V. Stevenson, … Alireza Minagar, in Multiple Sclerosis, 2016
The concept of remyelination as therapy for MS
The myelin sheath insulates axons of the CNS neurons to ensure that rapid transmission of electric impulses occurs across the nervous system. Within the CNS, the central myelin is generated by oligodendroyctes. MS lesions affect both gray and white matters, and both the inflammatory and degenerative arms of MS pathogenesis destroy the myelin sheath, oligodendrocytes, neurons, and their axons. Loss of the oligodendrocyte–myelin complex is a cardinal feature of MS neuropathology, which occurs continuously and relentlessly in MS (Compston & Coles, 2002). This demyelinating process is massive and widespread, and over time, overwhelms the remyelination process, which is intermediated by oligodendrocyte precursors. Restoration of the myelin sheath may save the neuronal–axonal unit from further degeneration and could improve impulse conduction. Therefore, the concept of activating or potentiating the process of remyelination in MS has fascinated many neuroscientists, and attempts have been made to develop agents which can facilitate remyelination. However, none of the currently FDA-approved therapies for MS have achieved this goal. A review of some of the experimental agents being tested for remyelination in MS is presented below.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128007631000026
Growth Factors in Development
Alya R. Raphael, William S. Talbot, in Current Topics in Developmental Biology, 2011
1 Introduction
The myelin sheath increases axonal conduction velocity by reducing capacitance of the axonal membrane and allowing saltatory conduction (Hodgkin, 1964; Stampfli, 1954). Thus, myelinated axons of small diameter can transmit information as rapidly as much larger unmyelinated axons. Myelin therefore is an evolutionary innovation that allows the nervous system to increase in speed and complexity without a corresponding increase in size and energy requirements. Although some invertebrate species have myelinated axons, myelin is ubiquitous among the gnathostomes (jawed vertebrates), and this adaptation has surely been essential for the formation of the large, complex nervous systems that distinguish the vertebrates from other groups (Bunge, 1968; Hartline and Colman, 2007).
Disruption of the myelin sheath underlies many debilitating diseases including Multiple Sclerosis, Charcot Marie Tooth disease, and others (Berger et al., 2006; McQualter and Bernard, 2007). Specialized glial cells, oligodendrocytes in the central nervous system (CNS) and Schwann cells in the peripheral nervous system (PNS), wrap their membranes many times around a segment of an axon to form the myelin sheath (Bunge, 1968; Geren and Raskind, 1953; Peters, 1964). Along its length, each axon is ensheathed by multiple myelin segments, which are separated by unmyelinated gaps called nodes of Ranvier (Bunge, 1968; Stampfli, 1954; Tasaki, 1959). Oligodendrocytes interact with and elaborate myelin sheaths around many different axons; in contrast, Schwann cells myelinate only one segment of one axon (Bunge, 1968).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123859754000073
Antimyelin-Associated Glycoprotein, Antimyelin Basic Protein, and Antiproteolipid Autoantibodies in Neurologic Diseases
Adi Vaknin-Dembinsky, … Dimitrios Karussis, in Autoantibodies (Third Edition), 2014
Abstract
The myelin sheath that wraps the neuronal axons in both the central and the peripheral nervous system (CNS, PNS) is composed of lipids and proteins. The proteinic part is the one that may be targeted by the immune system (by both its cellular and humoral arms: T and B cells and antibodies) in various neuroimmune conditions of the CNS and PNS. Proteins expressed mainly in the CNS myelin include proteolipid protein (PLP), myelin basic protein (MBP) and the quantitatively minor CNS protein, and myelin oligodendrocyte glycoprotein (MOG); some of them are present in both the CNS and PNS. PLP is the main protein of the CNS myelin, making up more than 50% of its components. MBP constitutes about 30% of the central myelin protein; it is localized on the cytoplasmic side of the myelin sheath, which makes it less accessible as an immunologic target. In contrast, the location of MOG at the outermost lamella of the CNS myelin membrane facilitates its targeting by autoantibodies. In the PNS, autoantibodies against myelin gangliosides are implicated in a variety of disorders, including sulfatide constituents of myelin-associated glycoprotein (MAG) in peripheral neuropathies associated with monoclonal gammopathies.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444563781000757
Peripheral Nervous System, Immunology of
Bernd C. Kieseier, Hans-Peter Hartung, in Encyclopedia of the Neurological Sciences, 2003
Protein Antigens
The myelin sheath is composed of three major proteins: P0, P1, and P2, all of which represent more than 70% of the total protein content. P0 accounts for more than 50% of total membrane protein in human PNS myelin, where it is exclusively found. It is physiologically involved in starting and stabilizing the compaction of the extracellular apposition of the myelin membrane in the PNS. P1 represents approximately 2–16% of all myelin proteins, and P2 can be found in large amounts in the PNS and also, to a lesser extent, in the central nervous system. Its primary localization is in the paranodal loops and in Schmidt–Lantermann incisures.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0122268709004548
Myelin Structure and Biochemistry
Matthew N. Rasband, … Joyce A. Benjamins, in Basic Neurochemistry (Eighth Edition), 2012
Publisher Summary
The myelin sheath is an extended and modified plasma membrane that is wrapped around the nerve axon in a spiral fashion. Myelin is an electrical insulator, although its function of facilitating conduction in axons has no exact analogy in electrical circuitry. The morphological distinction between white matter and gray matter is the one that is useful for the neurochemist. White matter is composed of myelinated axons, glial cells, and blood vessels. Gray matter contains, in addition, the nerve cell bodies with their extensive dendritic arborizations. The predominant element of white matter is the myelin sheath that comprises about 50% of its total dry weight and is responsible for the gross chemical differences between white and gray matter. In unmyelinated fibers, impulse conduction is propagated by local circuits of ion current that flows into the active region of the axonal membrane, through the axon, and out through adjacent sections of the membrane. These local circuits depolarize the adjacent piece of membrane in a continuous sequential fashion. In myelinated axons, the excitable axonal membrane is exposed to the extracellular space only at the nodes of Ranvier that is known as the location of sodium channels. Information concerning myelin structure is also available from electron microscope studies that visualize myelin as a series of alternating dark and less-dark lines (protein layers) separated by unstained zones (the lipid hydrocarbon chains).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123749475000109
The pathology of multiple sclerosis
Hans Lassmann, Hartmut Wekerle, in McAlpine’s Multiple Sclerosis (Fourth Edition), 2006
Immunological mechanisms of demyelination
The myelin sheath is a complex structure formed through spiral ensheathment of the axon by the oligodendrocyte plasma membrane (Bunge et al 1962). A single oligodendrocyte can form multiple segments, yet the number of myelin sheaths provided by a single cell depends upon axon and myelin thickness (see Chapter 10; A. Peters and Proskauer 1969). Biochemically, myelin sheaths are composed of lipids and protein. Major central nervous system myelin proteins are myelin basic protein and proteolipid protein. Both apparently have important functions in the stabilization of complex lipid layers. Minor myelin proteins – myelin associated glycoprotein, myelin oligodendrocyte glycoprotein and 2′,3′-cyclic nucleotide 3′-phosphodiesterase (CNPase) – may play a role in the axon–myelin interaction or as surface receptors of oligodendrocytes (Morell 1984; Quarles 1989).
In principle, all myelin proteins are potential target antigens for T-cell mediated encephalitogenic reactions. To be recognized by CD4 lymphocytes, these antigens must be released into the extracellular space and processed by antigen-presenting cells – principally perivascular macrophages or microglia but possibly also astrocytes. This type of T-cell mediated immune reaction appears responsible for the induction of inflammation although, alone, it is not capable of destroying the myelin sheaths (Wekerle et al 1986). The in vitro data indicate that myelin sheaths can be damaged by several immunological mechanisms. Oligodendrocytes have a limited capacity to express histocompatibility antigens and present antigen (S.C. Lee and Raine 1989; Lisak et al 1983; Mauerhoff et al 1988), although they express class I MHC molecules in the inflammatory background of active multiple sclerosis lesions (Höfteberger et al 2004). Thus, they may become a direct target for antigen-specific T-cell mediated cytotoxicity. In addition, myelin sheaths are particularly sensitive to cell-surface or soluble immunotoxins produced by lymphocytes or macrophages, such as TNF-α (Selmaj and Raine 1988; Zajicek et al 1992), lymphotoxin (Selmaj et al 1991b), complement (Scolding et al 1989b) and perforin (Scolding et al 1990). Alternatively, T lymphocytes can themselves destroy oligodendrocytes and myelin without the need for MHC-restricted antigen recognition (D’souza et al 1996b; M.S. Freedman et al 1991).
T-cell mediated cytotoxicity may be accomplished either through the release of cytotoxic granules or the activation of membrane-bound death receptors. The first pathway involves the liberation of perforin and granzymes from cytotoxic T cells. These are attached to target cells by the ‘immunological synapse’. Indeed, close contact of CD8 cells with a polar orientation of cytotoxic granules towards the surface of oligodendrocytes and axons can be found in the actively demyelinating lesions of multiple sclerosis (Neumann et al 2002). Cell destruction through death receptors involves the interaction of TNF-like receptors with their specific ligands. For example, activation of the Fas antigen by Fas ligand can trigger an intracellular death domain and induce apoptotic death of target cells. Fas expression has been described mainly on oligodendrocytes in chronic active lesions, whereas Fas ligand is expressed reciprocally on reactive microglia (Brosnan and Raine 1996; D’souza et al 1996b). In another study, widespread expression of Fas was described on all central nervous system cells whereas Fas ligand was mainly identified on oligodendrocytes and astrocytes (Dowling et al 1996). In addition, Fas-positive oligodendrocytes were taken up by reactive macrophages/microglia. No satisfactory explanation for these ambiguous results is apparent. Furthermore, the prominent expression of Fas and other members of the TNF receptor family on oligodendrocytes in multiple sclerosis lesions is not necessarily associated with apoptotic oligodendrocyte death (Bonetti and Raine 1997). Such resistance to apoptotic cell death may be due to activation of the NF-κB and c-jun transcription factors in oligodendrocytes within the lesions of multiple sclerosis (Bonetti et al 1999).
Demyelination may also follow the specific recognition and opsonization of myelin sheaths by antibodies present on the extracellular surface of myelin or oligodendrocytes (Bornstein and Appel 1961; Lassmann et al 1981b; Linington et al 1988). Thus far, however, only a few myelin antigens are known to be exposed at the extracellular surface, potentially serving as targets for antibody-mediated demyelination. Apart from myelin lipids such as galactocerebroside (Dubois-Dalcq et al 1970), myelin oligodendrocyte glycoprotein appears to be an important target antigen for antibody-mediated demyelination (Linington and Lassmann 1987; Linington et al 1988). In other patients, circulating antibodies against oligodendrocyte progenitor cells and surface antigens of neurons have been detected (Lily et al 2004; Niehaus et al 2000). Furthermore, high-affinity anti-DNA antibodies, which have been rescued from the intrathecal antibody response of patients with multiple sclerosis, were found to bind the surface of neuronal cells and oligodendrocytes (Williamson et al 2001). Destruction of antibody-opsonized myelin is mediated either by complement (Linington et al 1989; Piddlesden et al 1993a) or activated macrophages (Brosnan et al 1977; Scolding and Compston 1991) through interaction with their Fc receptors (Ulvestad et al 1994).
Apart from specific immunological processes, tissue may also be destroyed nonspecifically in inflammatory lesions by toxic molecules of activated effector cells, such as macrophages or microglia. Macrophages produce a spectrum of molecules that are lethal to cells and invading microorganisms or dissolve the extracellular matrix. Those that have been identified in actively demyelinating multiple sclerosis lesions include proteolytic (Anthony et al 1998; Cuzner and Opdenakker 1999; Cuzner et al 1996; R.L.P. Lindberg et al 2001; Scarisbrick et al 2002; Vos et al 2003) and lipolytic enzymes, reactive oxygen and nitrogen species (J.S. Liu et al 2001; K.J. Smith and Lassmann 2002; K.J. Smith et al 1999), complement components, cytotoxic cytokines (Probert et al 2000) and excitotoxins liberated in the lesions due to an altered glutamate homeostasis in neurons and glia (S.A. Lipton 1998; P. Werner et al 2001). These exert their toxic action nonselectively on all cellular components of the inflamed tissue. Certain cells and structures are, however, more vulnerable than others. Myelin sheaths and oligodendrocytes are particularly sensitive, and are destroyed by most of these toxins at concentrations far below those needed to injure other cells. Thus, macrophage-mediated inflammatory tissue damage in the central nervous system is always reflected by a pseudoselectivity of tissue injury – demyelination and oligodendrocyte loss being most pronounced, followed by some degree of axonal injury associated with nearly complete preservation of astrocytes and microglia cells. A key question for understanding the immunopathogenesis of multiple sclerosis lesions is therefore to identify the extent to which these mechanisms of demyelination are reflected in the various patterns of myelin and oligodendrocyte destruction in this disease.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780443072710500148