- Авторы
- Файлы
В последние годы классическое представление о рассеянном склерозе (РС) как об аутоиммунном заболевании центральной нервной системы (ЦНС), при котором доминирует иммунологически обусловленное повреждение миелина, претерпело значительные изменения. Изучены механизмы развития обострения РС. Это активация анергичных, неактивных СБ4+ Т-клеток вне ЦНС, проникновение их через гематоэнцефалический барьер (ГЭБ), а также образование комплекса, включающего соответствующий рецептор активированной Т-клетки и аутоантиген, связанный с молекулами II класса главного комплекса гисто-совместимости (ГКГ) на антигенпрезентирующих клетках, в качестве которых выступают макрофаги и клетки микроглии. Эти клетки секретируют провоспалительные цитокины (ИФН-у, ФНО-а, ЛФ-токсин и др.), которые ещё в большей степени индуцируют и поддерживают воспалительные реакции и усиливают нарушение проницаемости ГЭБ. Помимо активации клеточного звена, в патогенез РС вовлекается и гуморальное звено иммунитета, повышается активность системы комплемента. В результате каскада иммунологических и био-химических нарушений развивается повреждение миелина и олигодендроцитов. На более поздних этапах патологического процесса активируются неспецифические механизмы: фагоцитоз поврежденных структур и пролиферация глиальных элементов.
Однако помимо развития воспалительных реакций, демиелинизирующего процесса и глиальных нарушений в последние годы большое внимание при РС уделяют и вовлечению в процесс аксонов. Именно аксональное повреждение считают ответственным за развитие необратимого неврологического дефицита и трансформацию ремиттирующего течения во вторично-прогрессирующее с неуклонным нарастанием темпов инвалидизации пациентов, что позволило выделить аксональный компонент при РС. Постепенное повреждение аксонов, развивающееся вторично вследствие воспалительных реакций, начинается на ранних этапах; в результате кумулирующегося повреждения аксонов, которое достигает определённого порога, заболевание приобретает прогрессирующее течение с необратимым нарастанием неврологического дефицита.
В качестве наиболее вероятных причин деструкции аксонов при РС рассмотрены: непосредственное иммунологическое повреждение, воспалительные реакции и нарушение трофической поддержки миелина. Механизмом прямой иммунологической атаки аксонов при РС является экспрессия на них молекулы I класса ГКГ, что делает их уязвимыми к цитотоксическому влиянию OD8+ Т-лимфоцитов.
Показано, что развитие аксональной дегенерации, обусловленной воспалительными реакциями, может быть связано с несколькими механизмами. Так, при формировании очага демиелинизации нарушение проницаемости ГЭБ приводит к воспалительному отеку, что увеличивает внеклеточное давление, и может вызывать повреждение аксонов. Возбуждающая аминокислота глутамат, продуцируемая активированными макрофагами и микроглией, воздействуя на олигодендроглиальные рецепторы, является причиной токсического повреждения с последующим вовлечением аксонов. Активированные макрофаги и микроглия могут обусловливать аксональное повреждение также за счёт выделения провоспалительных цитокинов. Кроме этого, аксоны особенно подвержены дегенеративным изменениям при воздействии азота оксида, продуцируемого в больших концентрациях в месте развития воспалительных реакций. Нарушение функций митохондрий, развивающееся в данной ситуации, приводит к расстройству ионного гомеостаза с последующей кальцийопосредованной дегенерацией аксонального цитоскелета.
Однако дегенеративные изменения аксонов возможны и при хроническом демиелинизирующем процессе за счёт нарушения трофического влияния олигодендроглиоцитов и миелинаксональных взаимодействий. Другим важным аспектом аксонально-глиальных взаимодействий является воздействие трофических факторов.
Таким образом, нарушение аксонально-глиальных взаимосвязей, сопровождающееся изменением распределения ионных каналов и их проницаемости с расстройством кальциевого гомеостаза в аксоне, приводит к активации кальций-зависимых протеаз, деградации цитоскелета, уменьшению аксонального транспорта и, наконец, к повреждению аксонов, что является универсальным механизмом и при других заболеваниях ЦНС. Развитие неврологического дефицита при рассеянном склерозе имеет два патогенетических механизма: обратимая острая воспалительная демиелинизация, доминирующая при обострении заболевания при ремиттирующем РС с последующим формированием ремиссии, и преобладающая необратимая аксональная дегенерация при вторично-прогрессирующем течении. При этом как демиелинизация, так и аксональное повреждение при РС вызывают нарушение проведения нервного импульса, что является причиной непосредственного развития клинических расстройств.
Библиографическая ссылка
Парахонский А .П. АКСОНАЛЬНЫЙ КОМПОНЕНТ В ПАТОГЕНЕЗЕ РАССЕЯННОГО СКЛЕРОЗА // Современные наукоемкие технологии. – 2009. – № 4.
– С. 64-65;
URL: https://top-technologies.ru/ru/article/view?id=26320 (дата обращения: 03.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
При рассеянном склерозе иммунная система по трагической ошибке разрушает миелиновую оболочку нервных волокон в головном и спинном мозге. В результате этого разные системы организма перестают получать сигналы из головного мозга, и возникают симптомы болезни. Впрочем, способность ясно мыслить при этом сохраняется. Еще недавно большинство пациентов с рассеянным склерозом быстро оказывались прикованными к постели. Однако за последние десятилетия врачам и исследователям удалось достичь очень большого прогресса. В этой статье мы поговорим о том, у кого и почему возникает рассеянный склероз, как его диагностируют, и обсудим современные методы лечения.
Аутоиммунные заболевания
Мы продолжаем цикл по аутоиммунным заболеваниям — болезням, при которых организм начинает бороться сам с собой, вырабатывая аутоантитела и/или аутоагрессивные клоны лимфоцитов. Мы рассказываем о том, как работает иммунитет и почему иногда он начинает «стрелять по своим». Некоторым самым распространенным заболеваниям будут посвящены отдельные публикации. Для соблюдения объективности мы пригласили стать куратором спецпроекта доктора биологических наук, чл.-корр. РАН, профессора кафедры иммунологии МГУ Дмитрия Владимировича Купраша. К тому же у каждой статьи есть свой рецензент, более детально вникающий во все нюансы.
Рецензентом этой статьи стал Алексей Анатольевич Белогуров — старший научный сотрудник лаборатории биокатализа Института биоорганической химии РАН, кандидат химических наук, руководитель группы по изучению биохимических основ аутоиммунной нейродегенерации.
Партнеры проекта — Михаил Батин и Алексей Маракулин (Open Longevity / «Объединенные Консультанты Финправо»).
Рассеянный склероз — серьезное и непредсказуемое заболевание, которое может возникнуть в любом возрасте, но чаще всего «под удар» попадают молодые люди в самую активную фазу жизни. И хотя эта болезнь может серьезно изменить привычный ход вещей, она всё же оставляет пациентам возможность жить полной жизнью, не останавливаться и не смиряться. Пример вдохновляющей жизненной позиции при диагнозе «рассеянный склероз» подает Ирина Ясина — журналист, публицист, правозащитник [1], [2]. В 2012 году она издала автобиографическую повесть «История болезни. В попытках быть счастливой», в которой описала свою болезнь как «сущее, которое изменило мою жизнь, не исковеркало, не обворовало, а медленно и неуклонно выбивало старые привычки, устоявшиеся интересы, меняло вкусы и отношение к дому, к вещам, к любви, к чужим слабостям. Отнимая одно, всегда щедро давало другое». Даже с такой тяжелой болезнью, как рассеянный склероз, человек может справляться, не теряя желания и способности сохранять активный образ жизни. Во многом это стало возможным благодаря достижениям современной медицины. В этой статье мы обсудим, у каких людей и при каких обстоятельствах может возникать рассеянный склероз, каковы механизмы развития болезни и способы ее лечения. Поговорим и о том, где искать хорошие источники информации о заболевании, и обсудим пациентские организации.
Что такое рассеянный склероз?
Рассеянный склероз (РС) впервые описал в 1868 году французский невролог Жан Мартен Шарко (Jean-Martin Charcot). Сейчас это одно из наиболее распространенных хронических заболеваний центральной нервной системы (ЦНС), поражающее людей практически всех возрастов во многих частях света, однако отдающее «предпочтение» молодым европеоидным женщинам, проживающим в северных широтах. При РС иммунная система организма атакует свой собственный миелин — оболочку, окружающую аксоны нервных клеток и влияющую на скорость передачи по ним электрического импульса (рис. 1) [3]. Оставшись без защитного миелинового слоя, волокна нервных клеток становятся уязвимыми и могут погибнуть. Снижение скорости нервных импульсов и гибель нервных волокон приводят к появлению неврологических симптомов (см. раздел «Симптомы рассеянного склероза»). Учитывая, что разные доли головного мозга отвечают за различные функции организма, в зависимости от того, в каком месте произошла демиелинизация аксонов, будут проявляться разные симптомы. Именно поэтому РС называют аутоиммунным (иммунная система работает против собственного организма), демиелинизирующим (разрушается миелин) и нейродегенеративным (повреждаются нервные волокна) заболеванием.
Рисунок 1. Здоровый нейрон и нейрон с поврежденным миелином. Скорость передачи электрического импульса по миелинизированным аксонам достигает 100 м/с, тогда как по немиелинизированным волокнам импульсы распространяются в 5–50 раз медленнее.
Так как демиелинизация и нейродегенерация происходят постепенно, развивающийся РС может длительное время никак не проявляться. Этот скрытый период болезни может продолжаться вплоть до нескольких лет. Диагностика РС достаточно сложна и требует времени, а кроме того, нет надежных методов прогнозирования заболевания и его лечения. Всё это наряду с широким распространением делает РС одним из самых социально значимых заболеваний, а его изучение — одной из важнейших медико-биологических задач.
Очаги демиелинизации при РС выглядят как уплотнения, которые врачи впервые обнаружили в 19 веке в мозге пациентов, умерших от РС. Эти очаги получили название «склероз», что в переводе с греческого означает «рубец». Сейчас патологи называют их «бляшками рассеянного склероза», и они являются важнейшим признаком заболевания. Размеры бляшек варьируют от нескольких миллиметров до нескольких сантиметров, и с течением болезни очаги демиелинизации могут появляться во всё новых местах ЦНС — рассеиваться. Именно поэтому болезнь называется «рассеянный склероз».
Факторы риска и эпидемиология
Большинство заболеваний человека считаются комплексными, то есть развивающимися вследствие взаимодействия генетических, эпигенетических и внешних факторов. К таким заболеваниям относится и РС. Он возникает у людей с генетической предрасположенностью в результате воздействия на организм факторов внешней среды, запускающих патологические механизмы. Генетическая предрасположенность отвечает за риск развития РС только на 30%. Оставшиеся 70% связаны с вкладом негенетических факторов. Ниже мы выясним, что может влиять на риск развития РС, однако стόит сразу упомянуть, что однозначно предсказать возникновение болезни по этим факторам невозможно.
Генетика и эпигенетика
Наиболее убедительно роль наследственности показана в близнецовых исследованиях. Если болезнь находится под генетическим контролем, то РС должен проявляться у однояйцевых близнецов (с полностью идентичным геномом) чаще, чем у разнояйцевых (с неидентичными геномами). Для однояйцевых близнецов вероятность развития РС составляет 25%, а для двойняшек — только 5% [4]. Семейные случаи РС достаточно редки (в среднем около 5%), и чем более далеких родственников мы рассматриваем, тем ниже риск заболевания.
За исключением семейных случаев, РС не передается по наследству. С вероятностью 98% у ребенка, родитель которого болен РС, болезнь НЕ разовьется. Однако наследуется генетическая предрасположенность к заболеванию: варианты генов (аллели), определяющие предрасположенность к РС, могут передаваться от родителей детям. Предрасположенность к РС складывается из эффекта нескольких генов, вклад каждого из которых невелик. У разных пациентов за развитие болезни могут отвечать разные комбинации генов. Таким образом, РС — это типичное полигенное заболевание [5].
Но для того чтобы развился РС, недостаточно одной генетической предрасположенности. Необходимо влияние и остальных факторов риска, к которым, помимо воздействий внешней среды (см. ниже), относят эпигенетическую регуляцию [6], [7], [8]. Сигналы из внешней среды с помощью эпигенетических механизмов (ковалентной модификации ДНК и/или гистонов и действия малых регуляторных РНК) определяют, какие именно гены будут активными, а какие — нет.
Возраст, пол и этническая принадлежность
РС — это болезнь молодых. Пик заболеваемости приходится на самый активный период жизни человека — 20–40 лет. Однако болезнь может развиться даже у детей. Как правило, чем позже начинается РС, тем тяжелее он протекает. Женщины заболевают примерно в три раза чаще мужчин, но зато у мужчин чаще развивается более тяжелая форма болезни.
Повышенная заболеваемость среди женщин характерна не только для РС, но и для некоторых других аутоиммунных патологий (например, ревматоидного артрита и системной красной волчанки [13]). Предполагают, что дело тут во влиянии половых гормонов, которые, помимо физиологических и поведенческих функций, регулируют еще и иммунный ответ. Например, у беременных пациенток с РС состояние существенно улучшается, однако после родов течение болезни вновь ухудшается, что может быть связано с падением уровня эстрогенов. Беременность относится к одним из самых сильных индукторов иммунологической толерантности, то есть способности «не замечать» возможные патогены. Гормоны беременности способствуют резкому увеличению количества регуляторных T- и B-лимфоцитов, которые ослабляют развитие иммунного ответа и снижают угрозу отторжения плода организмом матери [14]. Эти же клетки формируют временную толерантность к собственным антигенам (аутоантигенам) при РС, ослабляя проявления болезни.
РС встречается в большинстве этнических групп: европейской, африканской, азиатской, латиноамериканской. Заболеванию практически не подвержены эскимосы, венгерские цыгане, норвежские саамы, коренные жители Северной Америки, Австралии и Новой Зеландии и некоторые другие.
Факторы внешней среды
Территория проживания. В мире насчитывается около 2,5 млн пациентов с РС, из которых в России, по оценкам экспертов, проживает примерно 200 тысяч. Чаще всего РС встречается у жителей Северной Европы и Канады (рис. 2).
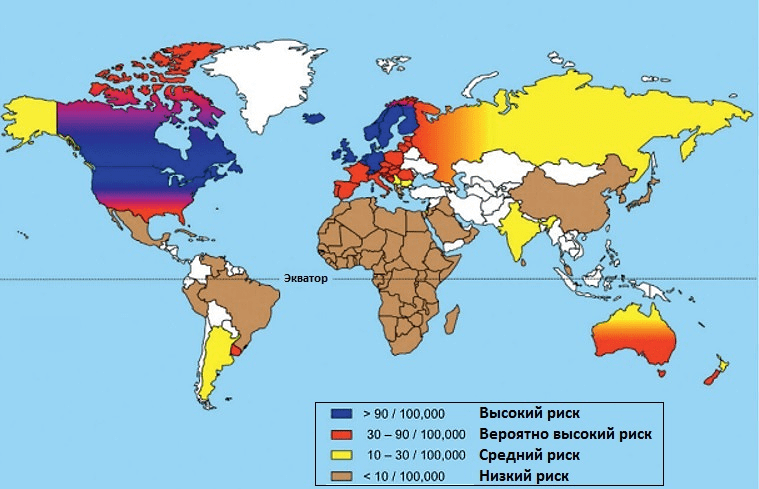
Рисунок 2. Распространенность рассеянного склероза в мирe. Самая высокая заболеваемость РС зафиксирована в Канаде: 291 случай на 100 000 населения. В России частота РС составляет 30–70 случаев на 100 000 населения (зона высокого и среднего риска). Чтобы увидеть рисунок в полном размере, нажмите на него.
Частота РС увеличивается по мере удаления от экватора на север. Чем дальше территория от экватора, тем меньше она получает солнечного света. Под действием ультрафиолетового излучения в коже синтезируется витамин D, который затем превращается в свою активную форму — кальцитриол. Это вещество обладает гормональной активностью и участвует в формировании костной ткани, регуляции клеточного деления и дифференцировки иммунных клеток. Дефицит витамина D сказывается на дифференцировке регуляторных Т-лимфоцитов, сдерживающих иммунный ответ на аутоантигены. Но, хотя низкий уровень витамина D повышает вероятность развития РС [15], это вовсе не означает, что постоянный прием витамина D предотвратит болезнь. Тем не менее у пациентов с РС, получавших этот витамин в качестве пищевой добавки, облегчалось течение болезни [16].
Установлено, что миграция людей из одного географического района в другой влияет на риск развития РС [17]. Иммигранты и их потомки, как правило, «принимают на себя» уровень риска, характерный для нового места жительства, причем, если переселение произошло в раннем детстве, новый риск дает о себе знать сразу, а если это случилось после пубертатного периода, то эффект проявится только в следующем поколении. Предполагают, что этот эффект опосредован изменением уровня гормонов во время полового созревания.
Инфекции. Риск развития РС могут повысить и инфекционные агенты, в первую очередь некоторые вирусы: вирус Эпштейна-Барр (вирус простого герпеса (ВПГ) типа 4), цитомегаловирус (ВПГ типа 5), ВПГ типа 6, некоторые ретро- и полиомавирусы [18]. Особое внимание исследователи уделяют вирусу Эпштейна-Барр [19], [20], [21], вызывающему мононуклеоз. У детей раннего возраста это заболевание, как правило, протекает легко или даже незаметно, в старшем возрасте клинические проявления неспецифичны, а к 40 годам 90% людей уже заражены этим вирусом, но совсем не обязательно из-за него болели. Однажды попав в организм, вирус остается там навсегда. Один из возможных механизмов провокации РС связан с проникновением вируса в ЦНС (в частности, в головной мозг), где он атакует клетки, производящие миелин, — олигодендроциты. Это может вызвать иммунный ответ, при котором CD8+ Т-лимфоциты, атакуя вирус, заодно повреждают олигодендроциты и нейроны «дружеским огнем». Дело тут может быть в молекулярной мимикрии — когда вирус «подделывается» под некоторые белки организма (например, миелин). Однако эта теория всё еще считается спорной.
Кишечный микробиом. Несмотря на то, что кишечный микробиом — не совсем фактор внешней среды, мы рассмотрим его в этом разделе, т.к. изменение его состава из-за внешних обстоятельств может быть связано с возникновением аутоиммунитета. Практически общепризнано, что наш кишечный микробиом активно участвует в развитии иммунной системы и поддержании ее работы [22]. Бактерии, населяющие кишечник, помогают иммунным клеткам распознавать антигены и игнорировать аутоантигены. В исследованиях на модельных животных и человеке показано, что иногда по роковой случайности антигены микроорганизмов пищеварительного тракта, которые для иммунных клеток служат этакими тренажерами по распознаванию бактериальных антигенов, провоцируют запуск аутоиммунных механизмов и прогрессирование демиелинизации [23], [24].
Другие внешние факторы риска — курение и диета. Курение увеличивает как риск возникновения болезни, так и скорость ее прогрессирования, а диета с преобладанием насыщенных/животных жиров может повышать риск возникновения РС. Впрочем, эти результаты пока лучше считать предварительными.
Патогенез рассеянного склероза
Что же происходит внутри организма пациента с РС? В этой статье речь пойдет только о ремиттирующей форме РС (см. ниже), в случае прогрессирующего РС механизмы несколько отличаются [25]. Чтобы лучше понимать изложенные далее молекулярные иммунологические детали, рекомендуем сначала ознакомиться с вводной статьей этого цикла: «Иммунитет: борьба с чужими и… своими» [26].
В какой момент начинается болезнь? Оказывается, несмотря на то что при РС повреждается прежде всего ЦНС, запуск аутоиммунных процессов происходит не в ней [27]. Активация аутореактивных Т- и В-лимфоцитов происходит на периферии — в первую очередь в лимфоузлах.
Откуда в организме аутореактивные лимфоциты?
Аутореактивные лимфоциты обладают повышенным аутоиммунным потенциалом, то есть готовы «палить по своим», уничтожая клетки собственного организма. Они всегда присутствуют в организме здоровых людей, но находятся под строгим контролем иммунной системы. Дело в том, что все Т-лимфоциты проходят «обучение» в тимусе; важной частью этого обучения является так называемая негативная селекция: иммунные клетки, нацеленные на аутоантигены, просто уничтожаются. Смысл этой операции заключается как раз в том, чтобы предотвратить аутоиммунные реакции, но несовершенство механизмов обучения приводит к тому, что часть Т-лимфоцитов, распознающих аутоантигены, всё-таки покидает пределы тимуса и может стать причиной неприятностей.
А теперь поэтапно разберем механизмы развития РС.
Первичная активация лимфоцитов
Для того чтобы аутореактивные лимфоциты смогли добраться до ЦНС, сначала должна произойти их активация вне ЦНС (рис. 3) [28]. Это позволит им преодолеть защитные механизмы головного мозга. Сигналом к первичной активации аутореактивных клеток служит презентация им антигена или аутоантигена антигенпрезентирующими клетками (АПК). Активировать аутореактивные Т- и B-лимфоциты могут бактериальные суперантигены — вещества, которые вызывают массовую неспецифическую активацию. Т-лимфоциты могут активироваться и по механизму молекулярной мимикрии (см. выше), а также собственными антигенами, иммуногенность которых повышена, например, при хроническом воспалении.
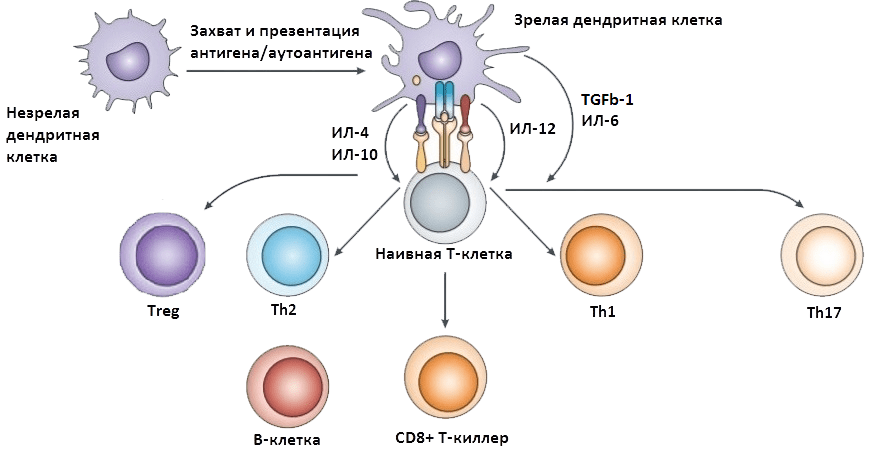
Рисунок 3. Первичная (периферическая) активация иммунных клеток. Незрелая антигенпрезентирующая клетка активируется при встрече с антигеном или аутоантигеном. Это приводит к нарушению баланса цитокинов, поддерживаемого Т-хелперами 2 типа (Th2) и регуляторными Т-клетками (Treg). В условиях повышенной продукции воспалительных цитокинов наивные T-лимфоциты, распознав антиген, дифференцируются под действием интерлейкина-12 (ИЛ-12) предпочтительно в Т-хелперы 1 типа (Th1), а под влиянием ИЛ-6 и трансформирующего ростового фактора бета 1 (transforming growth factor beta 1, TGFb-1) — в Т-хелперы 17 типа (Th17). Th1 вырабатывают интерферон-γ и фактор некроза опухоли (ФНОa), а Th17 секретируют ИЛ-17; эти молекулы — мощные воспалительные цитокины. Распознав антиген, под действием ИЛ-12 также активируются CD8+ T-киллеры. При взаимодействии с антигеном или аутоантигеном активированный B-лимфоцит становится источником цитокинов, необходимых для активации патологических Th1 и Th17. Кроме того, из него образуются плазматические клетки, которые секретируют аутоантитела к компонентам миелина. Круг замыкается: активированные аутореактивные Т- и В-лимфоциты сами продуцируют цитокины — мощные индукторы воспаления. При определенных условиях такие клетки обретают способность мигрировать в ЦНС. Чтобы увидеть рисунок в полном размере, нажмите на него.
Активация аутореактивных Т- и B-лимфоцитов приводит к преобладанию патологических клеток над популяциями Тreg и Тh2, поддерживающими иммунологическое равновесие. Патологические клетки создают «воспалительный фон», необходимый для развития аутоиммунного повреждения, и сами приобретают способность воспринимать специальные сигналы, позволяющие им мигрировать в ЦНС, где они смогут нанести свой главный удар.
Отмена привилегий: как аутореактивные лимфоциты проникают в головной мозг
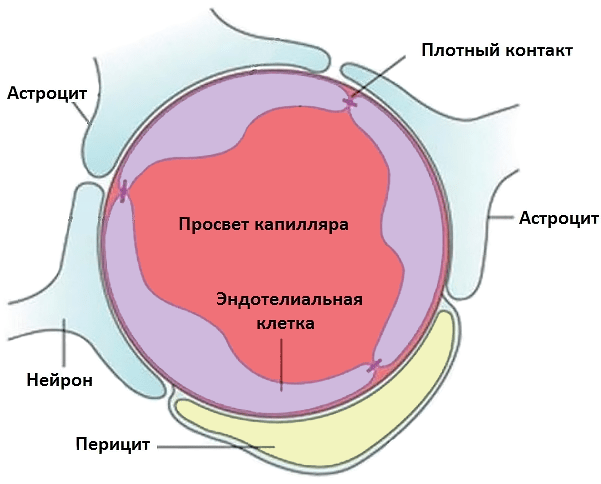
Многочисленные эксперименты показали, что инициировать иммунный ответ в ЦНС гораздо труднее, чем в других структурах тела: головной мозг называют иммунологически привилегированным органом [29]. С аутоантигенами нервной системы история очень интересная: во время обучения в тимусе Т-лимфоциты просто не встречаются с некоторыми из них (включая миелин), а значит, не учатся их распознавать (игнорировать) [30]. Организм так пытается предотвратить развитие иммунного ответа в головном мозге. Кроме того, Т-лимфоциты не способны распознавать аутоантигены здоровой ЦНС, так как в ее клетках синтезируется очень мало молекул главного комплекса гистосовместимости типов I и II, необходимых для презентирования. Еще одна линия защиты головного мозга — гематоэнцефалический барьер (ГЭБ), изолирующий ЦНС от кровеносного русла (рис. 4).
Рисунок 4. Строение капилляра головного мозга и структура гематоэнцефалического барьера. ГЭБ состоит из эндотелиальных клеток, соединенных плотными контактами, в комплексе с перицитами (компоненты сосудистой стенки) и астроцитами со стороны ЦНС. Эта «защитная броня» не пускает в ЦНС ненужные молекулы и иммунные клетки.
Сосуды головного мозга здоровых людей непроницаемы для циркулирующих в крови клеток. Однако некоторые иммунные клетки всё же способны преодолевать ГЭБ. Спинномозговую жидкость (ликвор) от кровеносного русла отделяет гематоликворный барьер. Т-лимфоциты в рамках иммунологического надзора «патрулируют» ликворосодержащие анатомические пространства головного и спинного мозга. Если в ЦНС всё в порядке, клетки уходят обратно в кровеносное русло через сосудистое сплетение. Из этого следует, что изоляция ЦНС не абсолютна.
Следующий (после первичной активации аутореактивных клеток) ключевой этап развития РС — увеличение проницаемости ГЭБ. Под действием воспалительных цитокинов, производимых активированными клетками Th1 и Th17, происходит целая череда роковых событий:
- различные иммунные клетки начинают производить хемокины (цитокины, регулирующие миграцию клеток иммунной системы), которые «созывают» лимфоциты в капилляры головного мозга;
- эндотелиальные клетки производят больше молекул адгезии на своей поверхности, что приводит к «заякориванию» лимфоцитов на стенках сосудов;
- развивающееся воспаление усиливает синтез ферментов (матриксных металлопротеиназ), которые нарушают плотные контакты в эндотелии, в результате чего в ГЭБ появляются бреши, облегчающие массовую миграцию патологических клеток из сосудистого русла в ЦНС.
Вторичная активация лимфоцитов
Итак, активированные Т- и В-лимфоциты, специфичные к компонентам миелина, преодолев ГЭБ, попадают в ЦНС, где во множестве представлены их мишени. В ЦНС миелиновая оболочка аксонов сформирована мембраной специализированных клеток — олигодендроцитов. Их отростки накручиваются на аксон по спирали наподобие изоляционной ленты [3]. С химической точки зрения миелин — это комплекс липидов (70–75%) с белками (25–30%). И именно белки миелина становятся основными аутоантигенами при РС. Активированные на периферии лимфоциты продолжают синтезировать воспалительные цитокины, которые, в свою очередь, активируют резидентные АПК — микроглиальные клетки и астроциты, которые презентируют аутоантигены миелина Т-хелперам, попавшим в ЦНС (рис. 5) [31]. Это и есть сигнал к повторной (вторичной) активации.

Рисунок 5. Основные стадии патогенеза РС. В ЦНС активированные Т- и В-лимфоциты, специфичные к компонентам миелина, наконец встречаются со своими мишенями. Из-за повсеместного воспалительного фона усиливается синтез молекул главного комплекса гистосовместимости, что ведет к активному презентированию CD4+ T-лимфоцитам аутоантигенов миелина. Так запускается повторная (вторичная) активация. Активированные Th1 и Th17 синтезируют воспалительные цитокины, которые активируют микроглию и макрофаги. Последние начинают усиленно поглощать аутоантигены миелина и повторно их презентировать. Кроме того, активированные макрофаги синтезируют активные формы кислорода (O2●) [32], монооксид азота (NO●), глутамат, ФНОa — нейротоксические вещества, напрямую повреждающие миелиновую оболочку. Одновременно с этим В-лимфоциты синтезируют антитела к белкам и липидам миелиновой оболочки. Эти антитела активируют комплекс белков, который называется системой комплемента. В результате образуется мембраноатакующий комплекс, повреждающий миелиновую оболочку. Активированные CD8+ Т-киллеры, специфичные к компонентам миелина, способны напрямую разрушать миелин, усугубляя повреждения в ЦНС. Разбушевавшиеся аутоиммунные процессы ведут к обострению РС. Противоборствуя им, лимфоциты субпопуляций Th2 и Treg продуцируют противовоспалительные цитокины (ИЛ-4, ИЛ-10, TGFb-1), а также факторы ремиелинизации (фактор роста нервов и нейротрофический фактор головного мозга), помогают сдержать аутоиммунное воспаление в ЦНС, давая надежду на выход из обострения и установление ремиссии. Чтобы увидеть рисунок в полном размере, нажмите на него.
[31], рисунок адаптирован
Повторно активированные патологические клетки продолжают усиленно вырабатывать воспалительные цитокины, которые подстегивают презентацию аутоантигенов ЦНС. Кроме того, активированные макрофаги синтезируют разнообразные нейротоксические соединения, а В-лимфоциты — антитела к белкам и липидам миелиновой оболочки, повреждающие эту оболочку. В то же время Treg и Тh2 пытаются сохранить иммунологическое равновесие.
Нейродегенерация в центральной нервной системе
Нейродегенерация — это гибель нервных клеток, приводящая в конечном итоге к полной остановке передачи нервного импульса. При РС она развивается независимо от аутоиммунного воспаления [33]. Так, нейровизуализация (магнитно-резонансная томография, МРТ) фиксирует признаки нейродегенерации уже на ранних стадиях болезни.
Существует несколько возможных механизмов, ведущих к нейродегенерации при РС. Один из них — вызываемая глутаматом эксайтотоксичность, приводящая к гибели олигодендроцитов и нейронов. Глутамат — важнейший возбуждающий медиатор ЦНС [34] — сам по себе токсичен, и после того как выполнит свою функцию, должен быстро удаляться. Однако при РС по разным причинам этого не происходит. Более того, активированные T-лимфоциты сами служат источником глутамата. Не удивительно, что в головном мозге пациентов с РС обнаруживают повышенное его содержание.
Еще один механизм связан с перераспределением ионных каналов и изменением их проницаемости в аксонах нейронов, что приводит к нарушению ионного баланса, а для аксона заканчивается повреждением и гибелью.
И наконец, причиной нейродегенерации может стать нарушение баланса факторов ремиелинизации (фактора роста нервов и нейротрофического фактора головного мозга), необходимых для выживания олигодендроцитов и нейронов.
Перечисленные выше процессы могут вести к нейродегенерации, из-за которой нарушается передача нервного импульса и развивается характерная для РС симптоматика.
***
Итак, описанная череда патологических событий приводит к образованию на нервных волокнах участков демиелинизации, гибели олигодендроцитов и нейродегенерации. Снижается скорость передачи нервного импульса от нейрона к нейрону, в результате чего разные системы организма перестают получать сигналы из головного мозга, и возникают симптомы заболевания.
Cимптомы рассеянного склероза и постановка диагноза
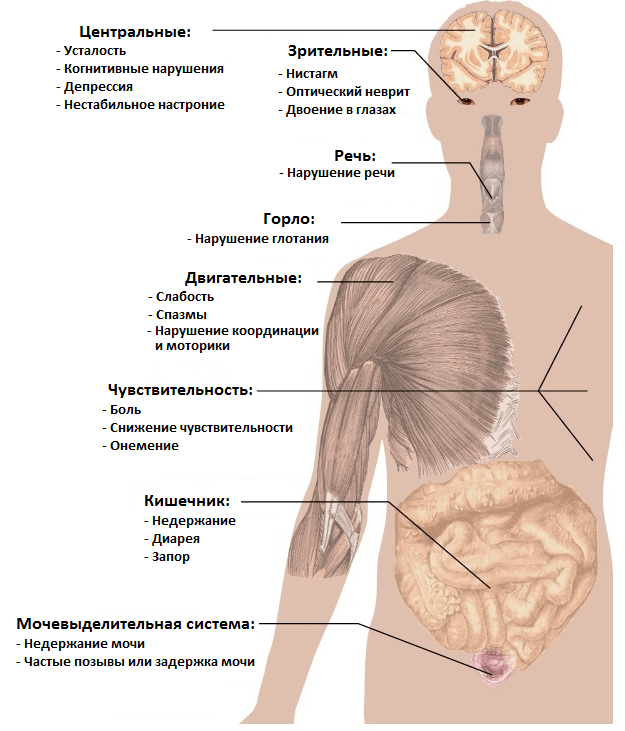
То, как именно проявится РС, зависит от места и степени повреждения нервных волокон. Поэтому симптомы РС носят неврологический характер (рис. 6) и неспецифичны. Иными словами, они свойственны и ряду других неврологических патологий, а потому прямо на РС не указывают. Иногда пациенты ретроспективно отмечают эпизод(ы) появления тех или иных симптомов за несколько месяцев/лет до первого обращения к врачу. Некоторые из таких отдаленных симптомов в молодом возрасте зачастую списываются на усталость, последствия простуды и т.д. и не воспринимаются всерьез.
Рисунок 6. Основные симптомы рассеянного склероза.
Диагностика
Диагноз «рассеянный склероз» должен быть доказан. Ни один из симптомов, показателей физикального исследования или лабораторных тестов сам по себе не подтверждает наличие у человека РС. У пациентов с КИС врач может только заподозрить РС. Главный инструмент для постановки диагноза — нейровизуализация. Если в головном мозге пациента с КИС есть очаги демиелинизации (по данным МРТ), такой пациент имеет высокие шансы испытать второй эпизод неврологических симптомов с последующей постановкой диагноза «достоверный рассеянный склероз». Если на снимках пациента с КИС бляшек нет, то вероятность развития РС невелика. Для постановки диагноза «достоверный рассеянный склероз» врачу необходимо одновременно:
- найти признаки демиелинизации по крайней мере в двух разных областях ЦНС (рассеяние в пространстве);
- показать, что бляшки появились с разницей во времени;
- исключить все другие возможные диагнозы.
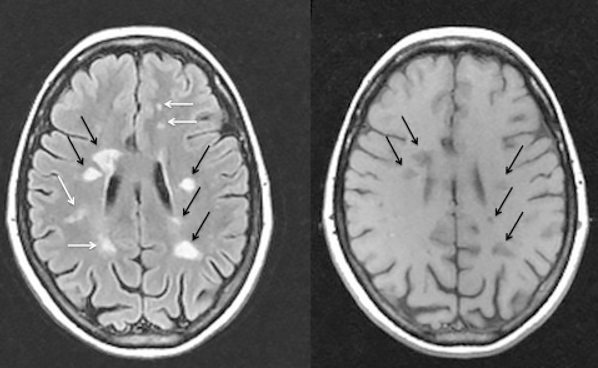
Таким образом, основным критерием достоверного РС является рассеяние очагов демиелинизации в пространстве и времени. После выявления на томограмме первого очага следующие снимки делают с интервалом 6 месяцев до появления второго очага (рис. 
Рисунок 8. Магнитно-резонансные томограммы головного мозга пациента с рассеянным склерозом в разных режимах съемки. Черными и белыми стрелками показаны очаги демиелинизации (бляшки).
Лечение рассеянного склероза
Препараты, изменяющие течение рассеянного склероза
Рассеянный склероз требует пожизненного лечения. Если раньше всё сводилось к симптоматической терапии и попыткам подавить обострения заболевания, то в последние 20 лет, благодаря накопленным знаниям о механизмах развития болезни, появились препараты, изменяющие течение РС (ПИТРС; в англоязычной литературе их называют disease modifying treatments). Все ПИТРС снижают активность аутоиммунного воспаления и замедляют нейродегенерацию (см. врезку); их действие направлено на формирование у пациентов устойчивой и долгой ремиссии. Незамедлительное назначение ПИТРС сразу после постановки диагноза повышает шансы на успешное лечение.
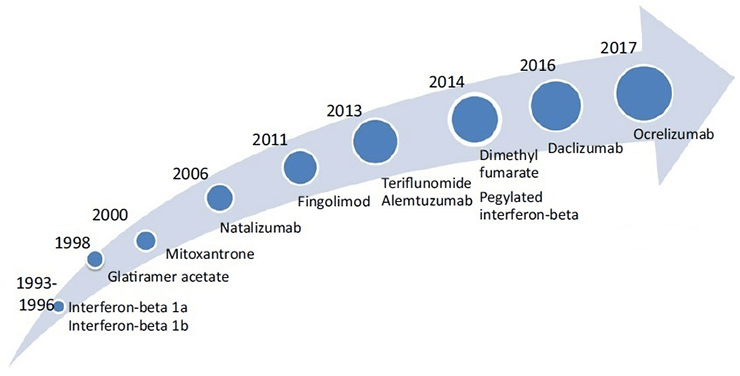
В настоящее время в мире для лечения РС одобрено более 10 ПИТРС (рис. 9) [35]. Все они с разной степенью эффективности и риска возникновения побочных эффектов применяются для лечения ремиттирующей формы РС, некоторые — для лечения вторично-прогрессирующей формы. В марте 2017 года Управление по контролю качества продуктов питания и лекарственных средств США (FDA) одобрило первый препарат для лечения первично-прогрессирующего РС — окрелизумаб (ocrelizumab), эффективность которого была подтверждена клиническими испытаниями [36].
Рисунок 9. Препараты для лечения РС, одобренные FDA и/или EMA (Европейским агентством по лекарственным средствам).
Наиболее безопасными препаратами для лечения РС остаются интерферон-β (ИФН-β) и глатирамера ацетат (ГА), хотя их эффективность сильно варьирует у разных пациентов. Новые лекарства более эффективны, однако чем эффективнее препарат, тем выше вероятность побочных эффектов и развития осложнений.
Новые препараты для лечения рассеянного склероза
Российские исследователи под руководством академика РАН Александра Габибовича Габибова [37] из Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова сейчас разрабатывают новое лекарство для лечения РС, которое уже прошло две фазы клинических испытаний [38]. Препарат создан с использованием липосом — искусственных липидных пузырьков, содержащих специально отобранные фрагменты миелина (пептиды) и адресно доставляющих эти фрагменты в антигенпрезентирующие клетки. По всей видимости, презентирование пептидов из липосом активирует регуляторные клетки, способные подавлять аутоиммунное воспаление в ЦНС. Во второй фазе клинических испытаний новый экспериментальный препарат вводили пациентам с ремиттирующим и вторично-прогрессирующим РС, которым терапия препаратами первой линии не помогла. В результате зафиксировали стабилизацию состояния пациентов, хорошую переносимость и безопасность препарата. Эти многообещающие результаты позволяют надеяться, что в России будет одобрено новое средство для лечения РС.
Другой разрабатываемый подход направлен на активное восстановление поврежденного миелина в ЦНС. На поверхности олигодендроцитов есть белок LINGO-1, который блокирует способность этих клеток дифференцироваться и миелинизировать аксоны. В исследованиях на модельных животных показано, что моноклональные антитела блокируют LINGO-1 и таким образом обеспечивают восстановление миелина. В первой фазе клинических испытаний показана эффективность, безопасность и хорошая переносимость препарата [39]. Иной способ восстановления миелина при РС связан с активацией сигнальных путей, запускающих его синтез. Обеспечение адекватной ремиелинизации, по всей вероятности, станет частью арсенала терапии РС в будущем.
Еще одним кандидатом на роль лекарства является биотин (витамин H), высокие дозы которого, как показывают клинические испытания [40], [41], снижают темпы развития РС. Дело тут в том, что это вещество участвует в регуляции энергетического обмена и синтезе липидов, необходимых для продукции миелина олигодендроцитами. Однако ранее в исследованиях на животных моделях сообщалось о возможном тератогенном эффекте биотина, так что его судьба как лекарства при РС пока не определена.
Лечение рассеянного склероза стволовыми клетками
Аутологичная трансплантация гемопоэтических стволовых клеток
Одним из перспективных подходов к лечению РС считают «перезагрузку» иммунной системы. Идея основана на том, что изменения, приводящие к появлению патологических лимфоцитов, провоцирующих РС, происходят не на уровне стволовых клеток, а гораздо позже, при их дифференцировке. Это значит, что если «перезапустить» процесс, уничтожив опасные лимфоциты и позволив иммунной системе заново восстановить свои клетки, то можно достичь серьезных улучшений.
К сожалению, повлиять на патологические изменения, уже произошедшие в организме пациента с РС, невозможно, но есть шанс затормозить или остановить процесс демиелинизации. Однако перезапуск иммунной системы довольно опасен, так как требует введения в организм потенциально смертельных токсических веществ, уничтожающих все иммунные клетки. После этого пациенту проводят трансплантацию собственных, полученных заранее, гемопоэтических стволовых клеток (дающих начало клеткам крови) [42]. Это должно привести к полному обновлению пула миелоидных и лимфоидных клеток и перенастройкам иммунологической толерантности.
Такой подход, называемый аутологичной трансплантацией гемопоэтических стволовых клеток (АТГСК), изначально был разработан гематологами для лечения лейкозов, но уже достаточно давно исследуется в отношении РС. Пока что АТГСК рассматривают как своего рода крайнюю меру для пациентов с быстро прогрессирующим и не поддающимся терапии РС. Все испытания с участием больных РС проводились на небольших группах, что не позволяет сделать окончательных выводов об эффективности метода. Действительно, бывает так, что успешные результаты, полученные в исследованиях на малой выборке пациентов, не подтверждаются на больших группах. К сожалению, количество случаев успешного восстановления функций организма у пациентов с РС после проведения АТГСК ничтожно мало по сравнению с примерами неэффективного или осложнившегося лечения [43]. Это, однако, не мешает клиникам с сомнительной научной базой и врачам с невысокой квалификацией уже сейчас предлагать больным РС лечение АТГСК.
Клинические исследования АТГСК продолжаются, и за последнее десятилетие достигнут большой прогресс в снижении рисков, связанных с этой процедурой. После окончания рандомизированных контролируемых клинических испытаний можно будет окончательно судить о том, каким пациентам показан этот метод. По мнению экспертов, оценка пользы и риска АТГСК вкупе с доступностью эффективных препаратов моноклональных антител, позволяющих контролировать заболевание у пациентов с тяжелым течением РС, скорее всего, оставит эту пока еще не до конца проработанную технологию резервным методом лечения РС.
Применение индуцированных плюрипотентных стволовых клеток для восстановления структур ЦНС
Другие перспективные разработки для лечения РС основаны на применении индуцированных плюрипотентных стволовых клеток (ИПСК) для замещения погибших олигодендроцитов и нейронов. ИПСК, способные превращаться в разные типы клеток, можно получать с помощью «перепрограммирования», например, клеток кожи пациента. Эти исследования еще только начинаются. Так, недавно успешно завершились эксперименты по пересадке стволовых клеток, полученных из кожи больных РС, в мозг мышей, где они превратились в эффективных продуцентов миелина [44]. В другом исследовании сначала перепрограммировали стволовые клетки кожи мыши в нейронные стволовые клетки, а затем пересадили их в спинной мозг животных с демиелинизацией. В результате состояние животных улучшилось. По-видимому, пересаженные клетки выделяют вещества, стимулирующие процессы репарации ЦНС. Манипуляции со стволовыми клетками пока еще находятся на стадии детального изучения и далеки от внедрения в рутинную клиническую практику [45].
Узнать практически всё об ИПСК, технологиях их получения и рисках применения можно из статей: «Ствол и ветки: стволовые клетки» [46], «Была клетка простая, стала стволовая» [47], «Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки» [48], «В поисках клеток для ИПСК — шаг за шагом к медицине будущего» [49]. — Ред.
***
За последние 20 лет достигнуты огромные успехи в лечении РС. На сегодняшний день, так или иначе, все ПИТРС из арсенала неврологов направлены преимущественно на подавление аутоиммунного воспаления. В ближайшем будущем ожидается одобрение применения в клинической практике первого препарата для лечения первично-прогрессирующего РС. Благодаря клеточным технологиям удалось достичь очень хороших результатов по восстановлению утраченных функций у пациентов с РС. Однако эти случаи пока еще можно назвать единичными, а риск побочных явлений всё еще очень велик.
Можно ли предсказать течение рассеянного склероза и эффективность его лечения?
Вопрос персонализации лечения РС стоит очень остро [50]. Течение болезни невозможно предсказать, основываясь на клинических проявлениях РС. Это осложняет выбор тактики ведения конкретного пациента и создает для последнего дополнительную психологическую нагрузку. Между разными формами РС есть генетические различия, и было найдено несколько генетических маркеров [51], позволяющих предсказывать, насколько тяжело будет протекать РС, но, увы, только в рамках отдельных этносов. Пока что большинство таких исследований в мире не увенчалось успехом.
Кроме того, у разных пациентов ответ на лечение ПИТРС может варьировать: эффективность может быть как высока, так и незаметна вовсе. Дело в том, что физиологические процессы, отвечающие за метаболизм лекарств, находятся под строгим генетическим контролем. Наука, которая изучает связь генетических вариантов с различиями в этих процессах, называется фармакогенетикой [52]. Фармакогенетические исследования проводятся для того, чтобы на основании генотипа конкретного пациента как можно раньше подбирать для него наиболее эффективный препарат. Подобные исследования в отношении РС с определенным успехом проводятся с 2001 года. Найдено несколько генетических маркеров эффективности лечения препаратами ИФН-β и ГА, но для разных этносов они различаются. Например, для «русской» популяции — пациентов славянского происхождения, считающих себя и своих ближайших родственников русскими, — найден комплексный маркер (определенный набор аллелей генов иммунного ответа), у носителей которого лечение препаратами ИФН-β будет с высокой вероятностью эффективным [53]. Найден и маркер, ассоциированный с низкой эффективностью ГА, — таким пациентам, скорее всего, показано назначение альтернативного препарата.
Исследования по поиску универсальных генетических маркеров прогноза течения и лечения РС ведутся под руководством профессоров Ольги Олеговны Фаворовой и Алексея Николаевича Бойко из Российского национального исследовательского медицинского университета им. Н.И. Пирогова [53], [54], [55]. Продолжение таких исследований (особенно с учетом появления новых препаратов) с привлечением тысяч пациентов из различных этнических групп может привести к созданию прогностических тестов. Это позволило бы врачу быть начеку и заранее определиться с тактикой ведения конкретного пациента.
Пациентские организации
Клинические проявления заболевания — далеко не единственное, с чем приходится бороться пациенту. Это всегда еще и страх, одиночество, чувство отчуждения и изоляции. Деятельность пациентских организаций необходима для информационной поддержки, защиты прав и интересов пациентов, решения проблем с лечением и социальной реабилитацией пациентов и членов их семей. Общероссийская общественная организация инвалидов — больных рассеянным склерозом является самой крупной российской пациентской организацией для страдающих РС. Своей главной целью она называет создание условий для повышения качества жизни граждан Российской Федерации с РС. Действительно, на своем сайте организация регулярно публикует фотоотчеты о социальных мероприятиях в разных городах России и поднимает важные вопросы, касающиеся качества жизни больных РС: там можно найти, например, обращение к министру здравоохранения с просьбой включить диметилфумарат в список жизненно необходимых лекарств.
На Информационном портале о рассеянном склерозе, созданном при поддержке фармацевтической компании Teva (производитель глатирамера ацетата), можно оставить заявку на получение психологической поддержки по телефону и письменной консультации квалифицированного юриста. На сайте есть информация о возможностях реабилитации, интервью и личные истории пациентов с РС, новости о культурных событиях Москвы.
Московское общество рассеянного склероза недавно запустило бесплатную программу реабилитации для пациентов с РС. Организованы регулярные групповые занятия йогой и лечебной физкультурой по специально разработанным методикам. Кроме того, при поддержке компании Teva создана «Карта доступности» московских медицинских, социальных, спортивных, культурных и развлекательных объектов, оборудованных для людей с ограниченной подвижностью.
На сайтах российских пациентских организаций, к сожалению, очень мало материалов, которые позволили бы больному РС узнать актуальную информацию о своем заболевании: причинах его развития, диагностике и современных методах лечения. На зарубежных пациентских порталах такая информация изложена доступным языком и очень хорошо систематизирована, там постоянно обновляются разделы о научных исследованиях в области РС. На сайтах пациентских организаций разных стран очень часто встречается информация о текущих клинических испытаниях новых препаратов и возможности зарегистрироваться для участия в них. Ниже перечислены основные англоязычные организации пациентов с РС:
- Великобритания: Multiple Sclerosis Society of Great Britain, Multiple sclerosis trust;
- Австралия: National Multiple Sclerosis Society of Australia;
- Канада: Multiple Sclerosis Society of Canada;
- США: National multiple sclerosis society, Multiple Sclerosis Association of America;
- Новая Зеландия: Multiple sclerosis. Society of New Zealand.
Сейчас большинство больных РС при условии своевременного и правильно подобранного лечения могут жить полной жизнью. Люди, находясь практически в любой точке земного шара, каждый день остаются в контакте друг с другом, находят друг у друга поддержку и понимание. Страница Ирины Ясиной на Фейсбуке обновляется практически каждый день. Можно только восхищаться тем, насколько активный образ жизни ведет автор, рассказывая о путешествиях, впечатлениях, делясь восприятием разных событий, оставаясь при этом открытой своей аудитории, а иногда и поддерживая ее. Решение о том, насколько использовать собственные возможности и участвовать в жизни общества, быть ли счастливыми и свободными, всегда зависит только от нас самих.
- Ясина И. (2012). Женщины, сильные духом: Ирина Ясина. Сайт Forbes;
- Ясина И. (2011). История болезни. Знамя. 5;
- Обёртка для аксона;
- Willer C.J., Dyment D.A., Risch N.J., Sadovnick A.D., Ebers G.C., Canadian Collaborative Study Group. (2003). Twin concordance and sibling recurrence rates in multiple sclerosis. Proc. Natl. Acad. Sci. USA. 100, 12877–12882;
- Jill A. Hollenbach, Jorge R. Oksenberg. (2015). The immunogenetics of multiple sclerosis: A comprehensive review. Journal of Autoimmunity. 64, 13-25;
- Jimmy L Huynh, Patrizia Casaccia. (2013). Epigenetic mechanisms in multiple sclerosis: implications for pathogenesis and treatment. The Lancet Neurology. 12, 195-206;
- Баулина Н.М., Кулакова О.Г., Фаворова О.О. (2016). МикроРНК: роль в развитии аутоиммунного воспаления. Acta Naturae. 1, 23–36;
- Эпигенетика: невидимый командир генома;
- Загадочная генетика «загадочной болезни кожи» — витилиго;
- GWAS и психогенетика: консорциумы в поисках ассоциаций;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- V. V. Bashinskaya, O. G. Kulakova, A. N. Boyko, A. V. Favorov, O. O. Favorova. (2015). A review of genome-wide association studies for multiple sclerosis: classical and hypothesis-driven approaches. Hum Genet. 134, 1143-1162;
- Системная красная волчанка: болезнь с тысячью лиц;
- Konstantinos Patas, Jan Broder Engler, Manuel A. Friese, Stefan M. Gold. (2013). Pregnancy and multiple sclerosis: feto-maternal immune cross talk and its implications for disease activity. Journal of Reproductive Immunology. 97, 140-146;
- Ascherio A., Munger K.L., Giovannucci E. (2011). Sun exposure and vitamin D are independent risk factors for CNS demyelination. Neurology. 77, 1405–1406;
- L. Airas. (2015). Hormonal and gender-related immune changes in multiple sclerosis. Acta Neurol Scand. 132, 62-70;
- J. G. McLeod, S. R. Hammond, J. F. Kurtzke. (2011). Migration and multiple sclerosis in immigrants to Australia from United Kingdom and Ireland: a reassessment. I. Risk of MS by age at immigration. J Neurol. 258, 1140-1149;
- Alberto Ascherio, Kassandra L. Munger. (2007). Environmental risk factors for multiple sclerosis. Part I: The role of infection. Ann Neurol.. 61, 288-299;
- От поцелуя до лимфомы один вирус;
- A. G. Gabibov, A. A. Belogurov, Y. A. Lomakin, M. Y. Zakharova, M. E. Avakyan, et. al.. (2011). Combinatorial antibody library from multiple sclerosis patients reveals antibodies that cross-react with myelin basic protein and EBV antigen. The FASEB Journal. 25, 4211-4221;
- Michael P Pender, Scott R Burrows. (2014). Epstein–Barr virus and multiple sclerosis: potential opportunities for immunotherapy. Clin Trans Immunol. 3, e27;
- Микробиом кишечника: мир внутри нас;
- Kiel Telesford, Javier Ochoa-Repáraz, Lloyd H. Kasper. (2014). Gut Commensalism, Cytokines, and Central Nervous System Demyelination. Journal of Interferon & Cytokine Research. 34, 605-614;
- Kerstin Berer, Marsilius Mues, Michail Koutrolos, Zakeya Al Rasbi, Marina Boziki, et. al.. (2011). Commensal microbiota and myelin autoantigen cooperate to trigger autoimmune demyelination. Nature. 479, 538-541;
- E. V. Popova, V. V. Bryukhov, A. N. Boyko, M. V. Krotenkova. (2016). Primary-progressive multiple sclerosis as an atypical demyelinating process. Z. nevrol. psikhiatr. im. S.S. Korsakova. 116, 42;
- Иммунитет: борьба с чужими и… своими;
- Calliope A. Dendrou, Lars Fugger, Manuel A. Friese. (2015). Immunopathology of multiple sclerosis. Nat Rev Immunol. 15, 545-558;
- Volker Brinkmann, Andreas Billich, Thomas Baumruker, Peter Heining, Robert Schmouder, et. al.. (2010). Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis. Nat Rev Drug Discov. 9, 883-897;
- Antoine Louveau, Tajie H. Harris, Jonathan Kipnis. (2015). Revisiting the Mechanisms of CNS Immune Privilege. Trends in Immunology. 36, 569-577;
- Ludger Klein, Bruno Kyewski, Paul M. Allen, Kristin A. Hogquist. (2014). Positive and negative selection of the T cell repertoire: what thymocytes see (and don’t see). Nat Rev Immunol. 14, 377-391;
- Baranzini S.E. and Hauser S.L. (2002). Large-scale gene-expression studies and the challenge of multiple sclerosis. Genome Biol. 3, reviews1027;
- Активный кислород: друг или враг, или О пользе и вреде антиоксидантов;
- Céline Louapre, Catherine Lubetzki. (2015). Neurodegeneration in multiple sclerosis is a process separate from inflammation: Yes. Multiple Sclerosis Journal. 21, 1626-1628;
- Очень нервное возбуждение;
- Soelberg Sorensen P. (2016). Safety concerns and risk management of multiple sclerosis therapies. Acta Neurol. Scand.;
- Xavier Montalban, Stephen L. Hauser, Ludwig Kappos, Douglas L. Arnold, Amit Bar-Or, et. al.. (2017). Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med. 376, 209-220;
- Лаборатория биокатализа ИБХ: дизайнерские ферменты и клоны-мятежники;
- Alexey Belogurov, Konstantin Zakharov, Yakov Lomakin, Kirill Surkov, Sergey Avtushenko, et. al.. (2016). CD206-Targeted Liposomal Myelin Basic Protein Peptides in Patients with Multiple Sclerosis Resistant to First-Line Disease-Modifying Therapies: A First-in-Human, Proof-of-Concept Dose-Escalation Study. Neurotherapeutics. 13, 895-904;
- Jonathan Q. Tran, Jitesh Rana, Frederik Barkhof, Isaac Melamed, Hakop Gevorkyan, et. al.. (2014). Randomized phase I trials of the safety/tolerability of anti-LINGO-1 monoclonal antibody BIIB033. Neurol Neuroimmunol Neuroinflamm. 1, e18;
- Frédéric Sedel, Caroline Papeix, Agnès Bellanger, Valérie Touitou, Christine Lebrun-Frenay, et. al.. (2015). High doses of biotin in chronic progressive multiple sclerosis: A pilot study. Multiple Sclerosis and Related Disorders. 4, 159-169;
- Tourbah A., Lebrun-Frenay C., Edan G., Clanet M., Papeix C., Vukusic S. et al. (2016). MD1003 (high-dose biotin) for the treatment of progressive multiple sclerosis: A randomised, double-blind, placebo-controlled study. Mult. Scler. 22, 1719–1731;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Harold L Atkins, Marjorie Bowman, David Allan, Grizel Anstee, Douglas L Arnold, et. al.. (2016). Immunoablation and autologous haemopoietic stem-cell transplantation for aggressive multiple sclerosis: a multicentre single-group phase 2 trial. The Lancet. 388, 576-585;
- Panagiotis Douvaras, Jing Wang, Matthew Zimmer, Stephanie Hanchuk, Melanie A. O’Bara, et. al.. (2014). Efficient Generation of Myelinating Oligodendrocytes from Primary Progressive Multiple Sclerosis Patients by Induced Pluripotent Stem Cells. Stem Cell Reports. 3, 250-259;
- Снежный ком проблем с плюрипотентностью;
- Ствол и ветки: стволовые клетки;
- Была клетка простая, стала стволовая;
- Нобелевская премия по физиологии и медицине (2012): индуцированные стволовые клетки;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- От медицины для всех — к медицине для каждого!;
- Alessandro Didonna, Jorge R. Oksenberg. (2015). Genetic determinants of risk and progression in multiple sclerosis. Clinica Chimica Acta. 449, 16-22;
- «Омики» — эпоха большой биологии;
- Olga G Kulakova, Ekaterina Yu Tsareva, Dmitrijs Lvovs, Alexander V Favorov, Alexey N Boyko, Olga O Favorova. (2014). Comparative pharmacogenetics of multiple sclerosis: IFN-β versus glatiramer acetate. Pharmacogenomics. 15, 679-685;
- Ivan Kiselev, Vitalina Bashinskaya, Olga Kulakova, Natalia Baulina, Ekaterina Popova, et. al.. (2015). Variants of MicroRNA Genes: Gender-Specific Associations with Multiple Sclerosis Risk and Severity. IJMS. 16, 20067-20081;
- V.V. Bashinskaya, O.G. Kulakova, I.S. Kiselev, N.M. Baulina, A.V. Favorov, et. al.. (2015). GWAS-identified multiple sclerosis risk loci involved in immune response: Validation in Russians. Journal of Neuroimmunology. 282, 85-91.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
Захарова М.Н.
ФГБНУ «Научный центр неврологии»
Механизмы нейродегенерации при рассеянном склерозе
Авторы:
Елисеева Д.Д., Захарова М.Н.
Как цитировать:
Елисеева Д.Д., Захарова М.Н. Механизмы нейродегенерации при рассеянном склерозе. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски.
2022;122(7‑2):5‑13.
Eliseeva DD, Zakharova MN. Mechanisms of Neurodegeneration in Multiple Sclerosis. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2022;122(7‑2):5‑13. (In Russ.)
https://doi.org/10.17116/jnevro20221220725

Читать метаданные
Рассеянный склероз (РС) — хроническое воспалительное заболевание центральной нервной системы (ЦНС), которое приводит к формированию очагов первичной демиелинизации в белом и сером веществе и диффузному поражению аксонов и нейронов. Несмотря на значительный прогресс в разработке лекарственных средств для ремиттирующего РС, влияние на прогрессирование заболевания остается недостаточным. Диффузная и компартментализованная лимфоцитарная и макрофагальная инфильтрация ткани ЦНС ингибирует дифференцировку миелинизирующих зрелых олигодендроцитов и нарушает процессы ремиелинизации. Хроническое воспаление, которое возникает при сохранном гематоэнцефалическом барьере (ГЭБ), вызывает активацию микроглии, что усиливает повреждение аксонов и нейронов и, как следствие, запускает хронический оксидантный стресс и гистотоксическую гипоксию. В настоящее время является актуальным уточнение механизмов, лежащих в основе нейродегенерации, которая на поздних этапах РС обусловлена хроническим нейроаксональным поражением, нарушением регенеративных возможностей и в значительной степени определяет исход заболевания.
Авторы:
Елисеева Д.Д.
ФГБНУ «Научный центр неврологии»
Захарова М.Н.
ФГБНУ «Научный центр неврологии»
Дата поступления:
28.04.2022
Дата принятия в печать:
03.06.2022
Список литературы:
- Lassmann H, Brück W, Lucchinetti C. The immunopathology of multiple sclerosis: an overview. Brain pathology (Zurich, Switzerland). 2007;17(2):210-218. https://doi.org/10.1111/j.1750-3639.2007.00064.x
- Adamczyk-Sowa M, Adamczyk B, Kułakowska A, et al. Secondary progressive multiple sclerosis — from neuropathology to definition and effective treatment. Neurol Neurochirurgia Pol. 2020;54(5):384-398. https://doi.org/10.5603/PJNNS.a2020.0082
- Weinshenker B, Reich D, Lucchinetti C, et al. The natural history of multiple sclerosis: a geographically based study. NEJM. 2018;378;169-180. https://doi.org/10.1093/brain/112.1.133
- Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology. 2014;83(3):278-286. https://doi.org/10.1212/WNL.0000000000000560
- Hohlfeld R, Dornmair K, Meinl E, et al. The search for the target antigens of multiple sclerosis, part 1: autoreactive CD4+ T lymphocytes as pathogenic effectors and therapeutic targets. Lancet Neurol. 2016;15(2):198-209. https://doi.org/10.1016/S1474-4422(15)00334-8
- Trapp BD, Nave K. Multiple sclerosis: an immune or neurodegenerative disorder? Ann Rev Neurosci. 2008;31:247-269. https://doi.org/10.1146/annurev.neuro.30.051606.094313
- Stys P, Zamponi G, van Minnen J, et al. Will the real multiple sclerosis please stand up? Nat Rev Neurosci. 2012;13(7):507-514. https://doi.org/10.1038/nrn3275
- Confavreux C, Vukusi S. Natural history of multiple sclerosis: a unifying concept. Brain J Neurol. 2006;129(Pt 3):606-616. https://doi.org/10.1093/brain/awl007
- Novotna M, Paz Soldán M, Abou Zeid N, et al. Poor early relapse recovery affects onset of progressive disease course in multiple sclerosis. Neurology. 2015;85(8):722-729. https://doi.org/10.1212/WNL.0000000000001856
- Scalfari A, Neuhaus A, Degenhard A, et al. The natural history of multiple sclerosis: a geographically based study 10. Brain J Neurol. 2010;133(Pt 7):1914-1929. https://doi.org/10.1093/brain/awq118
- Yong H, Yong VW. Mechanism-based criteria to improve therapeutic outcomes in progressive multiple sclerosis. Nat Rev Neurol. 2022;18(1):40-55. https://doi.org/10.1038/s41582-021-00581-x
- Sádaba M, Tzartos J, Paíno C, et al. Axonal and oligodendrocyte-localized IgM and IgG deposits in MS lesions. J Neuroimmunol. 2012;247(1-2):86-94. https://doi.org/10.1016/j.jneuroim.2012.03.020
- Kuhlmann T, Ludwin S, Prat A, et al. An updated histological classification system for multiple sclerosis lesions. Acta Neuropathol. 2017;133(1):13-24. https://doi.org/10.1007/s00401-016-1653-y
- Frischer J, Weigand S, Guo Y, et al. Clinical and pathological insights into the dynamic nature of the white matter multiple sclerosis plaque. Ann Neurol. 2015;78(5):710-721. https://doi.org/10.1002/ana.24497
- Mahad DH, Trapp BD, Lassmann H. Pathological mechanisms in progressive multiple sclerosis. The Lance. Neurol. 2015;14(2):183-193. https://doi.org/10.1016/S1474-4422(14)70256-X
- Hauser SL, Oksenberg JR. The neurobiology of multiple sclerosis: genes, inflammation, and neurodegeneration. Neuron. 2006;52(1):61-76. https://doi.org/10.1016/j.neuron.2006.09.011
- Kebir H, Kreymborg K, Ifergan I, et al. Human TH17 lymphocytes promote blood-brain barrier disruption and central nervous system inflammation. Nature Med. 2007;13(10):1173-1175. https://doi.org/10.1038/nm1651
- van Nierop GP, van Luijn MM, Michels SS, et al. Phenotypic and functional characterization of T cells in white matter lesions of multiple sclerosis patients. Acta Neuropathol. 2017;134(3):383-401. https://doi.org/10.1007/s00401-017-1744-4
- Mockus T, Munie A, Atkinson J, et al. Encephalitogenic and Regulatory CD8 T Cells in Multiple Sclerosis and Its Animal Models. J Immunol (Baltimore, Md.: 1950). 2021;206(1):3-10. https://doi.org/10.4049/jimmunol.2000797
- Na S, Hermann A, Sanchez-Ruiz M, et al. Oligodendrocytes enforce immune tolerance of the uninfected brain by purging the peripheral repertoire of autoreactive CD8+ T cells. Immunity. 2012;37(1):134-146. https://doi.org/10.1016/j.immuni.2012.04.009
- Neumann H, Medana I, Bauer J, et al. Cytotoxic T lymphocytes in autoimmune and degenerative CNS diseases. Trends Neuroscis. 2002;25(6):313-319. https://doi.org/10.1016/s0166-2236(02)02154-9
- Tzartos J, Friese M, Craner M, et al. Interleukin-17 production in central nervous system-infiltrating T cells and glial cells is associated with active disease in multiple sclerosis. Am J Pathol. 2008;172(1):146-155. https://doi.org/10.2353/ajpath.2008.070690
- Lisak R, Benjamins J, Nedelkoska L, et al. Secretory products of multiple sclerosis B cells cytotoxic to oligodendroglia in vitro. J Neuroimmunol. 2012;246(1-2):85-95. https://doi.org/10.1016/j.jneuroim.2012.02.015
- Machado-Santos J, Saji E, Tröscher A, et al. The compartmentalized inflammatory response in the multiple sclerosis brain is composed of tissue-resident CD8+ T lymphocytes and B cells. Brain J Neurol. 2018;141(7):2066-2082. https://doi.org/10.1093/brain/awy151
- Abramova AA, Zakroyshchikova IV, Krotenkova IA, et al. Leptomeningeal B-cell follicles in multiple sclerosis: a role in the pathogenesis and prognostic value. Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2019;119(10. Vyp. 2):21-27. https://doi.org/10.17116/jnevro20191191021
- Harrison D, Wang K, Fiol J, et al. Leptomeningeal Enhancement at 7T in Multiple Sclerosis: Frequency, Morphology, and Relationship to Cortical Volume. J Neuroim. 2017;27(5):461-468. https://doi.org/10.1111/jon.12444
- Lassmann H. Pathogenic Mechanisms Associated With Different Clinical Courses of Multiple Sclerosis. Front Immunol. 2019;9:3116-3119. https://doi.org/10.3389/fimmu.2018.03116
- Magliozzi R, Howell O, Vora A, et al. Meningeal B-cell follicles in secondary progressive multiple sclerosis associate with early onset of disease and severe cortical pathology. Brain. 2007;130(Pt 4):1089-1104. https://doi.org/10.1093/brain/awm038
- Howell OW, Reeves CA, Nicholas R, et al. Meningeal inflammation is widespread and linked to cortical pathology in multiple sclerosis. Brain. 2011;134(9):2755-2771. https://doi.org/10.1093/brain/awr182
- Aloisi F, Serafini B, Magliozzi R, et al. Detection of Epstein- Barr virus and B-cell follicles in the mul-tiple sclerosis brain: what you find depends on how and where you look. Brain. 2010;133(Pt 12):e157. https://doi.org/10.1093/brain/awr221
- Serafini B, Rosicarelli B, Magliozzi R, et al. Detection of ectopic B-cell follicles with germinal centers in the meninges of patients with secondary progressive multiple sclerosis. Brain Pathol. 2004;14:164-174. https://doi.org/10.1111/j.1750-3639.2004.tb00049.x
- Mitsdoerffer M, Peters A. Tertiary Lymphoid Organs in Central Nervous System Autoimmunity. Front Immunol. 2016;7:451. https://doi.org/10.3389/fimmu.2016.00451
- Veroni C, Serafini B, Rosicarelli B, et al. Transcriptional profile and Epstein Barr virus infection status of lasercut immune infiltrates from the brain of patients with progressive multiple sclerosis. J Neuroinflammation. 2018;15:18. https://doi.org/10.1186/s12974-017-1049-5
- Ascherio A, Munger K. Epidemiology of Multiple Sclerosis: From Risk Factors to Prevention-An Update. Sem Neurol. 2016;36(2):103-114. https://doi.org/10.1055/s-0036-1579693
- Reali C, Magliozzi R, Roncaroli, F, et al. B cell rich meningeal inflammation associates with increased spinal cord pathology in multiple sclerosis. Brain Pathol. (Zurich, Switzerland). 2020;30(4):779-793. https://doi.org/10.1111/bpa.12841
- Choi S, Howell O, Carassiti D, et al. Meningeal inflammation plays a role in the pathology of primary progressive multiple sclerosis. Brain J Neurol. 2012;135(10):2925-2937. https://doi.org/10.1093/brain/aws189
- Calabrese M, Agosta F, Rinaldi F, et al. Cortical lesions and atrophy associated with cognitive impairment in multiple sclerosis. Arch Neurol. 2009;66(9):1144-1150. https://doi.org/10.1001/archneurol.2009.174
- Bø L, Vedeler C, Nyland H, et al. Subpial Demyelination in the Cerebral Cortex of Multiple Sclerosis Patients. J Neuropathol Exper Neurol. 2003;62(7):723-732. https://doi.org/10.1093/jnen/62.7.723
- Harrison D, Roy S, Oh J, et al. Association of Cortical Lesion Burden on 7-T Magnetic Resonance Imaging With Cognition and Disability in Multiple Sclerosis. JAMA Neurol. 2015;72(9):1004-1012. https://doi.org/10.1001/jamaneurol.2015.1241
- Kutzelnigg A, Lucchinetti C, Stadelmann C, et al. Cortical demyelination and diffuse white matter injury in multiple sclerosis. Brain J Neurol. 2005;128(Pt 11):2705-2712. https://doi.org/10.1093/brain/awh641
- Lucchinetti CF, Popescu BF, Bunyan RF, et al. Inflammatory cortical demyelination in early multiple sclerosis. NEJM. 2011;365:2188-2197. https://doi.org/10.1056/NEJMoa1100648
- Blauth K, Soltys J, Matschulat A, et al. Antibodies produced by clonally expanded plasma cells in multiple sclerosis cerebrospinal fluid cause demyelination of spinal cord explants. Acta Neuropathol. 2015;130(6):765-781. https://doi.org/10.1007/s00401-015-1500-6
- Chu R, Hurwitz S, Tauhid S, et al. Automated segmentation of cerebral deep gray matter from MRI scans: effect of field strength on sensitivity and reliability. BMC Neurol. 2017;17(1):172. https://doi.org/10.1186/s12883-017-0949-4
- Haider L, Simeonidou C, Steinberger G, et al. Multiple sclerosis deep grey matter: the relation between demyelination, neurodegeneration, inflammation and iron. J Neurol Neurosurg Psych. 2014;85(12):1386-1395. https://doi.org/10.1136/jnnp-2014-307712
- Nave K, Werner H. Myelination of the nervous system: mechanisms and functions. Annu Rev Cell Dev Biol. 2014;30:503-533. https://doi.org/10.1146/annurev-cellbio-100913-013101
- Franklin R, Goldman S. Glia Disease and Repair-Remyelination. Cold Spring Harb Persp Biol. 2015;7(7):a020594. https://doi.org/10.1101/cshperspect.a020594
- Mitew S, Hay C, Peckham H, et al. Mechanisms regulating the development of oligodendrocytes and central nervous system myelin. Neurosci. 2014;276:29-47. https://doi.org/10.1016/j.neuroscience.2013.11.029
- Clarke L, Young K, Hamilton N, et al. Properties and fate of oligodendrocyte progenitor cells in the corpus callosum, motor cortex, and piriform cortex of the mouse. J Neurosci. 2012;32:8173-8185. https://doi.org/10.1523/jneurosci.0928-12.2012
- McTigue D, Wei P, Stokes B. Proliferation of NG2-positive cells and altered oligodendrocyte numbers in the contused rat spinal cord. J Neurosci. 2001;21(10):3392-3400. https://doi.org/10.1523/JNEUROSCI.21-10-03392.2001
- Birey F, Kloc M, Chavali M, et al. Genetic and Stress-Induced Loss of NG2 Glia Triggers Emergence of Depressive-like Behaviors through Reduced Secretion of FGF2. Neuron. 2015;88(5):941-956. https://doi.org/10.1016/j.neuron.2015.10.046
- Hughes E, Kang S, Fukaya M, et al. Oligodendrocyte progenitors balance growth self-repulsion to achieve homeostasis adult brain. Nat Neurosci. 2013;16(6):668-676. https://doi.org/10.1038/nn.3390
- Zawadzka M, Rivers L, Fancy S, et al. CNS-resident glial progenitor/stem cells produce Schwann cells as well as oligodendrocytes during repair of CNS demyelination. Cell Stem Cell. 2010;6(6):578-590. https://doi.org/10.1016/j.stem.2010.04.002
- Kuhlmann T, Miron V, Cui Q, et al. Differentiation block of oligodendroglial progenitor cells as a cause for remyelination failure in chronic multiple sclerosis. Brain J Neurol. 2008;131(7):1749-1758. https://doi.org/10.1093/brain/awn096
- Foote A, Blakemore F. Inflammation stimulates remyelination in areas of chronic demyelination. Brain J Neurol. 2005;128(Pt 3):528-539. https://doi.org/10.1093/brain/awh417
- Mi S, Miller R, Tang W, et al. Promotion of central nervous system remyelination by differentiation of oligodendrocyte precursor cells. Ann Neurol. 2009;65(3):304-315. https://doi.org/10.1002/ana.21581
- Patrikios P, Stadelmann C, Kutzelnigg A, et al. Remyelination is extensive in a subset of multiple sclerosis patients. Brain J Neurol. 2006;129(Pt 12):3165-3172. https://doi.org/10.1093/brain/awl217
- Ponomarev ED, Shriver LP, Maresz K, et al. Microglial cell activation and proliferation precedes the onset of CNS autoimmunity. J Neuroscie Res. 2005;81(3):374-389. https://doi.org/10.1002/jnr.20488
- Xue J, Schmidt S, Sander J, et al. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation. Immunity. 2014;40(2):274-288. https://doi.org/10.1016/j.immuni.2014.01.006
- Benveniste E. Role of macrophages/microglia in multiple sclerosis and experimental allergic encephalomyelitis. J Mol Med (Berlin, Germany). 1997;75(3):165-173. https://doi.org/10.1007/s001090050101
- Frohman E, Racke M, Raine C. Multiple sclerosis — the plaque and its pathogenesis. NEJM. 2006;354(9):942-955. https://doi.org/10.1056/NEJMra052130
- Prinz M, Priller J. Microglia and brain macrophages in the molecular age: from origin to neuropsychiatric disease. Nat Rev Neurosci. 2014;15(5):300-312. https://doi.org/10.1038/nrn3722
- Miller E, Wachowicz B, Majsterek I. Advances in antioxidative therapy of multiple sclerosis. Curr Med Chem. 2013;20(37):4720-4730. https://doi.org/10.2174/09298673113209990156
- Fischer M, Sharma R, Lim J, et al. NADPH oxidase expression in active multiple sclerosis lesions in relation to oxidative tissue damage. Brain J Neurol. 2012;135(3):886-899. https://doi.org/10.1093/brain/aws012
- Haider L, Fischer M, Frischer J, et al. Oxidative damage in multiple sclerosis lesions. Brain J Neurol. 2011;134(Pt 7):1914-1924. https://doi.org/10.1093/brain/awr128
- Correale J, Farez M. The Role of Astrocytes in Multiple Sclerosis Progression. Front Neurol. 2015;6:180. https://doi.org/10.3389/fneur.2015.00180
- Argaw A, Asp L, Zhang J, et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. J Clin Invest. 2012;122(7):2454-2468. https://doi.org/10.1172/JCI60842
- Gimenez M, Sim J, Russell J. TNFR1-dependent VCAM-1 expression by astrocytes exposes the CNS to inflammation. J Neuroimmunol. 2004;151(1-2):116-125. https://doi.org/10.1016/j.jneuroim.2004.02.012
- Wang Y, Cheng X, He Q, et al. Astrocytes from the contused spinal cord inhibit oligodendrocyte differentiation of adult oligodendrocyte precursor cells by increasing the expression of bone morphogenetic proteins. J Neurosc. 2011;31(16):6053-6058. https://doi.org/10.1523/JNEUROSCI.5524-09.2011
- Omari K, John G, Sealfon S, et al. CXC chemokine receptors on human oligodendrocytes: implications for multiple sclerosis. Brain J Neurol. 2005;128(5):1003-1015. https://doi.org/10.1093/brain/awh479
- Luo C, Jian C, Liao Y, et al. The role of microglia in multiple sclerosis. Neuropsychiatr Dis Treat. 2017;13:1661-1667. https://doi.org/10.2147/NDT.S140634
- Smith K, Kapoor R, Felts P. Demyelination: the role of reactive oxygen and nitrogen species. Brain Path. (Zurich, Switzerland). 1999;9(1):69-92. https://doi.org/10.1111/j.1750-3639.1999.tb00212.x
- Bizzozero O, DeJesus G, Callahan K, et al. Elevated protein carbonylation in brain white and gray matter patients multiple sclerosis. J Neurosc Res. 2005;81(5):687-695. https://doi.org/10.1002/jnr.20587
- Butts B, Houde C, Mehmet H. Maturation-dependent sensitivity of oligodendrocyte lineage cells to apoptosis: implications for normal development and disease. Cell Death Diff. 2008;15(7):1178-1186. https://doi.org/10.1038/cdd.2008.70
- Blomgren K, Hagberg H. Free radicals, mitochondria, and hypoxia-ischemia in the developing brain. Free Rad Biol Med. 2006;40(3):388-397. https://doi.org/10.1016/j.freeradbiomed.2005.08.040
- Trapp B, Stys P. Virtual hypoxia and chronic necrosis of demyelinated axons in multiple sclerosis. Lancet Neurol. 2009;8(3):280-291. https://doi.org/10.1016/S1474-4422(09)70043-2
- Lee N, Ha S, Sati P, et al. Potential role of iron in repair of inflammatory demyelinating lesions. J Clin Invest. 2019;129(10):4365-4376. https://doi.org/10.1172/JCI126809
- Cronin S, Woolf C, Weiss G, et al. The Role of Iron Regulation in Immunometabolism and Immune-Related Disease. Front Mol Biosci. 2019;6:116-120. https://doi.org/10.3389/fmolb.2019.00116
- Urrutia P, Aguirre P, Esparza A, et al. Inflammation alters the expression of DMT1, FPN1 and hepcidin, and it causes iron accumulation in central nervous system cells. J Neurochem. 2013;126(4):541-549. https://doi.org/10.1111/jnc.12244
- Hametner S, Wimmer I, Haider L, et al. Iron and neurodegeneration in the multiple sclerosis brain. Ann Neurol. 2013;74(6):848-861. https://doi.org/10.1002/ana.23974
- Bagnato F, Hametner S, Yao B, et al. Tracking iron in multiple sclerosis: a combined study at 7 Tesla. Brain J Neurol. 2011;134(Pt 12):3602-3615. https://doi.org/10.1093/brain/awr278
- Filippi M, Brück W, Chard D, et al. & Attendees of the Correlation between Pathological and MRI findings in MS workshop (2019). Association between pathological and MRI findings in multiple sclerosis. Lancet Neurol. 2019;18(2):198-210. https://doi.org/10.1016/S1474-4422(18)30451-4
- Dal-Bianco A, Grabner G, Kronnerwetter C, et al. Long-term evolution of multiple sclerosis iron rim lesions in 7 T MRI. Brain J Neurol. 2021;144(3):833-847. https://doi.org/10.1093/brain/awaa436
- Elkady A, Cobzas D, Sun H, et al. Progressive iron accumulation across multiple sclerosis phenotypes classification of deep gray matter. JMRI. 2017;46(5):1464-1473. https://doi.org/10.1002/jmri.25682
- Bergsland N, Tavazzi E, Laganà M, et al. White Matter Tract Injury is Associated with Deep Gray Matter Iron Deposition in Multiple Sclerosis. J Neuroim. 2017;27(1):107-113. https://doi.org/10.1111/jon.12364
- Zivadinov R, Tavazzi E, Bergsland N, et al. Brain Iron at Quantitative MRI Is Associated with Disability in Multiple Sclerosis. Radiology. 2018;289(2):487-496. https://doi.org/10.1148/radiol.2018180136
- Wiendl H, Gold R, Berger T, et al. Multiple Sclerosis Therapy Consensus Group’ (MSTCG) (2021). Multiple Sclerosis Therapy Consensus Group (MSTCG): position statement on disease-modifying therapies for multiple sclerosis (white paper). Ther Adv Neurol Dis. 2021;14:17562864211039648. https://doi.org/10.1177/17562864211039648
Рассеянный склероз (РС) — хроническое воспалительное заболевание центральной нервной системы, которое приводит к формированию очагов демиелинизации в белом и сером веществе и диффузному поражению аксонов и нейронов [1]. РС является одной из основных причин неврологической инвалидизации у лиц молодого возраста. Результаты обсервационных исследований позволили расширить наши представления о естественном течении РС. В большинстве случаев течение РС представлено развитием острой ремиттирующей фазы, во время которой происходят проникновение эффекторных иммунных клеток через гематоэнцефалический барьер (ГЭБ), инфильтрация ткани ЦНС и развитие воспаления с образованием острых активных очагов демиелинизации, а также постепенным прогрессированием нейродегенеративных изменений, характеризующихся истончением и разрывом аксонов, гибелью нейронов и ускоренным нарастанием атрофии головного мозга, что приводит к накоплению тяжелого неврологического дефицита. Воспаление и нейродегенерация протекают относительно зависимо друг от друга [2].
В 85% случаев РС начинается на третьем десятилетии жизни с ремиттирующего типа течения (РРС). По прошествии 15—20 лет от появления первых симптомов РС большинство пациентов вступают в фазу медленного прогрессирования с постепенным нарастанием неврологического и когнитивного дефицита. Такое течение заболевания принято определять как вторично-прогрессирующий РС (ВПРС), при котором может еще сохраняться незначительная воспалительная активность [3]. У небольшого (приблизительно 10%) числа пациентов заболевание с самого начала имеет прогрессирующее течение без четко очерченных периодов обострений (первично-прогрессирующий РС — ППРС). Средний возраст начала ППРС примерно на 10 лет позже, чем РРС [4]. Несмотря на различия в начальных этапах РРС и ППРС, механизмы прогрессирующей нейродегенерации при этих типах течения заболевания очень схожи. Также выделяют агрессивные и атипичные формы РС (Марбурга, псевдотуморозный вариант РС), которые протекают с массивным поражением ЦНС. Причина, по которой встречаются такие разные типы поражения ЦНС при РС, остается до конца не ясной. В связи с этим возникает вопрос: различные по интенсивности воспалительные паттерны — это проявления одного и того же заболевания или принципиально другие нозологические формы [5]. До сих пор не идентифицирован аутоантиген, запускающий выработку специфических антител и активацию эффекторных лимфоцитов при РС. Многие исследователи предполагают, что РС имеет первичную аутоиммунную этиологию. Большое количество научных работ, проведенных за последние несколько десятилетий, было сосредоточено на раскрытии иммунологических причин и молекулярных мишеней, благодаря чему обнаружены прочные генетические ассоциации с механизмами иммунной регуляции, выяснены механизмы иммунной атаки на ЦНС. Наблюдение за естественным течением РС выявило ряд несоответствий, которые ставят под сомнение предположение об исключительно аутоиммунной теории развития РС. Другая точка зрения предполагает, что РС является нейродегенеративным заболеванием, а первоначальный сбой происходит внутри ЦНС. Эта альтернативная модель утверждает, что первичная нейродегенерация, возможно, сфокусированная на комплексе олигодендроцит—миелин, является начальным событием и, высвобождая высокоантигенные компоненты, вторично способствует запуску каскада иммунопатологических процессов [6]. В этом случае возможно объяснить существование ППРС и диффузной потери миелина, олигодендроцитов, аксонов и нейронов в неизмененном белом и сером веществе, выявляемых уже на ранних этапах РС, но преобладающих на более поздних стадиях РС [7].
Остается спорным вопрос о влиянии обострений на долгосрочную инвалидизацию. Известно, что прогрессирование РС и достижение выраженной нетрудоспособности как при ВПРС, так и при ППРС происходят с одинаковой скоростью. С учетом того, что при ППРС отсутствуют эпизоды обострений, данное обстоятельство подчеркивает низкую степень влияния рецидивов заболевания на окончательное накопление инвалидизации [8]. Изучение естественного течения РС позволяет предполагать, что частые обострения в начале заболевания, короткий интервал между первыми двумя атаками РС, ранний остаточный неврологический дефицит с вовлечением пирамидных и мозжечковых путей связаны с большей выраженностью инвалидизации в последующем [9]. Напротив, рецидивы, возникающие на более позднем этапе болезни, не оказывают заметного влияния в прогрессирование нетрудоспособности. Таким образом, высокая частота рецидивов на ранних стадиях заболевания является предиктором тяжелой инвалидизации [10].
По мере перехода РС во вторичное прогрессирование аутоиммунные реакции на периферии угасают и воспаление распространяется в ЦНС за сохранный ГЭБ. Скопления макрофагов, B- и T-лимфоцитов преобладают в лептоменингеальных оболочках, в большинстве случаев с формированием фолликулоподобных структур, которые вырабатывают множество растворимых медиаторов, способствующих поражению нейронов головного мозга и антеградной дегенерации аксонов. В процесс хронического воспаления вовлекается резидентная микроглия, секретирующая активные формы кислорода и оксид азота. Развивающийся окислительный стресс приводит к прямому повреждению клеток, дисфункции митохондрий и гипоксии. Активированная микроглия и немногочисленные периваскулярные инфильтраты диффузно распространяются по белому и серому веществу, которое выглядит неизмененным, но содержит поврежденные аксоны и нейроны. При прогрессировании РС и старении организма становится заметным накопление токсического железа в глубоком сером веществе и вокруг хронических очагов. Ионы железа оказывают нейротоксическое действие и усиливают окислительные процессы. Блок дифференцировки миелинобразующих олигодендроцитов ведет к недостаточной ремиелинизации. В совокупности эти механизмы приводят к распространенному нейроаксональному повреждению и атрофии головного мозга [11].
Поражение белого вещества ЦНС при РС
Миелин является основной мишенью иммунной атаки. Первым повреждается и подвергается деградации миелинолигодендроцитарный гликопротеин (МОГ), имеющий самую низкую молекулярную массу и экспрессирующийся на самой внешней поверхности миелиновой оболочки. Несколько позже происходит повреждение других белков с более высокой молекулярной массой, в частности основного белка миелина (ОБМ) и миелин-ассоциированного гликопротеина (МАГ) — структурного белка, входящего в состав мембраны олигодендроцитов [12]. Возникновение острых очагов РС характеризуется обширной инфильтрацией макрофагами (CD68+), которые содержат продукты распада миелина (ОБМ, МОГ и МАГ). С течением времени участки острого поражения претерпевают ряд морфологических изменений. Более поздние острые очаги демиелинизации характеризуются уже многочисленным скоплением макрофагов, содержащих неспецифические липидные остатки, в них отсутствуют МОГ и МАГ. T- и B-клетки в этих очагах не только периваскулярно локализуются, но и диффузно распространяются по всей области поражения. Далее острые поражения преобразуются в хронические активные очаги («тлеющие бляшки»), характеризующиеся зонами как активного, так и неактивного воспаления. Лимфоцитарные и макрофагально-микроглиальные инфильтраты перемещаются к периферии очага, формируют воспалительный ободок, при этом центральная часть такого очага характеризуется менее выраженной клеточной инфильтрацией, но выраженной демиелинизацией с признаками дегенерации аксонов и гипертрофии астроцитов. В краевых зонах «тлеющих бляшек» можно наблюдать начинающиеся процессы неполной ремиелинизации. Хронические активные очаги («выгорающие бляшки») резко отграничены от окружающей ткани. В них уже практически существует активное разрушение миелина и имеется лишь незначительное количество T-клеток и микроглии/макрофагов. «Выгорающие бляшки» практически лишены олигодендроглии, и плотность аксонов резко снижена, что говорит об их дегенерации. Также отмечается крайне низкое количество клеток-предшественников олигодендроцитов, что препятствует ремиелинизации. Интенсивный астроглиоз в итоге превращает бляшку в астроглиальный рубец [13]. При РРС преобладает классическое активное очаговое поражение белого вещества. С течением времени у пациентов при переходе заболевания в прогрессирующую стадию активные бляшки встречаются реже, преобладают «тлеющие» и «выгорающие» очаги [14].
Помимо очаговых повреждений белого вещества ЦНС, у пациентов с РС обнаруживается диффузно измененное белое вещество, представляющее области периваскулярной и интерстициальной воспалительной инфильтрации с нечеткими границами, окружающие бляшки. Во внешне неизмененном белом веществе при микроскопическом исследовании выявляются диффузная активация микроглии и немногочисленные скопления лимфоцитов. Типичными для этих зон являются диффузная потеря миелина, истончение аксонов и пролиферация астроглии [15].
Очаги РС характеризуются значительным гистопатологическим разнообразием — от разной степени воспалительного демиелинизирующего поражения, при котором еще сохранены миелин, аксоны, олигодендроциты и имеется возможность ремиелинизации, до формирования хронических глиальных рубцов. Нейроаксональное поражение не ограничивается только бляшками РС, а распространяется далеко за их пределы.
Иммуногистопатологические изменения при РС
На первых этапах развития РС аутореактивные CD4+ и CD8+ T-лимфоциты, B-клетки (CD20+) и макрофаги (CD68+) с разными кластерами дифференцировки (Cluster of differentiation, CD), праймированные антигеном на периферии, преодолевают поврежденный ГЭБ за счет взаимодействия между интегринами лимфоцитов и молекулами адгезии на поверхности эндотелиальных клеток в условиях повышенной продукции провоспалительных цитокинов [16]. Далее различные субпопуляции лимфоцитов скапливаются вокруг сосудов, образуя плотные инфильтраты, которые инициируют демиелинизирующее поражение. На ранних стадиях высока роль CD4+ T-лимфоцитов, особенно подтипа Th17, образование которых опосредовано трансформирующим фактором роста бета и интерлейкином-6 (ИЛ-6). Во время развития аутоиммунной атаки наблюдается дихотомия наивных CD4+ T-лимфоцитов, они начинают экспрессировать маркеры, присущие Th17, в свою очередь снижается образование индуцированных регуляторных T-клеток с фенотипом CD4+CD25+FoxP3+, которые обеспечивают баланс между про- и противовоспалительной активностью иммунных клеток. Th17 являются высокоэнцефалитогенными за счет секреции большого количества ИЛ-17, который участвует в повреждении ГЭБ и стимуляции продукции медиаторов воспаления резидентными клетками ЦНС [17]. На самых ранних этапах развития РС CD4+ T-лимфоциты отвечают за рекрутирование макрофагов, осуществляющих антигенпрезентирующую функцию. CD4+ T-клетки участвуют в инициации иммуноопосредованной демиелинизации, но в последующем даже в острых очагах воспаления выявляются лишь их единичные представители [18].
Вне зависимости от типа течения РС в острых и хронических очагах демиелинизации в зонах компартментализированного воспаления, связанного с мозговыми оболочками, и в диффузно измененном или неизмененном белом и сером веществе преобладает инфильтрация цитотоксическими лимфоцитами (ЦТЛ) CD8+ T-лимфоцитами. Активированные CD8+ T-клетки могут участвовать в разрушении ГЭБ посредством перфорин-опосредованной активации астроцитов, изменения плотных контактов и индукции фактора роста эндотелия сосудов. ЦТЛ имеют сродство к главному комплексу гистосовместимости I, который высоко экспрессируют такие антигенпредставляющие клетки ЦНС, как олигодендроциты, астроциты, нейроны, эндотелиоциты. За счет формирования контактов с клетками CD8+ T-лимфоциты вызывают их апоптоз, опосредованный Fas-лигандом фактора некроза опухоли (ФНО) [19]. Прямое цитотоксическое действие CD8+ T-лимфоцитов на олигодендроглию и аксоны обусловлено также секрецией гранзима B и перфоринов [20]. Степень повреждения аксонов в активных очагах РС коррелирует со степенью инфильтрации ЦТЛ [21]. Значительный процент ЦТЛ в процессе развития аутоиммунного воспаления, особенно в прогрессирующей стадии, приобретает способность к продукции ИЛ-17 и в сочетании с секрецией интерферона гамма обусловливает апоптоз в хронических неактивных бляшках и неизмененном белом веществе [22]. Именно ЦТЛ отводится одна из ведущих патогенетических ролей в развитии как острых очагов демиелинизации, так и последующей компартментализации воспаления и поражения белого вещества ЦНС.
B-лимфоциты являются еще одной популяцией лимфоцитов, принимающих активное участие в развитии РС. B-лимфоциты обеспечивают гуморальный иммунный ответ на всех стадиях заболевания. В острой фазе развития аутоиммунного процесса при РС стимулированные антигеном и эффекторными T-клетками B-лимфоциты трансформируются в плазматические клетки, которые продуцируют иммуноглобулины (IgG). Попадая в ЦНС, плазматические клетки реализуют антителозависимую клеточную цитотоксичность, направленную в основном против нейронов и астроцитов, и в меньшей степени участвуют в повреждении миелина. Значение гуморального иммунного ответа подтверждается интратекальным синтезом олигоклональных IgG у пациентов с РС и является в большинстве случаев патогномоничным признаком заболевания. Другим направлением дифференцировки B-лимфоцитов как на периферии, так и за ГЭБ является образование долгоживущих B-клеток памяти, которые способны быстро активироваться при повторной встрече с антигеном и начать продуцировать большое количество IgG [23].
B-лимфоциты и плазматические клетки также являются частью воспалительных периваскулярных инфильтратов. B-лимфоциты экспрессируют главный комплекс гистосовместимости II, за счет чего способны презентировать антигены и привлекать T-лимфоциты в очаги воспаления. Клональная экспансия B-клеток и продукция провоспалительных цитокинов в основном за счет секреции высоких уровней ФНО-α и экзосом обусловливают апоптоз глиальных клеток. Следует отметить, что при прогрессировании РС наблюдается тенденция к увеличению инфильтрации мягкой мозговой оболочки B-лимфоцитами с образованием фолликулярных структур, которые приводят к демиелинизации прилежащего серого вещества и за счет продукции антител способствуют гибели нейронов, вызывая нарастание нейродегенеративных изменений. Предполагается, что B-клетки продуцируют цитотоксический растворимый фактор, который может вызывать как прямое поражение клеток глии и нейронов, так и опосредованное — через активацию микроглии, его действие может наблюдаться в отдалении от очагов демиелинизации, что объясняет диффузное поражение белого и серого вещества [24].
Компартментализация воспаления. Демиелинизация коркового и глубокого серого вещества
При прогрессирующих формах РС на периферии уже отсутствует активный аутоиммунный процесс, сопровождающийся повышением проницаемости ГЭБ и проникновением аутореактивных иммунных клеток, при этом воспаление продолжается и локализуется непосредственно в ЦНС. Воспалительные инфильтраты, состоящие из CD8+ T-клеток и B-клеток, в основном располагаются в лептоменингеальных оболочках и могут образовывать сложные агрегаты, имеющие черты третичных лимфатических фолликулов [25, 26]. Лептоменингеальное воспаление вносит вклад в демиелинизацию коры головного мозга и нейроаксональное повреждение и ассоциировано с менее благоприятным прогнозом [27].
Эктопические лимфоидные фолликулы (Ectopic Lymphoid Follicules, ELF), напоминающие герминативные узловые структуры, образуются при различных инфекционных, аутоиммунных и опухолевых заболеваниях. В мозговых оболочках глубоких борозд, полученных при исследовании аутопсийного материала пациентов с ВПРС, в 40% случаев выявляются ELF, которые имеют связь с тяжестью корковой дегенерации и прогрессированием инвалидизации [28, 29]. В источниках литературы определение ELF варьирует от «менингеальных очагов» (например, более 10 воспалительных клеток) до структур, схожих с лимфоидными узелками периферической лимфоидный ткани. Чтобы провести четкое разграничение между ELF и менингеальным воспалением, включающим диффузные B-клеточные инфильтраты, наиболее правильно определять ELF как крупные агрегаты B-клеток, локализованные в субарахноидальном пространстве внутри мозговых борозд, демонстрирующие некоторые признаки герминативных центров периферических лимфоидных фолликулов с наличием в их структуре фолликулярных (стромальных) дендритных клеток, фолликулярных T-хелперов, антиген-активированных пролиферирующих B-клеток, B-клеток памяти и плазматических клеток, но лишенных мантийной и маргинальной зон [30].
В процессе развития иммунного ответа, на начальном этапе образования фолликула, CD4+ и CD8+ T-клетки распознают антигенный пептид, представленный на молекуле главного комплекса гистосовместимости II, экспрессируемого дендритными клетками. Часть активированных T-хелперов за счет секреции определенных хемокинов преобразуется в фолликулярные T-хелперы и начинает контактировать с компартментализированными зонами B-клеток, стимулируя их дифференцировку и пролиферацию. Дендритные клетки посредством секреции хемокинов привлекают наивные и активированные B-лимфоциты, начиная формировать герминативный центр. Активно делящиеся антигенспецифичные B-клетки вытесняют покоящиеся B-лимфоциты на периферию, а сами трансформируются в B-клетки памяти или плазматические клетки [31]. Последние обладают способностью продуцировать антитела, напрямую повреждающие нейроны и астроциты, особенно в областях мозга рядом с крупными субпиальными поражениями, обусловливая демиелинизацию серого вещества и микроглиальную активацию в корковых структурах. Наличие ELF в мозговых оболочках связывают с ранним дебютом РС, более быстрым прогрессированием и смертью в молодом возрасте [32].
Интерес представляют результаты исследования, в котором, используя гибридизацию in situ, было обнаружено, что ELF в мозговых оболочках ряда пациентов с ВПРС являются основными зонами расположения B-клеток, экспрессирующих поздний литический антиген gp350 вируса Эпштейна—Барр (ВЭБ) и привлекающих CD8+ T-лимфоциты, перекрестно реагирующие на латентный антиген ВЭБ [33]. На основании крупномасштабных эпидемиологичских исследований, было показано, что пациенты с РС имеют более высокие титры антител к ВЭБ по сравнению со здоровыми. ВЭБ рассматривается как фактор риска развития РС [34].
Кроме того, у пациентов с ВПРС, имеющих ELF в оболочках переднего мозга, подобные структуры в небольшом количестве иногда выявляются и в менингеальных оболочках спинного мозга. Предполагается, что низкий процент выявления спинальных ELF связан с трудностью их идентификации, так как требуется обширный скрининговый поиск по всей протяженности спинного мозга, и наличие только одной борозды в его передней срединной щели может анатомически препятствовать накоплению крупных и организованных иммунных клеточных инфильтратов. Тем не менее наличие менингеальных ELF в головном мозге пациентов с ВПРС связано с бо́льшим инфильтративным B-клеточным поражением спинальных оболочек, что ассоциировано с непрерывно текущей дегенерацией нейронов и аксонов в спинном мозге [35]. ELF — это гистопатологическая отличительная особенность именно ВПРС, при ППРС подобные структуры не выявляются. У пациентов с ППРС обнаруживаются диффузные менингеальные и периваскулярные инфильтраты T- и B-клеток, коррелирующие с тяжестью заболевания [36].
Клинико-радиологические находки демонстрируют, что когнитивные нарушения и прогрессирование инвалидизации у пациентов с РС ассоциированы не только с вовлечением белого вещества, но в большей степени обусловлены поражением коркового и глубокого серого вещества головного мозга [37]. Очаги демиелинизации в сером веществе при прогрессирующем РС подразделяют на четыре типа. Очаги первого типа являются смешанными, распространяясь через толщу белого вещества, они частично вовлекают серое вещество (14%). Другие типы очагов являются внутрикорковыми и отличаются по локализации и объему поражения серого вещества. Очаги второго типа локализуются исключительно внутри серого вещества и не переходят на поверхность коры (2,1%). Третий, наиболее частый тип, — очаги, прилежащие к мягкой мозговой оболочке и распространяющиеся вдоль субпиальных участков коры (67%). Именно этот тип очагов является причиной диффузной и компартментализованной инфильтрации менингеальных оболочек лимфоцитами. Наконец, очаги четвертого типа, не затрагивая белое вещество, поражают всю толщу коры головного мозга (17%) [38, 39]. Принято считать, что демиелинизация коркового вещества является отличительным признаком прогрессирующего РС [40]. Однако, согласно гистологическим исследованиям биоптатов мозговой ткани, в 38% случаев вовлечение серого вещества в патологический процесс наблюдается при клинически изолированном синдроме и на ранних стадиях РС, но в большей степени данные наблюдения характерны для высокоактивных и агрессивных форм заболевания с наличием крупных субкортикальных поражений, что может объяснить распространение воспалительного процесса на прилежащее к зонам поражения серое вещество [41]. Помимо этого, часто встречающиеся при РС субпиальные распространенные очаги (3-й тип), захватывающие обширные области коры и проникающие в глубокие слои по ходу инвагинаций поверхности мозга, способны вызывать менингеальное воспаление. Лимфоциты и макрофаги в оболочках мозга могут диффундировать из субарахноидального пространства в подлежащую кору и за счет синтеза цитокинов, медиаторов воспаления и специфических антител усиливать воспалительный процесс в этой области, вызывая распространенную демиелинизацию и гибель нейронов [42].
Патологоанатомические исследования с использованием посмертных образцов мозговой ткани свидетельствуют и о патологии глубокого серого вещества у пациентов с РС. Наиболее часто встречаются поражения таламуса, гипоталамуса и хвостатых ядер, реже — гиппокампа и коры мозжечка [43]. Причинами атрофии глубокого серого вещества являются как очаговая демиелинизация, так и окислительное повреждение, обусловливающее снижение плотности синапсов и нарушение гомеостаза глутамата [44].
Ремиелинизация, астроглиоз и активация микроглии
Миелиновая оболочка состоит из высокоорганизованных богатых липидами слоев мембран, окружающих аксоны. Ее наличие способствует тому, что аксоны обладают высоким сопротивлением, обеспечивая эффективное и быстрое скачкообразное распространение нервных импульсов с оптимальным использованием пространства и энергии. Миелиновая оболочка играет важную роль в поддержании и защите аксонов, а также обеспечивает трофическую функцию [45]. Регенерация миелина ЦНС в основном опосредована мультипотентной паренхиматозной популяцией стволовых клеток — клеток-предшественников олигодендроцитов (Oligodendrocyte Precursor Cells, OPC). При поражении миелина OPC быстро амплифицируются в областях демиелинизации, где впоследствии дают начало миелинизирующим олигодендроцитам [46]. OPC представляют высокопролиферативные, подвижные биполярные клетки, экспрессирующие большое количество ганглиозидов, распознаваемых антителом A2B5, рецептором PDGF-альфа (PDGFαR) и протеогликаном NG2. Специализация и дифференцировка OPC регулируются транскрипционными факторами олигодендроцитов 1 и 2 [47]. OPC составляют 5—8% всех клеток ЦНС и диффузно распределены во взрослом мозге, с наибольшим скоплением в субвентрикулярной зоне, зрительном нерве, моторной коре, мозолистом теле и мозжечке. Указанные зоны являются резервуаром новых олигодендроцитов [48]. Олигодендроциты постоянно пролиферируют в здоровом мозге для поддержания своей клеточной плотности, но значительно медленнее, чем это происходит в детском возрасте или при повреждении [49]. Предполагается, что образование новых миелинизирующих олигодендроцитов является важным механизмом нейропластичности, что обусловлено их участием в регуляции гомеостаза ЦНС посредством влияния на глутаматергическую нейротрансмиссию [50]. Вновь образованные олигодендроциты принимают важное участие в формировании и преобразовании глиальных рубцов [51]. После повреждения миелина зрелые OPC, экспрессирующие NG2/PDGFαR, дифференцируются в олигодендроциты, способные к ремиелинизации аксонов и восстановлению нервной проводимости [52].
Считается, что для обеспечения ремиелинизации необходима активация OPC. Подобно другим регенеративным реакциям, ремиелинизация наиболее эффективно протекает на ранних активных стадиях развития очагов РС, которые характеризуются обилием воспалительных и липидсодержащих клеток, и где часто выявляются OPC, участвующие в формировании новой миелиновой оболочки, и их плотность в этих зонах сопоставима с таковой в окружающем белом веществе. Напротив, зрелые миелинизирующие олигодендроциты чрезвычайно редко встречаются в хронических участках поражения при РС, что, как предполагается, обусловлено блоком дифференцировки и остановки развития OPC на ранних стадиях [53]. Причины, по которым OPC не могут пройти курс полной дифференцировки в зрелые олигодендроциты, вероятно, определяются внутренними изменениями в популяции OPC или специфическим изменением очагов при прогрессирующем РС. Так, экспериментальное истощение макрофагов, T- и B-лимфоцитов отрицательно влияет на процессы ремиелинизации, сигналы, поступающие от этих клеток, являются движущей силой, стимулирующей активацию, рекрутинг и регуляцию дифференцировки OPC [54].
При хроническом поражении РС OPC могут присутствовать в достаточном количестве, но не активируются и не участвуют в ремиелинизации. Существует понятие «временное окно возможностей ремиелинизации», в течение которого может успешно проходить дифференцировка OPC. Открывается это окно после достаточной экспансии OPC и закрывается конверсией острого воспаления в хроническое [55]. В результате полностью ремиелинизированные очаги сравнительно редко встречаются на поздних стадиях РС. Однако во многих участках поражения восстановление миелина не прекращается полностью, а остается ограниченным небольшим ободком новообразованных миелиновых оболочек на границе области поражения, которые представляют из себя так называемые теневые бляшки [56].
В процессах прогрессирующей нейроаксональной гибели при РС важная роль отводится активированным по разным причинам макрофагам и микроглии. Активированная микроглия выявляется как в очагах поражения белого и серого вещества, так и в неизмененном белом и сером веществе на ранних и поздних стадиях РС. Микроглия представлена резидентными иммунными клетками ЦНС, которые происходят от миелоидных предшественников, и играет важную роль в развитии ЦНС, иммунном надзоре и восстановлении за счет экспрессии основных антигенов гистосовместимости, секреции множества провоспалительных и противовоспалительных цитокинов, таких как ИЛ-1, ФНО-α и ИЛ-10 [57]. Микроглия способна реализовывать как антителозависимую, так и комплиментзависимую клеточную цитотоксичность за счет экспрессии Fc-рецепторов и рецепторов комплемента. В экспериментальных моделях показано, что микроглия имеет различную морфологию во время демиелинизации и ремиелинизации [58]. Микроглия способствует ремиелинизации посредством экспрессии противовоспалительных молекул, фагоцитоза продуктов деградации миелина и восстановления тканей [59, 60]. Также микроглия представляет антигены и секретирует провоспалительные молекулы, которые могут разрушить миелиновую оболочку и/или олигодендроциты. В качестве антигенпрезентирующих клеток микроглия участвует в перекрестных взаимодействиях с другими иммунными клетками, такие взаимодействия приводят к активации T-клеток в ходе демиелинизации и ремиелинизации при РС [61]. Окислительный стресс в активированной микроглии и макрофагах считается основным источником активных форм кислорода, перекисей, свободных радикалов и оксида азота при РС [62].
Степень окисления липидов и ДНК коррелирует с воспалением и окислительным повреждением олигодендроцитов и нейронов. В очагах демиелинизации обнаружена повышенная экспрессия окислительных молекул и антиоксидантных ферментов, что указывает на их роль в процессах демиелинизации и нейродегенерации при РС [63]. Таким образом, активированная микроглия/макрофаги является важной причиной окислительного стресса, к которому крайне чувствительны нейроны и OPC [64].
Астроглиоз также является одним из патологических признаков РС. Астроциты играют активную роль как в демиелинизации, так и в нарушении ремиелинизации, регулируя перенос периферических иммунных клеток, модулируя целостность ГЭБ, являясь источником ряда хемокинов и цитокинов. Активация астроцитов и потеря их концевых ножек вокруг мелких кровеносных сосудов представляет раннее событие в развитии нарушения ГЭБ [65]. Активация астроцитов усиливает экспрессию васкулоэндотелиального фактора роста-А, что вызывает снижение активности белков, составляющих плотные соединения эндотелиальных клеток, и приводит к повреждению ГЭБ [66]. Экспрессия молекулы сосудистой адгезии-1 астроцитами имеет решающее значение для инвазии T-клеток в паренхиму ЦНС [67]. В очагах демиелинизации астроциты пролиферируют и участвуют в образовании глиальных рубцов, состоящих из густой сети гипертрофированных клеток. Эти реактивные астроциты имеют выраженные изменения уровня экспрессии молекул адгезии, цитокинов, факторов роста, рецепторов ферментов и ингибиторов протеаз, которые влияют на процессы эволюции очагов при РС. Формирование глиального рубца имеет решающее значение для восстановления целостности ГЭБ, однако при демиелинизации он создает физический барьер, препятствующий проникновению OPC в пораженную область [68]. В свою очередь реактивные астроциты на границе активных очагов при РС экспрессируют молекулы хемоаттрактантов для OPC, индуцируя их миграцию к демиелинизированной бляшке, что может быть важно для ремиелинизации [69]. Астроциты имеют многочисленные связи с нейронами и способны регулировать уровень нейротрансмиттеров, в частности глутамата. В очагах поражения и корковом сером веществе при РС выявляются функциональная несостоятельность астроцитов и повышенная концентрация глутамата, что ассоциировано с худшими исходами заболевания [70].
Окислительный стресс и повреждение митохондрий
Окислительное повреждение играет важную роль в патогенезе РС. OPC особенно чувствительны к окислительному стрессу, потому имеют низкий уровень антиоксидантных ферментов и антиапоптотических белков и более высокий — проапоптотических белков [71, 72]. Окислительный стресс в активированной микроглии и макрофагах считается основным источником активных форм кислорода и оксида азота при РС [73, 74]. Активированная микроглия является важной причиной окислительного повреждения, она запускает процесс гистотоксической гипоксии, под которой понимают состояние сниженного потребления кислорода и энергетическую недостаточность вследствие митохондриального повреждения в условиях нормального кровоснабжения и кислородного обеспечения. Развитие гистотоксической гипоксии имеет непосредственную связь с валлеровской дегенерацией аксонов и гибелью нейронов при прогрессирующем РС. Механизм развития повреждения митохондрий при РС объясняется трехступенчатой гипотезой. На первом этапе в ответ на демиелинизацию происходит группировка и скопление нормальных митохондрий. Отмечается увеличение количества, размера, активности и скорости движения митохондрий в демиелинизированном аксоне в качестве защитного механизма. На втором этапе, который наблюдается в предпрогрессирующей стадии РС, продукты воспаления повреждают хромосомы клеток, в том числе нейронов, в очагах поражения, что ведет к дисфункции цитохром-C-оксидазы и развитию дефицита энергии. В ответ на окислительный стресс происходит мутация митохондриальной ДНК и увеличение копий аномальных хромосом. На финальной стадии развивается дефицит ферментов дыхательной цепи в нейронах, их тела становятся резервуаром аномальных митохондрий, которые постепенно подвергаются перемещению в демиелинизированный аксон, вызывают энергетический дисбаланс и повышенную продукцию активных форм кислорода в аксоне. Развиваются хронический клеточный стресс и дисбаланс ионного гомеостаза, что приводит к гибели аксонов и нейронов [75].
Нарушение гомеостаза железа
Железо является важным кофактором многих процессов в ЦНС, включая образование миелина олигодендроцитами [76]. При нормальном гомеостазе обмен железа обеспечивают в ЦНС расположенные на поверхности клеток импортеры и экспортеры ионов железа, ферроксидазы и трансферрин, способствуя транспорту железа во внутриклеточное депо [77]. Воспалительная инфильтрация ЦНС и повышенная секреция таких провоспалительных цитокинов, как ФНО-α и ИЛ-6, индуцируют системный синтез основного регулятора железа гепсидина. Последний в свою очередь снижает экспрессию транспортера двухвалентного металла 1 и ферропортина на нейронах и микроглии, что ведет к повышенному внутриклеточному накоплению токсических ионов железа и усиливает окислительное повреждение клеток [78]. В дополнение к этому нейродегенерацию усиливает накопление железа в интерстициальном пространстве. Железо хранится в виде ферритина в миелиновых пластинах. При дегенерации олигодендроцитов и миелина железо высвобождается во внеклеточное пространство и может фагоцитироваться микроглией и макрофагами [79]. Дегенерация этих миелоидных клеток способствует отложению железа в межклеточном пространстве и усиливает окислительный стресс [80]. С помощью МРТ в режиме SWI (изображений, взвешенных по магнитной восприимчивости, — Susceptibility Weighted Imaging) и гистологических исследований в краевой зоне медленно увеличивающихся хронических очагов демиелинизации и глубоком сером веществе обнаружена повышенная аккумуляция железа [81]. Участки поражения при ВПРС, окруженные ободком железа, имеют более выраженные деструктивные изменения [82]. МРТ-исследования продемонстрировали, что накопление железа в глубоком сером веществе наблюдается уже на ранних стадиях заболевания, его уровень постепенно нарастает по мере прогрессирования РС [83]. Повышенный уровень железа в глубоком сером веществе приводит к нарушению связи серого и белого вещества и обусловливает в итоге утрату целостности ткани ЦНС [84]. Нарушения обмена железа в мозговой ткани, связанные с повышенным накоплением как в клетках, так и в интерстиции, ассоциированы с прогрессированием инвалидизации у пациентов с РС. Продолжительность РС и старение организма вносят дополнительный вклад, обусловленный возрастзависимым отложением железа [85].
Заключение
В настоящее время мы не можем с уверенностью сказать, какой процесс запускает каскад иммуноопосредованной гибели нейронов и аксонов при РС. Существует много доказательств как первичной демиелинизации, так и первичной цитодегенерации, в ответ на которую развивается воспаление в ЦНС. Тем не менее, согласно данным многоцентровых рандомизированных клинических исследований, чем в более ранние сроки начата высокоактивная терапия, направленная на различные иммунные мишени, тем лучшие исходы наблюдаются у пациентов [86]. Понимание механизмов, лежащих в основе прогрессирования нейродегенерации при РС, важно для разработки эффективных лекарственных средств, мишенью для которых должно быть не только аутоиммунное воспаление, но и предупреждение/подавление механизмов нейроаксональной гибели.
Авторы заявляют об отсутствии конфликта интересов.
Remyelination in Multiple Sclerosis
Martin Stangel, … Viktoria Gudi, in Neuroinflammation, 2011
Publisher Summary
Remyelination is the natural repair mechanism of demyelination, and it is proposed that remyelination protects against progressive axonal injury and consequently also diminishes long-term disability in multiple sclerosis (MS) patients. It is thought that remyelination recapitulates many steps also occurring during physiologic myelin development. Although many factors have been identified that drive this process, it is still not well understood why remyelination fails in MS. Based on postmortem histopathologic studies, it is known that remyelination of demyelinated plaques occurs in individuals with MS. Remyelination is particularly associated with early stages of the disease and acute phases, but it can also occur in later and chronic stages of the disease. Remyelination can be quite extensive in a subset of patients, but there is a profound diversity in the amount of remyelination between cases. In some cases, virtually all lesions showed signs of remyelination, whereas in others only small amounts of remyelination were found [8]. This diverse capacity to form remyelinated plaques did not correlate with clinical subtype, age of disease onset disease course, or gender. The location of a lesion influences the likelihood of remyelination, with subcortical lesions showing more signs of remyelination than periventricular or cerebellar lesions.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123849137000095
Functional Neural Transplantation IV
Natalia A. Murphy, Robin J.M. Franklin, in Progress in Brain Research, 2017
6 Concluding Remarks
Remyelination is a remarkable example of CNS regeneration. Studying the biology of this process, along with the conditions in which it fails, has led to important discoveries that are increasingly likely to become translatable into disease-modifying therapies (Table 1). Crucially, in acquired demyelinating disorders, it seems that remyelination failure is not insurmountable, and enhancing endogenous remyelination by therapeutic intervention may soon be achievable. A continued effort to identify the essential pathways and downstream effectors of the OPC differentiation process is needed to increase the range of potential therapeutic targets.
Table 1. Compounds Currently Undergoing Clinical Trials With Possible Effects on Endogenous Remyelination
| Intervention | General Description and Mode of Action | Evidence of Influence on Remyelination | Clinical Status |
|---|---|---|---|
| Lithium carbonate | Used to treat manic phase of bipolar disorder. Mode of action uncertain, though presumed to act by inhibiting the activity of PKC in the brain | LiCl shown to stimulate myelin gene expression in oligodendrocytes and promote remyelination in tissue slices (Meffre et al., 2015) | Completed pilot study in progressive MS (NCT01259388). Awaiting results |
| Clemastine fumarate | Antihistamine and anticholinergic used for treating allergy | Identified to enhance oligodendrocyte differentiation in screen, and validated to enhance remyelination in vivo in focal toxic demyelination (Mei et al., 2014) | Ongoing phase 2 trials in RRMS and optic neuritis (NCT02040298, NCT02521311) |
| Biotin (MD1003) | A.k.a vitamin B7, a coenzyme for carboxylase enzymes essential for fatty acid metabolism and gluconeogenesis | Hypothesized to enhance myelin formation (Sedel et al., 2016) | Two studies have shown a beneficial effect in progressive MS (Sedel et al., 2015; Tourbah et al., 2016). Phase 3 trials ongoing (NCT02936037) |
| Quetiapine fumarate | Atypical antipsychotic and mood stabilizer, used to treat schizophrenia, bipolar disorder, and depression. Mode of action remains uncertain | Shown to enhance remyelination in cuprizone-induced demyelination (Zhang et al., 2012) and EAE (Mei et al., 2012) | Recently started phase 1/2 trial (NCT02087631) |
| rHIgM22 | Humanized autoantibody shown to increase oligodendorcyte survival and hypothesized to enhance remyelination | Promotes OPC survival in vitro, in the presence of other glia cells (Watzlawik et al., 2013) | NCT01803867 phase 1 study awaiting results. NCT02398461 study currently recruiting participants |
| Liothyronine | Synthetic form of thyroid hormone. TH acts in a diverse manner on many cells to regulate and integrate the metabolism of the entire organism | Thyroid hormone has been shown to promote OPC differentiation in vitro and to enhance remyelination in EAE (reviewed in Calzà et al., 2005) | Two phase 1 studies recruiting participants: NCT02506751, NCT02760056 |
| Domperidone | Peripherally selective dopamine D2 receptor agonist, used to relieve nausea, increase prolactin release, or increase GI peristalsis | Prolactin enhances OPC differentiation and remyelination in mice (Gregg et al., 2007) | Two phase 2 studies ongoing: NCT02308137, NCT02493049 |
| GSK239512 | Synthetic histamine H(3) receptor antagonist | In vitro screen on primary rat OPCs identified this drug as enhancing OPC differentiation (GSK) | Phase 2 trial (NCT01772199), small positive effects observed (Schwartzbach et al., 2016) |
| Bexarotene | Retinoid X receptor gamma agonist. RXR family of nuclear receptors are transcriptional regulators in virtually every cell in the body | Upregulating RXRg signaling was shown to accelerate remyelination in focal toxic demyelinating lesion (Huang et al., 2011) | Ongoing phase 1 trial (EU2014-003145-99) |
| vx15-2503 | Humanized antisemaphorin 4D antibody. SEMA4D (CD100) is an axonal guidance molecule | SEMA4D has been shown to inhibit oligodendrocyte differentiation (Yamaguchi et al., 2012) and induce process collapse (Giraudon et al., 2004) | Phase 1 trial completed, awaiting results (NCT01764737) |
| BIIB061 | Biogen proprietary compound, undisclosed mechanism of action | Reported to be an “oral remyelinating compound” (Biogen) | Phase 1 trial completed, awaiting results (NCT02521545) |
| Olesoxime | Cholesterol-like synthetic mitochondrial pore modulator | Shown to accelerate remyelination in animal models (Magalon et al., 2012) | Phase 1 trial awaiting results (NCT01808885) |
| GNbAC1 | Humanized antibody against envelope protein of MSRV (multiple sclerosis-associated retrovirus) | The viral envelope protein has been shown to inhibit OPC differentiation (Kremer et al., 2013) | Phase 2 study currently recruiting participants (NCT02782858) |
Although we now know more than ever before about remyelination, questions still remain. Is remyelination as robust as developmental myelination in terms of supporting long-term axonal integrity? Can remyelination capacity be irreversibly exhausted? Is Schwann cell remyelination in the CNS a desired phenomenon? These and other questions will need to be answered, before we can fully comprehend the nature and harness the function of endogenous remyelination.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0079612316301856
Neuropathology
Romana Höftberger, Hans Lassmann, in Handbook of Clinical Neurology, 2018
Remyelination
Remyelination of demyelinated lesions occurs spontaneously but is often structurally and functionally incomplete. Remyelination is mediated by oligodendrocyte precursor cells (OPC) that are present in the normal white matter. During remyelination the OPCs are activated and subsequently migrate to the lesion and undergo differentiation into myelin-generating cells. Remyelinated fibers are characterized by thinner myelin sheaths and may be only encountered at the border zone of a lesion or can also fully remyelinate a lesion, which is then called a shadow plaque (Fig. 19.7 A–C). Some shadow plaques may undergo new demyelination, either within or overlapping the previously remyelinated areas (Prineas et al., 1993; Bramow et al., 2010). The extent of remyelination varies considerably between patients and seems to be more prevalent in the early stage of the disease and in lesions with inflammation and macrophage activity (Foote and Blakemore, 2005). Repair capacity is also dependent on the lesion site, with periventricular lesions showing less extensive remyelination (Patrikios et al., 2006). The lack of remyelination in a considerable number of patients has been attributed to a failure of OPC differentiation, which may be influenced by age and hormones (Chang et al., 2002; Chari et al., 2003; Kotter et al., 2011), loss of axons in the lesions (Charles et al., 2002), and the loss of macrophages in the chronic lesion.
Fig. 19.7. Remyelinating shadow plaque. Overlap of a sharply demarcated chronic inactive plaque centered by a small vein, next to a remyelinated shadow plaque on the left, characterized by thinly myelinated fibers, demonstraded in hematoxylin and eosin (A), luxol fast blue (B), and myelin basic protein (C).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128023952000195
Myelin: Structure, Function, Pathology, and Targeted Therapeutics
Joseph Hanig, Geeta Negi, in Handbook of Developmental Neurotoxicology (Second Edition), 2018
VIII Remyelination and CNS disorders: myelin to axonal regeneration
Remyelination, in a broader sense, refers to the regeneration of the myelin sheath, which reestablishes normal nerve conduction and restores normal functioning of demyelinated axons. Very little is known about the mechanism of remyelination and whether it follows a course similar to developmental myelination. Although the molecular mechanisms of remyelination need more study, they have been found to share some similarities with myelinogenesis. OPCs in the adult brain can differentiate into new myelinating oligodendrocytes and can restore normal myelin layers. Any injury to intact myelin activates a series of cellular signals that in turn activates OPCs, which consequently upregulates genes that were quiescent in the resting state. This is followed by rapid proliferation of OPCs, which migrate to the lesion site and associate with denuded axons. These OPCs then differentiate into mature oligodendrocytes, which ensheath the axons with compact myelin.11 Remyelination at the later stages is not as efficient as it is during developmental myelination and results in a thinner and shorter myelin sheath, especially for large-diameter axons. Also, as with other regenerative processes, remyelination becomes less efficient with aging.116 However, the proteolipid contents and transcription factors regulating the process are profoundly analogous to those produced during developmental myelination.117
The remyelination process is very efficient following exposure to demyelinating toxicants like cuprizone, tellurium, or lysolecithin and usually complete remyelination can be achieved. However, in certain conditions, such as MS, remyelination usually fails. There may be many reasons for remyelination failure but the failure may occur at two critical stages: (1) the recruitment stage wherein OPCs fail to populate the lesion site or (2) the differentiation stage wherein OPCs fail to differentiate into mature oligodendrocytes. Usually it is at the differentiation stage where failure occurs and this is manifested by clusters of OPCs at the demyelinated lesion site.117,118 In MS, remyelination must take place in a milieu of inflammatory elements, which by itself is unfavorable for OPCs. Therefore, in MS and other autoimmune inflammatory demyelinating conditions, failure to remyelinate axons can be attributed to an environment that is hostile to oligodendroglial progenitors, rather than incompetence of the remyelination process, per se. In addition to inflammatory components, several inhibitors of myelination have been identified at MS lesion sites: pathological changes in CNS demyelinating conditions result in aberrant deposition of fibronectin, hyaluronic acid, semaphorin 3A, LINGO-1, myelin debris, and chondroitin sulfate proteoglycans, all of which inhibit OPC differentiation as well as axonal regeneration.119 Remyelination by activation of quiescent OPCs and their recruitment to lesion sites is seen as a panacea for demyelination diseases, but before this can be achieved, a comprehensive understanding of the pathways regulating OPC differentiation during remyelination and the identification of physiological and pathological inhibitors of OPC differentiation are required.
Many demyelination conditions are frequently associated with subsequent axonal degeneration and many studies postulate that this might be due, in part, to the lack of myelin-associated trophic signals, which play a vital role in preserving axonal structure and function. For example, CNP expressed in myelin has unknown functions in myelin but seems to be indispensable for neuronal survival. The absence of the CNP1 gene in mice resulted in axonal degeneration and premature death without affecting myelin ultrastructure or stability.120 In another study, the replacement of PLP in CNS myelin with P0, a component of PNS myelin, resulted in axonal degeneration and severe neurological deficits.121 These studies reinforce the idea that the myelin sheath also provides dynamic neuroprotective signals/factors to axons and indicate that remyelination is critically advantageous in preserving axon integrity.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128094051000043
Remyelination in Multiple Sclerosis
Shyamal C. Bir, … Alireza Minagar, in Neuroinflammation (Second Edition), 2018
Failure of the Demyelination in MS
Endogenous remyelination often fails in MS, and understanding the causes of failure of remyelination is very important. Oligodendrocytes-mediated myelination of axons in the central nervous system (CNS) is a dynamic process and it involves both the cytoarchitecture and microenvironment of the brain and spinal cord.6 OPCs in adult CNS are able to proliferate and differentiate into mature oligodendrocytes, which stimulates remyelination process in the damaged axons.7–9 However, various factors are involved in failure of remyelination in demyelinated axons. Among them, the decreased number of adult OPCs over time and the failure of OPCs to mature into myelin-producing oligodendrocytes are notable.4,8 Changes in the microenvironment surrounding the damaged axon are also responsible for remyelination failure. Such undesirable alterations consist of disruption to the blood-brain barrier, disturbances in basal lamina, and vasculature leakage. These undesirable events lead to abnormal deposition of fibronectin, hyaluronic acid and chondroitin sulfate proteoglycans in the extracellular matrix which can prohibit the remyelination process.10–12 Inhibitory factors including myelin-associated glycoprotein and oligodendrocyte myelin glycoprotein (OMgp) from damaged myelin can prevent the remyelination process.13,14 In addition, Nogo-A that signals through the Nogo receptor 1 and its coreceptors p75NTR, TROY, and LINGO1 also can block the remyelination as well as regeneration of damaged myelin.15,16 Nevertheless, pro-inflammatory cytokines including semaphorin from activated innate immunity and peripheral cells can contribute to failure of remyelination.17,18 Semaphorin 3A impairs OPCs recruitment, however, semaphorin 3F overexpression in demyelinated areas accelerates not only oligodendrocyte precursor cell recruitment, but also remyelination rate.19,20 Upregulated semaphorin 4D in the demyelinated areas can cause inhibition of the remyelination as well as death of oligodendrocytes.21,22 Astrogliosis following axonal injury along with astrocyte-induced oxidative materials including reactive oxygen and nitrogen species can affect recruitment and functions of lymphocytes and oligodendrocytes to the MS lesion.23–25 Glial-neuronal network disruption among the astrocytes, oligodendrocytes, and neurons also results in metabolic deficiency, which is severe enough to cause dysfunctions and death of these cells.26–28 Age, sex, diet, and individual genetic background also can play significant roles in the failure of the remyelination process.29
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128117095000089
The pathophysiology of multiple sclerosis
Kenneth Smith, … Hans Lassmann, in McAlpine’s Multiple Sclerosis (Fourth Edition), 2006
Remyelination
Remyelination is a feature of multiple sclerosis (see Chapters 10 and 12; Prineas and Connell 1979; Prineas et al 1987; 1993b). Although it seems logical to imagine that morphological repair will result in improved conduction and the restoration of function, this cannot be assumed. In common with remyelination seen in experimental lesions, the new internodes are both thinner and shorter than normal (Gledhill and McDonald 1977; Gledhill et al 1973; B.M. Harrison et al 1972). These features will raise the internodal capacitance and reduce internodal resistance, both acting to impair conduction. Although the short internodal length will tend to compensate, this also means that new nodes are formed at sites on the axolemma previously covered by myelin, lacking the specializations characteristic of normal nodes, including the dense accumulation of the sodium channels essential for impulse formation. However, despite these limitations, serial studies of conduction in a single group of central axons undergoing demyelination and remyelination have demonstrated restoration of fast and secure conduction, probably in all remyelinated axons (Figure 13.27; K.J. Smith et al 1979; 1981). Indeed, conduction has been documented in axons ensheathed with new myelin composed of only five lamellae (Felts et al 1997). At least in thicker sheaths, not only is the velocity almost fully restored and the refractory period for transmission returned to within normal limits, but remyelinated axons can also conduct trains of impulses faithfully at high frequency (K.J. Smith et al 1979; 1981). Accordingly, remyelination has been associated with the restoration of behavioural function (Jeffery and Blakemore 1997) and it is reasonable to conclude that, where it occurs in multiple sclerosis, remyelination will contribute to the remission of clinical deficits resulting from demyelination. This view is supported by the observation that latency of the visual evoked potential progressively shortens during the two years following an attack of optic neuritis, particularly during the 3–6 months when remyelination might be expected to occur (Figure 13.28; Brusa et al 2001). The changes in visual evoked potential are accompanied by improvements in contrast sensitivity and sensitivity of the central visual field. Latency of the evoked potential may eventually be restored to normal following optic neuritis, especially in children (Figure 13.29; Kriss et al 1988). This is less predictable in adults, and the age-related differences may reflect the extent of remyelination, or greater likelihood of recurrent episodes of inflammatory demyelination in the adult optic nerve.
Remyelination restores conduction irrespective of whether it is achieved primarily by oligodendrocytes (K.J. Smith et al 1979; 1981), endogenous Schwann cells (Felts and Smith 1992), transplanted normal or frozen human Schwann cells (Honmou et al 1996; Kohama et al 2001), olfactory ensheathing cells (Imaizumi et al 1998; 2000; Utzschneider et al 1994), human neural precursor cells (Akiyama et al 2001), or bone marrow cells (Akiyama et al 2002). Although not proven beyond doubt, it seems safe to assume that each new node of Ranvier formed by remyelination will be excitable, and actually excited during conduction, as occurs in peripheral remyelinated axons (K.J. Smith et al 1982). Certainly, the new nodes have aggregations of sodium channels, at least in experimental preparations of peripheral axons (Dugandzija-Novakovic et al 1995) and central axons (Felts et al 1998).
It is understandable that the promotion of remyelination is a major research goal in multiple sclerosis, especially because repair may not only improve conduction, but also perhaps provide protection from degeneration (see Chapter 10). Furthermore, where remyelination is dependent on Schwann cells or other non-oligodendrocyte cells, the new myelin might be less vulnerable to antigen-specific inflammatory demyelination. As discussed in Chapters 10 and 19, attempts to promote remyelination are being pursued using immunological (Asakura and Rodriguez 1998; Warrington et al 2000) and biological strategies (Baron-Van et al 1997; Blakemore 2000; Blakemore and Franklin 2000; Blakemore et al 2000).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978044307271050015X
Opioid Hormones
Fei Wang, Feng Mei, in Vitamins and Hormones, 2019
1.3 Remyelination therapies
Remyelination therapies seek to reconstruct the cellular architecture and restore neuronal functions, more importantly, to preserve axons from degeneration in demyelinating diseases. Despite that remyelination can spontaneously occurs in the lesions, it often remains incomplete and insufficient (Franklin, 2002; Gilson & Blakemore, 1993). The pre-existing mature OLs are unlikely to contribute to remyelination, given that these cells are stable and stop adding new myelin segments (Keirstead & Blakemore, 1997). Rather, oligodendrocyte precursor cells (OPCs) are responsible for remyelinating the denuded axons via differentiation into mature OLs (Goldschmidt, Antel, Konig, Bruck, & Kuhlmann, 2009; Nunes et al., 2003; Patrikios et al., 2006). Evidence has shown that oligodendroglial cells are present but arrested from terminal maturation in the lesions of MS brains (Chang et al., 2002; Kuhlmann et al., 2008; Wolswijk, 1998, 2000). Indeed, abundant OPCs are evenly present in adult CNS throughout the life span and they are capable of migrating and proliferating (Hughes, Kang, Fukaya, & Bergles, 2013). Several recent lines of evidence have shown life-long myelinogenesis in the healthy mouse CNS, suggesting OPCs maintain their full abilities of differentiation, albert gradually declining while aging (Cantuti-Castelvetri & Fitzner, 2018; Hill, Li, & Grutzendler, 2018; Hughes & Orthmann-Murphy, 2018; Safaiyan et al., 2016). The access to OPCs may not the major reason that causes the failure of remyelination, since a number of OPCs are present within and adjacent to the lesions (Wolswijk, 1998). In support with this notion, addition of platelet-derived growth factor (PDGF), a mitogen to promote OPC proliferation, did not successfully accelerate remyelination (Woodruff, Fruttiger, Richardson, & Franklin, 2004). It has been hypothesized that the inhibitory signals in the microenvironment niche may block oligodendroglial differentiation, thus deactivating the inhibitory signals may represent an effective remyelination approach. One remarkable example is the utilization of anti-LINGO-1 antibody as a remyelination reagent. LINGO-1 is a potent inhibitory signal that blocks oligodendroglial differentiation and it is widely expressed by axons and myelin sheaths. It has been demonstrated that the anti-LINGO-1 antibody is efficient in promoting remyelination in the demyelination mouse models (Mi et al., 2007, 2004, 2005; Sun, Ren, Xu, & Zhang, 2015). A second strategy is to enhance endogenous oligodendroglial differentiation and myelination by using small molecule compounds. With this regard, screening and identification of remyelination-enhancing compounds may be a feasible and realistic approach (Deshmukh et al., 2013; Hubler et al., 2018; Mei et al., 2014; Najm et al., 2015). Recent efforts in screening myelination-enhancing drugs have yielded a number of potent compounds that can accelerate oligodendrocyte remyelination, and some of them are FDA-approved drugs, such as clemastine and benzatropine (Cree et al., 2018; Deshmukh et al., 2013; Jensen et al., 2018; Li, He, Fan, & Sun, 2015; Liu & Dupree, 2016; Mei et al., 2014). As a proof of concept, a recent stage-two clinical trial reveals that clemastine, an anti-allergy drug, can improve neuronal functional recovery in MS patients (Cohen & Tesar, 2017; Green et al., 2017). Together, these findings indicate that enhancing myelination may be promising and realistic approach to preserve axonal integrity and promote functional recovery in demyelination diseases.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0083672919300408
The person with multiple sclerosis: a prospectus
Alastair Compston, … John Noseworthy, in McAlpine’s Multiple Sclerosis (Fourth Edition), 2006
REMYELINATION AND AXON REGENERATION
Remyelination occupies a special role in ideas on the treatment of multiple sclerosis. To the affected person, it is an icon of hope – a holy grail – sustaining the vision of reversing chronic deficits and thereby rewriting the neurological natural history. For the clinical scientist, remyelination seems the neatest trick for protecting axons in the chronic stages, both through the direct provision of trophic support and in order to raise the threshold for further injury from residual inflammatory activity. In addition, if axonal outgrowth and connectivity could be ordered in the context of late chronic multiple sclerosis through one or other of the neurobiological strategies suggested from the identification of inhibitory molecules and growth support, it would be necessary to clothe these fragile processes with myelin in order to restore function. This analysis lifts the status of remyelination above that of a luxury – icing on the therapeutic cake – to one in which it plays an essential part in any coherent strategy for limiting and reversing the clinical deficits that invariably accumulate once recovery from the individual episode proves incomplete. The extent to which endogenous remyelination already contributes to clinical recovery, and the factors that determine the dynamics of this process, are discussed in Chapters 12 and 13. Failure of remyelination, and the reasons for this limitation from the experimental perspective, are set out in Chapter 10. So what are the prospects for making progress with this much discussed aim? It is convenient to list the issues:
- •
-
Will cessation of the inflammatory process allow sufficient repair and reversal of deficits or is assistance needed?
- •
-
Do remedies already exist that promote remyelination?
- •
-
Does suppression of the inflammatory process inhibit remyelination?
- •
-
Are some individuals good, and others bad, remyelinators; and if so, might this propensity change with time?
- •
-
Is the potential for enhancing endogenous remyelination real enough to make the concept of exogenous rescue unnecessary?
- •
-
Is there a critical period when the naked axon can be rescued by reclothing it in myelin?
- •
-
How much axonal loss can be tolerated before attempting to remyelinate ‘open space’ becomes illogical?
- •
-
How many axons must be remyelinated to achieve useful conduction through a critical pathway?
- •
-
Can axon outgrowth be promoted in order to increase the ‘theatre’ of remyelinaton?
- •
-
Which intervention provides the best ‘medicine’?
- •
-
How can the treatment most effectively be delivered and distributed?
- •
-
Which lesion(s) should be targeted?
- •
-
How should remyelination be measured in clinical studies?
- •
-
What is needed to protect neo-myelin?
The relationship between suppression of the inflammatory response and remyelination is complex. Experimental therapies increasingly need to be considered in the context of their relative impact on injury and repair. The weight of the evidence might be taken as indicating that the suppression of inflammation is a bad thing. As we discuss in Chapter 10, remyelination is most active, experimentally and perhaps also in the clinical context, during the phase of active inflammation. But that is not the whole story. M. Rodriguez and Lindsley (1992) showed enhanced remyelination in animals with Theiler’s virus demyelination treated with cyclophosphamide, or monoclonal antibodies directed against CD8 and CD4 cells; methylprednisolone increases the rate but not the extent of remyelination in a non-immune model of demyelination (Pavelko et al 1998); glatiramer acetate, which we presume mainly to suppress the inflammatory process in multiple sclerosis, increases growth factor production (Ziemssen et al 2002) and thereby possibly enhances repair.
But before investing wholesale in strategies for remyelination, it may yet be too early to conclude that effective anti-inflammatory treatment will not do enough to prevent all aspects of the natural history in multiple sclerosis, making repair an essential further part of the strategy for comprehensive management of the disease, and one that must be instituted sufficiently early in the course to save axons. Nor can we provide any evidence to sustain the hope expressed by many patients in the clinic as ‘Might I be someone with a better than average capacity for remyelination and repair?’ or can we support the clinical evidence that structure and function do recover over time by showing that genetic factors determine good and poor responders. As we discuss in Chapter 3, there is no confirmation of the single report, itself indirect, that a ciliary neurotrophic factor polymorphism confers poor regenerative potential following disease activity. Standing back from these dilemmas of neurobiological reasoning and clinical science timing, we do anticipate that clinical and neurobiological programmes of research will soon converge to the point where it is appropriate to attempt clinical trials aimed at directly restoring structure and function of strategically placed demyelinating lesions, displacing the passive attitude that treating the disease process is sufficient and may (or may not) carry the added value of improved remyelination.
Hints that endogenous repair might proceed better if only the environment of stubborn lesions could be altered, were originally provided by the observation that spontaneous remyelination is much enhanced in animals with Theiler’s murine (demyelinating) encephalomyelitis virus treated with immune serum raised by immunization with spinal cord homogenate. A decade later, the best analysis is that a family of naturally present, autoreactive, IgM antibodies acts to promote the normal reparative potential of the central nervous system. As we discuss in Chapter 18, the earliest attempts to induce remyelination using commercially prepared immunoglobulin failed to demonstrate clinical improvement as a marker of successful remyelination. These trials did not combine immunoglobulin administration with aggressive efforts to stabilize the inflammatory process, and may partly have failed on that account. Addressing the possibility of enhancing remyelination through increased availability of growth promoting molecules, Cannella et al (1998) reported that glial growth factor 2 (GGF2) enhances myelin repair in experimental model systems; this compound is currently being tested in preclinical studies for a possible human trial. Butzkueven et al (2002) have shown that leukaemia inhibitory factor promotes oligodendrocyte survival and reduces immune-mediated demyelination; and J.L. Mason et al (2003) reported that insulin-like growth factor promotes oligodendrocyte survival and enhances remyelination. Considering the complexity of myelination, it seems unlikely that the application of a single growth factor will ever solve the problem, as we discuss in Chapter 10 with respect to the experimental literature. To us, it seems unlikely that the complex task of recoating axons with a myelin sheath could be accomplished better or more easily by anything other than a member of the oligodendrocyte lineage even if, pragmatically, intermediates that stimulate endogenous cells prove easier to administer and deliver.
Remyelination requires juxtaposing cells that have the ability to re-form compact myelin close to intact naked axons. In practice, this will involve access to a cell that is proliferative and migratory because the available experimental evidence indicates that the fully differentiated oligodendrocyte is incapable of division, and intrinsically immobile. This is not surprising in view of the enormous structural complexity of oligodendrocytes, each having multiple processes anchoring the cell to several axons. It seems that only the more streamlined glial progenitor can circumvent these navigational problems; but, even then, inhibitions created physically and biologically by astrocyte scars may prove problematic. As we discuss in Chapter 10, the need somehow to enhance mobility of the remyelinating cell, perhaps through modification of integrins and other cell surface adhesion molecules that determine migration, or manipulation of the environment through which migration is set to occur, is already identified and the problem partly characterized.
When the notion that remyelination might be promoted in multiple sclerosis first arose, it was in the wake of experimental studies using gliotoxins to create focal demyelinating lesions, and their repair by cell implantation. It followed that transplantation became the paradigm for assisted repair in multiple sclerosis. The many limitations and problems that later emerged from the experimental literature made it difficult to suggest a preferred strategy or clinical protocol. Soon after, the arrival of techniques for identifying and manipulating cells of the glial lineage in vitro and in vivo led to the recognition that adult nervous systems contain oligodendrocyte precursors; and, subsequently, that these accumulate around the edge of persistently demyelinated lesions. There followed a change in emphasis whereby it became simpler and more practical to consider a strategy that exploited this availability, and had as its aims harnessing the potential for endogenous repair, with all the ethical and immunological advantages so conferred, rather than continuing to debate the problems of which cell type and how this might be delivered as the formula for success. But to come full circle, the apparent sluggish behaviour of endogenous oligodendrocyte precursors, and the delays in identifying the environmental conditions needed to coax them into activity, have to some extent been parked by the advent of stem cell biology. As we discuss in Chapter 10, the two features that suggest new possibilities are the evidence for transdifferentiation, whereby cells harvested from one source (skin or bone marrow) can be used to supply another (the nervous system), and the discovery that intravenous delivery of stem cells achieves widespread distribution to the sites of tissue injury. For all these reasons, we keep an open mind on whether the cell needed to enhance remyelination will be provided by host (local or surrogate) or donor tissue.
We do not know whether there is a critical period during which the recently demyelinated axon must be rescued by new myelin, and whether later it loses molecular arrangements that make remyelination possible. Nor is it clear how much percentage loss can be tolerated in a given pathway before function is irreversibly sacrificed, and the opening up of alternative routes or tolerating persistent disabilities become the only options. There are no firm ideas on how many fibres must be repaired in order to achieve sufficient increase in electrical activity to restore function. These issues need answers before clinical strategies are declared, but the thinking has begun. Clearly, it makes no sense to attempt remyelination in a situation where there is already extensive axon degeneration, as is now thought to be the case in patients well established in the progressive phase. For this reason, it could be argued that attempts to repair the lesions of advanced chronic progressive multiple sclerosis are futile. In Chapter 10, we discuss the mechanisms of axon degeneration and regeneration. The message is clear. Fibres in the peripheral nervous system regenerate, those in the central nervous system do not. The difference is in the environment, not the intrinsic capacity for regeneration. Already, some of the molecules that inhibit and facilitate axon growth in the central nervous system are identified; others will no doubt be added to the list – such as brain-derived neurotrophic factor (BDNF), which appears to prevent myelin-associated glycoprotein from inhibiting nerve regeneration (Cai et al 1999) – opening other therapeutic mechanisms in due course. Even now, we can speculate that the problems of progressive multiple sclerosis, attributable to axonopathy, might be improved by the use of chondroitin sulfatase, which digests extracellular matrix, and anti-Nogo antibodies, which inhibit the molecules present on myelin that limit axon outgrowth – both soon to be evaluated in the context of spinal cord injury. Trials in multiple sclerosis seem logical and appropriate.
So what are the possibilities, based on contemporary experimental evidence, for repairing demyelinated pathways? Before starting such trials, consideration must be given to how it can be proved that enhancing remyelination stabilizes tissue integrity, re-establishes saltatory conduction and restores neurological function. There is some progress in differentiating demyelinated from remyelinated lesions in the brain by imaging techniques: the magnetization transfer ratio (MTR) is significantly higher in lesions that are remyelinated (Barkhof et al 2003; Schmierer et al 2004). In some patients and some lesions, oligodendrocyte progenitor cells are lost, whereas in others the axon is degenerate or not permissive for remyelination. Any strategy for stimulating remyelination depends critically on knowing whether the key problem resides in the axon or the oligodendrocyte. Whatever decisions are ultimately taken on choice of the intervention, and the method of its delivery, an informative lesion is needed in which to assess outcomes. Clinical, imaging and other biomarkers, selected for their sensitivity and specificity in this particular context, are needed. We favour attention to a sentinel lesion rather than general measures of brain structure and constitution. Our view is that, notwithstanding the dilemma posed above, any attempts to enhance remyelination would need to be combined with adequate suppression of disease activity. We conclude that immunological processes, as they occur in the person with multiple sclerosis, do more harm than good; and we find no evidence that the short- or longer-term course of the disease has been adversely affected by immunological treatments, as would by now have become apparent were these systematically compromising repair processes and thereby advancing rates of disability and progression.
Most is known about the spinal cord and this might appear the obvious choice for a first clinical intervention. The symptoms are a major cause of disability, and can to some extent be measured using physiological and imaging techniques. Magnetic resonance imaging usually shows many lesions in series within the corticospinal tracts so that remyelinating any one would be of limited value. Cord atrophy indicating axon degeneration is usually present in patients with stable or progressive deficits. The optic nerve is attractive because the symptoms are clinically eloquent; physiological assessment and imaging are well developed. However, the natural history of optic neuritis is usually for recovery occurring over many months, making it difficult to demonstrate that intervention has altered the natural history of visual recovery. Timing would need fine judgment – waiting for the establishment of persistent visual deficits but avoiding manipulation of a nerve with degenerate axons, because the evidence is that atrophy occurs after unilateral optic neuritis despite recovery of vision (Hickman et al 2002a). The cerebellar peduncle gives rise to symptoms that can be measured, and at a site where remyelination is known to occur and can be imaged. The typical severe proximal tremor is usually unilateral. It presents early and rarely recovers spontaneously. The responsible lesion can often be identified, although the presence of multiple infratentorial abnormalities may make identification of the sentinel lesion difficult, and it has spectroscopic features consistent with preserved axons with near normal tissue integrity (Charlotte Brierley, unpublished observations).
If there is a commitment to applying advances in neurobiology to the management of disability and progression in multiple sclerosis, it is not too early to be planning the clinical science strategy. We are sensitive to the needs and aspirations of people with multiple sclerosis for whom remyelination seems to be the missing element in a comprehensive strategy for managing the disorder. At the same time, the application of new knowledge in neurobiology needs to be targeted at individuals in whom the dividend from novel interventions is most likely to be present and detectable – in the interests of the many others for whom this may represent an important adjunct to presently available (or future) therapies that successfully limit ongoing disease activity. Planning for these applications requires a sophisticated infrastructure and needs to be no less rigorous than the programme of neurobiology on which much preclinical work depends. To summarize much that has gone before, the planning must address:
- •
-
Goals: the prospect for combining existing treatments for modifying the course of multiple sclerosis with interventions that aim to restore structure and function is timely given the advances in knowledge relating to the processes of tissue damage and repair. Patients have long expected that clinical science can deliver strategies that both limit and repair the damage.
- •
-
Therapy: candidates are likely either to be cell based – sacrificing detailed knowledge of the elements needed to replace myelin sheaths and protect the underlying axons in the interests of using ‘something that works’ – or factors that act to engage host tissues and realize the potential for endogenous remyelination.
- •
-
Delivery: intravenous or intrathecal administration results in widespread delivery throughout the inflammatory neuraxis, with axonal protection and functional improvement, obviating the need for multiple stereotactic transplants – an important practical consideration and one that has (reasonably) proved a conceptual stumbling block for those asked to evaluate the possibility of cell-based therapies in recent years.
- •
-
Recipient: timing matters, selecting an epoch when the nervous system is irreversibly injured but not so degenerate as to leave no tissue amenable for repair and the restoration of function.
- •
-
Treatment of ongoing disease activity: it seems certain that disease-modifying treatment will be needed in order to maximize prospects that the intervention gains a foothold, and protects functional new myelin from further waves of tissue destruction.
- •
-
Outcomes: detailed protocols must be developed for screening the outcome of remyelination therapy, extrapolating the experience of a sentinel lesion to the disease as a whole, and selecting the anatomically defined lesion on the basis that this has objectively measurable clinical and paraclinical outcomes; assessments will include neurophysiological, imaging and clinical disability/functional measurements.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780443072710500215
MULTIPLE SCLEROSIS: REMYELINATION
JEFFERY D. KOCSIS, … CHRISTINE RADTKE, in CNS Regeneration (Second Edition), 2008
REMYELINATION BY ENDOGENOUS CELLS AND CONDUCTION IMPROVEMENT
Robust remyelination occurs following experimentally induced demyelination in spinal cord of rodents even after a few weeks (Gledhill and McDonald, 1977; Smith et al., 1979; Akiyama et al., 2004). Characteristic of remyelination the CNS are thinner and shorter internodes implying that new nodes of Ranvier have regenerated on these axons (Harrison et al., 1972; Gledhill and McDonald, 1977). Endogenous remyelination in rat spinal cord is accompanied by restoration of rapid and secure conduction (Smith et al. 1979). While structurally different from normal axons (thinner myelin and shorter internodal lengths), the remyelinated axons were able to conduct at rapid velocities and to follow high frequency stimuli. Functional improvement has been reported after endogenous remyelination of dorsal column axons (Jeffery and Blakemore, 1997). In agreement with these early physiological studies, recent work indicates that nodal sodium channels (Navl.6) and paranodal potassium channels (Kvl.2) are restored on the endogenously remyelinated axons (Black et al., 2006).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123739940500208
Functional Neural Transplantation IV
Satoshi Nori, … Hideyuki Okano, in Progress in Brain Research, 2017
4.1 Remyelination
Remyelination was achieved by grafted CNS oligodendrocytes or grafted PNS SCs. OPCs can be efficiently derived from murine and human ESCs (Brustle et al., 1999; Nistor et al., 2005) and give rise to mature myelinating oligodendrocytes when transplanted to the CNS (Brustle et al., 1999; Keirstead et al., 2005).
Previously, Yasuda et al. (2011) showed the contribution of remyelination to functional recovery following contusive SCI in mice. To isolate the effect of remyelination from other possible regenerative effects of the grafted cells, we transplanted shi-NSPCs which were obtained from myelin-deficient shiverer mutant mice alongside wild-type (wt-)NSPCs. Except for their myelinating potential, shi-NSPCs showed the same behavior as wt-NSPCs in vitro and in vivo. Myelin basic protein (MBP) was not expressed by shi-NSPCs-derived oligodendrocytes in vitro and formed much thinner myelin sheaths in vivo compared with wt-NSPCs-derived oligodendrocytes. Although shi-NSPC-grafted mice showed some locomotor and electrophysiological recovery, significantly better recovery was observed in wt-NSPC-grafted mice. These findings showed the biological importance of remyelination by the graft-derived cells for motor functional and electrophysiological recovery after the transplantation of NSPCs. In a similar study was performed by another laboratory, Salewski et al. (2015) transplanted the wt-mouse iPSC-derived NSPCs (wt-iPSC-NSPCs) and shi-mouse iPSC-derived NSPCs (shi-iPSC-NSPCs) into mouse thoracic contusion injury. They showed significantly better motor functional and electrophysiological recovery in the wt-iPSC-NSPCs group than in the shi-iPSC-NSPCs group. The compact and multilayer remyelination conveyed by wt-iPSC-NSPCs group contrasted with the inefficient myelination of shi-iPSC-NSPCs group. They concluded the importance of remyelination for SCI repair and regeneration.
Unlike the mouse cells, human NSPCs and human-iPSC-NSPCs predominantly differentiate into neurons and less mature oligodendrocytes in vitro as well as in vivo (Kobayashi et al., 2012; Nori et al., 2011; Romanyuk et al., 2015). Therefore, Numasawa-Kuroiwa et al. (2014) developed the induction method for oligodendroglial differentiation of hiPSC-NSPCs. This hiPSC-OPC-enriched NSPCs differentiated into oligodendrocytes, as well as into neurons and astrocytes. Kawabata et al. (2016) transplanted hiPSC-OPC-enriched NSPCs into the injured spinal cord of NOD-SCID mice to evaluate the therapeutic potential. Grafted hiPSC-OPC-enriched NSPCs differentiated into oligodendrocytes (34.5%), astrocytes (36.1%), and neurons (26.1%) in mouse spinal cord. Graft-derived oligodendrocytes migrated broadly into host white matter and contributed to remyelination of spared axons. Moreover, graft-derived neurons formed synapses with host mouse neurons in the injured spinal cord, the reconstruction of neuronal circuits, were also observed. The hiPSC-OPC-enriched NSPC transplanted group showed significantly better motor and electrophysiological functional recovery compared with the control group. By simply comparing the behavioral data of hiPSC-OPC-enriched NSPCs and conventional hiPSC-NSPCs, their recovery is equivalent. Therefore, further studies using larger animal SCI models may be needed for assessing the differences in functional recovery between these two cells.
Other reports showed that SCs and OECs also had the ability to wrap injured axons in peripheral myelin (Pinzon et al., 2001; Takami et al., 2002). However, they required trophic adjuvants to functionally remyelinate host axons.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0079612316301790
Рассеянный склероз
Утратил силу — Архив
Версия: Клинические рекомендации РФ 2013-2017 (Россия)
Категории МКБ:
Рассеянный склероз (G35)
Разделы медицины:
Неврология детская, Педиатрия
Общая информация
Краткое описание
Союз педиатров России
Клинические рекомендации
Рассеянный склероз
Год утверждения (частота пересмотра): 2016 (пересмотр каждые 3 года)
Рассеянный склероз (РС) – хроническое прогрессирующее инвалидизирующее заболевание нервной системы, характеризующееся диссеминированными очагами воспаления и демиелинизации с формированием вторичной диффузной дегенерации.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 500 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Кодирование по МКБ-10
G 35.0 – Рассеянный склероз
Классификация
В настоящее время не принято используемое ранее выделение клинических форм РС (оптической, цереброспинальной и мозжечковой), основанное на ведущих проявлениях заболевания, так как данные нейровизуализационных и электрофизиологических методов исследования свидетельствуют о поражении различных отделов ЦНС при любой из этих форм.
Клинические формы РС выделяют на основе типа течения заболевания:
• ремиттирующий РС (РРС);
• вторично-прогрессирующий РС (ВПРС);
• первично-прогрессирующий РС (ППРС);
• первично-прогрессирующий РС с обострениями (ППРСО).
Основными показателями течения заболевания являются наличие и частота клинически определяемых обострений и темпы нарастания неврологической симптоматики.
Обострение РС (экзацербация) – это появление новой неврологической симптоматики, выявляемой при клиническом обследовании (или усиление имевшихся ранее симптомов), продолжающееся более 24 часов. Интервалы между обострениями составляют не менее 3 месяцев. Обострения РС следует отличать от «псевдообстрений», при которых отмечается появление новой клинической симптоматики или усугубление уже имеющейся, которое может развиться на фоне сопутствующего соматического заболевания, например, при повышении температуры тела и проходит с нормализацией общего состояния. Ремиссия РС – это отсутствие новой неврологической симптоматики.
Примеры диагнозов
• Рассеянный склероз, ремитирующее течение, стадия обострения
• Рассеянный склероз, ремитирующее течение, стадия клинической ремиссии
• Рассеянный склероз, вторично-прогредиентное течение
• Рассеянный склероз, первично-прогредиентное течение
Этиология и патогенез
Несмотря на большое число исследований, посвященных изучению этиопатогенеза рассеянного склероза, причины его развития окончательно неясны. Наиболее обоснованной считается мультифакторная теория, подразумевающая сочетание генетической предрасположенности и внешних факторов (включая инфекционные агенты).
Некоторые основные положения о роли наследственных факторов подтверждаются данными многолетних исследований о генетической предрасположенности к РС, которая определяется набором генов, как связанных, так и не связанных с иммунным ответом (в зависимости от этнического своеобразия). РС является мультигенным заболеванием с вовлечением локусов, имеющих разное значение в различных этнических группах. Генетические факторы могут обусловливать своеобразие клинических форм РС; при этом возможно одновременное присутствие различных генов, влияющих на особенности патогенеза, течения и прогноз процесса демиелинизации. Единственный универсальный локус, слабо связанный с повышенным риском развития PC, был картирован на 6-й хромосоме в области Human Leukocytes Antigens (HLA) класса II главного комплекса гистосовместимости, т.е. подтвердилась хорошо известная ранее, слабая, но наиболее устойчивая ассоциация РС с определенным гаплотипом HLA, как правило, DR2 [15, 39]. Наиболее значимой эта ассоциация оказалась при обследовании случаев РС с ранним началом заболевания, то есть в возрасте до 16 лет [5].
Проявления генетической предрасположенности к РС нередко связаны с внешними факторами. Среди внешних факторов имеет значение частота перенесенных ребенком инфекций, психоэмоциональный стресс, наличие контактов с токсическими веществами (СО, мышьяк, свинец, цинк, марганец и др.), особенности питания (избыточное количество белка и жиров животного происхождения) и алиментарный дефицит по ряду витаминов (витамин D, В12 и т.д.). Накапливается все больше доказательств роли недостаточности витамина D в развитии РС. Витамин D – мощный регуляторный фактор, способный подавлять иммунопатологические реакции организма (чрезмерную активность Т1-хелперов, повреждающих миелиновую оболочку нервов), он является прямым и косвенным регулятором дифференцировки и активации CD4+ Т-клеток. Высокий уровень содержания витамина D в крови снижает риск РС (у лиц европеоидной расы); повышение уровня 25-гидроксивитамина D на каждые 50 нмоль/л уменьшает риск заболевания примерно на 40%).
Некоторые инфекционные факторы могут являться «триггерами» РС: вирусы (кори, ретровирусы, Эпштейна-Барр, другие герпесвирусы, парамиксовирусы и т.д.), микоплазмы, стафилококки, стрептококки, бледная спирохета, грибки и другие патогены [1, 32].
Теория «медленного вируса», согласно которой РС развивается и прогрессирует под воздействием неизвестного вируса (или вирусов) на сегодня утратила свою актуальность, поскольку изменения, происходящие в мозге при медленных инфекциях нервной системы, значительно отличается от таковых при РС.
Патогенез РС складывается из трёх основных патологических процессов: воспаление, демиелинизация и нейродегенерация.
Развитию воспалительной реакции в центральной нервной системе ЦНС при РС предшествует активация анергичных Т-клеток на периферии вне ЦНС с последующим проникновением аутореактивных Т-клеток через ГЭБ посредством увеличения экспрессии молекул адгезии [72]. Выход лейкоцитов из сосудистого русла осуществляется через ряд этапов: селектинопосредованная адгезия, диапедез, миграция к очагу воспаления [64].
В физиологических условиях ГЭБ имеет очень низкую проницаемость для иммунокомпетентных клеток и молекул. Обычно в ЦНС иммунная реактивность регулируется клетками микроглии и астроцитами. Другими веществами, повышающими открытость ЦНС, являются молекулы адгезии, хемокины, цитокины и матриксные металлопротеазы (ММП).
Проведенные в последние годы исследования по детализации различных звеньев патогенеза РС, в частности, показали важную роль матриксных металлопротеаз (ММП) в повышении проницаемости ГЭБ. ММП-7 и ММП-9 продуцируются астроцитами и макроглией под влиянием провоспалительных цитокинов и играют важную роль в повышении проницаемости ГЭБ, миграции аутореактивных Т-клеток в паренхиму центральной нервной системы, механизмах демиелинизации.
Проникшие в нервную систему активированные Т-клетки, вторично активированные макрофаги и клетки микроглии выделяют провоспалительные цитокины: интерферон-гамма, лимфотоксин, фактор некроза опухолей-α, что ведет к развитию ограниченной воспалительной реакции. На этом фоне начинает быстро меняться микроокружение головного мозга за счет резкого возрастания содержания медиаторов воспаления, изменяется проницаемость ГЭБ, в результате открывается доступ вторичного потока моноцитов и других клеток воспаления в ЦНС [63]. Помимо активации клеточного звена, в патогенез PC вовлекается и гуморальное звено иммунитета, повышается активность системы комплемента. В результате каскада иммунологических и биохимических нарушений развивается повреждение миелина и олигодендроцитов.
Raine C.S., Bonetti B., Cannella B. (1998) было показано, что ключевым фактором патогенеза повреждений при РС является гибель нейронов, которая реализуется как программированная гибель клетки (ПГК) (апоптоз) и патологическая клеточная смерть (некроз). В результате происходит повреждение аксонов и нейронов, степень выраженности которого варьирует по интенсивности как в различных очагах поражения у одного пациента, так и при сравнении очагов у разных больных РС. В настоящее время установлено, что в качестве индуцирующих апоптоз факторов выступают провоспалительные цитокины (фактор некроза опухолей-α, гамма-интерферон) [67].
Основные патоморфологические изменения (воспалительные бляшки) развиваются в белом веществе и характеризуются распадом миелиновых оболочек проводниковых систем в различных отделах головного и спинного мозга. Наиболее часто они локализуются в боковых и задних столбах спинного мозга, в области моста, мозжечке и зрительных нервах. Поражаются, главным образом, эволюционно молодые нервные структуры — пирамидные проводники, задние столбы спинного мозга, неперекрещенные волокна зрительного нерва. Проведенные в последние годы исследования доказали, что патологические изменения при РС также имеют место в сером веществе коры головного мозга, подкорковых образованиях и периферической нервной системе.
Проявлениями активного воспалительного процесса являются клинические обострения РС, а также появление новых очагов и накопление в них контрастного вещества при проведении МРТ головного мозга.
Одновременно с процессом демиелинизации идет и процесс ремиелинизации, что особенно заметно на краях активной бляшки. Ремиелинизация обусловливает аличие клинических ремиссий заболевания. Однако, несмотря на появление процесса ремиелинизации уже на ранних стадиях образования бляшки, восстановление миелиновой оболочки происходит недостаточно эффективно. Чем длительнее течение заболевания, тем менее выражен процесс ремиелинизации, что обусловливает прогрессирование неврологического дефицита [8].
Помимо развития воспалительных реакций, демиелинизирующего процесса и глиальных нарушений в последние годы большое внимание при PC уделяют и вовлечению в процесс аксонов. Именно аксональное повреждение считают ответственным за развитие необратимого неврологического дефицита и трансформацию ремиттирующего течения с лабильностью симптомов в виде чередования периодов ухудшения и последующего восстановления нарушенных функций во вторично-прогрессирующее с неуклонным нарастанием темпов инвалидизации пациентов [28].
Эпидемиология
В мире зарегистрировано 3 млн. случаев, в Европе – 350 тыс., в США – 450 тыс., в России – 150 тыс. [48]. При изучении эпидемиологии рассеянного склероза в Москве было установлено, что дебют заболевания до 16 лет отмечался у 5,66% пациентов [49].
Самым ранним возрастом дебюта достоверного, патоморфологически подтвержденного РС принято считать 10 мес. – клинический случай, описанный C.Shaw и E.Alvord в 1987г. [38, 50]. В Европе на педиатрический рассеянный склероз приходится до 5% всех случаев болезни [42]. Во всех популяциях женщины болеют PC в 1,5-2 раза чаще, чем мужчины. При этом у детей в возрастной группе до 10 лет частота возникновения РС примерно одинакова как у девочек, так и у мальчиков, и лишь в подростковом возрасте она значительно возрастает в женской популяции. Данная закономерность послужила одной из причин, разделения педиатрического РС на две возрастные категории: «детский” РС с дебютом заболевания до 10 лет (до начала пубертатного периода) и “ювенильный” РС с дебютом заболевания от 10 до 15 лет. Отдаленный прогноз прогрессирования заболевания, более благоприятен в группе больных с “детским” РС, в то время как пациенты с ювенильным” РС, независимо от пола, имеют более “злокачественное” течение РС с частыми обострениями и быстрым формированием стойкого неврологического дефицита [44].
Распространенность РС значительно зависит от географических зон: она наиболее низка в зоне экватора и увеличивается по мере удаления от него. Самая высокая заболеваемость РС отмечается в Северной Европе, средней части Северной Америки и на юге Австралии. Болеют преимущественно лица европеоидной расы, реже – выходцы из Азии, Африки.
Клиническая картина
Cимптомы, течение
Классическим считается волнообразное течение заболевания с периодами ухудшения и улучшения состояния, то есть ремиттирующий тип течения РС, протекающий с обострениями и ремиссиями, полным или неполным восстановлением функций в периоды между обострениями и отсутствием нарастания симптомов в периоды ремиссий. Клинические ремиссии не приводят к затуханию патологического процесса, который продолжается и при отсутствии клинических проявлений. Об этом свидетельствуют данные нейровизуализационных методов исследования, которые выявляют увеличение размеров уже имеющихся или появление новых очагов, а также накопление контрастного вещества в некоторых из них. Как правило, с течением времени ремиссии становятся менее полными и продолжительными, а у большинства пациентов РС переходит в стадию вторичного прогрессирования.
Для ВПРС характерно постепенное нарастание симптоматики с редкими обострениями (или без них), с периодами стабилизации. При этом частота трансформации ремиттирующего течения РС во вторично-прогрессирующее увеличивается по мере длительности заболевания, достигая 24%, 47%, 59%, 74% и 78% при длительности заболевания 5, 10, 15, 20 и 25 лет, соответственно.
Предсказать частоту обострений или скорость прогрессирования процесса сложно, но обычно по прошествии 15-20 лет от начала заболевания у всех больных отмечается инвалидность той или иной степени тяжести. Поскольку эффективность доступной терапии при ВПРС невысока, одной из важнейших задач лечения больных с РРС является предупреждение трансформации течения заболевания в ВПРС.
Первично-прогрессирующий тип РС отмечается у 10-15% больных и характеризуется неуклонно прогрессирующим нарастанием неврологических нарушений с самого начала заболевания и на протяжении не менее 1 года. У 25% пациентов с ППРС каждый год развития заболевания приводит к ухудшению состояния, по крайней мере, на один балл по шкале инвалидизации Куртцке (expanded disability status scale – EDSS). Течение ППРС более злокачественное, чем при ремиттирующем РС. Ранее продемонстрировано, что у всех больных с ППРС при длительности заболевания в ≥25 лет имеются существенные проблемы в самообслуживании, тогда как при вторично-прогрессирующем РС это характерно не более чем для 50% больных. У детей и подростков с РС этот тип течения встречается крайне редко.
Первично-прогрессирующий РС с обострениями характеризуется прогрессирующим нарастанием неврологического дефицита с самого начала заболевания, на фоне которого наступают обострения. Данный вариант встречается редко – в 3-5% случаев.
Диагностика
Диагностика РС, особенно в дебюте болезни, представляет некоторые трудности. Частота диагностических ошибок даже в специализированных центрах составляет около 10-15%, в связи с чем при установлении диагноза РС необходимо использовать критерии McDonald W.I. и соавт..
Диагностические критерии РС у детей и подростков соответствуют таковым у взрослых; при этом используются рекомендации (диагностические критерии), разработанные международной экспертной группой McDonald W.I. и соавт. (2001) с пересмотром и модификацией Polman C.H. и соавт. [34] (Приложение Г1).
Жалобы и анамнез
• Рекомендуется обращать внимание на наличие подострой, обычно односторонней неполной потерей зрения, сопровождающейся болезненностью при движениях глаз, афферентными нарушениями зрачковых реакций и развитием центральной или парацентральной скотомы. Снижение остроты зрения развивается обычно в течение 7- 10 дней с последующим полным или частичным восстановлением зрения
Комментарии: Наиболее часто у детей РС дебютирует оптическим невритом, обусловленным демиелинизацией зрительного нерва. Источником миелина аксонов ганглионарных клеток сетчатки, образующих зрительный нерв, являются олигодендроциты, а не шванновские клетки (в отличие от других черепных и периферических нервов), что делает миелиновую оболочку зрительных нервов идентичной миелину ЦНС. Как правило, воспаление локализуется на участке зрительного нерва от выхода его из костного канала до зрительного перекреста, поэтому чаще используют термин «ретробульбарный неврит» [70].
• Рекомендуется оценить наличие чувствительных нарушений. Характерным симптомом чувствительных расстройств является симптом Лермитта — ощущение прохождения электрического тока по позвоночнику с иррадиацией в ноги или руки при наклоне головы.
Комментарии: второй наиболее распространённой группой симптомов являются чувствительные нарушения. На ранних этапах заболевания они кратковременны и проявляются, как правило, парестезиями или снижением тактильной и болевой чувствительности, начинаясь в кончиках пальцев с последующим распространением, не всегда соответствуя топическим областям проводниковых нарушений. При дальнейшем прогрессировании заболевания развиваются нарушения глубокой чувствительности в виде асимметрии вибрационной чувствительности, значительным нарушением мышечно-суставного чувства (при длительности заболевания более 5 лет), а также нарушения температурной чувствительности и (реже) болевой синдром.
• Рекомендуется оценить наличие двигательный расстройств, а именно наличие мышечной слабости, спастичности, а также мозжечковой и сенситивной атаксии.
Комментарии: наиболее частыми двигательными расстройствами при РС являются мышечная слабость, спастичность, а также мозжечковая и сенситивная атаксия. Спастичность обусловлена демиелинизацией кортико-спинального тракта и сопровождается характерными пирамидными симптомами: повышением сухожильных и надкостничных рефлексов, появлением патологических знаков (симптом Бабинского появляется одним из первых). У части пациентов первым симптомом РС может быть острый поперечный миелит (трансверз-миелит) с развитием нижнего спастического парапареза, нарушением чувствительности (соответственно уровню поражения) и тазовых нарушений. Симптомы вовлечения мозжечка и его связей могут проявляться в виде нарушения походки и равновесия (вплоть до невозможности самостоятельно ходить), статической и динамической атаксии, дисметрии, гиперметрии, асинергии, интенционного дрожания, неточного выполнения координаторных проб, скандированной речи, мегалографии, генерализованного дрожания по типу тяжелого гиперкинеза [59].
• Для течения РС у детей характерны симптомы вовлечения ствола головного мозга и черепных нервов: глазодвигательные и бульбарные нарушения, поражение лицевого и тройничного нервов.
Комментарии: нарушения движений глаз, приводящие к двоению, часто встречаются у детей с РС, как в дебюте заболевания, так и при дальнейшем его развитии. При этом лишь изредка они обусловлены демиелинизацией отводящего, глазодвигательного или блокового нервов. Значительно чаще причиной двоения становится поражение медиального продольного пучка в стволе мозга, что приводит к развитию межъядерной офтальмоплегии.
• Тазовые расстройства чаще всего представлены задержкой мочеиспускания, которая значительно снижает качество жизни молодых пациентов с РС.
Комментарии: пациенты страдают от императивных позывов в сочетании с трудностью опорожнения мочевого пузыря, что называется детрузорно-сфинктерной диссинергией. Более того, у значительной части больных даже при отсутствии жалоб обследование выявляет неполное опорожнение мочевого пузыря. Если остаточный объём мочи после опорожнения мочевого пузыря превышает 100 мл, велик риск вторичного присоединения инфекции.
• Необходимо оценить наличие нейропсихологических нарушений: частичное или тотальное снижение когнитивных функций, аффективные расстройства (депрессия, эйфория, тревожность, панические атаки) и церебрастенические проявления (синдром хронической усталости, утомляемость).
Комментарии: Помимо стойких очаговых неврологических симптомов у пациентов с РС встречаются также пароксизмальные расстройства, длительностью обычно не более 2 минут, повторяющиеся в течение дня до нескольких сотен раз. К ним относят симптом Лермитта, лицевые миокимии, кратковременные эпизоды дизартрии, акинезии, атаксии, а также эпилептические приступы (обусловленные, вероятно, расположением бляшек вблизи коры головного мозга) [65].
• К атипичным проявлениям РС относятся афазия, гемианопсия, экстрапирамидные двигательные расстройства, выраженная мышечная атрофия, а также фасцикуляции. Отдельные клинические проявления РС с различной частотой встречаются в дебюте и в развернутой фазе заболевания [53].
Физикальное обследование
• Для балльной оценки степени выраженности неврологических нарушений рекомендуется использовать шкалу функциональных систем (ФС) [27] (см. Приложение Г2).
• Определение степени инвалидизации больного рекомендуется проводить по Расширенной шкале инвалидизации по Курцке — Expanded Disability Status Scale, EDSS (1983г.) (Приложение Г3)
Лабораторная диагностика
(Сила рекомендаций – 2; достоверность доказательств – С)
• Изменения состава цереброспинальной жидкости (ЦСЖ) при РС не патогномоничны. Рекомендуется определение олигоклональных антител к белкам миелина в ЦСЖ, а также повышение уровня иммуноглобулина G в ЦСЖ по сравнению с сывороткой крови.
Комментарии: Наиболее доказательным критерием диагностики РС является наличие олигоклональных антител к белкам миелина в ЦСЖ, а также повышение уровня иммуноглобулина G в ЦСЖ по сравнению с сывороткой крови. Олигоклональные антитела обнаруживаются у 90-95% пациентов с достоверным РС, при этом, появившись однажды, они сохраняются в ЦСЖ пожизненно. Тем не менее, существует целый ряд заболеваний, при которых также возможно появление олигоклональных антител: системная красная волчанка, острый рассеянный энцефаломиелит, синдром Гийена-Барре, нейроборрелиоз и другие. И напротив, отсутствие олигоклональных антител к белкам миелина в ЦСЖ не исключает диагноз РС, хотя и снижает вероятность его установки [70].
Инструментальная диагностика
• Рекомендуется проведение магнитно-резонансной томографии головного и спинного мозга, до и после в/в контрастирования.
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Основной параклинический метод диагностики РС — магнитно-резонансная томография головного и спинного мозга. В режиме Т2-взвешенных изображений выявляются характерные гиперинтенсивные очаги, размером обычно от 3 мм и более, овоидной формы, часто сливные, соответствующие зонам демиелинизации в головном мозге. Наиболее типичная локализация очагов — перивентрикулярно, в мозолистом теле с характерным распространением очагов из мозолистого тела в белое вещество («пальцы Доусона»), в стволе мозга, мозжечке, спинном мозге и зрительных нервах. Важным диагностическим признаком РС является «диссеминация процесса в пространстве» – выявление гиперинтенсивных очагов сразу в нескольких зонах ЦНС. С целью определения активности воспалительного процесса проводится МРТ с в/в контрастированием. Накопление контрастного вещества (гадолиний, магневист) очагами, происходящее вследствие нарушения гематоэнцефалического барьера, наблюдается как в «активных» очагах (с преобладанием воспалительных процессов), так и в «неактивных» демиелинизированных и ремиелинизированных участках мозга. При этом в активных очагах накопление контраста отмечается в виде кольца или полукольца, а неактивные очаги, как правило, накапливают контрастное вещество гомогенно [52].
• Рекомендуется в качестве дополнительного метода диагностики исследование вызванных потенциалов (зрительных, слуховых и сомато-сенсорных).
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: дополнительным методом диагностики РС может служить метод вызванных потенциалов. Удлинение латентности ответов зрительных, слуховых и сомато-сенсорных вызванных потенциалов служит наиболее ранним признаком начавшейся демиелинизации, а при ретробульбарном неврите чувствительность метода зрительных ВП составляет 100%. Однако необходимо помнить, что изменения показателей ВП не являются специфичными для РС и должны оцениваться в совокупности с клиническими и нейровизуализационными данными.
Дифференциальный диагноз
Наиболее часто РС дифференцируют с острым рассеянным энцефаломиелитом (ОРЭМ), при котором также возникают эпизоды очаговой неврологической симптоматики (как монофазные, так и повторные) и выявляются участки демиелинизации на МРТ. Однако при ОРЭМ чувствительные или двигательные расстройства обязательно должны сопровождаться нарушениями психики или нарушением сознания. Часто развитию ОРЭМ предшествует вирусная инфекция, но это не является обязательным условием постановки диагноза. В клинической картине наиболее характерно: поведенческие расстройства, нарушения психики, угнетение сознания вплоть до комы. Очаговая неврологическая симптоматика может быть представлена двигательными нарушениями, атаксией, оптическим невритом, мононевропатиями с поражением черепных нервов, дизартрией или афазией, эпилептическими приступами. Основные ориентиры при проведении дифференциальной диагностики между РС и ОРЭМ у детей представлены в Приложении Г4.
РС необходимо дифференцировать от других заболеваний, при которых поражается белое вещество головного и/или спинного мозга: новообразования (опухоли ЦНС), особенно лимфомы и глиомы полушарий, ствола и спинного мозга; дегенеративные заболевания (атаксия Фридрейха, болезни мотонейронов); болезнь Бехчета; миелопатия, вызванная человеческим Т-клеточным лимфотропным вирусом I-го типа, постинфекционный и поствакцинальный энцефаломиелит; ВИЧ-энцефалопатия; головокружение различного генеза; гиповитаминоз В12 (манифестация в виде фуникулярного миелоза); адренолейкодистрофия (АЛД). Кроме того, РС обычно дифференцируют с некоторыми формами эпилепсии, синдромом Гийена-Барре, вторичным энурезом или синдромом нейрогенной дисфункции мочевого пузыря, группой офтальмологических заболеваний, антифосфолипидным синдромом и т.д.
Лечение
Цель современной терапии РС – облегчить симптомы болезни, уменьшить активность заболевания, тем самым замедлив прогрессирование патологического процесса и дольше сохранить качество жизни пациента. В настоящее время не существует методов излечивания РС, но благодаря современным иммуномодулирующим препаратам, появилась возможность вмешиваться в естественный ход развития заболевания – препараты, изменяющие течение рассеянного склероза (ПИТРС).
Консервативное лечение
• С момента установления диагноза «Рассеянный склероз» всем пациентам показано назначение препаратов, изменяющих течение рассеянного склероза (ПИТРС), пожизненно (при хорошей переносимости) [3, 11, 13. 15, 17-20, 25, 26, 33, 41, 44-46, 59, 64, 65, 69].
(Сила рекомендаций – 1; достоверность доказательств – В)
Комментарии: Рекомендации международной исследовательской группы педиатрического рассеянного склероза (International Pediatric Multiple Sclerosis Study Group – IPMSSG) от 2012 г. предлагают начинать терапию первого ряда детям и подросткам, не лечившимся ранее и с подтвержденным диагнозом рецидивирующе-ремиттирующего PC, одной из форм интерферона-βж,7н (IFN β) или глатирамера ацетатаж,7н (GA)
В Российской Федерации зарегистрированы следующие препараты из группы ПИТРС:
• Интерферон бета–1аж,7н
— Препарат в растворе для инъекций (по 0,5 мл/22 мкг (6 млн. МЕ) и 0,5 мл/44 мкг (12 млн. МЕ).
Препарат вводится подкожно 3 раза в неделю, в одно и то же время, желательно вечером, в определенные дни недели, с интервалом не менее 48 ч. В начале терапии препаратом рекомендуется в течение первых 2-х недель вводить 8,8 микрограмма (0,1 мл 44 мкг или 0,2 мл 22 мкг), в течение 3-й и 4-й недели 22 микрограмма (0,25 мл 44 мкг или 0,5 (22 мкг), начиная с 5-й недели и далее вводить все содержимое шприца (0,5 мл 44 мкг).
— Лиофилизат для приготовления раствора для инъекций (по 30 мкг (6 млн. МЕ) в 1 мл).
Рекомендуемая доза препарата составляет 30 мкг (6 млн. МЕ) один раз в неделю, в одно и то же время, в один и тот же день недели, внутримышечно. Препарат вводится сразу после приготовления раствора. В 1 мл растворенного препарата во флаконе содержится 30 мкг (6 млн. МЕ).
Препарат вводится подкожно. Рекомендуемую дозу 0,25 мг (8 млн. МЕ), которая содержится в 1 мл приготовленного раствора; вводят через день.
Применение препаратов интерферона-бета ограничено у детей, согласно инструкции (в зависимости от производителя – применяется с 12 или с 16 лет).
В связи с этим применение препаратов в более раннем возрасте возможно только с разрешения Локального этического комитета медицинской организации, при наличии информированного согласия родителей/законных представителей и ребенка в возрасте старше 14 лет.
• Глатирамера ацетат ж,7н
Препарат вводится подкожно, ежедневно, 20 мг/сут однократно, предпочтительно в одно и то же время, длительно. Применение глатирамера ацетата ограничено у детей, согласно инструкции (с 16 лет). В связи с этим применение препаратов в более раннем возрасте возможно только с разрешения Локального этического комитета медицинской организации, при наличии информированного согласия родителей/законных представителей и ребенка в возрасте старше 14 лет.
• Пациентам, находящимся на терапии ПИТРС рекомендуется контролировать клинический анализ крови для оценки побочных эффектов не реже 1 раза в 6 месяцев [3, 17, 25, 26, 41, 46, 65, 69].
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: Наиболее частые побочные эффекты – лейкопения (обычно лимфопения), анемия, реже – тромбоцитопения. При наличии угрожающего снижения элементов крови необходимо рассмотреть вопрос об отмене препарата.
• При развитии обострения РС рекомендовано назначение пульс-терапии глюкокортикостероидами [3, 11, 35, 44]
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: Средство первого выбора при лечении обострений РС – метилпреднизолонж,вк. Доза препарата и продолжительность лечения устанавливается врачом индивидуально в зависимости от показаний и тяжести заболевания. Пульс-терапия метилпреднизолоном при обострении РС – в среднем 1 г/сут в/в (25-30 мг/кг/сут), в течение 3-7 дней, до купирования симптомов обострения. Терапия высокими дозами ГКС проводится только в стационарных условиях, в утренние часы, с учётом возраста и веса пациента, под контролем клинических и биохимических показателей периферической крови (гемоглобин, лейкоциты, тромбоциты, глюкоза, печеночные ферменты) и мочи (удельный вес, лейкоциты, белок), артериального давления в связи с возможным развитием побочных эффектов применения ГКС. При многократном применении пульс-терапии ГКС у детей с частыми обострениями РС возможно развитие вторичного иммунодефицита, гипокалиемии, остеопороза, стероидной язвы желудка, синдрома Иценко-Кушинга, сахарного диабета, тромбозов, катаракты, а также стероидного психоза.
• Пульс-терапию глюкокортикостероидами рекомендовано проводить на фоне применения препаратов-корректоров, направленных на предупреждение возникновения побочных реакций: препараты калия, кальция, селективные Н2-блокаторы, антацидные препараты [3, 35, 44].
(Сила рекомендаций – 1; достоверность доказательств – С)
• В случае тяжело купируемого обострения, при неэффективности пульс-терапии кортикостероидами рекомендуется дополнительное проведение плазмафереза (3-5 сеансов) [20, 54, 58, 61, 72].
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: Процедура плазмафереза завершается введением 0,5 – 1 г метилпреднизолона внутривенно, либо плазмаферез чередуется с введением глюкокортикоида по схеме «день — через день».
• Не рекомендовано проведение терапии глюкокортикостероидами per os [17, 20, 65].
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: Применение преднизолона per os для купирования обострений даёт неплохой клинический эффект, но в долгосрочной перспективе (в течение последующих 2 лет) приводит к более выраженной активности заболевания
• Пациентам, получающим пульс-терапию глюкокортикостероидами не реже 1 раза в год рекомендовано проведение исследования костной плотности 1 раз в год для оценки риска развития остеопороза [51, 53, 56, 61].
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: При выявлении признаков остеопороза рекомендуется проведение терапии препаратами кальция, витамина Д, альфакальцидола.
• При отсутствии снижения частоты обострений по сравнению с периодом до начала терапии ПИТРС или при наличии 3 и более обострений с проведением курсов кортикостероидов и нарастанием EDSS рекомендовано сменить препарат на другой из группы ПИТРС [4, 6, 10, 11, 16, 18, 23, 41, 45, 64, 65, 69].
(Сила рекомендаций – 2; достоверность доказательств – С)
Комментарии: При неэффективности препаратов первой линии (препараты интерферона-бета и глатирамера ацетат) применяются препараты второй линии:
— Митоксантронж
Препарат для лечения РРС, ППРС, ВПРС.
Внутривенно капельно, в течение 30 минут, из расчета 12 мг/м2 1 раз в 3 месяца, суммарная доза препарата не должна превышать 80-100 мг/м2.
Непосредственно перед внутривенным введением необходимое количество препарата концентрата разбавляют не менее чем в 50 мл 0,9% раствора натрия хлорида. Разбавленный раствор должен использоваться немедленно после приготовления.
— Натализумабж, 7н
Это препарат рекомбинантных моноклональных антител к молекулам адгезии, который применяется в виде ежемесячных внутривенных инфузий 300 мг раствора, содержащего 20 мг натализумаба. Препарат хорошо переносится, однако одним из редких, но крайне тяжёлый осложнений его применения является прогрессирующая мультифокальная лейкоэнцефалопатия (ПМЛ).
Развитие данного состояния связывают с реактивацией латентного полиомавируса JC (JCV), вызывающей массивное поражение белого вещества. В опубликованных работах, описывающих использование натализумаба у детей и подростков с РС, отмечены уменьшение клинических и МРТ-обострений и благоприятный профиль переносимости и безопасности (Huppke P. et al., 2008; Borriello G et al., 2009).
Применение натализумаба ограничено у детей, согласно инструкции (с 18 лет). В связи с этим применение препаратов в более раннем возрасте возможно только с разрешения Локального этического комитета медицинской организации, при наличии информированного согласия родителей/законных представителей и ребенка в возрасте старше 14 лет.
— Финголимодж,вк
Финголимод – пероральный синтетический модулятор сфингозин-1-фосфатных рецепторов лимфоцитов (Левин О.С. и др., 2011; Волошина Н.П. и др., 2012). При приеме финголимода необходимо с настороженностью относиться к возможным оппортунистическим инфекциям, макулярному отеку, реальный риск которых (или каких-либо других побочных действий) будет известен после многолетнего использования финголимода в клинической практике. FDA рекомендует проводить кардиоваскулярный мониторинг пациентов, что связано с повышенным риском возникновения брадиаритмии. Применение финголимода ограничено у детей, согласно инструкции (с 18 лет). В связи с этим применение препаратов в более раннем возрасте возможно только с разрешения Локального этического комитета медицинской организации, при наличии информированного согласия родителей/законных представителей и ребенка в возрасте старше 14 лет.
— Иммуноглобулины человека нормальные для внутривенного введения ж,вк
В ряде случаев для снижения частоты и выраженности обострений, замедления прогрессирования инвалидизации используется внутривенное введение иммуноглобулина G. При этом препарат может быть назначен: пациентам детского возраста; пациенткам, планирующим беременность, и в период лактации; при плохой переносимости ИФН-β и глатирамера ацетата.
Внутривенные иммуноглобулины применяются в дозировке 0,15-0,2 г/кг в течение 5 дней, а затем 1 раз в месяц по 0,15-0,2 г/кг на протяжении длительного времени. Противопоказания: гиперчувствительность (в том числе к мальтозе и сахарозе в случае препаратов, которые содержат данные вспомогательные вещества), дефицит иммуноглобулина класса A (IgA) и наличие антител против IgA. Побочные эффекты и осложнения: головная боль, головокружение, мигренозные боли, тошнота, рвота, боли в животе, диарея, боли в спине, миалгия, артериальная гипо- или гипертензия, тахикардия, чувство сдавливания или боль в грудной клетке. Редко аллергические реакции, гипертермия, коллапс, асептический менингит, острый некроз почечных канальцев.
Хирургическое лечение
Не предусмотрено.
Существуют различные методы нетрадиционного лечения РС (лечение пчёлами, пиявками, различными растительными или гомеопатическими препаратами), однако ни один из них не доказал свою эффективность при сравнительных исследованиях.
Медицинская реабилитация
В случае наличия стойких двигательных нарушений у пациентов с РС им может потребоваться проведение реабилитационных мероприятий, направленных на уменьшение спастичности в конечностях, улучшения координации (занятия на стабилоплатформе) или мелкой моторики (при наличии тремора или слабости в руках). Кроме того, дети с РС особенно требуют регулярной психологической поддержки, в связи с трудным процессом принятия диагноза и возникающими в ходе прогрессирования заболевания эмоциональные расстройства.
Прогноз
Исходы и прогноз
При РС исходы и прогноз заболевания зависят от своевременности диагностики и начала адекватной терапии болезни препаратами, изменяющими течение рассеянного склероза (ПИТРС).
Более чем у половины больных с РРС через 10 лет болезнь трансформируется в ВПРС, а через 25 лет почти у всех пациентов данной группы имеется ВПРС, эффективность терапии при котором невысока.
По прошествии 15 лет после начала заболевания, (без терапии ПИТРС) у 80% пациентов имеет место ограничение функций, у 70% – имеются трудности при самообслуживании, а 50% больных не могут передвигаться без посторонней помощи.
Для оценки прогноза РС рассчитывают временной интервал до наступления стойкой инвалидности, что соответствует 3 баллам по шкале EDSS. Помимо балльной оценки по рубрикам (и суммарно) шкалы EDSS, в учет принимаются следующие важнейшие показатели: возраст ребенка к моменту дебюта РС; клинические особенности дебюта РС; ежегодная частота обострений РС за период ремиттирующего течения (отношение количества обострений заболевания за период ремиттирующего течения к длительности этого периода, выраженного в годах); так называемый «индекс прогрессирования» РС (отношение показателей FSS к длительности заболевания, выраженной в годах), отражающий скорость нарастания неврологического дефицита; продолжительность ремиссий (особенно – первой и второй); время наступления вторичного прогрессирования; время формирования стойкого неврологического дефицита (оценка по EDSS=3 балла).
У пациентов с началом РС в детском возрасте среднее время от дебюта болезни до наступления вторичного прогрессирования составляет около 28 лет, а средний возраст пациентов к моменту трансформации РС в стадию вторичного прогрессирования – 41 год.
При дебюте РС в детском возрасте среднее время достижения по шкале EDSS уровня 4 баллов (ограниченная способность ходить, но возможность пройти более 500 м без помощи и отдыха), 6 баллов (способность ходить с односторонней поддержкой не более 100 м без отдыха), 7 баллов (способность пройти не более 10 м без отдыха, используя стену или предметы мебели в качестве опоры), составляет 20,0 лет, 28,9 года и 37,0 лет, соответственно, (а средний возраст при этом – 34,6 года, 42, 2 года и 50,5 года). Таким образом, у пациентов с началом РС в детском возрасте формирование стойкой инвалидности занимает больше времени, но это происходит в более юном возрасте, чем у больных с РС, дебютировавшем в периоде совершеннолетия.
Основными факторами, определяющими качество жизни у подростков с РС, являются хроническая усталость, депрессия, а также ситуативная и личностная тревожность.
Благодаря появлению ПИТРС, стало возможным влиять на течение заболевания, предупреждая возникновение обострений, уменьшая их выраженность, что обеспечивает замедление нарастания инвалидизации, а также в значительной мере улучшает качество жизни пациентов.
Профилактика
Профилактика и диспансерное наблюдение
К профилактическим мерам можно отнести не столько профилактику развития заболевания, сколько меры, направленные на профилактику развития обострений у пациентов с уже установленным диагнозом. К ним относятся ограничения инсоляции, перегревания, переохлаждения, а также минимизация стрессовых ситуаций, что особенно важно для подростков.
В стадии клинической ремиссии пациенты могут наблюдаться неврологом амбулаторно с обязательным осмотром 1 раз в 6 месяцев (при развитии обострения или появлении новых симптомов – чаще). Наблюдение в рамках дневного стационара показано при наличии какой-либо сопутствующей патологии или необходимости симптоматического лечения (срок госпитализации определяется неврологом и составляет от 7 до 21 дня).
Необходимо проведение регулярного обследования с выполнением МРТ головного и спинного мозга с внутривенным контрастированием 1 раз в 6 месяцев, контролем гематологических показателей (клинический анализ крови 1 раз в 3 месяца), своевременное купирование появляющихся симптомов (спастичности, дисфории, нарушений когнитивных функций).
Динамический контроль за больными с РС, с привлечением в случае необходимости специалистов различных профилей, пациента должен осуществляться в течение всей жизни пациента. Зачастую пациентам с РС необходима психологическая коррекция и поддержка, иногда – психотерапия.
Информация
Источники и литература
-
Клинические рекомендации Союза педиатров России
- Alotaibi S., Kennedy J., Tellier R., Stephens D., Banwell B. Epstein-Barr virus in pediatric
multiple sclerosis // JAMA. — 2004. — 291. — P. 1875-1879.
Banwell B., Krupp L., Kennedy J., Tellier R. et al. Clinical features and viral serologies in
children with multiple sclerosis: a multinational observational study // Lancet Neurol. — 2007. —
6. – P. 773-781.
Banwell B., Reder A.T., Krupp L., Tenembaum S., Eraksoy M., Alexey B. et al. Safety and
tolerability of interferon beta-1b in pediatric multiple sclerosis // Neurology. — 2006. — 66. — P.
472-476.
Biogen Idec. Tysabri (natalizumab) injection: full prescribing information. Revised: 08/2012
// http://www.tysabri.com/en_US/tysb/site/pdfs/TYSABRI-pi.pdf
Boiko A.N., Gusev E.I., Sudomoina M.A. et al. Association and linkage of juvenile MS with
HLA-DR2 (15) in Russians. //J. Neurology – 2002; – 58: P. 658-660.
Borriello G., Prosperini L., Luchetti A. et al. Natalizumab treatment in pediatric multiple
sclerosis: a case report // Eur. J. Paediatr. Neurol. — 2009. — 13. — P. 67-71.
Callen D.J., Shroff M.M., Branson H.M., Lotze T., Li D.K., Stephens D. et al. MRI in the
diagnosis of pediatric multiple sclerosis // Neurology. — 2009. — 72. — P. 961-967.
Caprariello A.V., Mangla S., Miller R.H., Selkirk S.M. Apoptosis of oligodendrocytes in the
central nervous system results in rapid focal demyelination // Ann. Neurol. – 2012; 72 (3):395-405.
Chabas D., Ness J., Belman A. et al. Younger children with pediatric MS have a distinct CSF
inflammatory profile at disease onset // Neurology. — 2009. In press.
Chen Y., Bord E., Tompkins T., Miller J., Tan C.S., Kinkel R.P. et al. Asymptomatic
reactivation of JC virus in patients treated with natalizumab // N. Engl. J. Med. — 2009. — 361. —
P. 1067-1074.
Chitnis T., Tenembaum S., Banwell B. et al. Consensus statement: evaluation of new and
existing therapeutics for pediatric multiple sclerosis // Multiple Sclerosis Journal. — 2012. — 18
(1). — P. 116-127.
Comunicado de la FDA sobre la seguridad de los medicamentos: Recomendaciones
modificadas para observaciуn cardiovascular y uso del medicamento Gilenya (fingolimod) para la
esclerosis multiple // http://www.fda.gov/Drugs/DrugSafety/ucm304654.htm
Duzova A., Bakkaloglu A. Central nervous system involvement in pediatric rheumatic
diseases: current concepts in treatment // Curr. Pharm. Des. — 2008. — 14. — P. 1295-1301.
Cree B.A. Acute inflammatory myelopathies/ Handbook Clinical Neurol 2014, V.122, №3.-
p.613-667
Ebers G. Prognostic factors for multiple sclerosis: the importance of natural history studies.
//J. Neurol. – 2005;Suppl 252:15-20.
European Agency for the Evaluation of Medicinal Products. Tysabri: EPAR — product
information//http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-
Product_Information/human/000603/WC500044686.pdf
Ghezzi A., Amato M.P., Annovazzi P., Capobianco M., Gallo P., La Mantia L. et al. Longterm
results of immunomodulatory treatment in children and adolescents with multiple sclerosis:
the Italian experience // Neurol. Sci. — 2009. — 30. — P. 193-199.
Ghezzi A., Amato M.P., Capobianco M. et al. Treatment of earlyonset multiple sclerosis
with intramuscular interferonbeta-1a: long-term results // Neurol. Sci. — 2007 Jun. — 28(3). — С.
127-132.
Ghezzi A., Amato M.P., Capobianco M., Gallo P., Marrosu G., Martinelli V. et al. Diseasemodifying
drugs in childhoodjuvenile multiple sclerosis: results of an Italian co-operative study //
Mult Scler (Houndmills). — 2005. — 11. – P. 420-424.
Ghezzi A., Banwell B., Boyko A. et al. The management of multiple sclerosis in children: a
European view // Mult. Scler. — 2010. — 16. — P. 1258-1267.
Gilenya (Fingolimod) Prescribing Information, May 2012. Highlights of prescribing
information// ttp://www.accessdata.fda.gov/drugsatfda_docs/label/2012/022527s008lbl.pdf
Hammarin A.L., Bogdanovic G., Svedhem V., Pirskanen R., Morfeldt L., Grandien M.
Analysis of PCR as a tool for detection of JC virus DNA in cerebrospinal fluid for diagnosis of
progressive multifocal leukoencephalopathy // J. Clin. Microbiol. — 1996. — 34. — P. 2929-2932.
Huppke P., Stark W., Zurcher C. et al. Natalizumab use in pediatric multiple sclerosis //
Arch. Neurol. — 2008. — 65. — P. 1655-1658.
Johnson T.A., Shames I., Keezer M. et al. Reconstitution of circulating lymphocyte counts
in FTY720-treated MS patients // Clin. Immunol. — 2010. — 137. — P. 15-20.
Kornek B., Bernert G., Balassy C., Geldner J., Prayer D., Feucht M. Glatiramer acetate
treatment in patients with childhood and juvenile onset multiple sclerosis // Neuropediatrics. —
2003. — 34. — P. 120-126.
Krupp L.B., Banwell B., Tenembaum S. Consensus definitions proposed for pediatric
multiple sclerosis and related disorders // Neurology. — 2007. — 68 (Suppl. 2). — P. 7-12.
Kurtzke J.F. Rating neurologic impairment in multiple sclerosis: an expanded disability
status scale (EDSS). // Neurology. – 1983. – 33 (11). – Р:1444-52.
Lucchinetti C., Brueck W., Rodriguez M., Lassmann H. Distinct patterns of multiple
sclerosis pathology indicates heterogeneity in pathogenesis // Brain Pathol.– 1996.– V. 6.– P. 259-
274.
Mikaeloff Y., Caridade G., Tardieu M. et al. Parental smoking at home and the risk of
childhood-onset multiple sclerosis in children // Brain. — 2007. — 130. — P. 2589-2595.
Mikaeloff Y., Moreau T., Debouverie M., Pelletier J., Lebrun C., Gout O. et al. Interferonbeta
treatment in patients with childhood-onset multiple sclerosis // J. Pediatr. — 2001. — 139. —
P. 443-446.
Mowry E.M., Krupp L.B., Milazzo M., Chabas D., Strober J.B. et al. Vitamin D status is
associated with relapse rate in pediatric-onset multiple sclerosis // Ann. Neurol. — 2010. — 67. —
P. 618-624.
Pohl D., Krone B., Rostasy K., Kahler E., Brunner E., Lehnert M. et al. High
seroprevalence of Epstein-Barr virus in children with multiple sclerosis // Neurology. — 2006. —
67. — P. 2063-2065.
Pohl D., Rostasy K., Gartner J., Hanefeld F. Treatment of early onset multiple sclerosis with
subcutaneous interferon beta-1a // Neurology. — 2005. — 64. — P. 888-890.
Polman C.H., Reingold S.C., Banwell B. et al. Diagnostic criteria for multiple sclerosis:
2010 revisions to the McDonald criteria // Ann. Neurol. — 2011 Feb. — 69 (2). — P. 292-302.
Ramanan A.V., Campbell-Webster N., Ota S. et al. The effectiveness of treating juvenile
dermatomyositis with methotrexate and aggressively tapered corticosteroids // Arthritis Rheum. —
2005. — 52. — P. 3570-3578.
Ranchin B., Fargue S. New treatment strategies for proliferative lupus nephritis: keep
children in mind! // Lupus. — 2007. — 16. — P. 684-691.
Rostasy K., Reindl M. Role of autoantibodies in acquired inflammatory demyelinating
diseases of the central nervous system in children/ Neuropediatricsa 2013 V.44 №6.- p.297-901
Shaw C.M., Alvord E.C. Multi ple sclerosis beginning in infancy. J Child Neurol 1987; 2:
252.256.
Szczucinski A., Losy J. Chemokines and chemokines receptors I multiple sclerosis:
Potential targets for new therapies. //Acta Neurol Scand 2007; v 115 P. 137-146.
Suppiej A., Cainelli E., Casara Y., Cappellari A., Nasadini M., Sartori S. Long- term
neurocngenitive outcome and quality of life in pediatric acute disseminated
encephalomyelitis/Pediar Neurol 2014. V.5 №4. –p.363-367
Tenembaum S.N., Segura M.J. Interferon beta-1a treatment in childhood and juvenile-onset
multiple sclerosis // Neurology. — 2006. — 67. — P. 511-513.
Tenembaum S.N.Treatment of multiple sclerosis and neuromyelitis optica in children and
adults/ Clinical neurol. Neurosyurg 2013, 115 suppl1: p.21-29
Till C., Ghassemi R., Aubert-Broche B. et al. MRI correlates of cognitive impairment in
childhood-onset multiple sclerosis // Neuropsychology. — 2011 May. — 25 (3). — P. 319-332.
Venkateswaran S., Banwell B. Pediatric multiple sclerosis // Neurologist. – 2010. – 16 (2). –
Р. 92-105.
Waubant E., Hietpas J., Stewart T., Dyme Z., Herbert J., Lacy J. et al. Interferon beta-1a in
children with multiple sclerosis is well tolerated // Neuropediatrics. — 2001. — 32. — P. 211-213.
Yeh E., Rodriguez M. Disease modifying therapy and response to treatment in pediatric MS
// Demyelinating Disorders of the Central Nervous System in Childhood / Ed. by Chabas D.,
Waubant E. — Cambridge University Press, Cambridge UK, 2010. In press.
Yeh E.A., Weinstock-Guttman B., Ramanathan M. et al. Magnetic resonance imaging
characteristics of children and adults with paediatric-onset multiple sclerosis // Brain. — 2009. —
132. — P. 3392-3400.
А.А. Баранов, Л.С. Намазова-Баранова «Атлас редких болезней» / ФГБУ «Науч. центр
здоровья детей» РАМН. – М. ПедиатрЪ, 2013. — 304 с.
Бойко А.Н, Кукель Т.М., Лысенко М.А., Вдовиченко Т.В., Гусев Е.Н. Клиническая
эпидемиология рассеянного склероза. Журнал неврологии и психиатрии.2014г, Т.114, в.2,
с.10-15
Быкова О.В., Маслова О.И., Гусева М.Р., Бойко С.Ю., Тотолян Н.А., Матвеева Т.А.,
Бойко А.Н. Рассеянный склероз у детей и подростков: история изучения проблемы и
современный опыт иммуномодулирующего лечения – Ж. Неврологии и психиатрии 2004;
104:4: 4-10
Волошина Н.П., Егоркина Проект протокола лечения педиатрического рассеянного
склероза Международный неврологический журнал 8 (54) 2012.
Высоцкая Л.М. Особенности иммунологических и нейрофизиологических
показателей у детей с рассеянным склерозом: Автореф. дис. … канд. мед. наук. – М. 2007.
Гольцова Н.В. Особенности клинической картины и эндокринного статуса у
подростков с рассеянным склерозом: Автореф. дис. … канд. мед. наук. – М. 2009.
Гузева В.И. Руководство по детской неврологии – 3 изд. – М.: Мед. информ.
агентство, 2009. – 640 с.
Гузева В.И., Чухловина М.Л. Рассеянный склероз и другие демиелинизирующие
заболевания. – М.: Миклош, 2004. — 540 с.
Гузева В.И., Чухловина М.Л. Рассеянный склероз. Диагностика и лечение (возрастные
аспекты).- СПб.: Фолиант, 2003. – 174с.
Гусев Е.И., Бойко А.Н., Столяров И.Д. Рассеянный склероз. Справочник. – М.: Реал
Тайм, 2009. – 296 с.
Ж. Айкарди Заболевания нервной системы у детей. Пер. с англ. под ред. А.А.
Скоромца Издательство: Бином и Издательство Панфилова — 2013 — 568с.
Кузенкова Л.М., Пак Л.А., Студеникин В.М., Шатилова Н.Н., Бурсагова Б.И.,
Смирнов И.Е. Опыт применения препарата интерферона бета-1aльфа в лечении рассеянного
склероза у детей // Вопросы современной педиатрии. – 2013. – N 5. – С.24-29.
Левин О.С. Основные лекарственные средства, применяемые в неврологии:
справочник / О.С. Левин – 6е изд. – М.: МЕДпресс-информ. – 2012. – 352 с.
Левин О. С., Штульман Д. Р. Неврология. Справочник практического врача 7-е изд.,
доп. и перераб. — М.: Медпресс-информ, 2011. – 1024 с.
Малашхия Ю.А. Иммунный барьер мозга. – М.: Медицина, 1986. – 147 с.
Опольский М.Б. Патогенетические механизмы нарушения гемато-энцефалического
барьера при рассеянном склерозе: Автореф. дис. … канд. мед. наук. – М. 2005.
Пак Л.А., Смирнов И.Е., Кучеренко А.Г., Кузенкова Л.М., Бурсагова Б.И., Шатилова
Н.Н. Изменения продукции матриксных металлопротеиназ и цитокинов при лечении
рассеянного склероза у детей препаратами интерферона-бета. // Российский педиатрический
журнал. – 2014. – N 1. – С.14-18.
Платонова А.Н. Качество жизни подростков с рассеянным склерозом на фоне терапии
интерферонами бета: Автореф. дис. … канд. мед. наук. М 2010.
Соколова Л.И., Кобысь Т.А., Домрес Н.В. Современные критерии Мак-Дональда в
диагностике рассеянного склероза Международный неврологический журнал 7 (53) 2012.
Смирнов И.Е., Кучеренко А.Г., Шатилова Н.Н., Кузенкова Л.М. Диагностическое и
патогенетическое значение маркеров апоптоза при рассеянном склерозе у детей. //
Педиатрия. – 2013. – N 6. – С.47-53.
Чухловина М.Л., Улицкий Л.А. Неврология: Справочник. – СПб.: Питер, 2009. – 304с.
Шатилова Н.Н. Динамика активности матриксных металлопротеиназ и маркеров
апоптоза при рассеянном склерозе у детей. [Текст]: дис…канд.мед.наук: 14.01.08: защищена
08.06.2013: утв. 28.09.2013 / Шатилова Надежда Николаевна. – Москва, 2013. – 125 с.
Шмидт Т.Е., Яхно Н.Н. Рассеянный склероз: руководство для врачей / Т.Е.Шмидт,
Н.Н.Яхно. –2-е изд. – М. : МЕДпресс-информ, 2010. – 272 с.
Шток В.Н., Левин О.С. Справочник по формулированию клинического диагноза
болезней нервной системы. – М.: Медицинское информационное агенство, 2010. – 520 с.
Яхно H.H., Штульман Д.Р. Болезни нервной системы. 2-е изд. Т. 1. – М.: Медицина,
2003. – С. 443-459.
- Alotaibi S., Kennedy J., Tellier R., Stephens D., Banwell B. Epstein-Barr virus in pediatric
Информация
Ключевые слова
• Рассеянный склероз
• Ретробульбарный неврит
• Демиелинизация
• Пульс-терапия
• Глюкокортикостероиды
• Интерферон-бета
• Качество жизни
• Шкала инвалидизации
Список сокращений
АД – артериальное давление
АКТГ – адренокортикотропный гормон
БОС – биологическая обратная связь
ВВИГ – внутривенный иммуноглобулин
ВП – вызванные потенциалы
ВПРС – вторично-прогрессирующий рассеянный склероз
ГКС – глюкокортикостероиды
ГЭБ – гематоэнцефалический барьер
КИС – клинически изолированный синдром
ЛФК – лечебная физкультура
МРТ – магнитно-резонансная томография
ОРЭМ – острый рассеянный энцефаломиелит
ПИТРС – препараты, изменяющие течение рассеянного склероза
ПМЛ – прогрессирующая мультифокальная лейкоэнцефалопатия
ППРС – первично-прогрессирующий рассеянный склероз
ППРСО – первично-прогрессирующий рассеянный склероз с обострениями
РРС – ремиттирующий рассеянный склероз
РС – рассеянный склероз
ФС – функциональная система
ЦНС – центральная нервная система
ЦСЖ – цереброспинальная жидкость
EDSS – Expanded Disability Status Scale
FDA – Food and Drug Administration (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов)
GA – глатирамера ацетат
IFN-β – интерферон-бета
IgA – иммуноглобулин A
IgG – иммуноглобулин G
IPMSSG – International Pediatric MS Study Group (международная группа по изучению педиатрического РС)
JCV – John Cunningham virus (JC-virus)
MELAS – Mitochondrial encephalomyopathy, lactic acidosis, and stroke-like episodes
NMSS – National Multiple Sclerosis Society
Термины и определения
Рассеянный склероз (РС) – хроническое прогрессирующее инвалидизирующее заболевание нервной системы, характеризующееся диссеминированными очагами воспаления и демиелинизации с формированием вторичной диффузной дегенерации.
Обострение РС (экзацербация) – это появление новой неврологической симптоматики, выявляемой при клиническом обследовании (или усиление имевшихся ранее симптомов), продолжающееся более 24 часов.
Критерии качества оказания медицинской помощи
Таблица 1 — Организационно-технические условия оказания медицинской помощи детям с РС в стадии ремиссии.
| Вид медицинской помощи | специализированная медицинская помощь |
| Возрастная группа | дети |
|
Условия оказания медицинской помощи |
стационарно, в дневном стационаре |
|
Форма оказания медицинской помощи |
плановая |
|
Фаза заболевания, другие характеристики (при наличии) |
ремиссия |
Таблица 2 — Критерии качества оказания медицинской помощи детям с РС в стадии ремиссии.
| № | Критерий |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
| 1 |
Выполнена магнитно-резонансная томография головного и спинного мозга с в/в контрастированием не реже 1 раза в год |
В | 1 |
| 2 |
Проведена терапия препаратами, изменяющими течение рассеянного склероза |
В | 1 |
| 3 |
Выполнен контроль клинического анализа крови для оценки побочных эффектов от применения препаратами, изменяющими течение рассеянного склероза не реже 1 раза в 6 месяцев |
С | 1 |
| 4 |
Выполнена смена терапии препаратами, изменяющими течение рассеянного склероза (при отсутствии снижения частоты обострений или при появлении множественных новых Т2-гиперинтенсивных очагов по данным магнитно-резонансной томографии |
С | 2 |
Таблица 3 — Организационно-технические условия оказания медицинской помощи детям с РС в стадии обострения.
| Вид медицинской помощи | специализированная медицинская помощь |
| Возрастная группа | дети |
|
Условия оказания медицинской помощи |
стационарно, в дневном стационаре |
|
Форма оказания медицинской помощи |
неотложная |
|
Фаза заболевания, другие характеристики (при наличии) |
обострение |
Таблица 4 — Критерии качества оказания медицинской помощи детям с РС в стадии обострения.
| № | Критерий |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
| 1 |
Выполнена магнитно-резонансная томография головного и спинного мозга с внутривенным контрастированием |
В | 1 |
| 2 |
Выполнена пульс-терапия препаратами группы системные глюкокортикостероиды |
В | 1 |
| 3 |
Выполнен плазмоферез (при отсутствии эффективности пульс-терапии) |
С | 2 |
Приложение А1. Состав рабочей группы
Баранов А.А., акад. РАН, профессор, д.м.н., Председатель Исполкома Союза педиатров России.
Намазова-Баранова Л.С., акад. РАН, профессор, д.м.н., заместитель Председателя Исполкома Союза педиатров России.
Кузенкова Л.М., профессор, д.м.н., член Союза педиатров России
Столярова Н.Л., к.м.н.
Бурсагова Б.И., к.м.н.
Студеникин В.М., профессор, д.м.н. член Союза педиатров России
Куренков А.Л., д.м.н., член Союза педиатров России
Гольцова Н.В., к.м.н., член Союза педиатров России
Авторы подтверждают отсутствие финансовой поддержки/конфликта интересов, который необходимо обнародовать.
Приложение А2. Методология разработки клинических рекомендаций.
Целевая аудитория данных клинических рекомендаций:
1. Врачи-педиатры
2. Детские неврологи
3. Врачи общей практики (семейные врачи);
4. Студенты медицинских ВУЗов;
5. Обучающиеся в ординатуре и интернатуре по специальностям «Педиатрия» и «Неврология».
Методы, используемые для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для оценки качества и силы доказательств:
доказательной базой для рекомендаций являются публикации, вошедшие в Кохрейновскую библиотеку, базы данных EMBASE, MEDLINE и PubMed. Глубина поиска — 5 лет.
Методы, использованные для оценки качества и силы доказательств:
• консенсус экспертов;
• оценка значимости в соответствии с рейтинговой схемой.
Методы, использованные для анализа доказательств:
• обзоры опубликованных мета-анализов;
• систематические обзоры с таблицами доказательств.
Описание методов, использованных для анализа доказательств
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности.
Результат изучения влияет на уровень доказательств, присваиваемый публикации, что в свою очередь, влияет на силу рекомендаций.
Для минимизации потенциальных ошибок каждое исследование оценивалось независимо. Любые различия в оценках обсуждались всей группой авторов в полном составе.
При невозможности достижения консенсуса привлекался независимый эксперт.
Таблицы доказательств: заполнялись авторами клинических рекомендаций.
Методы, использованные для формулирования рекомендаций: консенсус экспертов.
Индикаторы доброкачественной практики (Good Practice Points – GPPs)
Рекомендуемая доброкачественная практика базируется на клиническом опыте авторов разработанных рекомендаций.
Анализ стоимости не проводился и публикации по фармакоэкономике не анализировались.
Метод валидации рекомендаций
• Внешняя экспертная оценка.
• Внутренняя экспертная оценка.
Описание метода валидации рекомендаций
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами, которых, прежде всего, попросили прокомментировать, насколько доступна для понимания интерпретация доказательств, лежащая в основе рекомендаций.
От врачей первичного звена получены комментарии в отношении доходчивости изложения данных рекомендаций, а также их оценка важности предлагаемых рекомендаций, как инструмента повседневной практики.
Все комментарии, полученные от экспертов, тщательно систематизировались и обсуждались членами рабочей группы (авторами рекомендаций). Каждый пункт обсуждался в отдельности.
Консультация и экспертная оценка
Проект рекомендаций был рецензирован независимыми экспертами, которых, прежде всего, попросили прокомментировать доходчивость и точность интерпретации доказательной базы, лежащей в основе рекомендаций.
Для окончательной редакции и контроля качества рекомендации были повторно проанализированы членами рабочей группы, которые пришли к заключению, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок при разработке рекомендаций сведен к минимуму.
Сила рекомендаций (1-2) на основании соответствующих уровней доказательств (А-С) и индикаторы доброкачественной практики (табл. 1) – good practice points (GPPs) приводятся при изложении текста рекомендаций.
Таблица П1 — Схема для оценки уровня рекомендаций
| Степень достоверности рекомендаций | Соотношение риска и преимуществ | Методологическое качество имеющихся доказательств | Пояснения по применению рекомендаций |
|
1А Сильная рекомендация, основанная на доказательствах высокого качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот |
Надежные непротиворечивые доказательства, основанные на хорошо выполненных РКИ или неопровержимые доказательства, представленные в какой-либо другой форме. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Сильная рекомендация, которая может использоваться в большинстве случаев у преимущественного количества пациентов без каких-либо изменений и исключений |
|
1В Сильная рекомендация, основанная на доказательствах умеренного качества |
Польза отчетливо превалирует над рисками и затратами, либо наоборот | Доказательства, основанные на результатах РКИ, выполненных с некоторыми ограничениями (противоречивые результаты, методологические ошибки, косвенные или случайные и т.п.), либо других веских основаниях. Дальнейшие исследования (если они проводятся), вероятно, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. | Сильная рекомендация, применение которой возможно в большинстве случаев |
|
1С Сильная рекомендация, основанная на доказательствах низкого качества |
Польза, вероятно, будет превалировать над возможными рисками и затратами, либо наоборот | Доказательства, основанные на обсервационных исследованиях, бессистемном клиническом опыте, результатах РКИ, выполненных с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. | Относительно сильная рекомендация, которая может быть изменена при получении доказательств более высокого качества |
|
2А Слабая рекомендация, основанная на доказательствах высокого качества |
Польза сопоставима с возможными рисками и затратами |
Надежные доказательства, основанные на хорошо выполненных РКИ или подтвержденные другими неопровержимыми данными. Дальнейшие исследования вряд ли изменят нашу уверенность в оценке соотношения пользы и риска. |
Слабая рекомендация. Выбор наилучшей тактики будет зависеть от клинической ситуации (обстоятельств), пациента или социальных предпочтений. |
|
2В Слабая рекомендация, основанная на доказательствах умеренного качества |
Польза сопоставима с рисками и осложнениями, однако в этой оценке есть неопределенность. |
Доказательства, основанные на результатах РКИ, выполненных с существенными ограничениями (противоречивые результаты, методологические дефекты, косвенные или случайные), или сильные доказательства, представленные в какой-либо другой форме. Дальнейшие исследования (если они проводятся), скорее всего, окажут влияние на нашу уверенность в оценке соотношения пользы и риска и могут изменить ее. |
Слабая рекомендация. Альтернативная тактика в определенных ситуациях может явиться для некоторых пациентов лучшим выбором. |
|
2С Слабая рекомендация, основанная на доказательствах низкого качества |
Неоднозначность в оценке соотношения пользы, рисков и осложнений; польза может быть сопоставима с возможными рисками и осложнениями. | Доказательства, основанные на обсервационных исследованиях, бессистемного клинического опыта или РКИ с существенными недостатками. Любая оценка эффекта расценивается как неопределенная. |
Очень слабая рекомендация; альтернативные подходы могут быть использованы в равной степени. |
*В таблице цифровое значение соответствует силе рекомендаций, буквенное — соответствует уровню доказательности
Приложение А3. Связанные документы.
Порядки оказания медицинской помощи:
• Приказ Министерства здравоохранения и социального развития РФ от 16 апреля 2012 г. N 366н «Об утверждении Порядка оказания педиатрической помощи»
• Приказ Министерства здравоохранения Российской Федерации от 14 декабря 2012 г. № 1047н «Об утверждении Порядка оказания медицинской помощи детям по профилю «неврология»
Стандарты оказания медицинской помощи:
• Приказ Министерства здравоохранения Российской Федерации от 20 декабря 2012 г.№ 1085н «Об утверждении стандарта специализированной медицинской помощи при первом клиническом проявлении рассеянного склероза (клинически изолированном синдроме)»
• Приказ Министерства здравоохранения Российской Федерации от 24 декабря 2012 г. N 1542н «Об утверждении стандарта первичной медико-санитарной помощи при рассеянном склерозе в стадии ремиссии».
Приложение Б. Алгоритм ведения пациента
Схема 2. Лечение пациента с установленным диагнозом РС
Приложение В. Информация для пациентов.
Рассеянный склероз – это заболевание с наследственной предрасположенностью. Нет данных об однозначной связи заболевания с каким-либо геном или мутацией. Риск передачи заболевания детям существует (т.е. он выше, чем у людей без РС), однако наличие РС у родителей не обязательно означает, что ребёнок также будет болеть РС.
РС – это прогрессирующее заболевание, связанное с неправильной работой иммунной системы. Поэтому любые препараты, влияющие на иммунитет (иммуностимуляторы, иммуномодуляторы) могут ухудшить течение заболевания.
К сожалению, полностью излечить РС на данном этапе развития науки не представляется возможным. Лечение заболевания направлено на смягчение течения, урежение и облегчение обострений.
Важно лечить каждое обострение РС, несмотря на то, что некоторые проявления могут со временем пройти самостоятельно. Если Вы начинаете лечит обострение сразу же, риск необратимого поражения нервных клеток намного меньше.
При правильном лечении (регулярном приёме препаратов интерферона или копаксона или других препаратов для лечения РС, назначенных Вам врачом) и благоприятном течении заболевания продолжительность активного функционирования (без нарушения движений, координации, интеллекта) увеличивается на десятки лет. Пациенты с РС могут заводить семью, рожать детей, работать практически в любой сфере.
Однако существуют некоторые ограничения, которые снизят риск развития обострений:
• Ограничение инсоляции (не пребывать в жарком климате, на палящем солнце)
• Избегание перегревания (в том числе, баня, сауна, а также тяжёлые физ.нагрузки)
• Избегать переохлаждений и контактов с больными ОРВИ
• Минимизировать стрессовые ситуации
Эти ограничения могут потребовать даже смены любимой работы или привычного места проживания, однако не стоит забывать, что Ваше здоровье в Ваших руках.
Приложение Г1. Диагностические критерии рассеянного склероза (McDonald et al., 2010)
| Клинические проявления | Необходимые дополнительные исследования |
|
> 2 обострений, объективные клинические данные о наличии > 2 очагов |
Не требуются |
|
> 2 обострений, объективные клинические данные о наличии 1 очага и анамнез о предыдущем обострении |
Не требуются |
|
> 2 обострений, объективные клинические данные о наличии 1 очага |
МРТ: диссеминация в пространстве: • > 1 Т2-гиперинтенсивного очага, как минимум в 2 из 4 характерных для РС зонах (юкстакортикально, перивентрикулярно, инфратенториально, в спинном мозге)1 или • ожидание следующего обострения с другим топическим расположением очага |
|
1 обострение, объективные клинические данные о наличии > 2 очагов |
Диссеминация во времени: • появление на динамическом МРТ исследовании нового Т2-гиперинтенсивного очага и/или очага накапливающего контраст, независимо от срока проведения базового МРТ-исследования или • одновременное наличие на МРТ бессимптомного очага(ов) накапливающего контраст и очага не накапливающего контраст или • ожидание следующего обострения |
|
1 обострение, объективные клинические данные о наличии 1 очага (Клинически изолированный синдром – КИС) |
Соблюдение принципа диссеминации во времени и в пространстве Диссеминация в пространстве: • > 1 Т2-гиперинтенсивного очага, как минимум в 2 из 4 характерных для РС зонах (юкстакортикально, перивентрикулярно, инфратенториально, в спинном мозге)1 или • ожидание следующего обострения с другим топическим расположением очага Диссеминация во времени: • появление на динамическом МРТ исследовании нового Т2-гиперинтенсивного очага и/или очага накапливающего контраст, независимо от срока проведения базового МРТ-исследования или • одновременное наличие на МРТ бессимптомного очага(ов) накапливающего контраст и очага не накапливающего контраст или • ожидание следующего обострения |
|
Отсутствие обострений при постепенном прогрессировании неврологической симптоматики |
• прогрессирование заболевания в течение 1 года (ретроспективно или проспективно) И наличие как минимум 2 из 3 критериев1: • соблюдение принципа диссеминации в пространстве: 1 или более Т2-гиперинтенсивных очагов, расположенных в типичных для РС областях: юкстакортикально, перивентрикулярно или инфратенториально; • соблюдение принципа диссеминации в пространстве: > 2 Т2-гиперинтенсивных очагов в спинном мозге; • характерные изменения ЦСЖ (наличие олигоклональных групп IgG в ЦСЖ или повышенный индекс IgG) |
1 – не требуется обнаружение контраст-позитивных очагов; клинически значимые очаги (дающие симптоматику) в стволе головного мозга или спинном мозге не принимаются в расчёт.
Приложение Г2. Шкала функциональных систем
Для балльной оценки степени выраженности неврологических нарушений используется шкала функциональных систем (ФС) (Kurtzke J.F. 1983)
0 — Норма
1 — Патологические знаки без нарушения функций
2 — Минимальные нарушения
3 — Легкий или умеренный парапарез или гемипарез (выявляемая мышечная слабость при сохранении основной функциональности, утомляемость) или тяжелый монопарез (практически полная потеря функции одной конечности)
4 — Выраженный парапарез или гемипарез (двигательные функции значительно нарушены) или умеренный тетрапарез (двигательные функции снижены, но могут кратковременно поддерживаться) или моноплегия
5 — Параплегия, гемиплегия или выраженный тетрапарез
6 — Тетраплегия
Мозжечковые функции
0 — Норма
1 — Патологические знаки без нарушения функций
2 — Легкая атаксия (тремор или лёгкая неуклюжесть, минимально нарушающие функционирование)
3 — Умеренная туловищная или конечностная атаксия (тремор или неловкость движений, нарушающие функционирование во всех сферах)
4 — Выраженная атаксия всех конечностей (большинство функций значительно затруднены)
5 — Неспособность выполнять координированные движения из-за атаксии
Стволовые функции
0. Норма
1 — Патологические знаки без нарушения функций
2 — Умеренный нистагм или другие легкие нарушения
3 — Выраженный нистагм, значительная слабость глазодвигательных мышц или умеренное нарушение функций других черепных нервов
4 — Выраженная дизартрия или другие выраженные нарушения
5 — Неспособность глотать и/или говорить
Сенсорные функции
0 — Норма
1 — Снижение только вибрационной или двумерно-пространственной чувствительности в 1 или 2 конечностях
2 — Легкое снижение тактильной или болевой, или мышечно-суставной чувствительности и/или умеренное снижение вибрационной чувствительности в 1 или 2 конечностях; или снижение только вибрационной или двумерно-пространственной чувствительности в 3 или 4 конечностях
3 — Умеренное снижение тактильной и болевой или мышечно-суставной чувствительности и/или почти полная потеря вибрационной чувствительности в 1 или 2 конечностях; или легкое снижение тактильной или болевой и/или умеренное снижение всех видов проприоцептивной чувствительности в 3 или 4 конечностях
4 — Значительное снижение тактильной или болевой, или проприоцептивной чувствительности, изолированно или одновременно, в 1 или 2 конечностях; или умеренное снижение тактильной или болевой и/или выраженное снижение проприоцептивной чувствительности более чем в 2 конечностях
5 — Потеря (почти полная) чувствительности в 1 или 2 конечностях; или умеренное снижение тактильной или болевой и/или потеря проприоцептивной чувствительности в большей части тела ниже головы
6 — Чувствительность почти полностью отсутствует во всем теле ниже головы
Функции мочевого пузыря и кишечника
0 — Норма
1 — Небольшая неуверенность при мочеиспускании, императивные позывы или задержка
2 — Умеренная неуверенность при мочеиспускании, императивные позывы, задержка мочеиспускания или стула, или изредка недержание (периодическая необходимость самостоятельной катетеризации, ручного сдавления мочевого пузыря или ручной эвакуации стула)
3 — Частое недержание мочи
4 — Необходимость почти постоянной катетеризации и мер по опустошению кишечника
5 — Потеря функции мочевого пузыря
6 — Потеря функции кишечника и мочевого пузыря
Зрительная функция
0 — Норма
1 — Скотома и снижение остроты зрения (с коррекцией) не ниже 20/30 (0,67)
2 — Скотома на худшем глазу и максимальная острота зрения (с коррекцией) от 20/30 до 20/59 (0,67-0,34)
3 — На худшем глазу большая скотома или умеренное сужение полей зрения, с максимальной остротой зрения (с коррекцией) от 20/60 до 20/99 (0,33-0,2)
4 — На худшем глазу выраженное сужение полей зрения, максимальная острота зрения (с коррекцией) от 20/100 до 20/200 (0,1-0,2); нарушения, перечисленные в п. 3, в сочетании с максимальной остротой зрения на лучшем глазу не более 20/60 (0,3)
5 — На худшем глазу максимальная острота зрения (с коррекцией) менее 20/200 (0,1); нарушения, перечисленные в п. 4, в сочетании с максимальной остротой зрения на лучшем глазу не более 20/60 (0,3)
6. Нарушения, перечисленные в п. 5, в сочетании с максимальной остротой зрения на лучшем глазу не более 20/60 (0,3)
Функции мышления
0 — Норма.
1 — Только колебания настроения/небольшая утомляемость (не влияет на балл EDSS)
2 — Небольшое снижение интеллекта
3 — Умеренное снижение интеллекта
4 — Выраженное снижение интеллекта
5 — Деменция
Приложение Г3. Расширенная шкала инвалидизации по Курцке — Expanded Disability Status Scale, EDSS, 1983
0.0 — Норма в неврологическом статусе (0 по всем функциональным системам).
1.0 — Признаков инвалидизации нет, минимальные признаки нарушений в одной ФС (1 уровень нарушений), исключая ФС «Функции мышления».
1.5 — Признаков инвалидизации нет, минимальные признаки нарушений (1 уровень) в более чем одной ФС, за исключением ФС «Функции мышления».
2.0 — Легкие признаки инвалидизации, нарушения 2 уровня в одной ФС, в остальных – 0 или 1.
2.5 — Легкие признаки инвалидизации, нарушения 2 уровня в двух ФС, в остальных – 0 или 1.
3.0 — Пациент ходячий с умеренными признаками инвалидизации, нарушения 3 уровня в одной ФС (остальные 0 или 1) либо нарушения 2 уровня в трёх или четырёх ФС, в остальных – 0 или 1.
3.5 — Пациент ходячий с умеренными признаками инвалидизации, нарушения 3 уровня в одной ФС и 2 уровня в одной или двух ФС; или нарушения 3 уровня в двух ФС; или нарушения 2 уровня в пяти ФС.
4.0 — Пациент ходячий, посторонней помощи не требует, самообслуживание сохранено. Проводит в повседневной активности около 12 часов в день несмотря на наличие тяжёлых нарушений (4 уровень) в одной ФС (остальные – 0 или 1) или сочетания менее выраженных нарушений, выходящих за рамки предыдущей ступени. Может пройти без посторонней помощи или остановки около 500 м.
4.5 — Пациент ходячий, посторонней помощи не требует. Активен большую часть дня, может работать в течение полного рабочего дня. Возможна необходимость в небольшой помощи. Относительно серьёзные признаки инвалидизации, как правило проявляющиеся нарушениями 4 уровня в одной из ФС (остальные 0 или 1) или сочетанием менее выраженных нарушений, не входящих в рамки предыдущей ступени. Может пройти без посторонней помощи или остановки около 300 м.
5.0 — Может пройти без посторонней помощи или остановки около 200 м.
Повседневная активность нарушена (например, не может работать полный день без специальной помощи). Обычно 5 уровень нарушений в одной из ФС (остальные 0 или 1) или сочетание менее выраженных нарушений, не входящих в рамки предыдущей ступени (4,0 баллов).
5.5 — Может пройти без посторонней помощи или остановки около 100 м. Активность в течение всего дня невозможна. Обычно 5 уровень нарушений в одной из ФС (остальные 0 или 1) или сочетание менее выраженных нарушений, не входящих в рамки предыдущей ступени (4,0 баллов).
6.0 — Есть необходимость периодической или односторонней поддержки (трость, костыли), чтобы пройти около 100 м с отдыхом или без. Обычно сочетание нарушений 3 уровня и выше более, чем в двух ФС.
6.5 — Ходьба с постоянной двусторонней поддержкой (трость костыли) около 20 м без отдыха. Как правило, сочетание нарушений 3 уровня и выше более, чем в двух ФС.
7.0 — Не может пройти более 5 м, даже с посторонней помощью. Прикован к инвалидной коляске, в которой передвигается самостоятельно. Повседневная активность в инвалидной коляске 12 часов в день. Обычно эквивалентно сочетанию нарушений 4 уровня и выше в более, чем одной ФС. Очень редко нарушения 5 уровня только в пирамидной системе.
7.5 — Может пройти всего несколько шагов. Передвигается только в инвалидной коляске. Может нуждаться в помощи при передвижении. Не может находиться в инвалидной коляске в течение всего дня. Может потребоваться инвалидное кресло с мотором. Обычно соответствует сочетанию нарушений 4 уровня и выше более, чем в одной ФС.
8.0 — Прикован к кровати или креслу, может быть транспортирован в инвалидной коляске. Может находиться вне постели большую часть дня. Основные функции самообслуживания сохранены. Активно пользуется руками. Как правило, соответствует сочетанию нарушений 4 уровня в нескольких ФС.
8.5 — Прикован к постели большую часть дня. В некоторой степени может пользоваться руками. Самообслуживание частичное. Обычно эквивалентно сочетанию нарушений 4 уровня в нескольких ФС.
9.0 — Беспомощный, прикованный к постели больной. Может вступать в контакт и есть. Соответствует сочетанию нарушений 4 уровня в большинстве ФС.
9.5 — Полностью беспомощный, прикованный к постели больной. Неконтактен или не может есть/глотать. Нарушения 4 уровня практически во всех ФС.
10.0 — Смерть из-за рассеянного склероза.
Приложение Г4. Дифференциальная диагностика рассеянного склероза и ОРЭМ
Приложение Д. Расшифровка примечаний.
… ж – лекарственный препарат, входящий в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2016 год (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
… вк – лекарственный препарат, входящий в Перечень лекарственных препаратов для медицинского применения, в том числе лекарственных препаратов для медицинского применения, назначаемых по решению врачебных комиссий медицинских организаций (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
… 7н – препараты из перечня 7 нозологий (Распоряжение Правительства РФ от 26.12.2015 N 2724-р)
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.