From Wikipedia, the free encyclopedia
The squid giant axon is the very large (up to 1.5 mm in diameter; typically around 0.5 mm) axon that controls part of the water jet propulsion system in squid. It was first described by L. W. Williams[1] in 1909,[2] but this discovery was forgotten until English zoologist and neurophysiologist J. Z. Young demonstrated the axon’s function in the 1930s while working in the Stazione Zoologica in Naples, the Marine Biological Association in Plymouth and the Marine Biological Laboratory in Woods Hole.[3][4] Squids use this system primarily for making brief but very fast movements through the water.
On the underside of the squid’s body, between the head and the mantle, is a siphon through which water can be rapidly expelled by the fast contractions of the body wall muscles of the animal.
This contraction is initiated by action potentials in the giant axon.
Action potentials travel faster in a larger axon than a smaller one,[5] and squid have evolved the giant axon to improve the speed of their escape response. The increased radius of the squid axon decreases the internal resistance of the axon, as resistance is inversely proportional to the cross sectional area of the object. This increases the space constant (

In their Nobel Prize-winning work uncovering ionic mechanism of action potentials, Alan Hodgkin and Andrew Huxley performed experiments on the squid giant axon, using the longfin inshore squid as the model organism.[7] The prize was shared with John Eccles. The large diameter of the axon provided a great experimental advantage for Hodgkin and Huxley as it allowed them to insert voltage clamp electrodes inside the lumen of the axon.
While the squid axon is very large in diameter it is unmyelinated which decreases the conduction velocity substantially. The conduction velocity of a typical 0.5 mm squid axon is about 25 m/s. During a typical action potential in the cuttlefish Sepia giant axon, an influx of 3.7 pmol/cm2 (picomoles per centimeter2) of sodium is offset by a subsequent efflux of 4.3 pmol/cm2 of potassium.[8]
See also[edit]
- Lateral giant neuron
- Squid giant synapse
- Hodgkin–Huxley model
References[edit]
- ^ Kingsley, J. S. (1913). «Obituary. Leonard Worcester Williams». The Anatomical Record. 7: 33–38. doi:10.1002/ar.1090070202.
- ^ Williams, Leonard Worcester (1909). Anatomy of the Common Squid: Loligo pealii, Lesueur. Leiden, Holland: Library and Printing-office late E.J. Brill. p. 74. OCLC 697639284 – via Internet Archive.
- ^ Young, J.Z. (April 1938). «The Functioning of the Giant Nerve Fibres of the Squid». Journal of Experimental Biology. 15 (2): 170–185. doi:10.1242/jeb.15.2.170 – via The Company of Biologists Ltd.
- ^ Young, J.Z. (June 1985). «Cephalopods and Neuroscience». Biological Bulletin. 168 (3S): 153–158. doi:10.2307/1541328. JSTOR 1541328.
- ^ Purves, Dale; Augustine, George J.; Fitzpatrick, David; Katz, Lawrence C.; LaMantia, Anthony-Samuel; McNamara, James O.; Williams, S. Mark (2001). Neuroscience. 2nd edition. Sunderland, MA.
{{cite book}}: CS1 maint: date and year (link) - ^ Holmes, William (2014). «Cable Equation». In Jaeger, Dieter; Jung, Ranu (eds.). Encyclopedia of Computational Neuroscience. New York, NY: Springer. doi:10.1007/978-1-4614-7320-6. ISBN 978-1-4614-7320-6. S2CID 29482994. Retrieved August 30, 2020.
- ^ Hodgkin AL, Huxley AF (August 1952). «A quantitative description of membrane current and its application to conduction and excitation in nerve». The Journal of Physiology. 117 (4): 500–44. doi:10.1113/jphysiol.1952.sp004764. PMC 1392413. PMID 12991237.
- ^ Plonsey, Robert; Barr, Roger C. (2007). Bioelectricity: A Quantitative Approach (3rd ed.). New York, NY: Springer. p. 109. ISBN 978-0-387-48864-6.
Intermediate Filament Proteins
Philip Grant, Harish C. Pant, in Methods in Enzymology, 2016
2 Squid Giant Fiber System
The giant axon is the largest of 8–10 third-order giant axons arising in the stellate ganglion that innervate the circular muscles of the mantle, contractions of which underlie the rapid jet propulsion mode of squid swimming behavior (Fig. 1A). Each giant axon originates from the fusion of many axons of small neurons in the GFL (Martin, 1965; Young, 1939) thereby increasing axon diameter (up to 1 mm) to facilitate rapid impulse transmission essential to the escape response (Otis & Gilly, 1990; Young, 1938). Giant axons receive input via axon-axonal synapses within a giant synapse in the ganglion from second-order giant fibers in the squid brain (Martin & Miledi, 1975; Williamson & Chrachri, 2004; Young, 1973).
Figure 1. Squid giant fiber system: (A) Diagram of Loligo stellate ganglion showing giant axons, GF3, exiting the ganglion in stellate nerves (S.N.) to innervate mantle muscles (M). Axons of small cells in giant fiber lobe (GFL) fuse to form giant axons. Second-order giant fibers (GF2), from the brain, in the pallial nerve (P.N.) enter the ganglion where they synapse with giant axons in the giant synapse region (SYN). (B) Stellate ganglion with stubs of attached giant axons (a.) appearing as clear areas in stellate nerves (S.N.). GIS is neuropil region of the ganglion showing how cell bodies of the giant fiber lobe (GFL) are dissected from the body of the ganglion.
Panel (A) modified after Young (1939), fig. 11. Panel (B) modified after Tytell et al. (1990), fig. 1, Wiley-Liss.
Three major cytoskeletal structures contribute to the cytoskeletal scaffolding underlying the axonal architecture, MTs, MFs, and NFs. In addition, MAPs, myosins, and the various molecular motors kinesin and dynein contribute to the dynamics of axonal transport and function. Fast and slow axon transport include vesicular cargos of transmitters, modulators, receptor proteins, and ion channels, while larger oligomers of tubulin and NFs exchange slowly with a stable MT–NF lattice core (Adams & Gillespie, 1988; Allen et al., 1982; Brady, Lasek, & Allen, 1982; Brady et al., 1985; Galbraith, Reese, Schlief, & Gallant, 1999). Mitochondria are the largest organelles transported from cell body to the neuromuscular synapses in mantle muscle (Brinley & Tiffert, 1978; Pratt, 1986).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0076687915005510
Glial Cells: Invertebrate☆
J.A. Coles, in Reference Module in Biomedical Sciences, 2015
Possible role of glial cells in homeostasis of extracellular K+ around the giant axon of the squid
The giant axon of the squid (a cephalopod) is unmyelinated but achieves a high conduction velocity by having a large diameter, which can exceed 500 μm. It is surrounded by a thin continuous sheath composed of Schwann glial cells, each approximately 2 μm thick, 20 μm wide, and 100–600 μm long. This sheath is further surrounded by connective tissue. The ion channels of both the axon and the Schwann cells are well characterized.
Two Schwann cell conductances have been described – an L-type Ca2 + conductance and an outwardly rectifying K+ conductance activated by entry of Ca2 +. These currents are functionally almost identical to conductances found on mammalian Schwann cells. Although propagation of action potentials along the axon causes release of K+ through the axon membrane, little increase in [K+] in the periaxonal space is observed in healthy squid nerves. The K+ conductances of the Schwann cells are not suited to clearing K+. Possibly, [K+] does not rise excessively simply because the extracellular space is large.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383046134
Cytoskeleton and Intracellular Motility
Merri Lynn Casem BA, PhD, in Case Studies in Cell Biology, 2016
Methods
Preparation of dissociated axoplasm
The giant axon was dissected from the squid L. pealeii in running seawater. Axons were stored in liquid nitrogen. To make a dissociated axoplasm preparation, an axon was thawed and the axoplasm extruded onto a glass coverslip. 20 μL of motility buffer containing 2 mM ATP was added and a second glass coverslip was placed on top of the sample and light pressure was applied.
Preparation of vesicles and supernatant from axoplasm
Axoplasm from 6–8 axons was placed in 50 μL of cold motility buffer supplemented with a protease inhibitor cocktail and homogenized by pipetting multiple times, using a 200 μL pipette. The homogenate was centrifuged at 10,000g for 4 min at 4°C, and the supernatant was carefully collected. The pellet was resuspended in 60 μL of the same homogenization buffer and centrifuged as before. Supernatants were combined to form the S1 supernatant.
The S1 supernatant was treated with 20 μM taxol and 1 mM GTP for 25 min at 23°C to induce MT polymerizastion. The taxol-treated S1 supernatant was then layered onto sucrose gradient and centrifuged at 150,000g for 60 min at 4°C using a swinging bucket rotor. The top 50 μL of the gradient, containing the S2 high-speed supernatant, was collected with a 200 μL pipette and kept on ice. Vesicles gathered at the 35% sucrose interface and were collected by puncturing the side of the tube. The MT fraction was discarded.
Preparation of squid optic lobe microtubules
Optic lobes were dissected from 8–10 squid and placed in a buffer containing a protease inhibitor cocktail and homogenized using a Dounce homogenizer. The homogenate was centrifuged at 30,000g for 30 min at 4°C. The supernatant was collected and centrifuged for 140,000g for 90 min at 4°C. The final supernatant was collected and mixed with taxol and GTP to a final concentration of 20 μM and 1 mM, respectively. The mixture was incubated for 20 min at 23°C to promote MT polymerization followed by centrifugation through a 15% sucrose cushion at 27,000g for 1 h. The pellet was gently resuspended in buffer containing taxol and GTP. To remove MT-associated proteins (MAPs) 1 mL of the taxol pellet was incubated with 0.5 mL of a 3 M NaCl solution in buffer containing taxol and GTP for 15 min at 23°C. Salt-extracted MTs were then pelleted by centrifugation at 35,000g for 30 min at 4°C. The pellet was washed with buffer and resuspended as described previously.
In vitro motility assay
Salt-washed squid optic lobe MTs (1 μL from a 500 μg/mL stock) were added to a glass coverslip followed by the addition of 3 μL of the S2 supernatant. If MT motility was being assayed, then a second coverslip was placed on top of the sample and motility was analyzed with video microscopy.
For assaying organelle motility, 4 μL of the organelle fraction was added to 1 μL of salt-washed MTs in the presence or absence of the S2 supernatant. Organelle motility was measured using video microscopy. The influence of various inhibitors was tested by adding 2 μL of a concentrated stock solution to the organelle mix.
Movement of carboxylated latex beads was assayed using coverslips that were treated overnight with poly-d-lysine, to adhere the MTs to the coverslip surface. Beads were diluted in motility buffer and mixed with S2 supernatant in a ratio of one part beads to four parts S2 and incubated for 5 min on ice. MTs and S2-treated beads were added to the poly-d-lysine–coated coverslips and observed using video microscopy.
Electron microscopy
Negative stain images of MTs and vesicles were made by applying one drop of MT, supernatant, or organelle fractions onto a formvar-coated copper grid for 30 s. The grid was washed with several drops of motility buffer and placed on a drop of 1% uranyl acetate for 30 s, then dried with filter paper. Specimens were examined using a transmission electron microscope.
- ■
-
Speculate on the reason for including a mixture (cocktail) of protease inhibitors in the motility buffer.
- ■
-
Create a flow chart that outlines the steps required to obtain the S2 supernatant used in these experiments.
- ■
-
What was the final concentration of NaCl used to remove MT-associated proteins (MAPs) from the surface of squid optic lobe MTs?
- ■
-
Characterize the nature of the MT–MT-associated protein interactions given that they can be disrupted by high salt concentration.
- ■
-
What concentration of MT protein is used in the in vitro motility assay?
- ■
-
Discuss how negative stain EM images differ from more traditional EM images.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128013946000063
Volume 2
Mark O. Bevensee, Walter F. Boron, in Seldin and Giebisch’s The Kidney (Fifth Edition), 2013
Involvement of K+ and HCO3−; Energetics
In the squid giant axon dialyzed with a fluid containing K+, but lacking Na+ and Cl−, the cotransporter moves K+ and HCO3− out of the axon, eliciting a pHi decrease.265 Under the appropriate conditions, the K+/HCO3− cotransporter can also operate in the forward direction, moving HCO3− into the squid giant axon.268,269 Exposing axons dialyzed with a fluid devoid of K+, Na+, and Cl− to an artificial seawater containing K+ and CO2/HCO3− elicits a pHi decrease (due to CO2 entry), followed by a pHi increase (due to K+/HCO3− influx). The HCO3− fluxes mediated by K+/HCO3− cotransporter can be enhanced by using out-of-equilibrium CO2/HCO3− solutions to introduce HCO3− exclusively to either the inside or outside of the axon.268,270
As mentioned above, two independent groups have also reported DIDS-sensitive, K+-coupled HCO3− transport in the medullary thick ascending limb (mTAL), either from tubule suspensions266 or perfused tubules.267 In the perfused-tubule study,267 luminal DIDS increased transepithelial HCO3− reabsorption—a finding consistent with DIDS-sensitive K+-coupled HCO3− transport opposing HCO3− reabsorption.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123814623000525
Ion Channels of Excitable Cells
John G. Starkus, Martin D. Rayner, in Methods in Neurosciences, 1994
Advantages and Disadvantages of the Crayfish Giant Axon Preparation
The crayfish medial giant axon preparation offers substantial advantages for axial-wire voltage-clamp studies on axonal sodium channels in their native membrane. Crayfish are inexpensive and readily available on a year-round basis, either by catching them oneself (if you live in the right climate) or by purchasing them from commercial farms in California and Louisiana. They are easy to maintain in the laboratory and allow one to avoid the bureaucratic problems which arise with use of vertebrate preparations. More significantly, however, crayfish medial giant axons offer two technical advantages which make this a premium preparation for detailed biophysical studies: (i) the axoplasm is fluid and easily washed out of the axon when the internal perfusate is driven by a very low hydrostatic pressure head (see below), to yield a “clean” membrane preparation without requiring either dialysis, or enzymatic or roller techniques for axoplasm removal; (ii) the Schwann cell sheath is permeated by a tubular lattice with openings into the periaxonal space every ∼0.2 μ m (as opposed to the 5- to 13-μm intervals between Schwann cell clefts in squid axons); see Shrager et al. (1). Thus, the crayfish Schwann cells permit very rapid reequilibration of periaxonal ion concentrations (some 25-fold faster than that in squid axons (1)). Furthermore, the close spacing of the tubule lattice openings reduces the possibility that microscopic space clamp errors can arise from the lateral resistance of the Frankenhaeuser-Hodgkin space, as described for squid axons by Stimers et al. (2). In almost 15 years of gating current recording we have never seen a gating current “rising phase” which outlasts the clamp rise time in a crayfish axon, an observation which tends to confirm that such rising phases are an artifact arising from microscopic space-clamp errors induced by the geometry of the squid’s periaxonal space (2). Finally, the relatively faster kinetics of crayfish axons (even at 6 to 8°C) makes the gating currents in this preparation seem relatively larger and, therefore, easier to record (3).
Against the advantages described above, there is the disadvantage of the smaller diameter of crayfish giant axons. We find that the “best” axons fall between 180 and 250 μm in diameter; axons larger than this (we have seen axons as large as 400 μ m) are often of variable diameter and are discarded for this reason. However, the small size of our best axons limits the diameter of the axial wire, makes electrode placement more difficult (our success rate rarely exceeds ∼80%), and raises questions with respect to both electrode polarization and potential space-clamp errors which we address below.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121852870500119
Anemonia Sulcata Toxin II☆
M. Cataldi, in Reference Module in Biomedical Sciences, 2015
Neuronal excitability
Studies performed on crayfish giant axon showed that ATX II significantly prolongs action potential duration by slowing membrane repolarization and that this effect can be partially inhibited by depolarising currents (Romey et al., 1976; Warashina et al., 1981). In the presence of the toxin, the action potential duration in the giant axons of the crustacean abdominal nerve cord can be longer than 1 s (Rathmayer and Beress, 1976). The ATX II effect is reversible upon washout (Rathmayer and Beress, 1976). The ATX II slowing effect on nerve action potential is also observed in frog myelinated fibers (Bergman et al., 1976) and in cultured neuroblastoma cells (Lazdunski et al., 1979). Upon exposure to ATX II (1 μM for 3 h) c-fos expression greatly increases in cultured rat striatal neurons (Falk et al., 2008). A significant increase in recovery time from seizure-like activity induced by electroshock was observed in Drosophila larvae fed with ATX II and this toxin also induced an increase in Na+ persistent current in motorneurons from these insects (Marley and Baines, 2011).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383994790
Neurons
Constance Hammond, in Cellular and Molecular Neurophysiology (Fourth Edition), 2015
The pioneer living preparation
The squid’s giant axon is most commonly used for these observations since its axoplasm can easily be extruded and a translucent cylinder of axoplasm devoid of its membrane is thus obtained. This living extruded axon keeps its transport properties for several hours. The absence of plasma membrane allows precise control of the experimental conditions and entry into the axoplasm of several components that cannot usually pass through the membrane barrier in vivo (e.g. antibodies). The improvement of video techniques applied to light microscopy allowed the first observations of the movement of a multitude of small particles along the microtubules in a living extruded axon.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123970329000017
Membrane Potential and Action Potential
David A. McCormick, in From Molecules to Networks, 2004
The membrane of the squid giant axon, at rest, is most permeable to K+ ions, less so to Cl−, and least permeable to Na+. (Chloride appears to contribute considerably less to the determination of the resting potential of mammalian neurons.) These results indicate that the resting membrane potential is determined by the resting permeability of the membrane to K+, Na+, and Cl−. In theory, this resting membrane potential may be anywhere between EK (e.g., −76 mV) and ENa (+55 mV). For the three ions at 20°C, the equation is
Vm = 58.2 log{(1.20 + 0.04.440 + 0.45.40)/(1.400 + 0.04.50 + 0.45.560)} = −62 mV.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121486600500068
Sodium Channels
KATSUSHIGE ONO, MAKOTO ARITA, in Heart Physiology and Pathophysiology (Fourth Edition), 2001
2. Macroscopic Na+ Current
The classical description of ionic currents in the squid giant axon by Hodgkin and Huxley (20, 21) has been widely used for other electrically excitable membranes. In the Hodgkin–Huxley equations for the Na+ current, the term m3·h is considered to be the probability of an open sodium channel. The symbol m denotes the activation variable, h the inactivation variable, and the kinetics of m and h are described by first-order differential equations. Therefore, the current relaxation at a given membrane potential is specified by the parameters m∞ (steady-state activation variable), h∞ (steady-state inactivation variable), τm (time constant of Na+ activation), and τh (time constant of Na+ inactivation). The steady-state properties of activation and inactivation have been discussed for a long time and can be summarized as follows. Hodgkin and Huxley observed the onset of the Na+ current as a sigmoidal form after a voltage step, so that they postulated that activation was a multistep process or the result of three independent events with the probability m, yielding the probability of opening of m3. Therefore the voltage dependence of the activation process itself would be the cubic root of the peak conductance. The decay of INa represented the accumulation of channels in the inactivation state. Because they observed that INa decayed with a single time constant, they described inactivation as only a single transition with the probability of (1 – h). These parameters of activation (m3) and inactivation (h) in cardiac myocytes are plotted as a function of membrane potential (Fig. 3) (22). Overlap between the activation and the inactivation curve is independent of the assumed resting potential. The “window” between the m3∞ and h∞ curves (shaded area in Fig. 3) is of particular interest because it may reflect the potential range in which steady-state Na+ currents can be observed. The amplitude of these stationary currents may be proportional to m3∞ h∞.
FIGURE 3. Steady-state parameters m∞, m3∞, and h∞ of Na+ current activation and inactivation in a single myocardial mouse cell (22).
In the classical Hodgkin–Huxley equations described earlier, the probability of an open Na+ channel was formulated by the product of the probabilities of a channel being activated (m3) and not being inactivated (h): the transient Na+ current was proportional to m3·h. Therefore, it was assumed that the two gating processes of Na+ activation and inactivation proceed independently of each other. This concept has long been supported by experiments in which strong modification of Na+ inactivation had only a small effect on Na+ activation. However, some experiments have provided evidence that activation and inactivation are functionally coupled (23, 24). This bold hypothesis has been confirmed by mutagenesis studies involving mutations in the outer S4 segment of domain IV. Replacing charged arginine residues with cysteines markedly slows the rate of fast inactivation during depolarization in the Na+ channel in skeletal muscle. In the cardiac counterpart, naturally occurring mutations in the domain IV-S4 segment are implicated in both skeletal muscle myopathies (25) and the long QT syndrome (described later) (26). It is therefore concluded that the domain IV-S4 charged segment serves as the voltage sensor for both activation and inactivation and that outward motion of this segment is a prerequisite to normal inactivation gating. Studies also suggest that the charged S4 segments in all four domains contribute to both activation and inactivation (26, 27), indicating that the classical Hodgkin–Huxley model is probably wrong and a reinterpretation of the activation/inactivation gate is required based on the molecular function (28).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780126569759500146
Axonal and Dendritic Transport by Dyneins and Kinesins in Neurons
L.S.B. Goldstein, in Encyclopedia of Neuroscience, 2009
Kinesins
Kinesin molecular motor proteins were originally discovered in the giant axon of the squid. Although not recognized at the time, this new type of molecular motor protein, although biochemically distinct from myosins and dyneins, is the founding member of a diverse but related collection of molecular motor proteins that were deployed for many different functions in eukaryotic cells. The founding member of this family, originally called conventional kinesin, and now called kinesin-1, is a heterotetrameric protein composed of two kinesin heavy chains (KHCs) and two kinesin light chains (KLCs) (Figure 4). The motor activity of kinesin-1 resides in KHC in an N-terminal region of approximately 350 amino acids. This protein domain has been shown to be capable of generating adenosine 5′-triphosphate (ATP)-dependent movements along microtubules in vitro, has been crystallized and solved structurally, and has proven to be conserved and shared among all kinesin-related motor proteins. The nonmotor portion of KHC has two structural domains. One structural domain is an alpha-helical coiled coil that mediates KHC dimerization. The other region is of unknown structure and complexes with the KLCs to form the so-called tail or cargo binding domain of kinesin-1. KLC has a short coiled coil domain at its N-terminus that may mediate the dimerization and/or association with KHC, and then has a region of six relatively well-conserved tetratricopeptide repeat (TPR) units, whose structure has been solved in other proteins and which are predicted to form a triple alpha-helical groove composed of three TPR units. Thus, KLC is predicted to have two of these triple alpha-helical grooves that may be important in cargo binding and kinesin regulation.
Figure 4. Schematic diagram of kinesin-1 structure. Kinesin-1 is a heterotetramer consisting of two kinesin heavy chain (KHC) subunits and two kinesin light chain (KLC) subunits. KHC contains the motor domain, the dimerization domain, and a short terminal domain that interacts with the KLC subunits. Cargo binding may be mediated by KHC and KLC together or individually. KLC also plays roles in regulating KHC motor domain activity. ATP, adenosine 5′-triphosphate; TPR, tetratricopeptide repeat.
The sequence of the KHC motor domain led to the discovery that eukaryotic genomes encode many different kinesin motor proteins. These proteins are all predicted to share a common motor domain but to have a variety of structurally diverse ‘tail’ domains attached that may harness force-generating activities by kinesins to a variety of cargoes in various cellular types and functions (Figure 5). Although the initial expectation was that all these predicted motor proteins would be plus end-directed motor proteins, a surprising degree of diversity in behavior was discovered. Some of these kinesin motor proteins mediate minus end-directed movements, and some may not be motor proteins at all and may mediate the rapid depolymerization of microtubules. Both of these types of proteins nonetheless couple ATP hydrolysis to their activities. Some kinesins may have other functional activities in the motor domain, but these have not yet been clearly elucidated. While many kinesins appear to play roles in nonneuronal cells, in particular in the process of cell division, a number are shared between neurons and nonneuronal cells. Many kinesins are specific only to neurons, where they may be involved in axonal or dendritic transport processes. For example, in mammals, on the order of 10–15 of the known kinesins among the 50 or so predicted to be encoded in the genome are specialized for cell division. In Drosophila, because of the smaller genome, proportionally fewer are used in mitosis and in neurons. A key question is which motor proteins move which types of vesicles and organelles in each type of neuron.
Figure 5. Principles of kinesin and dynein diversification. Kinesins appear to have evolved by gene duplication and divergence such that a conserved motor (shaded ovals) has become harnessed to a wide array of diverse tail domains. The location of the motor domain in the heavy chain polypeptide allows kinesin motors to be divided into several groups: an N-terminal group, a central group, and a C-terminal group. In addition, N-terminal kinesins have been found as homodimers, heterodimers, homotetramers, and monomers. Cytoplasmic dyneins appear to have conserved the bulk of their principal motor polypeptide and have generated far fewer divergent genes. Accessory chain diversification may be the principal mechanism for functional specialization. Reproduced with permission from Goldstein LS and Yang Z (2000) Microtubule-based transport systems in neurons: The roles of kinesins and dyneins. Annual Review of Neuroscience 23: 39–71.
In neurons, although there is a large diversity of different kinesin motor proteins and cargoes, some simple principles have begun to emerge. For example, kinesin-1 appears to play roles in the anterograde transport of a number of different types of vesicles whose contents are needed along the axonal membrane and at the synapse, such as vesicles containing the amyloid precursor protein (APP), whose processing may cause Alzheimer’s disease. Kinesin-1 also appears to play a role in the transport of neurofilaments, which are required for radial growth of axons, and in the movement of mitochondria. It is interesting to note that recent work suggests that mitochondrial movement by kinesin-1 may be mediated by a special form of kinesin-1 in which KLC is replaced by another protein, whose name is Milton. A second prominent class of kinesins, referred to as kinesin-3, appears to play roles in the movement of protein components of synaptic vesicles and may also play a role in the movement of mitochondria. Other kinesins may move mRNA particles, components of postsynaptic complexes and postsynaptic receptors, as well as other organelles, including peroxisomes, elements of endoplasmic reticulum, and the Golgi apparatus. An important and unresolved question is whether the movements of nonmembrane particles and proteins are mediated by direct interactions with the motor proteins or by binding to vesicle or organelle membranes and hitchhiking.
Another type of kinesin used for movements in some types of neurons is called kinesin-2. This kinesin is generally a heterotrimer of two nonidentical motor subunits associated with a third nonmotor domain protein, which may form part of the tail. This class of motor protein has been found to be used primarily for movement of materials in cilia and is thus necessary for the construction of cilia and perhaps for signaling mediated by cilia. In neurons in particular, this class of kinesin appears to be used most prominently in sensory neurons of various types, which often use modified cilia as their sensory endings within which receptors for odors or chemical molecules are bound and signals are transmitted. Vertebrate photoreceptors have a modified cilium as their light-sensing domain, the so-called outer segment, and this modified cilium also appears to require the use of this kinesin-2 type of motor protein for the movement of photoreceptive components such as opsin.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469007087
Статья на конкурс «био/мол/текст»: Тайна того, каким образом «работает» человеческий мозг, мучила философов и естествоиспытателей с древнейших времен. Современные ученые постепенно подходят к ее разгадке, приближая тот час, когда мы сможем полностью понять, как и с помощью чего мы на самом деле думаем. Именно сейчас развитие вычислительной техники и последние достижения в нейробиологии сделали реальным то, что раньше казалось недостижимым. Появились компьютеры, способные понимать речь, ориентироваться в пространстве и даже писать научные статьи. Работа таких машин частично основана на принципах работы головного мозга. Каким образом они работают, что такое мышление и где оно происходит? Обо всем этом мы попытаемся рассказать.
Клетки-деревья
Общеизвестно, что наш мозг состоит из нейронов (по крайней мере, именно они отвечают за мыслительный процесс). Морфологически эти клетки похожи на деревья с корнями-дендритами и стволом-аксоном. На дендритах суммируются электрические сигналы, поступающие от других нейронов, и в зависимости от этого нейрон «принимает решение», формировать ли ему потенциал действия (т.е. нервный импульс). Потенциалом действия называется волна токов ионов натрия и калия, которая быстро проходит через мембрану и распространяется без затухания по аксону к другим нейронам. Именно это свойство позволяет нейронам передавать сигнал без потери информации на большие расстояния. Так, потенциал действия, сформированный в коре головного мозга, может достичь нейронов в позвоночнике, а затем в руке, за считанные миллисекунды. В окончании аксона находятся синапсы, из которых после прохождения потенциала действия высвобождаются особые вещества — нейромедиаторы. Именно они передают сигнал к следующему нейрону, и так далее, по цепочке [14].
Однако один нейрон сам по себе не способен обеспечить сложное поведение, характерное для животных и тем более самого умного из них — человека. По оценкам ученых, в человеческом мозге около 100 миллиардов нервных клеток, которые соединены в сложнейшую сеть со 100 триллионами синаптических контактов между ними (рис. 1). При виде таких чисел в пору отчаяться и бросить попытки разобраться в том, как функционирует этот сложнейший природный объект. К счастью, ученые — люди не робкого десятка и продолжают упорно двигаться вперед.
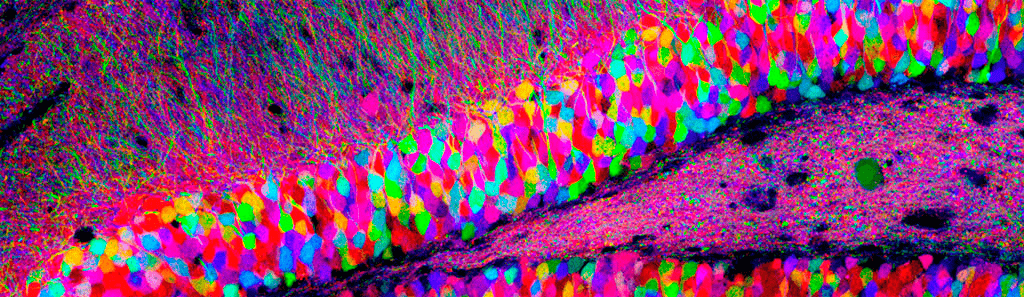
Рисунок 1. Множество нейронов в срезе гиппокампа крысы. Клетки помечены различными флуоресцентными белками с помощью технологии Brainbow.
Моделирование вместо опыта
Один из главных вопросов изучения биологических нейронных сетей — каким образом при соединении нейронов относительно простое поведение отдельной единицы трансформируется в сложное поведение сети в целом. Однако полностью разобраться в этом мешают ограниченные возможности эксперимента: в настоящей нейронной сети практически невозможно измерить все сигналы со всех 100 миллиардов нейронов и отследить все процессы, происходящие в ней. Тут-то на помощь ученым и приходит компьютерное моделирование. Математические модели всегда помогали исследователям отвечать на подобного рода сложные вопросы. А после появления вычислительных машин возможности в этой области постоянно расширяются.
Одним из последних достижений в этой области является проект Blue Brain, возглавляемый Генри Маркромом [2], [3]. В рамках этой инициативы ученые пытаются воспроизвести поведение одной колонки кортекса, состоящей из сотен тысяч клеток, которые моделируются с максимальной степенью детализации. Колонки в новой коре являются ее важнейшим функциональным элементом, на уровне которых, по мнению многих ученых, происходят вычисления, которые являются основой высших психических функций, включая мышление. Именно поэтому детальное изучение этих структур является крайне важным.
Первая модель работы нейрона была создана еще в 1907 году французским физиологом Льюисом Лаписиком [4] — задолго до того, как был изучен механизм формирования нейроном потенциала действия [5]. Модель была очень простой: согласно ей нейрон как конденсатор накапливает напряжение до определенного порогового значения, после чего генерирует потенциал действия. Стоит отметить, что концепция работы нейрона как порогового интегратора почти не изменилась после публикации работы Льюиса Лаписика, но было выяснено множество важнейших деталей.
Нобелевская премия за кальмара
Однако наибольшее распространение получила модель Ходжкина-Хаксли, построенная на основе экспериментов с гигантским аксоном кальмара [5] (рис. 2). Тут мы позволим себе небольшое отступление, чтобы рассказать о том, почему нейроны именно этого живого организма оказались такими удобными для исследований.
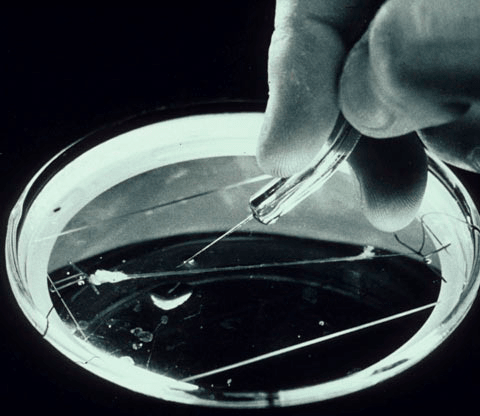
Рисунок 2. Гигантский аксон кальмара в чашке Петри. Может быть, на первый взгляд он и не кажется таким уж большим, но по сравнению с аксонами нейронов головного мозга, которые невозможно увидеть невооруженным глазом, он просто огромен.
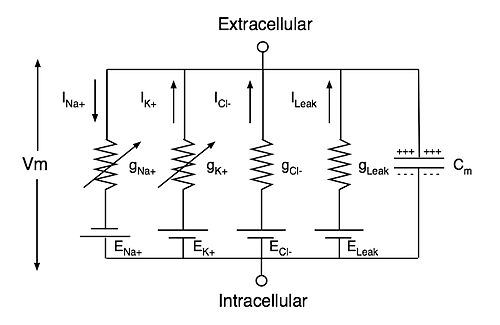
Модель Ходжкина-Хаксли (рис. 3) описывает поведение нейрона, представляя его в виде достаточно простой электрической цепи, где мембрана является конденсатором, ионные каналы — проводимостями (величина, обратная сопротивлению, измеряемая в Сименсах), градиенты ионов натрия, калия и хлора на мембране (то есть, разница между концентрацией ионов внутри и снаружи) — источниками напряжения. При этом активируемые каналы для ионов калия, натрия и хлора описываются нелинейными проводимостями gK, gNa и gCl, а каналы утечки, которые открыты всегда, — постоянной проводимостью gL (от англ. leak — «утечка»). Полученная модель работы нейрона оказалась применима не только для кальмара, но и для млекопитающих, в том числе для человека. Поэтому авторы исследования — британцы Алан Ходжкин и Эндрю Хаксли — получили в 1963 году Нобелевскую премию по физиологии и медицине.
Рисунок 3. Схема электрической цепи модели Ходжкина—Хаксли гигантского аксона кальмара, за которую была получена Нобелевская премия в 1963 году. Cm — емкость мембраны нейрона, ENa+, EK+, ECl− и ELeak — потенциалы реверсии токов натрия, калия, хлора и утечки, а gNa+, gK+, gCl− и gLeak — соответствующие проводимости ионных каналов. Vm — трансмембранный потенциал.
От подневольного труда к искусственному интеллекту
Первые упоминания об искусственных разумных существах можно обнаружить еще в греческой мифологии. Согласно легендам, Гефест по просьбе Зевса создал бронзового гиганта Талоса (рис. 4), который охранял Елену на острове Крит. В средние века появились предания о гомункулусах и Големе — созданных человеком разумных существах.
Рисунок 4. Бронзовый гигант Талос — пожалуй, первый робот в мифологическом фольклоре (кадр из фильма «Ясон и аргонавты», 1965 год).
С конца XIX века искусственные живые существа стали неотъемлемой частью культуры, начиная с «Франкенштейна» Мэри Шелли и пьесы Карела Чапека (рис. 5) «R.U.R.» («Россумские Универсальные Роботы»). Кстати, именно в этой пьесе Чапек впервые использовал придуманное с братом Йозефом слово «робот» (по-чешски robota означает «подневольный труд»).
Рисунок 5. Монстр Франкенштейна (а), Карел Чапек (б) и Алан Тьюринг (в)
До середины XX века разговоры о разумных машинах носили чисто теоретический характер, но уже в 1956 году разработка искусственного интеллекта приобрела статус научной дисциплины. Произошло это благодаря появлению электронных вычислительных машин, а также прорыву в нейробиологии. Наука о мозге помогла понять, что нервная система функционирует благодаря обмену нейронов электрическими импульсами, а вычислительные машины позволили описывать эти процессы с помощью программ.
Вскоре стало понятно, что создание искусственного интеллекта требует как минимум понимания значений слов «искусственный» и «интеллект». Алан Тьюринг нашел элегантный выход: вместо того, чтобы пытаться сформулировать, что же такое «интеллект», он предложил определять, есть он у машины или нет, способом, который получил название «Тест Тьюринга» [8].
Идея теста заключается в том, что экзаменатор общается в текстовом режиме с двумя испытуемыми, один из которых — машина, а другой — человек. Цель экзаменатора — определить, кто есть кто. Тест считается успешным, если машине удается обмануть эксперта. Несмотря на кажущуюся простоту, ни одной программе до сих пор не удалось его пройти.
Хотя настоящего думающего робота создать пока не удалось, различные современные подходы позволяют непрерывно расширять область задач, которые способны решать компьютеры, даже в тех сферах, которые всегда считались доступными лишь людям — например, работа с символами и написание научных статей.
Символьный подход
Первые достижения в создании искусственного интеллекта были связаны с использованием возможностей математической логики. Уже в 1956 году была создана программа с говорящим названием Logic Theorist, которая смогла доказать 38 из 52 теорем, описанных в книге Бертрана Рассела и Альберта Уайтхэда «Основания математики», причем для некоторых из них она смогла найти новые, более простые доказательства. В это же время были созданы программы, способные правдоподобно имитировать переписку с живым человеком (правда, недостаточно хорошо для прохождения теста Тьюринга), и многие другие.
Все эти программы основывались на предположении, что интеллект заключается в осуществлении операций над различными символами по законам логики. На этом принципе были основаны первые коммерчески успешные программы искусственного интеллекта — экспертные системы. Они позволяли частично заменить работу реального эксперта — например, оценить риск организации при предоставлении кредита клиенту. Такая программа работает с базой знаний (набором фактов и правил, формализующих работу экспертов в данной области) по определенным логическим законам. Но далеко не все проблемы могут быть решены в рамках строгой логики, поэтому зачастую в таких программах используется нечеткая или вероятностная логика. Ее особенностью является то, что вместо 0 и 1 — «да» или «нет» — в ней используются все значения между 0 и 1, — например, 0.2 или 0.7: «скорее да», «скорее нет».
Весьма ограниченный успех логического подхода продемонстрировал одну важную вещь: интеллект — это не только способность логически мыслить. Поэтому для решения сложно формализуемых задач (например, распознавания образов) пришлось отказаться от красоты и стройности формальной логики.
Нейронные сети
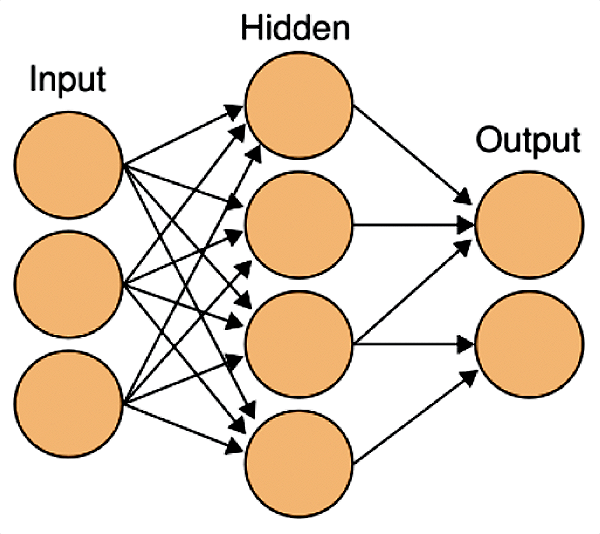
Разработчики искусственных нейронных сетей были вдохновлены работой настоящих нейронов в мозге. Только вместо реальных клеток в сетях используются уравнения, моделирующие их работу (рис. 6).
Рисунок 6. Схема искусственной нейронной сети. На входные нейроны подается стимул, затем он обрабатывается в нейронах скрытого слоя (таких слоев может быть несколько) и результаты предоставляются на выходных нейронах.
Первыми в нейронной сети получают информацию входные нейроны. Именно они получают сигналы от внешнего стимула, который может быть всем, чем угодно: изображения, отдельные звуки и даже человеческая речь. Но для того, чтобы передать полученную информацию, входным нейронам необходимо перевести сигнал стимула на их «язык». Это уже работа другого вида клеток — рецепторов, которые преобразуют информацию о стимуле в нервные импульсы. Биологическим примером таких рецепторов являются палочки и колбочки в сетчатке глаза. Подобные рецепторы есть и в искусственных нейронных сетях: при обработке изображений это фотоэлементы, звуков — микрофоны.
Конечным этапом обработки информации в нейросети являются выходные нейроны, активность которых интерпретируется как результат: преобразованный входными нейронами сигнал от рецепторов попадает в сеть, затем переходит к следующим нейронам и преобразуется за счет взаимодействий между ними через синапсы. Например, если сеть занимается распознаванием букв алфавита, то после успешного обучения на выходе будут активны нейроны, соответствующие этим буквам.
Для того чтобы сеть могла правильным образом классифицировать входной сигнал, связи между нейронами должны быть правильно подобраны. В 1943 году нейрофизиолог Фрэнк Розенблатт создал модель, которая называется перцептрон (от лат. perceptio — восприятие) [9]. Она работает следующим образом: в начале обучения связи между нейронами являются одинаковыми, затем сети предъявляются различные буквы по нескольку раз, и если буквы классифицируются на выходных нейронах правильно, то связи, приводящие к правильной классификации, усиливаются, а если нет, то ослабляются [13]. Таким образом, после предъявления большого количества стимулов сеть учится их распознавать. При этом, чем больше букв необходимо выучить сети, тем бóльшим должно быть количество нейронов. В качестве результата сеть может распознавать буквы, которые лишь отдаленно напоминают те, которые использовались при обучении. Более того, буквы могут быть повреждены или написаны другим шрифтом, но сеть все равно будет способна их распознать!
На самом деле многие программы в компьютере используют такой подход: например, программа Fine Reader, которая распознает изображение и переводит его в текст, использует в своей работе нейросети. По такому же принципу работает распознавание рукописного ввода на смартфонах и планшетах.
Генетические алгоритмы
Еще одним подходом в программировании, вдохновленным биологией, являются эволюционные алгоритмы (рис. 7). В рамках этого подхода занимаются моделированием процесса биологической эволюции, только вместо живых организмов используются программы [10]. На первый взгляд у алгоритмов и животных мало общего, но, если присмотреться, можно увидеть похожее.
Под алгоритмом в общем случае подразумевают последовательный набор действий, который приводит к желаемому результату за конечное число ходов. Например, чтобы прийти в университет, необходимо: 1) проснуться, 2) умыться, 3) одеться, 4) позавтракать, 5) собраться, 6) пойти. Конечно, детали алгоритмов могут быть разными: например, кому-то не нужно собирать вещи, потому что они были собраны вчера. Но важным является то, что в любом случае выполняется последовательность действий, приводящая к нужному результату.
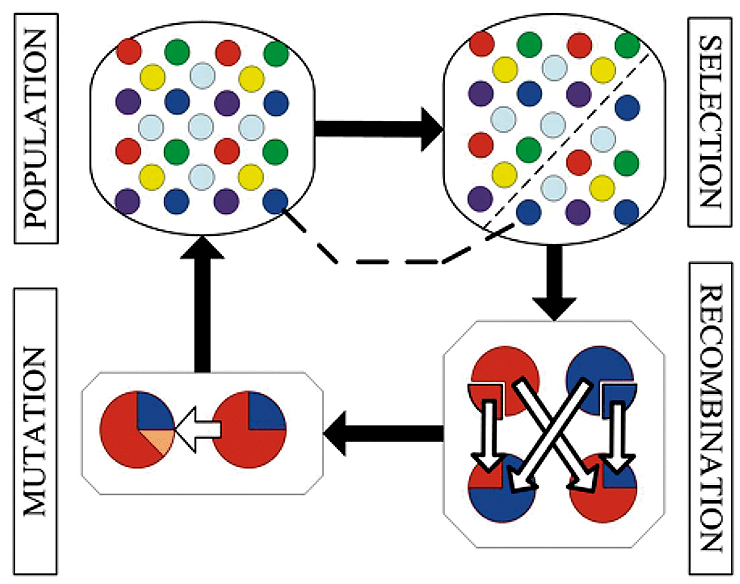
Рисунок 7. Принцип работы генетических алгоритмов. В начале рассматривается популяция алгоритмов, которые выполняют определенную задачу. Затем вводится правило, в соответствии с которым селективно выбираются только те из них, которые способны выполнить задачу лучше других. Затем алгоритмы обмениваются отдельными частями, чтобы получить новые на этапе рекомбинации. После этого на этапе мутаций в алгоритмы вносятся небольшие случайные изменения, чтобы увеличитель их разнообразие. Затем процедура выбора алгоритмов повторяется много раз, и на завершающем этапе остаются только те алгоритмы, которые выполняют задачу наилучшим образом.
Для того, чтобы алгоритмы могли эволюционировать, их разделяют на отдельные части, которые можно менять между собой. Например:
- проснуться—умыться—одеться—позавтракать—собраться—пойти;
- проснуться—собраться—одеться—позавтракать—умыться—пойти и т.д.
Также необходимо отказаться от невозможных вариантов: к примеру, алгоритм «одеться→позавтракать→проснуться→…» невозможен по понятным причинам.
После этого оценивают работу каждого алгоритма и выбирают наилучший. К примеру, в случае с походом в университет лучшим алгоритмом будет самый быстрый. Затем производится обмен их частей между собой и внесение мутаций (добавление и/или видоизменение действий), после чего появляются новые алгоритмы, которые снова оцениваются. Таким образом, через несколько поколений отбираются именно те, которые справляются с задачей лучше всего. Такие алгоритмы часто используют в биоинформатике, инженерном деле и многих других приложениях, чтобы находить наилучшие решения.
Во что играть против робота?
В 1994 году программа Chinook стала чемпионом мира по шашкам, впоследствии защитив этот титул в 1996 году. В 2007 году команда разработчиков Chinook закончила полный анализ всех возможных комбинаций этой игры, и Chinook стала непобедимой. На сегодняшний день шашки — самая сложная полностью проанализированная игра; в ней имеется 5×1020 возможных комбинаций фигур на игровом поле.
Но не стоит отчаиваться, потому что все еще существуют игры, в которых человек легко побеждает компьютер [11]. Например, к ним относится китайская игра го (рис. 8). Выглядит она достаточно просто: поле состоит из сетки 19×19 и двух видов шашек: черных и белых. Целью игры является захват территории — это чем-то напоминает игру в точки. Однако, несмотря на простоту правил, ней существует огромное количество возможных комбинаций. Если в шахматах после четвертого хода от начала партии может возникнуть несколько сотен тысяч различных вариантов, то в го их число превышает шестнадцать миллиардов. Так что пока человек все еще непобедимый соперник в некоторых играх против компьютера.
Рисунок 8. Игра го считается одной из наиболее сложных логических игр для освоения компьютером. Уже средние игроки легко побеждают любые существующие на данный момент компьютерные программы.
Заменят ли роботы ученых?
Казалось бы, кому, как не ученым, меньше всего стоит бояться того, что машины смогут конкурировать с ними? Не тут-то было: программисты из Массачусетского технологического института создали программу под названием SCIgen, способную «писать» тексты, посвященные разработке новых компьютерных алгоритмов, с иллюстрациями, графиками, ссылками и всеми остальными необходимыми атрибутами [12]! Правда, эти тексты похожи на научные статьи лишь по форме, а их осмысленность стремится к нулю.
Авторы создали эту программу для того, чтобы вывести на чистую воду конференции, которые публикуют присылаемые на них тезисы не глядя, и им это удалось. Тексты, сгенерированные программой, были приняты к публикации в сборниках тезисов сразу нескольких конференций. Группа российских ученых решила проверить, насколько тщательно подходят к отбору статей в отечественных журналах, и перевела текст, сгенерированный SCIgen, на русский язык. В итоге «статья» под названием «Корчеватель: Алгоритм типичной унификации точек доступа и избыточности» была опубликована в «Журнале научных публикаций аспирантов и докторантов»!
Разумные роботы уже рядом
Итак, полным ходом идет работа над созданием искусственного интеллекта — программ, обладающих, хотя бы частично, свойствами человеческого интеллекта. Пока что лучше всего ученым удается решение конкретных специализированных задач, таких как распознавание образов, автоматизированное написание финансовых отчетов или описание итогов спортивных игр на основе статистических данных о ходе игры.
Однако создание так называемого «сильного» искусственного интеллекта, то есть полноценного искусственного сознания, до сих пор представляется трудно достижимой целью. Тем не менее попытки его создания чрезвычайно полезны, так как позволяют лучше понять, что такое человеческий разум. Сегодня основная работа направлена на создание алгоритмов, позволяющих компьютерам осуществлять логические размышления, собирать, систематизировать и оперировать знаниями об окружающем мире, ставить цели и искать оптимальные пути их достижения, обучаться, распознавать речь и многое другое. «Сильный» искусственный интеллект должен объединять все эти алгоритмы и осуществлять взаимодействие между ними. При этом современные тенденции развития в этой области свидетельствуют о том, что, если «сильный» искусственный интеллект будет создан, большую роль в его создании будут играть нейронные сети, а значит, мы вряд ли будем знать в точности, как он работает. Стоит также отметить любопытное явление: многие успехи в развитии искусственного интеллекта, которые казались невозможными ранее, после их достижения не воспринимаются как «О, это же действительно искусственный разум!» Так что вполне возможно, что мы просто не заметим появление разумных роботов.
Статья написана в соавторстве с Антоном Сабанцевым. Частично материалы статьи были опубликованы в журнале «Я — Леонардо» (лето—осень 2013).
- Jean Livet, Tamily A. Weissman, Hyuno Kang, Ryan W. Draft, Ju Lu, et. al.. (2007). Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62;
- Henry Markram. (2006). The Blue Brain Project. Nat Rev Neurosci. 7, 153-160;
- Blue Brain Project: как все связано?;
- Nicolas Brunel, Mark C. W. van Rossum. (2007). Lapicque’s 1907 paper: from frogs to integrate-and-fire. Biol Cybern. 97, 337-339;
- A. L. Hodgkin, A. F. Huxley. (1952). A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117, 500-544;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Формирование мембранного потенциала покоя;
- Alan M. Turing. (2009). Computing Machinery and Intelligence. Parsing the Turing Test. 23-65;
- F. Rosenblatt. (1958). The perceptron: A probabilistic model for information storage and organization in the brain.. Psychological Review. 65, 386-408;
- Barricelli N.A. (1957). Symbiogenetic evolution processes realized by artificial methods. Methodos. 9, 143–182;
- Johnson G. (1997). To test a powerful computer, play an ancient game. The New York Times;
- Cyril Labbé, Dominique Labbé. (2013). Duplicate and fake publications in the scientific literature: how many SCIgen papers in computer science?. Scientometrics. 94, 379-396;
- Hebb D.O. The organization of behavior: A neuropsychological theory. Psychology Press, 2002;
- Kandel E.R. et al. Principles of neural science. NY: McGraw-Hill, 2000.
Гигантский аксон кальмара — Squid giant axon
Гигантский аксон кальмара
В гигантский аксон кальмара очень большой (до 1,5 мм в диаметре; обычно около 0,5 мм) аксон что контролирует часть воды реактивный двигатель система в Кальмар. Впервые он был описан Л. В. Уильямсом.[1] в 1909 г.,[2] но это открытие было забыто до тех пор, пока английский зоолог и нейрофизиолог Дж. З. Янг продемонстрировал функцию аксона в 1930-х годах, работая в Stazione Zoologica в Неаполь, Морская биологическая ассоциация в Плимут и Морская биологическая лаборатория в Woods Hole.[3][4] Кальмары используют эту систему в первую очередь для коротких, но очень быстрых движений по воде.
Между щупальцами кальмара находится сифон через которую вода может быстро вытесняться за счет быстрых сокращений мускулов стенки тела животного. Это сокращение инициируется потенциалы действия в гигантском аксоне. Потенциалы действия перемещаются быстрее в большем аксоне, чем в меньшем,[5] и кальмар развили гигантский аксон, чтобы улучшить скорость своего ответ на побег. Увеличенный радиус аксона кальмара уменьшает внутреннее сопротивление аксона, так как сопротивление обратно пропорционально площади поперечного сечения объекта. Это увеличивает пространственная постоянная (

В их Нобелевская премия — работа по раскрытию ионного механизма потенциалов действия, Алан Ходжкин и Эндрю Хаксли провели эксперименты на гигантском аксоне кальмара, используя Прибрежный кальмар как модельный организм. Приз был разделен с Джон Экклс. Большой диаметр аксона предоставил Ходжкину и Хаксли большое экспериментальное преимущество, поскольку он позволил им вставить электроды зажима напряжения внутри просвета аксона.
Хотя аксон кальмара очень большой в диаметре, он немиелинизированный что существенно снижает скорость проводимости. Скорость проводимости типичного аксона кальмара размером 0,5 мм составляет около 25 м / с. Во время типичного потенциала действия в каракатица Сепия гигантский аксон, приток 3,7 пмоль / см2 (пикомоль на сантиметр2) натрия компенсируется последующим оттоком 4,3 пмоль / см2 калия.[7]
Смотрите также
- Боковой гигантский нейрон
- Гигантский синапс кальмара
Рекомендации
- ^ Кингсли, Дж. С. (1913). «Некролог. Леонард Вустер Уильямс». Анатомический рекорд. 7: 33–38. Дои:10.1002 / ar.1090070202.
- ^ Уильямс, Леонард Вустер (1909). Анатомия обыкновенного кальмара: Loligo pealii, Lesueur. Лейден, Голландия: Библиотека и типография покойного Э.Дж. Брилл. п. 74. OCLC 697639284 — через Интернет-архив.
- ^ Янг, J.Z. (Апрель 1938 г.). «Функционирование гигантских нервных волокон кальмаров». Журнал экспериментальной биологии. 15 (2): 170–185 — через ООО «Компания биологов».
- ^ Янг, J.Z. (Июнь 1985 г.). «Головоногие моллюски и неврология». Биологический бюллетень. 168 (3С): 153–158. Дои:10.2307/1541328. JSTOR 1541328.
- ^ Первес, Дейл; Августин, Джордж Дж .; Фитцпатрик, Дэвид; Кац, Лоуренс С .; Ламантия, Энтони-Самуэль; Макнамара, Джеймс О .; Уильямс, С. Марк (2001). Неврология. 2-е издание. Сандерленд, Массачусетс.CS1 maint: дата и год (связь)
- ^ Холмс, Уильям (2014). «Кабельное уравнение». В Jaeger, Дитер; Юнг, Рану (ред.). Энциклопедия вычислительной нейробиологии. Нью-Йорк, штат Нью-Йорк: Спрингер. Дои:10.1007/978-1-4614-7320-6. ISBN 978-1-4614-7320-6. Получено 30 августа, 2020.
- ^ Плонси, Роберт; Барр, Роджер С. (2007). Биоэлектричество: количественный подход (3-е изд.). Нью-Йорк, штат Нью-Йорк: Спрингер. п. 109. ISBN 978-0-387-48864-6.
Мало какое животное сыграло такую важную роль в развитии нейробиологии, как кальмар. А точнее — гигантский аксон в его мантии, аксон нейрона, который отвечает (в том числе), за реактивную систему кальмара. Этот аксон достигает в диаметре до полутора миллиметров (обычно полмиллиметра). Его открывали дважды: сначала аксон описал в 1909 году Леонард Уорчестер Уильямс, но открытие не заметили и забыли — и только через 27 лет британец Джон Юнг заново открыл его, и знаменитые Ходжкин и Хаксли получили материал, при помощи которого они построили модель потенциала действия и получили свою Нобелевскую премию 1963 года.
«Можно утверждать, что введение Юнгом в 1936 году препарата аксона кальмара имело для науки об аксоне большее значение, чем какое-либо другое открытие, сделанное за последние 40 лет. Один выдающийся нейрофизиолог заметил недавно во время ужина на одном из конгрессов (не самым тактичным образом, должен признать): «Если честно, Нобелевскую премию нужно было присвоить кальмару»», — вспоминал Ходжкин.
Нам попалось видео, в котором вы можете увидеть анатомирование кальмара и Тот Самый Аксон. А анатомирование проводит Тот Самый Джон Янг, «один из самых влиятельных биологов ХХ века».
Тревога поднялась только в 1939 г. Одновременно две группы исследователей в двух местах — Кол и Кертис, работавшие на морской станции Океанологического института в Вудс-Холе (США), и Ходжкин и Хаксли,, работавшие на морской станции в Плимуте (Англия),— измерили ПД и ПП на самом совершенном уровне тогдашней экспериментальной техники они взяли гигантский аксон кальмара, т. е. одиночное нервное волокно, ввели электрод внутрь волокна и смогли таким образом непосредственно измерить разность потенциалов между внутренней и внешней сторонами мембраны одной клетки, а не на пучке волокон. [c.81]
Эксперименты по блокированию солями четвертичного аммония позволили получить более точные данные о структуре и свойствах обеих функций калиевого канала. Ионы тетраэтиламмония (ТЭА) блокируют выходящий калиевый ток. В гигантском аксоне кальмара подобный эффект наблюдался только при попадании ТЭА внутрь нервного волокна во время перфузии аксона. Отсюда следует, что канал пронизывает мембрану асимметрично. Еще более интересно то [27], что блокирующая способность ионов четвертичного аммония увеличивается при замене одной из этиловых групп более длинной гидрофобной боковой цепью (рис. 6.8). Эти производные не просто блокируют, они инактивируют уже начавшийся калиевый ток (рис. 6.9), как бы проникая в открытый канал. [c.156]
Как показали три простых наблюдения, для синаптической передачи необходим приток ионов кальция в окончание аксона. Во-первых, если в момент прибытия нервного импульса во внеклеточной среде вокруг окончания аксона эти ионы отсутствуют, то медиатор не высвобождается и передачи сигнала не происходит. Во-вторых, если через микропипетку искусственно ввести Са в цитоплазму нервного окончания, выход нейромедиатора происходит тотчас даже без электрической стимуляции аксона (это трудно осуществить на нервно-мышечном соединении из-за малых размеров окончания аксона, поэтому такой эксперимент был проведен на синапсе между гигантскими нейронами кальмара) В-третьих, искусственная деполяризация окончания аксона (тоже в синапсе между гигантскими нейронами) без нервного импульса и в условиях блокады натриевых и калиевых каналов специфическими токсинами [c.306]
Гигантский аксон кальмара занимает особое место в истории наших представлений о мембранном потенциале и потенциале действия. Благодаря его большим размерам (0,2-1,0 мм в диаметре и 5-10 см в длину) в него можно вводить электроды, и в прошлом такие электроды, хотя и очень крупные по сравнению с современными, позволили впервые измерить разность электрических потенциалов между цитоплазмой и внеклеточной жидкостью. При введении электрода в интактный гигантский аксон регистрируется мембранный потенциал, равный —70 мВ. Если аксон, помещенный в сосуд с морской водой, стимулировать, то при проведении нервного импульса мембранный потенциал временно возрастает от -70 мВ до +40 мВ. [c.61]
Глиальные клетки иногда связаны друг с другом контактными зонами, где может происходить метаболический обмен. Напротив, от нервных клеток они всегда отделяются щелью щириной, по крайней мере, 20 нм. Однако есть основания предполагать, что метаболический обмен происходит также между глией и аксонами, причем роль посредника в этом процессе может играть межклеточная концентрация ионов калпя [10]. Так, было показано, что в гигантских аксонах кальмара — модельной системе многих нейробиологических исследований — 20—40% глиальных белков с М 20 000—200 000 переносятся в аксон по еще неизвестному механизму [10]. [c.31]
У многих животных обнаружены гигантские нервные волокна, т. е. волокна особенно большого диаметра. Про гигантский аксон кальмара мы уже много говорили. Но гигантские волокна обнаружены и у дождевых червей, и у пиявок, и у речного рака, и у других животных, В чем же роль этих волокон [c.147]
Многие беспозвоночные умеют избегать опасности, внезапно совершая быстрое движение. Эта реакция, запускаемая внешним раздражителем, состоит в резком одновременном сокращении особых быстрых мышц, благодаря которому животное удаляется от источника опасности. Такая форма поведения встречается у самых различных беспозвоночных, например у дождевых червей, раков и кальмаров (а также и у некоторых позвоночных см. ниже). Оказалось, что важнейшим звеном нервного пути, обеспечивающего такое отскакивание , служит гигантский аксон. Это вполне естественно, так как скорость проведения нервных импульсов в волокне тем выше, чем оно толще (см. гл. 7). Ясно, что реакция избегания должна быть прежде всего быстрой. (Подробнее свойства гигантского аксона кальмара рассматривались в гл. 7.) [c.54]
При изучении механизмов возникновения потенциала действия в нейронах (а также в других клетках) мы будем отталкиваться от нескольких общепризнанных фактов. Прежде всего процессы, приводящие к генерации нервного импульса, разыгрываются на мембране и заключаются в кратковременных изменениях мембранного потенциала. Идеи о том, что потенциал действия возникает именно на мембране, высказывались уже в XIX веке. Они были подтверждены в изящных опытах на гигантских аксонах кальмара проведение импульсов в этих аксонах сохранялось даже после выдавливания из них аксо-плазмы. [c.152]
Микроэлектродный метод дал возможность измерить биопотенциалы не только на гигантском аксоне кальмара, но и на клетках нормальных размеров нервных волокнах других животных, клетках скелетных мышц, клетках миокарда и других. [c.69]
В заключение рассмотрим необычный пример — головоногого моллюска. Характерные приспособительные признаки осьминога < рис. 2.11)—потеря раковины, появление длинных щупалец е области головы, а также развитие мантийного мышечного сифона для накачивания воды. Как и у других моллюсков, центральная нервная система расположена вокруг пищевода. Ганглии сильно увеличены и, слившись, образуют настоящий мозг (рис. 2.12). Из органов чувств самого высокого уровня развития достигают глаза, и соответственно зрительные ганглии превращаются в сложные.зрительные доли мозга, которые становятся -самыми крупными его отделами. Нейроны зрительной доли дифференцируются на ряд форм, сильно отличающихся от обычных униполярных нейронов, характерных для беспозвоночных (см. гл. 17). В отличие от брюхоногих моллюсков головоногие — это активные, стремительные животные. Механизм движения их заключается в выбрасывании воды через сифон по принципу ре-.активного движения, что ставит моллюсков в ряд самых быстрых морских животных как при нападении, так и при избегании опасности. Бегству способствует система гигантских волокон, особенно хорошо развитая у кальмара. Кальмар дал нейрофизиологам возможность экспериментировать на гигантском аксоне, что очень важно для изучения нервного импульса. [c.53]
В основе представлений о процессе генерации нервного импульса лежат исследования, выполненные на гигантских нервных волокнах кальмара А. Ходжкиным, А. Хаксли и Б. Катцем. Для измерения потенциала действия внутри аксона вводят тонкий стеклянный капилляр с диаметром кончика менее 0,5 мкм, заполненный концентрированным раствором КС1, что не оказывает заметного влияния на активность аксона. [c.166]
У кальмара гигантские нервные волокна управляют сокращением мантии. К заднему концу мантии идут более толстые аксоны, а к переднему — несколько более тонкие. В результате такого устройства сигналы, выходящие из ганглия кальмара, управляющего его плаванием, приходят к разным участкам мантии практически одновременно, обеспечивая мощный выброс воды из мантийной полости через воронку и быстрое движение кальмара в воде. [c.147]
Без использования гигантского аксона кальмара наше понимание генерации потенциала действия не продвинулось бы так вперед (рис. 12.1) [1, 2]. Аналогично, нейромышечное соединение (рис. 12.2)—это классическая экспериментальная модель синаптической передачи [1, 2]. Простые нервные системы пиявки (Hirudo) и морского моллюска (Aplysia) (рис. 12.3)—ценные модели изучения физиологии поведения 3] (гл. 11). При изучении поведения этих животных, например способности плавать у пиявки и рефлекса втягивания жабры у Aplysia, удалось идентифицировать нейроны, обусловливающие [c.352]
Электровозбудимые мембраны играют первостепенную роль в изучении сложных неравновесных явлений, протекающих в биологических системах. Именно их сложность делала до последнего времени невозможным количественное описание большинства биологических систем. Нервные мембраны — одно из немногих исключений в биологии они были изучены количественно весьма подробно как в экспериментальном, так и в теоретическом плане. Одной из наиболее изученных систем является гигантский аксон кальмара. Диаметр его составляет приблизительно 500 мкм, что дает экспериментальные преимущества по сравнению с другими системами, поскольку в этот аксон гораздо легче вставить микроэлектроды, чтобы стимулировать или регистрировать его электроактивность. В понимании механизма действия электровозбудимых мембран большую роль сыграла работа Ходжкина и Хаксли [9.4] на гигантском аксоне кальмара, использовавшая метод фиксации напряжения (рис. 9.7 и 9.8). Они развили также успешное феноменологическое описание динамических свойств нервной мембраны, которое до сих пор занимает центральное место в электрофизиологии. [c.350]
Основные эксперименты по электростимуляции нервных клеток были проведены Колом, Ходжкином и Хаксли на гигантском аксоне кальмара. На рис. 101 приведена схема экспериментальной установки. Мембранный потенциал измеряли с помощью двух хлорсеребряных электродов сравнения, соединенных с исследуемыми жидкостями микропипетками,заполненными физиологическим раствором (0,9%-ный раствор Na l), желатини- [c.235]
Вернемся теперь к нервам. Электрическую структуру нервного волокона в принципе угадал еще Гальвани. (Правда, он рассуждал о целом нерве, а не о составляющих его отдельных нервных волокнах.) Он писал, что внутри нерва имеется проводящая среда, окруженная изолирующей оболочкой, подобно проводу от электрической машины, заизолированному воском. С помощью специальных химических экспериментов Гальвани пришел к правильному выводу, что изоляция нерва образована жироподобными веществами. Дальнейшее изучение строения уже отдельных нервных волокон подтвердило догадку Гальвани. А в 1946 г. Ходжкин и Раштон экспериментально показали, что такие одиночные волокна, как гигантский аксон кальмара, ведут себя подобно бесконечному кг-белю, т. е. к ним полностью применима теория Томсона. Они вводили в аксон микроэлектрод и пропускали черс з него ток, создавая в этой точке изменение мембранно о потенциала. С помощью второго микроэлектрода мною-кратно измеряли разность потенциалов на мембране па разных расстояниях от первого электрода (рис. 33, а). Потенциал действительно спадал по экспоненте. Константу затухания можно найти непосредственно по графику спада потенциала (рис. 33, б). Оказалось, что длина аксона кальмара во много раз больше его константы затухания. После этого Ходжкин и Раштон провели расчеты, которые были, так сказать, обратной задачей по сравнению с первым приложением теории Томсона. При расчете трансатлантического кабеля нужно было, зная удельные сопротивления материалов жилы и изоляции кабеля, рассчитать его параметры (диаметр жилы, толщину изоляции). Здесь же был готовый кабель — аксон, но удельные сопротивления его оболочки — мембраны и жилы — аксоплазмы былинеиз- [c.130]
Подобно тому как гигантский аксон кальмара является образцом] нервлого волокна, образцом нервной клетки является мотонейрон кошки (рис. 51). Эта клетка имеет относительно большие размеры (около 30 мкм) и позтому наиболее детально изучена. Мотонейрон (МН) имеет тело и дендриты, на которых расположены около 10 ООО синапсов, образованных окончаниями других нервных клеток. От тела МН отходит выходной отросток — ак-сон представляющий собой миелинизированное волокно, У его основания имеется особая структура — аксонный холмик это часть МН, имеющая мембрану с наиболее низким порогом. Аксоны МН могут быть очень длинными, например, у кошки — сантиметров 25, а у слона или жирафа — и несколько метров. В конце аксон МН разделяется на веточки — терминали, которые оканчиваются на мышечных волокнах. Кроме того, еще внутри спинного мозга, где лежат МН, аксон отдает боковые веточки (кол-латерали) которые идут к другим нервным клеткам. [c.206]
Цитоплазма, окружающая органеллы нервных клеток, состоит главным образом из воды, белков и неорганических солей (рис. 6.1). К белкам относятся как структурные макромолекулы и высокомолекулярные ферменты, так и более низкомолекулярные вещества типа полипептидов, пептидов и различных аминокислот. Концевые группы многих подобных молекул диссоциируют в водной среде цитоплазмы, и благодаря этому молекулы приобретают электрический заряд, т. е. превращаются в ионы. Содержание этих органических ионов в гигантском аксоне кальмара можно определить путем простого выдавливания цитоплазмы с ее последующим анализом. Подобный анализ показал, что главным органическим ионом нервных клеток является изетионат. Поскольку суммарный заряд этого иона отрицателен, он представляет собой органический анион (А ). Полагают, что в других типах нервных клеток содержатся глутамат, аспартат и органические фосфаты. Все подобные молекулы несут отрицательный суммарный заряд, т. е. являются анионами. [c.129]
Все эти методы вместе с традиционными биохимическими методами измерения потоков радиоактивного Са + в согласии друг с другом показывают, что концентрации свободного ионизированного Са в нервных клетках чрезвычайно низки. Они находятся в интервале от 10 до 10 М. Сопоставьте это Ю » М для суммарного содержания Са + в аксоплазме гигантского аксона кальмара (и около 10 М для морской воды). Таким образом, большая часть Са в нейроне (равно как и в любой другой клетке тела) находится в связанной форме, и только очень малая часть — в свободном ионизированном состоянии в цитозоле. Это один из ключей к пониманию функций Са, поскольку это означает, что клетка может использовать малые изменения локальной концентрации Са +, чтобы вызвать значительные эффекты. Зто основа той критической роли, которую Са + играет в таких разных функциях, как секреция, течение аксоплазмы, подвижность, сокращение, ферментативные реакции и проницаемость мембраны. Указанные функции и ряд других представлены на рис. 9.5. [c.212]
Я уже отмечал, что еще очень недавно исследователи были разделены на два непримиримых лагеря — сторонников сорбционной теории, возглавляемых Д. Н. Насоновым, и сторонников мембранной теории во главе с Д. Л. Рубинштейном. Темпераментные, не всегда академические споры завершились во втором поколении противников победой мембранной теории. Она восторжествовала благодаря замечательным достижениям в изучении биоэлектрических явлений на гигантских аксонах кальмаров и других удобных объектах. В самом деле, можно перфу-зировать, промыть гигантский аксон, удалить из него всю протоплазму— а способность к раздражению, к генерации нервного импульса останется. Более того, можно получить искусственную-возбудимую мембрану, обладающую всеми основными свойствами естественной [434, 435]. Следовательно, функция аксона и. в самом деле обусловлена лишь его мембраной. Следовательно, ионная асимметрия и в самом деле создается без участия избирательной сорбции ионов в толще внутриклеточной протоплазмы. [c.100]
Большую скорость распространения нервного импульса по аксону кальмара обеспечивает их гигантский по сравнению с аксонами позвоночных диаметр. У позвоночных большая скорость передачи возбуждения в нервных волокнах достигает другими способами. Аксоны позвоночных снабжены миелиновой оболочкой, которая увеличивает сопротивление мембраны и ее толш,ину. [c.89]
Биологические модели представляют собой биологические объекты, удобные для экспериментальных исследований, на которых изучаются свойства, закономерности биофизических процессов в реальных сложных объектах. Например, закономерности возникновения и распространения потенциала действия в нервных волокнах были изучены только после нахождения такой удачной биологической модели, как гигантский аксон кальмара. Опыт Уссинга, доказывающий существование активного транспорта, был проведен на биологической модели — коже лягушки, которая моделировала свойство биологической мембраны осуществлять активный транспорт. Закономерности сократимости миокарда устанавливают на основе модельных экспериментов на папиллярной мышце. [c.165]
Многочисленными опытами доказана исключительная зависимость экзоцитоза от ионов Са во внешней среде. Удаление Са + из среды или добавление в среду Са-комплексона — ЭГТА или ингибиторов Са-каналов (см. табл. 7) приводит к резкому торможению или практически полному прекращению Са-зависимой секреции медиаторов нервными окончаниями и гормонов железистыми клетками. Ионофоретическое введение Са + в гигантский аксон кальмара в концентрации 1—10 мкМ при отсутствии деполяризующих воздействий индуцирует процесс секреции ацетилхолина путем экзоцитоза. Электрофизиологиче-ский анализ секреции ацетилхолина в нервно-мышечных синапсах показал, что в состоянии покоя (без деполяризации мембран) также происходит Са-зависимая секреция медиатора путем экзоцитоза, а секретируемый ацетилхолин генерирует в постсинаптической мембране мышц так называемый миниатюрный потенциал. В этом случае экзоцитоз индуцируется случайным (по типу броуновского столкновения частиц) контактом синаптических пузырьков с пресинаптической мембраной, а кроме того, и достаточно закономерным контактом, индуцируемым локальным накоплением Са + в примембранной области за счет постоянного, хотя и небольшого входа Са + в клетку из внешней среды, и локального высвобождения Са + из внутриклеточных депо хранения. [c.75]
В экспериментальных условиях возникновение и проведение нервного импульса можно наблюдать в аксоне, лишенном тела нейрона. Например, нерв лягушки проводит импульсы более недели после отделения от клеток. Даже если из аксона удалить аксоплазму и заменить ее солевым раствором, то оставшаяся мембранная трубочка сохраняет способность к возбуждению и проведению импульса. Именно с применением таких трубочек, изготовленных из гигантского аксона кальмара, впервые были изучены электрические характеристики и механизм нервного импульса. [c.533]
К )-насосом (разд. 36.2). В состоянии покоя проницаемость мембраны нервной клетки для К гораздо выше, чем проницаемость для Na, и поэтому мембранный потенциал определяется главным образом отношением внутриклеточной концентрации К к внеклеточной (рис. 37.2, А). В нестиму-лированных аксонах мембранный потенциал составляет-60 мВ это близко к величине-75 мВ (равновесный К -потен-циал), которая соответствует проницаемости мембраны для одних только ионов К»». Нервный импульс, или потенциал действия, возникает при деполяризации мембраны, выходяшей за пределы выше порогового уровня (а именно с —60 до —40 мВ). За несколько миллисекунд мембранный потенциал становится положительным и достигает примерно +30 мВ, после чего вновь делается отрицательным. Эта усиленная в несколько раз деполяризация распространяется по нерву, достигая нервного окончания. В раскрытии природы потенциала действия важную роль сыграло изучение гигантского аксона кальмара. Поскольку в этот необычайно крупный аксон (диаметром около миллиметра) нетрудно ввести электроды, он стал излюбленным объектом исследователей. [c.327]
Среди моллюсков (тип Mollus a) наибольший интерес для биохимиков представляют головоногие — кальмары и осьминоги. У кальмара имеются нервные клетки (нейроны) с гигантским аксоном, изучение которого внесло большой вклад в развитие наших представлений о механизме проведения нервных импульсов. У осьминогов есть зачатки разумного -поведения, не свойственные другим беспозвоночным, нервные реакции которых полностью запрограммированы . Мозг некоторых брюхоногих моллюсков состоит всего из 10 нейронов отдельные из них необычайно велики. Мозг моллюсков является объектом интенсивного исследования, направленного на изучение его организации и механизма функционирования. [c.53]
Все, что способствует быстроте и эффективности пассивного распространения деполяризации, будет повышать скорость и эффективность распространения потенциалов дейстиия. Одним из таких факторов может быть большой диаметр аксона. У некоторых беспозвоночных, например у кальмара, для быстрой передачи сигналов в ходе эволюции выработались гигантские аксоны толщиной до 1 мм. Однако позвоночные обладают еще лучшим приспособлением столь же высокая скорость проведения сигналов достигается у них гораздо более экономным способом-путем изоляции большей части поверхности аксона миелиновой оболочкой. Эту оболочку образуют специализированные глиальные клетки-шванновские клетки в периферической н олигодендроциты в центральной нервной системе. Плазматическая мембрана этих клеток слон за слоем плотно наматывается на аксон (рис. 18-22). Каждая шваниовская клетка миелинизирует одни аксон, образуя сегмент оболочки длиной около миллиметра, а олигодендроциты формируют подобные сегменты оболочки одновременно у нескольких аксонов. [c.91]
Два простых наблюдения показывают, что для синаптической передачи необходим приток нонов Са в окончание аксона. Во-первых, если во внеклеточной среде Са отсутствует, медиатор не высвобождается и передачи сигнала не происходит. Во-вторлх, если искусственно ввести Са в цитоплазму нервного окончания при помощи микропипетки, выход нейромедиатора происходит даже без электрической стимуляции аксона, рто трудно осуществить на нервно-мышечном соединении из-за малых размеров окончани аксона поэтому такой эксперимент был проведен на синапсе между гигантскими нейронами кальмара.) Эти наблюдения позволили воссоздать последо вательность событий, происходящих в окончании аксона, которая описана ниже. [c.96]
Например, у дождевых червей вдоль всего тела проходят гигантские аксоны (их диаметр достигает 60 мкм, что очень много для дождевого червя). Как видите, они не такие гигантские, как у кальмара, да и устроены они иначе. На самом деле это не аксон, т. е. не отросток одной клетки. Этот аксон состоит из множества цилиндрических кусочков. В каждом сегменте тела есть нервная клетка, которая отращивает такой кусочек затем торцевые мембраны этих цилиндров соединяются коннексона-ми, так что получается кабель с перегородками, пронизанными каналами коннексонов (рис. 41,е). В результате импульс бежит по этому составному аксону как по обычному толстому нервному волокну. Эти волокна вызывают быстрое сокращение тела червя, обеспечивая реакции отдергивания от раздражителя или быстрого втягивания в норку. При химических синапсах эта реакция занимала бы несколько десятых долей секунды ведь задержка между сегментами в ХС холоднокровного составляет несколько миллисекунд, а сегментов может быть несколько десятков и даже сотня задержка на ЭО составляет всего 0,01 мс ясно, что тут за счет ЭС обеспечивается жизненно важная экономия времени. Такие же аксоны есть и у речного рака когда опасность грозит спереди, они обеспечивают быстрое подгибание брюшка (эта реакция называ- [c.169]
Как отмечалось, в механизме проведения сигналов по нерву посредством волны деполяризации источником необходимой энергии служит неравновесное состояние градиентов концентрации катионов — калия, натрия, кальция. Скорость проведения нервного импульса зависит от скорости изменения этих градиентов, т. е. от быстроты конформационной перестройки мембранных компонентов. По мнению Катца [130], скорость распространения волны деполяризации зависит от продольной электропроводности внутренней области аксона и поэтому она тесно коррелирует с толщиной волокна. Как известно, один из способов увеличения скорости передачи сигналов состоит в уменьщении осевого сопротивления кабеля путем увеличения диаметра волокна. Именно это ре-щенпе избрала природа для удовлетворения потребности в высокоскоростной передаче импульсов у некоторых беспозвоночных. Например, быстрое движение кальмара при бегстве от опасности контролируется небольшим числом гигантских аксонов, иннервирующих обширную мускулатуру его мантии, которая действует как реактивный двигатель. Однако для животного, которому по-М1ИМ0 быстроты реакции необходимо и наличие огромного числа каналов для передачи множества сенсорных сообщений и обеспечения двигательных реакций, гигантские аксоны оказались бы непригодными. Ясно, например, что в з,рительном нерве, где должно находиться больше миллиона параллельных аксонов для передачи зрительной информации просто не хватило бы места для большого числа гигантских волокон. Решением, найденным нервной системой позвоночных, явилось образование миелинизиро-ванного аксона, в котором кабельные потери сильно снижены благодаря миелиновой оболочке (130, с. 114). [c.207]