25
На
тему:
«Методы фиксации потенциала.Ионные
токи в аксоне»
Кафедра: медицинской и биологической физики
Заведующая кафедрой: Стюрева Галина Михайловна
Выполнил:
Мугутдинов Ислам Н.
Студент
стомат. Факультета
17 Группа 1 курс
Москва
2012
Метод
измерения ионных токов
1. Метод фиксации потенциала
Для
изучения потенциалзависимых мембранных
каналов применяется метод фиксации
потенциала. В данном методе используют
электронную систему с обратной связью,
которая обеспечивает автоматическое
поддержание мембранного потенциала.
Разность потенциалов по разные стороны
мембраны фиксируют на определенном
уровне, при этом мембранный потенциал
можно ступенчато изменят на строго
определенную величину. Такой метод
позволяет измерить ионные токи,
протекающие сквозь мембрану через
каналы, которые активируются при
изменении потенциала. В соответствии
с законом Ома, если напряжение на мембране
постоянно, изменения тока однозначно
связанные с изменениями проводимости.
В свою очередь, мы можем фиксировать
мембранный потенциал на разном уровне
и измерять возникающие при этом токи.
Если же использовать растворы с
различенным ионным составом, и препараты,
избирательно блокирующие тот или иной
канал, то можно будет изучать поведение
различных ионных каналов, через которые
протекают измеряемые нами токи. Технически
фиксация потенциала осуществляется
следующим образом. При помощи
усилителя-регулятора внутриклеточный
потенциал сравнивают с управляющим
потенциалом (см. рис.1). Любое отклонение
мембранного потенциала от управляющего
усиливается и на выходе усилителя
возникает управляющий ток. Этот ток
течет через электроды, расположенные
по разные стороны мембраны в таком
направлении, что мембранный потенциал
вновь становится равным управляющему.
Такое автоматическое согласование
происходит за долю миллисекунды после
того, как задается ступенчатый управляющий
потенциал.
Когда
в ответ на такую ступенчатую деполяризацию
открываются натриевые (или какие-либо
другие) каналы, соответствующие ионы
входят в аксон по электрохимическому
градиенту и переносят с собой электрические
заряды. Эти входящие заряды стремятся
сдвинуть мембранный потенциал в
положительном направлении, однако
малейшее отклонение от управляющего
потенциала немедленно компенсируется
в результате удаления из клеток избыточных
зарядов с помощью усилителя-регулятора.
При этом записывается тот ток, который
подается усилителем для поддержания
мембранного потенциала на необходимом
уровне, и этот ток в точности равен
ионному току, протекающему через
мембрану.
Метод
фиксации напряжения, или кламп метод,
позволяет измерять ионный поток при
перемещении иона по контролируемому
градиенту электрохимического потенциала
и получать информацию об электрической
проводимости мембраны и её пассивной
проницаемости в отношении интересующего
нас иона. Этот метод используется для
измерения вольт-амперных характеристик
растительных клеток, что позволяет
получить информацию о тонких механизмах
функционирования различных систем
мембранного транспорта.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки[1]. В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
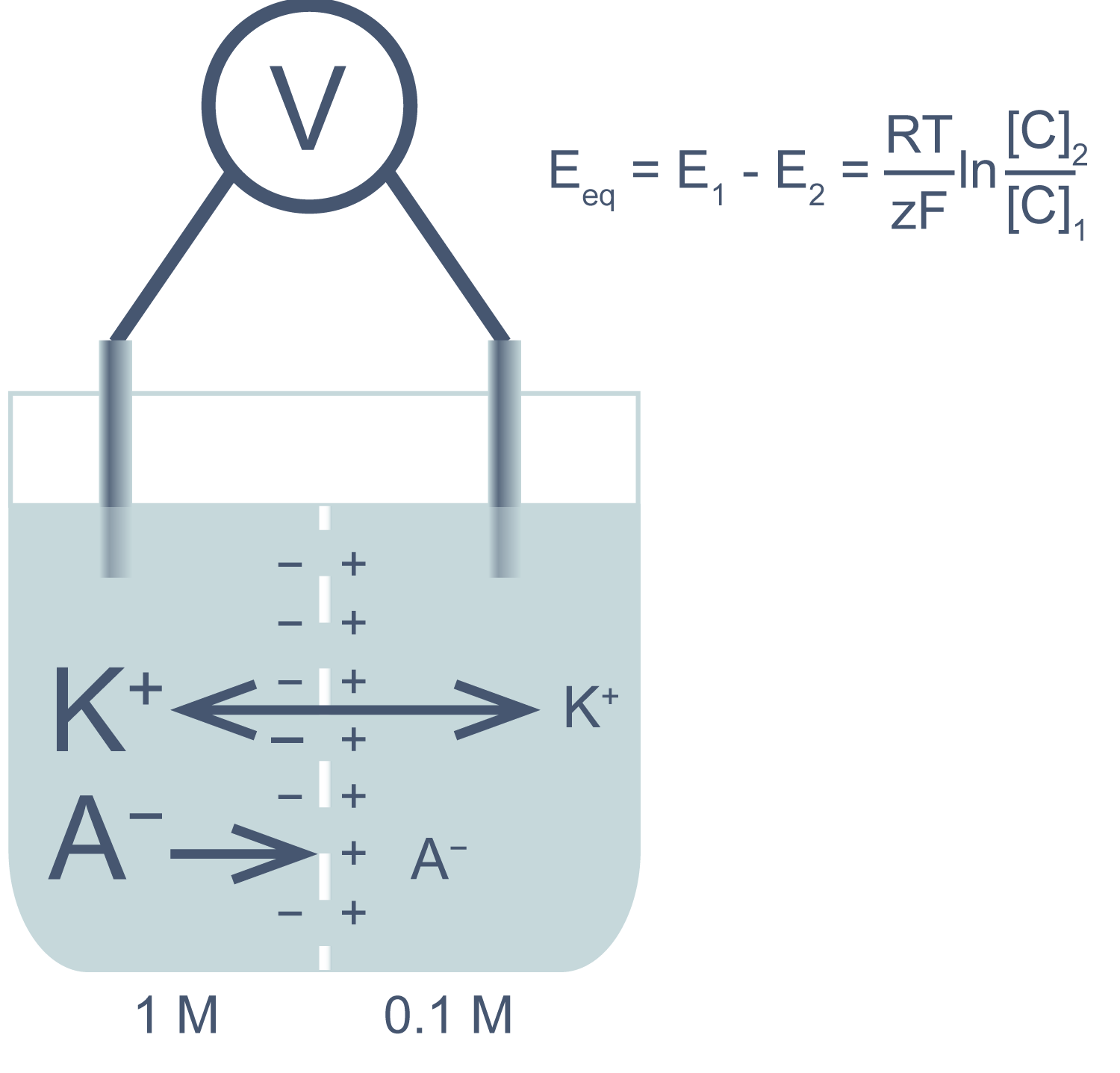
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K+, но не анионы Cl−. Ионы K+ в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl−, неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K+ из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль–1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K+ в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
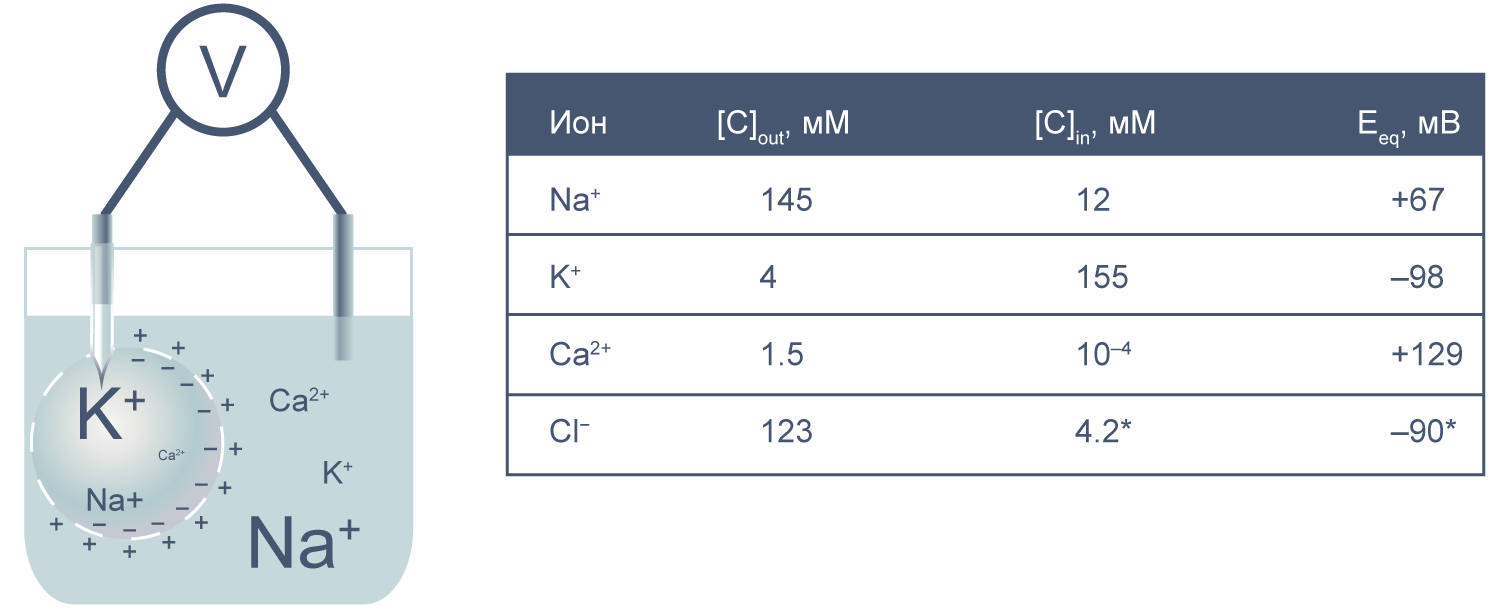
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки[2].
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
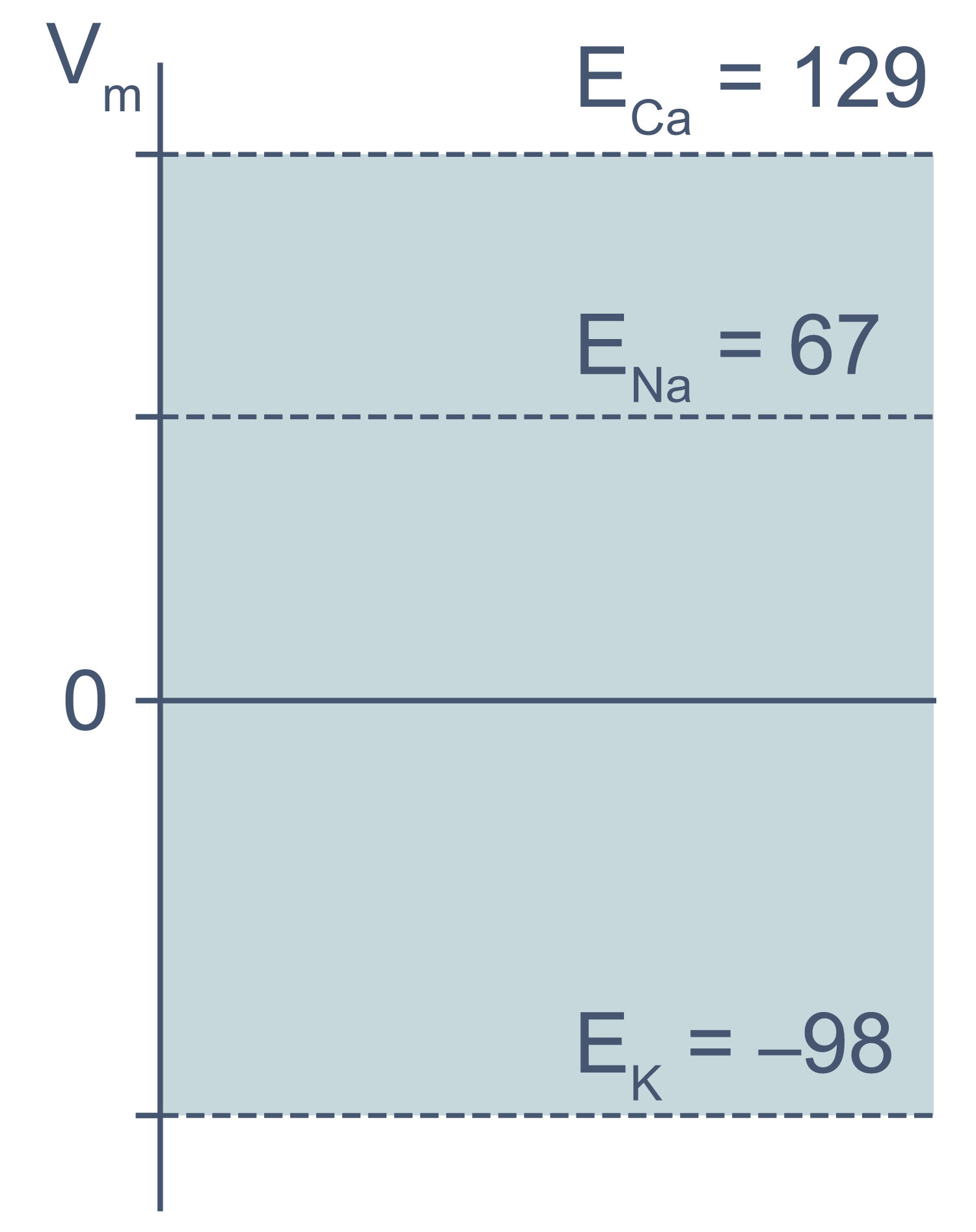
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na+, Ca2+) и анионов (в первую очередь для Cl– и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K+, однако строго не равна ему, поскольку в реальности другие катионы и Cl– могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K+ будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль–1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K+ channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K+ channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K+ (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C[3], кислым pH[4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum)[3], эндоканнабиноидом анандамидом[5], окситоцином[6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии[7], муковисцидоза[8], некоторых аритмий[9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na+ наружу и два K+ внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ[11].
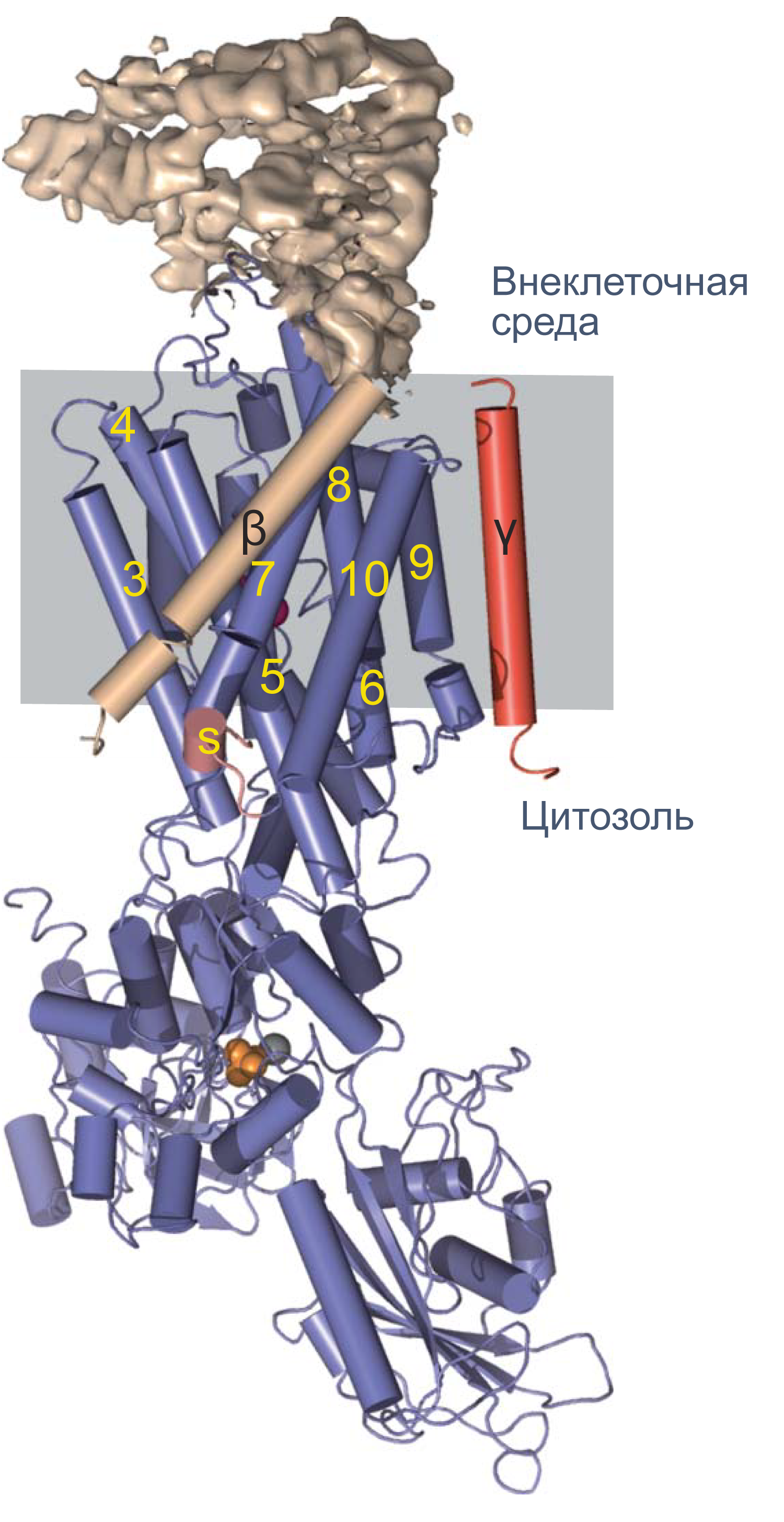
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками[12].
Активный и пассивный транспорт веществ через мембрану
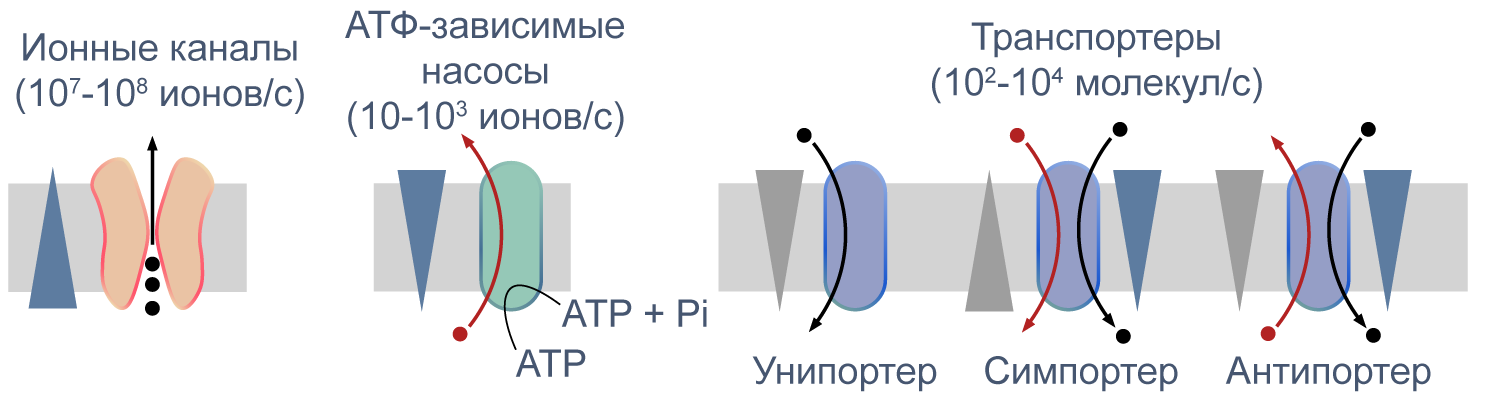
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×106 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na+ и 200 K+ в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина[15]. Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала[16]. Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl− [17].
Клеточная мембрана как электрическая цепь
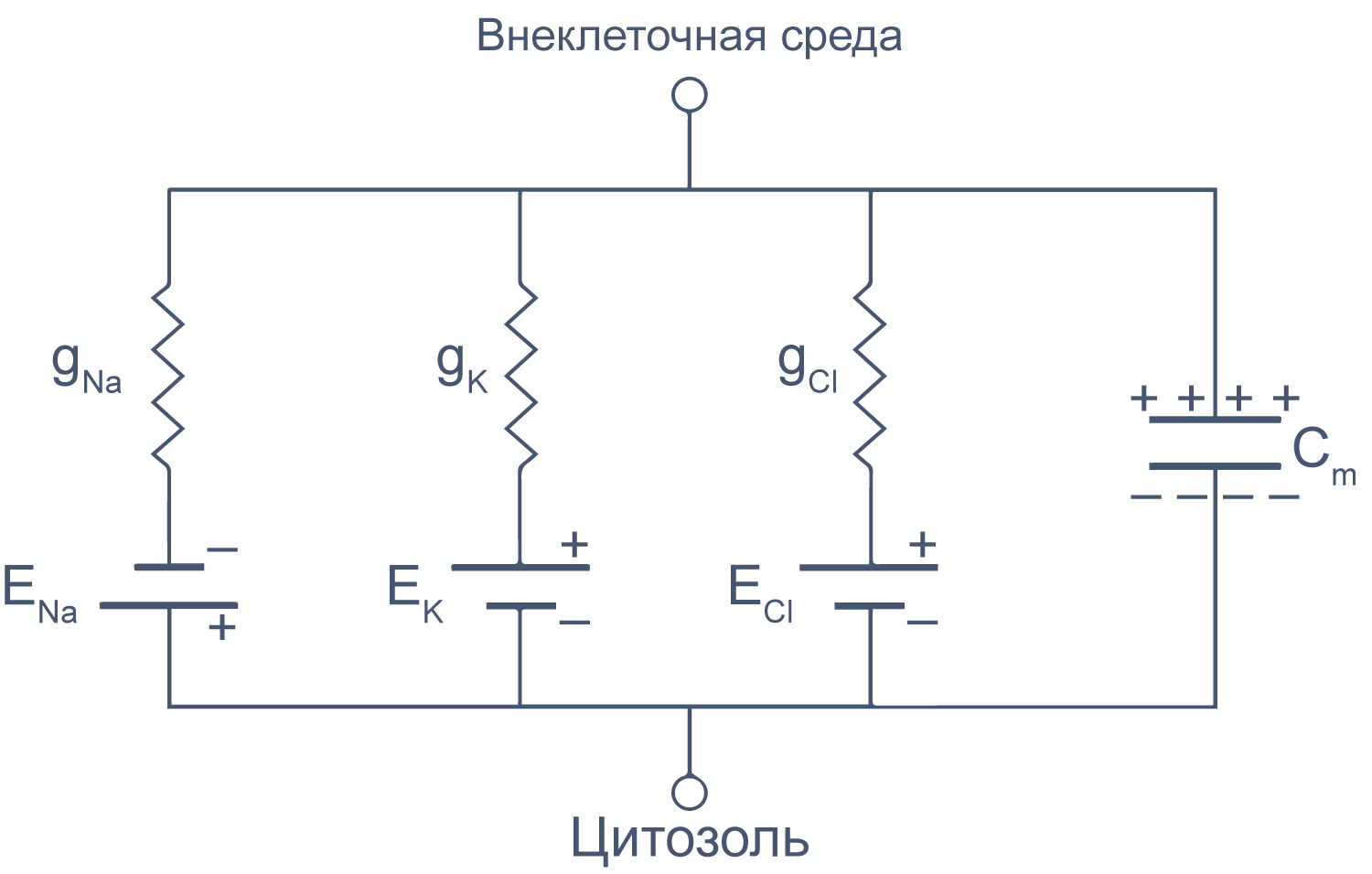
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na+, K+ и Cl–, соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
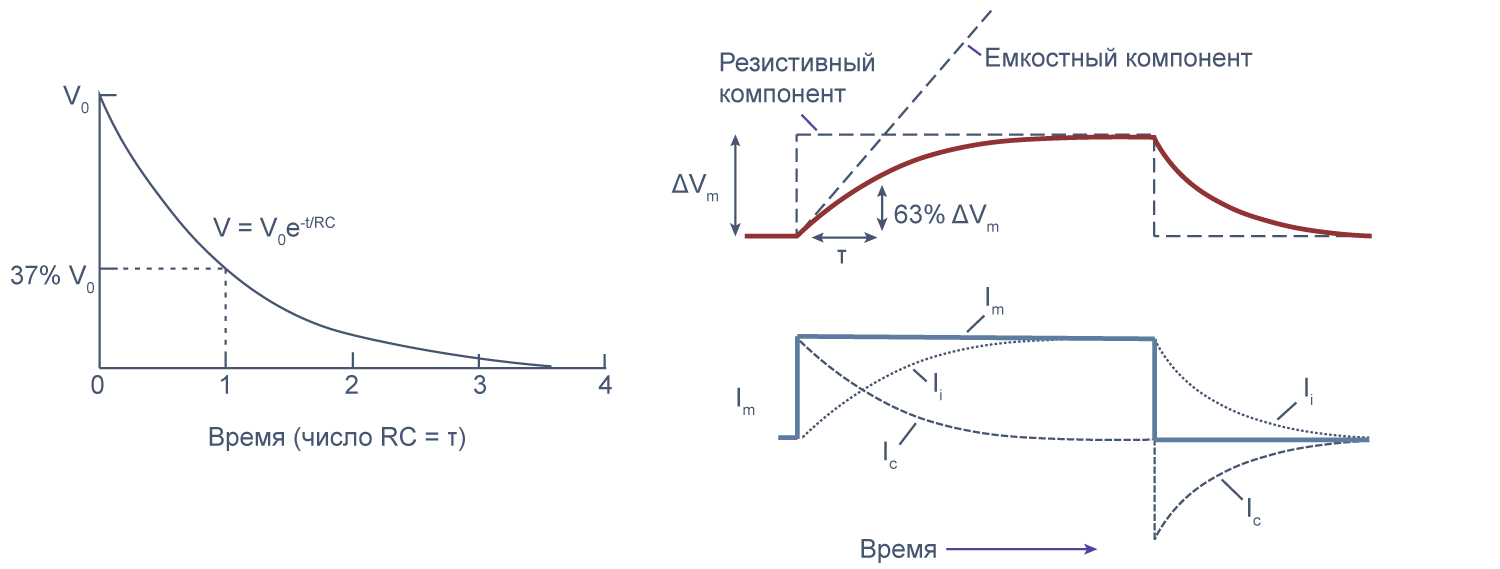
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см2 или 0,01 пФ/мкм2*** и мало зависит от типа клеток[2]. Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e–t/RC, то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22], Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом[18]. До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
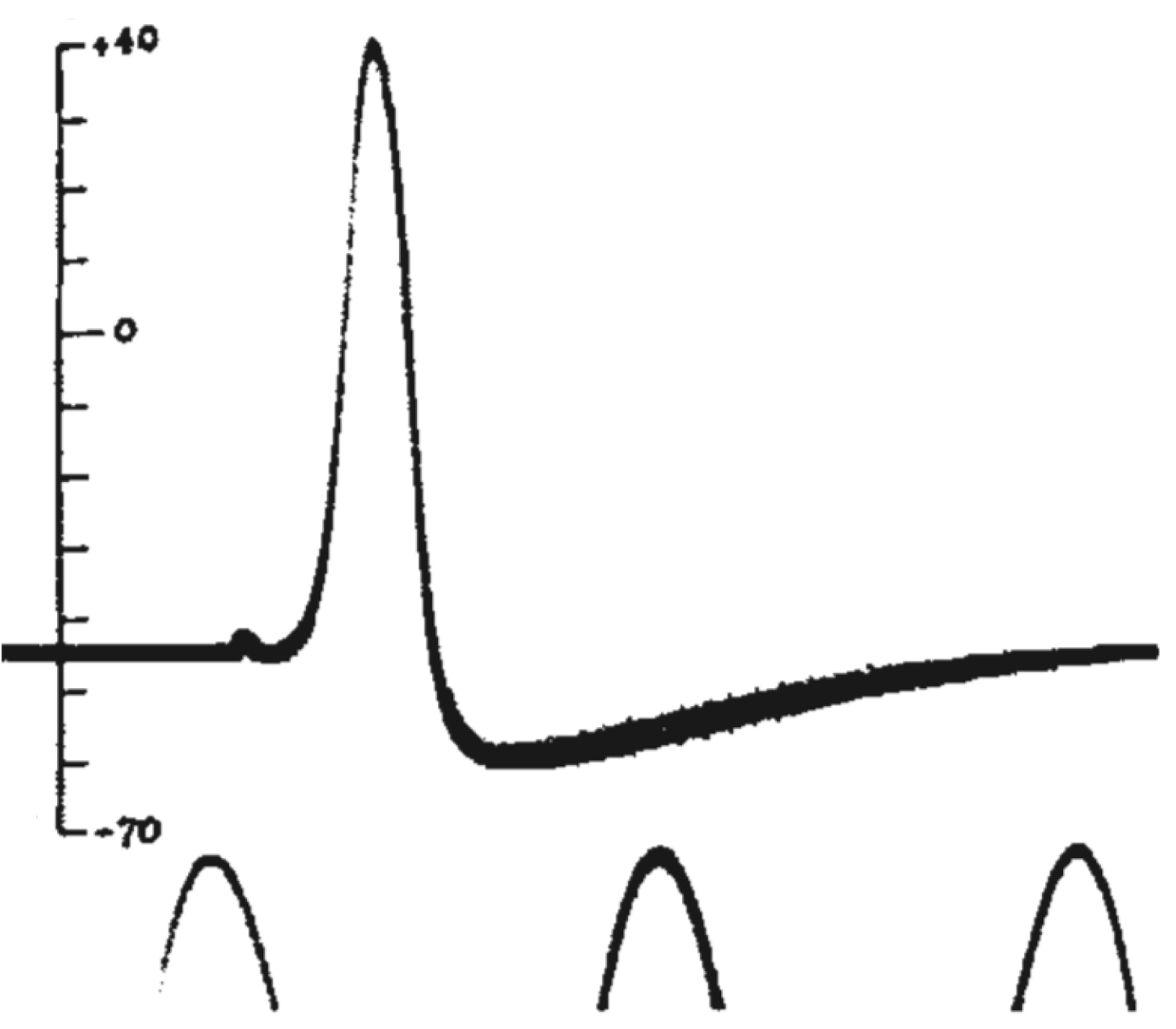
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна»[19], в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года[19]. Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис[20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см2 до 40 мСм/см2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
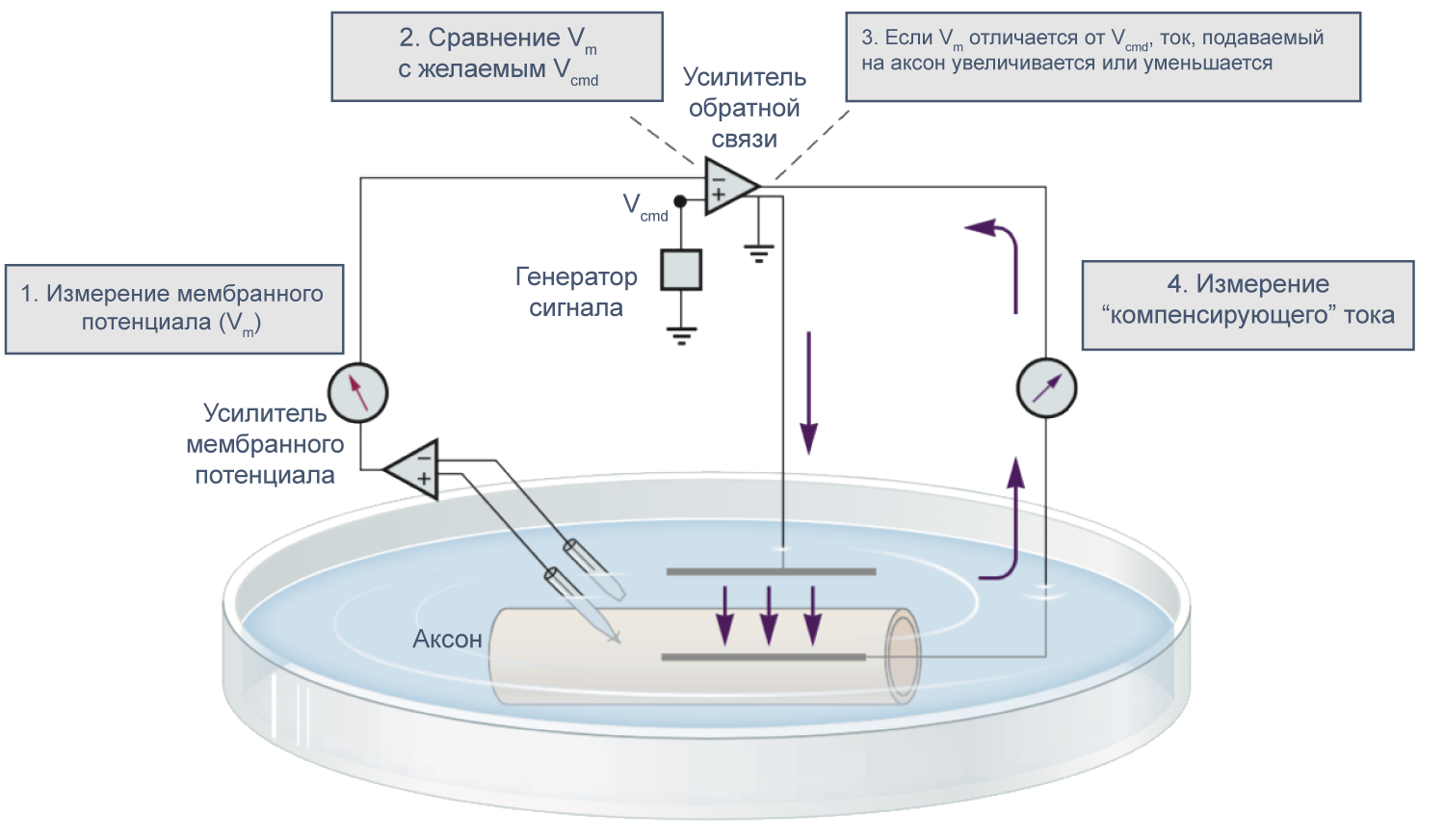
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом[21]. Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов[21].
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
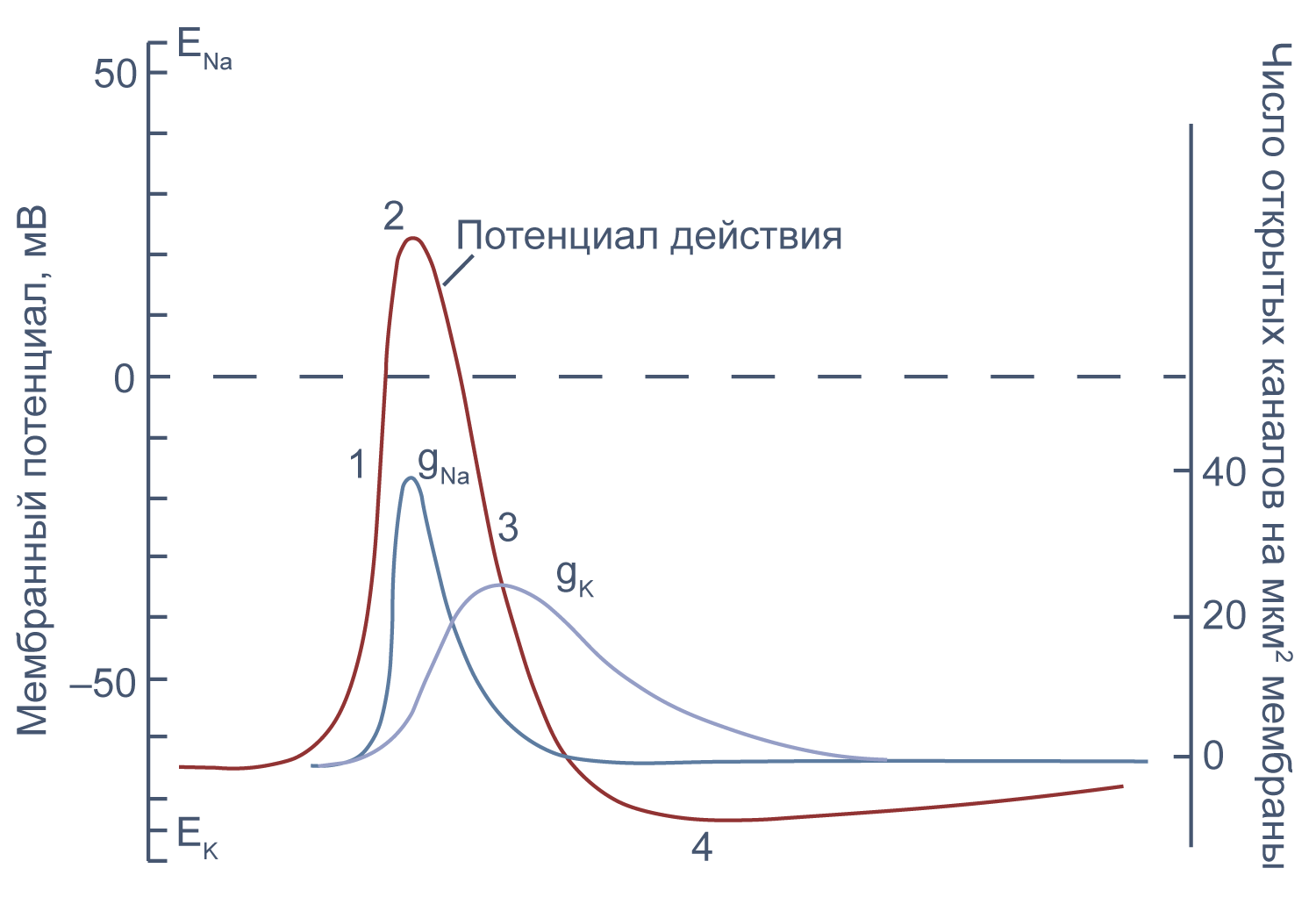
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na+ и K+ в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток[20]. Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли[23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
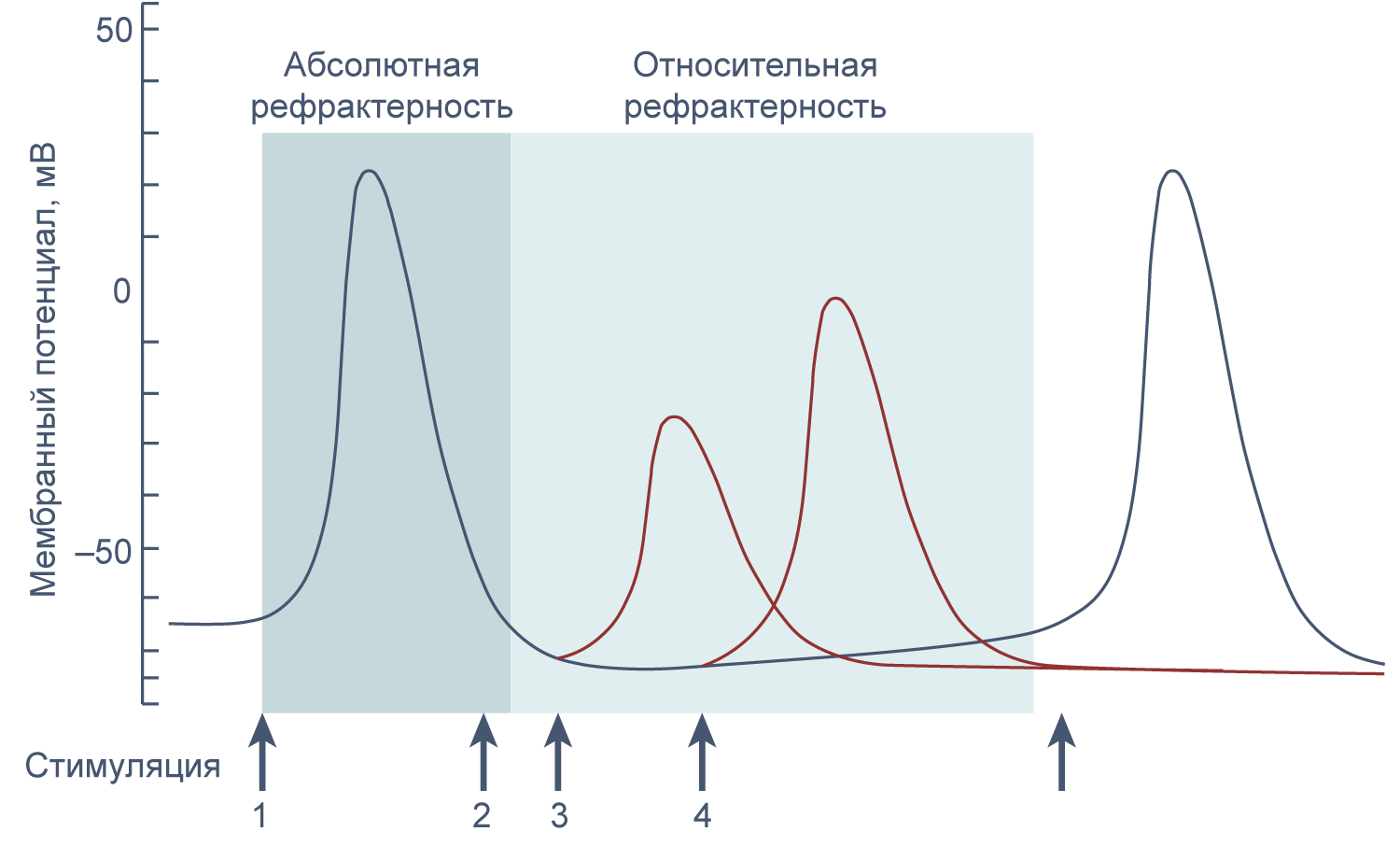
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na+ и K+. Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см2, а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см2 × 0,1 В = 10−7 Кл/см2. Величина заряда одного иона Na+ или K+ (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см2, или 6250 ионов/мкм2. Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr2 = 314 мкм2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr3/3 = 524 мкм3. При внутриклеточной концентрации Na+ 10 мМ, а K+ 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм2 × 6,250 ионов/мкм2 ≈ 2 000 000 ионов Na+ входит в клетку в фазе деполяризации и примерно столько же ионов K+ выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na+ и K+ все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром[25].
Распространение возбуждения по аксону
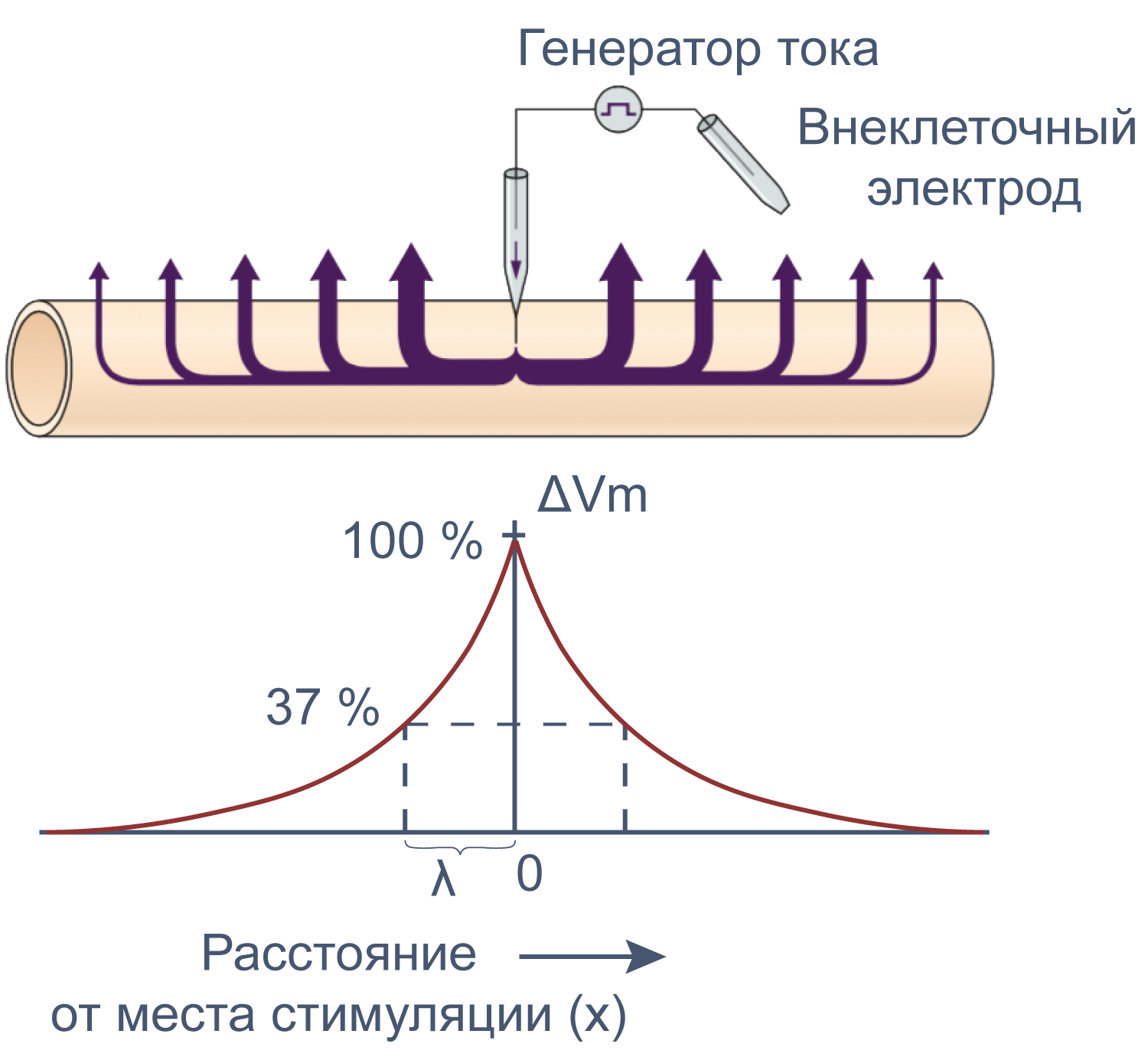
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e–x/λ, где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR2, а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне[26]; эти значения на несколько порядков выше, чем 100 нМ свободного Ca2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см-2∙с-1], D — коэффициент диффузии [см2∙с-1], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см2, разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
Библиография
- Hediger M.A. et al. The ABCs of membrane transporters in health and disease (SLC series): Introduction // Mol. Aspects Med. 2013. Vol. 34. P. 95–107.
- Hille B. Ion Channels of Excitable Membranes. Third edit. Sinauer Associates, Inc., 2001.
- Caterina M.J. et al. The capsaicin receptor: A heat-activated ion channel in the pain pathway // Nature. 1997. Vol. 389, № 6653. P. 816–824.
- Jordt S.-E., Tominaga M., Julius D. Acid potentiation of the capsaicin receptor determined by a key extracellular site // Proc. Natl. Acad. Sci. 2000. Vol. 97, № 14. P. 8134–8139.
- Smart D. et al. The endogenous lipid anandamide is a full agonist at the human vanilloid receptor (hVR1) // Br. J. Pharmacol. 2000. Vol. 129, № 2. P. 227–230.
- Nersesyan Y. et al. Oxytocin Modulates Nociception as an Agonist of Pain-Sensing TRPV1 // Cell Rep. 2017. Vol. 21, № 6. P. 1681–1691.
- Berkovic S.F. et al. Human epilepsies: interaction of genetic and acquired factors // Trends Neurosci. 2006. Vol. 29, № 7. P. 391–397.
- Welsh M.J., Smith A.E. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis // Cell. 1993. Vol. 73, № 7. P. 1251–1254.
- Ruan Y., Liu N., Priori S.G. Sodium channel mutations and arrhythmias // Nat. Rev. Cardiol. 2009. Vol. 6, № 5. P. 337–348.
- Giudicessi J.R., Ackerman M.J. Potassium-channel mutations and cardiac arrhythmias — Diagnosis and therapy // Nat. Rev. Cardiol. Nature Publishing Group, 2012. Vol. 9, № 6. P. 319–332.
- Thomas R.C. Electrogenic sodium pump in nerve and muscle cells // Am. J. Physiol. 1972. Vol. 52, № 3. P. 563–594.
- Morth J.P. et al. Crystal structure of the sodium-potassium pump // Nature. 2007. Vol. 450, № 7172. P. 1043–1049.
- Lodish H. et al. Molecular Cell Biology (5th edition) // Biochemistry and Molecular Biology Education. 2003.
- Scheel O. et al. Voltage-dependent electrogenic chloride/proton exchange by endosomal CLC proteins // Nature. 2005. Vol. 436, № 7049. P. 424–427.
- Artigas P., Gadsby D.C. Ouabain affinity determining residues lie close to the Na/K pump ion pathway. // Proc. Natl. Acad. Sci. U. S. A. 2006. Vol. 103, № 33. P. 12613–12618.
- Li, C., Ramjeesingh, M., Wang, W., Garami, E., Hewryk, M., Lee, D., Rommens, J. M., Galley, K., Bear, C. E. ATPase Activity of the Cystic Fibrosis Transmembrane Conductance Regulator // Journal of Biological Chemistry. 1996. № 45 (271). P. 28463–28468.
- Martineau M. et al. VGLUT1 functions as a glutamate/proton exchanger with chloride channel activity in hippocampal glutamatergic synapses // Nat. Commun. Springer US, 2017. Vol. 8, № 1.
- Ling G., Gerard R.W. The normal membrane potential of frog sartorius fibers // J. Cell. Comp. Physiol. Wiley-Blackwell, 1949. Vol. 34, № 3. P. 383–396.
- Hodgkin A.L., Huxley A.F. Action potentials recorded from inside a nerve fibre // Nature. 1939. Vol. 144. P. 710–711.
- Cole K.S., Curtis H.J. Electric Impedance of the Squid Giant Axon During Activity // J. Gen. Physiol. 1939. Vol. 22, № 5. P. 649–670.
- Cole K.S. Mostly membranes // Annu. Rev. Physiol. 1979. Vol. 41, № 1. P. 1–24.
- Kandel E.R. et al. Principles of Neural Science. Fifth Edit. The McGraw-Hill Companies, Inc., 2013. 1709 p.
- Hodgkin A.L., Huxley A.F. A quantitative description of membrane current and its application to conduction and excitation in nerve // J. Physiol. 1952. Vol. 117. P. 500–544.
- Capes D.L. et al. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels // J. Gen. Physiol. 2013. Vol. 142, № 2. P. 101–112.
- http://www.physiologyweb.com/lecture_notes/neuronal_action_potential/neuronal_action_potential_na_and_k_concentrations_do_not_change_during_an_action_potential.html
- Bygrave F.L., Benedetti A. What is the concentration of calcium ions in the endoplasmic reticulum? // Cell Calcium. Churchill Livingstone, 1996. Vol. 19, № 6. P. 547–551.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Описывает, как нейроны передают электрические сигналы. 
Модель Ходжкина – Хаксли или на основе проводимости модель — это математическая модель, которая описывает, как потенциалы действия в нейронах инициируются и распространяются. Это набор нелинейных дифференциальные уравнения, которые аппроксимируют электрические характеристики возбудимых клеток, таких как нейроны и сердечные миоциты. Это непрерывная динамическая система.
Алан Ходжкин и Эндрю Хаксли описал модель в 1952 году, чтобы объяснить ионные механизмы, лежащие в основе инициирования и распространения потенциалов действия в гигантском аксоне кальмара. Они получили в 1963 году Нобелевскую премию по физиологии или Медицина для этой работы.
Содержание
- 1 Основные компоненты
- 2 Характеристики ионного тока
- 2.1 Напряжение управляемых ионных каналов
- 2.2 Каналы утечки
- 2.3 Насосы и теплообменники
- 3 Математические характеристики
- 3.1 Центральный коллектор
- 3.2 Разветвления
- 4 Усовершенствования и альтернативные модели
- 5 См. Также
- 6 Ссылки
- 7 Дополнительная литература
- 8 Внешние ссылки
Основные компоненты
Типичная модель Ходжкина – Хаксли рассматривает каждый компонент возбудимой клетки как электрический элемент (как показано на рисунке). липидный бислой представлен как емкость (Cm). управляемые по напряжению ионные каналы представлены электрическими проводимостью (gn, где n — конкретный ионный канал), которые зависят как от напряжения, так и от времени. Каналы утечки представлены линейной проводимостью (g L). электрохимические градиенты, управляющие потоком ионов, представлены источниками напряжения (En), напряжения которых определяются соотношением внутри- и внеклеточных концентраций ионных частиц. представляет интерес. Наконец, ионные насосы представлены источниками тока (Ip). мембранный потенциал обозначается V m.
Математически ток, протекающий через липидный бислой, записывается как
- I c = C md V mdt { displaystyle I_ {c} = C_ {m} { frac {{ mathrm {d}} V_ {m}} {{ mathrm {d}} t}}}
, а ток через данный ионный канал равен произведению
- I i = gi ( V m — V i) { displaystyle I_ {i} = {g_ {i}} (V_ {m} -V_ {i}) ;}
где V i { displaystyle V_ {i} }
- I = C md V mdt + g K (V m — VK) + g N a (V m — VN a) + gl (V m — V l) { displaystyle I = C_ {m} { frac {{ mathrm {d}} V_ {m}} {{ mathrm {d}} t}} + g_ {K} (V_ {m} -V_ {K}) + g_ {Na} (V_ {m} -V_ {Na}) + g_ {l} (V_ {m} -V_ {l})}
где I общий ток мембраны на единицу площади, C m — емкость мембраны на единицу площади, g K и g Na — проводимость калия и натрия на единицу площади соответственно, V K и V Na — потенциалы обращения калия и натрия, соответственно, а g l и V l — проводимость утечки на единицу площади и потенциал обращения утечки соответственно. Элементами этого уравнения, зависящими от времени, являются V m, g Na и g K, где две последние проводимости также явно зависят от напряжения.
Характеристика ионного тока
В потенциалозависимых ионных каналах проводимость канала gl { displaystyle g_ {l}}



ионные каналы, управляемые напряжением
Используя серию экспериментов с ограничением напряжения и варьируя внеклеточные концентрации натрия и калия, Ходжкин и Хаксли разработали модель, в которой свойства возбудимая клетка описывается набором из четырех обыкновенных дифференциальных уравнений. Вместе с уравнением для полного тока, упомянутым выше, это:
- I = C md V mdt + g ¯ K n 4 (V m — VK) + g ¯ Na m 3 h (V m — VN a) + г ¯ l (В м — V l), { Displaystyle I = C_ {m} { frac {{ mathrm {d}} V_ {m}} {{ mathrm {d}} t}} + { bar {g}} _ { text {K}} n ^ {4} (V_ {m} -V_ {K}) + { bar {g}} _ { text {Na}} m ^ {3} h (V_ {m} -V_ {Na}) + { bar {g}} _ {l} (V_ {m} -V_ {l}),}
- dndt = α n (V m) (1 — n) — β N (В м) n { displaystyle { frac {dn} {dt}} = alpha _ {n} (V_ {m}) (1-n) — beta _ {n} ( V_ {m}) n}
- dmdt = α m (V m) (1 — m) — β m (V m) m { displaystyle { frac {dm} {dt}} = alpha _ {m } (V_ {m}) (1-m) — beta _ {m} (V_ {m}) m}
- dhdt = α h (V m) (1 — h) — β h (V m) час { displaystyle { frac {dh} {dt}} = alpha _ {h} (V_ {m}) (1-h) — beta _ {h} (V_ {m}) h}
где I — ток на единицу площади, а α i { displaystyle alpha _ {i}}





- α p (V m) = p ∞ (V m) / τ p { displaystyle alpha _ {p} (V_ {m}) = p _ { infty} (V_ {m}) / tau _ {p}}
- β p (V m) = (1 — p ∞ (V m)) / τ p. { displaystyle beta _ {p} (V_ {m}) = (1-p _ { infty} (V_ {m})) / tau _ {p}.}
p ∞ { displaystyle p_ { infty}}




- α n (V m) = 0,01 (10 + V m) exp (10 + V m 10) — 1 α m (V m) = 0,1 (25 + V m) exp (25 + V m 10) — 1 α h (V m) = 0,07 exp (V m 20) β n (V m) = 0,125 exp (V m 80) β m (V m) = 4 exp (V m 18) β h (V m) = 1 ехр (30 + V м 10) + 1 { displaystyle { begin {array} {lll} alpha _ {n} (V_ {m}) = { frac {0,01 (10 + V_ {m })} { exp { big (} { frac {10 + V_ {m}} {10}} { big)} — 1}} alpha _ {m} (V_ {m}) = { frac {0.1 (25 + V_ {m})} { exp { big (} { frac {25 + V_ {m}} {10}} { big)} — 1}} alpha _ { h} (V_ {m}) = 0,07 exp { bigg (} { frac {V_ {m}} {20}} { bigg)} \ beta _ {n} (V_ {m}) = 0,125 exp { bigg (} { frac {V_ {m}} {80}} { bigg)} beta _ {m} (V_ {m}) = 4 exp { bigg (} { frac {V_ {m}} {18}} { bigg)} beta _ {h} (V_ {m}) = { frac {1} { exp { big (} { frac {30+) V_ {m}} {10}} { big)} + 1}} end {array}}}
в то время как во многих современных программах модели типа Ходжкина – Хаксли ge преобразовать α { displaystyle alpha}

- A p (V m — B p) exp ( В м — В п С п) — D п { displaystyle { frac {A_ {p} (V_ {m} -B_ {p})} { exp { big (} { frac {V_ {m}) -B_ {p}} {C_ {p}}} { big)} — D_ {p}}}}
Чтобы охарактеризовать каналы с ограничением по напряжению, уравнения соответствуют данным фиксации напряжения. Для вывода уравнений Ходжкина – Хаксли при ограничении напряжения см. Вкратце, когда мембранный потенциал поддерживается на постоянном значении (т. Е. Фиксируется по напряжению), для каждого значения мембранного потенциала нелинейные уравнения стробирования сводятся к уравнениям вида:
- m (t) = m 0 — [ (m 0 — m ∞) (1 — e — t / τ m)] { displaystyle m (t) = m_ {0} — [(m_ {0} -m _ { infty}) (1-e ^ { -t / tau _ {m}})] ,}
- час (t) = час 0 — [(час 0 — час ∞) (1 — е — t / τ час)] { displaystyle h ( t) = h_ {0} — [(h_ {0} -h _ { infty}) (1-e ^ {- t / tau _ {h}})] ,}
- n (t) = n 0 — [(n 0 — n ∞) (1 — e — t / τ n)] { displaystyle n (t) = n_ {0} — [(n_ {0} -n _ { infty}) (1 -e ^ {- t / tau _ {n}})] ,}
Таким образом, для каждого значения мембранного потенциала V m { displaystyle V_ {m}}
- IN a (t) = g ¯ N am (V m) 3 h (V m) (V m — EN a), { displaystyle I _ { mathrm {Na}} (t) = { bar {g}} _ { mathrm {Na}} m (V_ {m}) ^ {3} h (V_ {m}) (V_ {m} -E _ { mathrm {Na} }),}
- IK (t) = g ¯ K n (V m) 4 (V m — EK). { displaystyle I _ { mathrm {K}} (t) = { bar {g}} _ { mathrm {K}} n (V_ {m}) ^ {4} (V_ {m} -E _ { mathrm {K}}).}
Чтобы прийти к полному решению для распространенного потенциала действия, нужно записать текущий член I в левой части первого дифференциального уравнения через V, так что уравнение становится уравнением только для напряжения. Связь между I и V может быть получена из теории кабеля и задается формулой
- I = a 2 R ∂ 2 V ∂ x 2, { displaystyle I = { frac {a} {2R }} { frac { partial ^ {2} V} { partial x ^ {2}}},}
где a — радиус аксона, R — удельное сопротивление аксоплазмы , а x — положение вдоль нервного волокна. Подстановка этого выражения на I преобразует исходный набор уравнений в набор дифференциальных уравнений в частных производных, поскольку напряжение становится функцией как x, так и t.
Алгоритм Левенберга – Марквардта часто используется для согласования этих уравнений с данными фиксации напряжения.
В то время как в исходных экспериментах рассматривались только натриевые и калиевые каналы, алгоритм Ходжкина– Модель Хаксли также может быть расширена для учета других видов ионных каналов.
каналов утечки
Каналы утечки учитывают естественную проницаемость мембраны для ионов и принимают форму уравнения для напряжения — стробированные каналы, где проводимость gleak { displaystyle g_ {leak}}

Насосы и теплообменники
Мембранный потенциал зависит от поддержания градиента ионной концентрации на нем. Поддержание этих градиентов концентрации требует активного транспорта ионных частиц. Из них наиболее известны обменники натрий-калий и натрий-кальций. Некоторые из основных свойств обменника Na / Ca уже хорошо известны: стехиометрия обмена составляет 3 Na: 1 Ca, а обменник является электрогенным и чувствительным к напряжению. Обменник Na / K также был подробно описан со стехиометрией 3 Na: 2 K.
Математические свойства
Модель Ходжкина – Хаксли можно рассматривать как дифференциал уравнение с четырьмя переменными состояния, v (t), m (t), n (t) и h (t), которые изменяются во времени t. Систему сложно изучать, потому что она является нелинейной системой и не может быть решена аналитически. Однако для анализа системы доступно множество числовых методов. Можно доказать, что существуют определенные свойства и общие закономерности, такие как предельные циклы.

Центральный коллектор
. Поскольку существует четыре переменных состояния, визуализация пути в фазовом пространстве может быть затруднена. Обычно выбираются две переменные, напряжение v (t) и переменная стробирования калия n (t), что позволяет визуализировать предельный цикл. Однако нужно быть осторожным, потому что это специальный метод визуализации четырехмерной системы. Это не доказывает существования предельного цикла.
Лучшая проекция может быть построена на основе тщательного анализа якобиана системы, оцененного в точке равновесия. В частности, собственные значения якобиана указывают на существование центрального многообразия. Аналогично, собственные векторы якобиана показывают ориентацию центрального многообразия. Модель Ходжкина – Хаксли имеет два отрицательных собственных значения и два комплексных собственных значения с немного положительными действительными частями. Собственные векторы, связанные с двумя отрицательными собственными значениями, уменьшатся до нуля с увеличением времени t. Оставшиеся два комплексных собственных вектора определяют центральное многообразие. Другими словами, 4-мерная система коллапсирует на 2-мерную плоскость. Любое решение, начинающееся с центрального коллектора, будет распадаться по направлению к центральному коллектору. Кроме того, предельный цикл содержится на центральном многообразии.

Бифуркации
Если введенный ток I { displaystyle I}
Улучшения и альтернативные модели
Модель Ходжкина – Хаксли считается одним из величайших достижений биофизики 20-го века. Тем не менее, современные модели типа Ходжкина-Хаксли были расширены несколькими важными способами:
- На основании экспериментальных данных были включены дополнительные популяции ионных каналов.
- Модель Ходжкина-Хаксли была модифицирована для включения теория переходного состояния и создать термодинамические модели Ходжкина – Хаксли.
- Модели часто включают очень сложные геометрические формы дендритов и аксонов, часто основывается на данных микроскопии.
- Стохастические модели поведения ионных каналов, ведущие к стохастическим гибридным системам.
- Модель Пуассона – Нернста – Планка (PNP) основана на на приближении среднего поля ионных взаимодействий и континуальных описаниях концентрации и электростатического потенциала.
Также было разработано несколько упрощенных нейронных моделей (например, модель ФитцХью – Нагумо ), способствуя эффективному крупномасштабному моделированию групп нейронов, а также математическому пониманию динамики генерации потенциала действия. эрация.
См. Также
- Потенциал действия
- Возбуждение разрыва анода
- Автоволна
- Модель биологического нейрона
- Биологическая нейронная сеть
- Модель ФитцХью-Нагумо
- Модель Гальвса-Лёчербаха
- Уравнение потока GHK
- Уравнение Гольдмана
- Мемристор
- Нейронная аккомодация
- Реакция – диффузия
- Тета-модель
- Карта Рулкова
Ссылки
Дополнительная литература
Внешние ссылки
- Интерактивное моделирование модели HH с помощью Javascript Работает в любом браузере с поддержкой HTML5. Позволяет изменять параметры модели и текущего впрыска.
- Интерактивный Java-апплет модели HH Параметры модели могут быть изменены, а также возможны параметры возбуждения и построение графиков в фазовом пространстве всех переменных.
- Прямая ссылка на модель Ходжкина-Хаксли и Описание в базе данных биомоделей
- Нейронные импульсы: потенциал действия в действии Гаррет Неске, Демонстрации Вольфрама Проект
- Интерактивная модель Ходжкина – Хаксли Шимона Марома, Демонстрационный проект Вольфрама
- ModelDB База данных исходного кода вычислительной нейробиологии, содержащая 4 версии (в разных симуляторах) оригинальной модели Ходжкина – Хаксли модель и сотни моделей, которые применяют модель Ходжкина – Хаксли к другим каналам во многих типах электрически возбудимых клеток.
- Несколько статей о стохастической версии модели и ее связи с исходной.





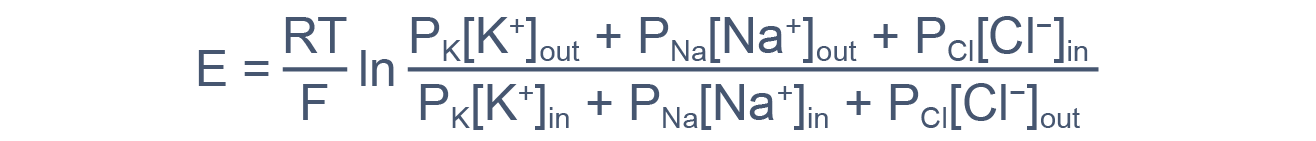
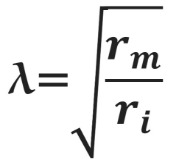











![m (t) = m_ {0} - [(m_ {0} -m _ { infty}) (1-e ^ {- t / tau _ {m}})] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/7628fde7c11cc9053f49af7569f0807ffa6bf09c)
![h (t) = h_ {0} - [(h_ {0} -h _ { infty}) (1-e ^ {- t / tau _ {h}})] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bba9ecee241689c0b7b5374c9567462a9b8931d)
![n (t) = n_ {0} - [(n_ {0} -n _ { infty}) (1-e ^ {- t / tau _ {n}})] ,](https://wikimedia.org/api/rest_v1/media/math/render/svg/46507359f94faf96b2f83d41dc74bbce09630fd1)


