В нейроне генерируется и по аксону посылается потенциал действия, который затем передается на синапс посредством выделения нейротрансмиттеров, вызывающих ответную реакцию в другом нейроне или эффекторной клетке (например, мышечные клетки, большинство экзокринных и эндокринных клеток). Нейротрансмиттеры позволяют нейронам общаться друг с другом. Высвобождающиеся нейротрансмиттеры связываются с рецепторами другого нейрона. Нейроны, которые выделяют нейротрансмиттеры, называются пресинаптическими нейронами. Нейроны, которые получают нейротрансмиттерные сигналы, называются постсинаптическими нейронами. В зависимости от типа нейротрансмиттера и рецептора, сигнал может или активировать, или тормозить воспринимающую клетку. Другие факторы, в том числе лекарства и расстройства, влияют на связь между нейронами, модулируя выработку и действие нейротрансмиттеров, в том числе
-
Их высвобождение, обратный захват и распад
-
Количество и функция постсинаптических нейромедиаторных рецепторов
Иногда сигналы между нейронами проходят в обратном направлении (так называемая ретроградная нейротрансмиссия). В таких случаях дендриты (приемные ветви нейрона) постсинаптических нейронов высвобождают нейротрансмиттеры, которые влияют на рецепторы пресинаптических нейронов. Ретроградная передача может препятствовать высвобождению дополнительных нейротрансмиттеров пресинаптическими нейронами и помочь контролировать уровень активности и связи между нейронами.
Межклеточные взаимодействия в центральной нервной системе (ЦНС) очень сложны. Импульс от одного нейрона к другому может проходить от
-
аксона к телу клетки
-
аксона к дендриту
-
тела клетки к телу клетки
-
дендрита к дендриту
Нейрон воспринимает одновременно огромное количество импульсов – как возбуждающих, так и тормозящих – от других нейронов, и эти сигналы объединяет в различные паттерны разрядов.
Проведение потенциала действия по аксону имеет электрическую природу и вызвано переходом ионов натрия и калия через мембрану аксона. Отдельный нейрон генерирует однотипные сигналы после каждого стимула, проводя их с фиксированной скоростью по аксону. Скорость проведения зависит от диаметра аксона и степени его миелинизации и составляет от 1–4 м/секунду для малых немиелинизированных волокон до 75 м/секунду в крупных миелинизированных. Распространение импульса происходит с намного большей скоростью в миелинизированных волокнах, поскольку по ходу миелиновой оболочки с равной частотой располагаются промежутки (перехваты Ранвье), где обнажается мембрана аксона. Электрический импульс «перепрыгивает» с одного перехвата к другому, пропуская миелинизированный участок аксона. Вследствие этого при заболеваниях, нарушающих миелиновую оболочку (например, рассеянный склероз Рассеянный склероз (РС) Рассеянный склероз (РС) характеризуется появлением в головном и спинном мозге диссеминированных очагов демиелинизации. Характерные симптомы включают зрительные и глазодвигательные нарушения… Прочитайте дополнительные сведения 
Передача импульса имеет химическую природу и вызывается высвобождением определенных нейромедиаторов из нервного окончания. Медиаторы диффундируют через синаптическую щель и на короткое время связываются со специфическими рецепторами на эффекторной клетке. В зависимости от рецептора результатом взаимодействия может быть как возбуждение, так и торможение. Обычно нейроны не касаются друг друга; вместо этого они общаются посредством трансмиссии нейромедиаторов через синапсы. При некоторых условиях нейроны рядом друг с другом могут общаться с помощью электрических импульсов через щелевое соединение.
В теле нейрона вырабатываются ферменты, синтезирующие большинство медиаторов, которые затем хранятся в везикулах нервного окончания (см. рисунок Нейротрансмиссия Нейротрансмиссия 
Один из подвидов синапсов, электрический синапс, не включает высвобождение нейромедиаторов; цитоплазмы пре- и постсинаптического нейронов непосредственно связывают ионные каналы. Эта разновидность соединения является наиболее быстрой.
Возбуждающие и тормозящие импульсы
Реакция, вызванная высвобождением нейротрансмиттера, может либо возбуждать или активировать постсинаптический нейрон, либо ингибировать или блокировать его активность. Постсинаптические нейроны получают множественные нейромедиаторные и электрические сигналы от многих нейронов. Принимающий нейрон в конечном итоге складывает входящие данные вместе, и, если поступает больше возбуждающих сигналов, нейрон «выстреливает» и посылает сигналы другим нейронам. Если сумма сигналов является ингибирующей, нейрон не «выстреливает» и не оказывает влияния на активность других нейронов. Это сочетание реакций называется суммированием. Нейротрансмиттеры, таким образом, способствуют быстрой связи между нейронами, изменяя возбуждение потенциала действия.
Другие формы суммирования включают
-
Пространственная суммация: когда нейрон получает несколько импульсов в разных местах, он затем их суммирует
-
Временное суммирование: когда импульсы получены в течение короткого периода времени, а затем суммируются
Чтобы нейрон генерировал сигнал и выстрелил, он должен достичь порогового потенциала. Пороговый потенциал создается за счет чистого увеличения притока натрия в клетку во время обмена ионов натрия и калия. Когда в клетку поступает достаточное количество натрия, достигается пороговая величина; при достижении пороговой величины срабатывает потенциал действия; он движется вдоль мембраны нейрона. Порог должен быть достигнут для создания потенциала действия.
Нейротрансмиссия
Потенциалы действия открывают аксональные кальциевые каналы (не показано). Ca++ активирует высвобождение нейромедиаторов (НМ) из везикул. НМ заполняют синаптическую щель. Некоторые из них связываются с постсинаптическими рецепторами, вызывая ответную реакцию. Остальные подвергаются обратному захвату в аксон, где накапливаются, или диффундируют в окружающие ткани.
Количество нейромедиаторов в нервном окончании не зависит от активности нейрона и сохраняется относительно постоянным благодаря непрерывной модификации процессов захвата предшественников нейромедиатора и активности ферментов, синтезирующих и разрушающих нейромедиатор. Стимуляция пресинаптических рецепторов может уменьшить пресинаптический синтез нейромедиатора, а их блокада может его увеличить.
Взаимодействие нейромедиатора с рецептором для окончания продолжающегося действия трансмиттера и/или с целью обеспечения быстрой повторной активации рецепторов должно быть достаточно коротким. После связывания нейротрансмиттеров с рецепторами возможен один из следующих вариантов:
-
С целью повторного использования или уничтожения нейромедиаторы быстро захватываются обратно в пресинаптическое нервное окончание активным АТФ-зависимым транспортом (обратный захват).
-
Они могут быть устранены ферментами вблизи рецепторов.
-
Нейротрансмиттеры диффундируют в окружающие ткани.
При обратном захвате нейромедиаторов нервными окончаниями происходит их накопление в гранулах или везикулах на концевых участках аксонов – для повторного высвобождения.
Нарушение этих процессов может привести к клиническому заболеванию. Например, считается, что потеря памяти при болезни Альцгеймера связана с недостаточностью нейротрансмиттера ацетилхолина в синапсах, что способствует закладыванию новых воспоминаний. Некоторые лекарства (например, донепезил, галантамин, ривастигмин) блокируют фермент ацетилхолинэстеразу (которая расщепляет ацетилхолин) и, таким образом, увеличивают количество ацетилхолина в синапсе. В результате может улучшиться функция памяти.
Некоторые типы отдельных нейронов могут выделять два или более различных нейротрансмиттеров (называемых котрансмиссией) — например, ацетилхолин и глутамат. Множество нейротрансмиттеров могут воздействовать на один постсинаптический нейрон или влиять на множество постсинаптических нейронов. Котрансмиссия позволяет осуществлять сложную связь между нейронами для контроля различных событий в ЦНС и периферической нервной системе (ПНС).
Нейротрансмиттеры могут также способствовать более длительным изменениям, которые включают дополнительные пути, например, изменения активности генов и белков.
Рецепторы к нейромедиаторам представляют собой белковые комплексы, расположенные на клеточной мембране. Именно от их природы зависит, будет ли влияние отдельно взятого нейромедиатора возбуждающим или тормозным. В случае если рецепторы постоянно стимулируются медиаторами или определенными препаратами, их чувствительность снижается; те рецепторы, которые не стимулируются нейромедиаторами или при их хронической медикаментозной блокаде, они становятся сверхчувствительными (открытые рецепторы). Указанные процессы сильно влияют на развитие толерантности и физической зависимости. Особую значимость эти принципы приобретают в случаях трансплантации органов или тканей, при которой денервация лишает рецепторы возможности связываться с нейромедиаторами; в результате трансплантированные органы могут стать чрезмерно чувствительными к нервной стимуляции. Синдром отмены частично можно объяснить феноменом «рикошета» из-за измененной аффинности или плотности рецепторов.
Большинство нейромедиаторов взаимодействуют с постсинаптическими рецепторами, однако некоторые рецепторы расположены на пресинаптических нейронах, обеспечивая точное регулирование высвобождения нейротрансмиттера.
Одна из групп рецепторов, называемая ионотропными рецепторами (например, рецепторы N-метил-D-глутамата, каината, ацетилхолина, глицина и гамма-аминомасляной кислоты [ГАМК]), состоит из ионных каналов, которые открываются при связывании с нейромедиатором, приводя к возникновению быстрого ответа. В другой группе метаботропные рецепторы (например, рецепторы к серотонину, альфа- и бета-адренорецепторы, допаминергические рецепторы), нейромедиаторы взаимодействуют с G-белком и активируют молекулу-посредник (вторичный «мессенджер», например, цАМФ), являющийся катализатором целого каскада реакций, реализующихся посредством фосфорилизации белков и/или мобилизации ионов кальция; изменения, происходящие в клетке под воздействием вторичных молекул-посредников, медленнее, чем в 1-ой группе рецепторов, однако они позволяют обеспечить более точную регуляцию быстрого ионотропного ответа. Большинство медиаторов активируют специфичные им рецепторы, меньшая часть – вторичные мессенджеры.
По крайней мере 100 молекул могут выступать в роли нейромедиаторов; из них 18 имеют первостепенное значение. Некоторые встречаются в различных формах. Нейротрансмиттеры могут быть сгруппированы в разные классы, такие как
-
Небольшие молекулы (например, глутамат, гамма-аминомасляная кислота, глицин, аденозин, ацетилхолин, серотонин, гистамин, норадреналин)
-
Нейропептиды (например, эндорфины)
-
Газообразные молекулы (например, оксид азота, оксид углерода)
-
Эндоканнабиноиды
Эти аминокислоты (глутамат и аспартат) являются основными возбуждающими нейромедиаторами в ЦНС. Их обнаруживают в коре головного мозга, мозжечке и спинном мозге. В ответ на воздействие глутамата в нейронах повышается синтез оксида азота (NO). Избыточная концентрация глутамата может оказывать токсическое действие, повышая уровень внутриклеточного кальция, свободных радикалов и активность протеиназ. Эти нейромедиаторы участвуют в развитии толерантности к опиоидам и опосредуют развитие гипералгезии.
Глутаматные рецепторы (стимулируемые глутаматом и менее сильно аспартатом) классифицируются как NMDA (N-метил-d-аспартат) и не-NMDA рецепторы. Фенциклидин (ФЦД, также известный под названием «ангельская пыль» [в РФ не зарегистрирован]) и мемантин (применяемый в лечении болезни Альцгеймера) связываются с рецепторами NMDA.
Гамма-аминобутировая кислота (ГАМК) – основной тормозной нейромедиатор в мозге. Это аминокислота, синтезируемая из глутаминовой кислоты посредством декарбоксилирования глутаматдекарбоксилазой. После взаимодействия с рецепторами ГАМК активно захватывается обратно в нервные окончания и метаболизируется. Глицин, который по действию напоминает ГАМК, встречается преимущественно во вставочных нейронах (клетки Реншоу) спинного мозга и в нейронных цепях, расслабляющих мышцы-антагонисты.
Разделяют GABA-A (активирующие хлорные каналы) и GABA-B (активирующие образование цАМФ) рецепторы. GABA-A-рецепторы являются точкой приложения для нескольких нейроактивных препаратов, включая бензодиазепины, барбитураты, пикротоксин и мусцимол. Алкоголь также связывается с рецепторами ГАМК-А (GABA-A). GABA-B-рецепторы активируются баклофеном, используемым при лечении мышечного спазма.
Серотонин (5-гидрокситриптамин, или 5-НТ) синтезируется в ядре шва и нейронах средней линии моста и верхней части ствола мозга. Триптофан гидроксилируется гидроксилазой триптофана до 5-гидрокситриптофана, затем декарбоксилируется с образованием серотонина. Уровень серотонина регулируется интенсивностью захвата триптофана и внутриклеточной концентрацией фермента моноаминооксидазы (МАО), которая разрушает серотонин. В конечном итоге серотонин выводится с мочой в виде 5-гидроксииндоацетиловой кислоты, или 5-ГИАК.
Серотонинергические (5-НТ) рецепторы, которых на сегодня насчитывается по крайней мере 15 подтипов, подразделяют на 5-HT1 (4 подтипа), 5-HT2 и 5-HT3. Селективные агонисты серотониновых рецепторов (например, суматриптан) могут купировать приступы мигрени. Селективные ингибиторы обратного захвата серотонина (СИОЗС) также использоваться для лечения нескольких психических расстройств (например, депрессии, тревоги, обсессивно-компульсивного расстройства, посттравматического стрессового расстройства).
Ацетилхолин – основной нейромедиатор мотонейронов ствола головного мозга и спинного мозга, вегетативных преганглионарных волокон, постганглионарных холинергических (парасимпатических) волокон и многих нейронов в ЦНС (например, в базальных ганглиях, двигательных отделах коры головного мозга). Ацетилхолин синтезируется из холина и ацетил-коэнзима А с участием фермента ацетилхолинтрансферазы, его действие непродолжительно из-за локального гидролиза ацетилхолинэстеразой до холина и ацетогруппы. Уровень ацетилхолина регулируется активностью фермента ацетилхолинтрансферазы и количеством захватываемого холина. При болезни Альцгеймера уровень ацетилхолина снижается.
Холинергические рецепторы подразделяются на никотиновые N1 (мозговое вещество надпочечников и ганглии вегетативной нервной системы) или N2 (скелетная мускулатура) и мускариновые M1 – M5 (широко представлены в ЦНС). M1 экспрессируются в вегетативной нервной системе, полосатом теле, коре и гиппокампе; M2 – в вегетативной нервной системе, сердце, гладких мышцах кишечной стенки, заднем мозге (ствол и варолиев мост) и мозжечке.
Дофамин взаимодействует с рецепторами ряда периферических нервных волокон, но преимущественно – с центральными нейронами (в частности, нейронами черной субстанции, среднего мозга, передней части покрышки и гипоталамуса). Аминокислота тирозин захватывается дофаминергическими нейронами и преобразуется тирозингидроксилазой в 3,4-дигидроксифенилаланин (ДОФА), который декарбоксилируется декарбоксилазой ароматических l-аминокислот с образованием дофамина. После высвобождения и взаимодействия с рецепторами оставшийся дофамин подвергается активному обратному захвату в нервное окончание. Уровень дофамина в нервных окончаниях регулируется МАО (разрушающей дофамин) и тирозингидроксилазой.
Дофаминергические рецепторы подразделяются на D1 – D5. D3 и D4 задействованы в процессы контроля мышления (уменьшая выраженность негативных симптомов шизофрении); D2-рецепторы регулируют функции экстрапирамидной системы. Однако сродство к определенному типу рецепторов не позволяет предсказать функциональный ответ (внутреннюю активность). Например, у ропинирола, имеющего высокое сродство к D3-рецепторам, внутренняя активность проявляется активацией D2-рецепторов.
Норадреналин – нейромедиатор большинства постганглионарных симпатических волокон и многих центральных нейронов (например, в голубоватом пятне ретикулярной формации ствола и гипоталамусе). Его предшественник, тирозин, преобразуется в дофамин, который гидроксилируется дофамин-бета-гидроксилазой с образованием норадреналина. После высвобождения и взаимодействия с рецепторами часть норадреналина разлагается катехол-O-метилтрансферазой (КОМТ), а остаток подвергается активному обратному захвату в нервное окончание, где он разлагается под действием МАО. Внутринейронный уровень норадреналина регулируют ферменты тирозингидроксилазы, дофамин-бета-гидроксилазы и моноаминоксидазы (МАО).
Адренергические рецепторы подразделяют на альфа-1 (постсинаптические в симпатической нервной системе), альфа-2 (пресинаптические в симпатической нервной системе и постсинаптические в головном мозге), бета-1 (в сердце) или бета-2 (в других структурах, иннервируемых симпатической нервной системой).
Эта группа соединений представляет собой опиоиды.
Эндорфины – полипептиды, которые активизируют многие центральные нейроны (например, в гипоталамусе, оливах, таламусе и голубоватом пятне). Тело клетки содержит крупномолекулярный полипептид, называемый проопиомеланокортин, предшественник альфа-, бета- и гамма-эндорфинов. Проопиомеланокортин транспортируется по аксону и расщепляется на фрагменты; один из них – это бета-эндорфин, содержащийся в нейронах, расположенных в околоводопроводном сером веществе, структурах лимбической системы и крупных катехоламинсодержащих нейронах головного мозга. После высвобождения и взаимодействия с рецепторами бета-эндорфин подвергается гидролизу пептидазами.
Энкефалины включают в себя мет-энкефалин и лей-энкефалин – это низкомолекулярные пептиды, присутствующие во многих центральных нейронах (например, в сером веществе бледного шара, таламуса, хвостатого и центрального ядер). Их предшественник проэнкефалин образуется в теле клетки, затем расщепляется специфическими пептидазами до активных пептидов. Эти вещества также определяются в спинном мозге, где они действуют как нейромедиаторы сигналов боли. Нейромедиаторы сигналов боли в заднем роге спинного мозга – глутамат и субстанция Р. Энкефалины уменьшают количество высвобождаемого нейромедиатора и гиперполяризуют (придают больший отрицательный заряд) постсинаптическую мембрану, снижая образование потенциалов действия и восприятие боли на уровне постцентральной извилины. После высвобождения и взаимодействия с пептидергическими рецепторами энкефалины гидролизируются в меньшие, неактивные пептиды и аминокислоты. По причине быстрой инактивации экзогенных энкефалинов в организме их клиническое использование невозможно. В качестве анальгетиков применяют более устойчивые молекулы (например, морфин).
Рецепторы энкефалинов-эндорфинов (опиоидные) классифицируют на мю-1 и мю-2 (влияющие на сенсорно-двигательную интеграцию и анальгезию), дельта-1 и дельта-2 (влияющие на двигательную интеграцию, познавательные функции и анальгезию) и каппа-1, каппа-2 и каппа-3 (влияющие на регуляцию водного баланса, анальгезию и потребление пищи). Сигма-рецепторы, в настоящее время классифицируемые как неопиоидные, расположены преимущественно в гиппокампе и связываются с фенилциклидином. Новые данные предполагают наличие еще многих фармакологически значимых подтипов рецепторов. Компоненты молекулы предшественника белка-рецептора могут быть перестроены в ходе синтеза рецептора с образованием нескольких вариантов рецептора (например, 27 вариантов соединения мю-опиоидного рецептора). Кроме того, 2 рецептора могут объединиться (димеризация) с образованием нового рецептора.
Динорфины – группа из 7 пептидов со сходными аминокислотными последовательностями. Наряду с энкефалинами они относятся к опиоидам.
Субстанция Р – пептид, обнаруживаемый в центральных нейронах (ножке шишковидной железы – эпифиза, черной субстанции, базальных ганглиях, продолговатом мозге и гипоталамусе) и в высоких концентрациях – в ганглиях задних корешков. Интенсивные афферентные болевые стимулы индуцируют высвобождение субстанции Р. Последняя модулирует нейрональный ответ на боль и настроение; посредством активации NK1A-рецепторов, расположенных в стволе головного мозга, она регулирует такие эффекты, как тошнота и рвота.
Оксид азота (NО) – неустойчивое газообразное соединение, которое опосредует многие нейрональные процессы. Он образуется из аргинина при участии NO синтетазы. Нейромедиаторы, вызывающие повышение внутриклеточного содержания кальция (например, субстанция Р, глутамат, ацетилхолин), стимулируют синтез NО в нейронах, экспрессирующих NO-синтетазу. NО может выполнять функцию внутриклеточного мессенджера; он может диффундировать из клетки во второй нейрон и вызывать в нем физиологические реакции (например, долговременную потенциацию – усиление определенных пре- и постсинаптических ответов как один из механизмов обучения) или увеличивать глутаматную (NMDA) рецептор-опосредованную нейротоксичность (например, при болезни Паркинсона, инсульте или болезни Альцгеймера). NO влияет на другие нейромедиаторы (например, ГАМК и ацетилхолин), изменяя приток кальция в клетки для увеличения высвобождения других нейромедиаторов.
Дополнительные газообразные нейромедиаторы включают монооксид углерода (CO) и сероводород (H2S). Эти медиаторы вырабатываются в клетках по всему телу (включая головной мозг). Эндогенный CO образуется в результате метаболизма гема и может участвовать в процессах, связанных с развитием лихорадки, воспалением, выживанием клеток и контролем расширения кровеносных сосудов. Некоторые ферменты участвуют в продукции H2S, который, как полагают, необходим для формирования и сохранения воспоминаний.
Остается не до конца изученной роль еще многих потенциальных нейромедиаторов, в том числе гистамина, вазопрессина, вазоактивного кишечного пептида, карнозина, брадикинина, холецистокинина, бомбезина, соматостатина, рилизинг-фактора адренокортикотропного гормона, нейротензина и, возможно, аденозина.
Эндоканнабиноиды — это эндогенные нейромедиаторы на основе липидов, регулирующие работу мозга, эндокринной и иммунной систем.
В результате заболеваний либо воздействия веществ, способных нарушать синтез, высвобождение, взаимодействие с рецептором, распад или обратный захват нейромедиаторов, вызывать изменения количества и аффинности рецепторов развиваются неврологические или психические симптомы и заболевания (см. таблицу Примеры заболеваний, связанных с нарушениями нейротрансмиссии Примеры заболеваний, связанных с нарушениями нейротрансмиссии ). Препараты, вмешивающиеся в процесс нейротрансмиссии, могут облегчить течение многих из этих заболеваний (например, болезнь Паркинсона, депрессии).
Как неврологи понимают эмоции
Прежде чем мы начнем говорить о том, как и какие вещества управляют нашими эмоциями, обозначим оптику, через которую мы будем их рассматривать. Наиболее полным кажется когнитивно-поведенческий подход. Именно его называют золотым стандартом современной психотерапии [1].
Когнитивно-поведенческий подход, работающий с неосознанными установками и поведенческими реакциями, выделяет 3 уровня:
-
Реактивный. Это уровень базовых, или витальных, эмоций, которые в том или ином виде существуют у всех позвоночных. У ребенка они проявляются уже в первые дни жизни. Они направляют нас к полезным стимулам вроде еды и помогают избежать тех, что причиняют вред. Реактивный уровень обеспечивается глубинными структурами мозга, которые у детей еще не контролируются корой. Ребенок отчаянно плачет, когда мама выходит из комнаты, и не успокаивается, пока его не возьмут на руки.
-
Повседневный. Этот уровень нужен для социальных взаимодействий. К примеру, нам приятнее иметь дело с человеком, проявляющим эмпатию и интерес. Это значит, что даже деловая коммуникация, основанная на понимании эмоционального состояния другого и искреннем интересе, будет гораздо более эффективной. Такие эмоции не требуют обдумывания: мы испытываем их, понимаем, что они значат, но делаем это инстинктивно.
-
Рефлексивный. Связан с мышлением. Такое есть только у человека, и этим мы обязаны префронтальной коре и лобным долям мозга — центрам, благодаря которым мы можем оценивать свое поведение и управлять им. Рефлексивный уровень связан с безопасностью, но, в отличие от реактивных эмоций, это — осознанное ощущение наличия или отсутствия опасности. У детей рефлексивные эмоции появляются только около 3–4 лет. Поэтому маленькому ребенку не объяснишь, что человек в белом халате всего лишь посмотрит, красное ли у него горло. Ребенок помнит, что однажды кто-то в белом халате сделал ему укол, а значит, снова будет больно. С другой стороны, даже те взрослые, кто чувствуют себя некомфортно в темноте, все-таки понимают, что их страх иррационален и у себя в спальне бояться совершенно нечего.
Какие структуры мозга отвечают за эмоции и реакции
Поговорим о том, где и как рождаются наши эмоции и реакции. Для этого заглянем в глубь человеческого мозга [2].
- Таламус. Является координирующей структурой. Его функция в том, чтобы переводить воспринятое извне — грохот, прикосновение, вспышку света — в нервный импульс.
- Миндалевидное тело, или амигдала. Если угодно, это наша тревожная кнопка. У детей до 3–4 лет амигдала функционирует независимо от коры. Генетическая предрасположенность к тревожности как раз обусловлена работой миндалевидного тела. Оно также отвечает за выражение эмоций, память и обучение.
- Гиппокамп. Это наша книга памяти, пишущаяся на основе полученного опыта. Эта структура хранит информацию, извлекает ее и помогает разобраться, как вести себя в аналогичных обстоятельствах в следующий раз. Каждый знает, что замешательство — первичная реакция на всё новое. Это как раз обусловлено тем, что гиппокамп просто не может отыскать ту или иную ситуацию в предыдущих записях.
- Префронтальная кора лобных долей. Необходима для сознательной оценки происходящего. Как мы уже отметили, префронтальная кора не работает полноценно у детей до 3–4 лет.
- Гипоталамус. Отвечает за такие вегетативные проявления, как сердцебиение, потоотделение и другие. Покраснели, услышав неудобный вопрос? Всё просто: сработал гипоталамус.

Рассмотрим теперь, как эти структуры работают при появлении приятного или, напротив, нежелательного раздражителя. Схема зависит от силы стимула. Если он резок и силен, импульс передается немедленно по пути таламус — амигдала — гипоталамус. Если же стимул недостаточно силен и не воспринимается как опасный сию же секунду, мы наблюдаем другую маршрутизацию: таламус — префронтальная кора — гиппокамп — гипоталамус. Здесь за счет включения таких компонентов, как сознательная оценка и сличение ситуации с предыдущим опытом, реагирование носит отложенный характер. То есть мы не действуем немедленно, но анализируем разные модели поведения, выбирая наиболее адекватную.
Что такое нейромедиаторы
Нейромедиаторы мозга как раз те вещества, что обеспечивают работу описанных механизмов. Без них нервные импульсы не могли бы передаваться четко, не формировались бы нервные пути.
Рассмотрим механизм нейромедиаторов. В нервной ткани есть множество синапсов — мельчайших образований, соединяющих нейроны. Внутри клетки нейромедиаторы компактно упакованы в специальные синаптические пузырьки. При возбуждении пузырьки лопаются и, высвобождаясь за пределы клетки, эти вещества попадают в синаптическую щель — контактное межклеточное пространство. Оттуда их молекулы попадают на рецепторы следующего нейрона в цепи. Так импульс распространяется по волокну, формируя нервный путь.
Этот способ генерации нервных импульсов называют химическим. Когда-то давно существовала теория, что они передаются и распространяются только с помощью электрических синапсов, то есть без участия специальных веществ. По мере развития нейронауки стало очевидно, что электрическая передача не самая эффективная. Во-первых, она крайне неточная, так как возбуждение распространяется неизбирательно, на все нейроны вокруг. С другой стороны, разряд, проходя по нервному волокну, затухает. Действие нейромедиаторов, напротив, точное и идет без потерь [3].
Классификация нейромедиаторов
Традиционно выделяют три группы нейромедиаторов:
- тормозные
- возбуждающие
- модулирующие
Как несложно догадаться, в первую входят вещества, которые угнетают активность соседних нейронов. Роль нейромедиаторов возбуждающего типа, напротив, состоит в активизации нервных клеток. Что касается третьей группы, то они изменяют восприимчивость нейронов к тормозным или возбуждающим влияниям.
С точки зрения химической структуры, можно говорить о самых разных видах нейромедиаторов, например:
- Аминокислоты (глутамат и ГАМК)
- Пептиды (окситоцин и эндорфины)
- Моноамины (серотонин, адреналин, норадреналин, дофамин, гистамин и др.)
Функции нейромедиаторов
Кажется логичным разделить эти вещества на 2 большие группы: способствующие и препятствующие хранению и извлечению информации.
Нейромедиаторы, способствующие хранению и извлечению информации
Благодаря им мы реагируем на стимул — пугаемся, злимся, радуемся. Эти реакции возникают на основе опыта, и память играет здесь ключевое значение.
Глутамат
Больше всего в мозге именно его: он необходим для каждого нового процесса. Так, благодаря выделению глутамата мозг запоминает, что звук хрустнувшего кресла связан с падением. В следующий раз, услышав этот звук, мы рефлекторно сделаем попытку привстать. Чем ярче событие, тем больше его выделяется.
В этом свете не кажется таким удивительным, что некоторые люди наступают на одни и те же грабли, выбирают одни и те же модели поведения, похожих партнеров и так далее. В таких случаях коррекция поведения требует большой работы и часто нужна помощь психотерапевта. Цель психотерапии здесь — сломать старые глутаматные цепочки и сформировать новые.
Норадреналин
Блокирует кору в момент стресса. Его задача — сообщить нам: «Не думай — спасайся!». Предположим, за вами погналась собака. Вряд ли вы будете задумываться о том, кто бегает быстрее — вы или собака. Скорее, вы просто побежите вперед.
Этот моноамин также обеспечивает точность нахождения информации и подавляет страх. Вероятно, вы слышали рассказы, как под воздействием сильного стресса, например при внезапном пожаре или спасаясь от преследования, люди выпрыгивали из окон, ничего себе не сломав. Конечно, нейромедиаторы организма тут ни при чем: этим людям повезло и высота, скорее всего, была низкой. Однако норадреналин, возможно, помог им сориентироваться и правильно оценить, из какого окна лучше выпрыгнуть и куда и как приземлиться.
Кортизол
Усиливает действие норадреналина и повышает возбудимость миндалины, адаптируя организм к режиму сверхтревоги. Если вы когда-нибудь слышали выражение «море по колено», знайте: это про кортизол. В таком состоянии мы готовы сразиться с противником гораздо сильнее нас. Библейский богатырь Самсон, по легенде, разорвал пасть льву. Вероятно, успеху этой схватки легендарный Самсон был обязан этому моноамину.

Кортизол интересен тем, что способен искажать работу гиппокампа, нашей книги памяти, в том числе преуменьшая значимость события в прошлом. На этом свойстве основан его обратный эффект: когда его уровень высок, извлечение информации затруднено.
Дофамин
Это наша основа внимательности и восприимчивости к окружающей среде. Говорят, у страха глаза велики — это как раз результат работы дофаминовой системы. Представьте себе, что идете ночью через темный лес или кладбище и слышите за спиной шаги. Типичная норадреналиновая реакция в этой ситуации — бежать, в то время как дофаминовая — замереть и прислушаться.
Он также обеспечивает мотивацию и контроль деятельности на пути к цели. Допустим, вы мечтаете о красивом мышечном рельефе, ведь впереди пляжный сезон. Сейчас вечер, и вы счастливы, что сделали столько-то подходов в зале. При этом завтра вы готовы установить новый рекорд — и всё ради одной цели. Если так, вас стоит поздравить: от недостатка дофамина вы не страдаете, а вашей мотивации можно позавидовать.
Нейромедиаторы, препятствующие хранению и извлечению информации
Эти вещества дают то, что можно определить как счастье в моменте. Счастливые часов, как известно, не наблюдают, и всё благодаря им.
Серотонин
Моноамин, снижающий потребность в информации. Здесь можно вспомнить ту легкую усталость после какого-нибудь приятного занятия, например секса. Разве в этом состоянии хочется скролить новостную ленту?
Это же действие очень наглядно как побочный эффект при терапии тревожных расстройств и депрессий с помощью СИОЗС (селективных ингибиторов обратного захвата серотонина). Как мы уже сказали, если серотонин повышается, пациенту хорошо здесь и сейчас. Правда, иногда в таком состоянии уходит не только тревога, но и мотивация: не чувствуется никакой необходимости выходить за пределы того, что называют зоной комфорта. Вспоминается случай, когда СИОЗС принесли облегчение тревожному пациенту, который тогда усиленно готовился к экзаменам. Но возникла другая проблема: пациент забросил подготовку и не мог заставить себя заниматься. Разумеется, препарат пришлось сменить. Такое иногда встречается, но этого не стоит бояться: подобрать другой СИОЗС вполне реально.
Еще серотонин опосредует то, что называют объективным взглядом со стороны. Предположим, начальник был с нами резок. Конечно, мы расстроимся, но мы также можем посмотреть на случившееся иначе. «Ах, да, — вспоминается нам, — он же недавно развелся с женой». Как ни в чем не бывало мы продолжаем работать дальше и уже почти не злимся на начальника.
Эндорфины
Как и серотонин, снижают бдительность. А еще блокируют передачу болевых импульсов и вызывают эйфорию. Здесь можно упомянуть любопытное состояние, знакомое, например, участникам спортивных марафонов. Эффект состоит в том, что в определенный момент спортсмен перестает чувствовать усталость и боль и испытывает нечто сродни легкому опьянению. Это состояние, известное также как эйфория бегуна, развивается вследствие выброса эндорфинов.
Гамма-аминомасляная кислота
Это вещество — главный тормозной нейромедиатор в центральной нервной системе. Ее основная функция — предотвратить перевозбуждение. Препараты вроде Феназепама, иногда применяемые в терапии тревоги, воздействуют как раз на систему ГАМК, вызывая ощущение спокойствия и безопасности.
Как нейромедиаторы связаны с заболеваниями
Низкий уровень серотонина ассоциируется с подавленным настроением. Такие пациенты часто испытывают сложности с засыпанием, а, проснувшись, не ощущают бодрости. Им трудно радоваться привычным вещам, они сосредоточены на проблемах и пытаются найти пути их решения. От них окружающие часто слышат что-то вроде «У меня никогда ничего не получается» или «Только у меня всё плохо».
Нехватка серотонина лежит в основе тревожных расстройств. При его недостатке и дисбалансе других нейроаминов у пациентов развивается депрессия — механизм, известный в науке как моноаминовая теория депрессии [4].

Снижение норадреналина приводит к возникновению хронического болевого синдрома, когда боль мучит на протяжении месяцев. Это связано с тем, что при столь длительном сохранении боли норадреналин истощается, и тогда даже незначительный раздражитель вызывает полноценный болевой синдром.
Низкий норадреналин дает в перспективе снижение серотонина и, возможно, ассоциированные с этим депрессии.
Излишек дофамина провоцирует возбуждение. Известно, что с этим связаны шизофрения, бредовые расстройства, а также биполярное расстройство в стадии мании, когда на смену депрессивному эпизоду приходит период двигательного и психического возбуждения. В этом состоянии пациент видит или слышит то, чего нет. Ему вдруг начинает казаться, что он находится под воздействием человека, который, возможно, даже не знает о его существовании.
Он также влияет на качество движения, обеспечивая координацию и плавность, и опосредует двигательные автоматизмы вроде тех, что позволяют нам не задумываясь переставлять ноги при ходьбе или завязывать шнурки. Снижение дофамина дает болезнь Паркинсона. У таких больных заметно дрожание конечностей, высокий мышечный тонус и замедленные движения. Избыток, напротив, проявляется в навязчивых бесконтрольных движениях.
Еще дофаминовая система отвечает за формирование зависимостей. Психоактивные вещества изменяют физиологию мотивации, обеспечивая положительное подкрепление в виде эйфории, которая наступает после употребления. Любопытно, что дофаминовая основа есть и в других зависимостях, например цифровой. Доказано, что последняя связана с ростом дофаминовых рецепторов на фоне высокого норадреналина и низкого серотонина.
Говоря о зависимостях, нельзя не упомянуть гамма-аминомасляную кислоту. Алкоголь воздействует на систему ГАМК, что дает ощущение некоторого спокойствия. Это именно тот эффект, который имеют в виду те, кто говорят, что алкоголь помогает им снять стресс. Проблема в том, что ГАМК-рецепторы «устают» при избыточной стимуляции. Так возникает потребность в увеличении дозы и развивается алкоголизм.
Выводы
-
Когнитивно-поведенческая терапия выделяет 3 уровня эмоций: реактивный (биологический), повседневный (социальный) и рефлексивный (осознанный). В них задействованы разные отделы мозга: от более простых с эволюционной точки зрения до более сложных.
-
К ключевым структурам, обеспечивающим эмоции и реакции, относят таламус, миндалевидное тело, гиппокамп, префронтальную кору и гипоталамус. Важным является тот факт, что эмоции опосредованы памятью и прошлым опытом, но могут также формироваться без участия коры.
-
Функционирование указанных выше структур и уровней как единого целого возможно благодаря системам нейромедиаторов — биологически активных веществ, точно и эффективно передающих нервные импульсы.
-
Нейромедиаторы классифицируют по разным основаниям. Например, по действию (тормозные, возбуждающие и модулирующие) и по химическому составу (аминокислоты, пептиды, моноамины и др.).
-
Говоря об участии основных нейромедиаторов в управлении эмоциями и реакциями, удобно делить их на 2 группы: те, что способствуют хранению и извлечению информации, и те, что этому препятствуют.
-
Низкий серотонин провоцирует тревожные расстройства и депрессии. Недостаток норадреналина тоже может приводить к депрессиям. Он же участвует в формировании хронического болевого синдрома. Заболевания, ассоциированные с дофамином, возникают как на фоне его снижения (болезнь Паркинсона), так и при его повышении (бредовые расстройства, шизофрения, биполярное расстройство в фазе мании). Кроме того, дофаминовая система участвует в формировании зависимостей, а алкогольная зависимость также связана с системой ГАМК.
Клиника Наше Время — место, где вам помогут. Записывайтесь на прием, чтобы получить консультацию невролога и подобрать лечение.
Источники
David D., Cristea I., Hofmann S. G. Why cognitive behavioral therapy is the current gold standard of psychotherapy // Front Psychiatry. — 2018; 9:4.
Дуус П. Топический диагноз в неврологии. Анатомия. Физиология. Клиника // ИПЦ «Вазар Ферро». — Москва, 1996; 199–248.
Purves D., Augustine G.J., Fitzpatrick D., et al., editors. What defines a neurotransmitter? // Neuroscience. 2nd edition. Sunderland (MA): Sinauer Associates. — 2001.
Deakin J. The role of serotonin in depression and anxiety // European Psychiatry. — 1998; 13(2):57–63.
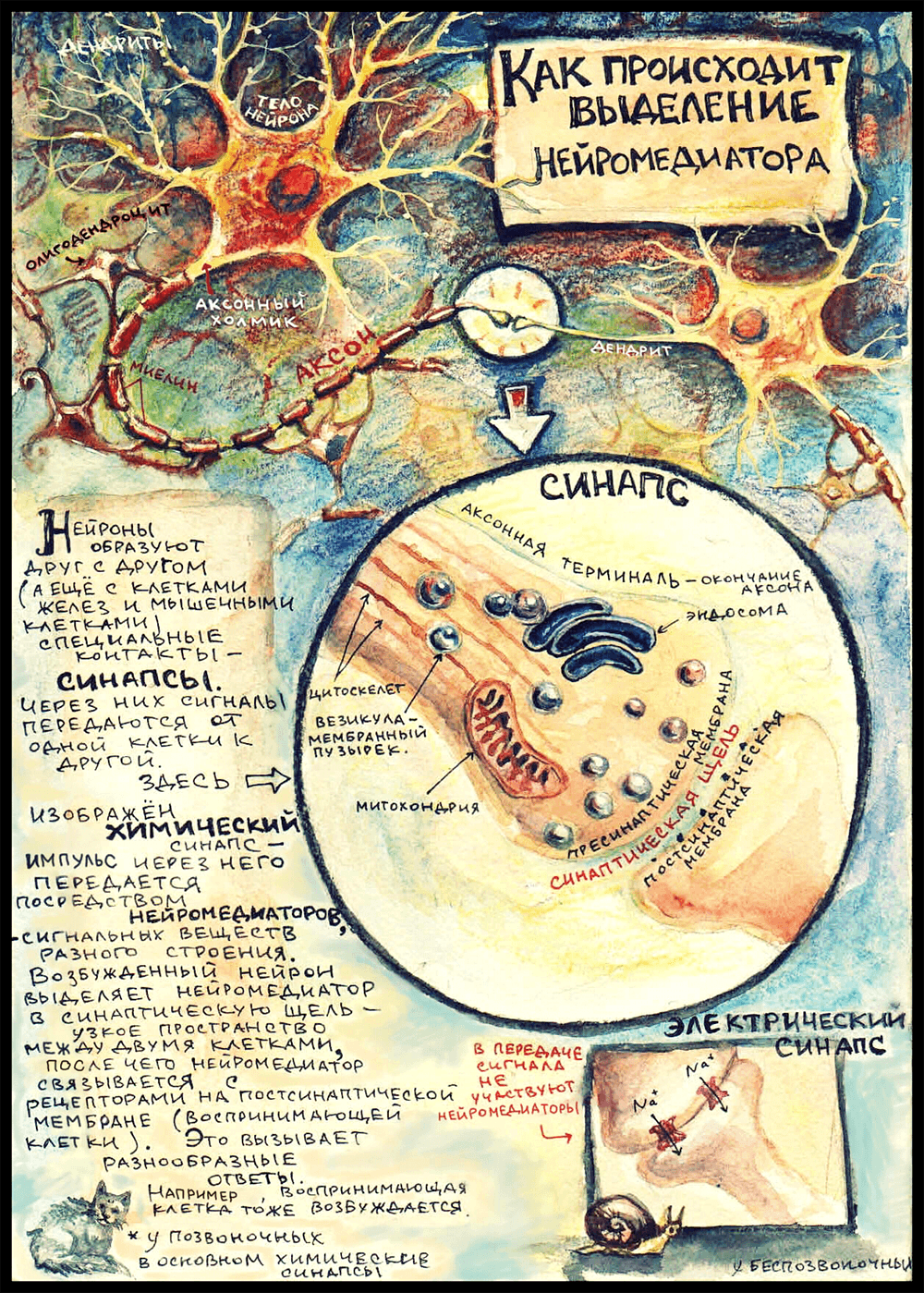
Комикс на конкурс «био/мол/текст»: Что происходит с момента синтеза нейромедиатора до связывания его с рецепторами на постсинаптической мембране? Комикс по мотивам Нобелевской лекции Томаса Зюдофа: молекулярный механизм выделения нейромедиатора в картинках. Конечно, это лишь малый фрагмент полной картины распространения импульсов в нервной системе, но зато посмотрите, как он красив!
Синапсы — области контакта между нейронами — бывают химическими и электрическими. Химический синапс представляет собой непрямой контакт двух клеток: между их мембранами остается узкое пространство — синаптическая щель. Эффекторная клетка (та, от которой идет импульс), возбуждаясь, выделяет в синаптическую щель молекулы нейромедиатора , которые связываются с рецепторами на мембране воспринимающей клетки и вызывают ее ответ.
Любознательный читатель приглашается к ознакомлению с эпической сагой о нейромедиаторах, написанной для «биомолекулы» Виктором Лебедевым. В сериал входят: дофамин, серотонин, норадреналин, ацетилхолин, γ-аминомасляная кислота и глутаминовая кислота [1–6]. Не счесть алмазов пламенных в лабазах каменных. — Ред.
На картинке изображен самый распространенный вид синапса — аксо-дендритический. (А бывают еще аксо-соматические синапсы, когда аксон подходит к телу воспринимающей клетки, аксо-аксональные, и даже дендро-дендритические — их образуют таинственные безаксонные нейроны где-то в глубине обонятельной луковицы, но это совсем редкий и маргинальный случай.) Еще на картинке виднеются олигодендроциты — глиальные клетки, которые в центральной нервной системе обматывают аксоны слоями миелина — изолирующей липидной мембраны, что препятствует рассеиванию импульса и ускоряет его проведение. (Олигодендроциты подрисованы просто для приличия; предполагается, что вся рассказанная ниже история происходит где-то в мозге: выбранный мной нейромедиатор выделяется в центральной нервной системе.) Начало аксона — место, где он отходит от тела клетки — называется «аксонный холмик». Именно там возникает потенциал действия, который потом распространяется дальше по аксону в сторону воспринимающей клетки.
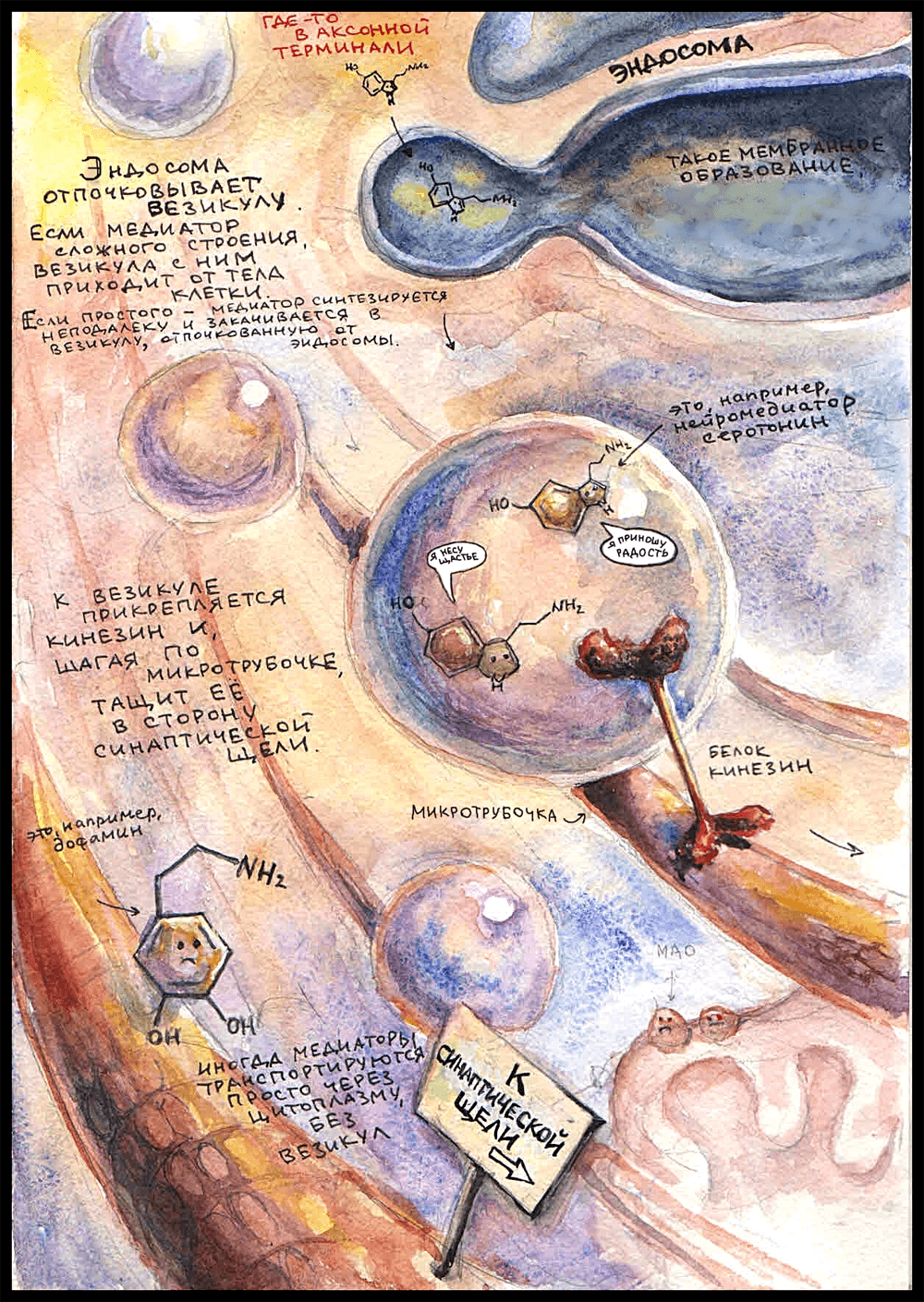
Аксон ближе к концу может разделяться на несколько веточек, идущих к разным клеткам. Каждая такая веточка оканчивается аксонной терминалью — зарубежные ученые ласково называют эту структуру «пуговкой» (button) или «бутончиком» (bouton). В аксонной терминали есть митохондрии, чтобы обеспечивать энергией многочисленные происходящие здесь процессы; почти всегда обнаруживается довольно много везикул — мембранных пузырьков, в которых транспортируются медиаторы и разные другие вещества — например, ферменты. Так же там есть довольно правильным образом организованный цитоскелет: микротрубочки цитоскелета образуют «рельсы», которые протягиваются в цитоплазме аксона от тела нейрона до самого окончания. Везикулы перемещаются по этим самым «рельсам». Еще в аксонной терминали есть эндосома — мембранная структура, похожая на аппарат Гольджи [7]. Надо сказать, что научное сообщество не пришло к единому мнению, постоянное это образование или временное, которое получается в результате слияния пузырьков; но, так или иначе, от эндосомы могут отпочковываться везикулы, которые используются для транспорта нейромедиаторов.
В электрических синапсах не задействованы нейромедиаторы, а синаптическая щель очень узкая. Цитоплазма двух клеток связана напрямую через специальные белковые каналы — коннексоны. Сигнал в таком синапсе передается путем перехода ионов из одной клетки в другую. Такие синапсы почти не встречаются в нашей нервной системе; они характерны главным образом для беспозвоночных.
Дальше речь пойдет о событиях, происходящих в химическом синапсе, а именно о том, как выделяется медиатор в синаптическую щель.
Маленькие и просто устроенные нейромедиаторы — например, ацетилхолин [4] — образуются из молекул-предшественников прямо в цитоплазме аксонной терминали. Там же они упаковываются в везикулы — мембранные пузырьки, которые могут отделяться от эндосомы или приходить от синаптической щели после высвобождения своего прошлого содержимого.
Медиаторы сложного строения — такие как пептиды — синтезируются в теле нейрона и, уже будучи упакованными в везикулы, транспортируются оттуда до аксонной терминали по микротрубочкам. Здесь в качестве медиатора, вместе с которым читателю предлагается пройти путь до синаптической щели, выбран серотонин [2]. Правда, хороший? Он — маленькая молекула, а значит, синтезируется в цитоплазме недалеко от окончания. Вот он попадает в везикулу, отпочкованную от эндосомы, и к мембране везикулы прикрепляется транспортный белок кинезин, который начинает тащить пузырек за собой, «шагая» по микротрубочке в сторону пресинаптической мембраны. (У кинезина есть две субъединицы — «ножки», которые по очереди прикрепляются и открепляются от микротрубочки, с каждым разом немного дальше, продвигая его вперед.) В одной везикуле могут быть тысячи молекул нейромедиатора. Раньше считалось, что один нейрон может выделять только один нейромедиатор (принцип Дейла [8]), но сейчас известно, что это не так. Более того, оказалось, что в везикуле одновременно могут находиться разные нейромедиаторы.
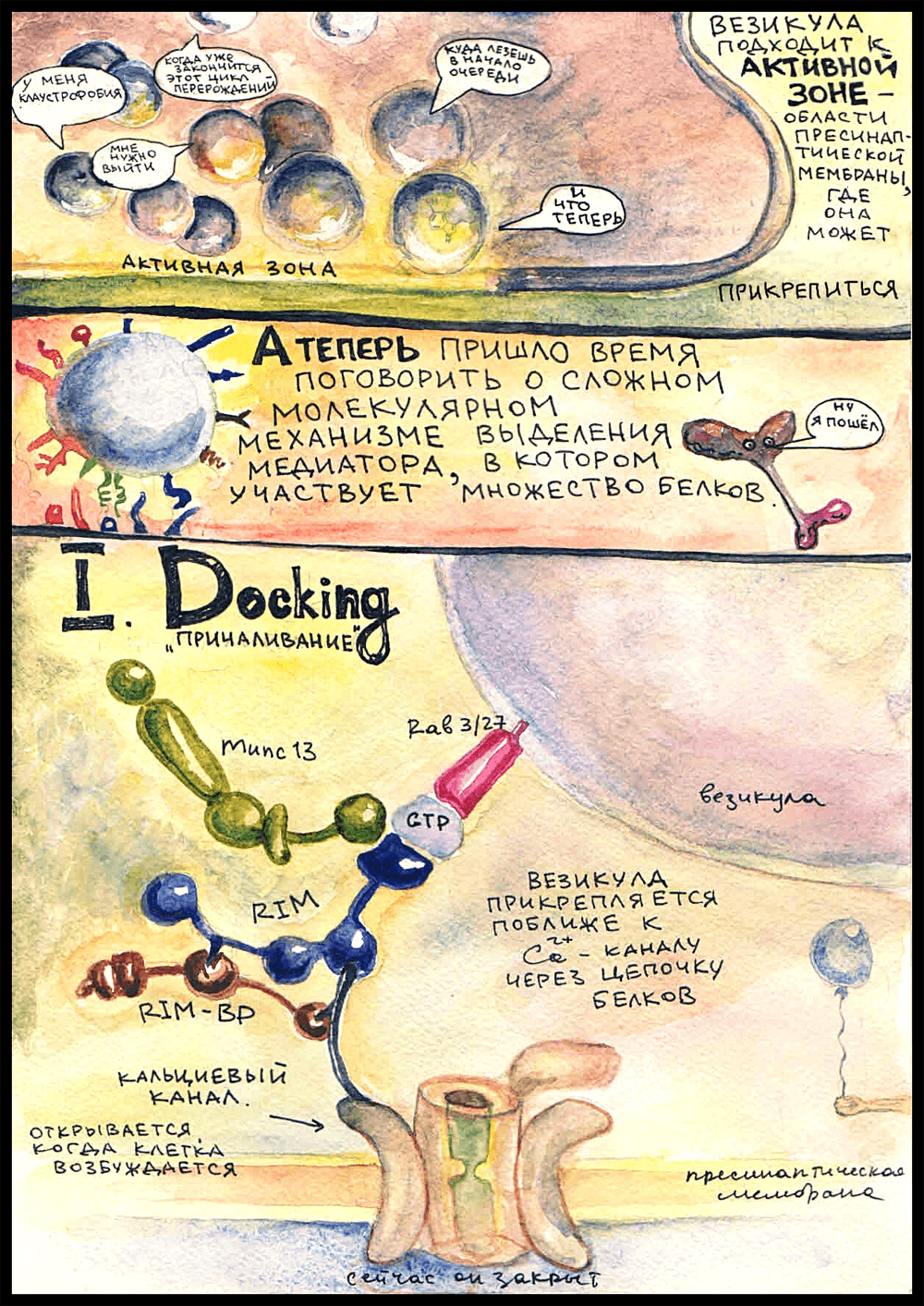
Не вся пресинаптическая мембрана подходит для того, чтобы медиатор выделился, а только области, которые называются «активными зонами». Только там есть специальные белки, нужные для прикрепления везикулы, а также локализованы потенциал-зависимые кальциевые каналы. Активные зоны располагаются ровно напротив рецепторных полей на постсинаптической мембране. Вот туда, к одной из активных зон, и держит путь кинезин.
Над активными зонами обычно собирается множество пузырьков, которые ждут своей очереди слиться с пресинаптической мембраной и освободиться от содержимого. У наших героев чудом получается проникнуть к самой активной зоне, и — …
И дальше начинается вот что.
Докинг
Первый этап прикрепления везикулы к пресинаптической мембране называется «docking», или «tethering» — «заякоривание». В мембране везикулы есть такой белок — Rab 3/27, принадлежащий к семейству Rab-ГТФаз, которые занимаются адресованием везикул в мембраны-реципиенты. (Rab — от «rat brain». В первый раз такие белки были найдены в мозгу крысы.) Rab 3/27 заякорен в липидном бислое мембраны; он включается туда на стадии образования везикулы. Будучи связанным с ГДФ, он неактивен и не может ничего присоединять, а при замене ГДФ на ГТФ активируется и становится способным к формированию связей. Когда везикула образуется, Rab 3/27 прикрепляется к ней уже в активированной форме.
Когда везикула оказывается в достаточной близости от активной зоны, Rab 3/27 связывается с белками RIM (Rab 3-interacting molecules), которые, в свою очередь, через RIM-BP (RIM-binding proteins) прикрепляются к кальциевым каналам в пресинаптической мембране. Это очень важный момент, потому что ключевым сигналом для выделения нейромедиатора служит поступление ионов кальция в цитоплазму. Кальциевые каналы открываются, когда потенциал действия доходит до аксонной терминали.
И вот, чтобы везикула могла как можно более оперативно выбросить медиатор, когда придет ПД, она прикрепляется к кальциевому каналу такой белковой «веревочкой». Формирование этой «веревочки» и называется докингом. Везикула «причаливает» к пресинаптической мембране, бросая «якорь» около кальциевого канала.
К белковой цепочке из RIM присоединяется еще белок Munc-13 — запомните его, он сыграет свою роль на следующей стадии.
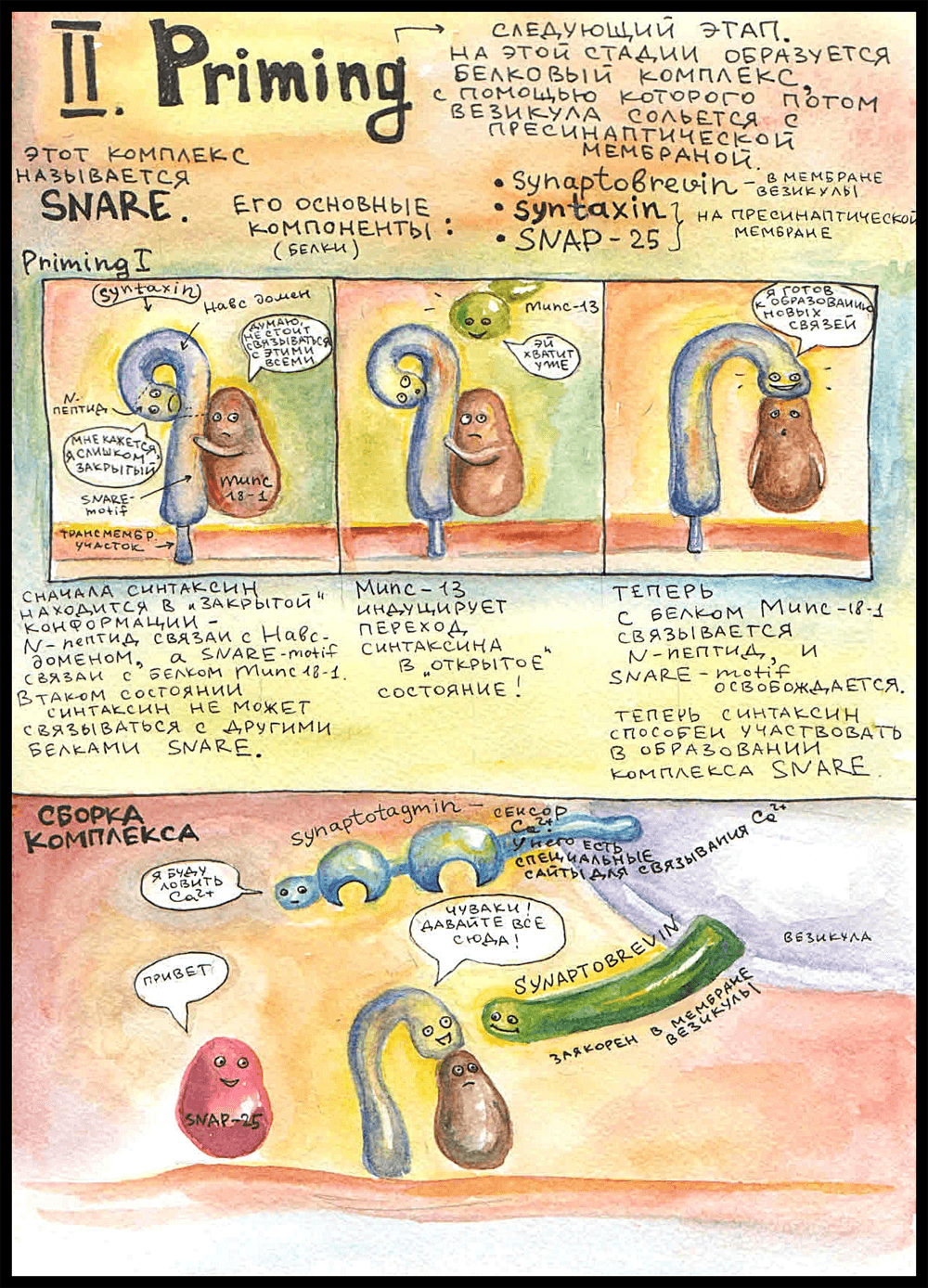
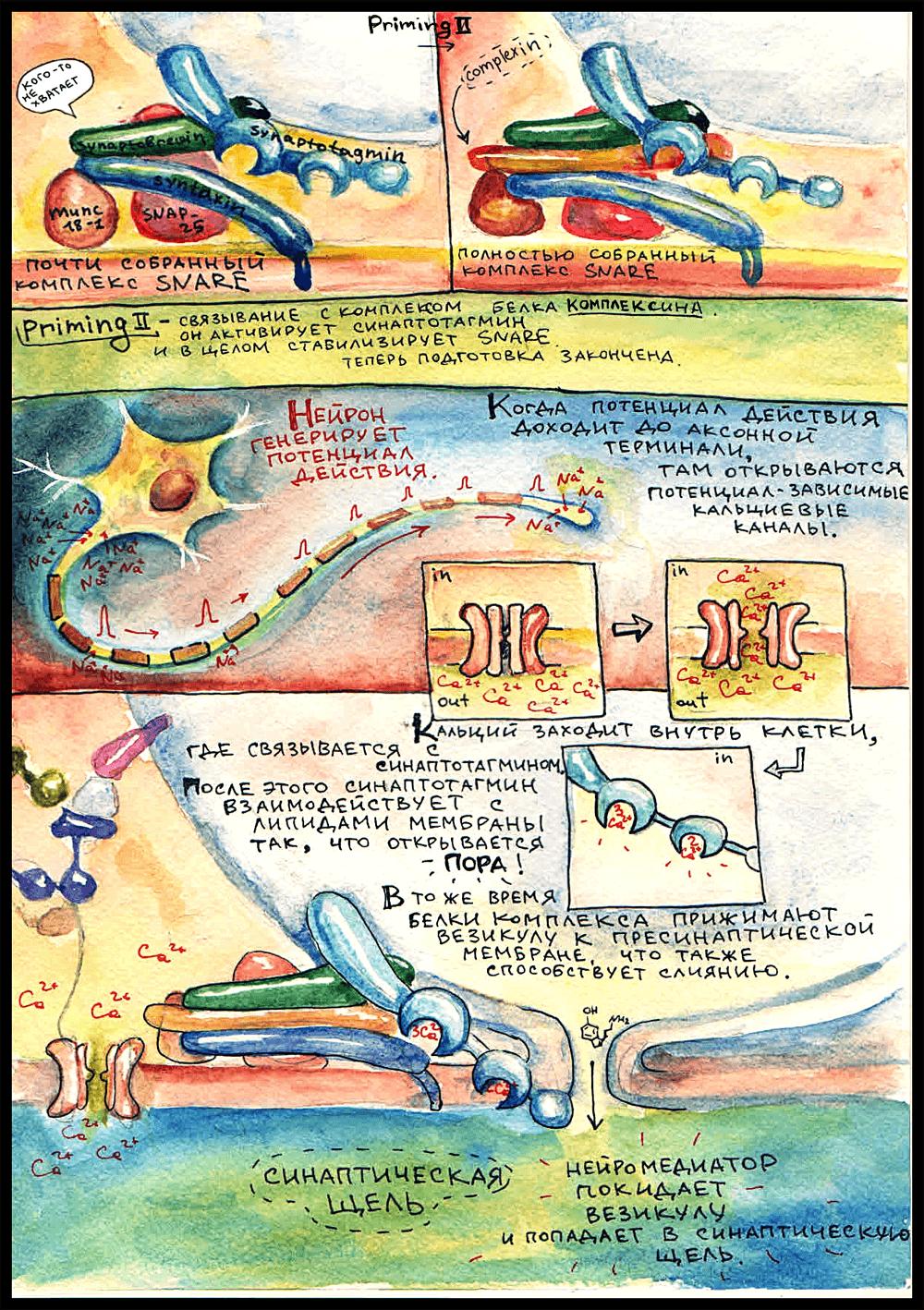
Прайминг
Следующий этап — это прайминг (priming; подготовка везикулы к слиянию). Подготовка заключается в образовании плотного белкового комплекса между мембраной везикулы и пресинаптической мембраной, в результате чего мембранный пузырек крепко прижимается к мембране аксона и становится способным реагировать на увеличение концентрации кальция.
Этот комплекс получил название SNARE — soluble NSF attachment receptor proteins, по названию АТФазы NSF, с которой он может реагировать. Как именно он реагирует и что при этом происходит — парой картинок ниже. Основные три компонента SNARE — синаптобревин, синтаксин и SNAP-25.
Синтаксин заякорен в пресинаптической мембране. В неактивном состоянии его концевой N-пептид связан с другим участком этой же молекулы — H-abc доменом, то есть неактивный синтаксин как бы замкнут сам на себя. Еще он на протяжении всей истории остается связанным с белком Munc 18-1. Сначала думали, что Munc 18-1 препятствует сборке комплекса, а потом оказалось, что он необходим для открытия поры в везикуле.
В неактивном состоянии синтаксин связан с Munc 18-1 через SNARE-мотив — участок, которым он потом связывается с белками SNARE. Поэтому это состояние и неактивное — синтаксин не может войти в состав комплекса, потому что нужный для этого участок занят.
Прайминг 1
Munc-13 — тот самый, который висел в белковой цепочке, — инициирует переход синтаксина в активное состояние: синтаксин отделяет N-пептид от самого себя и связывается им с Munc 18-1, а SNARE-мотив при этом освобождается. После этого он становится способным к образованию комплекса SNARE, что и происходит дальше: он плотно связывается с синаптобревином, который торчит из мембраны везикулы, и с белком SNAP-25. Munc 18-1 тоже входит в состав комплекса, будучи связанным с синтаксином, поэтому целый комплекс называется SNARE/SM.
Белок, который не входит в состав комплекса, но играет ключевую роль в процессе выделения — это синаптотагмин. Он заякорен в мембране везикулы неподалеку от синаптобревина. Синаптотагмин выполняет роль кальциевого сенсора: у него есть специальные сайты связывания Ca2+, то есть именно синаптотагмин делает возможным выделение нейромедиатора, когда приходит потенциал действия.
Прайминг 2
Для того, чтобы окончательно собрать комплекс, нужен еще белок комплексин. Он присоединяется в желобок между синаптобревином и синтаксином, а функция его заключается в активации синаптотагмина. Когда комплексин присоединяется к комплексу, синтаптотагмин становится способным связывать кальций. Вот теперь комплекс окончательно собран, все готово, и остается только ждать потенциала действия.
И вот — нейрон возбуждается! В аксонном холмике лавинообразно открываются натриевые каналы, мембрана деполяризуется, ПД бежит по аксону — и в пресинаптической мембране открываются кальциевые каналы. В цитоплазму заходят ионы Ca2+, синаптотагмин связывает пять штук — одним сайтом три, другим два — и взаимодействует с липидами мембраны так, что открывается пора — сквозная дырочка из везикулы в синаптическую щель. Также важным фактором при слиянии является давление, создаваемое белковым комплексом — он прижимает везикулу к пресинаптической мембране.
И — ура, нейромедиатор в синаптической щели!
Но что же происходит с SNARE/SM комплексом потом? Когда пора расширяется, белки меняют расположение, поворачиваясь как бы перпендикулярно плоскости мембраны. А вскоре NSF — такая АТФаза — приходит из цитоплазмы вместе со своим кофактором SNAP, и они вызывают распад SNARE/SM комплекса. После этого везикула может отделиться от пресинаптической мембраны, но тут может происходить по-разному:
Описанный выше механизм выброса медиаторов в синапсах, а также роль ионов кальция в этом процессе были установлены Томасом Зюдофом, который тем самым внес решающий вклад в нейробиологию и клеточную биологию. За данные открытия ему вместе с Джеймсом Ротманом и Рэнди Шекманом присуждена в 2013 году Нобелевская премия по физиологии и медицине — «за открытие системы везикулярного транспорта — основной транспортной системы в наших клетках» [9].
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Спокоен как GABA;
- Очень нервное возбуждение;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Фармаколог, понявший нейроны: Генри Дейл;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Thomas C. Südhof. (2014). The Molecular Machinery of Neurotransmitter Release (Nobel Lecture). Angew. Chem. Int. Ed.. 53, 12696-12717;
- Thomas C. Südhof. (2013). Neurotransmitter Release: The Last Millisecond in the Life of a Synaptic Vesicle. Neuron. 80, 675-690;
- Sebastian Jähne, Silvio O. Rizzoli, Martin S. Helm. (2015). The structure and function of presynaptic endosomes. Experimental Cell Research. 335, 172-179;
- Ege T Kavalali, Erik M Jorgensen. (2013). Visualizing presynaptic function. Nat Neurosci. 17, 10-16;
- Natalia L. Kononenko, Volker Haucke. (2015). Molecular Mechanisms of Presynaptic Membrane Retrieval and Synaptic Vesicle Reformation. Neuron. 85, 484-496;
- Juan S Bonifacino, Benjamin S Glick. (2004). The Mechanisms of Vesicle Budding and Fusion. Cell. 116, 153-166;
- Jeffrey P Bombardier, Mary Munson. (2015). Three steps forward, two steps back: mechanistic insights into the assembly and disassembly of the SNARE complex. Current Opinion in Chemical Biology. 29, 66-71;
- Purves D., Augustine G.J., Fitzpatrick D., Katz L.C., LaMantia A.-S., McNamara J.O., Williams S.M. Neuroscience (2nd Edition). Sunderland (MA): Sinauer Associates, 2001;
- Plopper G., Sharp D., Sikorski E. Lewin’s Cells (3rd Edition). Burlington: Jones & Bartlett Learning, 2013.