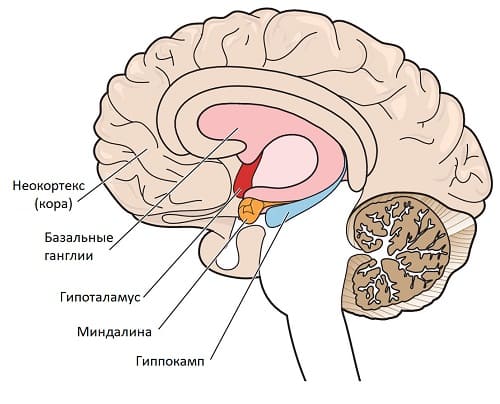
Медицинская реабилитация
7.2.1. Механизмы восстановления функций при повреждении периферических нервов и сплетений
Поврежденное нервное волокно не способно срастаться. Однако одновременно с процессом денервации начинаются восстановительные процессы, которые могут идти по трем направлениям.
(1) Регенерация нерва: проксимальная культя формирует аксональные выросты (наплывы аксоплазмы, или «колбы роста»), которые начинают продвигаться дистально и врастать в эндоневральные трубки (разумеется, лишь в тех случаях, когда последние сохранили свою целостность). Миелиновая оболочка вновь образующегося волокна формируется из тяжей леммоцитов. Скорость регенерации аксонов составляет приблизительно 1.5-2 мм в день [Buchtal F., Kuchl V., 1979]. Отдельные нервные проводники имеют различную способность к регенерации: среди периферических нервов особенно хорошо восстанавливается функция лучевого и мышечно-кожного нервов, а наихудшими регенеративными способностями обладают локтевой и малоберцовый нервы [Карчикян С.И., 1962; Weber R., 1996J. Для достижения хорошего восстановления растущие аксоны должны подключиться к дистальной культе нерва до того, как в ней наступят выраженные пери- и эндоневральные рубцовые сращения [Lefferet R., 1985]. В случаях формирования по ходу прорастающего волокна соединительнотканного рубца часть аксонов не распространяется в дистальном направлении, а беспорядочно отклоняется в стороны, формируя травматическую неврому.
При полном анатомическом повреждении нервного ствола через 2-3 недели после травмы на центральном конце образуется ампутационная неврома.
Регенерация нервного ствола может происходить гетерогенно: часть двигательных волокон врастает в оболочки чувствительных, а одноименные — в пучки, иннервирующие разноименные участки конечности [Гайдар Б.В.,1997].
(2) В случаях, когда в нервном стволе поражаются не все, а лишь часть нервных волокон, восстановление функции мышц возможно за счет разветвления сохранившихся аксонов и «захвата» ими тех мышечных волокон, которые иннервировались погибшими аксонами; при этом происходит укрупнение двигательных единиц мышцы. За счет этого механизма мышца может сохранять свою работоспособность в случаях утраты до 50% иннервировавших ее аксонов (а для мышц, не развивающих значительных усилий — даже до 90%), однако для полного завершения процесса компенсаторной иннервационной перестройки требуется около года [Weber R.,1996].
(3) В ряде случаев (обычно при травме нервного ствола типа ушиба) восстановление или улучшение функций связано с обратимостью некоторых патоморфологических процессов: с исчезновением реактивных воспалительных явлений, с рассасыванием мелких кровоизлияний и т.д. При нетяжелых травмах проводимость нерва, даже после полной ее потери, восстанавливается в течение первых дней или недель.
7.2.2. Факторы, определяющие прогноз восстановления
К основным факторам, определяющим при периферических невропатиях и плексопатиях скорость и степень спонтанного восстановления нарушенных функций (и, следовательно, объем и направленность лечебных вмешательств), относятся следующие:
— степень повреждения нервного проводника;
— уровень поражения;
— характер повреждающего агента.
7.2.2.1. Степень повреждения нервных проводников (при локальной травме)
Реабилитологи чаще всего определяют степень повреждения нерва по 3 категориям согласно классификации H.Seddon [1943]. Иногда используют также классификацию S.Sunderland [1990], выделяющего 5 степеней повреждения нервов; эта классификация основана на классификации H.Seddon, детализируя ее. Согласно классификации H.Seddon, все локальные повреждения нервных стволов делят, в зависимости от сохранности аксона и соединительнотканных структур, на три группы: (1) нейрапраксия; (2) аксонотмезис; (3) нейротмезис. (1) Нейрапраксия (neurapraxia, англ.) — это повреждение нерва, не приводящее к гибели аксона. Часто наблюдается при компрессии нерва (например, «ночной субботний паралич» вследствие компрессии лучевого нерва), при легкой травме нерва. Клинически характеризуется снижением вибрационной, проприоцептивной, иногда тактильной чувствительности. Болевая чувствительность страдает реже. Часто наблюдаются двигательные нарушения и парестезии. Блок проведения нервного импульса, наблюдающийся вследствие локального повреждения миелиновой оболочки, носит преходящий характер и регрессирует по мере восстановления миелина. Восстановление двигательных и чувствительных функций может продолжаться до 6 месяцев.
(2)Аксонотмезис (axonotmesis, англ.) — повреждение нерва, приводящее к гибели аксона при сохранности эпиневрия, периневрия, эндоневрия и шванновских клеток. Нередко наблюдается при закрытых переломах либо вывихах костей конечностей, а также при сдавлениях нервных стволов. Нарушаются двигательные, чувствительные и судомоторные функции нерва. Восстановление функций происходит за счет регенерации аксона. Скорость и степень восстановления зависит от уровня поражения, возраста (у молодых регенерация происходит быстрее) и общего состояния больного. В случаях, когда прорастание аксона происходит медленно, может произойти рубцевание эндоневральной трубки, в которую прорастает аксон, и восстановление не наступает. По этой же причине неблагоприятный прогноз имеется в случаях, когда дефект нервного ствола имеет значительную длину. При благоприятных условиях происходит постепенная невротизация дистального отдела поврежденного нерва, которая продолжается в течение многих месяцев, иногда год и более. Наблюдается восстановление утраченных функций, но не всегда полное.
О) Нейротмезис (neurotmesis, англ.) — разрыв нерва с пересечением аксона и соединительнотканных оболочек нерва. Из-за того, что повреждаются эндоневральные трубки, невозможным становится прорастание в них аксонов, регенерация аксонов приводит к образованию травматической невромы. Прогноз восстановления неблагоприятный. Данная классификация основана на микроскопических изменениях в нервном стволе. Макроскопически различить степень повреждения практически невозможно. Диагностика основана на динамическом клиническом и электрофизиологическом наблюдении. В связи с этим при закрытых травмах нервных стволов отечественные авторы нередко применяют иную классификацию, основанную на выделении следующих 4 форм поражения нервного ствола [Макаров А.Ю., Амелина О.А., 1998]: сотрясение, ушиб, сдавление, тракция. Сотрясение не сопровождается морфологическими изменениями в нерве, нарушения функции нерва кратковременны (не более 1-2 недель) и полностью обратимы. Ушиб нерва характеризуется возникновением мелких кровоизлияний, участков размозжения нервных волокон и пучков, что приводит к полному либо частичному нарушению проводимости, длительным и стойким выпадением функций. При сдавлении нерва степень нарушения проводимости зависит в первую очередь от длительности сдаачения: при своевременном удалении сдвливающих нерв субстратов (гематома, инородное тело, отломок кости и т.д.) может наблюдаться быстрое и полное восстановление проводимости, тогда как при длительном сдавлении в нервном стволе развиваются дегенеративные изменения. Отсутствие восстановления функции в течение 2-3 месяцев является критерием полного анатомического перерыва нерва. Тракция (например, тракдия ветвей плечевого сплетения при вправлении вывиха плеча) обычно сопровождается частичным нарушением функции, однако восстановление проводимости по нерву происходит достаточно длительно (в течение нескольких месяцев).
7.2.2.2. Уровень поражения
Чем проксимальнее поражение нервного ствола или сплетения (т.е. чем больше расстояние от места повреждения до периферических окончаний), тем хуже прогноз восстановления функции, поскольку тем больший срок требуется для прорастания нервного волокна и тем больше вероятность развития в эндоневральной трубке периферического отрезка нерва необратимых Рубцовых изменений [Lefferet R., 1985]. Так, например, по данным С.И.Карчикяна [1962], при ранениях седалищного нерва в верхней трети бедра первые движения стопы и пальцев появляются лишь спустя 15-20 месяцев и позже после наложения нервного шва, а при ранениях этого же нерва в нижней трети бедра — через 10-15 месяцев после оперативного вмешательства.
Наихудший прогноз отмечается при повреждениях на корешковом уровне, поскольку корешки спинальных нервов не регенерируют и не могут быть восстановлены хирургическим путем. Поражение корешков (обычно — отрыв корешка на шейном уровне), в отличие от поражения сплетения, характеризуется следующими признаками:
— интенсивная жгучая боль, иррадиирущая вдоль соответствующего дерматома;
— парализация паравертебральных мышц, иннервируемых задними ветвями спинальных нервов;
— паралич мышц лопатки вследствие нарушения функции коротких нервов плечевого пояса (крыловидная лопатка);
— синдром Горнера (при поражении С8-ты корешков);
— трофические нарушения и быстро прогрессирующая мышечная атрофия с грубыми вторичными контрактурами.
7.2.2.3. Характер повреждающего агента
Периферические невропатии и плексопатии могут иметь самую различную этиологию (таблица 7.2). В мирное время наиболее частой формой поражений периферических нервов являются туннельные невропатии, составляя около 30-40% от всех заболеваний периферической нервной системы. Туннельная невропатия — это локальное поражение нервного ствола, обусловленное его компрессией и ишемией в анатомических каналах (туннелях) или вследствие внешнего механического воздействия [Лейкин И.Б.,1998]. Предрасполагающие к развитию туннельных невропатий факторы включают генетически обусловленную узость естественных вместилищ нерва, приобретенную узость этих вместилищ вследствие отеков и гиперплазии соединительной ткани при различных заболеваниях (например, сахарном диабете, гипотиреозе, коллагенозах), длительное перенапряжение мышечно-связочного аппарата у лиц определенных профессий, последствия трав, мышечно-тонические и нейро-дистрофические нарушения при рефлекторных синдромах остеохондроза позвоночника, ятрогенные травмирующие воздействия (неправильное наложение гипсовой повязки, кровоостанавливающего жгута). Нарушение функции нерва происходит вследствие как демиелинизации, так и поражения аксона (ухудшение нейротрофического контроля в связи с недостаточностью аксонального транспорта).
Туннельные поражения нервов проявляются в первую очередь болью, чувствительными и вегетативными расстройствами. Двигательные нарушения развиваются лишь у одной трети больных и заключаются, как правило, в снижении мышечной силы, гипотрофии мышц, развитии контрактур. Прогноз восстановления функций при рано начатом лечении обычно благоприятный, однако это восстановление может происходить достаточно длительно, до нескольких месяцев. Кроме того, прогноз зависит от основного заболевания, на фоне которого развилась невропатия, от того, сохраняются ли профессиональные перегрузки конечности. В 30-40% случаев туннельные невропатии рецидивируют [Герман А.Г.и соавт., 1989].
На втором месте по частоте находятся травматические невропатии. Среди причин травматических невропатий прогностически наиболее благоприятными являются резаные ранения, при которых своевременное оперативное вмешательство обеспечивает хороший исход. Тракционные и огнестрельные травмы имеют худший прогноз, поскольку при них нередко измененными оказываются центральный отрезок нерва и нейрон спинномозговых центров, что существенно затрудняет регенерацию нерва. Разрушение нервного ствола на большом протяжении может наблюдаться также при электротравме, при химическом повреждении (случайное введение в нерв различных лекарственных веществ). Весьма неблагоприятно сопутствующее повреждению нерва нарушение кровообращения в конечности (кровотечение либо длительное наложение кровоостанавливающего жгута, тромбоз магистральной артерии), которое может приводить к развитию в мышцах, сухожилиях, суставных сумках, коже и подкожной клетчатке атрофирующего склерозирующего процесса с образованием контрактур. Препятствовать восстановлению движений могут также вторичные изменения в суставах и сухожилиях, которые развиваются вследствие растяжения связок и суставных сумок при пассивном свешивании конечностей в случае вялого паралича или пареза.
При невро- и плексопатиях, развившихся на фоне соматических заболеваний, вследствие иммунных, неопластических, инфекционных, токсических поражений и воздействий прогноз зависит от характера течения основного заболевания либо процесса.
7.2.3. Клинические и электрофизиоло-гические признаки восстановления нервных проводников
Определение степени восстановления функции нервных проводников основывается на данных комплексного клинико-электрофизиологического обследования, проводимого в динамике. Наиболее полное описание клинических закономерностей восстановления функции нервных проводников представлено в трудах, обобщающих опыт по лечению травматических невропатий, накопленный в период Великой Отечественной войны (Карчи кян С.И. Травматическое повреждение периферических нервов. — Л.:Медгиз, 1962; Аствацатуров М.И. Руководство по военной невропатологии. — Л., 1951; Опыт Советской медицины в Великой Отечественной войне,1952. — Т.20). Ниже мы рассмотрим закономерности восстановления функций после полного перерыва нерва в случае благоприятно протекающей регенерации либо после своевременно проведенного нейрохирургического вмешательства.
Наиболее ранними клиническими симптомами восстановления служат обычно изменения со стороны чувствительной сферы, которые задолго предшествуют признакам восстановления двигательной функции [Карчикян С.И., 1962]:
— парестезии, возникающие в зоне анестезии при давлении на область нерва тотчас ниже зоны повреждения, т.е. на область регенерирующих молодых аксонов;
— появление чувствительности к резкому сдавлению складки кожи в зоне анестезии;
— болезненность при давлении на нервный ствол дистальнее места повреждения с иррадиацией боли в дистальном направлении по ходу нерва; по мере прорастания аксона эта болезненность получается с уровней, отстоящих все более и более к периферии.
Восстановление чувствительности наступает раньше в более проксимальных отделах, начиная с краев центральной зоны анестезии. Вначале восстанавливается протопатическая (примитивная) болевая и температурная чувствительность: способность восприятия только резких болевых и температурных раздражений без точного распознавания качества и точной локализации наносимого раздражения. Поэтому болевые и температурные раздражения кожи вызывают ощущения, имеющие свойства гиперпатии (диффузные, трудно локализуемые, очень неприятные). Возможно, это связано с недостаточной миелинизацией новообразуюшихся регенерирующих волокон, что приводит к широкой иррадиации возбуждения на соседние волокна. Затем начинает восстанавливаться тактильная, и лишь потом — тонкая температурная чувствительность, мышечно-суставное чувство, стереогностическое чувство. По мере восстановления эпикритической (более тонкой) чувствительности начинают исчезать гиперпатические черты восприятия болевых и температурных раздражений.
Необходимо помнить, что сужение зоны расстройства чувствительности может происходить не только в результате начавшейся регенерации, но и за счет компенсаторных явлений (перекрытие ветвями соседних нервов); важно различать эти процессы.
К наиболее ранним признакам восстановления двигательной функции относятся некоторое повышение тонуса парализованных мышц, уменьшение атрофии. Затем, начиная с более проксимальных отделов, появляются активные мышечные сокращения. Через 5-6 месяцев после травмы нерва возникают активные движения, которые вначале отличаются слабостью, быстрой истощаемостью, неловкостью. Особенно долго длится восстановление мелких дифференцированных изолированных движений (например, в межфаланговых суставах). Позже всего восстанавливаются рефлексы, они нередко остаются утраченными даже при полном восстановлении чувствительности и двигательных функций. В целом поврежденный аксон при устранении причины, препятствующей аксональному росту, восстанавливается в сроки от 1.5-2 до 8-10 месяцев [Лобзин B.C. и соавт., 1988].
Даже при отсутствии регенерации частичное восстановление утраченных движений может происходить за счет компенсаторного сокращения мышц, иннервируемых сохранными нервами. С другой стороны, отсутствие восстановления движений может быть связано не с отсутствием регенерации нерва, а с сопутствующим повреждением сухожилий, мышц и суставов.
Среди электрофизиологических методов, используемых для динамического контроля за процессами восстановления нервной проводимости, в настоящее время применяют игольчатую и стимуляционную электромиографию (ЭМГ), а также метод вызванных потенциалов (глава 2 первого тома). Напомним, что частичное нарушение проводимости по нерву при регистрации стимуляционной ЭМГ характеризуется снижением скорости проведения возбуждения, снижением по амплитуде и частоте потенциалов действия нерва и мышцы, изменением структуры М-ответа; при регистрации игольчатой ЭМГ наблюдается изменение структуры потенциалов действия двигательных единиц соответствующих мышц. При демиелинизирующих процессах в большей степени снижается скорость проведения по нерву, тогда как при аксонопатиях наблюдается преимущественное снижение потенциала действия нерва и изменение М-ответа, а изменений скорости проведения может не наблюдаться. При полном перерыве нерва дистальный отрезок продолжает проводить импульсы до 5-6 суток. Затем наблюдается полное отсутствие электрической активности пораженных нервов и мышц. Спустя первые три недели обычно появляется спонтанная активность мышц в покое (денервационные потенциалы фибрилляций и положительные острые волны), регистрируемая с помощью игольчатых электродов. Первые признаки реиннервации после полной денервации мышцы выявляются при регистрации игольчатой ЭМГ в виде возникновения при попытке произвольного сокращения серии низковольтных полифазных потенциалов длительностью 5- 10 мс [Попов А.К., Шапкин В.И., 1997]. По мере реиннервации мышц наблюдается также появление полифазных двигательных единиц, увеличение их амплитуды и продолжительности (возникновение гигантских потенциалов двигательных единиц связывают с захватом сохранившимися аксонами дополнительных мышечных волокон). Потенциалы реиннервации иногда могут быть обнаружены за 2- 4 месяца до первых клинических признаков восстановления [Зенков J1.P., Ронкин М.А., 1991].
Наиболее ранние суждения о динамике восстановительных процессов могут быть получены с помощью регистрации вызванных потенциалов (ВП). Периферические ВП вызываются стимуляцией периферического нерва (магнитной или электрической) и регистрируются в виде волн над различными участками нерва. Через 7 и более дней после травмы сравнивают периферические ВП с теми, которые наблюдались сразу после травмы, либо с их значениями на непораженной контрлатеральной стороне. При этом ориентируются не только на амплитуду ВП, но и на площадь под волной ВП [Weber R.,1996]. При обратимом характере нарушений (нейрапраксия) спустя 7 и более дней после травмы на дистальном участке нерва продолжают регистрироваться сенсорные и моторные ВП, вызываемые стимуляцией периферического нерва ниже уровня поражения. При аксонотмезисе и нейротмезисе спустя этот срок наблюдается снижение амплитуды и изменение формы ВП дистальнее места повреждения, а по завершении валлеровского перерождения ВП на периферическом отрезке нерва не вызываются.
Электродиагностические методы позволяют отличить нейрапраксию от аксонотмезиса и нейротмезиса, но не позволяют различить между собой ак сонотмезис и нейротмезис; для этого необходимо использование метода магнитно-резонансной томографии [Weber R., 1996].
При плексопатиях метод ВII может помочь в дифференциальной диагностике пре- и постганглионарного поражений, что имеет важное значение при определении показаний к нейрохирургическому вмешательству. При постганглионарном поражении стволов сплетения дистальный конец теряет связь с телом клетки спинального ганглия, поэтому как сенсорный, так и двигательный потенциалы действия при раздражении периферического отрезка нерва отсутствуют в любой его точке ниже места повреждения. При преганглионарном поражении двигательные периферические ВП не вызываются при сохранности в тех же отрезках нерва чувствительных ВП (несмотря на анестезию в соответствующих зонах иннервации). Эго объясняется следующим: при преганглионарном поражении повреждению подвергается центральный отросток биполярной клетки, что нарушает передачу чувствительных импульсов к коре головного мозга и, соответственно, сопровождается анестезией. Однако периферический отрезок при этом не теряет связи с телом клетки спинального (чувствительного) ганглия, остается жизнеспособным и нормально проводит чувствительные импульсы. В связи с этим при преганглионарном повреждении сенсорный ПД регистрируется по всему ходу нервного волокна вплоть до уровня травмы. Ошибочные выводы, однако, могут быть сделаны при мультифокальной травме, когда имеется как пре-, так и постганглионарное корешковое повреждение; при этом сенсорные периферические ВП не вызываются, «маскируя» преганглионарное повреждение. Выявление преганглионарного поражения свидетельствует о крайне неблагоприятном прогнозе, поскольку, как уже указывалось, регенерация корешков невозможна, а хирургическое вмешательство недоступно.
Прогнозирование возможного спонтанного восстановления нарушенных функций определяет направленность и объем дальнейших реабилитационных мероприятий.
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Стаховская Л.В.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Сердюк А.В.
ФГБОУ ВО «Российский национальный медицинский исследовательский университет им. Н.И. Пирогова», Москва, Россия
Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний
Авторы:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В.
Как цитировать:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В. Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний. Журнал неврологии и психиатрии им. С.С. Корсакова.
2018;118(5):143‑149.
Kovrazhkina EA, Stakhovskaya LV, Razinskaia OD, Serdyuk AV. Inhibitors of CNS regeneration, their physiological role and participation in pathogenesis of diseases. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2018;118(5):143‑149. (In Russ.)
https://doi.org/10.17116/jnevro201811851143

Функциональное восстановление ЦНС после повреждений ограничено неспособностью нейронов и аксонов к регенерации. При этом аксоны периферической нервной системы (ПНС) регенерируют достаточно хорошо и полно, аксоны ЦНС — в минимальной степени [1—3]. Необратимая дегенерация аксонов нейронов головного и спинного мозга — ведущая причина неизлечимости тяжелых повреждений ЦНС, а также нейродегенеративных заболеваний.
Дегенерация аксонов является анатомической основой патогенеза многих заболеваний ЦНС и ПНС, с ней связан неврологический дефицит, а его регресс — с возможностью регенерации осевых цилиндров. Вторичная демиелинизация развивается как типовая реакция на повреждение нервной ткани и способствует углублению аксонального повреждения. Демиелинизированные аксоны еще хуже проводят нервный импульс, т. е. вторичная демиелинизация ухудшает течение аксонопатии и способствует углублению неврологического дефицита. Однако миелин ЦНС и ПНС различен: в ЦНС это продукт клеток олигодендроглии, в ПНС — шванновских. Различаются и регенераторные возможности: если периферические нервы относительно быстро и полно регенерируют, то проводящие пути ЦНС (например, кортикоспинальные тракты) восстанавливаются медленно и неполно. Одна из причин этого — наличие в ЦНС ингибиторов аксонального роста, связанных с миелином, глией и межклеточным матриксом. Молекулы-ингибиторы аксонального роста играют важную роль в эмбриогенезе и развитии ЦНС млекопитающих, но у взрослых препятствуют регенерации аксонов. В настоящее время молекулы-ингибиторы аксонального роста являются объектом углубленного изучения, разрабатываются лекарственные препараты, нейтрализующие эти влияния.
Известно, что неспособностью к регенерации обладают только аксоны ЦНС взрослых высших млекопитающих, у более примитивных животных, а также на ранних стадиях онтогенеза у плодов эта способность сохранена [2, 4, 5]. Хорошей нейропластичностью после повреждений и заболеваний ЦНС обладают дети, причем тем лучшей, чем в более раннем возрасте получено данное повреждение. Потеря способности аксонов ЦНС к регенерации совпадает по времени с дифференцировкой клеток глии [2, 5]. Непосредственное окружение нейронов и аксонов (олигодендро- и астроцитарная глия, а также миелин) содержат молекулы-ингибиторы роста аксонов, к которым относятся миелинассоциированные ингибиторы роста аксонов [6] и сульфатированные сахара экстрацеллюлярного матрикса [7].
Настоящий обзор посвящен ингибиторам роста аксонов в ЦНС, их роли в норме и при различных видах патологии.
Rho-ROCK сигнальный путь
Аксональная регенерация в ЦНС ограничена множеством ингибиторных молекул, связанных с глией и миелином. Эти ингибиторы стимулируют внутриклеточный сигнальный Rho-механизм — единый путь торможения регенерации аксонов в ЦНС, «запускаемый» повреждениями аксонов и глии [8, 9]. Все ингибиторные молекулы действуют именно через этот механизм.
RhoA — малая ГТФаза, активированная форма которой представляет собой серин/тирозинпротеинкиназу (RhoA-киназа, ROCK). Rho-ROCK-механизм связан с такими функциями нейронов, как миграция, рост дендритов и аксонов, нейропластичность, причем оказывает на них именно тормозящее действие. Этот механизм играет важную роль в патогенезе повреждений спинного и головного мозга, а также нейродегенеративных заболеваний [8—10].
В последние годы проясняется физиологическая роль Rho-ROCK [11], связанная с локомоциями клеток. Локомоция клеток осуществляется посредством псевдоподиальной активности и представляет собой координированный циклический процесс, включающий выпячивание (протрузия) псевдоподий на переднем крае клетки, их прикрепление к внеклеточному матриксу, центростремительное натяжение прикрепившихся псевдоподий, освобождение от контактов с матриксом задней (хвостовая) части клетки. Движущаяся клетка приобретает «локомоторный фенотип»: она сильно поляризована, ее передняя часть имеет вид широкой и тонкой пластинки, по краю которой непрерывно образуются псевдоподии, противоположная часть клетки ретрактирована. Образование псевдоподий обусловлено полимеризацией актиновых микрофиламентов на концах, обращенных к плазматической мембране клетки, наращивание которых создает толкающую силу, «выпячивающую» участок мембраны в виде широкой ламеллоподии или нитевидной филоподии. Важную роль в локомоции клеток выполняют также микротрубочки, по ним к псевдоподии транспортируются вещества, необходимые для роста актиновых микрофиламентов, они также способствуют «разбору» слишком увеличившихся в размерах фокальных контактов, что позволяет мигрирующим клеткам ликвидировать старые участки прикрепления [12].
Для передвижения клеток необходимо воздействие специфических цитокинов — факторов роста и связывания интегриновых рецепторов с внеклеточным матриксом. Передача сигналов от рецепторов факторов роста и интегринов контролирует не только пролиферацию клеток, но и их локомоцию, поэтому многие факторы роста являются митогенами-мотогенами. К митогенам-мотогенам относятся тромбоцитарный и эпидермальный факторы роста (PDGF и EGF), фактор роста фибробластов (FGF), «рассеивающий» фактор (scatter factor, HGF/SF) и др. Связывание митогенов-мотогенов со своими рецепторами включает как митогенную Ras-Raf-МАР-киназную сигнальную цепь, так и «морфогеную» сигнальную цепь от активированного Ras, в которой сигнал передается через фосфатидилинозит-3-киназу (PI3K) на группу белков, играющих ключевую роль в контроле над организацией и динамикой цитоскелетных систем, актиновых микрофиламентов и микротрубочек. Это G-белки, или малые ГТФазы, семейства Rho, действующие как молекулярные «двусторонние переключатели», попеременно то переходя в активное состояние при связывании с ГТФ, то теряя активность в результате гидролиза ГТФ до ГДФ. В активном состоянии G-белки семейства Rho участвуют в передаче сигналов от рецепторов факторов роста и интегриновых. Активация малых ГТФаз стимулирует сборку актиновых микрофиламентов, усиливает их контрактильность, способствует формированию стресс-фибрилл и связанных с ними фокальных контактов (белок Rho), стимулирует полимеризацию актина на плюс-концах разветвляющихся микрофиламентов, что создает толкающую силу, формирующую ламеллоподию (белок Racl) [12—14].
Таким образом, суперсемейство малых ГТФаз является одним из ключевых регуляторов множества сигнальных путей у эукариот [15]. К нему относится и семейство Rho ГТФаз, играющих важную роль в эмбриогенезе и регенерации ЦНС. К настоящему времени в семействе Rho насчитывают 20 белков, разделяемых на восемь подсемейств. Rho ГТФазы участвуют в различных физио- и патологических процессах — эмбрио-, митогенезе, росте и дифференцировке клеток, фокальных контактах регенерации, контракции. Соответственно высока клиническая важность изучения Rho ГТФазы — с их функционированием связаны гипертонус гладких и скелетных мышц (при артериальной и хронической легочной гипертензии, вариантной стенокардии, глаукоме и др.), нарушения клеточной дифференцировки (при новообразованиях), проблемы регенерации клеток (в частности, при повреждениях нервной ткани и нейродегенеративных заболеваниях) [16, 17]. При повреждениях ЦНС и нейродегенерациях активация RhoA и ROCK является ключевым элементом прекращения роста аксонов, тормозит элонгацию конуса аксона, блокирует спратинг нейритов [18]. Экспериментально доказано [19], что химическая блокада Rho-ROCK-механизма меняет ингибиторные эффекты ROCK in vitro и способствует аксональной регенерации in vivo.
Миелинассоциированные протеины
Рост аксонов осуществляется конусами роста — расширениями терминалей нервных волокон. Их ультраструктура отличается очень высокой концентрацией ряда органелл (микротрубочки, микрофиламенты, митохондрии, гранулярный ретикулум, лизо- и рибосомы), включает многочисленные вакуоли, что является показателем активного пиноцитоза экзогенных белков. Направление роста аксонов определяется процессом узнавания, который реализуется посредством избирательного адгезивного взаимодействия между конусами роста и окружающим их субстратом. Узнавание обеспечивают молекулы адгезии, которые встроены в плазмолемму ламелло- и филоподий и взаимодействуют с комплементарными молекулами во внеклеточном матриксе. Рост аксонов происходит по градиенту концентрации специфических химических факторов, вырабатываемых в органах-мишенях. Соответственно рост аксонов направляется и регулируется в том числе молекулами экстрацеллюлярного матрикса [19].
В 1985 г. М. Schwab и Н. Thoenen [20] изучали различия в процессах восстановления: культивировали симпатические и сенсорные нейроны в обогащенной ростовыми факторами среде и регистрировали рост отростков нейритов. Они зафиксировали рост волокон седалищного (принадлежат ПНС), но не зрительного (относятся к ЦНС) нерва. Авторы предположили, что в ЦНС содержатся ингибиторные молекулы, тормозящие регенерацию аксонов. М. Schwab и D. Bartholdi [21] продолжили поиски молекул, ингибирующих рост аксонов в ЦНС, учитывая, что наиболее ярким отличием повреждений ЦНС от ПНС является активация астро- и олигодендроцитов с формированием глиального рубца, в состав которого входят потенциально ингибиторные молекулы (например, NG2-хондроитин-сульфат-протеогликан).
В 1988 г. Р. Caroni и М. Schwab [22] обнаружили ген Nogo, продуктом которого является белок, ингибирующий регенерацию аксонов. Белок Nogo существует в трех изоформах, но только Nogo-A, экспрессируемый олигодендроцитами, связан с миелином ЦНС. Nogo-A имеет молекулярную массу 220—250 кД, является нормальным компонентом миелина олигодендроцитов и играет в норме ведущую роль в направлении аксонального роста в процессе онтогенеза и подавлении нейропластичности. Структурно-функциональные особенности Nogo-A включают два ингибиторных домена: N-терминальный, отсутствующий у изоформ Nogo-B и -C, и 66-аминокислотный конец (Nogo-66), присутствующий у всех трех изоформ. Оба этих сегмента белка Nogo-A потенциально могут участвовать в ингибировании аксонального роста, но Nogo-66 работает именно при повреждении миелина и олигодендроцитов [21, 23—25]. У нокаутных по Nogo-A мышей одни авторы [26] обнаружили «драматический» эффект регенерации аксонов, однако другие [27, 28] — не выявили подобного эффекта. Это заставило предполагать, что Nogo-A является не единственным ингибитором роста аксонов.
В дополнение к Nogo-A были выделены еще два миелинассоциированных ингибитора роста аксонов — миелинассоциированный гликопротеин (myelin-associated glycoprotein — MAG) и олигодендроцит-миелиновый гликопротеин (oligodendrocyte-myelin glycoprotein — OMgp). MAG был выделен в 1994 г. независимо в лабораториях M. Filbin и L. McKerracher [29—31]; он очень активно ингибирует рост аксонов in vitro, но нокаутные по MAG мыши также не показывают значимый регенерации аксонов [32—34].
Важным моментом в понимании механизмов регенерации аксонов стало обнаружение рецептора Nogo-66 (NgR) А. Fournier и соавт. [35, 36]. NgR располагается на поверхности аксонов, дополнительно поддерживается трансмембранными белками, например трансмембранный протеин p75 является рецептором для семейства нейротрофинов и специфически взаимодействует с NgR [23, 34, 35]. NgR, p75 и Lingo-1 (еще один трансмембранный протеин) формируют рецепторный комплекс для ингибиторной активности компонентов миелина. Три основные связанные с миелином молекулы, ингибирующие рост аксонов (Nogo-A, MAG и ОМ гликопротеины), действуют через этот рецепторный комплекс [32—34]. Его сигнальный эффект активирует малую ГТФазу Rho (через Nogo-66 рецептор NgR и трансмембранные рецепторы нейротрофинов). Через этот рецепторный комплекс миелинассоциированные протеины, другие ингибиторные молекулы экстрацеллюлярного матрикса и сам компактный миелин стимулируют экспрессию генов, вызывают активацию MAP-киназы и ROCK [36]. Результатом является влияние на цитоскелет аксона и торможение роста аксонального конуса [6, 11].
Ингибиторные молекулы межклеточного матрикса
В дальнейшем, помимо миелинассоциированных протеинов, были идентифицированы и другие ингибиторные молекулы экстрацеллюлярного матрикса, обладающие свойством ограничивать рост нейритов: эфрины, семафорины, протеогликаны и др. [34]. На торможение роста аксонов и элонгацию аксонального конуса влияют и сам миелин, и сульфатированные сахара — хондроитин- и кератансульфатные протеогликаны [6]. Остатки миелина и протеогликаны являются основными компонентами глиальных рубцов [7, 18]. Их биологическое действие также осуществляется через Rho-ROCK-сигнальный путь.
Физиологическая роль ингибиторов регенерации ЦНС
Роль миелинассоциированных ингибиторов роста аксонов в патологии, особенно при травмах и повреждениях спинного мозга, изучена в многочисленных экспериментальных исследованиях — на культурах клеток и животных моделях. Физиологическая роль миелинассоциированных протеинов и Rho-ROCK-сигнального пути только начинает проясняться. Ингибиторы регенерации в ЦНС регулируют развитие миелина, электрическую и механическую стабильность аксонов, способствуют организации нейронных сетей, лимитируют синаптические контакты [11]. Миелинассоциированные ингибиторы также ограничивают обусловленную опытом пластичность, спраутинг нейритов и установление новых межнейронных связей в здоровой взрослой ЦНС, т. е. ограничивают анатомические изменения в ЦНС в норме и патологии, что делает их ведущими в фундаментальных исследованиях нейропластичности [8]. Нарушение функции миелинассоциированных ингибиторов связано с проблемами развития мозга, нейропсихиатрическими расстройствами, нейропатической болью [6, 11, 37].
Миелин обеспечивает быстрое и точное проведение нервного импульса по длинным аксонам, осуществляет метаболическую поддержку аксонов и обладает нейропротективными свойствами [38]. Недавние исследования [39, 40] показывают, что существуют механизмы регуляции активности нейронов, влияющие на степень миелинизации ЦНС. Предполагают, что адаптивная миелинизация является еще недостаточно изученной формой зависимой от активности пластичности нервной системы.
В процессе развития молекулы окружения аксонов участвуют в образовании сложных нейронных сетей. После своего образования нейронные сети «настраиваются» в течение короткого периода повышенной пластичности («критический период»), по окончании которого приобретают зрелую форму. Синаптические контакты в зрелом мозге стабильны в течение длительного времени, но имеет место и ограниченное структурное ремоделирование, что формирует клеточную основу обучения, памяти и нейропластичности [41]. Зависящая от активности модификация синаптических контактов может быть достигнута посредством динамической регуляции окружения аксонов. Ингибиторы регенерации ЦНС укрепляют нейронную архитектуру в конце критических периодов [42, 43]. Так, получены доказательства [44] вовлечения Nogo-A в ограничение нейрональной пластичности в зрительной системе грызунов. Важная физиологическая функция ингибиторов регенерации ЦНС заключается в консолидации нейронной архитектуры, созданной в конце критического периода.
Ингибиторы регенерации ЦНС экспрессируются глией и нейронами. Nogo-A, OMgp, NgR1-рецептор для Nogo-66, хондроитинсульфатные протеогликаны присутствуют в пре- и постсинаптических фракциях, выделенных из гиппокампа [29, 42, 45]. Ингибиторы регенерации ЦНС влияют на структуру и плотность синапсов [46]. В гиппокампе нокаутных мышей NgR1-дендритные шипы имеют менее зрелый профиль распределения, чем у мышей «дикого» типа, по-видимому, NgR1 необходим для правильного развития зрелых шипов [47]. Исследования показали, что потеря всех трех членов семейства NgR (NgR1, NgR2 и NgR3) увеличивает синаптическую плотность в молодом гиппокампе, указывая на то, что NgR функционируют как отрицательные регуляторы синаптогенеза. В недавних исследованиях[6] показано, что NgR1 является ключевой молекулой для ограничения ветвления дендритов в соматосенсорной коре взрослых мышей и пирамидальных нейронах гиппокампа.
Взаимодействие между ингибиторами регенерации ЦНС и факторами роста (например, BDNF) обеспечивает нейрональную пластичность и стабильность нейронных сетей после завершения критических периодов [45]. Многие нейропсихиатрические расстройства связаны с дефектами структуры или функции синапсов и могут быть вызваны сдвигом в возбуждающем/ингибиторном балансе. Учитывая, что ингибиторы регенерации ЦНС играют важную роль в регуляции этих процессов, их измененная экспрессия может способствовать развитию нарушений в работе мозга. В старческом мозге экспрессия в гиппокампе нескольких ингибиторов регенерации ЦНС увеличивается и коррелирует с дефицитом пространственного обучения и памяти, что показано в экспериментах на трансгенных животных [48, 49]. При этом крысы с пониженной экспрессией Nogo-A демонстрируют нарушения в социальном поведении [50]. Интересно, что мутации в NgR1 и Nogo-A у человека связаны с шизофренией [51].
Спинальная травма
Наиболее изучена роль миелинассоциированных ингибиторов роста и Rho-ROCK-механизма при спинальных повреждениях. Эффективность лечения этой патологии невелика. В недавнем обзоре P. Stahel и соавт. [52] перечислены все существующие терапевтические подходы: применение стероидов в острейшем периоде и стабилизация повреждений позвоночника в ближайшие 24 ч после травмы помогают ограничить вторичные повреждения; поддержание жизненно важных функций (дыхание, артериальное давление, борьба с кровопотерей) в острейшем и остром периодах и как можно более ранняя мобилизация пациента также позволяют предотвратить осложнения. Однако наибольшую надежду в плане именно восстановления неврологического дефицита сейчас возлагают на экспериментальные препараты, блокирующие молекулы — ингибиторы роста аксонов [52].
Аксональную регенерацию после спинальных травм блокируют окружающие место повреждения ткани. Аксональные контакты и восстановление в ЦНС блокируют остатки миелина, нейровоспаление и клеточная гибель в месте повреждения. Хондроитинсульфатные протеогликаны экстрацеллюлярного матрикса образуют глиальный рубец и периневральный барьер для аксонального роста и спрутинга [53—55]. Соответственно спонтанное восстановление после спинальной травмы, небольшие степени которого все же наблюдаются в клинике и эксперименте, зависит от присутствия миелинассоциированных протеинов-ингибиторов роста, воспалительного компонента в поврежденной нервной ткани, гиперактивации сигнального Rho-пути [56].
На экспериментальных животных моделях было показано [57, 58], что после селективного пересечения волокон кортикоспинального тракта на среднем грудном уровне терапевтическое введение антител против ингибиторного протеина Nogo-A способствует более быстрому и полному восстановлению двигательных функций, при этом отдаленная регенерация поврежденных аксонов отмечена только после Nogo-нейтрализации. Также после двустороннего пересечения кортикоспинального тракта в присутствии Nogo-A-нейтрализующих антител было показано увеличение коллатералей руброспинального тракта, иннервирующих шейный отдел спинного мозга, что коррелировало с клиническим улучшением и демонстрировало возможность для параллельных, анатомически обособленных систем по меньшей мере частично компенсировать повреждение другой системы [58].
В экспериментальных работах показана значимая роль в данной патологии миелинассоциированного протеина Nogo-A [56], липидов миелина [54], хондроитинсульфатных протеогликанов [53]. На культурах клеток в среде, лишенной этих молекул, аксонотомированные нейроны демонстрировали элонгацию аксонального конуса, животные нокаутных по генам миелинассоциированных протеинов линий лучше восстанавливались после экспериментальных спинальных повреждений. В экспериментах обнаружены динамические изменения экспрессии гена и синтеза Nogo-A после повреждения спинного мозга (низкая через 24 ч после травмы, продолжает понижаться далее до 3 дней, затем быстро повышается до пика около 7 дней, и постепенно снова снижается после 14 дней) [59], а также роль относительно сохранных надсегментарных проводников при спонтанном восстановлении у нокаутных по Rho-ROCK животных — имеет значение сохранность руброфугальных и руброспинальных путей с образованием de novo связей между красным ядром и ядром шва [56]. Эти данные очень важны для реабилитации пациентов со спинальными повреждениями, но наибольший интерес вызывают препараты — блокаторы ингибиторных молекул.
Нейродегенерации
Компонент аксональной дегенерации очень важен в патогенезе нейродегенеративных заболеваний. Сами зрелые нейроны практически не способны к регенерации (за исключением отдельных зон ЦНС), но аксоны обладают способностью к спраутингу и элонгации. На развернутых стадиях большинства нейродегенеративных заболеваний потеря тел нейронов всегда сопровождается потерей аксонов и нарушением способности к нейропластичности. Проблеме соотношения между дегенерацией тел нейронов и аксонов посвящен один из недавних обзоров, показавший, что молекулярные механизмы дегенерации аксонов различны с таковыми для тел нейронов, что делает воздействия на аксональный компонент нейродегенерации одним из возможных терапевтических подходов к данной патологии [60].
Гиперактивация Rho-ROCK-механизма описана при болезни Паркинсона, боковом амиотрофическом склерозе, спинальных амиотрофиях [60—64]. Особенно много внимания исследователей в последнее время привлечено к роли микроглиального окружения в дегенерации нейронов ЦНС. Важная роль астро- и микроглии и активации глиальной ROCK показана при боковом амиотрофическом склерозе [64] и болезни Паркинсона [62], особенно серьезное нейротоксическое и провоспалительное действие оказывает глиальное окружение нейронов на поздних стадиях нейродегенераций. Показано также [61], что активация ROCK усиливает присущую нейродегенеративным заболеваниям абнормальную белковую агрегацию (например, α-синуклеин при болезни Паркинсона), а препараты — ингибиторы ROCK могут ее понижать.
Другие заболевания
Гиперактивация Rho-ROCK-сигнального пути под воздействием миелинассоциированных ингибиторов влияет и на восстановление после инсульта [65, 66]. Миелинассоциированные протеины — ингибиторы роста аксонов синтезируются также некоторыми субпопуляциями клеток сетчатки и оказывают влияние на восстановление после повреждений зрительных нервов [67].
Ингибиторы RhoA и другие потенциальные лекарственные средства
Учитывая значительную роль Rho-ROCK-сигнального пути и «миелинассоциированных ингибиторов в торможении регенерации аксонов ЦНС, в последние годы велик интерес исследователей к поиску потенциальных терапевтических агентов — веществ, блокирующих Rho-ROCK-механизм и усиливающих нейропротекцию и стимуляцию регенерации. Особое значение приобретает поиск таких потенциальных лекарств для пациентов со спинальными повреждениями и нейродегенеративными заболеваниями.
В настоящее время выделен класс веществ — ингибиторов RhoA (C3-exoenzmye, fasudil, Y-27632, ibuprofen, siRhoA, p21), активно изучаемых в экспериментах на клеточных культурах и моделях животных [8, 9, 53, 55, 68, 69]. Ингибиторы RhoA селективно блокируют ее без влияния на другие ГТФ (С3-трансферазы), к веществам этой группы относится, например, активно сейчас изучаемый (проходит I/IIa фазы клинических испытаний) cethrin [55, 68]. Существуют и другие химические агенты, селективно «связывающие» RhoA, например collapsing response mediator protein 4 (CRMP4), образующий комплекс CRMP4b/RhoA и блокирующий тормозящий эффект на рост аксонов; блокируют Rho-ROCK-механизм и антагонисты АТФ-рецепторов P2Y12 и P2Y13 [37].
Исследования на животных показывают терапевтическую эффективность ингибиторов RhoA. Большинство подобных испытаний проведено на моделях спинальной травмы. Так, в одном из недавних исследований [9] 120 крыс разделили на три группы: 40 — ложно оперированные (только ламинэктомия, без рассечения спинного мозга), 40 — ламинэктомия и спинальная, получение физиологического раствора, 40 — ламинэктомия и спинальная транссекция, введение лекарства. Показано достоверно лучшее восстановление у животных, получавших fasudil (по шкале Basso—Beattie—Bresnahan), а также достоверное снижение экспрессии RhoA мРНК в ткани спинного мозга животных опытной группы. Выявлены положительное влияние ингибитора RhoA Y-27632 на элонгацию аксонального конуса в обогащенной протеогликанами среде [18] и регресс неврологического дефицита у перенесших рассечение спинного мозга на уровне СIV—СV позвонков крыс [8], положительное влияние ингибиторов АТФ-рецепторов P2Y12 и P2Y13 на нейропатическую боль при спинальных повреждениях [37].
Тем не менее в большинстве экспериментальных исследований на животных с ингибиторами RhoA не доказана их эффективность. В недавнем крупном метаанализе [69] изучалась эффективность различных PhoA/ROCK-ингибиторов на моделях животных повреждения спинного мозга (геми-, транссекция, контузия). Работы, опубликованные в базах PubMed, EMBASE, Web of Science и соответствующие критериям включения (экспериментальная спинальная торакальная травма, лечение ингибиторами PhoA/ROCK, оценка двигательного восстановления по протоколам Basso, Beattie, and Bresnahan score или Basso Mouse Scale for Locomotion), оценивались двумя независимыми исследователями по девяти пунктам. Метаанализ включил 30 работ (всего 725 животных) и обнаружил эффективность ингибиторов PhoA/ROCK в 15% случаев. В некоторых работах, сообщавших об эффективности ингибиторов PhoA/ROCK, было обнаружено нарушение методологии; эти данные не включались в окончательный анализ.
Ингибиторы PhoA/ROCK (facudil) показали свою эффективность на моделях церебрального инсульта и нейродегенеративных заболеваний [61, 66]. Так, ингибитор RhoA facudil изучался на мышиной СОД1-модели бокового амиотрофического склероза (линия G93A), где вызывал торможение дегенерации мотонейронов и замедление прогрессирования заболевания. Препарат предотвращал гибель мотонейронов у G93A мышей, подавлял нарастание ROCK-активности, редуцировал фосфорилирование актина, индуцированное СОД1. В другом исследовании in vivo [63] у G93A-мышей при пероральном приеме facudil также удлинялись сроки выживания и улучшались двигательные функции, а применение facudil in vitro увеличивало выживаемость поврежденных мотонейронов. Facudil исследовался и на модели болезни Паркинсона, показав положительное влияние на выживаемость нейронов черной субстанции и даже уменьшение патологической агрегации α-синуклеина [61].
С целью возможного терапевтического влияния на рост и регенерацию аксонов изучали антагонисты к рецептору Nogo-66 (NgR1) [70], ингибитор гликозилирования хондроитинсульфатных протеогликанов PTPσ [53], моноклональные антитела против миелинассоциированных протеинов-ингибиторов аксонального роста. В недавнем исследовании [65] эффект моноклонального антитела GSK249320 против миелинассоциированного гликопротеина (MAG) показан на модели кортикального ишемического инсульта: у приматов, получавших GSK249320, к 16-му дню заболевания функциональное восстановление было достоверно лучше, чем в контрольной группе. Важно, что функциональное преимущество опытной группы было получено не за счет периинфарктной области и прилегающей премоторной зоны, что было продемонстрировано нейрофизиологическим — картированием двигательных зон (представительство вентральной премоторной зоны в экспериментальной группе было меньше, чем в контроле).
Таким образом, ингибиторную активность миелина ЦНС можно нейтрализовать с помощью антител к миелинассоциированным протеинам (например, анти Nogo-A), делеции генов Nogo, MAG и OMgp, введения растворимых NgR-фрагментов и NgR-блокирующих пептидов, торможения поступления кальция во внутриклеточное пространство, использования высоких концентраций цАМФ, применения ингибиторов RhoA или ROCK [71]. In vivo показаны нейтрализующий эффект моноклональных IgM-антител к Nogo (IN-1), умеренно выраженное, но достоверное улучшение восстановления после спинального повреждения у нокаутных по Nogo-A мышей, эффективность пептидов, взаимодействующих с активным 66-аминокислотным С-концом Nogo (например, NEP1−40), связывающихся с Nogo, но не активирующих его. Активно изучаются и нейтрализующие эффекты вторичных мессенджеров ингибиторной активности миелина: инактивирующих Rho-энзимов (например, С3-трансфераза), ингибиторов ROCR (например, Y27632,), эффекты нейтрализации активности Nogo и MAG продемонстрированы при инфузии in vivo аналогов цАМФ, а также медиатора p75 [71—73]. Представленный подход к управлению регенерацией аксонов кажется физиологически обоснованным и потенциально эффективным, однако решение данной проблемы далеко от завершения, необходимы дальнейшие исследования.
В заключение еще раз отметим, что ингибиторы регенерации ЦНС, работающие через Rho-ROCK-сигнальный путь, играют важную физиологическую роль не только в развитии ЦНС, но и по окончании критических периодов — в стабилизации нейронных сетей, ограничении ветвления дендиритов, структуре и функционировании синаптических контактов, работая в противоположном факторам роста направлении. Нестабильное функционирование нейронных сетей является основой многих нейропсихиатрических заболеваний. При повреждениях ЦНС, травмах, нейродегенеративных заболеваниях, старении избыточная экспрессия связанных с миелином ингибиторов регенерации ЦНС тормозит рост аксонов, играет отрицательную роль для реабилитационного потенциала. Изучение аксон-миелиновых отношений, роли окружения аксонов в их дегенерации и регенерации важно для развития подходов к лечению ряда заболеваний и повреждений ЦНС.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: elekov2@yandex.ru
04 Сентября 2017
Восстановленные аксоны
Исследователи смогли справиться с последствиями инсультов и спинномозговых травм
Анна Керман, ХХ2 век, по материалам MedicalNewsToday: Nerve fibers regenerated with molecular mix
Учёным удалось найти способ восстановления аксонов – важнейших частей нейрона – после повреждения. Открытие может помочь пациентам, перенёсшим спинномозговую травму, инсульт, а также тем, кто страдает нейродегенеративными заболеваниями. Теоретически, благодаря результатам новой работы такие больные могут получить возможность восстановить двигательные навыки.
По статистике, именно инсульт чаще всего оказывается причиной паралича, на него приходится около трети случаев. На втором месте – спинномозговая травма, на её «счету» 27% случаев паралича.
Инсульт и спинномозговая травма сопровождаются повреждением аксонов, расположенных в коре головного мозга и в спинном мозге. Аксон – это длинный «хвост» нервной клетки, передающий информацию от тела нейрона к другим клеткам.
В рамках нового исследования, проведённого под руководством Чжигана Хэ (Zhigang He), сотрудника Бостонской детской больницы (Boston Children’s Hospital) и Гарвардской медицинской школы (Harvard Medical School), учёные ввели подопытным мышам разработанную ими смесь в надежде, что это поможет восстановить аксоны. Результаты работы опубликованы
в журнале Neuron.
В предыдущих исследованиях было показано, что сочетание инсулиноподобного фактора роста 1 с белком остеопонтином помогло восстановить зрение грызунам за счёт регенерации аксонов зрительного нерва. Кроме того, известно, что остеопонтин вовлечён в процессы воспаления и дегенерации нервной системы, он играет важную роль в развитии таких нейродегенеративных заболеваний как рассеянный склероз, болезнь Альцгеймера и болезнь Паркинсона.
В рамках новой работы Хэ и его коллеги разделили подопытных мышей на две группы. Все животные перенесли спинномозговую травму или инсульт, но часть мышей получала лечение смесью упомянутых выше веществ, в то время как остальным животным, составившим контрольную группу, смесь не назначалась.
После этого исследователи оценили моторные навыки животных, в том числе – сложные, для чего мышей заставили ходить по горизонтальной лесенке с неравномерно размещёнными перекладинами.
Оказалось, что у получивших лечение мышей способность к перемещению восстанавливалась значительно активнее. Кроме того, через 12 недель после травмы мыши из экспериментальной группы гораздо реже (46% против 70% в контрольной) совершали ошибки при перемещении по горизонтальной лесенке.
Затем учёные повторили эксперимент, добавив к смеси упомянутых выше веществ 4-аминопиридин-3-метанол, вещество, известное способностью улучшать аксонные связи у пациентов с рассеянным склерозом. Мыши, получившие лечение новой смесью, ошибались на лесенке лишь в 30% случаев, в то время как здоровые мыши – в 20%. То есть, в сравнении «пролеченные» животные практически не уступали животным, у которых в анамнезе не было ни инсультов, ни спинномозговых травм.
«В нашей лаборатории мы впервые разработали лекарство, позволившее животным с моделями спинномозговой травмы и инсульта восстановить функциональную активность», – говорит Хэ.
Теперь авторы работы планируют протестировать разработанную смесь в клинических испытаниях с участием людей-добровольцев.
Портал «Вечная молодость» http://vechnayamolodost.ru
04.09.2017
Подписаться на рассылку:
Введите Email
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Восстанавливаются ли нервные клетки

Гимранов Ринат Фазылжанович
Невролог, нейрофизиолог, стаж — 33 года;
Профессор неврологии, доктор медицинских наук;
Клиника восстановительной неврологии.Об авторе
Дата публикации: 18 декабря, 2021
Десятилетия споров в научной среде, появление мифов и теорий, сотни экспериментов – все это окружает главный вопрос 20 века в области нейрофизиологии: «Как восстанавливается мозг человека и возможно ли это в принципе?».
Ученым удалось определить механизм создания новых нервных клеток головного мозга. Мы знаем, как работают нейроны. Известны и практические экспериментов, доказавшие, что повреждения мозга возможно обратить вспять при определённых условиях.
Содержание статьи:
- 1 История создания и разрушения мифа
- 1.1 Как на самом деле?
- 2 Особенности нейронов
- 3 Опасность стресса
- 4 Как помочь мозгу восстановиться?
- 4.1 Переверните мир
- 4.2 Правило семи дней
- 4.3 Аэробика для мозга
- 4.4 Читайте
- 4.5 Продолжайте учиться
- 4.6 Осваивайте новые навыки
- 4.7 Нагружайте интеллект
- 5 Список использованной литературы
История создания и разрушения мифа
О том, как восстановить функции мозга, сегодня рассказывается в авторитетных научных изданиях мира. Разработаны методики, доступные каждому.
«Нервные клетки не восстанавливаются!» – эта поговорка сопровождает человека с детства, создавая впечатление правдивости этой фразы. Нам даже не приходит в голову сомневаться в однажды полученной и потом постоянно повторяемой вокруг информации. А зря. Ведь это высказывание, основанное на научных исследованиях полувековой давности давно опровергнуто.
Разбираясь с тем, миф или реальность идея о том, что нервные и мозговые клетки не восстанавливаются, где же правда и будут ли еще существовать картинки, утверждающие, что это научный факт, мы изучили историю формирования и развенчания этой идеи.
Как на самом деле?
Действительно, ученым раньше не удавалось обнаружить следы молодых тканей в зрелом мозге. Сейчас это объясняется недостаточно чувствительной аппаратурой [1].
Революция случилась в 1977 году, когда Майкл Каплан и Джеймс Хиндс разработали новый способ отслеживания изменений в коре головного мозга и применили его на уже взрослых лабораторных крысах. Уже через месяц после повреждения, срез мозга животных дал четкие результаты – образование новых клеток идет.
Последующие исследования позволили выявить особенности работы мозга млекопитающих и человека:
- Зрелые нервные клетки не способны делиться, так как стали узкоспециализированными.
- За образование новых элементов системы отвечают сохранившиеся стволовые клетки.
- После деления стволовой клетки, один из ее потомков постепенно приобретает нужную узкую специализацию [2]. И дозревает до того, чтобы занять свое место в мозге, восстанавливая его функциональность. Новый нейрон становится на место погибшего товарища.
- Другая дочерняя клетка, которая образовалась после первоначального деления, остается стволовой. Это дает возможность до старости поддерживать в организме способность к восстановлению узкоспециализированных клеток при необходимости.
- Клетки-предшественники образуются в глубоких отделах мозга, а затем постепенно мигрируют в нужную область. Там замещают поврежденные, «дозревают» и встраиваются в рабочие процессы.
Задумываясь над вопросом, почему же до сих пор говорят, что нервные клетки не восстанавливаются, есть или все-таки нет подтвержденных данных о нервах человека, помните: научное знание медленно проникает в общественное мнение.
Требуются десятилетия, чтобы победить укоренившиеся в массовом сознании мифы. Тем более, когда они вошли в повседневный оборот в виде пословиц и поговорок.
Особенности нейронов
Вопрос о том, восстанавливаются ли нервные клетки мозга у людей, мужчин и женщин, во время жизни и сколько на это понадобиться времени, ученые раскрыли. Однако, чтобы повысить когнитивные функции, восстановить память, способность воспринимать и обрабатывать информацию, этого мало.
За сложные познавательные процессы отвечают еще малоизученные элементы – нейроны и связи между ними. Особенно актуален этот вопрос в связи с развивающимися у взрослых людей проблемами с памятью.
Самих нейронов и связей между ними в мозгу не счесть. Число настолько велико, что потеря части клеток, происходящая каждый день под воздействием негативных внешних факторов или возраста, незаметна для взрослого человека, пока не достигнет критического показателя. Исследования нейрофизиолога Кэрол Барнс позволили выявить несколько закономерностей:
- Со временем, часть нейронов, сохранивших в себе информацию, человеческую память, уходит в своеобразную спячку. Они не отмирают, но перестают посылать сигналы, замолкают. В это момент мы теряем часть своих воспоминаний, забываем. И это физиологический процесс.
- Гиппокамп, глубокий подкорковый отдел, у взрослых людей сохраняет способность создавать новые нейроны. Свежие клетки мигрируют по мозгу человека, формируют новые нейронные связи, записывают информацию. Спустя время и эти группы постепенно уходят в «спячку», если к ним не поступают запросы от других клеток.
- Многих из «спящих» элементов нейронной сети можно разбудить и перевести в активное состояние. Для этого применяется комбинация из медикаментов, физиотерапевтических процедур и психо-нейрофизиологических техник тренировки [3].
Возможно ли, что мозг взрослого человека создает новые клетки в неограниченном количестве? Или он только поддерживает баланс, сформированный в юности? Ответ на эти вопросы, ученым еще предстоит найти.
Вопрос о том, восстанавливаются ли нейроны головного мозга или нет, в современной науке считается раскрытым. Сегодня идут исследования, помогающие лучше понять этот процесс, найти более действенные методики улучшения работы мозга.
Опасность стресса
О том, что стресс убивает нервные клетки, знают все. Но влияет ли состояние нервного напряжения, волнение, на то, как восстанавливается мозг человека?
На помощь снова пришли лабораторные крысы. Дело в том, что ученые в большинстве своем изучают мозг человека после его смерти, поэтому отследить динамику образования новых клеток в период взрослой жизни было крайне сложно.
Ответ дали эксперименты на крысах. Образование новых клеток специально подавлялось у испытуемых животных. Результатом подобного обращения стала депрессия, отказ от вещей, приносящих радость, отсутствие положительной реакции на то, что раньше даже вызывало эйфорию.
Анализ данных экспериментов показал своеобразный замкнутый круг. Сильный стресс, постоянные переживания, угнетенное состояние или психические заболевания в активной фазе, не позволяют стволовым клеткам размножаться, создавать нейронные связи [4].
Когнитивный застой, отсутствие стимула к развитию и других изменений, приводящих к усилению работы мозга, постепенно погружает животное в депрессивное состояние.
Точно также этот процесс происходит и в организме человека. Поэтому при лечении повреждений мозга, часто применяются успокоительные процедуры, психотерапия.
На то, как восстанавливается мозг человека после повреждений, возрастной деградации, влияет масса факторов. Одним из самых важных является покой. При лечении после травм головы, на этот момент обращают особенное внимание все врачи.
Если человек испытывает интенсивный стресс, то образование новых клеток, а значит и нейронных связей, – невозможно. Никакие упражнения, обучение и даже прием специальных препаратов не дадут заметного результата.
Как помочь мозгу восстановиться?
Разобравшись с главным вопросом, можно ли восстановить нейронные связи головного мозга и нервные клетки, перейдем к руководству, как это сделать.
Даже во взрослом возрасте, причиненный мозгу ущерб возможно если не полностью, то частично исправить. Потребуется специализированная медицинская помощь: подобранные курсы лекарственных препаратов и физиопроцедур. Не меньшую результативность дает самостоятельная работа над собой – развитие и укрепление когнитивных функций.
Рассмотрим подробнее методы с доказанной эффективностью.
Переверните мир
Находясь в окружении привычных вещей, мы начинает воспринимать их как детали интерьера и перестаем замечать.
Чтобы убрать этот эффект и одновременно заставить мозг задействовать новые для него типы мышления, переверните вокруг себя предметы (какие получится) вверх тормашками.
Мозг не сможет воспринять их как привычную деталь и вынужден будет воспринять, как что-то новое, задействовать для этого нейронные связи.
Новизна впечатлений подстегнет нейроны к работе, усилится внимательность, улучшится навык воспринимать новое.
Правило семи дней
Есть данные, что для создания и фиксации новой нейронной связи нужно повторять тренировочное действие в течение семи дней.
После этого периода тренировок связь становится устойчивой, однако это не значит, что можно будет бросить тренироваться. Без необходимой работы, такая связь быстро «уснет».
Все семь дней, минимум полчаса в день уделяйте тренировке мозга – и вы заметите результат. Например – изучайте новое, ходите домой новой дорогой.
Аэробика для мозга
Чтобы находиться в постоянном развитии, создавать новые связи, мозг постоянно должен сталкиваться с чем-то необычным, новым. Это просто устроить даже в обыденной жизни.
Давайте умеренную нагрузку на органы восприятия информации. Начните утро не привычным ритуалом, измените напиток, почистите зубы другой рукой, меняйте запахи в доме. Разнообразьте привычную звуковую атмосферу вокруг себя, концентрируйте зрительное внимание на непривычных вещах.
Читайте
Художественная или научно-популярная литература заставляет нейроны работать, улучшает когнитивные функции. Не только за счет поступления новой информации, но и благодаря обработке и оценке ее качества, достоверности, последующему анализу.
Продолжайте учиться
Изучайте новый иностранный язык или незнакомую научную область. Непривычные знания заставляют лучше работать память, тренируют внимание, абстрактное и логическое мышление. В мозгу тогда активируются ранее спящие отделы, налаживается взаимодействие между ними [5].
Осваивайте новые навыки
С хорошей стороны себя показали умения, направленные на развитие мелкой моторики. Собирайте конструкторы и пазлы, шейте и вышивайте, рисуйте.
Нагружайте интеллект
Для этого существуют интеллектуальные настольные игры и занятия. Регулярные партии в шахматы или групповые игры в настолки требуют применения когнитивных функций.
Решение логических и ситуационных задач, разгадывание кроссвордов – то, что нужно. Такие мероприятия поддержат уже существующие нейронные связи в рабочем состоянии, заставят образоваться новые.
Восстановление нейронных связей головного мозга зависит не от обновления нервных клеток, а от восстановления функций отдельных отделов [6]. То есть, чтобы улучшить когнитивные функции, необходимо их тренировать целенаправленно и регулярно.
Человеческий мозг – сложная и не до конца изученная структура, таящая в себе огромное количество тайн. Однако главная загадка его уже разрешена: миф о невозможности его восстановления разрушен.
Даже взрослый или сильно пострадавший интеллект возможно частично или полностью восстановить.
Список использованной литературы
- ^ Namba, Takashi et al. “Time-lapse imaging reveals symmetric neurogenic cell division of GFAP-expressing progenitors for expansion of postnatal dentate granule neurons.” PloS one vol. 6,9 (2011): e25303.
- ^ Sawa, Hitoshi. “Specification of neurons through asymmetric cell divisions.” Current opinion in neurobiology vol. 20,1 (2010): 44-9.
- ^ Turlejski, Kris, and Ruzanna Djavadian. “Life-long stability of neurons: a century of research on neurogenesis, neuronal death and neuron quantification in adult CNS.” Progress in brain research vol. 136 (2002): 39-65.
- ^ Puga, Denise A et al. “Stress exacerbates neuron loss and microglia proliferation in a rat model of excitotoxic lower motor neuron injury.” Brain, behavior, and immunity vol. 49 (2015): 246-54.
- ^ Timiras, P S. “Education, homeostasis, and longevity.” Experimental gerontology vol. 30,3-4 (1995): 189-98.
- ^ Bikson, Marom et al. “Rational modulation of neuronal processing with applied electric fields.” Conference proceedings : … Annual International Conference of the IEEE Engineering in Medicine and Biology Society. IEEE Engineering in Medicine and Biology Society. Annual Conference vol. 2006 (2006): 1616-9.
Была ли эта статья полезна?
- Да
- Нет
Вы можете подписаться на нашу рассылку и узнать много интересного о лечение заболевания, научных достижений и инновационных решений:
Приносим извинения!
Как можно улучшить эту статью?
Более подробную информацию, возможно уточнить у врачей-неврологов, на нашем форуме!Перейти На Форум
Восстановление повреждённых нервов возможно
7 мая 2020
+7 926 604 54 63
address
Самые тяжёлые последствия разного рода травм — потеря чувствительности и двигательных функций частей тела. Они случаются, когда повреждены нервы — пучки аксонов, вытянутых отростков нервных клеток. Медицина в таких случаях бессильна — выросшие аксоны имеют слабую способность восстанавливаться.
Но всё может измениться. Новая работа специалистов из Медицинской школы Льюиса Каца университета Темпл (Lewis Katz School of Medicine Temple University, LKSOM) показывает, что восстановление нормальной работы нервной системы после травм возможно, а ключ к этому — регулирующая клеточный рост молекула, известная как Lin28.
В статье, опубликованной в журнале Molecular Therapy, сообщается о восстановлении аксонов у взрослых мышей с травмой спинного мозга или зрительного нерва. Это стало возможным благодаря повышенной экспрессии гена Lin28.
«Наши результаты показывают, что Lin28 является главным регулятором регенерации аксонов и перспективной терапевтической мишенью при травмах центральной нервной системы», — говорит один из руководителей проекта, профессор анатомии и клеточной биологии Шусинь Ли (Shuxin Li).
Регенеративный потенциал Lin28 при повреждении спинного мозга животных продемонстрирован впервые.
Чтобы изучить влияние Lin28 на регенерацию аксонов, профессор Ли с коллегами вывели линию мышей со сверхэкспрессией Lin28 в некоторых тканях. Взрослые животные были разделены на группы, у одной группы был повреждён спинной мозг, у другой — зрительный нерв.
В экспериментах участвовала и группа взрослых мышей с нормальной экспрессией Lin28. Они получили такие же повреждения, после чего Lin28 им был введён с помощью вирусного вектора, таким образом изучалось прямое действие молекулы на восстановление тканей.
Избыток Lin28 стимулировал регенерацию аксонов во всех случаях, но особенно заметно это было в случае инъекции Lin28 после травмы. У мышей с повреждением спинного мозга инъекция приводила к росту аксонов более чем на три миллиметра за пределы зоны повреждения аксонов, у животных с повреждением зрительного нерва аксоны отрастали по всей длине тракта зрительного нерва. Двигательная активность и зрение мышей восстановились.
Ближайшая цель — определение безопасных и эффективных средств доставки Lin28 к повреждённым тканям у больных людей. Для этого надо разработать вектор (средство доставки) для Lin28, способный добраться до повреждённых нервов. Также предстоит более полно изучить сигнальный путь Lin28, узнать, какие ещё молекулы участвуют в росте нервных клеток, и как их можно использовать в медицине.
При большинстве нейродегенеративных заболеваний повреждается не только тело нейронов, но и аксоны, необходимые для передачи нервных импульсов. Механизмы, которые защищают нейроны от разрушения, одновременно ингибируют восстановление аксонов. Это большая проблема в разработке терапии заболеваний, связанных с потерей нейронов — от болезни Альцгеймера до глаукомы. Однако с помощью высокопроизводительного скрининга удалось найти киназы, ингибирование которых приводит и к сохранению нейрона, и к восстановлению аксонов. Хотя механизм этого эффекта до конца не понятен, обнаруженные киназы в будущем могут стать потенциальной мишенью для терапии нейродегенеративных заболеваний.
Развитие нервной системы и ее работа — постоянный баланс между клеточной смертью и выживанием, восстановлением и дегенерацией клеток и связей между ними. Нервная система состоит из множества взаимодействующих между собой нейронов. Соединения между ними, а также взаимодействие нейронов с рецепторами, мышцами и другими тканями и органами устанавливается не только во время эмбрионального развития, но и после рождения. Этот процесс включает в себя возникновение нейронов и их миграцию, появление синапсов, а также и постоянную работу над ошибками. Нейроны, которые неправильно взаимодействуют с соседними клетками или не смогли установить взаимодействие вовсе, и избыточные нейроны, которые были произведены нейрональными клетками-предшественниками «про запас», подлежат уничтожению путем апоптоза. Кроме того, существуют механизмы, которые редактируют только взаимодействие отростков нервных клеток (аксонов и дендритов), и не влияют на жизнеспособность клетки. Нарушение этого процесса может приводить к дефектам развития и нейродегенеративным заболеваниям — болезням Альцгеймера и Паркинсона, а также другим заболеваниям, связанным с потерей нейронов. Развитие и функционирование нервной системы регулируется в организме разными способами, один из которых — сигнальные каскады протеинкиназ.
Протеинкиназы — ферменты, которые присоединяют фосфатную группу к другим белкам (то есть фосфорилируют их). Фосфорилирование влияет на белки, например, активируя их способность к ферментативным реакциям или побуждая формировать белковые комплексы. Протеинкиназы нередко объединены в сигнальные каскады, состоящие из последовательных модулей. На вершине таких каскадов находятся протеинкиназы, реагирующие на внешние сигналы, в роли которых может выступать повреждение клетки, воздействие каких-либо веществ или избыток/недостаток питательных веществ. В ответ на сигнал протеинкиназа фосфорилируется, после чего она сама может фосфорилировать и активировать следующую киназу или киназы в каскаде. Классическим примером таких каскадов являются сигнальные пути митоген-активированных протеинкиназ (MAPK), которые, как правило, состоят из трех модулей (рис. 2).
Киназа киназы MAP-протеинкиназы DLK (Dual leucine zipper kinase — киназа с двойной лейциновой застежкой) — одна из ключевых протеинкиназ в нейронах млекопитающих. Она фосфорилирует протеинкиназы JNK (c-Jun N-terminal kinases), которые в свою очередь фосфорилируют огромное количество белков, связанных с транскрипцией генов, различными сигнальными путями, движением клеток, а также апоптозом. Таким образом, DLK участвует в огромном количестве процессов — порой противоположных друг другу. При развитии нервной системы DLK одновременно контролирует как образование аксонов и миграцию нейронов (за счет фосфорилирования белков, связанных с цитоскелетом), так и апоптоз лишних или нефункциональных нейронов (за счет активации соответствующих белков JNK-киназами). Кроме того, DLK участвует в дегенерации аксонов, но этот процесс не зависит от активности JNK-киназ. Во взрослом организме DLK запускает гибель нейронов в ответ на повреждение при ишемии, травме, отравлении нейротоксинами или нейродегенеративных заболеваниях (K. A. Fernandes et al., 2014. DLK-dependent signaling is important for somal but not axonal degeneration of retinal ganglion cells following axonal injury).
Повреждение аксонов сопутствует большому количеству патологических состояний, а также нормальному старению. Известно, что протеинкиназа DLK участвует в передаче сигнала от поврежденного участка аксона в тело нейрона, приводя к его апоптозу. Такой эффект хорошо изучен на примере ганглионарных клеток сетчатки глаза (см. картинку дня Конусы роста аксонов). Аксоны этих нейронов, объединяясь в зрительный нерв, передают зрительный импульс в мозг. При повреждении зрительного нерва сигнал о повреждении передается в тело нейронов на достаточно большое расстояние (длина зрительного нерва составляет примерно 30 мм).
Одной из стратегий по спасению ганглионарных клеток может быть подавление активности DLK. Действительно, при повреждении зрительного нерва не экспрессирующие DLK ганглионарные клетки выживают гораздо лучше (T. A. Watkins et al., 2013. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury). Но так как DLK также участвует в образовании аксонов, их регенерация невозможна, а восстановление функции нейронов становится все более маловероятным. Поэтому требуется поиск альтернативных методов, которые могли бы одновременно и сохранить поврежденный нейрон и обеспечить регенерацию аксонов.
Исследователи из Калифорнийского университета в Сан-Диего, которые ранее обнаружили роль DLK в регенерации аксонов (T. A. Watkins et al., 2013. DLK initiates a transcriptional program that couples apoptotic and regenerative responses to axonal injury), провели поиск новых киназ, которые важны как для сохранения нейрона при повреждении, так и для восстановления аксонов. Для поиска исследователи провели высокопроизводительный скрининг (high-throughput screening) 366 веществ, способных ингибировать 224 известные киназы. Некоторые из этих веществ подавляют активность не одной, а нескольких киназ, поэтому авторы провели скрининг двумя способами. Сначала они искали вещества, которые помогают выживать ганглионарным клеткам после повреждения. Так как каждую клетку нельзя повредить механически, к клеткам добавляли колхицин — вещество, мешающее работе микротрубочек цитоскелета, в том числе в аксонах. Такое химическое повреждение запускает те же механизмы, что и механическое. Во втором скрининге искали вещества, которые увеличивали рост отростков нейронов (аксонов и дендритов). В обоих случаях каждую из 366 молекул добавляли к культурам ганглионарных клеток, полученных из индуцированных плюрипотентных стволовых клеток человека, и наблюдали за исходом с помощью микроскопа.
Альтернативой такому подходу мог бы быть скрининг, в котором последовательно «выключали» гены с помощью малых интерферирующих РНК (siRNA, small interfering RNA). Но использование молекул решает две задачи. Во-первых, ингибиторы часто влияют на несколько киназ сразу, позволяя очертить круг из нескольких кандидатов, некоторые из которых могут оказаться неизвестными. Во-вторых, если вещество успешно снижает активность киназы, то оно сразу же становится кандидатом в лекарственные препараты или хотя бы в основу для нового лекарственного препарата. А это сохраняет огромное количество времени в последующих исследованиях.
По результатам скрининга вещества разделили на три группы: первая — неактивные вещества, вторая — вещества, увеличивающие выживаемость нейронов и (или) рост отростков нейронов, третья — вещества, уменьшающие эти параметры. При анализе полученных результатов удалось найти уже известные киназы. Ингибирование rho-зависимых киназ (Rho-associated protein kinase) ранее было связано с регенерацией аксонов ганглионарных клеток, а ингибирование циклинзависимых киназ — с их выживаемостью. Среди киназ, которые обеспечивали и то, и другое, выделялись три киназы, которые входят в подсемейство GCK-IV-киназ — MINK1, MAP4K4 и TNIK (рис. 3). Интересно, что эти киназы участвуют в активации DLK в нейронах в ответ на стресс (M. Larhammar et al., 2017. The Ste20 Family Kinases MAP4K4, MINK1, and TNIK Converge to Regulate Stress-Induced JNK Signaling in Neurons).
Роль киназ-кандидатов, безусловно, проверили с помощью альтернативных методов. Снижение их активности ранее известными ингибиторами приводило к увеличению выживаемости ганглионарных клеток и росту аксонов в клеточных культурах. Авторы также смогли изучить последствия того, что будет, если нарушить работу этих киназ в ганглионарных клетках, полученных из сетчатки мышей: снижение активности одновременно трех киназ увеличивало их выживаемость в культуре. Кроме того, нарушение работы киназ защищало нейроны от различных видов повреждений (окислительного стресса, повреждений микротрубочек, повреждения ДНК). После таких результатов настало время исследовать, как протеинкиназы GCK-IV действуют в живом организме.
Исследователям достаточно было изучить, как «выключение» активности киназ влияет на ганглионарные клетки. Поэтому они воспользовались аденоассоциированными вирусами, несущими направляющую РНК (guide RNA) против трех киназ, которые вводили напрямую в глаза трансгенных мышей, экспрессирующих нуклеазу Cas9, или контрольных мышей. Через 14 дней удалось достичь «выключения» целевых генов.
Далее у мышей разрушали зрительный нерв (подробности этой методики описаны в статье Z. Tang et al., 2011. An Optic Nerve Crush Injury Murine Model to Study Retinal Ganglion Cell Survival). Эта процедура имитирует то, что происходит в сетчатке пациентов с глаукомой или травмой зрительного нерва: после нарушения целостности аксонов сигнал о повреждении передается в тело ганглионарных клеток, и они отмирают путем апоптоза. Мышам с модифицированными нейронами и контрольным мышам проводили эту процедуру (или имитировали ее), а затем изучали, как выживают ганглионарные клетки. Гипотеза подтвердилась: через две и через десять недель после операции у мышей с нефункциональными протеинкиназами GCK-IV в сетчатке оставалось больше ганглионарных клеток, чем у контрольных животных. Такой же эффект наблюдался при «выключении» уже известной киназы DLK.
А что с аксонами? Авторы повторили описанную выше процедуру, включив в эксперимент вирусы с направляющей РНК против киназы DLK. Через две недели у мышей разрушали зрительный нерв, а через три недели изучали вновь образованные аксоны. У контрольных мышей наблюдали новые, но редкие отростки ганглионарных клеток. У мышей с неактивной киназой DLK, как и предполагалось, аксоны не восстанавливались. В случае неактивных GCK-IV-киназ новые аксоны появлялись, но в недостаточном количестве. Тогда авторы пошли еще на одну уловку — «выключение» гена PTEN. Этот способ помогает восстановить синтез белка в поврежденных нейронах (K. K. Park et al., 2008. Promoting Axon Regeneration in the Adult CNS by Modulation of the PTEN/mTOR Pathway) — еще одна проблема, которую нужно преодолеть для регенерации аксонов. Снижение уровня PTEN в ганглионарных клетках без DLK не приводит к восстановлению аксонов, зато в клетках, где отсутствовали GCK-IV-киназы, аксоны восстанавливались значительно лучше.
Пока авторы не могут объяснить, за счет чего ингибиторы GCK-IV-киназ одновременно увеличивают выживаемость самих нейронов и их аксонов. Одна из вероятных гипотез состоит в том, что GCK-IV-киназы участвуют в активации DLK. При их «выключении» DLK активируется, но не настолько, чтобы запустить клеточную смерть. В пользу этой гипотезы свидетельствует лишь частичная регенерация аксонов после повреждения зрительного нерва. Вторая гипотеза предполагает, что GCK-IV-киназы участвуют в ответе на повреждение аксонов независимо от DLK. Например, киназа MAP4K4 активируется в ответ на повреждение кардиомиоцитов при окислительном стрессе. «Выключение» этой киназы увеличивает выживаемость и улучшает функцию клеток в этих условиях (L. R. Fiedler et al., 2019. MAP4K4 Inhibition Promotes Survival of Human Stem Cell-Derived Cardiomyocytes and Reduces Infarct Size In Vivo). При этом в кардиомиоцитах DLK отсутствует.
Тем не менее, наличие еще одной мишени для разработки препаратов, помогающих восстановить утраченные или поврежденные нейроны, не может не радовать. Дальнейшее изучение того, как работают GCK-IV-киназы в нейронах при различных условиях, поможет в этом процессе.
Источник: Amit K. Patel, Risa M. Broyer, Cassidy D. Lee, Tianlun Lu, Mikaela J. Louie, Anna La Torre, Hassan Al-Ali, Mai T. Vu, Katherine L. Mitchell, Karl J. Wahlin, Cynthia A. Berlinicke, Vinod Jaskula-Ranga, Yang Hu, Xin Duan, Santiago Vilar, John L. Bixby, Robert N. Weinreb, Vance P. Lemmon, Donald J. Zack, and Derek S. Welsbie. Inhibition of GCK-IV kinases dissociates cell death and axon regeneration in CNS neurons // PNAS. 2020. DOI: 10.1073/pnas.2004683117.
Екатерина Грачева