С позиций нормальной физиологии нервная система рассматривается как возбудимая ткань: она способна менять трансмембранную разницу потенциалов при раздражении, а в некоторых случаях — спонтанно. Отдельно взятый нейрон находится в непрерывном процессе биоэлектрогенеза.
Регистрация активности нейронов показывает непрерывную смену базовых электрофизиологических процессов: потенциал покоя, потенциал действия, постсинаптические потенциалы (ПСП): возбуждающий или тормозный. Других источников электрического поля, кроме нейронов, в головном мозге нет.
Классификация нейронов
По структуре
Полярность
Большинство нейронов можно подразделить на:
- Униполярные (англ. unipolar neuron) – нейроны с одним отростком
- Биполярные (англ. bipolar neuron) – имеют один аксон и один дендрит
- Мультиполярные (англ. multipolar neuron) -имеют один аксон и несколько дендритов
- Клетка Гольджи I – нейроны с длинными аксональными отростками
- Клетка Гольджи II – нейроны либо не имеющие аксона, либо имеющие короткий аксон
- Псевдоуниполярные (англ. pseudounipolar neuron) – имеет один отросток, который является и дендритом и аксоном
- Нейроны без аксона (англ. anaxonic neuron) – нейрон, у которого нет аксона, либо его сложно отлечить от дендритов
Другие
Некоторые нейроны могут быть идентифицированы согласно их местоположению и структурным особенностям. Вот некоторые примеры:
- Корзинчатый нейрон (англ. basket cell) – интернейроны, которые образуют плотное сплетение терминалей вокруг сомы клеток-мишеней, обнаруживаются в коре и мозжечке;
- Клетки Бетца (англ. Betz cell) – крупные двигательные нейроны;
- Клетки Лугаро (англ. Lugaro cell) – интернейроны мозжечка;
- Средние шипиковые нейроны (англ. medium spiny neuron) – составляют полосатое тело;
- Клетки Пуркинье (англ. purkinje cell) – крупные нейроны, расположенные мозжечке, относятся к мультиполярным клеткам Гольджи I;
- Пирамидные клетки (англ. pyramidal cell) – нейроны с треугольной сомой, тип Гольджи I;
- Клетки Реншоу (англ. renshaw cell) – нейроны, связанные обоими концами с альфа-моторными нейронами;
- Униполярные микроворсинчатые (щеточные) клетки (англ. unipolar brush cell) – интернейроны с уникальным дендритом, заканчивающимся кистевидным пучком;
- Гранулярные клетки (англ. granule cell) – тип нейрона Гольджи II;
- Веретенообразные нейроны (англ. spindle neurons) – интернейроны, которые соединяют разные области мозга.
По функциональной активности
- Афферентные нейроны передают информацию от тканей и органов в центральную нервную систему и также называются сенсорными нейронами .
- Эфферентные нейроны (двигательные нейроны) передают сигналы от центральной нервной системы эффекторным клеткам.
- Интернейроны соединяют нейроны в определенных областях центральной нервной системы.
Афферентный и эфферентный также обычно относятся к нейронам, которые, соответственно, передают информацию или отправляют информацию от мозга.
Пирамидные нейроны как простейшие электрические диполи
Маленькие электрические токи всех дендритов одного нейрона суммируются по-разному в различных типах нейронов. Если нейрон — звездчатая клетка и возбуждающие синапсы покрывают множество дендритов, ориентированных в различных направлениях, суммарный ток на уровне клетки в целом будет близок к нулю, и суммарный потенциал, произведенный звездчатой клеткой, будет незначителен. Но если нейрон — пирамидная клетка и возбуждающие синапсы расположены на апикальных дендритах, суммарный ток пирамидной клетки будет направлен вдоль апикального дендрита, и нейрон может быть представлен как маленький диполь с отрицательным полюсом в апикальном дендрите и с положительным полюсом в базальной части нейрона (рис. 1). Также, если возбуждающие синапсы активизированы на соме и базальных дендритах нейрона, нейрон становится диполем, который заряжен отрицательно в соме и положительно — в апикальном дендрите.
А. Пирамидная клетка с длинным апикальным дендритом. Б. Звездчатая клетка. На этом примере поток Na* внутрь клетки вызван связыванием молекул возбуждающего медиатора глутамата с рецепторами дендрита. Обратите внимание, что ионные токи в пирамидной клетке формируют отдельный диполь, в то время как ионные токи в звездчатой клетке формируют вне клетки нулевое поле.
ЭЭГ — это результат общей электрической активности пирамидных нейронов, то есть суммирования сотен тысяч маленьких диполей, соответствующих этим пирамидным нейронам. Диполи образованы локальными токами, которые связаны с возбуждающими и тормозными постсинаптическими потенциалами. Возбуждающие постсинаптические потенциалы деполяризуют мембрану, приближая ее к порогу возникновения спайка, и делают выше вероятность овершута (перезарядки мембраны при возникновении ПД). Тормозные постсинаптические потенциалы гиперполяризуют мембрану, уводя ее от порога генерации спайка, и таким образом уменьшают вероятность перезарядки.
Продолжительность постсинаптических потенциалов в десять раз больше продолжительности отдельного спайка. Как мы знаем, продолжительность постсинаптического потенциала зависит от типа соединения рецептора-медиатора, но длится по крайней мере 20—30 мс, что соответствует частоте 30—50 Гц. Продолжительность спайка — приблизительно 1 мс, что соответствует частоте 1000 Гц.
Кроме того, пространство, занятое синапсами, где производятся постсинаптические потенциалы, намного больше, чем пространство, занятое аксональным бугорком, где возникают спайки. Из этих двух факторов следует, что постсинаптические потенциалы играют критическую роль в генерации электрических потенциалов, регистрируемых со скальпа в диапазоне частот 0-70 Гц и известных как электроэнцефалограмма.
Дипольная структура внутри корковых потенциалов экспериментально демонстрируется, когда локальные электрические потенциалы, измеренные в различных корковых слоях посредством сетки микроэлектродов, помещенных в кору, показывают явную смену полярности потенциала в средних слоях коры. Эти внутрикорковые диполи производят скальповые потенциалы, которые могут быть вычислены согласно законам физики. Проблема вычисления скальповых потенциалов от известных внутрикорковых диполей известна как прямая задача.
Синхронизация нейронных элементов — другой фактор, который определяет скальповый электрический потенциал. Интуитивно понятно, что для того чтобы возник существенный потенциал на относительно отдаленном расстоянии от корковых слоев (на поверхности скальпа), нейроны должны быть не только должным образом ориентированы, но они должны работать вместе, синхронно. Например, область источника эпилептического спайка, который внезапно перекрывает фоновую электрическую активность головного мозга, была экспериментально оценена приблизительно в 2000 мм2, в то время как для других элементов ЭЭГ может быть достаточно кластера в 40—200 мм2. Так или иначе синхронизация нейронных элементов на расстоянии десятков миллиметров — необходимый фактор для возможности регистрации элементов ЭЭГ со скальпа.
Электрическая активность нейрона
Потенциал покоя
Мембрана нейрона за счет избирательной проницаемости для различных ионов и работы специальных устройств — «ионных насосов» — постоянно поддерживает разницу концентрации ионов1. В основном разница концентрации поддерживается для Na+ и К+: концентрация Na+ внутри клетки в 150 раз меньше, чем на ее поверхности. В результате между наружной и внутренней поверхностями мембраны образуется разность потенциалов — потенциал покоя (ПП). Введя микроэлектрод внутрь клетки, потенциал покоя можно измерить. В нервной клетке он составляет около -60 … —70 мВ, внутренняя поверхность мембраны заряжена отрицательно относительно наружной. Наличие разности потенциалов между внутриклеточной и внеклеточной средой обозначают термином «поляризация».
Потенциал покоя является тем базовым уровнем, от которого измеряются изменения поляризации мембраны в результате процессов возбуждения и торможения. Увеличение амплитуды потенциала покоя называется гиперполяризацией, а уменьшение — деполяризацией. Флюктуация уровня поляризации идет на мембране постоянно в основном в результате синаптического взаимодействия с другими нейронами.
Потенциал действия
Импульсная активность нейронов связана с процессом генерации потенциала действия (ПД). Потенциал действия возникает при снижении заряда мембраны до некоторого критического уровня — критического уровня деполяризации. В этот момент наступает электрический «пробой» мембраны: открываются ионные каналы, ток Na+ устремляется внутрь клетки. В результате лавинообразного тока ионов генерируется ПД. Потенциал действия имеет очень высокую амплитуду по отношению к исходному уровню поляризации. Уровень ПП составляет — 60 мВ, а при генерации ПД заряд мембраны меняется на противоположный (овершут) и достигает порядка +70 … +120 мВ. ПД имеет длительность порядка 1—2 мс. Восстановление исходного уровня поляризации участка мембраны, на котором произошла генерация ПД, обеспечивается работой ионных насосов, которые восстанавливают исходный уровень градиентов концентрации ионов. В этот период мембрана становится невозбудимой — рефрактерной и генерация следующего потенциала действия невозможна.
Потенциал действия подчиняется закону «все или ничего»: он либо генерируется при достижении критического уровня деполяризации мембраны, либо не возникает, если уровень локального изменения поляризации недостаточен. Во втором случае наблюдаются градуальные электрические реакции, которые представляют собой ПСП. В зависимости от вида медиатора выделяют возбуждающие и тормозные синапсы. Типичными возбуждающими синапсами являются, например, холинергические, адренергические. Основным тормозным медиатором в ЦНС выступает гамма-аминомасляная кислота (ГАМК). При выделении в синаптическую щель возбуждающего медиатора на постсинаптической мембране возбуждающего синапса происходит градуальная деполяризация — генерируется возбуждающий постсинаптический потенциал (ВПСП). В тормозном синапсе происходит гиперполяризация мембраны, соответственно, генерируется тормозный постсинаптический потенциал (ТПСП). ПСП отличаются от потенциала действия локальностью возникновения, декрементным (затухающим) распространением по мембране, сравнительно малой амплитудой (не более 20—40 мВ), а главное — большой длительностью (до 20—50 мс). Перечисленные свойства ПСП обеспечивают возможность суммации градуальных потенциалов во времени и пространстве, обеспечивая процессы интеграции на уровне нейрона.
Итак, на уровне нейрона можно выделить два вида электрических процессов: генерация импульсной активности (потенциал действия) и градуальные изменения поляризации (ПСП). Как следует из изложенного выше, ПД представляет собой значительно более редкое событие, чем градуальные потенциалы. Приблизительное соотношение между вероятностью этих событий можно получить из следующего сопоставления. Средняя частота генерации ПД нейроном составляет около 10 в секунду. Но по каждому из синаптических окончаний к дендритам и соме нейрона притекает соответственно, в среднем, 10 синаптических воздействий за секунду. На поверхности дендритов и сомы одного коркового нейрона могут оканчиваться до нескольких тысяч синапсов. В результате объем синаптической бомбардировки одного нейрона, а соответственно, и вероятность возникновения градуальных реакций, превосходит вероятность генерации ПД в несколько десятков тысяч раз. Кроме того, длительность ПСП в 50—100 раз превышает длительность ПД.
Таким образом, перечисленные основания позволяют считать, что основу суммарной ЭЭГ составляют соматодендритные ПСП нейронов коры.
Ритмическая активность нейронов
Ритмическая активность на микроуровне вызвана генерацией потенциала действия, в результате изменения заряда мембраны. Нейроны генерируют множественные последовательные потенциалы – пачки спайков (spike trains), которые являются основой для нейронного кодирования и передачи информации в мозге. Они формируют все виды паттернов.2 Помимо стандартной колебательной активности одиночные нейроны способны генерировать регулярный паттерн подпороговых колебаний мембранного потенциала (англ. regular pattern of SMPO), что не сопровождается формированием потенциала действия. Это происходит, когда постсинаптический потенциал не смог достигнуть порога возбудимости нейрона и не активировал его, либо это может быть связано со спонтанными изменениям потенциала нейронов. Характеризуется средней частотой 86 Гц и средней амплитудой 3,3 мВ.
На мезоуровне происходит взаимодействие больших нейронных популяций между собой через связи головного мозга, здесь же в коре головного мозга обрабатывается сенсорная информация, которая вовлекает в себя подкорковые структуры, для чего необходима тесная связь между этими областями. Популяция нейронов может запускаться вместе либо реагируя на входной перцептивный или выходной моторный импульс, либо из-за синаптических взаимодействий. Благодаря синаптическим взаимодействиям паттерны возбуждения различных нейронов синхронизируются, что вызывает изменение ритма биоэлектрической активности мозга, при этом если импульс пришел в одну фазу, то сигнал усиливается, а если в разные, то наоборот ослабевает. Синхронизированные паттерны импульсов одной нейронной популяции приводит к синхронизации других областей коры, что вызывает высокоамплитудные колебания потенциала локального поля (LFP). Синхронная деятельность нейронов является главным условием для формирования колебательной активности мозга. В ином случае, если одна популяция нейронов отправит другой недостаточной силы импульс, либо он придет, когда часть нейронов еще находится в рефрактерном периоде, то вторая популяция не сможет поддержать возбуждение, и волна в итоге затухает. Контролируется это эндогенно через локальные взаимодействия между возбуждающими и тормозными нейронами. В частности, тормозные интернейроны играют важную роль в создании нейронно-ансамблевой синхронии, создавая узкое окно для эффективного возбуждения и ритмически модулируя частоту испускания импульсов возбуждающих нейронов.3
Неритмическая активность нейронов
➥ Основная статья: Шум в биоэлектрической активности мозга
На уровне нейронов неритмическая активность может быть связана с молекулярными и синаптическими взаимодействими. Поток ионов через открытые ионные затворы вызывает 1/f-шум (также розовый шум, фликкер-шум или избыточный шум), что видно из спектральной плотности мощности (PSD) мембранного потенциала.
Регистрация активности нейронов
➥ Основная статья: Регистрация активности нейронов
Одним из самых распространенных методов регистрации активности нейронов является электроэнцефалография. Связь ЭЭГ с элементарными электрическими процессами на уровне нейрона, безусловно, нелинейная. Предполагается, что ЭЭГ является результатом сложной суммации электрических потенциалов целостного нейронного ансамбля. Расчетным путем установлено, что активность, регистрируемая под одним электродом на поверхности головы, отражает суммацию постсинаптических потенциалов нейронов коры на площади 100—200 мм2 45.
Footnotes
- Электроэнцефалография : руководство / М. В. Александров, Л. Б. Иванов, С. А. Лытаев [и др.] / под ред. М. В. Александрова. — 3-е изд., перераб. и доп. — Санкт-Петербург: СпецЛит, 2020. — 224 с.
- Wang XJ (2010). “Neurophysiological and computational principles of cortical rhythms in cognition”. Physiol Rev. 90 (3): 1195–1268. doi:10.1152/physrev.00035.2008.
- Nunez PL, Srinivasan R (1981). Electric fields of the brain: The neurophysics of EEG. Oxford University Press.
- Бреже М. Электрическая активность нервной системы : пер. с англ. — М. : Мир, 1979. — 264 с.
- Кропотов Ю. Д. Количественная ЭЭГ, когнитивные вызванные потенциалы мозга человека и нейротерапия : пер. с англ. — Донецк : Издатель Заславский А. Ю., 2010. — 512 с.
В курсе лекций «Анатомия ЦНС для психологов» я уже писала об анатомической терминологии и нервной системе. В этой статье я решила рассказать о нервной ткани, ее особенностях, видах нервной ткани, классификациях нейронов, нервных волокон, типах глиальных клеток и многом другом.
Хочу напомнить, что все статьи в разделе «Анатомия ЦНС», я пишу именно для психологов, учитывая их программу подготовки. Я по своему опыту помню, как сложно и непривычно было изучать подобные темы во время своей учебы. Поэтому я стараюсь изложить весь материал наиболее понятно.
Содержание
- Нейроны
- Виды нейронов
- Нервные волокна и нервы
- Список черепно-мозговых нервов с обозначением доминирующих волокон
- Глия
Для начала, я советую посмотреть небольшое видео, в котором рассказывается о различных тканях человека. Но нас будет интересовать именно нервная ткань. В более красочном и наглядном виде вам будет легче усвоить основы, а потом вы сможете расширить свои знания.
Основной тканью, из которой образована нервная система является нервная ткань, которая состоит из клеток и межклеточного вещества.
Ткань — это совокупность клеток и межклеточного вещества, сходных по строению и выполняемым функциям.
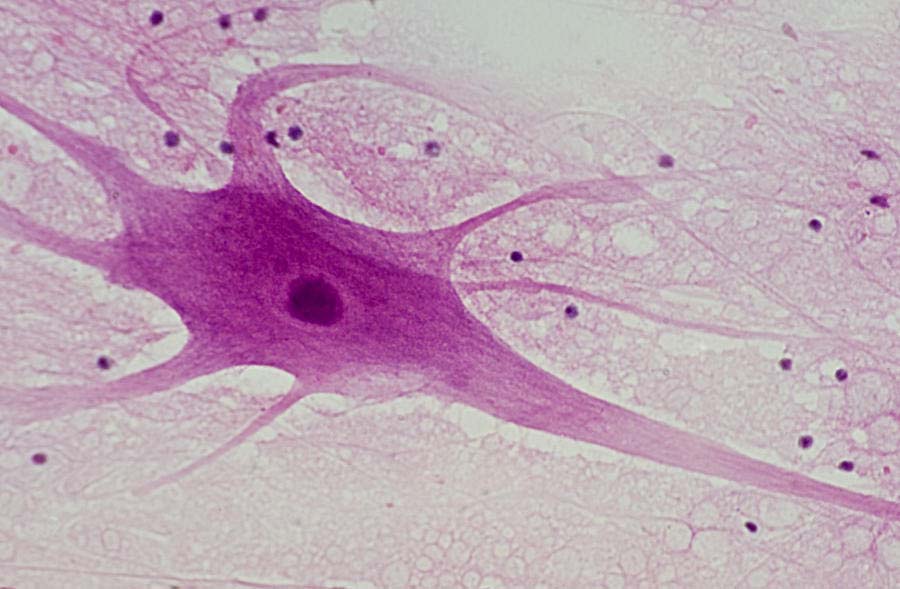
Нервная ткань имеет эктодермальное происхождение. Нервная ткань отличается от других видов ткани тем, что в ней отсутствует межклеточное вещество. Межклеточное вещество является производной глиальной клетки, состоит из волокон и аморфного вещества.
Функцией нервной ткани является обеспечение получения, переработки и хранения информации из внешней и внутренней среды, а также регуляция и координация деятельности всех частей организма.
Нервная ткань состоит из двух видов клеток: нейронов и глиальных клеток. Нейроны играют главную роль, обеспечивая все функции ЦНС. Глиальные клетки имеют вспомогательное значение, выполняя опорную, защитную, трофическую функции и др. В среднем количество глиальных клеток превышает количество нейронов в соотношении 10:1 соответственно.
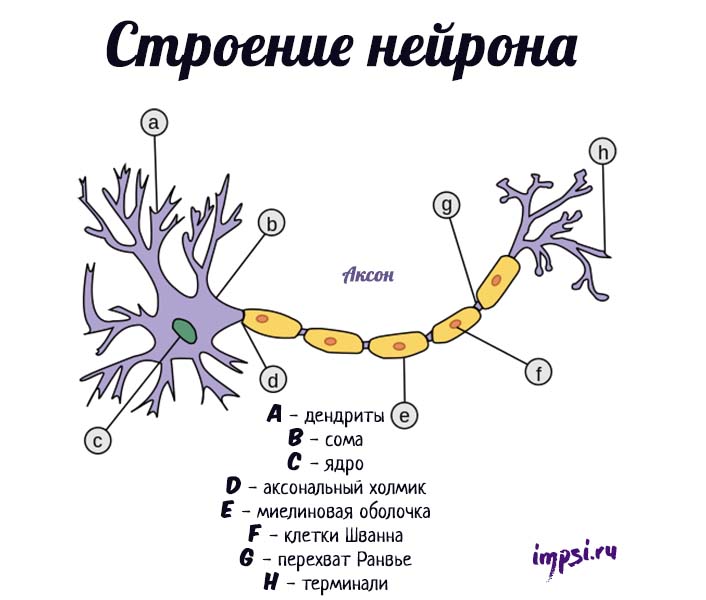
Каждый нейрон имеет расширенную центральную часть: тело — сому и отростки — дендриты и аксоны. По дендритам импульсы поступают к телу нервной клетки, а по аксонам от тела нервной клетки к другим нейронам или органам.
Отростки могут быть длинными и короткими. Длинные отростки нейронов называются нервными волокнами. Большинство дендритов (дендрон — дерево) короткие, сильно ветвящиеся отростки. Аксон (аксис — отросток) чаще длинный, мало ветвящийся отросток.
Нейроны
Нейрон — это сложно устроенная высокоспециализированная клетка с отростками, способная генерировать, воспринимать, трансформировать и передавать электрические сигналы, а также способная образовывать функциональные контакты и обмениваться информацией с другими клетками.
Каждый нейрон имеет только 1 аксон, длина которого может достигать несколько десятков сантиметров. Иногда от аксона отходят боковые отростки — коллатерали. Окончания аксона, как правило, ветвятся, и их называют терминалями. Место, где от сомы клеток отходит аксон, называется аксональным (аксонным) холмиком.
По отношению к отросткам сома нейрона выполняет трофическую функцию, регулируя обмен веществ. Нейрон обладает признаками, общими для всех клеток: имеет оболочку, ядро и цитоплазму, в которой находятся органеллы (эндоплазматический ретикулум, аппарат Гольджи, митохондрии, лизосомы, рибосомы и т.д.).

Кроме того, в нейроплазме содержатся органеллы специального назначения: микротрубочки и микрофиламенты, которые различаются размером и строением. Микрофиламенты представляют внутренний скелет нейроплазмы и расположены в соме. Микротрубочки тянутся вдоль аксона по внутренним полостям от сомы до окончания аксона. По ним распространяются биологически активные вещества.
Кроме того, отличительной особенностью нейронов является наличие митохондрий в аксоне как добавочного источника энергии. Взрослые нейроны не способны к делению.
Виды нейронов
Существует несколько классификаций нейронов, основанных на разных признаках: по форме сомы, количеству отростков, функциям и эффектам, которые нейрон оказывает на другие клетки.
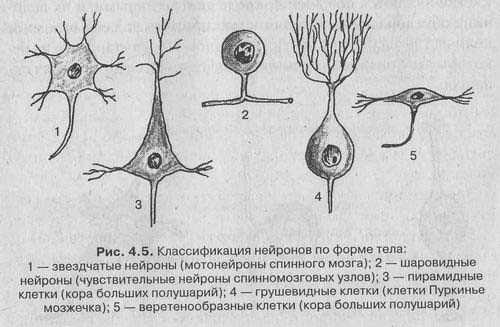
В зависимости от формы сомы различают:
1. Зернистые (ганглиозные) нейроны, у которых сома имеет округлую форму;
2. Пирамидные нейроны разных размеров — большие и малые пирамиды;
3. Звездчатые нейроны;
4. Веретенообразные нейроны.
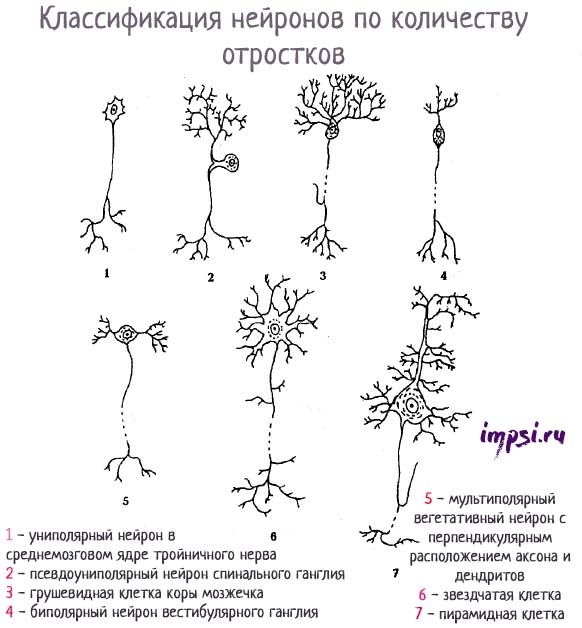
По количеству отростков (по строению)выделяют:
1. Униполярные нейроны (одноотростчатые), имеющие один отросток, отходящий от сомы клеток, в нервной системе человека практически не встречаются;
2. Псевдоуниполярные нейроны (ложноодноотростчатые), такие нейроны имеют Т-образный ветвящийся отросток, это клетки общей чувствительности (боль, изменения температуры и прикосновение);
3. Биполярные нейроны (двухотростчатые), имеющие один дендрит и один аксон (т.е. 2 отростка), это клетки специальной чувствительности (зрение, обоняние, вкус, слух и вестибулярные раздражения);
4. Мультиполярные нейроны (многоотростчатые), которые имеют множество дендритов и один аксон (т.е. много отростков); мелкие мультиполярные нейроны являются ассоциативными; средние и крупные мультиполярные, пирамидные нейроны — двигательными, эффекторными.
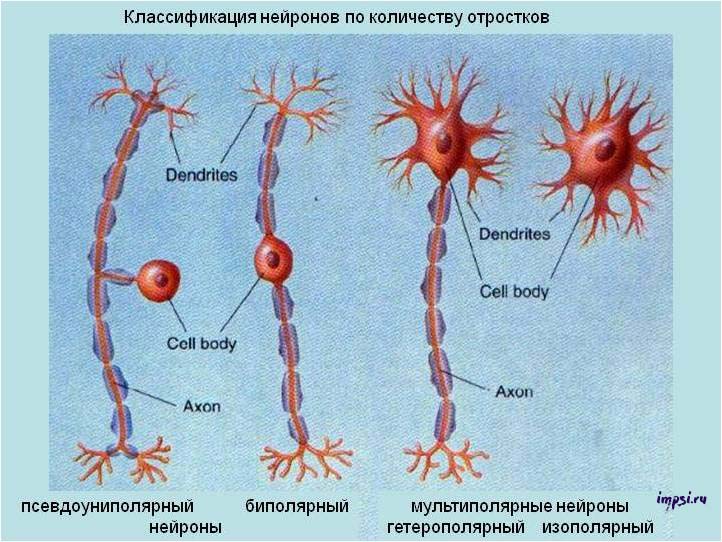
Униполярные клетки (без дендритов) не характерны для взрослых людей и наблюдаются только в процессе эмбриогенеза. Вместо них в организме человека имеются псевдоуниполярные клетки, у которых единственный аксон разделяется на 2 ветви сразу же после выхода из тела клетки. Биполярные нейроны имеются в сетчатке глаза и передают возбуждение от фоторецепторов к ганглионарным клеткам, образующим зрительный нерв. Мультиполярные нейроны составляют большинство клеток нервной системы.
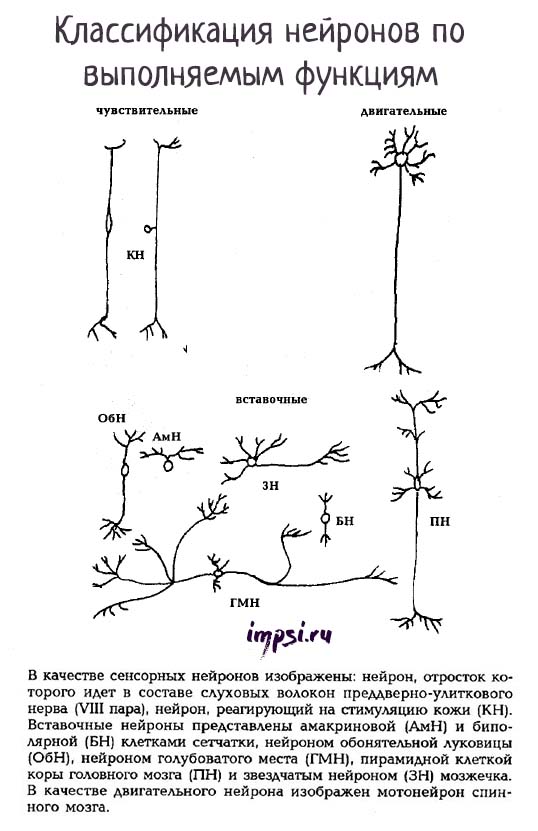
По выполняемым функциям нейроны бывают:
1. Афферентные (рецепторные, чувствительные) нейроны — сенсорные (псевдоуниполярные), их сомы расположены вне ЦНС в ганглиях (спинномозговых или черепно-мозговых). По чувствительным нейронам нервные импульсы движутся от периферии к центру.
Форма сомы — зернистая. Афферентные нейроны имеют один дендрит, который подходит к рецепторам (кожи, мышц, сухожилий и т.д.). По дендритам информация о свойствах раздражителей передается на сому нейрона и по аксону в ЦНС.
Пример чувствительных нейронов: нейрон, реагирующий на стимуляцию кожи.
2. Эфферентные (эффекторные, секреторные, двигательные) нейроны регулируют работу эффекторов (мышц, желез и т.д.). Т.е. они могут посылать приказы к мышцам и железам. Это мультиполярные нейроны, их сомы имеют звездчатую или пирамидную форму. Они лежат в спинном или головном мозге или в ганглиях автономной нервной системы.
Короткие, обильно ветвящиеся дендриты воспринимают импульсы от других нейронов, а длинные аксоны выходят за пределы ЦНС и в составе нерва идут к эффекторам (рабочим органам), например, к скелетной мышце.
Пример двигательных нейронов: мотонейрон спинного мозга.
Тела чувствительных нейронов лежат вне спинного мозга, а двигательные нейроны лежат в передних рогах спинного мозга.
3. Вставочные (контактные, интернейроны, ассоциативные, замыкающие) составляют основную массу мозга. Они осуществляют связь между афферентными и эфферентными нейронами, перерабатывают информацию, поступающую от рецепторов в центральную нервную систему.
В основном это мультиполярные нейроны звездчатой формы. Среди вставочных нейронов различают нейроны с длинными и короткими аксонами.
Пример вставочных нейронов: нейрон обонятельной луковицы, пирамидная клетка коры головного мозга.
Цепь нейронов из чувствительного, вставочного и эфферентного получила название рефлекторной дуги. Вся деятельность нервной системы, по определению И.М. Сеченова, носит рефлекторный характер («рефлекс» – обозначает отражение).
По эффекту, который нейроны оказывают на другие клетки:
1. Возбуждающие нейроны оказывают активизирующий эффект, повышая возбудимость клеток, с которыми они связаны.
2. Тормозные нейроны снижают возбудимость клеток, вызывая угнетающий эффект.
Нервные волокна и нервы
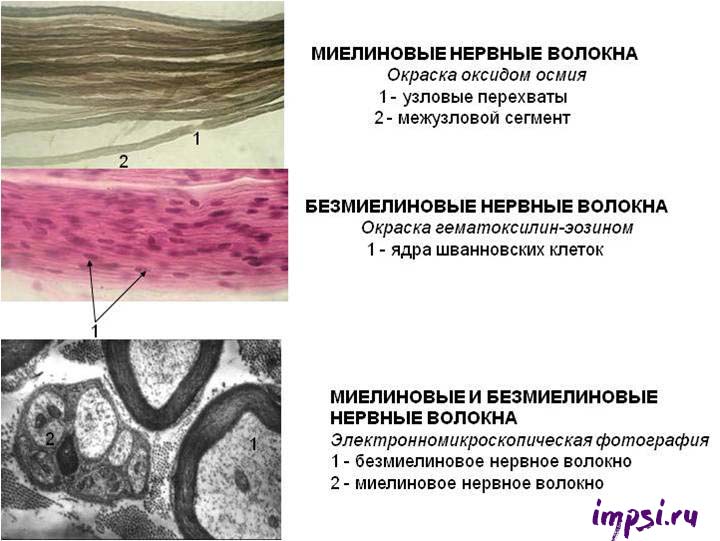
Нервные волокна — это покрытые глиальной оболочкой отростки нервных клеток, осуществляющие проведение нервных импульсов. По ним нервные импульсы могут передаваться на большие расстояния (до метра).
Классификация нервных волокон основана на морфологических и функциональных признаках.
По морфологическим признакам различают:
1. Миелинизированные (мякотные) нервные волокна — это нервные волокна, имеющие миелиновую оболочку;
2. Немиелинизированные (безмякотные) нервные волокна — это волокна, не имеющие миелиновой оболочки.
По функциональным признакам различают:
1. Афферентные (чувствительные) нервные волокна;
2. Эфферентные (двигательные) нервные волокна.
Нервные волокна, выходящие за пределы нервной системы, образуют нервы. Нерв — это совокупность нервных волокон. Каждый нерв имеет оболочку и кровоснабжение.
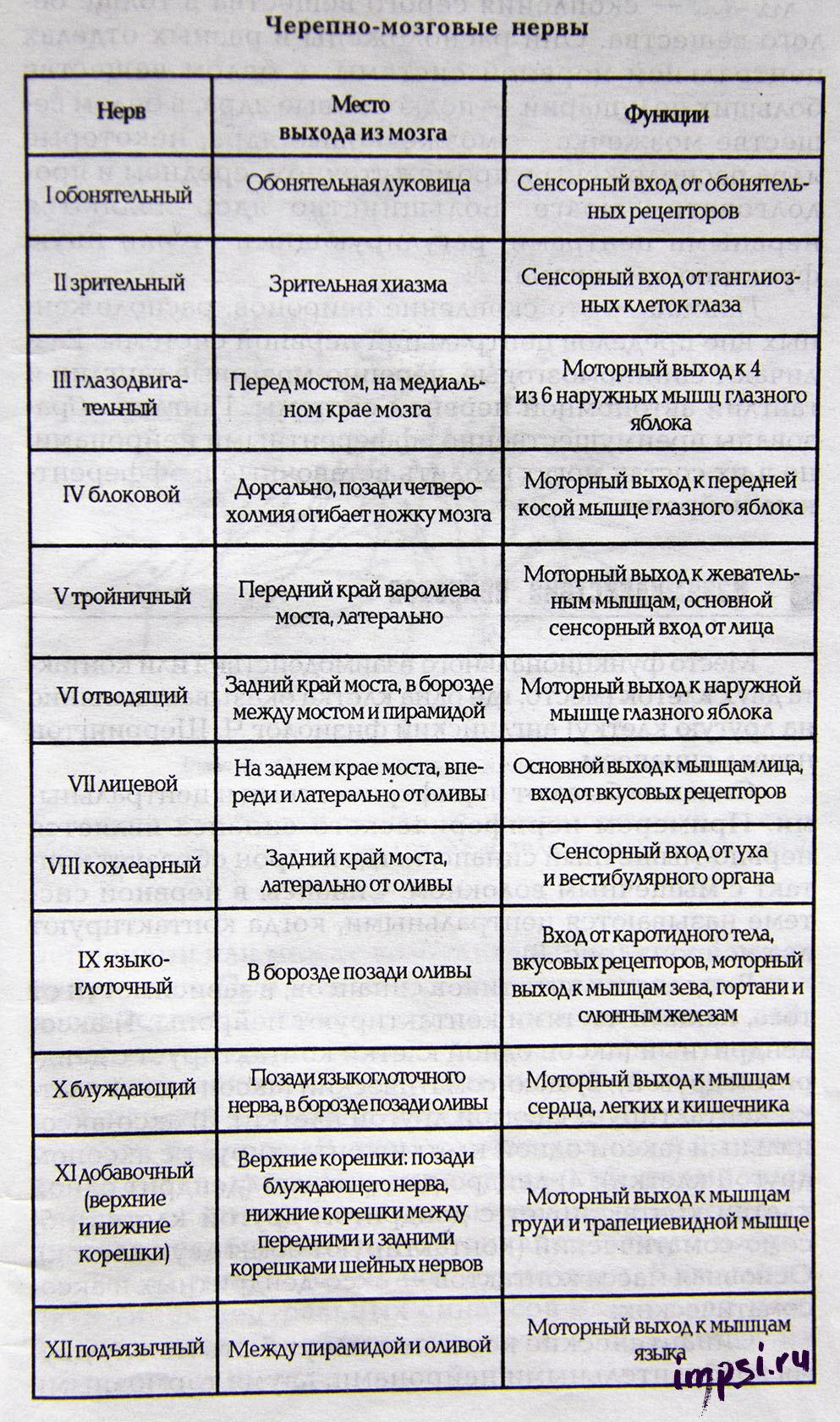
Различают спинномозговые нервы, связанные со спинным мозгом (31 пара), и черепно-мозговые нервы (12 пар), связанные с головным мозгом. В зависимости от количественного соотношения афферентных и эфферентных волокон в составе одного нерва различают чувствительные, двигательные и смешанные нервы (см. таблицу ниже).
В чувствительных нервах преобладают афферентные волокна, в двигательных — эфферентные, в смешанных — количественное соотношение афферентных и эфферентных волокон приблизительно равно. Все спинномозговые нервы являются смешанными нервами. Среди черепно-мозговых нервов выделяют три вышеперечисленных типа нервов.
Список черепно-мозговых нервов с обозначением доминирующих волокон
I пара — обонятельные нервы (чувствительные);
II пара — зрительные нервы (чувствительные);
III пара — глазодвигательные (двигательные);
IV пара — блоковые нервы (двигательные);
V пара — тройничные нервы (смешанные);
VI пара — отводящие нервы (двигательные);
VII пара — лицевые нервы (смешанные);
VIII пара — вестибуло-кохлеарные нервы (чувствительные);
IX пара — языкоглоточные нервы (смешанные);
X пара — блуждающие нервы (чувствительные);
XI пара — добавочные нервы (двигательные);
XII пара — подъязычные нервы (двигательные).
Глия
Пространство между нейронами заполнено клетками, которые называются нейроглией (глией). По подсчетам глиальных клеток примерно в 5-10 раз больше, чем нейронов. В отличие от нейронов клетки нейроглии делятся в течение всей жизни человека.
Клетки нейроглии выполняют многообразные функции: опорную, трофическую, защитную, изолирующую, секреторную, участвуют в хранении информации, то есть памяти.
Выделяют два типа глиальных клеток:
1. клетки макроглии или глиоциты (астроциты, олигодендроциты, эпендимоциты);
2. клетки микроглии.
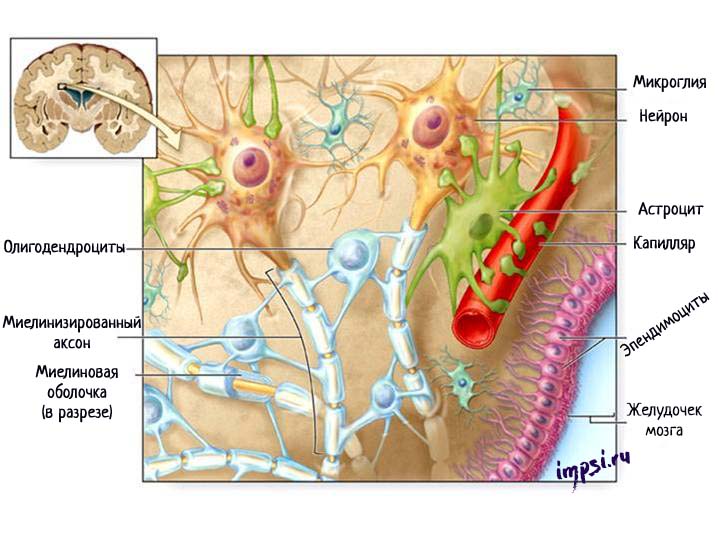
Астроциты имеют звездчатую форму и много отростков, которые отходят от тела клетки в разных направлениях, некоторые из них оканчиваются на кровеносных сосудах. Астроциты служат опорой для нейронов, обеспечивая их репарацию (восстановление) после повреждения, и участвуют в их метаболических процессах (обмене веществ).
Считается, что астроциты очищают внеклеточные пространства от избытка медиаторов и ионов, способствуя устранению химических «помех» для взаимодействий, происходящих на поверхности нейронов. Астроциты играют важную роль в объединении элементов нервной системы.
Таким образом, можно выделить такие функции астроцитов:
1. восстановление нейронов, участие в регенерационных процессах ЦНС;
2. удаление избытка медиаторов и ионов;
3. участие в формировании и поддержании гематоэнцефалического барьера (ГЭБ), т.е. барьера между кровью и тканью мозга; обеспечивается поступление питательных веществ из крови к нейронам;
4. создание пространственной сети, опоры для нейронов («клеточный скелет»);
5. изоляция нервных волокон и окончаний друг от друга;
6. участие в метаболизме нервной ткани — поддержание активности нейронов и синапсов.
Олигодендроциты — это мелкие овальные клетки с тонкими короткими отростками. Находятся в сером и белом веществе вокруг нейронов, входят в состав оболочек и в состав нервных окончаний. Олигодендроциты образуют миелиновые оболочки вокруг длинных аксонов и длинных дендритов.
Функции олигодендроцитов:
1. трофическая (участие в обмене веществ нейронов с окружающей тканью);
2. изолирующая (образование миелиновой оболочки вокруг нервов, что необходимо для лучшего проведения сигналов).
Миелиновая оболочка выполняет роль изолятора и увеличивает скорость проведения нервных импульсов вдоль мембраны отростков, предотвращает распространение на соседние ткани идущих по волокну нервных импульсов. Она сегментарна, пространство между сегментами называется перехват Ранвье (в честь ученого, который их открыл). Из-за того, что электрические импульсы проходят по миелинизированному волокну скачкообразно от одного перехвата к другому, такие волокна имеют высокую скорость проведения нервных импульсов.

Каждый сегмент миелиновой оболочки, как правило, образован одним олигодендроцитом в центральной нервной системе (Шванновская клетка (или клетки Шванна) в периферической нервной системе), которые, истончаясь, закручиваются вокруг аксона.
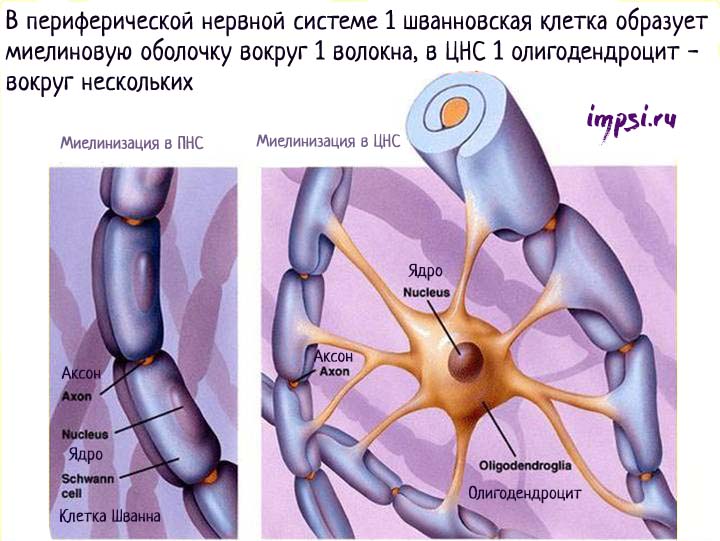
Миелиновая оболочка имеет белый цвет (белое вещество), так как в состав мембран олигодендроцитов входит жироподобное вещество — миелин. Иногда одна глиальная клетка, образуя выросты, принимает участие в образовании сегментов нескольких отростков.
Сома нейрона и дендриты покрыты тонкими оболочками, которые не образуют миелин и составляют серое вещество.
Т.е. миелином покрыты аксоны, поэтому они имеют белый цвет, а сома (тело) нейрона и короткие дендриты не имеют миелиновой оболочки, и поэтому они серого цвета. Вот так скопление аксонов, покрытых миелином, образуют белое вещество мозга. А скопление тел нейрона и коротких дендритов — серое.
Эпендимоциты — это такие клетки, которые выстилают желудочки мозга и центральный канал спинного мозга, секретируя спинномозговую жидкость. Они участвуют в обмене ликвора и растворения в нем веществ. На поверхности клеток, обращенных в спинномозговой канал, имеются реснички, которые своим мерцанием способствуют движению цереброспинальной жидкости.
Таким образом, функцией эпендимоцитов является секреция ликвора.
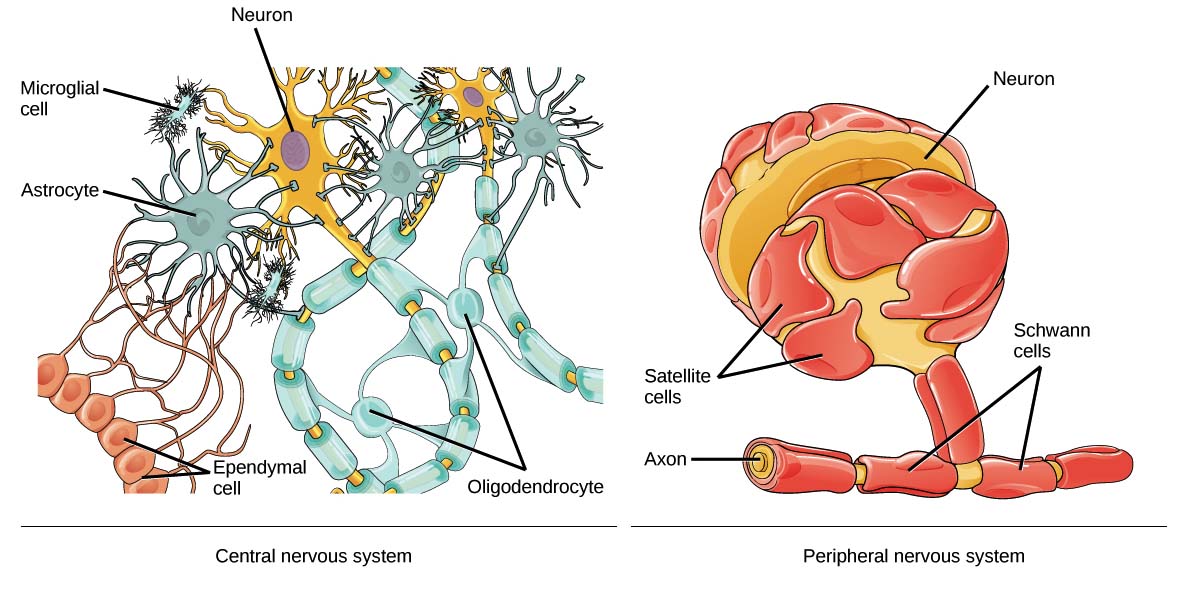
Микроглия — это часть из вспомогательных клеток нервной ткани, которая не является ею, т.к. имеет мезодермальное происхождение. Представлена мелкими клетками, которые находятся в белом и сером веществе мозга. Микроглия способна к амебовидному передвижению и фагоцитозу.
Функция микроглии — это защита нейронов от воспалений и инфекций (по механизму фагоцитоза — захватывание и переваривание генетически чужеродных веществ). Т.е. микроглия является «санитарами» нервной ткани.
Клетки микроглии доставляют нейронам кислород и глюкозу. Кроме того, они входят в состав гематоэнцефалического барьера, который образован ими и эндотелиальными клетками, образующими стенки кровеносных капилляров. Гематоэнцефалический барьер задерживает макромолекулы, ограничивая их доступ к нейронам.
Разделяй и властвуй
Импульсы плывут туда, куда ведут аксоны. Каждый аксон тонкой ниточкой выходит из тела своего нейрона, прокладывая линию связи от одного к другому. Когда мы говорим о соединении двух нейронов, может показаться, что аксон — это просто провод между нейронами, игрушечная телеграфная линия, две консервные банки на веревке. Но аксон — это не выделенная линия, передающая персональное сообщение одного нейрона единственному приватному адресату.
Аксон — извилистая структура, которая многократно раздваивается, яростно ветвится, извивается, скручиваясь и изворачиваясь. Аксон простой клетки, по которому мы несемся, следуя за нашим импульсом, впереди извивается и поворачивает, как быстрая река, разделяясь на протоки больше ста раз. От него отходят ветки, но расположены они неравномерно: одни находятся рядом с телом клетки, другие ответвляются в слоях, расположенных выше и ниже, некоторые — где-то вдалеке от нас. И он такой не один — большинство нейронов в коре головного мозга испускают извилистые заросли аксонов, покрывающих объем, который многократно превосходит размеры родительского нейрона вместе с его дендритным деревом. Поднимаясь над простой клеткой, мы видим возвышающиеся стволы ветвящихся аксонов пирамидальных нейронов третьего слоя. Они делятся сотни раз, одна длинная ветвь каскадом спускается мимо нас, а затем снова и снова расщепляется под нами в пространстве пятого слоя. У нас едва хватает времени осознать эту картину, как наш импульс налетает на первую развилку.
При каждом ветвлении импульс копируется, клонируется, отправляется в каждую новую ветвь, чтобы множество копий сообщения неслись по аксону всё дальше и дальше. Сотни разветвлений на пути вниз. Таким образом из одного импульса, исходящего из тела нейрона, создаются сотни клонов. А те в свою очередь вызывают высвобождение молекул нейромедиаторов в синаптических промежутках на конце каждой из ветвей, потому что соединения между нашим аксоном и дендритами других нейронов разбросаны по всей его длине. Периодически мы пролетаем мимо этих соединений, расположенных через каждые пять микрометров, упакованных настолько плотно, насколько позволяет размер их молекулярного механизма, и каждый готов к сбросу своего молекулярного заряда, чтобы вызвать всплеск напряжения на другой стороне. Мы проходим и через длинные отрезки аксона без единого разветвления, без связей с другими нейронами, часто до странности прямые, — это «магистрали» аксона, предназначенные для передачи импульса в другие зоны коры головного мозга, где вновь будет взрыв ветвления и извивов.
Достигнув конца аксона, наш импульс с помощью клонов успел вступить в контакт с тысячами других нейронов. По другую сторону большинства синаптических промежутков находится другой нейрон.
Таким образом бóльшая часть из примерно 7000 возбуждающих входов одного коркового нейрона принимает сигналы от разных аксонов, исходящих из разных нейронов.
Это означает, что каждый возбуждающий нейрон коры головного мозга через аксон осуществляет соединения примерно с 7000 различными нейронами, что возможно именно благодаря ветвлению и извилистости аксона, когда он изгибается и разделяется после каждого синаптического контакта, чтобы достичь новой цели.
Путем клонирования аксон одного нейрона передает импульс возбуждения тысячам принимающих его нейронов коры головного мозга. Знание, что это за получатели и где именно они расположены, может многое сказать нам о назначении этого нейрона. Чтобы разобраться, какое сообщение несет наш импульс, нам нужно знать две вещи о нейроне, который его отправил. Во-первых, на что реагирует этот нейрон, что в первую очередь вызвало его возбуждение — и мы знаем из предыдущей главы, что это был легион импульсов из сетчатки. Во-вторых, нам нужно понять, куда он отправляет этот импульс, кому тот передается. Ведь аксон может доставлять импульсы в любую область головного мозга. Он может разослать их адресатам по соседству, чтобы возбудить больше однотипных нейронов, то есть усилить и прояснить сообщение. Или, наоборот, унести свое сообщение очень далеко, через всю кору головного мозга, и попасть в дальние области, чтобы там объединиться с другими информационными импульсами, создавая всё более сложные представления и вычисления. Или на другую сторону, пересекая границу между полушариями, чтобы мозг работал слаженно.
По соседству
Первые адресаты нашего импульса — другие простые клетки. Здесь, на месте первого промежуточного пункта назначения, в толще коры головного мозга, в четвертом слое первичной зрительной области, нас окружают такие же простые нейроны. Аксон нашей клетки отходит от нее, извиваясь и многократно разветвляясь, каждая ветка переплетена с дендритными деревьями других простых клеток. И если мы проследим за каждым клонированным импульсом, бегущим к кончикам ветвей аксона и прыгающим через синаптические промежутки, то обнаружим, что многие простые клетки на другой стороне синапсов поразительно похожи на ту, которую мы только что покинули. Они реагируют на одни и те же вещи.
Вопреки своему названию простые клетки представляют собой эклектичное сборище. С одной стороны, они отображают упорядоченную карту видимого мира, исходящую от сетчатки, то есть соседние простые клетки реагируют на сигналы от соответствующих соседних участков окружающего мира.
С другой, десятки информационных каналов, исходящих из сетчатки, поступают в простые клетки, которые нас сейчас окружают. Тридцать с лишним каналов, свой для каждой отдельной зоны видимого пространства — для середины, левого и правого, верхнего и нижнего и т. п. Таким образом наборы простых клеток, сгруппированных вместе, озабочены разными вещами в одном и том же месте наблюдаемого мира: некоторые ждут сообщения о вертикальной линии, другие — о горизонтальной, третьи — под углом 120°; четвертые — 41,3°; некоторые — о краях, созданных пятном света сверху и темной областью снизу, другие — наоборот. И так для каждой возможной комбинации.
Получается, если бы наша простая клетка протянула свой аксон случайным образом, импульс с равной вероятностью попал бы на вход любой из этих эклектичных групп. Но это не так. Исследователи из лаборатории Томаса Мрсич-Флогеля в Университетском колледже Лондона в серии чрезвычайно остроумных экспериментов отслеживали локальные места назначения одиночных импульсов в этой первичной зоне зрительной области.
Они одновременно записывали сигналы сотен нейронов из зрительной коры головного мозга мышей, которые сидели в кинотеатре для мышей и смотрели слайд-шоу и фильмы, чтобы на основе этой активности определить, что из происходящего в пространстве видимого мира и где именно вызывает реакцию каждого нейрона. Узнав, что вызывает возбуждение каждого нейрона — настройку нейрона, — ученые в лаборатории Мрсич-Флогеля собирались установить, какие связи существуют между ними. Они перешли на тонкую и сложную технику регистрации каждого скачка напряжения от горстки нейронов, максимум четырех одновременно. Аккуратно подведя электроды непосредственно к мембране тела каждого нейрона, микроскопической точке в десятки раз меньше толщины человеческого волоса, они начали искать убедительные доказательства прямого соединения между этими нейронами, вызывая генерацию импульса одним из этих нейронов и проверяя наличие последующего скачка напряжения в остальных. Нет скачка — нет связи. Наличие точно регистрируемых всплесков в нейроне Берта после того, как стимулировано возбуждение с отправкой импульса нейроном Алеф, является чертовски убедительным доказательством того, что нейрон Алеф напрямую соединяется с нейроном Берта.
Обнаружив связь, Мрсич-Флогель и его команда могли вернуться к своим записям сотен сигналов мозга мышей, наслаждающихся фильмом, и спросить: на что эти нейроны реагируют в видимом мире?
Сложная работа с простым выводом: вероятность найти связь между двумя нейронами со сходной настройкой весьма велика. Нейроны, которые реагируют на очень похожие вещи в очень похожих местах в видимом мире, тоже, скорее всего, соединены друг с другом. И не просто соединены, а сильной связью. Потому что выяснилось, что сила сигнала между двумя одинаково настроенными нейронами, измеряемая амплитудой всплеска напряжения, также намного больше, чем можно было бы предсказать (рис. 4.1).
Наш импульс отправлен из простой клетки, которая реагирует на края под углом 30° в правом верхнем углу вашего поля зрения, где оказался кончик крышки коробки с печеньем. Эта радостная новость поступила к ней по множеству каналов, выходящих из сетчатки. Локальные ветви ее аксона разослали клоны нашего импульса соседним простым клеткам со сходной реакцией, с настройкой на 30-градусные края в правом верхнем углу видимого мира. И эти нейроны в ответ сделают то же самое, послав один из своих клонированных импульсов обратно тому нейрону, который мы только что покинули.
Работа лаборатории Мрсич-Флогеля продемонстрировала, как мы вместе с нашим импульсом оказались в нейронах, реагирующих на схожие вещи в видимом мире, но не объяснила, почему так происходит. Однако это довольно просто. Как вы помните, чтобы инициировать один исходящий импульс, требуется легион входящих. Итак, если мы хотим, чтобы остальная часть мозга узнала о 30-градусных верхних правых краях, имеет смысл отправить как можно больше импульсов с одним и тем же сообщением, уговорить соседние нейроны посылать свои импульсы, которые присоединятся к нашему в предстоящем путешествии по коре головного мозга.
В этом четвертом слое коры головного мозга нас окружают не только простые клетки. Вокруг много других нейронов, которые реагируют на более сложные комбинации информации, исходящей от глаза; их остроумно назвали «сложными клетками».
Сложные клетки посылают импульсы, когда получают сигнал о том, на что настроены, — о комбинациях светлых и темных пятен. Причем каждая пара светлых и темных пятен находится под определенным углом.
Звучит знакомо? Действительно, простейшее объяснение того, как работает зрение, состоит в том, что сложные ячейки создаются путем объединения входных данных простых ячеек. Каждая простая ячейка является детектором признаков для одного типа границ, а сложная ячейка объединяет выходы нескольких таких детекторов в комбинацию границ. Поэтому клоны нашего импульса также поступают на входы сложных клеток, расположенных вокруг нас, неся сообщение об одной из простых особенностей мира, которые сложная клетка будет суммировать с другими сигналами.
Читайте также
Игра на нервах: как музыка действует на мозг
Эта аккуратная картинка пригодится для понимания принципов, но она не совсем точна. И простые, и сложные нейроны принадлежат континууму нервных клеток различной функциональности. Некоторые нейроны совсем примитивны — они реагируют только на один вид границы, расположенной под одним углом; другие — чрезвычайно сложные, вычисляющие результаты комбинаций простых. Но большинство находятся где-то посередине. Тем не менее все сказанное выше верно для любой клетки зрительной зоны; они с большей вероятностью будут связаны с другими нейронами, имеющими аналогичные настройки на аналогичные изображения в ближайшем окружении в видимом мире.
Olfactory Bulb Physiology
A.V. Masurkar, W.R. Chen, in Encyclopedia of Neuroscience, 2009
Introduction
The olfactory bulb is the first processing station in the central olfactory pathway. It receives olfactory nerve input from the sensory epithelium in the nose and sends mitral/tufted cell axonal output to the olfactory cortex. One critical determinant of olfactory bulb function is the nose-to-bulb projection. Olfactory sensory neurons expressing a given odor receptor gene project their axons into two or very few specific spherical structures called olfactory glomeruli. Such a unique sensory projection indicates that the glomerulus is a basic coding unit for olfactory signals. A single odorant activates one set of glomeruli that are distributed widely across the olfactory bulb surface. Different odorants activate distinct but overlapping sets of glomeruli. Thus, a central function of the olfactory bulb is to process odor coding patterns and relay processed odor codes to the higher olfactory brain centers.
Odor processing starts at the level of the olfactory glomerulus. Besides olfactory nerve terminals, the glomerulus is surrounded by hundreds of juxtaglomerular cells. It also receives dendritic projections from tens of mitral/tufted cells located more deeply. As mitral/tufted cells (and most juxtaglomerular cells) send their dendrites into only a single glomerulus for receiving olfactory nerve input, a glomerulus and its associated mitral/tufted and juxtaglomerular cells form a functional module. Thousands of glomerular modules serve as parallel channels for relaying odor signals throughout the olfactory bulb to the piriform cortex. Between these vertical or radial modules are two levels of horizontal circuits mediating lateral intermodular interactions. One is via short-axon cells in the glomerular layer, and the other is through mitral/tufted cell basal secondary dendrites in the external plexiform layer.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469016879
Myelin Structure and Biochemistry
Matthew N. Rasband, … Joyce A. Benjamins, in Basic Neurochemistry (Eighth Edition), 2012
Myelin affects axonal structure
Traditionally, the role of the myelin membrane has been relegated to its passive properties (increased transverse membrane resistance and decreased membrane capacitance). However, it is now appreciated that the myelin sheath also performs active functions such that the presence of a myelin sheath affects the structure of the axon that it surrounds (Trapp & Kidd, 2004), thereby optimizing its properties for transmission of action potentials by saltatory conduction. Therefore, one major role of the myelin sheath is to actively recruit ion channels and other axonal membrane proteins to specific, polarized locations along the axon. In general, myelinating glia provide factors that interact with axonal cell adhesion molecules to initiate assembly of these polarized domains (Schafer & Rasband, 2006). For example, in the PNS, Schwann cells secrete a protein called gliomedin that is an instructive signal for the assembly of Na+ channel clusters at nodes of Ranvier. On the extracellular side of the axonal membrane gliomedin binds to, and clusters, the axonal cell adhesion molecule neurofascin-186 (Eshed et al., 2005). Neurofascin-186 in turn functions as an attachment site for ankyrinG, which is found in the axonal cytoplasm. As ankyrinG accumulates at nascent nodes, Na+ and K+ channels are recruited to this scaffold and clustered in high density (Dzhashiashvili et al., 2007). Lastly, this entire protein complex is linked to the actin cytoskeleton through ankyrinG binding to βIV spectrin. While all of these same axonal proteins are found at CNS nodes, the glial derived signals that initiate nodal assembly in the CNS remain unknown.
The myelin sheath actively sculpts the membrane protein composition along the entire length of the axon, not just at nodes of Ranvier. Adjacent to the nodes are the paranodes, with their own unique sets of axonal and glial cell adhesion molecules (see below) and cytoskeletal scaffolding proteins. Paranodes themselves can function as a lateral membrane diffusion barrier, restricting proteins to distinct membrane domains. Flanking each paranode is another region called the juxtaparanode. This domain is enriched in a different class of voltage-gated K+ channels, the Kv1 family of channels. Like the Na+ channels at nodes of Ranvier, they are recruited to juxtaparanodes through interactions with axonal cell adhesion molecules, cytoskeletal scaffolds, and glial cell adhesion molecules (Poliak et al., 2003). The majority of the length of the myelinated axon is internode. Although this domain is not enriched in voltage-gated ion channels, a unique set of cell adhesion molecules and cytoskeletal proteins is also found in this region and these are organized by the overlying myelin sheath. Thus, myelin regulates the polarized organization of the axonal membrane. Figure 10-10 shows an example of a node of Ranvier labeled with antibodies to illustrate nodal, paranodal, and juxtaparanodal domains of myelinated axons.
Figure 10-10. A node of Ranvier from optic nerve, triple-labeled using antibodies against Na1 channels (green), Caspr (red), and Kv1.2 K+ channels (blue) to define nodal, paranodal and juxtaparanodal domains, respectively.
Another one of the effects of myelin is to increase axonal diameter by inducing biochemical changes in components of the axonal cytoskeleton such as neurofilaments (see Chapter 6). The effects of myelin on axonal structure imply that there are signaling mechanisms from myelin or myelin-forming glia to axons. A common theme, emerging from recent research on transgenic mice deficient in some of the myelin proteins described later in this chapter, is that, in addition to their roles in the structure of the myelin sheaths, several of them are necessary for the normal formation, maintenance and survival of the axons that are ensheathed.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123749475000109
Multipotent Adult Progenitor Cells
Rangarajan Sambathkumar, … Catherine M. Verfaillie, in Principles of Regenerative Medicine (Third Edition), 2019
Spinal Cord Injury
Multipotent adult progenitor cells and related cell types have been shown to modulate the inflammatory response after spinal cord injury, driving macrophages toward an alternatively activated phenotype and reducing the effects of the inhibitory glial scar [101,102]. DePaul et al. demonstrated that intravenous delivery of hMAPCs in an acute contusive spinal cord injury model reduced macrophage-mediated axonal cell death and decreased inflammation by homing MAPCs into the spleen. Functionally, improved recovery of locomotion and urinary function was documented that correlated with reduced macrophage infiltration and increased tissue sparing at the lesion site. Furthermore, the researchers reported a significant increase in arginase 1, a well-established marker of alternatively activated macrophages, in the acutely injured spinal cord. Biodistribution studies demonstrated that hMAPCs preferentially homed to the spleen. These results demonstrate that hMAPCs exert their primary effects in the periphery and support the hypothesis that hMAPCs alter the dynamics of the inflammatory response to central nervous system injury, ultimately leading to improved outcomes [103].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128098806000126
Hippocampus: Molecular Anatomy
C.L. Thompson, E.S. Lein, in Encyclopedia of Neuroscience, 2009
Hippocampal Interneurons
Inhibitory interneurons that use γ-aminobutyric acid (GABA) as their neurotransmitter form a diverse set of hippocampal cell types. At least 16 subtypes of interneurons exist in CA1 alone, with a remarkable diversity of morphological and physiological properties as well as distinct patterns of connectivity. For example, axo-axonal cells innervate the axon initial segment of large numbers of pyramidal neurons, putting them in position to strongly modulate action potential generation in those neurons. Several other cell types selectively innervate other interneurons, presumably evoking disinhibition in their target neurons.
Different interneuron subtypes are also distinguished by differential gene expression. Calcium-binding proteins, neuropeptides, and certain neurotransmitter receptors in particular are robustly and differentially expressed in different interneuron populations. CA1 expression patterns for most of the defined interneuron markers are shown in Figure 3, illustrating specificity of somal locations in the different sublaminae of CA1 but with highly overlapping patterns. Few, if any, interneuron classes are uniquely identified with current genetic markers, however, and are typically distinguished by a combination of characteristics including soma location, axonal and dendritic patterns of connectivity, and physiological response properties in addition to marker expression. These findings indicate, as for excitatory neuronal populations, that cellular phenotype is the product of the expression of complex combinations of gene products. Although it is possible that there exist single genetic markers that specifically delineate different interneuron populations, it seems highly likely that a set of genes may be necessary to identify a particular neuronal class.
Figure 3. Interneuron markers in CA1. Cellular localization patterns for a pan-GABAergic interneuron marker (Gad1) and a series of markers commonly used to define subtypes of hippocampal interneurons. Calb2, calretinin; Chrm2, cholinergic receptor, muscarinic 2, cardiac; Gad1, glutamic acid decarboxylase 1; NPY, neuropeptide Y; Pvalb, parvalbumin; Sst, somatostatin; VIP, vasoactive intestinal peptide; Vlut3, vesicular glutamate transporter 3. Sublaminae of CA1: stratum oriens, stratum pyramidale, stratum radiatum, and stratum lacunosum-moleculare. In situ hybridization data on adult mouse brain from the Allen Brain Atlas project at http://www.brain-map.org.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469018118
Pathophysiology of the Blood–Spinal Cord Barrier in Traumatic Injury
HARI SHANKER SHARMA, in Blood-Spinal Cord and Brain Barriers in Health and Disease, 2004
N. Spinal Cord Cell and Tissue Injury
Profound cellular reactions seen following spinal cord trauma can be divided into (a) acute and (b) chronic pathological changes (Schwab and Bartholdi, 1996; Stålberg et al., 1998; Winkler et al., 1998). The acute phase includes hemorrhages and edema demyelination, as well as axonal, neuronal, and glial cell injury (Gledhill et al., 1973; Crock and Yoshizawa, 1977; Sharma et al., 1993b,c,d). These acute changes are responsible for cyst formation followed by necrosis and infarction during the chronic pathological state, leading to permanent disability (Kao and Chang, 1977; Kao et al., 1977; Tator and Fehlings, 1991).
Early pathological changes are present within 15 min after SCI. The microcirculatory disturbances and microhemorrhages further spread during the first 2 h. Swelling of nerve cells and glial cells and demyelination or vesiculation of myelin spread both longitudinally and transversely across the injured spinal cord. These pathological changes continue up to 6 days, followed by severe necrosis, a process that leads to spinal cord autodestruction (Tator and Fehlings, 1991; Schwab and Bartholdi, 1996).
Electron microscopy of acute SCI shows granular dissolution of the axoplasm and vesicular disruption of myelin, particularly in the white matter (Balentine, 1988). The nerve cells show much electron-dense particles in the neuronal cytoplasm. Damage to cell membranes and vacuolation of the neuropil are frequent findings (see Schwab and Bartholdi, 1996). These cellular changes are progressive and spread throughout the spinal cord, leading to paraplegia and lifetime disability.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780126390117500279
The Structure of Myelinated Axons in the CNS
Claes Hildebrand Ph.D., Simin Mohseni Ph.D., in Multiple Sclerosis As A Neuronal Disease, 2005
a. The Juxtaparanodal Segment of the Myelinated Axon
The juxtaparanode is markedly different in PNS and CNS axons. In a thick myelinated PNS axon, this region extends some 35 μm in an abnodal direction from the paranode. In the juxtaparanodes of a large myelinated PNS axon, the axon and the Schwann cell form a complex structural relation, the axon-Schwann cell network, which is composed of axonal and Schwann cell processes containing lysosomes and residual bodies. In each juxtaparanode-paranode-node-paranode-juxtaparanode region, the network tends to be most prominent in the distal juxtaparanode. It has been suggested that the network takes care of (potentially injurious) material taken up by peripheral terminals and transported in a retrograde fashion toward the CNS. The transported material interacts with primary lysosomes so that secondary lysosomes form. Large myelinated CNS axons exhibit few axoglial networks and secondary lysosomes. Although such formations are prominent in the ventral root part of motor axons, they are lacking or weakly developed in the CNS segments of the same axons. Similarly, dorsal root ganglion axons show more robust network formations in their dorsal root part than in their dorsal column part (Gatzinsky and Berthold, 1990; Gatzinsky et al., 1997).
There is another major juxtaparanodal PNS/CNS difference. In large myelinated PNS axons the juxtaparanodal myelin sheath exhibits three to five longitudinal crests, with intervening furrows, which extend to a distance of about 40 μm from the node. Hence, the juxtaparanodal segment of the axon has a markedly noncircular shape. The axon-Schwann cell network resides on the axonal side of the crests. The furrows on the outside of the juxtaparanodal myelin sheath are filled with mitochondrion- and glycogen-loaded Schwann cell cytoplasm. These “mitochondrion bags” are continuous with the nodal Schwann cell processes (Berthold and Rydmark, 1995). Large myelinated CNS axons are devoid of any direct counterpart to the juxtaparanodal myelin crests and mitochondrion bags (Hildebrand, 1971).
As revealed by freeze-fracture EM, the juxtaparanodal region of CNS axons shows accumulations of large E-face particles, possibly representing K+ channels (Fig. 13B) (Arroyo and Scherer, 2000; Peles and Salzer, 2000). These accumulations show a sharp boundary toward the paranode and a gradually decreasing concentration in the direction of the unspecialized internodal segment. Such juxtaparanodal particle accumulations do not occur in PNS axons (Rosenbluth, 1983; Tao-Cheng and Rosenbluth, 1984). A detailed consideration of the molecular anatomy of the juxtaparanodal region is presented elsewhere (see Arroyo and Scherer, 2000; Peles and Salzer, 2000, and elsewhere in this volume).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012738761150002X
Injury and Repair: Retinal Remodeling
R.E. Marc, in Encyclopedia of the Eye, 2010
Progression
Remodeling kinetics are largely independent of the source of photoreceptor deafferentation and occur in distinct phases (Figure 1). In phase 1, neuronal and glial cells react to photoreceptor stress signals prior to photoreceptor death. In phase 2, neurons, glia, and microglia interact in the processes of photoreceptor death, outer nuclear layer (ONL) decimation, and formation of the glial seal, encapsulating the remnant retina. In phase 3, neural cells respond to deafferentation and non-neural cells form new cytoarchitectures in the remnant retina. The speed of these phases depends on the nature of the degeneration (Figure 2). Aggressive primary rod, cone–rod, or cone dystrophies, as well as RPE phagocytosis defects can rapidly transit phases 1 and 2 to extensive phase 3 remodeling. Slower photoreceptor degenerations (e.g., autosomal-dominant RP (adRP) models of rhodopsin mutations) can lead to extended periods of cone survival, delaying the onset of phase 3. In rodent models, the faster overall kinetics are partly due to the small eye and the likely constancy of cell–cell interaction areas. Greater loss of peripheral retina is tolerated in humans as long as the macula is spared.
Figure 1. Remodeling phases in the mammalian retina. Phase 0 is the normal retina prior to the onset of acquired or inherited defect stress. The mammalian retina uses separate cone (C) and rod (r) channels prior to converging on retinal GCs (G). Cone BCs receive cone input with either ionotropic sign-conserving glutamate receptors (solid circle) or metabotropic sign-inverting glutamate receptors (double circle), and drive ACs (A) and GCs which decode signals with sign-conserving glutamate receptors. Rod BCs receive rod input with metabotropic sign-inverting glutamate receptors and then drive glycinergic rod ACs, which fan their signals out to ON cone channels through gap junctions (resistor symbol) and OFF cone channels through glycine release decoded by inhibitory receptors (open circles). In phase 1, rod photoreceptors reprogram to either bypass rod BCs with new axons or retract their synapses. Rod BCs both retract dendrites and retarget some to adjacent cone pedicles. In phase 2, photoreceptors are lost and all BCs lose their dendrites. In phase 3, extensive rewiring, neuritogenesis, microneuroma formation, cell migration, and neuronal death occur.
Figure 2. Different forms of retinal degeneration express different kinetics. The abscissa is exponential in time in either postnatal or postlight exposure days. Light-induced retinal degeneration (LIRD) is fast with phase 1 stress appearing almost immediately and phase 2 photoreceptor death extending for a couple of weeks before patches of phase 3 remodeling begin. In the the Royal College of Surgeons (RCS) rat, photoreceptor debris build up in the subretinal space causes stress, but photoreceptor death is not complete for 3 months or more, after which extensive remodeling occurs. The triple mutation valine 20 → glycine, proline 23 → histidine, proline 27 → leucine GHL mouse model of autosomal-dominant RP (adRP) does not begin to show photoreceptor stress until opsin synthesis begins and slowly traverses phase 2 for nearly a year before phase 3 remodeling begins. In contrast, the rd1 model of autosomal-recessive RP (arRP) is already stressed at birth with phase 2 photoreceptor death reaching completion close to 90 days. Similarly the rodless–coneless (rdcl) mouse is a model of cone–rod dystrophy (CRD) and cell death actually begins prenatally. This model spends most of its life in phase 3.
Phase 1
The first evidence that remodeling precedes photoreceptor death was the demonstration that human rods harboring a rhodopsin defect were able to form new fascicles of axons, bypass their normal BC targets, and project into the ganglion cell (GC) layer prior to apoptotic stress and death. Some rodent model degenerations show the same ability. Furthermore, rodents with autosomal-recessive RP, such as the phosphodiesterase B 6 (Pdeb6rd1) mouse (the rd1 mouse), show truncated BC dendritic arbors and horizontal cell (HC) axonal fields long before photoreceptor death. MC stress signals and protective alterations in neuronal glutamate receptor expression in light-induced retinal degeneration (LIRD) albino rodents are activated within hours of light-stress onset and long before photoreceptor death.
Phase 2
The degenerations transition to extensive cell-autonomous and/or bystander photoreceptor death. The ONL is dismantled with the involvement of activated microglia and hypertrophic MCs. The details are poorly understood and may vary according to gene defect. For example, dominant mutations that impair rhodopsin trafficking may activate endoplasmic reticulum (ER) stress in several ways such as anomalous protein multimerization, inhibition of proteasome cycling, and activation of the unfolded protein response. This results in a slow dismantling of the ONL by sporadic apoptosis. Conversely, mutations of transduction pathways that trigger calcium-dependent apoptosis are faster and more coherent. In either case, photoreceptor apoptosis and migroglial-initiated bystander cytolysis may create debris zones that must be cleared. The mechanisms of such clearance are unknown. Phase 2 ends with the entombment of the remnant neural retina by a thick seal of distal MC processes similar to the normal outer limiting membrane, with extensive intermediate junctions between the processes. Though often termed a glial scar, there is no evidence that the seal involves astrocyte proliferation as in CNS glial scars. There are occasional breaks in the seal that are associated with phase 3 RPE and choroidal vascular invasion of the neural retina and neuronal escape into the choroid.
Phase 2+
In some degenerations, the death of rods is slow and seems to trigger variable bystander killing, leaving clusters of deconstructed cones with apparently functional synaptic contacts. This results in patches of retina suspended in late phase 2 (phase 2+) in a sea of phase 3 retina. The extent to which these preserve vision is unknown, but they definitely provide evidence that even marginal rescue of cones is a critical step if late-phase therapies are to be viable.
Phase 3
After loss of all photoreceptors, the stability of neuronal connectivity in the retina becomes progressively compromised through at least nine distinct processes (see below) including molecular reprogramming, individual cell rewiring, large-scale neuritogenesis, synaptogenesis and microneuroma formation, spontaneous self-signaling, neuronal migration to ectopic foci, progressive neuronal death, MC remodeling and altered gene expression, as well as RPE and vascular remodeling and migration. In severe degenerations, including human late-stage RP and geographic atrophy, the revision of the retina can be so severe that no visual function could ever be restored. In other cases, the neural retina survives but is likely to be so altered that upstream strategies such as subretinal implants, stem/progenitor cell transplants, or even fetal retinal transplants will likely not successfully deliver form vision. Further, there is increasing evidence that bionic implants and transplants do not stabilize phase 3 remodeling and may accelerate it.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123742032002207
Molecular Motors and Motility
B.E. Clancy, S.M. Block, in Comprehensive Biophysics, 2012
4.18.1.2 Discovery of Kinesin
The study of molecular motors has a rich history. Experiments to understand the function of the molecular motor found in muscle, myosin, can be traced back to 1864. Almost a hundred years later the first cytoskeletal motor, dynein, which moves on microtubules in the opposite direction to that of kinesin, was discovered in 1963.11 Before the discovery of kinesin, organelles were observed to move on filaments within the cytoplasm of most animal cells.12 This movement was directional, and ATP dependent, indicating that the movement was powered by an ATPase.13,14 Fast transport of organelles was observed in axonal cells, but the only known cytoskeletal molecular motor at the time, dynein, was not identified in those cells.14
In 1985 kinesin-1 was first purified from squid axons and optic lobes by Ron Vale and co-workers.15 Kinesin molecules were isolated from the squid giant axon by rigidly affixing them to microtubules using the nonhydrolyzable ATP analogue adenylyl-imidodiphosphate (AMP-PNP), which arrests processive movement.16 Although kinesin cannot move in the presence of this analogue, it still strongly binds to microtubules, allowing kinesin to be preferentially isolated from other material in the axoplasm. After the kinesin-covered microtubules were purified from solution, the motors were subsequently released from the microtubule through the addition of ATP. Purified kinesin was then attached to a microscope coverslip, where it was found to power the movement of microtubules with a velocity roughly equal to the previously observed speed of vesicle transport. The newly discovered protein was given the name kinesin, which originates from the Greek word kinein, meaning to move.
Kinesin-1 is a plus end-directed motor, and single kinesin motors have been observed to step processively along microtubules.17 During stepping, a kinesin molecule takes discrete steps of 8.2 nm along a microtubule,18 which corresponds to the distance between binding sites along a periodic protofilament. In vivo, cargoes are generally thought to be transported by multiple kinesins, but it has been found through single molecule experiments that an isolated kinesin can travel along a microtubule at a rate near 800 nm s−1 for a distance of roughly a micrometer before detaching.17 Dividing the processive run length by the step size yields roughly 100 stepping events before a detachment event. Since kinesin steps by alternating its twin catalytic heads between strong and weak microtubule binding states in the process of hydrolyzing ATP,19 this requires the enzymatic cycle of kinesin to be tightly regulated to ensure a high level of processivity.
Structurally, kinesin has a relatively simple architecture, especially when compared to the much larger molecular motors myosin and dynein. But even though kinesin is smaller than all other motors, it shares a structural motif in its catalytic domain that is common amongst many nucleotidases including GTP binding proteins (G proteins), and other motors including myosin and dynein, making it an attractive molecule to study due to the possibility of a common enzymatic mechanism.20 But despite the similarities in their catalytic domains, the mechanical and enzymatic behaviors of myosin and kinesin are still vastly different. The binding affinity for substrate at different nucleotide states is different for both motors, and it has become clear that myosin and kinesin use different conformational changes to translocate and perform work.21 Due to the importance of kinesin in many cellular functions, considerable experimental effort has been expended to understand the underlying kinetic mechanism of these molecular motors.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123749208004227
Clinical Neurophysiology: Basis and Technical Aspects
Manoj Raghavan, … Paul E. Barkhaus, in Handbook of Clinical Neurology, 2019
Nodes of Ranvier
In the normal NoR, the VGNaCs are localized at the node, whereas the VGKCs are primarily localized in the juxtaparanodal area. The myelin sheath attachments in the paranodal area need to be “tight” enough to prevent too much current from passing under them (Arancibia-Carcamo and Attwell, 2014; Zhang and Rasband, 2016). Physiologically, current does reach the juxtaparanodal region to activate VGKCs, but too much current to the juxtaparanodal area negates the resistance-increasing and capacitance-decreasing effects of myelin. Disruption of this architecture can lead to, or worsen, disease states. For example, in multiple sclerosis, disruption of myelin sheath attachments in the paranodal area results in more current to the juxtaparanodal region and less efficient, impaired AP propagation. Remyelination results in altered NoR structure and internodal length, either of which can result in slower AP propagation.
A brief review of the NoR is illustrative of the complexity of structures involved in saltatory conduction (Fig. 1.7). The membrane protein, NF186, is required for NoR formation (Griggs et al., 2017). NF186 functions as an attachment site of ankyrins (Ank), AnkG being predominant (Arancibia-Carcamo and Attwell, 2014; Zhang and Rasband, 2016). AnkG binds to the axonal cell membrane in the NoR and is required for clustering of VGNaCs at the node. The NF186–AnkG–VGNaC complex is connected to the cytoskeleton by way of βIV spectrin protein (Zollinger et al., 2015; Zhang and Rasband, 2016).
Fig. 1.7. Peripheral NoR. In the PNS, NoR formation is dependent on expansion of the NrCAM, gliomedin, and NF186 complex from adjacent Schwann cells until the complexes meet. VGNaCs are located in the NoR. VGKCs are predominantly in the juxtaparanode, but some are in the NoR.
© Dominic Fee, MD, with permission.
External factors influence VGNaC clustering and subsequent activation. These external factors are different between the PNS and CNS. In the PNS, Schwann cells secrete gliomedin that forms a protein complex with NF186 and the cell adhesion molecule (CAM), NrCAM (Griggs et al., 2017). Schwann cell microvilli form the edge of the NoR (Arancibia-Carcamo and Attwell, 2014; Griggs et al., 2017). In the PNS, the gliomedin–NF186–NrCAM complexes cluster on the microvilli and, through subsequent complex-binding, expand into the NoR. Eventually, the expanded complexes NF186–NrCAM from the two adjacent Schwann cells fuse and form the NoR (Zollinger et al., 2015).
In the CNS, paranodal junctions are formed prior to the clustering of NF186. Gliomedin is not secreted by oligodendrocytes, nor do oligodendrocytes have microvilli projections. Instead, NF186 interacts with four glial or neuronal derived extracellular matrix molecules in order to cluster. These proteins are brain-specific linkprotein 1, a cleaved form of NrCAM, and the two proteoglycans, versican and brevican (Zollinger et al., 2015; Griggs et al., 2017).
The paranodal junction formed by the Schwann cells in the PNS and oligodendrocytes in the CNS also influence NoR functioning. Various CAMs are present at the paranodal junction and influence its assembly. Disruption of the paranodal junction will affect AP propagation by alteration of clustering and distribution of VGNaCs and VGKCs (Arancibia-Carcamo and Attwell, 2014; Zollinger et al., 2015; Zhang and Rasband, 2016).
Different isoforms of many of the proteins mentioned can be encountered across different locations within the nervous system, as well as in disease states. There are at least 10 genes encoding VGNaCs and 70 genes encoding VGKCs that are known at this time (Miceli et al., 2015). Different VGNaCs are expressed during NoR development, but Nav1.2 is predominant. At maturation, Nav1.6 is predominantly expressed, and less frequently Nav1.1. As mentioned previously, the VGNaCs and VGKCs are not homogeneously distributed along the axonal membrane, but rather “cluster” at different regions of the node, paranode, and juxtaparanode complex. VGNaCs are in the NoR, whereas VGKCs such as Kv1 are in the juxtaparanodal region. There are some VGKCs in the NoR (e.g., KCNQ) (Arancibia-Carcamo and Attwell, 2014). These intrinsic properties and distribution of channels affect NoR functioning both in normal and in disease states.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444640321000011
Brain Extracellular Matrix in Health and Disease
Renato Frischknecht, … Constanze I. Seidenbecher, in Progress in Brain Research, 2014
4 Axon Initial Segment-specific ECM in Development and Plasticity
The AIS separates the somatodendritic compartment from the axon and is the site of axon potential initiation. It comprises a high density of several types of voltage-gated ion channels such as sodium channels (Nav1.2/1.6) and potassium channels (Kv1). Positioning and composition of the AIS are crucial for excitability of a neuron. The closer the AIS to the cell body, the lower the threshold to elicit axon potentials (Grubb and Burrone, 2010). Further, changes in channel properties, for example, due to auxiliary subunits or channel-binding proteins such as TNR or TNC, may also alter the threshold for action potential generation (Srinivasan et al., 1998). Aggrecan, brevican, neurocan, versican, and TNR were found at the AIS and comprise an ECM environment similar to the PNNs and CNS nodal ECM (Bruckner et al., 2006; Frischknecht et al., 2009; John et al., 2006; Susuki et al., 2013). It has previously been described that the PNN extends from the cell body to the AIS (Bruckner et al., 2006); however, the ECM of the AIS seems to be distinct from that of the PNNs. First, the AIS ECM can be observed at neurons without PNNs (Fig. 2; Hedstrom et al., 2007; John et al., 2006). Second, the AIS ECM staining has a more compact appearance compared to the PNN (Fig. 2; John et al., 2006). Third, degradation of HA removes the PNNs but not the AIS ECM, and finally, the components of the ECM are found at the AIS before the formation of the PNNs (Frischknecht et al., 2009). A central role for the assembly of the ECM at the AIS plays the axonal cell adhesion molecule neurofascin 186 kDa isoform (NF186), which directly binds to brevican, versican, and TNR (Hedstrom et al., 2007; Susuki et al., 2013; Volkmer et al., 1998). Therefore, at the AIS, unlike at other cellular compartments, the ECM seems to be surface-bound via direct interaction of the lectican-type CSPGs with NF186. Indeed, knockdown of NF186 abolishes staining for brevican and versican without affecting other components such as channel density or composition (Hedstrom et al., 2007; Susuki et al., 2013), indicating a role of NF186 in ECM recruitment but no direct role of the ECM in the assembly of the AIS. Noteworthy, AIS length and position are dynamic in the visual cortex during development and become stabilized only after the critical period when the mature ECM is formed (Gutzmann et al., 2014). The AIS has long been thought to be a rigid structure. Only recently has it been discovered that the AIS can be relocated to regulate excitability of a neuron in vitro and in vivo (Grubb et al., 2011; Kuba, 2012). Prolonged depolarization moves the AIS away from the cell bodies and thereby decreases neuronal excitability (Grubb and Burrone, 2010). This homeostatic adaptation of excitability depends on L-type voltage-gated calcium channels and the calcium-sensitive phosphatase calcineurin (Evans et al., 2013). These experiments have been performed during early stages of development, and hence, no mature ECM was present. To what degree these forms of homeostatic plasticity are still present in mature neurons with fully developed ECM thus remains to be investigated. It is possible that the ECM, like at synapses, acts as a stabilizing factor, and therefore, this form of plasticity may be limited in mature neurons.
Figure 2. Immunostaining of versican (Vcan) at the PNN and AIS. (A) A cultured mouse hippocampal neuron was stained for Vcan V0/V2 isoforms (GAGα domain, green), AnkG (labeling the AIS, red), and MAP2 (labeling the somatodendritic domain, blue). The grayscale image of Vcan V0/V2 staining is shown in (A′). (B) A P24 rat cortex was stained for Vcan (G1 domain, green) and AnkG (red). The grayscale image of Vcan staining is shown in (B′). The soma was not stained and appears as a black hole. Scale bar = 16 μm.
Further, positioning and composition of voltage- or ligand-gated ion channels within the neuronal membrane can regulate neuronal excitability. For instance, ECM-derived surface compartments hinder lateral diffusion of AMPA receptors to form an environment to guarantee specific synaptic properties. ECM removal leads to increased mobility of AMPA receptors and altered short-term plasticity (Frischknecht et al., 2009). Thus, modification of the ECM during homeostatic plasticity may allow for a rearrangement of ion channels, which alters the cell’s excitability. Indeed, reduced GABAergic perisomatic inhibition of CA1 neurons has been observed in TNR knockout mice and enzymatic ECM removal increases excitability of basket cells (Dityatev et al., 2007; Saghatelyan et al., 2001). Noteworthy, several ECM molecules have been implicated in the regulation of L-type calcium channels (Evers et al., 2002; Kochlamazashvili et al., 2010) and sodium channels (Srinivasan et al., 1998). Further, the ECM molecule thrombospondin may regulate calcium channel function via its interaction with α2δ1, the auxiliary subunit of voltage-gated calcium channels (Eroglu et al., 2009). Thus, there are several mechanisms that involve the ECM to regulate excitability during homeostatic plasticity. However, their exact role remains to be investigated.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444634863000049
Наш мозг – огромный мегаполис, дорожная инфраструктура которого напоминает связи и проводящие пути; по ним с огромной скоростью и частотой подобно спорткарам проносятся сигналы, а разные линии жилых районов имитируют различные уровни организации головного мозга. Здесь есть разделение труда, «неравноправие», доминирование, свои валюты и множество других вещей, которые так или иначе напоминают жизнь людей в крупном городе-миллионнике. Наша нервная система состоит из приблизительно 86 миллиардов нервных, и почти такого же количества (85 миллиардов глиальных клеток и от ста до пятисот триллионов синапсов (соединений). При этом она чрезвычайно разнолика и имеет в своём арсенале около сотни клеточных типов, которые способны строить тысячи связей между собой и создавать настоящие клеточные ансамбли.
В таком разнообразии очень легко запутаться, поэтому сегодня мы с вами разберём, что же именно отличает нервную ткань от других, какие клеточные варианты имеются в её составе, чем уникален нейрон и почему именно у нервной системы получается делать нас мыслящими.
Начнём с «внутренностей» нейрона
Как и любая нормальная клетка, он имеет ядро, цитоплазму и клеточную мембрану, которая обособляет его от внешней среды. Однако, это не всё. Нейрон – одна из немногих клеток, которая способна к генерации нервного импульса. О нём мы с вами поговорим в следующих выпусках, а сейчас стоит отметить лишь то, что такая возбудимость позволяет мозгу обрабатывать информацию, а нам — существовать.
У нейрона есть несколько характерных составных элементов, увидев которые вы никогда не спутаете его с другими клетками: это аксон— длинный отросток, по которому сигналы идут от перикариона, или тела, и дендриты – короткие отростки, по которым информация движется к нейрону от его соседей. Аксон, главный «кабель», покрыт «изоляцией», миелиновой оболочкой. Миелиновая оболочка аксонов есть только у позвоночных, а поскольку у нас явно есть позвоночник, то… Эту оболочку образуют «накручивающиеся» на аксон специальные шванновские клетки (в центральной нервной системе — олигодендроциты, несколько другой тип клеток, нежели шванновские), между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье.
Перикарион имеет в своём составе обычные для живых эукариотических (ядерных) клеток субъединицы: собственно ядро, гранулярную эндоплазматическую сеть (ЭПС), которая синтезирует белки и прочие нужные клетке вещества и окрашивается при специальной окраске в тёмный цвет, которым покрываются глыбки тигроида или субстанции Ниссля, которые можно разглядеть даже в световой микроскоп. Также здесь есть аппарат Гольджи или «накопительный резервуар», митохондрии — «энергетические станции», лизосомы с «пищеварительными» ферментами, рибосомы, благодаря которым происходит синтез белков, а также целая сеть внутреннего цитоскелета, в которую входят микротрубочки, особые частицы — MAP (протеины, ассоциированные с микротрубочками), а также нейрофиламенты (типа промежуточных нитей). Благодаря этому скелету в клетке протекает очень важный для неё перенос веществ от центра к периферии, что особенно актуально для длинного (порой до нескольких десятков сантиметров) аксона, который питается также от тела. Такой ток бывает аксональным быстрым (до 100-1000 мм/сутки) и медленным (1-3 мм/сутки), дендритическим (75 мм/сутки), а также движущимся в обратном направлении — ретроградным.
А теперь представим, что перед нами микроскоп, а на предметном столике – покрашенный одним из специфических способов (по Нисслю или импрегнацией серебром) срез мозга. Как определить, где в переплетении отростков аксоны, а где – дендриты? Посмотреть нужно на тигроид, о котором мы упоминали. Дело в том, что он в виде гранул «рассыпан» по всему телу и коротким отросткам, но никогда вы его не найдёте в отростке длинном. А заканчивается он в районе аксонального холмика – структуры, близкой к началу аксона, в которой начинается генерация импульса.
Нейрон снаружи
Теперь, когда мы разобрались, что внутри у нервных клеток, посмотрим на их внешнюю организацию и попробуем разобраться в функциональном разделении.
Вспомните, что мы говорили про один длинный аксон и короткие дендриты. Так вот, этот вид нейронов называется мультиполярным, и он — самый «популярный», однако, есть и другие: униполярные (всего один отросток), биполярные (два отростка) и псевдоуниполярные (один отросток, который потом делится на два). Есть и вовсе аполярные(«голые») нейроны. Это предшественники нервных клеток – нейробласты.
Интересно, что униполярные нейроны представлены у человека всего лишь в одном виде: амакриновыми клетками сетчатки глаза. Псевдоуниполярные встречаются гораздо чаще и составляют основную массу спинномозговых чувствительных узлов, о которых мы поговорим чуть позже. Биполярных тоже не так много, и их пул, главным образом, приходится на обонятельные рецепторные клетки. Ну а с мультиполярными и так всё понятно – это универсальные представители нервной системы (например, мотонейроны спинного мозга).
Но, при всей своей важности, строение – это всё же не функции. Каждый нейрон, представляя собой возбуждаемую и возбуждающую клетку (не путать с некими другими физиологическими процессами!), должен своим «настроением» делиться с соседями, иначе сигнал не дойдёт до адресата и не будет обработан и выполнен, что никого, конечно, не устраивает. Поэтому, подобно водителям, въезжающим на платную скоростную трассу, нейроны должны «заплатить», чтобы передать импульс дальше. Эта «валюта» существует в двух формах: электрической и химической. Второй случай — более частый. А контрольно-пропускные пункты с кассами на автомагистралях воплощаются в синапсах — местах передачи возбуждения с клетки на клетку, то есть местах соединения нейронов. Такие места образуются на специальных выростах на дендритах: дендритных шипиках. Они чаще всего бывают трёх видов: пеньковые, грибовидные и тонкие шипики. Но бывают и другие
Дендритный шипик — с его шейкой и головкой
Тонкий, грибовидный и пеньковый шипики
Какие же бывают синапсы?
Реже бывает так. Благодаря ионным каналам в мембране и плотным контактам клеток электрический сигнал без особых усилий перескакивает с нейрона на нейрон и «летит» дальше — пробок нет, оплата принята, водитель доволен. Но это — электрический синапс, или, как еще умничают нейробиологи, эфапс.
Электрические синапсы (эфапсы). а — коннексон (двойная пора) в закрытом состоянии; b — коннексон в открытом состоянии; с — коннексон, встроенный в мембрану; d — мономер коннексина (белка, из которого сделаны коннексоны), е — плазматическая мембрана; f — межклеточное пространство; g — промежуток в 2-4 нанометра в электрическом синапсе; h — гидрофильный канал коннексона.
Но намного чаще случаются ситуации, когда синапс имеет достаточно широкую щель – порядка десятков микрон. То есть перед водителем река, а переправляться придётся на пароме. Здесь вступает в силу химическая «валюта» в виде нейромедиатора, который накапливается в везикулах (пузырьках) пресинаптической мембраны, затем вырабатывается в эквивалентоном силе пришедшего импульса количестве, «переплывает» щель и принимается рецепторами на другом берегу – постсинаптической мебране. Вот он, универсальный язык нервной системы, а нейроны по типу нейромедиаторов делятся на холинергические, адренергические, ГАМК-ергические и некоторые другие (об этом читайте в следующих выпусках). Исходя из этого, действие, в зависимости от типа нейромедиатора, бывает либо возбуждающим, либо тормозным.
Химический синапс
Но и это ещё не всё! Есть нейроны чувствительные, которые воспринимают сигнал из внешней или внутренней среды, затем следующие за ними в центральную нервную систему — вставочные, которые обеспечивают ассоциацию в нейронных сетях и могут быть в единичном или множественном числе, и двигательные, которые завершают сигнал действием и иннервируют сократительные или секреторные элементы. Также их ещё можно назвать афферентными (восходящими, двигающимися к центру), интернейронами и эфферентыми (нисходящими, двигающимися к периферии).
«Серый кардинал» нервной системы
Мы поговорили о нейронах, но нельзя забывать и о другой, не менее важной части нервной системы – нейроглии, тем более, что она составляет половину объёма головного мозга и принимает чуть ли не основное участие (как выяснилось в последние годы) в регуляции синаптической передачи, усиливая либо ослабляя сигнал.
Так вот, вся глия по строению, функциям и расположению делится на эпендимную(выстилающую внутреннее пространство цереброспинального канала и желудочков мозга), макро— и микроглию.
Макроглия, в свою очередь, имеет в своём распоряжении целый веер различных подтипов и для центральной, и для периферической нервной системы. Так, в головном мозге она представлена астроцитами, название которых говорит само за себя (большие звёздчатые клетки с большим количеством отростков, которые оплетают нейроны и сосуды), а также олигодендроцитами, которые обеспечивают внутримозговые волокна миелином (по сути, наматываются отростками на аксон — мы уже упомянули о них), многократно увеличивающим скорость передачи импульса. Периферическая нервная система в основном обходится лишь шванновскими клетками, которые также миелинизируют волокна, но уже за пределами центра, и расходятся по всему организму. И ещё сюда добавляются так называемые мантийные глиоциты или сателлиты, которые образуют оболочку (мантию) вокруг тел нейронов в ганглиях (узлах). Микроглия представляет из себя собственную фагоцитарную систему головного мозга и активируется в основном тогда, когда в нём появляются патологические процессы.
Астроцит
Но нужно всё-таки подчеркнуть важность глии. Работы по её изучению ведутся не так много лет – буквально два последних десятилетия. Появилась такая рабочая гипотеза (автор — Филип Хейдон [Philip G. Haydon]), согласно которой астроциты, обмениваясь сигналами, активируют нейроны, чьи аксоны находятся от них не только на близком расстоянии, но и сравнительно далеко. Эта активация в итоге способствует высвобождению нейромедиаторов. Таким образом, астроциты регулируют готовность даже отдалённых синапсов к изменению своей эффективности, что представляет собой клеточную основу процессов памяти и обучения.
Сотрудники из лаборатории Бена Барреса (Ben A. Barres, Стэнфордский университет) пошли дальше и открыли специфический белок тромбоспондин астроцитарного происхождения, который стимулирует образование синапсов. Сравнение же головного мозга показывает, что чем более высокое положение занимают животные на «эволюционной лестнице», тем больше в их мозге глиальных клеток по отношению к нервным. Так вот, возможно, что увеличение связности астроцитов может даже повышать способность животных к обучению. Однако это ещё только предстоит доказать.
На острие чувств
В завершение нашего небольшого путешествия внутрь нервной системы разберёмся в том, откуда берутся наши ощущения. Оказывается, здесь строение нервного окончания также имеет самое непосредственное отношение к процессу. Нервные окончания могут располагаться в тканях свободно, могут оканчиваться специальными сенсорными рецепторами, а могут «заключаться» в соединительнотканную капсулу.
Тактильные «граждане» располагаются в слоях соединительной ткани внутренних органов и кожи. Большинство из них – механорецепторы (тактильные, пластинчатые тельца), которые реагируют на какие-либо механические воздействия. Например, тельца Руффини реагируют на растяжение кожи, тельца Пачини – на давление. Некоторые окончания в эпидермисе «заточены» под регистрацию изменений температуры (тепло – тельца Руффини, холод – колбы Краузе). Есть даже такие рецепторы, которые могут определять изменения рН, рО2 и рСО2.
Поперечное сечение телец Руффини
Для суставов и мышц есть свои детекторы чувств. К ним относятся мышечные веретёна, сухожильные органы и чувствительные нервные окончания в капсуле суставов.
А дальше – только интереснее. Оставайтесь с нами!
Текст: Анна Хоружая
Читайте материалы нашего сайта в Facebook, ВКонтакте, Яндекс-Дзен и канале в Telegram, а также следите за новыми картинками дня в Instagram.
Нейрон. Строение нервной клетки
Нейрон (от др.-греч. νεῦρον — волокно, нерв) — это структурно-функциональная единица нервной системы. Эта клетка имеет сложное строение, высоко специализирована и по структуре содержит ядро, тело клетки и отростки. В организме человека насчитывается более ста миллиардов нейронов.
Обзор
Сложность и многообразие функций нервной системы определяются взаимодействием между нейронами, которое, в свою очередь, представляют собой набор различных сигналов, передаваемых в рамках взаимодействия нейронов с другими нейронами или мышцами и железами. Сигналы испускаются и распространяются с помощью ионов, генерирующих электрический заряд, который движется вдоль нейрона.
Строение
Тело клетки
Тело нервной клетки состоит из протоплазмы (цитоплазмы и ядра), снаружи ограничена мембраной из двойного слоя липидов(билипидный слой). Липиды состоят из гидрофильных головок и гидрофобных хвостов, расположены гидрофобными хвостами друг к другу, образуя гидрофобный слой, который пропускает только жирорастворимые вещества (напр. кислород и углекислый газ). На мембране находятся белки: на поверхности (в форме глобул), на которых можно наблюдать наросты полисахаридов (гликокаликс), благодаря которым клетка воспринимает внешнее раздражение, и интегральные белки, пронизывающие мембрану насквозь, в которых находятся ионные каналы.
Типичная структура нейрона
Нейрон состоит из тела диаметром от 3 до 130 мкм, содержащего ядро (с большим количеством ядерных пор) и органеллы (в том числе сильно развитый шероховатый ЭПР с активными рибосомами, аппарат Гольджи), а также из отростков. Выделяют два вида отростков: дендриты и аксоны. Нейрон имеет развитый и сложный цитоскелет, проникающий в его отростки. Цитоскелет поддерживает форму клетки, его нити служат «рельсами» для транспорта органелл и упакованных в мембранные пузырьки веществ (например, нейромедиаторов). Цитоскелет нейрона состоит из фибрилл разного диаметра: Микротрубочки (Д = 20-30 нм) — состоят из белка тубулина и тянутся от нейрона по аксону, вплоть до нервных окончаний. Нейрофиламенты (Д = 10 нм) — вместе с микротрубочками обеспечивают внутриклеточный транспорт веществ. Микрофиламенты (Д = 5 нм) — состоят из белков актина и миозина, особенно выражены в растущих нервных отростках и в нейроглии. В теле нейрона выявляется развитый синтетический аппарат, гранулярная ЭПС нейрона окрашивается базофильно и известна под названием «тигроид». Тигроид проникает в начальные отделы дендритов, но располагается на заметном расстоянии от начала аксона, что служит гистологическим признаком аксона.
Различается антероградный (от тела) и ретроградный (к телу) аксонный транспорт.
Дендриты и аксон
Аксон — обычно длинный отросток, приспособленный для проведения возбуждения от тела нейрона. Дендриты — как правило, короткие и сильно разветвлённые отростки, служащие главным местом образования влияющих на нейрон возбуждающих и тормозных синапсов (разные нейроны имеют различное соотношение длины аксона и дендритов). Нейрон может иметь несколько дендритов и обычно только один аксон. Один нейрон может иметь связи со многими (до 20-и тысяч) другими нейронами.
Дендриты делятся дихотомически, аксоны же дают коллатерали. В узлах ветвления обычно сосредоточены митохондрии.
Дендриты не имеют миелиновой оболочки, аксоны же могут её иметь. Местом генерации возбуждения у большинства нейронов является аксонный холмик — образование в месте отхождения аксона от тела. У всех нейронов эта зона называется триггерной.
Схема строения нейрона
Синапс
Си́напс (греч. σύναψις, от συνάπτειν — обнимать, обхватывать, пожимать руку) — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторнойклеткой. Служит для передачи нервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Одни синапсывызывают деполяризацию нейрона, другие — гиперполяризацию; первые являются возбуждающими, вторые — тормозными. Обычно для возбуждения нейрона необходимо раздражение от нескольких возбуждающих синапсов.
Термин был введён в 1897 г. английским физиологом Чарльзом Шеррингтоном.
Классификация
Структурная классификация
На основании числа и расположения дендритов и аксона нейроны делятся на безаксонные, униполярные нейроны, псевдоуниполярные нейроны, биполярные нейроны и мультиполярные (много дендритных стволов, обычно эфферентные) нейроны.
Безаксонные нейроны — небольшие клетки, сгруппированы вблизи спинного мозга в межпозвоночных ганглиях, не имеющие анатомических признаков разделения отростков на дендриты и аксоны. Все отростки у клетки очень похожи. Функциональное назначение безаксонных нейронов слабо изучено.
Униполярные нейроны — нейроны с одним отростком, присутствуют, например в сенсорном ядре тройничного нерва в среднем мозге.
Биполярные нейроны — нейроны, имеющие один аксон и один дендрит, расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях.
Мультиполярные нейроны — нейроны с одним аксоном и несколькими дендритами. Данный вид нервных клеток преобладает в центральной нервной системе.
Псевдоуниполярные нейроны — являются уникальными в своём роде. От тела отходит один отросток, который сразу же Т-образно делится. Весь этот единый тракт покрыт миелиновой оболочкой и структурно представляет собой аксон, хотя по одной из ветвей возбуждение идёт не от, а к телу нейрона. Структурно дендритами являются разветвления на конце этого (периферического) отростка. Триггерной зоной является начало этого разветвления (то есть находится вне тела клетки). Такие нейроны встречаются в спинальных ганглиях.
Функциональная классификация
По положению в рефлекторной дуге различают афферентные нейроны (чувствительные нейроны), эфферентные нейроны (часть из них называется двигательными нейронами, иногда это не очень точное название распространяется на всю группу эфферентов) и интернейроны (вставочные нейроны).
Афферентные нейроны (чувствительный, сенсорный или рецепторный). К нейронам данного типа относятся первичные клетки органов чувств и псевдоуниполярные клетки, у которых дендриты имеют свободные окончания.
Эфферентные нейроны (эффекторный, двигательный или моторный). К нейронам данного типа относятся конечные нейроны — ультиматные и предпоследние — не ультиматные.
Ассоциативные нейроны (вставочные или интернейроны) — группа нейронов осуществляет связь между эфферентными и афферентными, их делят на интризитные, комиссуральные и проекционные.
Секреторные нейроны — нейроны, секретирующие высокоактивные вещества (нейрогормоны). У них хорошо развит комплекс Гольджи, аксон заканчивается аксовазальными синапсами.
Морфологическая классификация
Морфологическое строение нейронов многообразно. В связи с этим при классификации нейронов применяют несколько принципов:
- учитывают размеры и форму тела нейрона;
- количество и характер ветвления отростков;
- длину нейрона и наличие специализированных оболочек.
По форме клетки, нейроны могут быть сферическими, зернистыми, звездчатыми, пирамидными, грушевидными, веретеновидными, неправильными и т. д. Размер тела нейрона варьирует от 5 мкм у малых зернистых клеток до 120—150 мкм у гигантских пирамидных нейронов. Длина нейрона у человека составляет от 150 мкм до 120 см.
По количеству отростков выделяют следующие морфологические типы нейронов:
- униполярные (с одним отростком) нейроциты, присутствующие, например, в сенсорном ядре тройничного нерва в среднем мозге;
- псевдоуниполярные клетки, сгруппированные вблизи спинного мозга в межпозвоночных ганглиях;
- биполярные нейроны (имеют один аксон и один дендрит), расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях;
- мультиполярные нейроны (имеют один аксон и несколько дендритов), преобладающие в ЦНС.
Развитие и рост нейрона
Нейрон развивается из небольшой клетки-предшественницы, которая перестаёт делиться ещё до того, как выпустит свои отростки. (Однако, вопрос о делении нейронов в настоящее время остаётся дискуссионным) Как правило, первым начинает расти аксон, а дендриты образуются позже. На конце развивающегося отростка нервной клетки появляется утолщение неправильной формы, которое, видимо, и прокладывает путь через окружающую ткань. Это утолщение называется конусом роста нервной клетки. Он состоит из уплощенной части отростка нервной клетки с множеством тонких шипиков. Микрошипики имеют толщину от 0,1 до 0,2 мкм и могут достигать 50 мкм в длину, широкая и плоская область конуса роста имеет ширину и длину около 5 мкм, хотя форма её может изменяться. Промежутки между микрошипиками конуса роста покрыты складчатой мембраной. Микрошипики находятся в постоянном движении — некоторые втягиваются в конус роста, другие удлиняются, отклоняются в разные стороны, прикасаются к субстрату и могут прилипать к нему.
Конус роста нейрона
Конус роста заполнен мелкими, иногда соединёнными друг с другом, мембранными пузырьками неправильной формы. Непосредственно под складчатыми участками мембраны и в шипиках находится плотная масса перепутанных актиновых филаментов. Конус роста содержит также митохондрии, микротрубочки и нейрофиламенты, имеющиеся в теле нейрона.
Вероятно, микротрубочки и нейрофиламенты удлиняются главным образом за счёт добавления вновь синтезированных субъединиц у основания отростка нейрона. Они продвигаются со скоростью около миллиметра в сутки, что соответствует скорости медленного аксонного транспорта в зрелом нейроне. Поскольку примерно такова и средняя скорость продвижения конуса роста, возможно, что во время роста отростка нейрона в его дальнем конце не происходит ни сборки, ни разрушения микротрубочек и нейрофиламентов. Новый мембранный материал добавляется, видимо, у окончания. Конус роста — это область быстрого экзоцитоза и эндоцитоза, о чём свидетельствует множество находящихся здесь пузырьков. Мелкие мембранные пузырьки переносятся по отростку нейрона от тела клетки к конусу роста с потоком быстрого аксонного транспорта. Мембранный материал, видимо, синтезируется в теле нейрона, переносится к конусу роста в виде пузырьков и включается здесь в плазматическую мембрану путём экзоцитоза, удлиняя таким образом отросток нервной клетки.
Росту аксонов и дендритов обычно предшествует фаза миграции нейронов, когда незрелые нейроны расселяются и находят себе постоянное место.
Материал из Википедии — свободной энциклопедии
Введение в нейробиологию
| Напечатано:: | Гость |
| Дата: | Понедельник, 3 Апрель 2023, 15:11 |
Описание
Оглавление
- 1. Эволюция нервной системы
- 2. Клеточные мембраны структура и функции
- 3. Белки мембран
- 4. Липиды мозга
- 4.1. Транспорт холестерина в ЦНС
- 5. Основные клеточные компоненты ЦНС и их взаимосвязи
- 6. Немного истории
- 7. Нейроны
- 7.1. Развитие и рост нейрона Конус роста
- 7.2. Классификации нейронов
- 8. Нейроглия
- 8.1. Классификация глиальных клеток
- 8.2. Астроциты
- 8.3. Миелинирующие олигодендроциты
- 8.4. Микроглия и эпендимальные клетки
- 8.5. Шванновские клетки (леммоциты)
- 9. Миелин
- 9.1. Молекулярная организация миелина
- 10. Белки миелина
- 11. Протеолипидный белок
- 11.1. Основной белок миелина
- 11.2. Миелин-ассоциированный гликопротеин
- 11.3. P0 гликопротеин
- 11.4. Другие миелиновые белки
- 11.5. Сортировка и транспортировка липидов и белков
- 11.6. Образование миелиновых мембран
- 11.7. Демиелинизирующие болезни
- 11.8. Синдром Гийена — Барре
- 12. Мембранный транспорт и генерация мембранных потенциалов
- 12.1. Na+/K+ АТФаза
- 12.2. Регуляция Na+/K+
- 12.3. Ca2+ ATФазы
- 12.4. V0V1-ПРОТОННЫЕ НАСОСЫ
- 12.5. Транспортеры ABC
- 12.6. Вторичный активный транспорт
- 12.7. ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ТРАНСПОРТЕРОВ НЕЙРОТРАНСМИТТЕРОВ
- 12.8. КАТИОННЫЕ АНТИПОРТЫ
- 13. Мембранные потенциалы и электрические сигналы в возбудимых клетках
1. Эволюция нервной системы
Чарльз Дарвин представил нам отличную теорию о зарождении и развитии жизни на Земле. Правда, в ней еще очень много вопросов и спорных моментов. Но на данном этапе лучшего у нас пока нет. Самая большая проблема с теорией мистера Дарвина в том, что мы можем догадываться и строить предположения как и почему все произошло, но мы не можем проверить или опровергнуть эту теорию. Предлагаю использовать теорию эволюции как паттерн, чтобы представить, как развивалась нервная система и какие процессы привели к появлению сознания. Мы обсудим возможные перспективы такого подхода позже.
Разнообразные типы клеток объединяются в ансамбли и паттерны, так что специализированные компоненты интегрируются в физиологию всего органа
Закроем глаза и будем представлять.
У нас есть целый океан одиночных клеток, которые переносятся потоками или плавают в лужах. Днем солнце нагревает их, а ночью они остывают. Мы можем представить, что в какой-то момент клетки научились сокращаться и этим приобрели способность к передвижению, что в совокупности с умением распознавать температуру дало им возможность перемещаться, а со временем, сокращая только одну сторону начало получаться перемещаться в более комфортном направлении.
Но некоторые все равно перемещались в неудачном направлении и погибали, и их мертвые тела, разлагаясь, создавали химический маркер для таких мест, и другие особи научились со временем различать такие маркеры. Так же со временем возможность сенсоров по распознаванию маркеров росла, и мы можем видеть, что со временем они научились распознавать не только тепло/холод, но и опасные места, где ощущаются маркеры разложения, и места где есть еда. Предлагаю называть такую систему внешними маркерами.
Система внешних маркеров, по сути, очень проста, когда на внешнем сенсоре есть определенный раздражитель, то сокращается определенная часть тела, чтобы обеспечить движение к или от раздражителя. Можно представить это как двигатель с выключателем, где роль переключателя играет внешний раздражитель. Для примера, муравей переносит упавший лист за черенок, потому что на черенке присутствует специальный химический маркер, сделанный самой природой, муравей натыкаясь на него, запускает алгоритм перетаскивания листика.
Наблюдая за насекомыми, мы можем видеть, что следующим шагом развития стала система внешних маркеров на заказ. В какой-то момент времени, мы можем предположить что внешние сенсоры научились различать не только химию разложения, но также и химические маркеры живых особей, и природа не упустила возможности создать органы способные производить различные выделения для пометок окружающей среды. Это тоже очень простая система. Например, при наличии определенного стимула в качестве переключателя животное может услышать шум и испугаться. Оно оставляет след в виде мочи или кала как маркер для других, что это опасное место.Это очень похоже на примитивную систему коммуникации. Мы можем предположить, что изначально это произошло в тот момент, когда особи научились различать свой след и возвращаться по нему назад в зону комфорта, или другие особи могли следовать за первой. Может по ночам им было более комфортно находиться вместе. Систему с внешними маркерами на заказ мы можем видеть почти у всех живых существ. Правда, у людей это чаще заметно например в таком бытовом мероприятии как покупки. Когда женская особь оставила химические маркеры на куске бумаги, а мужская особь видит совпадающие маркеры на полке, берет и кладет в корзину, вычеркивает в списке. 
Но с ростом размера тел, эволюция столкнулась с парой проблем. Так как количество клеток в одной особи росло, то росло и количество сенсоров которое приходилось обрабатывать. И на этом пути эволюция собрала максимальное количество цепей обработки сигналов в одном месте. К тому же все информационно тяжелые сенсоры, зрение, слух, обоняние разместились не очень далеко.
Другой проблемой стало то, что появилась необходимость переключать весь набор клеток в различные режимы работы одновременно. Например, режимы сна, спокойствия, паники, агрессии. Реализовать это при помощи подведения командных нервов к каждой клетке не представляется возможным. И в данном случае эволюция не стала изобретать ничего нового, а просто использовала старый трюк с маркерами. Только теперь это стали маркеры внутри организма. То есть появились механизмы, начавшие вырабатывать определенные маркеры, которые разносятся кровью по организму. Клетки, раздражаясь на маркер, изменяют свой режим работы. Назовем это сигнальной системой. Самый простой и известный всем пример работы сигнальной системы, это приступ паники. Когда при наличии определенных раздражителей система начинает вырабатывать адреналин.
И вот тут мы подходим к самому интересному. На каком-то неизвестном этапе, случилось так, что некоторые особи утратили возможность распознавать внешние маркеры. У китообразных, сирен, большинства рукокрылых и узконосых приматов, включая человека, вомероназальный орган рудиментарен или полностью утрачен. На самом деле, мы, конечно, не можем знать, что случилось, было ли наращивание маркеров в сигнальной системе первичным и система внешних маркеров стала не нужна. Или сначала по какой-то причине система внешних маркеров стала недоступна и тогда началось наращивание маркеров во внутренней сигнальной системе. В случае с человеком, на данный момент известно более 100 внутренних маркеров. Так же известно, что гормоны человека могут воздействовать на животных. Но гормоны животных либо не имеют воздействия на человека, либо их реакция очень ослаблена. То есть мы можем предположить, что сигнальная система человека гораздо более развита, чем у животных. И возможно это именно та грань, которая нас различает.
Но вернемся к теме возникновения сознания.
На данном этапе наших теоретических исследований, мы пришли к тому, что у нас есть система выключателей, которые при раздражении производят какую-то работу. При этом все эти выключатели собраны физически в одном месте и крайние из них имеют в качестве подключения сенсоры или нервы.
Еще у нас имеется сигнальная система, которая управляется теми же самыми выключателями. Но при этом сами выключатели умеют реагировать на маркеры сигнальной системы. То есть мы можем это себе представить как замкнутый круг. Выключатели управляют сигнальной системой, сигнальная система воздействует на выключатели.
Имея 100 маркеров в сигнальной системе, это дает нам 2100 вариантов коктейлей из маркеров, что дает нам огромное количество вариантов для записи сообщений между клетками. Давайте представим, что группа из выключателей при своем создании запоминает коктейль маркеров существовавший в тот момент и в дальнейшем при возникновении похожего коктейля, эта группа будет становится активной. Это обеспечивает нам связь между различными физически удаленными группами, и активацию групп при похожих ситуациях. Также не стоит забывать что производством маркеров управляют группы выключателей. Для примера, я буду очень утрировать, если мы хотим отработать блок от удара. Физически зрительная область которая отвечает за распознавание удара находится далеко ( в рамках расстояний между клетками) от области управления мышцами. Предположим что на первом этапе сообщение между этими двумя группами выключателей произойдет на уровне сигнальной системы. То есть зрительная область закажет сообщение в “сигнальной системе” в котором будет сообщение для двигательной системы произвести какие то действия. Все это будет занимать какое то время. Но вполне логично, что если повторять одно и то же действие в течении нескольких лет, то системы выключателей посылающих и принимающих сообщения отшлифуют это действие до идеала, избавят “сигнальную систему” от лишних маркеров порождающих вариативность действий, и оно перейдет почти на уровень рефлексов.
Обобщив сказанное, мы можем сказать что сознание представляет из себя бесконечный замкнутый цикл из двух систем, воздействующих друг на друга, триггеров и гормональной, в попытках найти равновесие. При этом внешние раздражители вносят свои поправки и нарушают равновесие. Эмоции в данном случае есть не более чем побочный эффект работы этих систем.
Для подтверждения данной модели, нам понадобится обнаружить нейроны которые взаимодействуют со всем спектром гормонов, что представляется мало возможным на данном уровне развития техники. Подобные нейроны исчисляются несколькими тысячами на каждый гормон, в общей массе почти сотни миллиардов нейронов.
В следующей части мы рассмотрим детальнее как из набора триггеров и сигнальной сети организовать то что мы называем сознанием. В качестве примера будем использовать реализованную компьютерную модель на ранней стадии обучения
geektimes.ru
2. Клеточные мембраны структура и функции
Нейроны специализированы для интеграции выбранных внеклеточных сигналов, как пространственно, так и во времени. В дополнение к генерированию потенциалов действия и посредством синаптической активности, сигнализируя о других клетках, структурные модификации инициируются внутри нейронов, которые могут быть столь же кратковременными, как стробирование ионного канала или как долгое время, как память. Почти вся эта активность связана с клеточными мембранами, и многие из этих мембранных функций обсуждаются в последующих главах. Эта глава начинается с кратких обсуждений физической химии, лежащей в основе липидного и белкового компонентов клеточных мембран (рис. 2-1-2-4), приступает к изучению некоторых аспектов мембранной биохимии, относящихся к нейронам и их поддерживающим клеткам, и заканчивается обсуждением некоторых проблем функций клеточной мембраны, которые являются субъектами текущих исследований. Чтобы выполнить свою уникальную функциональную роль, каждый нейрон должен регулировать множество внутриклеточных действий. которые происходят в аксонах и дендритах, удаленных от ядра клетки. Например, аксоновское руководство во время разработки или ремоделирование дендритных шипов в ответ на местный ввод, каждый из них включает в себя множество различных сложных систем управления, которые сильно локализованы и в значительной степени автономны.
Рис. Обзор структуры плазматической мембраны. Плазменные мембраны отличаются от других клеточных мембран наличием как гликолипидов, так и гликопротеинов на их внешних поверхностях и прикрепления цитоскелетных белков к их цитоплазматическим поверхностям. Изображены взаимосвязи между типичными мембранными компонентами. Белки, которые вводятся через липидный бислой (A1-A3), называемый «интегральными» мембранными белками, часто являются гликозилированными (круги лаванды), как и некоторые двухслойные липиды (D) и многие компоненты внеклеточного матрикса (E). Многие взаимодействия на внеклеточной поверхности стабилизируются водородной связью между этими гликозильными остатками. Некоторые интегральные мембранные белки могут взаимодействовать в силу специфических сайтов рецепторов с внутриклеточными белками (В), с внеклеточными компонентами (С) и формировать специфические соединения с другими клетками (А2). Множество интегральных мембранных белков опосредует различные пути передачи сигналов и активного транспорта.
3. Белки мембран
Мембранные интегральные белки имеют трансмембранные домены, которые вставляются непосредственно в липидные бислои. Трансмембранные домены (TMD) состоят преимущественно из неполярных аминокислотных остатков и могут проходить через бислой один или несколько раз. Структурная информация с высоким разрешением доступна только для нескольких интегральных мембранных белков, прежде всего потому, что трудно получить кристаллы мембранного белка, которые являются адекватными для рентгеновских дифракционных измерений. TMD обычно состоят из спирали. Пептидная связь является по своей природе полярной и может образовывать внутренние водородные связи между карбонильными атомами кислорода и амидными нитрогенами, или любой из них может быть гидратирован. Внутри липидного бислоя, где вода по существу исключена, пептиды обычно принимают альфа-спиральную конфигурацию, которая максимизирует их внутреннюю водородную связь. Длина спирали из 18-21 аминокислотных остатков достаточна для охвата обычной ширины липидного бислоя рис. . Поскольку поверхностные свойства спирали определяются ее боковыми цепями, один спиральный сегмент, который может вставляться в двухслойный слой или через него, будет состоять в основном из гидрофобных остатков. Интегральные мембранные белки с одним трансмембранным доменом могут иметь «растворимые» домены на обеих или обеих поверхностях. Пример монотопного белка, цитохром b5 имеет один гидрофобный сегмент, который образует петлю шпильки, действуя как якорь к поверхности цитоплазмы, но, вероятно, не полностью проникает в двухслойный слой. Биотопные белки с одной трансмембранной спиралью более распространены. Если они ориентированы с экстрацитоплазмой N-конца, они классифицируются как тип I или, если цитоплазматический тип II рис.. Битопические мембранные белки часто участвуют в сигнальной трансдукции, примером которой являются рецептор-активированные тирозинкиназы (глава 24): агонистическая активность домена экстрацитоплазматического рецептора может передавать структурные изменения через одну трансмембранную спираль для активации латентной киназной активности в цитоплазматическом домене. Ионные каналы, транспортеры и многие рецепторы являются политопическими. Полярные и спирально-дестабилизирующие остатки, вероятно, происходят в их трансмембранных сегментах, чтобы сформировать необходимые ворота, каналы или связывающие домены. Трансмембранные спирали в политопных белках обычно плотно упакованы. Примерами этого являются рецепторы, связанные с G-белком (GPCRs, глава 19), и саркоплазматический Ca2 + pump (глава 5). Каждая пептидная связь имеет значительный дипольный момент, который передается на концы спирали. Это обстоятельство способствует близкой упаковке антипараллельных спиралей и является наблюдаемым расположением спиралей в бактериородопсине [3]. В олигомерных трансмембранных белках межзубная упаковка может охватывать экстрамембранные белковые домены и двухслойные липиды. Многие трансмембранные белки, которые опосредуют внутриклеточные сигналы, образуют комплексы как с внутри-, так и с внеклеточными белками. Например, молекулы адгезии нервных клеток (NCAM) являются гликопротеинами клеточной поверхности (глава 7). Внеклеточные домены NCAM могут активировать рецепторы фактора роста фибробластов при кластеризации путем реакции с антителами NCAM [4] или путем гомотипического связывания с доменами соседних клеток (см. Рис. 7-2). Было обнаружено, что активация секвестрирует комплекс NCAM, βI spectrin и PKCβ2 в плотах, как определено рабочими критериями, описанными на стр. 28. Мембранные ассоциации могут происходить путем селективного связывания белка с группами липидных голов. Одним из примеров является спектрин, который связывается с фосфатидилинозитол-4,5-бисфосфатом с помощью домена плекстрина-гомологии (PH) [5]. а также к фосфатидилсерину [6] рис. . Приток Ca2 + инициирует белковые и мембранные ассоциации несколькими различными механизмами. Часто происходит аллостерическая регуляция гидрофобности поверхностей, связывающих белок. Одним из наиболее изученных примеров является Ca2 + -зависимое связывание кальмодулина с другими белками (глава 22). Приекнины представляют собой семейство белков, которые проявляют Ca2 + -зависимые ассоциации с клеточными мембранами путем прямого взаимодействия с фосфолипидами, и, наоборот, взаимодействия с фосфолипидами увеличивают их аффинность для Ca2 + [7]
Рис. Слева: интегральные мембранные белки можно классифицировать относительно ориентации и сложности их трансмембранных сегментов. Справа: белки могут ассоциироваться с мембранами через несколько типов взаимодействий с двухслойными липидами и взаимодействием с интегральными мембранными белками. Они также могут быть «закреплены» путем интеграции в двухслойный слой ковалентно связанных липидов. GPI = гликозилфосфатидилинозитол
Рис. Область гомологичности плекстрина (PH) GrP1, фактор обмена валовой ГТФ (гуанозин 5 ‘трифосфат) для Arf GTPases. Активация GrP1 происходит, когда этот домен связывается с PI (3,4) P2 или PI (3,4,5) P3, полученным во внутреннем листе плазменных мембран с помощью PI3-киназы (глава 20). Эта структура показана в комплексе с инозитолом 1,3,4,5-тетрафосфата, поскольку она кристаллизовалась для дифракции рентгеновских лучей, тогда как диацилглицерин этерифицировался до 1-фосфата инозита в связанной с мембраной форме. Аминокислотными остатками (модели с шариком и палкой) показаны те, которые приближаются к титрофосфату инозита, достаточно близко к образованию водородных связей (зеленые штрихи). Модель, построенная из базы данных протеиновых координат 1fgy [32] с использованием DeepView 3.7 [33]
4. Липиды мозга
Нейробиолог Филипп Хайтович: «Человеком нас сделал жир в мозге»
Свойства липидов мозга
- Липиды имеют множество функций в мозге.
- Мембранные липиды являются амфифильными молекулами.
- Гидрофобные компоненты многих липидов состоят либо из изопреноидов, либо из жирных кислот и их производных.
- Изопреноиды представляют собой структуры с пятью углеродными атомами.
- Жирные кислоты представляют собой карбоновые кислоты с длинной цепью, которые могут содержать одну или несколько двойных связей
Липиды
являются не только структурными компонентами ЦНС, но и важнейшими участниками
функциональной активности. Головной мозг характеризуется высоким содержанием
липидов (более 50% сухой массы).
Мозг
содержит уникальные мембранные структуры — миелиновые оболочки, которые имеют
самое высокое содержание липидов (до 80%) по сравнению с другими тканями или
субклеточными структурами, за исключением адипозной ткани. Для ЦНС характерно и
наибольшее структурное разнообразие липвдов по сравнению с мембранами других
органов. Липидный состав нервной ткани практически постоянен и остается
неизменным даже под влиянием внешних факторов (диета, гормоны,
фармакологические вещества, стрессы), которые меняют липидный состав
висцеральных органов и плазмы. Это — следствие защищенности ЦНС от различных
внешних воздействий. Изменение липидного состава нервной ткани рассматривается
обычно как патология, хотя при этом следует помнить, что существенные изменения
в липидном составе нервной системы происходят в период развития.
Вся
сложнейшая деятельность нервной ткани опосредуется через мембраны, в
формировании и функционировании которых липиды принимают непосредственное
участие.
В
клетках нервной системы представлено несколько типов высокоспециализированных
мембран: соматические мембраны мульти- и униполярных нейронов, мембраны
дендритов, миелинизированных и немиелинизированных аксонов, аксонного холмика,
где генерируется потенциал действия, мембраны рыхлого и компактного миелина,
мембраны синаптических пузырьков, пре- и постсинаптические мембраны, мембраны
макро- и микроглии. Возбудимость этих мембран колеблется в широких пределах от
высоковозбудимых (синаптические, аксонного холмика) до относительно устойчивых
мультимембранных структур миелина. В составе, строении и функционировании
мембран нервной ткани еще очень много неясного. Для того чтобы раскрыть
надмолекулярную организацию этих мембран, надо иметь достаточно полное
представление об их липидном и белковом составе. Однако исследователи пока не
владеют этими сведениями в полной мере , хотя ряд важных закономерностей уже
намечен.
Липидный состав серого и белого вещества мозга человека представлен в табл.
4.1, а различных клеток мозга — в табл. 4.2. Видно, что липидный состав белого
вещества ближе к миелину, а серое вещество содержит меньше типичных миелиновых
липидов (цереброзидов, сульфатидов, фосфатидилэтаноламина), но относительно
больше ганглиозидов.
Сравнивая
молярное содержание основных классов липидов в специализированных клетках
мозга, можно видеть, что олигодендроглия и миелин наиболее обогащены
цереброзидами, а нейроны и астроглия имеют более высокое содержание
фосфолипидов. Это лишний раз подтверждает, что плазматические мембраны
совершенно отличны от миелина. Состав фосфолипидов обогащенных фракций нейронов
и нейроглии коры мозга крысы представлен в табл. 4.3.
Чем
более анатомически дифференцированно подходить к нервной ткани, тем больше
различий обнаруживается в липидном составе, поскольку функционально различные
нейрональные и глиальные клетки имеют своеобразный липидный состав. В состав
большинства липидов входят жирные кислоты.
В
мозге они гораздо разнообразнее, чем в других тканях. Это намного увеличивает
число индивидуальных липидов мозга. Содержание жирных кислот в головном мозге
гораздо выше, чем в других органах, и составляет примерно 20-25% в расчете на
сухую массу ткани. Разнообразие жирных кислот в этом органе поразительно.
Применение газожидкостной хроматографии позволило продемонстрировать наличие в
головном мозге более 50 жирных кислот с длиной цепи от 12 до 26 углеродных
атомов, среди которых найдены насыщенные, ненасыщенные, нормальные,
гидроксизамещенные, нечетные и др. Ненасыщенные кислоты мозга могут содержать
от 1 до 6 двойных связей. Особенностью, липидов мозга является относительно
большое содержание длинноцепочечных полиеновых кислот 20:4, 22: 5, 22:6. Отдельные
классы и фракции липидов мозга характеризуются своим набором жирных кислот.
Имеет место также определенная специфичность жирнокислотного состава в липидах
разных отделов мозга, разных типов его клеток, субклеточных структур.
Таблица
4.2. Состав липидов основных типов нервных клеток мозга крысы (мкмоль/мг сухой
массы)
|
Липиды |
Нейроны |
Астроглия |
Олигоден-дроглия |
Миелин |
|
Холестерин |
6,610 |
14,100 |
10,800 |
54,900 |
|
Цереброзиды |
0,513 |
0,689 |
2,610 |
22,000 |
|
Сульфатиды |
0,090 |
0,142 |
0,472 |
2,890 |
|
Общие |
22,400 |
35,600 |
23,400 |
41,800 |
|
Ганглиозиды |
0,223 |
0,582 |
0,239 |
0,0453 |
|
Молярное |
1:0,075:3,5 |
1:0,05:2,5 |
1:0,25:2,2 |
1:0,40:0,76 |
Иллюстрацией этого могут служить данные табл.4.4, где приведен жирнокислотный состав фосфолипидов синаптосом и миелина — двух разных типов мембранных структур ЦНС резко различающихся по своему происхождению и функциям.
Основные фосфотриглицериды мозга и точки гидролиза фосфолипазами показаны на рисунке

На рисунке структура фосфоглицеридов. В большинстве липидов Х представляет собой ацил, то есть R (C). В алкиловых эфирах, присутствующих главным образом в мозге этаноламинфосфоглицериды (2 — 3%), X является длинноцепочечным углеводородом (C16, C18). Для плазмогагенов, составляющих около 60% взрослого человеческого мозга PtdEtn, X представляет собой 1-алк-1-енил (то есть CH CH- R). Стрелки указывают места ферментативного гидролиза фосфоглицеридов. PLA1, фосфолипаза A1; PLA2, фосфолипаза A2; PLC, фосфолипаза C; PLD, фосфолипаза D. Обратите внимание, что мио-инозитол записывается в d-конфигурации, где 1-я позиция связана с частью PtdOH. Для полифосфоинозитидов в 3, 4 или 5 положениях присутствуют дополнительные фосфатные группы. Стереохимии инозита принято рассматривать с использованием представлений черепахи.
Таблица
4.3. Содержание индивидуальных фосфолипидов в коре мозга крысы
|
Фосфолипиды |
Нейроны |
Нейроглия |
|
Лизофосфатидилхолин |
3,9 |
1,9 |
|
Фосфатидилхолин |
46,1 |
46,9 |
|
Сфингомиелин |
6,7 |
9,5 |
|
Фосфатидилсерин |
9,1 |
7,1 |
|
Фосфатидилинозит |
7,7 |
5,9 |
|
Фосфатидилэтаноламин |
25,1 |
24,9 |
|
Фосфатидная |
1,8 |
3,6 |
В
синаптосомах велико содержание жирных кислот — С 22:6, а в миелине высок
процент моноеновых кислот — 18:1. Возможно, что высокое содержание
докозагексаеновой кислоты в синаптосомах необходимо для активного транспорта
ионов, так как активность №+, К+-АТФазы в них зависит от присутствия полиеновых
кислот в фосфолипидах. В мозге имеются регуляторные механизмы, поддерживающие
степень ненасыщенности и специфичность жирнокислотного состава в липидах.
Таблица
4.4. Состав жирных кислот фосфолипидов синаптосомальных и миелиновых мембран
коры мозга обезьяны (% от общего содержания кислот)
|
Шифр |
Фосфатидилхолин |
этаноламин |
серин+монофосфоинозитид |
|||
|
синаптосомы |
миелин |
синаптосомы |
миелин |
синаптосомы |
миелин |
|
|
18:0 |
12,4 |
17 |
25,5 |
15,9 |
44,3 |
43 |
|
18:1 |
27,2 |
42,3 |
12,1 |
33,2 |
11,4 |
38,5 |
|
20:1 |
0,7 |
0,9 |
1,6 |
‘ |
9,3 |
2,5 |
|
20:4 |
3,8 |
3,2 |
10,1 |
11,6 |
8,3 |
6,3 |
Изменение
жирнокислотного состава приводит к нарушению функциональной деятельности мозга.
Таблица 4.5. Распределение жирных кислот в фрагментах диацилглицерина фосфоглицеридов мозга крыс
|
C-1 |
C-2 |
PtdIns (mol %) |
PtdIns4,5P2 (mol %) |
PtdCho (mol %) |
PtdEtn (mol %) |
PtdSer (mol %) |
|
16:0 |
22:6 |
1.4 |
0.1 |
3.3 |
4.8 |
0.8 |
|
16:0 |
20:4 |
7.8 |
9.5 |
4.4 |
2.3 |
0.6 |
|
18:1 |
20:3 |
4.1 |
1.1 |
Tr |
Tr |
Tr |
|
18:0 |
22:6 |
Tr |
1.0 |
2.5 |
17.6 |
42.4 |
|
14:0 |
16:0 |
0.6 |
0.4 |
3.1 |
1.5 |
0.8 |
|
18:0 |
22:5 |
1.0 |
0.7 |
0.4 |
0.2 |
5.3 |
|
18:0 |
20:4 |
49.5 |
66.1 |
3.8 |
22.5 |
3.8 |
|
18:1 |
18:1 |
1.7 |
2.1 |
3.4 |
11.1 |
7.0 |
|
16:0 |
18:1 |
12.7 |
6.5 |
36.2 |
15.8 |
9.1 |
|
16:0 |
16:0 |
6.9 |
1.4 |
19.2 |
0.7 |
Tr |
|
18:0 |
18:1 |
7.0 |
4.6 |
14.1 |
14.8 |
23.7 |
PtdIns, фосфотидилинозитол; PtdIns(4,5)P2,
фосфотидилинозитол-4,5-дифосфат; PtdCho, фосфатидилхолин; PtdEtn,
фосфатидилетаноламин; PtdSer, фосфатидилсерин.
Строение основных сфинголипидов мозга
Рис.Структура некоторых простых сфинголипидов. X может быть сложным полисахаридом, содержащим сиаловую кислоту (ганглиозиды) или нет (глобозиды). См. Также следующие рисунки 3-4 и 3-9 для понимания номенклатуры и структуры некоторых сложных сфинголипидов мозга.
(A) Структура основного ганглиозида головного мозга, который называется GD1a в соответствии с номенклатурой Svennerholm. G обозначает ганглиозид, D обозначает дисдиало, 1 относится к основному основанию тетрасахарида (Gal-GalNac-GalGlc-) и отличает позиционные изомеры в терминах расположения остатков сиаловой кислоты (см. Также фиг.3-9). В номенклатуре IUPAC-IUB этот ганглиозид называется IV3NeuAc, II3NeuAc-Gg4Cer, где римские цифры обозначают сахарный фрагмент (из церамида), к которому прикреплены сиаловые кислоты (NeuAC), а аравийский цифровой надстрочный символ обозначает положение в сахарном фрагменте где NeuAC прилагаются; Gg относится к сериям ганглио (Gal-GalNAc-Gal-Glc) и индексу 4 к четырехуглеводной магистрали для серии «ганглио». (B) Структура сиаловой кислоты, также называемая N-ацетилнеураминовой кислотой (NeuAc или NANA). Ганглиозиды мозга человека — все производные N-ацетила; однако некоторые другие млекопитающие, такие как коровы, в мозгу могут содержать N-гликолильные производные. Предшественником метаболического биосинтеза для сиалилирования гликоконъюгатов является CMP-сиаловая кислота, образующая фосфодиэфир 5’OH цитидина и 2-положение нейрамининовой кислоты.
4.1. Транспорт холестерина в ЦНС
Перемещение и регуляция холестерина в центральной нервной системе отличается от транспорта периферических тканей. Хлор-холестерин с кровью исключается из ЦНС гематоэнцефалическим барьером. Нейроны экспрессируют форму цитохрома Р-450, 46А, которая окисляет холестерин до 24 (S) -гидроксихолестерина [11] и может дополнительно окислять его до 24,25 и 24,27-дигидроксиэфиров [12]. Известно, что в других тканях гидроксилирование алкильной боковой цепи холестерина при С22 или С27 приводит к образованию продуктов, которые диффундируют из клеток в циркуляцию плазмы. Хотя скорость холестерина в зрелом мозге относительно низка, 24-гидроксилирование может быть основным оттоком к печени, потому что он не окисляется в ЦНС [10]. Во время развития мозга синтез de novo холестерина происходит с высокими темпами на разных стадиях во всех типах клеток головного мозга. У взрослых людей уровень холестерина в мозге составляет 23% от общего холестерина в организме, что примерно в десять раз превышает средний показатель по всем тканям. Большая часть этого холестерина происходит от компонента плазмидной мембраны олигодендроцита миелина; около 80% связано с миелином в мозге мыши и несколько большей фракцией у человека. В отличие от его высокого содержания метаболический оборот холестерина головного мозга у взрослых относительно невелик: для человека коэффициент текучести оценивается в 0,03% в день для мозга по сравнению с 0,7% в день для холестерина всего тела [10]. В взрослом мозгу синтез большинства холестерина происходит в астроцитах. Апопротеин E (apoE) является основным аполипопротеином ЦНС и секретируется астроцитами. В культурах астроцитов apoE появляется в среде в виде богатых холестерином частиц размером, подобным периферическому HDL (5-12 нм) Рис 2.7 ATP-зависимый транспортер ABCA1, экспрессируемый как астроцитами, так и нейронами, способствует образованию стабилизированных apoE частиц с высокой плотностью липопротеинов (HDL) из астроцитарного холестерина.
Рис. Предполагаемая модель apoE в rHDL. Две молекулы apoE в общей сложности около четырех молекул на дискоидную частицу изображены, чтобы ограничить периферию бислоя фосфолипидов. Спиральные оси ориентированы перпендикулярно к фосфолипидным жирным ацильным цепям. Адаптировано из [36] с разрешения.
Хотя внеклеточное высвобождение холестерина иногда описывается как пассивный «проливающий» процесс, в астроцитах кажется очевидным, что холестерин и фосфолипид мобилизуются из плазматических мембран и что их перенос в внеклеточный апоэлемент с образованием частиц липопротеина облегчается транспортными средствами ABCA1. Механизм передачи холестерина в нейроны менее определен. Есть семь членов семейства «липопротеиновых рецепторов низкой плотности» (LDLR), и все они выражены либо в развивающемся, либо в взрослом мозге. Все они являются рецепторами биотопических рецепторов I типа, которые равномерно включают характерный массив доменов: они проявляют внеклеточно лигандсвязывающий домен и между одним и восемью доменами эпидермального фактора роста и внутриклеточным, одним или двумя мотивом NPxY, которые действуют как фосфотирозин -связывающие домены и эндоцитотические сигналы. Два LDLR, apoER2 и липопротеиновый рецептор с очень низкой плотностью (VLDLR), являются апоэпидемирующими рецепторами, экспрессируемыми на мембранах нейронной плазмы и, вероятно, опосредуют поглощение HDL-липидов в нейроны. Эти же рецепторы взаимодействуют с сигнальными лигандами и переходными белками, которые опосредуют миграцию нейронов во время развития мозга [13]. Считается, что эти сигнальные пути играют роль во взрослом мозге, возможно, связаны с аксоплазматическим переносом основных компонентов для синаптического ремоделирования (Chs 9, 53) и могут быть повреждены при болезни Альцгеймера (глава 47). Несмотря на то, что частицы apoE HDL образуются астроцитами in vitro, содержание головного мозга в нокауте apoE (- / -) не было найдено в зависимости от содержания липидов по сравнению с данными, полученными от нормальных животных [14]. Вероятное объяснение состоит в том, что недавно синтезированный холестерин можно транспортировать из астроцитарной ER в плазматическую мембрану по альтернативному маршруту, в котором используются кавеола с образованием apoA1-HDL [15].
Астроцитарное распределение холестерина в нейронах важно для развития нейронов и ремоделирования. Это подтверждается наблюдениями нейронной клеточной культуры [16]. Чистые культуры ганглиозных клеток крысы у крыс с 8-дневными крысами, в отсутствие глии или сыворотки, будут расширять аксоны и формировать синапсы (аутопсисы), которые проявляют токи постнафталей низкой частоты. Было обнаружено, что совместное культивирование этих нейронов с глией у 2-дневных крыс стимулирует образование в два раза больше синапсов, и они проявляют примерно в 12 раз более высокие частоты постсинаптической активности. Астроциты и олигодендроциты, но не микроглии, вызывали подобные эффекты, как и замена глии глиальным культуральным средой. ApoE секретируется glia в их культуральную среду, но добавление рекомбинантного apoE к сетчаткам клеток сетчатки сетчатки не стимулирует образование синапсов и не повышает их эффективность. Однако оба этих эффекта были воспроизведены просто путем добавления холестерина к сетчатым культурам сетчатки сетчатки (рис. 2-8). Другие исследователи выращивали аналогичные очищенные препараты ганглиозных клеток сетчатки на пластинах с надписью, которые заставляют аксоны проходить линейно, чтобы обеспечить измерение скоростей удлинения аксонов [17]. Эти аксоны будут расти через силицированные барьеры в боковые каналы, которые эффективно изолируют, извне, мембраны аксонов из сомы. Было обнаружено, что среда с блестящими средами стимулирует скорость удлинения аксонов примерно на 50% в течение нескольких дней при добавлении к боковым каналам, но она не имела эффекта, если присутствовала только в центральных отсеках, содержащих нейронную сому. Липопротеины HDL, очищенные из глиальмонизированной среды, стимулировались одинаково хорошо, но, в отличие от эффектов на синапсы в предыдущем исследовании, ни чистый apoE, ни холестерин не могли заменить липопротеин в стимулировании удлинения аксонов. Проблема того, почему холестерин является достаточным для поддержки образования синапсов, но не удлинение аксонов, остается нерешенным. Стимуляции синаптической активности и удлинения аксонов, наблюдаемые в этих экспериментах, были ингибированы RAP, белком ингибитора, избирательным для членов семейства LDLR. Эти ингибирования наиболее легко объясняются в результате блокады поглощения apoE-липопротеинов через нейронные рецепторы LDL. Развивающиеся нейроны могут синтезировать холестерин, но эта способность уменьшается по мере созревания нейронов. В условиях быстрого расширения нейритов глиальная поддержка может потребоваться для удовлетворения больших энергетических потребностей биосинтеза нейрональной мембраны (глава 31), а также для обхода ограничений эндоцитотического переноса везикул от нейронной сомы до дистальных аксонов и дендритов (глава 9 ). Даже во взрослом мозге непрерывный синтез холестерина необходим для ремоделирования синапсов, который теперь признан частью обработки информации (глава 50). Холестерин и сфинголипиды синтезируются и транспортируются через системы ER и Golgi [18]. Однако они присутствуют на гораздо более высоких уровнях во внешнем листе плазменных мембран. Добавление холестерина и сфингомиелина в синтетический липидный бислой может приводить к образованию более толстых «жидких упорядоченных» мембран. Это привело к предложениям о том, что двухслойная толщина может быть фактором при сортировке интегральных мембранных белков между ER и Golgi. Жидкие упорядоченные бислои имеют «эластичную» способность регулировать толщину при взаимодействии с ТВД. Алкильные цепные ассоциации с гидрофобными остатками белка являются энергетически выгодными по сравнению с взаимодействием с более полярными поверхностями. Эта регулировка имеет энергетическую стоимость, которая зависит от степени двухслойной деформации [19]. Поскольку многие интегральные белки плазматической мембраны (PMIP) являются политопическими, с TMD различной длины, гетерогенность алкильной цепи по длине и ненасыщенность липидных бислоев могут быть факторами при сортировке белков в разные мембраны. Механизмы отбора интегральных мембранных белков для транзита через систему Гольджи или их удержания в значительной степени неизвестны. Обнаружено, что укорачивание TMD белка плазматической мембраны приводит к удержанию Гольджи [20], и обратный эффект возникает при удлинении TMD обычно сохраняющегося белка Гольджи [21]. Длины трансмембранных доменов для белков, удерживаемых Гольджи, обычно меньше, чем для тех, которые направлены на плазматическую мембрану.
5. Основные клеточные компоненты ЦНС и их взаимосвязи
Основные компоненты ЦНС и их взаимосвязи. Microglia изображены в светло-фиолетовом. В этой упрощенной схеме ЦНС простирается от ее менингеальной поверхности (М) через базальную пластину (сплошную черную линию), лежащую над субпиальным астроцитарным слоем паренхимы ЦНС и собственно паренхимой ЦНС (содержащей нейроны и глии) и субэпидемическими астроцитами, к ресничным эпендимальным клеткам, выстилающим желудочковое пространство (V). Обратите внимание, как астроцит также инвестирует кровеносные сосуды (BV), нейроны и клеточные процессы. Пиаастроглия (glia limitans) обеспечивает барьер между внешней (дурой и кровеносными сосудами) и паренхимой ЦНС. Наблюдается один нейрон (в центре), с синаптическими контактами на его соме и дендритах. Его аксон появляется справа и миелинизирован олигодендроцитом (см. Выше). Другие аксоны показаны в поперечном разрезе, некоторые из которых миелинизированы. Олигодендроцит в левом нижнем углу нейрона относится к немиелинизирующему спутниковому типу. Желудочки (V) и субарахноидальное пространство менингов (M) содержат спинномозговую жидкость.
6. Немного истории
Рамон-и-Кахаль, Сантьяго
[править | править код]
Материал из Википедии — свободной энциклопедии
Перейти к навигацииПерейти к поиску
| Сантьяго Рамон-и-Кахаль | |
| исп. Santiago Ramón y Cajal | |
 Сантьяго Рамон-и-Кахаль. Фотография 1899 года. |
|
| Имя при рождении | исп. Santiago Ramón y Cajal |
|---|---|
| Дата рождения | 1 мая 1852 |
| Место рождения | Петилья-де-Арагон, Наварра, Испания |
| Дата смерти | 17 октября 1934 (82 года) |
| Место смерти | Мадрид, Испания |
| Страна | |
| Научная сфера | гистология, патология |
| Место работы |
|
| Альма-матер |
|
| Научный руководитель | en:Aureliano Maestre de San Juan |
| Известные ученики | Josep Pujol i Capsada[d], Fernando de Castro Rodríguez[d] и Nicolás Achúcarro y Lund[d] |
| Известен как | исследователь микроструктуры мозговой ткани |
| Награды и премии | Медаль Гельмгольца (1904) |
| Подпись |  |
Сантья́го Рамо́н-и-Каха́ль (исп. Santiago Ramón y Cajal; 1 мая 1852, Петилья-де-Арагон — 17 октября 1934, Мадрид) — испанский врач и гистолог, один из основоположников современной нейробиологии. Лауреат Нобелевской премии по физиологии и медицине за 1906 год (совместно с Камилло Гольджи).
Содержание
- 1Биография
- 2Вклад в науку Кахаля
- 3Признание
- 4Названы в честь Рамон-и-Кахаля
- 5Примечания
- 6Литература
- 7Ссылки
Биография[править | править код]
Сантьяго Рамон-и-Кахаль родился 1 мая 1852 года в испанском городке Петилья-де-Арагон. В детстве он учился сначала ремеслу парикмахера, а затем сапожника, но мечтал стать художником — его способности к рисованию видны в иллюстрациях к опубликованным работам. Однако его отец, профессор прикладной анатомии в университете Сарагосы, убедил его заняться медициной, что Рамон-и-Кахаль и сделал. Вместе с отцом они подготовили к выпуску анатомический атлас, рисунки к которому были выполнены Рамоном-и-Кахалем, однако книга не была опубликована.
В 1873 году в Сарагосе Рамон-и-Кахаль сдал экзамены на медицинскую лицензию и поступил на армейскую службу в качестве врача. Он принял участие в экспедиции на Кубу 1874-75 годов, во время которой переболел малярией и туберкулёзом. По возвращении в Испанию ему предложили пост ассистента в школе анатомии медицинского факультета университета Сарагосы (1875), а затем, по его личной просьбе, назначили директором Музея Сарагосы (1879). В 1877 годув Мадриде Рамон-и-Кахаль получил звание доктора медицины, и в 1883 году был назначен профессором описательной и общей анатомии в Валенсии. В 1879 году Рамон-и-Кахаль женился на Донье Сильверии Фаньянас Гарсия. В браке у них родилось четыре дочери и три сына.
В 1887 году он стал профессором гистологии и патологической анатомии в Барселоне, а в 1892 году занял такой же пост в Мадриде. В 1900—1901 годах Рамон-и-Кахаль был директором Национального института гигиены и Института биологических исследований.
Первые научные работы Рамона-и-Кахаля были опубликованы в 1880 году. Среди важнейших трудов учёного: «Руководство по гистологии и микрографии» (1889), «Элементы гистологии» — переработанное издание первой книги (1897), «Руководство по общей патологической анатомии» (1890). В дополнение следует упомянуть «Новые представления о гистологической анатомии и нервных центрах» (1894), «Сборник статей о нервной системе человека и позвоночных» (1897—1899), «Сетчатка глаза позвоночных» (1894).
Помимо этих работ Рамон-и-Кахаль опубликовал более сотни статей в испанских и французских научных журналах, большая часть которых касалась гистологической структуры нервной системы и других тканей, а также различных аспектов общей патологии. Эти статьи разошлись по многим изданиям, некоторые были собраны Рамоном-и-Кахалем и его учениками в «Ежеквартальном обзоре нормальной и патологической гистологии» (начал издаваться в 1888 году), затем многие появлялись под заголовком «Сообщения лаборатории биологических исследований Мадридского университета».
Работы Рамона-и-Кахаля по структуре коры головного мозга в 1900—1901 годах были частично объединены и переведены на немецкий язык Й. Бреслером.
Перу Рамона-и-Кахаля принадлежат «Правила научных исследований», выдержавшие шесть изданий на испанском языке и перевод на немецкий (1933).
Рамон-и-Кахаль является одним из создателей теории цветной фотографии. Ему принадлежат сочинения философского и литературного характера.[1]
Умер Рамон-и-Кахаль 17 октября 1934 года в Мадриде.
Вклад в науку Кахаля[править | править код]
- Создание на основе клеточной теории нейронной теории нервной системы. Нейроны различаются в анатомическом, генетическом, функциональном, трофическом, патологическом, поведенческом смысле.
- Открытие принципа динамической поляризации нейрона. Возбуждения в нейроне всегда передаются от дендрита нервной клетки к телу и дендритам другой нервной клетки, затем к аксону этой нервной клетки. Нервные клетки соединены в цепи, передающие возбуждения от одной клетки к другой.
- Создание новой микроскопической анатомии мозга и нервной системы. Впервые дал ясное описание нервных структур, особенно коры мозжечка, коры больших полушарий, обонятельной луковицы, спинного мозга, среднего мозга, таламуса, гиппокампа, сетчатки, вегетативных ганглиев и т.д.
- Морфологическая разработка учения о дегенерации и регенерации в нервной системе. Сформулировал теорию нейротропизма, которая и поныне играет большое значение в работах по культивированию и трансплантации нервной ткани.
- Изучение нейрогенеза нервной ткани как метод научного исследования.
- Создание и усовершенствование гистологических методов, основанных на избирательной импрегнации серебром.
- Открытия в области патологической анатомии и гистологии.[1]
Признание[править | править код]
За свою жизнь Рамон-и-Кахаль заслужил немало наград и почетных званий: член Мадридской королевской академии наук (1895), член Мадридской королевской медицинской академии (1897), член Испанского общества естественной истории (1897), член Лиссабонской академии наук (1897), почётный член Испанской академии медицины и хирургии. Его также избрали почётным доктором медицины Кембриджского (1894), Вюрцбургского университетов (1896) и доктором философии университета Кларка (Уорчестер, США, 1899).
Рамон-и-Кахаль являлся членом-корреспондентом Медико-физиологического общества Вюрцбурга (1895), Медицинского общества Берлина (1895), Общества медицинских наук Лиссабона (1896), Венского общества психиатрии и неврологии (1896), Парижского биологического общества (1887), Национальной медицинской академии Лимы (1897), Институтского общества Коимбры (1898); почётным членом Итальянского психиатрического общества (1887) и Медицинского общества Гента(Бельгия, 1900). В 1906 году он был избран членом-корреспондентом Парижской медицинской академии, в 1909 году избран иностранным членом Лондонского королевского общества[2], в 1920 — Национальной академии наук США[3], в 1916 был избран в Шведскую академию наук.
Рамону-и-Кахалю присвоено несколько наград, включая Rubio Prize за «Элементы гистологии», Fauvelle Prize Парижского биологического общества (1896), Приз Москвы, присуждаемый Московской городской думой за работы в области медицины каждые три года (1897). В 1900 году на Международном медицинском конгрессе в Париже его чествовали за службу науке и человечеству. В 1901 году получил Орден Изабеллы Католической.
В марте 1904 года Рамона-и-Кахаля пригласили в Лондон, где он прочёл лекцию перед Королевским обществом, и в университет Кларка в Уорчестере, США, для выступления с тремя лекциями о структуре человеческого мозга и последних исследованиях в этой области.
В 1905 году Берлинская королевская академия наук наградила Рамона-и-Кахаля медалью Гельмгольца.
В 1906 году учёного ожидала высочайшая научная награда: Нобелевская премия в области физиологии и медицины за работы по структуре нервной системы, которую он разделил с Камилло Гольджи. Учёный описал структуру и организацию клеток в различных областях головного мозга. Эта цитоархитектоника до сих пор является основой для изучения церебральной локализации – определения специализированных функций различных областей головного мозга.
В 1914 году получил Орден Почётного легиона.
В 1952 году Институт Каролины опубликовал книгу объемом 651 страница в честь столетнего юбилея учёного (Acta Physiol. Scand., Vol. 29, Suppl. 106).
Названы в честь Рамон-и-Кахаля[править | править код]
- Интерстициальная клетка Кахаля
- Тельце Кахаля
- Клетка Кахаля — Ретциуса
- В 1935 г. Международный астрономический союз присвоил имя Рамона-и-Кахаля кратеру на видимой стороне Луны.
Примечания[править | править код]
- ↑ Перейти к:1 2 С.Р. Кахаль Автобиография (воспоминания о моей жизни), М.: Медицина, 1985, тираж 7000 экз.
- Перейти↑ Ramon y Cajal; Santiago (1852 — 1934) (англ.)
- Перейти↑ Santiago Ramon y Cajal (англ.)
Литература[править | править код]
- Архангельский Г. В. История неврологии от истоков до XX века. М, Медицина, 1965.
- Дойников Б. С. Избранные труды по нейроморфологии и невропатологии. М, Медгиз, 1955, с. 59-111, 224—310 и др.
- Поляков Г. И. Современное состояние нейронной теории. — В кн.: «Некоторые теоретические вопросы строения и деятельности мозга», М., Медгиз, 1960, 22-48.
- Бабминдра В. П., Воробьев В. С. Сантьяго Рамон-и-Кахаль и его роль в создании современной нейробиологии (к 50-летию со дня смерти). «Арх. анат., гистол. и эмбриол.», 1985, т. 88, № 2, 87-92.
Ссылки[править | править код]
- Биография Сантьяго Рамон-и-Кахаля на сайте Нобелевского комитета (англ.)
Гольджи, Камилло
[править | править код]
Материал из Википедии — свободной энциклопедии
Перейти к навигацииПерейти к поиску
В Википедии есть статьи о других людях с фамилией Гольджи.
| Камилло Гольджи | ||||
| итал. Camillo Golgi | ||||
 |
||||
| Дата рождения | 7 июля 1843 | |||
|---|---|---|---|---|
| Место рождения | Кортено, Ломбардия, Ломбардо-Венецианское королевство | |||
| Дата смерти | 21 января 1926 (82 года) | |||
| Место смерти | Павия, Ломбардия, Италия | |||
| Страна | ||||
| Научная сфера | гистология | |||
| Место работы |
|
|||
| Альма-матер |
|
|||
| Учёная степень | доктор медицины (1868) | |||
| Научный руководитель | Джулио Биззоцеро | |||
| Известен как | исследователь нервной системы | |||
| Награды и премии |
|
|||
Ками́лло Го́льджи (итал. Camillo Golgi; 7 июля 1843, Кортено — 21 января 1926, Павия) — итальянский врач и учёный, лауреат Нобелевской премии по физиологии и медицине в 1906 году, совместно с Сантьяго Рамон-и-Кахалем, «в знак признания их трудов о структуре нервной системы».
Биография[править | править код]
Камилло Гольджи родился 7 июля 1843 года (по некоторым источникам 7 июля 1844 года) на севере Италии, в деревне Кортено (сейчас Кортено-Гольджи), рядом с городом Брешиа. Его отец был врачом, что и определило дальнейшую судьбу будущего нобелевского лауреата.
Медицинское образование Гольджи получил в университете Павии. Среди его преподавателей были такие видные медики XIX века, как Паоло Мантегацца и Джулио Биззоцеро (сам Гольджи позже заявлял, что Биззоцеро очень сильно повлиял на него и его научные исследования). После окончания университета в 1865 году Гольджи продолжил работу в местном госпитале св. Матвея. В это время он в основном занимался неврологией, в том числе расстройствами психики и изучением мозга.
В 1872 году Гольджи был приглашен на пост главного врача в госпиталь хронических болезней в Аббьятеграссо, и, как считается, именно здесь, в уединении, превратив маленькую кухню в лабораторию, он начал изучение нервной системы человека.
Некоторое время Гольджи занимал должность профессора гистологии в университете Павии[1], затем короткое время пребывал в Сиене, но снова вернулся в Павию, где в 1881 году получил кафедру общей патологии, унаследовав её от своего учителя, Джулио Биззоцеро. Гольджи надолго обосновался в Павии и женился на племяннице Биззоцеро, Донне Лине.
Ещё во время работы в госпитале св. Матвея Гольджи проявлял интерес к изучению малярии. Ему удалось определить три формы паразитов и три вида лихорадки, связанных с этой болезнью. После длительного изучения в 1890 годуГольджи нашёл способ наиболее характерных фаз.
Гольджи был известным преподавателем, чья лаборатория была всегда открыта желающим заниматься наукой. Он никогда не занимался практической медициной, но возглавлял отделение общей патологии в госпитале св. Матвея, где проходили практику молодые доктора. Он также основал и возглавил Институт серотерапии и вакцинации провинции Павия. Гольджи долгое время являлся ректором университета Павии и избирался сенатором Итальянского королевства. В 1905 году он стал иностранным членом-корреспондентом Российской академии наук.
К началу Первой мировой войны Гольджи перешагнул семидесятилетний рубеж, но принял на себя руководство военным госпиталем в Павии, на базе которого создал нейропатологический и механотерапевтический центр для изучения и лечения периферической нервной системы и реабилитации раненых.
Но величайшей работой Гольджи стал революционный метод окрашивания отдельных нервов и клеток, названный «чёрной реакцией». В методе использовался слабый раствор нитрата серебра, с помощью которого удавалось проследить процесс деления клетки. Гольджи считал свои заслуги более чем скромными, хотя на самом деле метод стал настоящим открытием. В течение всей жизни он продолжал работу над процессом, изменяя и совершенствуя технологию.
Высшее признание пришло к Гольджи в 1906 году, когда он был награждён Нобелевской премией за изучение нервной системы, разделив её с Сантьяго Рамон-и-Кахалем. В музее университета Павии есть зал, посвящённый Гольджи, где представлены более восьми десятков дипломов, грамот и других наград, полученных учёным.
В браке с Донной Линой Алетти Гольджи не имел собственных детей, но пара удочерила племянницу Гольджи. 21 января 1926 года в Павии, где прожил всю жизнь, Гольджи скончался.
Объекты, названные в честь учёного[править | править код]
- Аппарат Гольджи
- Сухожильный орган Гольджи — один из типов клеток-рецепторов сухожилий
- Окрашивание по методу Гольджи — техника окрашивания нервной ткани
- Клетка Гольджи в мозжечке
- Нейрон Гольджи I типа — нервные клетки с длинным аксоном
- Нейрон Гольджи II типа — нервные клетки с коротким аксоном или без аксона
- Гольджи — кратер на видимой стороне Луны
Примечания[править | править код]
- Перейти↑ Гольджи, Камилло // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки[править | править код]
- Биография Камилло Гольджи на сайте Нобелевского комитета (англ.)
- Профиль Камилло Гольджи на официальном сайте РАН
7. Нейроны
Основными структурными особенностями нейронов являются перикария, дендриты и аксоны Нейроны содержат те же самые внутриклеточные компоненты, что и другие клетки Молекулярные маркеры могут использоваться для идентификации нейронов
Нейро́н, или невро́н (от др.-греч. νεῦρον — волокно, нерв) — структурно-функциональная единица нервной системы. Нейрон — электрически возбудимая клетка, которая обрабатывает, хранит и передает информацию с помощью электрических и химических сигналов. Нейрон имеет сложное строение и узкую специализацию. Клетка содержит ядро, тело клетки и отростки (дендриты и аксоны). В головном мозге человека насчитывается около 85—86 миллиардов нейронов[1][2]. Нейроны могут соединяться один с другим, формируя биологические нейронные сети. Нейроны разделяют на рецепторные, эффекторные и вставочные.
Сложность и многообразие функций нервной системы определяются взаимодействием между нейронами. Это взаимодействие представляет собой набор различных сигналов, передаваемых между нейронами или мышцами и железами. Сигналы испускаются и распространяются с помощью ионов. Ионы генерируют электрический заряд (потенциал действия), который движется по телу нейрона.
Важное значение для науки имело изобретение метода Гольджи в 1873 году, позволявшего окрашивать отдельные нейроны[3][4]. Термин «нейрон» (нем. Neuron) для обозначения нервных клеток введён Г. В. Вальдейером в 1891 году[5][6].
Строение нейронов
Нейрон состоит из тела диаметром от 3 до 130 мкм. Тело содержит ядро (с большим количеством ядерных пор) и органеллы (в том числе сильно развитый шероховатый ЭПР с активными рибосомами, аппарат Гольджи), а также из отростков. Выделяют два вида отростков: дендриты и аксон. Нейрон имеет развитый цитоскелет, который проникает в его отростки. Цитоскелет поддерживает форму клетки, его нити служат «рельсами» для транспорта органелл и упакованных в мембранные пузырьки веществ (например, нейромедиаторов). Цитоскелет нейрона состоит из фибрилл разного диаметра: Микротрубочки (Д = 20—30 нм) — состоят из белка тубулина и тянутся от нейрона по аксону, вплоть до нервных окончаний. Нейрофиламенты (Д = 10 нм) — вместе с микротрубочками обеспечивают внутриклеточный транспорт веществ. Микрофиламенты (Д = 5 нм) — состоят из белков актина и миозина, особенно выражены в растущих нервных отростках и в нейроглии.(Нейроглия, или просто глия (от др.-греч. νεῦρον — волокно, нерв + γλία — клей), — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в среднем в 10—50 раз больше, чем нейронов).
В теле нейрона выявляется развитый синтетический аппарат, гранулярная ЭПС нейрона окрашивается базофильно и известна под названием «тигроид». Тигроид проникает в начальные отделы дендритов, но располагается на заметном расстоянии от начала аксона, что служит гистологическим признаком аксона. Нейроны различаются по форме, числу отростков и функциям. В зависимости от функции выделяют чувствительные, эффекторные (двигательные, секреторные) и вставочные. Чувствительные нейроны воспринимают раздражения, преобразуют их в нервные импульсы и передают в мозг. Эффекторные (от лат. effectus — действие) — вырабатывают и посылают команды к рабочим органам. Вставочные — осуществляют связь между чувствительными и двигательными нейронами, участвуют в обработке информации и выработке команд.
Различается антероградный (от тела) и ретроградный (к телу) аксонный транспорт.
Аксоны и дендриты
Аксон — длинный отросток нейрона. Приспособлен для проведения возбуждения и информации от тела нейрона к нейрону или от нейрона к исполнительному органу. Дендриты — короткие и сильно разветвлённые отростки нейрона, служащие главным местом образования влияющих на нейрон возбуждающих и тормозных синапсов (разные нейроны имеют различное соотношение длины аксона и дендритов), и которые передают возбуждение к телу нейрона. Нейрон может иметь несколько дендритов и обычно только один аксон. Один нейрон может иметь связи со многими (до 20 тысяч) другими нейронами.
Дендриты делятся дихотомически, аксоны же дают коллатерали. В узлах ветвления обычно сосредоточены митохондрии.
Дендриты не имеют миелиновой оболочки, аксоны же могут её иметь. Местом генерации возбуждения у большинства нейронов является аксонный холмик — образование в месте отхождения аксона от тела. У всех нейронов эта зона называется триггерной.
Си́напс (греч. σύναψις, от συνάπτειν — обнимать, обхватывать, пожимать руку) — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторнойклеткой. Служит для передачи нервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Одни синапсы вызывают деполяризацию нейрона и являются возбуждающими, другие — гиперполяризацию и являются тормозными. Обычно для возбуждения нейрона необходимо раздражение от нескольких возбуждающих синапсов.
Термин был введён английским физиологом Чарльзом Шеррингтоном в 1897 г.
7.1. Развитие и рост нейрона Конус роста
Развитие и рост нейрона Конус роста Вопрос о делении нейронов в настоящее время остаётся дискуссионным. По одной из версий нейрон развивается из небольшой клетки-предшественницы, которая перестаёт делиться ещё до того, как выпустит свои отростки. Первым начинает расти аксон, а дендриты образуются позже. На конце развивающегося отростка нервной клетки появляется утолщение, которое прокладывает путь через окружающую ткань. Это утолщение называется конусом роста нервной клетки. Он состоит из уплощенной части отростка нервной клетки с множеством тонких шипиков. Микрошипики имеют толщину от 0,1 до 0,2 мкм и могут достигать 50 мкм в длину, широкая и плоская область конуса роста имеет ширину и длину около 5 мкм, хотя форма её может изменяться. Промежутки между микрошипиками конуса роста покрыты складчатой мембраной. Микрошипики находятся в постоянном движении — некоторые втягиваются в конус роста, другие удлиняются, отклоняются в разные стороны, прикасаются к субстрату и могут прилипать к нему. Конус роста заполнен мелкими, иногда соединёнными друг с другом, мембранными пузырьками неправильной формы. Под складчатыми участками мембраны и в шипиках находится плотная масса перепутанных актиновых филаментов. Конус роста содержит также митохондрии, микротрубочки и нейрофиламенты, аналогичные имеющимся в теле нейрона. Микротрубочки и нейрофиламенты удлиняются главным образом за счёт добавления вновь синтезированных субъединиц у основания отростка нейрона. Они продвигаются со скоростью около миллиметра в сутки, что соответствует скорости медленного аксонного транспорта в зрелом нейроне. Поскольку примерно такова и средняя скорость продвижения конуса роста, возможно во время роста отростка нейрона в его дальнем конце не происходит ни сборки, ни разрушения микротрубочек и нейрофиламентов. Новый мембранный материал добавляется у окончания. Конус роста — это область быстрого экзоцитоза и эндоцитоза, о чём свидетельствует множество находящихся здесь пузырьков. Мелкие мембранные пузырьки переносятся по отростку нейрона от тела клетки к конусу роста с потоком быстрого аксонного транспорта. Мембранный материал, синтезируется в теле нейрона, переносится к конусу роста в виде пузырьков и включается здесь в плазматическую мембрану путём экзоцитоза, удлиняя таким образом отросток нервной клетки. Росту аксонов и дендритов обычно предшествует фаза миграции нейронов, когда незрелые нейроны расселяются и находят себе постоянное место.
7.2. Классификации нейронов
Структурная классификация
На основании числа и расположения дендритов и аксона нейроны делятся на безаксонные, униполярные нейроны, псевдоуниполярные нейроны, биполярные нейроны и мультиполярные (много дендритных стволов, обычно эфферентные) нейроны.
Безаксонные нейроны — небольшие клетки, сгруппированы вблизи спинного мозга в межпозвоночных ганглиях, не имеющие анатомических признаков разделения отростков на дендриты и аксоны. Все отростки у клетки очень похожи. Функциональное назначение безаксонных нейронов слабо изучено.
Униполярные нейроны — нейроны с одним отростком, присутствуют, например в сенсорном ядре тройничного нерва в среднем мозге. Многие морфологи считают, что униполярные нейроны в теле человека и высших позвоночных не встречаются.
Биполярные нейроны — нейроны, имеющие один аксон и один дендрит, расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях.
Мультиполярные нейроны — нейроны с одним аксоном и несколькими дендритами. Данный вид нервных клеток преобладает в центральной нервной системе.
Псевдоуниполярные нейроны — являются уникальными в своём роде. От тела отходит один отросток, который сразу же Т-образно делится. Весь этот единый тракт покрыт миелиновой оболочкой и структурно представляет собой аксон, хотя по одной из ветвей возбуждение идёт не от, а к телу нейрона. Структурно дендритами являются разветвления на конце этого (периферического) отростка. Триггерной зоной является начало этого разветвления (то есть находится вне тела клетки). Такие нейроны встречаются в спинальных ганглиях.
Функциональная классификация
По положению в рефлекторной дуге различают афферентные нейроны (чувствительные нейроны), эфферентные нейроны (часть из них называется двигательными нейронами, иногда это не очень точное название распространяется на всю группу эфферентов) и интернейроны (вставочные нейроны).
Афферентные нейроны (чувствительный, сенсорный, рецепторный или центростремительный). К нейронам данного типа относятся первичные клетки органов чувств и псевдоуниполярные клетки, у которых дендриты имеют свободные окончания.
Эфферентные нейроны (эффекторный, двигательный, моторный или центробежный). К нейронам данного типа относятся конечные нейроны — ультиматные и предпоследние — не ультиматные.
Ассоциативные нейроны (вставочные или интернейроны) — группа нейронов осуществляет связь между эфферентными и афферентными, их делят на интризитные, комиссуральные и проекционные.
Секреторные нейроны — нейроны, секретирующие высокоактивные вещества (нейрогормоны). У них хорошо развит комплекс Гольджи, аксон заканчивается аксовазальными синапсами.
Морфологическая классификация
Морфологическое строение нейронов многообразно. При классификации нейронов применяют несколько принципов:
учитывают размеры и форму тела нейрона;
количество и характер ветвления отростков;
длину аксона и наличие специализированных оболочек.
По форме клетки, нейроны могут быть сферическими, зернистыми, звездчатыми, пирамидными, грушевидными, веретеновидными, неправильными и т. д. Размер тела нейрона варьирует от 5 мкм у малых зернистых клеток до 120—150 мкм у гигантских пирамидных нейронов.
По количеству отростков выделяют следующие морфологические типы нейронов[7]:
униполярные (с одним отростком) нейроциты, присутствующие, например, в сенсорном ядре тройничного нерва в среднем мозге;
псевдоуниполярные клетки, сгруппированные вблизи спинного мозга в межпозвоночных ганглиях;
биполярные нейроны (имеют один аксон и один дендрит), расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях;
мультиполярные нейроны (имеют один аксон и несколько дендритов), преобладающие в ЦНС.
8. Нейроглия
Практически ничто не может входить или выходить из паренхимы центральной нервной системы, не проходя через астроцитарную интерфазу. Олигодендроциты являются миелин-продуцирующими клетками в центральной нервной системе. Микроглиевая клетка играет роль в фагоцитозе и воспалительных реакциях. Эпиндемальные клетки выстраивают линии желудочков мозга и центральный канал спинного мозга. Шванновская клетка является клеткой, производящей миелин периферической нервной системы. Внеклеточное пространство между периферическими нервными волокнами занято пучками коллагеновых фибрилл, кровеносных сосудов и эндонейральных клеток
Нейроглия, или просто глия (от др.-греч. νεῦρον — волокно, нерв + γλία — клей), — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в мозге примерно равно количеству нейронов[1]. Термин ввёл в 1846 году Рудольф Вирхов[2].
Глиальные клетки имеют общие функции и, частично, происхождение (исключение — микроглия). Они составляют специфическое микроокружение для нейронов, обеспечивая условия для генерации и передачи нервных импульсов, а также осуществляя часть метаболических процессов самого нейрона.
Нейроглия выполняет опорную, трофическую, секреторную, разграничительную и защитную функции.
8.1. Классификация глиальных клеток
Микроглиальные клетки, хоть и входят в понятие «глия», не являются собственно нервной тканью, так как имеют мезодермальное происхождение. Они представляют собой мелкие отростчатые клетки, разбросанные по белому и серому веществу мозга и способные к фагоцитозу.
Макроглия — производная глиобластов, выполняет опорную, разграничительную, трофическую и секреторную функции.
- Эпендимальные клетки (некоторые ученые выделяют их из глии вообще, некоторые — включают в макроглию) напоминают однослойный эпителий, лежат на базальной мембране и имеют кубическую или призматическую форму. Выделяют:
- Эпендимоциты 1 типа — лежат на базальной мембране мягкой мозговой оболочки и участвуют в образовании гематоглифического барьера.
- Эпендимоциты 2 типа — выстилают желудочки мозга и спинномозговой канал; на апикальной части имеют реснички по направлению тока ликвора.
- Танициты — на поверхности имеют ворсинки.
- Олигодендроциты — полигональные крупные клетки, имеющие 1-5 слабо ветвящихся отростков, в зависимости от их расположения, выделяют:
- Олигодендроциты, окружающие тела нейронов в периферических ганглиях (сателиты);
- Олигодендроциты, окружающие тела нейронов в ЦНС (центральные глиоциты);
- Олигодендриды, обобщающие нервные волокна (Шванновские клетки).
- Астроциты — небольшие клетки, имеющие многочисленные ветвящиеся отростки. Различают:
- Протоплазматические астроциты — содержатся в сером веществе, отростки их усиленно ветвятся и образуют множество глиальных мембран.
- Волокнистые астроциты — их количество больше в белом веществе; морфологически отличаются наличием слабо ветвящихся отростков.
- Волокнистые астроциты — их количество больше в белом веществе; морфологически отличаются наличием слабо ветвящихся отростков.
В эмбриогенезе глиоциты (кроме микроглиальных клеток) дифференцируются из глиобластов, которые имеют два источника — медуллобласты нервной трубки и ганглиобласты ганглиозной пластинки. Оба эти источника на ранних этапах образовались из эктодермы.
Микроглия же — производное мезодермы.
8.2. Астроциты
Практически ничто не может войти или оставить паренхиму центральной нервной системы без прохождения астроцитарной интерфазы. Комплексная упаковка, достигаемая процессами и клеточными телами астроцитов, подчеркивает их участие в метаболизме мозга. Хотя астроциты традиционно были разделены на протоплазматические и волокнистые астроциты [4], эти две формы, вероятно, представляют противоположные концы спектра одного и того же типа клеток. Однако Raff et al. [23] предположили, что две группы могут происходить от разных предшественников и что предшественник волокнистого астроцита такой же, как у олигодендроцита, хотя недавние данные подтверждают линию миелинизации олигодендроцитов с участием моторных нейронов [24]. Структурные компоненты волокнистых и протоплазматических астроцитов идентичны; различия являются количественными. В первые дни эмбриогенеза различия между этими двумя вариантами были более очевидными из-за неточных методов, но с развитием лучших процедур различия стали менее очевидными.
Функции астроцитов давно обсуждались. Их основная роль связана с соединительной тканью или скелетной функцией, поскольку они инвестируют, возможно, поддерживают и обеспечивают упаковку для других компонентов ЦНС. В случае астроцитарной перестройки вокруг синаптических комплексов и тел некоторых нейронов, таких как клетки Пуркинье, было высказано предположение, что астроцит изолирует эти структуры и их нейротрансмиттеры, которые могут быть высвобождены во внеклеточное пространство, поскольку некоторые нейротрансмиттеры способны осаждение клеточного повреждения, если внеклеточные скопления не быстро очищаются. В случае глутамата, возбуждающего нейротрансмиттера, это может привести к экситотоксичности глутамата из-за переактивации ионных каналов на нервных клетках и чрезмерного проникновения кальция, что может вызвать апоптоз. При нормальных обстоятельствах астроцит участвует в поглощении глутамата, благодаря чему он ферментативно детоксифицирует это вещество передатчика, превращая его в глутамин, который затем рециркулируют в нейрон.
Одна известная функция астроцита связана с ремонтом. После травмы астроциты неизменно размножаются, разбухают, накапливают гликоген и подвергаются фиброзу путем накопления филаментов, выраженных нейрохимически как увеличение глиального фибриллярного кислого белка (GFAP). Это состояние глиоза может быть полным, и в этом случае все остальные элементы теряются, оставляя глиальный шрам, или это может быть обобщенный ответ, возникающий на фоне регенерированной или нормальной паренхимы ЦНС. Волокнистый астроцитоз может встречаться как в сером, так и в белом веществе, тем самым указывая на общие связи между протоплазматическими и волокнистыми астроцитами. С возрастом как фиброзные, так и протоплазматические астроциты накапливают нити. При некоторых заболеваниях астроциты становятся макрофагами. Интересно отметить, что астроцит, вероятно, является наиболее устойчивым к болезням компонентом в ЦНС, потому что очень немногие заболевания, кроме алкоголизма, вызывают истощение астроцитов. Другой предполагаемой ролью астроцита является его участие в транспортных механизмах (см. Главу 5) и в системе ВВВ (см. Главу 32). Астроциты взаимодействуют с нейронами в различных метаболических и транспортных процессах. Считалось, что в течение некоторого времени транспортировка воды и электролитов осуществлялась астроцитом, что никогда не было окончательно продемонстрировано и в значительной степени было получено из патологических или экспериментальных данных. Известно, например, что повреждение сосудистой сети мозга, местная травма из-за жары или холода и воспалительных изменений, приводит к очаговому отеку астроцитов, по-видимому, из-за нарушений переноса жидкости. Астроцитарные вливания кровеносных сосудов указывают на роль в системе ВВВ, но исследования Риз и Карновского [25] и Брайтмана [26] показывают, что астроцитические конечные ноги оказывают малое сопротивление движению молекул и что блокирование прохода материала в мозг происходит в кровеносных сосудах, покрывающих эндотелиальные клетки (см. главу 32). Энцетелиальные клетки ЦНС проявляют избирательный перенос при трансцитозе, а поверхность астроцита также часто демонстрирует признаки эндоцитоза из-за присутствия покрытых клатрином ям, структур, которые, как известно, участвуют в ряде секреторных и рециркулирующих механизмов. Во время воспаления эти механизмы нарушаются и происходят изменения проницаемости эндотелиальных плотных соединений и образования отеков внутри и вокруг соседних астроцитов. Наконец, считается, что астроциты ответственны за регулирование локальных уровней рН и локального ионного баланса.
8.3. Миелинирующие олигодендроциты
Миелинирующие олигодендроциты широко изучались [5, 30] (см. Гл.4). Изучение ЦНС во время миелиногенеза (рис.1-15) показывает связи между телом клетки и миелиновой оболочкой [31]; однако связи между этими элементами никогда не были продемонстрированы у обычного взрослого животного, в отличие от аналога PNS, клетки Шванна. В отличие от клетки Шванна (см. Ниже), олигодендроцит способен одновременно продуцировать многие междоузлии миелина. Было подсчитано, что олигодендроциты в зрительном нерве продуцируют от 30 до 50 междоузлий миелина [5]. В дополнение к этой тяжелой структурной приверженности олигодендроцит обладает медленной митотической скоростью и низкой регенеративной способностью. Поэтому можно ожидать, что повреждение только нескольких олигодендроцитов приведет к заметной области первичной демиелинизации. В большинстве заболеваний ЦНС, в которых миелин является мишенью, олигодендроциты являются одними из наиболее уязвимых элементов и первыми дегенерируют. Несколько аналогичный нейрону, относительно небольшая олигодендроцитная сома продуцирует и поддерживает еще много раз собственный объем мембраны и цитоплазмы. Например, рассмотрим средний олигодендроцит 12 мкм, продуцирующий 20 междоузлий миелина [5]. Каждый аксон имеет диаметр 3 мкм и покрыт по меньшей мере шестью пластинами миелина, каждая пластинка представляет собой два плавленых слоя единичной мембраны. При статистическом анализе с учетом длины междоузлия миелина, который может составлять 500 мкм, и длины мембран клеточных процессов, соединяющих оболочку с телом клетки (≈12 мкм), соотношение между поверхностью площадь сотовой ячейки и миелин, который она поддерживает, составляет приблизительно 1: 620. Однако в большинстве случаев это отношение, вероятно, находится в области 1: 3000. В редких случаях олигодендроциты продуцируют миелин вокруг структур, отличных от аксонов, в том, что миелин был задокументирован вокруг нейронных сомата и неаксиальных профилей.
8.4. Микроглия и эпендимальные клетки
Микроглиальная клетка играет роль в фагоцитозе и воспалительных реакциях. Микроглиальная клетка, клетка мезодермального происхождения, расположенная в нормальном мозге в состоянии покоя (рис. 1-3) и предполагается для того, чтобы стать очень подвижный активный макрофаг во время болезни и основную эффекторную клетку в иммуно-опосредованном повреждении ЦНС. Микроглия может быть окрашена выборочно и продемонстрирована с помощью световой микроскопии с использованием метода карбоната серебра Hortega, но для их ультраструктурной демонстрации не существует сопоставимого метода.
Эпендимальные клетки выстилают мозговые желудочки и центральный канал спинного мозга. Эпендимальные клетки расположены в единичных массивах палисада и выстилают желудочки мозга и центрального канала спинного мозга. Они обычно ресничны, их реснички распространяются в полость желудочков. Их тонкая структура была освещена Брайтманом и Палеем [39]. Они обладают несколькими особенностями, которые четко отличает их от любой другой клетки ЦНС. Цилии выходят из верхушечного полюса клетки, где они прикреплены к блефаропласту, базальному телу (рис.1-17), который закреплен в цитоплазме с помощью цилиарных корешков и базальной стопы. Базальная стопа — это сократительный компонент, который определяет направление цилиарного удара. Как и все жгутиковые структуры, ресничка содержит общее расположение микротрубочек из девяти периферических пар вокруг центрального дублета.
8.5. Шванновские клетки (леммоциты)
Шванновские клетки (леммоциты) — вспомогательные клетки нервной ткани, которые формируются вдоль аксонов периферических нервных волокон. Создают, а иногда и разрушают, электроизолирующую миелиновую оболочку нейронов. Выполняют опорную (поддерживают аксон) и трофическую (питают тело нейрона) функции. Описаны немецким физиологом Теодором Шванном в 1838 году и названы в его честь.
Каждое периферическое нервное волокно одето тонким цитоплазматическим слоем — невролеммой или шванновской оболочкой. Волокно является миелинизированным, если между ним и цитоплазмой шванновской клетки имеется значительный слой миелина. Если волокна лишены миелина, то они называются немиелинизированными безмякотными.[1] Шванновские клетки могут осуществлять волнообразные движения, что, вероятно, способствует транспортировке различных веществ по отросткам нервных клеток.
С нарушением работы шванновских клеток связаны такие нервные заболевания, как синдром Гийена — Барре, болезнь Шарко — Мари — Тута, шванноматозис и хроническая воспалительная демиелинизирующая полинейропатия. Демиелинизация в основном происходит[2] из-за ослабления двигательных функций шванновских клеток, в результате чего они оказываются не способны образовывать миелиновую оболочку.
С мутацией шванновских клеток (отсутствием одной из 14 хромосом) связана трансмиссивная злокачественная лицевая опухоль тасманийского дьявола, угрожающая его дикой популяции[3].
9. Миелин
Миелин (в некоторых изданиях употребляется некорректная теперь форма миэлин) — вещество, образующее миелиновую оболочку нервных волокон.
Миелиновая оболочка — электроизолирующая оболочка, покрывающая аксоны многих нейронов. Миелиновую оболочку образуют глиальные клетки: в периферической нервной системе — Шванновские клетки, в центральной нервной системе — олигодендроциты. Миелиновая оболочка формируется из плоского выроста тела глиальной клетки, многократно оборачивающего аксон подобно изоляционной ленте. Цитоплазма в выросте практически отсутствует, в результате чего миелиновая оболочка представляет собой, по сути, множество слоёв клеточной мембраны.
Комбинированная диаграмма, суммирующая ультраструктурные данные о миелине ЦНС. В верхней части олигодендроглиальная клетка показана соединением с оболочкой процессом. Обрезанный вид миелина и аксона иллюстрирует взаимосвязь этих двух структур в узловой и паранодальной областях. (Для ясности были сделаны только несколько миелиновых слоев.) В междоменной области поперечное сечение раскрывает внутренние и внешние мезаксоны и их связь с внутренними цитоплазматическими клиньями и внешней петлей цитоплазмы. Обратите внимание, что в отличие от минелина PNS, нет полного кольца цитоплазмы, окружающего снаружи оболочки. Нижняя часть рисунка показывает примерно размеры и внешний вид одной повторяющейся единицы миелина, как видно с фиксированными и внедренными препаратами в электронном микроскопе. Это контрастирует с размерами кривой электронной плотности минелина ЦНС, полученной рентгеноструктурными исследованиями в свежем нерве. Ниже перечислены компоненты, отвечающие за пики и впадины кривой. (Адаптировано с разрешения Нортона, У. Т. Миелин-оболочка. У Е. С. Голденсона и С. Х. Аппеля (ред.), Научные подходы к клинической неврологии. Филадельфия: Lea & Febiger, 1977, pp. 259-298.)
Миелин прерывается только в области перехватов Ранвье, которые встречаются через правильные промежутки длиной примерно 1 мкм. В связи с тем, что ионные токи не могут проходить сквозь миелин, вход и выход ионов осуществляется лишь в области перехватов. Это ведёт к увеличению скорости проведения нервного импульса. Таким образом, по миелинизированным волокнам импульс проводится приблизительно в 5—10 раз быстрее, чем по немиелинизированным.
Из вышесказанного становится ясным, что миелин и миелиновая оболочка являются синонимами. Обычно термин миелин употребляется в биохимии, вообще при упоминании его молекулярной организации, а миелиновая оболочка — в морфологии и физиологии.
Химический состав и структура миелина, произведённого разными типами глиальных клеток, различны. Цвет миелинизированных нейронов — белый, отсюда название «белого вещества» мозга.
Приблизительно на 70—75 % миелин состоит из липидов, на 25—30 % — из белков. Такое высокое содержание липидов отличает миелин от других биологических мембран.
Склерозы, аутоиммунные заболевания, связанные с разрушением миелиновой оболочки аксонов в некоторых нервах, приводит к нарушению координации и равновесия.
9.1. Молекулярная организация миелина
Уникальной особенностью миелина является его формирование в результате спирального обвития отростков глиальных клеток вокруг аксонов, настолько плотного, что между двумя слоями мембраны практически не остается цитоплазмы. Миелин представляет собой эту двойную мембрану, то есть состоит из липидного бислоя и белков, связанных с ним.
Среди белков миелина выделяют так называемые внутренние и внешние белки. Внутренние интегрированы в мембрану, внешние расположены поверхностно, и поэтому связаны с ней слабее. Миелин также содержит гликопротеиды и гликолипиды.
Белки составляют 25—30 % массы сухого вещества миелиновой оболочки нейронов ЦНС млекопитающих. На долю липидов приходится приблизительно 70—75 % от сухой массы. В миелине спинного мозга процент содержания липидов выше, чем в миелине головного. Большую часть липидов составляют фосфолипиды (43 %), остальное — холестерин и галактолипиды в примерно равном соотношении
Миелинизация аксонов
В образовании миелиновой оболочки и структуре миелина ЦНС и периферической нервной системы имеются отличия.
Миелинизация в ЦНС
Обеспечивается олигодендроцитами. Каждый олигодендроглиоцит образует несколько «ножек», каждая из которых оборачивает часть какого-либо аксона. В результате один олигодендроцит связан с несколькими нейронами. Перехваты Ранвье здесь шире, чем на периферии. Согласно исследованию 2011 г. мощную миелиновую изоляцию в мозге получают наиболее активные аксоны, что позволяет им далее работать ещё эффективнее. Важную роль в этом процессе играет сигнализатор глутамат[1][2].
Диаграмма, показывающая одну клетку Шванна и ее оболочку из миелина, развернутую из периферического аксона (вверху слева). Лист миелина PNS, как и миелоин ЦНС, окружен трубкой цитоплазмы и имеет дополнительные трубки цитоплазмы, которые составляют щели Шмидта-Лантермана, проходящие через междольные области. Горизонтальная секция (вверху справа) показывает, что эти дополнительные трубки цитоплазмы возникают из областей, где поверхности цитоплазматической мембраны не слиты. Диаграмма внизу — увеличенный вид части верхней левой диаграммы, с ячейкой Шванна и ее мембраной, обернутой вокруг аксона. Трубка, образующая латеральные петли, уплотняется до аксолемы в паранодальной области, а цитоплазматические трубки в междолинной области образуют щели Шмидта-Лантермана. Эти чертежи не масштабируются. (Адаптировано из Hirano, A. and Dembitzer, H. M. Структурный анализ миелиновой оболочки в центральной нервной системе J. Cell Biol., 34: 555-567, 1967).
Миелинизация в периферической НС
Обеспечивается Шванновскими клетками. Каждая Шванновская клетка формирует спиральные пластинки миелина и отвечает лишь за отдельный участок миелиновой оболочки отдельного аксона. Цитоплазма Шванновской клетки остается только на внутренней и наружной поверхностях миелиновой оболочки. Между изолирующими клетками также остаются перехваты Ранвье, которые здесь уже, чем в ЦНС.
Так называемые «немиелинизированные» волокна все равно изолированы, но по несколько иной схеме. Несколько аксонов частично погружены в изолирующую клетку, которая не смыкается вокруг них до конца.
Образование миелина в периферической нервной системе. (A) Шванновская ячейка окружила аксон, но внешние поверхности плазматической мембраны еще не слиты в мезаксоне. (B) Мезаксон слился в пятислойную структуру и спиралел один раз вокруг аксона. (C) Несколько слоев миелина сформировались, но не полностью уплотнены. Обратите внимание на цитоплазму, захваченную в зонах, где поверхности цитоплазматической мембраны еще не слиты. (D) Компактный миелин показывает только несколько слоев для ясности. Обратите внимание, что клеточная цитоплазма Шванна образует кольцо как внутри, так и снаружи оболочки. (Адаптировано с разрешения Нортона, У. Т. Миелин-оболочка. У Е. С. Голденсона и С. Х. Аппеля (ред.), Научные подходы к клинической неврологии. Филадельфия: Lea & Febiger, 1977, pp. 259-298.)
Установлено, что поздняя миелинизация нейронов, продолжающаяся у человека даже во взрослом возрасте, сильно отличает его от шимпанзе и других приматов[3].
10. Белки миелина
Миелин центральной нервной системы содержит некоторые уникальные белки. Белковый состав миелина ЦНС проще, чем у других мембран головного мозга, с основным белком миелина (MBP) и протеолипидным белком (PLP), составляющим 60-80% от общего количества у большинства видов. Многие другие белки и гликопротеины присутствуют в меньшей степени. За исключением MBP, миелиновые белки не являются легко экстрагируемыми и не растворимыми в водных средах. Однако, как и другие мембранные белки, они могут быть солюбилизированы в растворах додецилсульфата натрия и в этом состоянии могут быть легко разделены электрофорезом в полиакриламидных гелях. Этот метод разделяет белки в основном в соответствии с их молекулярной массой (общая нотация Mr для относительной молекулярной массы, а другая — для определения молекулярной массы в килодальтонах, кДа). Наличие связанных углеводов или необычных структурных особенностей несколько искажает связь между электрофоретической миграцией и молекулярным весом, поэтому терминология для определения местоположения белка в таком геле воспринимается как «кажущаяся» молекулярная масса. Белковый состав миелина головного мозга человека и крысы показан на рис. 4-12, В и D соответственно. Количественное преобладание двух белков в миелине ЦНС человека является ясным, то есть MBP и PLP. Эти два белка являются основными составляющими всех миелиновых мембран млекопитающих млекопитающих, и подобные белки присутствуют в миелиновых мембранах многих более низких видов. Общая ориентация этих двух белков в компактном миелине ЦНС изображена на рис. 4-11
Полиакриламидный гель-электрофорез белков миелина в присутствии додецилсульфата натрия (SDS). Белки миелина (А) человека, миелина ЦНС человека (В), миелина (П) крысиного типа (П) и миелина ЦНС крысы (Ц) были солюбилизированы детергентным SDS, электрофорезированным и окрашенным голубым голубым кумасси. Электрофоретическая система отделяет белки в основном в зависимости от их молекулярного размера с наименьшими белками, мигрирующими дальше на дно геля. Аббревиатуры для белков такие же, как в тексте или определенные ниже. Три полосы MBP в дорожках A и B представляют собой изоформы 17,2, 18,5 и 21,5 кДа, генерируемые альтернативным сплайсированием мРНК у людей, а четыре полосы MBP в дорожках C и D представляют собой 14,0, 17,0, 18,5 и 21,5 кДа изоформы, образующиеся у крыс (см. рис. 4-13). 18.5 кДа MBP и 14 кДа MBP также называются P1 и Pr, соответственно, в терминологии для PNS. Модификация 26 кДа, вероятно, является слабой полосой чуть выше PLP, что наиболее очевидно в полосе D. CNP мигрирует как плотный дублет, а нижняя и верхняя полосы иногда называются CNP1 и CNP2 соответственно. Обратите внимание, что местоположение, показанное для MAG (которое слишком слабо окрашивается, чтобы хорошо видно на гелях) находится чуть выше дискретной группы Coomassie-bluestained на дорожке D, которая, вероятно, является субъединицей 96 кДа Na +, K + — ATPase. Т, тубулин. 170 кДа GP, 170 кДа гликопротеина.
11. Протеолипидный белок
Протеолипидный белок. Myelin PLP, также известный как белок Folch-Lees [8, 9], обладает необычным физическим свойством растворимости в органических растворителях. Молекулярная масса PLP составляет около 30 000, хотя она аномально мигрирует на гелях додецилсульфата натрия (SDS) и дает более низкую кажущуюся молекулярную массу. Аминокислотная последовательность, сильно сохраняющаяся во время эволюции, содержит четыре мембраны, охватывающие домены, и PLP описывается как один из белков tetraspan. Оба N- и С-конца находятся на цитоплазматической стороне, как показано на рис.4-11.
Диаграммное представление современных концепций молекулярной организации компактных ЦНС и МПС-миелина. Прикладка внеклеточных (Ext.) Поверхностей олигодендроцитов или клеточных мембран Шванна для формирования линии внутрипериода (IP) показана в верхней части рисунка. В нижней части рисунка показано расположение цитоплазматических (Cyto.) Поверхностей мембран миелинообразующих клеток с образованием основной плотной линии (MD). Ширина липидных бислоев и расстояние внутрипериодических и крупных плотных линий на этом рисунке пропорциональны размерам, определяемым методом рентгеновской дифракции [4]. См. Текст для подробного описания этой модели. Темно-оранжевые структуры на P0 и PMP представляют собой одиночные олигосахаридные фрагменты на каждом белке. Видимость на вершине P0 представляет собой остаток триптофана, который, по мнению рентгеноструктурного анализа, может взаимодействовать с биполярным слоем, но ожидаемая тетрамеризация P0 не показана для схематического упрощения. Хотя молекулы PLP могут проявлять гомофильные взаимодействия, как было предложено в одном положении на рисунке, нет сильных экспериментальных данных, подтверждающих это, как в случае P0. Эти диаграммы не включают CNP, MAG и другие количественно незначительные белки изолированного миелина, потому что они, вероятно, не играют значительной структурной роли в большинстве компактных миелинов. Фактически, многие из них локализованы выборочно в областях миелиновых оболочек, отличных от компактного миелина.
Важную роль PLP в стабилизации внутрипериодной линии миелина ЦНС, как правило, принимали, в основном, из-за того, что внеклеточные петли этого белка присутствуют в этом месте. Кроме того, внутрипериодная линия ЦНС аномально конденсируется как у мышей с нокаутом PLP, так и у самопроизвольно возникающих PLP-мутантов [10] (табл. 4-2), что подтверждает структурную роль PLP при определении интервала между мембранами на линии внутрипериодического периода. PLP имеет альтернативно сплайсированную изоформу, DM20 (Mr = 20000), которая присутствует в миелине ЦНС при более низкой концентрации, чем PLP (рис.4-12). DM20 имеет сходные физические свойства с PLP и идентичен по последовательности, за исключением делеции 35 аминокислот во внутриклеточном домене [8, 9]. PLP / DM20 содержит около 4-6 молей жирных кислот (в первую очередь пальмитата, олеата или стеарата) на моль белка в сложноэфирной связи у нескольких цистеинов. Существует быстрый оборот жирных кислот, не зависящих от пептидного скелета.
11.1. Основной белок миелина
Основно́й бело́к миели́на (также осно́вный белок миелина, англ. myelin basic protein) — представляет собой основной (порядка 50 %) белковый компонент миелина. При электрофоретическом анализе в ПААГ с SDS экстрактов миелиновой оболочки человека определяется до 10 полос. Основной белок миелина находится в комплексе с липидами и имеет молекулярную массу около 30 кДа.[1][2][3]
Для основного белка миелина человека существует полиморфизм последовательностей аминокислот в 46 и 47 положении. В данном положении находятся остатки глицина, часто в сочетании остатками серина.[4] Было показано, что у больных с рассеянным склерозом отмечалась замена серина на глицин в 44—49 положениях.[5] Рядом авторов была показана высокая степень гомологии — порядка 80—90 % аминокислотной последовательности основного белка миелина у различных видов животных.[6][7][8] Так, аминокислотные последовательности основного белка миелина человека и быка отличаются лишь по остаткам аминокислот в нескольких положениях, в то время как основной белок миелина крысы отличается от основного белка миелина человека и быка положением 40 аминокислотных остатков в середине полипептидной цепи (от 118 до 157 остатка).
Основной белок миелина содержит значительный процент (приблизительно 25 %) основных аминокислот (аргинин, лизин и гистидин), равномерно распределенных по всей полипептидной цепи, что обусловливает очень высокую изоэлектрическую точку (рI = 12—13). Такие особенности приводят к взаимодействию всей молекулы основного белка миелина с карбоксильными группами мембранных липидов.[9][10]Основной белок миелина является мембранным белком и имеет значительное сродство к липидам, в комплексе с которыми и выделяется.[11]Основной белок миелина является поликатионом и формирует особенно стабильные комплексы с анионными липидами.[12] Несмотря на то, что степень связывания основного белка миелина значительно выше с кислыми липидами, она достаточно выражена и в отношении цвиттер-ионов, особенно в отношении сфингомиелина. Основной белок миелина также взаимодействует с фосфатидилэтаноламином при рН 7,2, когда этот липид находится преимущественно в цвиттер-форме. Необычна способность основного белка миелина образовывать нерастворимые комплексы с додецилсульфатом натрия при значениях рН выше и ниже изоэлектрической точки. При формировании комплексов основного белка миелина с основной массой анионных фосфолипидов, в равной степени играют роль как гидрофобные, так и электростатические взаимодействия.[13] Наиболее выраженное влияние на стабилизацию липидов основной белок миелина показывает при встраивании в липидные хвосты.[14][15] Методом рентгеноструктурного анализа было показано, что при формировании миелина происходит погружение большей части молекул основного белка миелина в слой головок липидов.

11.2. Миелин-ассоциированный гликопротеин
Миелин-ассоциированный гликопротеин и другие гликопротеины миелина ЦНС. Миелин-ассоциированный гликопротеин (MAG) представляет собой количественно меньший, 100 кДа гликопротеин в очищенных ЦНС и мицерин PNS [19, 20], который электрофореза в положении, показанном на рисунке 4-12. Однако из-за его небольшого количества (<1% от общего белка) и слабого окрашивания кумасси синим оно не соответствует одной из дискретных белковых полос, видимых на рисунке. MAG имеет единственный трансмембранный домен, который отделяет сильно гликозилированную внеклеточную часть молекулы, состоящую из пяти Ig-подобных доменов и восьми или девяти сайтов для N-связанного гликозилирования из внутриклеточного карбоксиконцевого домена. Его общая структура аналогична структуре молекулы адгезии нейронов (N-CAM). МАГ у грызунов встречается в двух регулируемых по закону изоформах, которые отличаются по своим цитоплазматическим доменам и генерируются путем альтернативного сплайсинга его мРНК. Изоформа с более длинным C-концевым хвостом (L-MAG) преобладает в начале развития во время активного миелинирования ЦНС, тогда как изоформа с более коротким цитоплазматическим хвостом (S-MAG) во время развития увеличивается, чтобы стать заметной у взрослых грызунов. MAG отсутствует в компактном многослойном миелине, но находится в периалсоциальных глиальных мембранах миелиновых оболочек. Это место рядом с аксоном и его членство в надсемействе Ig (см. Гл.7) показывают, что он функционирует в адгезии и сигнале между миелин-образующими клетками и аксолемой. Действительно, теперь накоплено существенное доказательство того, что МАГ участвует в сигнализации в обоих направлениях между глиями и аксонами, хотя его наиболее важные функции, по-видимому, различны в ЦНС и ПНС. MAG находится в подгруппе «siglec» [сиалиновая кислота-связывающие иммуноглобулин-подобные лектины] надсемейства Ig и связывается с гликопротеинами и ганглиозидами с концевыми α2-3-связанными фрагментами сиаловой кислоты.
11.3. P0 гликопротеин
P0 гликопротеин. Гель-электрофоретический анализ (рис.4-12А, С) показывает, что один белок 30 кДа, Р0, составляет более половины белка миелина ПНС. P0 является мембранным гликопротеином 1-го типа, содержащим около 220 аминокислот после удаления его сигнальной последовательности. Крыса P0 содержит один внеклеточный Ig-подобный домен из 124 аминокислот, гидрофобный трансмембранный домен из 26 аминокислот и внутриклеточный домен из 69 аминокислот [19, 23]. Аминотерминальный внеклеточный домен имеет единственный сайт для N-связанного гликозилирования, и гликаны в этом месте очень гетерогенны, многие из которых содержат сиаловую кислоту и сульфат. В дополнение к гликозилированию другие посттрансляционные модификации P0 включают фосфорилирование и ацилирование. Основное различие в общей белковой композиции PNS и миелина ЦНС состоит в том, что P0 замещает PLP в качестве основного белка, хотя миелин-образующие клетки Шванна действительно выражают очень низкие уровни PLP. Интересно отметить, что белки PLP и P0, которые настолько различны в последовательности, посттрансляционные модификации и мембранная топология, могут иметь схожие роли в формировании структур, тесно связанных с миелином CNS и PNS соответственно. Экспрессия P0 в трансфицированных клетках приводит к клеточным клеточным взаимодействиям, которые обусловлены гомофильным связыванием его внеклеточных доменов, что указывает на то, что P0 стабилизирует линию внутрипериодического минелина PNS с помощью аналогичного гомофильного связывания (рис.4-11). Относительно большой, гликозилированный, внеклеточный Ig-подобный домен P0, вероятно, объясняет большее разделение внеклеточных поверхностей в мицеине PNS относительно миелина ЦНС, где более близкое расположение этих поверхностей возможно при наличии меньших внеклеточных доменов PLP. Доказательства, рассмотренные Kirschner et al. [23] предполагает, что гомофильные взаимодействия между молекулами Р0 связаны как с белково-белковым, так и с белково-углеводными взаимодействиями. Кроме того, исследование кристаллической структуры внеклеточного домена Р0 предполагает, что молекулы Р0 кластеризуются на каждой поверхности мембраны в виде тетрамеров. Кристаллическая структура также предположила, что остаток триптофана в верхушке внеклеточного домена может взаимодействовать непосредственно с липидным бислоем на мембране. P0-белок также имеет относительно большой положительно заряженный домен на цитоплазматической стороне мембраны, что в значительной степени способствует стабилизации основной плотной линии в PNS. Полный нокаут P0 имеет глубокие последствия для структуры миелина, в отличие от ранее отмеченного, относительно доброкачественного ЦНС, связанного с делецией гена PLP. P0-нулевые мыши проявляют аномальную двигательную координацию, тремор, случайные судороги и тяжелую гипомиелинизацию с тонкими некомпактными миелиновыми оболочками.
11.4. Другие миелиновые белки
Периферический миелиновый белок-22. В дополнение к основному гликопротеину P0 компактный миелин PNS содержит белок 22 кДа, называемый периферическим миелиновым белком-22 (PMP-22), на долю которого приходится менее 5% общего белка (фиг.4-12C) [19, 24] , Подобно P0, PMP-22 имеет единственный сайт для N-связанного гликозилирования. Однако, в отличие от P0, который специфичен для нервов, PMP-22 экспрессируется во многих других тканях. Он имеет четыре трансмембранных домена гидрофобного потенциала и представляет собой белок tetraspan, такой как основной PLP миелоина ЦНС, но гомологичности последовательности PLP не существует. Он находится в очень гомологичном семействе небольших гидрофобных белков тетрасса, которые также включают белки эпителиальных мембран (EMP-1, -2 и -3). Он упоминается как «белок для остановки роста», потому что его кДНК сначала клонировали из неразделенных фибробластов, а синтез PMP-22 и других миелиновых белков прекращается, когда клетки Шванна начинают размножаться после перерезки нерва.
2 ‘: 3′-Циклическая нуклеотидная 3’-фосфодиэстераза: В дополнение к PLP и MBP в миелине присутствует много высокомолекулярных белков (фиг.4-12). Они варьируются в зависимости от вида (у грызунов обычно больше млекопитающих), а возраст (у незрелого миелина больше). Дублет с Mr ≈46 кДа и 48 кДа присутствует в миелине ЦНС, который содержит несколько процентов общего миелинового белка и обладает ферментативной активностью 2′: 3′-циклический нуклеотид 3′-фосфодиэстераза (CNP) [18]. Несмотря на низкий уровень CNP, связанный с другими типами клеток, он значительно обогащается миелином и олигодендроцитами ЦНС, для которых он является широко используемым биохимическим маркером. Он выражается в гораздо более низкой концентрации в клетках Шванна в начале миелинизации и не увеличивается во время развития с накоплением миелина, как в ЦНС. Фермент чрезвычайно активен с субстратом 2 ‘, 3′-цАМФ, а также cGMP, cCMP и cUMP-аналогами, которые все гидролизуются до соответствующего 2’-изомера. Это может быть нефизиологической активностью, поскольку показано, что только 3 ‘: 5’ циклические нуклеотиды обладают биологической активностью. Тем не менее, эволюционное сохранение каталитического сайта указывает на то, что его аминокислотная последовательность, вероятно, имеет важную функцию, хотя точная роль CNP остается неуловимой в течение многих лет с момента ее обнаружения.
Периферийный P2 белок. Минеин PNS содержит положительно заряженный белок, отличный от MBP, который называется P2 (15 000). Он не связан последовательно с MBP и является членом семейства белков, связывающих цитоплазматическую жирную кислоту (FABP), которые присутствуют в различных типах клеток [25]. Количество белка Р2 является переменным среди видов, что составляет около 15% общего белка в бычьем PNS myelin, 5% у людей и менее 1% у грызунов. Р2-белок обычно считается миелоидным белком ПНС, но он выражен в небольших количествах в миелиновых оболочках ЦНС некоторых видов. P2 представляет собой антиген для экспериментального аллергического неврита, аналог PNS от EAE
Тетраспан. Интересно, что в миелине и связанных глиальных мембранах (27), включая PLP / DM20, PMP-22, миелин и лимфоцитарный белок (MAL / MVP17 / VIP17) и плазмолипином в компактном миелине, присутствуют многочисленные белки tetraspan (содержащие четыре трансмембранных охватывающих домена) в миелине и связанных глиальных мембранах [27]; и олигодендроцитарный белок (OSP) / claudin-11, CD9 и коннексины в специализированных связанных структурах оболочек миелина, таких как плотные соединения или паранодальные петли. Наличие или отсутствие этих белков может быть существенным для специализированной структуры и функции миелина. Паранопальные петли, которые образуют плотные соединения между глиальными процессами и аксонами в паранодальных областях оболочек (рис. 4-3, 4-9), имеют решающее значение для нормального обжига миелинизированных аксонов. Быстрая солеударная проводимость нервных импульсов в миелиновых волокнах, таким образом, зависит от структурной целостности узлов Ранвье и плотных контактов в этом месте, что предотвращает утечку ионов в междоузлия.
Помимо PLP / DM20 и PMP22, одним из самых ранних белков мицелин-тетраспана был мицелин и теляспенский белок миелина и лимфоцитов 17 кДа. Этот белок первоначально был идентифицирован в компактном миелине как MVP17, новый миелиновый мембранный белок [28], который был быстро продемонстрирован как идентичный MAL и VIP17. MAL (MVP17 / VIP17) является частью аппарата апикальной сортировки в клетках, не являющихся нейронными поляризациями, и было предложено участвовать в сортировке белков в мембранных доменах миелина. Он ассоциируется с глифосфинголипирифицированным белком / липидным плотом и может функционировать при их сортировке и транспортировке в миелин [29, 30]. Было установлено, что MAL является частью расширенного семейства генов, который включает в себя плазмолипин, еще один мицеин-тетраспановый белок [31]. Плазмолипин также связан с доменами, обогащенными гликосфинголипидами, из миелина. Таким образом, это семейство белков, два из которых находятся в компактном миелине, может участвовать в сортировке белков или при передаче сигналов через липидные плоты в миелине.
11.5. Сортировка и транспортировка липидов и белков
Сортировка и транспортировка липидов и белков происходит во время сборки миелина. После синтеза компонентов миелина они должны быть собраны для образования мембран, образующих миелиновые оболочки [16]. Биогенез этих оболочек является экстраординарным процессом формирования и моделирования мембран. В ЦНС это требует спиралирования многочисленных олигодендроглиальных процессов вокруг аксонов и их плотного наслаивания для образования компактного миелина. Кроме того, существует дополнительное моделирование специализированных мембранных доменов различного состава внутри и снаружи оболочек и в паранодальных глиа-аксонных переходах. Два основных белка компактного миелина ЦНС, PLP и MBP входят в миелин различными путями. PLP синтезируется на мембраносвязанных полисомах в перикарионе и переносится в мембранные везикулы на миелин, образующийся в конце олигодендроглиальных процессов. Напротив, MBP синтезируется на свободных полисомах, которые фактически расположены в непосредственной близости от вновь образующегося миелина в конце олигодендроглиальных процессов [16]. Его мРНК транспортируется из перикариона в окрестности образования миелина в гранулах рибонуклеопротеинов с помощью транслокационной системы на основе микротрубочек. Эти различия в пути ввода отражаются в разных кинетиках включения белков в миелиновые мембраны в экспериментах с маркировкой радиоактивными аминокислотами после внутричерепной инъекции или инкубации срезов мозга. Радиоактивный MBP синтезируется и очень быстро интегрируется в миелин с временем задержки всего в несколько минут, тогда как значительное количество радиоактивного PLP не появляется в миелине до примерно 45 минут [1]. Другие белки, селективно локализованные в специализированных областях миелиновой оболочки, такие как внутренняя и внешняя поверхности (например, MAG и MOG соответственно) или в паранопальных областях (например, нейрофасцин-155), должны сортироваться и транспортироваться различными механизмами, включающими специфическую сортировку сигналы. Вероятно, механизмы сортировки связаны с апикальным и базолатеральным нацеливанием, которое происходит в простых поляризованных эпителиальных клетках.
11.6. Образование миелиновых мембран
Миелин является образованием глиальной плазматической мембраны. Миелинизации в ПНС предшествует инвазия нервных пучков клетками Шванна, быстрое размножение этих клеток и сегрегация отдельных аксонов клеточными процессами Шванна. Меньшие аксоны (≤1μm), которые останутся немиелинизированными, будут разделены; несколько могут быть окружены одной ячейкой Шванна, каждая в своем кармане, подобно одному аксону, показанному на рисунке 4-10А. Большие аксоны (≥1 мкм), предназначенные для миелинизации, заключены отдельно, по одной клетке на аксон на междоузлий. Эти клетки выстраиваются вдоль аксонов с интервалами между ними; интервалы становятся узлами Ранвье. Перед миелинизацией аксон лежит в инвагинации ячейки Шванна (рис. 4-10А). Плазмалемма клетки затем окружает аксон и соединяется с образованием двойной мембранной структуры, которая связывается с поверхностью клетки. Эта структура, называемая мезаксоном, затем удлиняется вокруг аксона по спирали (рис. 4-10). Таким образом, образование миелина топологически напоминает свертывание спального мешка: мезасонные ветры вокруг аксона, а цитоплазматические поверхности конденсируются в компактный миелин и образуют основную плотную линию. Две внешние поверхности образуют линию внутрипериодов миелина.
В ЦНС миелин образуется олигодендроцитами. Это имеет много общего, но также и точки различия в отношении миелинизации в ПНС. Нервные волокна ЦНС не отделены соединительной тканью и не окружены клеточной цитоплазмой, и специфические глиальные ядра, очевидно, не связаны с конкретными миелинированными волокнами. Миелин ЦНС представляет собой спиральную структуру, подобную миелину ПНС: он имеет внутренний мезаксон и внешний мезаксон, который заканчивается петлей или языком глиальной цитоплазмы (фиг.4-3). В отличие от периферического нерва, где оболочка окружена клеточной цитоплазмой Шванна внутри и снаружи (фиг.4-10), цитоплазматический язык в ЦНС ограничен небольшой частью оболочки (рис. 4-3, 4-8) , Этот глиальный язык является непрерывным с плазматической мембраной олигодендроглиальной клетки через тонкие процессы. Один олигодендроцит может миелинировать целых 40 или более отдельных аксонов.. Миелиновое окружение в ПНС может привести к тому, что один аксон имеет до 100 миелиновых слоев, и, похоже, миелин не заложен простым вращением ячейки Шванна вокруг аксона. В ЦНС такое вращение исключается из-за того, что одна глиальная клетка может миелинировать несколько аксонов. Во время миелинизации увеличивается длина междоузлия, диаметр аксона и количество миелиновых слоев. Поэтому Милин расширяется во всех плоскостях одновременно. Любой механизм учета этого роста должен предполагать, что мембранная система способна расширяться и сжиматься, а слои скользят друг над другом
11.7. Демиелинизирующие болезни
К
демиелинизирующим заболеваниям нервной системы относятся болезни,
морфологической основой которых является повреждение миелинового слоя нервных
волокон. В последние годы отмечается увеличение числа демиелинизирующих
заболеваний.
Известно, что в
центральной нервной системе миелин синтезируется олигодендроцитами. У человека
миелин составляет 35% сухой массы мозга. В коре головного мозга миелинизация
продолжается до 45 лет. Маркером олигодендроцитов и миелина является фермент
циклонуклеотид-3-фосфогидролаза, активность которого после рождения
увеличивается параллельно с отложением миелина. Необходимо подчеркнуть, что
процесс миелинизации влияет на способность к обучению. Недостаток витамина В6 в
рационе экспериментальных животных приводит к снижению активности
циклонуклеотид-3-фосфогидролазы и к нарушению условно-рефлекторной
деятельности. Дефицит гормона роста и тиреоидного гормона также снижает
активность данного фермента и вызывает гипомиелинизацию с последующим
затруднением процесса обучения.
Миелин
представляет собой особый тип плазматических мембран в центральной и
периферической нервной системе, формируется миелинсодержащими оболочками нервных
волокон. Среди функций миелиновых оболочек выделяют изолирующую, опорную,
барьерную, участие в передаче импульсов, трофическую, транспортную. По
химическому составу миелин — это липопротеидная мембрана, состоящая из
бимолекулярного липидного слоя, расположенного между мономолекулярными слоями
белков, спирально закрученная вокруг нервного волокна.
Миелинизация
в центральной и периферической нервной системе наступает в ходе онтогенеза
сравнительно поздно и протекает длительно, начинается обычно в филогенетически
более старых системах. До рождения начинается миелинизация волокон в пре- и
постцентральных извилинах, в шпорной борозде, образованиях гиппокампа, своде.
После рождения миелинизация выявляется в средней и нижней лобных и височных
извилинах, нижней теменной извилине. В постнатальном периоде происходит миелинизация
волокон пирамидного пути и семиовального центра. Как отмечалось, основные
компоненты миелина — липиды и белки. Липиды составляют до 80% миелина,
представлены в нем тремя классами — фосфолипиды, гликолипиды и стероиды.
Основную структурную роль в формировании липидного бислоя играют фосфолипиды,
подразделяющиеся на глицерофосфолипиды и сфингофос- фолипиды. Состав липидов
миелина уникален и определяет функциональные особенности биологической мембраны.
Миелин имеет низкое содержание белков (20% сухой массы), содержит основной
белок миелина, протеолипид Фолча—Лиза, белок Вольфграма, гликопротеины,
ферменты (циклонуклеотид-3-фосфогидролаза, гидролаза эфиров холестерина,
карбоангидраза, протеинкиназы). На электронных микрофотографиях миелин
выглядит как серия чередующихся липидных и белковых слоев, число которых у
крупных аксонов может достигать 250.
Следует
подчеркнуть, что миелин не является инертной структурой, он биохимически
активен, обменивается своими компонентами с другими мембранами. Нормальное функционирование
мозга возможно только при определенных
соотношении
и взаимодействии аксона, миелиновой оболочки и глии, повреждение одного из
элементов нарушает всю систему. Выделить группу демиелинизирующих заболеваний
достаточно сложно, поскольку, по-видимому, нет болезней, при которых имеет
место только демиелинизация, обычно она сочетается с другими патологическими
изменениями.
В
связи с этим приняты следующие критерии демиели- низирующего заболевания:
1)
деструкция миелиновых оболочек нервных волокон;
2)
относительная сохранность других элементов нервной ткани (аксонов, нервных
клеток);
3)
периваскулярная инфильтрация воспалительными клетками;
4)
особенности распределения повреждения — часто перивенозные и первично в белом
веществе в виде множественных небольших диссеминированных очагов или больших
сливных фокусов;
5)
относительное отсутствие валлеровского перерождения нервных волокон.
Авторы
подчеркивают, что на «языке неврологии» термин демиелинизация имеет
приобретенный специфический смысл. Такое представление о демиелинизирующих
заболеваниях было высказано еще в 1961 г. С. М. Розег, разделившем эту группу
болезней на два типа.
Первый
тип был назван миелинокластическим, характеризовался разрушением нормально
сформированного миелина и встречался при всех приобретенных формах
демиелинизирующей патологии (истинные демиелинизи- рующие заболевания). Второй
тип, лейкодистрофический, характеризовался распадом миелина с наследственно
обусловленным дефектом и наблюдался при так называемых дисмиелиновых болезнях.
Аналогичный подход находим в работах А. П. Хохлова, Ю. Н. Савченко,
выделяющих демиелинизирующие заболевания и миелинопатии. Необходимо отметить,
что с течением времени состав болезней, входивших в группу
демиелинизированных, менялся, что связано с расшифровкой этиологии отдельных
форм.
Так,
подострый склерозирующий энцефалит Ван-Богарта после открытия роли вируса кори
в его патогенезе стал рассматриваться в группе медленных инфекций. Адрено-
лейкодистрофия оказалась наследственной болезнью обмена, относящейся к группе
пероксисомных болезней, поскольку вызывается мутацией гена (регион X^28),
кодирующего синтез интегрального белка пероксисом, мелких органелл клетки, в
которых осуществляется широкий спектр метаболических процессов.
Метахроматическая лейкодистрофия связана с генетически обусловленным
дефицитом цереброзидсульфатазы (ген локализован на 22^13.31-^
11.8. Синдром Гийена — Барре
(СГБ, острый полирадикулоневрит) — острая аутоиммунная воспалительная полирадикулоневропатия, проявляющаяся вялыми парезами, нарушениями чувствительности, вегетативными расстройствами.
Опубликовано в 1916 году и названо в честь двух французских врачей Жоржа Гийена и Жана Барре впервые описавших это заболевание
Этиология и патогенез
За 1-3 недели до проявления заболевания у большинства пациентов отмечают признаки инфекции желудочно-кишечного тракта или дыхательных путей. Чаще всего — после энтерита, вызванного Campylobacter jejuni (риск развития СГБ повышается примерно в 100 раз)[1][2][3]. Также это может быть инфекция, вызванная герпес-вирусами (цитомегаловирус, вирус Эпштейна — Барр и др.), микоплазмами, гемофильной палочкой и др. В частности, Синдром Гийена — Барре может быть проявлением ВИЧ-инфекции[4]. Вероятно, перенесённая инфекция запускает аутоиммунную реакцию (иммунная система организма поражает собственные клетки). Эту же роль могут играть вакцинации, оперативные вмешательства, травмы периферических нервов. Аутоиммунная реакция против антигенов шванновских клеток и миелина приводит к отёку, лимфоцитарной инфильтрации и сегментарной демиелинизации корешков спинномозговых и черепных нервов. Реже атаке подвергаются антигены аксонов периферических нервов (при аксональном варианте синдрома).
Клиническая картина
Заболевание характеризуется относительно симметричной мышечной слабостью (вялый парез), которая типично начинается в проксимальных отделах мышц ног и через несколько часов или дней распространяется на руки. Часто слабость сопровождается парестезиями пальцев стоп и кистей[5]. Иногда слабость в первую очередь возникает в руках или одновременно в руках и ногах[6]. Повышается содержание белка в спинномозговой жидкости (начиная со 2-й недели заболевания). В тяжелых случаях возникают параличи дыхательных и краниальных мышц, главным образом мимических и бульбарных. Нередки боли в спине, плечевом и тазовом поясе, иногда иррадиирующие по ходу корешков, симптомы натяжения. Пациенты, особенно с сопутствующим сахарным диабетом, расположены к развитию пролежней. Часто отмечаются выраженные вегетативные нарушения: повышение или падение артериального давления, ортостатическая гипотензия, синусовая тахикардия, брадиаритмия, преходящая задержка мочи. Интубация или отсасывание слизи могут спровоцировать резкую брадикардию, коллапс и даже остановку сердца. Достигнув пика, симптоматика стабилизируется (фаза плато длится 2-4 недели), а затем начинается восстановление, которое может продолжаться от нескольких недель до 1-2 лет. Смерть возможна от дыхательной недостаточности, связанной с параличом дыхательного и/или бульбарного центров, пневмонии, тромбоэмболии лёгочных артерий, остановки сердца, сепсиса, но благодаря современным методам интенсивной терапии, прежде всего ИВЛ, летальность в последнее десятилетие снизилась до 5 %.
Лечение
Даже в лёгких случаях к синдрому Гийена — Барре в острой фазе следует относиться как к неотложному состоянию ввиду опасности быстрого развития тяжелой дыхательной недостаточности или нарушения сердечного ритма. Обязательна срочная госпитализация больных в отделения интенсивной терапии. В фазе прогрессирования — почасовое наблюдение за состоянием больного с оценкой дыхательной функции, сердечного ритма, артериального давления, состояния бульбарной мускулатуры, тазовых функций. Ранние признаки дыхательной недостаточности: ослабление голоса, необходимость делать паузы для вдоха во время разговора, выступание пота на лбу и тахикардия при форсированном дыхании, ослабление кашля. При бульбарном параличе бывают необходимы интубация и введение назогастрального зонда. Плазмаферез и иммуноглобулин внутривенно, способные ускорять восстановление и уменьшать остаточный дефект, особенно целесообразны в фазе прогрессирования (обычно в первые 2-3 недели от начала заболевания). Кортикостероиды не улучшают исход заболевания. В целях профилактики тромбоза глубоких вен голени (при плегии в ногах) назначают малые дозы гепарина или низкомолекулярный гепарин (фраксипарин). При парезе мимической мускулатуры необходимы меры по защите роговицы (закапывание глазных капель, повязка на ночь). Важное значение имеют ранние реабилитационные мероприятия, включающие массаж, лечебную гимнастику, другие физиотерапевтические процедуры (парафиновые аппликации, магнитотерапия, радоновые и сероводородные ванны, электростимуляция и др.).[источник не указан 988 дней]
Прогноз
Полное восстановление — в 70 % случаев, у 15 % больных сохраняются выраженные остаточные параличи, вызывающие инвалидизацию. В 2-5 % развивается рецидив и формируется хроническая рецидивирующая полиневропатия.
Известные люди, болевшие синдромом Гийена — Барре
Мортен Вигхорст — датский футболист
Аримура Рютаро — вокалист японской visual kei группы Plastic Tree[7]
Маркус Баббель — немецкий футболист
Скотт Маккензи — американский музыкант, исполнитель хита «San Francisco (Be Sure to Wear Flowers in Your Hair)»
Оскар Табарес — уругвайский футбольный тренер.
Андрей Курпатов — российский публицист, психотерапевт, телеведущий.
12. Мембранный транспорт и генерация мембранных потенциалов
Первичные активные катионные транспортеры активируют многие из основных функций нервной системы. Они превращают свободную энергию из гидролиза АТФ в электрохимическую энергию, которая хранится в градиентах трансмембранной концентрации Na +, K +, Ca2 + и протонов. Эти устройства хранения энергии используются сигнальными белками мембранных каналов, а также вторичными транспортерами, которые избирательно концентрируют многие другие ионы и молекулы. Вторичные транспортеры поддерживают множество различных нервных функций, таких как упаковка нейротрансмиттеров в везикулах и прерывание сигналов в синапсах. Также классифицируются как транспортеры — медиаторы — белки; они позволяют специфическим молекулам диффундировать через мембраны, часто под контролем регулятора, но неспособные «поднимать» транспорт (рис. 5-1). Что касается ионных каналов, которые при открытии позволяют рассеивать тысячи ионов на канал в миллисекундах (глава 6), транспортерам обычно требуется миллисекунды для перемещения ионов 1-3 или молекул в течение реакционного цикла в направлении подъема. Таким образом, транспортеры обычно экспрессируются с гораздо большей плотностью в мембранах, чем ионные каналы.
Первичные транспортеры, обсуждаемые в этой главе, относятся к трем отдельным геномным надсемействам, которые заметно отличаются по структуре и механизму реакции. Эти P-, V0V1- и ABC-суперсемейные элементы все катализируют реакции с АТФ, которые приводят к конформационным циклам для перемещения субстратов через мембраны и «в гору» до более высоких концентраций. Транспортеры типа Р имеют один и тот же общий механизм реакции. Большинство насосов, принадлежащих к надсемейству транспортеров P-типа, эволюционировали для создания градиентов катионов. В случае насосов Na +, K + P-типа Na +, концентрации Na + и K + концентрации, генерируемые во всех эукариотических плазматических мембранах, представляют собой большое потенциальное хранилище энергии, которое используется для электрической сигнализации и для вождения вторичных транспортеров. Градиенты Ca2 + также генерируются транспортерами P-типа, но эти градиенты используются в основном для внутриклеточной сигнализации (глава 22). Структуры и механизмы реакции насосов Na +, K + и Ca2 + аналогичны и обеспечили понимание функционирования всего класса транспортеров P-типа. Из-за различий в роли двух различных катионов субстрата в его механизме реакции насос Na +, K + наиболее удобно иллюстрирует механизм насосов типа P. Насосы Na +, K + управляются циклом конформационных переходов, который обусловлен фосфорилированием их каталитических участков, активированным цитоплазматическим Na +, и гидролизом тех же фосфорилированных сайтов, активированных внеклеточным K + Рис. Цикл инициируется связыванием АТФ с каталитическим сайтом и цитоплазматическим связыванием Na + со всеми тремя ионофорическими сайтами. Каталитические сайты содержат аспартильный остаток, который становится фосфорилированным только тогда, когда все три связывания Na + связываются с ионами натрия. Фосфорилирование аспартила легко обратимо, когда молекула насоса находится в конформации Е1; то есть энергетические состояния E1-аспартилфосфатной связи и фосфатной связи АТФ аналогичны. Это продемонстрировано способностью фосфорилированного фермента рефосфорилировать ADP к АТФ в условиях, которые ингибируют стадию 3 в Рис. Однако активное формирование накачки аспартилфосфатной связи инициирует быстрый переход к конформации E2-P, в котором ионофорические сайты изменили свою избирательность, в результате чего три Na + выгружаются внеклеточно в обмен на связывание двух K +. Это инициирует гидролиз аспартилфосфатной связи в состоянии E2, который, в сочетании с связыванием АТФ, заставляет E2 возвращаться к E1. Вследствие этого ионофорические сайты выгружают два K + в цитоплазму. Связывание ATP инициирует следующий транспортный цикл. Эта реакция переноса может происходить со скоростью ≈10000 циклов в минуту. Как отмечалось выше, насос Na +, K + обменивает три Na + на два K + на транспортный цикл. Это создает чистый поток положительного заряда, который может генерировать электрогенный потенциал. Степень гиперполяризации мембраны насосом может быть оценена путем измерения снижения мембранного потенциала, создаваемого селективными ингибиторами Na +, K +, такими как уабаин. Электрогенный потенциал обычно мал, 10 мВ или менее, потому что противоположные ионные токи протекают через каналы или вторичные транспортеры в смежной мембране. Однако в некоторых нейронах и мышечных клетках гиперполяризация натрийского насоса может сократить продолжительность действия потенциала и способствовать отрицательным послепотенциалам. В сердечной мышце гиперполяризация из-за перекачки Na + происходит после устойчивого увеличения частоты следования импульсов и может быть фактором сердечных аритмий. [1].
Типы мембранных транспортных белков. Ионные каналы обеспечивают стробированные диффузионные пути через клеточные мембраны, которые регулируются мембранным напряжением, взаимодействиями с лигандами и / или фосфорилированием. Фасилитаторы или несвязанные транспортеры обеспечивают высокоселективные пути, например. для d-глюкозы или воды, но не связаны с источниками энергии и поэтому не могут концентрировать свои субстраты. Транспортеры, которые соединены с источниками энергии, могут изменять стабильное распределение их ионов субстрата и / или молекул. Вторичные транспортеры получают энергию от существующих ионных градиентов для переноса второго иона или молекулы в направлении, которое либо совпадает с (симпортом), либо противоположно (антипорту) с энергией иона. Первичные транспортеры соединяют химическую реакцию с конформационными переходами белка, которые подают энергию для получения градиентов концентрации одного или нескольких субстратов через клеточные мембраны. Для определения и классификации транспортных средств и каналов см. Онлайн-базы данных [41].
12.1. Na+/K+ АТФаза
Механизм АТФ-зависимого натриевого насоса. Последовательность этапов реакции обозначена большими стрелками. С левой стороны молекулы накачки находятся в конформации E1, которая имеет высокое сродство к Na + и АТФ и низкое сродство к K +. Ионофорические сайты доступны только с цитоплазматической стороны. Шаг 1. К + выгружается, когда метаболическая энергия добавляется к системе путем связывания АТФ. Шаг 2. Три связывания Na + и фермент обратимо фосфорилируют. Шаг 3. Конформационный переход от E1 ~ P к E2-P, показанный наверху, представляет собой «энергетический ход» насоса, в течение которого ионофорические участки с тремя связанными Na + становятся доступными внеклеточной стороне и уменьшают их сродство к Na +. Часть свободной энергии фермента ацилфосфата была рассеяна в этом процессе. Шаг 4. Три Na + диссоциируют из E2-P. Шаг 5. Два связывания K + и более свободная энергия рассеиваются по мере гидролиза фермента ацилфосфата. В этот момент два K + становятся жестко связанными («закупоренными»), а на этапе 6 E2 возвращается к E1, несущим K + к цитоплазматической стороне. Каждый шаг этого цикла экспериментально обратим.
Основная доля производства мозговой энергии потребляется насосом Na +, K +. Большая часть этого требуется для компенсации экструзии внутриклеточного Na +, который поступает через каналы во время электрической активности и через Na + -зависимые вторичные транспортеры при восстановлении нейротрансмиттера. Предполагая типичные значения градиентов концентрации Na + и K +, то есть [Na +] e / [Na +] i 12 и [K +] i / [K +] e 50, тогда ΔG составляет около 3,8 ккал (16 кДж) на моль Na + обменялся на K +. Гидролиз высокоэнергетической фосфатной связи АТФ может давать до 12 ккал / моль в физиологических условиях, что позволяет обмен примерно на три эквивалента катиона для каждого моля гидролизата АТФ. Из этой стехиометрии видно, что химическая свободная энергия гидролиза АТФ должна использоваться с эффективностью 95% (3 × 3,8 / 12) для работы натриевого насоса в физиологических условиях. Другие процессы, использующие хранилища энергии, перечислены в таблице 31-1.
Энергетические затраты
мозга
|
Функции |
Энергетические |
|
Сигнальная функция |
75 |
|
Потенциал |
35.3 |
|
Постсинаптические |
25.5 |
|
Потенциал покоя |
9.8 |
|
Рециркуляция |
2.3 |
|
Постсинаптический |
2.3 |
|
Основная |
25 |
|
Обмен |
≈5 |
|
Круговорот белков и |
2 |
|
Аксональный |
* |
|
Протонные течи в митохондриях |
† |
Источник: adapted from Attwell and Laughlin [1].
*Энергетические
затраты неизвестны.
†Значения не известны для мозга, но
в других они тканях равны 20%
Na, K-АТФаза представляет собой гетеродимер, состоящий из каталитической α-субъединицы и вспомогательной β-субъединицы. Четыре изоформы α-субъединицы и три β-субъединицы выражены у млекопитающих. Три изоформы α-субъединицы экспрессируются в мозге и будут обсуждаться в более позднем разделе. Β-субъединицы (≈40 кДа) являются монотопными гликопротеинами и обладают некоторыми характеристиками молекул клеточной адгезии. По крайней мере, одна из трех изоформ β-субъединицы должна быть коэкспрессирована для того, чтобы транслоцировать α-субъединицу из эндоплазматического ретикулума (ER) в плазмалемму. Три изоформы β-субъединицы имеют примерно 45% идентичности последовательности. Β1 наиболее выражен [2]. Β2 первоначально описывался как «молекула адгезии на глие» (AMOG), поскольку он временно экспрессируется на поверхности мозжечка Bergmann glia во время дифференциации клеток гранул. По мере взросления мозга он широко выражается на астроцитах и исчезает из большинства нейронов. Специфическая изоформа β-субъединицы в паре с α-субъединицей мало влияет на параметры насоса [3]. Однако различные β-изоформы могут влиять на конечную клеточную и субклеточную локализацию насосов Na + [4]. Существуют также γ-субъединицы Na +, семейства протеолипидов ≈15 кДа, которые могут связываться с α-субъединицами натрия. Однако они не нужны для активности насоса и не экспрессируются во всех клетках. Γ-субъединицы классифицируются как члены семейства генов FXYD, а некоторые из них экспрессируются в мозге [5]. Почечная экспрессирует почти исключительно Na +, K + насосы с α1-субъединицами на функционально разнообразных сегментах нефрона, но разные γ-субъединицы выражены в разных сегментах. Из этого следует, что различные γ-субъединицы оптимизируют натрий-насос для работы в различных ионных средах [6].
В центральной нервной системе Na, K-АТФаза наиболее выражена в регионах, где ожидаются высокие уровни обмена Na + / K +. К ним относятся аксональные терминалы, узлы Ранвье, дендритные процессы и нейронная сома, но не в оболочках миелина. В спинном мозге экспрессия нейрона α1 ограничена набором расположенных в боковом направлении передних роговых клеток и промежуточных клеток грудного корня. Различные клетки ганглиозного дорзального корня экспрессируют α3 самостоятельно или вместе с α1, но не экспрессируют только α1. В эпигенетическом пигментном эпителии и сосудистой оболочке саркоидной мембраны насос Na + наиболее сконцентрирован на апикальных (просветных) поверхностях (рис.5-3). С этими исключениями эпителиальные клетки, адаптированные для секреции или реабсорбции, экспрессируют Na + насос исключительно на базалатеральных или абламинальных поверхностях.
Na, K-АТФазы изменяются с развитием, старением и деменцией. Активность Na, K-АТФазы относительно общего белка увеличивается примерно в десять раз непосредственно перед стадией быстрого миелинизации у крыс. Это происходит через 2-12 дней после дня и соответствует времени глиальной пролиферации, разработке нейронных и глиальных процессов и увеличению нейрональной возбудимости. Нейроны могут играть роль в повышении глиальной экспрессии изоформы α2 во время пиковых периодов миелинизации, и эффект, вероятно, зависит от контакта [7]. Изменения в развитии Na, K-АТФазы в мозге, по-видимому, зависят от тиреоидных влияний. Культуры глиальных клеток из 1-дневного мозга крыс выражают постепенно возрастающие количества изоформ α1, α2, β1 и β2 в зависимости от увеличения воздействия трийодтиронина [8]. В церебральной коре человека (рис.5-4) и крысе α3 мРНК находится в кластеризации над пирамидальной и другой нейронной сомой, тогда как α1 мРНК распределяется диффузно через нейропил. У лиц без сутенеров пожилых людей экспрессия α1 мРНК существенно не изменяется, хотя имеются значительные, но небольшие сокращения в α3 мРНК нейрональной перикарьи. Напротив, при деменции болезни Альцгеймера (глава 47) содержание α3 мРНК в нейрональной перикарье и нейропиле заметно снижается в начале нейродегенеративного процесса до дистрофических изменений нейронов (рис.5-4).
РИСУНОК 5-5. В эпителиальных клетках почек, которые экспрессируют только изомер α1, понижающую регуляцию Na, K насосов можно инициировать дофамином посредством активации GPCR эндоцитоза, и это контролируется фосфорилированием одного Ser-остатка в N- терминалы α-субъединиц Na, K-АТФазы для интернализации. Анализ мутаций предполагает, что активация PI3K-IA происходит от ее связывания с богатым пролином доменом, присутствующим в α-субъединице Na, K-АТФазы, но которая становится доступной только для киназы после Ѕ-PKC-зависимого Ser-фосфорилирования. Активация PI3K-IA набирает адаптеры AP-2, которые переносят везикулы плазматической мембраны в ранние эндосомы. Таким образом, Na, K-АТФаза служит своим собственным каркасом, организуя рецепторные сигналы, которые в конечном счете снижают его активность. Серотонин, действуя через GPCR, может активировать фосфорилирование β-PKC двух серинов в N-концах эндоцитированных Na-1-субъединиц Na, K-АТФазы. Это, очевидно, рекрутирует AP-1 адаптеры, которые инициируют повторное включение насосов Na, K в плазматическую мембрану. Однако в случае культивируемых стригальных колючих нейронов, которые экспрессируют все три изоформы Na, K-насоса, регуляция является более сложной: хотя допамин продуцирует понижающую регуляцию на основе эндоцитоза, это может быть предотвращено глутаматом, а глутамат может приводить к активации чистого насоса путем набора α2-изоформы [20]. (Адаптировано с разрешения на фиг.4 ссылки [83]).
Изоформы α-субъединицы представляют собой продукты отдельных генов, которые отличаются по 5′-фланкирующим регуляторным последовательностям. Они могут усилить или затруднить сборку комплекса пренициации РНК-полимеразы и соответствующих факторов транскрипции [9]. Выражение физиологической изоформы зависит от типа и зрелости клеток. В сердце крысы преобладающая форма переходит от неонатального α3 к взрослым α2. Изоформа α3 экспрессируется главным образом в взрослых нейронах и неонатальных кардиомиоцитах. Ген α3 демонстрирует три позитивно регулируемых цис-элемента, которые связывают NP-Y, Sp1 и Sp2 [10]. Специфичность нейронов, по-видимому, связана с нейрон-ограничительным элементом глушителя и положительно действующим цис-элементом [11]. «Базальный промотор», необходимый для конститутивной экспрессии гена α1, представляет собой позитивный регуляторный элемент, называемый ARE [12], содержащий сайты связывания для нескольких факторов транскрипции, включая элемент, чувствительный к цАМФ (CRE). CRE происходит внутри промоторов многих генов cAMPinducible и может взаимодействовать с CRE-связывающим (CREB) и CRE-модулятивным (CREM) белками и с активирующим транскрипционным фактором (ATF) -1. Это подгруппа в семействе лейцин-молнии, определяемая их сходством аминокислотной последовательности и способностью димеризоваться друг с другом. Сайт CRE регулируется несколькими путями, в том числе cAMP, Ca2 + и трансформирующим фактором роста (TGF) β. Фосфорилирование ATF-1 и CREB с помощью PKA или PKC усиливает их связывание с сайтом ATF / CRE и может потребоваться для транскрипции гена AT1 α1 [13]. Na, K-АТФаза подвержена гормональной регуляции. В гиппокампе крысы зубчатые гранулированные клетки экспрессируют изоформы α1 и α3, а у крыс с надпочечниками — альдостерон может избирательно регулировать α3 в этих нейронах. Однако в других кортикальных нейронах, которые экспрессируют обе мРНК, альдостерон не влияет ни на [14], а в почках альдостерон регулирует уровень экспрессии α1. Регулирование Isoform альдостероном, по-видимому, определяется местными факторами, такими как тип клеток и местоположение. Эти положительные или отрицательные локальные факторы в регуляции генов были названы «клеточным контекстом». Белковая система цАМФ или CREB также взаимодействует с системой рецепторов минералокортикоидов для модификации транскрипции α-субъединицы [15]. В крысиной коре почки альдостерон увеличивает α-1 субъединичную мРНК, и это, как было показано, происходит непосредственно из-за альдостерона, а не с увеличением потока Na + [16]. Альдостерон также усиливает мРНК изоформы α3 и β1 в мозге крыс надпочечников [17]. Na + также может регулировать экспрессию Na, K-pump. Изменения в локальной ионной среде за счет изменений в цитоплазматическом Ca2 + и Na + могут влиять на экспрессию Na, K-насоса через ранние ответы генов [18]
12.2. Регуляция Na+/K+
Активность Na, K-насоса может контролироваться быстрым удалением эндоскота и инсерцией в ответ на GPCR-регулированное фосфорилирование α-субъединиц. Например, почечная проксимальная канальцевая эпителия выделяет допамин, который действует на аутокрин-D1-подобные рецепторы для удаления насосов Na, K из их базолатеральной плазматической мембраны (рис.5-5). Эндоцитоз насосов инициируется фосфорилированием в ser-18 его α1-субъединицы с помощью ζ-PKC, что позволяет взаимодействовать PI3KIA с α-субъединицей и AP-2, тем самым индуцируя связывание клатрина (см. Гл. 9). Ультрарегуляция насосов Na, K путем рекрутинга требует α1-фосфорилирования как ser-11, так и ser-18, который может быть через β-PKC в ответ на активированные серотонином или ангиотензином GPCR, что приводит к связыванию AP-1. Другой путь активации для рекрутирования Na, K-насоса в плазматические мембраны, по-видимому, включает фосфатирование субъединицы α1 на tyr-527 [19]. Эндоцитоз и рекрутирование насосов Na, K происходит в первичных изолятах полосатых нейронов. Однако в этих нейронах только две субъединицы были удалены в ответ на допамин, тогда как субъединицы α1 были выборочно завербованы в ответ на глутамат [20]. Сотовые и субклеточные распределения изоформ α-субъединиц дают ключ к их различным физиологическим функциям. Четыре изоформы демонстрируют примерно 85% идентичности последовательности. Наиболее существенные различия наблюдаются в их N-концевых областях и в последовательности с 11 остатками большой цитоплазматической петли. При измерении в культурах клеток изоформы отличаются по своей видимой аффинности для внутриклеточного Na + (α1 <α2 <α3) [21] и внеклеточного K + (α3 <α2 = α1) [22]. Во взрослых тканях α1 является основной изоформой в большинстве клеток и функционирует как изомера «домашнего хозяйства» или «объемной экстракции Na». Изоформы α2, α3 и α4 подвержены уникальным формам регуляции и субклеточной локализации. У взрослых млекопитающих мозг α1 экспрессируется как в нейронах, так и в глии, α2 выражается в глии и некоторых нейронах, а α3 выражается в большинстве нейронов. В тканевой культуре астроциты, нейроны гиппокампа и артериальные миоциты все экспрессируют α1 диффузно в своей плазмалемме. Напротив, иммуноцитохимически окрашенные α2 в астроглии и α3 в миоцитах и нейронах показывают ретикулярные структуры и колокализуются с Na + / Ca2 + -обменником (NCX) (фиг.5-6). Эти ретикулярные картины плазмалеммы совпадают с закономерностями окрашивания для соединительных комплексов на саркоплазматическом ретикулуме, а также в астроглии и нейронах, соединительных комплексах на эндоплазматическом ретикулуме [23]. [Na +] и, во-вторых, увеличивают цитозольный [Ca2 +], который затем увеличивает сократительную способность сердечной мышцы. Это предполагаемый кардиотонический механизм наперстянки и родственных кардиостероидов.
Генетические данные подтверждают важность координированного экспрессии и распределений изоформ α2 или α3 Na + / K + с насосами Na + / Ca2 + (NCX) и Ca2 + для работы в возбудимых и сократимых клетках: удаление одной копии насоса α2 Na + / K + ген у мышей приводит к увеличению сократительной силы в сердечной и скелетной мышцах, в то время как делеция одной копии гена α1 приводит к уменьшению сократительной силы [25]. В астроцитах крысиного зрительного нерва делеция α2-гена или ауабаиновой обработки клеток, экспрессирующих α2, приводит к увеличению ответов «емкостного входа в кальций», которые отражают снижение способности быстро удалять цитозольный Ca2 + [26].
Насосы Na, K могут функционировать в качестве преобразователей сигналов. Как обсуждалось выше, кардиоактивные стероиды уже давно используются для увеличения сердечной силы. Это происходит потому, что они ингибируют Na + / K + насосы, увеличивая таким образом цитоплазматический [Na +], замедляя активность Na + / Ca2 + -обменника и увеличивая цитозоль [Ca2 +]. Эти натриевые насосы имеют эволюционно консервативный и высокоселективный сайт связывания кардиоактивных стероидов, что побудило поиск возможного эндогенного «уабаин-подобного вещества» или OLS. Фактически такие вещества были идентифицированы в головном мозге, коре надпочечников, плазме и моче, хотя и при очень низких концентрациях. Повышенные уровни OLS были связаны, экспериментально и клинически, с сохранением соли, гипертонией и гипертрофией сердца. Их химические структуры очень похожи на уабаин [27]. Недавняя работа связана с кардиоактивным связыванием стероидов с натриевым насосом, причем не только с ингибированием накачки, но также с активацией сигнального каскада протеинкиназы (ERK), вызванного внеклеточным рецептором. После контакта с сердечками крыс с положительной инотропной дозой уабаина содержание фосфорилированного / активированного ERK1 / 2 увеличивается в два-три раза, тогда как Src и α2-изоформа Na, K-АТФазы увеличиваются на 50-60% в изолированных кавеолах. Изолированные обогащенные кавеолином мембранные фракции из миоцитов сердца крысы содержат почти все кардиоспецифичные кавеолин-3, 20-30% от общего количества натриевых насосов, и они обогащены сигнальными белками, Src, рецептором эпидермального фактора роста (EGFR) и ERK1 / 2 [28]. Такие наблюдения предполагают, что OLS может действовать в системах сигнализации с участием некоторых из этих белков.
12.3. Ca2+ ATФазы
ATP-зависимые насосы Ca2 + и антипортеры Na +, Ca2 + действуют сообща, чтобы поддерживать низкую концентрацию свободного цитозольного Ca2 +. Концентрация цитозольного свободного иона кальция [Ca2 +] i в нестимулированных клетках составляет от 10-8 до 10-7 моль / л, что более чем в 10 000 раз ниже, чем внеклеточный свободный Ca2 +. Большинство внутриклеточных Ca2 + хранится в эндоплазматическом ретикулуме. Поскольку цитоплазматический [Ca2 +] имеет множество различных внутриклеточных сигнальных функций, его регуляция является сложной. и его обесценение может быть катастрофическим (рис.5-7). Первичный переносчик Ca2 + плазменной мембраны (PMCA) представляет собой насос P-типа с высоким сродством к Ca2 + (Km = 100-200 нмоль / л), но относительно небольшую транспортную емкость [19].
РИСУНОК 5-7 Гомеостаз кальция. На рисунке ионы кальция представлены заполненными красными кругами. Ca2 + поступает в клетки через различные каналы, контролируемые лигандом и напряжением, но базальный цитоплазматический свободный Ca2 + поддерживается на уровне менее микромолярного. Цитоплазматический Ca2 + регулируется координатами Na + / Ca2 + антипортером в плазменных мембранах и Ca-АТФазами P-типа в плазматических мембранах и эндоплазматическом ретикулуме. Движущей силой для обмена Na + / Ca2 + антипортером является направленный внутрь Na + градиент, который поддерживается α2 или α3 Na, K-ATPases. Митохондрии могут временно участвовать в гомеостазе Ca2 +, если мощности этих других систем превышены. ER-накопители Ca2 + могут выделяться вторыми мессенджерами, такими как IP3 или Са2 +, в ответ на различные рецепторные системы.
Стехиометрия PMCA представляет собой один Ca2 +, переносимый для каждого гидролизата ATP. Эти насосы, вероятно, не выполняют объемные движения Ca2 +, но наиболее эффективны при поддержании очень низких концентраций цитозольного Ca2 + в покоящихся клетках. Отличительной характеристикой PMCA является то, что в дополнение к связыванию Ca2 + в качестве субстрата они дополнительно активируются связыванием Ca2 + / кальмодулина. Эффект связывания кальмодулина заключается в увеличении сродства сайта Ca2 + субстрата в 20-30 раз. Этот механизм взаимодействия с высокой степенью кооперации делает PMCA очень чувствительным к небольшим изменениям в [Ca2 +] i. Группа из по меньшей мере пяти PMCA образует мультигенную семью. Три изоформы, PMCA1-3, встречаются в головном мозге, и каждый из них имеет различное распределение [20]. Глазные эндоплазматические ретикулярные кальциевые насосы (SERCA), обнаруженные в головном мозге, были впервые идентифицированы в саркоплазматическом ретикулуме. Три изоформы SERCA представляют собой продукты отдельных генов: SERCA-1 выражается в скелетной мышце с быстрым подергиванием; SERCA-2a в сердечной / медленной мышце; SERCA-2b, альтернативно сплайсированная форма, выражается в гладкомышечных и немышечных тканях; SERCA-3 экспрессируется в эндотелиальных, эпителиальных и лимфоцитарных клетках и тромбоцитах. SERCA-2b является основной формой, выраженной в мозге, преимущественно в нейронах. Уникальные структурные данные высокого разрешения, доступные для насоса SERCA1a Ca2 +, освещают структуру всех транспортеров P-типа.
РИСУНОК 5-8. Структуры кальциевого насоса SERCA1a: E1 (Ca) 2 были получены из кристаллов, образованных в присутствии Ca2 +; E2 был получен из кристаллов, образующихся в отсутствие Ca2 + и в присутствии селективного ингибитора тапсигаргина [84]. Две конформации рассматриваются в плоскости, перпендикулярной (сверху) и параллельной внутри (внизу) липидного бислоя. Десять трансмембранных сегментов нумеруются в порядке от N- до С-конца и окрашены последовательно от синего до красного. Пурпурные сферы представляют собой два Са2 + -связывающих участка в структурах E1, а на нижних рисунках боковые цепи, которые взаимодействуют с Ca2 +, показаны в форме палочки для обеих конформаций. На верхних фигурах N, A и P цитоплазматические домены окрашены в пурпурный, оранжевый и зеленый цвета. Аспартильный остаток D351, который фосфорилирован и дефосфорилирован в каждом цикле накачки, показан как модель заполнения пространства. (Модели, построенные из баз данных базы данных белка 1eul и 1iwo с использованием DeepView 3.7.) [85].
В отличие от насоса Na, K, каталитическая субъединица насосов SERCA Ca2 + активна и не требует связывания с другой субъединицей. Однако сердечная изоформа SERCA-2a ассоциируется с небольшим мембранным белком, фосфоламбаном, который может регулировать силу сердцебиения и скорость. Механизм реакции Ca2 + -pump по существу такой же, как и на рис. 5-2, для насосов Na, K, за исключением того, что два цикла Ca2 + обмениваются в каждом цикле, возможно, для четырех протонов. Первичные последовательности для α-субъединиц Na, K- и H, K-ATPases могут быть наложены на эти структуры Ca2 + -pump с небольшими корректировками, необходимыми для малых удалений и вставок. Обратите внимание, что на рис. 5-8 катионы субстрата связаны с ионофорическими сайтами, состоящими из боковых цепей, образованных четырьмя смежными трансмембранными спиралями, и что конфигурации E2 этих спиралей повернуты относительно конфигураций E1. Изучение путей этих спиралей через двухслойный слой не обнаруживает никакого очевидного «канала» через мембрану. Это согласуется с исследованиями механизма реакции, которые показали, что на последовательных этапах цикла катионы либо имеют доступ только с одной стороны мембраны, либо «закупорены» внутри молекулы насоса. P-насосы имеют три четко демаркационных цитоплазматических домена, которые на рис. 5-8 окрашены в пурпурный (N или нуклеотидный связывание), оранжевый (P или фосфорил) и зеленый (A или активатор). Обратите внимание, что трансмембранная спираль 5, которая вносит вклад в ионофорический домен, простирается в виде спирали хорошо в цитоплазматический домен Р, превращаясь в структуру β-листа только на ее границе с «сигнатурной последовательностью», ICSDKTGTL. Он сохраняется во всех P-насосах и включает аспартильный остаток (заполненный пробелом остаток на рис. 5-8), который реагирует с АТФ и водой в каждом каталитическом цикле. Насыщенные и кальциевые насосы могут быть изолированы до почти чистоты и по-прежнему демонстрируют большую часть биохимических свойств «нативного» насоса. Некоторые кинетические свойства этих насосов в «нативных мембранах» изменяются или исчезают по мере очистки мембранных препаратов. Например, при измерении в неповрежденных мембранах временные зависимости фосфорилирования и дефосфорилирования каталитических центров накачки проявляют двухфазный быстрый медленный переход скорости; эта характеристика постепенно исчезает, так как мембраны обрабатываются мягкими моющими средствами. Одно из предложенных объяснений состоит в том, что, когда насосы начинают циклироваться, каталитические субъединицы связываются с более высокими олигомерами, которые могут обеспечить более эффективную передачу энергии из АТФ в процесс переноса ионов [29, 30]. Некоторые структурные данные показывают, что насосы Na, K существуют в клеточных мембранах как мультимеры (αβ) 2 [31].
Медные транспортеры P-типа важны для нервной функции. Болезни Вилсона и Менке имеют основные неврологические компоненты (глава 45). Ген болезни Вильсона кодирует транспортер, выраженный главным образом в печени, который, вероятно, функционирует в экскреции Cu2 +. Ген заболеваемости Menke кодирует тесно связанный транспортер, который регулирует абсорбцию Cu2 + в кишечнике [32].
12.4. V0V1-ПРОТОННЫЕ НАСОСЫ
V-ATPase накачивает протоны в органеллы, из Голджи. Его специализированная нейронная функция — генерировать электрохимический градиент, который активирует H + -антипортеры, которые загружают нейротрансмиттеры в пресинаптические везикулы (глава 10). Структура V0V1 этих насосов (фиг.5-9) аналогична структуре синтаз F0F1-ATP и они прокачивают протоны с помощью аналогичного ротора и механизма статора. В отличие от F0F1, животные которого выражаются только в митохондриях, особая органелла Гольджи, цели которой V0V1 зависит от изоформы субъединицы a, которая экспрессируется [33].
РИСУНОК 5-9 Структурная организация везикулярного протонного насоса V-ATPase: V-ATPase состоит из множества субъединиц, организованных, как показано цветовым кодированием: цитоплазматический домен V1 содержит восемь различных субъединиц (A-H) с тремя копиями связывающих субъединиц А и В АТФ; мембранный домен, называемый V0, представляет собой гексамерное кольцо, состоящее из субъединиц протеолипидов (5 c и 1 c ») и одиночных копий субъединиц a и d. Функционально V-ATPase состоит из ротора (белая надпись) и домена статора (черная надпись). Ротор состоит из гексамерного протеолипидного c-кольца и стебля из субъединиц D и F; статор состоит из оставшихся субъединиц, которые прикреплены к мембране через субъединицу a. Экспрессия различных субъединиц изоформы преследует VATPase для разных мембран. АТФ-связывание и гидролиз тремя субъединицами A, по-видимому, действуют на субъединицу D, чтобы индуцировать вращение через асимметричные конформационные переходы, как описано для синтазы F0F1 ATP. Вращение гексамерного c-кольца транслоцирует протоны из цитоплазматической границы гексамера протеолипида в просвет синаптических или везикул, полученных из Гольджи. Область V1 обратимо диссоциирует в физиологических условиях для регулирования активности V-АТФазы. (С разрешения ссылки [86].)
12.5. Транспортеры ABC
Транспортеры ABC являются продуктами одного из крупнейших надсемейств генов. Каждый из них состоит из двух цитоплазматических нуклеотидсвязывающих доменов (NBD) и двух трансмембранных доменов (TMD). NBD высококонсервативны в семействе ABC и содержат мотивы, типичные для сайтов ATPbinding, тогда как структуры TMD изменяются, вероятно, потому, что они адаптированы к широкому спектру субстратов. У эукариот C-конец каждого NBD связан с TMD. В некоторых случаях функциональная единица (NBD-TMD) 2, а в других, первая TMD ковалентно связана со вторым NBD. Определены трехмерные структуры нескольких АВС-транспортеров из прокариотов. На рис. 5-10 сравниваются структуры NBD из почти идентичных транспортеров из Vibrio cholerae и Escherichia coli, которые кристаллизовались с их TMD в двух «закрытых» и «открытых» конформациях соответственно.
РИСУНОК 5-10 (A) Структура транспортера ABC с множественной лекарственной устойчивостью, VC-MsbA, выраженная Vibrio cholerae. Взгляните в отверстие камеры (вид сбоку). Трансмембранный домен (TMD), внутриклеточный домен (ICD) и нуклеотидсвязывающий домен (NBD) окрашены в красный, синий и голубой. Отображаются трансмембранные и NBD-спирали, а соединительные петли показаны зеленым цветом. Цикл, соединяющий α- и β-домены NBD, показан оранжевым. АТФ-связывающие β-листы выделяются желтым цветом. Коричневые линии указывают приблизительное расположение клеточной мембраны. (B) Соответствующий вид очень сходного АВС-транспортера, выраженного Escherichia coli, Eco-MsbA. Получены кристаллы этих двух белков, которые имеют соответственно закрытые и открытые конформации. (С разрешения на фиг.2 ссылки [87].)
Гипотетически, субстрат будет приобретаться и транспортироваться в результате активизации конформационного цикла, связывая его с гидролизом АТФ. В замкнутой конформации (рис. 5-10А) две NBD-домены связываются друг с другом и, как показано на рисунке 5-11, нуклеотидное связывание происходит в карманах, образованных между этими двумя доменами.
РИСУНОК 5-11 Ленточная диаграмма димера NBD (PDB 1f30). β-нити изображаются стрелками и α-спиралями в виде спиральных лент. Два нуклеотида, показанные как модели палочек, связываются, чтобы сформировать часть интерфейса, которая стабилизирует димерное взаимодействие. (С разрешения на фиг.5 справки [88].)
Стехиометрия и нуклеотидная селективность этих связывающих карманов были определены для АВС-транспортера, который функционирует для экспорта пептидов из дрожжевых митохондрий [34]. Результаты этого исследования привели к тому, что предложенный реакционный цикл был описан и описан на рисунке 5-12.
РИСУНОК 5-12. Модель последовательного зажима для цикла ATPase транспортера ABC Mdl1p. Связывание АТФ (этап 1) на доменах NBD обоих мономеров индуцирует образование димера (стадия 2). После гидролиза АТФ с помощью первого NBD (стадия 3) сначала выделяют либо Pi (этап 4), затем гидролиз второго ATP (этап 5), так и высвобождение второго Pi (этап 
ABCA1 функционирует, чтобы транслоцировать холестерин и фосфолипиды наружу через плазматическую мембрану после их доставки во внутренний лист плазменной мембраны через везикулярные пути [35]. Это происходит в астроцитах и развивающихся нейронах. Астроциты также секретируют апоЕ. Внеклеточный apoE связывается и взаимодействует с ABCA1 для стимулирования холестерина и оттока ПК из культивируемых астроцитов с помощью механизма, который приводит к стабилизации апоЕ HDL-подобными частицами (см. Рис. 2-7). В отсутствие аполипопротеина ABCA1 быстро протеолизируется кальпаином с T1 / 2, содержащим приблизительно 20 минут в некоторых клетках. Однако аполипопротеины защищают ABC1A от кальпаина и повышают его уровень экспрессии [36]. Таким образом, взаимодействие аполипопротеина с ABCA1 является частью регуляционного процесса оттока холестерина. Тесно связанный транспортер ABCA2 экспрессируется в олигодендроцитах и заметно усиливается во время миелинизации [37].
Другое подсемейство ABC, белки с множественной лекарственной устойчивостью (MDR), может «переворачивать» амфипатические молекулы, включая мембранные фосфолипиды и сфинголипиды, от внутреннего к внешнему лифту плазматических мембран [38]. Один член MDR3 может избирательно транспортировать фосфатидилхолин [39]. MDR1or ‘P-гликопротеин’ является классическим MDR, состоящим из двух кассет внутри одной пептидной цепи. Выкачивая лекарства из клеток, повышенная экспрессия во время химиотерапии может снизить хемочувствительность раковых клеток. P-гликопротеин экспрессируется в высоких концентрациях в просветных мембранах мозговых капилляров [40] и, вероятно, объясняет многие функции исключения лекарств гематоэнцефалического барьера. Адренолеодистрофия и синдром Зеллвегера (глава 41) являются результатом дефектов в двух разных генах, которые определяют белки «одной кассетой», нацеленные на пероксисомы.
12.6. Вторичный активный транспорт
РИСУНОК 5-13 (А, В). Структура транспортера глутамата. Этот переносчик бактериальных глутаматов представляет собой первую модель с высоким разрешением для переноса глутамата [88]. Данные рентгеновского излучения указывают на тримерную структуру. (A) Вид тримера внеклеточно и перпендикулярно бислою. (B) Вид из двухслойной плоскости. Тример образует глубокую миску, которая позволяет внеклеточным растворам получить доступ к внеклеточному сайту связывания глутамата, расположенному вблизи центра двухслойной плоскости. Спиралью, представленную цветными цилиндрами, входят в структуру ионофорических сайтов, которые включают в себя трансмембранные спирали 7 и 8 и две петли повторного входа, HP1 (желтый) и HP2 (красный), которые поступают с противоположных сторон чаши. Объектами, отмеченными «Плотность», являются глутаматы, связанные на ионофорических сайтах. Авторы обсуждают эту структуру в терминах модели, в которой каждый связанный глутамат переносится в цитоплазму путем обязательной связи с симпортом 3 Na + и 1 H +. (С разрешения со ссылкой [88].) (C) Процессы, связанные с поглощением и упаковкой нейротрансмиттеров на нервных окончаниях. Концентрация в цитоплазме достигается с помощью симплексоров Na + с высокой аффинностью и специфичностью для нейротрансмиттера в плазмалемме. Как указано красным, μm внеклеточный глутамат концентрируется в мм в цитоплазме и примерно до 200 мм в везикулах. Синаптические пузырьковые мембраны содержат протонный насос V-ATPase (рис. 5-9) и хлоридные каналы, которые вместе подкисляют пространство внутреннего везикула и генерируют протонный градиент, который управляет селективными нейротрансмиттерами.
Вторичные транспортеры используют энергию, хранящуюся в градиентах ионов, для переноса других ионов и молекул. Многие из них являются симпортерами или антипортерами, связанными с Na + или протонными градиентами (фиг.5-1). Однако ситуация часто бывает более сложной, с участием более одного ионного градиента. Недавно была принята более систематическая номенклатура для вторичных перевозчиков. Он основан на геномных анализах эволюционных отношений между этими транспортёрами, которые являются членами большого «семейства растворенных носителей» (SLC) [41]. Примеры обсуждаются в следующих разделах. Восстановление нейротрансмиттеров из синаптических щелей и их хранение в цитоплазматических везикулах осуществляется тандемными действиями вторичных транспортеров в плазме и везикулярных мембранах. Натрий-зависимые симпортеры опосредуют повторный захват нейротрансмиттера от синаптических расщелин в нейроны и глии, тогда как прондезависимые антипортеры концентрируют нейротрансмиттеры из нейронной цитоплазмы на синаптические везикулы (рис. 5-13).
В то время как степень требований к метаболизму мозговых энергий обратного захвата нейротрансмиттера по-прежнему несколько противоречива, это в значительной степени способствует увеличению метаболизма, связанного с нейронной активностью [42] (см. Главу 31). Существует два разных подсемейства Na + -зависимых транспортеров, которые функционируют в плазменных мембранах. Одно подсемейство SLC6 характеризуется 12 трансмембранными сегментами и включает (Na +, Cl-) -зависимые транспортеры для гамма-аминомасляной кислоты (ГАМК), глицина, норэпинефрина, допамина, серотонина и гистамина. Другое подсемейство SLC1 включает в себя Na + -зависимые глютаматные транспортеры. Он охватывает некоторые переносчики амино- и карбоновой кислоты, включая переносчики глутамата, которые экспрессируются в бактериях. Данные рентгеновской дифракции получены из кристаллов одного из них [43] (рис. 5-13). Анализ множественных последовательностей последовательностей указывает на то, что эта молекула имеет высокую степень структурного сходства с переносчиками глутамата, которые выражены в мозге. Кажется, что каждая субъединица содержит ионофорический сайт, который может связывать глутамат, вероятно, в сочетании с тремя Na + и одним H +. Этот сайт расположен вблизи центральной плоскости бислоя и включает в себя две из восьми трансмембранных спиралей плюс две «петли повторного входа», по одному с каждой стороны, которые могут выступать в качестве «ворот доступа», которые открываются последовательно, чтобы разрешить связывание и диссоциацию внутри каждый транспортный цикл. Транспортеры глутамата в головном мозге кодируются пятью различными, но тесно связанными генами, SLC1A1-4 и SLC1A6. Существует несколько тривиальных имен для каждого из соответствующих белков. Транспортеры могут сопоставлять один Glu с тремя Na + и одним H + и антипортами K + в каждом цикле, но они отличаются своим клеточным выражением. Различные изоформы имеют различные регуляторные взаимодействия и выражены в разных типах клеток. Астроциты восстанавливают большую часть синаптически высвобожденного глутамата через транспортеры GLT1 / EAAT2 (SLC1A2) и GLAST / EAAT1 (SLC1A3). Они превращают большую часть этого в глутамин, который рециркулируют в нейроны (см. Chs 15 и 31), вероятно, с помощью Na + или H + -связанных членов семейства генов SLC38. Мутантная форма SLC1A2 ассоциирована с амиотрофическим боковым склерозом (см. Гл. 44). Мыши [34] и крысы [35] с дефицитом GLAST или GLT-1 имеют повышенный внеклеточный глутамат, а у мышей — летальные судороги [44]. Регулирование концентрации глутамата представляет особый интерес, поскольку его внеклеточное накопление является фактором различных патологий (см. Главу 32). В то время как общая концентрация глутамата в мозге составляет около 10 ммоль / л, внеклеточный глутамат, измеряемый микродиализом in vivo, обычно составляет всего 3-4 мкмоль / л. Глутамат в синаптической щели должен поддерживаться в еще более низких концентрациях в состоянии покоя. При использовании «нормальных» мембранных потенциалов и концентраций ионов транзитор глутамата теоретически может уменьшить это значение до 0,6 мкмоль / л или менее. Однако при деполяризационных или аноксических условиях мембранный потенциал и градиенты Na + и K + могут уменьшаться до уровней, которые приводят к тому, что симпордер не работает или работает в обратном направлении, что приводит к увеличению во внеклеточном глутамате в 100-1000 раз. В дополнение к своей функции транспортера перисинаптические транспортеры функционируют в качестве буферов для ограничения внеклеточного свободного глутамата до рецепторов, ближайших к местам постсинаптического высвобождения. По оценкам, общая концентрация глиальных транспортеров в некоторых синаптических областях ЦНС достаточна для связывания содержания глутамата от трех до пяти везикул на синапс [45]. Эта «буферизация», которая встречается главным образом в endfeet астроцитов, необходима для надежной синаптической передачи высокочастотных сигналов [46].Обратный захват GABA опосредуется вторичными транспортерами GAT1-4 (SLC6A1-4), которые экспрессируются в ГАМКергических нейронах. Семейство SLC6 также включает транспортерные гены для катехоламинов, серотонина, гистамина и глицина. Все активируются Na + symport. Хлорид котранспортируется, но, поскольку в большинстве клеток он пассивно распределяется по плазматической мембране, диффузия хлорида не подает энергию в систему. Многие из этих транспортеров экспрессируются при высоких плотностях в перисинаптической нейронной плазматической мембране. Однако до половины транспортеров обнаружены в небольших эндоцитотических везикулах, которые рециркулируют параллельно с везикулами нейротрансмиттеров [47, 48]. Переработка между везикулами и мембранами, по-видимому, является механизмом быстрого регулирования популяций многих различных интегральных мембранных белков. Транспортиры катехоламинов и серотонина ингибируются различными препаратами, как терапевтическими, так и вызывающими зависимость [49]. Синаптическое действие ацетилхолина уникально среди нейротрансмиттеров тем, что оно прекращается путем гидролиза, а не транспорта (глава 11). Следовательно, холинергические нейроны восстанавливают холин, а не ацетилхолин, через высокоаффинный холиновый транспортер CHT-1. Большая часть этих транспортеров CHT-1 находится в пресинаптических везикулах и только включена в пресинаптические мембраны одновременно с высвобождением ацетилхолина [50]. Это форма регулирования, несколько аналогичная той, которая наблюдалась для семейства SLC6, отмеченного выше. Структурно CHT-1 наиболее похож на Na + -зависимые переносчики глюкозы и классифицируется в семействе генов SLC5. Упаковочные нейротрансмиттеры в пресинаптические везикулы опосредуются протон-связанными антипортами. Как обсуждалось выше, мембраны, полученные из Гольджи, включая пресинаптические пузырьковые мембраны, содержат первичные транспортеры V-типа, которые накачивают протоны в просвет этих мембран и везикул. Антиподатчики с глутаматной упаковкой — VGLUT1, -2 и -3. VGLUT1 и -2 главным образом локализованы в глутаматергических нейронах и обладают высокой специфичностью, но с низким сродством (≈1 ммоль / л) для цитоплазматического глутамата, потому что концентрация цитоплазматического глутамата высока. Некоторое указание на функциональное значение различных изоформ можно получить из демонстраций, которые VGLUT2 экспрессируется в некоторых дофаминергических нейронах, тогда как везикулы VGLUT3 встречаются в некоторых серотонинергических и ГАМКергических интернейронах. Было высказано предположение, что такие нейроны могут высвобождать глутамат в качестве ауторегулятора, действующего на метаботропные пресинаптические рецепторы [51]. Антипортер GABA-упаковки, VGAT или VIAAT, был впервые идентифицирован по характеристике мутантного гена Caenorhabditis elegans, который продуцировал фенотип, который имитировал абляцию идентифицированного нейрона HABA. Ортолог млекопитающего этого гена функционирует как в ГАМКергическом, так и в глицинергическом нейронах. Он является протонным антипортером и, как и VGLUT, имеет относительно низкое сродство к его субстратам, ГАМК и глицину. Различные моноаминовые нейротрансмиттеры упаковываются в везикулы относительно неспецифическими антипортами VMAT1 (SLC18A1) и VMAT2 (SLC18A2). Селективность нейротрансмиттера в этих случаях, очевидно, определяется экспрессией биосинтетических ферментов. Упаковка ацетилхолина в синаптических везикулах как центральных, так и периферических нейронов опосредуется одним и тем же антипортером, VAChT (SLC18A3) [52]
12.7. ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ТРАНСПОРТЕРОВ НЕЙРОТРАНСМИТТЕРОВ
Предполагаемые пресинаптические везикулы содержат приблизительно 3000-5000 передающих молекул; внутренний объем везикул таков, что его внутренняя концентрация передатчика может составлять ≈0,5 моль / л; содержимое везикул может быть высвобождено менее чем за 1 мс, и это происходит в пределах <0,02 мкм постсинаптических рецепторов. Пространство внутри синаптической щели ≈1μm2 будет в 1000 раз больше объема пузырька, так что мгновенная концентрация составляет более 1 ммоль / л. Поскольку только 3-4 свободных молекул в объеме такой расщелины эффективно ≈1 мкмоль / л, быстрая инактивация постсинаптического рецептора требует удаления практически всего передатчика. Транспортеры глутамата имеют константы сродства более 10 мкмоль / л, а циклы реакции транспорта медленны относительно скоростей импульсов. Эта проблема, по-видимому, решается за счет наличия чрезвычайно высокой плотности транспортеров в астроглиальных процессах, непосредственно примыкающих к синапсам глутаматерапии ЦНС. По оценкам, плотность астроглиальных транспортеров в процессах около глутаматергических синапсов составляет 5000-10 000 / мкм2 [45]; связывание глутамата с транспортерами является важным фактором быстрого удаления (глушения) глутамата и, следовательно, распределение транспортеров может регулировать доступность глутамата к экстрасинаптическим рецепторам [53]. Цитоплазматический хлорид должен транспортироваться наружу, чтобы генерировать градиент, который позволяет GABA- или глицинегатированным каналам гиперполяризовать нейроны. Этот перенос в зрелых нейронах опосредуется K +, Cl-symporter, KCC2. Однако незрелые нейроны накапливают хлорид через Na +, Cl-symporter, NKCC1, и, таким образом, активация каналов GABAA деполяризуется [54]. Отношение экспрессии KCC2 / NKCC1 возрастает созреванием в большинстве нейронов. Однако это соотношение можно регулировать в зрелых нейронах: например, в супрахиазматических нейронах это соотношение контролируется часовыми генами и другими нейронами эндокринными циклами. В «нормальном» состоянии зрелых нейронов диффузионный потенциал K + похож на потенциал покоя мембраны и, следовательно, обладает небольшой способностью активировать KCC2. Однако K +, высвобождаемый при деполяризации мембраны, может временно активировать симптом KCC2, более низкий цитоплазматический [Cl-] и увеличивать тормозящий постсинаптический ток через каналы GABAA. Однако возбуждение также повышает цитоплазматический [Ca2 +]; эта высота, по-видимому, регулирует KCC2 и является основой ингибирующего «обнаружения совпадений», который был продемонстрирован в нейронах гиппокампа: это совпадение связано с возбуждающими импульсами, которые «одновременно» с активацией канала GABAA в ингибирующих синапсах [55]. Анионные антипортеры, содержащие семейство генов SLC8, все переносят бикарбонат [56]. Производство энергии CNS происходит почти полностью из аэробного гликолиза, что приводит к тому, что скорость метаболического производства CO2 почти равна скорости потребления кислорода. Во взрослом человеческом мозге это составляет около 1,5 ммоль / л в минуту (Ch.31). Поскольку большинство нейронов выражают только низкие концентрации карбоангидразы, СО2 диффундирует из нейронов, в основном негидратированных, но превращается в HCO-3, прежде чем попадает в кровь. Антипортер Cl- / HCO-3, AE1 / (SLC4A1), также известный как белок полосы 3, является основным белком эритроцитов, где он опосредует быстрое поглощение HCO-3 в обмен на Cl- и функционирует в обратном направлении в легкие для обмена HCO-3. Изоформа этого антипортера (AE3) экспрессируется в нейронах, что указывает на то, что значительный обмен анионом происходит через нейронные и / или глиальные мембраны. Поскольку некоторые нейроны выражают значительные концентрации цитоплазматической карбоангидразы, обмен Cl- / HCO-3 может иметь непризнанные функции: его действие в нейронах может влиять как на Cl-потенциалы, так и на цитоплазматический рН.
12.8. КАТИОННЫЕ АНТИПОРТЫ
Обмен Na +, Ca2 + важен для быстрого снижения высоких импульсов цитоплазматического Ca2 +.
Внутриклеточный рН в головном мозге регулируется антипортами Na +, H +, антипортами анионов и сополимерами Na +, HCO-3.
Цитоплазматический хлорид должен транспортироваться наружу, чтобы генерировать градиент, который позволяет GABA- или глицинегатированным каналам гиперполяризовать нейроны.
Быстрый клиренс K + из внеклеточного пространства нейронов является критическим, поскольку высокие внеклеточные K + деполяризуют нейроны.
13. Мембранные потенциалы и электрические сигналы в возбудимых клетках
Возбудимые клетки имеют отрицательный мембранный потенциал. Прежде чем рассматривать разнообразие электрических сигналов, рассмотрим электрохимическую теорию, лежащую в основе их генерации. В состоянии покоя цитоплазма электрически более отрицательна, чем внешняя купальная жидкость на 30-100 мВ. Это потенциальное падение появляется через плазматическую мембрану клетки, что обнаруживается путем записи с помощью микроэлектрода стеклянной пипетки, заполненной электролитом. Когда узкий кончик такого электрода проходит через плазматическую мембрану, появляется внезапное отрицательное падение, потенциал покоя ячейки. По соглашению мембранный потенциал определяется как «внутри» минус «снаружи», поэтому потенциал покоя является отрицательным числом. Говорят, что сигналы, которые делают цитоплазму более позитивными, чем в состоянии покоя, деполяризуют мембрану, а те, которые делают ее более отрицательной, говорят, что гиперполяризуют мембрану. Мембранные потенциалы возникают из-за диффузии ионов [3-5]. Рассмотрим систему электролита, представленную на рис. 6-2 (слева), где пористая мембрана разделяет водные растворы неравных концентраций фиктивной соли KA. Предположим, что поры мембраны проницаемы исключительно для K +, так что K + начинает диффундировать через мембрану, но A — нет. Первоначально перемещение K + с концентрированной стороны на разбавленную сторону превышает движение в обратном направлении, поэтому несколько ионов K + стекают вниз по их градиенту концентрации. Этот процесс длится недолго, потому что каждый ион K + несет положительный заряд из одного отсека в другой и оставляет отрицательный заряд позади. Растущее разделение заряда создает разность электрических потенциалов (мембранный потенциал) между двумя решениями. Накопленный положительный заряд на стороне, в которую диффундирует ионы K +, создает электрическую силу, которая препятствует дальнейшему сетевому движению K +, и вскоре мембранный потенциал перестает меняться. Мембранный потенциал, достигаемый в системе с одним единственным проницаемым ионом и без возмущающих сил, называется равновесием или потенциалом Нернста для этого иона; таким образом, конечный мембранный потенциал для системы на рис. 6-2 представляет собой равновесный потенциал K + EK. При этом потенциале нет никакого дальнейшего движения K +, и если не будет нарушено иное, мембранный потенциал и ионный градиент будут оставаться стабильными на неопределенный срок. Величина потенциала Нернста получена из термодинамики, признавая, что изменение электрохимического потенциала Δμj для перемещения проницаемого иона j + z через мембрану должно быть равно нулю при равновесии:
где R — газовая постоянная (8.31 Дж) / ° / моль, T — абсолютная температура в кельвине (° C + 273,2), а F — постоянная Фарадея (96 500 C / mol). Используя термины, соответствующие биологии, [j] o и [j] i представляют активность ионов j + z снаружи и внутри ячейки; z — ионная валентность, E — мембранный потенциал, определяемый как «внутри минус снаружи». Решая для E и называя его Ej обозначать ион в равновесии, дает уравнение Нернста для j:

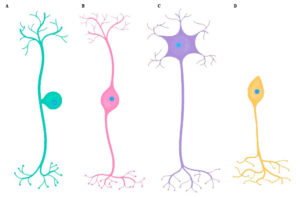
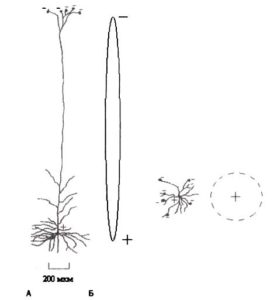

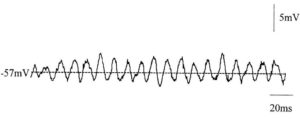

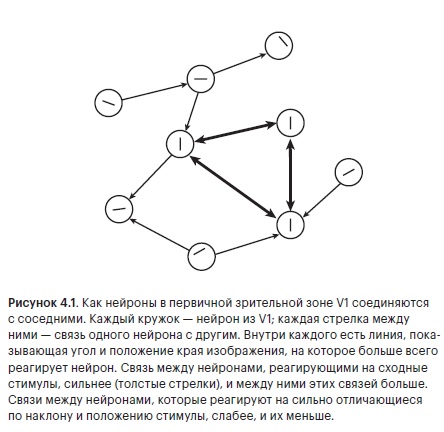














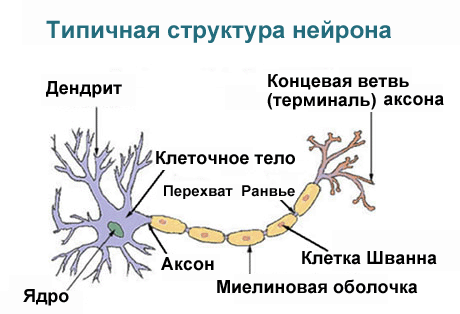
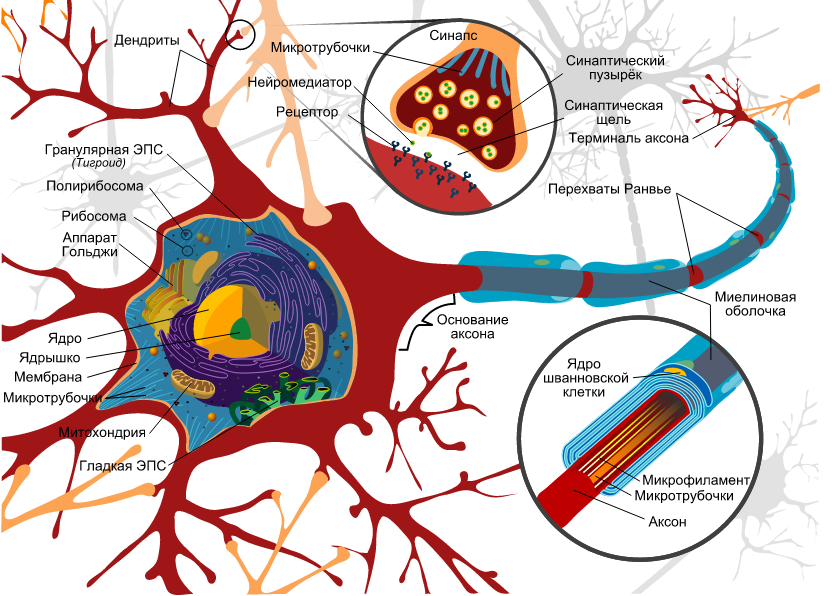
































![Delta mu_j=0=RTln frac{[j]_0}{[j]_i}-zFE Delta mu_j=0=RTln frac{[j]_0}{[j]_i}-zFE](https://edu.volgmed.ru/filter/tex/pix.php/dd8b15621a3c7161072de99caff2e8a7.gif)
![E_i = -frac{RT}{zF} times lnfrac{[j]_0}{[j]_i} E_i = -frac{RT}{zF} times lnfrac{[j]_0}{[j]_i}](https://edu.volgmed.ru/filter/tex/pix.php/923375cbcb852135f337e4347390ac7b.gif)