Общие сведения
Ретикулярная формация — это участок стволового отдела мозга, представленный разветвленной сетью нервных клеток и ядер, соединяющих между собой различные отделы головного мозга. В отличие от других структур, — например, таламуса, гипоталамуса, мозжечка, — которые имеют некую цельную форму (ядра, железы), ретикулярная формация не представлена единым морфологическим образованием, а является «сетью» (от латинского reticulum — сеть) дендритов и аксонов, которые с разной степенью плотности проникают между отделами и структурами головного мозга, объединяя их между собой и обеспечивая их совместную деятельность.
Метафорически выражаясь: если наш мозг представить в виде некоего изделия, скажем, рубашки, то ретикулярная формация — это нити, которыми рубашка сшита. Ретикулярная формация пронизывает структуры продолговатого, среднего мозга и моста, имеет непосредственные связи с мозжечком, спинным мозгом, таламусом и опосредованные — с вышележащими отделами: гипоталамусом, зрительными ядрами и корой.
Как устроена
В состав ретикулярной формации входит огромное количество нейронов с разветвленными дендритами и длинными аксонами, за счет чего становится возможным передавать нервные импульсы в различные отделы головного и спинного мозга. При этом можно выделить две наиболее крупные группы нейронных скоплений:
- Ретикулотегментальное ядро, нейроны которого получают сигналы от вышележащих отделов ГМ (четверохолмие, таламус) и передают их далее в структуры мозжечка, регулируя тем самым некоторые жизненно важные двигательные функции: координация взгляда, движения глаз.
- Латеральное ядро, нейроны которого восходят от структур спинного мозга и вестибулярных ядер и обеспечивают информирование коры ГМ о положении тела в пространстве, участвуют в регуляции дыхания и сосудистой иннервации.
- Кроме того, в состав ретикулярной формации входят нейроны, которые принимают важное участие в работе центров терморегуляции, насыщения и голода.

Основные функции
Основное предназначение ретикулярной формации состоит в сенсорном анализе многочисленных сигналов, поступающих от различных отделов ГМ.
За счет тесных связей со спинным мозгом она также принимает самое активное участие в моторной регуляции, начиная от глотательного рефлекса и заканчивая сложными двигательными операциями. Кроме того, ретикулярная формация осуществляет активирующее воздействие на весь ГМ в целом, участвуя в регуляции циклов сна и бодрствования.
В общем виде функции ретикулярной формации сводятся к следующим:
- Регуляция скелетной мускулатуры (участвует в управлении движениями тела) и вегетативных функций (дыхание, чихание, кровообращение и т.п.).
- Контроль процессов сна и бодрствования (за счет оказания активирующего и тормозящего воздействия на кору больших полушарий).
- Активизирующая функция (проявляется в том, что ретикулярная формация обеспечивает постоянное тоническое возбуждение коры ГМ, за счет чего становится возможным поддержание внимания, сознания и протекание мыслительных процессов.)
- Обработка сигналов, поступающих из внешней и внутренней среды.
Свойства ретикулярной формации
Отличительные особенности работы ретикулярной формации связаны, прежде всего, с определенными свойствами ее нейронов:
Нервные клетки, входящие в состав ретикулярной формации, обладают повышенной способностью к тоническому возбуждению. Это означает, что бо́льшая часть нейронов находятся в постоянном возбуждении и генерирует нервные импульсы, которые передаются в вышележащие отделы ГМ. Такая тоническая активность обусловлена рядом факторов:
- Проходимость большого количества сигналов через структуры ретикулярной формации. Приведем простую аналогию: представьте себе рояль или какой-либо другой струнный инструмент. Понятно, что когда мы напрямую касаемся струн, они начинают колебаться и издавать звук. То же самое происходит и с нервными клетками, когда к ним приходят сигналы от других нейронов.Однако представим далее, что мы не касаемся непосредственно струн инструмента, но, скажем, скачем рядом с ним, сильно стуча ногами о пол. Звука инструмента мы, может быть, и не услышим, но едва заметное колебание струн все же будет иметь место. То же самое происходит и с нейронами ретикулярной формации. Поскольку через нее постоянно проходят какие-то сигналы (как афферентные, так и эфферентные) от различных структур ЦНС, то это и создает постоянное тоническое возбуждение нейронов ретикулярной формации, за счет того, что она находится в эпицентре постоянного нервно-импульсного обмена.
- Повышенная чувствительность нейронов к химическим веществам (гормоны, медикаменты, психотропные вещества). Чашка кофе, выпитая утром, «включает» именно структуры ретикулярной формации и за счет длительного сохранения возбуждения в ее нейронах поддерживает нас в активном состоянии.

Нисходящее и восходящее влияние РФ
Как уже отмечалось, ретикулярная формация оказывает возбуждающее и тормозящее действие на различные отделы ГМ. При этом можно выделить два отдела, которые специализируются на передаче возбуждения в те или иные структуры мозга.
Нисходящий отдел: представлен вегетативными и двигательными центрами и оказывает нисходящее влияние на отделы спинного мозга. Соответствующие нейронные скопления регулируют деятельность дыхательного, сосудодвигательного, слюноотделительного центров, а также центров, отвечающих за построение простых и сложных двигательных реакций. Это указывает на решающую роль именно центральной нервной системы в регуляции даже элементарных безусловных рефлексов. Стимуляция нисходящего отдела приводит к затормаживанию спинальных центров и вызывает в естественной среде состояние глубоко сна (спать «без задних ног»). Тот же эффект можно вызвать и искусственным путем, например, вводя человека в состояние транса или наркоза.
Восходящий отдел: представлен нервными волокнами, соединяющими структуры ретикулярной формации с вышележащими отделами: таламусом, гипоталамусом, мозжечком и корой. Восходящее влияние оказывает стимулирующее действие на кортикальные структуры и обеспечивает активное состояние сознания. Восходящее влияние не прекращается, даже когда мы спим. Если бы наш мозг мог полностью «отключаться», то каждое пробуждение было бы сродни рождению: кто я? Где я? Как я сюда попал? Однако за счет работы ретикулярных структур у нас сохраняется возможность всегда возвращаться в то исходное состояние сознания, в котором мы находились до момента сна. Кроме того, и во время ночного отдыха у нас остается способность реагировать на некоторые жизненно важные раздражители, т.е. мы, как правило, не спим «мертвым сном» и можем проснуться, если рядом зашевелился и заплакал ребенок, что-то громко упало и т.п.
Проявление повреждения структур
Ретикулярная формация играет значимую роль в интегративной деятельности всего головного мозга. За счет выполнения функции ведущего проводника всех видов нервных импульсов во все отделы ЦНС, ретикулярная формация находится в постоянной работе. Чрезмерные умственные и эмоциональные перегрузки вредны для мозга в целом и для ретикулярной формации, в частности. К счастью, своевременный прием седативных препаратов может (за счет повышенной восприимчивости нейронов к химическому воздействию) быстро исправить ситуацию и нормализовать состояние.
Однако возможны и менее благоприятные исходы. Повреждение возможно в результате черепно-мозговых травм, онкологических заболеваний головного мозга, инфекционных поражений.
Основным проявлением неблагополучия является потеря сознания.
Нарушение восходящих связей обнаруживает себя в состоянии апатии, слабости, повышенной сонливости, двигательной растороможенности, нарушениях ночного сна. Нередки сопутствующие вегетативные расстройства.
Обновлено: 02.04.2023
6. Роль ретикулярной формации мозгового ствола в регуляции функций. Варолиев мост
Ретикулярная формация (сетчатое образование) представляет собой скопление нейронов, начинающееся на уровне продолговатого мозга и продолжающееся на протяжении всего ствола мозга. В ретикулярной формации выделяют нисходящую часть , которая снижает деятельность спинного мозга и мышечный тонус (передняя часть продолговатого мозга и средняя часть моста), и восходящую часть – структуры ствола, среднего и промежуточного мозга – оказывает общее активирующее влияние на вышележащие отделы ЦНС; ей принадлежит важнейшая роль в регуляции уровня бодрствования и организации поведенческих реакций.
Нейроны ретикулярной формации имеют длинные маловетвящиеся дендриты и хорошо ветвящийся аксон, который образует синапсы более чем с 25 тысячами нейронов. В ретикулярную формацию поступают афферентные окончания:
— от температурных и болевых рецепторов,
— от сенсорной и частично от других зон коры,
— от ядер мозжечка.
Эфферентные волокна из ретикулярной формации идут:
— в спинной мозг (нисходящий путь),
— к неспецифическим ядрам таламуса, заднему гипоталамусу, полосатому телу (восходящие пути),
Ретикулярная формация координирует функционирование двигательных ядер черепных нервов, моторных спинальных центров и активность мышечных рецепторов.
Нисходящее влияние ретикулярной формации проявляется в центральном торможении рефлексов спинного мозга. Восходящее ее влияние может быть и активирующим, и тормозным. Активирующее влияние проявляется в том, что стимуляция ретикулярной формации приводит к активации коры больших полушарий и переходу из состояния сна в состояние бодрствования (пробуждению), тогда как тормозящее влияние переводит организм из состояния бодрствования в сон. Таким образом, важнейшей функцией восходящей части ретикулярной формации является регуляция цикла сон – бодрствование.
Кроме этого, ретикулярная формация поддерживает тонус вегетативных центров, интегрирует влияние симпатической и парасимпатической систем для обеспечения потребностей всего организма, передает модулирующие влияния от гипоталамуса к внутренним органам, содержит в себе такие жизненно важные центры, как сосудодвигательный, и дыхательный центр (в продолговатом мозге), пневмотаксический центр, осуществляющий переключение вдоха на выдох и наоборот (в среднем мозге).
Мост (варолиев мост) располагается выше продолговатого мозга.
Функции моста:
1- Сенсорные функции обеспечиваются:
— улитковыми и преддверными (треугольное, латеральное – Дейтерса, верхнее – Бехтерева) ядрами преддверно-улиткового нерва (первичный анализ вестибулярных раздражений, их силы и направленности);
— чувствительным ядром тройничного нерва (сигналы от рецепторов кожи лица, передних отделов волосистой части головы, слизистой оболочки носа и рта, конъюнктивы глазного яблока).
2 – Двигательные функции обеспечиваются:
— двигательным ядром тройничного нерва (V) – иннервирует жевательные мышцы, мышцы, натягивающие барабанную перепонку, мышцу, натягивающую небную занавеску;
— лицевой нерв (VII) иннервирует все мимические мышцы лица;
— отводящий нерв (VI) иннервирует прямую латеральную мышцу, отводящую глазное яблоко кнаружи.
3 – Проводящие функции:
— в покрышке моста – длинный медиальный и тектоспинальный пути;
— переднее и заднее ядро трапециевидного тела и латеральной петли обеспечивают первичный анализ информации от органов слуха и затем передают ее в задние бугры четверохолмий.
Функции ретикулярной формации ствола мозга
Ретикулярной формацией (РФ) называется сеть нейронов различных типов и размеров, имеющих многочисленные связи между собой, а также со всеми структурами ЦНС. Она располагается в толще серого вещества продолговатого, среднего и промежуточного мозга и регулирует уровень функциональной активности (возбудимости) всех нервных центров этих отделов ЦНС. Таким же образом она влияет на КБП.
В ЦНС выделяют две подсистемы, выполняющие разные организующие функции: специфическую и неспецифическую. Первая обеспечивает восприятие, проведение, анализ и синтез сигналов специфической чувствительности. К ним относятся все ее виды, т.е. зрительная, слуховая, болевая и т.д.
Неспецифической подсистемой является РФ. Она оказывает генерализованное возбуждающее или тормозящее влияние на многие структуры мозга. Следовательно, она может регулировать уровень функциональной активности моторной, сенсорной, висцеральных систем и организма в целом. Когда нервные импульсы идут по специфическим проводящим путям, по коллатералям этих путей они поступают и к нейронам РФ. Это приводит к их диффузному возбуждению. От нейронов РФ возбуждение передается на кору, что сопровождается возбуждением нейронов всех ее зон и слоев. Благодаря этому восходящему активирующему влиянию РФ, повышается активность аналитико-синтетической деятельности, увеличивается скорость рефлексов, организм подготавливается к реакции на неожиданную ситуацию. Поэтому РФ участвует в организации оборонительного, полового, пищедобывательного поведения. С другой стороны, она может избирательно активировать или тормозить определенные системы мозга. В свою очередь кора больших полушарий, через нисходящие пути, может оказывать возбуждающее действие на РФ.
Нисходящие ретикулоспинальные пути идут от РФ к нейронам спинного мозга. Поэтому она может оказывать нисходящие возбуждающие и тормозящие влияния на его нейроны. Например, ее гипоталамические и мезэнцефальные отделы повышают активность -мотонейронов спинного мозга. В результате этого растет тонус скелетных мышц, усиливаются двигательные рефлексы. Тормозящее влияние РФ на спинальные двигательные центры осуществляется через тормозные нейроны Реншоу. Это приводит к торможению спинальных рефлексов.
РФ контролирует передачу сенсорной информации через продолговатый, средний мозг, а также ядра таламуса. Она непосредственно участвует в регуляции бодрствования и сна, за счет синхронизирующих центров сна и бодрствования, находящихся в ней. На нейроны РФ оказывают влияние различные фармакологические вещества: амфетамины, кофеин, LSD-25, морфин (опыт Эдисона).
Функции мозжечка
Мозжечок состоит из 2-х полушарий и червя между ними. Серое вещество образует кору и ядра. Белое образовано отростками нейронов. Мозжечок получает афферентные нервные импульсы от тактильных рецепторов, рецепторов вестибулярного аппарата, проприорецепторов мышц и сухожилий, а также двигательных зон коры. Эфферентные импульсы от мозжечка идут к красному ядру среднего, ядру Дейтерса продолговатого мозга, к таламусу, а затем моторным зонам КБП и подкорковым ядрам.
Общей функцией мозжечка является регуляция позы и движений. Эту функцию он осуществляет путем координации активности других двигательных центров: вестибулярных ядер, красного ядра, пирамидных нейронов коры. Поэтому он выполняет следующие двигательные функции: 1. Регуляцию мышечного тонуса и позы.
2. Коррекцию медленных целенаправленных движений в ходе их выполнения, а также координацию этих движений с рефлексами положения тела.
3. Контроль за правильным выполнением быстрых движений, осуществляемых корой.
В связи с тем, что мозжечок выполняет данные функции, при его удалении у животного развивается комплекс двигательных нарушений, называемый триадой Лючиани. Он включает:
1. Атония и дистония — снижение и неправильное распределение тонуса скелетных мышц.
2. Астазия — невозможность слитного сокращения мышц, а как следствие, сохранения устойчивого положения тела при стоянии, сидении (покачивание).
3. Астения — быстрая утомляемость мышц.
4. Атаксия — плохая координация движений при ходьбе. Неустойчивая «пьяная» походка.
5. Адиадохокинез — нарушение правильной последовательности быстрых целенаправленных движений.
В клинике умеренные поражения мозжечка проявляются триадой Шарко:
1. Нистагм глаз в состоянии покоя.
2. Тремор конечностей, возникающий при их движениях.
3. Дизартрия — нарушения речи.
Л.А.Орбели установил, что мозжечок влияет и на различные вегетативные функции. Эти влияния могут быть возбуждающими и тормозящими. Например, при раздражении мозжечка увеличивается или снижается кровяное давление, изменяется частота сердцебиений, дыхание, пищеварение. Мозжечок влияет на обмен веществ. На эти функции он воздействует через вегетативные нервные центры, координируя их активность с движением. Функции внутренних органов изменяются в связи с изменением обменных процессов в них. Поэтому мозжечок оказывает на них адаптационно-трофическое влияние.
Ретикулярная формация ствола мозга
Ретикулярная формация — совокупность различных нейронов, расположенных на протяжении ствола мозга, оказывающих активирующее или тормозящее влияние на различные структуры центральной нервной системы, тем самым контролируя их рефлекторную деятельность.
Ретикулярная формация ствола мозга оказывает активирующее влияние на клетки коры головного мозга и тормозное действие на мотонейроны спинного мозга. Посылая в спинной мозг к его двигательным нейронам тормозящие и возбуждающие импульсы ретикулярная формация участвует в регуляции тонуса скелетных мышц.
Ретикулярная формация поддерживает тонус вегетативных центров, интегрирует симпатические и парасимпатические влияния, передает модулирующее влияние от гипоталамуса и мозжечка к внутренним органам.
Функции ретикулярной формации
Соматодвигательный контроль (активация скелетной мускулатуры), может быть прямым через tr. reticulospinalis и непрямым через мозжечок, оливы, бугорки четверохолмия, красное ядро, черное вещество, полосатое тело, ядра таламуса и даже соматомоторные зоны коры.
Соматочувствительный контроль, т.е. снижение уровней соматосенсорной информации — «медленная боль», модификация восприятия различных видов сенсорной чувствительности (слуха, зрения, вестибуляции, обоняния).
Висцеромоторный контроль состояния сердечно-сосудистой, дыхательной систем, активности гладкой мускулатуры различных внутренних органов.
Нейроэндокринная трансдукция через влияние на нейромедиаторы, центры гипоталамуса и далее гипофиз.
Биоритмы через связи с гипоталамусом и шишковидной железой.
Различные функциональные состояния организма (сон, пробуждение, состояние сознания, поведение) осуществляются посредством многочисленных связей ядер ретикулярной формации со всеми частями ЦНС.
Координация работы разных центров ствола мозга, обеспечивающих сложные висцеральные рефлекторные ответы (чихание, кашель, рвота, зевота, жевание, сосание, глотание и др.).
Строение ретикулярной формации
Ретикулярная формация образована совокупностью многочисленных нейронов, лежащих отдельно или сгруппированных в ядра (см. рис. 1 и 2). Ее структуры локализуются в центральных участках ствола, начиная с верхних сегментов шейного отдела спинного мозга до верхнего уровня ствола мозга, где они постепенно сливаются с ядерными группами таламуса. Ретикулярная формация занимает пространства между ядрами черепных нервов, другими ядрами и трактами, проходящими через ствол мозга.
Нейроны ретикулярной формации характеризуются большим разнообразием форм и размеров, но их общим признаком является то, что они образуют длинными дендритами и широко ветвящимися аксонами многочисленные синаптические контакты как между собой, так и с нейронами других ядер мозга. Эти ветвления формируют своеобразную сеть (ретикулум), откуда произошло название — ретикулярная формация. У нейронов, формирующих ядра ретикулярной формации, имеются длинные аксоны, образующие проводящие пути к спинному мозгу, ядрам ствола мозга, мозжечка, таламуса и других областей головного мозга.
Рис. 1. Важнейшие структурные образования среднего мозга (поперечный срез)
К нейронам ретикулярной формации поступают многочисленные афферентные сигналы из различных структур ЦНС. Можно выделить несколько групп нейронов, к которым поступают эти сигналы. Это группа нейронов латерального ядра ретикулярной формации, расположенного в продолговатом мозге. Нейроны ядра получают афферентные сигналы от вставочных нейронов спинного мозга и входят в состав одного из непрямых спиномозжечковых путей. Кроме того, они получают сигналы от вестибулярных ядер и могут интегрировать информацию о состоянии активности вставочных нейронов, связанных с мотонейронами спинного мозга, и о положении тела и головы в пространстве.
Следующая группа — это нейроны ретикулотегментального ядра, расположенные на границе дорсального края моста. Они получают афферентные синаптические входы от нейронов претектальных ядер и верхних холмиков четверохолмия и посылают свои аксоны в структуры мозжечка, участвующие в контроле движений глаз.
Нейроны ретикулярной формации получают разнообразные сигналы через пути, связывающие их с корой головного мозга (кортикоретикулоспинальные пути), черной субстанцией, гипоталамусом и лимбической системой.
Рис. 2. Расположение некоторых ядер в стволе мозга и гипоталамусе: 1 — паравентрикулярное; 2 — дорсомедиальное: 3 — преоптическое; 4 — супраоптическое; 5 — заднее
Кроме описанных афферентных путей в ретикулярную формацию поступают сигналы по аксонным коллатералям проводящих путей сенсорных систем. При этом на один и тот же нейрон могут конвергировать сигналы от разных рецепторов (тактильных, зрительных, слуховых, вестибулярных, болевых, температурных, проприорецепторов, рецепторов внутренних органов).
Из приведенного перечня основных афферентных связей ретикулярной формации с другими областями ЦНС видно, что состояние ее тонической нейронной активности определяется притоком практически всех типов сенсорных сигналов от чувствительных нейронов, а также сигналов от большинства структур ЦНС.
Отделы
Характеристика
- дыхательный;
- сосудодвигательный;
- слюноотделительный и др.
- специфические центры, формирующие специфические ретикулоспинальные пути;
- неспецифические центры, формируют неспецифические ретикулоспинальные пути двух видов — активирующие, тормозные
Ретикулокортикальные: активирующие; гипногенные
Ядра ретикулярной формации и их функции
Долгое время считалось, что ретикулярная формация, строение которой характеризуется широкими межнейронными связями, интегрирует сигналы различной модальности, не выделяя при этом специфической информации. Однако становится все более очевидным, что ретикулярная формация является не только морфологически, но и функционально гетерогенной, хотя различия между функциями ее отдельных частей не столь очевидны, как это характерно для других областей мозга.
Действительно, многие нейронные группы ретикулярной формации формируют ее ядра (центры), выполняющие специфические функции. Это нейронные группы, формирующие сосудодвигательный центр продолговатого мозга (гигантоклеточное, парамедианное, латеральное, вентральное, каудальное ядра продолговатого мозга), дыхательный центр (гигантоклеточное, мелкоклеточное ядра продолговатого мозга, оральное и каудальное ядра моста), центры жевания и глотания (латеральное, парамедианное ядра продолговатого мозга), центры движений глаз (парамедианная часть моста, ростральная часть среднего мозга), центры регуляции тонуса мышц (ростральное ядро моста и каудальное — продолговатого мозга) и др.
Одной из важнейших неспецифических функций ретикулярной формации является регуляция общей нейронной активности коры и других структур ЦНС. В ретикулярной формации проводится оценка биологической значимости поступающих сенсорных сигналов, и в зависимости от результатов этой оценки она может активировать или тормозить через неспецифические или специфические нейронные группы таламуса нейронные процессы во всей коре головного мозга или в се отдельных зонах. Поэтому стволовая ретикулярная формация называется также активирующей системой ствола мозга. Благодаря этим свойствам ретикулярная формация может оказывать влияние на уровень общей активности коры, поддержание которой является важнейшим условием для сохранения сознания, состояния бодрствования, формирования направленности внимания.
Повышение активности ретикулярной формации (на общем высоком фоне) в отдельных сенсорных, ассоциативных областях коры обеспечивает возможность выделения и обработки специфической, наиболее важной в данный момент времени информации для организма и организации адекватных ответных поведенческих реакций. Обычно эти реакции, организуемые при участии ретикулярной формации ствола мозга, предваряются ориентационными движениями глаз, головы и тела в направлении источника сигнала, изменениями дыхания и кровообращения.
Активирующее влияние ретикулярной формации на кору и другие структуры ЦНС осуществляется по восходящим путям, идущим от гигантоклеточного, латерального и вентрального ретикулярных ядер продолговатого мозга, а также от ядер моста и среднего мозга. По этим путям потоки нервных импульсов проводятся к нейронам неспецифических ядер таламуса и после их обработки переключаются в таламических ядрах для последующей передачи к коре. Кроме того, от перечисленных ретикулярных ядер потоки сигналов проводятся к нейронам заднего гипоталамуса и базальных ганглиев.
Кроме регуляции нейронной активности высших отделов мозга ретикулярная формация может регулировать сенсорные функции. Это осуществляется путем влияния на проведение афферентных сигналов в нервные центры, на возбудимость нейронов нервных центров, а также на чувствительность рецепторов. Повышение активности ретикулярной формации сопровождается повышением активности нейронов симпатической нервной системы, иннервирующей органы чувств. В результате может повышаться острота зрения, слуха, тактильная чувствительность.
Наряду с восходящими активирующими и тормозящими влияниями на высшие отделы головного мозга ретикулярная формация принимает участие в регуляции движений, оказывая активирующие и тормозные воздействия на спинной мозг. На ее ядрах происходит переключение как восходящих путей, идущих от проприорецепторов и спинного мозга к головному мозгу, так и нисходящих двигательных путей от коры мозга, базальных ядер, мозжечка и красного ядра. Хотя восходящие нейронные пути, идущие из ретикулярной формации в таламус и кору, играют роль преимущественно в поддержании общего уровня активности коры больших полушарий мозга, но именно эта их функция важна для осуществления бодрствующей корой планирования, запуска, исполнения движений и контроля за их исполнением. Между восходящими и нисходящими через ретикулярную формацию путями имеется большое число коллатеральных связей, через которые они могут оказывать взаимное влияние. Существование такого тесного взаимодействия создает условия для взаимного воздействия области ретикулярной формации, влияющей через таламус на активность коры, планирующей и инициирующей движения, и области ретикулярной формации, влияющей на исполнительные нейронные механизмы спинного мозга. В ретикулярной формации имеются группы нейронов, которые посылают большинство аксонов в мозжечок, участвующий в регуляции и координации сложных движений.
По нисходящим ретикулоспинальным путям ретикулярная формация непосредственно воздействует на функции спинного мозга. Прямое влияние на его двигательные центры осуществляется по медиальному ретикулоспинальному тракту, идущему от ядер моста и активирующему преимущественно интер- и у-моторные нейроны разгибателей и тормозящему моторные нейроны мышц-сгибателей туловища и конечностей. По латеральному ретикулоспинальному тракту, начинающемуся от гигантоклеточного ядра продолговатого мозга, ретикулярная формация оказывает активирующее влияние на интер- и у-моторные нейроны мышц-сгибателей конечностей и тормозящее на нейроны мышц-разгибателей.
Из экспериментальных наблюдений на животных известно, что стимуляция более рострально расположенных нейронов ретикулярной формации на уровне продолговатого и среднего мозга, оказывает диффузное облегчающее влияние на спинальные рефлексы, а стимуляция нейронов каудальной части продолговатого мозга сопровождается торможением сиинальных рефлексов.
Активирующее и тормозное влияние ретикулярной формации на моторные центры спинного мозга может осуществляться через у-мотонейроны. При этом ретикулярные нейроны рострального участка ретикулярной формации активируют у-мотонейроны, которые своими аксонами иннервируют интрафузальные мышечные волокна, вызывают их сокращение, активируют рецепторы мышечных веретен. Поток сигналов от этих рецепторов активирует а-мотонейроны и вызывает сокращение соответствующей мышцы. Нейроны каудального участка ретикулярной формации тормозят активность у-мотонейронов спинного мозга и вызывают расслабление мышц. От баланса нейронной активности этих участков ретикулярной формации зависит распределение тонуса в больших мышечных группах. Поскольку этот баланс зависит от нисходящих влияний на ретикулярную формацию коры головного мозга, базальных ганглиев, гипоталамуса, мозжечка, то эти структуры мозга также могут через ретикулярную формацию и другие ядра ствола мозга воздействовать на распределение тонуса мышц и позу тела.
Широкое ветвление аксонов ретикулоспинальных путей в спинном мозге создает условия для влияния ретикулярной формации практически на все моторные нейроны и соответственно на состояние мышц различных частей тела. Такая особенность обеспечивает эффективное воздействие ретикулярной формации на рефлекторное распределение тонуса мышц, позу, ориентацию головы и тела в направлении действия внешних раздражителей и участие ретикулярной формации в осуществлении произвольных движений мышц проксимальных частей тела.
В центральной части ретикулярного гигантоклеточного ядра располагается участок, раздражение которого тормозит все двигательные рефлексы спинного мозга. Наличие такого торможения структур головного мозга на спинной мозг было открыто И.М. Сеченовым в опытах на лягушках. Суть опытов состояла в исследовании состояния рефлексов спинного мозга после перересечения ствола мозга на уровне промежуточного мозга и раздражении каудального участка разреза кристалликом поваренной соли. Оказалось, что двигательные спинальные рефлексы при раздражении не проявлялись или становились ослабленными и восстанавливались после устранения раздражения. Таким образом было впервые выявлено, что один нервный центр может тормозить активность другого. Это явление назвали центральным торможением.
Ретикулярная формация играет важную роль в регуляции не только соматических, но и вегетативных функций (ретикулярные ядра ствола мозга входят в структуру жизненно важных отделов дыхательного центра и центров регуляции кровообращения). Латеральная группа ретикулярных ядер моста и дорсолатеральное ядро покрышки формируют мочевыделительный центр моста. Аксоны нейронов ядер этого центра достигают преганглионарных нейронов крестцового отдела спинного мозга. Стимуляция нейронов этих ядер в мосту сопровождается сокращением мускулатуры стенки мочевого пузыря и мочевыделением.
В дорсолатеральном мосту расположено парабрахиальное ядро, на нейронах которого заканчиваются волокна сенсорных нейронов вкуса. Нейроны ядра, подобно нейронам голубоватого пятна и черной субстанции, содержат нейромеланин. Число таких нейронов в парабрахиальном ядре уменьшается при болезни Паркинсона. Нейроны парабрахиального ядра имеют связи с нейронами гипоталамуса, амигдалы, ядрами шва, одиночного тракта и другими ядрами ствола мозга. Предполагают, что парабрахиальные ядра имеют отношение к регуляции вегетативных функций и понижение их числа при паркинсонизме объясняет возникновение вегетативных нарушений при этом заболевании.
В опытах на животных было показано, что при раздражении некоторых локальных участков ретикулярных структур продолговатого мозга и моста можно вызвать торможение активности коры и сон. На ЭЭГ при этом возникают низкочастотные (1-4 Гц) волны. На основе описанных фактов считают, что важнейшими функциями восходящих влияний ретикулярной формации являются регуляция цикла сон — бодрствование и уровня сознания. Оказалось, что к формированию этих состояний имеют прямое отношение ряд ядер ретикулярной формации ствола мозга.
Так, с каждой стороны центрального шва моста располагаются парамедианные ретикулярные ядра, или ядра шва, содержащие серотонинергические нейроны. В каудальной части моста они включают нижнее центральное ядро, которое является продолжением ядра шва продолговатого мозга, а в ростральной части моста в состав ядер шва моста входит верхнее центральное ядро, называемое ядром Бехтерева, или срединным ядром шва.
В ростральной части моста на дорсальной стороне покрышки располагается группа ядер голубоватого пятна. В них имеется около 16 000-18 000 меланинсодержащих норадренергических нейронов, аксоны которых широко представлены в различных отделах ЦНС — гипоталамусе, гиппокампс, коре больших полушарий мозга, мозжечке и спинном мозге. Голубоватое пятно простирается в средний мозг, и его нейроны прослеживаются в ссром веществе околоводопроводного пространства. Число нейронов в ядрах голубоватого пятна уменьшается при паркинсонизме, болезни Альцгеймера и синдроме Дауна.
Как серотонинергические, так и норадреналинергические нейроны ретикулярной формации играют роль в контроле цикла сон — бодрствование. Подавление синтеза серотонина в ядрах шва ведет к развитию бессонницы. Предполагают, что серотонинергические нейроны являются частью нервной сети регуляции медленноволнового сна. При действии серотонина на нейроны голубоватого пятна возникает парадоксальный сон. Разрушение ядер голубоватого пятна у экспериментальных животных не ведет к развитию бессонницы, но вызывает на несколько недель исчезновение фазы парадоксального сна.
Функции ретикулярной формации
Ретикулярная формация расположена во внутренней части ствола на протяжении от нижних отделов промежуточного мозга до продолговатого мозга, где она проходит между двигательными и чувствительными ядрами.
Собственные ядра ретикулярной формации имеют низкую плотность нейронов, относительно высокий процент клеток нейроглии и слабо выраженные границы ядер, количество которых измеряется несколькими десятками. Большинство нейронов ретикулярной формации принимает коллатерали от нескольких сенсорных путей (полисенсорная конвергенция) и обладает тонической активностью покоя (5—10 импульсов в секунду), растущей в связи с поступлением афферентных сигналов. Аксоны нейронов ретикулярной формации обычно делятся на две ветви, следующие в восходящем и нисходящем направлениях. Восходящие влияния ретикулярной формации регулируют возбудимость нейронов коры в связи с циклом сон—бодрствование, они необходимы для сохранения сознания и восприятия сенсорных сигналов. Нисходящие влияния осуществляются посредством ретику- лоспинального тракта, входящего в состав медиального пути к спинному мозгу и регулирующего его двигательную функцию. Координационные центры ретикулярной формации обеспечивают согласование афферентной и эфферентной систем, участвующих в регуляции вегетативных функций (кровообращение, дыхание, пищеварение). Особенности нейронной организации ретикулярной формации
Афферентные сенсорные входы представлены волокнами спиноретикулярного тракта, образованного отростками нейронов задних рогов спинного мозга, коллатералями от аксонов интернейронов чувствительных ядер (тройничного, блуждающего, языкоглоточного, вестибулярного и слухового нервов), а также небольшим количеством волокон от других сенсорных проводящих путей, следующих через ствол. Остальные проекции на нейроны ретикулярной формации представлены окончаниями нейронов ядер мозжечка, гипоталамуса и коры, они регулируют активность нейронов ретикулярной формации.
Разные области и ядра ретикулярной формации образуют синаптические контакты между собой, как, например, каудальная область с ростральной, и могут реципрокно влиять друг на друга.
В дорсальном отделе продолговатого мозга находится ядро солитарного или одиночного тракта, получающее сенсорную информацию от внутренних органов. В составе волокон языкоглоточного и блуждающего нервов сюда поступают сигналы от периферических баро- и хеморецепторов. От нейронов ядра солитарного тракта отходят аксоны к парасимпатическим нейронам черепно-мозговых нервов (дорсальные ядра блуждающих нервов и обоюдные ядра) и к рострально-вентролатеральной области продолговатого мозга, регулирующей активность симпатических нейронов спинного мозга.
Вегетативные центры ретикулярной формации продолговатого мозга находятся под контролем гипоталамуса, который изменяет активность симпатического и парасимпатического отделов соответственно возникающим задачам, например поддержанию температуры тела, осуществлению оборонительного, пищевого или полового поведения. Гипоталамус обеспечивает функциональное объединение вегетативных центров ствола и спинного мозга в целостные системы, регулирующие функции кровообращения и дыхания, температуру тела. Гипоталамус подвержен влиянию лимбических структур мозга, обеспечивающих формирование эмоциональных реакций, при возникновении которых происходит комплексное изменение активности вегетативных центров, приспосабливающее внутренние процессы организма к решению текущих поведенческих задач.
В ретикулярной формации моста и продолговатого мозга располагаются структуры сосудодвигательного центра, состоящего из прессорного и депрес- сорного отделов. Прессорный отдел находится в рострально-вентральной области продолговатого мозга, где сосредоточены нейроны, имеющие решающее значение в повышении общей выходной активности симпатического отдела вегетативной нервной системы. Депрессорный отдел расположен в медиокаудальных отделах ствола, его активация сопровождается понижением тонуса симпатических нервов и одновременным повышением тонуса блуждающего нерва.
Поблизости от ядер одиночного тракта билатерально расположен дыхательный центр, состоящий из дорсальной и вентральной групп нейронов.
В зависимости от выполняемой функции нейроны дыхательного центра подразделяются на инспираторные, экспираторные, преинспираторные и постинспираторные. Инспираторные нейроны генерируют ритм дыхания, их нисходящие в спинной мозг аксоны возбуждают мотонейроны диафрагмы и наружных межреберных мышц, при сокращении которых происходит вдох. Экспираторные нейроны регулируют активность мотонейронов внутренних межреберных мышц, сокращения которых происходят при активном выдохе. Преинспираторные и постинспираторные нейроны регулируют активность инспираторных нейронов. Смена вдоха выдохом и наоборот происходит при участии нейронов пневмотаксического центра, расположенного в передней части моста. Нисходящие и восходящие влияния ретикулярной формации
Нисходящие влияния ретикулярной формации предназначены для регуляции рефлекторной деятельности спинного мозга (см. раздел 4.2.2). Восходящие дивергентные проекции ретикулярной формации к другим отделам головного мозга образованы ветвящимися аксонами моноаминергических нейронов среднего мозга, голубого пятна и ядер шва, а также холинергических нейронов. Метаботропное действие моноаминергических медиаторов влияет на биохимические процессы нейронов-мишеней, это действие проявляется медленно по сравнению с распространением сигналов, передающихся через синапсы с помощью ионотропных рецепторов. Результатом такого действия является модуляция функций многих нервных клеток, участвующих в формировании мотиваций, эмоций и целенаправленного поведения.
Норадренергические нейроны голубого пятна обладают фоновой активностью, изменяющейся в зависимости от сенсорной афферентации разных модальностей, а также под влиянием других центров ретикулярной формации, гипоталамуса и мозжечка. Аксоны нейронов голубого пятна проецируются почти во все области мозга и заканчиваются варикозными расширениями, из которых выделяется норадреналин, диффундирует через межклеточное пространство и через него действует на большие популяции нейронов.
Активность норадренергических нейронов необходима для поддержания бодрствования, при физиологическом повышении этой активности формируются двигательные и вегетативные компоненты апресс-реакции, чрезмерное повышение активности нейронов голубого пятна приводит к развитию панического синдрома, а при сниженной активности возникает депрессия.
Проекция нейронов черной субстанции среднего мозга к полосатому телу (нигростриатный путь) необходима для регуляции его активности при осуществлении произвольных движений. Дегенеративное поражение нейронов черной субстанции приводит к развитию болезни Паркинсона, проявляющейся возникновением ригидности мышц и тремором. Еще одна проекция дофаминергических нейронов направлена к структурам лимбической системы и фронтальной коре (мезолимбический и мезокортикальный пути), участвующим в образовании мотиваций и эмоций. Влияние дофамина на эти структуры усиливается при удовлетворении биологических потребностей, а переживание в этот момент положительных эмоций побуждает людей к повторению действий, приводящих к подобному результату. Роль дофамина состоит в модуляции возбудимости нейронов-мишеней лимбических структур и коры, чтобы их взаимодействие становилось оптимальным при создании программы поведения, а сами дофаминергические нейроны являются необходимым звеном образующихся поведенческих программ. При избытке дофамина вследствие патологически повышенной активности дофаминергических нейронов возникают грубые нарушения поведения и мышления, проявляющиеся, например, при заболевании шизофренией.
Нейроны ядер шва, синтезирующие серотонин, образуют проекции в спинной мозг, кору мозжечка, ядра таламуса и кору больших полушарий, что в совокупности создает восходящую и нисходящую системы, каждая из которых принимает участие в регуляции циклических процессов сна и бодрствования. Активация холинергических нейронов рострального отдела среднего мозга и гигантоклеточной области покрышки моста, образующих проекции к зрительному бугру и коре, необходима для поддержания сознания, переработки сенсорной и ассоциативной информации в коре и обеспечения познавательной интеллектуальной деятельности. Активность холинергических, норадренергических и серотонинергических нейронов в цикле сна и бодрствования периодически изменяется под влиянием супра- хиазмальных и вентромедиальных ядер гипоталамуса, играющих роль основных водителей суточной ритмики физиологических процессов.
РЕТИКУЛЯРНАЯ ФОРМАЦИЯ
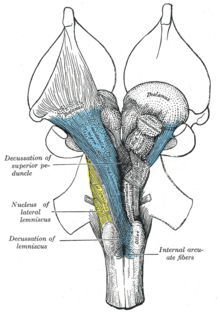
В шейном отделе спинного мозга между боковыми и задними рогами имеются клетки с большим количеством отростков. Такие же клетки есть в продолговатом мозге, мосту, среднем и промежуточном мозге. Нейроны густо переплетаются между собой, поэтому структура похожа на сеть и называется сетчатой структурой, или ретикулярной формацией (рис. 11.8 [1] ). Между нейронами ретикулярной формации образуется особенно много контактов, один аксон на протяжении 2 см образует до 27 тыс. синапсов. Большинство нейронов имеют длинные дендриты и короткий аксон.
В ретикулярной формации человека выделяют 48 отдельных ядер. Наиболее крупное — гигантоклеточное ядро, которое составляет 2 /3 размера ретикулярной формации и отличается тем, что содержит гигантские нейроны, отсутствующие в других ядрах.
Рис. 11.8. Проекции восходящей ретикулярной активирующей системы
Сетевое строение обеспечивает высокую надежность функционирования ретикулярной формации, устойчивость к повреждениям, так как локальные повреждения всегда компенсируются за счет сохранившихся элементов сети. Высокая надежность функционирования ретикулярной формации проявляется в том, что раздражение любой ее части отражается на активности всей структуры за счет диффузности связей.
Основной функцией ретикулярной формации является регуляция уровня активности коры большого мозга, мозжечка, таламуса и спинного мозга.
В ретикулярной формации моста, продолговатого и среднего мозга имеются нейроны, которые реагируют на болевые раздражения, идущие от мышц или внутренних органов, что создает общее диффузное дискомфортное, не всегда четко локализованное болевое ощущение «тупой боли».
Ретикулярная формация ствола мозга принимает участие в регуляции мышечного тонуса, поскольку в сетевую структуру поступают нервные импульсы от зрительного и вестибулярного анализаторов и мозжечка. От ретикулярной формации к мотонейронам спинного мозга и ядрам черепных нервов поступают сигналы, обеспечивающие положение головы и туловища в пространстве.
К ядрам сетчатой структуры от всех афферентных систем по неспецифическому пути направляется поток чувствительных импульсов. Поэтому ретикулярная формация у бодрствующего человека постоянно находится в тонусе — возбуждении. От нее беспрерывно идут импульсы, которые обеспечивают оптимальный уровень функционирования коры головного мозга. Если фармакологически заблокировать ретикулярную формацию, то человек погружается в сон и кора перестает воспринимать раздражения из окружающего мира (зрение, слух).
Поток импульсов, идущий от ретикулярной формации к коре, называется «восходящей активирующей системой». Кора работает, только если к ней подходят импульсы от ретикулярной формации.
В ретикулярной формации заложены центры вегетативных функций (сердечно-сосудистой, дыхательной и пищеварительной систем).
Ретикулярная формация принимает участие в регуляции цикла «сон — бодрствование». При раздражении сетчатой структуры продолговатого мозга в ЭЭГ медленные волны с малой амплитудой, характеризующие состояние сна, сменяются быстрыми волнами, характеризующими состояние бодрствования.
В ретикулярной формации происходит взаимодействие афферентных и эфферентных импульсов, возможна их циркуляция по кольцевым связям, вследствие чего создается постоянный уровень возбуждения сетчатой структуры, благодаря которому обеспечиваются тонус и определенная степень готовности к деятельности различных отделов ЦНС.
Читайте также:
- Осложнения острого аппендицита. Послеоперационные осложнения аппендэктомии
- Герпетический панариций
- Акцидентальная инволюция тимуса. Этапы акцидентальной инволюции тимуса
- Хирургические заболевания печени. Нагноительные заболевания печени
- Туберкулез суставов. Синдром Кастелляни. Синдром Сьогрена.
| Reticular formation | |
|---|---|

Coronal section of the pons, at its upper part.[1] (Formatio reticularis labeled at left.) |
|

Traverse section of the medulla oblongata at about the middle of the olive. (Formatio reticularis grisea and formatio reticularis alba labeled at left.) |
|
| Details | |
| Location | Brainstem |
| Identifiers | |
| Latin | formatio reticularis |
| MeSH | D012154 |
| NeuroNames | 1223 |
| NeuroLex ID | nlx_143558 |
| TA98 | A14.1.00.021 A14.1.05.403 A14.1.06.327 |
| TA2 | 5367 |
| FMA | 77719 |
| Anatomical terms of neuroanatomy
[edit on Wikidata] |
The reticular formation is a set of interconnected nuclei that are located throughout the brainstem. It is not anatomically well defined, because it includes neurons located in different parts of the brain. The neurons of the reticular formation make up a complex set of networks in the core of the brainstem that extend from the upper part of the midbrain to the lower part of the medulla oblongata.[2] The reticular formation includes ascending pathways to the cortex in the ascending reticular activating system (ARAS) and descending pathways to the spinal cord via the reticulospinal tracts.[3][4][5][6]
Neurons of the reticular formation, particularly those of the ascending reticular activating system, play a crucial role in maintaining behavioral arousal and consciousness. The overall functions of the reticular formation are modulatory and premotor,[A]
involving somatic motor control, cardiovascular control, pain modulation, sleep and consciousness, and habituation.[7] The modulatory functions are primarily found in the rostral sector of the reticular formation and the premotor functions are localized in the neurons in more caudal regions.
The reticular formation is divided into three columns: raphe nuclei (median), gigantocellular reticular nuclei (medial zone), and parvocellular reticular nuclei (lateral zone). The raphe nuclei are the place of synthesis of the neurotransmitter serotonin, which plays an important role in mood regulation. The gigantocellular nuclei are involved in motor coordination. The parvocellular nuclei regulate exhalation.[8]
The reticular formation is essential for governing some of the basic functions of higher organisms and is one of the phylogenetically oldest portions of the brain.[citation needed]
Structure[edit]
A cross section of the lower part of the pons showing the pontine reticular formation labeled as #9
The human reticular formation is composed of almost 100 brain nuclei and contains many projections into the forebrain, brainstem, and cerebellum, among other regions.[3] It includes the reticular nuclei,[B]
reticulothalamic projection fibers, diffuse thalamocortical projections, ascending cholinergic projections, descending non-cholinergic projections, and descending reticulospinal projections.[4] The reticular formation also contains two major neural subsystems, the ascending reticular activating system and descending reticulospinal tracts, which mediate distinct cognitive and physiological processes.[3][4] It has been functionally cleaved both sagittally and coronally.
Traditionally the reticular nuclei are divided into three columns:
- In the median column – the raphe nuclei
- In the medial column – gigantocellular nuclei (because of larger size of the cells)
- In the lateral column – parvocellular nuclei (because of smaller size of the cells)
The original functional differentiation was a division of caudal and rostral. This was based upon the observation that the lesioning of the rostral reticular formation induces a hypersomnia in the cat brain. In contrast, lesioning of the more caudal portion of the reticular formation produces insomnia in cats. This study has led to the idea that the caudal portion inhibits the rostral portion of the reticular formation.
Sagittal division reveals more morphological distinctions. The raphe nuclei form a ridge in the middle of the reticular formation, and, directly to its periphery, there is a division called the medial reticular formation. The medial RF is large and has long ascending and descending fibers, and is surrounded by the lateral reticular formation. The lateral RF is close to the motor nuclei of the cranial nerves, and mostly mediates their function.
Medial and lateral reticular formation [edit]
The medial reticular formation and lateral reticular formation are two columns of nuclei with ill-defined boundaries that send projections through the medulla and into the midbrain. The nuclei can be differentiated by function, cell type, and projections of efferent or afferent nerves. Moving caudally from the rostral midbrain, at the site of the rostral pons and the midbrain, the medial RF becomes less prominent, and the lateral RF becomes more prominent.[citation needed]
Existing on the sides of the medial reticular formation is its lateral cousin, which is particularly pronounced in the rostral medulla and caudal pons. Out from this area spring the cranial nerves, including the very important vagus nerve.[clarification needed] The lateral RF is known for its ganglions and areas of interneurons around the cranial nerves, which serve to mediate their characteristic reflexes and functions.
Function[edit]
The reticular formation consists of more than 100 small neural networks, with varied functions including the following:
- Somatic motor control – Some motor neurons send their axons to the reticular formation nuclei, giving rise to the reticulospinal tracts of the spinal cord. These tracts function in maintaining tone, balance, and posture – especially during body movements. The reticular formation also relays eye and ear signals to the cerebellum so that the cerebellum can integrate visual, auditory, and vestibular stimuli in motor coordination. Other motor nuclei include gaze centers, which enable the eyes to track and fixate objects, and central pattern generators, which produce rhythmic signals of breathing and swallowing.
- Cardiovascular control – The reticular formation includes the cardiac and vasomotor centers of the medulla oblongata.
- Pain modulation – The reticular formation is one means by which pain signals from the lower body reach the cerebral cortex. It is also the origin of the descending analgesic pathways. The nerve fibers in these pathways act in the spinal cord to block the transmission of some pain signals to the brain.
- Sleep and consciousness – The reticular formation has projections to the thalamus and cerebral cortex that allow it to exert some control over which sensory signals reach the cerebrum and come to our conscious attention. It plays a central role in states of consciousness like alertness and sleep. Injury to the reticular formation can result in irreversible coma.
- Habituation – This is a process in which the brain learns to ignore repetitive, meaningless stimuli while remaining sensitive to others. A good example of this is a person who can sleep through loud traffic in a large city, but is awakened promptly due to the sound of an alarm or crying baby. Reticular formation nuclei that modulate activity of the cerebral cortex are part of the ascending reticular activating system.[9][7]
Major subsystems[edit]
Ascending reticular activating system[edit]
Ascending reticular activating system. Reticular formation labeled near center.
The ascending reticular activating system (ARAS), also known as the extrathalamic control modulatory system or simply the reticular activating system (RAS), is a set of connected nuclei in the brains of vertebrates that is responsible for regulating wakefulness and sleep-wake transitions. The ARAS is a part of the reticular formation and is mostly composed of various nuclei in the thalamus and a number of dopaminergic, noradrenergic, serotonergic, histaminergic, cholinergic, and glutamatergic brain nuclei.[3][10][11][12]
Structure of the ARAS[edit]
The ARAS is composed of several neural circuits connecting the dorsal part of the posterior midbrain and anterior pons to the cerebral cortex via distinct pathways that project through the thalamus and hypothalamus.[3][11][12] The ARAS is a collection of different nuclei – more than 20 on each side in the upper brainstem, the pons, medulla, and posterior hypothalamus. The neurotransmitters that these neurons release include dopamine, norepinephrine, serotonin, histamine, acetylcholine, and glutamate.[3][10][11][12] They exert cortical influence through direct axonal projections and indirect projections through thalamic relays.[11][12][13]
The thalamic pathway consists primarily of cholinergic neurons in the pontine tegmentum, whereas the hypothalamic pathway is composed primarily of neurons that release monoamine neurotransmitters, namely dopamine, norepinephrine, serotonin, and histamine.[3][10] The glutamate-releasing neurons in the ARAS were identified much more recently relative to the monoaminergic and cholinergic nuclei;[14] the glutamatergic component of the ARAS includes one nucleus in the hypothalamus and various brainstem nuclei.[11][14][15] The orexin neurons of the lateral hypothalamus innervate every component of the ascending reticular activating system and coordinate activity within the entire system.[12][16][17]
| Nucleus type | Corresponding nuclei that mediate arousal | Sources |
|---|---|---|
| Dopaminergic nuclei |
|
[3][10][11][12] |
| Noradrenergic nuclei |
|
[3][10][12] |
| Serotonergic nuclei |
|
[3][10][12] |
| Histaminergic nuclei |
|
[3][10][18] |
| Cholinergic nuclei |
|
[3][11][12][14] |
| Glutamatergic nuclei |
|
[11][12][14][15][18][19] |
| Thalamic nuclei |
|
[3][11][20] |
The ARAS consists of evolutionarily ancient areas of the brain, which are crucial to the animal’s survival and protected during adverse periods, such as during inhibitory periods of Totsellreflex, aka, «animal hypnosis».[C][22]
The ascending reticular activating system which sends neuromodulatory projections to the cortex — mainly connects to the prefrontal cortex.[23] There seems to be low connectivity to the motor areas of the cortex.[23]
Functions of the ARAS[edit]
Consciousness[edit]
The ascending reticular activating system is an important enabling factor for the state of consciousness.[13] The ascending system is seen to contribute to wakefulness as characterised by cortical and behavioural arousal.[6]
Regulating sleep-wake transitions[edit]
The main function of the ARAS is to modify and potentiate thalamic and cortical function such that electroencephalogram (EEG) desynchronization ensues.[D][25][26] There are distinct differences in the brain’s electrical activity during periods of wakefulness and sleep: Low voltage fast burst brain waves (EEG desynchronization) are associated with wakefulness and REM sleep (which are electrophysiologically similar); high voltage slow waves are found during non-REM sleep. Generally speaking, when thalamic relay neurons are in burst mode the EEG is synchronized and when they are in tonic mode it is desynchronized.[26] Stimulation of the ARAS produces EEG desynchronization by suppressing slow cortical waves (0.3–1 Hz), delta waves (1–4 Hz), and spindle wave oscillations (11–14 Hz) and by promoting gamma band (20–40 Hz) oscillations.[16]
The physiological change from a state of deep sleep to wakefulness is reversible and mediated by the ARAS.[27] The ventrolateral preoptic nucleus (VLPO) of the hypothalamus inhibits the neural circuits responsible for the awake state, and VLPO activation contributes to the sleep onset.[28] During sleep, neurons in the ARAS will have a much lower firing rate; conversely, they will have a higher activity level during the waking state.[29] In order that the brain may sleep, there must be a reduction in ascending afferent activity reaching the cortex by suppression of the ARAS.[27]
Attention[edit]
The ARAS also helps mediate transitions from relaxed wakefulness to periods of high attention.[20] There is increased regional blood flow (presumably indicating an increased measure of neuronal activity) in the midbrain reticular formation (MRF) and thalamic intralaminar nuclei during tasks requiring increased alertness and attention.
Clinical significance of the ARAS[edit]
Mass lesions in brainstem ARAS nuclei can cause severe alterations in level of consciousness (e.g., coma).[30] Bilateral damage to the reticular formation of the midbrain may lead to coma or death.[31]
Direct electrical stimulation of the ARAS produces pain responses in cats and elicits verbal reports of pain in humans.[citation needed] Ascending reticular activation in cats can produce mydriasis,[32] which can result from prolonged pain. These results suggest some relationship between ARAS circuits and physiological pain pathways.[32]
Pathologies[edit]
Some pathologies of the ARAS may be attributed to age, as there appears to be a general decline in reactivity of the ARAS with advancing years.[33] Changes in electrical coupling[E] have been suggested to account for some changes in ARAS activity: if coupling were down-regulated, there would be a corresponding decrease in higher-frequency synchronization (gamma band). Conversely, up-regulated electrical coupling would increase synchronization of fast rhythms that could lead to increased arousal and REM sleep drive.[35] Specifically, disruption of the ARAS has been implicated in the following disorders:
- Narcolepsy: Lesions along the pedunculopontine (PPT/PPN) / laterodorsal tegmental (LDT) nuclei are associated with narcolepsy.[36] There is a significant down-regulation of PPN output and a loss of orexin peptides, promoting the excessive daytime sleepiness that is characteristic of this disorder.[16]
- Progressive supranuclear palsy (PSP) : Dysfunction of nitrous oxide signaling has been implicated in the development of PSP.[37]
- Parkinson’s disease: REM sleep disturbances are common in Parkinson’s. It is mainly a dopaminergic disease, but cholinergic nuclei are depleted as well. Degeneration in the ARAS begins early in the disease process.[36]
Developmental influences[edit]
There are several potential factors that may adversely influence the development of the ascending reticular activating system:
- Preterm birth:[38] Regardless of birth weight or weeks of gestation, premature birth induces persistent deleterious effects on pre-attentional (arousal and sleep-wake abnormalities), attentional (reaction time and sensory gating), and cortical mechanisms throughout development.
- Smoking during pregnancy:[39] Prenatal exposure to cigarette smoke is known to produce lasting arousal, attentional and cognitive deficits in humans. This exposure can induce up-regulation of α4β2 nicotinic receptors on cells of the pedunculopontine nucleus (PPN), resulting in increased tonic activity, resting membrane potential, and hyperpolarization-activated cation current. These major disturbances of the intrinsic membrane properties of PPN neurons result in increased levels of arousal and sensory gating, deficits (demonstrated by a diminished amount of habituation to repeated auditory stimuli). It is hypothesized that these physiological changes may intensify attentional dysregulation later in life.
Descending reticulospinal tracts[edit]
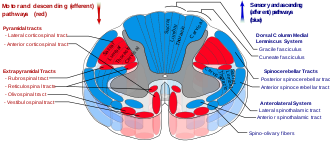
Spinal cord tracts — reticulospinal tract labeled in red, near-center at left in figure
The reticulospinal tracts, also known as the descending or anterior reticulospinal tracts, are extrapyramidal motor tracts that descend from the reticular formation[40] in two tracts to act on the motor neurons supplying the trunk and proximal limb flexors and extensors. The reticulospinal tracts are involved mainly in locomotion and postural control, although they do have other functions as well.[41] The descending reticulospinal tracts are one of four major cortical pathways to the spinal cord for musculoskeletal activity. The reticulospinal tracts works with the other three pathways to give a coordinated control of movement, including delicate manipulations.[40] The four pathways can be grouped into two main system pathways – a medial system and a lateral system. The medial system includes the reticulospinal pathway and the vestibulospinal pathway, and this system provides control of posture. The corticospinal and the rubrospinal tract pathways belong to the lateral system which provides fine control of movement.[40]
Medial and lateral tracts[edit]
This descending tract is divided into two parts, the medial (or pontine) and lateral (or medullary) reticulospinal tracts (MRST and LRST).
- The medial reticulospinal tract is responsible for exciting anti-gravity, extensor muscles. The fibers of this tract arise from the caudal pontine reticular nucleus and the oral pontine reticular nucleus and project to lamina VII and lamina VIII of the spinal cord.
- The lateral reticulospinal tract is responsible for inhibiting excitatory axial extensor muscles of movement. It is also responsible for automatic breathing. The fibers of this tract arise from the medullary reticular formation, mostly from the gigantocellular nucleus, and descend the length of the spinal cord in the anterior part of the lateral column. The tract terminates in lamina VII mostly with some fibers terminating in lamina IX of the spinal cord.
The ascending sensory tract conveying information in the opposite direction is known as the spinoreticular tract.
Functions of the reticulospinal tracts[edit]
- Integrates information from the motor systems to coordinate automatic movements of locomotion and posture
- Facilitates and inhibits voluntary movement; influences muscle tone
- Mediates autonomic functions
- Modulates pain impulses
- Influences blood flow to lateral geniculate nucleus of the thalamus.[42]
Clinical significance of the reticulospinal tracts[edit]
The reticulospinal tracts provide a pathway by which the hypothalamus can control sympathetic thoracolumbar outflow and parasympathetic sacral outflow.[citation needed]
Two major descending systems carrying signals from the brainstem and cerebellum to the spinal cord can trigger automatic postural response for balance and orientation: vestibulospinal tracts from the vestibular nuclei and reticulospinal tracts from the pons and medulla. Lesions of these tracts result in profound ataxia and postural instability.[43]
Physical or vascular damage to the brainstem disconnecting the red nucleus (midbrain) and the vestibular nuclei (pons) may cause decerebrate rigidity, which has the neurological sign of increased muscle tone and hyperactive stretch reflexes. Responding to a startling or painful stimulus, both arms and legs extend and turn internally. The cause is the tonic activity of lateral vestibulospinal and reticulospinal tracts stimulating extensor motoneurons without the inhibitions from rubrospinal tract.[44]
Brainstem damage above the red nucleus level may cause decorticate rigidity. Responding to a startling or painful stimulus, the arms flex and the legs extend. The cause is the red nucleus, via the rubrospinal tract, counteracting the extensor motorneuron’s excitation from the lateral vestibulospinal and reticulospinal tracts. Because the rubrospinal tract only extends to the cervical spinal cord, it mostly acts on the arms by exciting the flexor muscles and inhibiting the extensors, rather than the legs.[44]
Damage to the medulla below the vestibular nuclei may cause flaccid paralysis, hypotonia, loss of respiratory drive, and quadriplegia. There are no reflexes resembling early stages of spinal shock because of complete loss of activity in the motorneurons, as there is no longer any tonic activity arising from the lateral vestibulospinal and reticulospinal tracts.[44]
History[edit]
The term «reticular formation» was coined in the late 19th century by Otto Deiters, coinciding with Ramon y Cajal’s neuron doctrine. Allan Hobson states in his book The Reticular Formation Revisited that the name is an etymological vestige from the fallen era of the aggregate field theory in the neural sciences. The term «reticulum» means «netlike structure», which is what the reticular formation resembles at first glance. It has been described as being either too complex to study or an undifferentiated part of the brain with no organization at all. Eric Kandel describes the reticular formation as being organized in a similar manner to the intermediate gray matter of the spinal cord. This chaotic, loose, and intricate form of organization is what has turned off many researchers from looking farther into this particular area of the brain.[citation needed] The cells lack clear ganglionic boundaries, but do have clear functional organization and distinct cell types. The term «reticular formation» is seldom used anymore except to speak in generalities. Modern scientists usually refer to the individual nuclei that compose the reticular formation.[citation needed]
Moruzzi and Magoun first investigated the neural components regulating the brain’s sleep-wake mechanisms in 1949. Physiologists had proposed that some structure deep within the brain controlled mental wakefulness and alertness.[25] It had been thought that wakefulness depended only on the direct reception of afferent (sensory) stimuli at the cerebral cortex.
As direct electrical stimulation of the brain could simulate electrocortical relays, Magoun used this principle to demonstrate, on two separate areas of the brainstem of a cat, how to produce wakefulness from sleep. He first stimulated the ascending somatic and auditory paths; second, a series of «ascending relays from the reticular formation of the lower brain stem through the midbrain tegmentum, subthalamus and hypothalamus to the internal capsule.»[45] The latter was of particular interest, as this series of relays did not correspond to any known anatomical pathways for the wakefulness signal transduction and was coined the ascending reticular activating system (ARAS).
Next, the significance of this newly identified relay system was evaluated by placing lesions in the medial and lateral portions of the front of the midbrain. Cats with mesencephalic interruptions to the ARAS entered into a deep sleep and displayed corresponding brain waves. In alternative fashion, cats with similarly placed interruptions to ascending auditory and somatic pathways exhibited normal sleeping and wakefulness, and could be awakened with physical stimuli. Because these external stimuli would be blocked on their way to the cortex by the interruptions, this indicated that the ascending transmission must travel through the newly discovered ARAS.
Finally, Magoun recorded potentials within the medial portion of the brain stem and discovered that auditory stimuli directly fired portions of the reticular activating system. Furthermore, single-shock stimulation of the sciatic nerve also activated the medial reticular formation, hypothalamus, and thalamus. Excitation of the ARAS did not depend on further signal propagation through the cerebellar circuits, as the same results were obtained following decerebellation and decortication. The researchers proposed that a column of cells surrounding the midbrain reticular formation received input from all the ascending tracts of the brain stem and relayed these afferents to the cortex and therefore regulated wakefulness.[45][27]
See also[edit]
- Locus coeruleus
- Pedunculopontine nucleus
- Medial pontine reticular formation
- Midbrain reticular formation
Footnotes[edit]
- ^ premotor function as in integrating feedback sensory signals with commands from upper motor neurons and deep cerebellar nuclei, and organizing the efferent activities of lower visceral motor and some somatic motor neurons in the brainstem and spinal cord.[2]
- ^ reticular nuclei including structures in the medulla, pons, and midbrain,[4]
- ^ Animal hypnosis is a state in nonhuman animals in which there is no motor response. The state may occur because of stroking, salient stimuli, or physical restraint. The name comes from its claimed resemblance to human hypnosis and trance.[21]
- ^ An EEG’s electrode on the scalp measures the activity of a very large number of pyramidal neurons in the underlying brain region. Each neuron generates a small electrical field that changes over time. In the sleep state, the neurons activate at approximately the same time, and the EEG wave, representing the summation of the neurons’ electrical fields, tend to be in phase and has higher amplitude, and hence it is «synchronized.» In the waking state, they don’t activate at the same time because of irregular or out-of-phase inputs, the EEG wave, representing the algebraic sum, will have a smaller amplitude, and hence «dysynchronized.»[24]
- ^ Electrical coupling is the passive flow of electric current from one cell into an adjacent cell through gap junctions, such as the cells in the heart muscle or the neurons with electrical synapses. Electrically coupled cells fire synchronously because generated currents in one cell rapidly spread to the other cells.[34]
References[edit]
- ^ Gray, Henry. «Fig. 701: Henry Gray (1825–1861). Anatomy of the Human Body. 1918». Bartleby.com. Archived from the original on 2018-04-21. Retrieved 2019-09-12.
- ^ a b Purves, Dale (2011). Neuroscience (5. ed.). Sunderland, Mass.: Sinauer. pp. 390–395. ISBN 978-0878936953.
- ^ a b c d e f g h i j k l m Iwańczuk W, Guźniczak P (2015). «Neurophysiological foundations of sleep, arousal, awareness and consciousness phenomena. Part 1». Anaesthesiol Intensive Ther. 47 (2): 162–167. doi:10.5603/AIT.2015.0015. PMID 25940332.
The ascending reticular activating system (ARAS) is responsible for a sustained wakefulness state. It receives information from sensory receptors of various modalities, transmitted through spinoreticular pathways and cranial nerves (trigeminal nerve – polymodal pathways, olfactory nerve, optic nerve and vestibulocochlear nerve – monomodal pathways). These pathways reach the thalamus directly or indirectly via the medial column of reticular formation nuclei (magnocellular nuclei and reticular nuclei of pontine tegmentum). The reticular activating system begins in the dorsal part of the posterior midbrain and anterior pons, continues into the diencephalon, and then divides into two parts reaching the thalamus and hypothalamus, which then project into the cerebral cortex (Fig. 1). The thalamic projection is dominated by cholinergic neurons originating from the pedunculopontine tegmental nucleus of pons and midbrain (PPT) and laterodorsal tegmental nucleus of pons and midbrain (LDT) nuclei [17, 18]. The hypothalamic projection involves noradrenergic neurons of the locus coeruleus (LC) and serotoninergic neurons of the dorsal and median raphe nuclei (DR), which pass through the lateral hypothalamus and reach axons of the histaminergic tubero-mamillary nucleus (TMN), together forming a pathway extending into the forebrain, cortex and hippocampus. Cortical arousal also takes advantage of dopaminergic neurons of the substantia nigra (SN), ventral tegmenti area (VTA) and the periaqueductal grey area (PAG). Fewer cholinergic neurons of the pons and midbrain send projections to the forebrain along the ventral pathway, bypassing the thalamus [19, 20].
- ^ a b c d Augustine JR (2016). «Chapter 9: The Reticular Formation». Human Neuroanatomy (2nd ed.). John Wiley & Sons. pp. 141–153. ISBN 978-1119073994. Archived from the original on 4 May 2018. Retrieved 4 September 2017.
- ^ «the definition of reticular activating system». Dictionary.com. Archived from the original on 2017-02-05.
- ^ a b Jones, BE (2008). «Modulation of cortical activation and behavioral arousal by cholinergic and orexinergic systems». Annals of the New York Academy of Sciences. 1129 (1): 26–34. Bibcode:2008NYASA1129…26J. doi:10.1196/annals.1417.026. PMID 18591466. S2CID 16682827.
- ^ a b Saladin, KS (2018). «Chapter 14 – The Brain and Cranial Nerves». Anatomy and Physiology: The Unity of Form and Function (8th ed.). New York: McGraw-Hill. The Reticular Formation, pp. 518–519. ISBN 978-1259277726.
- ^ «The Brain From Top To Bottom». Thebrain.mcgill.ca. Archived from the original on 2016-04-23. Retrieved 2016-04-28.
- ^ «Anatomy of the Brain – Reticular Formation». Biology.about.com. 2015-07-07. Archived from the original on 2003-04-14. Retrieved 2016-04-28.
- ^ a b c d e f g Malenka RC, Nestler EJ, Hyman SE (2009). «Chapter 12: Sleep and Arousal». In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 295. ISBN 978-0071481274.
The RAS is a complex structure consisting of several different circuits including the four monoaminergic pathways … The norepinephrine pathway originates from the locus ceruleus (LC) and related brainstem nuclei; the serotonergic neurons originate from the raphe nuclei within the brainstem as well; the dopaminergic neurons originate in ventral tegmental area (VTA); and the histaminergic pathway originates from neurons in the tuberomammillary nucleus (TMN) of the posterior hypothalamus. As discussed in Chapter 6, these neurons project widely throughout the brain from restricted collections of cell bodies. Norepinephrine, serotonin, dopamine, and histamine have complex modulatory functions and, in general, promote wakefulness. The PT in the brain stem is also an important component of the ARAS. Activity of PT cholinergic neurons (REM-on cells) promotes REM sleep. During waking, REM-on cells are inhibited by a subset of ARAS norepinephrine and serotonin neurons called REM-off cells.
- ^ a b c d e f g h i Brudzynski SM (July 2014). «The ascending mesolimbic cholinergic system – a specific division of the reticular activating system involved in the initiation of negative emotional states». Journal of Molecular Neuroscience. 53 (3): 436–445. doi:10.1007/s12031-013-0179-1. PMID 24272957. S2CID 14615039.
Understanding of arousing and wakefulness-maintaining functions of the ARAS has been further complicated by neurochemical discoveries of numerous groups of neurons with the ascending pathways originating within the brainstem reticular core, including pontomesencephalic nuclei, which synthesize different transmitters and release them in vast areas of the brain and in the entire neocortex (for review, see Jones 2003; Lin et al. 2011). They included glutamatergic, cholinergic, noradrenergic, dopaminergic, serotonergic, histaminergic, and orexinergic systems (for review, see Lin et al. 2011). … The ARAS represented diffuse, nonspecific pathways that, working through the midline and intralaminar thalamic nuclei, could change activity of the entire neocortex, and thus, this system was suggested initially as a general arousal system to natural stimuli and the critical system underlying wakefulness (Moruzzi and Magoun 1949; Lindsley et al. 1949; Starzl et al. 1951, see stippled area in Fig. 1). … It was found in a recent study in the rat that the state of wakefulness is mostly maintained by the ascending glutamatergic projection from the parabrachial nucleus and precoeruleus regions to the basal forebrain and then relayed to the cerebral cortex (Fuller et al. 2011). … Anatomical studies have shown two main pathways involved in arousal and originating from the areas with cholinergic cell groups, one through the thalamus and the other, traveling ventrally through the hypothalamus and preoptic area, and reciprocally connected with the limbic system (Nauta and Kuypers 1958; Siegel 2004). … As counted in the cholinergic connections to the thalamic reticular nucleus …
- ^ a b c d e f g h i j Schwartz MD, Kilduff TS (December 2015). «The Neurobiology of Sleep and Wakefulness». The Psychiatric Clinics of North America. 38 (4): 615–644. doi:10.1016/j.psc.2015.07.002. PMC 4660253. PMID 26600100.
This ascending reticular activating system (ARAS) is comprised of cholinergic laterodorsal and pedunculopontine tegmentum (LDT/PPT), noradrenergic locus coeruleus (LC), serotonergic (5-HT) Raphe nuclei and dopaminergic ventral tegmental area (VTA), substantia nigra (SN) and periaqueductal gray projections that stimulate the cortex directly and indirectly via the thalamus, hypothalamus and BF.6, 12-18 These aminergic and catecholaminergic populations have numerous interconnections and parallel projections which likely impart functional redundancy and resilience to the system.6, 13, 19 … More recently, the medullary parafacial zone (PZ) adjacent to the facial nerve was identified as a sleep-promoting center on the basis of anatomical, electrophysiological and chemo- and optogenetic studies.23, 24 GABAergic PZ neurons inhibit glutamatergic parabrachial (PB) neurons that project to the BF,25 thereby promoting NREM sleep at the expense of wakefulness and REM sleep. … The Hcrt neurons project widely throughout the brain and spinal cord92, 96, 99, 100 including major projections to wake-promoting cell groups such as the HA cells of the TM,101 the 5-HT cells of the dorsal Raphe nuclei (DRN),101 the noradrenergic cells of the LC,102 and cholinergic cells in the LDT, PPT, and BF.101, 103 … Hcrt directly excites cellular systems involved in waking and arousal including the LC,102, 106, 107 DRN,108, 109 TM,110-112 LDT,113, 114 cholinergic BF,115 and both dopamine (DA) and non-DA neurons in the VTA.116, 117
- ^ a b Squire L (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. p. 1095. ISBN 978-0123858702.
- ^ a b c d Saper CB, Fuller PM (June 2017). «Wake-sleep circuitry: an overview». Current Opinion in Neurobiology. 44: 186–192. doi:10.1016/j.conb.2017.03.021. PMC 5531075. PMID 28577468.
Parabrachial and pedunculopontine glutamatergic arousal system
Retrograde tracers from the BF have consistently identified one brainstem site of input that is not part of the classical monoaminergic ascending arousal system: glutamatergic neurons in the parabrachial and pedunculopontine nucleus … Juxtacellular recordings from pedunculopontine neurons have found that nearly all cholinergic neurons in this region, as well as many glutamatergic and GABAergic neurons, are most active during wake and REM sleep [25], although some of the latter neurons were maximally active during either wake or REM, but not both. … [Parabrachial and pedunculopontine glutamatergic neurons] provide heavy innervation to the lateral hypothalamus, central nucleus of the amygdala, and BF - ^ a b Pedersen NP, Ferrari L, Venner A, Wang JL, Abbott SG, Vujovic N, Arrigoni E, Saper CB, Fuller PM (November 2017). «Supramammillary glutamate neurons are a key node of the arousal system». Nature Communications. 8 (1): 1405. Bibcode:2017NatCo…8.1405P. doi:10.1038/s41467-017-01004-6. PMC 5680228. PMID 29123082.
Basic and clinical observations suggest that the caudal hypothalamus comprises a key node of the ascending arousal system, but the cell types underlying this are not fully understood. Here we report that glutamate-releasing neurons of the supramammillary region (SuMvglut2) produce sustained behavioral and EEG arousal when chemogenetically activated.
- ^ a b c Burlet S, Tyler CJ, Leonard CS (April 2002). «Direct and indirect excitation of laterodorsal tegmental neurons by Hypocretin/Orexin peptides: implications for wakefulness and narcolepsy». J. Neurosci. 22 (7): 2862–2872. doi:10.1523/JNEUROSCI.22-07-02862.2002. PMC 6758338. PMID 11923451.
- ^ Malenka RC, Nestler EJ, Hyman SE (2009). «Chapter 12: Sleep and Arousal». In Sydor A, Brown RY (eds.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 295. ISBN 978-0071481274.
Orexin neurons are located in the lateral hypothalamus. They are organized in a widely projecting manner, much like the monoamines (Chapter 6), and innervate all of the components of the ARAS. They excite the REM-off monoaminergic neurons during wakefulness and the PT cholinergic neurons during REM sleep. They are inhibited by the VLPO neurons during NREM sleep.
- ^ a b Cherasse Y, Urade Y (November 2017). «Dietary Zinc Acts as a Sleep Modulator». International Journal of Molecular Sciences. 18 (11): 2334. doi:10.3390/ijms18112334. PMC 5713303. PMID 29113075.
The regulation of sleep and wakefulness involves many regions and cellular subtypes in the brain. Indeed, the ascending arousal system promotes wakefulness through a network composed of the monaminergic neurons in the locus coeruleus (LC), histaminergic neurons in the tuberomammilary nucleus (TMN), glutamatergic neurons in the parabrachial nucleus (PB) …
- ^ Fuller PM, Fuller P, Sherman D, Pedersen NP, Saper CB, Lu J (April 2011). «Reassessment of the structural basis of the ascending arousal system». The Journal of Comparative Neurology. 519 (5): 933–956. doi:10.1002/cne.22559. PMC 3119596. PMID 21280045.
- ^ a b Kinomura S, Larsson J, Gulyás B, Roland PE (January 1996). «Activation by attention of the human reticular formation and thalamic intralaminar nuclei». Science. 271 (5248): 512–515. Bibcode:1996Sci…271..512K. doi:10.1126/science.271.5248.512. PMID 8560267. S2CID 43015539.
This corresponds to the centro-median and centralis lateralis nuclei of the intralaminar group
- ^ VandenBos, Gary R, ed. (2015). animal hypnosis. APA dictionary of psychology (2nd ed.). Washington, DC: American Psychological Association. p. 57. doi:10.1037/14646-000. ISBN 978-1433819445.
a state of motor nonresponsiveness in nonhuman animals, produced by stroking, salient stimuli, or physical restraint. It is called «hypnosis» because of a claimed resemblance to human hypnosis and trance
- ^ Svorad D (January 1957). «Reticular activating system of brain stem and animal hypnosis». Science. 125 (3239): 156. Bibcode:1957Sci…125..156S. doi:10.1126/science.125.3239.156. PMID 13390978.
- ^ a b Jang SH, Kwon HG (October 2015). «The direct pathway from the brainstem reticular formation to the cerebral cortex in the ascending reticular activating system: A diffusion tensor imaging study». Neurosci. Lett. 606: 200–203. doi:10.1016/j.neulet.2015.09.004. PMID 26363340. S2CID 37083435.
- ^ Purves et al (2018b), Box 28A – Electroencephalography, pp. 647–649
- ^ a b Steriade, M. (1996). «Arousal: Revisiting the reticular activating system». Science. 272 (5259): 225–226. Bibcode:1996Sci…272..225S. doi:10.1126/science.272.5259.225. PMID 8602506. S2CID 39331177.
- ^ a b Reiner, P. B. (1995). «Are mesopontine cholinergic neurons either necessary or sufficient components of the ascending reticular activating system?». Seminars in Neuroscience. 7 (5): 355–359. doi:10.1006/smns.1995.0038. S2CID 5575547.
- ^ a b c Evans, B.M. (2003). «Sleep, consciousness and the spontaneous and evoked electrical activity of the brain. Is there a cortical integrating mechanism?». Neurophysiologie Clinique. 33 (1): 1–10. doi:10.1016/s0987-7053(03)00002-9. PMID 12711127. S2CID 26159370.
- ^ Purves et al (2018b), The Neural Circuits Governing Sleep, pp. 655–656
- ^ Mohan Kumar V, Mallick BN, Chhina GS, Singh B (October 1984). «Influence of ascending reticular activating system on preoptic neuronal activity». Exp. Neurol. 86 (1): 40–52. doi:10.1016/0014-4886(84)90065-7. PMID 6479280. S2CID 28688574.
- ^ Tindall SC (1990). «Chapter 57: Level of Consciousness». In Walker HK, Hall WD, Hurst JW (eds.). Clinical Methods: The History, Physical, and Laboratory Examinations. Butterworth Publishers. ISBN 978-0409900774. Archived from the original on 2009-01-29. Retrieved 2008-07-04.
- ^ Nolte, J (ed.). «chpt 11». The Human Brain: An Introduction to its Functional Anatomy (5th ed.). pp. 262–290.
- ^ a b Ruth RE, Rosenfeld JP (October 1977). «Tonic reticular activating system: relationship to aversive brain stimulation effects». Exp. Neurol. 57 (1): 41–56. doi:10.1016/0014-4886(77)90043-7. PMID 196879. S2CID 45019057.
- ^ Robinson, D. (1999). «The technical, neurological and psychological significance of ‘alpha’, ‘delta’ and ‘theta’ waves confounded in EEG evoked potentials: a study of peak latencies». Clinical Neurophysiology. 110 (8): 1427–1434. doi:10.1016/S1388-2457(99)00078-4. PMID 10454278. S2CID 38882496.
- ^ Lawrence, Eleanor, ed. (2005). electrical coupling. Henderson’s dictionary of biology (13th ed.). Pearson Education Limited. pp. 195. ISBN 978-0131273849.
- ^ Garcia-Rill E, Heister DS, Ye M, Charlesworth A, Hayar A (2007). «Electrical coupling: novel mechanism for sleep-wake control». Sleep. 30 (11): 1405–1414. doi:10.1093/sleep/30.11.1405. PMC 2082101. PMID 18041475.
- ^ a b Schwartz JR, Roth T (December 2008). «Neurophysiology of sleep and wakefulness: basic science and clinical implications». Curr Neuropharmacol. 6 (4): 367–378. doi:10.2174/157015908787386050. PMC 2701283. PMID 19587857.
- ^ Vincent, S. R. (2000). «The ascending reticular activating system — from aminergic neurons to nitric oxide». Journal of Chemical Neuroanatomy. 18 (1–2): 23–30. doi:10.1016/S0891-0618(99)00048-4. PMID 10708916. S2CID 36236217.
- ^ Hall RW, Huitt TW, Thapa R, Williams DK, Anand KJ, Garcia-Rill E (June 2008). «Long-term deficits of preterm birth: evidence for arousal and attentional disturbances». Clin Neurophysiol. 119 (6): 1281–1291. doi:10.1016/j.clinph.2007.12.021. PMC 2670248. PMID 18372212.
- ^ Garcia-Rill E, Buchanan R, McKeon K, Skinner RD, Wallace T (September 2007). «Smoking during pregnancy: postnatal effects on arousal and attentional brain systems». Neurotoxicology. 28 (5): 915–923. doi:10.1016/j.neuro.2007.01.007. PMC 3320145. PMID 17368773.
- ^ a b c Squire L (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 631–632. ISBN 978-0123858702.
- ^ FitzGerald MT, Gruener G, Mtui E (2012). Clinical Neuroanatomy and Neuroscience. Philadelphia: Saunders Elsevier. p. 192. ISBN 978-0702037382.
- ^ Brownstone, Robert M.; Chopek, Jeremy W. (2018). «Reticulospinal Systems for Tuning Motor Commands». Frontiers in Neural Circuits. 12: 30. doi:10.3389/fncir.2018.00030. ISSN 1662-5110. PMC 5915564. PMID 29720934.
- ^ Pearson, Keir G; Gordon, James E (2013). «Chapter 41 / Posture». In Kandel, Eric R; Schwartz, James H; Jessell, Thomas M; Siegelbaum, Steven A; Hudspeth, AJ (eds.). Principles of Neural Science (5th ed.). United States: McGraw-Hill. The Brain Stem and Cerebellum Integrate Sensory Signals for Posture, p. 954. ISBN 978-0071390118.
- ^ a b c Michael-Titus et al (2010b), Box 9.5 Decorticate and decrebrate regidity, p. 172
- ^ a b Magoun HW (February 1952). «An ascending reticular activating system in the brain stem». AMA Arch Neurol Psychiatry. 67 (2): 145–154, discussion 167–171. doi:10.1001/archneurpsyc.1952.02320140013002. PMID 14893989.
Other references[edit]
- Systems of The Body (2010)
- Michael-Titus, Adina T; Revest, Patricia; Shortland, Peter, eds. (2010a). «Chapter 6 – Cranial Nerves and the Brainstem». Systems of The Body: The Nervous System – Basic Science and Clinical Conditions (2nd ed.). Churchill Livingstone. ISBN 978-0702033735.
- Michael-Titus, Adina T; Revest, Patricia; Shortland, Peter, eds. (2010b). «Chapter 9 – Descending Pathways and Cerebellum». Systems of The Body: The Nervous System – Basic Science and Clinical Conditions (2nd ed.). Churchill Livingstone. ISBN 978-0702033735.
- Neuroscience (2018)
- Purves, Dale; Augustine, George J; Fitzpatrick, David; Hall, William C; Lamantia, Anthony Samuel; Mooney, Richard D; Platt, Michael L; White, Leonard E, eds. (2018b). «Chapter 28 – Cortical State». Neuroscience (6th ed.). Sinauer Associates. ISBN 978-1605353807.
- Anatomy and Physiology (2018)
- Saladin, KS (2018a). «Chapter 13 – The Spinal Chord, Spinal Nerves, and Somatic Reflexes». Anatomy and Physiology: The Unity of Form and Function (8th ed.). New York: McGraw-Hill. ISBN 978-1259277726.
- Saladin, KS (2018b). «Chapter 14 – The Brain and Cranial Nerves». Anatomy and Physiology: The Unity of Form and Function (8th ed.). New York: McGraw-Hill. The Reticular Formation, pp. 518–519. ISBN 978-1259277726.
External links[edit]
The dictionary definition of reticular formation at Wiktionary
Reticular Formation
Anja K.E. Horn, Christopher Adamczyk, in The Human Nervous System (Third Edition), 2012
Introduction
The human brainstem reticular formation was first recognized as a cytoarchitectonic entity by August Forel (Forel, 1877). The word “reticular” is derived from the Latin word rete, meaning net, and refers to its characteristically diffuse structure, a network of loosely packed multipolar neurons, embedded in a dense neuropile. The reticular formation has no distinct cytoarchitectural boundaries, and forms the central core of the brainstem, in which other brainstem nuclei with clearly outlined cytoarchitectural boundaries, are embedded, e.g. the red nucleus (RPC) or nucleus reticularis tegmenti pontis (RtTg). It stretches throughout the length of the brainstem, from the mesencephalon through the pons to the medulla oblongata (Figure 9.1). In the spinal cord the intermediate zone, i.e. Rexed’s lamina V–VIII, is recognized through its cytoarchitecture as the continuation of the reticular formation into the spinal cord (see Chapter 7). There are subtle regional differences in the brainstem reticular formation cytoarchitecture, which led Jerzy Olszewski and his colleagues to subdivide it into nuclei (Olszewski and Baxter, 1982). These subdivisions have become the accepted classical standard, although the generally accepted nomenclature has evolved to include the word reticular, which Olszewski rigorously avoided. For example, Olszewski used the term “nucleus centralis pontis caudalis”; but presently, mostly due to the work of Brodal (Brodal, 1957) and Taber (Taber, 1961), the same area is now usually referred to as nucleus reticularis pontis caudalis (PnC). The typical wide dendritic fields of the multipolar reticular cells collect afferent signals from multiple sources (Scheibel and Scheibel, 1958) and funnel them onto nearby output structures, such as the trigeminal, facial, or oculomotor nuclei, or via descending pathways to motoneurons in the spinal cord.
FIGURE 9.1. A sagittal view of the human brainstem showing the location of the reticular formation (shaded area) and several structures essential for the control of eye movements and gaze. The dashed lines indicate the levels of the transverse sections shown in Figures 9.3 and 9.4. The stars indicate the location of the cell groups of the paramedian tract (section I). 3, oculomotor nucleus; 4, trochlear nucleus; 6, abducens nucleus; 6n, abducens nerve; 12, hypoglossal nucleus; CeCa, central caudal nucleus; fr, fasciculus retroflexus; InC, interstitial nucleus of Cajal; IO, inferior olive; mlf, medial longitudinal fasciculus; MB, mammillary body; mt, mammillo-thalamic tract; pc, posterior commissure; PPRF, paramedian pontine reticular formation; Pr, prepositus hypoglossal nucleus; R, red nucleus; RI, rostral interstitial nucleus of the medial longitudinal fasciculus; RtTg, reticulotegmental nucleus of the pons; SC, superior colliculus.
Over recent years much progress has been made in the identification and characterization of functional cell groups within the reticular formation and their connectivity, either by single cell recording in behaving animals, or with immunohistochemical and tract tracing techniques for review (Nieuwenhuys et al., 2008). Localized reticular cell groups, without any obvious cytoarchitectonic features, have been found to have highly specific functions and connections, and, therefore, in no way conform to the old idea that the reticular formation is part of a “diffuse arousal network” (Moruzzi and Magoun, 1949). Presently this concept has been replaced by the demonstration of highly localized functions within the reticular formation: while the role in arousal can be attributed to compact brainstem nuclei such as locus coeruleus (LC) (see Chapter XX) or pedunculopontine tegmental nucleus (PPTg) (see Chapter 14), whose cells have enormous dendritic fields extending up to, and including, the cerebral cortex (Steckler et al., 1994; Jenkinson et al., 2009). In parallel to these experimental studies attempts have been made to identify the homologous cell groups in humans not only by their location and cytoarchitecture, but also by their histochemical properties, e.g. cytochrome-oxidase activity, acetylcholine esterase activity, expression of calcium-binding proteins, such as parvalbumin (Paxinos et al., 1990; Paxinos and Huang, 1995; Horn et al., 1996).
The reticular formation of the pons and medulla can be divided into three longitudinal zones, a median zone around the midline with the raphe nuclei, a medial magnocellular zone with the medial tegmental field, and a lateral parvocellular zone with the lateral tegmental field for review (Nieuwenhuys et al., 2008). The lateral tegmental field contains smaller cells which are interneurons, or premotor neurons, for the trigeminal, facial, vagal, and hypoglossal motor nuclei. In addition it houses the premotor neurons with long descending axons to motor neurons of the spinal cord involved in respiration, abdominal pressure, micturition, and blood pressure (Holstege, 1991; Holstege and Mouton, 2003; see Chapter 29). The medial tegmental field contains the premotor circuitry for eye and head movements; and gives rise to descending pathways involved in postural orientation. These pathways are separate and distinct from the serotonergic raphe nuclei (see Chapter 11), which have widespread connections to the spinal gray matter and modulate, or set, the firing level of the sensory or motor spinal circuits (for review: Holstege, 1991). A systematic description of the nuclei from caudal to rostral including an atlas is given in Chapter 8. The brainstem nuclei involved in the generation of eye and head movements, blinks, gaze-holding, or postural orientation lie mostly in the medial tegmental field, and their functional neuroanatomy is the subject of this chapter.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123742360100094
Auricular acupuncture mechanisms
In Auricular Acupuncture & Addiction, 2009
The reticular formation
The reticular formation is involved in a multitude of physiological functions and is an evolutionarily, very ancient part of the brain structure. Along with the limbic system it is considered one of the most important brain regions concerning human behaviour. In fact, antipsychotic drugs provide much of their effect at the reticular formation. Included in its roles are an involvement in pain sensitisation, alertness, fatigue, sleep and motivation. It is also felt to be related to character traits such as introversion and extroversion. Introverted individuals are in possession of a more easily stimulated reticular formation and so are less likely to seek out stimulation, while extroverts actively seek out stimulation because their reticular formation is somewhat underactive. It could be hypothesised that addicted patients are in possession of an underactive reticular formation and so therefore crave stimulation. Most importantly the sagittal division of the reticular formation forms the raphe nuclei.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780443068850500227
Brain Stem and Cerebellum
David L. Felten MD, PhD, … Mary Summo Maida PhD, in Netter’s Atlas of Neuroscience (Third Edition), 2016
11.31 Reticular Formation: General Pattern of Nuclei in the Brain Stem
The reticular formation (RF), the neuronal core of the brain stem, consists of neurons with characteristic isodendritic morphology. The RF extends from the rostral spinal cord through the hypothalamus into the septal region. RF neurons are large cells with axonal arborizations that terminate at a distance from their cell bodies and dendritic tree; they are not interneurons. The major nuclei of the RF are found in a lateral zone (predominantly sensory functions), a medial zone (predominantly motor functions), and a column of raphe nuclei (serotonergic neurons). The serotonergic neurons exert mainly modulatory influences on their targets. The catecholaminergic neurons (locus coeruleus, tegmental noradrenergic, and adrenergic groups) in several regions of the RF have widespread projections and exert mainly modulatory influences on their targets. The dopaminergic neurons of the midbrain are included in this illustration, although some experts question whether they are RF neurons.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323265119000114
Substrates of tinnitus and hyperacusis in the animal auditory system
Jos J. Eggermont, in Tinnitus and Hyperacusis, 2022
4.4.4 A role for the reticular formation and cerebellum in tinnitus and hyperacusis
The RF comprises a set of interconnected nuclei that are located throughout the brainstem. The neurons of the RF make up a complex set of networks in the core of the brainstem that extend from the lower part of the medulla oblongata to the upper part of the midbrain. A large proportion of RF neurons receives auditory input albeit that the majority of acoustically responsive neurons are multimodal. Most acoustically responsive RF neurons show simple onset responses, and are broadly frequency tuned, even near threshold. The source is likely the ventral nucleus of the lateral lemniscus (Fig. 4.3) that projects to the RF (Irvine and Jackson, 1983). A projection of the RF to auditory cortex (ACx) is evident in human cortical auditory evoked potentials (Ponton et al., 2000). In rodents, DCN neurons receive input from and project to the caudal pontine reticular nucleus, which has been shown to play a role in the acoustic startle response. This nucleus is also the target of input from various brain nuclei, which are involved in PPI of the ASR (Koch et al., 1992). Recent research (reviewed in Eggermont, 2013) suggests that the modulation of the ASR could be mediated locally or modulated by descending effects from the IC, ACx, or amygdala.
Figure 4.3. Simplified schematic of putative afferent pathways for hyperacusis (black/purple) and tinnitus (blue). Black represents the lemniscal pathway, blue the extra-lemniscal pathway with direct access to the thalamus, and red a strong direct pathway to the auditory thalamus, albeit with collaterals to the inferior colliculus and MRF. The tuberoventral cells inhibit the fusiform cells. Cerebellar connections according to Azizi et al. (1985). The ascending reticular activating system pathway to auditory association cortex is shown in purple (according to Irvine and Jackson, 1983 and Garcia-Rill et al., 2016). Stars indicate increased bursting, and plus signs indicate document increased SFR reflecting central gain changes. ACx, auditory (association) cortex; ILT, intralaminar thalamus; MRF, midbrain reticular formation.
From Eggermont, J.J., 2021a. Separate auditory pathways for the induction and maintenance of tinnitus and hyperacusis? Prog. Brain Res. 260, 101–127. ISSN 0079-6123. With permission from Elsevier. https://doi.org/10.1016/bs.pbr.2020.01.00
Chen et al. (2015) found that salicylate induces hyperactivity in an auditory network composed of IC, MGB, and ACx with side branches to cerebellum, amygdala, and RF. They also reported that salicylate enhanced spontaneous activity in the RF and increased the functional coupling between the RF and the ACx. Interestingly, high doses of salicylate greatly enhanced the amplitude of the ASR.
The cerebellum, particularly the flocculus and paraflocculus, has auditory connections (green lines in Fig. 4.3) and is implicated in hearing loss and tinnitus through a modulatory role (Mennink et al., 2020).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323919128000025
Tinnitus — An Interdisciplinary Approach Towards Individualized Treatment: From Heterogeneity to Personalized Medicine
Jos J. Eggermont, in Progress in Brain Research, 2021
3.1 The reticular formation and the auditory system
The reticular formation (RF) comprises a set of interconnected nuclei that are located throughout the brainstem. The neurons of the RF make up a complex set of networks in the core of the brainstem that extend from the lower part of the medulla oblongata to the upper part of the midbrain. A large proportion of RF neurons receives auditory input albeit that the majority of acoustically responsive neurons are multimodal. Most acoustically responsive RF neurons show simple onset responses, and are broadly frequency tuned, even near threshold. The source is likely the nucleus of the lateral lemniscus (Fig. 2) that projects to the RF (Irvine and Jackson, 1983).
A projection of the RF to auditory cortex (ACx) is evident in human cortical auditory evoked potentials. Acoustic stimulation gives rise to several distinct components via the (1) lemniscal pathway activating A1 (e.g., the auditory steady-state response), (2) extralemniscal pathway activating A2 (e.g., N1) and (3) RF activating association areas (e.g., P1 and P2). In particular, the P2, despite having a latency about twice as long as the N1, matures around age 2—at the same time as the ABR and indicating its brainstem origin— whereas the N1 continues to mature into late adolescence (Ponton et al., 2000). Auditory P2 has its source in the anterior auditory cortex in the lateral part of Heschl’s gyrus (Ross and Tremblay, 2009).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0079612320300066
Muscle tone and movement
JAMES W. LANCE CBE, MD, FRCP, FRACP, FAA, JAMES G. McLEOD MB, BS, BSc(Med), DPhil(Oxon), FRCP, FRACP, in A Physiological Approach to Clinical Neurology (Third Edition), 1981
RETICULOSPINAL TRACTS
The reticular formation is a convenient collective term for the mass of individual nerve cells which extends throughout the neuraxis, from thalamus to medulla as a network (‘reticulum’) without being grouped into clearly recognizable nuclei. The rostral part of the reticular formation (in the midbrain and the medial and intralaminar nuclei of the thalamus) projects diffusely to the cerebral cortex as the ‘reticular activating system’ or ‘arousal system’ which is responsible for the maintenance of awareness. The pontine and medullary reticular formation project downwards to the spinal cord43,45 (Figure 5.1), partly as an excitatory or alerting system comparable with the upstream arousal effect of reticulocortical fibres, and partly as a number of inhibitory pathways regulating motor neurones and spinal reflexes.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780407001961500115
Physiological and Pathophysiological Expansion of Neuronal Networks
Prosper N’Gouemo, … Carl L. Faingold, in Neuronal Networks in Brain Function, CNS Disorders, and Therapeutics, 2014
Reticular Formation Neuronal-Firing Changes in AGS Kindling
Although the brainstem reticular formation (BRF) neuronal-firing changes induced by AGS kindling in GEPR-9s have not been evaluated, the changes in BRF firing induced by AGS kindling in GEPR-3s have been studied.59,63 The pontine BRF also plays a critical part in the neuronal network for AGS in GEPR-9s and GEPR-3s.59,64 AGS in unkindled GEPR-3s culminate in generalized clonus, but AGS kindling in GEPR-3s results in a different additional seizure behavior, F&F clonus, which is not seen prior to AGS kindling but is seen after kindling in several other AGS models.48,50,52 After AGS kindling in GEPR-3s, BRF neuronal firing greatly increased. Tonic BRF neuronal firing (relatively high-rate continuous firing) occurred during generalized clonus, and it changed to burst firing (repeated short periods of very rapid firing followed by silent periods) after AGS-kindling (see Chapter 9). Burst firing in BRF neurons also occurred during F&F clonus.59 Thus, increased neuronal firing and the change from tonic to burst firing suggest that AGS kindling involves increased BRF excitability. These data support an important role for BRF neurons in the generation of both generalized clonus and the F&F clonus induced by AGS kindling in GEPR-3s. Similar changes may also be induced in BRF neurons following AGS kindling in GEPR-9s. The origin of burst firing in BRF neurons may lie within the BRF itself or may result from an altered neuronal excitability in the other brain nuclei in the network that project to the BRF.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124158047000277
Consistencies and Variances in the Anatomical Organization of Aspects of the Mammalian Brain stem
P.R. Manger, in Evolutionary Neuroscience (Second Edition), 2020
15.2.5 The Reticular/Tegmental Nuclei of the Midbrain
The reticular formation of the midbrain forms the core of this brain region across mammals. This region is bordered rostrally by the ascending medial lemniscus and caudally by the decussation of the superior cerebellar peduncle. Across mammals in general, the reticular formation is bordered dorsally by the tectum/periaqueductal gray matter, medially by the median raphe nucleus, laterally by the dorsal thalamus, and ventrally by the substantia nigra complex. This region houses a range of both large and small cells forming a homogeneous mesh-like dendritic network around fascicles of axons. Within the midbrain, in well-studied mammals, parabrachial, cuneiform, and subcuneiform nuclei are often described; however, these are difficult to compare across mammalian species more generally due to a lack of distinctive anatomical compartmentalization of these reticular subdivisions. Housed within the midbrain reticular formation are the red nucleus and retrorubral catecholaminergic field (see aforementioned section).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128205846000155
Spinal cord
J.L. Wilkinson OBE, MD, FRCS, in Neuroanatomy for Medical Students (Second Edition), 1992
RETICULOSPINAL TRACTS
The reticular formation is a phylogenetically primitive network of small neurons extending throughout the brainstem and into the spinal cord. It has a diverse input; its descending connexions are mostly from the cerebral cortex, cerebellum and red nuclei. Spinal projections terminate on α and γ motor neurons, the latter influencing muscle tone. Its tracts are not well localized in the spinal cord: our understanding of them is derived mainly from animal study, direct information about their human anatomy is very limited. They comprise long and short polysynaptic routes. The medullary (lateral) reticulospinal tract, sited deep in the lateral funiculus, descends bilaterally from an inhibitory area of the medullary reticular formation. The smaller pontine (medial) reticulospinal tract consists of scattered fibres in the ventral funiculus which descend, mostly uncrossed, from a facilitatory area of the pontine reticular formation. Precise functional inter-relationships between the two tracts is not clearly defined and during normal activity (as distinct from experimental stimulation) it probably varies with the complex input to the reticular formation. Reticulospinal tracts innervate axial and proximal limb musculature and are involved in control of muscle tone, posture, locomotion and other stereotyped limb movements. Reticulospinal tracts, like corticospinal, can influence the central transmission of sensory information.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780750614474500086
Function of the brain
Min Suk Chung, Beom Sun Chung, in Visually Memorable Neuroanatomy for Beginners, 2020
Reticular formation
Fig. 4.41.
The “reticular” formation is a “network” composed of vague tracts and nuclei (Fig. 2.4) in the brainstem. This primitive structure is evolutionally old and also present in animals, so it is assumed that the reticular formation works for lower level activity, namely for survival.
Fig. 4.42. Ascending reticular activating system.
Including the reticular formation, the ascending reticular activating system is responsible for enhancing consciousness (Fig. 4.3). This system responds to all kinds of external stimuli. An example is waking up by the sound of alarm clock (Fig. 4.20).
In this ascending reticular activating system, the 1st neuron in the cranial and spinal nerves synapses with the 2nd neuron in the reticular formation. The 2nd neuron ascends and synapses with the 3rd neuron at the intralaminar nucleus of thalamus (Fig. 4.19). The 3rd neuron diffusely ends at the whole cerebral cortex (Table 3).
Fig. 4.43.
Parts of the reticular formation (cardiovascular and respiratory centers) in the medulla oblongata control heartbeat and breathing (Fig. 4.28).
Fig. 4.44.
In case of cerebrum death (vegetative state), the patient has no consciousness (Fig. 4.2). In case of brainstem death (brain death), the patient has neither consciousness nor self-breathing (Fig. 4.43).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128199015000041