From Wikipedia, the free encyclopedia
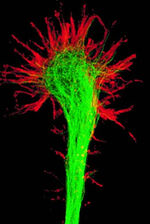
Image of a fluorescently-labeled growth cone extending from an axon F-actin (red) microtubules (green).
A growth cone is a large actin-supported extension of a developing or regenerating neurite seeking its synaptic target. It is the growth cone that drives axon growth.[1] Their existence was originally proposed by Spanish histologist Santiago Ramón y Cajal based upon stationary images he observed under the microscope. He first described the growth cone based on fixed cells as «a concentration of protoplasm of conical form, endowed with amoeboid movements» (Cajal, 1890).[2] Growth cones are situated on the tips of neurites, either dendrites or axons, of the nerve cell. The sensory, motor, integrative, and adaptive functions of growing axons and dendrites are all contained within this specialized structure.
Structure[edit]
Two fluorescently-labeled growth cones. The growth cone (green) on the left is an example of a “filopodial” growth cone, while the one on the right is a “lamellipodial” growth cone. Typically, growth cones have both structures, but with varying sizes and numbers of each.
The morphology of the growth cone can be easily described by using the hand as an analogy. The fine extensions of the growth cone are pointed filopodia known as microspikes.[3] The filopodia are like the «fingers» of the growth cone; they contain bundles of actin filaments (F-actin) that give them shape and support. Filopodia are the dominant structures in growth cones, and they appear as narrow cylindrical extensions which can extend several micrometres beyond the edge of the growth cone. The filopodia are bound by a membrane which contains receptors, and cell adhesion molecules that are important for axon growth and guidance.
In between filopodia—much like the webbing of the hands—are the «lamellipodia». These are flat regions of dense actin meshwork instead of bundled F-actin as in filopodia. They often appear adjacent to the leading edge of the growth cone and are positioned between two filopodia, giving them a «veil-like» appearance. In growth cones, new filopodia usually emerge from these inter-filopodial veils.
The growth cone is described in terms of three regions: the peripheral (P) domain, the transitional (T) domain, and the central (C) domain. The peripheral domain is the thin region surrounding the outer edge of the growth cone. It is composed primarily of an actin-based cytoskeleton, and contains the lamellipodia and filopodia which are highly dynamic. Microtubules, however, are known to transiently enter the peripheral region via a process called dynamic instability. The central domain is located in the center of the growth cone nearest to the axon. This region is composed primarily of a microtubule-based cytoskeleton, is generally thicker, and contains many organelles and vesicles of various sizes. The transitional domain is the region located in the thin band between the central and peripheral domains.
Growth cones are molecularly specialized, with transcriptomes and proteomes that are distinct from those of their parent cell bodies.[4] There are many cytoskeletal-associated proteins, which perform a variety of duties within the growth cone, such as anchoring actin and microtubules to each other, to the membrane, and to other cytoskeletal components. Some of these components include molecular motors that generate force within the growth cone and membrane-bound vesicles which are transported in and out of the growth cone via microtubules. Some examples of cytoskeletal-associated proteins are fascin and filamins (actin bundling), talin (actin anchoring), myosin (vesicle transport), and mDia (microtubule-actin linking).
Axon branching and outgrowth[edit]
The highly dynamic nature of growth cones allows them to respond to the surrounding environment by rapidly changing direction and branching in response to various stimuli. There are three stages of axon outgrowth, which are termed: protrusion, engorgement, and consolidation. During protrusion, there is a rapid extension of filopodia and lamellar extensions along the leading edge of the growth cone. Engorgement follows when the filopodia move to the lateral edges of the growth cone, and microtubules invade further into the growth cone, bringing vesicles and organelles such as mitochondria and endoplasmic reticulum. Finally, consolidation occurs when the F-actin at the neck of the growth cone depolymerizes and the filopodia retract. The membrane then shrinks to form a cylindrical axon shaft around the bundle of microtubules. One form of axon branching also occurs via the same process, except that the growth cone “splits” during the engorgement phase. This results in the bifurcation of the main axon. An additional form of axon branching is termed collateral (or interstitial) branching;.[5][6] Collateral branching, unlike axon bifurcations, involves the formation of a new branch from the established axon shaft and is independent of the growth cone at the tip of the growing axon. In this mechanism, the axon initially generates a filopodium or lamellipodium which following invasion by axonal microtubules can then develop further into a branch extending perpendicular from the axon shaft. Established collateral branches, like the main axon, exhibit a growth cone and develop independently of the main axon tip.
Overall, axon elongation is the product of a process known as tip growth. In this process, new material is added at the growth cone while the remainder of the axonal cytoskeleton remains stationary. This occurs via two processes: cytoskeletal-based dynamics and mechanical tension. With cytoskeletal dynamics, microtubules polymerize into the growth cone and deliver vital components. Mechanical tension occurs when the membrane is stretched due to force generation by molecular motors in the growth cone and strong adhesions to the substrate along the axon. In general, rapidly growing growth cones are small and have a large degree of stretching, while slow moving or paused growth cones are very large and have a low degree of stretching.
The growth cones are continually being built up through construction of the actin microfilaments and extension of the plasma membrane via vesicle fusion. The actin filaments depolymerize and disassemble on the proximal end to allow free monomers to migrate to the leading edge (distal end) of the actin filament where it can polymerize and thus reattach. Actin filaments are also constantly being transported away from the leading edge by a myosin-motor driven process known as retrograde F-actin flow. The actin filaments are polymerized in the peripheral region and then transported backward to the transitional region, where the filaments are depolymerized; thus freeing the monomers to repeat the cycle. This is different from actin treadmilling since the entire protein moves. If the protein were to simply treadmill, the monomers would depolymerize from one end and polymerize onto the other while the protein itself does not move.
The growth capacity of the axons lies in the microtubules which are located just beyond the actin filaments. Microtubules can rapidly polymerize into and thus “probe” the actin-rich peripheral region of the growth cone. When this happens, the polymerizing ends of microtubules come into contact with F-actin adhesion sites, where microtubule tip-associated proteins act as «ligands». Laminins of the basal membrane interact with the integrins of the growth cone to promote the forward movement of the growth cone. Additionally, axon outgrowth is also supported by the stabilization of the proximal ends of microtubules, which provide the structural support for the axon.
Axon guidance[edit]
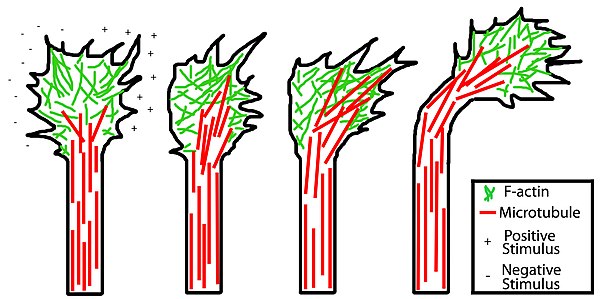
Model of growth cone-mediated axon guidance. From left to right, this model describes how the cytoskeleton responds and reorganizes to grow towards a positive stimulus (+) detected by receptors in the growth cone or away from a negative stimulus (-).
Movement of the axons is controlled by an integration of its sensory and motor function (described above) which is established through second messengers such as calcium and cyclic nucleotides. The sensory function of axons is dependent on cues from the extracellular matrix which can be either attractive or repulsive, thus helping to guide the axon away from certain paths and attracting them to their proper target destinations. Attractive cues inhibit retrograde flow of the actin filaments and promote their assembly whereas repulsive cues have the exact opposite effect. Actin stabilizing proteins are also involved and are essential for continued protrusion of filopodia and lamellipodia in the presence of attractive cues, while actin destabilizing proteins are involved in the presence of a repulsive cue.
A similar process is involved with microtubules. In the presence of an attractive cue on one side of the growth cone, specific microtubules are targeted on that side by microtubule stabilizing proteins, resulting in growth cone turning in the direction of the positive stimulus. With repulsive cues, the opposite is true: microtubule stabilization is favored on the opposite side of the growth cone as the negative stimulus resulting in the growth cone turning away from the repellent. This process coupled with actin-associated processes result in the overall directed growth of an axon.
Growth cone receptors detect the presence of axon guidance molecules such as Netrin, Slit, Ephrins, and Semaphorins. It has more recently been shown that cell fate determinants such as Wnt or Shh can also act as guidance cues. The same guidance cue can act as an attractant or a repellent, depending on context. A prime example of this is Netrin-1, which signals attraction through the DCC receptor and repulsion through the Unc-5 receptor. Furthermore, it has been discovered that these same molecules are involved in guiding vessel growth. Axon guidance directs the initial wiring of the nervous system and is also important in axonal regeneration following an injury.[7]
References[edit]
- ^ Santos, TE; Schaffran, B; Broguière, N; Meyn, L; Zenobi-Wong, M; Bradke, F (21 July 2020). «Axon Growth of CNS Neurons in Three Dimensions Is Amoeboid and Independent of Adhesions». Cell Reports. 32 (3): 107907. doi:10.1016/j.celrep.2020.107907. PMID 32698008. S2CID 220716911.
- ^ Ramon, Cajal S (1890). «A quelle epoque apparaissent les expansions des cellule nerveuses de la moelle epinere du poulet». Anat. Anzeiger. 5: 609–613.
- ^ Gilbert, Scott (2006). Developmental biology (8th ed.). Sunderland, Mass.: Sinauer Associates, Inc. Publishers. p. 395. ISBN 9780878932504.
- ^ Poulopoulos, Alexandros; Murphy, Alexander J.; Ozkan, Abdulkadir; Davis, Patrick; Hatch, John; Kirchner, Rory; Macklis, Jeffrey D. (2019). «Subcellular transcriptomes and proteomes of developing axon projections in the cerebral cortex». Nature. 565 (7739): 356–360. Bibcode:2019Natur.565..356P. doi:10.1038/s41586-018-0847-y. ISSN 0028-0836. PMC 6484835. PMID 30626971.
- ^ Gallo G (2011). «The cytoskeletal and signaling mechanisms of axon collateral branching». Dev Neurobiol. 71 (3): 201–20. doi:10.1002/dneu.20852. PMID 21308993. S2CID 205758311.
- ^ Kalil K, Dent EW (2014). «Branch management: mechanisms of axon branching in the developing vertebrate CNS». Nat. Rev. Neurosci. 15 (1): 7–18. doi:10.1038/nrn3650. PMC 4063290. PMID 24356070.
- ^ Yoo S, van Niekerk EA, Merianda TT, Twiss JL (2010). «Dynamics of axonal mRNA transport and implications for peripheral nerve regeneration». Experimental Neurology. 1. 223 (1): 19–27. doi:10.1016/j.expneurol.2009.08.011. PMC 2849851. PMID 19699200.
На этой микрофотографии видны длинные отростки (аксоны) ганглионарных клеток сетчатки, выращенных из стволовых клеток человека. Аксоны искусственно окрашены в красный цвет, а их конусы роста (см. Growth cone) с движущимися выростами-органеллами разных типов — филоподиями (см. Filopodia) и ламеллиподиями (см. Lamellipodium) — в зеленый.
Окраска производилась методом иммунофлюоресценции: культуру клеток обработали антителами двух видов, которые при взаимодействии со специфичным антигеном активировали флюоресцентные маркеры разного цвета. Одно антитело специфично к β3-изоформе белка тубулина, формирующего микротрубочки, по которым в цитоплазме аксона к конусу роста транспортируются питательные вещества (это антитело активировало красную флюоресценцию). Другое же специфично к фибриллярной форме белка актина (F-актину), которая образуется в конусах роста (зеленая флюоресценция).
Методика выращивания искусственной сетчатки из стволовых клеток уже хорошо разработана. Вкратце ее суть состоит в помещении таких клеток в питательную среду и воздействии на них двумя комплексами химических веществ. Первый, NIM, индуцирует их развитие в сторону образования нейронов; второй, RDM, — в сторону дифференциации в разные типы клеток, формирующие между собой пространственные связи так же, как в живой сетчатке. Основу обоих комплексов составляет питательное вещество DMEM/F12, состоящее из глюкозы, аминокислот и витаминов, а также из дополнительных наборов разных аминокислот.
Однако до сих пор в научных работах на эту тему недостаточно внимания уделялось развитию ганглионарных клеток. Между тем, это единственные нервные клетки сетчатки, способные генерировать нервные импульсы. Ганглионарные клетки формируют множество отростков: короткие (дендриты) собирают информацию от биполярных клеток-посредников (связанных, в свою очередь, с фоторецепторами), длинные (аксоны) передают ее на большое расстояние в зрительный нерв. Болезни и нарушения развития, связанные с разрушением аксонов, приводят к нарушениям зрения и слепоте.
Новое исследование показало, что ганглионарные клетки дифференцируются быстрее, чем клетки других типов, и происходит это во внутреннем слое сетчатки. Включает механизм дифференциации примерно к 30-му дню развития искусственной сетчатки ген BRN3. Ученые доказали это, подсадив в культуру генетически модифицированные с помощью метода CRISPR/Cas9 стволовые клетки, начинающие флюоресцировать красным при экспрессии BRN3 (см. Систему CRISPR-CAS9 удалось заснять в действии, «Элементы», 06.12.2017).
Развитием отростков ганглионарных клеток сетчатки управляют как внутренние, так и внешние факторы. В качестве внешних выступают химические вещества, вырабатываемые другими клетками — стимулирующие рост и движение хемоаттрактанты и «отпугивающие» хеморепелленты. Ученые протестировали несколько веществ-кандидатов на роль таких стимуляторов. Самым сильным оказался эффект от воздействия на ганглионарные клетки белка нетрина-1, способность которого управлять аксональным поведением ранее уже была показана (см. Как белок нетрин подсказывает аксонам, куда им расти, «Элементы», 17.06.2014). Под его действием некоторые аксоны достигали длины 1,5 мм уже на 24-й день своего развития, что является хорошим результатом: максимальная длина аксонов ганглионарных клеток сетчатки составляет 4–5 мм.
В искусственной сетчатке агрегаты ганглионарных нейронов распространяют отростки равномерно во все стороны. В развивающемся живом организме ситуация иная: там рост аксонов направляется в сторону клеток зрительного нерва, с помощью описанного выше химического механизма. Астроциты (тип глиальных клеток) головки зрительного нерва, которая выходит в сетчатку, вырабатывают нетрин-1. Благодаря этому аксоны ганглионарных клеток растут в нужном направлении.
Однако в обоих случаях аксоны разных ганглионарных клеток сплетаются друг с другом, образуя «лучи», растущие в одном направлении — как это показано на верхней картинке. На кончиках «лучей» концентрируются конусы роста. Именно они реагируют на внешние химические факторы, определяя направление, в котором будет расти отросток. Конус роста имеет собственный цитоскелет (см. картинку дня Раскрашенный цитоскелет) на основе белка актина и подвижные отростки двух типов: ламеллоподии, осуществляющие движения конца отростка вперед, и филлоподии, поддерживающие это движение.
Установлено, что нетрин-1 значительно стимулирует активность конусов роста аксонов ганглионарных клеток. Этот белок воздействует на рецепторы, расположенные на поверхности конусов роста, что включает экспрессию отвечающих за рост и движение генов. Интересно, что у разных ганглионарных клеток набор экспрессируемых при этом генов различается. Всего этих генов 34, но по экспрессии всего шести из них клетку можно отнести к одной из пяти групп. Смысл существования этих групп пока неясен.
Исследование закономерностей развития ганглионарных клеток сетчатки и их отростков в перспективе, как надеются ученые, может помочь в борьбе с некоторыми нарушениями зрения, в том числе с помощью имплантации искусственной сетчатки, выращенной из собственных стволовых клеток человека.
Фото с сайта bpod.mrc.ac.uk.
Олег Соколенко
Большое актиновое расширение развивающегося нейрита ищет свою синаптическую цель 
A конус роста представляет собой большое актин -поддерживаемое расширение развивающегося или регенерирующего нейрит ищет свою синаптическую цель. Их существование было первоначально предложено испанским гистологом Сантьяго Рамоном-и-Кахал на основании неподвижных изображений, которые он наблюдал под микроскопом. Он впервые описал конус роста, основанный на фиксированных клетках, как «концентрацию протоплазмы конической формы, наделенную амебоидными движениями» (Cajal, 1890). Конусы роста расположены на концах нейритов, либо дендритов, либо аксонов, нервной клетки. Сенсорные, моторные, интегративные и адаптивные функции растущих аксонов и дендритов содержатся в этой специализированной структуре.
Содержание
- 1 Структура
- 2 Разветвление и рост аксонов
- 3 Руководство по аксонам
- 4 Ссылки
Структура

Морфологию ростового конуса можно легко описать, используя руку в качестве аналогии. Тонкие продолжения конуса роста представляют собой заостренные филоподии, известные как микрошипы. Филоподии подобны «пальцам» конуса роста; они содержат пучки актиновых филаментов (F-актин), которые придают им форму и опору. Филоподии — это доминирующие структуры в конусах роста, они выглядят как узкие цилиндрические выступы, которые могут выходить на несколько микрометров за край конуса роста. Филоподии связаны мембраной, которая содержит рецепторы, а молекулы клеточной адгезии, которые важны для роста аксонов и руководства.
Между филоподиями — очень похожими на перепонки рук — находятся » ламеллиподии «. Это плоские области плотной сети актина вместо связанного F-актина, как у филоподий. Они часто появляются рядом с передним краем конуса роста и располагаются между двумя филоподиями, придавая им вид «вуали». В конусах роста новые филоподии обычно появляются из этих межфилоподийных вуалей.
Конус роста описывается в терминах трех областей: периферического (P) домена, переходного (T) домена и центрального (C) домена. Периферийный домен — это тонкая область, окружающая внешний край конуса роста. Он состоит в основном из актинового цитоскелета и содержит ламеллиподии и филоподии, которые очень динамичны. Микротрубочки, однако, как известно, временно проникают в периферическую область посредством процесса, называемого динамической нестабильностью. Центральный домен расположен в центре ближайшего к аксону конуса роста. Эта область состоит в основном из цитоскелета на основе микротрубочек, обычно более толстая и содержит множество органелл и везикул различных размеров. Переходный домен — это область, расположенная в тонкой полосе между центральным и периферическим доменами.
Конусы роста являются молекулярно специализированными, с транскриптомами и протеомами, которые отличаются от таковых их тел родительских клеток. Существует много белков, связанных с цитоскелетом, которые выполняют множество функций внутри конуса роста, например, прикрепляют актин и микротрубочки друг к другу, к мембране и другим компонентам цитоскелета. Некоторые из этих компонентов включают молекулярные моторы, которые генерируют силу в конусе роста, и связанные с мембраной везикулы, которые транспортируются в конус роста и из него через микротрубочки. Некоторыми примерами белков, связанных с цитоскелетом, являются фасцин и филамины (связывание актина), талин (закрепление актина), миозин (транспорт везикул).) и mDia (связывание микротрубочек с актином).
Разветвление и рост аксонов
Высокодинамичная природа конусов роста позволяет им реагировать на окружающую среду, быстро меняя направление и разветвляясь в ответ на различные стимулы. Существует три стадии роста аксона, которые называются: протрузия, нагрубание и консолидация. Во время протрузии происходит быстрое распространение филоподий и ламеллярных расширений вдоль переднего края конуса роста. Набухание происходит, когда филоподии перемещаются к боковым краям конуса роста, а микротрубочки проникают дальше в конус роста, принося везикулы и органеллы, такие как митохондрии и эндоплазматический ретикулум. Наконец, консолидация происходит, когда F-актин на шейке конуса роста деполимеризуется и филоподии втягиваются. Затем мембрана сжимается, образуя цилиндрический стержень аксона вокруг пучка микротрубочек. Одна форма ветвления аксонов также происходит посредством того же процесса, за исключением того, что конус роста «расщепляется» во время фазы нагрубания. Это приводит к бифуркации главного аксона. Дополнительную форму ветвления аксонов называют коллатеральным (или интерстициальным) ветвлением. Коллатеральное ветвление, в отличие от бифуркаций аксонов, включает образование новой ветви от установленного вала аксона и не зависит от конуса роста на кончике растущего аксона. В этом механизме аксон первоначально генерирует филоподий или ламеллиподий, которые после инвазии аксональными микротрубочками могут затем развиться дальше в ветвь, идущую перпендикулярно от вала аксона. Установленные коллатеральные ветви, такие как главный аксон, имеют конус роста и развиваются независимо от кончика главного аксона.
В целом удлинение аксона является результатом процесса, известного как рост кончика. В этом процессе новый материал добавляется к конусу роста, в то время как остальная часть аксонального цитоскелета остается неподвижной. Это происходит посредством двух процессов: динамики цитоскелета и механического напряжения. Благодаря динамике цитоскелета микротрубочки полимеризуются в конус роста и доставляют жизненно важные компоненты. Механическое напряжение возникает, когда мембрана растягивается из-за генерирования силы молекулярными двигателями в конусе роста и сильной адгезии к субстрату вдоль аксона. В общем, быстрорастущие конусы роста имеют небольшие размеры и большую степень растяжения, в то время как медленно движущиеся или приостановленные конусы роста очень большие и имеют низкую степень растяжения.
Ростовые конусы непрерывно формируются за счет конструирования актиновых микрофиламентов и расширения плазматической мембраны посредством слияния везикул. Актиновые филаменты деполимеризуются и разбираются на проксимальном конце, позволяя свободным мономерам мигрировать к переднему краю (дистальному концу) актинового филамента, где они могут полимеризоваться и, таким образом, повторно прикрепляться. Актиновые филаменты также постоянно отводятся от переднего края с помощью миозин-моторного процесса, известного как ретроградный поток F-актина. Актиновые филаменты полимеризуются в периферической области и затем транспортируются обратно в переходную зону, где филаменты деполимеризуются; таким образом освобождая мономеры для повторения цикла. Это отличается от беговой дорожки с актином, поскольку движется весь белок. Если бы протеин был просто беговой дорожкой, мономеры деполимеризовались бы с одного конца и полимеризовались бы на другом, в то время как сам белок не двигался бы.
Ростовая способность аксонов заключается в микротрубочках, которые расположены сразу за актиновыми филаментами. Микротрубочки могут быстро полимеризоваться и, таким образом, «зондировать» богатую актином периферическую область конуса роста. Когда это происходит, полимеризующиеся концы микротрубочек входят в контакт с участками адгезии F-актина, где белки, связанные с кончиками микротрубочек, действуют как «лиганды». Ламинины базальной мембраны взаимодействуют с интегринами конуса роста, способствуя продвижению конуса роста. Кроме того, разрастание аксона также поддерживается за счет стабилизации проксимальных концов микротрубочек, которые обеспечивают структурную поддержку аксона.
Направление аксонов

Движение аксонов контролируется интеграция его сенсорной и моторной функции (описанной выше), которая осуществляется через вторичные посредники, такие как кальций и циклические нуклеотиды. Сенсорная функция аксонов зависит от сигналов внеклеточного матрикса, которые могут быть либо притягивающими, либо отталкивающими, помогая тем самым увести аксон от определенных путей и привлечь их к их надлежащим целям назначения. Привлекательные реплики подавляют ретроградный поток актиновых филаментов и способствуют их сборке, тогда как репульсивные реплики имеют прямо противоположный эффект. Белки, стабилизирующие актин, также задействованы и необходимы для продолжения выпячивания филоподий и ламеллиподий в присутствии сигналов притяжения, тогда как белки, дестабилизирующие актин, участвуют в присутствии сигналов отталкивания.
Аналогичный процесс происходит с микротрубочками. В присутствии привлекательного сигнала на одной стороне конуса роста, специфические микротрубочки нацелены на этой стороне стабилизирующими микротрубочками белками, что приводит к повороту конуса роста в направлении положительного стимула. С отталкивающими сигналами верно обратное: стабилизация микротрубочек предпочтительна на противоположной стороне конуса роста в качестве отрицательного стимула, в результате которого конус роста отворачивается от репеллента. Этот процесс в сочетании с процессами, связанными с актином, приводит к общему направленному росту аксона.
Рецепторы конуса роста обнаруживают присутствие молекул, направляющих аксоны, таких как нетрин, Slit, эфрины и семафорины. Недавно было показано, что детерминанты клеточной судьбы, такие как Wnt или Shh, также могут действовать как ориентиры. Один и тот же сигнал наведения может действовать как аттрактант или репеллент, в зависимости от контекста. Ярким примером этого является Нетрин-1, который сигнализирует о притяжении через рецептор DCC и отталкивании через рецептор Unc-5. Кроме того, было обнаружено, что эти же молекулы участвуют в управлении ростом сосудов. Направление аксонов направляет начальную проводку нервной системы, а также важно в регенерации аксонов после травмы.
Ссылки
Assessment |
Biopsychology |
Comparative |
Cognitive |
Developmental |
Language |
Individual differences |
Personality |
Philosophy |
Social |
Methods |
Statistics |
Clinical |
Educational |
Industrial |
Professional items |
World psychology |
Biological:
Behavioural genetics ·
Evolutionary psychology ·
Neuroanatomy ·
Neurochemistry ·
Neuroendocrinology ·
Neuroscience ·
Psychoneuroimmunology ·
Physiological Psychology ·
Psychopharmacology
(Index, Outline)
Image of a growth cone (red) extending from an axon (green).
A growth cone is a dynamic, actin-supported extension of a developing axon seeking its synaptic target. Their existence was originally proposed by Spanish histologist Santiago Ramón y Cajal based upon stationary images he observed under the microscope.
Structure
The morphology of the growth cone can be easily described by using the hand as an analogy. The fine extensions of the growth cone are known as «filopodia». The filopodia are like the «fingers» of the growth cone; they contain actin filaments that give them shape and support. In between filopodia—much like the webbing of the hands—are the «lamellipodia». The filopodia contain receptors that are important for axon guidance.
Movement
The growth cones are continually being built up through construction of the actin microfilaments and extension of the plasma membrane via vesicle fusion. The actin filaments depolymerize and disassamble on one end to allow free monomers to migrate to the leading edge of the actin filament where it can polymerize and thus reattach. Actin filaments thus do not actually grow but rather migrate. The growth capacity of the axons lies in the microtubules which are located just beyond the actin filaments. Laminins of the basal membrane interact with the integrins of the growth cone to promote the forward movement of the growth cone.
Axon guidance
- Main article: Axon guidance
Movement of the axons is controlled by an integration of its sensory and motor function (described above) which is established through second messengers such as calcium and cyclic nucleotides. The sensory function of axons is dependent on cues from the extracellular matrix which can be either attractive or repulsive, thus helping to guide the axon away from certain paths and attracting them to their proper target destinations. Attractive cues inhibit retrograde flow of the actin filaments and promote their assembly whereas repulsive cues have the exact opposite effect. Growth cone receptors detect the presence of axon guidance molecules such as Netrin, Slit, Ephrins, and Semaphorins. It has more recently been shown that cell fate determinants such as Wnt can also act as guidance cues. Quite interestingly, the same guidance cue can act as an attractant or a repellent, depending on context. A prime example of this is Netrin-1, which signals attraction through the DCC receptor and repulsion through the Unc-5 receptor. Furthermore, it has been discovered that these same molecules are involved in guiding vessel growth. Axon guidance directs the initial wiring of the nervous system and is also important in axonal regeneration following an injury.
References
- Gordon-Weeks, P. R. 2005. Neuronal Growth Cones, Cambridge University Press, Cambridge. ISBN, 0521 44491 8
- Kandel ER, Schwartz JH, Jessell TM 2000. Principles of Neural Science, 4th ed. pp.1070-1074. McGraw-Hill, New York. ISBN 0-8385-7701-6
- de:Wachstumskegel
Клетки общаются друг с другом с помощью химических сигналов.
Выделяя те или иные вещества, клетка может «подзывать» к себе другие клетки либо «отпугивать» их, сообщать им различные сведения, «звать на помощь» клетки иммунной системы в случае атаки патогенов. Химическое общение между клетками играет важнейшую роль во множестве клеточных процессов. Мы рассмотрим подробно один из таких процессов — аксональное наведение — и роль в нем «химической подсказки» — белка нетрина. Связываясь с разными рецепторами, нетрин образует совершенно разные комплексы, что приводит к разным каскадам реакций, которые могут по-разному поворачивать конус роста аксона.
Аксональное наведение — это сложный процесс, в результате которого аксон прорастает в нужное место, а не куда попало. Нечего и говорить о том, какая тут нужна точность — представьте себе, например, путешествие аксона от спинного мозга до пятки. Или — менее наглядный, но более важный пример — образование правильных связей между нейронами в головном мозге, без которого мозг работать не будет (о том, насколько это сложно, запутанно и интересно, можно прочесть в статье Blue Brain Project: как все связано?).
Самый кончик аксона — конус роста — чрезвычайно подвижное и, можно сказать, любопытное образование. Он нашпигован рецепторами к так называемым «химическим подсказкам» — веществам, которые окружают аксон снаружи и сообщают, куда ему расти. Предполагается, что связывание рецептора на конусе роста с химической подсказкой вызывает каскады реакций, приводящие к перестройке цитоскелета и повороту конуса роста — а значит, к изменению направления роста аксона. Так и представляешь себе, как конус роста «ловит» сигналы от разных подсказок, вертится из-за этого в разные стороны и наконец, выбрав итоговое направление, поворачивает туда весь аксон.
Химические подсказки могут находиться на поверхности окружающих аксон клеток или выделяться этими клетками в окружающую среду. Если они прикреплены к поверхности клеток, то могут действовать только при непосредственном соприкосновении этих клеток и конуса роста; если же они выделяются в окружающую среду, то дальность их действия повышается. Большинство химических подсказок играет роль не только в аксональном наведении, но и в других процессах, например в прорастании кровеносных сосудов — ангиогенезе.
Есть несколько классов химических подсказок:
— Семафорины (от слова «семафор») — могут как выделяться окружающими нейрон клетками, так и находиться на их поверхности. Они в основном отталкивают, «отпугивают» аксоны, не позволяя им прорасти в неподходящие для этого области.
— Нетрины (от санскритского «netr» — проводник) — выделяются окружающими аксон клетками и могут как привлекать аксоны, так и отпугивать их
— Слиты (см. Slit-Robo) — выделяются окрестными клетками и, связываясь с Robo-рецепторами, отпугивают аксоны.
— Эфрины — находятся на поверхности окружающих аксон клеток. Эти молекулы-перевертыши могут быть одновременно и лигандами, и рецепторами. Соединяясь с эфриновыми рецепторами на конусе роста, они могут как привлекать, так и отпугивать нейроны; в то же время, соединение их с этими самыми эфриновыми рецепторами может приводить и к изменениям внутри тех клеток, на поверхности которых находятся сами эфрины.
— Молекулы клеточной адгезии — находятся на поверхности почти всех клеток организма и связывают их друг с другом и с внеклеточным матриксом. Они важны не только для аксонального наведения, но и для множества других процессов: без них наш организм вообще распался бы на отдельные клетки.
— А также другие, чуть менее специализированные молекулы.
Как вы уже, наверное, заметили, некоторые из вышеописанных молекул выполняют только одно действие — например, только отпугивают аксон, в то время как другие умеют и привлекать, и отпугивать аксоны в зависимости от конкретных условий, прежде всего от наличия на поверхности конуса роста тех или иных рецепторов. В результате аксон, на конусе роста которого находятся «привлекательные» рецепторы к этой молекуле, прорастет туда, где находится данная химическая подсказка, а аксон, на конусе роста которого рецепторы «отталкивающие», будет избегать места с этой подсказкой как чумы. Причем вокруг конуса роста много разных подсказок, а на самом конусе много разных рецепторов, и в результате все полученные сигналы суммируются, и аксон прорастает туда, куда ему показывает итоговый вектор.
Большая интернациональная группа ученых задалась целью подробней исследовать один из классов химических подсказок — нетрины — и разобраться на молекулярном уровне, как этим молекулам удается так противоположно действовать на аксоны. Сама по себе работа не представляет особого интереса для широкой публики, но на ее примере хорошо видны правила, по которым взаимодействуют друг с другом белки, и то, как эти взаимодействия могут влиять на жизнь клетки.
В работе рассматривались:
— Нетрин-1 (рис. 1) — один из главных нетринов. У мыши состоит из 603 аминокислот, у человека — из 604. Имеет три домена — ламининовый N-концевой, или LN (см. Laminin N-terminal); ламининовый EGF-подобный (см. EGF-like domain), состоящий из трех модулей, посередине; и маленький положительно заряженный LC-домен на C-конце.
— DCC — его «привлекательный» рецептор. Связывается с LN-LE доменами нетрина-1 посредством своих фибронектиновых доменов III типа (см. Fibronectin type III domain).
— Неогенин (см. статью N. H. Wilson, B. Key, 2007. Neogenin: One receptor, many functions) — многофункциональный рецептор, имеющий некоторое структурное сходство с DCC. Возможно, играет роль и в аксональном наведении за счет связывания с нетрином-1.
— Unc5 — «отталкивающий» рецептор нетрина-1.
Нетрин-1 образует тетрамерный комплекс с неогенином
Одна молекула нетрина в принципе не в состоянии связаться с одной молекулой неогенина: линкер между нетринсвязывающими доменами неогенина не может так растянуться, чтобы прилипнуть к нужным доменам нетрина. Поэтому нетрины-1 образуют с рецепторами комплексы, в которых несколько нетринов связываются с несколькими молекулами рецепторов. Комплекс, который нетрин-1 образует с неогенином, состоит из двух молекул нетрина и двух молекул рецептора. Нетрин при этом практически не меняет свою конформацию по сравнению со свободным состоянием. Два нетрина встают крест-накрест и сцепляются своими срединными LE-2 доменами, а к их концам присоединяются два параллельно расположенных неогенина (рис. 2).
Нетрин-1 связывается с DCC
У DCC линкерный (соединяющий два домена) регион между доменами FN4 и FN5 короче, чем у неогенина, и потому он не может связываться с нетрином-1 в такой красивый тетрамерный комплекс, как неогенин. Вместо этого нетрины и DCC чередуются в длинных (теоретически — бесконечных) цепочках (рис. 3). При этом молекулы DCC в этих цепочках расположены параллельно друг другу, так же, как и молекулы неогенина в вышеописанном комплексе.
Другие возможности
Исследователи предположили, что, поскольку связи между нетрином-1 с DCC и нетрином-1 с неогенином практически идентичны, возможна ситуация, когда нетрин одним концом сцепляется с одним своим рецептором, а другим — с другим. Кроме того, не будем забывать и об «отталкивающем» рецепторе для нетрина-1 — Unc-5. Судя по всему, он присоединяется к LE2-домену нетрина (см. статью R. P. Kruger et al., 2004. Mapping Netrin Receptor Binding Reveals Domains of Unc5 Regulating Its Tyrosine Phosphorylation). В результате помимо двух вышеописанных структур могут получаться другие, в которых нетрины, неогенины, DCC и UNC5 слипаются друг с другом в самых причудливых сочетаниях, что приводит к самым разнообразным последствиям: различные изменения конформации рецептора приводят к разным каскадам реакций, которые могут совершенно по-разному поворачивать конус роста аксона. Похожим образом могут работать и другие сигнальные молекулы, чьи эффекты отличаются в зависимости от того, на какие рецепторы им довелось попасть.
http://elementy.ru/news/432271
Развитие и рост нейрона Конус роста
Нейрон развивается
из небольшой клетки-предшественницы,
которая перестаёт делиться ещё до того,
как выпустит свои отростки. (Однако,
вопрос о делении нейронов в настоящее
время остаётся дискуссионным.) Как
правило, первым начинает расти аксон,
а дендриты образуются позже. На конце
развивающегося отростка нервной клетки
появляется утолщение неправильной
формы, которое и прокладывает путь через
окружающую ткань. Это утолщение называется
конусом роста
нервной клетки.
Он состоит из уплощенной части отростка
нервной клетки с множеством тонких
шипиков. Микрошипики имеют толщину от
0,1 до 0,2 мкм и могут достигать 50 мкм в
длину, широкая и плоская область конуса
роста имеет ширину и длину около 5 мкм,
хотя форма её может изменяться. Промежутки
между микрошипиками конуса роста покрыты
складчатой мембраной. Микрошипики
находятся в постоянном движении —
некоторые втягиваются в конус роста,
другие удлиняются, отклоняются в разные
стороны, прикасаются к субстрату и могут
прилипать к нему.
Конус роста заполнен
мелкими, иногда соединёнными друг с
другом, мембранными пузырьками
неправильной формы. Непосредственно
под складчатыми участками мембраны и
в шипиках находится плотная масса
перепутанных актиновых филаментов.
Конус роста содержит также митохондрии,
микротрубочки и нейрофиламенты, имеющиеся
в теле нейрона.
Вероятно,
микротрубочки и нейрофиламенты удлиняются
главным образом за счёт добавления
вновь синтезированных субъединиц у
основания отростка нейрона. Они
продвигаются со скоростью около
миллиметра в сутки, что соответствует
скорости медленного аксонного транспорта
в зрелом нейроне. Поскольку примерно
такова и средняя скорость продвижения
конуса роста, возможно, что во время
роста отростка нейрона в его дальнем
конце не происходит ни сборки, ни
разрушения микротрубочек и нейрофиламентов.
Новый мембранный материал добавляется,
видимо, у основания. Конус роста — это
область быстрого экзоцитоза и эндоцитоза,
о чём свидетельствует множество
находящихся здесь пузырьков. Мелкие
мембранные пузырьки переносятся по
отростку нейрона от тела клетки к конусу
роста с потоком быстрого аксонного
транспорта. Мембранный материал, видимо,
синтезируется в теле нейрона, переносится
к конусу роста в виде пузырьков и
включается здесь в плазматическую
мембрану путём экзоцитоза, удлиняя
таким образом отросток нервной клетки.
Росту аксонов и
дендритов обычно предшествует фаза
миграции нейронов, когда незрелые
нейроны расселяются и находят себе
постоянное место.
Конус роста,
удлинение аксона и роль актина
Кончик растущего
аксона удлиняется, образуя конус роста.
Рамон-и-Кахаль первым обнаружил, что
конус роста является частью аксона,
ответственной за навигацию и удлинение
его в направлении конечной цели. Конус
роста удлиняется и сокращается за счет
широких пластинок, называемых
ламмелиподиями,
и тонких, остроконечных выпячиваний,
называемых филоподиями.
Филоподии достигают размеров в несколько
десятков микрометров и могут удлиняться
и сокращаться, как бы ощупывая субстрат
во всех направлениях. Филоподии адгезируют
к определенному субстрату и тянут конус
роста в этом направлении.
Актин играет
ключевую роль в подвижности конуса
роста. Как ламеллиподии, так и филоподии
богаты филаментным актином и веществами,
ингибирующими полимеризацию актина,
такими как грибной токсин цитохалазин
В, обездвиживающий конусы роста.
Выпячивание и ретракция ламеллиподий
и филоподий, а также движение вперед
самого конуса роста, скорее всего,
управляется двумя процессами: (1)
полимеризацией и разборкой актиновых
филаментов и (2) зависимой от миозина
транслокацией актиновых филаментов
прочь от ведущего края конуса роста.
Миозин, связанный
с микротрубочками, обеспечивает движение
актиновых филаментов в направлении
назад, в то время как в филаментах
постоянно происходит процесс полимеризации
со стороны ведущего края конуса роста
и деполимеризация в центре.
Полимеризация актина в этом случае
приводит к продвижению конуса роста, в
то время как миозин обеспечивает движение
микротрубочек вперед, продвигая
центральный домен конуса роста.
Оба процесса
используют энергию гидролиза АТФ и
могут управляться белками, связывающими
актин. Кальций, протеинкиназы и другие
внутриклеточные вторичные посредники
управляют активностью актин-связывающих
белков. Например, остановка роста и
ретракция конуса роста, два частых
события в процессе роста аксонов, связаны
с входящим током кальция и увеличением
частоты кратковременных повышений
концентрации кальция в цитоплазме
клетки.
Молекулы адгезии
клетки и внеклеточного матрикса и рост
аксона
Молекулы клеточной
адгезии управляют ростом аксона,
обеспечивая наиболее благоприятное
окружение для вытягивания конуса роста.
Клеточные молекулы адгезии представляют
собой трансмембранные или связанные с
мембраной гликопротеины. Фрагменты
этих макромолекул
во многом гомологичны постоянным
фрагментам иммуноглобулинов. Эти
молекулы обеспечивают адгезию клеток
друг к другу посредством связей между
гликопротеинами.
Дополнительно присутствующей везде
молекулой клеточной адгезии является
молекула N-кадгерина, которая обеспечивает
кальций-зависимую адгезию между клетками.
В культуре клеток
синтез N-кадгерина приводит к их агрегации,
вытягиванию аксонов в сторону клеточных
субстратов, а также соединению отдельных
растущих аксонов в пучки (фасцикулы,
fascicles). Стимуляция роста аксонов молекулами
клеточной адгезии не обеспечивается
просто «липкостью» субстрата; она
управляется активацией рецепторов,
связанных с тирозинкиназой, например
рецептора к фактору роста фибробластов
(fibroblast growth factor, FGF).
Рецептор FGF включает внутриклеточный
каскад, связанный с фосфорилированием
тирозина, что приводит к удлинению
аксона. Исследования при помощи
специальных блокирующих антител
показывают, что конусы роста редко
используют только один субстрат для
своего движения; несколько типов молекул
адгезии клетки и внеклеточного матрикса
могут обеспечивать рост нервных отростков
у определенных типов нейронов. Например,
для полного ингибирования роста аксонов
в сторону шванновской клетки необходимо
применять одновременно антитела к
нескольким факторам роста.
Итак, рост аксона,
его движение вдоль клеток определяется
различными ростовыми и ингибирующими
факторами, которые синтезируются
клетками и встраиваются в их мембраны.
, но каким же образом регулируется
направление роста аксонов? В этой
проблеме пока больше вопросов, чем
ответов, хотя некоторые факты уже можно
считать установленными. Оказалось, что
когда расстояние между телом нейрона
и его мишенью очень короткое конусы
роста аксонов следуют по градиенту
концентрации некоторых молекул,
вырабатываемых клетками-мишенями.
В противоположность
этому, способность аксонов, например,
спинальных мотонейронов расти в
направлении конечностей не зависит от
наличия мышечной клетки-мишени. Это
было показано путем удаления в раннем
периоде сомита, из которого развивается
мускулатура конечностей. Аксоны
мотонейронов направляются нормально
из спинного мозга, врастают в конечность
и образуют мышечные нервы, даже в
отсутствие мышцы. Таким образом, факторы,
которые управляют ростом аксонов
мотонейронов к определенной мишени на
конечности, не выделяются мышцами, с
которыми аксоны в конечном итоге образуют
связи. Когда
дистанция от нейрона до его цели
составляет больше чем несколько сотен
микрон, его путь обозначен специальными
промежуточными целями. Например, конус
роста, идущий от сенсорной клетки
конечностей у развивающегося кузнечика,
делает несколько резких поворотов на
своем пути в ЦНС). Эти повороты происходят
в тот момент, когда конус роста касается
так называемых клеток-ориентиров.
Такое поведение указывает на наличие
взаимодействия с клетками-ориентирами,
ответственными за перенаправление
конусов роста. Этими клетками чаше всего
являются незрелые нейроны. Эти
взаимодействия можно продемонстрировать
при помощи удаления клеток-ориентиров
лучом лазера до того, как их достигнет
конус роста. В этом случае не происходит
соответствующего изменения в траектории
движения конуса роста. Установлено, что
аксоны образуют кратковременные
синаптические контакты с клетками-ориентирами
во время развития. Например, аксоны
нейронов из ядра ЛКТ в зрительной системе
млекопитающих достигают развивающуюся
корковую пластинку раньше, чем образуются
их синаптические мишени — пирамидные
клетки слоя 4. Поэтому аксоны ядра ЛКТ
образуют синапсы с нейронами подпластинки,
которые образуются в раннем эмбриогенезе.
Нейроны подпластинки лежат под
развивающейся корковой пластинкой, и
им суждено исчезнуть вскоре после
рождения. Через нескольких недель, когда
пирамидные клетки слоя 4 достигают
своего месторасположения в коре, аксоны
из ЛКТ разрывают свои связи с нейронами
подпластинки и направляются в кору,
чтобы образовать связи, характерные
для взрослого животного. Если нейроны
подпластинки удалить в раннем периоде
развития местной аппликацией нейротоксинов,
аксоны ядра ЛКТ прорастают за пределы
развивающейся зрительной коры и не
могут образовать синаптических связей
со своими мишенями.
Гибель нейронов
Удивительной
особенностью развития нервной системы
является то, что многим ее нейронам
суждено погибнуть во время развития. У
беспозвоночных интенсивная гибель
нейронов сопровождается стремительными
изменениями, происходящими во время
метаморфоза, и регулируется гормонами.
Однако в развивающейся ЦНС как позвоночных,
так и беспозвоночных гибель клеток
происходит также и в отсутствие
значительных морфологических изменений.
Эксперименты,
выполненные Гамбургером и Леви-Монтальчини,
впервые выявили запрограммированную
гибель нейронов эмбрионов позвоночных,
а также показали, что степень гибели
клеток может зависеть от размеров
ткани-мишени. Они показали, например,
что в развивающейся конечности в то
время, когда формируются первые
синаптические связи с миофибриллами,
от 40 до 70 % мотонейронов, которые послали
аксоны в эту конечность, погибают.
Имплантация дополнительной конечности
уменьшает долю погибающих мотонейронов,
а удаление одного из зачатков конечностей
приводит к увеличению числа гибнущих
клеток, что дает основания для
предположения, что мотонейроны конкурируют
за некие трофические вещества, выделяемые
тканью-мишенью.
Избыточная продукция
нейронов, после которой следует период
гибели клеток, является характерной
чертой развития нервной системы
позвоночных. Некоторые из нейронов,
которые погибают, возможно, не смогли
образовать синапсов, или образовали их
с неподходящей клеткой-мишенью. В
подобных случаях гибель клеток связана
с особенностью иннервации. Однако
большинство клеток, которые гибнут,
достигают и иннервируют правильные
клетки-мишени. Таким образом, гибель
клеток является основным механизмом,
который поддерживает равновесие между
количеством нейронов и их мишеней.
Неожиданной
находкой явилось то, что ингибиторы
образования м-РНК или синтеза белка в
нейронах предотвращали их гибель.
Результаты этих и более поздних
экспериментов показали, что гибель
нейронов типично происходит путем
апоптоза. Апоптоз
— это процесс, который активирует
внутреннюю «суицидальную» программу
клетки, которая приводит к упорядоченному
(запрограммированному) распаду ДНК и
белков в клетке. Существенно, что для
этого необходим предварительный синтез
протеолитических ферментов или их
активаторов.
Развитие синапсов
Многие исследования
функции и формирования синапсов были
сфокусированы на нейромышечных синапсах
— синапсах между двигательными нейронами
и скелетными мышцами, из-за их относительной
доступности и простоты. Они показали,
что формирование синапсов нуждается в
сложном обмене информацией между
нейроном и его мишенью, это делает
возможным взаимное распознавание и
инициирует сигнальные каскады, которые
ведут к дифференцировке и формированию
пресинаптических и постсинаптических
участков мембраны со всем комплексом
структур, необходимых для передачи
импульса возбуждения. Полученная
информация с достоверностью показала,
что принципиальной разницы между
процессами формирования нервномышечных
и центральных синапсов нет. Следовательно
нейромышечные синапсы могут рассматриваться
как хорошая модель синапсов.
Во время развития
аксоны от двигательных нейронов выходят
из спинного мозга и проводятся к своим
мишеням с помощью клеточных и молекулярных
сигналов, которые могут или привлекать
или отталкивать их. Оказавшись в
непосредственно близи к мишени, аксон
замедляет рост и в конечном итоге
останавливается. Кончик аксона
контактирует с мишенью и тем самым
инициируется дифференцировка
пресинаптических окончаний.
Комплекс
последовательных событий запускается
уже при первом контакте врастающего
аксона с растущей мышцей. Когда аксон
впервые достигает мышечной массы,
миобласты всё ещё сливаются вместе,
заканчивая формирование первичных и
вторичных миобибрилл. Одним из наиболее
важных событий, которое следует сразу
после контакта аксона с дифференцирующимся
мышечным волокном, является быстрый
сбор (в течение минут) до этого
диспергированных ацетилхолиновых
рецепторов под формирующимся нервным
окончанием. Эта быстрая агрегация
холинорецепторов является характерной
особенностью образования синапса.
Установлено, что
синаптическая базальная мембрана
содержит в виде различных белков всю
информацию, необходимую для запуска и
управления всеми аспектами образования
синапса. Одним из белков, запускающих
агрегацию холинорецепторов, является
агрин.
Этот белок синтезируется и в мышцах и
нервах, секретируется и проникает в
базальную мембрану. Описано несколько
форм агрина, однако только тот, который
синтезируется в двигательных нейронах
эффективно собирает холинорецепторы
постсинаптической мембраны точно на
вершинах складок постсинаптической
мембраны в непосредственной близости
от места выделения медиатора, так же
собирает в комплексы натриевые каналы,
активирует синтез холинэстеразы.
Уменьшение числа
связей и исчезновение полинейрональной
иннервации
После того как
популяция нейронов, иннервирующих
определенную мишень, уменьшается
благодаря гибели клеток, оставшиеся
нейроны конкурируют друг с другом за
синаптическую территорию. Это
конкурирование обычно приводит к потере
некоторых первично образованных веточек
и синапсов («обрезка»). Уменьшение числа
связей обеспечивает механизм для
формирования правильной и полной
иннервации мишени определенной популяцией
нейронов. В некоторых случаях механизм
уменьшения числа связей также обеспечивает
механизмы коррекции ошибок; в других
случаях он отражает стратегию поиска
пути аксоном.
Особо яркий пример
конкурентного уменьшения числа связей
можно увидеть в развивающейся скелетной
мышце. У взрослых животных каждый
мотонейрон иннервирует группу до 300
мышечных волокон, формируя двигательную
единицу , но каждое мышечное волокно
иннервируется только одним аксоном.
Однако в развивающейся мышце мотонейроны
бурно ветвятся, так что каждое мышечное
волокно в итоге иннервируется аксонами
от нескольких мотонейронов, что называется
полинейрональной иннервацией. В каждом
развивающемся мышечном волокне
синаптические окончания всех аксонов
разбросаны вокруг одного участка, вблизи
скоплений рецепторов АХ и других
компонентов постсинаптического аппарата.
По мере развития веточки аксонов
исчезают, что приводит в конечном итоге
к формированию взрослого паттерна. Этот
процесс не вызывает гибель клетки
(которая обычно происходит на более
ранних стадиях развития), а только
уменьшение количества мышечных волокон,
иннервируемых каждым из мотонейронов.
НЕРВНЫЕ ЦЕНТРЫ
— совокупность
нервных клеток, «ансамбль» нейронов,
которые включаются в регуляцию
определенной функции или в осуществление
конкретного рефлекторного акта.
Свойства нервных
центров мы подробно разберем позднее,
а пока отметим лишь функциональное
значение центров. В нервном центре
происходит интеграция всей
поступающей по афферентным путям
информации, а из центра поступает
команда к действию.
Центры рефлексов
могут быть расположены в любом отделе
ЦНС. В
зависимости от расположения нервных
центров
различают рефлексы СПИНАЛЬНЫЕ — нервные
центры находятся в сегментах спинного
мозга, БУЛЬБАРНЫЕ — в продолговатом
мозге, МЕЗЭНЦЕФАЛЬНЫЕ — в структурах
среднего мозга, КОРТИКАЛЬНЫЕ — в
различных областях коры большого
мозга. Например, одергивание руки при
ожоге – спинальный рефлекс.
В соответствии
с выполняемой функцией
среди нервных центров можно выделить
чувствительные центры, центры вегетативных
функций, двигательные центры. Кроме
того, можно выделить структурно
организованные центры, которые регулируют
определенную функцию: сосудодвигательный
центр, дыхательный центр, центр
слюноотделения. Центры регуляции
вегетативных функций представлены в
таблице 3.
Таблица 3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
30.03.201543.08 Mб39Марк Бирс Руководство по медицине.djvu
- #
- #
- #
- #
- #
- #
- #
Рост аксона
РОСТ
АКСОНА
Конус роста, удлинение аксона и роль актина
Кончик
растущего аксона удлиняется, образуя конус роста. Рамон-и-Кахаль первым
обнаружил, что конус роста является частью аксона, ответственной за навигацию и
удлинение его в направлении конечной цели . Конус роста удлиняется и
сокращается за счет широких пластинок, называемых ламмелиподиями, и тонких,
остроконечных выпячиваний, называемых филоподиями Филоподий достигают размеров
в несколько десятков микрометров и могут удлиняться и сокращаться, как бы
ощупывая субстрат во всех направлениях. Филоподий адгезируют к определенному
субстрату и тянут конус роста в этом направлении.
Актин
играет ключевую роль в подвижности конуса роста (рис. 1) . Как ламеллиподии,
так и филоподий богаты филаментным актином и веществами, ингибирующими
полимеризацию актина, такими как грибной токсин цитохалазин В, обездвиживающий
конусы роста. Выпячивание и ретракция ламеллиподий и филоподий, а также
движение вперед самого конуса роста, скорее всего, управляется двумя
процессами: (1) полимеризацией и разборкой актиновых филаментов и (2) зависимой
от миозина транслокацией актиновых филаментов прочь от ведущего края конуса
роста. Оба процесса используют энергию гидролиза АТФ и могут управляться
белками, связывающими актин. Кальций, протеинкиназы и другие внутриклеточные
вторичные посредники управляют активностью актин-связывающих белков. Например,
остановка роста и ретракция конуса роста, два частых события в процессе роста
аксонов, связаны с входящим током кальция и увеличением частоты кратковременных
повышений концентрации кальция в цитоплазме клетки.
|
Рис. 1. Модель подвижности конусов |
Молекулы адгезии
клетки и внеклеточного матрикса и рост аксона
Молекулы
клеточной адгезии управляют ростом аксона, обеспечивая наиболее благоприятное
окружение для вытягивания конуса роста. Клеточные молекулы адгезии представляют
собой трансмембранные или связанные с мембраной гликопротеины,
характеризующиеся структурными мотивами своих внеклеточных частей, которые во
многом гомологичны постоянным доменам иммуноглобулинов и фибронектина 3 типа
(рис.2). Представителями надсемейства этих иммуноглобулинов (Ig) являются клеточные молекулы адгезии (N-CAM), молекулы адгезии нейроглии САМ
(NgCAM), TAG-1, MAG, и DCC83). Эти молекулы обеспечивают адгезию
клеток друг к другу посредством гетерофильных связей между различными
надсемействами иммуноглобулинов (например, связь между NrCAM и TAG-1).
Дополнительно присутствующей везде молекулой клеточной адгезии является молекула
N-кадгерина (N-cadherin, рис. 2), которая обеспечивает кальций-зависимую
адгезию между клетками.
В
культуре клеток экспрессия N-CAM и N-кадгерина в клетках приводит к их
агрегации, вытягиванию аксонов в сторону клеточных субстратов, но не субстратов
внеклеточного матрикса, а также соединению отдельных растущих аксонов в пучки
(фасцикулы, fascicles). Стимуляция роста аксонов молекулами клеточной адгезии
не обеспечивается просто «липкостью» субстрата; она управляется активацией
рецепторов, связанных с тиро1инкиназой, например рецептора к фактору роста
фибробластов (fibroblast growth factor, FGF).
|
Рис. 2. Два класса молекул адгезии |
Рецептор
FGF включает внутриклеточный каскад, связанный с фосфорилированием тирозина,
что приводит к удлинению аксона. Белковая тирозинфосфатаза, фермент, удаляющий
остатки фосфата с тирозина, также участвует в регулировании этих сигналов. Молекулы
адгезии внеклеточного матрикса, включая ламинин, фибронектин, тенасцин (Л,
цитотактин), а также перлецан, тоже являются благоприятным субстратом для роста
нервных отростков85· 86). Эти гликопротеины с большой
массой имеют две или более сходные субъединицы, удерживаемые вместе благодаря
дисульфидным мостикам (рис. 2). Каждая субъединица характеризуется
повторяющимися структурными мотивами. Белки внеклеточного матрикса
взаимодействуют с клетками через семейство рецепторов, называемых интегринами.
Было идентифицировано большое количество изоформ субъединиц интегрина. Каждая
комбинация приводит к формированию рецепторов с различными свойствами.
Интегрины обеспечивают структурные связи между белками внеклеточного матрикса и
внутриклеточным актиновым цитоскелетом, регулируя форму клетки и ее миграцию.
Кроме того, они активируют внутриклеточные сигнальные пути, которые управляют
ростом клетки, пролиферацией и дифференцировкой.
Исследования при помощи
специальных блокирующих антител показывают, что конусы роста редко используют
только один субстрат для своего движения; несколько типов молекул адгезии
клетки и внеклеточного матрикса могут обеспечивать рост нервных отростков у
определенных типов нейронов. Например, для полного ингибирования роста аксонов
в сторону шванновской клетки необходимо применять одновременно антитела к
Ll/NgCAM, N-кадгерину и интегринам. Один тип антител сам по себе не может
помешать росту аксона.
|
Рис. 3. Белки внеклеточного |
Управление
ростом аксона
Аксоны
нервных клеток могут достигать 1 метра и более в длину, образуя синапсы в
определенном месте на строго определенной клетке в области, где имеется большое
количество других потенциальных клеток-мишеней. Две основные теории, касающиеся
того, каким образом устанавливается такая специфичность в синаптических связях
во время развития, были предложены в первой четверти двадцатого века. Согласно
одной, нейроны и их мишени заранее запрограммированы на образование
определенных синаптических связей. Другая теория считает, что первоначально
связи устанавливаются более или менее случайно, а затем часть из них
реорганизовывается благодаря влияниям на нейроны со стороны клеток-мишеней, в
результате чего происходит устранение ошибочных синапсов и гибель неправильно
соединенных клеток. Экспериментальные доказательства, полученные к настоящему
времени, говорят в пользу того, что рост аксонов и образование синаптических
связей является селективным процессом; аксон направляется строго к своей цели
благодаря определенным сигналам в своем окружении.
Навигация аксона,
зависящая и не зависящая от клетки-мишени
Какие
внеклеточные сигналы управляют конусом роста? Рамон-и-Кахаль сначала предложил
хемоаттрактантную модель управления аксоном, согласно которой конусы роста
аксонов следуют по градиенту концентрации некоторых молекул, вырабатываемых клетками-мишенями.
Такой механизм возможен для роста аксона, когда расстояние между телом нейрона
и его мишенью очень короткое. Например, Лумсден и Дэвис изучали рост аксонов из
ганглия тройничного нерва, расположенного в голове мыши, в соседние эпителиальные
ткани, расстояние до которых составляло менее 1 мм (эти аксоны в конечном счете образовывали сенсорную иннервацию вибрисс, Если развивающийся
ганглий тройничного нерва помещался в культуру вблизи эксплантантов из
нескольких периферических тканей, нервные отростки росли из ганглия в
направлении собственной клетки-мишени, игнорируя другие ткани. Эксплантаты
эпителия ткани-мишени оказывали подобное действие на рост аксонов только в том
случае, если они брались у эмбриона в период становления иннервации.
В
противоположность этому, способность аксонов спинальных мотонейронов расти в
направлении конечностей не зависит от наличия мышечной клетки-мишени. Это было
показано путем удаления в раннем периоде сомита, из которого развивается мускулатура
конечностей. Аксоны мотонейронов направляются нормально из спинного мозга,
врастают в конечность и образуют определенный паттерн мышечных нервов, даже в
отсутствие мышцы. Таким образом, факторы, которые управляют ростом аксонов
мотонейронов к определенной мишени на конечности, не выделяются мышцами, с
которыми аксоны в конечном итоге образуют связи.
|
Рис. 4. Конусы роста периферических |
Синаптические
|
|
Рис. 5. Молекулы внеклеточного |
Все молекулы
адгезии либо способствуют росту, либо нет. Управление ростом аксона на большом
расстоянии включает в себя движение аксона вдоль градиента концентрации
растворимого фактора.
Навигация конусов
роста в спинном мозге
Хороший
пример разнообразия механизмов и молекул, которые используют конусы роста для
навигации к своим клеткам-мишеням, представляют аксоны комиссуральных
интернейронов спинного мозга позвоночных В раннем периоде развития
комиссуралъные интернейроны, которые лежат в дорзальной части спинного мозга,
«выпускают» аксоны, которые начинают расти в вентральном направлении, пересекая
среднюю линию, и затем растут вдоль спинного мозга по направлению к своим
синаптическим мишеням (рис. 6) .
Аксоны комиссуральных
нейронов первоначально привлекаются к вентральной средней линии белком
нетрин-1, растворимым хемоаттрактантом, образуемым специальными клетками
базальной пластинки, лежащими вдоль средней линии спинного мозга (рис. 23.24А)111).
Нетрин-1 взаимодействует с рецептором, экспрессируемым комиссуральными
нейронами, называемым DCC (который уже упоминался ранее из-за своего
взаимодействия с молекулами клеточной адгезии. Существование растворимого
фактора, образующегося в базальной пластинке, который способен привлекать
(attract) аксоны комиссуральных нейронов, было впервые показано при
культивировании кусочков дорзальной части спинного мозга изолированно, либо
вместе с кусочками базальной пластинки (рис. 7). Аксоны
комиссуральных нейронов растут четко по направлению к базальной пластинке, даже
если эксплантаты находятся друг от друга на расстоянии нескольких сотен микрон.
Эта дистанция слишком велика для того, чтобы ее прошел филоподий конуса роста и
требует растворимого фактора. Такой фактор, нетрин-1, входящий в семейство
секреторных белков, характеризуется сходством доменов с N-концевыми доменами 7
цепи ламинина-1 (рис. 7А). Гомологи нетрина также играют роль в росте аксонов у
дрозофилы и С. elegans.
Далее
аксоны комиссурального нейрона пересекают вентральную среднюю линию, что они
делают только однажды, таким образом оставаясь на контралатеральной стороне
(рис. 7В, С). Это пересечение облегчается взаимодействиями между двумя
адгезивными молекулами клеточной поверхности: TAG-1, которая экспрессируется на
поверхности аксона спаечного нейрона, и NrCAM, экспрессируемого на клетках
базальной пластинки. После пересечения средней линии экспрессия TAG-1 в аксонах
ингибируется сигналами от клеток базальной пластинки, под действием которых в
аксонах начинает синтезироваться протеин, называемый robo. Robo представляет
собой рецептор для другого белка, называемого slit, который высвобождается
клетками базальной пластинки. Взаимодействие между slit и robo отталкивает
конусы роста комиссуральных интернейронов. Потеря аттракции к TAG-1—NrCAM
контакту и приобретение коротко-дистантного отталкивающего взаимодействия
slit-robo предупреждают возможное повторное пересечение аксоном средней линии.
|
Рис. 8. Роль нетрина и его рецепторов в аттракции и |
Slit и нетрин-1 также
диффундируют из базальной пластинки для отталкивания конусов роста
мотонейронов. Такие отталкивающие взаимодействия направляют аксоны мотонейронов
прочь от спинного мозга в направлении периферии (рис.6D)
Литература:
1.
McConnell, S. K. 1995. Constructing
the cerebral cortex: Neurogenesis and fate determination. Neuron 15: 761-768.
2.
Mueller, В. К. 1999. Growth cone guidance: First
steps towards a deeper understanding. Annu. Rev. Neurosci. 22: 351-388.
3.
OLeary, D. D., and Wilkinson, D. G. 1999. Eph receptors and heparins
in neural development. Curr. Opin. Neurobiol. 9: 65-73.
4.
Oppenheim, R.W. 1991. Cell death during development of the
nervous system. Annu. Rev. Neurosci. 14: 453-501.