| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
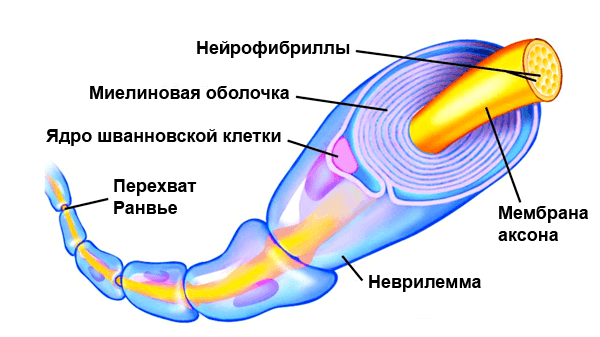
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
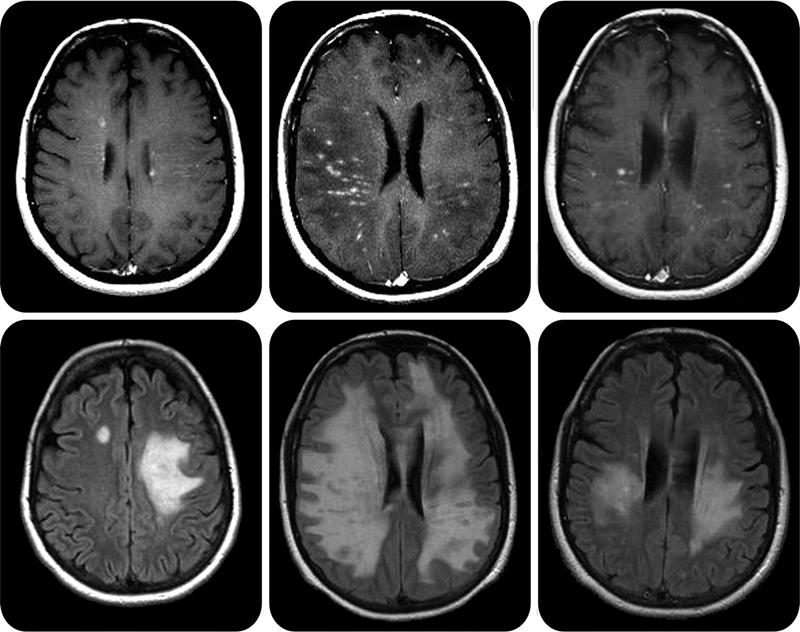
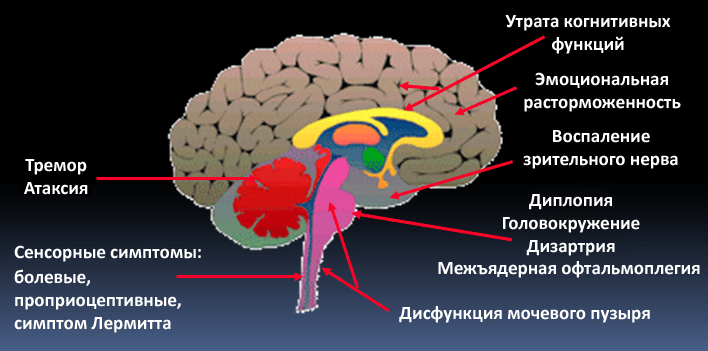
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
Microscopic Anatomy of the Peripheral Nervous System
C.-H. BERTHOLD, … MARTIN RYDMARK, in Peripheral Neuropathy (Fourth Edition), 2005
Axolemma
The axolemma appears as a conventional three-layered unit membrane about 8 nm thick when examined in standard electron microscopic preparations. Freeze-fracturing demonstrates that the outside of the inner leaflet of the axolemma, the so-called P face, is comparatively rich in intramembranous particles (IMPs) (see Fig. 3-12C later). The inside of the outer leaflet, the so called E face, displays, except at nodes of Ranvier (see later), relatively few IMPs.145,272,405 Many E-face IMPs are about 10 nm in size and may represent voltage-sensitive Na+ channels.224,344,404,449 The axolemma conveys signals between the neuron and its Schwann cells that control the proliferative and myelin-producing functions of the Schwann cells and partly regulate axon size.46,49,84,85,171,172,194,239,355,429 The additional presence of receptor and transducer proteins involved in axon–Schwann cell communication has been postulated by several authors.108,109,209,244 The axolemma is stabilized by the immediate subjacent part of the axoplasm, which here forms the axoplasmic cortex (see Fig. 3-10C), an outer condensed part of the cytoskeletal microtrabecular matrix containing ankyrin, fodrin, actin, and A-60.112,151,184,189,192,194,241,335,366,438
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721694917500065
Molecular Specializations at the Glia-Axon Interface
Elior Peles Ph.D., in Multiple Sclerosis As A Neuronal Disease, 2005
III. The Paranodal Junction
These junctions that are formed between the axon and the myelinating cell border the nodes of Ranvier (Fig. 1B). In this region, the compact myelin lamellae open up into a series of cytoplasmic loops that spiral around the axon. These glial loops are closely opposed to the axon; being separated by a gap of only 2.5 to 3 nm, form a series of ridges (transverse bands) that are reminiscent of invertebrate septate junctions (Rosenbluth, 1995). The axoglial junctions appear relatively late during myelination, being first generated closer to the nodes by the most outer paranodal loop, and continue gradually as additional loops are attached to the axon (Tao-Cheng and Rosenbluth, 1983). As a result, they are composed of a number of rings, each representing a turn of the myelin wrap.
A. Molecular Composition
The axonal membrane at the axoglial junction contains a complex of two cell-recognition molecules: Caspr (contactin-associated protein; also known as paranodin) (Einheber et al., 1997; Menegoz et al., 1997) and contactin (Rios et al., 2000) (Fig. 2B). Caspr is a Type I transmembrane protein that belongs to a distinct subgroup of the neurexins, a polymorphic protein family involved in cell adhesion and intercellular communication (Bellen et al., 1998; Missler and Sudhof, 1998). There are five human genes in the Caspr family (Caspr-Caspr5 [Peles et al., 1997; Poliak et al., 1999; Spiegel et al., 2002]), two in Drosophila (nrxIV and axo [Baumgartner et al., 1996; Yuan and Ganetzky, 1999]), and two in C. elegans (itx and nlr; Haklai-Topper and Peles, unpublished observations). These proteins bind several cell adhesion molecules and thus considered as CAM-associated-proteins (acronym CASPR). Their extracellular region consists of several domains implicated in mediating protein-protein interactions, including a discoidin and a fibrinogen-like domain, EGF motifs, and several regions with homology to the G domain of laminin A. Caspr, but not other members of the Caspr family, forms a complex with contactin when both are present in the same cell (i.e., in cis) (Peles et al., 1997). The interaction between Caspr and contactin is required for the efficient export of Caspr from the endoplasmic reticulum to the plasma membrane (Faivre-Sarrailh et al., 2000) and regulates the glycosylation and transport of contactin (Bonnon et al., 2003; Gollan et al., 2003). In accordance with these in vitro findings, Caspr is retained in the neuronal cell bodies and does not reach the axons in contactin-deficient mice (Boyle et al., 2001), while Caspr is necessary to maintain contactin at the paranodes (Bhat et al., 2001; Gollan et al., 2002, 2003).
Both Caspr and contactin are essential for the generation of the axoglial junction, and their absence results in the disappearance of septa and a widening of the space between the axon and the paranodal loops (Bhat et al., 2001; Boyle et al., 2001; Gollan et al., 2003). These results suggest that Caspr and contactin are part of a paranodal adhesion complex required for the tight attachment of the two membranes. This phenotype is similar to two other paranodal mutants: the galactolipids–deficient mice (UDP-galactose ceramide galactosyltransferase, cgt), which do not synthesize galactocerebroside (GalC) and sulfatide, and cerebroside sulfotransferase (cst) null mice, which are lacking only sulfatide (Bosio et al., 1996; Coetzee et al., 1998, 1996; Honke et al., 2002; Ishibashi et al., 2002). In all of these mice mutants, Caspr and contactin are absent from the paranodes (Bhat et al., 2001; Boyle et al., 2001; Dupree et al., 1999; Ishibashi et al., 2002; Poliak et al., 2001). The way in which the absence of GalC and sulfatide causes paranodal abnormalities is not clear, but it may result from direct binding of sulfatide to the Caspr/contactin complex, or misrouting of junctional glial components to noncompact myelin (Schafer et al., 2004).
B. Generation of Molecular Complexes at the PNJ
1. Cytoplasmic Linkage to the Axonal Cytoskeleton
The intracellular regions of Caspr and Caspr2 contain a juxtamembrane sequence that binds protein 4.1B (Denisenko-Nehrbass et al., 2003; Gollan et al., 2002; Menegoz et al., 1997; Peles et al., 1997), which is present at the paranodes and juxtaparanodes (Denisenko-Nehrbass et al., 2003; Ohara et al., 2000; Parra et al., 2000; Poliak et al., 2001). Similar to other 4.1 proteins, 4.1B contains a conserved actin-spectrin-binding domain and thus, could immobilize Caspr (and hence contactin) to the cytoskeleton (Gollan et al., 2002). Consistent with this notion, protein 4.1B is abnormally distributed along peripheral myelinated axons of mice lacking either contactin and galactolipids, both of which lack paranodal Caspr (Gollan et al., 2002; Poliak et al., 2001). In these mutants, the position of protein 4.1B is strongly correlated with those of Caspr and Caspr2, suggesting that they determine its localization. Furthermore, the cytoplasmic tail of Caspr is required for stabilizing the Caspr/contactin complex at the paranodes, as a Caspr mutant lacking this domain is not properly maintained at the axoglial junction (Gollan et al., 2002). Thus, Caspr appears to serve as a transmembrane scaffold that stabilizes the Caspr/contactin adhesion complex at septatelike junctions by connecting it to the axonal cytoskeleton via protein 4.1B.
2. Extracellular Interactions Mediating Axoglial Contact
The intracellular regions of Caspr and the distribution of Caspr and contactin along the internodes (Arroyo et al., 1999; Poliak et al., 2001; Rios et al., 2003) (discussed later), their accumulation at the paranodes as a number of rings that represent each turn of the myelin wrap during development (Pedraza et al., 2001; Rasband et al., 1999; Rios et al., 2000), and the abnormal distribution of Caspr in multiple sclerosis tissue (Wolswijk and Balesar, 2003), as well as in several myelin mutants (Arroyo et al., 2002; Dupree et al., 1999; Ishibashi et al., 2002; Jenkins and Bennett, 2002; Poliak et al., 2001; Rasband et al., 1999), all indicate that the myelin sheath dictates their localization in the axolemma. Furthermore, the addition of a soluble RPTPβ protein that binds contactin to myelinating co-cultures perturbs the paranodal accumulation of Caspr, suggesting that the localization of the Caspr/contactin complex to this site is mediated by its interaction with a glial ligand (Rios et al., 2000). The most likely candidate to serve as a glial ligand of the Caspr/contactin complex is NF155, a glial isoform of the cell adhesion molecule neurofascin, which is located across Caspr and contactin at the axoglial junction (Tait et al., 2000) and is not localized to this site in the absence of Caspr (Bhat et al., 2001; Boyle et al., 2001; Marcus et al., 2002; Poliak et al., 2001). In agreement, it was recently reported that a soluble NF155-Fc chimera binds to cells expressing Caspr and contactin and precipitates these proteins from rat brain lysates, suggesting that NF155 indeed serves as a receptor for the Caspr/contactin complex (Charles et al., 2002). However, it was recently shown that while NF155 binds directly to contactin, Caspr inhibits this interaction, suggesting the existence of other receptors for the Caspr/contactin complex in myelinating glia (Gollan et al., 2003). This conclusion aligns with previous observations that demonstrate that NF155 appears much later than Caspr in the paranodes (Marcus et al., 2002), suggesting that other ligands for the Caspr/contactin complex exist.
3. Functional Aspects of the PNJ
The paranodal junction was proposed to attach the myelin sheath to the axon, to separate the electrical activity at the node of Ranvier from the internodal region under the compact myelin sheath, and to serve as a fence that limits the lateral diffusion of axolemmal proteins (Rosenbluth, 1976). Recent studies using four different paranodal mutant mice (i.e., Caspr, Contactin, cgt, and cst), all of which lack the characteristic septa in their axoglial junction, allowed close examination of these original ideas. In the CNS of these mutants, the paranodal loops are disorganized, with many overlapping and inverted loops that face away from the axon (Bhat et al., 2001; Dupree et al., 1998; Honke et al., 2002). In the PNS, possibly due to the presence of the basal lamina, the morphological alterations are much milder, the paranodes are well organized, but there is an increase in the space between the glial membrane and the axon. Even in the absence of septa, however, the paranodal loops are still closely attached to the axon in many sites in the PNS and CNS, suggesting the presence of yet unidentified paranodal components that mediate axoglial contact at this site. Together with ultrastructural data demonstrating that the transverse bands are generated rather late during myelination (Marcus et al., 2002; Tao-Cheng and Rosenbluth, 1983), these studies suggest a role for the septa in securing the paranodal loops to the axon at the axoglial junction. In agreement, a gradual, age-dependent detachment of the paranodal loops from the axon was observed in the CNS of Caspr-null mice (Rios et al., 2003).
The absence of paranodal septa in all four paranodal mutants results in a reorganization of the axonal membrane (Bhat et al., 2001; Boyle et al., 2001; Dupree et al., 1999; Ishibashi et al., 2002; Poliak et al., 2001). In these mutants, the Shaker-type K+ channels normally present in the juxtaparanodal region are mislocalized to the paranodal axonal membrane (Bhat et al., 2001; Boyle et al., 2001; Dupree et al., 1999; Ishibashi et al., 2002; Poliak et al., 2001). Thus, it appears that the paranodal septate junction functions as a barrier that restricts the movement of K+ channels from under the compact myelin, separating them from the Na+ channels at the nodes. In contrast to the juxtaparanodal K+ channels, disruption of the paranodal septa only minimally affects the distribution of the nodal Na+ channels (Bhat et al., 2001; Boyle et al., 2001; Dupree et al., 1999). There is a small increase in the nodal length, accompanied by a reduction in membrane particles at the nodal axolemma detected by freeze-fracture EM, suggesting that the paranodal septate junction is not required for the generation of the nodes (Bhat et al., 2001; Rios et al., 2003; Rosenbluth et al., 2003). In the CNS, however, glial attachment at the paranodes is required to maintain Na+ clustering at the nodal axolemma (Ishibashi et al., 2002; Rasband et al., 2003a; Rios et al., 2003; Rosenbluth et al., 2003).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127387611500043
The Biological Basis of Diffusion Anisotropy
Christian Beaulieu, in Diffusion MRI (Second Edition), 2014
8.5 Summary
Overall, axonal membranes are shown to be the primary determinant of diffusion anisotropy of water in neural fibers, while myelin can modulate the degree of anisotropy in a given tract. Similar to the non-specific issues that plague much of the rest of quantitative MRI, however, there are a multitude of reasons that could be responsible for an increase or decrease of the degree of diffusion anisotropy in a particular study. The specificity of the interpretation will depend on comparing apples to apples, on the pathological process under study, and on considering multiple, complementary diffusion measures such as the parallel and perpendicular diffusivities, in addition to anisotropy. Nonetheless, quantitative diffusion imaging is useful for identifying abnormal brain regions deemed “normal” on conventional MRI. Many basic and clinical diffusion MRI studies, particularly ones combined with histological comparisons, will continue to provide the foundation for better understanding what these non-invasive water diffusion measurements may reflect at the microstructural level of neural fibers.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123964601000081
Functional Organization of Vertebrate Plasma Membrane
Kae-Jiun Chang, Matthew N. Rasband, in Current Topics in Membranes, 2013
2.2.2 Paranodes
The nodal axolemma is exposed to the external environment without being covered by myelin. Immediately flanking the node are paranodes, where the compact myelin opens to form cytoplasm-containing loops (Fig. 5.1). The glial loop membranes indent and closely attach to the axolemma with a distance of only 2.5–3 nm (Elfvin, 1961; Peters, 1966). The loops are actually a single cytoplasmic collar that forms a spiral wrap around the axon (Arroyo & Scherer, 2000). The intimate neuron–glia interactions at this spiral wrap form a septate-like paranodal junction, which is characterized by electron-dense transverse bands between glial and axonal membranes. The paranodal junction is not a complete seal like a tight junction, but instead forms a narrow, spiral, long passage that makes diffusion of ions and other substances much slower between the nodal extracellular environment and the space between myelin and internodal axolemma (Rosenbluth, 2009). Therefore, paranodal junctions provide high resistance indispensable for the insulating function of myelin.
Freeze-fracture studies of myelinated axons showed that the E face of the axolemma has a high density of intramembranous particles at the node and juxtaparanode that are separated by undulating indentations (paranodes) containing much fewer particles. Thus, the paranodal junction has been proposed to function as a membrane protein diffusion barrier that restricts the position of the nodal particles (presumably Nav channel complexes) between myelin sheaths and separates the juxtaparanodal particles (presumably Kv1 channel complexes, see below) from the nodal ones (Rosenbluth, 1999). Paranodal junctions have characteristic parallel rows of particles in the axolemmal P face and glial P and E faces, which may be related to the transverse bands (Schnapp & Mugnaini, 1978; Wiley & Ellisman, 1980).
The paranodal axoglial junction is formed mainly by three CAMs: glial NF155 (neurofascin 155 kDa isoform) and an axonal complex consisting of Caspr (contactin-associated protein) and contactin (Fig. 5.3; Einheber et al., 1997; Menegoz et al., 1997; Rios et al., 2000; Tait et al., 2000). However, whether the Caspr/contactin complex and NF155 interact directly or indirectly remains controversial (Charles et al., 2002; Gollan, Salomon, Salzer, & Peles, 2003). Knocking out any one of these CAMs disrupts paranodal junctions and delays nerve conduction, but causes no gross defect in myelination (Bhat et al., 2001; Boyle et al., 2001; Pillai et al., 2009; Rosenbluth, Petzold, & Peles, 2012). These mutant mice exhibit severe ataxia, hypomobility, trembling, and limb weakness, similar to myelin mutants. Some mutant strains lacking these proteins die between 2 and 5 weeks of age. In these mutants, the paranodal enrichment of the other two CAMs is impaired, the transverse bands are absent, the axolemmal indentations are absent or reduced, and the distance between the glial loops and axolemma becomes wider. In addition, the nodal length increases, the density of the nodal intramembranous particles decreases, and the juxtaparanodal molecular complexes translocate to paranodes, consistent with the idea that an intact paranodal junction functions as a membrane protein diffusion barrier. In the PNS, the alignment of glial loops toward the axon is relatively preserved, but in the CNS, paranodal loops are often everted and face away from the axon.
The cytoskeletal scaffolds 4.1B, αII spectrin and βII spectrin are present at the cytoplasmic side of the paranodal axolemma (Fig. 5.3; Einheber et al., 2013; Ogawa et al., 2006; Ohara, Yamakawa, Nakayama, & Ohara, 2000). αII spectrin and βII spectrin form a functional tetramer (Bennett & Baines, 2001). 4.1B interacts with Caspr and βII spectrin, and 4.1B and αII/βII spectrins may stabilize each other’s association with the actin cytoskeleton (Bennett & Baines, 2001; Cifuentes-Diaz et al., 2011; Denisenko-Nehrbass et al., 2003; Einheber et al., 2013; Ogawa et al., 2006). The junctional CAM complex may in turn be stabilized through 4.1B and βII spectrin’s interaction with the actin cytoskeleton. This view of the role of these cytoskeletal adaptors is consistent with the observation that in 4.1B knockouts (KOs), some paranodal Caspr immunoreactivity appears attenuated and fragmented. In some instances, proteins normally restricted to juxtaparanodes can be observed in paranodal regions (Buttermore et al., 2011; Cifuentes-Diaz et al., 2011; Duflocq, Chareyre, Giovannini, Couraud, & Davenne, 2011; Einheber et al., 2013). Furthermore, without its 4.1B-binding site, paranodal Caspr clusters are less stable and allow invasion of juxtaparanodal proteins (Horresh, Bar, Kissil, & Peles, 2010). These results suggest that the interaction of Caspr with paranodal cytoskeletal scaffolds may be important for the stabilization of the paranodal domain and its function as a membrane protein diffusion barrier. It will be very interesting to directly test these ideas by analyzing loss-of-function phenotypes in mice lacking axonal αII/βII spectrins.
In addition to the aforementioned paranodal cytoskeletal proteins, AnkB and AnkG have also been described at paranodes (Ogawa et al., 2006; Rasband, Peles, et al., 1999). However, their cellular locations and functions remain poorly understood.
Besides the protein components described earlier, a specialized lipid environment also exists at paranodes. Along with the assembly of Caspr/contactin/NF155 clusters, the paranodal membrane domain acquires a specialized detergent-insoluble property (Schafer, Bansal, Hedstrom, Pfeiffer, & Rasband, 2004). Galactocerebroside and its sulfated derivative sulfatide are highly enriched in myelin preparations of the similar detergent-insoluble property (Lee, 2001). Interestingly, mice lacking CGT (UDP–galactose–ceramide galactosyltransferase, the enzyme that catalyzes production of these two galactolipids) exhibit paranodal abnormalities including the disappearance of transverse bands, disrupted paranodal CAM clusters, and translocation of the juxtaparanodal Kv1 channels into paranodes (Dupree, Girault, & Popko, 1999; Dupree & Popko, 1999; Poliak et al., 2001). Loss of CST (3′-phosphoadenylylsulfate–galactosylceramide 3′-sulfotransferase, the enzyme that catalyzes production of sulfatide) results in similar, but milder, paranodal defects (Honke et al., 2002; Hoshi et al., 2007; Ishibashi et al., 2002). In paranodal mutants with disrupted axon–glia interactions (e.g., Caspr KOs), partitioning of NF155 into the insoluble fractions is attenuated (Ogawa & Rasband, 2009). Altogether, these observations suggest that assembly of the paranodal junctional complex may involve a mutual cooperative recruitment and stabilization of CAMs and special lipid components.
During development, the nodal Nav channel subtypes switch from Nav1.2 to Nav1.6 in the CNS and from Nav1.2/Nav1.6 to Nav1.6 in the PNS (Boiko et al., 2001; Kaplan et al., 2001; Schafer, Custer, Shrager, & Rasband, 2006). However, this switch is impaired in paranodal mutants (Rios et al., 2003; Suzuki et al., 2004), indicating that paranodal neuron–glia interactions play key roles in regulating the expression of distinct Nav channel subtypes at nodes. However, the molecular basis of this regulation remains unknown.
Several other molecules are enriched in the noncompact myelin and therefore also in the paranodal loops. These include CNP (2′,3′-cyclic nucleotide 3′ phosphodiesterase), MAG (myelin-associated glycoprotein), 4.1G, and Necl4 (nectin-like CAM 4) (Ohno et al., 2006; Spiegel et al., 2007; Trapp, Bernier, Andrews, & Colman, 1988; Trapp & Quarles, 1982). However, loss of these proteins causes only mild paranodal phenotypes (Ivanovic et al., 2012; Rasband et al., 2005). Finally, the paranodal loops are interconnected by autotypic tight, gap, and adherens junctions, and the components of these junctions can also be found at paranodal loops (Poliak, Matlis, Ullmer, Scherer, & Peles, 2002; Salzer, 2003).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124170278000052
Electromyography and Nerve Conduction Velocity
Bernard Abrams, in Pain Management, 2007
Nerve Conduction
The cell membrane (axolemma) of a nerve axon separates the intracellular axoplasm from the extracellular fluid.8 The unequal distribution of ions between these fluids produces a potential difference across the cell membrane, with a resting potential of about 70 mV, negative inside with respect to the outside of the cell membrane. When a nerve fiber is stimulated, it causes a change in the membrane potential, and a rapid but brief flow of sodium ions occurs through ionic channels inward across the cell membrane, giving rise to an action potential. The way an action potential is conducted along an axon depends on whether the axon is myelinated or unmyelinated.17 In a myelinated fiber the action potential is regenerated only at the nodes of Ranvier, so that the resulting action potentials “jump” from node to node (salutatory conduction). The velocity of nerve conduction depends on the diameter of a myelinated fiber. Small myelinated fibers may conduct as slowly as 12 m/sec, whereas large motor and sensory fibers conduct at a rate of 50 to 70 m/sec, in humans. In an unmyelinated fiber in a human, the conduction rate is about 2 m/sec.
Several factors influence nerve conduction velocity, other than whether or not the axon is myelinated. Among them are the temperature of the limb,18 the age of the patient (with infants having slowed conduction velocities and older adults having increasingly slowed conduction with age) as well as the height of an individual, which may increase the internodal distances of the nodes of Ranvier.8
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721603346500200
Local Anesthetics
Suzuko Suzuki, … Kai Kuck, in Pharmacology and Physiology for Anesthesia (Second Edition), 2019
Electrophysiology of Neural Conduction
The lipid bilayer of the axonal membrane is relatively impermeable to sodium ions but selectively permeable to potassium ions. The adenosine triphosphate (ATP)-dependent Na+/K+ pump (sodium-potassium adenosine triphosphatase) exports Na+ and imports potassium ions (K+) in a 3 : 2 ratio to maintain a concentration gradient of these ions across the axonal membrane.21 The higher concentration of K+ in the intracellular space and the greater permeability of the membrane to K+ lead to the relative negative electrochemical potential of the cell interior. Resting neural membranes have an electrochemical potential of around −70 mV. When Na+ channels open, sodium ions rush inward down the concentration gradient. Other channels, including Ca2+ and K+ channels, are sensitive to the change in electrical potential and open in response to the depolarization. Neurons are activated by the transduction of chemical, molecular, or thermal stimuli into electrical potential via the influx of cations to raise the electrical potential. The conduction of electrochemical impulses in axons is an all-or-none phenomenon. When the depolarization is strong enough, the stimulus is conducted by sequential depolarization of the neural membrane along the axonal length via the opening of Na+ channels and net inward movement of sodium ions. The sodium ions inside the cell diffuse along the axon in both directions and passively depolarize the adjacent membrane, thereby triggering the opening of additional Na+ channels by reaching their activation threshold potential. Because the upstream region of the membrane is already depolarized and in a refractory state, the electrical impulse can propagate only in an anterograde direction along the axon (Fig. 20.4A). In myelinated axons, the myelin sheath serves as insulation, and this local phenomenon takes place only at the nodes of Ranvier. Therefore the nerve impulse is able to “skip” the length of myelin to the next node (saltatory conduction), making much faster conduction possible (see Fig. 20.4B). As a rule of thumb, three nodes of Ranvier need to be blocked to reliably interrupt impulse propagation.22
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978032348110600020X
The Conduction Properties of Demyelinated and Remyelinated Axons
Kenneth J. Smith Ph.D., Stephen G. Waxman M.D., Ph.D., in Multiple Sclerosis As A Neuronal Disease, 2005
2. Conduction of Pairs of Impulses
The slow conduction along demyelinated axolemma inevitably limits the ability of the axons to transmit pairs (and trains) of impulses because the second action potential of a pair, traveling close behind the first, will run into the relative and absolute refractory periods of the first impulse as this is slowed at the site of demyelination. McDonald and Sears (1970) coined the phrase the refractory period of transmission (RPT) to describe this deficit, defining the RPT as the maximum interval between two conducted impulses such that the second impulse fails to be conducted successfully through the lesion. In a subsequent study of central axons proven to be segmentally demyelinated, the refractory period of the normal portion of the axon was always in the range 0.5 to 1.4 m/sec, but this was prolonged to 1.0 to 6.0 m/sec if the site of demyelination was included in the conduction pathway (Fig. 4). In one axon the RPT was prolonged to 27 m/sec when the lesion was included in the pathway (Felts et al., 1997).
Figure 4. Recordings from a central demyelinated axon either excluding (A) or including (B) the lesioned portion in the conduction pathway. The normal portion of the axon can conduct two closely spaced impulses resulting from electrical stimuli presented 0.77 ms apart (A, third record), but not less than 0.77 ms apart (A, second record). However, the demyelinated portion of the same axon was only able to conduct impulses spaced by more than 1.32 ms (B).
(Reproduced from Felts et al., 1995.)Copyright © 1995
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780127387611500079
Autonomic Neuroplasticity and Regeneration
P.J. Kingham, G. Terenghi, in Encyclopedia of Neuroscience, 2009
Early Responses to Nerve Injury
Nerve injury causes damage to axonal membranes and interrupts the retrograde flow of signals from the normal innervation target. Before the ends can be resealed, Ca2+ enters the axoplasm and activates calcium-dependent proteases such as calpains, leading to extensive cytoskeletal remodeling. This may underlie new growth cone formation and may direct new intra-axonal protein synthesis, preventing the axons from simply withering away. Both myelinated and unmyelinated (sympathetic postganglionic nerves) axons are surrounded by Schwann cells. In the healthy nerve, Schwann cells appear quiescent and their function is tightly regulated by the axon they ensheath. When this interaction is lost, Schwann cells become highly active. Within hours of nerve injury, Schwann cells produce elevated levels of inflammatory cytokines such as tumor necrosis factor α and interleukin-1 which act to attract infiltrating macrophages, T-cells, and neutrophils. Both resident and recruited macrophages are critical for removal of nerve debris, which might impede the regeneration of axons.
Schwann cells proliferate in large numbers at the distal stump, forming a strand of cells called the band of Büngner, which provides an indispensable pathway for guiding regenerating axons to their end target. Perhaps more importantly, the Schwann cells release a number of neurotrophic factors to compensate for the decline occurring as a result of lost contact with the end target. Following nerve injury, Schwann cells produce increased levels of NGF which remain 10- to 15-fold elevated for at least 2 weeks. High levels of NGF are maintained by interactions between Schwann cells and invading macrophages. NGF may subsequently be taken up by the newly forming growth cones at the proximal stump. It is likely that the growth factor is dispersed diffusely in a gradient fashion around regenerating axons and therefore boosts axonal elongation. Brain-derived neurotrophic factor (BDNF) is another growth factor important for the survival of sympathetic neurons. Quiescent Schwann cells contain low levels of BDNF, which is upregulated following axotomy. In contrast to NGF, the response to denervation is slower and peak levels of BDNF are reached weeks following injury. Ciliary neurotrophic factor (CNTF) is a growth factor important for the survival of parasympathetic ciliary ganglion neurons. Schwann cells in intact nerves contain high levels of CNTF. Following injury, the levels decline and are reestablished only upon reinnervation, suggesting that contact with axons is necessary for the synthesis of CNTF in Schwann cells. Studies exploring the downstream targets of CNTF such as signal transducer and activator of transcription-3 (STAT-3) indicate that this could be an important mediator of early responses to nerve injury. Local release of CNTF by denervated Schwann cells activates the CNTF receptor on nearby axons, leading to phosphorylation of STAT-3 and its retrograde transport to the cell bodies of injured neurons. Therefore, the release of neurotrophic factors by Schwann cells at the injury site can help maintain a viable population of neurons which can switch to a growth phenotype, enabling their axons to regenerate across the lesion and back to the periphery.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469006458
Myelin: Molecular Architecture of CNS and PNS Myelin Sheath☆
S.S. Scherer, E.J. Arroyo, in Reference Module in Biomedical Sciences, 2014
Specializations at Juxtaparanodes
By freeze-fracture EM, the axolemma in the region extending 10–15 μm from the paranode contains clusters of five or six particles. The distribution of these juxtaparanodal particles corresponds to the distribution of delayed rectifying K+ channels, likely composed of Shaker-type Kv1.1 and Kv1.2, which mix in varying proportions to form tetramers, the functional channels. The size of the particles (10 nm in diameter) compares well to the expected size of K+ channels. Each Kv1.1 and 1.2 subunit is associated with a Kvβ2 subunit. Although they appear to be concealed under the myelin sheath, juxtaparanodal Kv1.1/Kv1.2 channels are thought to have an important physiological function, dampening the excitability of myelinated fibers. The finding that Kcnac1/Kv1.1 null mice have abnormal impulse generators near the neuromuscular junctions supports this idea. Similarly, mutations in the human KCNAC1 gene cause a form of familial episodic ataxia that is associated with ectopic impulse generators in the distal aspects of motor axons, causing neuromyotonia/neuromyokymia.
Caspr2 and TAG-1 (transiently expressed glycoprotein-1 or contactin-2, an Ig CAM) are also found in the juxtaparanodal axolemma in both the CNS and the PNS. Caspr2 has a similar domain structure to Caspr, especially in the extracellular region; its intracellular C-terminus contains a band 4.1 binding domain, a PDZ binding domain, but not an SH3 domain (Figure 10). Caspr2 co-localizes and even co-immunoprecipitates with Kv1.1 and Kv1.2, perhaps because they all bind to a common PDZ protein. Although PSD-93/-95, and the metalloproteinase ADAM22, are localized to juxtaparanodes,Caspr2, Kv1.1, Kv1.2, and Kvβ2 are not mislocalized in mice that lack either PSD-93/-95 or ADAM22. Rather, cis interactions of Caspr2 with homodimers of TAG-1, may localize the complex of Caspr2/Kv1.1/Kv1.2/Kvβ2 to juxtaparanodes, because TAG-1 can form homodimers with TAG-1 on the adaxonal membrane of the myelin sheath (Figure 10). In keeping with this model, Kv1.1 and Kv1.2 are mislocalized in mice that lack either TAG-1 or Caspr2, but not in mice that lack Kv1.1, Kv1.2, or Kvβ2.
The adaxonal Schwann cell membrane in the juxtaparanodal region contains hexamers (12 nm in diameter), shown by freeze-fracture EM. These particles have the appearance of hemichannels and are composed of Cx29. The importance of these putative hemichannels is unknown, because the myelinated axons in cx29 null mice appear normal, and how such hemichannels might function is a matter of speculation. Because TAG-1 and Cx29 are unlikely to interact directly, there must be other proteins that mediate this interaction (Figure 10).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383046766
Peripheral Nerve Disorders
Grahame J. Kidd, … Bruce D. Trapp, in Handbook of Clinical Neurology, 2013
Axoglial septate-like junctions
By EM, the paranodal membrane that apposes the axolemma is separated from it by a constant distance of 2.5−3.0 nm (Peters et al., 1991). Evenly spaced densities appear to connect paranodal loops and axons. Originally referred to as transverse bands, these densities represent septate-like junctions and are the major adhesive apparatus between myelin and axons. As illustrated in Fig. 5.6C, the axoglial septate-like junction includes the axonal membrane proteins, contactin, and contactin-associated protein (Caspr), which are enriched in paranodal axolemma in both the CNS and PNS (Einheber et al., 1997; Menegoz et al., 1997; Rios et al., 2000). They function as heterodimers that may be assembled prior to insertion in the axolemma. Paranodal loop membranes contain an isoform of neurofascin, NF155, which co-localizes with and binds to contactin and Caspr (Tait et al., 2000; Charles et al., 2002). Homologs of these proteins are associated with septate junctions in invertebrates and axoglial junctions are abnormal or missing in Caspr- and contactin-null mice (Bhat et al., 2001; Boyle et al., 2001). Clustering of nodal Na+ channels is not grossly altered in contactin-null mice. Shaker type Kv1.1 and Kv1.2 potassium channels, which are enriched in the juxtaparanodal axolemma and excluded from paranodal axolemma in wild-type mice, are detected in paranodal axolemma in mice deficient in Caspr (Bhat et al., 2001), or contactin (Boyle et al., 2001). The paranodal axoglial junction therefore appears to play a role in spatially separating Na+ and K+ channel distribution at the node of Ranvier. Extracellularly, the spiral length of the extracellular paranodal compartment makes it a pathway of high resistance to solute diffusion, but some passage of small molecules occurs along this pathway (Mackenzie et al., 1984).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444529022000059
Мембрана — аксон
Cтраница 1
Мембрана аксона имеет сопротивление 1000 Ом — см2, ее емкость равна 1 мкФ / см2, что соответствует бимолекулярному липидному слою толщиной 50 А с диэлектрической проницаемостью е5 и удельным сопротивлением 2 — Ю9 Ом — см. Во время генерации импульса проводимость мембраны увеличивается примерно в 1000 раз. Рисунок изображает лишь один элемент мембраны, и следует представить себе длинную линейную последовательность таких элементов, моделирующих непрерывный кабель. Сопротивление R характеризует аксоплазму, наружный раствор имеется в большом избытке и изображается проводником без сопротивления. Y ответственна за движение других ионов, не изменяющееся при возбуждении.
[1]
При изучении мембраны аксона методом электронной микроскопии практически нет возможности обнаружить какие-либо компоненты, участвующие в потенциале действия. При средней плотности 50 каналов на 1 мкм2 на каждый канал приходится тысячи других белков и более миллиона липидных молекул. На электронных микрофотографиях видна необычная трнлами-нарная структура толщиной — 8 5 нм.
[3]
Вольт-амперная характеристика мембраны аксона своеобразна. Это следствие зависимости Na — и К-проводимости от потенциала на мембране.
[4]
Миелии защищает мембрану аксона от окружающей среды.
[5]
Если подвести к мембране аксона ток, деполяризующий ее до порогового уровня, то натриевые каналы откроются и начнут пропускать в клетку ионы Na, произойдет дальнейшая местная деполяризация и в результате возникнет потенциал действия. В результате перехода внутрь большого количества ионов Na в аксоне возникнут продольные токи, деполяризующие соседние участки мембраны, подобно тому как это происходило при пропускании тока с помощью микроэлектрода в условиях пассивного распространения. Но теперь деполяризация смежных участков мембраны достигает такой величины, что возбуждает и их до порогового значения, и здесь в свою очередь возникает потенциал действия. Этот процесс распространяется вдоль аксона наподобие того, как бежит огонь по бикфордову шнуру, со скоростью от 1 до 100 м / с, в зависимости от типа аксона.
[6]
Установлено, что в мембранах аксонов и мышечных клеток имеются три отдельных транспортных системы — Na 1 -, К 1 — и Са2 — каналы, Свойства их сходны друг с другом, что дает основания полагать, что эти каналы возникли в результате эволюции одной исходной системы.
[7]
Прохождение импульса определяется изменением состояния мембраны аксона при ее стимуляции. Как уже говорилось, в состоянии покоя клеточной мембраны в результате активного транспорта ионов концентрация ионов К в цитоплазме ( аксо-плазме) значительно превосходит их концентрацию во внешней среде, а для ионов Na ситуация противоположна В табл. 4.2 [3] приведен состав аксоплазмы аксонов Loligo и состав плазмы крови, характерный для внешней среды, и близкий к нему состав морской воды.
[9]
Прохождение импульса определяется изменением состояния мембраны аксона при ее стимуляции.
[11]
ТТХ действует только на внешней стороне мембраны аксона.
[12]
Каким же образом ионы переносятся через мембрану аксона ( ср.
[13]
Опыт показывает, что при изменении проводимости мембраны аксона, при ее возбуждении, действительно происходят структурные изменения. Свойства отдельных каналов изучены Ермишкиным.
[15]
Страницы:
1
2
3
4
Очень часто при описании нервной системы используются «электрические» термины: например, нервы сравниваются с проводами. Это потому, что по нервному волокну действительно перемещается электрический сигнал. Каждому из нас известно, что оголенный провод опасен, ведь он бьет током, и по этой причине люди пользуются изоляционными материалами, не проводящими электричество. Природе тоже не чужда техника безопасности, и нервные «провода» она обматывает своим собственным изолирующим материалом — миелином.
Сложная обёртка
Миелин окружает отростки нервных клеток, изолируя их от внешнего воздействия. Это необходимо для более надежной и быстрой передачи сигнала по нервной системе. Благодаря изоляции нервного волокна электрический сигнал не рассеивается и добирается до места назначения без помех. Скорость прохождения сигнала по миелиновым и безмиелиновым волокнам может отличаться на три порядка: от 70 до 140 м/с и от 0,3 до 0,5 м/с соответственно.
По сути миелин — это клеточная мембрана глиальных клеток, многократно обмотанная вокруг аксона. Сама мембрана на 70–75% состоит из липидов и на 25–30% — из белков. В периферической нервной системе донором мембран становятся шванновские клетки, а в центральной — олигодендроциты. Эти клетки бережно обматывают своими мембранами ценные каналы связи, чтобы обеспечить надежное взаимодействие нервной системы и периферических органов. Миелин покрывает нервное волокно не целиком: существуют промежутки между наслоениями миелина, называемые перехватами Ранвье (рис. 1). Есть прямая зависимость между расстоянием от одного промежутка до другого и скоростью распространения нервного импульса по волокну: чем больше расстояние между перехватами Ранвье, тем выше скорость передачи сигнала в нерве [1].
Рисунок 1. Нервное волокно, обернутое миелином. Видны ядра шванновских клеток (nucleus of Schwann cell) и перехваты Ранвье (nodes of Ranvier) — участки аксона, которые не покрыты миелиновой оболочкой.
Если говорить о белках, входящих в состав миелина, то надо уточнить, что это не только простые белки. В миелине встречаются гликопротеины — белки, к которым присоединены короткие углеводные последовательности. Важной составляющей миелина является главный структурный белок миелина (myelin basic protein, MBP), впервые выделенный около 50 лет назад. MBP — это трансмембранный белок, который может многократно «прошивать» липидный слой клетки. Его различные изоформы (рис. 2) кодируются геном под названием Golli (gene in the oligodendrocyte lineage). Структурной основой миелина служит изоформа массой 18,5 килодальтон [2].
Рисунок 2. Различные изоформы основного белка миелина (MBP) создаются на основе одного и того же гена. Например, для синтеза изоформы массой 18,5 кДа используются все экзоны, кроме экзона II.
В состав миелина входят сложные липиды цереброзиды. Они представляют собой аминоспирт сфингозин, соединенный с жирной кислотой и остатком углевода. В синтезе липидов миелина принимают участие пероксисомы олигодендроцитов. Пероксисомы — это липидные пузырьки с различными ферментами (в общей сложности известно около 50 видов пероксисомных энзимов). Эти органеллы занимаются, в частности, β-окислением жирных кислот: жирных кислот с очень длинной цепью (very long chain fatty acids, VLCFA), некоторых эйкозаноидов и полиненасыщенных жирных кислот (ПНЖК, polyunsaturated fatty acids, PUFAs). Поскольку миелин может содержать до 70% липидов, пероксисомы крайне важны для нормального метаболизма этого вещества. Они используют N-ацетиласпартат, вырабатываемый нервной клеткой, для постоянного синтеза новых липидов миелина и поддержания его существования. Кроме этого, пероксисомы принимают участие в поддержании энергетического метаболизма аксонов [3].
Важная обёртка
Миелинизация (постепенная изоляция нервных волокон миелином) начинается у людей уже в эмбриональном периоде развития. Первыми этот путь проходят подкорковые структуры. В течение первого года жизни происходит миелинизация отделов периферической и центральной нервной системы, отвечающих за двигательную активность. Миелинизация участков головного мозга, регулирующих высшую нервную деятельность, заканчивается к 12–13 годам. Из этого видно, что миелинизация тесно связана со способностью отделов нервной системы осуществлять специфические для них функции. Вероятно, именно активная работа волокон до рождения запускает их миелинизацию.
Дифференцировка клеток — предшественниц олигодендроцитов зависит от ряда факторов, связанных с работой нейронов. В частности, работающие отростки нейронов могут выделять белок нейролигин 3, который способствует пролиферации и дифференциации клеток-предшественниц [4]. В дальнейшем созревание олигодендроцитов происходит за счет ряда других факторов. В статье с характерным названием «Насколько велик миелинизирующий оркестр?» описывается происхождение олигодендроцитов в разных частях мозга [5]. Во-первых, в различных частях мозга олигодендроциты начинают созревать в разное время. Во-вторых, за их созревание отвечают разные клеточные факторы, что тоже зависит от региона нервной системы (рис. 3). У нас может возникнуть вопрос: а сходны ли между собой олигодендроциты, появившиеся с таким расхождением в стартовых данных? И насколько схож у них миелин? В целом, авторы статьи считают, что между популяциями олигодендроцитов из разных участков головного мозга действительно существуют различия, и обусловлены они во многом именно местом закладки клеток, воздействием на них окружающих нейронов. И всё же типы миелина, синтезируемые разными пулами олигодендроцитов, не имеют настолько больших отличий, чтобы они не были взаимозаменяемыми.
Рисунок 3. Различия во времени закладки олигодендроцитов в разных отделах головного мозга и в клеточных факторах, влияющих на их развитие.
Сам процесс миелинизации нервных волокон в центральной нервной системе происходит следующим образом (рис. 4). Олигодендроциты выпускают несколько отростков к аксонам разных нейронов. Входя с ними в контакт, отростки олигодендроцитов начинают оборачиваться вокруг них и расползаться по длине аксона. Количество оборотов постепенно увеличивается: в некоторых участках ЦНС их число доходит до 50. Мембраны олигодендроцитов становятся всё более тонкими, распространяясь по поверхности аксона и «выдавливая» из себя цитоплазму. Чем раньше слой миелина был обернут вокруг нервного окончания, тем более тонким он будет. Самый внутренний слой мембраны остается довольно толстым — для осуществления метаболической функции. Новые слои миелина наматываются поверх старых, перекрывая их так, как показано на рисунке 4 — не только сверху, но и увеличивая площадь аксона, покрытую миелином.
Рисунок 4. Миелинизация нервного волокна. Мембрана олигодендроцита наматывается на аксон, постепенно уплотняясь с каждым оборотом. Внутренний, прилегающий к аксону слой мембраны остается относительно толстым, что необходимо для выполнения метаболической функции. На разных частях рисунка (а-в) с разных ракурсов показано постепенное наматывание новых слоев миелина на аксон. Красным цветом выделен более толстый, метаболически активный слой, синим — новые уплотняющиеся слои. Внутренний слой миелина (inner tongue на части б) охватывается всё новыми и новыми слоями мембраны не только сверху, но и по бокам (в), вдоль аксона.
Миелинизация нервных волокон олигодендроцитами также значимо зависит от белка нейрегулина 1. Если он не воздействует на олигодендроциты, то в них запускается программа миелинизации, не учитывающая активность нервной клетки. Если же олигодендроциты получили сигнал от нейрегулина 1, то далее они начнут ориентироваться на работу аксона, и миелинизация будет зависеть от интенсивности выработки глутамата и активации им специфических NMDA-рецепторов на поверхности олигодендроцитов [6]. Нейрегулин 1 — ключевой фактор для запуска процессов миелинизации и в случае шванновских клеток [7].
Изменчивая обёртка
Миелин постоянно образуется и разрушается в человеческом организме. На синтез и распад миелина могут влиять факторы, связанные с особенностями внешней среды. Например, воспитание. С 1965 по 1989 год Румынией руководил Николае Чаушеску. Он установил жесткий контроль над репродуктивным здоровьем и институтом брака в своей стране: усложнил процедуру развода, запретил аборты и ввел ряд стимулов и льгот для женщин, имевших более пяти детей. Итогом этих мер стало ожидаемое повышение рождаемости. Вместе с рождаемостью увеличилось количество криминальных абортов, не добавивших здоровья румынкам, и возросло количество детей-отказников. Последние воспитывались в детских домах, где с ними не очень-то активно общался персонал. Румынские дети в полной мере ощутили на себе то, что называется социальной депривацией — лишение возможности полноценного общения с другими людьми. Если речь идет о маленьком ребенке, то следствиями социальной депривации станут нарушение формирования эмоциональных привязанностей и расстройство внимания. Когда режим Чаушеску пал, западным ученым предстояло в полной мере оценить результат социальной политики этого диктатора. Румынских детей, имеющих выраженные проблемы со вниманием и установкой социальных контактов, впоследствии стали называть детьми Чаушеску.
Кроме различий при выполнении нейропсихологических тестов, у детей Чаушеску по сравнению с детьми, не находившимися в таких условиях, отличалось даже строение головного мозга [8]. При оценке состояния белого вещества мозга ученые используют показатель фрактальной анизотропии. Он позволяет оценить плотность нервных волокон, диаметр аксонов и их миелинизацию. Чем больше фрактальная анизотропия, тем разнообразнее волокна, которые встречаются в этой области мозга. У детей Чаушеску отмечалось снижение фрактальной анизотропии в пучке белого вещества, соединяющего височную и лобную доли в левом полушарии, то есть связи в этом регионе были недостаточно сложными и разнообразными, с нарушениями миелинизации. Такое состояние связей мешает нормальному проведению сигналов между височной и лобной долями. В височной доле находятся центры эмоционального реагирования (миндалина, гиппокамп), а орбитофронтальная кора лобной доли также связана с эмоциями и принятием решений. Нарушение формирования связей между этими отделами мозга и проблемы в их работе в итоге приводили к тому, что выросшие в детдомах дети испытывали трудности в установлении нормальных отношений с другими людьми.
На миелинизацию также может влиять и состав еды, которую дают ребенку. При белково-энергетической недостаточности питания отмечается снижение образования миелина. Недостаток жирных кислот тоже отрицательно сказывается на синтезе этого ценного вещества, так как оно больше чем на 2/3 состоит из липидов. Дефицит железа, йода и витаминов группы В приводит к снижению образования миелина [9]. В основном эти данные были получены при изучении лабораторных животных, но история, к сожалению, дала людям возможность оценить влияние недостатка еды и на формирующийся мозг ребенка [10]. Голодная зима (голл. hongerwinter) 1944–1945 гг. в Нидерландах привела к тому, что родилось множество детей, чьи матери плохо питались. Оказалось, что в условиях голодания мозг этих детей формировался с нарушениями. В частности, наблюдалось большое количество нарушений именно в белом веществе, то есть возникали проблемы с формированием миелина. В итоге это приводило к разнообразным психическим расстройствам.
Поврежденная обёртка
Рисунок 5. Нарушение чувствительности по полиневритическому типу. Название «носки — перчатки» связано с тем, что анатомические зоны, соответствующие поражению нервов, похожи на области, покрываемые этими предметами одежды.
Как мне кажется, для человеческого организма вполне подходит следующее правило: если есть орган, значит, к нему должна быть болезнь. В принципе, это правило можно расширить до молекулярных процессов: есть процесс — есть и болезни, связанные с нарушением этого процесса. В случае с миелином это демиелинизирующие заболевания. Их довольно много, но подробнее я расскажу о двух — синдроме Гийена-Барре и рассеянном склерозе. При этих расстройствах повреждение миелина приводит к нарушению адекватного проведения сигнала по нервам, что и обуславливает симптомы болезни.
Синдром Гийена-Барре (СГБ) — это заболевание периферической нервной системы, при котором происходит разрушение миелиновой оболочки, формируемой шванновскими клетками. СГБ является классическим аутоиммунным заболеванием. Как правило, ему предшествует инфекция (часто — вызванная микробом Campylobacter jejuni). Присутствие различных возбудителей в организме человека запускает аутоиммунное повреждение миелина нервных волокон T- и B-лимфоцитами. Клинически это проявляется мышечной слабостью, нарушением чувствительности по типу «носки — перчатки» (полиневритический тип) (рис. 5). В дальнейшем мышечная слабость может нарастать вплоть до полного паралича конечностей и поражения туловищной мускулатуры. Поражения чувствительной нервной системы также могут быть разнообразны: от снижения способности различать собственные движения (нарушение глубокой чувствительности) до выраженного болевого синдрома. При тяжелых формах СГБ главную опасность представляет потеря способности к самостоятельному дыханию, требующая подключения к аппарату искусственной вентиляции легких (ИВЛ). Для лечения СГБ в настоящее время используют плазмаферез (очистку плазмы от вредных антител) и внутривенные вливания препаратов человеческого иммуноглобулина для нормализации иммунного ответа. В большинстве случаев лечение приводит к стойкому выздоровлению.
Рассеянный склероз (РС) заметно отличается от СГБ. Во-первых, это демиелинизирующее заболевание приводит к поражению центральной нервной системы, то есть затрагивает миелин, синтезируемый олигодендроцитами. Во-вторых, с причинами РС до сих пор много неясного: слишком большое разнообразие генетических и средовых факторов задействовано в патогенезе заболевания. Принципиальный момент в запуске РС — нарушение непроницаемости гематоэнцефалического барьера (ГЭБ) для иммунных клеток. В норме ткань мозга отгорожена от всего остального организма этим надежным фильтром, который не пропускает к ней множество веществ и клеток, в том числе иммунных. ГЭБ появляется уже в эмбриональном периоде развития, изолируя ткань мозга от формирующейся иммунной системы. В это время иммунная система человека «знакомится» со всеми существующими тканями, чтобы в дальнейшем, при взрослой жизни, не нападать на них. Мозг и ряд других органов остаются «не представленными» иммунной системе. При нарушении целостности ГЭБ иммунные клетки получают возможность для атаки незнакомых ей тканей мозга. В-третьих, РС отличается более тяжелыми симптомами, которые требуют других терапевтических подходов. Симптоматика зависит от того, где локализуются повреждения нервной системы (рис. 6 и 7). Это может быть шаткость походки, нарушения чувствительности, различные когнитивные симптомы. Для лечения РС используются высокие дозы глюкокортикоидов и цитостатики, а также препараты интерферона и специфические антитела (натализумаб). По-видимому, в дальнейшем будут развиваться новые методы лечения РС, основанные непосредственно на восстановлении миелиновой оболочки в поврежденных участках мозга. Ученые указывают на возможность трансплантации клеток — предшественниц олигодендроцитов или усиления их роста за счет введения инсулиноподобного фактора роста или тиреоидных гормонов [11]. Однако это еще впереди, а пока неврологам недоступны более «молекулярные» методы лечения.
Рисунок 6. Очаги поражения центральной нервной системы при рассеянном склерозе на МРТ выглядят как белые бляшки.
Рисунок 7. В зависимости от места поражения нервной системы при рассеянном склерозе может быть разная симптоматика: от тремора и атаксии при повреждении мозжечка до эмоциональных расстройств при локализации очагов в лобных долях.
- Wu L.M., Williams A., Delaney A., Sherman D.L., Brophy P.J. (2012). Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum. Curr. Biol. 22, 1957–1961;
- Harauz G. and Boggs J.M. (2013). Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms. J. Neurochem. 125, 334–361;
- Kassmann C.M. (2014). Myelin peroxisomes — essential organelles for the maintenance of white matter in the nervous system. Biochemie. 98, 111–118;
- Venkatesh H.S., Johung T.B., Caretti V., Noll A., Tang Y., Nagaraja S. et al. (2015). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell. 161, 803–816;
- Tomassy G.S. and Fossati V. (2014). How big is the myelinating orchestra? Cellular diversity within the oligodendrocyte lineage: facts and hypotheses. Front. Cell Neurosci. 8, 201;
- Michalski J.-P. and Kothary R. (2015). Oligodendrocytes in a nutshell. Front. Cell Neurosci. 9, 340;
- Salzer J.L. (2012). Axonal regulation of Schwann cell ensheathment and myelination. J. Peripher. Nerv. Syst. 17, 14–19;
- Eluvathingal T.J., Chugani H.T., Behen M.E., Juhász C., Muzik O., Maqbool M. et al. (2006). Abnormal brain connectivity in children after early severe socioemotional deprivation: a diffusion tensor imaging study. Pediatrics. 117, 2093–2100;
- Prado E.L. and Dewey K.G. (2014). Nutrition and brain development in early life. Nutr. Rev. 72, 267–284;
- Hulshoff Pol H.E., Hoek H.W., Susser E., Brown A.S., Dingemans A., Schnack H.G. et al. (2000). Prenatal exposure to famine and brain morphology in schizophrenia. Am. J. Psychiatry. 157, 1170–1172;
- Bhatt A., Fan L.W., Pang Y. (2014). Strategies for myelin regeneration: lessons learned from development. Neural. Regen. Res. 9, 1347–1350.
Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
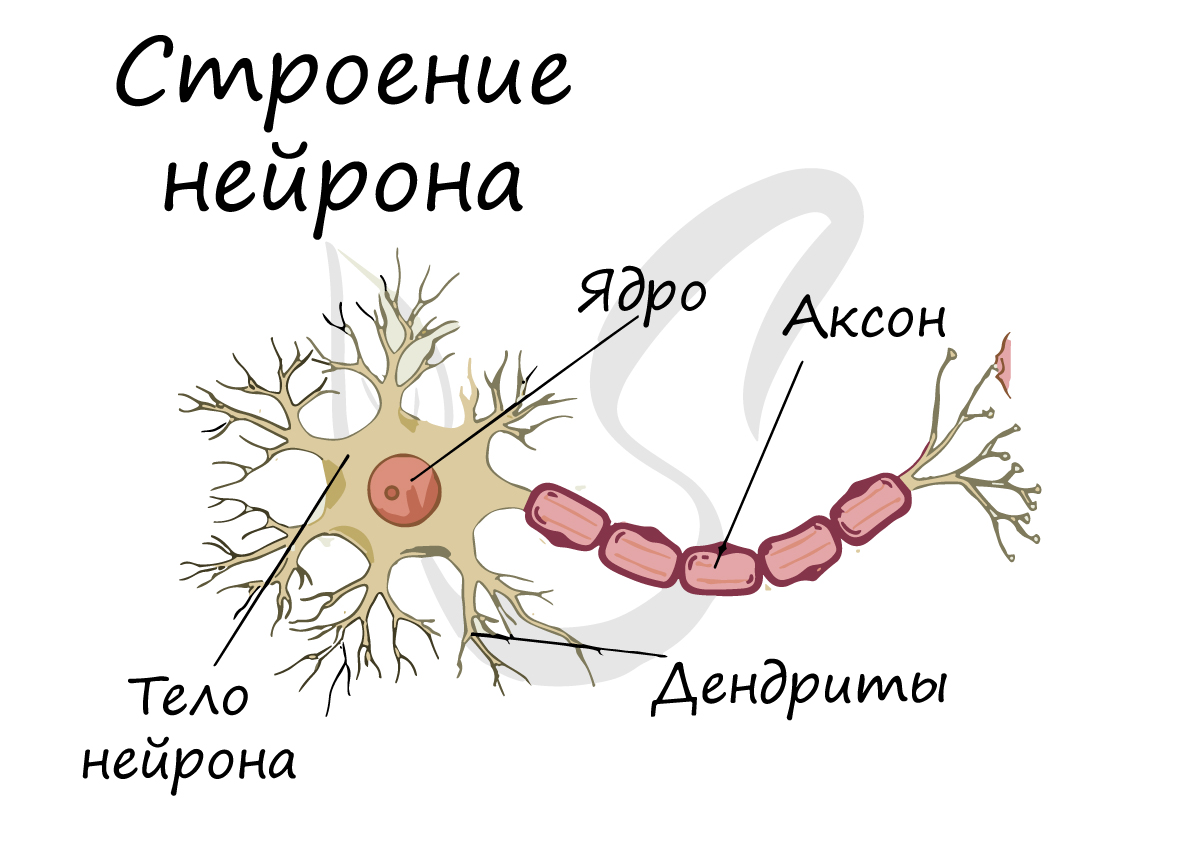
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
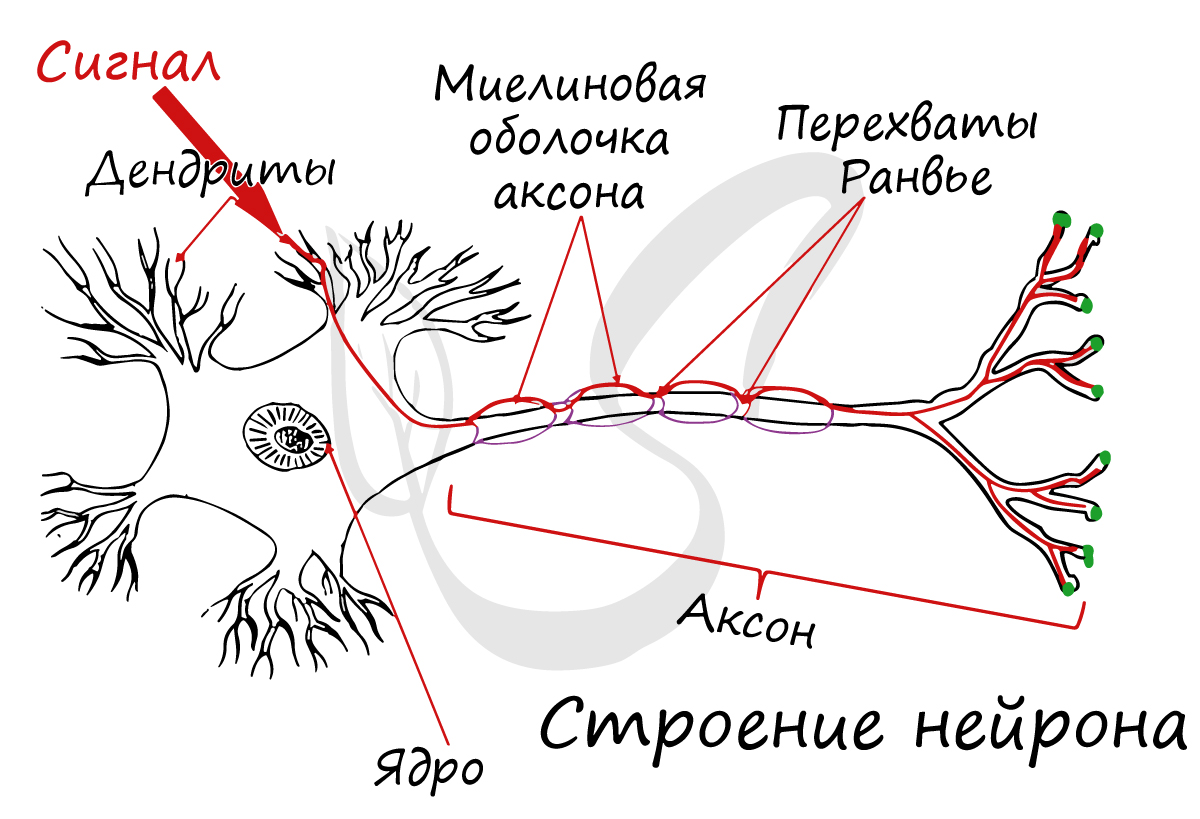
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
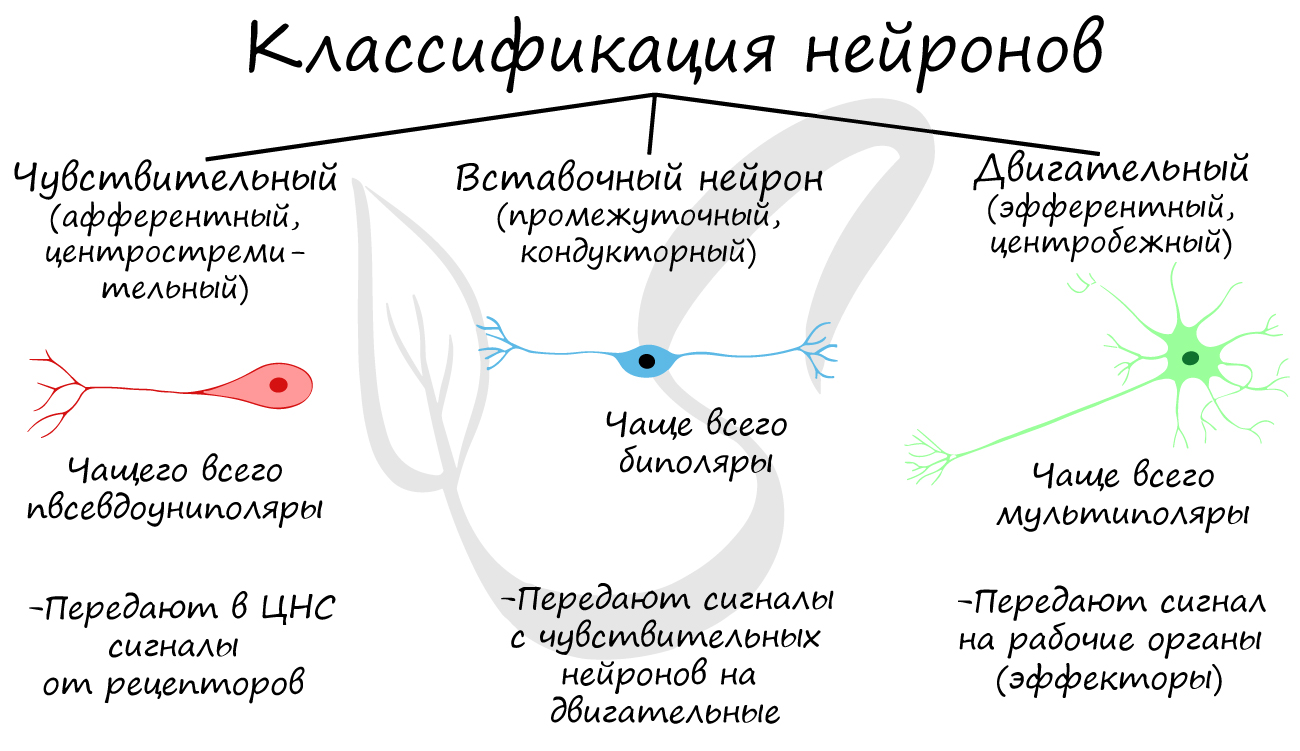
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
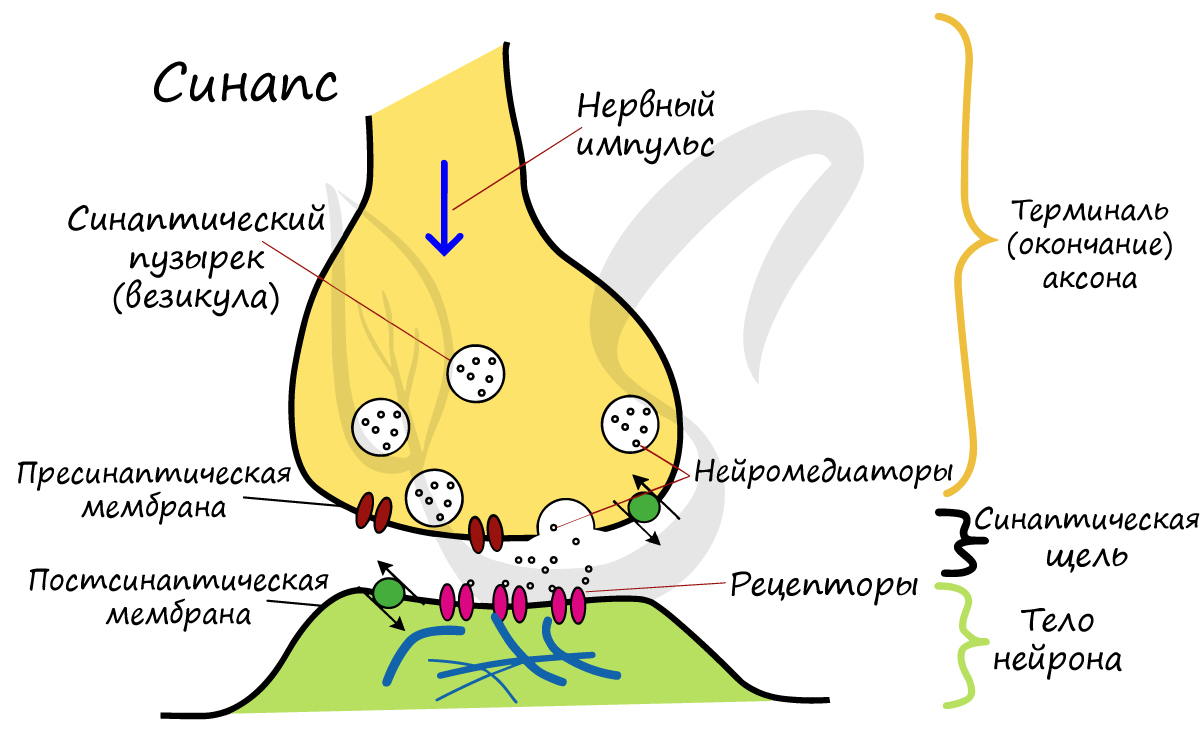
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Аксон
-
Аксон (др.-греч. ἄξων «ось») — это нейрит (длинный цилиндрический отросток нервной клетки), по которому нервные импульсы идут от тела клетки (сомы) к иннервируемым органам и другим нервным клеткам.
Каждый нейрон состоит из одного аксона, тела (перикариона) и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные или мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону, а затем сгенерированный потенциал действия от начального сегмента аксона передаётся назад к дендритам. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС).
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок терминали, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.
Источник: Википедия
Связанные понятия
Си́напс (греч. σύναψις, от συνάπτειν — соединение, связь) — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторной клеткой. Служит для передачи нервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Передача импульсов осуществляется химическим путём с помощью медиаторов или электрическим путём, посредством прохождения ионов из одной клетки в другую.
Нейро́н, или невро́н (от др.-греч. νεῦρον — волокно, нерв) — структурно-функциональная единица нервной системы. Нейрон — электрически возбудимая клетка, которая обрабатывает, хранит и передает информацию с помощью электрических и химических сигналов. Нейрон имеет сложное строение и узкую специализацию. Клетка содержит ядро, тело клетки и отростки (дендриты и аксоны). В головном мозге человека насчитывается около 90—95 миллиардов нейронов. Нейроны могут соединяться один с другим, формируя биологические…
Дендрит (от греч. δένδρον (dendron) — дерево) — разветвлённый отросток нейрона, который получает информацию через химические (или электрические) синапсы от аксонов (или дендритов и сомы) других нейронов и передаёт её через электрический сигнал телу нейрона (перикариону), из которого вырастает. Термин «дендрит» ввёл в научный оборот швейцарский ученый В. Гис в 1889 году.
Миелин (в некоторых изданиях употребляется некорректная теперь форма миэлин) — вещество, образующее миелиновую оболочку нервных волокон.
Вставочный нейрон (синонимы: интернейрон, промежуточный нейрон; англ. interneuron, relay neuron, association neuron, bipolar neuron) — нейрон, связанный только с другими нейронами, в отличие от двигательных нейронов, иннервирующих мышечные волокна, и сенсорных нейронов, преобразующих стимулы из внешней среды в электрические сигналы.
Упоминания в литературе
Аксон — длинное нервное волокно, отходящее от тела некоторых нейронов и заканчивающееся терминалями (до нескольких сотен) на клетках-мишенях: нейронах, миоцитах, клетках железы и др. В зависимости от наличия или отсутствия аксона выделяют нейроны I и II типа. Область тела нейрона, которой начинается аксон, называют начальным сегментом аксон, или аксонным холмиком. Мембрана аксонного холмика генерирует потенциалы действия (нервные импульсы), распространяющиеся по аксону. Некоторые аксоны покрыты прерывистыми цепочками миелиновых оболочек (муфт) и называются миелинизированными (волокна спинномозговых нервов). Аксоны, свободные от миелина, называются немиелинизированными (волокна вегетативных нервов). Между муфтами имеются промежутки – перехваты Ранвье. В участках, лишенных миелиновой оболочки, мембрана аксона контактирует непосредственно с внеклеточной средой. В ЦНС миелиновые муфты образованы глиальными клетками, олигодендритами. Миелиновые муфты аксонов, выходящих за пределы ЦНС (периферических волокон), образованы шванновскими клетками. Одна шванновская клетка может образовывать муфты, покрывая до девяти нервных волокон. Главная функция аксонов – передача нервных импульсов от тела нейрона к терминалям, которые заканчиваются на клетках-мишенях утолщениями, синаптическими бляшками. Скорость движения информации по аксонам составляет от нескольких миллиметров в секунду в мелких немиелинизированных волокнах до 90 м/с в крупных миелинизированных. Миелиновая оболочка увеличивает скорость передачи потенциалов действия по аксону.
НЕЙРО́Н, нервная клетка; основная структурная и функциональная единица нервной системы. Нейроны обладают особыми свойствами – возбудимостью и проводимостью. Из нейронов построена нервная ткань. Как и другие клетки, нейрон имеет ядро, цитоплазму и клеточную мембрану. Ядро содержится в теле нейрона (его расширенная часть), от которого отходят отростки – короткие (дендриты) и один длинный (аксон). Длина аксона может достигать 1 м и более. Аксоны образуют тяжки, которые называются нервами (наиболее крупные – нервными стволами). Дендриты принимают сигналы из внешней среды или от другой нервной клетки и проводят возбуждение к аксону, который передаёт его в удалённые от тела нейрона области. Тела нейронов образуют серое вещество головного и спинного мозга, а дендриты и аксоны – белое мозговое вещество.
Таким образом, основными функциями нейронов являются: восприятие внешних раздражений – рецепторная функция, их переработка – интегративная функция и передача нервных влияний на другие нейроны или различные рабочие органы – эффекторная функция. В теле нервной клетки, или соме, происходят основные процессы переработки информации. Многочисленные древовидно разветвленные отростки – дендриты (греч. дендрон – «дерево») служат входами нейрона, через которые сигналы поступают в нервную клетку. Выходом нейрона является отходящий от тела клетки отросток – аксон (греч. аксис – «ось»), который передает нервные импульсы дальше – другой нервной клетке или рабочему органу (мышце, железе). Особенно высокой возбудимостью обладает начальная часть аксона и расширение в месте его выхода из тела клетки – аксонный холмик нейрона. Именно в этом сегменте клетки возникает нервный импульс.
Таким образом, основными функциями нейронов являются: восприятие внешних раздражений – рецепторная функция, их переработка интегративная функция и передача нервных влияний на другие нейроны или различные рабочие органы – эффекторная функция. В теле нервной клетки, или соме, происходят основные процессы переработки информации. Многочисленные древовидно разветвленные отростки – дендриты (греч. дендрон – «дерево») служат входами нейрона, через которые сигналы поступают в нервную клетку. Выходом нейрона является отходящий от тела клетки отросток – аксон (греч. аксис – «ось»), который передает нервные импульсы дальше – другой нервной клетке или рабочему органу (мышце, железе). Особенно высокой возбудимостью обладает начальная часть аксона и расширение в месте его выхода из тела клетки – аксонный холмик нейрона. Именно в этом сегменте клетки возникает нервный импульс.
Нейрон. Основной функциональной и структурной единицей нервной системы является нейрон, строение которого показано на рис. 1.1. Нейрон состоит из клеточного тела, или сомы, коротких нервных отростков, называемых дендритами, и длинного нервного волокна – аксона. Область выхода аксона из клеточного тела нейрона называется аксонным холмиком. Хотя формально и дендриты и аксоны являются нервными волокнами, термин «нервное волокно» в основном употребляется при упоминании аксона. Дендриты передают нервный импульс к телу нейрона, тогда как аксон направляет импульс из тела нейрона на другие нервные клетки или на мышечные волокна.
Связанные понятия (продолжение)
Клетки Пуркинье (англ. Purkinje cells) — крупные нервные клетки коры мозжечка. Своё название клетки получили в честь их первооткрывателя, чешского врача и физиолога Яна Эвангелисты Пуркинье.
Пирамидальные нейроны, или пирамидные нейроны, — основные возбудительные нейроны мозга млекопитающих. Также обнаруживаются у рыб, птиц, рептилий. Напоминают по форме пирамиду, из которой вверх ведёт большой апикальный дендрит; имеют один аксон, идущий вниз, и множество базальных дендритов. Впервые были исследованы Рамон-и-Кахалем. Отмечены в таких структурах, как кора мозга, гиппокамп, миндалевидное тело (амигдала), но отсутствуют в обонятельной луковице, стриатуме, среднем мозге, ромбовидном мозге…
Подробнее: Пирамидальный нейрон
Нейроглия, или просто глия (от др.-греч. νεῦρον — волокно, нерв + γλία — клей), — совокупность вспомогательных клеток нервной ткани. Составляет около 40 % объёма ЦНС. Количество глиальных клеток в мозге примерно равно количеству нейронов. Термин ввёл в 1846 году Рудольф Вирхов.
Перикарион (др.-греч. περι- — приставка со значением «около, вокруг, кругом» + κάρυον — «орех») — сома (тело) нейрона, может иметь различную величину и форму. На цитолемме перикариона образуются многочисленные синаптические контакты с отростками других нейронов.
Нервная ткань — ткань эктодермального происхождения, представляет собой систему специализированных структур, образующих основу нервной системы и создающих условия для реализации её функций. Нервная ткань осуществляет восприятие и преобразование раздражителей в нервный импульс и передачу его к эффектору. Нервная ткань обеспечивает взаимодействие тканей, органов и систем организма и их регуляцию.
Мотонейро́н (от лат. motor — приводящий в движение и нейрон; двигательный нейро́н) — крупная нервная клетка в передних рогах спинного мозга. Мотонейроны обеспечивают моторную координацию и поддержание мышечного тонуса.
Шванновские клетки (леммоциты) — вспомогательные клетки нервной ткани, которые формируются вдоль аксонов периферических нервных волокон. Создают, а иногда и разрушают, электроизолирующую миелиновую оболочку нейронов. Выполняют опорную (поддерживают аксон) и трофическую (питают тело нейрона) функции. Описаны немецким физиологом Теодором Шванном в 1838 году и названы в его честь.
Астроцит (лат. astrocytus; от греч. astron — звезда; и kýtos, здесь — клетка) — тип нейроглиальной клетки звездчатой формы с многочисленными отростками. Совокупность астроцитов называется астроглией.
Гранулярные клетки — несколько разновидностей мелких нейронов мозга. Название «гранулярная клетка» («зернистая клетка», «клетка-зерно») используется анатомами для нескольких разных типов нейронов, единственной общей особенностью которых является крайне малый размер тел этих клеток.
Подробнее: Гранулярная клетка
Гипотала́мус (лат. hypothalamus, от греч. ὑπό — «под» и θάλαμος — «комната, камера, отсек, таламус») — небольшая область в промежуточном мозге, включающая в себя большое число групп клеток (свыше 30 ядер), которые регулируют нейроэндокринную деятельность мозга и гомеостаз организма. Гипоталамус связан нервными путями практически со всеми отделами центральной нервной системы, включая кору, гиппокамп, миндалину, мозжечок, ствол мозга и спинной мозг. Вместе с гипофизом гипоталамус образует гипоталамо-гипофизарную…
Не́рвные воло́кна — длинные отростки нейронов, покрытые глиальными оболочками. По нервным волокнам распространяются нервные импульсы, по каждому волокну изолированно, не заходя на другие.
Корзинчатые нейроны — тормозные ГАМК-эргические вставочные нейроны молекулярного слоя мозжечка. Длинные аксоны корзинчатых нейронов образуют корзиноподобные синапсы с телами клеток Пуркинье. Корзинчатые нейроны многополярны, их дендриты свободно ветвятся.
Подробнее: Корзинчатый нейрон
Тала́мус, иногда — зри́тельные бугры (лат. Thalamus; от др.-греч. θάλαμος — «камера, комната, отсек») — отдел головного мозга, представляющий собой большую массу серого вещества, расположенную в верхней части таламической области промежуточного мозга хордовых животных, в том числе и человека. Впервые описан древнеримским врачом и анатомом Галеном. Таламус — это парная структура, состоящая из двух половинок, симметричных относительно межполушарной плоскости. Таламус находится глубже структур большого…
Полоса́тое те́ло (лат. corpus striatum) — анатомическая структура конечного мозга, относящаяся к базальным ядрам полушарий головного мозга.
Гиппока́мп (от др.-греч. ἱππόκαμπος — морской конёк) — часть лимбической системы головного мозга (обонятельного мозга). Участвует в механизмах формирования эмоций, консолидации памяти (то есть перехода кратковременной памяти в долговременную). Генерирует тета-ритм при удержании внимания.
Латеральное коленчатое тело (наружное коленчатое тело, ЛКТ) — легко распознаваемая структура мозга, которая помещается на нижней латеральной стороне подушки таламуса в виде достаточно большого плоского бугорка. В ЛКТ приматов и человека морфологически определено шесть слоев: 1 и 2 — слои крупных клеток, 3-6 — слои мелких клеток. Слои 1, 4 и 6 получают афференты от контрлатерального (расположенного в противоположном по отношению к ЛКТ полушарии) глаза, а слои 2, 3 и 5 — от ипсилатерального (расположенного…
Зубчатая извилина (лат. gyrus dentatus) или зубчатая фасция гиппокампа (лат. fascia dentata hippocampi) — зазубренная извилина, расположенная в глубине борозды гиппокампа и переходящая в ленточную извилину. В некоторых классификациях она вместе с аммоновым рогом считается частью самого гиппокампа, однако большинство авторов относят её к гиппокамповой формации. В её структуре выделяют три слоя: полиморфный хилус, гранулярный слой и молекулярный слой, который непрерывно переходит в молекулярный слой…
Потенциа́л де́йствия — волна возбуждения, перемещающаяся по мембране живой клетки в виде кратковременного изменения мембранного потенциала на небольшом участке возбудимой клетки (нейрона или кардиомиоцита), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к внутренней поверхности мембраны, в то время, как в покое она заряжена положительно. Потенциал действия является физиологической основой нервного импульса.
Обонятельная луковица — часть обонятельного мозга, парное образование, состоящее из тел вторых нейронов биполярного типа обонятельного анализатора. Располагается во внутричерепной полости между лобной долей сверху и решётчатой пластинкой решётчатой кости снизу, через отверстие которой в неё поступают нервные волокна обонятельной области носа, а сзади продолжается в обонятельный тракт.
Реце́птор — объединение из терминалей (нервных окончаний) дендритов чувствительных нейронов, глии, специализированных образований межклеточного вещества и специализированных клеток других тканей, которые в комплексе обеспечивают превращение влияния факторов внешней или внутренней среды (раздражитель) в нервный импульс. В некоторых рецепторах (например, вкусовых и слуховых рецепторах человека) раздражитель непосредственно воспринимается специализированными клетками эпителиального происхождения или…
Ганглий (др.-греч. γάγγλιον — узел), или нервный узел — скопление нервных клеток, состоящее из тел, дендритов и аксонов нервных клеток и глиальных клеток. Обычно ганглий имеет также оболочку из соединительной ткани. Имеются у многих беспозвоночных и всех позвоночных животных. Часто соединяются между собой, образуя различные структуры (нервные сплетения, нервные цепочки и т. п.).
Голубое пятно (голубоватое место, голубоватое пятно, синее пятно/место, лат. locus coeruleus) — ядро, расположенное в стволе мозга на уровне моста (участок голубоватого цвета в верхнелатеральной части ромбовидной ямки ствола головного мозга кнаружи от верхней ямки), часть ретикулярной формации. Система его проекций очень широка — аксоны восходят к верхним слоям коры больших полушарий, гиппокампу, миндалине, перегородке, полосатому телу, коре мозжечка. Нисходящие проекции идут в спинной мозг к симпатическим…
Афферентация (от лат. afferens — «приносящий») — постоянный поток нервных импульсов, поступающих в центральную нервную систему от органов чувств, воспринимающих информацию как от внешних раздражителей (экстерорецепция), так и от внутренних органов (интерорецепция). Находится в прямой зависимости от количества и силы воздействующих раздражителей, а также от состояния — активности или пассивности — индивида.
Белое вещество (лат. substantia alba) — компонент центральной нервной системы позвоночных животных и человека, состоящий главным образом из пучков аксонов, покрытых миелином. Противопоставляется серому веществу мозга, состоящему из клеточных тел нейронов. Цветовая дифференциация белого и серого вещества нервной ткани обусловлена белым цветом миелина.
Нервно-мышечный синапс (также нейромышечный, либо мионевральный синапс) — эффекторное нервное окончание на скелетном мышечном волокне. Входит в состав нервно-мышечного веретена. Нейромедиатором в этом синапсе является ацетилхолин.
Ретикулярная формация (лат. reticulum — сеточка, formatio — образование) — это образование, тянущееся вдоль всей оси ствола головного мозга. Своим названием оно обязано сетчатой структуре, образуемой его нервными клетками с очень сложными связями. Формация состоит из ретикулярных ядер и большой сети нейронов с разветвлёнными аксонами и дендритами, представляющих единый комплекс, который осуществляет активацию коры головного мозга и контролирует рефлекторную деятельность спинного мозга. Эта сеть нейронов…
Средний мозг, или мезэнцефалон (англ. Midbrain, лат. Mesencephalon; термин «мезэнцефалон» происходит от др.-греч. μέσος — «месос» — средний, и ἐγκέφᾰλος — «энкефалос» — буквально «находящийся внутри головы», то есть головной мозг) — это отдел головного мозга хордовых животных, развивающийся из среднего из трёх первичных мозговых пузырей эмбриона. Этот отдел мозга ответствен за осуществление многих важных физиологических функций, таких, как зрение, слух, контроль движений, регуляция циклов сна и бодрствования…
Мозжечо́к (лат. cerebellum — дословно «малый мозг») — отдел головного мозга позвоночных, отвечающий за координацию движений, регуляцию равновесия и мышечного тонуса. У человека располагается позади продолговатого мозга и варолиева моста, под затылочными долями полушарий головного мозга. Посредством трёх пар ножек мозжечок получает информацию из коры головного мозга, базальных ганглиев, экстрапирамидной системы, ствола головного мозга и спинного мозга. У различных таксонов позвоночных взаимоотношения…
Мозгово́й ствол, или ствол головного мозга, — традиционно выделяющийся отдел третьего мозга, представляющий собой протяжённое образование, продолжающее спинной мозг.
Ганглионарная (ганглиозная) клетка — нервная клетка (нейрон) сетчатки глаза, способная генерировать нервные импульсы в отличие от других типов нейронов сетчатки (биполярных, горизонтальных, амакриновых). В их цитоплазме хорошо выражено базофильное вещество. Ганглионарные клетки граничат со стекловидным телом глаза и образуют слой сетчатки, который первым получает свет. Их аксоны по поверхности сетчатки направляются к слепому пятну (пятно Мариотта), собираются в зрительный нерв и направляются в мозг…
Конечный мозг (лат. telencephalon) — самый передний отдел головного мозга. Состоит из двух полушарий большого мозга (покрытых корой), мозолистого тела, полосатого тела и обонятельного мозга. Является наиболее крупным отделом головного мозга. Это также самая развитая структура, покрывающая собой все отделы головного мозга.
Дендритный шипик — мембранный вырост на поверхности дендрита, способный образовать синаптическое соединение. Шипики обычно имеют тонкую дендритную шейку, оканчивающуюся шарообразной дендритной головкой. Дендритные шипики обнаруживаются на дендритах большинства основных типов нейронов мозга. В создании шипиков участвует белок калирин.
Эпиталамус (буквально «надталамус») — это самая дорсальная (верхняя) задняя часть таламического мозга, или, иначе говоря, таламической области — той части промежуточного мозга, куда, помимо эпиталамуса, входят также таламус, субталамус и метаталамус, но не входят гипоталамус и гипофиз, причисляемые к гипоталамической области. Эпиталамус возвышается над таламусом. В число его структур входят поводок эпиталамуса, также называемый поводком мозга, треугольник поводка, спайка поводков, подспаечный орган…
Передний мозг, или прозэнцефалон (лат. prosencephalon, англ. forebrain) — это отдел головного мозга хордовых животных, выделяемый на основании особенностей его эмбрионального развития у этих видов животных. Передний мозг (прозэнцефалон) является одним из трёх первичных мозговых пузырей, образующихся в первичной нервной трубке вскоре после нейруляции и образования нейромер, на так называемой трёхпузырьковой стадии развития ЦНС эмбриона. Двумя другими первичными мозговыми пузырями являются средний…
Миоци́ты, или мы́шечные клетки — особый тип клеток, составляющий основную часть мышечной ткани. Миоциты представляют собой длинные, вытянутые клетки, развивающиеся из клеток-предшественников — миобластов. Существует несколько типов миоцитов: миоциты сердечной мышцы (кардиомиоциты), скелетной и гладкой мускулатуры. Каждый из этих типов обладает особыми свойствами. Например, кардиомиоциты, помимо прочего, генерируют электрические импульсы, задающие сердечный ритм.
Головно́й мозг (лат. cerebrum, др.-греч. ἐγκέφαλος) — главный орган центральной нервной системы подавляющего большинства хордовых, её головной конец; у позвоночных находится внутри черепа. В анатомической номенклатуре позвоночных, в том числе человека, мозг в целом чаще всего обозначается как encephalon — латинизированная форма греческого слова; изначально латинское cerebrum стало синонимом большого мозга (telencephalon).
Спинно́й мозг (лат. medulla spinalis) — орган центральной нервной системы позвоночных, расположенный в позвоночном канале. Принято считать, что граница между спинным и головным мозгом проходит на уровне перекреста пирамидных волокон (хотя эта граница весьма условна). Внутри спинного мозга имеется полость, называемая центральным каналом (лат. canalis centralis). Спинной мозг защищён мягкой, паутинной и твёрдой мозговой оболочкой. Пространства между оболочками и спинномозговым каналом заполнены спинномозговой…
Бледный шар (лат. globus pallidus s. pallidum) — парная структура переднего мозга, относящаяся к базальным ядрам, часть чечевицеобразного ядра, вентромедиальная часть полосатого тела. Подразделяется на латеральную и медиальную части.
Промежуточный мозг, или диэнцефалон (лат. Diencephalon, англ. Diencephalon; термин «диэнцефалон» происходит от др.-греч. διά — «диа-», обозначающее «через», «между», и ἐγκέφαλος — «энкефалос», буквально «находящийся внутри головы», то есть головной мозг) — отдел головного мозга хордовых животных, который образуется в процессе эмбрионального развития из задней части зародышевого переднего мозга (прозэнцефалона). На пятипузырьковой стадии из задней части зародышевого переднего мозга (прозэнцефалона…
Олигодендроциты, или олигодендроглия — это вид нейроглии, открытый Пио дель Рио-Ортегой (1928 год). Олигодендроциты есть только в центральной нервной системе, которая у позвоночных включает в себя головной мозг и спинной мозг.
Синаптогенез — процесс формирования синапсов между нейронами в нервной системе. Синаптогенез происходит на протяжении всей жизни здорового человека, а взрыв формирования синапсов, т. н. избыточный синаптогенез (exuberant synaptogenesis), наблюдается на ранних стадиях развития головного мозга. Синаптогенез особенно важен в ходе критического периода развития особи (в биологии развития, такого периода, когда нервная система особенно чувствительна к экзогенным стимулам), когда имеет место быть интенсивное…
Хвостатое ядро (лат. nucleus caudatus) — парная структура головного мозга, относящаяся к стриатуму. Расположена спереди от таламуса, от которого (на горизонтальном срезе) его отделяет белая полоска вещества — внутренняя капсула. Передний отдел хвостатого ядра утолщён и образует головку, caput nuclei caudati, которая составляет латеральную стенку переднего рога бокового желудочка. Головка хвостатого ядра примыкает внизу к переднему продырявленному веществу, в этом месте головка соединяется с чечевицеобразным…
Продолговатый мозг (лат. myelencephalon, medulla oblongata), или луковица головного мозга (лат. bulbus cerebri), — задний отдел головного мозга, непосредственное продолжение спинного мозга. Происходит из ромбовидного мозга и входит в ствол головного мозга. Регулирует такие основные процессы жизнедеятельности, как дыхание и кровообращение, поэтому в случае повреждения продолговатого мозга мгновенно наступает смерть.
Химический синапс — особый тип межклеточного контакта между нейроном и клеткой-мишенью. У данного типа синапса роль посредника (медиатора) передачи выполняет химическое вещество.
Электри́ческий си́напс (англ. electrical synapse) — место высокоспециализированных контактов (щелевых контактов) между нейронами, где происходит прямое перетекание электрических токов от одного нейрона к другому. В щелевых контактах мембраны соседних клеток находятся на расстоянии около 3,8 нм, в то время как в химическом синапсе расстояние между двумя нейронами составляет от 20 до 40 нм. У многих животных в нервной системе имеются как химические, так и электрические синапсы. По сравнению с химическими…
Упоминания в литературе (продолжение)
Основная единица нервной системы — нервная клетка (нейрон). Нейроны покрыты глиальными клетками, доставляющими им питание и удерживающими их на месте. Каждая нервная клетка состоит из тела, дендрита и аксона. В периферической нервной системе аксоны собраны в пучки – нервы. Бо́льшая часть аксонов покрыта миелиновой оболочкой, которая увеличивает скорость передачи информации в нервной системе, а также препятствует передаче нервных импульсов близлежащим клеткам. Современные исследователи опровергли бытовавшее ранее мнение о том, что «нервные клетки не восстанавливаются». Доказано, что клетки в зонах мозга, связанных с памятью и процессом обучения, продолжают развиваться и делиться в течение жизни человека.
Нервные клетки имеют несколько отростков – чувствительных древовидно ветвящихся дендритов, которые проводят к телу нейронов возбуждение, возникающее на их чувствительных нервных окончаниях, расположенных в органах, и одних двигательный аксон, по которому нервный импульс передается от нейрона к рабочему органу или другому нейрону. Нейроны вступают друг с другом в контакт с помощью окончаний отростков, образуя рефлекторные цепи, по которым передаются (распространяются) нервные импульсы.
От нервных центров по основному отростку (аксону) идут сигналы к каждой клетке и каждому органу тела, заставляя их путем электрической стимуляции выполнять определенную функцию. Нервные центры состоят из сотен и даже тысяч нервных клеток. Соответственно, существует такое же количество аксонов. Они собираются в пучки (так называемые тракты), которые, соединяясь вместе, образуют общий «кабель» – спинной мозг.
Основной ее элемент – нейрон: микроскопически малая нервная клетка с отходящими от нее отростками. Длинный отросток называется аксоном, короткий древовидной формы – дендритом. Посредством этих отростков все нервные клетки связаны между собой. Место соединения отростков называется синапсом. Пучки нервных волокон, идущие к поверхности тела, к внутренним органам и мышцам, образуют периферическую нервную систему. Разветвленные окончания нервных волокон образуют органы чувств.
Вспомогательные клетки нейроглии (астроциты) не только создают физическую опору для нейронов, но вместе с сосудами обеспечивают потребности нервной ткани в кислороде и необходимых для жизни веществах, включая аминокислоты, липиды, гликопротеиды. Тело нервной клетки имеет микроскопические размеры, но длина аксона может достигать одного метра! Отростки нейронов, как правило, укрыты миелиновой оболочкой, которая обеспечивает стабильность обмена веществ в длинных нервных проводниках и высокую скорость передачи возбуждения.
Нейрон представляет собой микроскопически малую нервную клетку с отходящими от нее отростками. Длинный отросток называется аксоном, короткий древовидной формы – дендритом. Посредством этих отростков все нервные клетки связаны между собой. Место соединения отростков называется синапсом. Пучки нервных волокон, идущие к поверхности тела, к внутренним органам и мышцам, образуют периферическую нервную систему. Разветвленные окончания нервных волокон образуют органы чувств.
Главная структурная и функциональная единица нервной системы – нейрон, представляющий собой клетку с отростками – длинным аксоном и короткими дендритами. Нейроны соединяются между собой синапсами, образуя нейронные цепи, приводимые в действие рефлекторно: в ответ на раздражение, поступаемое из внешней или внутренней среды, возбуждение из нервных окончаний передается по центростремительным волокнам в головной и спинной мозг, оттуда импульсы по центробежным волокнам поступают в различные органы, а по двигательным – к мышцам.
Аксон – вырост цитоплазмы, приспособленный для проведения информации, которая собирается ден-дритами и перерабатывается в нейроне. Аксон дендритной клетки имеет постоянный диаметр и покрыт миелиновой оболочкой, которая образована из глии, у аксона разветвленные окончания, в которых находятся митохондрии и секреторные образования.
Два слова о строении нейрона. У него есть центральная толстенькая часть – «тело», в котором находится клеточное ядро с генами. От тела отходят два вида отростков: «входные» (дендриты) и «выходные» (аксоны). Дендритов обычно много, а аксон, как правило, один, но на конце он может ветвиться.
При поражении центров коры головного мозга очень важна локализация, ведь повреждения происходят на микроскопическом уровне. Головной мозг состоит из нейронов и глиальных клеток, которые соединены между собой сложными проводимыми путями – аксонами и дендритами. По ним передаются нервные импульсы. Все мы еще со школьного курса биологии знаем, что в головном мозге есть серое и белое вещества. Серым веществом является скопление нейронов и коротких проводимых путей между ними. А вот белое вещество составляют длинные, сложные проводимые пути – нервные волокна, которые покрыты особой миелиновой оболочкой – она необходима для нормального прохождения импульсов и подобна изоляционной ленте на электрическом проводе.
В состоянии относительного физиологического покоя синапс находится в фоновой биоэлектрической активности. Ее значение заключается в том, что она повышает готовность синапса к проведению нервного импульса. В состоянии покоя 1–2 пузырька в терминале аксона могут случайно подойти к пресинаптической мембране, в результате чего вступят с ней в контакт. Везикула при контакте с пресинаптической мембраной лопается и ее содержимое в виде одного кванта АХ поступает в синаптическую щель, попадая при этом на постсинаптическую мембрану, где будет образовываться МПКН.
В состоянии относительного физиологического покоя синапс находятся в фоновой биоэлектрической активности. Ее значение заключается в том, что она повышает готовность синапса к проведению нервного импульса. В состоянии покоя 1–2 пузырька в терминале аксона могут случайно подойти к пресинаптической мембране, в результате чего вступят с ней в контакт. Везикула при контакте с пресинаптической мембраной лопается, и ее содержимое в виде 1 кванта АХ поступает в синаптическую щель, попадая при этом на постсинаптическую мембрану, где будет образовываться МПКН.
Таким образом, нейрофизиологические и психофизиологические механизмы tDCS и ТКМП достаточно многообразны, даже при приложении стандартизированных параметров тока и площади электродов (при tDCS). Нам представляется маловероятным сведение механизмов поляризаций к делоляризации или гиперполяризации мембраны нейронов. Если для пирамидных нейронов с их пространственной ориентацией в коре можно себе представить, что, например, при анодной поляризации входящий (гиперполяризующий) ток протекает преимущественно через дендрита, а выходящий (деполяризующий) ток – через начальный сегмент аксона (где генерируются спайки), вызывая его деполяризацию и увеличение возбудимости моторной коры, то это допущение плохо приложимо к другим областям коры, где ориентация нейронов не столь очевидна. Кроме того, возбуждающие или тормозные потенциалы длятся не более 10 мсек. Пассивная деполяризация мембраны еще короче. Установленные эффекты tDCS длятся десятки минут, а то и дольше. Следовательно, де– или гиперполяризация, если и играют существенную роль в возникновении эффектов, то она сводится к пусковой роли, запускающей каскад синаптических и метаболических реакций которые и лежат в основе более длительных эффектов поляризаций.
Надо сказать, что нейрон устроен очень интересно: у него, как у всякого компьютера, есть корпус – тело. И все же славится нейрон не этим, главное в нем – это его отростки. Весь нейрон чем-то напоминает дерево, которое имеет развитую крону и ствол. Крону у дерева образуют ветки, а у нейрона это короткие отростки, они называются дендритами. У дерева ствол, а у нейрона – длинный отросток, аксон. А теперь о месте соединения нервных клеток – это синапс. Если два компьютера соединить шнуром, то контакт компьютера и шнура будет как раз тем самым синапсом в нервной системе.
Активность генов в нейронах основана на свойствах молекул ДНК, т. е. активность вызвана причинно-следственными связями, которые определяют особенности контактов молекул ДНК с окружающими атомами и молекулами. В свою очередь, активность генов является причиной всех событий клеточного метаболизма и, значит, обмена веществ между нейронами и с окружающей средой. Все процессы в сообществе нервных клеток (клеточном сообществе – КС) – рождение клеток, их возбуждение и торможение, функциональная специализация и формирование в них устойчивых молекулярных структур, синтез в клетках нейромедиаторов и образование у них аксонов, дендритов и шипиков, образование и разрыв межклеточных связей, распространение и прекращение возбуждений в сообществе, гибель клеток – это детерминистские процессы. Так у нейронов в течение суток изменяются параметры метаболизма: количество и соотношение синтезируемых и разлагающихся веществ, в т. ч. количество синтезируемых нейромедиаторов и гормонов. У нейронов, как и у всех организмов, имеются суточные ритмы. В соответствии с этими ритмами в продолжение суток изменяются состав и количество клеток, возбуждающихся от воздействий окружающей среды и следов таких воздействий, результаты конкуренции клеток и узлов за прекращение своего возбуждения, используемые возбуждениями маршруты связей между клетками, конфигурация формирующихся способов прекращения возбуждений, распространяющихся из одних и тех же узлов.
Другая часть коллатералей соединяется с клетками ядра Кларка, расположенного в заднем роге спинного мозга. Данное ядро расположено от VIII шейного до II поясничного сегментов по длиннику спинного мозга. Клетки грудного ядра являются вторыми нейронами, чьи аксоны образуют задний спиномозжечковый путь. Коллатерали, идущие от задних корешков шейных сегментов, входят в состав клиновидного пучка, идут вверх к его ядру и к дополнительному клиновидному ядру. Его аксоны соединяются с мозжечком. Третья группа коллатеральных афферентных волокон заканчивается в задних рогах спинного мозга. Там расположены вторые нейроны, чьи аксоны образуют передний спино-мозжечковый путь.
Соответственно существует такое же количество аксонов. Они собираются в пучки (так называемые тракты), которые, соединяясь вместе, образуют общий «кабель» – спинной мозг.
Двигательная единица – это отдельный мотонейрон и мышечные волокна, которые он иннервирует. Таким образом, нейрон определяет, являются ли волокна медленно или быстро сокращающимися. Мотонейрон в МС двигательной единице имеет небольшое клеточное тело и иннервирует группу из 10-180 мышечных волокон. У мотонейрона в БС двигательной единице большое клеточное тело и больше аксонов, и он иннервирует от 300 до 800 мышечных волокон. Отсюда следует, что каждый МС-мотонейрон в состоянии активировать значительно меньшее количество мышечных волокон в противоположность БС-мотонейрону. При этом необходимо отметить, что сила, производимая отдельными МС- и БС-волокнами по величине отличается незначительно. МС- и БС-волокна имеют разные функции во время физической активности. МС-волокнам присущ высокий уровень аэробной выносливости, они эффективны в производстве АТФ на основе окисления углеводов и жиров и более приспособлены к выполнению длительной работы невысокой интенсивности. Быстро сокращающиеся мышечные волокна приспособлены к анаэробной деятельности (без кислорода), и при их работе АТФ образуется благодаря анаэробным реакциям. Б С двигательные единицы производят большую силу, однако легко устают ввиду ограниченной выносливости и используются главным образом при выполнении кратковременной работы высокой интенсивности.
• длинный отросток, отходящий от тела клетки, который тянется на большое расстояние – до 1,5–1,7 м. Он составляет основной, или осевой, отросток нервной клетки. Его называют аксоном (в переводе с латыни axis — ось, основание, основной).
Другая часть коллатералей соединяется с клетками ядра Кларка, расположенного в заднем роге спинного мозга. Данное ядро расположено от VIII шейного до II поясничного сегментов по длиннику спинного мозга. Клетки грудного ядра являются вторыми нейронами, чьи аксоны образуют задний спиномозжечковый путь.
Формирование мышечной ткани начинается на 4-6-й неделе внутриутробного развития. В это время формируются первичные мышечные волокна. Несколько позже в мышцы прорастают аксоны мотонейронов спинного мозга. С этой стадии начинается синхронное формирование нервно-мышечного аппарата, причем определяющее значение имеет развитие нервных элементов, происходящее на 6-7-м месяцах внутриутробного развития. К моменту рождения примерно половина мышечных волокон уже прошла стадию первичной дифференцировки, и уже определены как «белые» или «красные». Дифференцировочные процессы усиливаются в возрасте от 1 до 2 лет, а затем на стадии полового созревания.
Нейросекреторные клетки, как и обычные нервные клетки, воспринимают сигналы, поступающие к ним от других отделов нервной системы, но далее передают полученную информацию уже гуморальным путем (не по аксонам, а по сосудам) – посредством нейрогормонов. Таким образом, совмещая свойства нервных и эндокринных клеток, нейросекреторные клетки объединяют нервные и эндокринные регуляторные механизмы в единую нейроэндокринную систему. Этим обеспечивается, в частности, способность организма адаптироваться к изменяющимся условиям внешней среды. Объединение нервных эндокринных механизмов регуляции осуществляется на уровне гипоталамуса и гипофиза.
Гидроцефалический (интерстициальный) отек. Еще одной формой отека головного мозга, сопровождающейся увеличением объема интерстициального пространства, является гидроцефалический отек, обусловленный блокадой путей, соединяющих интерстициальное пространство головного мозга с макроскопическими ликворосодержащими пространствами. Для клинициста эта форма отека имеет практическое значение. Так, у больных с острой гидроцефалией в начале происходит увеличение объема интерстициальной жидкости в перивентрикулярных отделах. Узкие в норме пространства между глиальными клетками и аксонами расширяются. Астроциты набухают, атрофируются и погибают. У больных с хронической гидроцефалией деструкция аксонов, разрушение миелина, фагоцитоз липидов микроглии являются характерными гистологическими признаками. Кроме стаза внеклеточной жидкости, причиной отека у этих больных может быть и обратный ток спинномозговой жидкости из желудочков мозга. Так же, как и при любой иной форме отека мозга, в зоне отек; снижается регионарный мозговой кровоток. По-видимому, часть функциональных расстройств в ЦНС, наблюдаемых у больных с гидроцефалией, обусловлена снижением регионарного кровотока в зоне отека.
Эти два гормона относятся к особой группе, поскольку, синтезируясь в гипоталамусе, транспортируются по аксонам (отросткам нейронов) в задний гипофиз и там выделяются в системный кровоток.
Между концами может остаться небольшой диастаз, но он не должен превышать 1 мм. Свободный промежуток между концами нерва заполнит гематома, а в дальнейшем образуется соединительно—тканная прослойка, через эту гематому и соединительную ткань будут прорастать тяжи швашювских клеток и вновь сформированные аксоны.
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
- Электрофизиология
- Ганглиозное возвышение
- Гигантская аксональная нейропатия
- Нейронное отслеживание
- Пионерный аксон
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »