Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
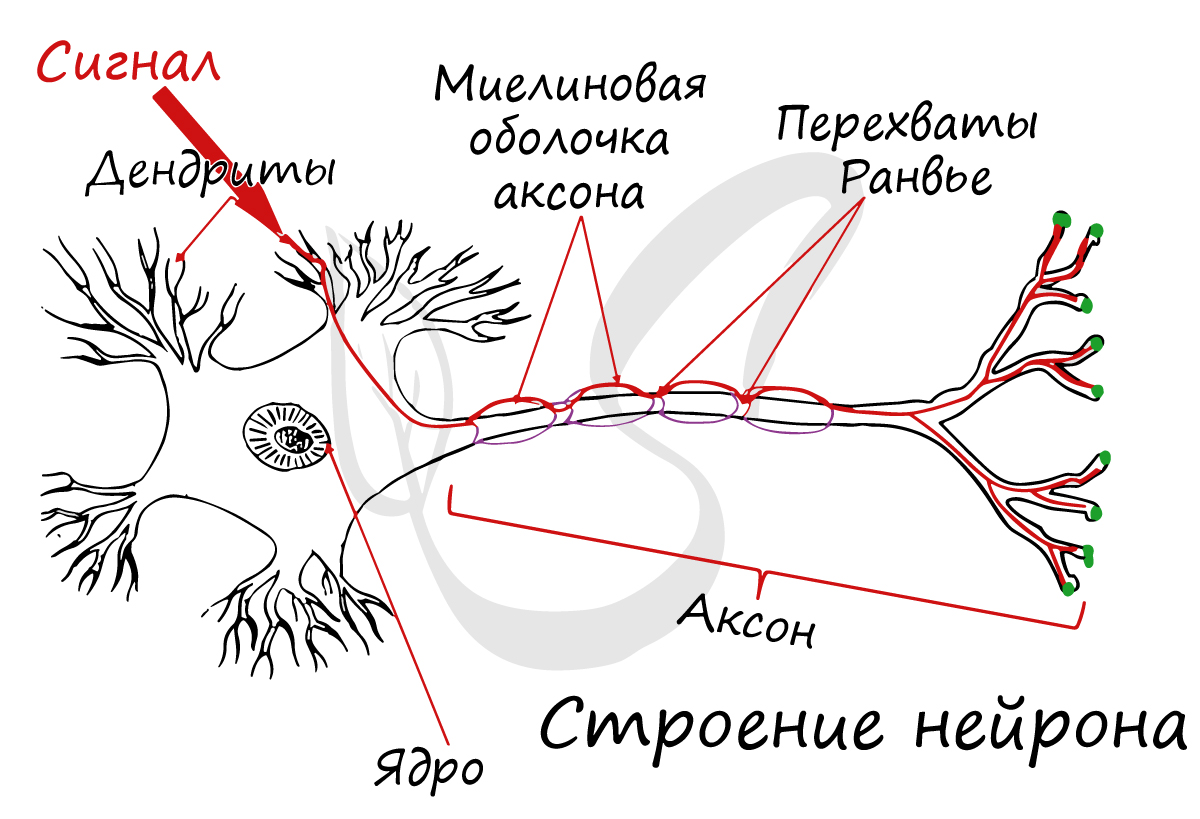
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
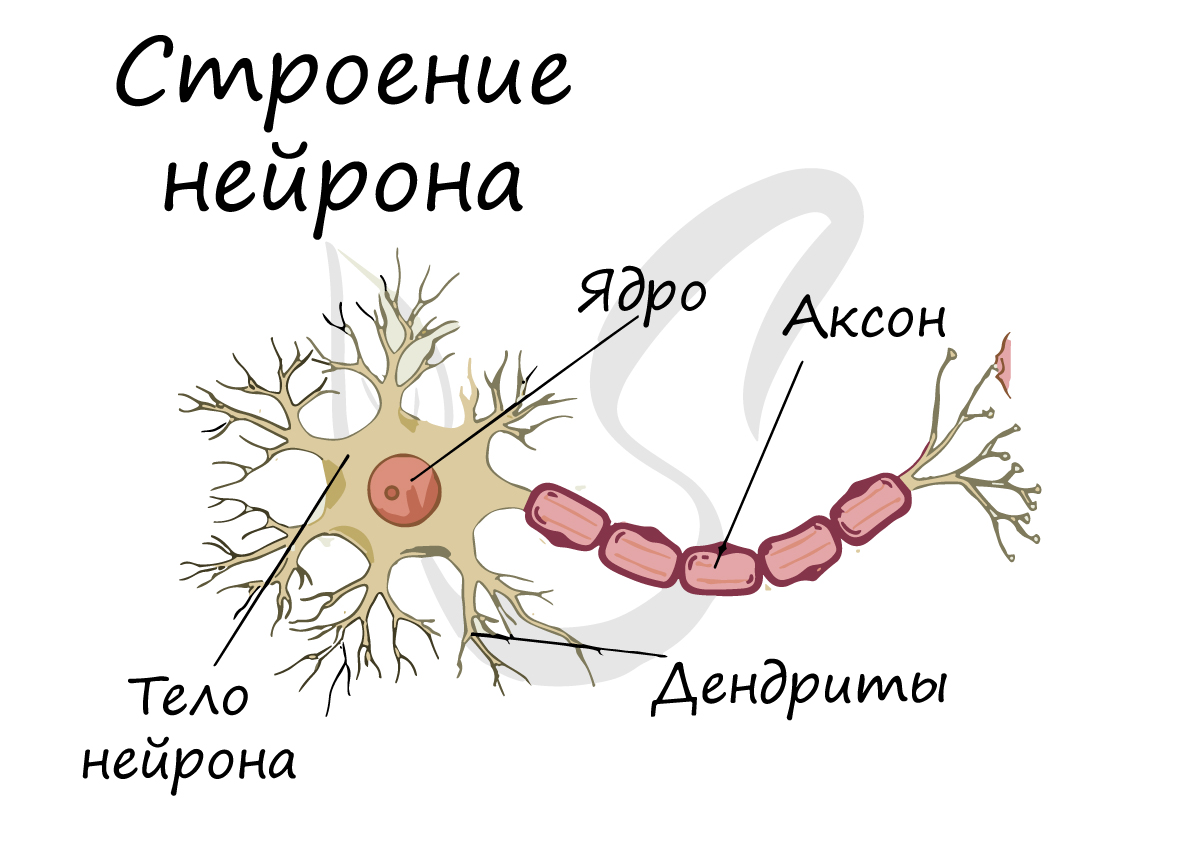
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
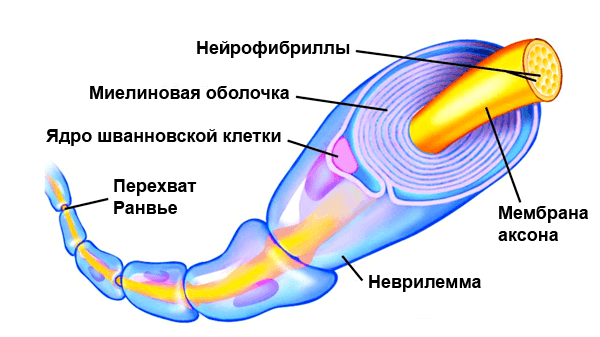
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
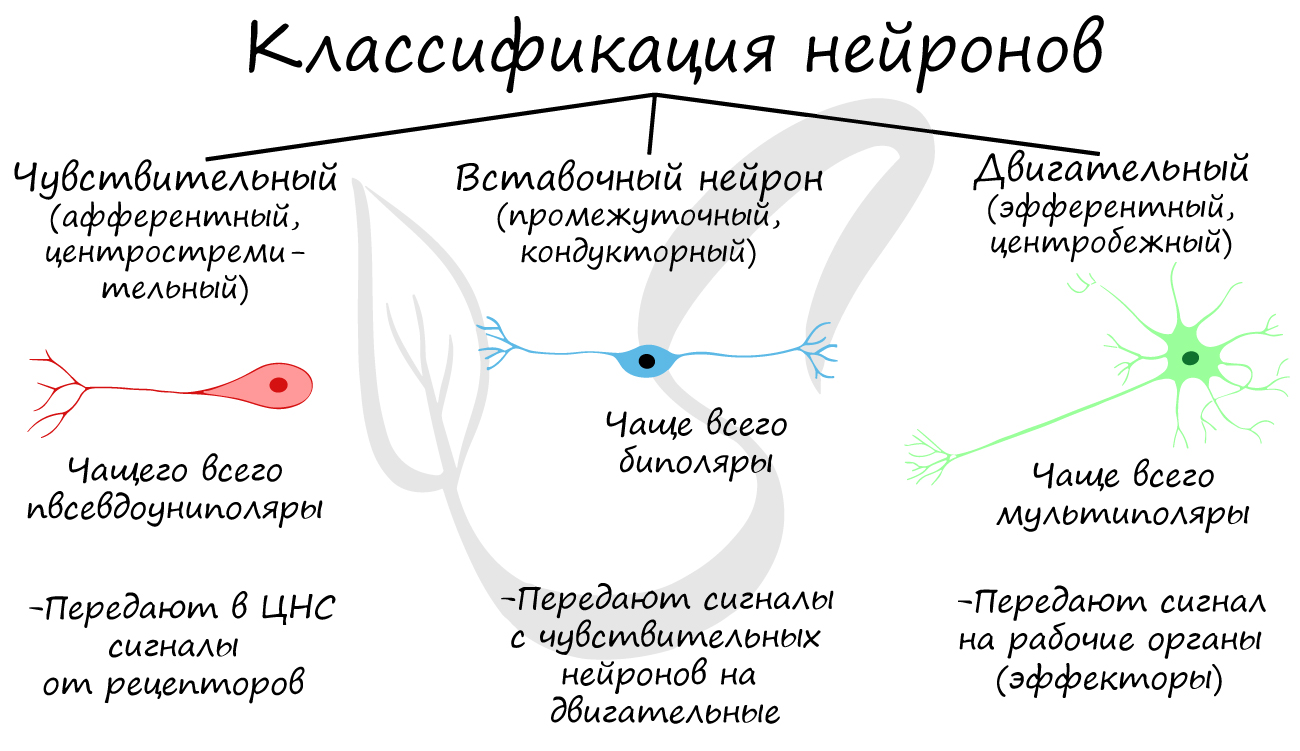
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
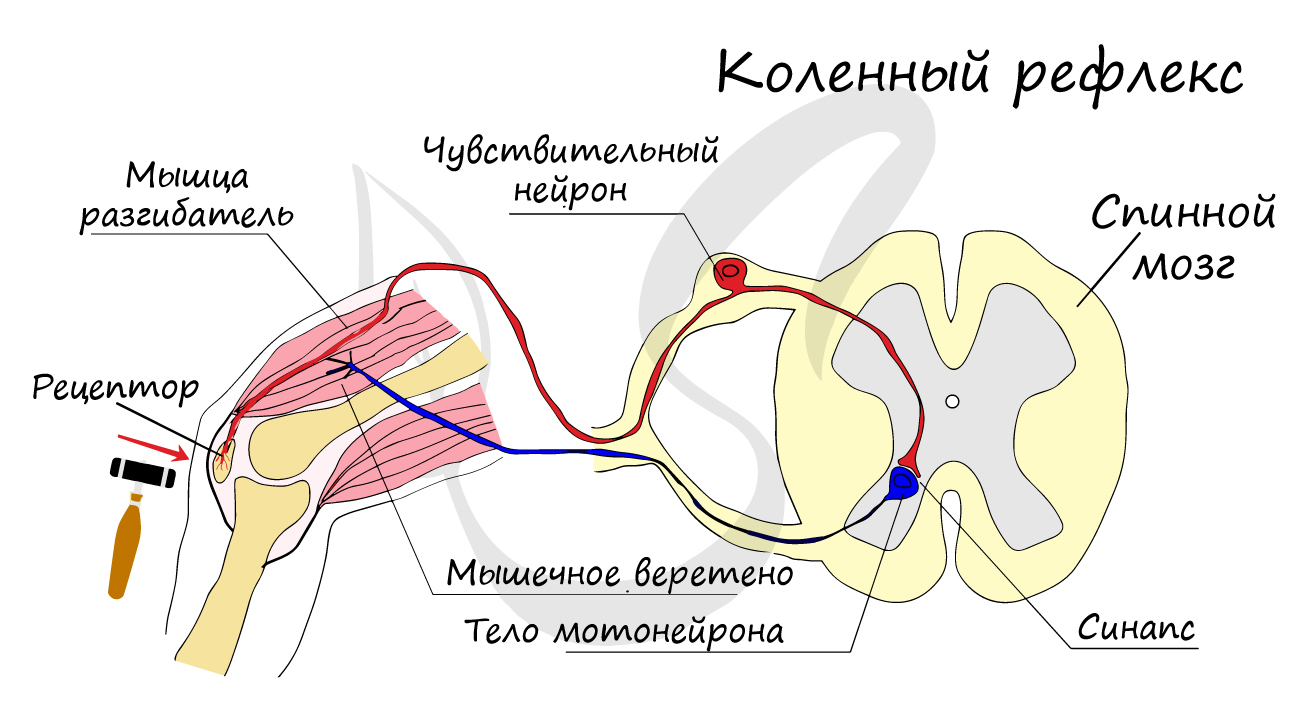
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
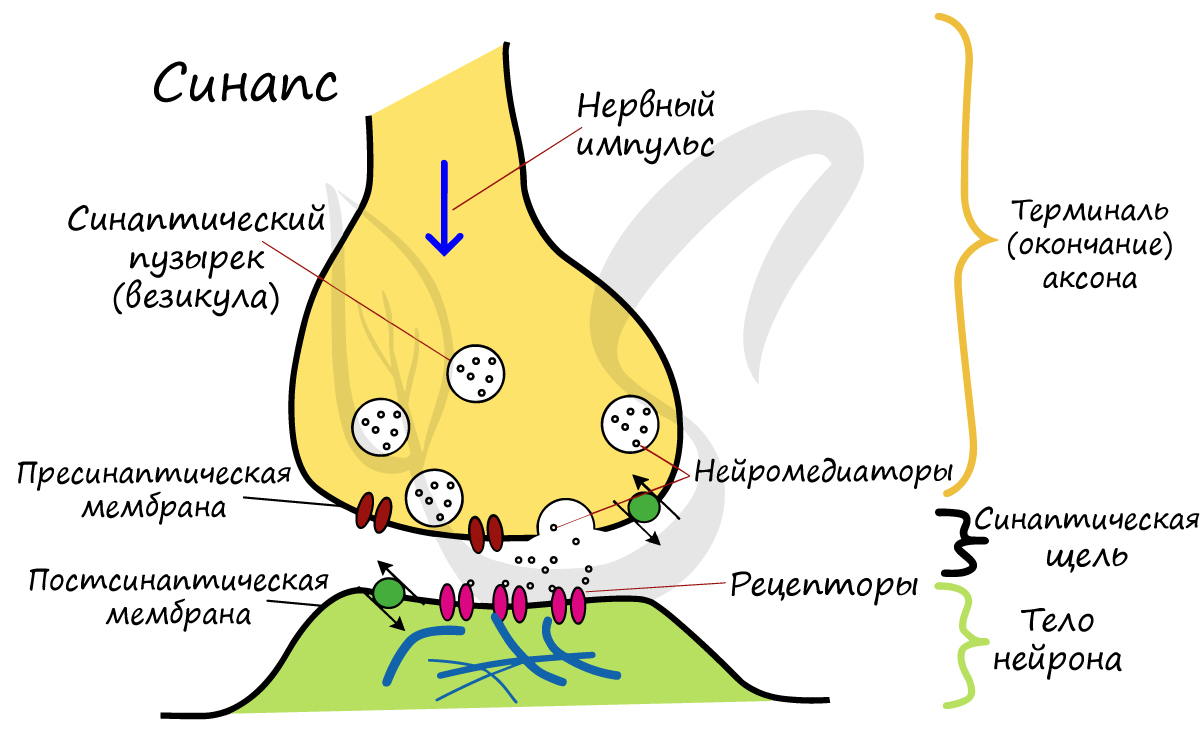
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

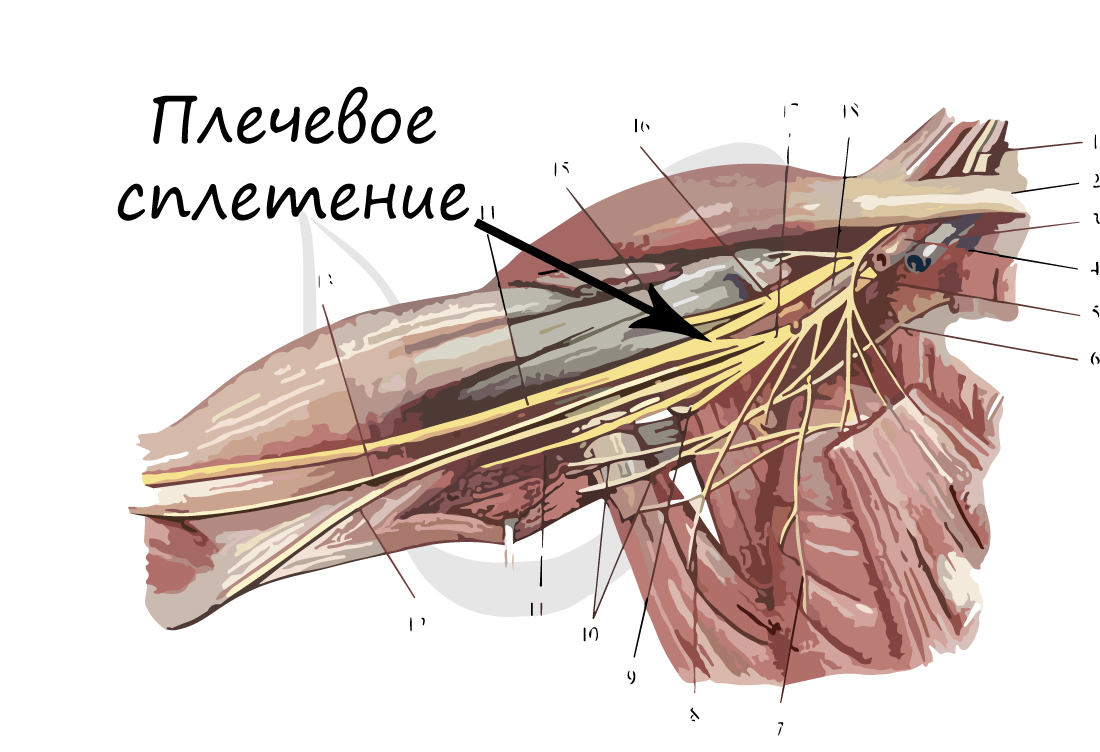
Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Очень часто при описании нервной системы используются «электрические» термины: например, нервы сравниваются с проводами. Это потому, что по нервному волокну действительно перемещается электрический сигнал. Каждому из нас известно, что оголенный провод опасен, ведь он бьет током, и по этой причине люди пользуются изоляционными материалами, не проводящими электричество. Природе тоже не чужда техника безопасности, и нервные «провода» она обматывает своим собственным изолирующим материалом — миелином.
Сложная обёртка
Миелин окружает отростки нервных клеток, изолируя их от внешнего воздействия. Это необходимо для более надежной и быстрой передачи сигнала по нервной системе. Благодаря изоляции нервного волокна электрический сигнал не рассеивается и добирается до места назначения без помех. Скорость прохождения сигнала по миелиновым и безмиелиновым волокнам может отличаться на три порядка: от 70 до 140 м/с и от 0,3 до 0,5 м/с соответственно.
По сути миелин — это клеточная мембрана глиальных клеток, многократно обмотанная вокруг аксона. Сама мембрана на 70–75% состоит из липидов и на 25–30% — из белков. В периферической нервной системе донором мембран становятся шванновские клетки, а в центральной — олигодендроциты. Эти клетки бережно обматывают своими мембранами ценные каналы связи, чтобы обеспечить надежное взаимодействие нервной системы и периферических органов. Миелин покрывает нервное волокно не целиком: существуют промежутки между наслоениями миелина, называемые перехватами Ранвье (рис. 1). Есть прямая зависимость между расстоянием от одного промежутка до другого и скоростью распространения нервного импульса по волокну: чем больше расстояние между перехватами Ранвье, тем выше скорость передачи сигнала в нерве [1].
Рисунок 1. Нервное волокно, обернутое миелином. Видны ядра шванновских клеток (nucleus of Schwann cell) и перехваты Ранвье (nodes of Ranvier) — участки аксона, которые не покрыты миелиновой оболочкой.
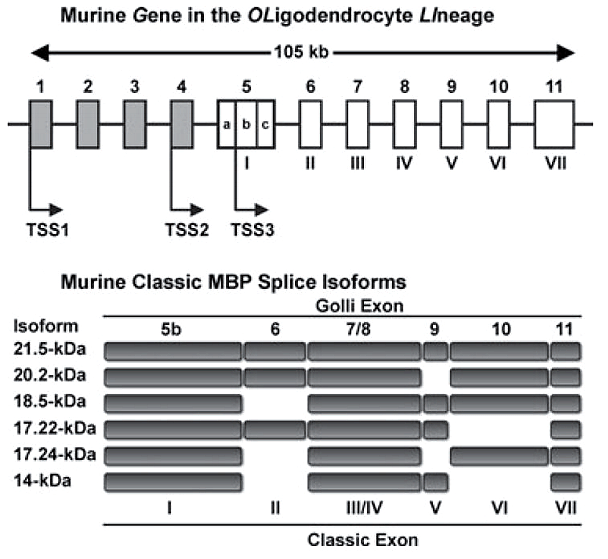
Если говорить о белках, входящих в состав миелина, то надо уточнить, что это не только простые белки. В миелине встречаются гликопротеины — белки, к которым присоединены короткие углеводные последовательности. Важной составляющей миелина является главный структурный белок миелина (myelin basic protein, MBP), впервые выделенный около 50 лет назад. MBP — это трансмембранный белок, который может многократно «прошивать» липидный слой клетки. Его различные изоформы (рис. 2) кодируются геном под названием Golli (gene in the oligodendrocyte lineage). Структурной основой миелина служит изоформа массой 18,5 килодальтон [2].
Рисунок 2. Различные изоформы основного белка миелина (MBP) создаются на основе одного и того же гена. Например, для синтеза изоформы массой 18,5 кДа используются все экзоны, кроме экзона II.
В состав миелина входят сложные липиды цереброзиды. Они представляют собой аминоспирт сфингозин, соединенный с жирной кислотой и остатком углевода. В синтезе липидов миелина принимают участие пероксисомы олигодендроцитов. Пероксисомы — это липидные пузырьки с различными ферментами (в общей сложности известно около 50 видов пероксисомных энзимов). Эти органеллы занимаются, в частности, β-окислением жирных кислот: жирных кислот с очень длинной цепью (very long chain fatty acids, VLCFA), некоторых эйкозаноидов и полиненасыщенных жирных кислот (ПНЖК, polyunsaturated fatty acids, PUFAs). Поскольку миелин может содержать до 70% липидов, пероксисомы крайне важны для нормального метаболизма этого вещества. Они используют N-ацетиласпартат, вырабатываемый нервной клеткой, для постоянного синтеза новых липидов миелина и поддержания его существования. Кроме этого, пероксисомы принимают участие в поддержании энергетического метаболизма аксонов [3].
Важная обёртка
Миелинизация (постепенная изоляция нервных волокон миелином) начинается у людей уже в эмбриональном периоде развития. Первыми этот путь проходят подкорковые структуры. В течение первого года жизни происходит миелинизация отделов периферической и центральной нервной системы, отвечающих за двигательную активность. Миелинизация участков головного мозга, регулирующих высшую нервную деятельность, заканчивается к 12–13 годам. Из этого видно, что миелинизация тесно связана со способностью отделов нервной системы осуществлять специфические для них функции. Вероятно, именно активная работа волокон до рождения запускает их миелинизацию.
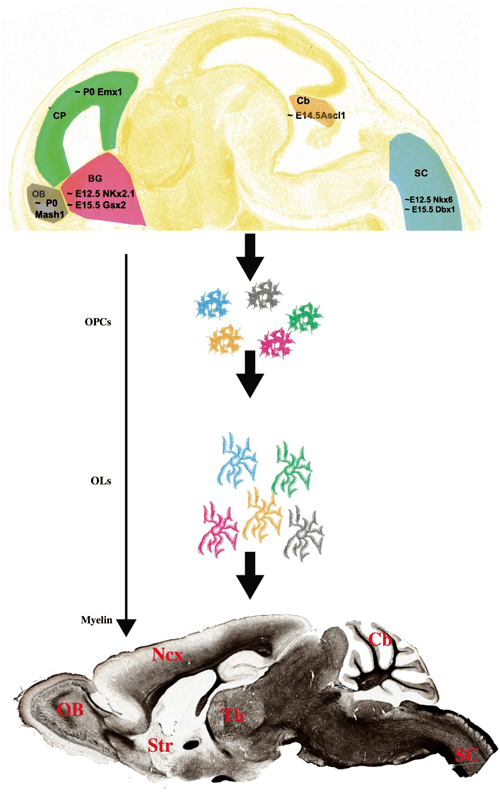
Дифференцировка клеток — предшественниц олигодендроцитов зависит от ряда факторов, связанных с работой нейронов. В частности, работающие отростки нейронов могут выделять белок нейролигин 3, который способствует пролиферации и дифференциации клеток-предшественниц [4]. В дальнейшем созревание олигодендроцитов происходит за счет ряда других факторов. В статье с характерным названием «Насколько велик миелинизирующий оркестр?» описывается происхождение олигодендроцитов в разных частях мозга [5]. Во-первых, в различных частях мозга олигодендроциты начинают созревать в разное время. Во-вторых, за их созревание отвечают разные клеточные факторы, что тоже зависит от региона нервной системы (рис. 3). У нас может возникнуть вопрос: а сходны ли между собой олигодендроциты, появившиеся с таким расхождением в стартовых данных? И насколько схож у них миелин? В целом, авторы статьи считают, что между популяциями олигодендроцитов из разных участков головного мозга действительно существуют различия, и обусловлены они во многом именно местом закладки клеток, воздействием на них окружающих нейронов. И всё же типы миелина, синтезируемые разными пулами олигодендроцитов, не имеют настолько больших отличий, чтобы они не были взаимозаменяемыми.
Рисунок 3. Различия во времени закладки олигодендроцитов в разных отделах головного мозга и в клеточных факторах, влияющих на их развитие.
Сам процесс миелинизации нервных волокон в центральной нервной системе происходит следующим образом (рис. 4). Олигодендроциты выпускают несколько отростков к аксонам разных нейронов. Входя с ними в контакт, отростки олигодендроцитов начинают оборачиваться вокруг них и расползаться по длине аксона. Количество оборотов постепенно увеличивается: в некоторых участках ЦНС их число доходит до 50. Мембраны олигодендроцитов становятся всё более тонкими, распространяясь по поверхности аксона и «выдавливая» из себя цитоплазму. Чем раньше слой миелина был обернут вокруг нервного окончания, тем более тонким он будет. Самый внутренний слой мембраны остается довольно толстым — для осуществления метаболической функции. Новые слои миелина наматываются поверх старых, перекрывая их так, как показано на рисунке 4 — не только сверху, но и увеличивая площадь аксона, покрытую миелином.
Рисунок 4. Миелинизация нервного волокна. Мембрана олигодендроцита наматывается на аксон, постепенно уплотняясь с каждым оборотом. Внутренний, прилегающий к аксону слой мембраны остается относительно толстым, что необходимо для выполнения метаболической функции. На разных частях рисунка (а-в) с разных ракурсов показано постепенное наматывание новых слоев миелина на аксон. Красным цветом выделен более толстый, метаболически активный слой, синим — новые уплотняющиеся слои. Внутренний слой миелина (inner tongue на части б) охватывается всё новыми и новыми слоями мембраны не только сверху, но и по бокам (в), вдоль аксона.
Миелинизация нервных волокон олигодендроцитами также значимо зависит от белка нейрегулина 1. Если он не воздействует на олигодендроциты, то в них запускается программа миелинизации, не учитывающая активность нервной клетки. Если же олигодендроциты получили сигнал от нейрегулина 1, то далее они начнут ориентироваться на работу аксона, и миелинизация будет зависеть от интенсивности выработки глутамата и активации им специфических NMDA-рецепторов на поверхности олигодендроцитов [6]. Нейрегулин 1 — ключевой фактор для запуска процессов миелинизации и в случае шванновских клеток [7].
Изменчивая обёртка
Миелин постоянно образуется и разрушается в человеческом организме. На синтез и распад миелина могут влиять факторы, связанные с особенностями внешней среды. Например, воспитание. С 1965 по 1989 год Румынией руководил Николае Чаушеску. Он установил жесткий контроль над репродуктивным здоровьем и институтом брака в своей стране: усложнил процедуру развода, запретил аборты и ввел ряд стимулов и льгот для женщин, имевших более пяти детей. Итогом этих мер стало ожидаемое повышение рождаемости. Вместе с рождаемостью увеличилось количество криминальных абортов, не добавивших здоровья румынкам, и возросло количество детей-отказников. Последние воспитывались в детских домах, где с ними не очень-то активно общался персонал. Румынские дети в полной мере ощутили на себе то, что называется социальной депривацией — лишение возможности полноценного общения с другими людьми. Если речь идет о маленьком ребенке, то следствиями социальной депривации станут нарушение формирования эмоциональных привязанностей и расстройство внимания. Когда режим Чаушеску пал, западным ученым предстояло в полной мере оценить результат социальной политики этого диктатора. Румынских детей, имеющих выраженные проблемы со вниманием и установкой социальных контактов, впоследствии стали называть детьми Чаушеску.
Кроме различий при выполнении нейропсихологических тестов, у детей Чаушеску по сравнению с детьми, не находившимися в таких условиях, отличалось даже строение головного мозга [8]. При оценке состояния белого вещества мозга ученые используют показатель фрактальной анизотропии. Он позволяет оценить плотность нервных волокон, диаметр аксонов и их миелинизацию. Чем больше фрактальная анизотропия, тем разнообразнее волокна, которые встречаются в этой области мозга. У детей Чаушеску отмечалось снижение фрактальной анизотропии в пучке белого вещества, соединяющего височную и лобную доли в левом полушарии, то есть связи в этом регионе были недостаточно сложными и разнообразными, с нарушениями миелинизации. Такое состояние связей мешает нормальному проведению сигналов между височной и лобной долями. В височной доле находятся центры эмоционального реагирования (миндалина, гиппокамп), а орбитофронтальная кора лобной доли также связана с эмоциями и принятием решений. Нарушение формирования связей между этими отделами мозга и проблемы в их работе в итоге приводили к тому, что выросшие в детдомах дети испытывали трудности в установлении нормальных отношений с другими людьми.
На миелинизацию также может влиять и состав еды, которую дают ребенку. При белково-энергетической недостаточности питания отмечается снижение образования миелина. Недостаток жирных кислот тоже отрицательно сказывается на синтезе этого ценного вещества, так как оно больше чем на 2/3 состоит из липидов. Дефицит железа, йода и витаминов группы В приводит к снижению образования миелина [9]. В основном эти данные были получены при изучении лабораторных животных, но история, к сожалению, дала людям возможность оценить влияние недостатка еды и на формирующийся мозг ребенка [10]. Голодная зима (голл. hongerwinter) 1944–1945 гг. в Нидерландах привела к тому, что родилось множество детей, чьи матери плохо питались. Оказалось, что в условиях голодания мозг этих детей формировался с нарушениями. В частности, наблюдалось большое количество нарушений именно в белом веществе, то есть возникали проблемы с формированием миелина. В итоге это приводило к разнообразным психическим расстройствам.
Поврежденная обёртка
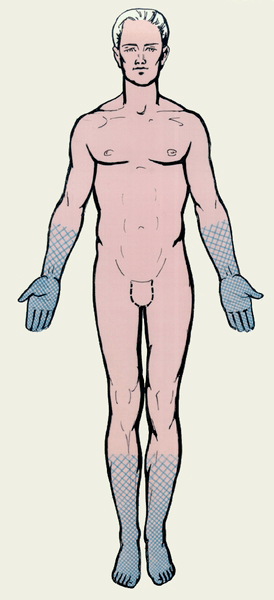
Рисунок 5. Нарушение чувствительности по полиневритическому типу. Название «носки — перчатки» связано с тем, что анатомические зоны, соответствующие поражению нервов, похожи на области, покрываемые этими предметами одежды.
Как мне кажется, для человеческого организма вполне подходит следующее правило: если есть орган, значит, к нему должна быть болезнь. В принципе, это правило можно расширить до молекулярных процессов: есть процесс — есть и болезни, связанные с нарушением этого процесса. В случае с миелином это демиелинизирующие заболевания. Их довольно много, но подробнее я расскажу о двух — синдроме Гийена-Барре и рассеянном склерозе. При этих расстройствах повреждение миелина приводит к нарушению адекватного проведения сигнала по нервам, что и обуславливает симптомы болезни.
Синдром Гийена-Барре (СГБ) — это заболевание периферической нервной системы, при котором происходит разрушение миелиновой оболочки, формируемой шванновскими клетками. СГБ является классическим аутоиммунным заболеванием. Как правило, ему предшествует инфекция (часто — вызванная микробом Campylobacter jejuni). Присутствие различных возбудителей в организме человека запускает аутоиммунное повреждение миелина нервных волокон T- и B-лимфоцитами. Клинически это проявляется мышечной слабостью, нарушением чувствительности по типу «носки — перчатки» (полиневритический тип) (рис. 5). В дальнейшем мышечная слабость может нарастать вплоть до полного паралича конечностей и поражения туловищной мускулатуры. Поражения чувствительной нервной системы также могут быть разнообразны: от снижения способности различать собственные движения (нарушение глубокой чувствительности) до выраженного болевого синдрома. При тяжелых формах СГБ главную опасность представляет потеря способности к самостоятельному дыханию, требующая подключения к аппарату искусственной вентиляции легких (ИВЛ). Для лечения СГБ в настоящее время используют плазмаферез (очистку плазмы от вредных антител) и внутривенные вливания препаратов человеческого иммуноглобулина для нормализации иммунного ответа. В большинстве случаев лечение приводит к стойкому выздоровлению.
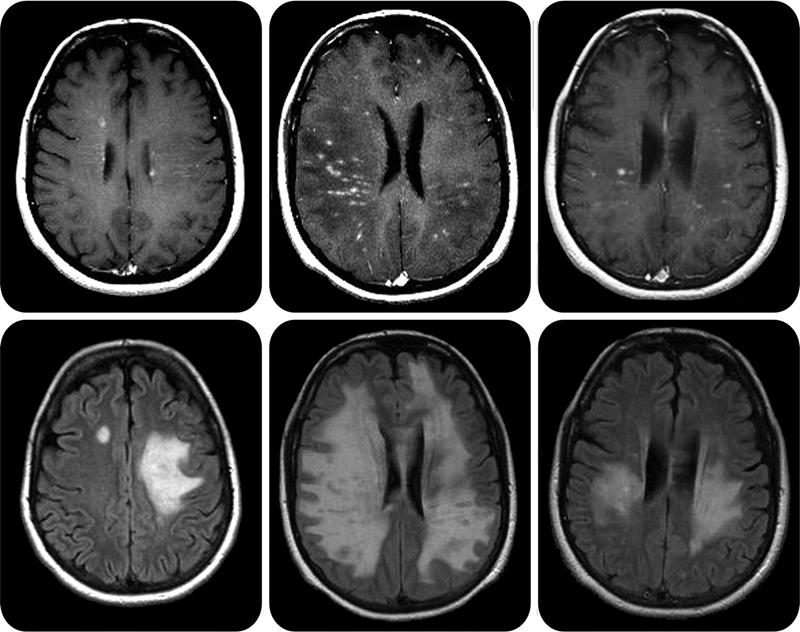
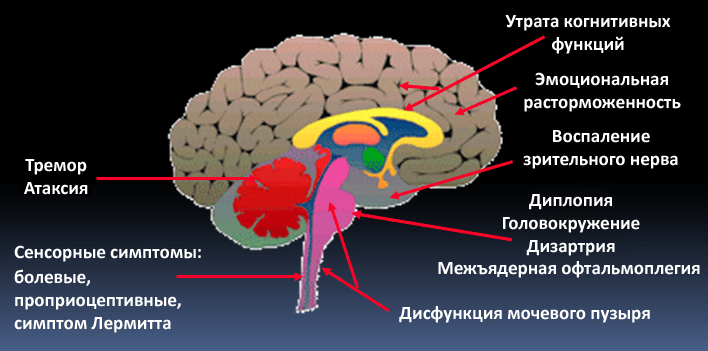
Рассеянный склероз (РС) заметно отличается от СГБ. Во-первых, это демиелинизирующее заболевание приводит к поражению центральной нервной системы, то есть затрагивает миелин, синтезируемый олигодендроцитами. Во-вторых, с причинами РС до сих пор много неясного: слишком большое разнообразие генетических и средовых факторов задействовано в патогенезе заболевания. Принципиальный момент в запуске РС — нарушение непроницаемости гематоэнцефалического барьера (ГЭБ) для иммунных клеток. В норме ткань мозга отгорожена от всего остального организма этим надежным фильтром, который не пропускает к ней множество веществ и клеток, в том числе иммунных. ГЭБ появляется уже в эмбриональном периоде развития, изолируя ткань мозга от формирующейся иммунной системы. В это время иммунная система человека «знакомится» со всеми существующими тканями, чтобы в дальнейшем, при взрослой жизни, не нападать на них. Мозг и ряд других органов остаются «не представленными» иммунной системе. При нарушении целостности ГЭБ иммунные клетки получают возможность для атаки незнакомых ей тканей мозга. В-третьих, РС отличается более тяжелыми симптомами, которые требуют других терапевтических подходов. Симптоматика зависит от того, где локализуются повреждения нервной системы (рис. 6 и 7). Это может быть шаткость походки, нарушения чувствительности, различные когнитивные симптомы. Для лечения РС используются высокие дозы глюкокортикоидов и цитостатики, а также препараты интерферона и специфические антитела (натализумаб). По-видимому, в дальнейшем будут развиваться новые методы лечения РС, основанные непосредственно на восстановлении миелиновой оболочки в поврежденных участках мозга. Ученые указывают на возможность трансплантации клеток — предшественниц олигодендроцитов или усиления их роста за счет введения инсулиноподобного фактора роста или тиреоидных гормонов [11]. Однако это еще впереди, а пока неврологам недоступны более «молекулярные» методы лечения.
Рисунок 6. Очаги поражения центральной нервной системы при рассеянном склерозе на МРТ выглядят как белые бляшки.
Рисунок 7. В зависимости от места поражения нервной системы при рассеянном склерозе может быть разная симптоматика: от тремора и атаксии при повреждении мозжечка до эмоциональных расстройств при локализации очагов в лобных долях.
- Wu L.M., Williams A., Delaney A., Sherman D.L., Brophy P.J. (2012). Increasing internodal distance in myelinated nerves accelerates nerve conduction to a flat maximum. Curr. Biol. 22, 1957–1961;
- Harauz G. and Boggs J.M. (2013). Myelin management by the 18.5-kDa and 21.5-kDa classic myelin basic protein isoforms. J. Neurochem. 125, 334–361;
- Kassmann C.M. (2014). Myelin peroxisomes — essential organelles for the maintenance of white matter in the nervous system. Biochemie. 98, 111–118;
- Venkatesh H.S., Johung T.B., Caretti V., Noll A., Tang Y., Nagaraja S. et al. (2015). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell. 161, 803–816;
- Tomassy G.S. and Fossati V. (2014). How big is the myelinating orchestra? Cellular diversity within the oligodendrocyte lineage: facts and hypotheses. Front. Cell Neurosci. 8, 201;
- Michalski J.-P. and Kothary R. (2015). Oligodendrocytes in a nutshell. Front. Cell Neurosci. 9, 340;
- Salzer J.L. (2012). Axonal regulation of Schwann cell ensheathment and myelination. J. Peripher. Nerv. Syst. 17, 14–19;
- Eluvathingal T.J., Chugani H.T., Behen M.E., Juhász C., Muzik O., Maqbool M. et al. (2006). Abnormal brain connectivity in children after early severe socioemotional deprivation: a diffusion tensor imaging study. Pediatrics. 117, 2093–2100;
- Prado E.L. and Dewey K.G. (2014). Nutrition and brain development in early life. Nutr. Rev. 72, 267–284;
- Hulshoff Pol H.E., Hoek H.W., Susser E., Brown A.S., Dingemans A., Schnack H.G. et al. (2000). Prenatal exposure to famine and brain morphology in schizophrenia. Am. J. Psychiatry. 157, 1170–1172;
- Bhatt A., Fan L.W., Pang Y. (2014). Strategies for myelin regeneration: lessons learned from development. Neural. Regen. Res. 9, 1347–1350.
Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.