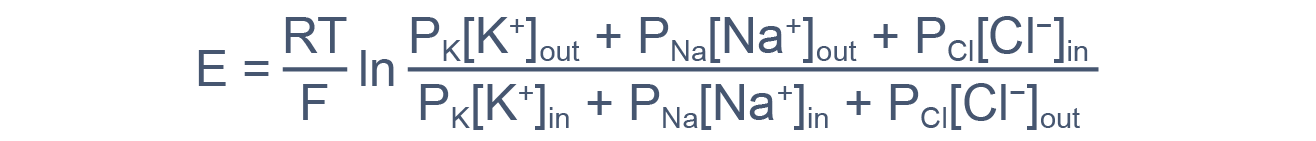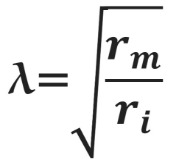Химический состав живых клеток отличается от внешней среды, причем различия есть не только в сложных молекулах, таких как белки и нуклеиновые кислоты, но и в ионах. Например, во внеклеточной среде преобладают ионы натрия, а в клетке — ионы калия, причем последних на порядок больше. Сама по себе плазматическая мембрана клеток практически непроницаема для ионов, и поэтому для их переноса через мембрану существуют специальные транспортные механизмы — встроенные в мембрану белки. В геноме человека более 800 генов ионных каналов и транспортеров, а общую долю генов, вовлеченных в трансмембранный транспорт, оценивают в 10 % от всех генов, кодирующих белки[1]. В этой серии статей мы рассмотрим механизмы трансмембранного переноса ионов и разнообразие реализуемых ими клеточных функций. Мы также уделим внимание патологиям, вызванным мутациями в генах, кодирующих соответствующие каналы и транспортеры.
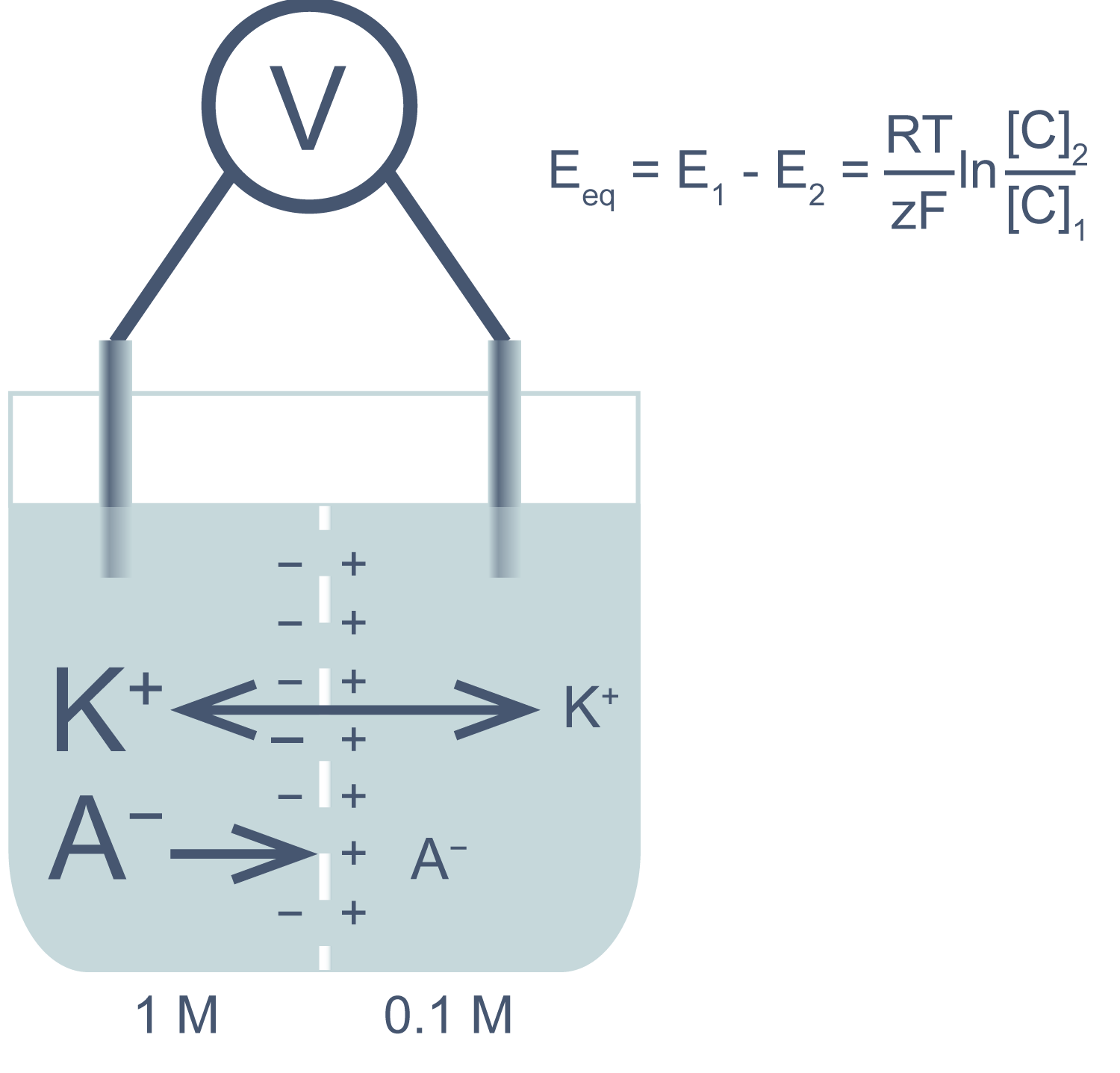
Представим себе электрохимическую ячейку — сосуд, разделенный пополам полупроницаемой мембраной, в левой части которого находится 1,0 М раствор KCl, а в правой — 0,1 М KCl. Через мембрану могут проходить катионы K+, но не анионы Cl−. Ионы K+ в результате процесса диффузии будут переходить из левого отсека в правый по градиенту концентрации*, тогда как ионы Cl−, неспособные последовать за катионами, останутся в исходном отсеке. Благодаря такому разделению зарядов на мембране будет накапливаться электрохимический потенциал: избыток анионов с левой стороны мембраны и избыток катионов с правой. Этот потенциал можно измерить, опустив в отсеки электроды, подсоединенные к вольтметру.
Асимметричный поток катионов не будет продолжаться бесконечно: накопленный электрический потенциал (с избытком положительного заряда с левой стороны мембраны) будет противодействовать диффузии ионов калия в левый отсек. Через некоторое время поток ионов K+ из правого отсека в левый сравняется по скорости с потоком из левого отсека в правый, и система достигнет равновесия. Для математического описания подобного равновесия применяют уравнение Нернста (рис. 1).
Рисунок 1 | Электрохимическая ячейка. V — вольтметр. Справа приведено уравнение Нернста, где Eeq — равновесный потенциал; E1 – E2 — разность потенциалов по обе стороны мембраны; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура (в кельвинах); F = 96485,55 Кл·моль–1 — константа Фарадея; z — степень окисления иона (его заряд); [C]1, 2 — равновесные концентрации ионов по обе стороны мембраны.
Если принять, что равновесные концентрации ионов K+ в нашем примере равны начальным, разность потенциала на мембране при 25 °C приблизительно равна –58 мВ.
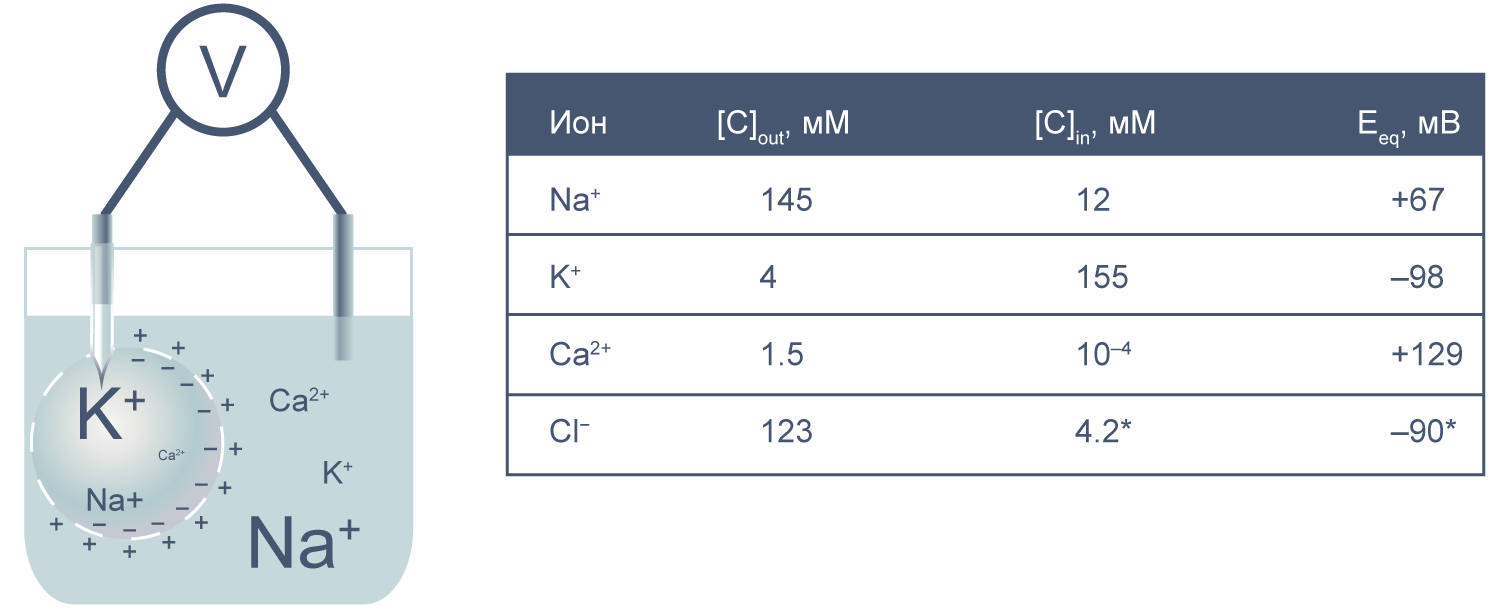
Рисунок 2 | Клетка как электрохимическая ячейка. Справа приведены концентрации основных ионов внутри и вне клетки[2].
Теперь представим, что левая часть нашей электрохимической ячейки — это живая клетка, а правая — внешняя среда. Добавим к этой картине концентрации других физиологически значимых ионов. На мембране клетки также будет накапливаться электрохимический потенциал. Величину электрической составляющей мембранного потенциала измеряют относительно потенциала вне клетки, принимая его за ноль.
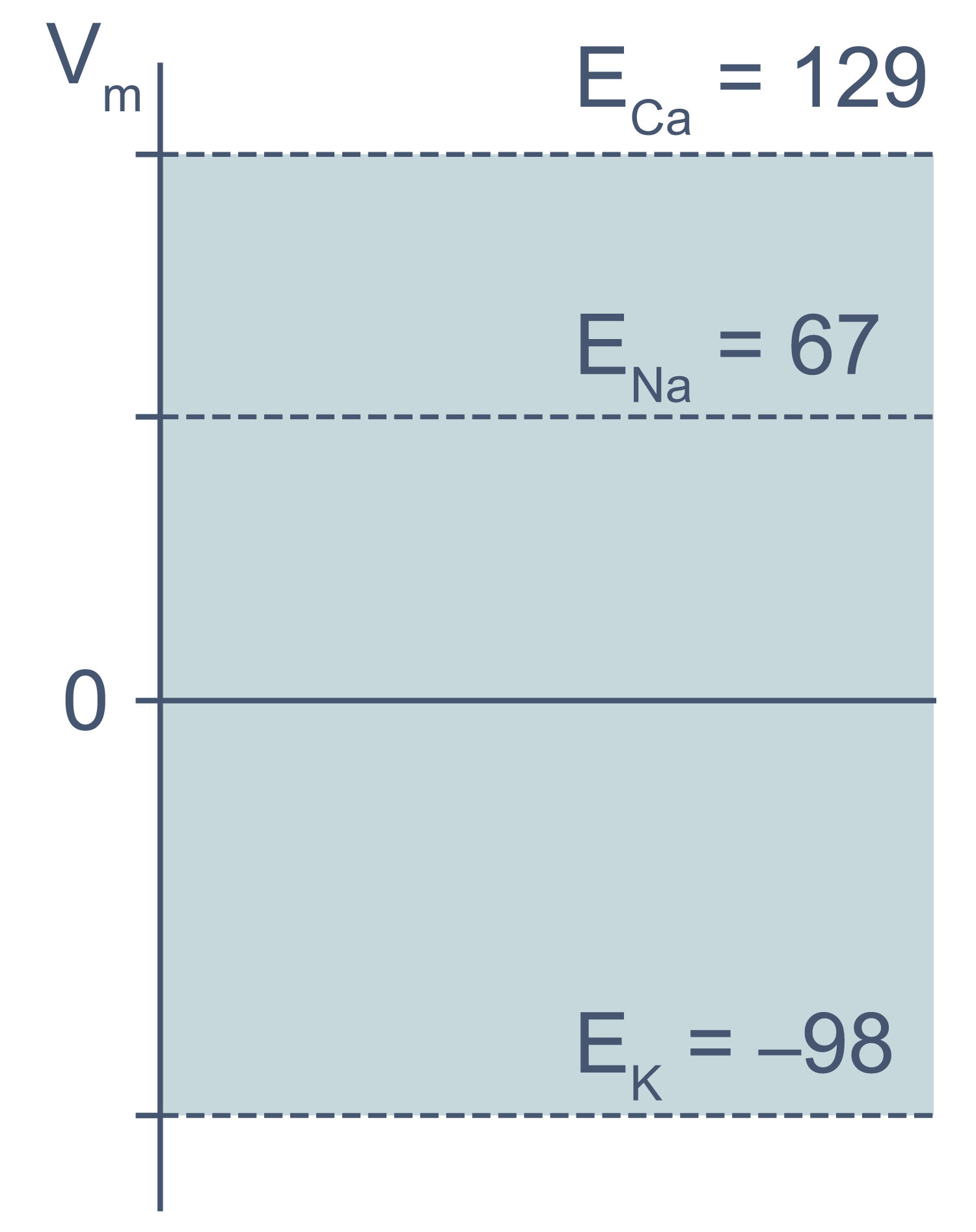
В первом приближении можно сказать, что мембрана клетки проницаема для калия и непроницаема для других катионов (Na+, Ca2+) и анионов (в первую очередь для Cl– и отрицательно заряженных участков макромолекул). Ионы калия, выходя из клетки, создают потенциал покоя. Его величина достаточно близка к значению равновесного потенциала для K+, однако строго не равна ему, поскольку в реальности другие катионы и Cl– могут участвовать в формировании потенциала покоя в различных типах клеток. Вычислив равновесные потенциалы для основных ионов, мы получим динамический диапазон величины потенциала на мембране клетки: он не может быть более отрицательным, чем EK, и не может достигать более положительных значений на пике потенциала действия, чем ECa. Причина такого поведения кроется в том, что система стремится к равновесию, и при малейших отклонениях мембранного потенциала в сторону более отрицательных значений, чем EK, K+ будет двигаться по электрохимическому градиенту внутрь клетки, возвращая мембранный потенциал к равновесному потенциалу для калия.
Рисунок 3 | Диапазон возможных значений мембранного потенциала от ЕK до ECa (показан голубым цветом).
Величина потенциала покоя зависит от типа клеток и равна около –30 мВ в невозбудимых клетках и около –80 мВ в возбудимых клетках (нейроны, мышечные и эндокринные клетки). Когда мембранный потенциал более отрицателен, чем потенциал покоя, говорят, что мембрана гиперполяризована, а когда он приближается к нулю или даже принимает положительные значения, говорят о деполяризации мембраны.
В общем случае мембранный потенциал можно вычислить согласно уравнению Гольдмана-Ходжкина-Катца, которое принимает в расчет все основные катионы и анионы:
где E — мембранный потенциал; R = 8,314 Дж/(моль·K) — универсальная газовая постоянная; T — абсолютная температура; F = 96485,55 Кл·моль–1 — константа Фарадея; PX — проницаемость мембраны для иона X; [C]in, out — равновесные концентрации ионов внутри и вне клетки. N.B.: для анионов внеклеточная концентрация стоит в знаменателе, а внутриклеточная — в числителе.
Что же обеспечивает проницаемость мембраны для ионов? Заряженные частицы не могут самостоятельно пересекать гидрофобный внутренний слой плазматической мембраны, и поэтому требуются специальные белки, образующие гидрофильную пору, через которую ионы могут двигаться через мембрану. Такие белки называются ионными каналами. Основной вклад в поддержание потенциала покоя вносят калиевые каналы семейств Kir (inward rectifying K+ channels — калиевые каналы внутреннего выпрямления) и K2P (two—pore domain K+ channels — калиевые каналы с двумя поровыми доменами, которые часто называют каналами утечки), а каналы других семейств могут обеспечивать быстрое изменение мембранного потенциала в возбудимых клетках. Каналы могут селективно пропускать определенный тип ионов, например, K+ (как каналы семейства Kir), или более широкий спектр веществ, как, например, коннексины — белки щелевых контактов.
Каналы бывают потенциал-зависимые (потенциал-управляемые), лиганд-зависимые, термо- и механочувствительные — в зависимости от стимула, который управляет открытием и закрытием канала. В роли стимула, таким образом, могут выступать изменения мембранного потенциала, химические агенты, температура, свет, механические и другие стимулы. Один и тот же канал может открываться под действием различных эндо- и экзогенных стимулов. Так, канал TRPV1 активируется повышением температуры более 43 °C[3], кислым pH[4] и разнообразными химическими веществами: капсаицином (алкалоид из перцев рода Capsicum)[3], эндоканнабиноидом анандамидом[5], окситоцином[6] и др.
Физиологическая роль каналов крайне важна. К примеру, мутации в генах, кодирующих белки ионных каналов, лежат в основе патогенеза многих заболеваний человека: некоторых видов эпилепсии[7], муковисцидоза[8], некоторых аритмий[9, 10] и др. Ионные каналы служат мишенями действия многих лекарств, ядов и токсинов.
Однако для формирования потенциала покоя недостаточно одних лишь каналов, ведь нужно создавать и поддерживать концентрационные градиенты на мембране. Основной механизм поддержания градиентов концентрации калия и натрия — это Na/K-АТФаза, фермент, за счет гидролиза одной молекулы АТФ переносящий три Na+ наружу и два K+ внутрь клетки. Она осуществляет электрогенный транспорт: в каждом транспортном цикле при переносе одного дополнительного положительного заряда наружу генерируется некоторая разность потенциалов на мембране. Чтобы оценить этот вклад Na/K-АТФазы в поддержание потенциала покоя, можно заблокировать работу фермента алкалоидом оубаином. Тогда мембрана деполяризуется примерно на 10 мВ[11].
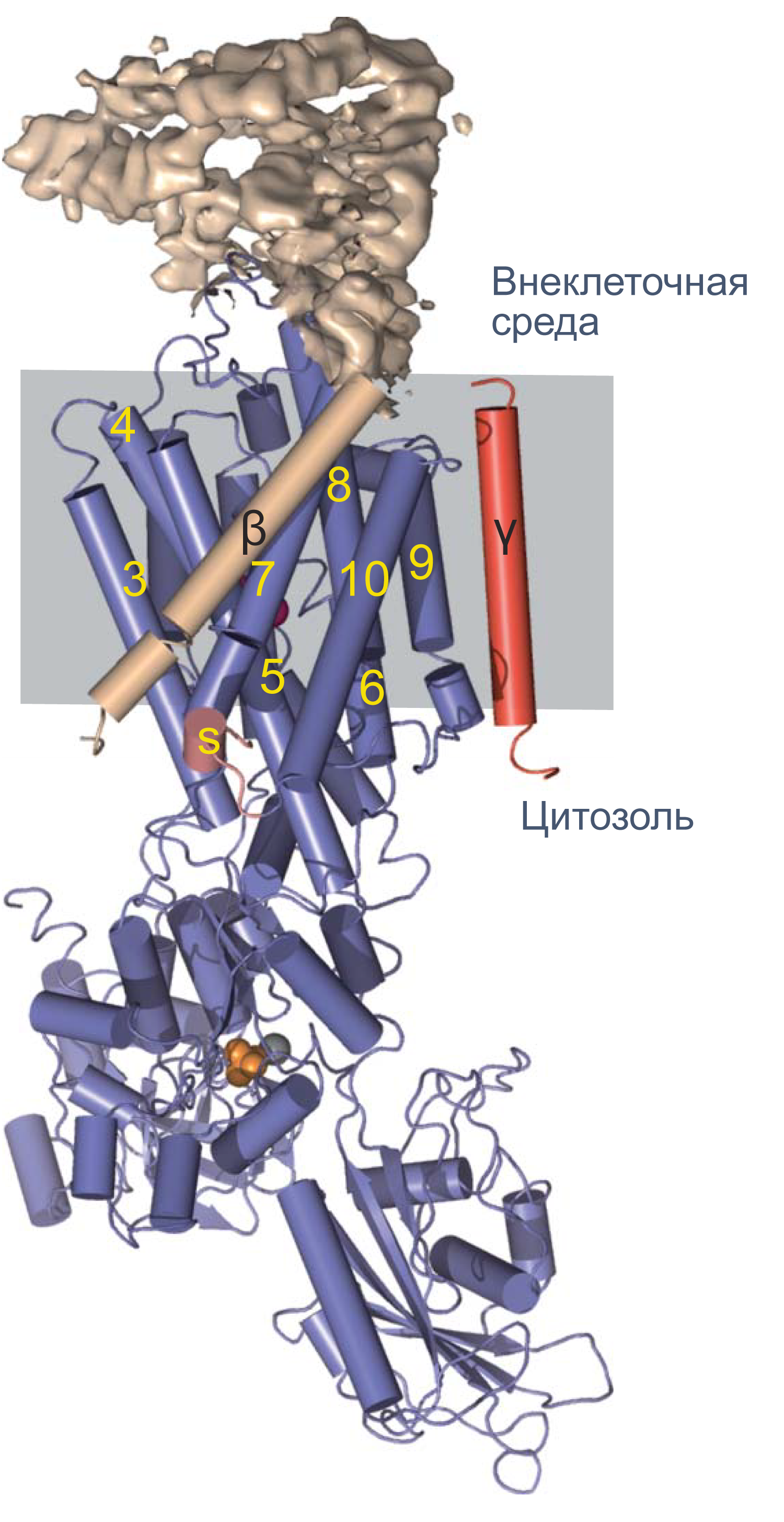
Рисунок 4 | Структура Na/K-АТФазы, полученная методом рентгеновской кристаллографии. Синим цветом показана α-субъединица, красным — γ-субъединица; β-субъединица показана бежевым цветом. Внеклеточная часть β-субъединицы показана в виде электронной плотности. Альфа-спирали изображены цилиндрами, бета-слои — плоскими стрелками[12].
Активный и пассивный транспорт веществ через мембрану
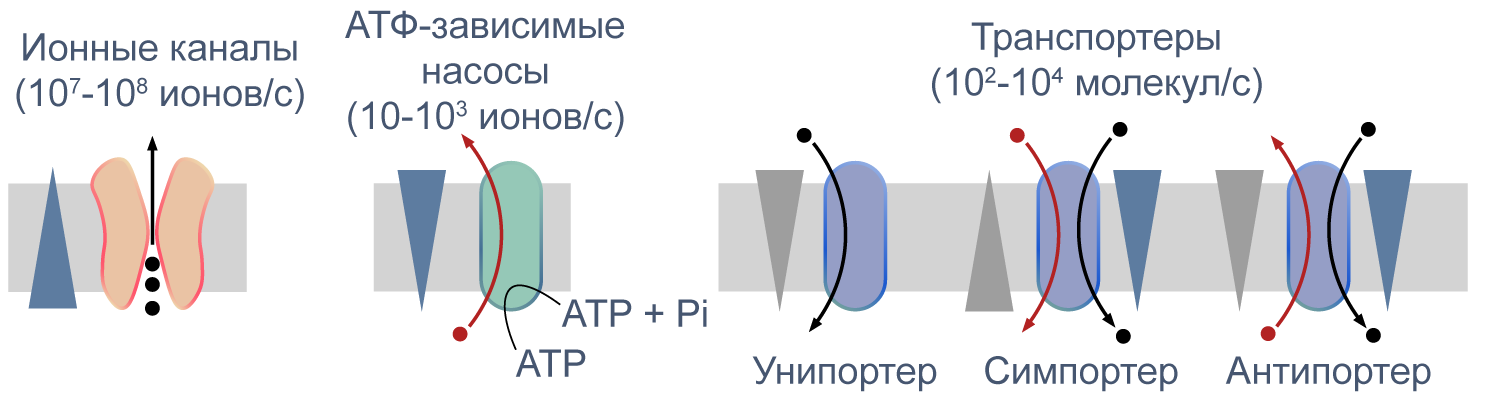
Процессы транспорта веществ через мембрану можно классифицировать по источнику энергии для транспорта. Пассивный транспорт — это движение вещества через канал или транспортер по градиенту концентрации*, то есть за счет энергии электрохимического градиента. Таким способом через калиевые каналы пассивно движутся ионы калия, или осуществляется перенос глюкозы через транспортер GLUT4 (такой тип транспорта еще называют облегченной диффузией, а транспортеры, переносящие только один субстрат — унипортерами). Кроме пассивного транспорта, существует активный транспорт, при котором субстраты переносятся против градиента концентрации с затратой энергии, запасенной клеткой в виде АТФ (например, Na/K-АТФаза).
Некоторые транспортеры сопрягают перенос ионов или молекул против градиента концентрации с движением ионов по градиенту концентрации. Симпортеры переносят различные частицы в одном направлении (например, KCC2 — K—Cl cotransporter 2 — K/Cl котранспортер 2), а антипортеры, или обменники, — в противоположных (например, NHE-1 — Na/H exchanger 1 — Na/H обменник, участвующий в поддержании клеточного pH). Такой транспорт называется вторично-активным.
Рисунок 5 | Пассивный и активный транспорт веществ через мембрану. Треугольниками показаны концентрационные градиенты. Черными стрелками показано движение по градиенту концентрации, красными — против градиента концентрации. По [13], с изменениями.
В старой литературе можно встретить концепцию «белков-переносчиков»: до открытия молекулярной идентичности многих каналов и транспортеров (т. е. какая молекула опосредует данный ионный ток и какой ген ее кодирует) существовало представление о переносчиках как о челноках, связывающих субстраты с одной стороны мембраны, диффундирующих через мембрану и высвобождающих субстраты с другой стороны. Однако, когда стали известны аминокислотные последовательности транспортных белков, стало понятно, что все они часто содержат многочисленные трансмембранные домены и образуют сквозной путь через мембрану.
Различия между каналами, транспортерами и насосами заключаются в механизме их работы и регуляции. Каналы представляют собой более или менее селективную пору, через которую ионы могут свободно диффундировать, не вызывая конформационных изменений в белке канала. При токе через отдельный канал в 1 пА по нему проходят 6×106 одновалентных ионов в секунду. Транспортер, связываясь с субстратом, изменяет свою конформацию для переноса субстрата. При ко-транспорте повышается аффинность транспортера в новой конформации к второму субстрату, и субстраты переносятся через мембрану сопряженно. Насосы, также называемые АТФазами, (ауто)фосфорилируются АТФ, и это фосфорилирование значительно изменяет их конформацию и приводит к транслокации субстратов через мембрану. Электрическая проводимость насосов очень мала: Na/K-АТФаза переносит всего около 300 Na+ и 200 K+ в секунду.
Граница между молекулами каналов и транспортеров не всегда строга. Например, семейство хлоридных каналов и транспортеров ClC (англ. Chloride Channel) включает в себя гомологичные друг другу каналы (ClC-1, 2, Ka и Kb) и Cl/H-обменники (ClC-3–7), которые можно превратить в каналы, внеся мутацию в единственный остаток глутамата (т. н. gating glutamate — воротный глутамат) [14]. Na/K-АТФазу также можно превратить в простую пору, например, с помощью палитоксина[15]. Хлоридный канал CFTR относится к группе ABC-транспортеров, однако он использует энергию АТФ не для транспорта ионов, а для регуляции открытия и закрытия канала[16]. Кроме того, существуют данные о том, что везикулярный транспортер глутамата VGLUT1 кроме обмена глутамата на протоны также опосредует не сопряженный с обменом ток Cl− [17].
Клеточная мембрана как электрическая цепь
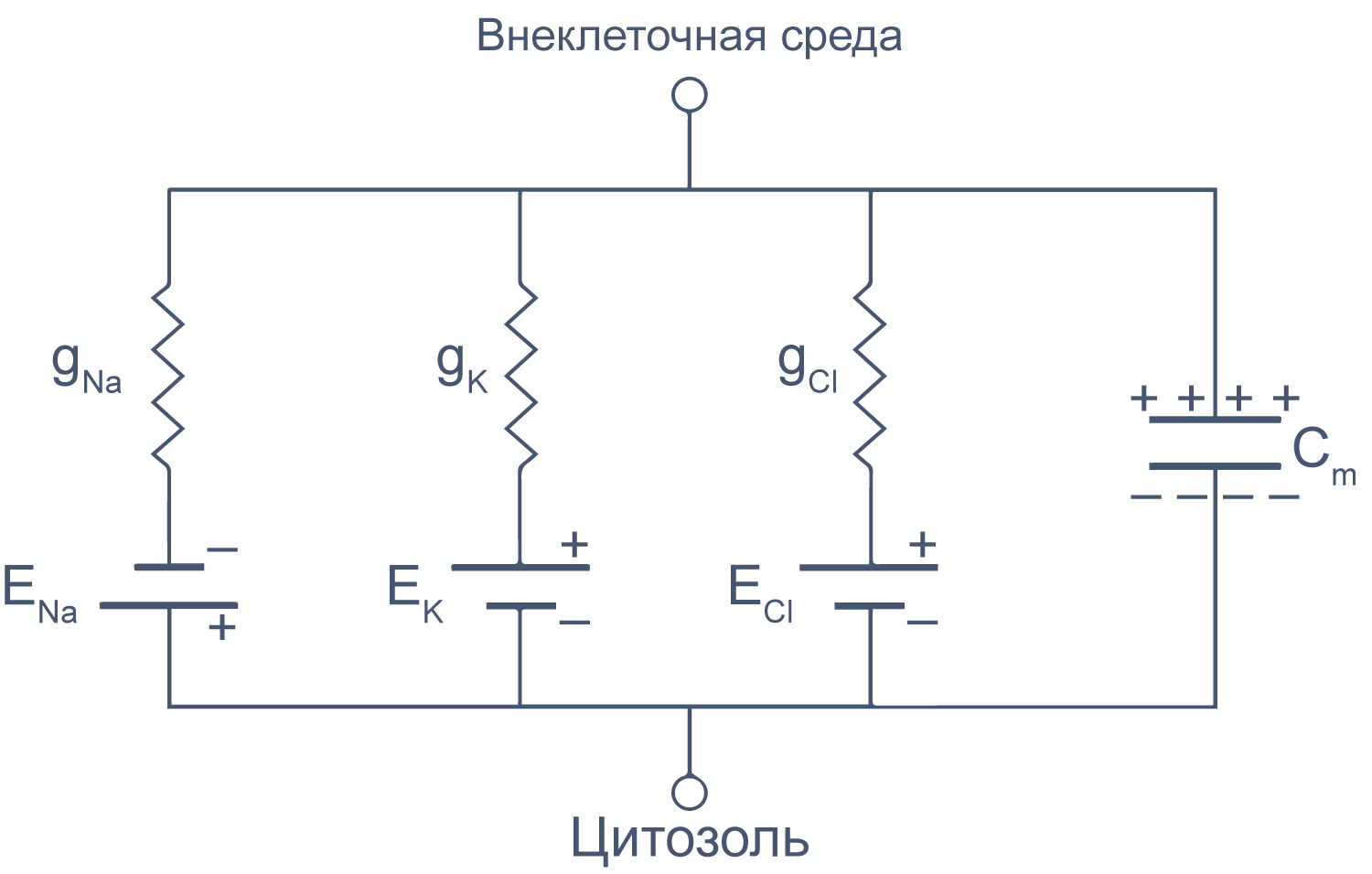
Липидный бислой мембраны можно представить как резистор (сопротивление) и конденсатор (емкость), соединенные параллельно. Величина сопротивления зависит от плотности каналов в мембране и их функционального состояния. Электроемкость возникает из-за разделения зарядов по обе стороны мембраны тонким слоем диэлектрика (гидрофобными хвостами фосфолипидов).
Рисунок 6 | Плазматическая мембрана, представленная в виде RC схемы. gNa, gK, gCl — проводимость** мембраны для ионов Na+, K+ и Cl–, соответственно; ENa, EK, ECl — электродвижущая сила, или равновесные потенциалы для соответствующих ионов, Сm — электроемкость мембраны.
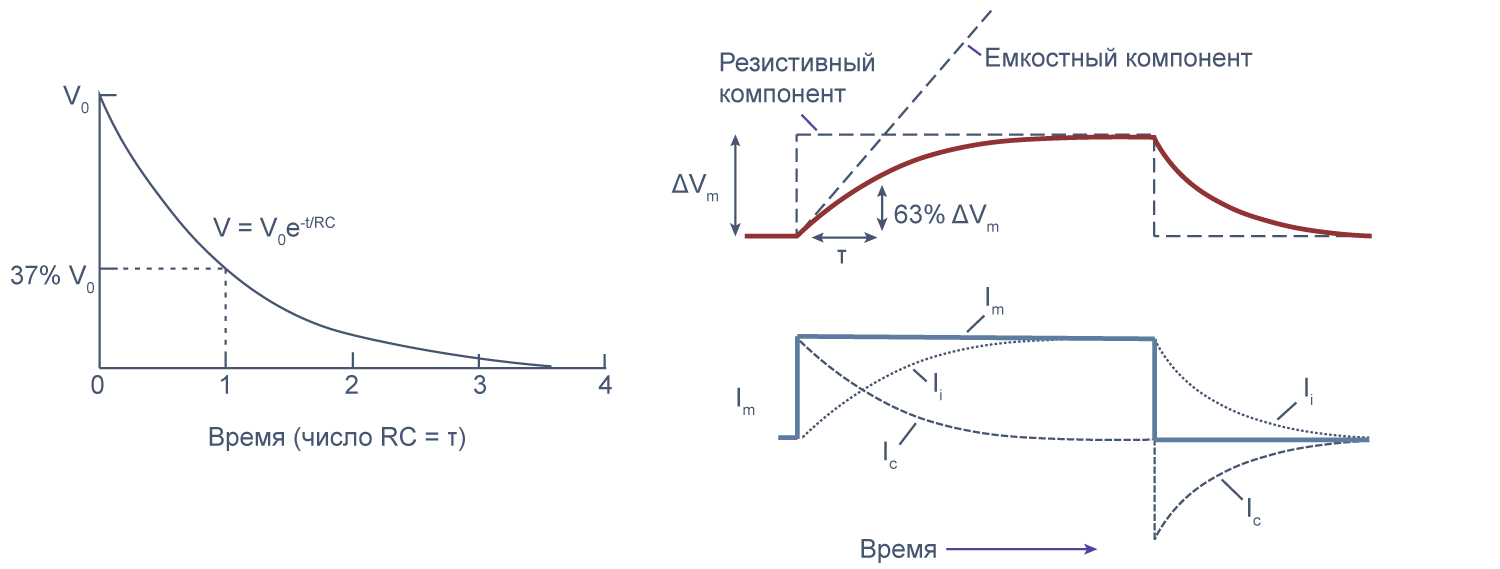
Можно считать, что проводимость (величина, обратная сопротивлению, измеряемая в сименсах) характеризует проницаемые для ионов компоненты структуры мембраны, а емкость — не проницаемые для ионов структуры. Удельная емкость мембраны составляет приблизительно 1 мкФ/см2 или 0,01 пФ/мкм2*** и мало зависит от типа клеток[2]. Это позволяет оценить размер клетки по ее электрическим характеристикам. Высокая электроемкость клеточных мембран задерживает изменения потенциала в ответ на ток. Эту задержку можно выразить через постоянную времени τ, которая равна произведению емкости и параллельно соединенного с ней сопротивления (RC). Если конденсатор зарядить на некоторую величину, а затем дать ему разрядиться через резистор, то потенциал будет убывать экспоненциально согласно формуле V = V0e–t/RC, то есть за каждые τ = RC секунд потенциал будет падать в 1/e раз (на 37 % от исходной величины). Этот расчет применим и к клеточной мембране: падение напряжения при разрядке мембраны будет подчиняться экспоненциальному закону. То есть, если приложить гипер- или деполяризующий стимул, то мембранный потенциал через время τ достигнет 63 % конечного сдвига.
Рисунок 7 | Падение напряжения при разрядке мембраны. Изменение мембранного потенциала при деполяризации мембраны на ΔVm [22], Ic — емкостный ток, Ii — ионный ток, Im — суммарный ток через мембрану. Пояснения в тексте.
Потенциал действия
Возбудимые клетки могут быстро изменять потенциал на мембране и этим запускать внутриклеточные процессы, например, мышечное сокращение или экзоцитоз везикул. Кратковременный локальный скачок мембранного потенциала от приблизительно –80 мВ (значения потенциала покоя) до 0…+20 мВ за счет изменения проницаемости мембраны для ионов называется потенциалом действия.
Для начала рассмотрим потенциал действия в аксонах нейрона на примере гигантского аксона кальмара. Выбор столь экзотического объекта обусловлен историческими причинами. Современная микроэлектродная техника — использование тонких стеклянных микропипеток, заполненных раствором электролита, — была предложена лишь в 1949 году Дж. Лингом и Р. Джерардом[18]. До этого поместить электрод, представлявший собой тонкую проволоку, внутрь клетки, не разрушив ее, можно было только в случае ее крупных размеров. Гигантский аксон кальмара стал идеальным модельным объектом для изучения потенциала действия: его диаметр может достигать 0,5–1 мм. Этот отросток служит для быстрой передачи нервных импульсов у беспозвоночных, у которых отсутствует миелинизация. Внутренним содержимым аксона легко манипулировать, заменяя ионный состав внутриклеточного раствора, а внутрь такого аксона можно поместить электрод для регистрации мембранного потенциала.
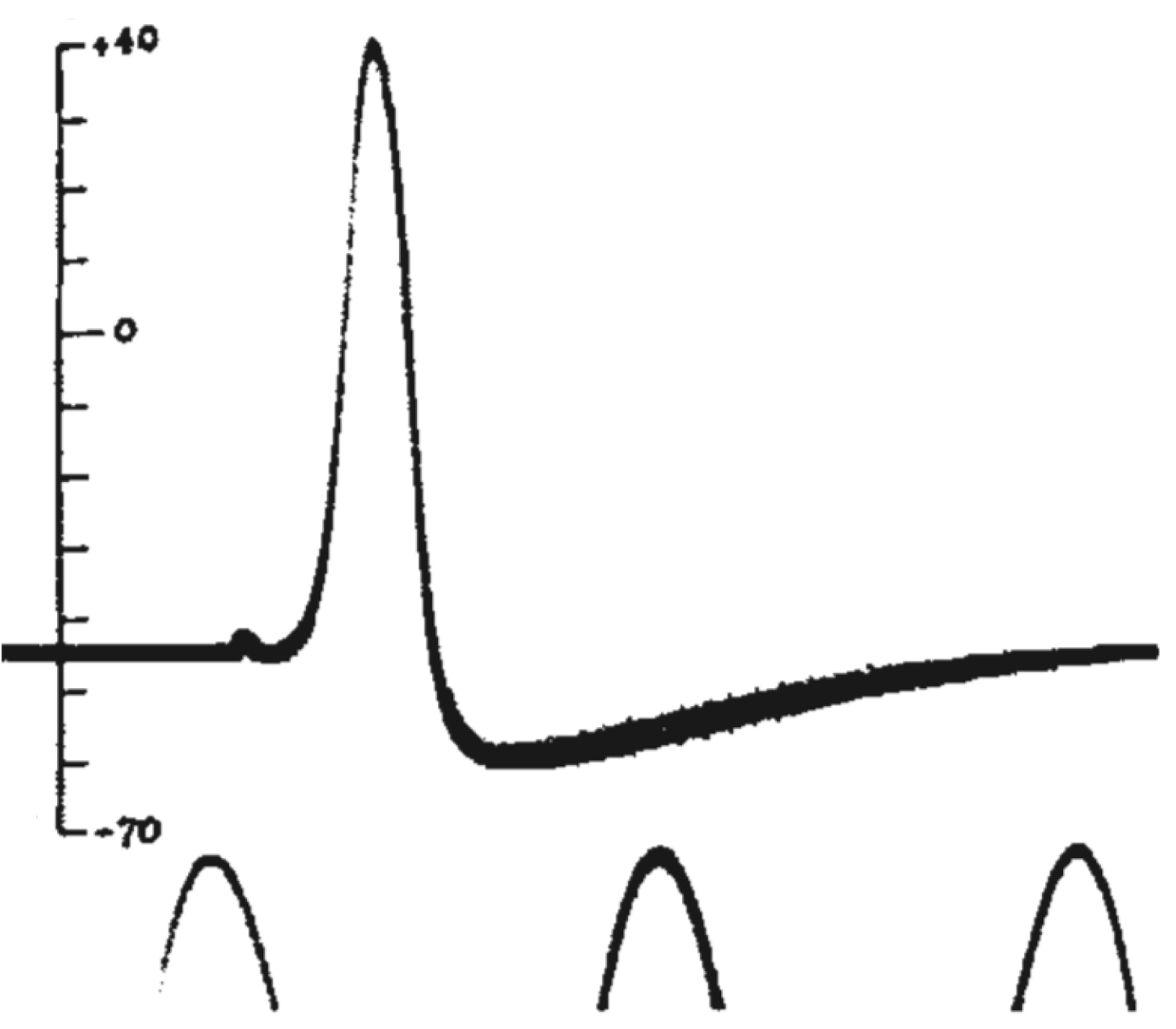
Так, в 1939 году А. Ходжкин и Э. Хаксли опубликовали в журнале Nature короткую заметку «Потенциалы действия, зарегистрированные внутри нервного волокна»[19], в которой они описали первый эксперимент по внутриклеточному измерению мембранного потенциала на гигантском аксоне кальмара. Посмотрим на потенциалы действия, которые зарегистрировали исследователи.
Рисунок 8 | Потенциал действия из статьи А. Ходжкина и Э. Хаксли 1939 года[19]. Потенциал действия был зарегистрирован как разность потенциала между внутренней средой аксона и внешней средой. Пики внизу рисунка — это фрагменты синусоидального сигнала с частотой 500 Гц. Вертикальной чертой отмечен потенциал внутреннего электрода в милливольтах, потенциал морской воды снаружи аксона был принят за ноль.
Мы видим резкую деполяризацию мембраны до положительных значений, а затем более плавное возвращение потенциала к отрицательным значениям, зачастую более отрицательным, чем величина потенциала покоя. Из этих наблюдений следовало два важных вывода: 1) потенциал действия генерируется мембраной клетки, что не было очевидно в 1930-е годы; 2) поскольку измеренная амплитуда потенциала действия была больше величины мембранного потенциала, генерация потенциала действия — это активный процесс, который нельзя объяснить временным «пробоем» в мембране (каким бы наивным такое представление нам не казалось сегодня, в 1930-е так думали многие физиологи). В том же году К. С. Коул и Х. Дж. Кертис[20] зарегистрировали кратковременное изменение проводимости мембраны с 1 мСм/см2 до 40 мСм/см2 при генерации потенциала действия. Эти данные также свидетельствовали о тонкой регуляции этого процесса.
После Второй мировой войны Ходжкин и Хаксли вернулись к своим исследованиям. В 1945 году они опубликовали статью с несколькими дополнительными экспериментами, подтверждающими сформулированные ранее выводы. Но и тогда ионные механизмы потенциала действия оставались неясными.
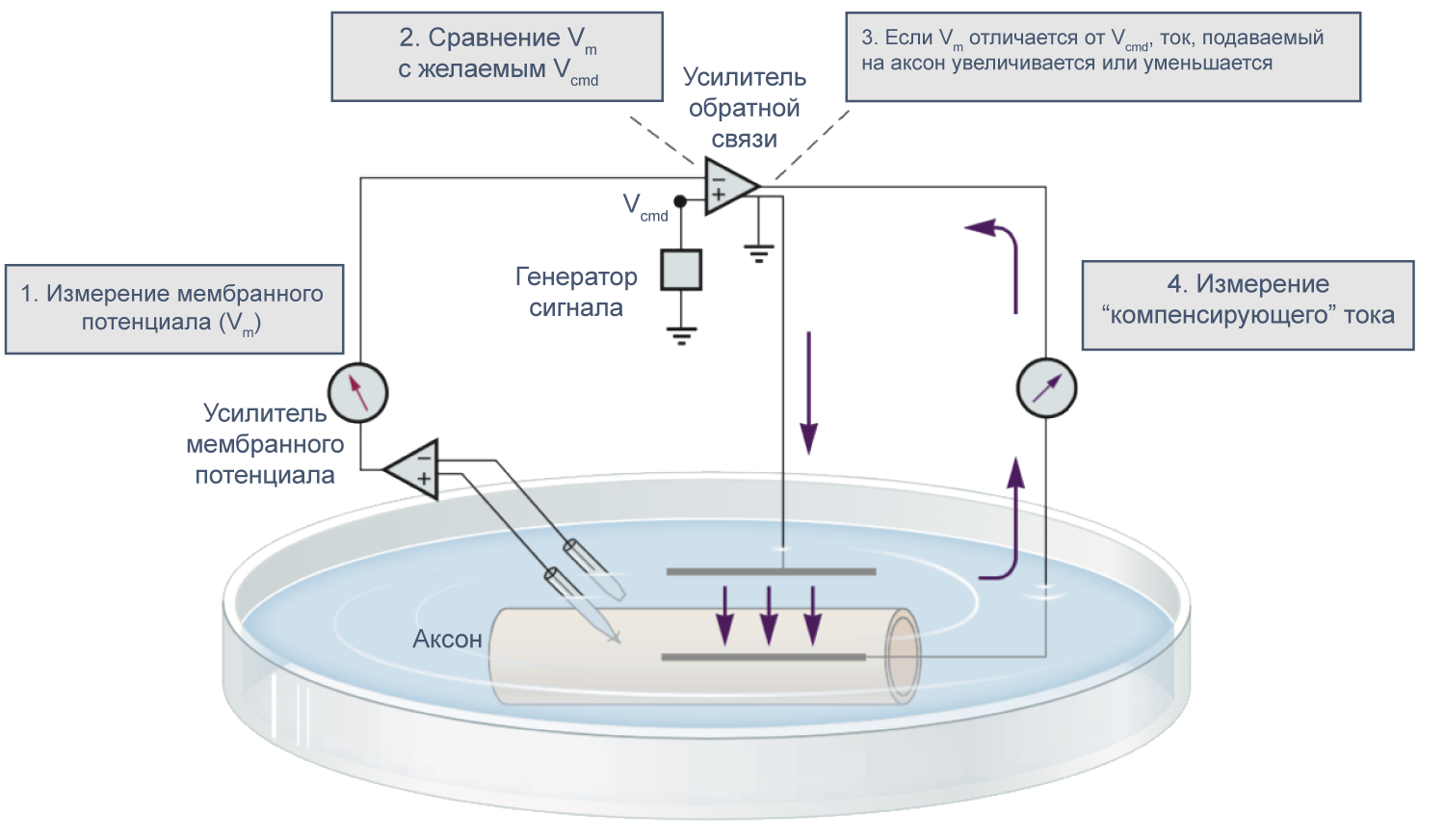
В 1952 году вышла серия статей, посвященных разгадке механизма генерации потенциала действия. Ведущую роль в этом открытии сыграл новый метод фиксации потенциала с помощью двух электродов (в англоязычной литературе TEVC — two-electrode voltage clamp), разработанный в конце 1940-х годов К. С. Коулом и Дж. Мармонтом[21]. Этот метод позволяет измерять не только потенциал, но и токи при заданном значении мембранного потенциала. Как же осуществляется фиксация потенциала с помощью двух электродов на заданном уровне (Vcmd — «командный потенциал»)? В клетку помещают два электрода, один из которых измеряет потенциал (относительно внеклеточного электрода сравнения) и передает его значение на специальный усилитель, который сравнивает измеренный потенциал со значением командного потенциала. Это устройство вычисляет ток, необходимый для компенсации этой разницы, и подает через второй внутриклеточный электрод ток такой величины, чтобы потенциал на мембране клетки стал равен Vcmd (Vm = Vcmd). Из амплитуды тока, необходимого для компенсации сдвига потенциала до Vcmd, можно сделать вывод о токе через мембрану при данном значении мембранного потенциала. Ток при данном значении потенциала равен току, подаваемому на второй электрод, взятому с обратным знаком.
Рисунок 9 | Схема фиксации потенциала с помощью двух электродов[21].
В 1970–80-х годах Эрвин Неер и Берт Сакман (Erwin Neher, Bert Sakmann) предложили метод локальной фиксации потенциала (англ. patch clamp), позволяющий работать с мелкими клетками и токами малой амплитуды и даже регистрировать активность отдельных каналов. Тем не менее, метод фиксации потенциала двумя электродами в микроэлектродной конфигурации используется и сегодня при работе с такими крупными клетками, как ооциты лягушки Xenopus laevis.
Временной ход потенциала действия
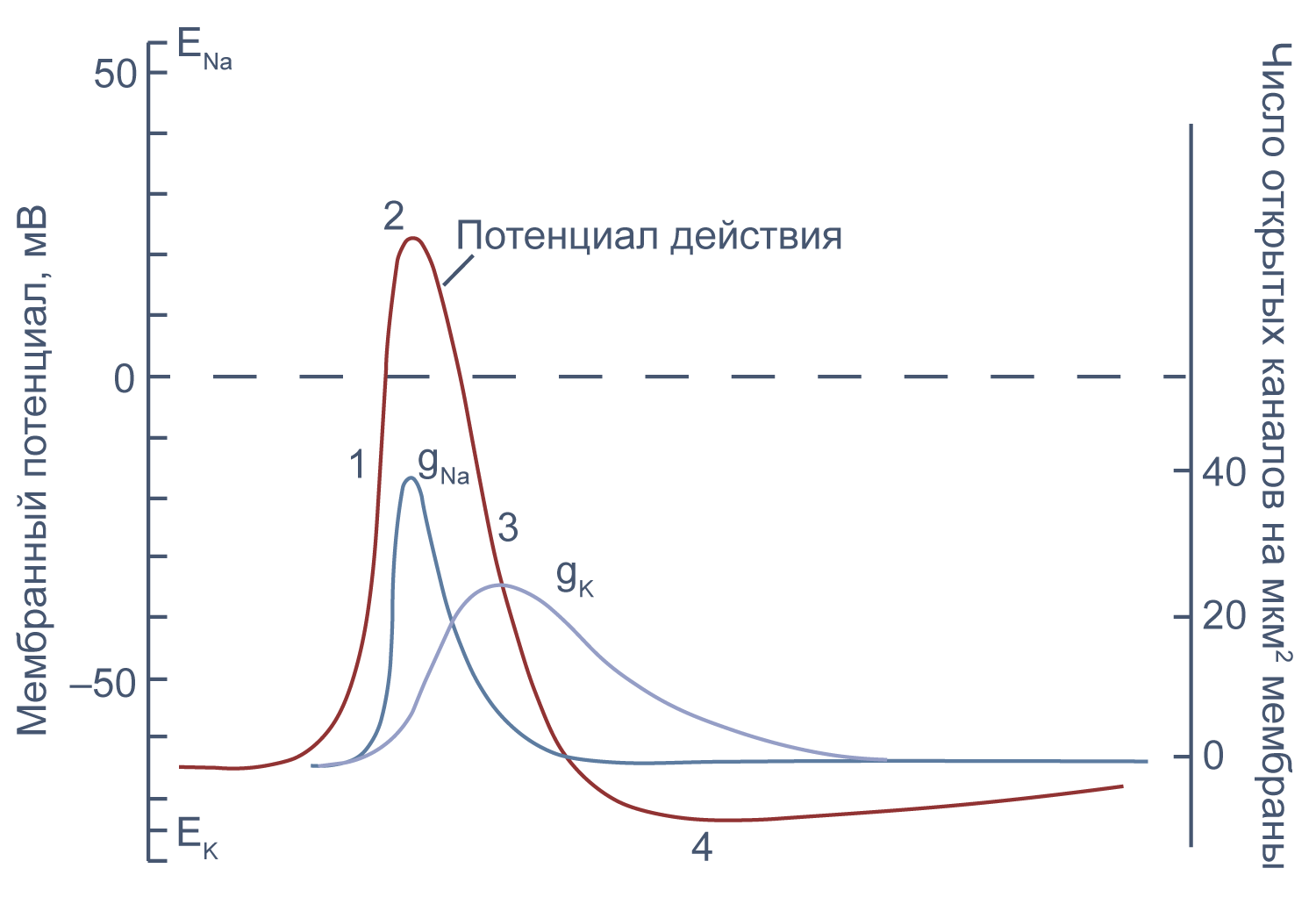
Потенциал действия в аксоне можно разделить на 1) фазу быстрой деполяризации до 2) положительных значений (овершута, от англ. overshoot), 3) фазу реполяризации, в которой потенциал возвращается к потенциалу покоя или даже до несколько более отрицательных значений — 4) следовая гиперполяризация.
Рисунок 10 | Потенциал действия и изменения проводимости мембраны для Na+ и K+ в гигантском аксоне кальмара. Из [22], с изменениями.
Изменяя ионный состав внутри- и внеклеточного раствора, можно изолировать ионные токи, которые опосредуют изменение мембранного потенциала при потенциале действия. Так, помещая аксон в раствор, в котором натрий заменен на холин, можно изолировать натриевый и калиевый компонент потенциала действия, то есть отдельно измерить калиевый ток[20]. Этого же можно достичь применением блокаторов потенциал-зависимых натриевых и калиевых каналов — тетродотоксина и тетраэтиламмония (TEA).
Чтобы понять взаимосвязь ионных токов и вызванных ими изменений потенциала, рассмотрим всю цепь событий при генерации потенциала действия. Сначала мембрана деполяризуется под действием внешнего стимула: поступления в клетку катионов через лиганд-управляемые каналы, закрытия калиевых каналов или электрической стимуляции в эксперименте. Если деполяризация достигает порогового значения для потенциалзависимых натриевых каналов (Nav), они открываются, натрий по градиенту своей концентрации входит в клетку, и мембрана деполяризуется еще сильнее. Дальнейшая деполяризация влечет за собой лавинообразное открытие все новых натриевых каналов, ток через которые приводит к еще большей деполяризации. Однако эта петля положительной обратной связи не работает бесконечно: открывшись на некоторое время, натриевые каналы инактивируются и не могут открыться вновь, пока мембранный потенциал не вернется к отрицательным значениям.
Механизм инактивации был предложен еще в математической модели Ходжкина и Хаксли[23] на основании кинетических характеристик тока. Они предположили, что в натриевом канале есть три активационные частицы m и одна инактивационная частица h. Когда стала известна аминокислотная последовательность канала, выяснилось, что канал на самом деле имеет четыре гомологичных активационных домена и один инактивационный, однако один из активационных доменов срабатывает значительно медленнее остальных трех, и его влияние на кинетические характеристики тока маскируется происходящей в то же время инактивацией канала (например, [24]).
В то же время деполяризация мембраны приводит к активации потенциал-зависимых калиевых каналов (Kv), которые открываются медленнее, чем натриевые, калий выходит из клетки, и потенциал возвращается к потенциалу покоя и может даже временно стать более отрицательным: пока натриевые каналы инактивированы, потенциал становится ближе к калиевому равновесному потенциалу, и это явление называется следовой гиперполяризацией.
Генерация потенциала действия происходит по принципу «все или ничего». Если деполяризующий стимул не достиг порогового значения, потенциал действия не генерируется. Если же порог был достигнут, положительная обратная связь обеспечивает открытие всех доступных натриевых каналов, и потенциал действия достигает своей максимальной амплитуды.
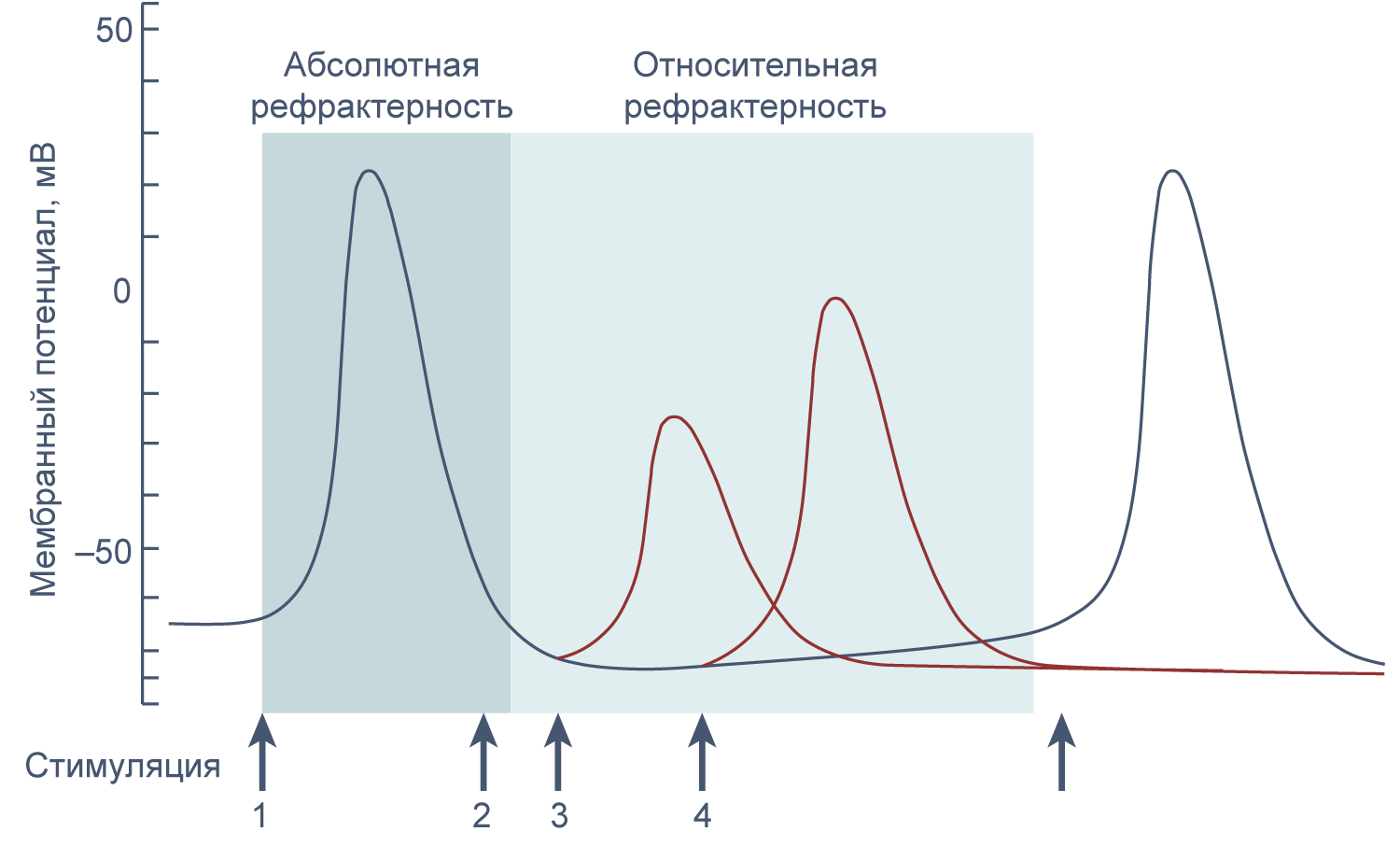
Если новый стимул приходит во время или сразу после генерации потенциала действия, второй потенциал действия не возникает или обладает меньшей амплитудой, чем первый. Это явление называется рефрактерностью. Стимул, возникший в период абсолютной рефрактерности, не вызывает генерации потенциала действия, а пришедшийся на период относительной рефрактерности вызывает потенциал действия уменьшенной амплитуды, так как часть натриевых каналов все еще инактивирована.
Рисунок 11 | Абсолютная и относительная рефрактерность. Стимуляция в период абсолютной рефрактерности (2) не ведет к генерации потенциала действия, а стимуляция в период относительной рефрактерности (3 и 4) приводит к генерации потенциала действия сниженной амплитуды.
Стоит отметить, что внутриклеточная концентрация физиологически значимых ионов при генерации потенциала действия не меняется, и ионные токи задействуют пренебрежимо малую долю от общего числа Na+ и K+. Это можно проиллюстрировать следующим примером. Рассчитаем число ионов, которое должно пересечь мембрану для деполяризации на 100 мВ. Заряд на мембране равен произведению емкости мембраны и потенциала: Q = CmVm. Удельная емкость мембраны близка к 1 мкФ/см2, а сдвиг потенциала в нашем случае равен 0,1 В. Тогда количество разделенных зарядов равно Q = 10−6 Ф/см2 × 0,1 В = 10−7 Кл/см2. Величина заряда одного иона Na+ или K+ (элементарного заряда) равна 1,6 × 10−19 Кл, тогда количество переносимых через мембрану ионов равно 10−7 Кл/см2 / 1,6 × 10−19 Кл = 6,25 × 1011 ионов/см2, или 6250 ионов/мкм2. Для клетки диаметром 10 мкм площадь поверхности мембраны будет приблизительно равна 4πr2 = 314 мкм2 (в этом расчете для простоты мы считаем клетку гладкой сферой), а объем — 4πr3/3 = 524 мкм3. При внутриклеточной концентрации Na+ 10 мМ, а K+ 150 мМ содержание этих ионов в цитозоле будет равно 3,2 × 109 и 4,7 × 1010 соответственно. В течение одного потенциала действия приблизительно 314 мкм2 × 6,250 ионов/мкм2 ≈ 2 000 000 ионов Na+ входит в клетку в фазе деполяризации и примерно столько же ионов K+ выходит из клетки в фазе реполяризации, что составляет всего 0,06 % от общего числа ионов натрия в клетке. Токи такой величины обычно не изменяют макроскопические концентрации ионов в клетке, поскольку работа Na/K-АТФазы компенсирует эти незначительные изменения. Однако при определенных условиях концентрации Na+ и K+ все же могут измениться, например, при продолжительной стимуляции аксонов с малым диаметром[25].
Распространение возбуждения по аксону
Электрические свойства мембраны помогают понять изменения мембранного потенциала не только во времени, но и в пространстве. Пассивное, или электротоническое распространение возбуждения по мембране происходит без изменения проводимости потенциал-зависимых каналов. Для распространения потенциала действия важен как активный (изменение проводимости натриевых и калиевых каналов), так и пассивный механизмы, поскольку деполяризация, вызывающая открытие новых потенциал-зависимых натриевых каналов, должна достигнуть нового невозбужденного участка аксона, и происходит это благодаря электротоническому распространению возбуждения.
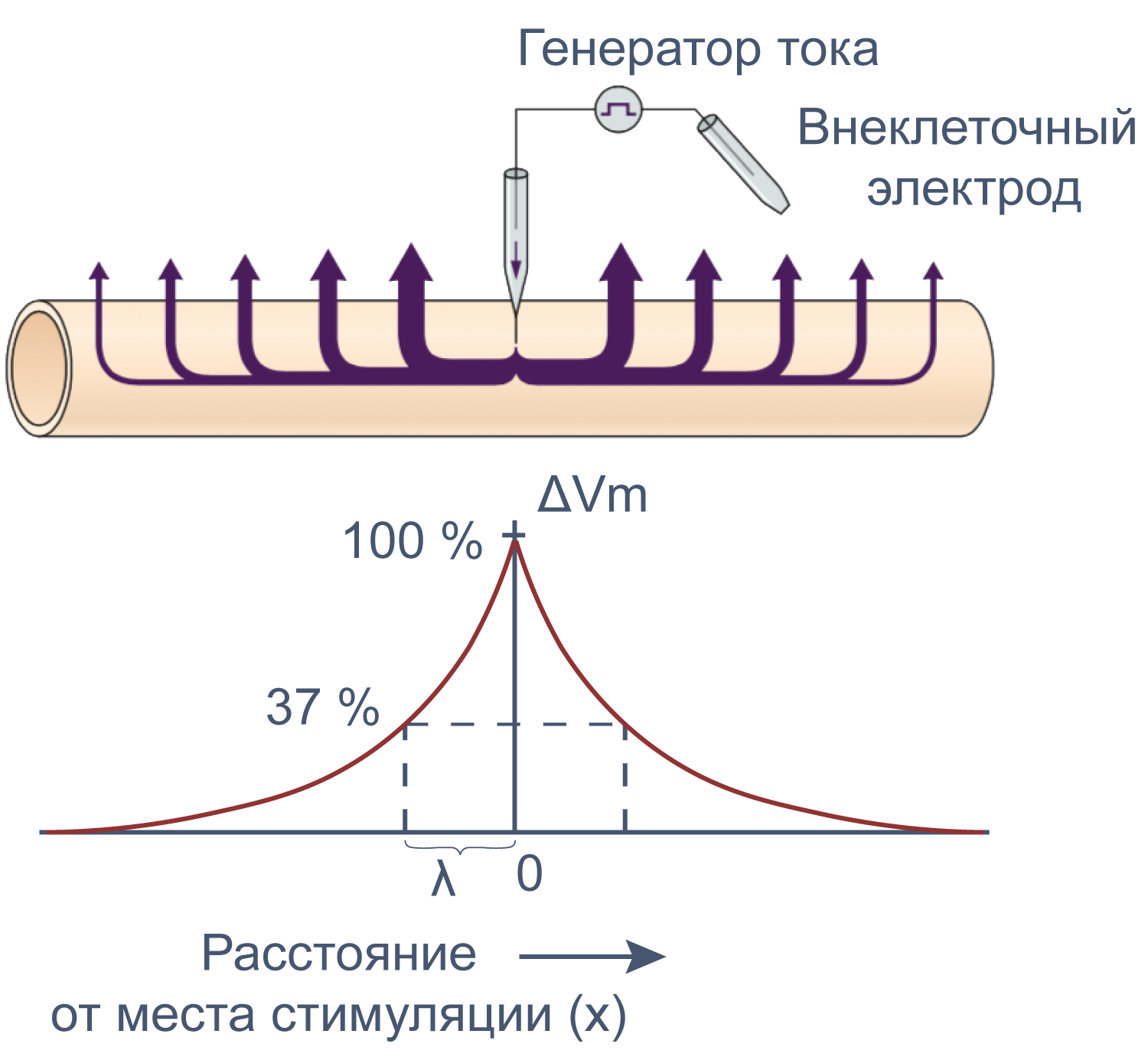
Рисунок 12 | Электротоническое распространение возбуждения. Пояснения в тексте [22].
Сдвиг потенциала в точке, отстоящий на x от места стимуляции, можно вычислить как Ex = E0e–x/λ, где E0 — это сдвиг потенциала в точке стимуляции, а λ — постоянная длины.
Постоянная длины возрастает с увеличением сопротивления мембраны (rm) и уменьшается с возрастанием сопротивления аксоплазмы (ri), которое в свою очередь зависит от концентрации подвижных зарядов в объеме аксона. Знание этих закономерностей позволяет понять зависимость скорости распространения возбуждения от радиуса (R) аксона. Сопротивление мембраны rm пропорционально 1/2πR, сопротивление аксоплазмы ri — 1/πR2, а емкость мембраны Cm пропорциональна R. По мере увеличения радиуса аксона и rm, и ri уменьшаются, но ri уменьшается сильнее. Постоянная длины увеличивается, следовательно, сдвиг потенциала может распространяться по более крупному аксону дальше. Кроме того, увеличение радиуса аксона ведет к увеличению емкости мембраны, однако этот эффект нивелируется тем, что емкость с увеличением радиуса растет линейно, а уменьшение ri пропорционально квадрату радиуса. Таким образом, проводимость аксоплазмы увеличивается быстрее (при снижении ri), чем растет емкость мембраны, и это позволяет току быстрее достигать невозбужденных участков мембраны более крупного аксона.
Зависимость скорости распространения потенциала действия по аксону от его диаметра объясняет необходимость в гигантских аксонах у кальмара. Однако у позвоночных гигантских аксонов нет, и достаточная скорость проведения нервных импульсов достигается с помощью миелинизации аксонов. Миелиновые оболочки образованы специальными глиальными клетками: олигодендроцитами в центральной нервной системе и клетками Шванна в периферической. Эти клетки оборачивают аксон, образуя вокруг него плотный чехол из десятков слоев плазматической мембраны, который работает как изолятор. Под миелиновой оболочкой очень мало или почти нет натриевых каналов. Они оказываются расположены на небольших участках мембраны аксона между двумя соседними шванновскими клетками или олигодендроцитами — в перехватах Ранвье. Миелиновая оболочка увеличивает скорость проведения потенциала действия благодаря повышению сопротивления мембраны rm. При этом снижаются потери тока через мембрану, и деполяризация может пассивно распространяться на бо́льшие расстояния. Кроме того, из-за снижения емкости мембраны Cm, меньшая доля тока тратится на перезарядку мембраны. Миелинизация делает передачу потенциала действия не только быстрее, но и эффективнее, поскольку натриевые каналы располагаются только в перехватах Ранвье, благодаря чему меньшее количество ионов натрия входит в клетку и меньше энергии требуется на работу Na/K АТФ-азы для поддержания концентрационного градиента.
Потенциалы действия в других возбудимых клетках
Минималистичный натриево-калиевый потенциал действия характерен только для аксонов нейронов. В других частях нейрона и в иных типах возбудимых клеток в генерации потенциала действия принимают участие разнообразные ионные каналы, в том числе калиевые каналы других семейств и кальциевые каналы плазматической мембраны и эндоплазматического ретикулума (ЭПР является внутриклеточным депо кальция; общая концентрация Ca2+ в нем достигает миллимолярных значений, а концентрация свободного кальция находится в микромолярном диапазоне[26]; эти значения на несколько порядков выше, чем 100 нМ свободного Ca2+ в цитозоле в состоянии покоя). Различия в экспрессии генов ионных каналов в различных типах возбудимых клеток порождают разнообразие потенциалов действия, различающихся ионными механизмами, длительностью (от 1,5 мс в аксонах до 500 мс в кардиомиоцитах желудочков), необходимостью внешнего стимула для генерации или наличием собственного ритма. Многие ионные каналы, не участвуя напрямую в генерации потенциала действия, влияют на возбудимость клеток и таким образом вносят вклад в разнообразие электрической активности клеток.
* Принятое в физиологической литературе употребление фраз «по» или «против градиента концентрации» расходится с физическим понятием градиента. В математике и физике градиент направлен в сторону наибольшей скорости возрастания функции или величины; так, если вещество движется в направлении этого вектора, то физиологи говорят о движении «против градиента концентрации», а если в противоположном направлении — то «по градиенту концентрации». Такое словоупотребление прочно закрепилось в литературе, но пусть оно не сбивает вас с толку, когда вы размышляете, откуда взялся минус перед градиентом концентрации в уравнении диффузионного потока (уравнении Фика): J = — D dC/dx, где J — диффузионный поток [моль∙см-2∙с-1], D — коэффициент диффузии [см2∙с-1], а dC/dx— градиент концентрации.
** Проводимость (g = 1/R) — это характеристика скорости движения любых зарядов через мембрану, а проницаемость (P) отражает, насколько легко частицы могут двигаться через мембрану независимо от того, движутся они или нет. Для ионов эти величины связаны. Например, в фазе быстрой деполяризации при потенциале действия возрастает как проводимость, так и проницаемость мембраны для ионов натрия. Однако зачастую, если проницаемость канала для какого-то иона высока из-за высокого сродства участков поры канала для этого иона, такие ионы будут двигаться через канал медленнее, и проводимость будет ниже, чем для других ионов, для которых канал менее проницаем.
*** Удельная емкость чистого липидного бислоя составляет около 0,8 мкФ/см2, разница между электроемкостью мембраны и липидного бислоя возникает из-за обилия встроенных в мембрану белков.
Библиография
- Hediger M.A. et al. The ABCs of membrane transporters in health and disease (SLC series): Introduction // Mol. Aspects Med. 2013. Vol. 34. P. 95–107.
- Hille B. Ion Channels of Excitable Membranes. Third edit. Sinauer Associates, Inc., 2001.
- Caterina M.J. et al. The capsaicin receptor: A heat-activated ion channel in the pain pathway // Nature. 1997. Vol. 389, № 6653. P. 816–824.
- Jordt S.-E., Tominaga M., Julius D. Acid potentiation of the capsaicin receptor determined by a key extracellular site // Proc. Natl. Acad. Sci. 2000. Vol. 97, № 14. P. 8134–8139.
- Smart D. et al. The endogenous lipid anandamide is a full agonist at the human vanilloid receptor (hVR1) // Br. J. Pharmacol. 2000. Vol. 129, № 2. P. 227–230.
- Nersesyan Y. et al. Oxytocin Modulates Nociception as an Agonist of Pain-Sensing TRPV1 // Cell Rep. 2017. Vol. 21, № 6. P. 1681–1691.
- Berkovic S.F. et al. Human epilepsies: interaction of genetic and acquired factors // Trends Neurosci. 2006. Vol. 29, № 7. P. 391–397.
- Welsh M.J., Smith A.E. Molecular mechanisms of CFTR chloride channel dysfunction in cystic fibrosis // Cell. 1993. Vol. 73, № 7. P. 1251–1254.
- Ruan Y., Liu N., Priori S.G. Sodium channel mutations and arrhythmias // Nat. Rev. Cardiol. 2009. Vol. 6, № 5. P. 337–348.
- Giudicessi J.R., Ackerman M.J. Potassium-channel mutations and cardiac arrhythmias — Diagnosis and therapy // Nat. Rev. Cardiol. Nature Publishing Group, 2012. Vol. 9, № 6. P. 319–332.
- Thomas R.C. Electrogenic sodium pump in nerve and muscle cells // Am. J. Physiol. 1972. Vol. 52, № 3. P. 563–594.
- Morth J.P. et al. Crystal structure of the sodium-potassium pump // Nature. 2007. Vol. 450, № 7172. P. 1043–1049.
- Lodish H. et al. Molecular Cell Biology (5th edition) // Biochemistry and Molecular Biology Education. 2003.
- Scheel O. et al. Voltage-dependent electrogenic chloride/proton exchange by endosomal CLC proteins // Nature. 2005. Vol. 436, № 7049. P. 424–427.
- Artigas P., Gadsby D.C. Ouabain affinity determining residues lie close to the Na/K pump ion pathway. // Proc. Natl. Acad. Sci. U. S. A. 2006. Vol. 103, № 33. P. 12613–12618.
- Li, C., Ramjeesingh, M., Wang, W., Garami, E., Hewryk, M., Lee, D., Rommens, J. M., Galley, K., Bear, C. E. ATPase Activity of the Cystic Fibrosis Transmembrane Conductance Regulator // Journal of Biological Chemistry. 1996. № 45 (271). P. 28463–28468.
- Martineau M. et al. VGLUT1 functions as a glutamate/proton exchanger with chloride channel activity in hippocampal glutamatergic synapses // Nat. Commun. Springer US, 2017. Vol. 8, № 1.
- Ling G., Gerard R.W. The normal membrane potential of frog sartorius fibers // J. Cell. Comp. Physiol. Wiley-Blackwell, 1949. Vol. 34, № 3. P. 383–396.
- Hodgkin A.L., Huxley A.F. Action potentials recorded from inside a nerve fibre // Nature. 1939. Vol. 144. P. 710–711.
- Cole K.S., Curtis H.J. Electric Impedance of the Squid Giant Axon During Activity // J. Gen. Physiol. 1939. Vol. 22, № 5. P. 649–670.
- Cole K.S. Mostly membranes // Annu. Rev. Physiol. 1979. Vol. 41, № 1. P. 1–24.
- Kandel E.R. et al. Principles of Neural Science. Fifth Edit. The McGraw-Hill Companies, Inc., 2013. 1709 p.
- Hodgkin A.L., Huxley A.F. A quantitative description of membrane current and its application to conduction and excitation in nerve // J. Physiol. 1952. Vol. 117. P. 500–544.
- Capes D.L. et al. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels // J. Gen. Physiol. 2013. Vol. 142, № 2. P. 101–112.
- http://www.physiologyweb.com/lecture_notes/neuronal_action_potential/neuronal_action_potential_na_and_k_concentrations_do_not_change_during_an_action_potential.html
- Bygrave F.L., Benedetti A. What is the concentration of calcium ions in the endoplasmic reticulum? // Cell Calcium. Churchill Livingstone, 1996. Vol. 19, № 6. P. 547–551.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Все живые клетки при действии различных
раздражителей (химических, механических,
температурных и пр.) способны переходить
в возбужденное состояние. Опыт показывает,
что возбужденный участок становится
электроотрицательным по отношению к
покоящемуся, что является показателем
перераспределения ионных потоков в
возбужденном участке. Реверсия потенциала
при возбуждении кратковременна, и после
окончания возбуждения через некоторое
время вновь восстанавливается исходный
потенциал покоя. Общее изменение разности
потенциалов на мембране, происходящее
при возбуждении клеток, называется
потенциалом действия. На рис. 11.17
представлен потенциал действия
гигантского аксона кальмара, обозначены
отдельные стадии изменения потенциала.
В частности, для клетки характерен так
называемый запаздывающий потенциал,
когда в течение некоторого времени на
мембране существует даже меньший
потенциал, чем потенциал покоя.
Было показано, что возбуждение связано
с увеличением электропроводности
клеточной мембраны. При этом временная
зависимость электропроводимости
повторяла форму потенциала действия.
Чтобы решить вопрос, для каких ионов
изменяется проницаемость м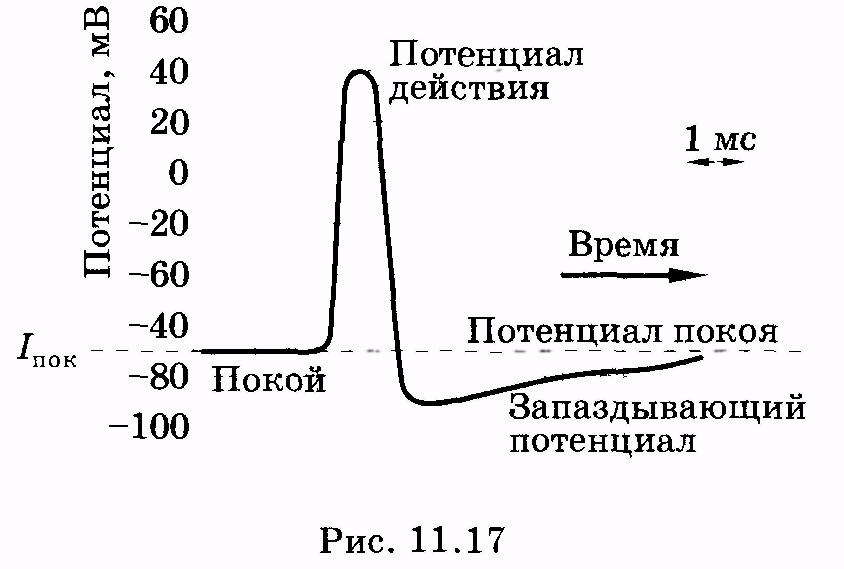
следует обратить внимание, что потенциал
действия приводит к кратковременному
возрастанию потенциала внутри клетки
(см. рис. 11.17). Отрицательный относительно
внешней среды потенциал становится
положительным. Если по уравнению Нернста
(11.38) вычислить равновесные потенциалы
на мембране аксона кальмара, то получим
соответственно для ионов К+, Na+ и Сl—величины -90, +46 и -29 мВ. Так как при
изменении проницаемости мембраны для
какого-либо иона этот ион будет проникать
через нее, стремясь создать равновесное
состояние, то числовые данные показывают,
что внутрь клетки проникают ионы Na+,
создавая там положительный потенциал.
Следовательно, при возбуждении клетки
в начальный период увеличивается
проницаемость мембран именно для ионов
натрия. «Натриевая теория» возникновения
потенциала действия была предложена,
разработана и экспериментально
подтверждена А. Ходжкином и А. Хаксли,
за что в 1963 г. они были удостоены
Нобелевской премии.
Измерить проницаемость мембран для
какого-либо иона (иначе говоря,
электропроводимость или сопротивление
мембраны для этого иона) можно, если на
основании закона Ома найти отношение
тока к напряжению, или наоборот.
Практическая реализация такой задачи
осложняется тем, что проницаемость
(электрическое сопротивление) мембраны
при возбуждении изменяется со временем.
Это приводит к перераспределению
электрического напряжения в цепи, и
разность потенциалов на мембране
изменяется. Ходжкин, Хаксли и Катц смогли
создать опыт с фиксацией определенного
значения разности потенциала на мембране.
Это позволило им провести измерение
ионных токов и, следовательно, проницаемости
(сопротивления) мембран для ионов.
Оказалось, что отношение проницаемостей
мембраны для ионов натрия и калия
практически повторяет форму потенциала
действия. Кроме того, были получены
кривые временной зависимости ионных
токов через мембрану (рис. 11.18). На этом
рисунке кривая1соответствует
временной зависимости суммарного
ионного тока через мембрану гигантского
аксона кальмара, полученного при
изменении потенциала на мембране до
+56 мВ (потенциал покоя равен60
мВ). Вначале направление тока отрицательно,
что соответствует прохождению
положительных ионов через мембрану
клетки. Было установлено, что ток этот
обусловлен прохождением ионов натрия
внутрь клетки, где концентрация их
значительно меньше, чем снаружи.
Естественно, что при таком нарушении
равновесия ионы калия начнут перемещаться
наружу, где их концентрация существенно
меньше. Для того чтобы выяснить, какая
часть тока «натриевая», а какая «калиевая»,
можно провести то же возбуждение, но в
искусственных условиях, когда в среде,
окружающей аксон, нет натрия. В этом
случае (см. кривую 2) ток обусловливается
только выходом ионов калия наружу из
клетки. Разница значений тока для двух
кривых показана на кривой3: кривая3есть разность кривых1и2.
Она дает зависимость от времени ионного
тока натрия. На этой кривой частьасоответствует открыванию натриевых
каналов, аб— их закрытию
(инактивации).
В целом
последовательность событий, происходящих
на клеточной мембране при возбуждении,
выглядит следующим образом. При
возбуждении в мембране открываются
каналы для ионов натрия (проницаемость
мембраны возрастает более чем в 5000 раз).
В результате отрицательный заряд с
внутренней стороны мембраны становится
положительным, что соответствует пику
мембранного потенциала (фаза деполяризации
мембраны). Затем поступление натрия из
внешней среды прекращается. В это время
натриевые каналы закрываются, но
открываются калиевые. Калий проходит
в соответствии с градиентом концентрации
из клетки до тех пор, пока не восстановится
первоначальный отрицательный заряд на
мембране и мембранный потенциал не
достигнет своего первоначального
значения (фаза реполяризации). На самом
деле выход ионов калия из клетки
продолжается дольше, чем это требуется
для восстановления потенциала покоя.
В результате за пиком потенциала действия
следует небольшой минимум (запаздывающий
потенциал).
Ионные
каналы имеют белковое происхождение
(см. рис. 11.3 и 11.13). Они селективно
(выборочно) пропускают ионы разного
вида. Канал может быть «закрыт»
(блокирован) молекулами ядов, его
пропускная способность зависит от
действия некоторых лекарственных
средств. Поэтому теория ионных каналов
в мембранах является важной частью
молекулярной фармакологии.
Механизм распространения потенциала
действия в деталях рассматривается в
курсе нормальной физиологии. Мы же
рассмотрим лишь некоторые основные
положения. Распространение потенциала
действия вдоль нервного волокна (аксона)
обусловлено возникновением так называемыхлокальных токов, образующихся
между возбужденным и невозбужденным
участками клетки. На рис. 11.19 схематично
указаны отдельные стадии возникновения
и распространения потенциала действия.
В состоянии покоя (рис. 11.19, а) внешняя
поверхность клеточной мембраны имеет
положительный потенциал, а внутренняя
— отрицательный. В момент возбуждения
полярность мембраны меняется на
противоположную (рис. 11.19,б). В
результате этого между возбужденным и
невозбужденным участками мембраны
возникает разность потенциалов. Наличие
разности потенциалов и приводит к
появлению между этими участкамилокальных
токов. На поверхности клетки локальный
ток течет от невозбужденного участка
к возбужденному; внутри клетки он течет
в обратном направлении (рис. 11.19, в).
Локальный ток, как и любой электрический
ток, раздражает соседние невозбужденные
участки и вызывает увеличение проницаемости
мембраны. Это приводит к возникновению
потенциалов действия в соседних участках.
В то же время в ранее возбужденном
участке происходят восстановительные
процессы реполяризации. Вновь возбужденный
участок в свою очередь становится
электроотрицательным и возникающий
локальный ток раздражает следующий
за ним участок. Этот процесс многократно
повторяется и обусловливает распространение
импульсов возбуждения по всей длине
клетки в обоих направлениях (рис. 11.19,г). В нервной системе импульсы
проходят лишь в определенном
направлении из-за наличия синапсов,
обладающих односторонней проводимостью.
По
электрическим свойствам аксон напоминает
кабель с проводящей сердцевиной и
изолирующей оболочкой. Однако для того
чтобы в кабеле не было значительных
потерь энергии при протекании
тока, сопротивление его должно быть
малым, а сопротивление
изоляции — очень большим. В аксоне
проводящим веществом
служит аксоплазма, т. е. раствор
электролита, удельноесопротивление
которого в миллионыраз
больше, чем у меди или алюминия,
из которых изготавливают обычные
кабели. Удельное сопротивление биомембран
достаточно велико, но вследствие их
малой толщины сопротивление изоляции
«аксонного кабеля» в сотни тысяч раз
меньше, чем у технического кабеля. По
этой причине однородное н
волокно не может проводить электрический
сигнал на далекое расстояние, интенсивность
сигнала быстро затухает. Расчеты
показывают, что напряжение на мембране
волокна будет экспоненциально уменьшаться
по мере удаления от места возбуждения
(рис. 11.20). Если величина потенциала
действия в месте возбуждения была равна mах,
то на расстоянии l
от этого места потенциал на мембране
будет равен:
(11.40)
где
—
постоянная
длины нервного
волокна, которая определяет степень
затухания сигнала в аксоне по
экспоненциальному закону. Эту величину
можно рассчитать по следующей приближеннойформуле:
(11.41)
где
d
— диаметр
волокна, R
— поверхностное
сопротивление мембраны
в Ом • м2
(т. е. сопротивление 1 м2
ее поверхности) и
— удельное сопротивление аксоплазмы
в Ом • м.
Расчеты,
проведенные для аксона кальмара,
показывают, что на
конце аксона величина сигнала должна
быть ничтожно малой. Однако
существование локальных токов приводит
к тому, что возбуждение
передается по нервному волокну без
затухания. Это объясняется тем, что
локальные токи лишь деполяризуют
мембрану до
критического уровня, а потенциалы
действия в каждом участке
мембраны поддерживаются независимыми
ионными потоками, перпендикулярными
к направлению распространения возбуждения.
Из
(11.40) видно, что с увеличением
степень затухания сигнала
уменьшается. Было показано, что при этом
возрастает скорость проведения импульса,
а это очень важно для жизнедеятельности
любого организма. Величины
и
примерно одинаковы
для всех животных
клеток, и поэтому увеличения постоянной
длины
можно добиться путем увеличения диаметра
d
аксона. Именно
поэтому у кальмаров аксоны достигают
«гигантских» размеров (диаметр до 0,5
мм), что обеспечивает кальмару достаточно
быстрое проведение нервного импульса
и, следовательно, быстроту реакции
на внешние раздражители.
У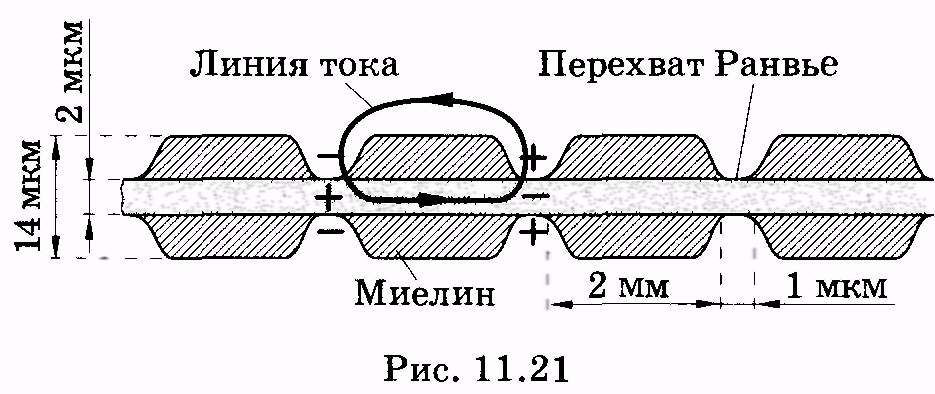
нервной системой
толстые волокна оказываются неэкономичными,
и затухание сигнала предотвращается
другим способом. Мембраны аксонов у них
покрытымиелином — веществом,
содержащим много холестерина и мало
белка (рис. 11.21). Удельное сопротивление
миелина значительно
выше удельного сопротивления других
биологических мембран. Помимо этого,
толщина миелиновой оболочки во много
раз больше толщины обычной мембраны,
что приводит к возрастанию диаметра
волокна и соответственно величины.
Как видно из рис. 11.21, миелиновая оболочка
не полностью покрывает
все волокно; оно разделено на отдельные
сегменты, между которыми на участках
длиной около 1 мкм мембрана аксона
непосредственно соприкасается с
внеклеточным раствором. Области, вкоторых мембрана
контактирует с раствором, называют
перехватами Ранвье. В связи с
большим сопротивлением миелиновой
оболочки по поверхности
аксона токи протекать не могут, и
затухание сигнала резко уменьшается.
При возбуждении одного узла возникают
токи между ним и другими узлами. Ток,
подошедший к другому узлу, возбуждает
его, вызывает появление в этом местепотенциала действия,
и процесс распространяется по всему
волокну. Затраты энергии на
распространение сигнала по волокну,покрытому миелином,
значительно меньше, чем по
немиелинизированному, так как общее
количество ионов натрия, проходящих
через мембрану
в области узлов, значительно меньше,
чем если бы они проходили через всю
поверхность мембраны. При некоторых
заболеваниях структура миелиновых
оболочек нарушается, и это
приводит к нарушению проведения нервного
возбуждения. При блокировании узлов
нервного волокна анестезирующими
средствами, например ядом кураре,
сопротивление аксона возрастает и
прохождение сигналов по нерву замедляется
или совсемпрекращается.
Поскольку
узлы замыкаются через аксоплазму и
внеклеточную
среду, то можно предположить, что при
увеличении сопротивления внешней среды
скорость проведения нервного импульса
уменьшится. Это предположение было
проверено на опыте. Нервные
волокна сначала помещали в морскую
воду, а затем в масло с большим удельным
сопротивлением. Скорость проведения
импульса во втором случае уменьшалась
в 1,5—2 раза (в зависимости от диаметра
волокна).
Существует
некоторая формальная аналогия между
распространением потенциала действия
по нервному волокну и электромагнитной
волной в двухпроводной линии или
коаксиальном кабеле. Однако между этими
процессами имеется существенное
различие.Электромагнитная
волна, распространяясь в среде, ослабевает,
так как растрачивает свою энергию.
Волна возбуждения, проходящая
по нервному волокну, не затухает, получая
энергию в самой
среде (энергию заряженной мембраны).
Волны, получающие энергию из среды
в процессе распространения, называютавтоволнами,
а среду —
активно-возбудимой
средой (ABC).
В § 11.9
будут рассмотрены более подробно
свойства авто волн, распространяющихся
в ABC.
Соседние файлы в папке лекции 2008-09
- #
- #
- #
- #
- #
- #
- #
Потенциал покоя и потенциал действия
Автор статьи Зыбина А.М.
Мембрана всех живых клеток поляризована. Внутренняя сторона мембраны несет отрицательный заряд по сравнению с межклеточным пространством (рис. 1). Величина заряда, который несет мембрана называется мембранным потенциалом (МП). В невозбудимых тканях МП низкий, и составляет около -40 мВ. В возбудимых тканях он высокий, около -60 — -100 мВ и называется потенциалом покоя (ПП).
Потенциал покоя, как и любой мембранный потенциал формируется за счет избирательной проницаемости клеточной мембраны. Как известно, плазмолемма состоит из липидного бислоя, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом, для формирования потенциала покоя ведущую роль играют ионы калия, кроме них важны ионы натрия и хлора.
Рис. 1. Концентрации и распределение ионов с внутренней и внешней стороны мембраны.
Большинство ионов распределяются неравномерно с внутренней и внешней стороны клетки (рис. 1). Внутри клетки концентрация ионов калия выше, а натрия и хлора – ниже, чем снаружи. В состоянии покоя мембрана проницаема для ионов калия и практически непроницаема для ионов натрия и хлора. Несмотря на то, что калий может свободно выходить из клетки, его концентрации остаются неизменными благодаря отрицательному заряду на внутренней стороне мембраны. Таким образом, на калий действуют две силы, находящиеся в равновесии: осмотические (градиент концентрации К+) и электрические (заряд мембраны), благодаря чему число входящих в клетку ионов калия равно выходящим. Движение калия осуществляется через калиевые каналы утечки, открытые в состоянии покоя. Величину заряда мембраны, при которой ионы калия находятся в равновесии можно вычислить по уравнению Нернста:
Ем = Ек = RT / nF ln [ K+]н / [ K+]вн
где Ек — равновесный потенциал для К+; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; n — валентность К+ (+1), [К+н] — [К+вн] — наружная и внутренняя концентрации К+.
Если подставить в уравнение значения из таблицы на рис. 43, то мы получим величину равновесного потенциала, равную примерно -95 мВ. Это значение вписывается в диапазон мембранного потенциала возбудимых клеток. Отличия ПП разных клеток (даже возбудимых) могут возникать по трем причинам:
- отличия внутриклеточной и внеклеточной концентраций ионов калия в разных тканях (в таблице приведены данные по среднестатистическому нейрону);
- натрий-калиевая АТФаза может вносить свой вклад в значение заряда, так как она выводит из клетки 3 Na+ в обмен на 2 К+;
- несмотря на минимальную проницаемость мембраны для натрия и хлора, эти ионы все-таки могут попадать в клетки, хоть и от 10 до 100 раз хуже, по сравнению с калием.
Чтобы учесть проникновение других ионов в клетку существует уравнение Нернста-Гольдмана:
Ем = RT / nF ln Pk[ K+]вн +PNa[ Na+]вн +PCl[ Cl—]н / Pk[ K+]н +PNa[ Na+]н + PCl[ Cl—]вн,
, где Еm — мембранный потенциал; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; РK , PNa и РCl — константы проницаемости мембраны для К+ Na+ и Сl, соответственно; [К+н], [K+вн], [Na+н], [Na+вн], [Сl—н] и [Сl—вн ]- концентрации K+, Na+ и Сl снаружи (н) и внутри (вн) клетки.
Такое уравнение позволяет установить более точную величину ПП. Обычно, мембрана оказывается на несколько мВ менее поляризована, по сравнению с равновесным потенциалом для К+.
Потенциал действия (ПД) может возникать в возбудимых клетках. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то ПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет кратковременная перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной, после чего восстановится ПП. Это кратковременное изменение ПП, происходящее при возбуждении клетки называется потенциалом действия.
Возникновение ПД возможно благодаря тому, что в отличие от ионов калия, ионы натрия далеки от равновесия. Если подставить в уравнение Нернста натрий вместо калия, то мы получим равновесный потенциал, равный примерно +60 мВ. Во время ПД, происходит кратковременное увеличение проницаемости для Na+. При этом, натрий начнет проникать в клетку под действием двух сил: по градиенту концентрации и по заряду мембраны, стремясь подстроить заряд мембраны под свой равновесный потенциал. Движение натрия осуществляется по потенциал-зависимым натриевым каналам, которые открываются в ответ на смещение мембранного потенциала, после чего сами инактивируются.
Рис. 2. Потенциал действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
На записи ПД выглядит как кратковременный пик (рис. 44), имеющий несколько фаз.
- Деполяризация (фаза нарастания) (рис. 44) – увеличение проницаемости для натрия из-за открытия натриевых каналов. Натрий стремится к своему равновесному потенциалу, но не достигает его, так как канал успевает инактивироваться.
- Реполяризация – возвращение заряда к величине потенциала покоя. Помимо калиевых каналов утечки здесь подключаются потенциал-зависимые калиевые каналы (активируются от деполяризации). В это время калий выходит из клетки, возвращаясь к своему равновесному потенциалу.
- Гиперполяризация (не всегда) – возникает в случаях, если равновесный потенциал по калию превышает по модулю ПП. Возвращение к ПП происходит после возвращения к равновесному потенциалу по К+.
Во время ПД происходит изменение полярности заряда мембраны. Фаза ПД, при которой заряд мембраны положителен, называется овершутом (рис. 2).
Для генерации ПД оказывается очень важной система активации и инактивации потенциал-управляемых натриевых каналов (рис. 3). Эти каналы имеют две створки: активационную (М-ворота) и инактивационную (Н-ворота). В состоянии покоя М-ворота открыты, а Н-ворота закрыты. Во время деполяризации мембраны М-ворота быстро открываются, а Н-ворота начинают закрываться. Ток натрия в клетку возможен пока М-ворота уже открыты, а Н-ворота еще не закрылись. Вход натрия приводит к дальнейшей деполяризации клетки, приводя к открытию большего количества каналов и запуская цепочку положительной обратной связи. Деполяризация мембраны будет продолжаться до тех пор, пока все потенциал-управляемые натриевые каналы не окажутся инактивированными, что происходит на пике ПД. Минимальная величина стимула, приводящая к возникновению ПД называется пороговой. Таким образом, возникший ПД будет подчиняться закону «все или ничего» и его величина не будет зависеть от величины стимула, вызвавшего ПД.
Благодаря Н-воротам инактивация канала происходит раньше, чем потенциал на мембране достигнет равновесной величины по натрию. После прекращения поступления натрия в клетку, происходит реполяризация за счет выходящих из клетки ионов калия. При этом к каналам утечки в этом случае подключаются еще и потениал-активируемые калиевые каналы. Во время реполяризации, в быстром натриевом канале быстро закрываются М-ворота. Н-ворота открываются гораздо медленнее и остаются закрытыми еще некоторое время после возвращения заряда к потенциалу покоя. Этот период принято называть периодом рефрактерности.
Рис. 3. Работа потенциал-управляемого натриевого канала.
Концентрации ионов внутри клетки восстанавливает натрий-калиевая АТФаза, которая с затратой энергии в виде АТФ откачивает из клетки 3 иона натрия и закачивает 2 иона калия.
По немиелинизированному волокну или по мембране мышцы потенциал действия распространяется непрерывно. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до порогового значения, в результате чего на соседнем участке возникает деполяризация. Главную роль в возникновении потенциала на новом участке мембраны предыдущий участок. При этом на каждом участки сразу после ПД наступает период рефрактерности, за счет которое ПД распространяется однонаправленно. При прочих равных условиях распространение потенциала действия по немиелинизированному аксону происходит тем быстрее, чем больше диаметр волокна. У млекопитающих скорость составляет 1-4 м/с. Поскольку у беспозвоночных животных отсутствует миелин, в гигантских аксонах кальмара скорость ПД может достигать 100 м/c.
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах немиелинизированных волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до порогового значения, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Сальтаторное проведение увеличивает скорость проведения ПД 15-20 раз до 120 м/с.
Работа нейронов
Нервная система состоит из нейронов и глиальных клеток. Однако, главную роль в проведении и передаче нервных импульсов играют нейроны. Они получают информацию от множества клеток по дендритам, анализируют ее и передают или не передают на следующий нейрон.
Передача нервного импульса с одной клетки на другую осуществляется с помощью синапсов. Различают два основных типа синапсов: электрические и химические (рис. 4). Задача любого синапса – передать информацию с пресинаптической мембраны (мембрана аксона) на постсинаптическую (мембрана дендрита, другого аксона, мышцы или другого органа-мишени). Большинство синапсов нервной системы образуется между окончанием аксонов и дендритами, которые в области синапса образуют дендритные шипики.
Преимущество электрического синапса состоит в том, что сигнал с одной клетки на другую переходит без задержки. Кроме того, такие синапсы не утомляются. Для этого пре- и постсинаптические мембраны соединены поперечными мостиками, через которые ионы из одной клетки могут перемещаться в другую. Однако, существенным минусом такой системы является отсутствие однонаправленной передачи ПД. То есть, он может передаваться как с пресинаптической мембраны на постсинаптическую, так и наоборот. Поэтому, такая конструкция встречается достаточно редко и в основном – в нервной системе беспозвоночных.
Рис. 4. Схема строения химического и электрического синапсов.
Химический синапс весьма распространен в природе. О устроен сложнее, так как необходима система преобразования электрического импульса в химический сигнал, затем, вновь в электрический импульс. Все это приводит к возникновению синаптической задержки, которая может составить 0,2-0,4 мс. Кроме того, может произойти истощение запасов химического вещества, что приведет к утомлению синапса. Однако, такой синапс обеспечивает однонаправленность передачи ПД, что является его главным преимуществом.
Рис. 5. Схема работы (а) и электронная микрофотография (б) химического синапса.
В состоянии покоя окончание аксона, или пресинаптическое окончание, содержит мембранные пузырьки (везикулы) с нейромедиатором. Поверхность везикул заряжена отрицательно, чтобы предотвратить связывание с мембраной, и покрыта специальными белками, и принимающими участие в высвобождении везикул. В каждом пузырьке находится одинаковое количество химического вещества, которое называется квантом нейромедиатора. Нейромедиаторы весьма разнообразны по химическому строению, однако, большинство из них производятся прямо в окончании. Поэтому, в нем могут находиться системы, для синтеза химического посредника, а также аппарат Гольджи и митохондрии.
Постсинаптическая мембрана содержит рецепторы к нейромедиатору. Рецепторы могут быть в виде как ионных каналов, открывающихся при контакте со своим лигандом (ионотропные), так и мембранными белками, запускающими внутриклеточный каскад реакций (метаботропные). Один нейромедиатор может иметь несколько как ионотропных, так и метаботропных рецепторов. При этом, часть из них может быть возбуждающими, а часть – тормозными. Таким образом, реакцию клетки на нейромедиатор будет определять тип рецептора на ее мембране, и разные клетки могут совершенно по-разному реагировать на одно и то же химическое вещество.
Между пре- и постсинаптической мембраной располагается синаптическая щель, шириной 10-15 нм.
При приходе ПД на пресинаптическое окончание, на нем открываются потенциал-активируемые кальциевые каналы и ионы кальция входят в клетку. Кальций связывается с белками на поверхности везикул, что приводит к их транспортировке к пресинаптической мембране с последующим слиянием мембран. После такого взаимодействия нейромедиатор оказывается в синаптической щели (рис. 5) и может связаться со своим рецептором.
Ионотропные рецепторы – это лиганд-активируемые ионные каналы. Это значит, что канал открывается только в присутствии определенного химического вещества. Для разных нейромедиаторов это могут быть натриевые, кальциевые или хлорные каналы. Ток натрия и кальция вызывает деполяризацию мембраны, поэтому такие рецепторы называют возбуждающими. Хлорный ток приводит к гиперполяризации, что затрудняет генерацию ПД. Следовательно, такие рецепторы называют тормозными.
Метаботропные рецепторы к нейромедиаторам относят к классу рецепторов, ассоцированных с G-белками (GPCR). Эти белки запускают разнообразные внутриклеточные каскады реакций, приводящих в конечном итоге либо к дальнейшей передачи возбуждения, либо к торможению.
После передачи сигнала необходимо быстро удалить нейромедиатор из синаптической щели. Для этого в щели присутствуют либо ферменты расщепляющие, нейромедиатор, либо на пресинаптическом окончании или соседних глиальных клетках могут располагаться транспортеры, закачивающие медиатор в клетки. В последнем случае он может использоваться повторно.
Каждый нейрон получает импульсы от 100 до 100 000 синапсов. Одиночная деполяризация на одном дендрите не приведет к дальнейшей передаче сигнала. На нейрон могут приходит одновременно множество как возбуждающих, так и тормозных стимулов. Все они суммируются на соме нейрона. Такая суммация называется пространственной. Далее, может возникнуть или не возникнуть (в зависимости от пришедших сигналов) ПД в области аксонного холмика. Аксонный холмик – это область аксона, примыкающая к соме и обладающая минимальным порогом ПД. Далее импульс распространяется по аксону, конец которого может сильно ветвиться и образовывать синапсы со множеством клеток. Помимо пространственной, существует временная суммация. Она происходит в случае, поступления часто повторяющихся импульсов от одного дендрита.
Помимо классических синапсов между аксонами и дендритами или их шипиками, существуют также синапсы, модулирующие передачу в других синапсах (рис. 6). К ним относят аксо-аксональные синапсы. Такие синапсы способны усиливать или тормозить синаптическую передачу. То есть, если на окончание аксона, образующего аксо-шипиковый синапс, пришел ПД, а в это время по аксо-аксональному синапсу на него пришел тормозный сигнал, высвобождения нейромедиатора в аксо-шипиковом синапсе не произойдет. Аксо-дендритные синапсы могут изменять проведение мембраной ПД на пути от шипика к соме клетки. Также существуют аксо-соматические синапсы, которые могут влиять на суммацию сигнала в области сомы нейрона.
Таким образом, существует огромное многообразие различных синапсов, отличающихся по составу нейромедиаторов, рецепторов и их местоположению. Все это обеспечивает разнообразие реакций и пластичность нервной системы.
Рис. 6. Разнообразие синапсов в нервной системе.
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
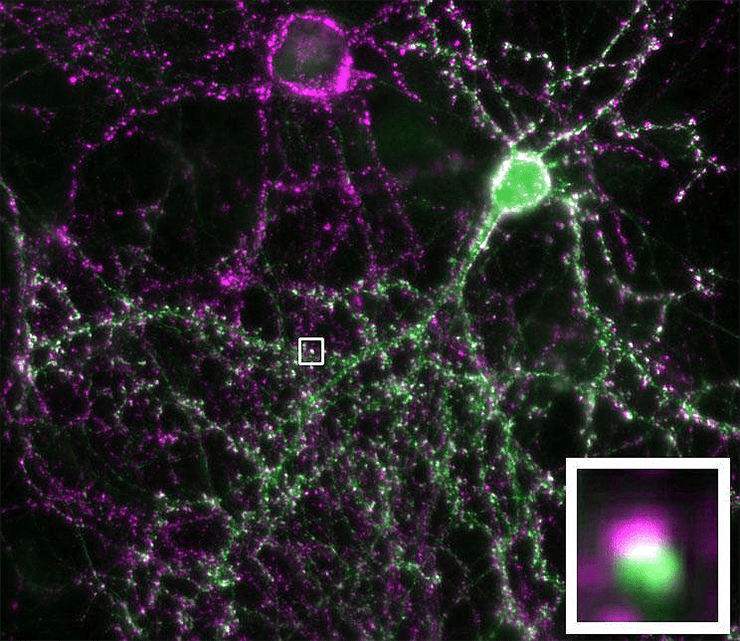
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
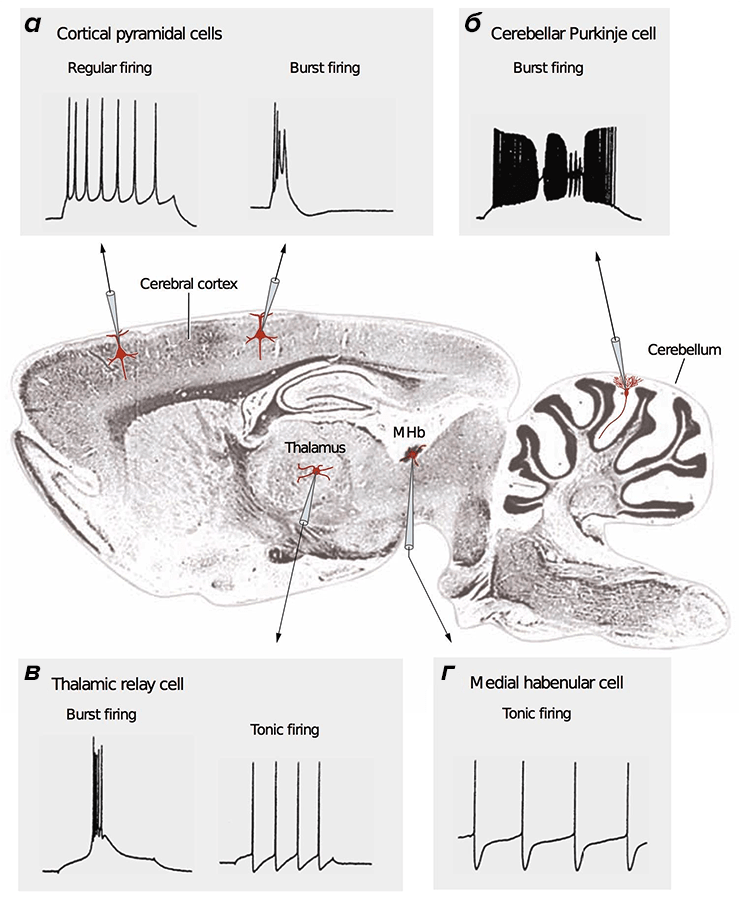
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
[14], рисунок адаптирован
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
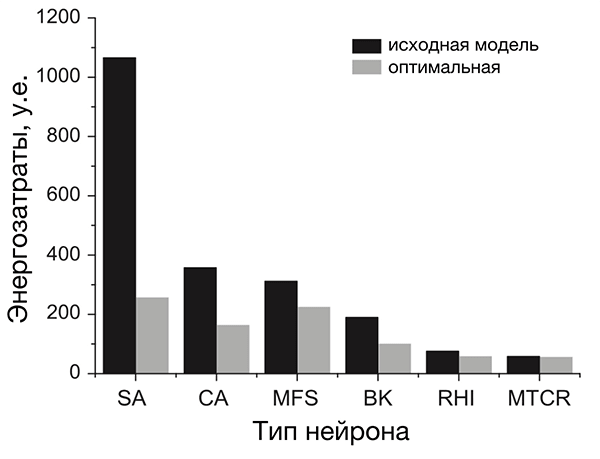
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
[20], рисунок адаптирован
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает… «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Литература
- Прожорливый мозг;
- SEYMOUR S. KETY. (1957). THE GENERAL METABOLISM OF THE BRAIN IN VIVO. Metabolism of the Nervous System. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al.. (1977). THE [14C]DEOXYGLUCOSE METHOD FOR THE MEASUREMENT OF LOCAL CEREBRAL GLUCOSE UTILIZATION: THEORY, PROCEDURE, AND NORMAL VALUES IN THE CONSCIOUS AND ANESTHETIZED ALBINO RAT. J Neurochem. 28, 897-916;
- Magistretti P.J. (2008). Brain energy metabolism. In Fundamental neuroscience // Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron. 86, 883-901;
- William B Levy, Robert A. Baxter. (1996). Energy Efficient Neural Codes. Neural Computation. 8, 531-543;
- Sharp P.E. and Green C. (1994). Spatial correlates of firing patterns of single cells in the subiculum of the freely moving rat. J. Neurosci. 14, 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergic interneurons: From cellular design to microcircuit function. Science. 345, 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Highly Energized Inhibitory Interneurons are a Central Element for Information Processing in Cortical Networks. J Cereb Blood Flow Metab. 34, 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 21, 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004). Interneurons of the neocortical inhibitory system. Nat Rev Neurosci. 5, 793-807;
- Как происходит выделение нейромедиатора;
- От живого мозга к искусственному интеллекту;
- Kandel E.R., Schwartz J.H., Jessell T.M., Siegelbaum S.A., Hudspeth A.J. Principles of neural science (5th Edition). NY: McGraw-Hill Education / Medical, 2012. — 1760 p.;
- 12 методов в картинках: нейробиология;
- Oliver Kann. (2016). The interneuron energy hypothesis: Implications for brain disease. Neurobiology of Disease. 90, 75-85;
- H. B. Barlow. (1969). Trigger Features, Adaptation and Economy of Impulses. Information Processing in The Nervous System. 209-230;
- Levy W.B. and Baxter R.A. (2002). Energy-efficient neuronal computation via quantal synaptic failures. J. Neurosci. 22, 4746–4755;
- Julia J. Harris, Renaud Jolivet, David Attwell. (2012). Synaptic Energy Use and Supply. Neuron. 75, 762-777;
- Biswa Sengupta, Martin Stemmler, Simon B. Laughlin, Jeremy E. Niven. (2010). Action Potential Energy Efficiency Varies Among Neuron Types in Vertebrates and Invertebrates. PLoS Comput Biol. 6, e1000840;
- Simon B. Laughlin, Rob R. de Ruyter van Steveninck, John C. Anderson. (1998). Unknown title.. Nat. Neurosci.. 1, 36-41;
- S Laughlin. (2001). Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology. 11, 475-480;
- J. E. Niven, S. B. Laughlin. (2008). Energy limitation as a selective pressure on the evolution of sensory systems. Journal of Experimental Biology. 211, 1792-1804;
- Jeremy E Niven. (2016). Neuronal energy consumption: biophysics, efficiency and evolution. Current Opinion in Neurobiology. 41, 129-135;
- Clare Howarth, Padraig Gleeson, David Attwell. (2012). Updated Energy Budgets for Neural Computation in the Neocortex and Cerebellum. J Cereb Blood Flow Metab. 32, 1222-1232;
- A. Hasenstaub, S. Otte, E. Callaway, T. J. Sejnowski. (2010). Metabolic cost as a unifying principle governing neuronal biophysics. Proceedings of the National Academy of Sciences. 107, 12329-12334;
- Abdelmalik Moujahid, Alicia D’Anjou, Manuel Graña. (2014). Energy demands of diverse spiking cells from the neocortex, hippocampus, and thalamus. Front. Comput. Neurosci.. 8;
- Bruce P. Bean. (2007). The action potential in mammalian central neurons. Nat Rev Neurosci. 8, 451-465;
- Izhikevich E.M. Dynamical systems in neuroscience: the geometry of excitability and bursting (computational neuroscience). The MIT Press, 2007. — 457 p.;
- Brett C. Carter, Bruce P. Bean. (2009). Sodium Entry during Action Potentials of Mammalian Neurons: Incomplete Inactivation and Reduced Metabolic Efficiency in Fast-Spiking Neurons. Neuron. 64, 898-909;
- Формирование мембранного потенциала покоя;
- Появление и эволюция клеточной мембраны;
- Липидный фундамент жизни;
- Alan Woodruff, Rafael Yuste. (2008). Of Mice and Men, and Chandeliers. PLoS Biol. 6, e243;
- György Buzsáki, Caroline Geisler, Darrell A. Henze, Xiao-Jing Wang. (2004). Interneuron Diversity series: Circuit complexity and axon wiring economy of cortical interneurons. Trends in Neurosciences. 27, 186-193;
- David Sterratt, Bruce Graham, Andrew Gillies, David Willshaw. (Unknown published date.). Introduction. Principles of Computational Modelling in Neuroscience. 1-12;
- B. C. Carter, B. P. Bean. (2011). Incomplete Inactivation and Rapid Recovery of Voltage-Dependent Sodium Channels During High-Frequency Firing in Cerebellar Purkinje Neurons. Journal of Neurophysiology. 105, 860-871;
- Камкин А.Г. и Каменский А.А. (2004). Фундаментальная и клиническая физиология. М.: «Академия», 2004. — 1073 с.;
- Hille B. (2001). Ion channels of excitable membranes. Sunderland: Sinauer Associates, 2001. — 814 p.;
- Brian D. Clark, Ethan M. Goldberg, Bernardo Rudy. (2009). Electrogenic Tuning of the Axon Initial Segment. Neuroscientist. 15, 651-668;
- Джаксон М.Б. Молекулярная и клеточная биофизика. М.: «БИНОМ», 2013. — 552 с.;
- Спокоен как GABA;
- P. Crotty. (2006). Metabolic Energy Cost of Action Potential Velocity. Journal of Neurophysiology. 96, 1237-1246;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Очень нервное возбуждение;
- György Buzsáki, Kai Kaila, Marcus Raichle. (2007). Inhibition and Brain Work. Neuron. 56, 771-783;
- David Attwell, Alasdair Gibb. (2005). Neuroenergetics and the kinetic design of excitatory synapses. Nat Rev Neurosci. 6, 841-849;
- Nace L. Golding, Donata Oertel. (2012). Synaptic integration in dendrites: exceptional need for speed. The Journal of Physiology. 590, 5563-5569;
- Ashish Raj, Yu-hsien Chen. (2011). The Wiring Economy Principle: Connectivity Determines Anatomy in the Human Brain. PLoS ONE. 6, e14832;
- B. L. Chen, D. H. Hall, D. B. Chklovskii. (2006). Wiring optimization can relate neuronal structure and function. Proceedings of the National Academy of Sciences. 103, 4723-4728;
- Dmitri B. Chklovskii, Thomas Schikorski, Charles F. Stevens. (2002). Wiring Optimization in Cortical Circuits. Neuron. 34, 341-347;
- Biswa Sengupta, Simon B. Laughlin, Jeremy E. Niven. (2013). Balanced Excitatory and Inhibitory Synaptic Currents Promote Efficient Coding and Metabolic Efficiency. PLoS Comput Biol. 9, e1003263;
- Болезнь Паркинсона: что изучать? как изучать?;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Болезнь Альцгеймера: ген, от которого я без ума;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска;
- Болезни и изменения клеточного метаболизма;
- Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?;
- Adelbert Ames. (2000). CNS energy metabolism as related to function. Brain Research Reviews. 34, 42-68.