Disruption of the synaptic membrane transport protein synaptobrevin prevents release of glycine and gamma-aminobutyric acid (GABA), blocking the inhibitory effect of affected interneurons.
From: Sheep and Goat Medicine (Second Edition), 2012
Receptors: Model Systems and Specific Receptors
Yi-Zhang Chen, … Zuo Guo, in Methods in Neurosciences, 1993
Radioligand-Binding Assay of Glucocorticoid Membrane Receptor
An SPM preparation is incubated with [3H]corticosterone ([3H]B) at 0−4°C for 3 hr. Nonspecific binding is determined by incubating identical aliquots with both labeled and a 1000-fold excess of unlabeled corticosterone. Free [3H]B is separated by vacuum filtration. The SPM bound with [3H]B is kept on an S6.9 glass fiber filter membrane (Shanghai Yuguang Purification Materials Corporation), and, after drying, counted in 1.5 ml of scintillation counting liquid. The difference between the counts measured in the presence and absence of unlabeled steroid represents the specific binding of SPM.
As revealed by the radioligand-binding assay [3H]B could bind specifically to SPM in a rapid and reversible manner, indicating the existence of specific membrane-binding sites for GC (GCMR) in SPM. The saturation binding curve presented in Fig. 2 is S shaped, and a convex curve can be seen in the Scatchard plot of the data (Fig. 3). After curve fitting (by the least-squares method) and mathematical treatment of the convex curve with the aid of a computer, the maximal binding capacity (Bmax) was calculated to be 46.67 ± 4.62 fmol/mg protein, the apparent equilibrium dissociation constant (Kd), 97.48 ± 18.85 nM, and the Hill coefficient, 1.633 ± 0.082 (n = 
Fig. 2. Specific binding of [3H]corticosterone ([3H]B) with SPM.
Fig. 3. Scatchard plot of binding of [3H]B with SPM.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121852719500071
Structure, Function, and Development of the Nervous System
Mish Shoykhet, Robert S.B. Clark, in Pediatric Critical Care (Fourth Edition), 2011
Electrical Synapses
At the electrical synapse, cell membranes of the adjoining neurons are tightly bound together into a gap-junction plaque.5 Each plaque contains numerous channels made of connexin proteins. There are 21 known connexin genes in humans. Each channel consists of two hemichannels, with one on each cell membrane. Two hemichannels join together to form a functional gap junction between two neurons, allowing intercellular diffusion of ions and small molecules such as glucose, cyclic AMP, and ATP. Gap junctions thus allow neurons to share information about their metabolic and excitable states, providing a mechanism for large-scale regulation of energy demands and neuronal network dynamics. Additionally, gap junction channels close in response to lowered intracellular pH or elevated Ca2+ levels; since both events occur in damaged cells, paired hemichannels at the gap junction may function to isolate healthy neurons from those damaged during ischemia or trauma. Recent evidence suggests that unpaired hemichannels outside of the gap junction plaques may also contribute to ischemic neuronal cell death.6
Glia, like neurons, are also connected by gap junctions. For example, brain astrocytes form an interconnected cellular network, which allows long-distance propagation of calcium signals across many cells. Additionally, layers of myelin generated by oligodendrocytes in the CNS and by Schwann cells in the PNS are linked by gap junctions. Myelin gap junctions provide structural stability to the myelin sheath and allow for rapid diffusion of nutrients and other substances across the sheath towards the underlying axon. In humans, mutations in gap junction protein connexin 32 result in X-linked Charcot-Marie-Tooth disease, a demyelinating neuropathy.7
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323073073100576
EPILEPTOGENESIS | Role of Transporter Proteins and Lipid Peroxidation in Epileptogenesis
Y. Ueda, L. James Willmore, in Encyclopedia of Basic Epilepsy Research, 2009
Immunoblotting and Quantitative Densitometry
To extract a crude synaptic membrane fraction from the hippocampus, we use the method of Danbolt et al. Briefly, each hippocampus is homogenized in 1 ml ice-cold 0.32 mol mannitol containing 1 mmol EDTA (pH 7.4), and centrifuged at 1000 g for 10 min at 4 °C. The supernatant is then centrifuged at 27 000 g for 20 min at 4 °C, and the pellet is suspended in 1 ml of hypotonic 1 mmol Tris–HCl containing 1 mmol EDTA. This suspension is centrifuged at 27 000 g for 20 min at 4 °C. The pellet is resuspended in 1 ml of resuspension buffer (100 mmol PBS, pH 7.4, 5 mmol Tris–HCl, 1 mmol MgSO4, 0.5 mmol EDTA, 1% glycerol) and centrifuged at 27 000 g for 20 min at 4 °C. The final pellet is resuspended in 200 μl of resuspension buffer, and is stored at −80 °C. Protein concentrations are determined by the Bio-Rad DC protein assay, using bovine serum albumin as the standard.
Samples of total protein (30 μg each) are solubilized by adding an equal volume of 4% SDS, 20% glycerol, and 125 mmol Tris–HCl, pH 6.8, and boiling them for 5 min. To obtain resolution of both small and large proteins, the samples are analyzed by discontinuous one-dimensional Tris–SDS-PAGE (4% stacking gel and 10% separating gel), using the method of Schagger and Von Jagow. Standard proteins for SDS-PAGE are as follows: phosphorylase (97 kDa), bovine serum albumin (67 kDa), ovalbumin (43 kDa), carbonic anhydrase (30 kDa), soybean trypsin inhibitor (20.1 kDa), α-lactalbumin (11.4 kDa), and myoglobin residues 1–153(17.2 kDa), residues 1–131 (14.6 kDa).
Proteins from the gel are transferred by electroblotting to 0.2-mm nitrocellulose membrane (Amersham). The nitrocellulose membrane is blocked for 10 min in 10% nonfat milk in PBS buffer containing 1% Tween 20 (PBS-T). Following this washing, the blot is incubated for 2 h in anti-GLT-1, prepared as 0.33 mg ml−1 of rabbit affinity-purified antibody raised against the 16 amino acid synthetic peptide RMHDSHLSSEEPKHRN 17–32, corresponding to part of the amino terminus (Alpha Diagnostic Inc, USA). The anti-GLAST, a 0.33 mg ml−1 antibody raised against the 15 amino acid synthetic peptide NRDVEMGNSVIEENE, 504–518, corresponds to part of the carboxy terminus, reported by Storck et al. (Alpha Diagnostic Inc, USA). The anti-EAAC-1 contains 0.33 mg ml−1 of antibody raised against the 14 amino acid synthetic peptide DKSDTISFTQTSQF, 510–523, corresponding to part of the carboxy terminus, reported by Kanai et al. (Alpha Diagnostic Inc., USA). These antibodies are suspended in PBS-T containing 0.67% blocking agent. The blot is then washed with PBS-T, incubated with horseradish peroxidase-conjugated goat anti-rabbit IgG for 20 min (1:3000, Chemicon), washed again, and processed for immunoreactivity using enhanced chemiluminescence (Amersham). The blot that is incubated with anti-EAAC-1 is incubated concomitantly with anti-β-tubulin (1:1000, Sigma), using horseradish peroxidase-conjugated goat anti-mouse IgG as secondary antibody for 20 min (1:3000, Chemicon). Densitometry of the immunoblots is used to quantify the changes in expression levels of each transporter protein on the blot. Each blot contains a range of standards of membrane fractions from normal rat brain (7.5–60 μg) that were used to generate a standard curve. The linearity of the relationship between optical density and protein concentration is verified on each film. The transferred blotted membrane fractions are stained with Ponceau-S to verify that each lane is loaded with equivalent amounts of protein. The blots are normalized to β-tubulin for densitometry.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123739612002137
Lipids and Membranes in Brain Aging☆
Wellington Gibson Wood, Grace Yee Sun, in Reference Module in Neuroscience and Biobehavioral Psychology, 2017
Transbilayer Cholesterol Distribution
The large difference in fluidity between SPM exofacial and cytofacial leaflets is associated with the transbilayer cholesterol distribution (TCD). Fig. 1A shows that cholesterol is asymmetrically distributed between the two leaflets. In young mice, approximately 15% of SPM cholesterol resides in the exofacial leaflet and the remaining 85% in the cytofacial leaflet. TCD is not static but, rather can be altered by different treatment conditions. Chronic ethanol consumption, apolipoprotein E (APOE) and its isoforms, and HMG-CoA reductase inhibitors (statins) all have been shown to alter TCD. Increasing age had a striking effect on SPM TCD. The exofacial leaflet of aged mice (24 or 25 months old) showed a twofold increase in cholesterol compared to that of younger mice. Mice 14 or 15 months of age were intermediate in their cholesterol distribution with respect to the young and aged mice. Interestingly, the increase in exofacial leaflet cholesterol of the aged mice was not the result of an increase in total SPM cholesterol. There were no significant differences in total SPM cholesterol among the three different age groups. A valuable conclusion which can be drawn from this study is that striking changes in neuronal membrane cholesterol homeostasis can occur in the absence of changes in total membrane cholesterol levels.
The mechanism for maintaining TCD is not well-understood. Several potential candidates have been proposed including APOE, the low density-lipoprotein receptor (LDLR), sterol carrier protein-2 (SCP-2), polyunsaturated fatty acids, phosphatidylethanolamine, fatty acid binding proteins (FABPs) and caveolin. However, it is worth mentioning that even when some of these potential mechanisms are experimentally altered, the cytofacial leaflet continues to maintain the greater amount of cholesterol as compared with the exofacial leaflet. From those results, one conclusion is that there may be multiple mechanisms, which are involved in the regulation of TCD. These mechanisms might involve multiple sites, such as the surface of the exofacial leaflet (APOE, LDLR, caveolin), within the plasma membrane (fatty acid composition) and cytofacial leaflet interaction with intracellular proteins (SCP-2, FABPs) and phosphatidylethanolamine. A question which has not been addressed is the functionality of changes in TCD. In the case of chronic ethanol consumption, the redistribution of cholesterol may be adaptive and diminish partitioning of ethanol into the cell and, in turn altering cell function. With respect to the redistribution of cholesterol in aged SPM, it is not known if such changes are adaptive or have pathophysiological consequences.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128093245025931
Presynaptic Endosomes
O. Shupliakov, R. Fernández-Chacón, in Encyclopedia of Neuroscience, 2009
Role of Endosomes in Synaptic Vesicle Recycling
The role of endosomes in synaptic membrane recycling also remains a matter of debate. A large proportion of vesicles in synapses are reformed via clathrin-mediated endocytosis, which occurs in the regions around active synapses referred to as periactive zones. Clathrin-coated intermediates formed in this region have the same diameter as functional synaptic vesicles. Thus, vesicles formed at the periactive zone may miss the endosomal compartment during the synaptic vesicle cycle, and thus originate directly from clathrin-coated vesicles pinched off from the plasma membrane or by the closing of a transient fusion pore (‘kiss-and-run’). Studies in hippocampal synapses using the fluorescent membrane dye FM1–43 to trace the membrane of a recycled vesicle have shown that most of the vesicles recycle through the pathways independent of endosomal compartments. They have demonstrated that the amount of dye per vesicle taken up by endocytosis equals the amount of dye a vesicle releases upon exocytosis. It was thus concluded that the internalized vesicles participating in endo–exo recycling do not communicate with intermediate endosomal compartments during the recycling process. These experiments, however, did not exclude the possibility that a remaining population of vesicles not participating in exo–endocytic recycling could exchange membrane with an endosome or that this organelle could be recruited upon a certain activity demand. The sorting endosomal compartment could also be critical for long-term maintenance of synaptic vesicle trafficking, since vesicles may become fusion incompetent following depletion of their protein content during repeated rounds of release. Evidence for an involvement of endosomes in synaptic vesicle cycling has recently been provided by studies using specific molecular endosomal markers.
The classical case of functionally distinct cellular microdomains is defined by the presence of specific Rab GTPases and their effector molecules. Three GTPases, Rab5, Rab4, and Rab11, are present on early endosomes. Cargo destined for degradation or recycling enters the early endosome via the Rab5 domain. Subsequently, cargo is sorted either for recycling via the Rab4 and Rab11 domains or for degradation via the Rab7 domain on late endosomes.
Rab5, initially delivered to the endosomal membrane in an inactive, GTP-bound form, undergoes activation catalyzed by specific effectors (GEFs), such as the Rabex5–Rabaptin5 complex, Ras interference 1 (RIN1), RIN2, or RIN3. Active Rab5 recruits two phosphatidylinositol-3-kinases, PI(3)-kinases p110/p85 and VPS34/p150, which trigger a local enrichment of phosphatidylinositol-3-phosphate, PI(3)P, in the endosomal membrane. PI(3)P specifically binds to the FYVE zinc finger domain (named after Fab1p, YOTB, Vac1p, and EEA1) of endosomal factors such as EEA1 and Rabenosyn-5 or Rabankyrin 5, which ultimately mediate endocytic vesicle tethering and fusion with early endosomes. Both Rab5 and the FYVE domain, which binds to PI(3)P within an intact lipid bilayer, can thus be considered markers for PI(3)P-containing endosomes.
The presence of Rab5-positive, PI(3)P-containing endosomes at the presynaptic terminal of Drosophila neuromuscular junctions has been determined using expression of GFP-tagged FYVE domains and antibodies against Rab5. Under conditions in which the synaptic vesicle pool was depleted, endosomes were drastically reduced in size and recovered by dynamin-mediated endocytosis. Interfering with Rab5 function using a dominant-negative version of Rab5 caused a reduction in the number of released quanta during synaptic transmission, whereas elevated levels of Rab5 increased the quantal content. These data strongly indicated that Rab5-dependent trafficking pathway plays a role in presynaptic vesicle cycling.
Live imaging of EGFP-Rab5a was also achieved in cultured neurons from mammalian hippocampus. For a number of years it has been known that the small GTPase Rab5 is present in vesicles isolated from synaptosomes. Moreover, overexpression of Rab5a has been shown to target the protein to synaptic terminals and to vesicular and endosome-like structures. The imaging data confirmed that EGFP-Rab5a is accumulated in clusters along the axon, forming green puncta, which colocalized with synaptic markers. Upon stimulation, Rab5a showed a minimum dispersion, far less than that seen with EGFP-Rab3a, which undergoes a cycle of association and dissociation with synaptic vesicles. These data suggested that like in Drosophila, mammalian Rab5 is confined to a specific population of vesicular structures most probably representing a recycling compartment.
Fusion of vesicles with the endosomal compartment would require a soluble N-ethylmaleimide-sensitive factor attachment protein (SNAP) receptor (soluble N-ethylmaleimide-sensitive factor attachment protein receptors (SNARE)) complex. The proteins Vti1b and Vti1a-β have been found on small vesicles isolated from nerve terminals. Vti1a-β was co-purified with synaptobrevin and was able to interact with N-ethylmaleimide-sensitive factor (NSF) and aSNAP, suggesting that it might form a SNARE complex. The protein complex, containing Vti1a-β, did not contain synaxin 1 and SNAP-25, and thus was different from the SNARE complex involved in fusion of synaptic vesicles with the plasma membrane. This Vti1a-β-containing protein complex is currently suggested as a potential SNARE for fusion with the endosomal compartment.
The formation of vesicles from the endosomal compartment also assumes a budding step. This budding step is thought to be dependent on the adaptor complex AP-3. The neuron-specific isoform of AP-3 (AP-3B) as well as ADP ribosylation factor 1 (ARF1) are required for the biogenesis of synaptic-like microvesicles budding from PC12 cell endosomes, but a similar function in nerve terminals has not yet been confirmed. It is known, however, that mutations in the AP-3 gene are linked to a variety of neurological defects. The mocha mouse, a null mutation of the δ-subunit of AP-3, exhibits balance and hearing problems, is hyperactive, and is prone to seizures. Mice in which the neuron-specific AP-3B subunit μ3B has been genetically deleted show specific defects related to the biogenesis of GABA-containing SSVs, suggesting a particularly important function for AP-3B at inhibitory synapses.
Another potential function for endosome-derived synaptic vesicles is in the recovery of membrane components of dense-core vesicles (DCVs) that have just undergone exocytosis. Membrane retrieval of this type has been detected in PC12 cells transfected with a chimeric P-selectin. Thus, neuronal AP-3B may recapture protein components of DCV proteins. It is believed that a recapture step could sequester selected DCV proteins from degradation and allow them to be incorporated into the synaptic vesicle cycle.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469017836
Molecular Basis of Memory
Robert M. Sears, … Joseph E. LeDoux, in Progress in Molecular Biology and Translational Science, 2014
4.2.4 Regulation of AMPARs by slow synaptic transmission mechanisms
Trafficking of AMPARs in and out of the synaptic membrane is required for memory formation for a variety of learning tasks including Pavlovian threat conditioning.22,135,136 This process is regulated by neuromodulatory signaling through metabotropic receptors,20,103 or calcium signaling from NMDAR activation (for reviews see Ref. 137) which will be discussed in greater detail in following sections. Early studies showed that synaptic activity can drive GluA1- and GluA4-containing AMPARs into the synaptic membrane, resulting in increased surface expression of AMPARs as well as increased conductance through these new channels.22,136,138–145 Surface expression depends on phosphorylation at two serine residues on the long cytoplasmic carboxyl terminus of the GluA1 subunit, ser831 and ser845,143,146,147 and phosphorylation of existing AMPARs at these serine residues can also influence conductance and open time allowing for stronger synaptic transmission.148–150 These residues are phosphorylated by distinct kinase activity; specifically, ser831 is phosphorylated by calcium and calmodulin-dependent kinase II (CamKII)143,151 or calcium-dependent protein kinase (PKC)152,153 while ser845 is phosphorylated by PKA.143,148
Synaptic activity-induced AMPAR trafficking has mostly been shown to involve AMPARs lacking a GluA2 subunit, and the synaptic activity-induced changes tend to occur on the GluA1 subunit (i.e., phosphorylation). These are usually GluA1 homomeric receptors, but can occur in other combinations as well. The absence of the GluA2 subunit renders AMPARs permeable to calcium, and GluA2-lacking receptors are designated CP-AMPARs. In the absence of the GluA1 gene, LTP and long-term depression (LTD) are impaired or eliminated at thalamo-LA and cortico-LA synapses.135 Furthermore, GluA1 knock out animals are impaired in acquisition of threat conditioning and conditioned freezing is abolished.135 Conversely, in wild-type animals, threat conditioning induces synaptic insertion of CP-AMPARs, and this is required for memory formation.20,22,154 Knockin animals with point mutations at the ser845 and ser831 sites of GluA1155 have been used to show that insertion of CP-AMPARs in the LA following threat conditioning depends on phosphorylation at ser845 but not ser831.20 However, plasticity and memory formation are normal in phospho-mutant animals. This suggests that phosphorylation at this site, though required for synaptic insertion of CP-AMPARs, may be dispensable for plasticity and memory formation.20
Phosphorylation of GluA1 subunits has also been implicated in a metaplasticity-like mechanism in the amygdala in which a subthreshold stimulus can be converted into a suprathreshold stimulus.156 In this study, one pairing of a light CS with a mild footshock does not induce STM or LTM as indicated by a lack of fear potentiated startle response. However, when one pairing is followed by another pairing 45 min to 7 days apart, LTM for the CS is evident. This result suggests that the first pairing primes the system for learning to the second pairing provided it occurs within a specified time window (45 min to a week). Correspondingly, phosphorylation of ser845 GluA1 as well as ser133 cAMP-responsive element-binding protein (CREB) is further enhanced by the second pairing. Phosphorylation at these sites by the first trial may be important for learning during the second trial.
After learning, GluA2-containing AMPARs replace the newly inserted CP-AMPARs over the course of about a day.154 Similarly, retrieval of a conditioned threat stimulus induces insertion of GluA1-containing AMPARs within 5 min, which are also replaced by GluA2-containing AMPARs over several hours. The exchange of GluA2-lacking CP-AMPARs to GluA2-containing calcium-impermeable AMPARs is thought to stabilize new plasticity into LTM because the GluA2 subunit appears to confer stability to synaptically expressed AMPARs.136,138–142,144
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124201705000106
Breathing, Emotion and Evolution
Hari H. Subramanian, Gert Holstege, in Progress in Brain Research, 2014
1 Introduction
Many details such as individual neuronal function, synaptic transmissions, and membrane channels are known about the various nuclei in the pons and medulla that contribute to eupneic respiratory rhythm (Bianchi et al., 1995; Cohen, 1979; Dutschmann and Dick, 2012; Ezure, 1990; Feldman et al., 2013; Lindsey et al., 2012; Richter, 1982; Smith et al., 2013; von Euler, 1983). These pontomedullary neuronal networks are influenced by a variety of sensory mechanisms, such as vagal afferent and peripheral chemosensory pathways, leading to a minute-by-minute regulation of ventilation (Bianchi et al., 1995; Cohen, 1979; Ezure, 1990; Feldman, 1986; Richter, 1982; von Euler, 1983).
Particularly in the awake state, eupnea is continuously adjusted by the emotional motor system (EMS; Fig. 1) in order to suit the changing environmental circumstances. The EMS produces not only fight or flight but also all other basic behaviors such as vocalization, micturition, defecation, parturition, vomiting, coughing, and even sexual behaviors such as ejaculation and orgasm in females (Huynh et al., 2013), all of which include changes in the breathing pattern. In humans, speech, laughter, and crying also require modulation of breathing.
Figure 1. The emotional motor system, of which respiration forms a critical component.
Adapted with permission from Holstege (1992).
One of the most important structures within the EMS is the midbrain periaqueductal gray (PAG), which is, in turn, under very strong influence of major parts of the limbic system and the prefrontal cortex. The PAG consists of a relatively large group of neurons, surrounding the mesencephalic aqueduct (Behbehani, 1995; Liu and Hamilton, 1980). It extends rostrally from the level of the posterior commissure to caudally the caudal inferior colliculi. The lateral borders of the PAG are established by the fibers of the mesencephalic trigeminal tract and tectospinal fibers originating in the deep layers of the superior colliculus on their way to the caudal brainstem and spinal cord. It has to be emphasized that the neurons located in regions laterally adjoining these fiber tracts do have similar functions as those located in the PAG medial to these fiber tracts (Cowie and Holstege, 1992). Within the PAG, no clear cytoarchitectonic boundaries are present either, although functional specificities of the PAG are expressed in the form of longitudinal columns along its rostrocaudal axis (Carrive, 1993; Zhang et al., 1990). Examples are the dorsomedial (PAGdm), dorsolateral (PAGdl), lateral (PAGl), and ventrolateral (PAGvl) columns of the PAG (Fig. 2). The size and shape of these columns vary considerably rostrocaudally. The dorsolateral column, for example, is pronounced in its intermediate third, but very small in its caudal third, while the lateral and ventrolateral columns are still well developed in the caudal third (Carrive, 1993).
Figure 2. Columnar organization of the PAG.
Adapted with permission from Carrive (1993).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444634887000173
Biomolecular Interactions Part B
Neha Kachappilly, … Poonam Thakur, in Methods in Cell Biology, 2022
4.3 Interaction with pre-synaptic membrane
The inner and outer leaflet of the pre-synaptic plasma membrane share common lipid components, including PC, PE, sphingomyelin and cholesterol, while featuring distinctive ones, such as PS, PI and phosphatidylinositol phosphates (PIPs), which are specific to inner leaflet, and gangliosides (GMs) and cerebrosides, which are specific to the outer leaflet. Chemical exchange saturation transfer (CEST) measurements of α-syn in the presence of SUVs mimicking the inner pre-synaptic membrane showed strong binding at the N-terminal region but binding strength decreased for the subsequent residues until a complete loss of binding in the 65–140 amino acid region, which includes both the NAC and the C-terminal region. Since studies have shown that α-syn can interact with two different membranes at the same time via a double-anchor mechanism, it was suggested that the preferential binding of N-terminal region to the inner leaflet of the pre-synaptic plasma membrane, while the 65–97 amino acid segment interacts with a synaptic vesicle, and therefore might help in vesicle docking (Fig. 5B). Experiments with IP-SUVs (inner plasma membrane mimicking SUVs) and SL-SUVs (synaptic vesicle mimicking SUVs) support this proposition (Man et al., 2021).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0091679X21001072
Microcompartmentation and Phase Separation in Cytoplasm
Gerhard Kopperschläger, in International Review of Cytology, 1999
C Affinity Ligands for Synaptic Membrane Domains
Affinity partitioning has been proven useful for separation of synaptic membranes obtained by fragmentation of synaptosomes from different sources (Johansson et al., 1981, 1984; Olde and Johansson, 1985, 1989; Muiño Blanco et al., 1986). The target membranes are characterized by specific receptor binding sites which can be recognized by natural or artificial ligands. For example, hexaethonium-PEG was used to study the heterogeneity of crude synaptosomal preparations (Olde and Johansson, 1989). Synaptic membrane domains from Torpedo California electroplax containing nicotinic cholinergic receptor molecules are separated by counter-current distribution in the presence of diverse bis-quatemary amines coupled to PEG (Flanagan et al., 1976). Naloxone and naltrexone, two ligands for the opiate receptor, have been applied after coupling to PEG for affinity partitioning of membranes from calf brain cortex yielding a selective extraction of membranes containing the receptor (Olde and Johansson, 1985).
In another approach to affinity partitioning, the reactive dye Procion Yellow H-E3G, coupled either to PEG or dextran, was applied to the separation of membrane fractions using a ficoll-dextran/PEG system (Muiño Blanco et al., 1986, 1991; Cebrian-Pérez et al.,1991). The dye is capable of extracting a part of the membranes into the upper phase (when bound to PEG) or into the lower phase (when bound to dextran). However, the chemical background of the interaction of the dye with the membranes still remains unclear. Nucleotides which frequently bind to membrane fragments due to the existence of specific binding domains do not compete with the polymer-bound dye.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0074769608605227
Functional Organization of Vertebrate Plasma Membrane
Sheila A. Baker, Vasily Kerov, in Current Topics in Membranes, 2013
6.2 Scaffold proteins
Maintenance of the intricate shape and organization of the photoreceptor synaptic membrane is due to multiple scaffold and adhesion proteins. They are found both as part of the ribbon complex and lining the membrane. Scaffolding proteins consist of multiple protein–protein interaction domains and form homomeric and heteromeric complexes that link together soluble, cytoskeletal, and membrane proteins (Feng, Long, Fan, Suetake, & Zhang, 2004; Karnak, Lee, & Margolis, 2002). For example, MPP4, PSD95, and Veli3 have all been shown to interact in a complex and loss of MPP4 prevents localization of PSD95 and Veli3 at the photoreceptor synapse. This is accompanied by loss of PMCA and Ano2 that seems to reflect specific targeting or retention of these plasma membrane proteins as some aspects of an organized synapse were intact, such as localization a related scaffold protein, SAP97, and synaptic vesicles (Aartsen et al., 2009, 2006; Stohr et al., 2009; Yang et al., 2007).
Scaffolding proteins often interact with adhesion molecules, providing another way for them to contribute to the organization of the plasma membrane. MAGI-1, an intracellular scaffolding protein with similar protein–protein interaction domains as PSD95, is necessary for the localization of sidekick2. Sidekick2 is a transmembrane cell adhesion molecule that participates in development of specific pre- and postsynaptic contacts in the retina (Sanes & Zipursky, 2010; Yamagata & Sanes, 2010). Neurexin–neuroligin pairs also participate in this process and interact with both PSD95 and SAP97 (Dirks, Thomas, & Montag, 2006). Photoreceptor synapses express components of the dystrophin–glycoprotein complex, which has been most thoroughly characterized at the neuromuscular junction where it functions to link cytoskeletal and signaling proteins with the extracellular matrix (Pilgram, Potikanond, Baines, Fradkin, & Noordermeer, 2010). In photoreceptors, components of this complex including dystrophin, syntrophin, β-dystroglycan, and α-dystroglycan are concentrated near the ribbon and associated with the extracellular protein pikachurin. In pikachurin knockout mice, the connectivity with bipolar cells is altered and photoreceptor synapses display abnormal morphology (Hu, Li, Zhang, & Yu, 2011; Omori et al., 2012; Sato et al., 2008). A major outstanding question in this area is to understand how these various complexes work together to organize the synaptic membrane.
This overview touches on a few proteins involved in developing and maintaining the photoreceptor synapse. Importantly, there must be flexibility or rapid remodeling built into the scaffolding complexes in the synapse to accommodate the changes in membrane volume that occur upon synaptic vesicle exocytosis and endocytosis. Additional studies are needed to understand the complete cast of characters and how specificity is achieved in this highly organized and dynamic membrane domain.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124170278000076
Строение и виды синапсов. Механизм их функционирования. Механизм их функционирования. Роль медиаторов.
Синапсы – это специализированная структура, которая обеспечивает передачу нервного импульса из нервного волокна на эффекторную клетку – мышечное волокно, нейрон или секреторную клетку.
Синапсы – это места соединения нервного отростка (аксона) одного нейрона с телом или отростком (дендритом, аксоном) другой нервной клетки (прерывистый контакт между нервными клетками).
Все структуры, обеспечивающие передачу сигнала с одной нервной структуры на другую – синапсы.
Значение – передает нервные импульсы с одного нейрона на другой => обеспечивает передачу возбуждения по нервному волокну (распространение сигнала).
Большое количество синапсов обеспечивает большую площадь для передачи информации.
Виды синапсов:
I. по расположению.
1. Аксодендритические синапсы — на дендритах и теле нейронов. Передатчики — аксоны.
2. Аксосоматические синапсы — между аксоном и телом нейрона.
3. Аксошипиковые синапсы — на шипиках (выросты на дендритах. С их изменением меняется работа нейронов).
4. Аксоаксональные синапсы — между аксонами нейронов.
5. Дендродендритические синапсы — между дендритами нейронов.
6. Сомосоматические синапсы — между телами нейронов.
II. по способу передачи сигналов.
1. Химические синапсы – возбуждение передается посредством медиаторов.
2. Электрические синапсы — возбуждение передается посредством ионов.
3. Смешанные синапсы — возбуждение передается посредством и медиаторов, и ионов.
III. по анатомо-гистологическому принципу.
1. Нейросекреторные.
2. Нервно-мышечные.
3. Межнейронные.
IV. по нейрохимическому принципу.
1. Адренергические – медиатор норадреналин.
2. Холинэргические – медиатор ацетилхолин.
V.по функциональному принципу.
1. Возбуждающие.
2. Тормозные.
Между окончаниями двигательного нейрона и мышечным волокном существует нервно-мышечное соединение, отличающееся по строению, но сходное в функциональном отношении с синаптическими контактами.
Строение синапса:
1. Пресинаптическая мембрана — принадлежит нейрону, ОТ которого передается сигнал.
2. Синаптическая щель, заполненная жидкостью с высоким содержанием ионов Са.
3. Постсинаптическая мембрана — принадлежит клеткам, НА которые передается сигнал.
Между нейронами всегда существует перерыв, заполненный межтканевой жидкостью.
В зависимости от плотности мембран, выделяют:
— симметричные (с одинаковой плотностью мембран)
— асимметричные (плотность одной из мембран выше)
Пресинаптическая мембрана покрывает расширение аксона передающего нейрона.
Расширение — синаптическая пуговка/синаптическая бляшка.
На бляшке — синаптические пузырьки (везикуль).
С внутренней стороны пресинаптической мембраны – белковая/гексогональная решетка (необходима для высвобождения медиатора), в которой находится белок — нейрин.Заполнена синаптическими пузырьками, которые содержат медиатор – специальное вещество, участвующее в передаче сигналов.
В состав мембраны пузырьков входит — стенин (белок).
Пузырьки содержат молекулы медиатора (внутри) — вещество, необходимое для передачи сигнала.
Постсинаптическая мембрана покрывает эффекторную клетку. Содержит белковые молекулы, избирательно чувствительные к медиатору данного синапса, что обеспечивает взаимодействие.
Эти молекулы – часть каналов постсинаптической мембраны + ферменты (много), способные разрушать связь медиатора с рецепторами.
Рецепторы постсинаптической мембраны.
Постсинаптическая мембрана содержит рецепторы, обладающие родством с медиатором данного синапса.
Между ними находится снаптическая щель. Она заполнена межклеточной жидкостью, имеющей большое количество кальция. Обладает рядом структурных особенностей – содержит белковые молекулы, чувствительные к медиатору, осуществляющему передачу сигналов.
Для каждого синапса характерна:
1. Химическая специфичность (их делят по типу медиаторов).
2. Одностороннее проведение возбуждения (от пре- к постсинаптической мембране).
3. Синаптическая задержка проведения возбуждения (5-20 миллисек).
4. Высокая избирательная чувствительность к химическим веществам.
Принципы работы синапса.
Передача возбуждения в синапсе представляет собой сложный процесс, который проходит в несколько стадий:
1. Синтез медиатора.
2. Секреция медиатора.
3. Взаимодействие медиатора с рецепторами постсинаптической мембраны.
4. Инактивация (полная утрата активности) медиатора.
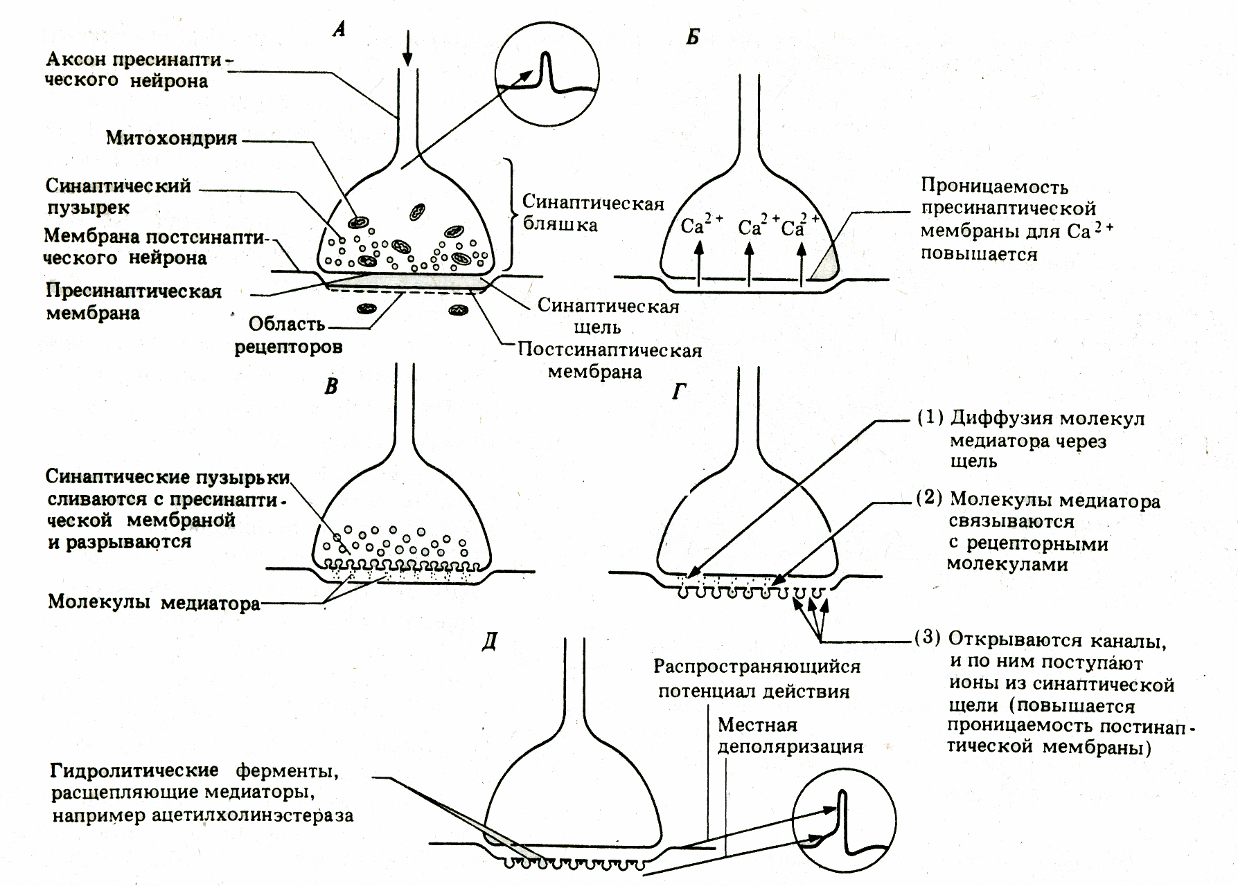
При распространении сигнал по аксону достигает пресинаптической мембраны и вызывает ее перезарядку. Во время ПД пресинаптическая мембрана становится проницаемой для ионов Na и Ca, которые входят внутрь синаптической бляшки из синаптической щели, где способствуют замыканию связи между белками гексогональнойрешетки и синаптических пузырьков. Это приводит к выходу медиатора, его проникновению в синаптическую щель и диффузии его на постсинаптическую мембрану.
Достигнув ее, он взаимодействует с ее рецепторами, в результате чего открываются ионные каналы и осуществляется движение ионов по градиенту концентрации.
В результате формируется постсинаптический потенциал на постсинаптической мембране. Связь медиатора с рецепторами разрывается , 30-70% медиатора возвращается, часть разрушается. Синапс готов воспринимать новые медиаторы.
Развитие возбуждающих и тормозных постсинаптических потенциалов.
В возбуждающих синапсах под действием ацетилхолина открываются специфические натриевые (натрий входит в клетку) и калиевые (калий выходит из клетки) каналы, что вызывает деполяризацию мембраны, или возбудждающий постсинаптический потенциал (ВПСП).
В тормозных синапсах высвобождение медиатора повышает проницаемость мембраны для ионов калия и хлора, которые вызывают гиперполяризацию мембраны, называемую тормозным постсинаптическим потенциалом (ТПСП).
ПД впервые возникает в области аксонного холмика нейрона – начального сегмента аксона в месте его отхождения от тела клетки. Аксонный холмик – это самый возбудимый участок нейрона с наиболее низким порогом.
Для того, чтобы в постсинаптическом нейроне возник нервный импульс, необходимо деполяризовать мембрану аксонного холмика на величину от -10 до -25 мВ.
ВПСП и ТПСП зависит от природы медиатора и специфики постсинаптической клетки.
Интеграция синаптических процессов на нейроне, ее значение.
Постсинаптический нейрон может получать сигналы от большего количества пресинаптических нейронов, которые он интегрирует и выдает ответ.
В некоторых синапсах имеет место облегчение, состоящее в том, что после каждого стимула синапс становится более чувствительным к следующему синапсу.
ВПСП, генерируемый в одном возбуждаемом синапсе, приводит лишь к незначительному колебанию мембранного потенциала в аксоном холмике (1 мВ или <). Это связано с тем, что ВПСП возникает в отдалении от аксонного холмика, а амплитуда его мала.
ПД может появиться лишь в случае повторных разрядов в одной синаптической бляшке (временная суммация – медиатор высвобождается порциями (квантами), а не в виде отдельных молекул) либо при одновременном возбуждении нескольких окончаний (пространственная суммация).
Отдельные ВПСП, генерируемые при повторных или одновременных разрядах, складываются и образуют суммарный ВПСП.
Если местные деполяризующие токи, возникающие под влиянием суммарного ВПСП, достаточно велики для того, чтобы мембрана аксонного холмика деполяризовалась до порогового уровня, возникает ПД.
ТПСП тормозит генерацию ПД, уменьшая величину суммарного ВПСП.
Возникновение нервного импульса зависит от того, достаточна ли амплитуда суммарного синаптического потенциала, образующегося в результате сложения всех ВПСП и ТПСП, для деполяризации мембраны аксонного холмика до порогового уровня.
Медиаторы.
— (от лат. — посредник) – химические вещества, молекулы которых способны реагировать со специфическими рецепторами клеточной мембраны и изменять ее проницаемость для определенных ионов, вызывая возникновение (генерацию) ПД – активного электрического сигнала.
Выделяясь под влиянием нервных импульсов, медиаторы участвуют в их передаче с нервного окончания на рабочий орган и с одной нервной клетки на другую.
В ЦНС роль медиатора осуществляют – ацетилхолин, норадреналин, дофамин, серотонин, гамма аминомасляная и глутаминовая кислоты, глицин.
Основные медиаторы – ацетилхолин и норадреналин.
Медиаторы сами по себе не обладают возбуждающим и тормозящим действием.
Синапс – (от греческого synapsis – соприкосновение, связь) – место контакта двух нейронов или нейрона и мышцы.
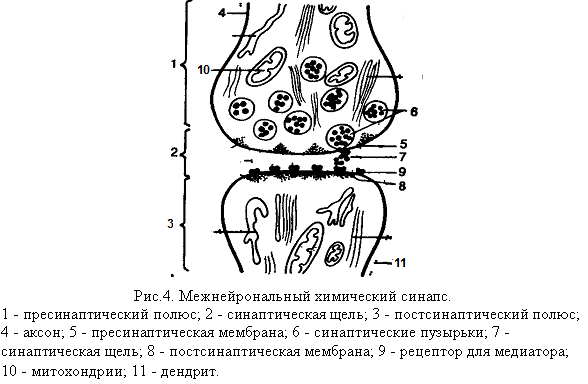
Межнейрональный химический синапс
Синапс состоит из 2-х мембран, соприкасающихся друг с другом: одна из них принадлежит разветвлению аксона одного нейрона, а другая – дендриту другого нейрона (рис. 4.). При исследовании синапса под электронным микроскопом ясно видна граница контактирующих друг с другом нейронов. На этой границе чётко вырисовываются две мембраны – пресинаптическая и постсинаптическая, отделённые друг от друга синаптической щелью. В центральной нервной системе синаптическая щель является непосредственным продолжением межклеточного пространства, их содержимое сообщается друг с другом. Ширина синаптической щели – от 2 до 30 нм, диаметр синаптического контакта – от 0,1 до 10 мкм.
Синаптическая щель – промежуток, разделяющий пресинаптическую мембрану аксона одной клетки и постсинаптическую мембрану тела или дендрита нейрона другой клетки или мышцы.
Пресинаптическая мембрана является продолжением поверхностной мембраны аксонального окончания, глиальные элементы не участвуют в образовании синапсов. Эта мембрана не сплошная, она имеет отверстия, через которые цитоплазма аксональных окончаний сообщается с синаптическим пространством. Постсинаптическая мембрана менее плотная, чем пресинаптическая, она не имеет отверстий. Толщина каждой из мембран синапса не превышает 5-6 нм. Несколько иначе построены органные синапсы, например, в области нервно-мышечного соединения. На поверхности мышечного волокна имеется углубление со множеством ветвящихся и взаимодействующих между собой складок, в которых размещаются разветвления аксона. Здесь также различаются пресинаптическая (аксональная) и постсинаптическая (мышечная) мембраны. Обе мембраны состоят из нескольких слоев, толщина каждой – около 10 нм; пространство между мембранами заполнено сильно гидратированным гелем.
Синапсы бывают двух видов – возбудительные и тормозные, с их помощью происходит соответственно передача или блокада нервного импульса.
Основной функцией синапса является передача возбуждения с одной нервной клетки на другую, либо с нейрона на эффекторный орган. По современным данным, в большинстве синапсов передача возбуждения осуществляется посредством медиатора, синтезируемого и накапливаемого в нервных окончаниях. Об этих функциях будет подробно рассказано при изучении физиологии ЦНС.
| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
Российский
государственный химико-технологический
университет
им.
Д. И. Менделеева
Задание №22.1:
Синапсы, строение,
классификация.
Физиологические
особенности проведения возбуждения в
синапсах.
Выполнил:
студент гр. О-36
Щербаков Владимир Евгеньевич
Москва — 2004
Синапс
– это морфофункциональное образование
ЦНС, которое обеспечивает передачу
сигнала с нейрона на другой нейрон или
с нейрона на эффекторную клетку (мышечное
волокно,
секреторную клетку).
Классификация
синапсов
Все
синапсы ЦНС можно классифицировать
следующим образом.
-
По локализации:
центральные (головной и спинной мозг)
и периферические (нервномышечный,
нейросекреторный синапс вегетативной
нервной системы). Центральные синапсы
можно в свою очередь разделить на
аксо-аксональные, аксо-дендритические
(дендритные), аксо-соматические,
аксо-шипиковый
синапс. (Большинство возбуждающих
синапсов локализуется в выростах
дендритов, содержащих большое количество
актина и называемых шипиками),
дендро-дендритические,
дендро-соматические и т. п. СогласноГ.
Шеперду, различают реципрокные синапсы,
последовательные синапсы и синаптические
гломерулы (различным способом соединенные
через синапсы клетки). -
По развитию в
онтогенезе:
стабильные (например, синапсы дуг
безусловного рефлекса) и динамичные,
появляющиеся в процессе индивидуального
развития.
-
По конечному
эффекту:
тормозные и возбуждающие.
-
По механизму
передачи сигнала:
электрические, химические, смешанные. -
Химические
синапсы можно классифицировать:
а)по форме контакта
– терминальные (колбообразное соединение)
и преходящие (варикозное расширение
аксона);
б)по природе
медиатора – холинергические (медиатор
– ацетилхолин, АХ), адренергические
(медиатор – норадреналин, НА),
дофаминергические (дофамин), ГАМК-ергические
(медиатор – гамма-аминомасляная кислота),
глицинергические, глутаматергические,
аспартатергические, пептидергические
(медиатор – пептиды, например, вещество
Р), пуринергические (медиатор – АТФ).
Электрические
синапсы.
Вопрос о них во многом не ясен. Многие
авторы недостаточно четко дифференцируют
понятия «электрический синапс» и
«нексусы» (в гладких мышцах, в миокарде).
В настоящее время признают, что в ЦНС
имеются электрические синапсы. С точки
зрения морфологии электрический синапс
представляет собой щелевидное образование
(размеры щели до 2 нм) с ионными
мостиками-каналами между двумя
контактирующими клетками. Петли тока,
в частности при наличии потенциала
действия (ПД), почти беспрепятственно
перескакивают через такой щелевидный
контакт и возбуждают, т. е. индуцируют
генерацию ПД второй клетки. В целом,
такие синапсы (они называются эфапсами)
обеспечивают очень быструю передачу
возбуждения. Но в то же время с помощью
этих синапсов нельзя обеспечить
одностороннее проведение, т. к. большая
часть таких синапсов обладает двусторонней
проводимостью. Кроме того, с их помощью
нельзя заставить эффекторную клетку
(клетку, которая управляется через
данный синапс) тормозить свою активность.
Аналогом электрического синапса в
гладких мышцах и в сердечной мышце
являются щелевые контакты типа нексуса.
Строение
химического синапса (схема
на рис.1-А)
По
строению химические синапсы представляют
собой окончания аксона
(терминальные синапсы) или его варикозную
часть (проходящие синапсы), которая
заполнена
химическим веществом – медиатором. В
синапсе различают иресинаптический
элемент,
который ограничен пресинаптической
мембраной, постсинаптический элемент,
который ограничен постсинаптической
мембраной, а также внесинаптическую
область и синаптическую
щель, величина которой составляет в
среднем 50 нм. В литературе существует
большое разнообразие в названиях
синапсов. Например, синаптическая бляшка
– это синапс между нейронами, концевая
пластинка – это постсинаптическая
мембрана мионеврального синапса,
моторная бляшка – это пресинаптическое
окончание аксона на мышечном волокне.
Пресинаптическая
часть
Пресинаптическая
часть – специализированная часть
терминали отростка нейрона, где
расположены синаптические пузырьки и
митохондрии. Пресинаптическая мембрана
(плазмолемма) содержит потенциалозависимые
Са2+-каналы.
При деполяризации мембраны каналы
открываются, и ионы Са2+
входят
в терминаль, запуская в активных зонах
экзоцитоз нейромедиатора.
Синаптические
пузьрьки содержат
нейромедиатор. Ацетилхолин, аспартат
и глутамат находятся в круглых светлых
пузырьках; ГАМК, глицин – в овальных;
адреналин и нейропептиды – в мелких и
крупных гранулярных пузырьках. Слияние
синаптических пузырьков с пресинаптической
мембраной происходит при увеличении
концентрации Са2+
в цитозоле нервной терминали.
Предшествующий слиянию синаптических
пузырьков и плазмолеммы процесс узнавания
синаптическим пузырьком пресинаптической
мембраны происходит при взаимодействии
мембранных белков семейства SNARE
(синаптобревин, SNAP-25
и синтаксин).
Активные
зоны. В
пресинаптической мембране выявлены
так называемые активные
зоны
– участки утолщения мембраны, в которых
происходит экзоцитоз. Активные зоны
расположены против скоплений рецепторов
в постсинаптической мембране, что
уменьшает задержку в передаче сигнала,
связанную с диффузией нейромедиатора
в синаптической щели.
Постсинаптическая
часть
Постсинаптическая
мембрана содержит рецепторы нейромедиатора,
ионные каналы.
Физиологические
особенности проведения возбуждения в
синапсах
Синаптическая
передача – сложный каскад событий.
Многие неврологические
и психические заболевания сопровождаются
нарушением синаптической
передачи. Различные лекарственные
препараты влияют на синаптическую
передачу,
вызывая нежелательный эффект (например,
галлюциногены) или, наоборот,
корригируя патологический процесс
(например, психофармакологические
средства [антипсихотические препараты]).
Механизм.
Синаптическая
передача возможна при реализации ряда
последовательных
процессов: синтез нейромедиатора, его
накопление и хранение в синаптических
пузырьках вблизи пресинаптической
мембраны, высвобождение нейромедиатора
из нервной терминали, кратковременное
взаимодействие нейромедиатора с
рецептором, встроенным в постсинаптическую
мембрану; разрушение
нейромедиатора или захват его нервной
терминалью. (схема на рис.
1.)
Синтез
нейромедиатора. Ферменты,
необходимые для образования
нейроме-диаторов,
синтезируются в перикарионе и
транспортируются к синаптической
терминали по аксонам, где взаимодействуют
с молекулярными предшественниками
нейромедиаторов.
Хранение
нейромедиатора. Нейромедиатор
накапливается в нервной терминали,
находясь внутри синаптических пузырьков
вместе с АТФ и некоторыми катионами.
В пузырьке находится несколько тысяч
молекул нейромедиатора, что
составляет квант.
Квант
нейромедиатора. Величина
кванта не зависит от импульсной
активности,
а определяется количеством поступившего
в нейрон предшественника и активностью
ферментов, участвующих в синтезе
нейромедиатора.
Рис.
1. Механизм химической передачи импульсов
в нервном синапсе; от А до Д –
последовательные этапы поцесса.
Секреция
нейромедиатора. Когда
потенциал действия достигает нервной
терминали,
в цитозоле резко повышается концентрация
Са2+,
синаптические пузырьки
сливаются с пресинаптической мембраной,
что приводит к выделению квантов
нейромедиатора в синаптическую щель.
Незначительное количество нейромедиатора
постоянно (спонтанно) секретируется в
синаптическую щель.
Взаимодействие
нейромедиатора с рецептором. После
выброса в синаптическую
щель молекулы нейромедиатора диффундируют
в синаптической щели и достигают
своих рецепторов в постсинаптической
мембране.
Удаление
нейромедиатора из синаптической щели
происходит
за счёт диффузии,
расщепления ферментом и выведения путём
захвата специфическим переносчиком.
Кратковременность взаимодействия
нейромедиатора с рецептором
достигается разрушением нейромедиатора
специальными ферментами (например,
ацетилхолина – ацетилхолинэстеразой).
В большинстве синапсов передача
сигналов прекращается вследствие
быстрого захвата нейромедиатора
пресинаптической
терминалью.
Свойства химических
синапсов
Односторонняя
проводимость – одно из важнейших свойств
химического синапса. Асимметрия –
морфологическая и функциональная –
является предпосылкой для существования
односторонней проводимости.
-
Наличие
синаптической задержки: для того, чтобы
в ответ на генерацию ПД в области
пресинапса
выделился медиатор и произошло изменение
постсинаптического потенциала (ВПСП
или ТПСП), требуется определенное время
(синаптическая задержка). В среднем оно
равно 0,2–0,5 мс. Это очень короткий
промежуток времени, но когда речь идет
о рефлекторных дугах (нейронных сетях),
состоящих из множества нейронов и
синаптических связей, это латентное
время суммируется и превращается в
ощутимую величину – 300 – 500 мс. В
ситуациях, встречающихся на автомобильных
дорогах, это время оборачивается
трагедией для водителя или пешехода. -
Благодаря
синаптическому процессу нервная клетка,
управляющая данным постсинаптическим
элементом (эффектором), может оказывать
возбуждающее воздействие или, наоборот,
тормозное (это определяется конкретным
синапсом). -
В
синапсах существует явление отрицательной
обратной связи – антидромный эффект,
Речь идет о том, что выделяемый в
синаптическую щель медиатор может
регулировать
выделение следующей порции медиатора
из этого же пресинаптического элемента
путем
воздействия на специфические рецепторы
пресинаптической мембраны. Так, известно,
что
в адренергических синапсах имеются
альфа2-адренорецепторы,
взаимодействие с которыми
(норадреналин связывается с ними)
приводит к снижению выделения порции
норадреналина при поступлении очередного
сигнала к синапсу. На пресинаптической
мембране обнаруживаются рецепторы и
к другим веществам. -
Эффективность
передачи в синапсе зависит от интервала
следования сигналов через синапс.
Если этот интервал до некоторых пор
уменьшать (учащать подачу импульса по
аксону), то на каждый последующий ПД
ответ постсинаптической мембраны
(величина ВПСП
или ТПСП) будет возрастать (до некоторого
предела). Это явление облегчает передачу
в синапсе, усиливает ответ постсинаптического
элемента (объекта управления) на
очередной
раздражитель; оно получило название
«облегчение» или «потенциация». В
основе его
лежит накопление кальция внутри
пресинапса. Если частота следования
сигнала через синапс очень большая, то
из-за того, что медиатор не успевает
разрушиться или удалиться из синаптической
щели, возникает стойкая деполяризация
или католическая депрессия – снижение
эффективности синаптической передачи.
Это явление называется депрессией.
Если через
синапс проходит много импульсов, то в
конечном итоге постсинаптичеркая
мембрана может
уменьшить ответ на выделение очередной
порции медиатора. Это называется
явлением десенситизации – утратой
чувствительности. В определенной мере
десенситизация похожа
на процесс рефрактерности (утрата
возбудимости). Синапсы подвержены
процессу утомления.
Возможно, что в основе утомления
(временного падения функциональных
возможностей
синапса) лежат: а) истощение запасов
медиатора, б) затруднение выделения
медиатора,
в) явление десенситизации. Т. о., утомление
– это интегральный показатель.
Литература:
1.
Агаджанян Н.А., Гель Л.З., Циркин В. И.,
Чеснокова С.А. ФИЗИОЛОГИЯ
ЧЕЛОВЕКА.
—
М.: Медицинская книга, Н. Новгород:
Издательство НГМА,
2003, глава 3.
2.
Грин Н., Стаут У., Тейлор Д. Биология
в 3-х томах. Т.2:Пер. англ./Под ред. Р. Сопера.
– 2-е изд., стереотипное – М.:Мир, 1996, стр.
254 – 256
3. Гистология
стр. 201 — 203
5
Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
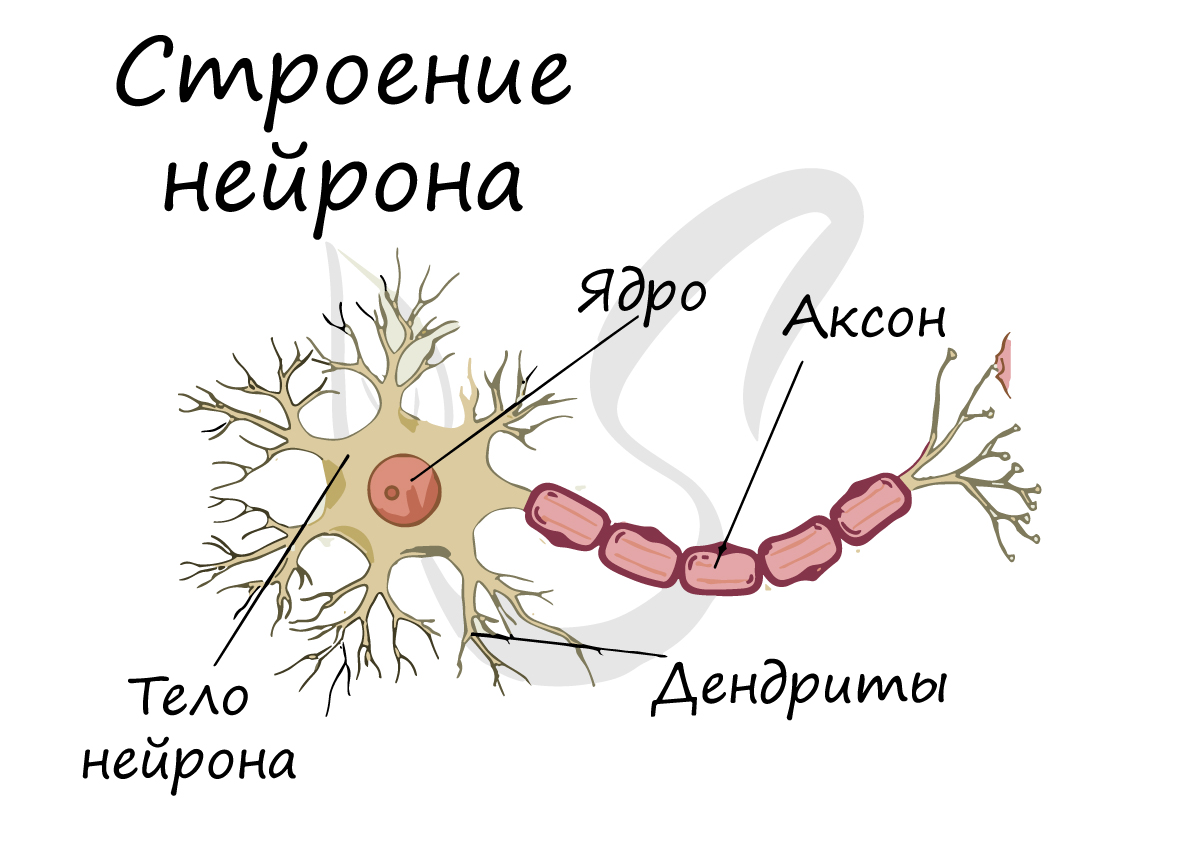
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
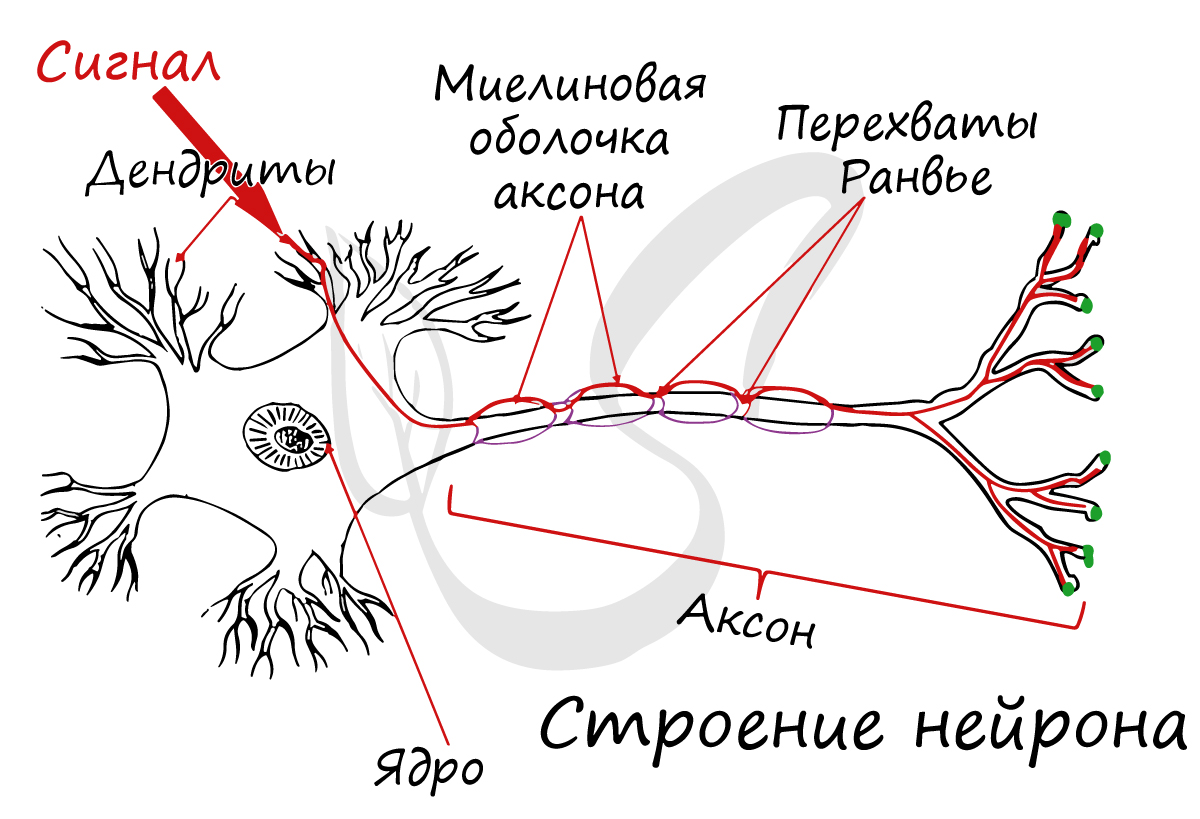
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
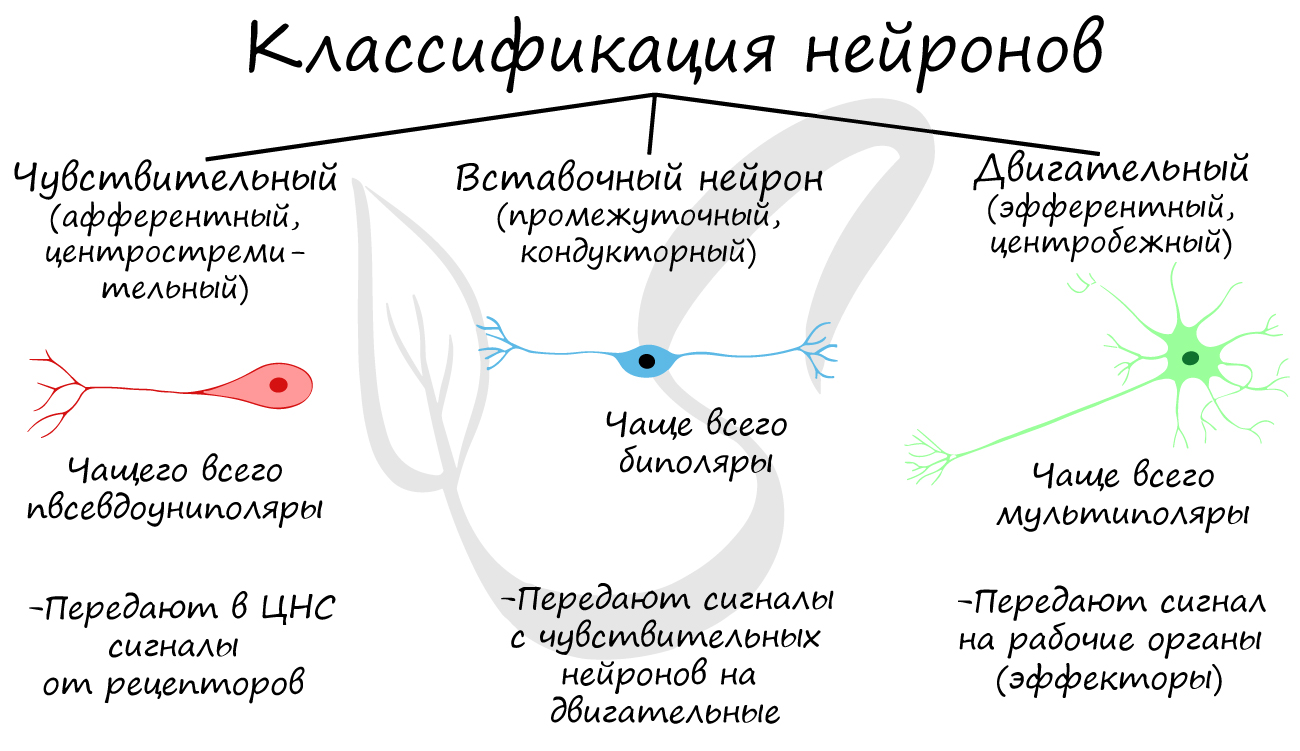
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
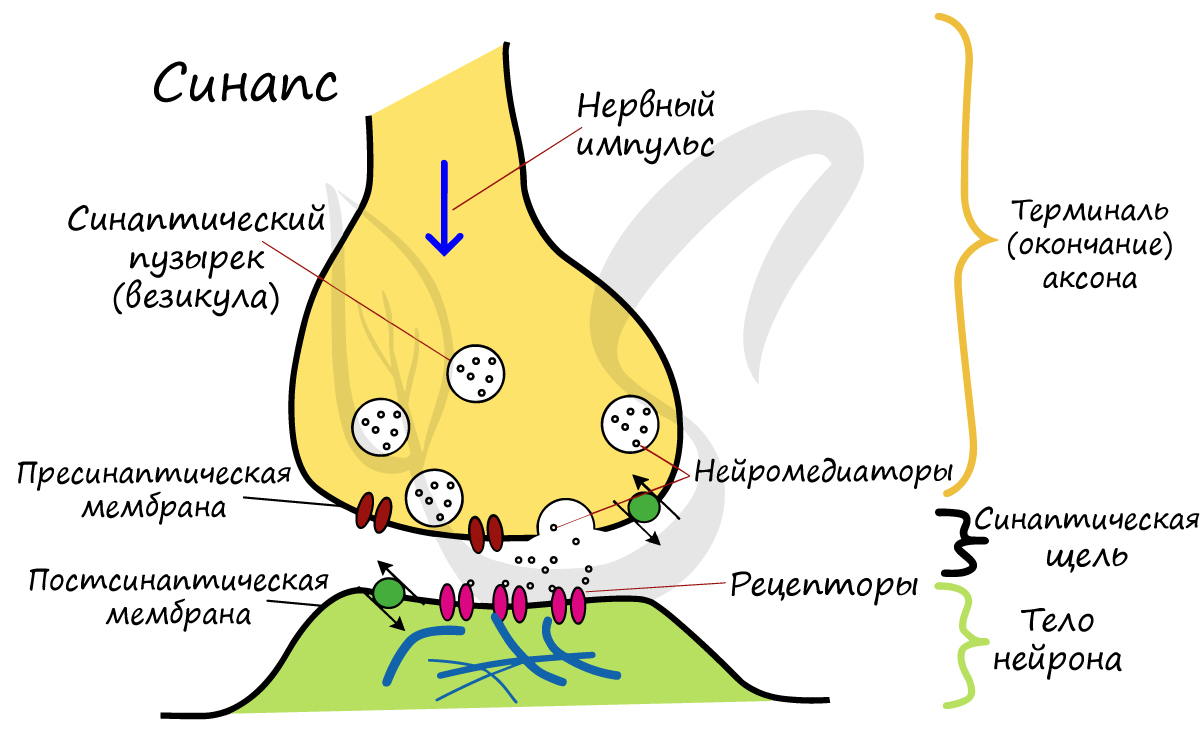
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.