Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
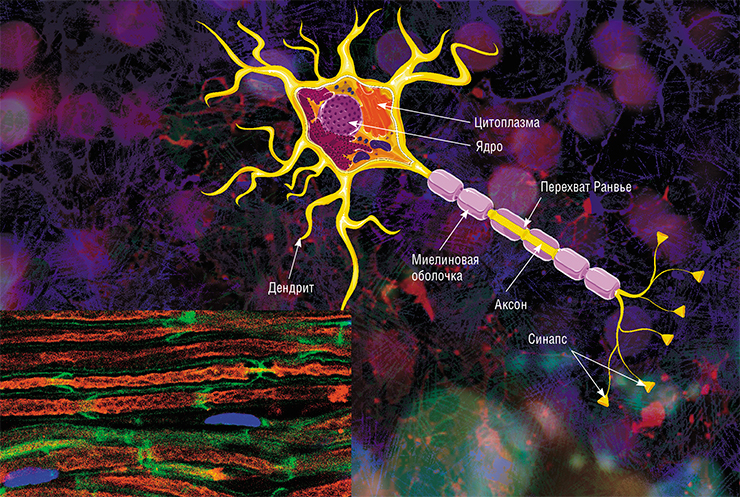
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
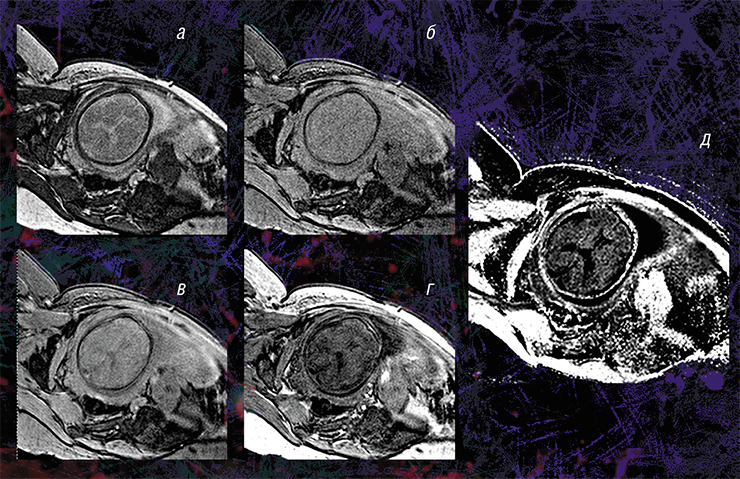
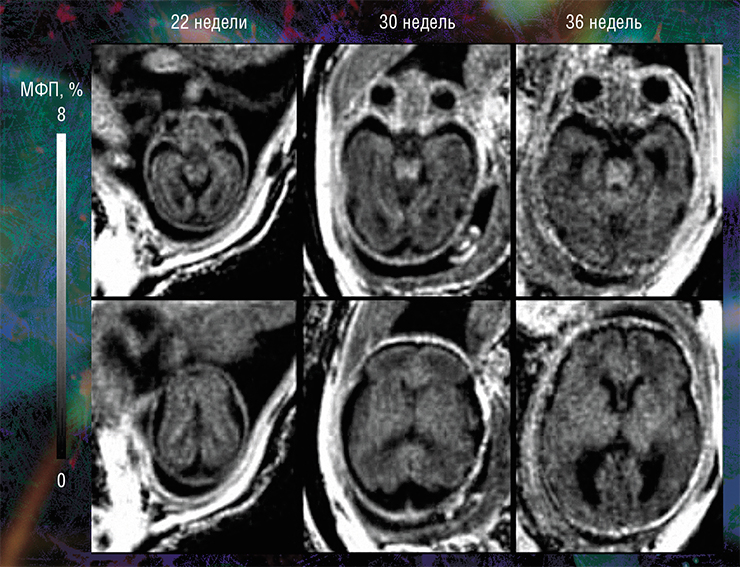
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
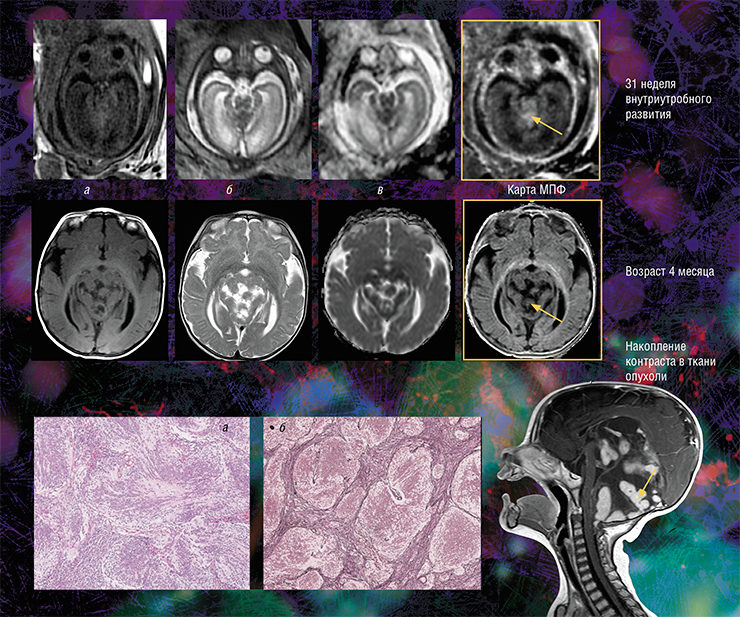
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
У нервных клеток есть два вида отростков — небольшие и чрезвычайно разветвлённые дендриты, с помощью которых нейрон собирает импульсы от других нервных клеток, и очень длинные аксоны, которые отправляют импульсы дальше. Почти все аксоны в центральной нервной системе (то есть в головном и спинном мозге) покрыты миелином — светлой субстанцией, состоящей преимущественно из липидов. Миелинизированных нервных волокон также много в периферической нервной системе, то есть в нервах, которые выходят из головного и спинного мозга и идут к другим органам.
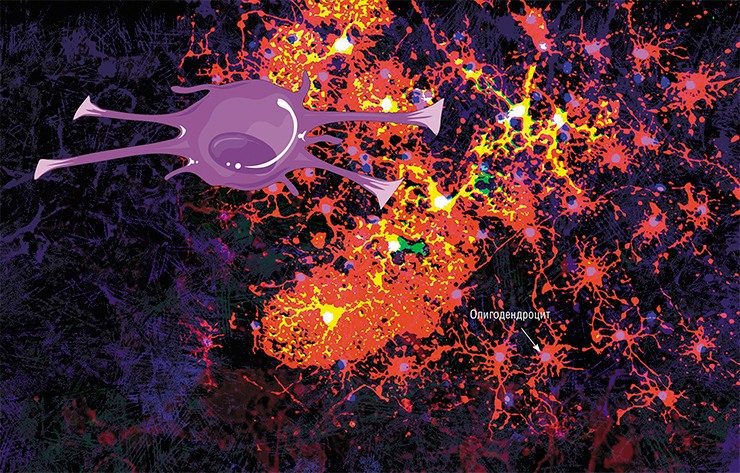
Олигодендроцит и миелиновая оболочка. Один олигодендроцит формирует миелиновую оболочку сразу на нескольких аксонах, но на каждом из них он создаёт только один сегмент оболочки (от одного перехвата Ранвье до другого). Иллюстрация: Holly Fischer/Wikimedia Commons/CC BY 3.0.
‹
›
Миелин одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Чтобы понять, как миелин ускоряет импульсы, нужно вспомнить, что любой импульс в нейроне — это перегруппировка ионов между наружной и внутренней стороной клеточной мембраны. Когда на каком-то участке мембраны открываются ионные каналы, то такие же ионные потоки сразу открываются на соседнем участке мембраны, потом — на участке чуть подальше и т. д. Электрические свойства мембраны последовательно меняются вдоль нейронного отростка — это и есть бегущий импульс. Миелин окутывает аксоны не всплошную с начала и до конца. В миелиновой обмотке есть пробелы, где мембрана не покрыта миелином, — перехваты Ранвье (названные так в честь открывшего их французского физиолога Луи Антуана Ранвье). И когда импульс распространяется по аксону, то перегруппировка ионов происходит как раз на перехватах Ранвье. То есть импульс не переползает медленно между участками, которые находятся вплотную друг к другу, а скачет от одного перехвата к другому. И если в аксоне без миелина импульс бежит со скоростью 0,5—10 м/с, то в таком же аксоне, но с миелином, скорость импульса достигает 150 м/с.
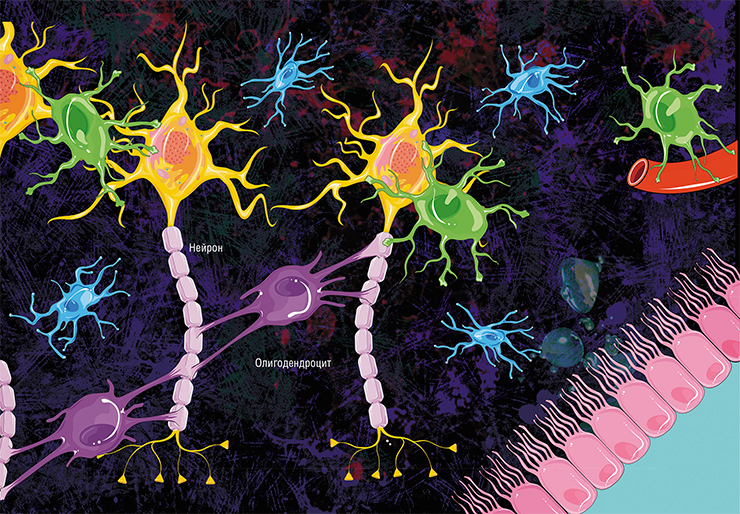
Скопления аксонов, обмотанных миелином, выглядят светлее, поэтому области в мозге, где преобладают аксонные «провода», называют белым веществом. (Скопления дендритов, которые обходятся без миелина, образуют серое вещество. Поскольку дендриты намного короче аксонов, они не передают импульсы на большие расстояния и скорость для них не так важна.) Нейроны не сами вырабатывают миелин, для того есть специальные клетки — олигодендроциты в центральной нервной системе и шванновские клетки в периферических нервах. И те и другие относятся к глие, или нейроглие — так называют совокупность различных клеток нервной системы, которые обслуживают нейроны, создавая им условия для работы. В последнее время появляется всё больше данных о том, что глиальные клетки не просто обслуживают нейроны, но напрямую вмешиваются в их работу (см. статью «Иммунные ”электрики” мозга», «Наука и жизнь» № 8, 2020 г.). Задача олигодендроцитов и шванновских клеток — сделать нейронам миелиновую обмотку. Олигодендроцит или шванновская клетка выпячивают собственную мембрану и обхватывают аксон, мембрана нарастает — и в итоге вокруг аксона получается слоистый липидный рулон. Глиальная клетка остаётся живой и поддерживает целостность миелиновой обмотки на том участке аксона, за который она отвечает.
Разрушение миелиновой оболочки приводит к неврологическим симптомам различного вида и различной степени тяжести. Есть много заболеваний, связанных с утратой миелина на аксонах, и рассеянный склероз среди них — самое известное. Это одна из аутоиммунных болезней, когда иммунитет по какой-то причине атакует собственные клетки и молекулы организма. При рассеянном склерозе срабатывают разные иммунные механизмы, в которых участвуют как иммунные клетки мозга, так и иммунные клетки, вошедшие в мозг из крови. Но, так или иначе, заканчивается всё тем, что миелиновая оболочка вокруг аксонов разрушается, а иногда разрушаются и сами аксоны. В очаг болезни приходят астроциты — так называется ещё одна разновидность глиальных клеток. Их задача — поддерживать и питать нейроны, а также залечивать повреждения; именно это они и делают, стараясь зарубцевать больной участок и формируя характерную бляшку. Стоит добавить, что обычно рассеянный склероз поражает центральную нервную систему; периферические нервы страдают от него редко.
Наш мозг – огромный мегаполис, дорожная инфраструктура которого напоминает связи и проводящие пути; по ним с огромной скоростью и частотой подобно спорткарам проносятся сигналы, а разные линии жилых районов имитируют различные уровни организации головного мозга. Здесь есть разделение труда, «неравноправие», доминирование, свои валюты и множество других вещей, которые так или иначе напоминают жизнь людей в крупном городе-миллионнике. Наша нервная система состоит из приблизительно 86 миллиардов нервных, и почти такого же количества (85 миллиардов глиальных клеток и от ста до пятисот триллионов синапсов (соединений). При этом она чрезвычайно разнолика и имеет в своём арсенале около сотни клеточных типов, которые способны строить тысячи связей между собой и создавать настоящие клеточные ансамбли.
В таком разнообразии очень легко запутаться, поэтому сегодня мы с вами разберём, что же именно отличает нервную ткань от других, какие клеточные варианты имеются в её составе, чем уникален нейрон и почему именно у нервной системы получается делать нас мыслящими.
Начнём с «внутренностей» нейрона
Как и любая нормальная клетка, он имеет ядро, цитоплазму и клеточную мембрану, которая обособляет его от внешней среды. Однако, это не всё. Нейрон – одна из немногих клеток, которая способна к генерации нервного импульса. О нём мы с вами поговорим в следующих выпусках, а сейчас стоит отметить лишь то, что такая возбудимость позволяет мозгу обрабатывать информацию, а нам — существовать.
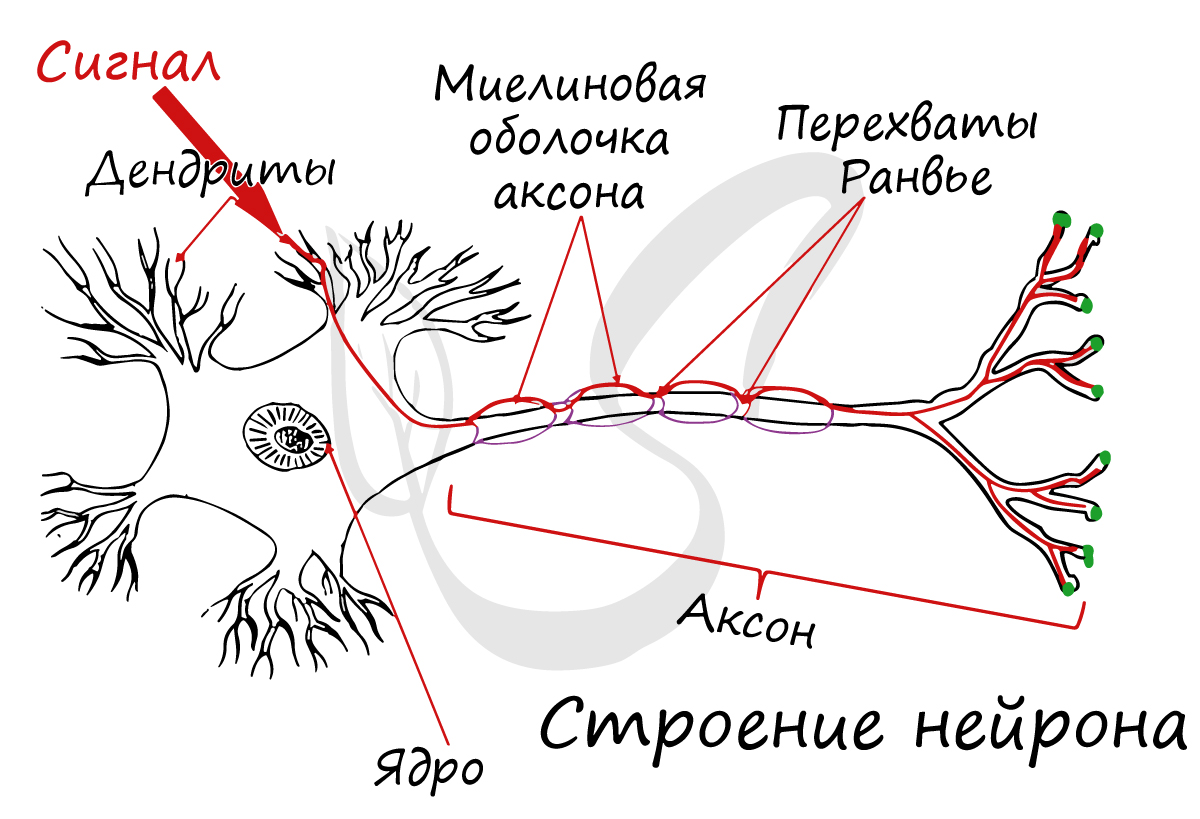
У нейрона есть несколько характерных составных элементов, увидев которые вы никогда не спутаете его с другими клетками: это аксон— длинный отросток, по которому сигналы идут от перикариона, или тела, и дендриты – короткие отростки, по которым информация движется к нейрону от его соседей.
Аксон, главный «кабель», покрыт «изоляцией», миелиновой оболочкой. Миелиновая оболочка аксонов есть только у позвоночных, а поскольку у нас явно есть позвоночник, то… Эту оболочку образуют «накручивающиеся» на аксон специальные шванновские клетки (в центральной нервной системе — олигодендроциты, несколько другой тип клеток, нежели шванновские), между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье.
Перикарион имеет в своём составе обычные для живых эукариотических (ядерных) клеток субъединицы: собственно ядро, гранулярную эндоплазматическую сеть (ЭПС), которая синтезирует белки и прочие нужные клетке вещества и окрашивается при специальной окраске в тёмный цвет, которым покрываются глыбки тигроида или субстанции Ниссля, которые можно разглядеть даже в световой микроскоп.
Также здесь есть аппарат Гольджи или «накопительный резервуар», митохондрии — «энергетические станции», лизосомы с «пищеварительными» ферментами, рибосомы, благодаря которым происходит синтез белков, а также целая сеть внутреннего цитоскелета, в которую входят микротрубочки, особые частицы — MAP (протеины, ассоциированные с микротрубочками), а также нейрофиламенты (типа промежуточных нитей). Благодаря этому скелету в клетке протекает очень важный для неё перенос веществ от центра к периферии, что особенно актуально для длинного (порой до нескольких десятков сантиметров) аксона, который питается также от тела. Такой ток бывает аксональным быстрым (до 100-1000 мм/сутки) и медленным (1-3 мм/сутки), дендритическим (75 мм/сутки), а также движущимся в обратном направлении — ретроградным.
А теперь представим, что перед нами микроскоп, а на предметном столике – покрашенный одним из специфических способов (по Нисслю или импрегнацией серебром) срез мозга. Как определить, где в переплетении отростков аксоны, а где – дендриты? Посмотреть нужно на тигроид, о котором мы упоминали. Дело в том, что он в виде гранул «рассыпан» по всему телу и коротким отросткам, но никогда вы его не найдёте в отростке длинном. А заканчивается он в районе аксонального холмика – структуры, близкой к началу аксона, в которой начинается генерация импульса.
Нейрон снаружи
Теперь, когда мы разобрались, что внутри у нервных клеток, посмотрим на их внешнюю организацию и попробуем разобраться в функциональном разделении.
Вспомните, что мы говорили про один длинный аксон и короткие дендриты. Так вот, этот вид нейронов называется мультиполярным, и он — самый «популярный», однако, есть и другие: униполярные (всего один отросток), биполярные (два отростка) и псевдоуниполярные (один отросток, который потом делится на два). Есть и вовсе аполярные(«голые») нейроны. Это предшественники нервных клеток – нейробласты.
Интересно, что униполярные нейроны представлены у человека всего лишь в одном виде: амакриновыми клетками сетчатки глаза. Псевдоуниполярные встречаются гораздо чаще и составляют основную массу спинномозговых чувствительных узлов, о которых мы поговорим чуть позже. Биполярных тоже не так много, и их пул, главным образом, приходится на обонятельные рецепторные клетки. Ну а с мультиполярными и так всё понятно – это универсальные представители нервной системы (например, мотонейроны спинного мозга).
Но, при всей своей важности, строение – это всё же не функции. Каждый нейрон, представляя собой возбуждаемую и возбуждающую клетку (не путать с некими другими физиологическими процессами!), должен своим «настроением» делиться с соседями, иначе сигнал не дойдёт до адресата и не будет обработан и выполнен, что никого, конечно, не устраивает. Поэтому, подобно водителям, въезжающим на платную скоростную трассу, нейроны должны «заплатить», чтобы передать импульс дальше.
Эта «валюта» существует в двух формах: электрической и химической. Второй случай — более частый. А контрольно-пропускные пункты с кассами на автомагистралях воплощаются в синапсах — местах передачи возбуждения с клетки на клетку, то есть местах соединения нейронов. Такие места образуются на специальных выростах на дендритах: дендритных шипиках. Они чаще всего бывают трёх видов: пеньковые, грибовидные и тонкие шипики. Но бывают и другие.
Дендритный шипик — с его шейкой и головкой
Тонкий, грибовидный и пеньковый шипики.
Какие же бывают синапсы?
Реже бывает так. Благодаря ионным каналам в мембране и плотным контактам клеток электрический сигнал без особых усилий перескакивает с нейрона на нейрон и «летит» дальше — пробок нет, оплата принята, водитель доволен. Но это — электрический синапс, или, как еще умничают нейробиологи, эфапс.
Электрические синапсы (эфапсы). а — коннексон (двойная пора) в закрытом состоянии; b — коннексон в открытом состоянии; с — коннексон, встроенный в мембрану; d — мономер коннексина (белка, из которого сделаны коннексоны), е — плазматическая мембрана; f — межклеточное пространство; g — промежуток в 2-4 нанометра в электрическом синапсе; h — гидрофильный канал коннексона.
Но намного чаще случаются ситуации, когда синапс имеет достаточно широкую щель – порядка десятков микрон. То есть перед водителем река, а переправляться придётся на пароме. Здесь вступает в силу химическая «валюта» в виде нейромедиатора, который накапливается в везикулах (пузырьках) пресинаптической мембраны, затем вырабатывается в эквивалентоном силе пришедшего импульса количестве, «переплывает» щель и принимается рецепторами на другом берегу – постсинаптической мебране.
Вот он, универсальный язык нервной системы, а нейроны по типу нейромедиаторов делятся на холинергические, адренергические, ГАМК-ергические и некоторые другие (об этом читайте в следующих выпусках). Исходя из этого, действие, в зависимости от типа нейромедиатора, бывает либо возбуждающим, либо тормозным.
Химический синапс.
Но и это ещё не всё! Есть нейроны чувствительные, которые воспринимают сигнал из внешней или внутренней среды, затем следующие за ними в центральную нервную систему — вставочные, которые обеспечивают ассоциацию в нейронных сетях и могут быть в единичном или множественном числе, и двигательные, которые завершают сигнал действием и иннервируют сократительные или секреторные элементы. Также их ещё можно назвать афферентными (восходящими, двигающимися к центру), интернейронами и эфферентыми (нисходящими, двигающимися к периферии).
«Серый кардинал» нервной системы
Мы поговорили о нейронах, но нельзя забывать и о другой, не менее важной части нервной системы – нейроглии, тем более, что она составляет половину объёма головного мозга и принимает чуть ли не основное участие (как выяснилось в последние годы) в регуляции синаптической передачи, усиливая либо ослабляя сигнал.
Так вот, вся глия по строению, функциям и расположению делится на эпендимную(выстилающую внутреннее пространство цереброспинального канала и желудочков мозга), макро— и микроглию.
Макроглия, в свою очередь, имеет в своём распоряжении целый веер различных подтипов и для центральной, и для периферической нервной системы. Так, в головном мозге она представлена астроцитами, название которых говорит само за себя (большие звёздчатые клетки с большим количеством отростков, которые оплетают нейроны и сосуды), а также олигодендроцитами, которые обеспечивают внутримозговые волокна миелином (по сути, наматываются отростками на аксон — мы уже упомянули о них), многократно увеличивающим скорость передачи импульса.
Периферическая нервная система в основном обходится лишь шванновскими клетками, которые также миелинизируют волокна, но уже за пределами центра, и расходятся по всему организму. И ещё сюда добавляются так называемые мантийные глиоциты или сателлиты, которые образуют оболочку (мантию) вокруг тел нейронов в ганглиях (узлах). Микроглия представляет из себя собственную фагоцитарную систему головного мозга и активируется в основном тогда, когда в нём появляются патологические процессы.
Астроцит.
Но нужно всё-таки подчеркнуть важность глии. Работы по её изучению ведутся не так много лет – буквально два последних десятилетия. Появилась такая рабочая гипотеза (автор — Филип Хейдон [Philip G. Haydon]), согласно которой астроциты, обмениваясь сигналами, активируют нейроны, чьи аксоны находятся от них не только на близком расстоянии, но и сравнительно далеко. Эта активация в итоге способствует высвобождению нейромедиаторов. Таким образом, астроциты регулируют готовность даже отдалённых синапсов к изменению своей эффективности, что представляет собой клеточную основу процессов памяти и обучения.
Сотрудники из лаборатории Бена Барреса (Ben A. Barres, Стэнфордский университет) пошли дальше и открыли специфический белок тромбоспондин астроцитарного происхождения, который стимулирует образование синапсов. Сравнение же головного мозга показывает, что чем более высокое положение занимают животные на «эволюционной лестнице», тем больше в их мозге глиальных клеток по отношению к нервным. Так вот, возможно, что увеличение связности астроцитов может даже повышать способность животных к обучению. Однако это ещё только предстоит доказать.
На острие чувств
В завершение нашего небольшого путешествия внутрь нервной системы разберёмся в том, откуда берутся наши ощущения. Оказывается, здесь строение нервного окончания также имеет самое непосредственное отношение к процессу. Нервные окончания могут располагаться в тканях свободно, могут оканчиваться специальными сенсорными рецепторами, а могут «заключаться» в соединительнотканную капсулу.
Тактильные «граждане» располагаются в слоях соединительной ткани внутренних органов и кожи. Большинство из них – механорецепторы (тактильные, пластинчатые тельца), которые реагируют на какие-либо механические воздействия.
Например, тельца Руффини реагируют на растяжение кожи, тельца Пачини – на давление. Некоторые окончания в эпидермисе «заточены» под регистрацию изменений температуры (тепло – тельца Руффини, холод – колбы Краузе). Есть даже такие рецепторы, которые могут определять изменения рН, рО2 и рСО2.
Поперечное сечение телец Руффини.
Для суставов и мышц есть свои детекторы чувств. К ним относятся мышечные веретёна, сухожильные органы и чувствительные нервные окончания в капсуле суставов.
Источник: портал «Нейроновости»
Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
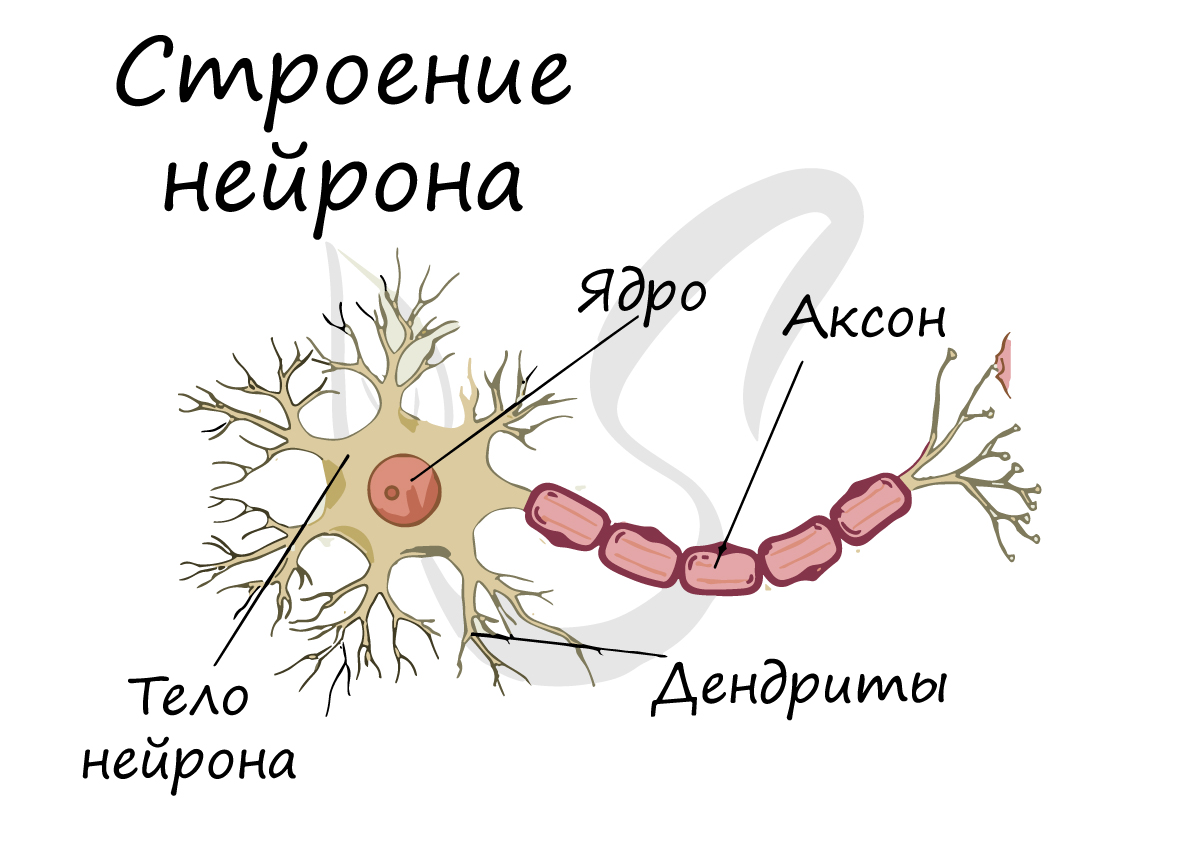
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
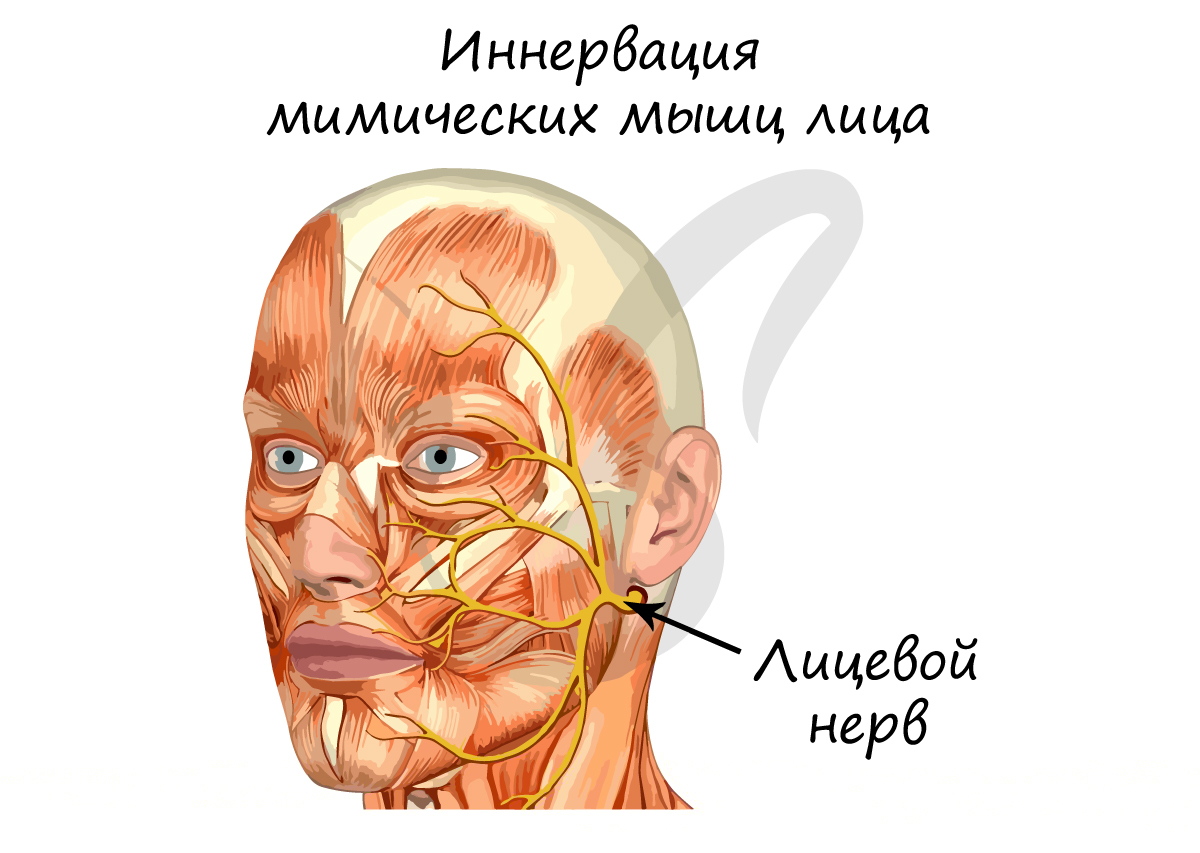
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
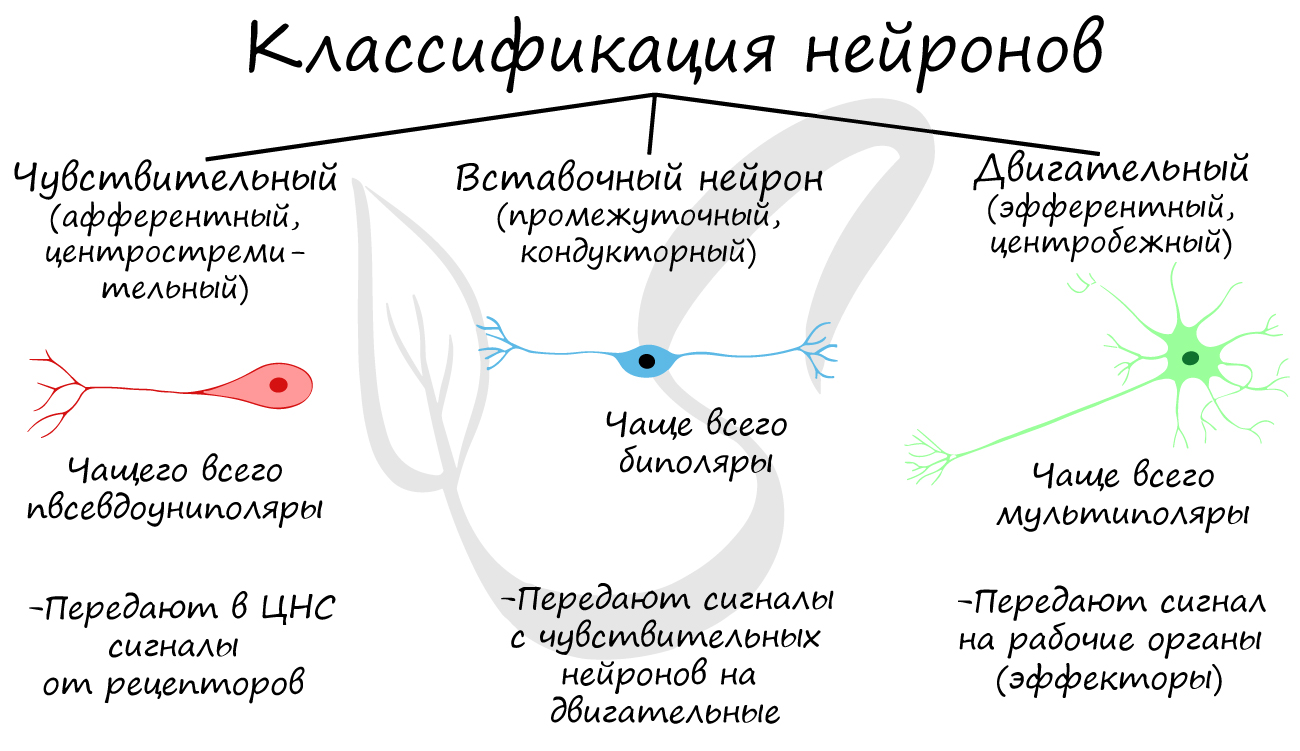
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
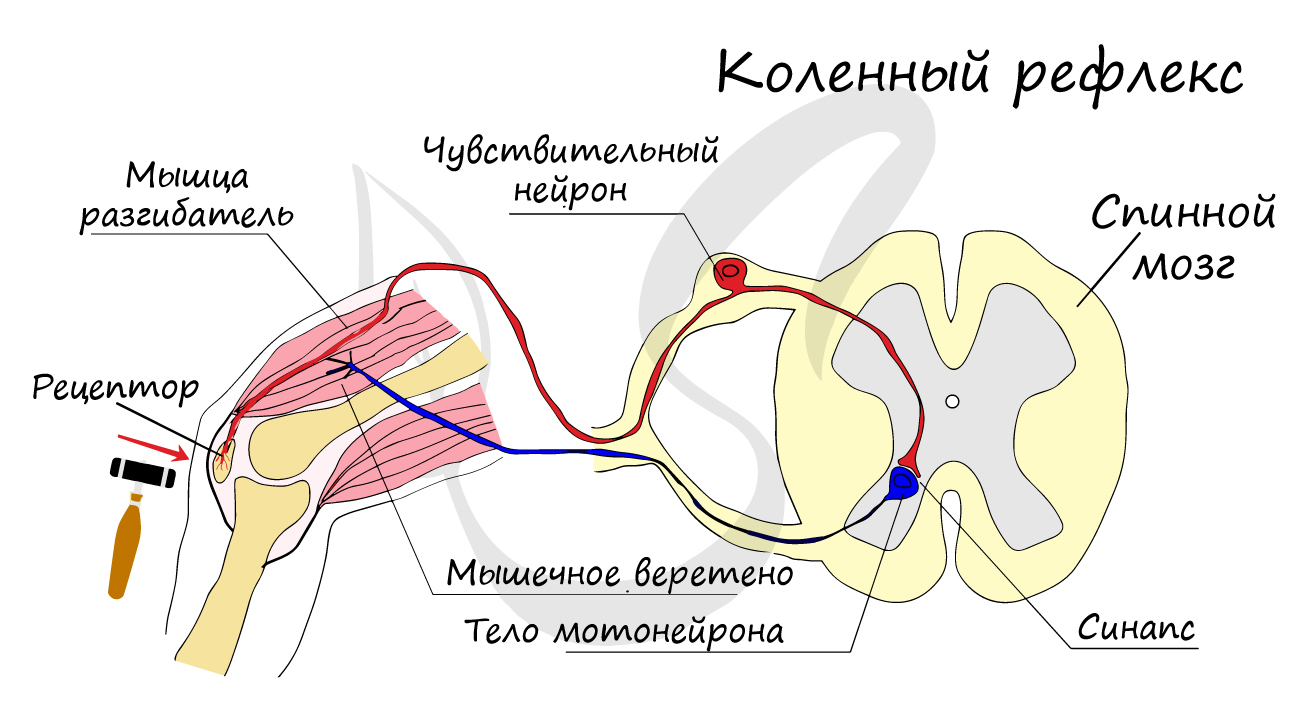
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
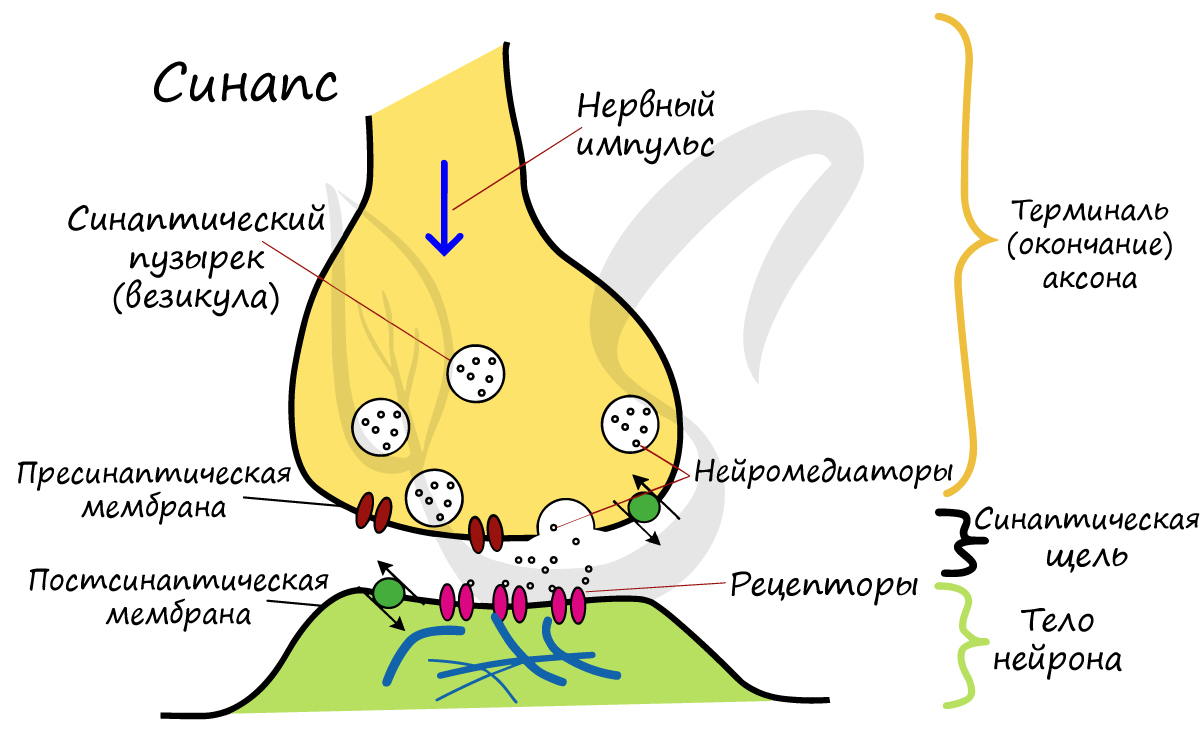
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
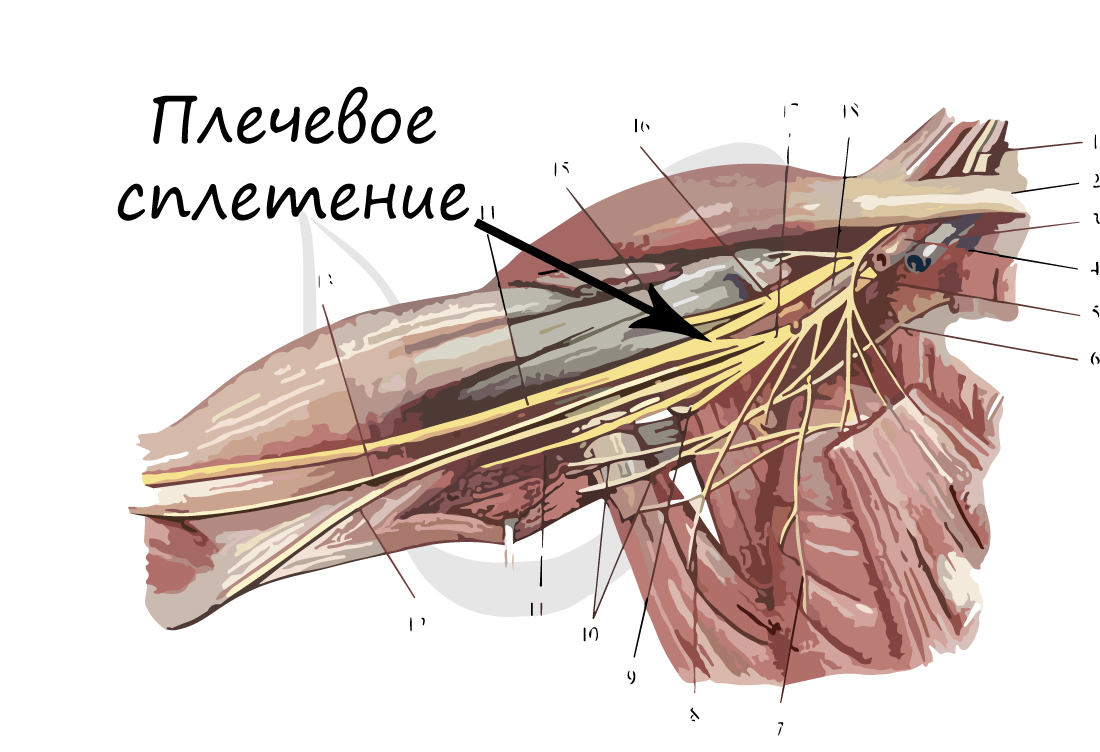
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
: 30 окт 2020 , Братство кольца , том 88,
№3
МИЕЛИНовая защита нейрона: все начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
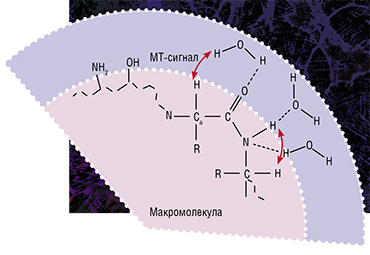
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Литература
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)
: 30 окт 2020 , Братство кольца , том 88,
№3