-
Микроструктура
нервной ткани -
Нейрон как основная
морфо-функциональная единица -
нервной системы
-
Классификации
нейронов -
Морфо-функциональная
характеристика синапса -
Общая характеристика
нервных волокон -
Структурно-функциональная
характеристика глиальных клеток
-
Микроструктура нервной ткани
Клетка.
Согласно клеточной теории клетка
является элементарной единицей строения,
функционирования и развития живого
организма.
Ткань
– исторически сложившаяся совокупность
клеток и межклеточного вещества,
обладающих общностью происхождения,
строения и функций. В организме человека
выделяют 4 основных вида тканей:
эпителиальная, мышечная, соединительная
и нервная. Эпителиальная ткань покрывает
тело снаружи и выстилает полости
внутренних органов. Мышечная ткань
образует скелетные мышцы тела, мышцу
сердца и мышцы внутренних органов и
сосудов. Соединительная ткань образует
кости, хрящи, плотные оболочки вокруг
внутренних органов, кровь и т.д. Нервная
ткань образует нервную систему.
В организме
животного и человека существует 4
основные разновидности тканей: мышечная,
соединительная (кровь, кости, связки,
хрящи, подкожная жировая клетчатка и
т.д.), эпителиальная (кожа и слизистые
полостей органов) и нервная.
Нервная ткань
образована клетками двух типов: нейронами,
осуществляющими специфические функции
нервной системы, и глиальными клетками,
которые являются вспомогательными и
выполняют функции опоры, изоляции,
питания (трофики) нейронов. Нейроны
в нервной ткани за счет своих отростков
соединяются в очень сложные системы,
взаимодействие между нейронами
осуществляется за счет специфических
контактов, называемых синапсами.
2. Нейрон как основная морфо-функциональная единица нервной системы
Согласно
«нейронной доктрине», сформулированной
крупнейшим испанским нейроанатомом
Сантьяго Рамон-и-Кахалом (1852-1934),
нейрон является основной структурной,
функциональной и генетической
единицей нервной системы.
В нервной системе насчитывается до 1011
нейронов, различающихся по форме и
функциям.
Нейрон
относится к высокоспециализированным
клеткам, способным воспринимать
раздражение, преобразовывать его в
нервный импульс (свойство возбудимости)
и проводить его вдоль поверхности клетки
(свойство проводимости) для передачи в
синапсе другим нервным клеткам или
клеткам эффекторных (рабочих) органов
(мышечным или железистым).
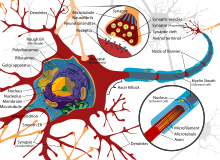
Нейрон состоит из
сомы (тела или перикариона) и отростков.
Размеры тела нейрона колеблются от 5 до
150 мкм. Короткие отростки ветвятся
наподобие дерева и поэтому называются
дендритами (от
греч. dendron
– дерево).
Их количество в разных нейронах колеблется
от одного до тысяч. На дендритах образуются
мелкие мембранные выросты микрошипики
длиной
до 2—3 мкм. Шипики являются местами
синаптических контактов. Они не
встречаются в месте отхода дендритов
от сомы. Нервное возбуждение всегда
проходит в направлении от дендрита к
соме.
Сома и
дендриты нейрона покрыты только клеточной
мембраной и внешне выглядят как серое
вещество
нервной системы.
От сомы отходит
один длинный отросток – аксон. Он
является основой нервного волокна.
Длина
такого отростка у человека может
достигать I20
см. Аксон служит для проведения нервных
импульсов от тела клетки к другим
нейронам (или эффекторным органам).
Начальную часть аксона, вытянутую
в виде воронки от тела клетки,
называют
аксонным
холмиком.
Аксонный
холмик наиболее возбудим и является
наиболее частым местом генерации нервных
импульсов. Сам
аксон, или осевой цилиндр, имеет серый
цвет. Но основная его часть покрыта как
чехлом белой жироподобной миелиновой
оболочкой.
Поэтому
внешне скопления аксонов выглядят как
белое вещество
нервной системы.
Миелиновая
оболочка периодически истончается,
образуя перехваты Ранвье. За счет
миелиновой оболочки нервный импульс
распространяется по аксону в десятки
раз быстрее, чем по дендритам или соме.
На
относительно большом удалении от сомы
аксон может ветвиться. Такие боковые
отростки называют коллатералями. Каждая
из коллатералей на самом окончании
также, как правило, ветвится, эти
ветвления называют терминалями
(от лат. terminalis
– заключительный, конечный). Терминали
уже не покрыты миелином. На конце каждой
терминали есть вздутие, которое является
составной частью синапса (пресинапс).
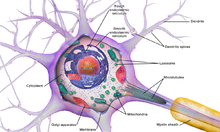
Нейрон, как и
типичная животная клетка, имеет в своем
внутреннем строении плазматическую
мембрану, ядро, цитоплазму и органеллы.
Особенностью
строения нейрона является большое
количество рибосом на эндоплазматической
сети в соме, которое при специальных
способах окраски выглядит как тигроидное
вещество (вещество Ниссля). В цитоплазме
нейрона содержатся органеллы
специального назначения микротрубочки
и микрофиламенты,
которые различаются размером и
строением. Микрофиламенты представляют
внутренний скелет цитоплазмы и расположены
в соме. Микротрубочки тянутся вдоль
аксона по внутренним полостям от
сомы до окончания аксона. По ним
распространяются биологически активные
вещества.
После созревания
нейроны не способны к делению в силу
своей высокой специализации. Именно
эта особенность нейронов обеспечивает
сохранение всей информации, которую
организм усваивает в течение жизни.
Соответственно погибшие нейроны не
возмещаются, однако, при отрезании
аксона в периферической нервной системе
может происходить его повторное
прорастание в иннервируемый орган.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В курсе лекций «Анатомия ЦНС для психологов» я уже писала об анатомической терминологии и нервной системе. В этой статье я решила рассказать о нервной ткани, ее особенностях, видах нервной ткани, классификациях нейронов, нервных волокон, типах глиальных клеток и многом другом.
Хочу напомнить, что все статьи в разделе «Анатомия ЦНС», я пишу именно для психологов, учитывая их программу подготовки. Я по своему опыту помню, как сложно и непривычно было изучать подобные темы во время своей учебы. Поэтому я стараюсь изложить весь материал наиболее понятно.
Содержание
- Нейроны
- Виды нейронов
- Нервные волокна и нервы
- Список черепно-мозговых нервов с обозначением доминирующих волокон
- Глия
Для начала, я советую посмотреть небольшое видео, в котором рассказывается о различных тканях человека. Но нас будет интересовать именно нервная ткань. В более красочном и наглядном виде вам будет легче усвоить основы, а потом вы сможете расширить свои знания.
Основной тканью, из которой образована нервная система является нервная ткань, которая состоит из клеток и межклеточного вещества.
Ткань — это совокупность клеток и межклеточного вещества, сходных по строению и выполняемым функциям.
Нервная ткань имеет эктодермальное происхождение. Нервная ткань отличается от других видов ткани тем, что в ней отсутствует межклеточное вещество. Межклеточное вещество является производной глиальной клетки, состоит из волокон и аморфного вещества.
Функцией нервной ткани является обеспечение получения, переработки и хранения информации из внешней и внутренней среды, а также регуляция и координация деятельности всех частей организма.
Нервная ткань состоит из двух видов клеток: нейронов и глиальных клеток. Нейроны играют главную роль, обеспечивая все функции ЦНС. Глиальные клетки имеют вспомогательное значение, выполняя опорную, защитную, трофическую функции и др. В среднем количество глиальных клеток превышает количество нейронов в соотношении 10:1 соответственно.
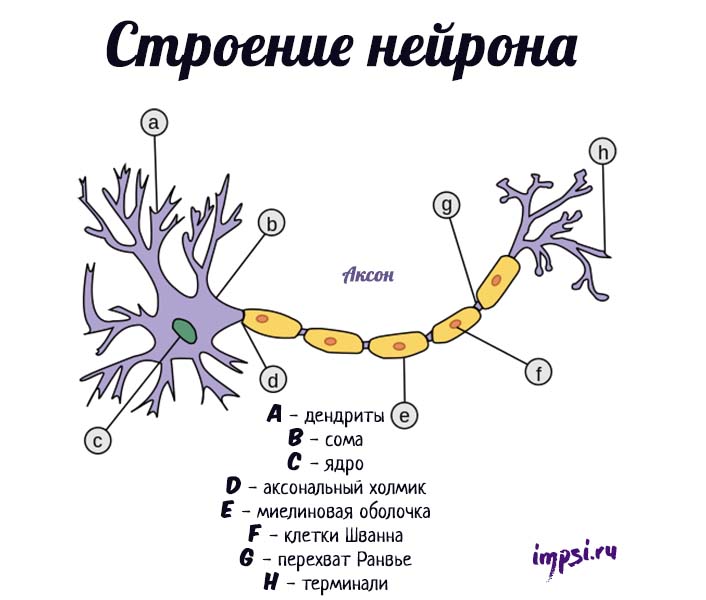
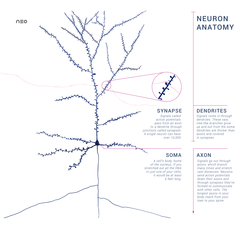
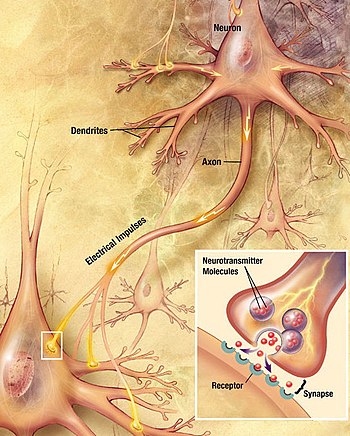
Каждый нейрон имеет расширенную центральную часть: тело — сому и отростки — дендриты и аксоны. По дендритам импульсы поступают к телу нервной клетки, а по аксонам от тела нервной клетки к другим нейронам или органам.
Отростки могут быть длинными и короткими. Длинные отростки нейронов называются нервными волокнами. Большинство дендритов (дендрон — дерево) короткие, сильно ветвящиеся отростки. Аксон (аксис — отросток) чаще длинный, мало ветвящийся отросток.
Нейроны
Нейрон — это сложно устроенная высокоспециализированная клетка с отростками, способная генерировать, воспринимать, трансформировать и передавать электрические сигналы, а также способная образовывать функциональные контакты и обмениваться информацией с другими клетками.
Каждый нейрон имеет только 1 аксон, длина которого может достигать несколько десятков сантиметров. Иногда от аксона отходят боковые отростки — коллатерали. Окончания аксона, как правило, ветвятся, и их называют терминалями. Место, где от сомы клеток отходит аксон, называется аксональным (аксонным) холмиком.
По отношению к отросткам сома нейрона выполняет трофическую функцию, регулируя обмен веществ. Нейрон обладает признаками, общими для всех клеток: имеет оболочку, ядро и цитоплазму, в которой находятся органеллы (эндоплазматический ретикулум, аппарат Гольджи, митохондрии, лизосомы, рибосомы и т.д.).

Кроме того, в нейроплазме содержатся органеллы специального назначения: микротрубочки и микрофиламенты, которые различаются размером и строением. Микрофиламенты представляют внутренний скелет нейроплазмы и расположены в соме. Микротрубочки тянутся вдоль аксона по внутренним полостям от сомы до окончания аксона. По ним распространяются биологически активные вещества.
Кроме того, отличительной особенностью нейронов является наличие митохондрий в аксоне как добавочного источника энергии. Взрослые нейроны не способны к делению.
Виды нейронов
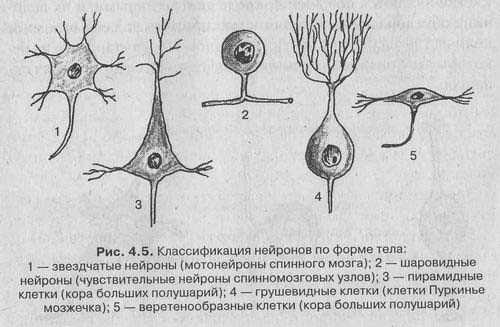
Существует несколько классификаций нейронов, основанных на разных признаках: по форме сомы, количеству отростков, функциям и эффектам, которые нейрон оказывает на другие клетки.
В зависимости от формы сомы различают:
1. Зернистые (ганглиозные) нейроны, у которых сома имеет округлую форму;
2. Пирамидные нейроны разных размеров — большие и малые пирамиды;
3. Звездчатые нейроны;
4. Веретенообразные нейроны.
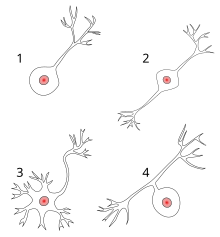
По количеству отростков (по строению)выделяют:
1. Униполярные нейроны (одноотростчатые), имеющие один отросток, отходящий от сомы клеток, в нервной системе человека практически не встречаются;
2. Псевдоуниполярные нейроны (ложноодноотростчатые), такие нейроны имеют Т-образный ветвящийся отросток, это клетки общей чувствительности (боль, изменения температуры и прикосновение);
3. Биполярные нейроны (двухотростчатые), имеющие один дендрит и один аксон (т.е. 2 отростка), это клетки специальной чувствительности (зрение, обоняние, вкус, слух и вестибулярные раздражения);
4. Мультиполярные нейроны (многоотростчатые), которые имеют множество дендритов и один аксон (т.е. много отростков); мелкие мультиполярные нейроны являются ассоциативными; средние и крупные мультиполярные, пирамидные нейроны — двигательными, эффекторными.
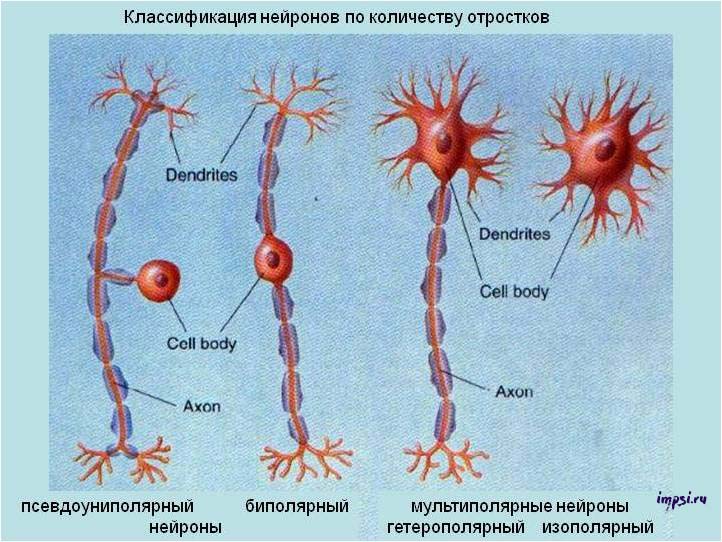
Униполярные клетки (без дендритов) не характерны для взрослых людей и наблюдаются только в процессе эмбриогенеза. Вместо них в организме человека имеются псевдоуниполярные клетки, у которых единственный аксон разделяется на 2 ветви сразу же после выхода из тела клетки. Биполярные нейроны имеются в сетчатке глаза и передают возбуждение от фоторецепторов к ганглионарным клеткам, образующим зрительный нерв. Мультиполярные нейроны составляют большинство клеток нервной системы.
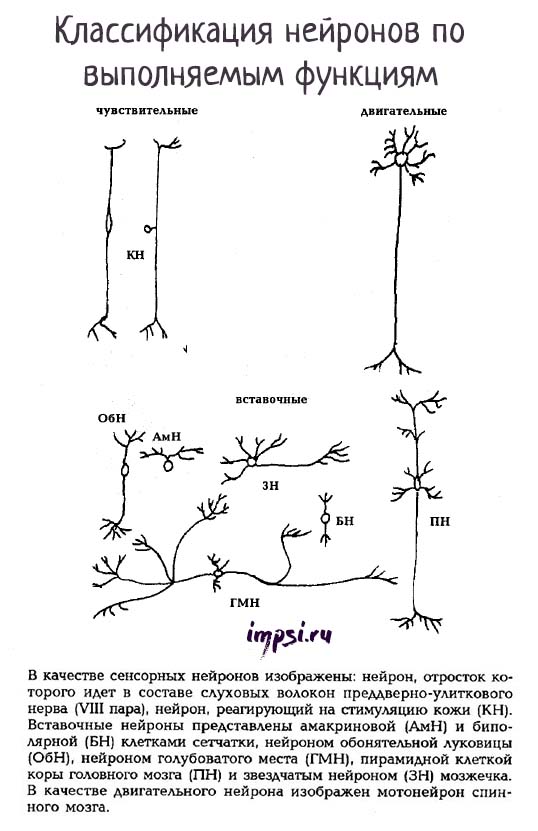
По выполняемым функциям нейроны бывают:
1. Афферентные (рецепторные, чувствительные) нейроны — сенсорные (псевдоуниполярные), их сомы расположены вне ЦНС в ганглиях (спинномозговых или черепно-мозговых). По чувствительным нейронам нервные импульсы движутся от периферии к центру.
Форма сомы — зернистая. Афферентные нейроны имеют один дендрит, который подходит к рецепторам (кожи, мышц, сухожилий и т.д.). По дендритам информация о свойствах раздражителей передается на сому нейрона и по аксону в ЦНС.
Пример чувствительных нейронов: нейрон, реагирующий на стимуляцию кожи.
2. Эфферентные (эффекторные, секреторные, двигательные) нейроны регулируют работу эффекторов (мышц, желез и т.д.). Т.е. они могут посылать приказы к мышцам и железам. Это мультиполярные нейроны, их сомы имеют звездчатую или пирамидную форму. Они лежат в спинном или головном мозге или в ганглиях автономной нервной системы.
Короткие, обильно ветвящиеся дендриты воспринимают импульсы от других нейронов, а длинные аксоны выходят за пределы ЦНС и в составе нерва идут к эффекторам (рабочим органам), например, к скелетной мышце.
Пример двигательных нейронов: мотонейрон спинного мозга.
Тела чувствительных нейронов лежат вне спинного мозга, а двигательные нейроны лежат в передних рогах спинного мозга.
3. Вставочные (контактные, интернейроны, ассоциативные, замыкающие) составляют основную массу мозга. Они осуществляют связь между афферентными и эфферентными нейронами, перерабатывают информацию, поступающую от рецепторов в центральную нервную систему.
В основном это мультиполярные нейроны звездчатой формы. Среди вставочных нейронов различают нейроны с длинными и короткими аксонами.
Пример вставочных нейронов: нейрон обонятельной луковицы, пирамидная клетка коры головного мозга.
Цепь нейронов из чувствительного, вставочного и эфферентного получила название рефлекторной дуги. Вся деятельность нервной системы, по определению И.М. Сеченова, носит рефлекторный характер («рефлекс» – обозначает отражение).
По эффекту, который нейроны оказывают на другие клетки:
1. Возбуждающие нейроны оказывают активизирующий эффект, повышая возбудимость клеток, с которыми они связаны.
2. Тормозные нейроны снижают возбудимость клеток, вызывая угнетающий эффект.
Нервные волокна и нервы
Нервные волокна — это покрытые глиальной оболочкой отростки нервных клеток, осуществляющие проведение нервных импульсов. По ним нервные импульсы могут передаваться на большие расстояния (до метра).
Классификация нервных волокон основана на морфологических и функциональных признаках.
По морфологическим признакам различают:
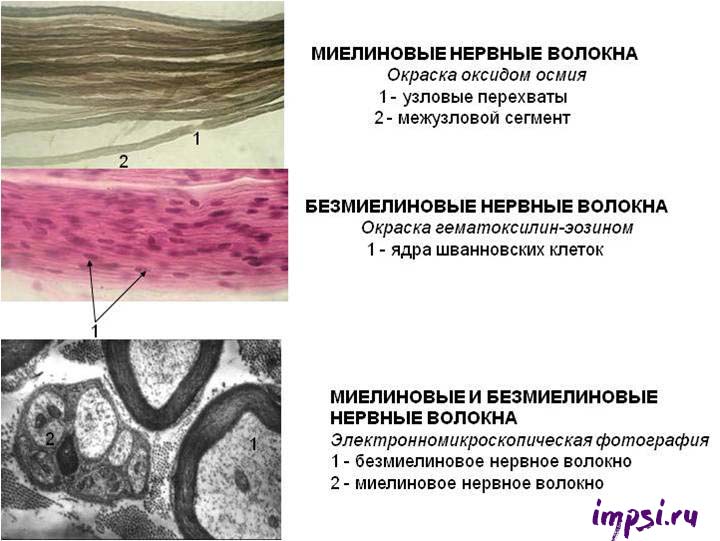
1. Миелинизированные (мякотные) нервные волокна — это нервные волокна, имеющие миелиновую оболочку;
2. Немиелинизированные (безмякотные) нервные волокна — это волокна, не имеющие миелиновой оболочки.
По функциональным признакам различают:
1. Афферентные (чувствительные) нервные волокна;
2. Эфферентные (двигательные) нервные волокна.
Нервные волокна, выходящие за пределы нервной системы, образуют нервы. Нерв — это совокупность нервных волокон. Каждый нерв имеет оболочку и кровоснабжение.
Различают спинномозговые нервы, связанные со спинным мозгом (31 пара), и черепно-мозговые нервы (12 пар), связанные с головным мозгом. В зависимости от количественного соотношения афферентных и эфферентных волокон в составе одного нерва различают чувствительные, двигательные и смешанные нервы (см. таблицу ниже).
В чувствительных нервах преобладают афферентные волокна, в двигательных — эфферентные, в смешанных — количественное соотношение афферентных и эфферентных волокон приблизительно равно. Все спинномозговые нервы являются смешанными нервами. Среди черепно-мозговых нервов выделяют три вышеперечисленных типа нервов.
Список черепно-мозговых нервов с обозначением доминирующих волокон
I пара — обонятельные нервы (чувствительные);
II пара — зрительные нервы (чувствительные);
III пара — глазодвигательные (двигательные);
IV пара — блоковые нервы (двигательные);
V пара — тройничные нервы (смешанные);
VI пара — отводящие нервы (двигательные);
VII пара — лицевые нервы (смешанные);
VIII пара — вестибуло-кохлеарные нервы (чувствительные);
IX пара — языкоглоточные нервы (смешанные);
X пара — блуждающие нервы (чувствительные);
XI пара — добавочные нервы (двигательные);
XII пара — подъязычные нервы (двигательные).
Глия
Пространство между нейронами заполнено клетками, которые называются нейроглией (глией). По подсчетам глиальных клеток примерно в 5-10 раз больше, чем нейронов. В отличие от нейронов клетки нейроглии делятся в течение всей жизни человека.
Клетки нейроглии выполняют многообразные функции: опорную, трофическую, защитную, изолирующую, секреторную, участвуют в хранении информации, то есть памяти.
Выделяют два типа глиальных клеток:
1. клетки макроглии или глиоциты (астроциты, олигодендроциты, эпендимоциты);
2. клетки микроглии.
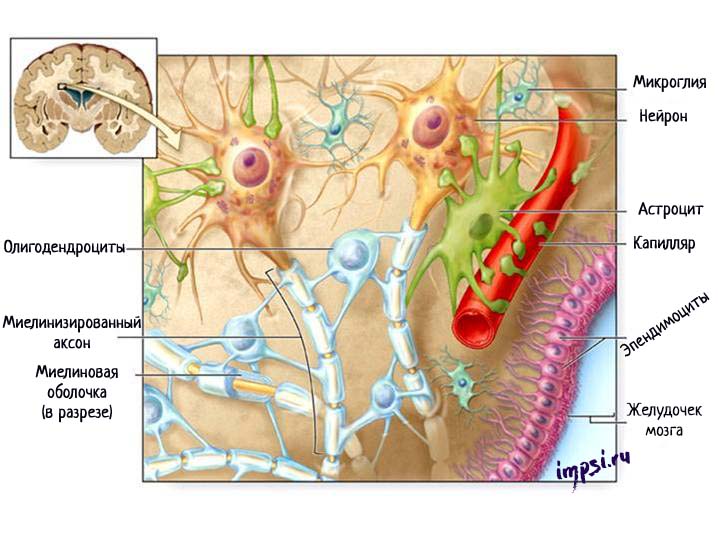
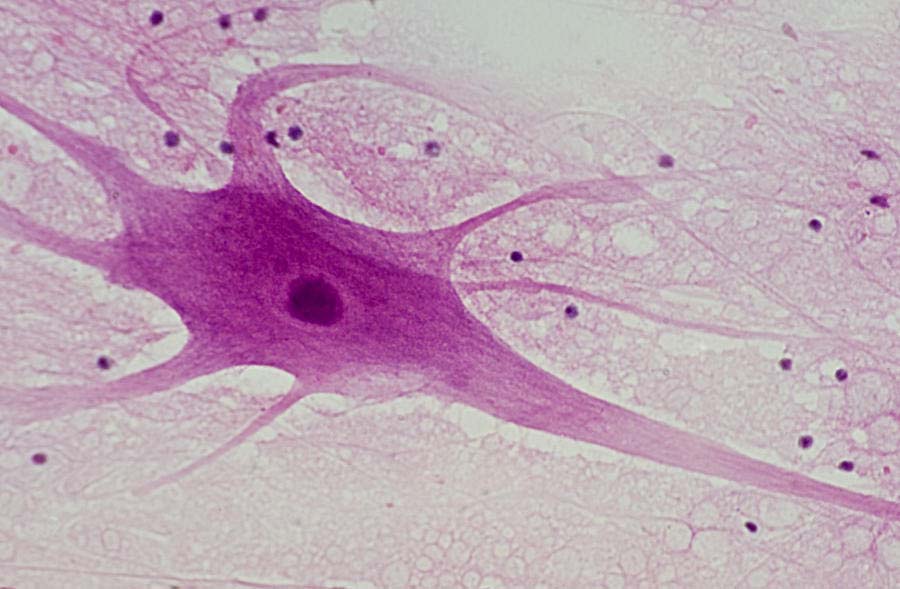
Астроциты имеют звездчатую форму и много отростков, которые отходят от тела клетки в разных направлениях, некоторые из них оканчиваются на кровеносных сосудах. Астроциты служат опорой для нейронов, обеспечивая их репарацию (восстановление) после повреждения, и участвуют в их метаболических процессах (обмене веществ).
Считается, что астроциты очищают внеклеточные пространства от избытка медиаторов и ионов, способствуя устранению химических «помех» для взаимодействий, происходящих на поверхности нейронов. Астроциты играют важную роль в объединении элементов нервной системы.
Таким образом, можно выделить такие функции астроцитов:
1. восстановление нейронов, участие в регенерационных процессах ЦНС;
2. удаление избытка медиаторов и ионов;
3. участие в формировании и поддержании гематоэнцефалического барьера (ГЭБ), т.е. барьера между кровью и тканью мозга; обеспечивается поступление питательных веществ из крови к нейронам;
4. создание пространственной сети, опоры для нейронов («клеточный скелет»);
5. изоляция нервных волокон и окончаний друг от друга;
6. участие в метаболизме нервной ткани — поддержание активности нейронов и синапсов.
Олигодендроциты — это мелкие овальные клетки с тонкими короткими отростками. Находятся в сером и белом веществе вокруг нейронов, входят в состав оболочек и в состав нервных окончаний. Олигодендроциты образуют миелиновые оболочки вокруг длинных аксонов и длинных дендритов.
Функции олигодендроцитов:
1. трофическая (участие в обмене веществ нейронов с окружающей тканью);
2. изолирующая (образование миелиновой оболочки вокруг нервов, что необходимо для лучшего проведения сигналов).
Миелиновая оболочка выполняет роль изолятора и увеличивает скорость проведения нервных импульсов вдоль мембраны отростков, предотвращает распространение на соседние ткани идущих по волокну нервных импульсов. Она сегментарна, пространство между сегментами называется перехват Ранвье (в честь ученого, который их открыл). Из-за того, что электрические импульсы проходят по миелинизированному волокну скачкообразно от одного перехвата к другому, такие волокна имеют высокую скорость проведения нервных импульсов.

Каждый сегмент миелиновой оболочки, как правило, образован одним олигодендроцитом в центральной нервной системе (Шванновская клетка (или клетки Шванна) в периферической нервной системе), которые, истончаясь, закручиваются вокруг аксона.
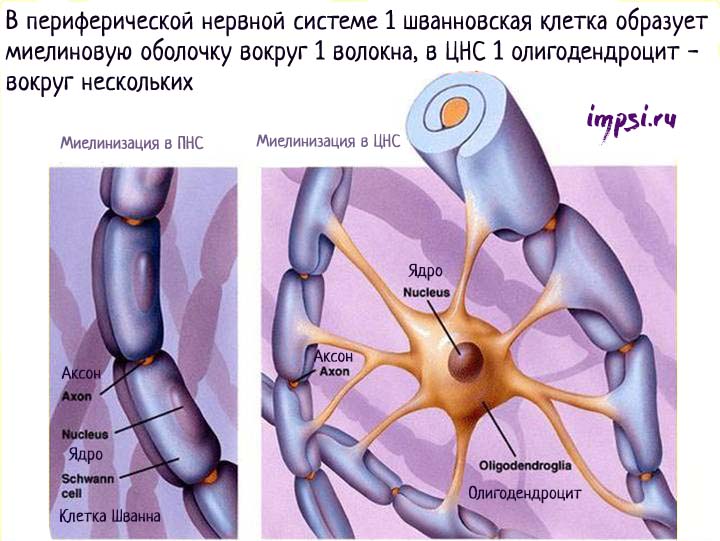
Миелиновая оболочка имеет белый цвет (белое вещество), так как в состав мембран олигодендроцитов входит жироподобное вещество — миелин. Иногда одна глиальная клетка, образуя выросты, принимает участие в образовании сегментов нескольких отростков.
Сома нейрона и дендриты покрыты тонкими оболочками, которые не образуют миелин и составляют серое вещество.
Т.е. миелином покрыты аксоны, поэтому они имеют белый цвет, а сома (тело) нейрона и короткие дендриты не имеют миелиновой оболочки, и поэтому они серого цвета. Вот так скопление аксонов, покрытых миелином, образуют белое вещество мозга. А скопление тел нейрона и коротких дендритов — серое.
Эпендимоциты — это такие клетки, которые выстилают желудочки мозга и центральный канал спинного мозга, секретируя спинномозговую жидкость. Они участвуют в обмене ликвора и растворения в нем веществ. На поверхности клеток, обращенных в спинномозговой канал, имеются реснички, которые своим мерцанием способствуют движению цереброспинальной жидкости.
Таким образом, функцией эпендимоцитов является секреция ликвора.
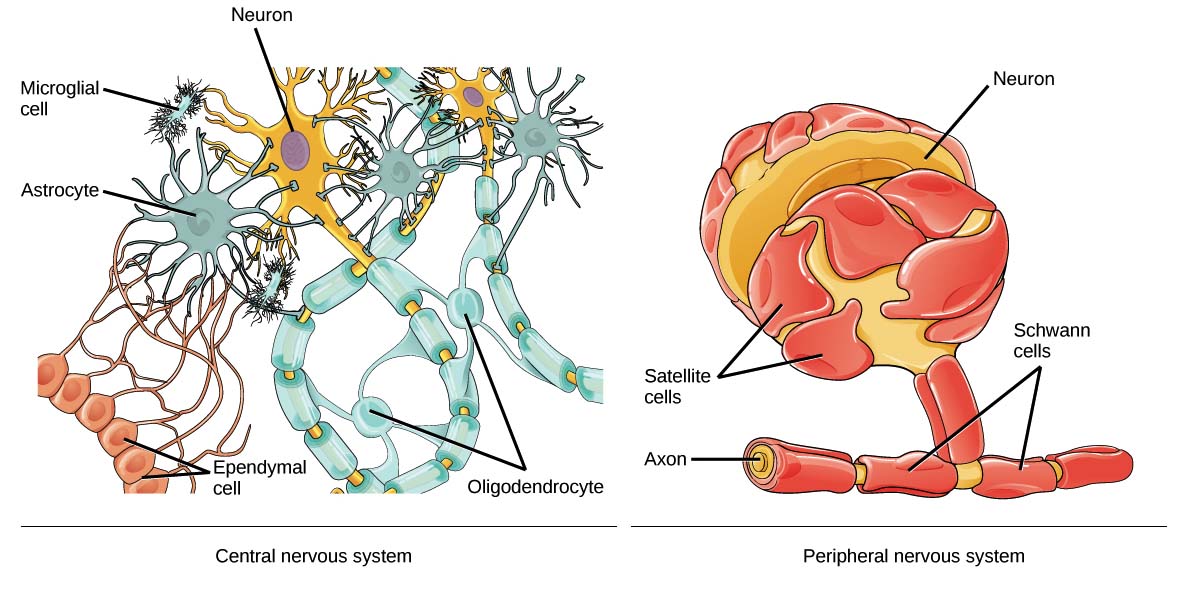
Микроглия — это часть из вспомогательных клеток нервной ткани, которая не является ею, т.к. имеет мезодермальное происхождение. Представлена мелкими клетками, которые находятся в белом и сером веществе мозга. Микроглия способна к амебовидному передвижению и фагоцитозу.
Функция микроглии — это защита нейронов от воспалений и инфекций (по механизму фагоцитоза — захватывание и переваривание генетически чужеродных веществ). Т.е. микроглия является «санитарами» нервной ткани.
Клетки микроглии доставляют нейронам кислород и глюкозу. Кроме того, они входят в состав гематоэнцефалического барьера, который образован ими и эндотелиальными клетками, образующими стенки кровеносных капилляров. Гематоэнцефалический барьер задерживает макромолекулы, ограничивая их доступ к нейронам.
Каждый нейрон имеет расширенную центральную часть: тело — сому и отростки — дендриты и аксоны. По дендритам импульсы поступают к телу нервной клетки, а по аксонам от тела нервной клетки к другим нейронам или органам. Отростки могут быть длинными и короткими. Длинные отростки нейронов называются нервными волокнами. Большинство дендритов (дендрон—дерево) короткие, сильно ветвящиеся отростки. Аксон (аксис—отросток) чаще длинный, мало ветвящийся отросток. Каждый нейрон имеет только од ин аксон, длина которого может достигать несколько десятков сантиметров. Иногда от аксона отходят боковые отростки — коллатерали. Окончания аксона, как правило, ветвятся, и их называют терми- налями. Место, где от сомы клеток отходит аксон, называется аксональным холмиком (рис. 1, А).
- — дендриты;
- — сома;
- — аксон;
- — терминали;
- — миелиновая оболочка.
/’/Ш’МЩЦ
Рис. 1Б.
Внутреннее строение нейрона:
- — аксодендрический синапс;
- — аксосоматический синапс;
- — пресинаптические пузырьки;
- — пресинаптическая мембрана;
- — синаптическая щель;
- — постсинаптическая мембрана;
- — эндоплазматическая сеть;
- — митохондрия;
- — внутриклеточный сетчатый аппарат (Гольджи);
- — нейрофибриллы;
И — ядро;
- — ядрышко.
По отношению к отросткам сома нейрона выполняет трофическую функцию, регулируя обмен веществ.
Нейрон обладает признаками, общими для всех клеток: имеет оболочку, ядро и цитоплазму, в которой находятся органеллы (эндоплазматический ре- тикулум, аппарат Гольджи, митохондрии, лизосомы, рибосомы и др.). Кроме того, в нейроплазме содержатся органеллы специального назначения: микротрубочки и микрофиламенты, которые различаются размером и строением. Микрофиламенты представляют внутренний скелет нейроплазмы и расположены в соме. Микротрубочки тянутся вдоль аксона по внутренним полостям от сомы до окончания аксона. По ним распространяются биологически активные вещества (рис. 1 Б).
Кроме того, отличительной особенностью нейронов является наличие митохондрий в аксоне как добавочного источника энергии. Взрослые нейроны не способны к делению.
Существует несколько классификаций нейронов, основанных на разных признаках: по форме сомы, количеству отростков, функциям и эффектам, которые нейрон оказывает на другие клетки.
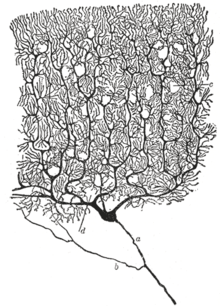
В зависимости от формы сомы различают зернистые (ганглиозные) нейроны, у которых сома имеет округлую форму; пирамидные нейроны разных размеров — большие и малые пирамиды; звездчатые нейроны; веретенообразные нейроны (рис. 2 А).
По количеству отростков выделяют униполярные нейроны, имеющие один отросток, отходящий от сомы клеток; псевдоуниполярные нейроны (такие нейроны имеют Т-образный ветвящийся отросток); биполярные нейроны, имеющие один дендрит и один аксон, и мультиполярные нейроны, которые имеют множество дендритов и один аксон (рис. 2 Б).
По выполняемым функциям нейроны бывают: афферентные, эфферентные и вставочные (контактные) (рис. ЗА—Б).
Афферентные нейроны — сенсорные (псевдоуниполярные), их сомы расположены вне центральной нервной системы в ганглиях (спинномозговых или черепно-мозговых).
Диатвмкя itpini системы
Рис. 2А.
Классификация нейронов по форме сомы:
- — пирамидная;
- — двойная пирамидная клетка гиппокампа;
- — клетка-зерно;
- — веретенообразная;
- — корзинчатая;
- — клетка Пуркинье.
Рис.2Б.
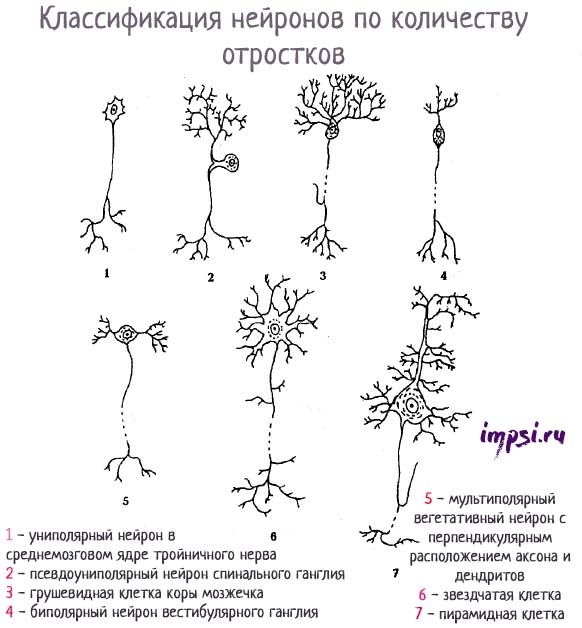
Классификация нейронов по количеству отростков:
-
— униполярный нейрон в среднемозговом ядре тройничного нерва;
- — псевдоуниполярный нейрон спинального ганглия;
- — грушевидная клетка коры мозжечка;
- — биполярный нейрон вестибулярного ганглия;
- — мультиполярный вегетативный нейрон с перпендикулярным расположением аксона и дендритов;
- — звездчатая клетка;
- — пирамидная клетка.
чувствительные двигательные
Рис. ЗА.
Классификация нейронов по выполняемым функциям.
В качестве сенсорных нейронов изображены: нейрон, отросток которого идет в составе слуховых волокон преддверно-улиткового нерва (VIII пара), нейрон, реагирующий на стимуляцию кожи (КН). Вставочные нейроны представлены амакриновой (АмН) и биполярной (БН) клетками сетчатки, нейроном обонятельной луковицы (ОбН), нейроном голубоватого места (ГМН), пирамидной клеткой коры головного мозга (ПН) и звездчатым нейроном (ЗН) мозжечка. В качестве двигательного нейрона изображен мотонейрон спинного мозга.

Сенсорные нейроны: 1 — биполярный; 2 — псевдобиполярный;
- — псевдоуниполярный; 4 — пирамидная клетка; 5 — нейрон спинного мозга; 6 — нейрон n. ambiguus; 7 — нейрон ядра подъязычного нерва.
Симпатические нейроны: 8 — из звездчатого ганглия; 9 — из верхнего шейного ганглия; 10 — из интермедиолатерального столба бокового рога спинного мозга.
Парасимпатические нейроны: 11 — из узла мышечного сплетения кишечной стенки; 12 — из дорсального ядра блуждающего нерва; 13 —gt; из ресничного узла.
AianMii iipmf сними
Форма сомы — зернистая. Афферентные нейроны имеют один дендрит, который подходит к рецепторам (кожи, мышц, сухожилий и т.д.). По дендритам информация о свойствах раздражителей передается на сому нейрона и по аксону в центральную нервную систему.
Эфферентные нейроны регулируют работу эффекторов (мышц, желез и т.д.). Это мультиполярные нейроны, их сомы имеют звездчатую или пирамидную форму, лежащие в спинном или головном мозге или в ганглиях автономной нервной системы. Короткие, обильно ветвящиеся дендриты воспринимают импульсы от других нейронов, а длинные аксоны выходят за пределы центральной нервной системы и в составе нерва идут к эффекторам (рабочим органам), например, к скелетной мышце. Вставочные нейроны (интернейроны, контактные) составляют основную массу мозга. Они осуществляют связь между афферентными и эфферентными нейронами, перерабатывают информацию, поступающую от рецепторов в центральную нервную систему. В основном это мультиполярные нейроны звездчатой формы. Среди вставочных нейронов различают нейроны с длинными и короткими аксонами.
По эффекту, который нейроны оказывают на другие клетки, различают возбуждающие нейроны и тормозные нейроны. Возбуждающие нейроны оказывают активизирующий эффект, повышая возбудимость клеток, с которыми они связаны. Тормозные нейроны, напротив, снижают возбудимость клеток, вызывая угнетающий эффект.
Гдня
Пространство между нейронами заполнено клетками, которые называются нейроглией. В отличие от нейронов клетки нейроглии делятся в течение всей жизни человека. Выделяют два типа глиальных клеток: клетки макроглии и клетки микроглии (рис. 4).
К макроглие относят астроциты и олигодендроци- ты. Астроциты имеют звездчатую форму и много отростков, которые отходят от тела клетки в разных направлениях, некоторые из них оканчиваются на кровенос-
Гша 1. Цитшгшест и [щщпнкм харашристш аервааЯ системы
капилляр
Рис. 4. Клетки макроглии и микроглии:
- — астроцит;
- — олигодендроцит;
- — микроглиальная клетка;
- — Шванновская клетка.
Анатомия перни! системы
ных сосудах. Астроциты служат опорой для нейронов, обеспечивая их репарацию (восстановление) после повреждения, и участвуют в их метаболических процессах (обмене веществ).
Олигодендроциты образуют миелиновые оболочки вокруг длинных аксонов и длинных дендритов. Миелиновая оболочка выполняет роль изолятора и увеличивает скорость проведения нервных импульсов вдоль мембраны отростков. Миелиновая оболочка сегментарна, пространство между сегментами называется перехват Ранвье. Каждый сегмент мие- линовой оболочки, как правило, образован одним олигодендроцйтом (Шванновская клетка), которые, истончаясь, закручиваются вокруг аксона. Миелиновая оболочка имеет белый цвет (белое вещество), так как в состав мембран олигодендроцитов входит жироподобное вещество — миелин. Иногда одна глиальная клетка, образуя выросты, принимает участие в образовании сегментов нескольких отростков (рис. 5 А—Б).
Сома нейрона и дендриты покрыты тонкими оболочками, которые не образуют миелин и составляют серое вещество.
Микроглия представлена мелкими клетками, способными к амебовидному передвижению. Функция микроглии — защита нейронов от воспалений и инфекций (по механизму фагоцитоза — захватывание и переваривание генетически чужеродных веществ). Клетки микроглии доставляют нейронам кислород и глюкозу. Кроме того, они входят в состав гематоэнцефалического барьера, который образован ими и эндотелиальными клетками, образующими стенки кровеносных капилляров. Гематоэнцефёлический барьер задерживает макромолекулы, ограничивая их доступ к нейронам.
Никита Гудимчук, Павел Захаров, Евгений Ульянов, Фазоил Атауллаханов
«Природа» №10, 2015
Об авторах
|
Никита Борисович Гудимчук — кандидат физико-математических наук, старший научный сотрудник Центра теоретических проблем физико-химической фармакологии РАН и Детского центра гематологии, онкологии и иммунологии им. Дмитрия Рогачева. Область научных интересов — теоретическое и экспериментальное исследование механизмов деления клетки и динамики микротрубочек. |
|
Павел Николаевич Захаров — младший научный сотрудник лаборатории биофизики Детского центра гематологии, онкологии и иммунологии. Занимается математическим моделированием митотического деления клетки. |
|
Евгений Владимирович Ульянов — аспирант физического факультета Московского государственного университета им. М. В. Ломоносова. Область научных исследований — компьютерное моделирование динамики микротрубочек. |
|
Фазоил Иноятович Атауллаханов — доктор биологических наук, профессор МГУ, директор Центра теоретических проблем физико-химической фармакологии, заведующий лабораторией биофизики Детского центра гематологии, онкологии и иммунологии. Научные интересы — клеточная биология, нелинейная динамика и самоорганизация в биологических системах. |
Микротрубочки — один из трех основных типов белковых нитей клетки. Вместе с актиновыми и промежуточными филаментами они образуют клеточный каркас — цитоскелет. Благодаря своим уникальным механическим свойствам микротрубочки выполняют целый ряд ключевых функций на всех этапах жизни клетки, в том числе помогают организовать ее содержимое и служат «рельсами» для направленного транспорта внутриклеточных «грузов» — везикул и органелл. Микротрубочки — динамические структуры, они постоянно меняют свою длину за счет роста или укорачивания. Такое поведение, называемое динамической нестабильностью, существенно влияет на различные внутриклеточные процессы. Например, если клетка выпячивает часть цитоплазмы во время амебоидного движения, микротрубочки быстро заполняют новый объем, повышая в нем интенсивность внутриклеточного транспорта. Часть этих филаментов избирательно стабилизируется, тем самым задавая направление, вдоль которого перемещение «грузов» происходит более регулярно. Вдоль выделенной линии активизируются внутриклеточные процессы, а значит, создаются условия для возникновения у клетки полярности. Главенствующую роль динамика микротрубочек играет во время клеточного деления. Их способность менять длину интенсивно исследуется уже более 30 лет, однако механизмы, лежащие в основе этого феномена, все еще плохо изучены.
Строение и свойства микротрубочек
Микротрубочки — это линейные полимеры. Они построены из димеров белка тубулина, которые образуют 13 цепей — протофиламентов (рис. 1). Каждый из них по бокам связан с двумя другими, и вся конструкция замкнута в цилиндр диаметром 25 нм. Такое строение обеспечивает микротрубочке прочность и большую изгибную жесткость: она может оставаться почти абсолютно прямой в масштабе клетки. Чтобы представить, насколько микротрубочка сложно сгибаема, мысленно увеличим ее до размеров стержня диаметром спагетти (около 2 мм). Такая «спица» не прогибалась бы, будь она длиной даже в сотни метров (высота современных небоскребов)! Жесткость позволяет микротрубочкам выполнять роль длинных прямых направляющих, которые организуют движение органелл внутри клетки. Остальные элементы цитоскелета (актиновые и промежуточные филаменты) существенно более гибкие, поэтому, как правило, используются клеткой в других целях.
Димер тубулина, из которого строится микротрубочка, состоит из мономеров двух типов. Внутри каждого протофиламента α-мономеры одного димера соединяются с β-мономерами соседнего. Поэтому по всей длине микротрубочки, содержащей десятки и сотни тысяч димеров тубулина, все они ориентированы одинаково. Тот конец микротрубочки, к которому обращены α-тубулины, называется минус-концом, а противоположный — плюс-концом. Благодаря такому упорядоченному расположению димеров микротрубочка имеет полярность, что обеспечивает направленность транспорта. Моторные белки, которые участвуют в перемещении «грузов» из одной части клетки в другую, «шагают» по микротрубочке, перетаскивая свою «ношу» за собой, как правило, только в одном направлении. Например, белок динеин двигает органеллы к минус-концу микротрубочки, а кинезин — к плюс-концу. Часто микротрубочки расположены в клетке радиально, а их плюс-концы направлены к ее периферии. Таким образом, кинезины осуществляют транспортировку из центра к внешней мембране, а динеины — от нее внутрь клетки. Поразительно, но в отростках аксонов везикулы и органеллы могут направленно передвигаться по микротрубочкам на расстояния в сотни микрометров и больше.
Динамическая нестабильность: в клетках и в пробирке
От обычных биополимеров микротрубочки отличаются не только механическими свойствами, но и уникальным динамическим поведением (рис. 2). Обычный полимер растет монотонно до тех пор, пока скорость присоединения новых субъединиц из раствора не сравняется со скоростью отделения уже прикрепленных. Полимеризация же микротрубочки носит колебательный характер. Ее длина попеременно то увеличивается, то уменьшается при фиксированной концентрации димеров тубулина в растворе. В одних и тех же условиях сосуществуют растущие и укорачивающиеся микротрубочки. Переходы от стадии роста к укорочению называют катастрофами, а обратные — спасениями. Впервые такое поведение — динамическую нестабильность — обнаружили Т. Митчисон (T. Mitchison) и М. Киршнер (M. Kirschner) около 30 лет назад [1].
Динамическая нестабильность микротрубочек особенно важна во время митоза. Из них строится специальный аппарат для разделения клетки — веретено деления. Оно центрируется благодаря микротрубочкам, которые отталкиваются от клеточной мембраны. Далее, удлиняясь и укорачиваясь, они «обыскивают» пространство клетки в поисках хромосом. Отыскав их и закрепившись за них своими концами, микротрубочки развивают тянущие и толкающие силы, перемещая хромосомы к экватору клетки. Четко выстроив на нем генетический материал и тем самым обеспечив готовность клетки к разделению, микротрубочки растаскивают хромосомы к клеточным полюсам. Все это происходит благодаря динамической нестабильности микротрубочек. Незаменимая роль динамики микротрубочек в митозе привела к разработке лекарств от онкологических заболеваний. Так, например, низкомолекулярное вещество таксол — известный противоопухолевый препарат, стабилизирующий микротрубочки, а значит, останавливающий деление раковых клеток.
Нестабильность микротрубочек проявляется не только в клетках, но и в пробирке — в растворе образующего их белка. Следовательно, для проявления ими этого свойства не требуется ничего, кроме тубулина. Он присоединяется из раствора к концу микротрубочки во время фазы ее роста или, наоборот, отделяется и уходит обратно в раствор во время стадии укорачивания. Тем не менее, другие клеточные белки могут влиять на параметры динамической нестабильности, например, ускорять рост микротрубочек в клетках, менять (увеличивать или уменьшать) частоты катастроф и спасений. Известно, что в пробирке скорость роста микротрубочек и эти частоты многократно ниже, чем в клетках при той же концентрации тубулина.
Модель ГТФ-«шапочки»
Почему микротрубочки, в отличие от других биополимеров, динамически нестабильны? Рост микротрубочки, как сказано, происходит благодаря присоединению к ее концу димеров тубулина. Каждый мономер этого белка связан с молекулой гуанозинтрифосфата (ГТФ). Однако вскоре после присоединения тубулина к микротрубочке молекула ГТФ, связанная с β-субъединицей, гидролизуется до гуанозиндифосфата (ГДФ). ГТФ-димеры тубулина в составе протофиламента стремятся вытянуться, образовать линейную структуру, а ГДФ-димеры — изогнуться в рожок с радиусом кривизны около 20 нм. За счет постоянного присоединения ГТФ-димеров микротрубочка удлиняется, а на ее конце формируется «пояс» из молекул, еще не успевших гидролизовать ГТФ. Пытаясь выпрямиться, этот слой — ГТФ-«колпачок» (или «шапочка») — не дает выгнуться наружу нижележащим ГДФ-димерам и таким образом предохраняет растущий конец микротрубочки от разборки. Считается, что микротрубочка устойчиво растет и защищена от катастрофы, пока на ее конце есть ГТФ-«шапочка». Исчезновение последней в результате гидролиза или случайного отделения ГТФ-димеров тубулина переводит микротрубочку в фазу укорочения.
Модель ГТФ-«шапочки» появилась практически сразу после открытия динамической нестабильности и покорила исследователей своей простотой и элегантностью. Получено уже довольно много экспериментальных фактов, подтверждающих эту модель. Один из классических опытов, показывающих, что на конце микротрубочки есть некая стабилизирующая структура, заключается в следующем. Растущую микротрубочку перерезают микроиглой или сфокусированным пучком ультрафиолетового света [2, 3]. Плюс-конец с отрезанной стороны немедленно начинает разбираться. Интересно, что минус-конец со стороны разреза обычно не разбирается, а продолжает расти. Р. Никлас (R. Nicklas) делал похожий опыт, но разрезал с помощью микроиглы микротрубочку в митотическом веретене внутри клетки [4]. Как и в предыдущем случае, микротрубочка тут же разбиралась со стороны разреза на плюс-конце и оставалась стабильной на минус-конце. Поведение последнего до сих пор остается загадкой, но результаты этих экспериментов сочли сильным доводом, подтверждающим наличие на растущем плюс-конце микротрубочки стабилизирующей ГТФ-«шапочки».
Другой важный аргумент в пользу этой модели появился, когда создали химически модифицированный ГТФ — очень похожий на свой прообраз, но практически неспособный к гидролизу. Когда в растворе плавают только такие молекулы, микротрубочки хорошо растут, но никогда не испытывают катастрофы [5]. Такое поведение подтверждает гипотезу о ГТФ-«шапочке»: ее слабогидролизуемый аналог никак не меняется со временем, а значит, не позволяет микротрубочке разбираться.
Косвенных доказательств существования ГТФ-«шапочки» много, однако ее до сих пор не удалось напрямую увидеть (хотя такие попытки предпринимались). По крайней мере, оценили размер минимальной структуры из слабогидролизуемого аналога ГТФ, которой достаточно, чтобы стабилизировать рост микротрубочки. Защитить ее от разборки, как оказалось, может «шапочка» всего в один слой димеров (при этом реально она может быть и толще). Наглядный способ оценить количество ГТФ-димеров на конце растущей микротрубочки — добавить белок с флуоресцентной меткой, который их распознает. Так называемый плюс-концевой белок EB1 in vitro светится на расстоянии порядка сотни слоев тубулина, причем интенсивность флуоресценции падает от конца к телу микротрубочки. Если этот белок действительно предпочитает связываться именно с ГТФ-димерами, то подобное распределение свечения указывает на то, что ГТФ-«шапочка» может быть значительно больше одного слоя. Примечательно, что белок ЕВ1 ярко окрашивает концы растущих микротрубочек, но начинает гаснуть за несколько секунд перед переходом филамента к катастрофе, как будто отражая постепенное исчезновение стабилизирующей ГТФ-«шапочки» [6]. Измеренная интенсивность флуоресценции белка EB1 на концах микротрубочек в живых клетках также свидетельствует в пользу большой (существенно толще одного слоя тубулинов) ГТФ-«шапочки» [7]. Кроме мечения микротрубочек белком EB1, «шапочку» также визуализировали в клетках с помощью специальных антител, узнающих ГТФ-тубулин [8]. Интересно, что они связывались не только с концами микротрубочек, но и образовывали «островки» на остальной поверхности.
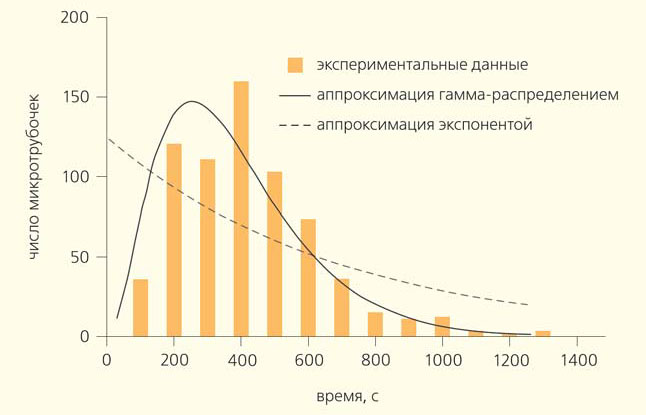
Микротрубочки стареют?
Модель ГТФ-«шапочки» привлекла внимание исследователей прежде всего потому, что позволила объяснить, почему микротрубочка может устойчиво расти и укорачиваться и почему между этими фазами возможны переходы — катастрофы и спасения.
В 1995 г. Д. Одде (D. Odde) с соавторами провел простой, но важный эксперимент [9]. Они наблюдали за ростом микротрубочек в пробирке и решили построить распределение их длин. Оно предполагалось экспоненциальным, но оказалось, что у него есть пик (рис. 3). Значит, в начале роста микротрубочки имеют очень маленькую вероятность испытать катастрофу, а дальше, по мере их роста, эта вероятность повышается. Если пересчитать распределение длин микротрубочек в частоты катастроф, то получится возрастающая зависимость частоты катастроф от времени. Этот эффект назвали «старением» микротрубочек — они как будто «портятся» со временем. Иначе говоря, «молодые» микротрубочки могут расти стабильно, а «старые» уже более склонны к разборке. Необычное распределение времен жизни микротрубочек хорошо аппроксимируется гамма-распределением, которое характеризует процессы с фиксированным количеством последовательных шагов. Поэтому возникла идея, что лучше всего результаты проведенного эксперимента описывает теория, согласно которой катастрофа микротрубочки происходит за три последовательных стадии, когда в ней накопились определенные дефекты неизвестной природы [10]. Эта гипотеза, исходно достаточно сомнительная, тем не менее существенно подогрела интерес к исследованию динамики микротрубочек на уровне отдельных димеров тубулина.
Чего пока не может эксперимент и как помогает теория?
Обнаруженный феномен «старения» микротрубочек показал, что общепринятая, ставшая классической, модель ГТФ-«шапочки» — некоторое упрощение. Действительно, она только постулирует, что микротрубочка испытывает катастрофу, когда теряет свой стабилизирующий «колпачок», но не объясняет, как и почему это происходит, а также из-за чего же вообще микротрубочка может «стареть». Что за таинственные дефекты накапливаются внутри «стареющей» микротрубочки, приводя ее к катастрофе? Сколько их и в какой последовательности они должны проявляться? Может быть, речь идет о гидролизе отдельных молекул ГТФ внутри «шапочки» или о каком-то другом процессе, зависящем от не установленных пока событий совсем иной природы?
Естественно, исследователи хотели бы как можно тщательнее разглядеть «живые» микротрубочки, чтобы ответить на эти вопросы. Однако современный экспериментальный арсенал не позволяет это сделать. Мы можем или увидеть замороженную (обездвиженную) микротрубочку с нанометровым разрешением, например, с помощью электронного микроскопа, или проследить динамику микротрубочки со скоростью сотни кадров в секунду под оптическим микроскопом. К сожалению, невозможно получить соответствующие данные одновременно, чтобы четко их соотнести. Во многом по вине таких ограничений современной науке неизвестно, каков точный размер ГТФ-«шапочки» и как он меняется со временем, а также какую форму имеют концы микротрубочек и как она определяет их динамику.
На помощь экспериментам приходят теоретические методы исследования, в частности компьютерное моделирование. Оно может воссоздать микротрубочку с очень высоким пространственно-временным разрешением, правда, ценой неизбежных идеализаций и упрощений, адекватность которых нужно тщательно проверять (сравнивая результаты модельного и настоящего экспериментов). Идеальная компьютерная модель должна описывать все имеющиеся экспериментальные данные. Тогда на ее основе можно будет изучить механизмы наблюдаемого поведения микротрубочек и предсказать принцип действия белков, влияющих на динамику этих филаментов в клетках. Также станет возможным подбор химических соединений для управления поведением микротрубочек в медицинских целях.
На сегодняшний день создано множество моделей микротрубочек — от очень простых до весьма сложных. Самыми лучшими оказались наиболее детальные модели — молекулярные, которые учитывают, что микротрубочка состоит из многих протофиламентов и что ее структура дискретна (совокупность отдельных субъединиц — тубулинов). Первые такие модели стали появляться почти сразу после обнаружения динамической нестабильности в 1984 г. Работая с ансамблем взаимодействующих тубулинов, они воссоздают поведение микротрубочки как целого. Со времен первых молекулярных моделей накопилось много новых экспериментальных данных о микротрубочках. С тех пор уточнили их строение, измерили новые зависимости характеристик роста и укорочения от различных параметров, изучили поведение этих филаментов после разбавления тубулина, оценили размер ГТФ-«шапочки», открыли способность концов микротрубочек развивать тянущие и толкающие силы [11–19]. Это позволяло корректировать расчеты и все точнее задавать параметры взаимодействия тубулинов. Однако росли и требования к моделям, поскольку они должны непротиворечиво описывать весь набор имеющихся экспериментальных результатов. Таким образом, способы описания взаимодействия тубулинов совершенствовались и усложнялись. От простых моделей, где субъединицы либо взаимодействуют друг с другом, либо нет, перешли к так называемым молекулярно-механическим (самым современным и наиболее реалистичным). Они рассматривают молекулы тубулина как физические объекты, подчиняющиеся законам механики и движущиеся в поле тепловых соударений и потенциалов притяжения друг к другу [20–22]. В ранних молекулярно-механических расчетах динамики микротрубочек из-за ограниченной производительности компьютеров нельзя было подробно описать взаимодействие тубулинов на основе уравнений движения и с учетом тепловых колебаний. Однако эта цель оставалась очень притягательной для нашей команды, поскольку мы предполагали, что тепловые флуктуации играют существенную роль в динамике микротрубочек.
Новая молекулярно-механическая модель
Ускорения расчетов нам удалось достичь главным образом за счет технологии параллельных вычислений на крупнейшем суперкомпьютере «Ломоносов» (в вычислительном центре МГУ) [23]. Он способен производить 1,7·1015 операций в секунду, что выводит его на первое место в Восточной Европе по производительности.
В рамках нашей новой модели субъединицы тубулина — это шарики, на поверхности которых размещены центры взаимодействий с «соседями» (рис. 4). Рассматриваются два типа взаимодействий — продольные и боковые. Сами шарики могут существовать в двух состояниях, соответствующих ГТФ- и ГДФ-формам. В первом случае центры шариков стремятся выстроиться вдоль прямой, а во втором — вдоль дуги, соответствующей углу 22° (для каждой пары субъединиц). Центры взаимодействия притягиваются на близких расстояниях и перестают «чувствовать» друг друга на больших. Движения шариков описываются уравнениями Ланжевена (следствиями второго закона Ньютона), в которых мы пренебрегаем членами, содержащими ускорения частиц (так как эти слагаемые малы по сравнению с остальными). Субъединицы тубулина, удалившиеся от микротрубочки на расстояние, где они перестают с ней взаимодействовать, исключаются из рассмотрения. Также в систему периодически с некоторой вероятностью вводятся новые ГТФ-тубулины, которые появляются в случайной позиции на конце микротрубочки. Внутри нее они могут с определенной вероятностью подвергаться гидролизу — превращаться в ГДФ-субъединицы, которые тут же хотят расположиться по дуге, т. е. сформировать изогнутый протофиламент. Но последний необязательно сразу изгибается, так как от этого его могут удерживать боковые связи. Полученная таким образом система взаимодействующих тубулинов эволюционирует во времени: микротрубочка растет, испытывает катастрофу, укорачивается, спасается и вновь удлиняется. При этом наша модель хорошо описывает характерные формы концов растущей и укорачивающейся микротрубочек, воспроизводит наблюдаемые в экспериментах зависимости динамических характеристик от концентрации тубулина в растворе, а также феномен «старения» микротрубочек. Итак, с помощью моделирования, исходя из простых и понятных принципов и без каких-либо экзотических допущений, мы получили на экране компьютера виртуальную микротрубочку — объект, обладающий всеми основными свойствами своего реального прототипа. Рассчитав координаты всех субъединиц микротрубочки, мы можем с беспрецедентными разрешением и достоверностью узнать все о каждом элементе модельной микротрубочки в любой момент времени. Остается только проанализировать сложную последовательность событий в жизни микротрубочки и понять, какие из них и как приводят ее к переключению от роста к укорачиванию.
Что же происходит с микротрубочкой перед катастрофой? Сначала мы выяснили, выполняется ли в нашей модели какой-либо из двух ранее предложенных гипотетических сценариев этого события. Согласно одному из них, в структуре микротрубочки по мере ее роста могут возникать и сохраняться дефекты, например «дырки» в стенке, возникающие из-за того, что один из протофиламентов замедляет или прекращает свой рост (рис. 5, а) [10]. В нашей модели нет никаких искусственно вложенных оснований для приостановки роста отдельных протофиламентов. Поэтому такая ситуация практически никогда не реализуется, а следовательно, не может быть объяснением механизма «старения» микротрубочек и возникновения катастроф. Вторая гипотеза гласит, что увеличение склонности микротрубочки испытывать катастрофы («старение») происходит по мере постепенного заострения ее конца (рис. 5, б) [24]. Мы тщательно изучили разброс длин у протофиламентов микротрубочки в нашей модели и выяснили, что он быстро достигает некоей устойчивой формы, после чего микротрубочка остается с этим уровнем заостренности. Даже если искусственно создать конфигурацию микротрубочки с концом, в котором длины отдельных протофиламентов будут сильно различаться, то довольно скоро растущая белковая нить, предоставленная сама себе, достигнет все того же устойчивого уровня заостренности, к которому она обычно стремится. Таким образом, медленное заострение конца растущей микротрубочки тоже не может объяснить феномен ее «старения» в нашей модели. Мы также обратили внимание, что и размер ГТФ-«шапочки» не имеет тенденции постепенно уменьшаться (хотя существенно колеблется во время роста микротрубочки), а значит, он не может быть причиной катастрофы.
Отсутствие явного кандидата на медленный необратимый дестабилизирующий процесс привело нас к мысли, что, возможно, его и вовсе нет. А катастрофа происходит не в результате медленного накопления каких-либо дефектов, а из-за возникновения множества короткоживущих обратимых событий. Они время от времени накапливаются на конце микротрубочки и тогда приводят ее к катастрофе (рис. 5, в). Наиболее вероятное событие, приводящее к дестабилизации микротрубочки, — возникновение изогнутого «рожка» на ее конце. Действительно, если протофиламент отогнулся, то даже в случае присоединения к его концу новых субъединиц тубулина из раствора микротрубочка не становится более стабильной и продолжает укорачиваться. Однако один изогнутый протофиламент может легко обломиться и отделиться от микротрубочки. Поэтому по-настоящему дестабилизирующий эффект будут оказывать только несколько изогнутых протофиламентов, образовавшихся на конце микротрубочки одновременно. Количество непрямых протофиламентов, возникающих незадолго до катастрофы в наших расчетах, подтверждает этот вывод.
Таким образом, компьютерное моделирование позволило пролить свет на механизм возникновения катастроф. Оказалось, что в этом процессе важную роль играет не только число ГТФ-димеров, но и механические конфигурации протофиламентов. Катастрофа — результат единовременного образования множества обратимых короткоживущих событий (изогнутых протофиламентов) на конце микротрубочки. Это дополняет классическую модель ГТФ-«шапочки» недостающими деталями, объясняя, как и почему может происходить катастрофа микротрубочки. Мы надеемся, что компьютерное моделирование со временем позволит ответить и на другие вопросы о динамике этих филаментов. Каков механизм спасения микротрубочек? Почему их плюс- и минус-концы в экспериментах по перерезанию пучком ультрафиолетового света или микроиглой ведут себя по-разному? Как белки-модуляторы и потенциальные лекарства воздействуют на динамику микротрубочек?
Работа выполнена при финансовой поддержке фонда «Династия» (грант для молодых биологов) и гранта Президента РФ для молодых кандидатов наук.
Литература
1. Mitchison T., Kirschner M. Dynamic instability of microtubule growth // Nature. 1984. V. 312. P. 237–242.
2. Walker R. A., Inoué S., Salmon E. D. Asymmetric behavior of severed microtubule ends after ultraviolet-microbeam irradiation of individual microtubules in vitro // J. Cell Biol. 1989. V. 108. P. 931–937.
3. Tran P. T., Walker R. A., Salmon E. D. A metastable intermediate state of microtubule dynamic instability that differs significantly between plus and minus ends // J. Cell Biol. 1997. V. 138. P. 105–117. doi: 10.1083/jcb.138.1.105.
4. Nicklas R. B., Lee G. M., Rieder C. L. et al. Mechanically cut mitotic spindles: clean cuts and stable microtubules // J. Cell Sci. 1989. V. 94. P. 415–423.
5. Hyman A. A., Salser S., Drechsel D. N. et al. Role of GTP hydrolysis in microtubule dynamics: information from a slowly hydrolyzable analogue, GMPCPP // Mol. Biol. Cell. 1992. V. 3. P. 1155–1167. doi: 10.1091/mbc.3.10.1155.
6. Maurer S. P., Fourniol F. J., Bohner G. et al. EBs recognize a nucleotide-dependent structural cap at growing microtubule ends // Cell. 2012. V. 149. P. 371–382. doi: 10.1016/j.cell.2012.02.049.
7. Seetapun D., Castle B. T., McIntyre A. J. et al. Estimating the microtubule GTP cap size in vivo // Curr. Biol. 2012. V. 22. P. 1681–1687. doi: 10.1016/j.cub.2012.06.068.
8. Dimitrov A., Quesnoit M., Moutel S. et al. Detection of GTP-tubulin conformation in vivo reveals a role for GTP remnants in microtubule rescues // Science. 2008. V. 322. P. 1353–1356. doi: 10.1126/science.1165401.
9. Odde D. J., Cassimeris L., Buettner H. M. Kinetics of microtubule catastrophe assessed by probabilistic analysis // Biophys. J. 1995. V. 69. P. 796–802. doi: 10.1016/S0006-3495(95)79953-2.
10. Gardner M. K., Zanic M., Gell C. et al. Depolymerizing kinesins Kip3 and MCAK shape cellular microtubule architecture by differential control of catastrophe // Cell. 2011. V. 147. P. 1092–1103. doi: 10.1016/j.cell.2011.10.037.
11. Mandelkow E. M., Mandelkow E., Milligan R. A. Microtubule dynamics and microtubule caps: a time-resolved cryo-electron microscopy study // J. Cell Biol. 1991. V. 114. P. 977–991.
12. Walker R. A., O’Brien E. T., Pryer N. K. et al. Dynamic instability of individual microtubules analyzed by video light microscopy: rate constants and transition frequencies // J. Cell Biol. 1988. V. 107. P. 1437–1448.
13. Walker R. A., Pryer N. K., Salmon E. D. Dilution of individual microtubules observed in real time in vitro: evidence that cap size is small and independent of elongation rate // J. Cell Biol. 1991. V. 114. P. 73–81.
14. Voter W. A., O’Brien E. T., Erickson H. P. Dilution-induced disassembly of microtubules: relation to dynamic instability and the GTP cap // Cell Motil. Cytoskeleton. 1991. V. 18. P. 55–62.
15. O’Brien E. T., Voter W. A., Erickson H. P. GTP hydrolysis during microtubule assembly // Biochemistry. 1987. V. 26. P. 4148–4156.
16. Drechsel D. N., Kirschner M. W. The minimum GTP cap required to stabilize microtubules // Curr. Biol. 1994. V. 4. P. 1053–1061. doi: 10.1016/S0960-9822(00)00243-8.
17. Caplow M., Shanks J. Evidence that a single monolayer tubulin-GTP cap is both necessary and sufficient to stabilize microtubules // Mol. Biol. Cell. 1996. V. 7. P. 663–675. doi: 10.1091/mbc.7.4.663.
18. Grishchuk E. L., Molodtsov M. I., Ataullakhanov F. I. et al. Force production by disassembling microtubules // Nature. 2005. V. 438. P. 384–388. doi: 10.1038/nature04132.
19. Dogterom M., Yurke B. Measurement of the force-velocity relation for growing microtubules // Science. 1997. V. 278. P. 856–860. doi: 10.1126/science.278.5339.856.
20. Molodtsov M. I., Ermakova E. A., Shnol E. E. et al. A molecular-mechanical model of the microtubule // Biophys. J. 2005. V. 88. P. 3167–3179. doi: 10.1529/biophysj.104.051789.
21. VanBuren V., Cassimeris L., Odde D. J. Mechanochemical model of microtubule structure and self-assembly kinetics // Biophys. J. 2005. V. 89. P. 2911–2926. doi: 10.1529/biophysj.105.060913.
22. Efremov A., Grishchuk E. L., McIntosh J. R. et al. In search of an optimal ring to couple microtubule depolymerization to processive chromosome motions // Proc. Natl. Acad. Sci. USA. 2007. V. 104. P. 19017–19022. doi: 10.1073/pnas.0709524104.
23. Воеводин В. В., Жуматий С. А., Соболев С. И. и др. Практика суперкомпьютера «Ломоносов» // Открытые системы. 2012. Т. 7. С. 36–39.
24. Coombes C. E., Yamamoto A., Kenzie M. R. et al. Evolving tip structures can explain age-dependent microtubule catastrophe // Curr. Biol. 2013. V. 23. P. 1342–1348. doi: 10.1016/j.cub.2013.05.059.
Not to be confused with Neutron.
| Neuron | |
|---|---|

Anatomy of a multipolar neuron |
|
| Identifiers | |
| MeSH | D009474 |
| NeuroLex ID | sao1417703748 |
| TA98 | A14.0.00.002 |
| TH | H2.00.06.1.00002 |
| FMA | 54527 |
| Anatomical terms of neuroanatomy
[edit on Wikidata] |
A neuron, neurone, or nerve cell is an electrically excitable cell that fires electric signals called action potentials. Neurons communicate with other cells via synapses — specialized connections that commonly use minute amounts of chemical neurotransmitters to pass the electric signal from the presynaptic neuron to the target cell through the synaptic gap. The neuron is the main component of nervous tissue in all animals except sponges and placozoa. Non-animals like plants and fungi do not have nerve cells.
Neurons are typically classified into three types based on their function. Sensory neurons respond to stimuli such as touch, sound, or light that affect the cells of the sensory organs, and they send signals to the spinal cord or brain. Motor neurons receive signals from the brain and spinal cord to control everything from muscle contractions to glandular output. Interneurons connect neurons to other neurons within the same region of the brain or spinal cord. When multiple neurons are functionally connected together, they form what is called a neural circuit.
A typical neuron consists of a cell body (soma), dendrites, and a single axon. The soma is a compact structure, and the axon and dendrites are filaments extruding from the soma. Dendrites typically branch profusely and extend a few hundred micrometers from the soma. The axon leaves the soma at a swelling called the axon hillock and travels for as far as 1 meter in humans or more in other species. It branches but usually maintains a constant diameter. At the farthest tip of the axon’s branches are axon terminals, where the neuron can transmit a signal across the synapse to another cell. Neurons may lack dendrites or have no axon. The term neurite is used to describe either a dendrite or an axon, particularly when the cell is undifferentiated.
Most neurons receive signals via the dendrites and soma and send out signals down the axon. At the majority of synapses, signals cross from the axon of one neuron to a dendrite of another. However, synapses can connect an axon to another axon or a dendrite to another dendrite.
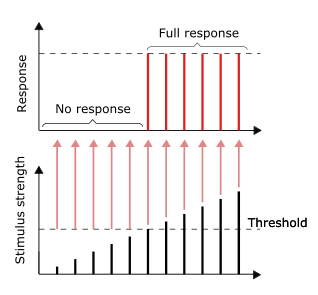
The signaling process is partly electrical and partly chemical. Neurons are electrically excitable, due to maintenance of voltage gradients across their membranes. If the voltage changes by a large enough amount over a short interval, the neuron generates an all-or-nothing electrochemical pulse called an action potential. This potential travels rapidly along the axon and activates synaptic connections as it reaches them. Synaptic signals may be excitatory or inhibitory, increasing or reducing the net voltage that reaches the soma.
In most cases, neurons are generated by neural stem cells during brain development and childhood. Neurogenesis largely ceases during adulthood in most areas of the brain.
Nervous system[edit]
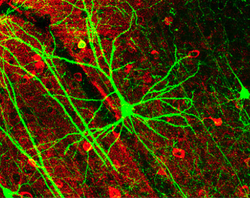
Schematic of an anatomically accurate single pyramidal neuron, the primaryious excitatory neuron of cerebral cortex, with a synaptic connection from an incoming axon onto a dendritic spine
Neurons are the primary components of the nervous system, along with the glial cells that give them structural and metabolic support.[1] The nervous system is made up of the central nervous system, which includes the brain and spinal cord, and the peripheral nervous system, which includes the autonomic and somatic nervous systems.[2] In vertebrates, the majority of neurons belong to the central nervous system, but some reside in peripheral ganglia, and many sensory neurons are situated in sensory organs such as the retina and cochlea.
Axons may bundle into fascicles that make up the nerves in the peripheral nervous system (like strands of wire make up cables). Bundles of axons in the central nervous system are called tracts.
Anatomy and histology[edit]
Diagram of the components of a neuron
Neurons are highly specialized for the processing and transmission of cellular signals. Given their diversity of functions performed in different parts of the nervous system, there is a wide variety in their shape, size, and electrochemical properties. For instance, the soma of a neuron can vary from 4 to 100 micrometers in diameter.[3]
- The soma is the body of the neuron. As it contains the nucleus, most protein synthesis occurs here. The nucleus can range from 3 to 18 micrometers in diameter.[4]
- The dendrites of a neuron are cellular extensions with many branches. This overall shape and structure are referred to metaphorically as a dendritic tree. This is where the majority of input to the neuron occurs via the dendritic spine.
- The axon is a finer, cable-like projection that can extend tens, hundreds, or even tens of thousands of times the diameter of the soma in length. The axon primarily carries nerve signals away from the soma and carries some types of information back to it. Many neurons have only one axon, but this axon may—and usually will—undergo extensive branching, enabling communication with many target cells. The part of the axon where it emerges from the soma is called the axon hillock. Besides being an anatomical structure, the axon hillock also has the greatest density of voltage-dependent sodium channels. This makes it the most easily excited part of the neuron and the spike initiation zone for the axon. In electrophysiological terms, it has the most negative threshold potential.
- While the axon and axon hillock are generally involved in information outflow, this region can also receive input from other neurons.
- The axon terminal is found at the end of the axon farthest from the soma and contains synapses. Synaptic boutons are specialized structures where neurotransmitter chemicals are released to communicate with target neurons. In addition to synaptic boutons at the axon terminal, a neuron may have en passant boutons, which are located along the length of the axon.
The accepted view of the neuron attributes dedicated functions to its various anatomical components; however, dendrites and axons often act in ways contrary to their so-called main function.[5]
Diagram of a typical myelinated vertebrate motor neuron
Axons and dendrites in the central nervous system are typically only about one micrometer thick, while some in the peripheral nervous system are much thicker. The soma is usually about 10–25 micrometers in diameter and often is not much larger than the cell nucleus it contains. The longest axon of a human motor neuron can be over a meter long, reaching from the base of the spine to the toes.
Sensory neurons can have axons that run from the toes to the posterior column of the spinal cord, over 1.5 meters in adults. Giraffes have single axons several meters in length running along the entire length of their necks. Much of what is known about axonal function comes from studying the squid giant axon, an ideal experimental preparation because of its relatively immense size (0.5–1 millimeter thick, several centimeters long).
Fully differentiated neurons are permanently postmitotic[6] however, stem cells present in the adult brain may regenerate functional neurons throughout the life of an organism (see neurogenesis). Astrocytes are star-shaped glial cells. They have been observed to turn into neurons by virtue of their stem cell-like characteristic of pluripotency.
Membrane[edit]
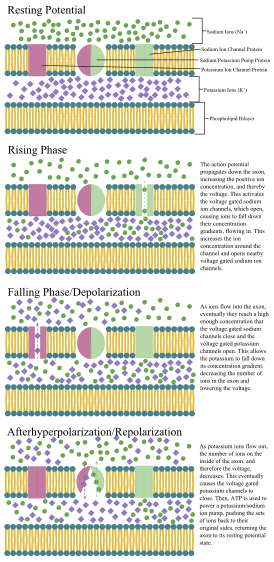
Like all animal cells, the cell body of every neuron is enclosed by a plasma membrane, a bilayer of lipid molecules with many types of protein structures embedded in it.[7] A lipid bilayer is a powerful electrical insulator, but in neurons, many of the protein structures embedded in the membrane are electrically active. These include ion channels that permit electrically charged ions to flow across the membrane and ion pumps that chemically transport ions from one side of the membrane to the other. Most ion channels are permeable only to specific types of ions. Some ion channels are voltage gated, meaning that they can be switched between open and closed states by altering the voltage difference across the membrane. Others are chemically gated, meaning that they can be switched between open and closed states by interactions with chemicals that diffuse through the extracellular fluid. The ion materials include sodium, potassium, chloride, and calcium. The interactions between ion channels and ion pumps produce a voltage difference across the membrane, typically a bit less than 1/10 of a volt at baseline. This voltage has two functions: first, it provides a power source for an assortment of voltage-dependent protein machinery that is embedded in the membrane; second, it provides a basis for electrical signal transmission between different parts of the membrane.
Histology and internal structure[edit]
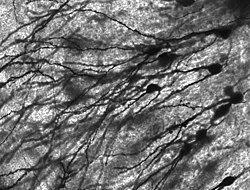
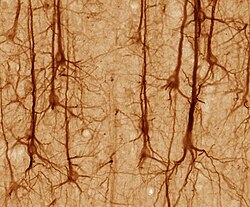
Golgi-stained neurons in human hippocampal tissue
Actin filaments in a mouse cortical neuron in culture
Numerous microscopic clumps called Nissl bodies (or Nissl substance) are seen when nerve cell bodies are stained with a basophilic («base-loving») dye. These structures consist of rough endoplasmic reticulum and associated ribosomal RNA. Named after German psychiatrist and neuropathologist Franz Nissl (1860–1919), they are involved in protein synthesis and their prominence can be explained by the fact that nerve cells are very metabolically active. Basophilic dyes such as aniline or (weakly) haematoxylin[8] highlight negatively charged components, and so bind to the phosphate backbone of the ribosomal RNA.
The cell body of a neuron is supported by a complex mesh of structural proteins called neurofilaments, which together with neurotubules (neuronal microtubules) are assembled into larger neurofibrils.[9] Some neurons also contain pigment granules, such as neuromelanin (a brownish-black pigment that is byproduct of synthesis of catecholamines), and lipofuscin (a yellowish-brown pigment), both of which accumulate with age.[10][11][12] Other structural proteins that are important for neuronal function are actin and the tubulin of microtubules. Class III β-tubulin is found almost exclusively in neurons. Actin is predominately found at the tips of axons and dendrites during neuronal development. There the actin dynamics can be modulated via an interplay with microtubule.[13]
There are different internal structural characteristics between axons and dendrites. Typical axons almost never contain ribosomes, except some in the initial segment. Dendrites contain granular endoplasmic reticulum or ribosomes, in diminishing amounts as the distance from the cell body increases.
Classification[edit]
Neurons vary in shape and size and can be classified by their morphology and function.[15] The anatomist Camillo Golgi grouped neurons into two types; type I with long axons used to move signals over long distances and type II with short axons, which can often be confused with dendrites. Type I cells can be further classified by the location of the soma. The basic morphology of type I neurons, represented by spinal motor neurons, consists of a cell body called the soma and a long thin axon covered by a myelin sheath. The dendritic tree wraps around the cell body and receives signals from other neurons. The end of the axon has branching axon terminals that release neurotransmitters into a gap called the synaptic cleft between the terminals and the dendrites of the next neuron.[citation needed]
Structural classification[edit]
Polarity[edit]
Most neurons can be anatomically characterized as:[citation needed]
- Unipolar: single process
- Bipolar: 1 axon and 1 dendrite
- Multipolar: 1 axon and 2 or more dendrites
- Golgi I: neurons with long-projecting axonal processes; examples are pyramidal cells, Purkinje cells, and anterior horn cells
- Golgi II: neurons whose axonal process projects locally; the best example is the granule cell
- Anaxonic: where the axon cannot be distinguished from the dendrite(s)
- Pseudounipolar: 1 process which then serves as both an axon and a dendrite
Other[edit]
Some unique neuronal types can be identified according to their location in the nervous system and distinct shape. Some examples are:[citation needed]
- Basket cells, interneurons that form a dense plexus of terminals around the soma of target cells, found in the cortex and cerebellum
- Betz cells, large motor neurons
- Lugaro cells, interneurons of the cerebellum
- Medium spiny neurons, most neurons in the corpus striatum
- Purkinje cells, huge neurons in the cerebellum, a type of Golgi I multipolar neuron
- Pyramidal cells, neurons with triangular soma, a type of Golgi I
- Renshaw cells, neurons with both ends linked to alpha motor neurons
- Unipolar brush cells, interneurons with unique dendrite ending in a brush-like tuft
- Granule cells, a type of Golgi II neuron
- Anterior horn cells, motoneurons located in the spinal cord
- Spindle cells, interneurons that connect widely separated areas of the brain
Functional classification[edit]
Direction[edit]
- Afferent neurons convey information from tissues and organs into the central nervous system and are also called sensory neurons.
- Efferent neurons (motor neurons) transmit signals from the central nervous system to the effector cells.
- Interneurons connect neurons within specific regions of the central nervous system.
Afferent and efferent also refer generally to neurons that, respectively, bring information to or send information from the brain.
Action on other neurons[edit]
A neuron affects other neurons by releasing a neurotransmitter that binds to chemical receptors. The effect upon the postsynaptic neuron is determined by the type of receptor that is activated, not by the presynaptic neuron or by the neurotransmitter. A neurotransmitter can be thought of as a key, and a receptor as a lock: the same neurotransmitter can activate multiple types of receptors. Receptors can be classified broadly as excitatory (causing an increase in firing rate), inhibitory (causing a decrease in firing rate), or modulatory (causing long-lasting effects not directly related to firing rate).[citation needed]
The two most common (90%+) neurotransmitters in the brain, glutamate and GABA, have largely consistent actions. Glutamate acts on several types of receptors, and has effects that are excitatory at ionotropic receptors and a modulatory effect at metabotropic receptors. Similarly, GABA acts on several types of receptors, but all of them have inhibitory effects (in adult animals, at least). Because of this consistency, it is common for neuroscientists to refer to cells that release glutamate as «excitatory neurons», and cells that release GABA as «inhibitory neurons». Some other types of neurons have consistent effects, for example, «excitatory» motor neurons in the spinal cord that release acetylcholine, and «inhibitory» spinal neurons that release glycine.[citation needed]
The distinction between excitatory and inhibitory neurotransmitters is not absolute. Rather, it depends on the class of chemical receptors present on the postsynaptic neuron. In principle, a single neuron, releasing a single neurotransmitter, can have excitatory effects on some targets, inhibitory effects on others, and modulatory effects on others still. For example, photoreceptor cells in the retina constantly release the neurotransmitter glutamate in the absence of light. So-called OFF bipolar cells are, like most neurons, excited by the released glutamate. However, neighboring target neurons called ON bipolar cells are instead inhibited by glutamate, because they lack typical ionotropic glutamate receptors and instead express a class of inhibitory metabotropic glutamate receptors.[16] When light is present, the photoreceptors cease releasing glutamate, which relieves the ON bipolar cells from inhibition, activating them; this simultaneously removes the excitation from the OFF bipolar cells, silencing them.[citation needed]
It is possible to identify the type of inhibitory effect a presynaptic neuron will have on a postsynaptic neuron, based on the proteins the presynaptic neuron expresses. Parvalbumin-expressing neurons typically dampen the output signal of the postsynaptic neuron in the visual cortex, whereas somatostatin-expressing neurons typically block dendritic inputs to the postsynaptic neuron.[17]
Discharge patterns[edit]
Neurons have intrinsic electroresponsive properties like intrinsic transmembrane voltage oscillatory patterns.[18] So neurons can be classified according to their electrophysiological characteristics:
- Tonic or regular spiking. Some neurons are typically constantly (tonically) active, typically firing at a constant frequency. Example: interneurons in neurostriatum.
- Phasic or bursting. Neurons that fire in bursts are called phasic.
- Fast spiking. Some neurons are notable for their high firing rates, for example some types of cortical inhibitory interneurons, cells in globus pallidus, retinal ganglion cells.[19][20]
Neurotransmitter[edit]
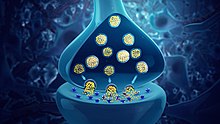
Synaptic vesicles containing neurotransmitters
Neurotransmitters are chemical messengers passed from one neuron to another neuron or to a muscle cell or gland cell.
- Cholinergic neurons – acetylcholine. Acetylcholine is released from presynaptic neurons into the synaptic cleft. It acts as a ligand for both ligand-gated ion channels and metabotropic (GPCRs) muscarinic receptors. Nicotinic receptors are pentameric ligand-gated ion channels composed of alpha and beta subunits that bind nicotine. Ligand binding opens the channel causing influx of Na+ depolarization and increases the probability of presynaptic neurotransmitter release. Acetylcholine is synthesized from choline and acetyl coenzyme A.
- Adrenergic neurons – noradrenaline. Noradrenaline (norepinephrine) is released from most postganglionic neurons in the sympathetic nervous system onto two sets of GPCRs: alpha adrenoceptors and beta adrenoceptors. Noradrenaline is one of the three common catecholamine neurotransmitter, and the most prevalent of them in the peripheral nervous system; as with other catecholamines, it is synthesised from tyrosine.
- GABAergic neurons – gamma aminobutyric acid. GABA is one of two neuroinhibitors in the central nervous system (CNS), along with glycine. GABA has a homologous function to ACh, gating anion channels that allow Cl− ions to enter the post synaptic neuron. Cl− causes hyperpolarization within the neuron, decreasing the probability of an action potential firing as the voltage becomes more negative (for an action potential to fire, a positive voltage threshold must be reached). GABA is synthesized from glutamate neurotransmitters by the enzyme glutamate decarboxylase.
- Glutamatergic neurons – glutamate. Glutamate is one of two primary excitatory amino acid neurotransmitters, along with aspartate. Glutamate receptors are one of four categories, three of which are ligand-gated ion channels and one of which is a G-protein coupled receptor (often referred to as GPCR).
-
- AMPA and Kainate receptors function as cation channels permeable to Na+ cation channels mediating fast excitatory synaptic transmission.
- NMDA receptors are another cation channel that is more permeable to Ca2+. The function of NMDA receptors depend on glycine receptor binding as a co-agonist within the channel pore. NMDA receptors do not function without both ligands present.
- Metabotropic receptors, GPCRs modulate synaptic transmission and postsynaptic excitability.
- Glutamate can cause excitotoxicity when blood flow to the brain is interrupted, resulting in brain damage. When blood flow is suppressed, glutamate is released from presynaptic neurons, causing greater NMDA and AMPA receptor activation than normal outside of stress conditions, leading to elevated Ca2+ and Na+ entering the post synaptic neuron and cell damage. Glutamate is synthesized from the amino acid glutamine by the enzyme glutamate synthase.
- Dopaminergic neurons—dopamine. Dopamine is a neurotransmitter that acts on D1 type (D1 and D5) Gs-coupled receptors, which increase cAMP and PKA, and D2 type (D2, D3, and D4) receptors, which activate Gi-coupled receptors that decrease cAMP and PKA. Dopamine is connected to mood and behavior and modulates both pre- and post-synaptic neurotransmission. Loss of dopamine neurons in the substantia nigra has been linked to Parkinson’s disease. Dopamine is synthesized from the amino acid tyrosine. Tyrosine is catalyzed into levodopa (or L-DOPA) by tyrosine hydroxlase, and levodopa is then converted into dopamine by the aromatic amino acid decarboxylase.
- Serotonergic neurons—serotonin. Serotonin (5-Hydroxytryptamine, 5-HT) can act as excitatory or inhibitory. Of its four 5-HT receptor classes, 3 are GPCR and 1 is a ligand-gated cation channel. Serotonin is synthesized from tryptophan by tryptophan hydroxylase, and then further by decarboxylase. A lack of 5-HT at postsynaptic neurons has been linked to depression. Drugs that block the presynaptic serotonin transporter are used for treatment, such as Prozac and Zoloft.
- Purinergic neurons—ATP. ATP is a neurotransmitter acting at both ligand-gated ion channels (P2X receptors) and GPCRs (P2Y) receptors. ATP is, however, best known as a cotransmitter. Such purinergic signalling can also be mediated by other purines like adenosine, which particularly acts at P2Y receptors.
- Histaminergic neurons—histamine. Histamine is a monoamine neurotransmitter and neuromodulator. Histamine-producing neurons are found in the tuberomammillary nucleus of the hypothalamus.[21] Histamine is involved in arousal and regulating sleep/wake behaviors.
Multimodel classification[edit]
Since 2012 there has been a push from the cellular and computational neuroscience community to come up with a universal classification of neurons that will apply to all neurons in the brain as well as across species. This is done by considering the three essential qualities of all neurons: electrophysiology, morphology, and the individual transcriptome of the cells. Besides being universal this classification has the advantage of being able to classify astrocytes as well. A method called Patch-Seq in which all three qualities can be measured at once is used extensively by the Allen Institute for Brain Science.[22]
Connectivity[edit]
A signal propagating down an axon to the cell body and dendrites of the next cell
Neurons communicate with each other via synapses, where either the axon terminal of one cell contacts another neuron’s dendrite, soma or, less commonly, axon. Neurons such as Purkinje cells in the cerebellum can have over 1000 dendritic branches, making connections with tens of thousands of other cells; other neurons, such as the magnocellular neurons of the supraoptic nucleus, have only one or two dendrites, each of which receives thousands of synapses.
Synapses can be excitatory or inhibitory, either increasing or decreasing activity in the target neuron, respectively. Some neurons also communicate via electrical synapses, which are direct, electrically conductive junctions between cells.[23]
When an action potential reaches the axon terminal, it opens voltage-gated calcium channels, allowing calcium ions to enter the terminal. Calcium causes synaptic vesicles filled with neurotransmitter molecules to fuse with the membrane, releasing their contents into the synaptic cleft. The neurotransmitters diffuse across the synaptic cleft and activate receptors on the postsynaptic neuron. High cytosolic calcium in the axon terminal triggers mitochondrial calcium uptake, which, in turn, activates mitochondrial energy metabolism to produce ATP to support continuous neurotransmission.[24]
An autapse is a synapse in which a neuron’s axon connects to its own dendrites.
The human brain has some 8.6 x 1010 (eighty six billion) neurons.[25] Each neuron has on average 7,000 synaptic connections to other neurons. It has been estimated that the brain of a three-year-old child has about 1015 synapses (1 quadrillion). This number declines with age, stabilizing by adulthood. Estimates vary for an adult, ranging from 1014 to 5 x 1014 synapses (100 to 500 trillion).[26]
An annotated diagram of the stages of an action potential propagating down an axon including the role of ion concentration and pump and channel proteins
Nonelectrochemical signaling[edit]
Beyond electrical and chemical signaling, studies suggest neurons in healthy human brains can also communicate through:
- force generated by the enlargement of dendritic spines[27]
- the transfer of proteins – transneuronally transported proteins (TNTPs)[28][29]
They can also get modulated by input from the environment and hormones released from other parts of the organism,[30] which could be influenced more or less directly by neurons. This also applies to neurotrophins such as BDNF. The gut microbiome is also connected with the brain.[31]
Neurons also communicate with microglia, the brain’s main immune cells via specialised contact sites, called «somatic junctions». These connections enable microglia to constantly monitor and regulate neuronal functions, and exert neuroprotection, when needed.[32]
Mechanisms for propagating action potentials[edit]
In 1937 John Zachary Young suggested that the squid giant axon could be used to study neuronal electrical properties.[33] It is larger than but similar to human neurons, making it easier to study. By inserting electrodes into the squid giant axons, accurate measurements were made of the membrane potential.
The cell membrane of the axon and soma contain voltage-gated ion channels that allow the neuron to generate and propagate an electrical signal (an action potential). Some neurons also generate subthreshold membrane potential oscillations. These signals are generated and propagated by charge-carrying ions including sodium (Na+), potassium (K+), chloride (Cl−), and calcium (Ca2+).
Several stimuli can activate a neuron leading to electrical activity, including pressure, stretch, chemical transmitters, and changes of the electric potential across the cell membrane.[34] Stimuli cause specific ion-channels within the cell membrane to open, leading to a flow of ions through the cell membrane, changing the membrane potential. Neurons must maintain the specific electrical properties that define their neuron type.[35]
Thin neurons and axons require less metabolic expense to produce and carry action potentials, but thicker axons convey impulses more rapidly. To minimize metabolic expense while maintaining rapid conduction, many neurons have insulating sheaths of myelin around their axons. The sheaths are formed by glial cells: oligodendrocytes in the central nervous system and Schwann cells in the peripheral nervous system. The sheath enables action potentials to travel faster than in unmyelinated axons of the same diameter, whilst using less energy. The myelin sheath in peripheral nerves normally runs along the axon in sections about 1 mm long, punctuated by unsheathed nodes of Ranvier, which contain a high density of voltage-gated ion channels. Multiple sclerosis is a neurological disorder that results from demyelination of axons in the central nervous system.
Some neurons do not generate action potentials, but instead generate a graded electrical signal, which in turn causes graded neurotransmitter release. Such non-spiking neurons tend to be sensory neurons or interneurons, because they cannot carry signals long distances.
Neural coding[edit]
Neural coding is concerned with how sensory and other information is represented in the brain by neurons. The main goal of studying neural coding is to characterize the relationship between the stimulus and the individual or ensemble neuronal responses, and the relationships among the electrical activities of the neurons within the ensemble.[36] It is thought that neurons can encode both digital and analog information.[37]
All-or-none principle[edit]
As long as the stimulus reaches the threshold, the full response would be given. Larger stimulus does not result in a larger response, vice versa.[38]: 31
The conduction of nerve impulses is an example of an all-or-none response. In other words, if a neuron responds at all, then it must respond completely. Greater intensity of stimulation, like brighter image/louder sound, does not produce a stronger signal, but can increase firing frequency.[38]: 31 Receptors respond in different ways to stimuli. Slowly adapting or tonic receptors respond to steady stimulus and produce a steady rate of firing. Tonic receptors most often respond to increased intensity of stimulus by increasing their firing frequency, usually as a power function of stimulus plotted against impulses per second. This can be likened to an intrinsic property of light where greater intensity of a specific frequency (color) requires more photons, as the photons can’t become «stronger» for a specific frequency.
Other receptor types include quickly adapting or phasic receptors, where firing decreases or stops with steady stimulus; examples include skin which, when touched causes neurons to fire, but if the object maintains even pressure, the neurons stop firing. The neurons of the skin and muscles that are responsive to pressure and vibration have filtering accessory structures that aid their function.
The pacinian corpuscle is one such structure. It has concentric layers like an onion, which form around the axon terminal. When pressure is applied and the corpuscle is deformed, mechanical stimulus is transferred to the axon, which fires. If the pressure is steady, stimulus ends; thus, typically these neurons respond with a transient depolarization during the initial deformation and again when the pressure is removed, which causes the corpuscle to change shape again. Other types of adaptation are important in extending the function of a number of other neurons.[39]
Etymology and spelling[edit]
The German anatomist Heinrich Wilhelm Waldeyer introduced the term neuron in 1891,[40] based on the ancient Greek νεῦρον neuron ‘sinew, cord, nerve’.[41]
The word was adopted in French with the spelling neurone. That spelling was also used by many writers in English,[42] but has now become rare in American usage and uncommon in British usage.[43][41]
History[edit]
The neuron’s place as the primary functional unit of the nervous system was first recognized in the late 19th century through the work of the Spanish anatomist Santiago Ramón y Cajal.[44]
To make the structure of individual neurons visible, Ramón y Cajal improved a silver staining process that had been developed by Camillo Golgi.[44] The improved process involves a technique called «double impregnation» and is still in use.
In 1888 Ramón y Cajal published a paper about the bird cerebellum. In this paper, he stated that he could not find evidence for anastomosis between axons and dendrites and called each nervous element «an absolutely autonomous canton.»[44][40] This became known as the neuron doctrine, one of the central tenets of modern neuroscience.[44]
In 1891, the German anatomist Heinrich Wilhelm Waldeyer wrote a highly influential review of the neuron doctrine in which he introduced the term neuron to describe the anatomical and physiological unit of the nervous system.[45][46]
The silver impregnation stains are a useful method for neuroanatomical investigations because, for reasons unknown, it stains only a small percentage of cells in a tissue, exposing the complete micro structure of individual neurons without much overlap from other cells.[47]
Neuron doctrine[edit]
The neuron doctrine is the now fundamental idea that neurons are the basic structural and functional units of the nervous system. The theory was put forward by Santiago Ramón y Cajal in the late 19th century. It held that neurons are discrete cells (not connected in a meshwork), acting as metabolically distinct units.
Later discoveries yielded refinements to the doctrine. For example, glial cells, which are non-neuronal, play an essential role in information processing.[48] Also, electrical synapses are more common than previously thought,[49] comprising direct, cytoplasmic connections between neurons. In fact, neurons can form even tighter couplings: the squid giant axon arises from the fusion of multiple axons.[50]
Ramón y Cajal also postulated the Law of Dynamic Polarization, which states that a neuron receives signals at its dendrites and cell body and transmits them, as action potentials, along the axon in one direction: away from the cell body.[51] The Law of Dynamic Polarization has important exceptions; dendrites can serve as synaptic output sites of neurons[52] and axons can receive synaptic inputs.[53]
Compartmental modelling of neurons[edit]
Although neurons are often described of as «fundamental units» of the brain, they perform internal computations. Neurons integrate input within dendrites, and this complexity is lost in models that assume neurons to be a fundamental unit. Dendritic branches can be modeled as spatial compartments, whose activity is related due to passive membrane properties, but may also be different depending on input from synapses. Compartmental modelling of dendrites is especially helpful for understanding the behavior of neurons that are too small to record with electrodes, as is the case for Drosophila melanogaster.[54]
Neurons in the brain[edit]
The number of neurons in the brain varies dramatically from species to species.[55] In a human, there are an estimated 10–20 billion neurons in the cerebral cortex and 55–70 billion neurons in the cerebellum.[56] By contrast, the nematode worm Caenorhabditis elegans has just 302 neurons, making it an ideal model organism as scientists have been able to map all of its neurons. The fruit fly Drosophila melanogaster, a common subject in biological experiments, has around 100,000 neurons and exhibits many complex behaviors. Many properties of neurons, from the type of neurotransmitters used to ion channel composition, are maintained across species, allowing scientists to study processes occurring in more complex organisms in much simpler experimental systems.
Neurological disorders[edit]
Charcot–Marie–Tooth disease (CMT) is a heterogeneous inherited disorder of nerves (neuropathy) that is characterized by loss of muscle tissue and touch sensation, predominantly in the feet and legs extending to the hands and arms in advanced stages. Presently incurable, this disease is one of the most common inherited neurological disorders, affecting 36 in 100,000 people.[57]
Alzheimer’s disease (AD), also known simply as Alzheimer’s, is a neurodegenerative disease characterized by progressive cognitive deterioration, together with declining activities of daily living and neuropsychiatric symptoms or behavioral changes.[58] The most striking early symptom is loss of short-term memory (amnesia), which usually manifests as minor forgetfulness that becomes steadily more pronounced with illness progression, with relative preservation of older memories. As the disorder progresses, cognitive (intellectual) impairment extends to the domains of language (aphasia), skilled movements (apraxia), and recognition (agnosia), and functions such as decision-making and planning become impaired.[59][60]
Parkinson’s disease (PD), also known as Parkinsons, is a degenerative disorder of the central nervous system that often impairs motor skills and speech.[61] Parkinson’s disease belongs to a group of conditions called movement disorders.[62] It is characterized by muscle rigidity, tremor, a slowing of physical movement (bradykinesia), and in extreme cases, a loss of physical movement (akinesia). The primary symptoms are the results of decreased stimulation of the motor cortex by the basal ganglia, normally caused by the insufficient formation and action of dopamine, which is produced in the dopaminergic neurons of the brain. Secondary symptoms may include high level cognitive dysfunction and subtle language problems. PD is both chronic and progressive.
Myasthenia gravis is a neuromuscular disease leading to fluctuating muscle weakness and fatigability during simple activities. Weakness is typically caused by circulating antibodies that block acetylcholine receptors at the post-synaptic neuromuscular junction, inhibiting the stimulative effect of the neurotransmitter acetylcholine. Myasthenia is treated with immunosuppressants, cholinesterase inhibitors and, in selected cases, thymectomy.
Demyelination[edit]
Demyelination is the act of demyelinating, or the loss of the myelin sheath insulating the nerves. When myelin degrades, conduction of signals along the nerve can be impaired or lost, and the nerve eventually withers. This leads to certain neurodegenerative disorders like multiple sclerosis and chronic inflammatory demyelinating polyneuropathy.
Axonal degeneration[edit]
Although most injury responses include a calcium influx signaling to promote resealing of severed parts, axonal injuries initially lead to acute axonal degeneration, which is the rapid separation of the proximal and distal ends, occurring within 30 minutes of injury.[63] Degeneration follows with swelling of the axolemma, and eventually leads to bead-like formation. Granular disintegration of the axonal cytoskeleton and inner organelles occurs after axolemma degradation. Early changes include accumulation of mitochondria in the paranodal regions at the site of injury. Endoplasmic reticulum degrades and mitochondria swell up and eventually disintegrate. The disintegration is dependent on ubiquitin and calpain proteases (caused by the influx of calcium ion), suggesting that axonal degeneration is an active process that produces complete fragmentation. The process takes about roughly 24 hours in the PNS and longer in the CNS. The signaling pathways leading to axolemma degeneration are unknown.
Neurogenesis[edit]
Neurons are born through the process of neurogenesis, in which neural stem cells divide to produce differentiated neurons. Once fully differentiated neurons are formed, they are no longer capable of undergoing mitosis. Neurogenesis primarily occurs in the embryo of most organisms.
Adult neurogenesis can occur and studies of the age of human neurons suggest that this process occurs only for a minority of cells, and that the vast majority of neurons in the neocortex forms before birth and persists without replacement. The extent to which adult neurogenesis exists in humans, and its contribution to cognition are controversial, with conflicting reports published in 2018.[64]
The body contains a variety of stem cell types that have the capacity to differentiate into neurons. Researchers found a way to transform human skin cells into nerve cells using transdifferentiation, in which «cells are forced to adopt new identities».[65]
During neurogenesis in the mammalian brain, progenitor and stem cells progress from proliferative divisions to differentiative divisions. This progression leads to the neurons and glia that populate cortical layers. Epigenetic modifications play a key role in regulating gene expression in differentiating neural stem cells, and are critical for cell fate determination in the developing and adult mammalian brain. Epigenetic modifications include DNA cytosine methylation to form 5-methylcytosine and 5-methylcytosine demethylation.[66] These modifications are critical for cell fate determination in the developing and adult mammalian brain. DNA cytosine methylation is catalyzed by DNA methyltransferases (DNMTs). Methylcytosine demethylation is catalyzed in several stages by TET enzymes that carry out oxidative reactions (e.g. 5-methylcytosine to 5-hydroxymethylcytosine) and enzymes of the DNA base excision repair (BER) pathway.[66]
At different stages of mammalian nervous system development two DNA repair processes are employed in the repair of DNA double-strand breaks. These pathways are homologous recombinational repair used in proliferating neural precursor cells, and non-homologous end joining used mainly at later developmental stages[67]
Intercellular communication between developing neurons and microglia is also indispensable for proper neurogenesis and brain development.[68]
Nerve regeneration[edit]
Peripheral axons can regrow if they are severed,[69] but one neuron cannot be functionally replaced by one of another type (Llinás’ law).[18]
See also[edit]
- Artificial neuron
- Bidirectional cell
- Biological neuron model
- Compartmental neuron models
- Connectome
- Dogiel cell
- List of animals by number of neurons
- List of neuroscience databases
- Neuronal galvanotropism
- Neuroplasticity
- Growth cone
- Sholl analysis
References[edit]
- ^ >Moore, Keith; Dalley, Arthur (2005). Clinically Oriented Anatomy (5th ed.). LWW. pp. 47. ISBN 0-7817-3639-0.
A bundle of nerve fibers (axons) connecting neighboring or distant nuclei of the CNS is a tract.
- ^ «What are the parts of the nervous system?». Retrieved 2022-07-08.
- ^ Davies, Melissa (2002-04-09). «The Neuron: size comparison». Neuroscience: A journey through the brain. Retrieved 2009-06-20.
- ^ Chudler EH. «Brain Facts and Figures». Neuroscience for Kids. Retrieved 2009-06-20.
- ^ «16.7: Nervous System». Biology LibreTexts. 2021-01-14. Retrieved 2022-02-28.
- ^ Herrup K, Yang Y (May 2007). «Cell cycle regulation in the postmitotic neuron: oxymoron or new biology?». Nature Reviews. Neuroscience. 8 (5): 368–78. doi:10.1038/nrn2124. PMID 17453017. S2CID 12908713.
- ^ Giménez, C. (February 1998). «[Composition and structure of the neuronal membrane: molecular basis of its physiology and pathology]». Revista de Neurologia. 26 (150): 232–239. ISSN 0210-0010. PMID 9563093.
- ^ State Hospitals Bulletin. State Commission in Lunacy. 1897. p. 378.
- ^ «Medical Definition of Neurotubules». www.merriam-webster.com.
- ^ Zecca L, Gallorini M, Schünemann V, Trautwein AX, Gerlach M, Riederer P, Vezzoni P, Tampellini D (March 2001). «Iron, neuromelanin and ferritin content in the substantia nigra of normal subjects at different ages: consequences for iron storage and neurodegenerative processes». Journal of Neurochemistry. 76 (6): 1766–73. doi:10.1046/j.1471-4159.2001.00186.x. PMID 11259494. S2CID 31301135.
- ^ Herrero MT, Hirsch EC, Kastner A, Luquin MR, Javoy-Agid F, Gonzalo LM, Obeso JA, Agid Y (1993). «Neuromelanin accumulation with age in catecholaminergic neurons from Macaca fascicularis brainstem». Developmental Neuroscience. 15 (1): 37–48. doi:10.1159/000111315. PMID 7505739.
- ^ Brunk UT, Terman A (September 2002). «Lipofuscin: mechanisms of age-related accumulation and influence on cell function». Free Radical Biology & Medicine. 33 (5): 611–9. doi:10.1016/s0891-5849(02)00959-0. PMID 12208347.
- ^ Zhao B, Meka DP, Scharrenberg R, König T, Schwanke B, Kobler O, Windhorst S, Kreutz MR, Mikhaylova M, Calderon de Anda F (August 2017). «Microtubules Modulate F-actin Dynamics during Neuronal Polarization». Scientific Reports. 7 (1): 9583. Bibcode:2017NatSR…7.9583Z. doi:10.1038/s41598-017-09832-8. PMC 5575062. PMID 28851982.
- ^ Lee WC, Huang H, Feng G, Sanes JR, Brown EN, So PT, Nedivi E (February 2006). «Dynamic remodeling of dendritic arbors in GABAergic interneurons of adult visual cortex». PLOS Biology. 4 (2): e29. doi:10.1371/journal.pbio.0040029. PMC 1318477. PMID 16366735.
- ^ Al, Martini, Frederic Et (2005). Anatomy and Physiology’ 2007 Ed.2007 Edition. Rex Bookstore, Inc. p. 288. ISBN 978-971-23-4807-5.
- ^ Gerber U (January 2003). «Metabotropic glutamate receptors in vertebrate retina». Documenta Ophthalmologica. Advances in Ophthalmology. 106 (1): 83–7. doi:10.1023/A:1022477203420. PMID 12675489. S2CID 22296630.
- ^ Wilson NR, Runyan CA, Wang FL, Sur M (August 2012). «Division and subtraction by distinct cortical inhibitory networks in vivo». Nature. 488 (7411): 343–8. Bibcode:2012Natur.488..343W. doi:10.1038/nature11347. hdl:1721.1/92709. PMC 3653570. PMID 22878717.
- ^ a b Llinás RR (2014-01-01). «Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective». Frontiers in Cellular Neuroscience. 8: 320. doi:10.3389/fncel.2014.00320. PMC 4219458. PMID 25408634.
- ^ Kolodin YO, Veselovskaia NN, Veselovsky NS, Fedulova SA. Ion conductances related to shaping the repetitive firing in rat retinal ganglion cells. Acta Physiologica Congress. Archived from the original on 2012-10-07. Retrieved 2009-06-20.
- ^ «Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat». Ykolodin.50webs.com. 2008-04-27. Retrieved 2013-02-16.
- ^ Scammell TE, Jackson AC, Franks NP, Wisden W, Dauvilliers Y (January 2019). «Histamine: neural circuits and new medications». Sleep. 42 (1). doi:10.1093/sleep/zsy183. PMC 6335869. PMID 30239935.
- ^ «Patch-seq technique helps depict the variation of neural cells in the brain». News-medical.net. 3 December 2020. Retrieved 26 August 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Macpherson, Gordon (2002). Black’s Medical Dictionary (40 ed.). Lanham, MD: Scarecrow Press. pp. 431–434. ISBN 0810849844.
- ^ Ivannikov MV, Macleod GT (June 2013). «Mitochondrial free Ca²⁺ levels and their effects on energy metabolism in Drosophila motor nerve terminals». Biophysical Journal. 104 (11): 2353–61. Bibcode:2013BpJ…104.2353I. doi:10.1016/j.bpj.2013.03.064. PMC 3672877. PMID 23746507.
- ^ Herculano-Houzel S (November 2009). «The human brain in numbers: a linearly scaled-up primate brain». Frontiers in Human Neuroscience. 3: 31. doi:10.3389/neuro.09.031.2009. PMC 2776484. PMID 19915731.
- ^ Drachman DA (June 2005). «Do we have brain to spare?». Neurology. 64 (12): 2004–5. doi:10.1212/01.WNL.0000166914.38327.BB. PMID 15985565. S2CID 38482114.
- ^ Ucar, Hasan; Watanabe, Satoshi; Noguchi, Jun; Morimoto, Yuichi; Iino, Yusuke; Yagishita, Sho; Takahashi, Noriko; Kasai, Haruo (December 2021). «Mechanical actions of dendritic-spine enlargement on presynaptic exocytosis». Nature. 600 (7890): 686–689. Bibcode:2021Natur.600..686U. doi:10.1038/s41586-021-04125-7. ISSN 1476-4687. PMID 34819666. S2CID 244648506.
Lay summary:
«Forceful synapses reveal mechanical interactions in the brain». Nature. 24 November 2021. doi:10.1038/d41586-021-03516-0. Retrieved 21 February 2022. - ^ «Researchers discover new type of cellular communication in the brain». The Scripps Research Institute. Retrieved 12 February 2022.
- ^ Schiapparelli, Lucio M.; Sharma, Pranav; He, Hai-Yan; Li, Jianli; Shah, Sahil H.; McClatchy, Daniel B.; Ma, Yuanhui; Liu, Han-Hsuan; Goldberg, Jeffrey L.; Yates, John R.; Cline, Hollis T. (25 January 2022). «Proteomic screen reveals diverse protein transport between connected neurons in the visual system». Cell Reports. 38 (4): 110287. doi:10.1016/j.celrep.2021.110287. ISSN 2211-1247. PMC 8906846. PMID 35081342.
- ^ Levitan, Irwin B.; Kaczmarek, Leonard K. (2015). «Electrical Signaling in Neurons». The Neuron. Oxford University Press. pp. 41–62. doi:10.1093/med/9780199773893.003.0003. ISBN 978-0-19-977389-3.
- ^ O’Leary, Olivia F.; Ogbonnaya, Ebere S.; Felice, Daniela; Levone, Brunno R.; C. Conroy, Lorraine; Fitzgerald, Patrick; Bravo, Javier A.; Forsythe, Paul; Bienenstock, John; Dinan, Timothy G.; Cryan, John F. (1 February 2018). «The vagus nerve modulates BDNF expression and neurogenesis in the hippocampus». European Neuropsychopharmacology. 28 (2): 307–316. doi:10.1016/j.euroneuro.2017.12.004. ISSN 0924-977X. PMID 29426666. S2CID 46819013.
- ^ Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z (January 2020). «Microglia monitor and protect neuronal function through specialized somatic purinergic junctions». Science. 367 (6477): 528–537. Bibcode:2020Sci…367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ^ Chudler EH. «Milestones in Neuroscience Research». Neuroscience for Kids. Retrieved 2009-06-20.
- ^ Patlak J, Gibbons R (2000-11-01). «Electrical Activity of Nerves». Action Potentials in Nerve Cells. Archived from the original on August 27, 2009. Retrieved 2009-06-20.
- ^ Harris-Warrick, RM (October 2011). «Neuromodulation and flexibility in Central Pattern Generator networks». Current Opinion in Neurobiology. 21 (5): 685–92. doi:10.1016/j.conb.2011.05.011. PMC 3171584. PMID 21646013.
- ^ Brown EN, Kass RE, Mitra PP (May 2004). «Multiple neural spike train data analysis: state-of-the-art and future challenges». Nature Neuroscience. 7 (5): 456–61. doi:10.1038/nn1228. PMID 15114358. S2CID 562815.
- ^ Thorpe SJ (1990). «Spike arrival times: A highly efficient coding scheme for neural networks» (PDF). In Eckmiller R, Hartmann G, Hauske G (eds.). Parallel processing in neural systems and computers. North-Holland. pp. 91–94. ISBN 9780444883902. Archived from the original (PDF) on 2012-02-15.
- ^ a b Kalat, James W (2016). Biological psychology (12 ed.). Australia. ISBN 9781305105409. OCLC 898154491.
- ^ Eckert R, Randall D (1983). Animal physiology: mechanisms and adaptations. San Francisco: W.H. Freeman. p. 239. ISBN 978-0-7167-1423-1.
- ^ a b Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Ramon y Cajal’s first paper on the Golgi stain was on the bird cerebellum, and it appeared in the Revista in 1888. He acknowledged that he found the nerve fibers to be very intricate, but stated that he could find no evidence for either axons or dendrites undergoing anastomosis and forming nets. He called each nervous element ‘an absolutely autonomous canton.’
- ^ a b Oxford English Dictionary, 3rd edition, 2003, s.v.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (January 2020). «Grey Matter Etymology and the neuron(e)». Brain. 143 (1): 374–379. doi:10.1093/brain/awz367. PMC 6935745. PMID 31844876.
- ^ «Google Books Ngram Viewer». books.google.com. Retrieved 19 December 2020.
- ^ a b c d López-Muñoz F, Boya J, Alamo C (October 2006). «Neuron theory, the cornerstone of neuroscience, on the centenary of the Nobel Prize award to Santiago Ramón y Cajal». Brain Research Bulletin. 70 (4–6): 391–405. doi:10.1016/j.brainresbull.2006.07.010. PMID 17027775. S2CID 11273256.
- ^ Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
… a man who would write a highly influential review of the evidence in favor of the neuron doctrine two years later. In his paper, Waldeyer (1891), … , wrote that nerve cells terminate freely with end arborizations and that the ‘neuron’ is the anatomical and physiological unit of the nervous system. The word ‘neuron’ was born this way.
- ^ «Whonamedit — dictionary of medical eponyms». www.whonamedit.com.
Today, Wilhelm von Waldeyer-Hartz is remembered as the founder of the neurone theory, coining the term «neurone» to describe the cellular function unit of the nervous system and enunciating and clarifying that concept in 1891.
- ^ Grant G (October 2007). «How the 1906 Nobel Prize in Physiology or Medicine was shared between Golgi and Cajal». Brain Research Reviews. 55 (2): 490–8. doi:10.1016/j.brainresrev.2006.11.004. PMID 17306375. S2CID 24331507.
- ^ Witcher MR, Kirov SA, Harris KM (January 2007). «Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus». Glia. 55 (1): 13–23. CiteSeerX 10.1.1.598.7002. doi:10.1002/glia.20415. PMID 17001633. S2CID 10664003.
- ^ Connors BW, Long MA (2004). «Electrical synapses in the mammalian brain». Annual Review of Neuroscience. 27 (1): 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Guillery RW (June 2005). «Observations of synaptic structures: origins of the neuron doctrine and its current status». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 360 (1458): 1281–307. doi:10.1098/rstb.2003.1459. PMC 1569502. PMID 16147523.
- ^ Sabbatini RM (April–July 2003). «Neurons and Synapses: The History of Its Discovery». Brain & Mind Magazine: 17.
- ^ Djurisic M, Antic S, Chen WR, Zecevic D (July 2004). «Voltage imaging from dendrites of mitral cells: EPSP attenuation and spike trigger zones». The Journal of Neuroscience. 24 (30): 6703–14. doi:10.1523/JNEUROSCI.0307-04.2004. hdl:1912/2958. PMC 6729725. PMID 15282273.
- ^ Cochilla AJ, Alford S (March 1997). «Glutamate receptor-mediated synaptic excitation in axons of the lamprey». The Journal of Physiology. 499 (Pt 2): 443–57. doi:10.1113/jphysiol.1997.sp021940. PMC 1159318. PMID 9080373.
- ^ Gouwens NW, Wilson RI (2009). «Signal propagation in Drosophila central neurons». Journal of Neuroscience. 29 (19): 6239–6249. doi:10.1523/jneurosci.0764-09.2009. PMC 2709801. PMID 19439602.
- ^ Williams RW, Herrup K (1988). «The control of neuron number». Annual Review of Neuroscience. 11 (1): 423–53. doi:10.1146/annurev.ne.11.030188.002231. PMID 3284447.
- ^ von Bartheld CS, Bahney J, Herculano-Houzel S (December 2016). «The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting». The Journal of Comparative Neurology. 524 (18): 3865–3895. doi:10.1002/cne.24040. PMC 5063692. PMID 27187682.
- ^ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (July 2000). «Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A». Brain. 123 (7): 1516–27. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ «About Alzheimer’s Disease: Symptoms». National Institute on Aging. Archived from the original on 15 January 2012. Retrieved 28 December 2011.
- ^ Burns A, Iliffe S (February 2009). «Alzheimer’s disease». BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ Querfurth HW, LaFerla FM (January 2010). «Alzheimer’s disease». The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ «Parkinson’s Disease Information Page». NINDS. 30 June 2016. Archived from the original on 4 January 2017. Retrieved 18 July 2016.
- ^ «Movement Disorders». The International Neuromodulation Society.
- ^ Kerschensteiner M, Schwab ME, Lichtman JW, Misgeld T (May 2005). «In vivo imaging of axonal degeneration and regeneration in the injured spinal cord». Nature Medicine. 11 (5): 572–7. doi:10.1038/nm1229. PMID 15821747. S2CID 25287010.
- ^ Kempermann G, Gage FH, Aigner L, Song H, Curtis MA, Thuret S, Kuhn HG, Jessberger S, Frankland PW, Cameron HA, Gould E, Hen R, Abrous DN, Toni N, Schinder AF, Zhao X, Lucassen PJ, Frisén J (July 2018). «Human Adult Neurogenesis: Evidence and Remaining Questions». Cell Stem Cell. 23 (1): 25–30. doi:10.1016/j.stem.2018.04.004. PMC 6035081. PMID 29681514.
- ^ Callaway, Ewen (26 May 2011). «How to make a human neuron». Nature. doi:10.1038/news.2011.328.
By transforming cells from human skin into working nerve cells, researchers may have come up with a model for nervous-system diseases and perhaps even regenerative therapies based on cell transplants. The achievement, reported online today in Nature, is the latest in a fast-moving field called transdifferentiation, in which cells are forced to adopt new identities. In the past year, researchers have converted connective tissue cells found in skin into heart cells, blood cells, and liver cells.
- ^ a b Wang Z, Tang B, He Y, Jin P (March 2016). «DNA methylation dynamics in neurogenesis». Epigenomics. 8 (3): 401–14. doi:10.2217/epi.15.119. PMC 4864063. PMID 26950681.
- ^ Orii KE, Lee Y, Kondo N, McKinnon PJ (June 2006). «Selective utilization of nonhomologous end-joining and homologous recombination DNA repair pathways during nervous system development». Proceedings of the National Academy of Sciences of the United States of America. 103 (26): 10017–22. Bibcode:2006PNAS..10310017O. doi:10.1073/pnas.0602436103. PMC 1502498. PMID 16777961.
- ^ Cserép, Csaba; Schwarcz, Anett D.; Pósfai, Balázs; László, Zsófia I.; Kellermayer, Anna; Környei, Zsuzsanna; Kisfali, Máté; Nyerges, Miklós; Lele, Zsolt; Katona, István (September 2022). «Microglial control of neuronal development via somatic purinergic junctions». Cell Reports. 40 (12): 111369. doi:10.1016/j.celrep.2022.111369. PMC 9513806. PMID 36130488. S2CID 252416407.
- ^ Yiu G, He Z (August 2006). «Glial inhibition of CNS axon regeneration». Nature Reviews. Neuroscience. 7 (8): 617–27. doi:10.1038/nrn1956. PMC 2693386. PMID 16858390.
Further reading[edit]
- Bullock TH, Bennett MV, Johnston D, Josephson R, Marder E, Fields RD (November 2005). «Neuroscience. The neuron doctrine, redux». Science. 310 (5749): 791–3. doi:10.1126/science.1114394. PMID 16272104. S2CID 170670241.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Peters A, Palay SL, Webster HS (1991). The Fine Structure of the Nervous System (3rd ed.). New York: Oxford University Press. ISBN 0-19-506571-9.
- Ramón y Cajal S (1933). Histology (10th ed.). Baltimore: Wood.
- Roberts A, Bush BM (1981). Neurones without Impulses. Cambridge: Cambridge University Press. ISBN 0-521-29935-7.
- Snell RS (2010). Clinical Neuroanatomy. Lippincott Williams & Wilkins. ISBN 978-0-7817-9427-5.
External links[edit]
- Neurobiology at Curlie
- IBRO (International Brain Research Organization). Fostering neuroscience research especially in less well-funded countries.
- NeuronBank an online neuromics tool for cataloging neuronal types and synaptic connectivity.
- High Resolution Neuroanatomical Images of Primate and Non-Primate Brains.
- The Department of Neuroscience at Wikiversity, which presently offers two courses: Fundamentals of Neuroscience and Comparative Neuroscience.
- NIF Search – Neuron via the Neuroscience Information Framework
- Cell Centered Database – Neuron
- Complete list of neuron types according to the Petilla convention, at NeuroLex.
- NeuroMorpho.Org an online database of digital reconstructions of neuronal morphology.
- Immunohistochemistry Image Gallery: Neuron
- Khan Academy: Anatomy of a neuron
- Neuron images










 — униполярный нейрон в среднемозговом ядре тройничного нерва;
— униполярный нейрон в среднемозговом ядре тройничного нерва;