Пресинаптический аппарат:
Это
окончание аксона нейрона (пресинаптическая
терминаль, пресинаптическая бляшка). У
одного аксона может быть множество
пресинаптических терминалей. В этих
терминалях отмечается значительное
скопление митохондрий, указывающее на
активные биосинтетические процессы,
хорошо выражена гладкая эндоплазматическая
сеть, содержащая депонированный кальций,
а также имеется множество микротрубочек
и микрофиламентов, участвующих во
внутриклеточном перемещении мелких
везикул с медиатором. Действительно,
здесь идет активный синтез медиатора
– химического посредника передачи
возбуждения в синапсе, а также упаковка
его в везикулы. В пресинаптическом
аппарате медиатор содержится в везикулах
разного размера. В крупных везикулах
находится запас (депо) медиатора. Эти
везикулы с помощью белка синаптосина
связаны с белками цитоскелета
пресинаптического аппарата и, таким
образом, находятся в фиксированном
состоянии. В мелких везикулах медиатор
находится в молекулярном виде, то есть
он готов к выбросу в синаптическую щель.
В одной такой везикуле находится до 10
тысяч и более молекул медиатора, а размер
везикулы составляет 40-50 нм (рис. 6).
Поверхностная
клеточная мембрана пресинаптического
аппарата, обращенная в синаптическую
щель, называется пресинаптической
мембраной.
В
мионевральном синапсе она имеет
достаточно большую протяженность (около
1-2 мм). Через нее медиатор может проникать
из пресинаптического аппарата в
синаптическую щель.
Синаптическая щель:
Это
пространство между пре- и постсинаптической
мембранами, заполненное межклеточной
жидкостью и содержащее поперечные
гликопротеидные нейрофиламенты
(гликокаликс), идущие от пресинаптической
к постсинаптической мембране. В это
пространство из пресинаптического
аппарата выбрасывается медиатор, который
должен попасть на постсинаптическую
мембрану.
Постсинаптической мембраной:
Постсинаптическая
(иногда ее называют субсинаптической)
мембрана представляет собой участок
поверхностной мембраны клетки (нервной,
мышечной или железистой), на которую
передается возбуждение. Этот участок
находится напротив пресинаптической
мембраны и в отличие от остальной
поверхностной мембраны той же клетки
(например, мышечной) здесь нет «быстрых»
(электровозбудимых) натриевых каналов,
но есть «медленные» — хемовозбудимые,
то есть чувствительные к определенному
медиатору. «Медленные» натриевые каналы
не могут быть открытыми одновременно
все сразу, так как очень быстро происходит
их закрывание (натриевая инактивация).
В связи с вышеизложенным, на постсинаптической
мембране не может возникнуть потенциал
действия, но может появиться местная
деполяризация.
Механизм передачи возбуждения в синапсе
Этот
механизм достаточно сложен. В него
последовательно включаются сначала
пресинаптический аппарат, а потом
постсинаптическая мембрана.
1)
идет перезарядка поверхностной клеточной
мембраны пресинаптического аппарата
(рис. 7А);
2)
ионы кальция по градиенту концентрации
входят в пресинаптический аппарат из
межклеточной жидкости (рис. 7Б);
3)
кальций способствует встраиванию
везикул с медиатором в структуру
пресинаптической мембраны – начальная
фаза экзоцитоза (рис. 7В);
4)
кальций способствует сокращению везикул
и выдавливанию (экзоцитозу) медиатора
в синаптическую щель (рис. 7Г).
Причиной
перезарядки поверхностной клеточной
мембраны пресинаптического аппарата
является возбуждение, поступающее сюда
по аксону и его терминалям от тела
нейрона.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Синаптическое торможение, приводящее к уменьшению эффективности возбуждающих синаптических влияний, может развиваться не только на уровне постсинаптической мембраны (как это было рассмотрено выше), но еще в пресинаптическом звене путем угнетения процесса высвобождения медиатора возбуждающими нервными окончаниями. В этом случае свойства постсинаптической мембраны не подвергаются каким бы то ни было изменениям.
Пресинаптическое торможение обнаружено в различных отделах ЦНС. Наиболее часто оно выявляется в структурах мозгового ствола и особенно в спинном мозге.
Так же как и постсинаптическое, пресинаптическое торможение осуществляется посредством специальных тормозных вставочных нейронов.
Структурной основой пресинаптического торможения являются аксоаксонные синапсы, образованные окончаниями аксонов тормозных вставочных нейронов и аксональными окончаниями возбуждающих нейронов. В этом случае окончание аксона тормозного нейрона является пресинаптическим по отношению к возбуждающему окончанию, которое в свою очередь будучи постсинаптическим по отношению к тормозному окончанию, является пресинаптическим по отношению к активируемой им нервной клетке (рис. 71).
Импульсы в пресинаптическом тормозном аксоне высвобождают медиатор (в спинном мозге это вероятнее всего γ-аминомасляная кислота), который вызывает деполяризацию возбуждающих окончаний за счет увеличения проницаемости их мембраны для С1~. Предполагается, что указанная деполяризация вызывает уменьшение амплитуды потенциала действия, приходящего в возбуждающее окончание, что в свою очередь уменьшает количество высвобождаемого им медиатора, вследствие чего амплитуда возбуждающего постсинаптического потенциала падает.
Другим механизмом пресинаптического торможения может быть уменьшение входящего внутрь потока Са²⁺, воздействующего на электросекреторную связь. И в этом случае пресинаптическое торможение приводит к уменьшению числа квантов медиатора, высвобождаемого возбуждающим пресинаптическим окончанием.
У млекопитающих продолжительность пресинаптического торможения значительно превосходит продолжительность постсинаптического торможения. Большая длительность пресинаптического торможения, по-видимому, обусловлена ритмической активностью тормозных вставочных нейронов.
Пресинаптическое торможение особенно эффективно при обработке информации, поступающей к нейрону по различным пресинаптическим путям. В этом случае возбуждение, поступающее по одному из синаптических входов, может быть избирательно уменьшено или даже полностью подавлено при отсутствии влияния на другие входы.
Подобного результата нельзя достичь путем воздействия на проводимость постсинаптической мембраны, как это имеет место при постсинаптическом торможении, влияющем на всю нервную клетку.
Статья на конкурс «био/мол/текст»: Клеточные процессы, обеспечивающие обмен информацией между нейронами, требуют много энергии. Высокое энергопотребление способствовало в ходе эволюции отбору наиболее эффективных механизмов кодирования и передачи информации. В этой статье вы узнаете о теоретическом подходе к изучению энергетики мозга, о его роли в исследованиях патологий, о том, какие нейроны более продвинуты, почему синапсам иногда выгодно не «срабатывать», а также, как они отбирают только нужную нейрону информацию.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2017.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Происхождение подхода
С середины ХХ века известно, что головной мозг потребляет значительную часть энергоресурсов всего организма: четверть всей глюкозы и ⅕ всего кислорода в случае высшего примата [1–5]. Это вдохновило Уильяма Леви и Роберта Бакстера из Массачусетского технологического института (США) на проведение теоретического анализа энергетической эффективности кодирования информации в биологических нейронных сетях (рис. 1) [6]. В основе исследования лежит следующая гипотеза. Поскольку энергопотребление мозга велико, ему выгодно иметь такие нейроны, которые работают наиболее эффективно — передают только полезную информацию и затрачивают при этом минимум энергии.
Это предположение оказалось справедливым: на простой модели нейронной сети авторы воспроизвели экспериментально измеренные значения некоторых параметров [6]. В частности, рассчитанная ими оптимальная частота генерации импульсов варьирует от 6 до 43 имп./с — почти так же, как и у нейронов основания гиппокампа. Их можно подразделить на две группы по частоте импульсации: медленные (~10 имп./с) и быстрые (~40 имп./с). При этом первая группа значительно превосходит по численности вторую [7]. Аналогичная картина наблюдается и в коре больших полушарий: медленных пирамидальных нейронов (~4—9 имп./с) в несколько раз больше, чем быстрых ингибиторных интернейронов (>100 имп./с) [8], [9]. Так, видимо, мозг «предпочитает» использовать поменьше быстрых и энергозатратных нейронов, чтобы те не израсходовали все ресурсы [6], [9–11].
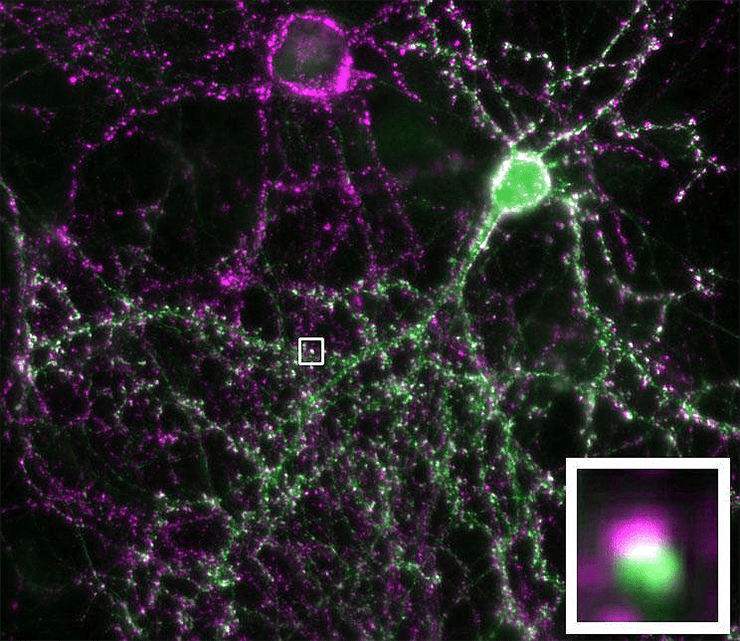
Рисунок 1. Представлены два нейрона. В одном из них фиолетовым цветом окрашен пресинаптический белок синаптофизин. Другой нейрон полностью окрашен зеленым флуоресцентным белком. Мелкие светлые крапинки — синаптические контакты между нейронами [12]. Во вставке одна «крапинка» представлена ближе.
Группы нейронов, связанных между собой синапсами, называются нейронными сетями [13], [14]. Например, в коре больших полушарий пирамидальные нейроны и интернейроны образуют обширные сети. Слаженная «концертная» работа этих клеток обусловливает наши высшие когнитивные и другие способности. Аналогичные сети, только из других типов нейронов, распределены по всему мозгу, определенным образом связаны между собой и организуют работу всего органа.
Работа Леви и Бакстера [6] развивает концепцию «экономии импульсов» Горация Барлоу из Университета Калифорнии (США), который, кстати, является потомком Чарльза Дарвина [17]. Согласно ей, при развитии организма нейроны стремятся работать только с наиболее полезной информацией, фильтруя «лишние» импульсы, ненужную и избыточную информацию. Однако эта концепция не дает удовлетворительных результатов, так как не учитывает метаболические затраты, связанные с нейрональной активностью [6]. Расширенный подход Леви и Бакстера, в котором внимание уделено обоим факторам, оказался более плодотворным [6], [18–20]. И энергозатраты нейронов, и потребность в кодировании только полезной информации являются важными факторами, направляющими эволюцию мозга [6], [21–24]. Поэтому, чтобы лучше разобраться в том, как устроен мозг, стоит рассматривать обе эти характеристики: сколько нейрон передает полезной информации и сколько энергии при этом тратит.
За последнее время этот подход нашел множество подтверждений [10], [22], [24–26]. Он позволил по-новому взглянуть на устройство мозга на самых разных уровнях организации — от молекулярно-биофизического [20], [26] до органного [23]. Он помогает понять, каковы компромиссы между выполняемой функцией нейрона и ее энергетической ценой и в какой степени они выражены.
Как же работает этот подход?
Положим, у нас есть модель нейрона, описывающая его электрофизиологические свойства: потенциал действия (ПД) и постсинаптические потенциалы (ПСП) (об этих терминах — ниже). Мы хотим понять, эффективно ли он работает, не тратит ли неоправданно много энергии. Для этого нужно вычислить значения параметров модели (например, плотность каналов в мембране, скорость их открывания и закрывания), при которых: (а) достигается максимум отношения полезной информации к энергозатратам и в то же время (б) сохраняются реалистичные характеристики передаваемых сигналов [6], [19].
Эти «оптимальные» значения параметров затем нужно сравнить с измеренными экспериментально и определить, насколько они отличаются. Общая картина отличий укажет на степень оптимизации данного нейрона в целом: насколько реальные, измеренные экспериментально, значения параметров совпадают с рассчитанными. Чем слабее выражены отличия, тем нейрон более близок к оптимуму и работает энергетически более эффективно, оптимально. С другой стороны, сопоставление конкретных параметров покажет, в каком конкретно качестве этот нейрон близок к «идеалу».
Далее, в контексте энергетической эффективности нейронов рассмотрены два процесса, на которых основано кодирование и передача информации в мозге. Это нервный импульс, или потенциал действия, благодаря которому информация может быть отправлена «адресату» на определенное расстояние (от микрометров до полутора метров) и синаптическая передача, лежащая в основе собственно передачи сигнала от одного нейрона на другой.
Потенциал действия
Потенциал действия (ПД) — сигнал, которые отправляют друг другу нейроны. ПД бывают разные: быстрые и медленные, малые и большие [28]. Зачастую они организованы в длинные последовательности (как буквы в слова), либо в короткие высокочастотные «пачки» (рис. 2).
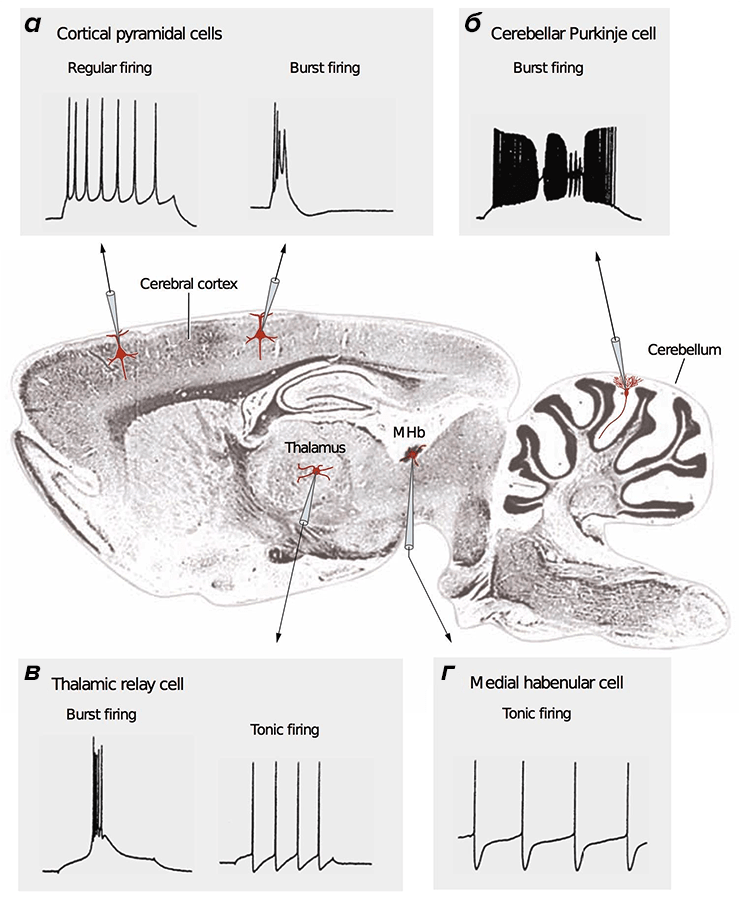
Рисунок 2. Разные типы нейронов генерируют различные сигналы. В центре — продольный срез мозга млекопитающего. Во вставках представлены разные типы сигналов, зарегистрированные методами электрофизиологии [15], [38]. а — Кортикальные (Cerebral cortex) пирамидальные нейроны могут передавать как низкочастотные сигналы (Regular firing), так и короткие взрывные, или пачечные, сигналы (Burst firing). б — Для клеток Пуркинье мозжечка (Cerebellum) характерна только пачечная активность на очень высокой частоте. в — Релейные нейроны таламуса (Thalamus) имеют два режима активности: пачечный и тонический (Tonic firing). г — Нейроны средней части поводка (MHb, Medial habenula) эпиталамуса генерируют тонические сигналы низкой частоты.
[14], рисунок адаптирован
Большое разнообразие сигналов обусловлено огромным количеством комбинаций разных типов ионных каналов, синаптических контактов, а также морфологией нейронов [28], [29]. Поскольку в основе сигнальных процессов нейрона лежат ионные токи, стоит ожидать, что разные ПД требуют различных энергозатрат [20], [27], [30].
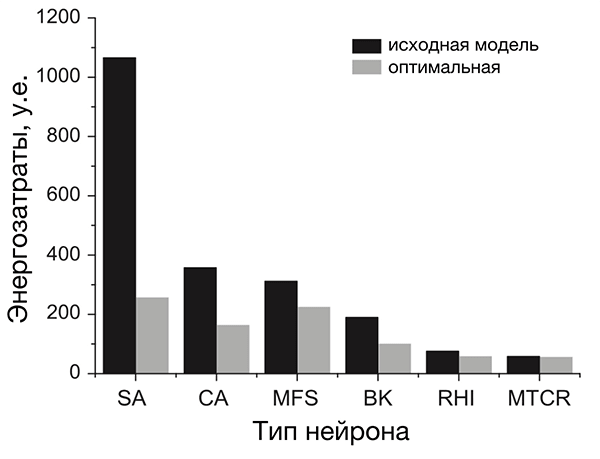
Анализ разных типов нейронов (рис. 4) показал, что нейроны беспозвоночных не очень энергоэффективны, а некоторые нейроны позвоночных почти совершенны [20]. По результатам этого исследования, наиболее энергоэффективными оказались интернейроны гиппокампа, участвующего в формировании памяти и эмоций, а также таламокортикальные релейные нейроны, несущие основной поток сенсорной информации от таламуса к коре больших полушарий.
Рисунок 4. Разные нейроны эффективны по-разному. На рисунке представлено сравнение энергозатрат разных типов нейронов. Энергозатраты рассчитаны в моделях как с исходными (реальными) значениями параметров (черные столбцы), так и с оптимальными, при которых с одной стороны нейрон выполняет положенную ему функцию, с другой — затрачивает при этом минимум энергии (серые столбцы). Самыми эффективными из представленных оказались два типа нейронов позвоночных: интернейроны гиппокампа (rat hippocampal interneuron, RHI) и таламокортикальные нейроны (mouse thalamocortical relay cell, MTCR), так как для них энергозатраты в исходной модели наиболее близки к энергозатратам оптимизированной. Напротив, нейроны беспозвоночных менее эффективны. Условные обозначения: SA (squid axon) — гигантский аксон кальмара; CA (crab axon) — аксон краба; MFS (mouse fast spiking cortical interneuron) — быстрый кортикальный интернейрон мыши; BK (honeybee mushroom body Kenyon cell) — грибовидная клетка Кеньона пчелы.
[20], рисунок адаптирован
Почему они более эффективны? Потому что у них малó перекрывание Na- и К-токов. Во время генерации ПД всегда есть промежуток времени, когда эти токи присутствуют одновременно (рис. 3в). При этом переноса заряда практически не происходит, и изменение мембранного потенциала минимально. Но «платить» за эти токи в любом случае приходится, несмотря на их «бесполезность» в этот период. Поэтому его продолжительность определяет, сколько энергетических ресурсов растрачивается впустую. Чем он короче, тем более эффективно использование энергии [20], [26], [30], [43]. Чем длиннее — тем менее эффективно. Как раз в двух вышеупомянутых типах нейронов, благодаря быстрым ионным каналам, этот период очень короткий, а ПД — самые эффективные [20].
Кстати, интернейроны гораздо более активны, чем большинство других нейронов мозга. В то же время они крайне важны для слаженной, синхронной работы нейронов, с которыми образуют небольшие локальные сети [9], [16]. Вероятно, высокая энергетическая эффективность ПД интернейронов является некой адаптацией к их высокой активности и роли в координации работы других нейронов [20].
Синапс
Передача сигнала от одного нейрона к другому происходит в специальном контакте между нейронами, в синапсе [12]. Мы рассмотрим только химические синапсы (есть еще электрические), поскольку они весьма распространены в нервной системе и важны для регуляции клеточного метаболизма, доставки питательных веществ [5].
Чаще всего, химический синапс образован между окончанием аксона одного нейрона и дендритом другого. Его работа напоминает… «переброс» эстафетной палочки, роль которой и играет нейромедиатор — химический посредник передачи сигнала [12], [42], [44–48].
На пресинаптическом окончании аксона ПД вызывает выброс нейромедиатора во внеклеточную среду — к принимающему нейрону. Последний только этого и ждет с нетерпением: в мембране дендритов рецепторы — ионные каналы определенного типа — связывают нейромедиатор, открываются и пропускают через себя разные ионы. Это приводит к генерации маленького постсинаптического потенциала (ПСП) на мембране дендрита. Он напоминает ПД, но значительно меньше по амплитуде и происходит за счет открывания других каналов. Множество этих маленьких ПСП, каждый от своего синапса, «сбегаются» по мембране дендритов к телу нейрона (зеленые стрелки на рис. 3а) и достигают начального сегмента аксона, где вызывают открывание Na-каналов и «провоцируют» его на генерацию ПД.
Такие синапсы называются возбуждающими: они способствуют активации нейрона и генерации ПД. Существуют также и тормозящие синапсы. Они, наоборот, способствуют торможению и препятствуют генерации ПД. Часто на одном нейроне есть и те, и другие синапсы. Определенное соотношение между торможением и возбуждением важно для нормальной работы мозга, формирования мозговых ритмов, сопровождающих высшие когнитивные функции [49].
Как это ни странно, выброс нейромедиатора в синапсе может и не произойти вовсе — это процесс вероятностный [18], [19]. Нейроны так экономят энергию: синаптическая передача и так обусловливает около половины всех энергозатрат нейронов [25]. Если бы синапсы всегда срабатывали, вся энергия пошла бы на обеспечение их работы, и не осталось бы ресурсов для других процессов. Более того, именно низкая вероятность (20–40%) выброса нейромедиатора соответствует наибольшей энергетической эффективности синапсов. Отношение количества полезной информации к затрачиваемой энергии в этом случае максимально [18], [19]. Так, выходит, что «неудачи» играют важную роль в работе синапсов и, соответственно, всего мозга. А за передачу сигнала при иногда «не срабатывающих» синапсах можно не беспокоиться, так как между нейронами обычно много синапсов, и хоть один из них да сработает.
Еще одна особенность синаптической передачи состоит в разделении общего потока информации на отдельные компоненты по частоте модуляции приходящего сигнала (грубо говоря, частоте приходящих ПД) [50]. Это происходит благодаря комбинированию разных рецепторов на постсинаптической мембране [38], [50]. Некоторые рецепторы активируются очень быстро: например, AMPA-рецепторы (AMPA происходит от α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid). Если на постсинаптическом нейроне представлены только такие рецепторы, он может четко воспринимать высокочастотный сигнал (такой, как, например, на рис. 2в). Ярчайший пример — нейроны слуховой системы, участвующие в определении местоположения источника звука и точном распознавании коротких звуков типа щелчка, широко представленных в речи [12], [38], [51]. NMDA-рецепторы (NMDA — от N—methyl-D—aspartate) более медлительны. Они позволяют нейронам отбирать сигналы более низкой частоты (рис. 2г), а также воспринимать высокочастотную серию ПД как нечто единое — так называемое интегрирование синаптических сигналов [14]. Есть еще более медленные метаботропные рецепторы, которые при связывании нейромедиатора, передают сигнал на цепочку внутриклеточных «вторичных посредников» для подстройки самых разных клеточных процессов. К примеру, широко распространены рецепторы, ассоциированные с G-белками. В зависимости от типа они, например, регулируют количество каналов в мембране или напрямую модулируют их работу [14].
Различные комбинации быстрых AMPA-, более медленных NMDA- и метаботропных рецепторов позволяют нейронам отбирать и использовать наиболее полезную для них информацию, важную для их функционирования [50]. А «бесполезная» информация отсеивается, она не «воспринимается» нейроном. В таком случае не приходится тратить энергию на обработку ненужной информации. В этом и состоит еще одна сторона оптимизации синаптической передачи между нейронами.
Что еще?
Энергетическая эффективность клеток мозга исследуется также и в отношении их морфологии [35], [52–54]. Исследования показывают, что ветвление дендритов и аксона не хаотично и тоже экономит энергию [52], [54]. Например, аксон ветвится так, чтобы суммарная длина пути, который проходит ПД, была наименьшей. В таком случае энергозатраты на проведение ПД вдоль аксона минимальны.
Снижение энергозатрат нейрона достигается также при определенном соотношении тормозящих и возбуждающих синапсов [55]. Это имеет прямое отношение, например, к ишемии (патологическому состоянию, вызванному нарушением кровотока в сосудах) головного мозга. При этой патологии, вероятнее всего, первыми выходят из строя наиболее метаболически активные нейроны [9], [16]. В коре они представлены ингибиторными интернейронами, образующими тормозящие синапсы на множестве других пирамидальных нейронов [9], [16], [49]. В результате гибели интернейронов, снижается торможение пирамидальных. Как следствие, возрастает общий уровень активности последних (чаще срабатывают активирующие синапсы, чаще генерируются ПД). За этим немедленно следует рост их энергопотребления, что в условиях ишемии может привести к гибели нейронов.
При изучении патологий внимание уделяют и синаптической передаче как наиболее энергозатратному процессу [19]. Например, при болезнях Паркинсона [56], Хантингтона [57], Альцгеймера [58–61] происходит нарушение работы или транспорта к синапсам митохондрий, играющих основную роль в синтезе АТФ [62], [63]. В случае болезни Паркинсона, это может быть связано с нарушением работы и гибелью высоко энергозатратных нейронов черной субстанции, важной для регуляции моторных функций, тонуса мышц. При болезни Хантингтона, мутантный белок хангтингтин нарушает механизмы доставки новых митохондрий к синапсам, что приводит к «энергетическому голоданию» последних, повышенной уязвимости нейронов и избыточной активации. Все это может вызвать дальнейшие нарушения работы нейронов с последующей атрофией полосатого тела и коры головного мозга. При болезни Альцгеймера нарушение работы митохондрий (параллельно со снижением количества синапсов) происходит из-за отложения амилоидных бляшек. Действие последних на митохондрии приводит к окислительному стрессу, а также к апоптозу — клеточной гибели нейронов.
Еще раз обо всем
В конце ХХ века зародился подход к изучению мозга, в котором одновременно рассматривают две важные характеристики: сколько нейрон (или нейронная сеть, или синапс) кодирует и передает полезной информации и сколько энергии при этом тратит [6], [18], [19]. Их соотношение является своего рода критерием энергетической эффективности нейронов, нейронных сетей и синапсов.
Использование этого критерия в вычислительной нейробиологии дало существенный прирост к знаниям относительно роли некоторых явлений, процессов [6], [18–20], [26], [30], [43], [55]. В частности, малая вероятность выброса нейромедиатора в синапсе [18], [19], определенный баланс между торможением и возбуждением нейрона [55], выделение только определенного рода приходящей информации благодаря определенной комбинации рецепторов [50] — все это способствует экономии ценных энергетических ресурсов.
Более того, само по себе определение энергозатрат сигнальных процессов (например, генерация, проведение ПД, синаптическая передача) позволяет выяснить, какой из них пострадает в первую очередь при патологическом нарушении доставки питательных веществ [10], [25], [56]. Так как больше всего энергии требуется для работы синапсов, именно они первыми выйдут из строя при таких патологиях, как ишемия, болезни Альцгеймера и Хантингтона [19], [25]. Схожим образом определение энергозатрат разных типов нейронов помогает выяснить, какой из них погибнет раньше других в случае патологии. Например, при той же ишемии, в первую очередь выйдут из строя интернейроны коры [9], [16]. Эти же нейроны из-за интенсивного метаболизма — наиболее уязвимые клетки и при старении, болезни Альцгеймера и шизофрении [16].
В общем, подход к определению энергетически эффективных механизмов работы мозга является мощным направлением для развития и фундаментальной нейронауки, и ее медицинских аспектов [5], [14], [16], [20], [26], [55], [64].
Благодарности
Искренне благодарен моим родителям Ольге Наталевич и Александру Жукову, сестрам Любе и Алене, моему научному руководителю Алексею Браже и замечательным друзьям по лаборатории Эвелине Никельшпарг и Ольге Слатинской за поддержку и вдохновение, ценные замечания, сделанные при прочтении статьи. Я также очень благодарен редактору статьи Анне Петренко и главреду «Биомолекулы» Антону Чугунову за пометки, предложения и замечания.
Литература
- Прожорливый мозг;
- SEYMOUR S. KETY. (1957). THE GENERAL METABOLISM OF THE BRAIN IN VIVO. Metabolism of the Nervous System. 221-237;
- L. Sokoloff, M. Reivich, C. Kennedy, M. H. Des Rosiers, C. S. Patlak, et. al.. (1977). THE [14C]DEOXYGLUCOSE METHOD FOR THE MEASUREMENT OF LOCAL CEREBRAL GLUCOSE UTILIZATION: THEORY, PROCEDURE, AND NORMAL VALUES IN THE CONSCIOUS AND ANESTHETIZED ALBINO RAT. J Neurochem. 28, 897-916;
- Magistretti P.J. (2008). Brain energy metabolism. In Fundamental neuroscience // Ed by. Squire L.R., Berg D., Bloom F.E., du Lac S., Ghosh A., Spitzer N. San Diego: Academic Press, 2008. P. 271–297;
- Pierre J. Magistretti, Igor Allaman. (2015). A Cellular Perspective on Brain Energy Metabolism and Functional Imaging. Neuron. 86, 883-901;
- William B Levy, Robert A. Baxter. (1996). Energy Efficient Neural Codes. Neural Computation. 8, 531-543;
- Sharp P.E. and Green C. (1994). Spatial correlates of firing patterns of single cells in the subiculum of the freely moving rat. J. Neurosci. 14, 2339–2356;
- H. Hu, J. Gan, P. Jonas. (2014). Fast-spiking, parvalbumin+ GABAergic interneurons: From cellular design to microcircuit function. Science. 345, 1255263-1255263;
- Oliver Kann, Ismini E Papageorgiou, Andreas Draguhn. (2014). Highly Energized Inhibitory Interneurons are a Central Element for Information Processing in Cortical Networks. J Cereb Blood Flow Metab. 34, 1270-1282;
- David Attwell, Simon B. Laughlin. (2001). An Energy Budget for Signaling in the Grey Matter of the Brain. J Cereb Blood Flow Metab. 21, 1133-1145;
- Henry Markram, Maria Toledo-Rodriguez, Yun Wang, Anirudh Gupta, Gilad Silberberg, Caizhi Wu. (2004). Interneurons of the neocortical inhibitory system. Nat Rev Neurosci. 5, 793-807;
- Как происходит выделение нейромедиатора;
- От живого мозга к искусственному интеллекту;
- Kandel E.R., Schwartz J.H., Jessell T.M., Siegelbaum S.A., Hudspeth A.J. Principles of neural science (5th Edition). NY: McGraw-Hill Education / Medical, 2012. — 1760 p.;
- 12 методов в картинках: нейробиология;
- Oliver Kann. (2016). The interneuron energy hypothesis: Implications for brain disease. Neurobiology of Disease. 90, 75-85;
- H. B. Barlow. (1969). Trigger Features, Adaptation and Economy of Impulses. Information Processing in The Nervous System. 209-230;
- Levy W.B. and Baxter R.A. (2002). Energy-efficient neuronal computation via quantal synaptic failures. J. Neurosci. 22, 4746–4755;
- Julia J. Harris, Renaud Jolivet, David Attwell. (2012). Synaptic Energy Use and Supply. Neuron. 75, 762-777;
- Biswa Sengupta, Martin Stemmler, Simon B. Laughlin, Jeremy E. Niven. (2010). Action Potential Energy Efficiency Varies Among Neuron Types in Vertebrates and Invertebrates. PLoS Comput Biol. 6, e1000840;
- Simon B. Laughlin, Rob R. de Ruyter van Steveninck, John C. Anderson. (1998). Unknown title.. Nat. Neurosci.. 1, 36-41;
- S Laughlin. (2001). Energy as a constraint on the coding and processing of sensory information. Current Opinion in Neurobiology. 11, 475-480;
- J. E. Niven, S. B. Laughlin. (2008). Energy limitation as a selective pressure on the evolution of sensory systems. Journal of Experimental Biology. 211, 1792-1804;
- Jeremy E Niven. (2016). Neuronal energy consumption: biophysics, efficiency and evolution. Current Opinion in Neurobiology. 41, 129-135;
- Clare Howarth, Padraig Gleeson, David Attwell. (2012). Updated Energy Budgets for Neural Computation in the Neocortex and Cerebellum. J Cereb Blood Flow Metab. 32, 1222-1232;
- A. Hasenstaub, S. Otte, E. Callaway, T. J. Sejnowski. (2010). Metabolic cost as a unifying principle governing neuronal biophysics. Proceedings of the National Academy of Sciences. 107, 12329-12334;
- Abdelmalik Moujahid, Alicia D’Anjou, Manuel Graña. (2014). Energy demands of diverse spiking cells from the neocortex, hippocampus, and thalamus. Front. Comput. Neurosci.. 8;
- Bruce P. Bean. (2007). The action potential in mammalian central neurons. Nat Rev Neurosci. 8, 451-465;
- Izhikevich E.M. Dynamical systems in neuroscience: the geometry of excitability and bursting (computational neuroscience). The MIT Press, 2007. — 457 p.;
- Brett C. Carter, Bruce P. Bean. (2009). Sodium Entry during Action Potentials of Mammalian Neurons: Incomplete Inactivation and Reduced Metabolic Efficiency in Fast-Spiking Neurons. Neuron. 64, 898-909;
- Формирование мембранного потенциала покоя;
- Появление и эволюция клеточной мембраны;
- Липидный фундамент жизни;
- Alan Woodruff, Rafael Yuste. (2008). Of Mice and Men, and Chandeliers. PLoS Biol. 6, e243;
- György Buzsáki, Caroline Geisler, Darrell A. Henze, Xiao-Jing Wang. (2004). Interneuron Diversity series: Circuit complexity and axon wiring economy of cortical interneurons. Trends in Neurosciences. 27, 186-193;
- David Sterratt, Bruce Graham, Andrew Gillies, David Willshaw. (Unknown published date.). Introduction. Principles of Computational Modelling in Neuroscience. 1-12;
- B. C. Carter, B. P. Bean. (2011). Incomplete Inactivation and Rapid Recovery of Voltage-Dependent Sodium Channels During High-Frequency Firing in Cerebellar Purkinje Neurons. Journal of Neurophysiology. 105, 860-871;
- Камкин А.Г. и Каменский А.А. (2004). Фундаментальная и клиническая физиология. М.: «Академия», 2004. — 1073 с.;
- Hille B. (2001). Ion channels of excitable membranes. Sunderland: Sinauer Associates, 2001. — 814 p.;
- Brian D. Clark, Ethan M. Goldberg, Bernardo Rudy. (2009). Electrogenic Tuning of the Axon Initial Segment. Neuroscientist. 15, 651-668;
- Джаксон М.Б. Молекулярная и клеточная биофизика. М.: «БИНОМ», 2013. — 552 с.;
- Спокоен как GABA;
- P. Crotty. (2006). Metabolic Energy Cost of Action Potential Velocity. Journal of Neurophysiology. 96, 1237-1246;
- Дофаминовые болезни;
- Серотониновые сети;
- Тайны голубого пятна;
- Молекула здравого ума;
- Очень нервное возбуждение;
- György Buzsáki, Kai Kaila, Marcus Raichle. (2007). Inhibition and Brain Work. Neuron. 56, 771-783;
- David Attwell, Alasdair Gibb. (2005). Neuroenergetics and the kinetic design of excitatory synapses. Nat Rev Neurosci. 6, 841-849;
- Nace L. Golding, Donata Oertel. (2012). Synaptic integration in dendrites: exceptional need for speed. The Journal of Physiology. 590, 5563-5569;
- Ashish Raj, Yu-hsien Chen. (2011). The Wiring Economy Principle: Connectivity Determines Anatomy in the Human Brain. PLoS ONE. 6, e14832;
- B. L. Chen, D. H. Hall, D. B. Chklovskii. (2006). Wiring optimization can relate neuronal structure and function. Proceedings of the National Academy of Sciences. 103, 4723-4728;
- Dmitri B. Chklovskii, Thomas Schikorski, Charles F. Stevens. (2002). Wiring Optimization in Cortical Circuits. Neuron. 34, 341-347;
- Biswa Sengupta, Simon B. Laughlin, Jeremy E. Niven. (2013). Balanced Excitatory and Inhibitory Synaptic Currents Promote Efficient Coding and Metabolic Efficiency. PLoS Comput Biol. 9, e1003263;
- Болезнь Паркинсона: что изучать? как изучать?;
- Как спасти Тринадцатую? (Перспективы лечения болезни Хантингтона);
- Болезнь Альцгеймера: ген, от которого я без ума;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- Возможно, β-амилоид болезни Альцгеймера — часть врождённого иммунитета;
- Новый шаг к пониманию болезни Альцгеймера: возможно, недосыпание является одним из факторов риска;
- Болезни и изменения клеточного метаболизма;
- Сон и старение II: Чем отличается сон пожилых и больных от сна молодых и здоровых?;
- Adelbert Ames. (2000). CNS energy metabolism as related to function. Brain Research Reviews. 34, 42-68.