From Wikipedia, the free encyclopedia
A neurohormone is any hormone produced and released by neuroendocrine cells (also called neurosecretory cells) into the blood.[1][2] By definition of being hormones, they are secreted into the circulation for systemic effect, but they can also have a role of neurotransmitter or other roles such as autocrine (self) or paracrine (local) messenger.[3]
The hypothalamus releasing hormones are neurohypophysial hormones in specialized hypothalamic neurons which extend to the median eminence and posterior pituitary. The adrenal medulla produces adrenomedullary hormones in chromaffin cells, cells which are very similar in structure to post-synaptic sympathetic neurons, even though they are not neurons they are derivatives of the neural crest.[4]
Enterochromaffin and enterochromaffin-like cells, both being enteroendocrine cells, are also considered neuroendocrine cells due to their structural and functional similarity to chromaffin cells, although they are not derivatives of the neural crest.[5] Other neuroendocrine cells are scattered throughout the body. Neurohormone are released by neurosecretory cells
Releasing hormones[edit]
Releasing hormones also known as hypophysiotropic or hypothalamic hormones are synthesized by different kinds of specialized neurons in the hypothalamus. They are then transported along neuronal axons to their axon terminals forming the bulk of the median eminence, where they are stored and released into the hypophyseal portal system. They then rapidly reach the anterior pituitary where they exert their hormonal action. The residual hormones pass into the systemic circulation where they are diluted, degraded and have comparatively little effects. The synthesis, control, and release of those hormones is co-regulated by hormonal, local and synaptic signals (neurotransmitters).[6][7] The neurons secreting various hormones have been found to discharge impulses in burst, causing a pulsatile release which is more efficient than a continuous release.[8] Hypophysiotropic hormones include:
- Thyrotropin-releasing hormone
- Corticotropin-releasing hormone
- Growth hormone-releasing hormone
- Somatostatin
- Gonadotropin-releasing hormone
- Dopamine
- Neurotensin
Neurohypophysial hormones[edit]
Neurohypophysial hormones are synthesized in the magnocellular secretory neurons of the hypothalamus. They are then transported along neuronal axons within the infundibular stalk to their axon terminals forming the pars nervosa of the posterior pituitary, where they are stored and released into the systemic circulation. The synthesis, control, and release of those hormones is co-regulated by hormonal, local and synaptic signals.[9] Neurohypophysial hormones include:
- Oxytocin
- Vasopressin
This is through this pathway that the vast majority of oxytocin and vasopressin hormones reach the systemic circulation.
Adrenomedullary hormones[edit]
Adrenomedullary hormones are catecholamines secreted from the adrenal medulla by chromaffin cells, neurosecretory cells connected to the central nervous system.[10] The synthesis, storage (in chromaffin cells) and release of catecholamines is co-regulated by synaptic input from their respective pre-synaptic sympathetic neurons, as well as hormonal and local inputs.[11][12] The adrenomedullary hormones are:
- Adrenaline
- Noradrenaline
- Dopamine
Enteric neurohormones[edit]
Enterochromaffin cells in the epithelia lining the lumen of the digestive tract secrete serotonin, while enterochromaffin-like cells at the stomach glands secrete histamine. Their synthesis, storage, and release of hormones is co-regulated by hormonal, local and nervous inputs.[13][14][15][16][17]
See also[edit]
- Natural neuroactive substance
References[edit]
- ^ Purves WK, Sadava D, Orians GH, Heller HC (2001). Life: The Science of Biology (6th ed.). Massachusetts: Sinauer Associates. p. 718. ISBN 978-0-7167-3873-2.
- ^ Nelson. 2005 An Introduction To Behavioral Endocrinology, Third Edition
- ^ Purves et al. p. 714.
- ^ Unsicker K, Huber K, Schütz G, Kalcheim C (Jun–Jul 2005). «The chromaffin cell and its development». Neurochemical Research. 30 (6–7): 921–5. doi:10.1007/s11064-005-6966-5. PMID 16187226.
- ^ Andrew A (June 1974). «Further evidence that enterochromaffin cells are not derived from the neural crest». Journal of Embryology and Experimental Morphology. 31 (3): 589–98. PMID 4448939.
- ^ Meites J, Sonntag WE (April 1981). «Hypothalamic hypophysiotropic hormones and neurotransmitter regulation: current views». Annual Review of Pharmacology and Toxicology. 21: 295–322. doi:10.1146/annurev.pa.21.040181.001455. PMID 6112966.
- ^ Nillni EA (April 2010). «Regulation of the hypothalamic thyrotropin releasing hormone (TRH) neuron by neuronal and peripheral inputs». Frontiers in Neuroendocrinology. 31 (2): 134–56. doi:10.1016/j.yfrne.2010.01.001. PMC 2849853. PMID 20074584.
- ^ Brown AG (2001). Nerve cells and nervous systems : an introduction to neuroscience. London: Springer. p. 200. ISBN 978-3-540-76090-0.
- ^ Burbach JP, Luckman SM, Murphy D, Gainer H (July 2001). «Gene regulation in the magnocellular hypothalamo-neurohypophysial system». Physiological Reviews. 81 (3): 1197–267. doi:10.1152/physrev.2001.81.3.1197. PMID 11427695.
- ^ Chung KF, Sicard F, Vukicevic V, Hermann A, Storch A, Huttner WB, Bornstein SR, Ehrhart-Bornstein M (October 2009). «Isolation of neural crest derived chromaffin progenitors from adult adrenal medulla». Stem Cells. 27 (10): 2602–13. doi:10.1002/stem.180. PMID 19609938.
- ^ Gasman S, Chasserot-Golaz S, Bader MF, Vitale N (October 2003). «Regulation of exocytosis in adrenal chromaffin cells: focus on ARF and Rho GTPases». Cellular Signalling. 15 (10): 893–9. doi:10.1016/S0898-6568(03)00052-4. PMID 12873702.
- ^ Bornstein SR, Ehrhart-Bornstein M (December 1992). «Ultrastructural evidence for a paracrine regulation of the rat adrenal cortex mediated by the local release of catecholamines from chromaffin cells». Endocrinology. 131 (6): 3126–8. doi:10.1210/endo.131.6.1446648. PMID 1446648.
- ^ Prinz C, Zanner R, Gerhard M, Mahr S, Neumayer N, Höhne-Zell B, Gratzl M (November 1999). «The mechanism of histamine secretion from gastric enterochromaffin-like cells». The American Journal of Physiology. 277 (5 Pt 1): C845-55. PMID 10564076.
- ^ Rhee SH, Pothoulakis C, Mayer EA (May 2009). «Principles and clinical implications of the brain-gut-enteric microbiota axis». Nature Reviews. Gastroenterology & Hepatology. 6 (5): 306–14. doi:10.1038/nrgastro.2009.35. PMC 3817714. PMID 19404271.
- ^ Haas HL, Sergeeva OA, Selbach O (July 2008). «Histamine in the nervous system». Physiological Reviews. 88 (3): 1183–241. doi:10.1152/physrev.00043.2007. PMID 18626069.
- ^ Rodriguez-Diaz R, Dando R, Jacques-Silva MC, Fachado A, Molina J, Abdulreda MH, Ricordi C, Roper SD, Berggren PO, Caicedo A (June 2011). «Alpha cells secrete acetylcholine as a non-neuronal paracrine signal priming beta cell function in humans». Nature Medicine. 17 (7): 888–92. doi:10.1038/nm.2371. PMC 3132226. PMID 21685896.
- ^ Sandor A, Kidd M, Lawton GP, Miu K, Tang LH, Modlin IM (April 1996). «Neurohormonal modulation of rat enterochromaffin-like cell histamine secretion». Gastroenterology. 110 (4): 1084–92. doi:10.1053/gast.1996.v110.pm8612997. PMID 8612997.
Эндокринная система вместе с нервной составляет единое целое. Объединяющим и координирующим центром нейроэндокринной системы является область промежуточного мозга — гипоталамус, который не только проводит нервные импульсы, но и секретирует различные физиологические вещества [1].
Гипоталамус расположен на основании мозга и ограничен спереди перекрестом зрительных нервов, сзади — маммилярными телами, по бокам — расходящимися трактами зрительных нервов. Сверху в гипоталамическую область внедряется третий желудочек мозга, превращая гипоталамус в парный орган с симметричным расположением клеточных образований. В основании гипоталамуса располагается срединное возвышение, переходящее в ножку гипофиза.
Эндокринные функции гипоталамуса осуществляют преимущественно его передняя и медиальная части. Нервные клетки гипоталамуса группируются в многочисленные ядра, часть которых обладает секреторными свойствами. Крупноклеточные ядра переднего гипоталамуса (супраоптические и паравентрикулярные) связаны нервными волокнами с задней долей гипофиза. Многочисленные ядра медиобазального и части заднего гипоталамуса, часть паравентрикулярных, вентромедиальные и аркуатные — продуцируют нейросекрет в систему воротных вен гипофиза. Многочисленные комиссуральные пути гипоталамуса обеспечивают взаимодействие между нейроэндокринными ядрами. Нервные клетки паравентрикулярных и аркуатных ядер имеют многочисленные контакты с вышележащими структурами ЦНС.
Роль гипоталамуса в регуляции эндокринных функций была выяснена в 1955 г. Гиллемин впервые показал, что гипоталамический экстракт при введении его животным стимулирует секрецию гипофизом АКТГ. В 60-х годах XX века интенсивно исследовали влияние экстрактов гипоталамуса и срединного возвышения на секрецию гипофизом гормона роста (соматотропин, СТГ) и тиреотропного гормона (тиреотропин, ТТГ). Благодаря достижениям аналитической химии пептидов, разработке радиоиммунологических методов определения гормонов, развитию техники культивирования клеток сделан революционный скачок в исследованиях гипоталамической регуляции функций эндокринной системы.
Наличие в гипоталамусе специфических рецепторов к периферическим гормонам эндокринных желез и тропным гипофизарным гормонам определяет его особое положение в системах обратной связи. В гипоталамусе происходит переключение информации с нервно-медиаторного на нейрогормональный путь, которой составляют либерины и статины: кортиколиберин (АКТГ-рилизинг гормон, КРГ), люлиберин (гонадолиберин, ЛГ/ФСГ-рилизинг-гормон, ГнРГ), тиролиберин (ТРГ), соматолиберин (РГГР), соматостатин, меланолиберин, а также дофамин (ДА) и энкефалины, оказывающие влияние на функции гипофиза.
Гипоталамус является высшим вегетативным центром, осуществляющим сложную интеграцию и различных внутренних систем. В организме нет ни одной функции, к регуляции которой гипоталамус не имел бы отношения: он играет существенную роль в поддержании оптимального уровня обмена веществ (белкового, углеводного, жирового, водного и минерального) и энергии, в регуляции температурного баланса организма, деятельности пищеварительной, сердечно-сосудистой, выделительной, дыхательной и эндокринной систем.
Нейроэндокринологи имеют полное право рассматривать гипоталамус как главный нейроэндокринный орган, который осуществляет взаимосвязь между ЦНС и железами внутренней секреции. Он является интегрирующим звеном, пультом управления, на котором замыкаются все пути между ЦНС и эндокринной системой. Естественно, возникает вопрос, каким образом маленькая структура промежуточного мозга справляется со столь многочисленными функциями.
Для эндокринологов, в первую очередь, важен вопрос о регуляции гормональной системы.
Связь между гипофизом, который является основным продуцентом всех тропных гормонов (АКТГ, ТТГ, ЛГ, ФСГ, СТГ, пролактин) и гипоталамусом осуществляется через портальную систему сосудов, а также через гипоталамо-гипофизарный тракт — самый короткий, но хорошо очерченный пучок аксонов нейронов гипоталамуса. Волокна их берут начало в супраоптическом и паравентрикулярных ядрах и проходят через гипофизарную ножку к нейрогипофизу.
Биохимиками было показано существование в гипоталамусе специфических веществ, которые синтезируются нервными клетками и освобождаются в капилляры портальной системы, достигая передней доли гипофиза. На сегодняшний день выделено и охарактеризовано более 10 гипоталамических нейрогормонов, каждый из которых обладает специфическим влиянием (стимуляцией или торможением) секреции того или иного тропного гормона гипофиза. Такие соединения получили название ингибирующих и рилизинг-гормонов (либерины и статины), обладающие высокой специфичностью действия и чрезвычайно высокой биологической активностью. Установлена и подтверждена химическим синтезом их структура.
Основной точкой приложения гипоталамических рилизинг-гормонов являются клетки гипофиза, и некоторое время считалось, что каждый гормон стимулирует один тип клеток аденогипофиза, который в свою очередь синтезирует лишь один тропный гормон.
В дальнейшем было показано, что в ряде случаев гипоталамические гормоны стимулируют секрецию нескольких гипофизарных гормонов. Например, ТРГ усиливает выделение и ТТГ, и ПРЛ. ГнРГ способствует секреции ЛГ и ФСГ; соматостатин угнетает секрецию и гормона роста, и ТТГ. Каждый клеточный элемент аденогипофиза подвергается действию многих регуляторных факторов, и клетки в аденогипофизе не строго специализированы: в одной клетке могут синтезироваться несколько гормонов, например ЛГ и ФСГ, АКТГ и β-липотропин, СТГ и ПРЛ, но не ТТГ или ЛГ. Бифункциональность некоторых гормонов объясняется по-разному. Способность ГнРГ вызывать секрецию как ЛГ, так и ФСГ, причем несовпадающую по времени, определяется разной чувствительностью гонадотрофов, секретирующих ЛГ или ФСГ, а также длительностью воздействия с учетом влияния половых стероидов на гипофизарные клетки в разные стадии полового цикла. Большие концентрации эстрогенов в плазме, предшествующие овуляторному выбросу ЛГ, увеличивают чувствительность гипофиза к ГнРГ, а минимальные количества эстрогенов и прогестерона, секретируемого после овуляции, напротив, снижают эту чувствительность. Секреция ФСГ более чувствительна к ингибирующему эффекту эстрогенов. Нельзя исключить наличие в аденогипофизе и двух видов рецепторов. Одни из них характеризуются высоким сродством к ГнРГ и низкой связывающей способностью; за их счет осуществляется быстрая секреция ЛГ; вторые — более низким сродством к ГнРГ, но большей силой связывания, что и определяет более медленное освобождение ФСГ. Возможно существование двух различных нейрогормонов — ЛГ-РГ и ФСГ-РГ.
Анатомия и физиология гипофиза
Гипофиз расположен в турецком седле в основании черепа. Сверху он отделен от мозга выростом твердой мозговой оболочки. Гипофиз состоит из трех долей: передней, задней и средней (промежуточной). Последняя, как правило, анатомически не обособлена и вместе с передней входит в состав аденогипофиза, который составляет около 80% массы железы; задняя доля — нейрогипофиз — анатомически и функционально объединена со срединным возвышением, являющимся частью гипоталамуса. Аденогипофиз образуется из задней стенки ротовой полости зародыша (карман Ратке), задняя доля — из дивертикула дна третьего желудочка мозга.
Структурно-функциональная связь гипофиза с гипоталамусом осуществляется нервным и гуморальным путем. Нервные волокна из крупноклеточных гипофизотропных ядер гипоталамуса (паравентрикулярного и супраоптического) через срединное возвышение и ножку гипофиза достигают задней его доли. По аксонам этих клеточных ядер в заднюю долю гипофиза поступают окситоцин и вазопрессин. На стенках капилляров срединного возвышения оканчиваются терминали пептидергических волокон. Аксоны гипоталамических нейронов, идущие к аденогипофизу, прерываются на уровне срединного возвышения, где и происходит секреция гипоталамических статинов и либеринов.
Нейрогормоны попадают в переднюю долю гипофиза с кровотоком по системе воротных вен гипофиза. Стенки каппиляров, образуемых ветвями верхних гипофизарных артерий в срединном возвышении, проницаемы для рилизинг-гормонов. Концентрация последних в крови воротных вен гипофиза во много раз выше, чем в периферической крови.
Кровоток через переднюю долю гипофиза значительнее, чем через любой другой орган, что, наряду с высоким содержанием нейрогормонов в крови сосудов гипофиза, создает оптимальные условия для регуляции функций аденогипофиза и зависимых от него эндокринных желез. Задняя доля гипофиза снабжается кровью нижних гипофизарных артерий.
Являясь анатомически целостным органом, гипофиз образован двумя онтогенетически разными образованиями: передним (железистым) и задним (нервным). Клетки аденогипофиза разделяются по своей гистологической окраске на базофилы, ацидофилы (эозинофилы), хромофобы. Однако выявление специализированных клеток—лактотрофов, тиреотрофов, соматотрофов, кортикотрофов, гонадотрофов, продуцирующих соответствующие гормоны, осуществляется иммуноцитохимическим методом, выявляющим специализацию клеток с помощью высокоспецифических антител к конкретному гормону. Большую часть популяции аденогипофизоцитов составляют лактотрофы и соматотрофы. Обнаруживаются и камбиальные элементы, способные при необходимости дифференцироваться в те или иные специализированные клетки.
Гипофиз как центральный орган эндокринной системы получает афферентную и эфферентную информацию. Из срединного возвышения по сосудам портальной системы в аденогипофиз поступает кровь, содержащая гипоталамические нейрогормоны. К гипофизу поступает также большое количество гормонов периферических эндокринных желез и биологически активных метаболитов. Переработка этой информации позволяет гипофизу осуществлять тонкую интегральную функцию и посылать периферическим эндокринным железам адекватные, строго дозированные регуляторные сигналы путем выделения в кровь тропных гормонов. Периферические эндокринные железы, реагируя на тропные гормоны гипофиза, секретируют в кровь собственные гормоны, регулирующие биохимические процессы в тканях-мишенях. Циркулирующие в крови гормоны и биологически активные метаболиты контактируют со всеми структурами нейроэндокринной системы: ЦНС, гипоталамусом, гипофизом, другими железами внутренней секреции, клетками АПУД-системы (которые присутствуют в различных органах и тканях и продуцируют полипептидные гормоны за счет поглощения и декарбоксилирования предшественников аминов).
Главным в механизме действия гипоталамических гормонов является их избирательное взаимодействие с рецепторами, локализованными на плазматических мембранах аденогипофизарных клеток; конформационные изменения гормон-рецепторных комплексов приводят к изменению активности ферментных систем клеточных мембран. Посредником в дальнейшей передаче гормонального сигнала, направленного на секрецию и синтез аденогипофизарных гормонов, является цАМФ, которым активирует цАМФ-зависимую протеинкиназу. Изменение проницаемости плазматических мембран, происходящее под влиянием рилизинг-гормонов, способствует проникновению в клетку экзогенного Са2+, необходимого для секреции тропных гормонов.
Вопрос и о локализации биосинтеза гипоталамических гормонов окончательно не решен. Имеются данные об их образовании в нервных окончаниях — синаптосомах, так как именно в них обнаруживается скопление этих гормонов и биогенных аминов. В настоящее время биогенным аминам отводится главная роль в регуляции секреции и синтеза гипоталамических гормонов. В гипоталамусе присутствуют специфические рецепторы гормонов и периферических аминорецепторов.
Воспринимая регуляторные сигналы сверху, железа ускоряет или тормозит выделение собственного гормона и, более того, она получает информацию о результатах действия ее гормонов на периферии. Механизм такой организации эндокринной железы, называемой в литературе принципом обратной связи (положительной и отрицательной), был впервые сформулирован М.М. Завадовским (1935). Он обеспечивает надежность работы нейроэндокринной системы в организме. Классическим примером может служить функционирование щитовидной железы, когда ТТГ стимулирует секрецию тиреоидных гормонов, которые в свою очередь, достигнув высоких концентраций в крови, тормозят секрецию гипофизом ТТГ. Обратная связь реализуется на четырех уровнях (ЦНС, гипоталамус, гипофиз, сама железа), и в ней различают длинные, короткие и ультракороткие звенья. Эндокринные регуляторы — гормоны дистантного действия — достигают своих целевых объектов с кровотоком.
Концентрация и ритм секреции гормонов определяют направленность действия и точку приложения в организме. Так, эстрогены, стимулируя секрецию пролактина гипофизом, увеличивают выделение ДА гипоталамусом, что приводит к торможению лактотропной функции гипофиза. На телах нейронов, синтезирующих ДА, обнаружены рецепторы эстрадиола. В этом процессе участвуют и метаболические регуляторы, такие как глюкоза [10].
В одной и той же железе имеется возможность обмена химической информацией между клетками, в которой принимают участие и гормоны. Показано, в частности, наличие рецепторов инсулина на альфа-клетках, секретирующих глюкогон (паракринная регуляция). Биологически активные вещества, в том числе гормоны, могут выделяться и связываться рецепторами той же клетки (аутокринная регуляция).
Чувствительность тканей к конкретному гормону определяется количеством специфических рецепторов, связывающих этот гормон. Высокие концентрации гормона, связывая большую часть рецепторов, снижают их биосинтез и уровень активных форм рецепторов, что предохраняет клетки-мишени от чрезмерного гормонального воздействия. Возможна и ситуация, когда гормон увеличивает концентрации собственных рецепторов.
Гормон может влиять не только на свои рецепторы, но и на рецепторы других гормонов. Так, ПРЛ стимулирует образование рецепторов ЛГ и ФСГ в гонадах, тиреоидные гормоны влияют на уровень эстрогенных и катехоламиновых рецепторов и т.д. Обратная связь реализуется довольно быстро, что обеспечивает постоянный относительный гомеостаз в организме; замедление или ускорение этого процесса свидетельствует о развитии патологического процесса.
Нарушения гормональной рецепции ведут к развитию патологического процесса (например, инсулинорезистентность при ожирении и сахарном диабете 2-го типа).
В срединном возвышении обнаружены многочисленные синаптические и аксональные контакты нейронов, вырабатывающих нейропептиды, а также анастомозы между капиллярами сосудов, идущими к аденогипофизу и нейрогипофизу, что и обеспечивает тесное взаимодействие различных эндокринных подсистем (гипоталамус—гипофиз—кора надпочечников, гипоталамус—гипофиз—щитовидная железа, гипоталамус—гипофиз—гонады и др.).
Главным достижением нейроэндокринологии последних лет является доказательство причастности нейромедиаторов к нейроэндокринной интеграции действия нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. К ним относятся норадреналин (НА), адреналин (А), ДА, серотонин, гистамин, гамма-аминомасляная кислота (ГАМК), ацетилхолин, соматостатин, ТРГ, КРГ, соматолиберин и многие другие соединения. Все эти вещества несут нейрогенную информацию, необходимую для нормального функционирования нейросекреторных нейронов, регулирующих секрецию тропных гормонов гипофиза. Прежде всего это люлиберинпродуцирующие нейроны, регулирующие выделение ЛГ и ФСГ, нейроны, секретирующие пролактинингибирующий гормон, ТРГ, вазоактивный интестинальный полипептид, а также ДА. Полное понимание нейроэндокринного контроля требует точного знания топографии нейросекреторных и обычных проводниковых нейронов. Необходимо определить главные проекции нейронов и идентифицировать нейромедиаторы, содержащиеся в них. Обнаружены синапсы между норадренергическими нейронами и ГАМК-содержащими нейронами в этой области. Следует отметить также возможность несинаптического взаимодействия катехолсодержащих нейронов в ЦНС.
Дофаминергические нейроны, иннервирующие гипоталамус, имеют клеточные тела в трех областях мозга: во-первых, это тубероинфундибулярные нейроны, которые составляют 3—5% клеточных тел нейронов аркуатной области и обозначаются как А12. Терминали этих нейронов обнаружены в срединном возвышении в тесном контакте с первичными капиллярами гипофизарного портального сплетения. Эти нейроны выделяют большое количество ДА в портальную кровь и играют ведущую роль в регуляции секреции ПРЛ, а также ГнРГ. Две другие группы дофаминергических нейронов расположены в каудальном таламусе, заднем гипоталамусе и перивентрикулярных ядрах. Диффузное распределение дофаминергических нейронов в гипоталамусе затрудняет изучение их роли в регуляции секреции гонадотропинов и других тропных гормонов.
Изложение контрольных функций адренергических нейронов в секреции гонадотропинов целесообразно начать с их роли в регуляции пульсирующего выделения ЛГ, которая определяется квантовым выделением ГнРГ. Большинство исследователей, занимающихся этой проблемой, приходят к выводу, что норадренергические нейроны в физиологических условиях включаются в этот процесс, хотя на отдельных нейронах обнаружены адренергические рецепторы, активация которых вызывает торможение пульсирующего выделения ЛГ. Направленность действия ДА-нейронов зависит, скорее всего, от уровня половых гормонов.
При изучении роли биогенных аминов в регуляции овуляторного выброса гонадотропинов особое внимание обращается на значение половых гормонов в активации или торможении катехолсодержащих нейронов в системе обратной связи. На модели овариэктомированных крыс с имплантацией эстрадиола показано, что выброс ЛГ каждые 24 ч сопровождается увеличением скорости обмена НА в преоптической и аркуатной областях и супрахиазматических ядрах, а также срединном возвышении. Аналогичные данные получены и в опытах на интактных животных, у которых отмечено увеличение скорости обмена НА в преоптической области во 2-й половине проэструса, т.е. во время овуляторного выброса ЛГ, тогда как в другие стадии цикла подобных изменений в обмене НА в этой области не зарегистрировано. О негативном действии эстрадиола на обмен НА свидетельствуют эксперименты на овариэктомированных животных, у которых скорость обмена НА в преоптической области увеличивалась через 3 сут, а введение эстрадиола приводило к снижению скорости его обмена в этой области и срединном возвышении уже через 3 ч. Действие эстрогенов на обмен НА может осуществляться как непосредственно на уровне норадренергических нейронов, содержащих эстрогенные рецепторы, так и через опиоидные или ГАМК-содержащие интернейроны, которые также содержат рецепторы стероидных гормонов. Скорость обмена адреналина в некоторых областях гипоталамуса также увеличивается одновременно с овуляторным выбросом ЛГ. Это касается, главным образом, медиобазального гипоталамуса и преоптической области. Возникает вопрос о степени сродства адренергических рецепторов нейронов к половым гормонам в ходе менструального цикла.
Влияние половых гормонов на активность дофаминергических нейронов проявляется менее отчетливо. Дело в том, что изменение состояния тубероинфундибулярных дофамин-содержащих нейронов теснее связано с секрецией ПРЛ. Введение эстрогенов повышает уровень ПРЛ, который в свою очередь усиливает обмен ДА в этих нейронах. Показано также наличие рецепторов к эстрадиолу в дофаминергических клеточных телах нейронов аркуатного ядра и повышение скорости обмена ДА в этом ядре и срединном возвышении во второй половине стадии проэструса. В преоптической области изменения дофаминергической активности в это время не наблюдается. Овариэктомия незначительно влияет на обмен ДА в некоторых областях гипоталамуса, тогда как введение эстрадиола вызывает снижение обмена ДА в преоптической области и срединном возвышении и увеличение в медиобазальном гипоталамусе.
Имеется ряд сообщений о влиянии катехоламинергических агентов на овуляторный выброс ЛГ в проэструсе и вызванный эстрогенами выброс ЛГ. Начало этим исследованиям было положено в 1950 г. Сойером, который показал, что α-адренергические антагонисты блокируют овуляцию у крыс. В дальнейшем были исследованы более специфические фармакологические агенты, такие как α-метил-р-тирозин и диэтилдитиокарбомат, блокирующие синтез НА и А соответственно. Они тормозили овуляторный выброс ЛГ. Блокада α-адренергических рецепторов также прерывает овуляцию, причем наиболее эффективным является препарат празозин, избирательно блокирующий подтип α1-рецепторов, тогда как блокада другого подтипа рецепторов (α2) пипероксаном неэффективна.
Приведенные данные позволяют утверждать, что норадренергические и адренергические нейроны включаются в стимуляцию овуляторного выброса ЛГ, и действие их опосредуется через α1-адренергические рецепторы, локализованные в основном в медиобазальной преоптической области гипоталамуса. Роль дофаминсодержащих нейронов в регуляции овуляторного выброса ЛГ спорна: введение относительно специфического антагониста ДА пимозина в утренние часы проэструса снижало выброс ЛГ у крыс во второй половине дня. Этот же препарат, введенный женщинам за 2 ч до ожидаемого выброса ЛГ в середине менструального цикла, снижает величину выброса. В другом случае внутрижелудочковое введение ДА в проэструсе у крыс способствует увеличению уровня ЛГ в крови. Исследования in vitro также дают спорные результаты. Так, перфузия ДА фрагментов медиобазального гипоталамуса самцов крыс увеличивает выделение ГнРГ, которое блокируется введением антагониста α-адренергических рецепторов (фентоламина), но не антагониста ДА (пимозина). ДА обладает способностью ускорять выделение НА из терминалей срединного возвышения, но не влияет на обратный захват и обмен НА. Противоречивые данные затрудняют интерпретацию роли и значения ДА в решении системы ГнРГ—ЛГ.
Серотонинергическая система ЦНС представляет собой популяцию нейронов ствола мозга, которые берут начало в ядрах шва среднего мозга. Аркуатные ядра получают плотную серотонинергическую иннервацию, тесно контактирующую с дофаминергическими клеточными телами аркуатного ядра и медиальной зоны инсепта. Описаны контакты между нейрональными элементами, содержащими ГнРГ и серотонин, в преоптической области, концевой пластинке и срединном возвышении. Серотонин обнаружен в нервных окончаниях, локализованных вокруг больших кровеносных сосудов аденогипофиза, а также в секреторных гранулах гонадотрофов. Причастность серотонина к регуляции гонадотропной функции гипофиза доказана многочисленными исследованиями. Он может как стимулировать, так и тормозить эту функцию в зависимости от гормонального фона. Действие серотонина на секрецию ЛГ и овуляцию опосредовано регуляцией секреции ГнРГ нейросекреторными нейронами. Серотонинергическая система является одной из многих нейросекреторных систем, тесно связанных с гонадотропинрегулирующей системой преоптикопереднего и медиобазального отделов гипоталамуса и срединного возвышения. Половые гормоны модулируют активность этой нейротрансмиттерной системы. Анализ роли нейромедиаторов адренергического ряда в регуляции гонадотропной функции гипофиза позволяет утверждать, что НА следует рассматривать в качестве ведущего агента в регуляции секреции ЛГ, основной точкой приложения которого является преоптическая область. ДА реализует свой эффект через аркуатную область гипоталамуса, а серотонин играет роль синхронизирующего агента.
Новый класс соединений, выделяемых в группу пептидных нейромедиаторов, вносит свой вклад в наши представления об участии нервной системы в регуляции эндокринных функций гипофиза. Обнаружение регуляторных пептидов, общих как для нервной, так и для эндокринной систем, вызвало революцию в наших представлениях. Возникло новое направление исследований — психонейроэндокринология.
Практически каждый из перечисленных выше нейропептидов причастен к регуляции секреции гонадотропинов, ПРА, АКТГ, ТТГ. Большинство из них обнаружено в медиобазальном гипоталамусе. Нейропептиды, выделяясь в гипофизарную портальную систему, действуют на несколько типов аденогипофизарных клеток и, кроме того, взаимодействуют с многими нейромедиаторами непептидной природы, поступающими в медиобазальный гипоталамус из других структур, что в свою очередь обеспечивает их прямое или опосредованное действие на гормональный контроль.
Гипоталамические нейроны, продуцирующие нейропептиды, составляют общую систему. Большинство их клеточных тел локализовано в паравентрикулярных ядрах, медиальной перивентрикулярной области и аркуатных ядрах. Незначительная часть таких нейронов обнаружена в преоптической области и супрахиазматических ядрах. Бóльшая часть всех этих нейронов заканчивается в области срединного возвышения. Аксональные коллатерали иннервируют ряд гипоталамических и экстрагипоталамических структур. Нервные клетки паравентрикулярных и аркуатных ядер в свою очередь имеют многочисленные контакты с большим числом других структур ЦНС, что и определяет их стратегическую позицию в координации гормональной регуляции, а также ряда поведенческих реакций. Особенно это касается полового поведения, требующего синхронизации поведенческих компонентов с процессами менструального цикла. Окончания нейронов, синтезирующих нейропептиды, тесно контактируют не только с перикарионами, вырабатывающими нейротрансмиттеры, но и с нейронами, синтезирующими нейропептиды. Например, ГнРГ-продуцирующие нейроны и их волокна могут оканчиваться на аналогичных клеточных телах; имеют место также аксо-аксональные контакты.
Учитывая большое число нейропептидов, принимающих участие в регуляции репродуктивной системы, целесообразно сгруппировать их по месту синтеза. Такими группами могут быть: 1) нейропептиды, продуцируемые нейронами, локализованными, главным образом, в преоптической области (соматостатин, ГнРГ, тахикинины, нейротензин, предсердный натрийуретический гормон); 2) нейропептиды, продуцируемые нейронами аркуатной области (панкреатический нейропептид, пептид YY, нейропептид Y); 3) нейропептиды, синтезирующиеся в перикарионах паравентрикулярных или супраоптических ядер (ТРГ, КРГ, холецистокинин, вазопрессин, окситоцин, ангиотензин, брадикинин, бомбезин); 4) гастроинтестинальные пептиды (ВИП, гастроинтестинальный пептид); 5) семейство опиоидных пептидов.
Механизм действия этих нейропептидов как на гипоталамическом, так и на гипофизарном уровне можно проследить на примере модуляции секреции гонадотропинов, ПРЛ, окситоцина, т.е. тех гормонов, которые имеют отношение к репродуктивной функции. Например, соматостатин, который обнаружен во многих структурах ЦНС и главным действием которого является угнетение продукции гормона роста и частично ТТГ и ПРЛ, способен изменять активность нейромедиаторных систем мозга, вызывая блокаду секреции ГнРГ.
Группа классических пептидов (тахикинины А и Б, субстанция Р) стимулирует выделение ПРЛ и тормозит выделение гормона роста. Пептид нейротензин широко распространен в ЦНС и проявляет свой эффект за счет стимуляции секреции инсулина, ингибиции секреции глюкагона и модуляции гастроинтестинальной перистальтики. Внутрижелудочковое введение нейротензина снижает уровень ЛГ в крови, что делает возможным его участие в контроле гонадотропной функции гипофиза. Предсердный натрийуретический гормон угнетает выделение вазопрессина и может стимулировать выделение ЛГ и пролонгировать действие ГнРГ. Семейство панкреатических пептидов также причастно к функционированию репродуктивной системы, они чаще всего блокируют секрецию ЛГ и снижают частоту пульсации ГнРГ в срединном возвышении.
Пептиды, синтезирующиеся в паравентрикулярных и супрахиазматических ядрах, основными из которых являются вазопрессин и окситоцин, наиболее активно влияют на репродуктивную систему. Основная гормональная функция вазопрессина на уровне аденогипофиза — стимуляция выделения АКТГ за счет усиления действия КРГ. Имеются данные о тормозном влиянии вазопрессина на секрецию ПРЛ за счет повышения обмена ДА в тубероинфундибулярных нейронах. Стимулирующий эффект вазопрессина на выделение ПРЛ может опосредоваться опиатными нейронами. ТРГ, синтезирующийся в паравентрикулярных ядрах, помимо своего прямого действия на секрецию ТТГ, способен стимулировать выделение ПРЛ и гормона роста, и его эффект усиливается под влиянием эстрогенов. ТРГ также оказывает влияние на обмен нейромедиаторов в мозге. Из группы гастроинтестинальных пептидов следует выделить вазоактивный интестинальный полипептид (ВИП), основное нейроэндокринное действие которого сводится к стимуляции выделения ПРЛ, а также гормона роста и ТТГ. Этот эффект является эстрогензависимым.
Особое внимание в регуляции гонадотропной функции гипофиза в последние годы уделяется опиоидным пептидам. Главным действием опиоидов является их способность повышать выделение ПРЛ и гормона роста и блокировать секрецию ЛГ, ФСГ и ТТГ. Они специфически ингибируют овуляторный выброс ЛГ и ФСГ. Опиаты способны регулировать амплитуду и частоту пульсации ЛГ за счет модуляции гипоталамического пейсмекера, контролирующего периодичность активации ГнРГ-продуцирующих нейронов. Влияние опиатов на секрецию ЛГ опосредовано повышением секреции ПРЛ. Опиаты блокируют тоническую секрецию ГнРГ на фоне высокого уровня ПРЛ. Регуляция процессов биосинтеза и секреции ПРЛ, как и ЛГ, опиоидными пептидами осуществляется через специфические рецепторы.
Приведенные выше данные о влиянии различных нейромедиаторов адренергической природы и нейропептидов ставят вопрос о том, каким образом разные вещества с различными механизмами действия координируют работу репродуктивной системы. В ряде случаев отмечен синергизм их действия как на гипоталамическом, так и на гипофизарном уровне, в других — антагонизм их влияния. Можно отметить параллелизм в действии различных медиаторов, вырабатываемых в одних и тех же структурах. В настоящее время наблюдается быстрый прогресс в изучении химии и нейроанатомии нейросекреторных нейронов, участвующих в регуляции репродуктивной функции.
В настоящее время цельное представление о функционировании гипоталамо-гипофизарной системы распалось на отдельные направления исследований с использованием новых специфических методических приемов. Интенсивно используются достижения смежных дисциплин, таких как иммунология. Показана тесная взаимосвязь нейроэндокринной и иммунной систем в различные периоды жизни и при различных физиологических состояниях. Например, с возрастом снижается реакция иммунной системы и параллельно снижается активность гормона роста. При беременности снижается секреция пролактина и окситоцина и повышается секреция половых гормонов — эстрогенов, прогестерона. Доказана взаимосвязь нервной, иммунной и эндокринной систем регуляции секреции инсулина. Разработка фундаментальных аспектов нейроэндокринологии открывает широкие перспективы лечения нарушений репродуктивной системы, заболеваний щитовидной железы или надпочечников гормональными средствами или препаратами, обладающими нейрогенными свойствами. Такими препаратами могут быть производные нейромедиаторов адренергической, холинергической природы, а также нейропептиды.
Начиная с конца 50-х годов прошлого столетия внимание исследователей всего мира все больше стало привлекать изучение воздействия гормональных факторов на функцию головного мозга. В результате многочисленных исследований родилась новая наука — психонейроэндокринология. Ее задачами является изучение вопросов, связанных с влиянием гормонов на высшие функции мозга, — от молекулярного уровня до различных сторон психической деятельности.
Проблема воздействия гормональных факторов на высшие интегративные функции мозга чрезвычайно сложна как по существу, так и в силу отсутствия объективной модели, отражающей зависимость между уровнем гормонов в организме и его влиянием на когнитивные функции.
Показано, что гормоны, взаимодействуя с нейромедиаторами, образуют на уровне ЦНС единую координирующую нейрогуморальную систему, контролирующую интегративную деятельность головного мозга. Нарушение биосинтеза или обмена нейромедиаторов, нарушения их взаимодействия с соответствующими рецепторами могут играть патогенетическую роль в развитии ряда нервно-психических состояний. Сложились устойчивые представления о том, что функция гормонов в ЦНС связана с контролем экспресии гормонзависимых генов и регуляции таких процессов, как развитие и старение мозга, регенерация, адаптация, память.
Различают геномный и негеномный механизм действия гормонов. Полипептидные гормоны действуют на специфические рецепторные зоны мембраны клетки. Связывание лиганда поверхностными рецепторами клетки индуцирует внутриклеточный сигнал (цАМФ и/или кальций) и приводит к быстрому результату (активации остеокластов, секреции кортизола и т.п.). Трансдукция сигнала полипептидных гормонов может вовлекать фосфатидилиновый путь или фосфорилирование рецепторов.
Стероидные и тиреоидные гормоны проявляют свое действие главным образом через специфические внутричерепные связывающие белки, которые взаимодействуют с элементами генов клеток-мишеней, что сопровождается изменением транскрипции специфических генов.
Гипофиз — главный регулятор функционирования эндокринных желез
В аденогипофизе секретируются следующие гормоны: ТТГ, АКТГ, ЛГ и ФСГ, которые оказывают стимулирующее влияние соответственно на клетки щитовидной железы, коры надпочечников и половые железы. Попадая в кровь, гормоны периферических желез активизируют деятельность всех органов и тканей организма, в том числе и аденогипофиза. Осуществляя обратную связь, они блокируют избыточное поступление тропных гормонов гипофиза. Наступает равновесие между мутацией гормонов гипофиза и потребностью организма в гормонах периферических желез. Несколько иной результат наблюдается в отношении ПРА и гормона роста, не имеющих специализированного целевого органа, секреция которого оказывала бы тормозной эффект на выделение этих гормонов. Помимо блокирующего эффекта гормонов периферических желез на синтез и секрецию тропных гормонов гипофиза, аналогичным эффектом обладают также ингибиторные факторы гипоталамического происхождения.
Синдромы эндокринной недостаточности, обусловленные полным или частичным выпадением функций передней и задней долей гипофиза, обозначаются как гипопитуаризм. Гипофункция гипофиза может быть следствием поражения самого гипофиза или гипоталамуса. Результат один — сниженная секреция гипофизарных гормонов с последующим дефицитом гормонов периферических желез.
Уровень гормона роста в крови в норме очень низок, но увеличивается при физической нагрузке, во время сна и при стрессе. Наиболее надежные стимулирующие тесты для данного гормона — индуцированная инсулином гипогликемия, инфузия аргинина или введение L-допа. Эти тесты сопровождаются увеличением секреции гипоталамического соматолиберина.
Секреция пролактина у здоровых людей обычно низкая в течение дня, увеличивается во сне, при стрессе и родах. В клинике используют провоцирующий тест с внутривенным введением ТРГ
На рубеже 2 столетий сформировалась новая область знаний — нейроиммуноэндокринология. Чтобы получить о ней представление, полезно вспомнить, как она формировалась, в частности как развивались представления о взаимодействиях основных регулирующих систем — нервной, эндокринной и иммунной. История развития этих представлений примечательна и в известной мере драматична. Ее отсчет начинается с того времени, когда появились факты, свидетельствовавшие о способности отдельных нейронов мозга секретировать гормоны, что сближало их с клетками эндокринных желез. Эти факты не укладывались в традиционные представления и поначалу сильно озадачивали.
Сложившаяся в нейробиологии логика исследовательского мышления не могла мириться с тем, что нервные клетки, характерным свойством которых является способность их электрогенных мембран генерировать и распространять нервные импульсы, могут одновременно вести себя как эндокринные железистые клетки, т. е. синтезировать нейрогормоны и транспортировать их по нервным отросткам. Такое двуединство нейрона, его способность функционировать одновременно как нервная и эндокринная клетка, были впервые описаны в гипоталамических нейронах у рыб [78], которые соответствовали крупным нейронам супраоптического и паравентрикулярного ядер млекопитающих, синтезирующим вазопрессин и окситоцин [14]. Этот факт был подтвержден в широком эволюционном ряду, включающем моллюсков и насекомых [9, 79, 80].
Более поздние наблюдения показали способность к нейросекреции также в тех нейронах гипоталамуса, аксоны которых оканчиваются на капиллярных корнях портальных сосудов гипофиза, приносящих кровь в его переднюю долю [1]. Предполагалось, что гипоталамические нейроны, контролирующие секрецию тропных гормонов гипофиза, выделяют в его портальное русло некие нейрогуморы, которые опосредуют их регулирующие влияния [42]. Нейрогуморами оказались пептидные гормоны, выделенные из этих гипоталамических нейронов, которые в зависимости от* их способности стимулировать или тормозить продукцию гормонов гипофиза получили название рилизинг-факторов, или ингибирующий факторов [67, 77]. В дальнейшем было показано, что нейросекреторные клетки гипоталамуса вовлечены в механизмы обратных связей с циркулирующими гормонами эндокринных желез и одновременно способны отвечать на нервные сигналы, опосредуемые через их синоптические связи [88]. Таким образом, двуединство гипоталамических нейронов перестало быть загадочным явлением. Более того, оно стало краеугольным камнем, который лег в основу рождения новой области знаний — нейроэндокринологии, получившей статус самостоятельной дисциплины, имеющей свой международный журнал и свое международное научное общество [2].
Между тем удивительные факты продолжали накапливаться. Было показано, что способность нейронов секретировать пептидные гормоны присуща не только гипоталамической области мозга, но практически всей центральной и периферической нервной системе [48, 87]. Оказалось, что контуры обратных связей с циркулирующими гормонами могут замыкаться не только на гипоталамических нейронах, но и на нейронах периферических вегетативных ганглиев, в связи с чем понятие нейроэндокринного центра стало распространяться также и на них [8].
В недавнее время фокус удивительных открытий сместился в область иммунологии. Иммунную систему в свете накопленных фактов стали рассматривать как некий сенсорный орган [19], способный экспрессировать рецепторы ко всем сигнальным молекулам, опосредующим воздействия нейроэндокринной системы: нейротрансмиттерам, пептидным гормонам, стероидным гормонам, факторам роста, цитокинам [44, 45, 59, 69, 94].
Существенная роль среди сигнальных молекул иммунной системы (на этом подробнее мы остановимся ниже) принадлежит семейству эволюционно консервативных пептидов. В их ряду заслуживают упоминания такие пептиды, как гормон роста (ГР) и пролактин (ПРЛ), рецепторы которых относятся к большому семейству гемопоэтиновых: рецепторов к интерлейкинам, эритропоэтину, к гранулоцитарно-макрофагальному колониеобразуещему фактору [53]. Активность ГР снижается с возрастом параллельно со снижением реакций иммунной защиты. Сходным образом при физиологических состояниях, сопровождающихся угнетением иммунной системы, например при беременности, снижается секреция ПРЛ. При этом имеет место повышенная секреция половых стероидов эстрогенов, прогестерона. После родов, когда снижается секреция стероидных гормонов и вновь активируется иммунная система, повышается секреция ПРЛ и окситоцина, который, как уже упоминалось, тоже принадлежит к эволюционно древним пептидам [36, 43]. Связь иммун-
Хромосома 6
Главный комплекс
тканесовместимости
КлассИ к______
О )У) >) >) )<)
Серологически иоенгисрици- I рованные Г молекулы HLA
Z2/77 DRw52
| T)Rw53
DR1Q
Гены главного комплекса гистосовместимости человека, локализованные на коротком плече хромосомы 6.
Экспрессируемые нами HLA-антигены подразделяются на класс I (А, В, С) и класс II (D). Гены, экспрессирующие HLA-антигены класса II, распределяются в 3 локусах: DP, DQ, DR. Кодируемые ими молекулы HLA-антигенов состоят из 2 поли- пептидных цепей А и В | I0J.
ной активности с гормональными производными других представителей эволюционно консервативных пептидов прослеживается также на примере опиоидных гормонов и адренокортикотропного гормона (АКТГ), которые являются фрагментами единого предшественника — проопиомеланокор- тина. В сущности тесные взаимодействия АКТГ с иммунной системой впервые дали начало исследованиям взаимодействий между основными регулирующими системами — нейроэндокринной и иммунной. Приоритет в этом принадлежит Гансу Селье. Итогом редких по прозорливости наблюдений этого ученого явилась концепция об общем адаптационном синдроме, в основе которой лежит идея о нейроэндокринном пути реализации защитной биологической реакции, названной им реакцией-стресс, развивающейся в ответ на действие широкого спектра агрессивных агентов внешней среды, нарушающих гомеостаз, таких как микробные, холодовые, болевые агенты, факторы неподвижности, эмоциональные воздействия и многие другие [83]. При всех этих воздействиях повышается секреция АКТГ и глюкокортикоидных гормонов и угнетается активность иммунной системы, что при сильном стрессе сопровождается инволюцией тимуса. Селье не мог ответить на вопрос, почему угнетается иммунная система. Механизмы последнего стали проясняться лишь в последнее время [3, 4, 6, 30, 55]. Прежде чем перейти к ним, уместно дать общее представление о принципах, лежащих в основе организации иммунной системы и иммунных ответов.
При их рассмотрении обращает на себя внимание сходство в организации нервной и иммунной систем. Последнее проявляется в том, что обе системы состоят из большого числа фенотипически различающихся клеток, организованных в сложные сети [26, 49, 50, 70]. В пределах такой сети отдельные клетки взаимосвязаны и функционируют по принципу обратной связи, когда пусковым сигналом служит адекватный раздражитель, а конечный ответ направлен на обеспечение полезного результата. Различие же заключается в том, что в нервной системе клетки жестко фиксированы в пространстве, тогда как в иммунной они непрерывно перемещаются и лишь кратковременно взаимодействуют друг с другом. Чтобы лучше понять сказанное, напомним, как осуществляется иммунный ответ, в процессе которого представляется возможность проследить тесные взаимодействия регулирующих систем.
Клетки иммунной системы, представленные лимфоцитами и макрофагами, происходят из общего источника — стволовых клеток костного мозга. По мере развития они дифференцируются на 2 группы клеток: предшественники В- и Т-лимфоцитов и клетки (предшественники моноцитов), из которых развиваются макрофаги. Название В-лимфоцитов происходит от английского слова bone marrow (костный мозг), а учитывается также и то, что у птиц они развиваются из кишечного кармана, или бурсы Фабрициуса. Функция В-лимфоцитов заключается в выработке антител, что определяет их участие в гуморальном иммунитете. Что касается Т-лимфоцитов, то их название и функции, в основе которых лежит организация клеточного иммунитета, тесно связаны с тимусом [31]. На ранней стадии развития часть незрелых лимфоцитов попадает в тимус, где пре- Т-лимфоциты проходят, образно выражаясь, курс обучения, в результате чего они дифференцируются на целый ряд функционально различающихся типов клеток: клетки, помогающие В-лимфо- цитам в реализации гуморального иммунитета, а Т-лимфоцитам — в реализации клеточного иммунитета (так называемые Т-хелперы); клетки-тор- мозящие по механизму обратной связи избыточную активность Т-хелперов (так называемые Т- супрессоры); наконец, клетки, способные уничтожать зараженные (вирусом, бактерией) или трансформированные в опухолевые собственные клеточные элементы — цитотоксические Т-лимфоциты и естественные клетки-киллеры [54, 95].
Тимус до недавнего времени был довольно загадочным органом, и лишь последние десятилетия приподняли завесу над его тайнами. Были выявлены 2 его важные функции: способность обучать пре-Т-лимфоциты не узнавать антигены собственного организма и тем самым предотвращать аутоиммунную агрессию (приобретенная толерантность) и способность развивающихся лимфоцитов узнавать особые антигены, строго специфические для каждого индивидуума, которые маркируют его наподобие номерных знаков автомашины (естественная толерантность). Эти антигены (гликопротеиновой природы) экспрессируются генами главного комплекса гистосовместимости и локализуются на поверхности клеток (см. рисунок). Их называют трансплантационными, так как впервые они были обнаружены у человека после переливания крови и выделены в виде антигенных детерминант, связанных с лейкоцитами. Они известны как антигены HLA (human leucocyte-associated) [16, 22, 25, 32, 47, 82].
Хотя существование обоих типов иммунитета (приобретенного и естественного) общепризнано, опосредующие их механизмы не до конца ясны. Предполагается, что в их основе лежат различные способы отбора, или селекции, развивающихся в тимусе лимфоцитов. В случае приобретенного иммунитета, формирующегося в раннем периоде индивидуального развития, имеет место негативная селекция, под которой подразумевают отбраковку (ее механизмы могут быть разными: апоптоз, или запрограммированная смерть клетки, либо формирование функциональной ареактивности) тех клонов пре-Т-лимфоцитов, у которых в результате случайной рекомбинации генов экспрессируются рецепторы к антигенам собственного организма, т. е. создаются предпосылки к развитию аутоиммунной агрессии. Позитивная селекция, лежащая в основе естественного иммунитета, допускает экспрессию Т-клеточных рецепторов к собственным антигенам, но не ко всем, а лишь к маркерным HLA-антигенам. Тем самым создаются предпосылки для иммунного ответа, однако иммунный ответ, рестриктированный этими антигенами, носит не агрессивный, а скорее сигнальный характер, информирующий иммунную систему о присутствии в организме чужеродного антигена. Последнее происходит в результате того, что чужеродный антиген способен связываться с HLA-антигенами, которые располагаются либо на поверхности каждой клетки (HLA-антигены I класса), либо на поверхности только клеток иммунной системы (HLA-антигены II класса): макрофагов, В-лимфоцитов, эпителиальных клеток тимуса и др. Таким образом, развивающиеся Т-лимфоциты обучаются узнавать ’’чужое” через узнавание «своего”, т. е. через узнавание маркерных HLA-антигенов I или II класса. Взаимодействуя с HLA-антигенами I класса, они индуцируют цитолитический эффект (активируются цитотоксические Т-лимфоциты), тогда как их взаимодействие с HLA-антигенами II класса индуцирует стимуляцию макрофагов и выделение ими интерлейкинов.
Процесс обучения пре-Т-лимфоцитов, происходящий в тимусе и лежащий в основе механизмов обоих типов иммунитета, начинается с того, что в раннем периоде индивидуального развития антигены собственного организма представляются находящимся в тимусе пре-Т-лимфоцитам. Наиболее важную роль в процессе презентации этих антигенов выполняют эпителиальные клетки тимуса [23, 62, 73, 92], о значении чего будет сказано ниже.
Итак, рассмотрев кратко основные принципы формирования иммунных ответов, вернемся к механизмам, которые лежат в основе взаимодействия нейроэндокринной и иммунной систем, что, как уже упоминалось, удобно сделать на модели реакции-стресс.
Показано, что важную роль посредников во взаимодействиях нейроэндокринной и иммунной систем выполняют клетки иммунной системы макрофаги, способные при их стимуляции секретировать ключевые иммунорегуляторные факторы, такие как интерлейкины (ИЛ-1, ИЛ-6), фактор некроза опухолей, тромбоцитактивирующий фактор и другие [4, 18, 30]. Стимуляцию макрофагов могут вызывать все упомянутые выше агенты, которые провоцируют реакцию-стресс, сопровождающуюся выделением АКТГ и глюкокортикоидов. В физиологических дозах последние способны стимулировать секрецию макрофагами ИЛ-1, который легко преодолевает гематоэнцефалический барьер в тех его участках, где существуют «окна” для такого рода соединений. Пониженная барьерная активность этих участков обусловлена особенностями организации и функционирования своеобразной эпендимной глии, выстилающей желудочки мозга [58]. Попав в мозг, ИЛ-1 стимулирует секрецию кортикотропин-рилизинг-фактора (КРФ), синтезируемого нейронами паравентрикулярного ядра гипоталамуса, причем этот эффект является простагландин-Е2-зави- симым [17, 65]. КРФ стимулирует повышенную секрецию АКТГ в гипофизе и соответственно глюкокортикоидов в коре надпочечников. Повышенная секреция этих гормонов тормозит секрецию ИЛ-1 в макрофагах и тем самым угнетает иммунный ответ при его избыточности [51, 56, 68]. Таким образом, здесь в чистом виде работают механизмы отрицательной обратной связи, замыкающиеся между иммунными пептидами (ИЛ-1), нейропептидами (КРФ) и гормонами: АКТГ и глюкокортикоиды [15, 18].
Нередко у лиц среднего и пожилого возраста после перенесенного эмоционального стресса (смерть близкого человека, конфликтные ситуации в быту или на службе и т. д.) наблюдаются нарушения углеводного гомеостаза. Одно из ранних проявлений таких нарушений — повышение уровня сахара в крови, что настораживает как тревожный сигнал возможного заболевания сахарным диабетом. Последнее действительно имеет место, что подтверждается дальнейшими обследованиями и проявляется в виде стойкого или преходящего заболевания. В этом случае легко допустить возможность того, что в механизме развития диабета, т. е. в его патогенезе, важная роль принадлежит описанному выше механизму обратной связи, в котором роль триггера выполняет эмоциональный стресс. Эмоциональный стресс приводит к повышенному выделению КРФ, который, по образному выражению Г. Селье, является «рилизинг-фактором стресса» [84]. Известно, что стрессовые реакции сопровождаются появлением бактериальных белков теплового шока, которые воспринимаются макрофагами как чужеродные антигены и вызывают в них повышенную секрецию иммунопептида ИЛ-1 [10]. Последний в свою очередь усиливает секрецию гипоталамического нейропептида КРФ, что приводит к повышению секреции ключевых гормонов реакции- стресс (АКТГ и глюкокортикоидов) и длительно поддерживает эту реакцию как некую патогенную доминанту, функционирующую в качестве генератора патологически усиленного возбуждения [7]. Образовавшийся замкнутый, или порочный, круг становится причиной нарушений со стороны иммунной системы, в частности нарушения такой важной ее функции, как дифференцирование своего и чужого антигенов. В результате развиваются агрессивные атаки, направленные против собственных клеток. Одной из наиболее частых мишеней таких аутоиммунных реакций являются В-клетки поджелудочной железы, секретирующие инсулин [10]. Таким образом, ломаются физиологические взаимодействия всех 3 регулирующих систем — нервной, иммунной и эндокринной.
Может быть и так, что первичные нарушения функции иммунной системы, приводящие к аутоиммунным ответам, вовлекают нервную систему в качестве мишени. Последнее демонстративно проявляется в форме тяжелого заболевания, известного как рассеянный склероз. В этом случае чужеродным антигеном становится основной белок миелина, покрывающего в виде пограничной оболочки нервные волокна [29, 71]. Миелин выполняет функцию изолятора, предотвращающего утечку ионных токов. При повреждении этого изолятора нервные импульсы затухают и не могут достичь своих мишеней. В результате нарушается иннервация мышц, и больные погибают от паралича дыхательной мускулатуры. Такой же печальный исход наблюдается при другом аутоиммунном заболевании, известном как тяжелая миастения (myastenia gravis). В данном случае чужеродным антигеном становятся белковые рецепторы к нейромедиатору ацетилхолину, выделяемому в области нервно-мышечных синапсов [60].
При обсуждении общности организации и функционирования 2 регулирующих систем (нервной и эндокринной) упоминалось о том, что нейроны, сохраняя специфические особенности регуляции, т. е. способность генерировать и распространять нервные импульсы, могут одновременно функционировать как эндокринные клетки, секретирующие пептидные нейрогормоны. Аналогичное можно сказать и о клеточных элементах иммунной системы, особенно о макрофагах. Участвуя в регуляции гомеостаза с помощью специфических иммунных механизмов, они одновременно проявляют способность секретировать пептиды, например ИЛ, которые можно рассматривать как пептидные иммуногормоны или иммуномедиаторы. Более того, они могут синтезировать пептиды, близкие по иммунореактивности и аминокислотному составу к нейроэндокринным пептидам, в частности к p-эндорфину и АКТГ [5, 61]. Их клеточные мембраны, подобно таковым в нейроэндокринных клетках, содержат рецепторы к гормонам, нейромедиаторам и нейропептидам [15, 19—21, 44, 45, 93], что обеспечивает тесные взаимодействия иммунной и нейроэндокринной систем.
Сходство в организации регулирующих систем усугубляется тем, что в нервных и глиальных клетках мозга в свою очередь обнаруживаются рецепторы к медиаторам иммунной системы, в частности к ИЛ-1 [11, 13, 35]. В них определяется иммунореактивность, свойственная ИЛ-1 [24, 57], последняя возрастает после воздействия эндотоксинов [90]. Показана также способность гипоталамических нейронов, в частности нейронов паравентрикулярного ядра, синтезировать иммуномедиаторы и даже выделен ген, ответственный за продукцию ИЛ-1, причем его экспрессия стимулируется липополисахаридами, т. е. бактериальными антигенами [12]. Подобно тому как гормоны, нейромедиаторы и нейропептиды влияют на секрецию ИЛ-1 в макрофагах, этот иммуномедиатор в свою очередь влияет на обмен и выделение гипоталамических нейромедиаторов и рилизинг-гормонов, в частности КРФ [66, 74, 85, 91]. Более того, показано влияние ИЛ-1 на экспрессию гена, ответственного за продукцию КРФ [52, 86]. С другой стороны, повышенная секреция КРФ под влиянием иммобилизационного стресса индуцирует экспрессию гена, ответственного за продукцию ИЛ-1 в гипоталамусе [64]. Наконец, в астроцитах мозга синтезируется интерферон, выделение которого повышает экспрессию ИЛ-2 в нервных структурах мозга [89]. Все это заставляет думать, что для формирования оптимальной величины иммунного ответа необходим баланс гормонов, нейропептидов, нейротрансмиттеров и иммуномедиаторов, и позволяет предполагать возможность осуществления иммунных ответов не только системного характера, но и местных, включая головной мозг [4].
Исследования последнего времени показали, что в механизмах взаимодействий нейроэндокринной и иммунной систем важным звеном является тимус, рассматриваемый в качестве некоего полигона, на котором разворачиваются критически важные события при формировании приобретенного и естественного иммунитета. Примечательно, что при развитии представлений о взаимодействиях нервной и эндокринной систем роль такого полигона отводилась гипоталамической области мозга, где впервые были обнаружены в нервных клетках признаки секреции гормонов. Аналогичным образом в эпителиальных клетках тимуса были недавно выявлены почти все известные пептидные гормоны [72, 76]. Это примечательно и потому, что в свете современных концепций важная роль в функциях тимуса отводится тем эволюционно древним пептидам, которые были первоначально выявлены в нейросекреторных клетках гипоталамуса, в частности окситоцину, вазопрессину и их белковым носителям нейрофизинам [41]. В связи с этим полезно напомнить об особенностях гистофизиологии клеток тимуса.
Клеточный состав тимуса, или, как принято говорить, его клеточное микроокружение, представлено тесно перемешанными собственными клетками тимуса эпителиального типа, локализованными субкапсулярно и медуллярно, и пришлыми клетками иммунной системы — развивающимися лимфоцитами и макрофагами. В свою очередь среди собственных клеток тимуса выделяют популяцию, клетки которой называют клетками-кормилицами. Оба типа клеток в равной мере метятся моноклональными антителами, распознающими сложные ганглиозиды тканей мозга и элементов диффузной эндокринной системы [46]. В них в свое время была выявлена секреция иммуномодуляторных пептидов тимозина и тимулина [46, 75], а позднее продемонстрирована способность к секреции эволюционно консервативных пептидов, относящихся к семействам гипоталамо-нейрогипофизарных [38, 39], инсулиновых пептидов [40] и тахикининов [33].
Особая роль во взаимодействиях между синтезируемыми в тимусе пептидами и развивающимися лимфоцитами принадлежит клеткам-кормилицам. Аналогичными по функции являются клетки Сертоли в семенниках. И в том, и в другом органе эти клетки обволакивают незрелые клеточные элементы (в тимусе — пре-Т-лимфоциты, в семенниках — сперматиды), которые, достигнув своей зрелости, мигрируют из этих органов. Недавно была высказана весьма привлекательная и ставшая достаточно признанной гипотеза [37], согласно которой, между клетками-кормилицами и их «воспитанниками» устанавливается межклеточный диалог, заключающийся в передаче созревающим клеткам сигнальных молекул. Функцию последних выполняют пептиды, секретируемые клетками-кормилицами. Такая секреция была названа кринотропной. Предполагается, что выделяемые путем кринотропной секреции пептидные гормоны индуцируют экспрессию соответствующих рецепторов в развивающихся клетках.
Идея кринотропной секреции эпителиальных клеток тимуса оказала существенное влияние на развитие современных представлений о механизмах, с помощью которых нейрогормоны могут участвовать в обучении пре-Т-лимфоцитов и соответственно быть причастными к формированию приобретенного и естественного иммунитета. Весьма интригующей в этом смысле представляется гипотеза Гинена [41], развиваемая применительно к взаимодействиям между преобладающим в тимусе эволюционно древним семейством гипоталамических нейропептидов (окситоцином, вазопрессином, их белковыми носителями нейро- физинами) и рецепторами пре-Т-лимфоцитов. Роль этих пептидов и механизмы их секреции в гипоталамо-нейрогипофизарной системе отличаются от таковых в тимусе. В первом случае нейропептиды секретируются нейронами супраоптического и паравентрикулярного ядер и с помощью нейрофизинов транспортируются по аксонам в заднюю долю гипофиза, где они депонируются и по мере надобности выделяются в кровь. Иная ситуация имеет место в тимусе, где совсем другая роль отводится нейропептидам и их белкам-носителям.
Показано, что между нейрофизинами, секретируемыми эпителиальными клетками тимуса, и HLA-антигенали существует сходство, определяемое по целому ряду показателей: сродству к моноклональным антителам и близким значениям молекулярной массы [41], сходству механизмов бе- лок-белкового узнавания в процессе презентации пре-Т-лимфоцитам [34, 63], признакам сходства в молекулярной организации нейрофизинов и протеинов суперсемейства HLA-антигены—иммуноглобулины [27, 28]. Наконец, показана экспрессия в тимусе предшественника нейропептидных гормонов, содержащего короткую аминокислотную цепь, способного воспроизводить все семейство нейропептидов и антигены HLA I класса, родственные нейрофизину [41].
Эти данные позволяли предполагать, что ней- рофизины, синтезируемые в эпителиальных клетках тимуса, близкородственны HLA-антигенам и способны выполнять функцию последних, т. е. презентировать пре-Т-лимфоцитам связываемые ими нейропептиды окситоцин и вазопрессин. Принимая во внимание, что развивающиеся Т- лимфоциты обучаются узнавать HLA-антигены, экспрессируя к ним рецепторы, логично было ожидать узнавание Т-лимфоцитами нейрофизинов и экспрессию рецепторов к презентируемым ими нейропептидам. Эти предположения подтвердились. Показано, что в тимусе рецепторы к окситоцину экспрессируются в пре-Т-лимфоцитах в той же временной последовательности, что и в гипоталамо-нейрогипофизарной системе, т. е. первоначально появляются провизорные рецепторы типа VI, а позднее — дефинитивные рецепторы [41]. Как упоминалось выше, пре-Т-лимфоци- ты обучаются узнавать HLA-антигены и не давать иммунного ответа в случае, когда они презентируют антигены собственного организма. В полной мере это относится к окситоцину, презентируемому нейрофизином. Что касается вазопрессина, здесь могут происходить срывы в механизме обучения пре-Т-лимфоцитов: этот нейропептид у отдельных индивидуумов воспринимается как чужеродный антиген. В этих случаях развивается ау- тоимунное заболевание, поражающее нейроны гипоталамуса, которые секретируют вазопрессин, т. е. развивается несахарный диабет [81].
Резюмируя вышесказанное, можно сформулировать некоторые заключения, которые носят характер перспективных гипотез. Прежде всего представленные факты позволяют думать, что нейроэндокринная и иммунная системы происходят от общих предков в процессе их эволюционного развития. Далее становится все более очевидным, что эволюционно консервативные пептиды, обнаруживаемые в тимусе, способны вовлекаться в механизмы, опосредующие обучение пре-Т-лимфоцитов в процессе формирования приобретенной и естественной толерантности. На сегодня такая возможность хорошо аргументирована для окситоцина, который, как выяснилось, наделен способностью оказывать митогенное действие на пре-Т-лимфоциты, что немаловажно в процессе положительной селекции, когда необходимо увеличивать популяцию развивающихся Т-лимфоцитов, не дающих аутоиммунной агрессии к собственному антигену [41].
Гипотеза о том, что нейропептиды принимают участие в механизмах селекции, представляется перспективной и с той точки зрения, что она может оказаться полезной в решении некоторых дискуссионных проблем современной иммунологии. До сих пор остается без каких-либо удовлетворительных объяснений некий парадокс в современных иммунологических концепциях, когда в рамках одной и той же тримолекулярной структуры (рецептор Т-лимфоцита—антиген— HLA- молекула) допускается реализация 2 диаметрально противоположных процессов: негативной селекции развивающихся лимфоцитов, когда уничтожаются целые клоны (клональная делеция) клеток, реагирующих на собственные антигены, и позитивной селекции, создающей условия для сохранения клеточных клонов и их размножения. Напрашивается предположение, что одних только HLA-молекул недостаточно для рестрикции этих процессов, что аналогичную функцию могут выполнять синтезируемые в клетках тимуса пептидные молекулы. Последнее может также объяснить столь широкий репертуар пептидов тимуса.
1. Акмаев И. Г. Структурные основы механизмов гипоталамической регуляции эндокринных функций. — М., 1979.
2. Акмаев И. Г. // Вести. Рос. АМН. — 1993. — № 7. — С. 55-59.
3. Акмаев И. Г. // Успехи физиол. наук. — 1996. — № 1. — С. 3-20.
4. Громыхина Н. Ю., Крымская Л. Г., Козлов В. А. // Там же. 1993.- № 1 — С. 59-79.
5. Завьялов В. П., Денесюк А. И. // Докл. АН СССР. — 1987. № 3. — С. 727-730.
6. Корнева Е. А., Шхинек Э. К. // Вести. АМН СССР. — 1985 — № 8. — С. 44-50.
7. Крыжановский Г. Н. Детерминантные структуры в патологии нервной системы: генераторные механизмы нейропатологических синдромов.— М., 1980.
8. Ноздрачев А. Д, Вуколова Р. П. // Успехи физиол. наук. — 1993- № 1. — С. 80-98.
9. Acher R. // Regul. Pept. — 1993. — Vol. 45. — P. 1-13.
10. Atkinson M. A., Maclaren N. K. // Sci. Am. — 1980. — Vol. 263. — P. 42-49.
11. Ban E., Milon G., Prudhomme N. et al. // Neuroscience. — 1991- Vol. 43. — P. 21-30.
12. Ban E., Haour F, Lenstra R. // Cytokine. — 1992. — Vol. 4.P. 48-54.
13. Ban E., Sarlieve L. L., Haour F. // Neuroscience. — 1993. — Vol. 52. — P. 725-733.
14. Bargmann W., Scharrer E. // Sci. Am. — 1951. — Vol. 39. — P. 255-259.
15. Bateman A., Singh A., Kral T. et al. // Endocrine Rev. — 1989.Vol. 10. — P. 98-112.
16. Benacerraf B. // J. Immunol. — 1978. — Vol. 120. — P. 1809-1812.
17. Bernardini R., Calogero A. E., Mauceri G. et al. // Life Sci. — 1990. — Vol. 47. — P. 1601-1607.
18. Besedovsky H., Del Rey., Sorkin E. et al. // Science. — 1986.Vol. 233. — P. 652-654.
19. Blalock J. E. // J. Immunol. — 1984. — Vol. 132. — P. 1067— 1070.
20. Blalock J. E., Bost K. L. // Prog. Allergy. — 1988. — Vol. 43.P. 1-165.
21. Blalock J. E. // Immunol. Today. — 1994. — Vol. 15. — P. 504-511.
22. Boehmer H. von, Haas W., Jerne N. E. // Proc. natl. Acad. Sci. USA. — 1978. — Vol. 75. — P. 2439-2442.
23. Bonomo A., Matzinger P. // J. exp. Med. — 1993. — Vol. 177.P. 1153-1164.
24. Breder C. D., Dinarello C. A., Saper С. B. // Science. — 1988. -Vol. 240. — P. 321-324.
25. Burnet F. M. The Clonal Selection Theory of Acquired Immunity. — Cambridge, 1959.
26. Cantor H. , Gershon R. K. // Fed. Proc. — 1979. — Vol. 38. — P. 205-2064.
27. Carpa J. D., Cheng K. W., Friesen H. G. et al. // FEBS Lett.1974. — Vol. 46. — P. 71-74.
28. Carpa J. D., Walter R. // Ann. N. Y. Acad. Sci. — 1975. — Vol. 248. — P. 397-407.
29. Cohen I. R. // Sci. Am. — 1988. — Vol. 258. — P. 34-42.
30. Dantzer R., Kelly K. W. // Life Sci. — 1989. — Vol. 44. — P. 1995-2008.
31. Davies A. J. S. // Transplant. Rev. — 1969. — Vol. 1. — P. 43-91
32. Dorf M. E. (Ed.) The Role of the Major histocompatibility Complex in Immunology. — New York, 1981.
33. Ericson A., Geenen V., Robert F. et al. // Mol. Endocrinol. — 1990. — Vol. 4. — P. 1211-1218.
34. Falk K., Rotzschke O., Stevanovic S. et al. // Nature. — 1991.Vol 351. — P. 290-296.
35. Farrar W. L., Killian P. L., Ruff M. R. et al. // J. Immunol. — 1987. — Vol. 139. — P. 459-463.
36. Friesen H. G., Di Mattia G. E., Too С. K. L. // Prog. NeuroEndocrinol. Immunol. — 1991. — Vol. 4. — P. 1—9.
37. Funder J. W. // Mol. Cell Endocrinol. — 1990. — Vol. 70. — P. C21-C24.
38. Geenen V., Legros J. J., Franchimont P. et al. // Science. — 1985- Vol. 232. — P. 508-51 1.
39. Geenen V, Legros J. J., Franchimont P. et al. // Ann. N. Y. Acad. Sci. — 1987. — Vol. 497. — P. 56-66.
40. Geenen V., Achour I., Robert F. et al. // Thymus. — 1993. — Vol. 21. — P. 115-127.
41. Geenen V., Cormann-Gojfin N., Vandersmissen E. et al. // Ann. N. Y. Acad. Sci. — 1994. — Vol. 741. — P. 85-99.
42. Green J. D., Harris G. W. // J. Endocrinol. — 1947. — Vol. 5.P. 136-146.
43. Grossman C. J. // Science. — 1985. — Vol. 227. — P. 257- 261.
44. Hall N. R. Psychoneuroimmunology. — New York, 1981.
45. Harting H. P., Walters K, Toyka K. // J. Immunol. — 1986. — Vol. 136. — P. 3856-3863.
46. Haynes B. E, Shimizu K, Eisenbarth G. S. // J. clin. Invest. — 1983- Vol. 71. — P. 9-14.
47. Howard J. G., Mitchison N. A. // Prog. Allergy. — 1975. — Vol. 18. — P. 43-96.
48. Inagaki S., Kito S. // Prog. Brain Res. — 1986. — Vol. 66. — P. 269-316.
49. Jerne I. // Sci. Am. — 1973. — Vol. 229. — P. 52-69.
50. Jerne N. K. // Ann. Immunol. — 1974. — Vol. 125C. — P. 378-389.
51. Johnson H. M., Tozres B. A. // Prog. Allergy. — 1988. — Vol. 43. — P. 37-67.
52. Kakucska I., Qi Y., Clark B. D. et al. // Endocrinology. — 1993. — Vol. 133. — P. 815-821.
53. Kelly P. A., Ali S., Rozakis M. et al. // Rec. Prog. Horm. Res. 1993. — Vol. 48. — P. 123-164.
54. Kiessling R., Wigzell H. // Immunol. Rev. — 1979. — Vol. 44. P. 165-208.
55. Korneva E. A., Khai L. M. // Foundations of Psychoneuroimmunology / Ed. S. Locke et al. — New York, 1986. — P. 11 — 20.
56. Knudsen P. J., Dinarello C. A., Strom T. B. // J. Immunol. — 1985- Vol. 139. — P. 4129-4134.
57. Lechan R. M., Toni R., Clark B. D. et al. // Brain Res. — 1990. — Vol. 514. — P. 135-140.
58. Leonhardt H. // Handbuch der mikroskopischen Anatomie des Menschen. / Hrsg A. Oksche. — Berlin, 1980. — Bd. 4, T. — S. 177-666.
59. Levi-Montalcini R. // Science. — 1987. — Vol. 237. — P. 1154-1162.
60. Lindstrom J. // Adv. Immunol. — 1979. — Vol. 27. — P. 1 — 50.
61. Lobait S. J., Lim A. T. W., Toh B. et al. // J. clin. Invest. — 1983- Vol. 73. — P. 277-280.
62. Marrack P., Mccormack J., Kappler J. // Nature. — 1989. — Vol. 338. — P. 503-505.
63. Maryanski J. L., Romero P., Van Pel A. et al. / Int. Immunol. 1991. — Vol. 3. — P. 1035-1042.
64. Minami M., Kuraishi Y., Yamaguchi T. et al. // Neurosci. Lett. 1991. — Vol. 123. — P. 254-256.
65. Navarra P., Tsagarakis S., Faria M. S. et al. // Endocrinology. 1991. — Vol. 128. — P. 37-44.
66. Palazzolo D. L., Quardi S. K. // Life Sci. — 1990. — Vol. 47. P. 2105-2109.
67. Pelletier G. // Hypothalamus and Endocrine Function / Ed. F. Labrie et al. — New York, 1976. — P. 433—450.
68. Peretti M., Becherucci C., Scapigliati G. et al. // Brit. J. Pharmacol. — 1989. — Vol. 98. — T. 1137—1142.
69. Plaut M. II Ann. Rev. Immunol. — 1987. — Vol. 5. — P. 621-629.
70. Raff M. I/ Nature. — 1977. — Vol. 265. — P. 205-207.
71. Rennie J. // Sci. Am. — 1990. — Vol. 263. — P. 76—85.
72. Robert F. R., Martens H., Cormann N. // Dev. Immunol.— 1991- Vol. 2. — P. 131-140.
73. Salaun J. C., Bandereira A., Khazaai I. et al. // Science. — 1990. — Vol. 247. — P. 1471-1473.
74. Sapolsky R., Rivier C., Yamamoto G. et al. // Ibid. — 1987. — Vol. 238. — P 522-524.
75. Savino W., Dardenne M., Papiernik M. et al. // J. exp. Med. — 1982. — Vol. 156. — P. 628-632.
76. Savino W., Dardenne M. // Immunol. Today. — 1995. — Vol. 16. — P. 318-322.
77. Schally A. V., Arimura A., Bowers C. Y. et al. // Rec. Prog. Horm. Res. — 1968. — Vol. 24. — P. 497-581.
78. Scharrer E. // Z. vergleich. Physiol. — 1928. — Bd 7. — S. 1 — 38.
79. Scharrer E., Scharrer B. // Biol. Rev.Camb. Phil. Soc. — 1937. Vol. 12. — P. 185-216.
80. Scharrer E., Scharrer B. Neuroendocrinology. — New York, 1963.
81. Scherbaum W. A., Botazzo G. E, Czernichow P. et al. // Front. Horm. Res. — 1985. — Vol. 13. — P. 232—238.
82. Schwartz R. H. // Scand. J. Immunol. — 1978. — Vol. 7. — P. 3-10.
83. Selye H. // J. clin. Erdocrinol. Metab. — 1946. — Vol. 6. — P. 117-129.
84. Selye H. The Stress of Life. — New York, 1976.
85. Shintani E, Kanba S., Nakai T. et al. // J. Neurosci. — 1993. Vol. 13. — P. 3574-3581.
86. Suda T, Tozawa F, Ushiyama T. et al. // Endocrinology. — 1990. — Vol. 126. — P. 1223-1228.
87. Swaab D. F. // Prog. Brain Res. — 1982. — Vol. 55. — P. 97-122
88. Szentagothai J., Flerko B., Mess B., Halasz B. Hypothalamic Control of the Anterior Pituitary. — Budapest, 1962.
89. Tedeshi B., Berrett J. N., Keane R. W. // J. Cell Biol. — 1986. Vol. 102. — P. 2244-2253.
90. van Dam A. M., Brouns M., Lousee S. et al. // Brain Res. — 1992. — Vol. 588. — P. 291-296.
91. Watanobe H., Sasaki S., Takebe K. // Neurosci. Lett. — 1991. Vol.133. — P. 7-10.
92. Webb S., Sprent J. // Eur. J. Immunol. — 1990. — Vol. 20. — P. 2525-2530.
93. Werb Z., Foley R., Munch A. // J. exp. Med. — 1978. — Vol. 147. — P. 1684-1694.
94. Wybran J., Appelboom T., Famaey J. P. et al. // J. Immunol. 1979. — Vol. 123. — P. 1068-1071.
95. Zinkemagel R. M., Doherty P. C. // Adv. Immunol. — 1979. — Vol. 27. — P. 51-177.
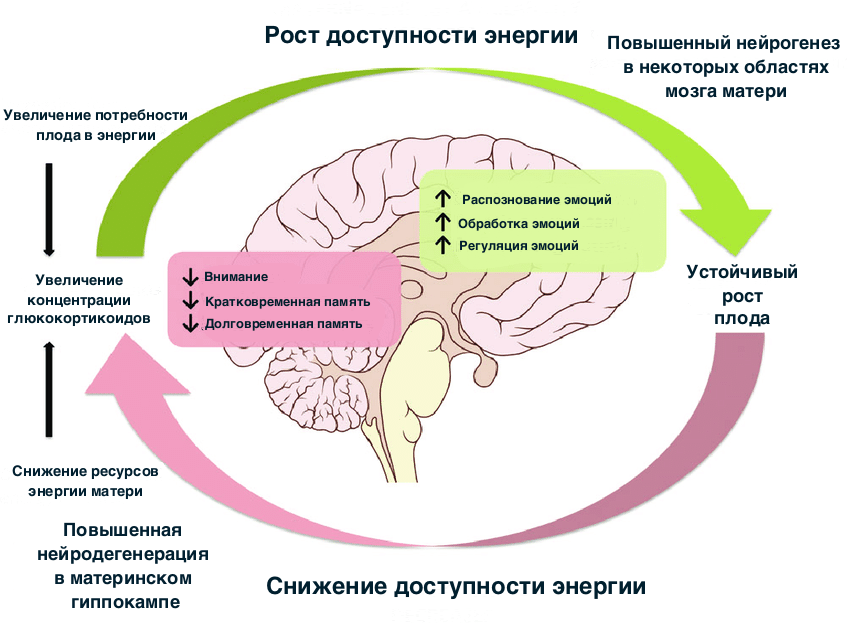
Статья на конкурс «Био/Мол/Текст»: Мы привыкли видеть внешние результаты изменений, связанных с беременностью и родами: растущий живот, набухание груди, проявления «материнского инстинкта». Все это — лишь верхушка айсберга, того, что происходит с женщиной в этот волнующий период ее жизни. На протяжении девяти месяцев беременности, пока ребенок из нескольких клеток вырастает в полноценный организм, мозг его мамы уже совершает чудеса адаптации. А после того, как малыш появляется на свет, приключение под названием «материнство» только набирает обороты: впереди месяцы заботы о беспомощном младенце, восстановление прежних «настроек» репродуктивной функции. Ради того, чтобы родить и вырастить здоровое и счастливое потомство, там, вдали от эпицентра событий — матки — трудится и необратимо меняется материнский мозг. Он столько всего сделал, а сколько еще впереди. Как он все это переживает и не сходит с ума? Давайте попробуем разобраться.
Так уж вышло, что человеческий мозг вовлечен в регуляцию происходящих в организме эндокринных процессов. Именно в нейронах головного мозга, а точнее в его участке — гипоталамусе (в его нейросекреторных клетках), происходит синтез нейрогормонов. Из тела нейрона такие гормоны бегут по аксону к нервным окончаниям, после чего попадают в кровоток. Нейрогормоны есть у моллюсков, членистоногих и других животных, включая млекопитающих. Кто-то ведь должен следить за порядком в таких сложных системах — живых организмах [1].
Нейрогормоны можно разделить на два типа. Первый включает в себя такие вещества, как дофамин и соматотропин. Они бегут прямиком к гипофизу и передают сигнал его нейронам. Лишь небольшая их часть попадает в кровоток, и поэтому их влияние на организм не так велико. Ко второму типу относятся гормоны, которым мы уделим больше внимания, — окситоцин и вазопрессин. Они попадают в сосуды также через гипофиз и спешат к своим мишеням, например, яичникам, матке, молочным железам.
В эмоциональных всплесках и бурных чувствах каждого из нас задействованы гормоны. Витаешь в облаках — это эндорфины создали тебе крылья; вновь и вновь касаешься возлюбленного — окситоцин постарался.
Но есть процесс, подконтрольный нейрогормонам, который длится практически всю жизнь и включает в себя несколько этапов. Конечно, речь о материнстве. Только представьте, сперва женский организм готовится к репродуктивному возрасту (и начинает это делать еще в утробе!), потом происходит зачатие и многомесячное вынашивание ребенка, его рождение, наступает время заботы о нем. Все вместе занимает далеко не два-три года. Поэтому вполне закономерно ожидать, что мозг, наш пластичный и удивительный мозг, не останется в этом деле безучастным. И так оно и есть! Интереснее всего здесь то, что мозг не только помогает самке зачать, выносить, родить и обеспечить малышу безопасные рост и развитие, но и меняется сам. Медленно, день за днем, в его структурах происходят перемены.
Репродуктивный возраст: бесконечное ожидание
У большинства млекопитающих выработка гормонов подчинена определенным циркадным ритмам . А у менструального цикла есть свой определенный ритм, повторяющийся месяц за месяцем и год за годом.
На «Биомолекуле» есть несколько статей, рассказывающих о циркадных ритмах: «Тик-так по-шведски. Нобелевская премия о циркадных ритмах» [2], «Найдена связь между обменом веществ и циркадным ритмом» [3] и «Снова о циркадных ритмах» [4].
Классические подходы к сбору нейробиологических данных не подразумевают длительные наблюдения с фокусировкой внимания на повторяющихся биохимических событиях. Обычно исследователи фиксируют наблюдения малым числом повторов (от одного до трех) у одного человека, что не позволяет оценить реальное воздействие эндогенных нейрогормонов на мозг. Поэтому большинство данных по «нейробиологии материнства» — это зафиксированные при помощи снимков результаты активности мозга в определенный момент. Однако стоит подойти к вопросу со стороны эндокринологии, как появляется свобода для исследований активности гормонов и их влияния на мозг. Благодаря этому подчиняющийся гормональным «волнам» менструальный цикл является одним из самых изученных процессов, касающихся материнства.
Менструальный цикл состоит из нескольких этапов, каждому из которых соответствуют свои уровни гормонов в крови. Чаще всего их называют — фолликулярной (менструация, подготовка к овуляции) и лютеиновой фазами (вероятное зачатие и подготовка к «закреплению» эмбриона в матке). В ходе цикла сперва снижается концентрация эстрогена и прогестерона, что служит сигналом для выработки гонадотропин-рилизинг-гормона (ГнРГ) в гипоталамусе. Затем ГнРГ следует до гипофиза и там стимулирует синтез лютеинизирующего и фолликулостимулирующего гормонов. Им предстоит путь до яичников, где будет запущен синтез эстрогена и прогестерона. Концентрация последних сперва повысится, а потом пойдет на убыль, и все повторится вновь (рис. 1) [1]. Все перечисленные гормоны необходимы для поддержки функционирования гипоталамо-гипофизарно-яичниково-маточной оси.
Рисунок 1. Схема менструального цикла. Цикл начинается с менструации, которая сопровождается отторжением эндометрия (слизистой оболочки матки). Здесь можно наблюдать небольшой скачок концентрации гормона эстрогена. В первой половине цикла (фолликулярной фазе) идет постепенный рост синтеза эстрогена. К середине цикла (овуляции) происходит резкий скачок концентрации фолликулостимулирующего и лютеинизирующего гормонов, что приводит к созреванию и выводу яйцеклетки в фаллопиеву трубу. Затем, во второй половине цикла (лютеиновой фазе), происходит спад синтеза фолликулостимулирующего и лютеинизирующего гормонов с одновременным ростом концентрации эстрогена и прогестерона, что способствует подготовке стенок матки к возможному прикреплению зародыша.
Мы уже выяснили, что мозг активно участвует в регуляции менструального цикла путем выработки нейрогормонов. Подобные гормональные «качели» влияют на мозг, что удобно фиксировать, наблюдая за сменой активности разных его областей или переменами в поведении особи. В ходе экспериментов на самках грызунов удалось выяснить, что объем гиппокампа меняется в ответ на изменения уровней эстрогена и прогестерона. В исследованиях с участием людей подтверждено, что гиппокамп достоверно увеличивается в поздней фолликулярной фазе по сравнению с ранней фолликулярной фазой, то есть в период овуляции. Кроме того, исследователи наблюдали более высокую функциональную связь между гиппокампом и двусторонней верхней теменной долей в поздней фолликулярной фазе [5]. Одна из самых важных функций гиппокампа связана с переводом кратковременной памяти в долговременную, с запоминанием. Влияет ли это на умственные способности — вопрос открытый. Что также интересно — известно, что эстрадиол стимулирует активность дофамина. Опосредованно становится ясно, что в конечном итоге уровень эстрадиола влияет на функцию памяти, ведь достоверное увеличение гиппокампа фиксируется именно в период резкого скачка концентрации эстрадиола. [6]
Гормональные перемены в течение цикла сказываются на активности и других участков головного мозга, например орбитофронтальной коры, которая задействована в принятии решений [7]. В результате измениться могут способности к эмпатии и коммуникации. Гормональные «качели» во время цикла — процесс крайне чувствительный. Многие ощущают его на себе без стороннего вмешательства (речь о ПМС), а что уж говорить о том, как на поведение и самочувствие женщины может повлиять прием гормональных препаратов. Концентрации принимаемых гормонов могут иметь тут огромное значение. Женщины ведут себя мягче и терпимее к ближним, если количество гормонов в их организме близко к норме определенной фазы цикла. Нормой в данном случае мы считаем ту концентрацию гормонов, при которой в организме все будет происходить согласно биологическому «плану», и женщина не будет жаловаться на здоровье. Подтверждено, что при приеме гормональных контрацептивов (и, соответственно, изменении количества и соотношения половых гормонов), поведение женщины чаще отклоняется от просоциального (нормального) [8].
Базисная стрессовая реакция «бей или беги» тоже будет разниться в зависимости от фазы все того же цикла. Так, во время лютеиновой фазы (когда повышены уровни эстрадиола и прогестерона) в кровь выбрасывается больше глюкокортикостероидов (к ним относится кортизол — самый известный гормон стресса) [9]. Зарождение жизни и последующее зачатие являются стрессом для организма. Стрессом, к которому следует быть готовым.
Исследования с использованием МРТ и поведенческих тестов позволяют многое понять в поведении женщин. Например, прекрасная половина человечества действительно регулярно находится в подверженном стрессу состоянии. Женщины с высоким уровнем эстрадиола демонстрируют меньшую деактивацию лимбических областей во время стресса по сравнению с женщинами с низким уровнем эстрадиола [10]. Они легче и быстрее реагируют на смену обстановки, лучше защищены от атак микробов, ведь для вероятной новой жизни нужны максимально хорошие условия. Нормальный уровень гормонов (и для каждой фазы цикла он свой) помогает женщинам выходить из непростых жизненных ситуаций с высоко поднятой головой. Буквально. Особенно в период перед овуляцией и вероятным зачатием в середине лютеиновой фазы — здесь наблюдаются пики синтеза эстрогенов. Предположительно, лобно-теменной контроль и дорсальные сети внимания будут наиболее чувствительны к гормональным колебаниям в течение цикла [11]. Возможно, это одно из объяснений, почему женщинам легче отлично выполнять сразу несколько дел, в отличие от мужчин, зачастую концентрирующихся на одной конкретной задаче.
И немного о наболевшем. Латеральная орбитофронтальная кора, которая участвует в принятии решений, у женщин в лютеиновой фазе менструального цикла (организм вовсю ожидает наступления беременности) активируется при взгляде на высококалорийное блюдо (рис. 2). Кажется, наш мозг хочет сказать — тебе скоро понадобится много сил, детка, скушай еще пирожок! А вот в фолликулярной фазе активность этой части головного мозга, наоборот, взаимосвязана с реакцией на блюда с низкокалорийной пищей [12]. Вот уж точно гормональная диета, а главное — естественная.
Рисунок 2. Предпочтения в пище на разных стадиях менструального цикла
Определенно, исследования показывают, как велика роль половых стероидных гормонов в регуляции структуры и функции мозга, особенно в областях, богатых рецепторами эстрогена, таких как префронтальная кора и гиппокамп [13]. Масштаб этого влияния трудно недооценить, ведь репродуктивный возраст — весьма длительный период в жизни женщины, чаще всего занимающий бóльшую ее часть. На этом фоне период беременности с последующими родами выглядят куда менее впечатляюще, но как бы не так…
Зарождение жизни и нейрогормональный переполох
Итак, зачатие произошло. Что же дальше? Чтобы беременность развивалась и закончилась благополучно, в головном мозге происходит ряд адаптационных изменений. В основном все они связаны с гормонами беременности, которые обеспечивают поступление ребенку питательных веществ, защиту плода от гормонов стресса и воспалительных медиаторов из крови матери, а также отвечают за родоразрешение.
Интересные подробности о том, как развивается эмбрион в теле женщины, можно найти в статье «Эмбриональное манипулирование» [14].
Но не только гормоны отвечают за изменения в мозге. Есть еще иммунная система и меняющийся режим, под который женщине и ее нервной системе приходится подстраиваться (рис. 3).
Рисунок 3. Факторы, которые оказывают значительное влияние на изменение функциональной активности некоторых отделов головного мозга
рисунок автора статьи
Гормональные изменения
Значительные перемены коснутся концентраций таких гормонов, как прогестерон, эстроген, кортизол, окситоцин, тестостерон и дофамин.
Уровни прогестерона и эстрогена помогают женскому организму подготовиться к родам и поддерживают развитие растущего внутри плода. Концентрации этих гормонов экспоненциально растут в течение беременности и резко снижаются после родоразрешения (рис. 4) [15].
Уровень кортизола постепенно увеличивается, достигая пика во время родов, а после них приходит в норму в течение всего трех дней. Этот гормон играет значительную роль в обеспечении нормального развития органов плода, а также участвует в активации путей, связанных с родами.
Уровень окситоцина также растет по мере приближения родов, активно вырабатывается во время последних и продолжает синтезироваться в значительных количествах при грудном вскармливании, и даже без него, формируя привязанность матери к ребенку.
Не так сильно, как в случае с предыдущими гормонами, вырастает уровень тестостерона и приходит в норму после родов [16].
Рисунок 4. Сравнение изменений уровней гормонов во время беременности и вскоре после родов у человека и крысы, которая не столь склонна к заботе о потомстве. В первую очередь, у человека наблюдается более плавный рост концентрации таких гормонов, как кортизол, эстрадиол и прогестерон. Снижение после родов также происходит постепенно. У крысы уровень синтеза этих гормонов возрастает интенсивнее, чем у человека, но и к норме возвращается быстрее. Это может быть обоснованно сроком беременности — у человека она протекает значительно дольше.
Другой интересный пример подготовки мозга к родам — это изменения в ингибиторно-опиоидных механизмах, которые способствуют накоплению нейрогипофизарных запасов окситоцина. Опиоидные пептиды, например эндорфины, взаимодействуют с опиоидными рецепторами. Как правило, эти механизмы необходимы для выстраивания реакции на болевые ощущения и формирования соответствующего эмоционального настроя. Аллопрегнанолон, нейроактивный метаболит прогестерона, сдерживает окситоциновые нейроны [17]. Они регулируют «расход» окситоцина. Большой запас окситоцина, контролирующего схватки , нужен для благополучного завершения беременности — родов.
Подробнее об окситоцине и всех его функциях читайте в статье «Сама неоднозначность: гормон окситоцин» [18].
Но есть и более тонкие «настройки». Перемены в том числе происходят в центральных механизмах контроля аппетита, например, за счет возникновения резистентности рецепторов к лептину [13]. Этот пептид регулирует образование и накопление жира в организме. Тут мы снова возвращаемся к желанию мозга нас накормить, ведь такое изменение способствует увеличению количества употребляемой пищи и обеспечивает дополнительный запас энергии для женщины, который откладывается в виде жира [19]. Однако переживать на этот счет не стоит, это особый жир, он пойдет в ход во время лактации.
Так а что с мозгом-то? Трудности с исследованием процессов на беременных женщинах ставят палки в колеса тем, кто хочет пролить свет на ситуацию. По большей части приходится довольствоваться экспериментами на животных и данными о воздействии гормонов на мозг у небеременных. Вне контекста беременности изменения фиксируются, давайте ознакомимся с некоторыми:
- растущие уровни половых стероидов в период полового созревания вызывают изменения в объемах серого и белого веществ головного мозга [20];
- колебания уровня эстрогена в течение менструального цикла воздействуют на активность некоторых областей мозга, например дорсо-латеральной префронтальной коры [21]. Так как эта часть мозга отвечает за планирование, то можно предположить, что женский мозг в течение цикла регулярно находится на низком старте в ожидании беременности;
- эндогенные гормоны (тестостерон, прогестерон, эстрадиол) модулируют нейронные сети, играющие роль в регуляции эмоций, — в миндалевидном теле, медиальной префронтальной и орбитофронтальной коре [22]. Вероятно, это может объяснять пресловутую женскую эмоциональность, вызванную беспрерывной гормональной игрой цикла.
Иммунные изменения
Иммунная система вовсю примеряет организм ребенка к матери. Известно, что во время беременности повышается уровень провоспалительных цитокинов в крови. А они в свою очередь опосредованно влияют на активность таких нейромедиаторов, как дофамин, серотонин и глутамат [23].
Например, цитокины активируют кинуреиновый путь распада триптофана, который истощает запасы этой аминокислоты, участвующей в синтезе серотонина [24]. Помимо этого, кинуреиновый путь способствует синтезу метаболитов, оказывающих влияние на регуляцию активности дофамина и глутамата. В результате затронутыми оказываются различные нейронные сети, включая базальные ганглии и переднюю поясную кору, что приводит к изменениям в двигательной активности, к чрезмерной тревоге и возбуждению [25]. Тут важно помнить, что все это — лишь побочные эффекты, а цель у организма совсем другая. Вынашивая ребенка, он приводит себя в тонус, чтобы в случае чего защитить новую жизнь от инфекций.
Изменения в длительности, частоте и качестве сна
Подтверждено, что структурные и функциональные изменения в головном мозге могут быть объяснены недостатком сна у матерей. Сперва он может быть вызван трудностями в вынашивании малыша, особенно на поздних сроках беременности, и связанной с этим тревогой. А после, даже если малыш ведет себя спокойно, в первые месяцы жизни он нуждается в ночных кормлениях, которые так или иначе приводят к нарушению привычного режима.
Сокращение продолжительности и качества сна влияет на объем серого вещества и функциональные связи в состоянии покоя [26]. Даже одна бессонная ночь может привести к повышению активности миндалевидного тела в ответ на изображения с негативным эмоциональным окрасом [27]. Закономерно будет наблюдать также снижение концентрации и когнитивных способностей в целом.
И вот долгожданный день настал, и ребенок оказался на руках у матери. Организму предстоит много работы по экспресс-возвращению в добеременное состояние. Впрочем, наступил период материнства, нейрогормональные приключения возвращаются к стадии «менструальные качели» плюс уже рожденный ребенок, которого еще следует выкормить и вырастить.
Материнство — кругом голова
Сразу после рождения ребенка женщина становится матерью. И тут происходит настоящий бедлам. Весь организм работает сверхурочно. Требуется срочная перестройка многих процессов. Запускаются нейронные цепи, которые организуют особенности материнского поведения. Снова главными героями выступают эстроген, прогестерон, лактоген, а одной из сцен, где разворачиваются активные действия, становится медиальная преоптическая область [28]. Именно с ней связаны функции родительской заботы у особей как женского, так и мужского пола.
Даже в самой миролюбивой женщине после родов просыпается настоящая тигрица, стоит зайти речи о безопасности ее детеныша. Из-за повышенного выделения окситоцина и снижения активности серотониновых нейронов растет агрессивность (в хорошем смысле). Кроме того, часть когнитивных функций начинает снижаться еще во время беременности, что с приходом материнства продолжает усугубляться (рис. 5). Одной из основных задач мозга матери становится сохранение жизни ее детеныша. Некоторые перемены могут показаться негативными, но это не так. У всех изменений одна цель — повысить шансы ребенка на выживание. Например, повышение материнской тревожности помогает обеспечить малышу безопасность.
Рисунок 5. Перераспределение энергии между потребностями матери и малыша. В некоторых областях мозга наблюдается нейродегенерация для того, чтобы другие получили больше ресурсов. Как правило, некоторые когнитивные функции материнского мозга снижаются в угоду поддержания жизни и благополучия ребенка.
Когда мама слышит плач своего малыша, на МРТ фиксируется активность правой лобно-инсулярной коры. При этом на плач чужого ребенка такой реакции не возникает [29]. Известно, что эта часть мозга связана с построением межличностных отношений, эмоциями и восприятием. Матери знают, насколько неприятно слышать плач своего малыша, это стрессовая ситуация, которая требует разрешения, желательно быстрого. По-видимому, именно в этой части головного мозга закрепляется самая базовая реакция матери, которая обеспечивает безопасность младенца — стоит ему только пискнуть, как материнские руки тут как тут. Другой значимой в материнстве частью мозга, как вы уже догадались, является миндалевидное тело. Ученые даже предположили, что сниженная активность матери в воспитании и уходе за ребенком связана со сниженной функцией этой части мозга [30]. Возможно, редкие случаи незаинтересованности матери в уходе за малышом связаны с гипофункцией миндалевидного тела в период материнства.
Способность матери сопереживать — одна из основополагающих для здорового психического воспитания детей. Подтверждено, что женщины с ребенком, как правило, проявляют больше способностей к эмпатии и острее чувствуют боль другого человека. Это можно понять, наблюдая повышенную двухстороннюю активацию передних островковых долей [31]. Возможно, негативной стороной такой активности может стать излишняя чувствительность и склонность к депрессии — нередкому явлению в послеродовой период.
Долгое путешествие в мир родительства
Некоторые изменения в структурах и активности отдельных частей мозга довольно быстро возвращаются к состоянию «до», другим понадобится больше времени, а часть из них останется навсегда измененной. Так, уменьшение объемов головного мозга у беременных с одновременным увеличением желудочков уже через полгода после родов нивелируется. А гипофиз, в клетках которого синтезируется часть нейропептидов, участвующих в поддержании беременности, увеличивается по мере протекания беременности и возвращается к нормальному размеру вскоре после родов [32].
А вот изменения в объеме серого вещества, которые происходят у женщин во время беременности, наблюдаются даже через шесть лет после родов [33]. Возможно, это связано с тем, что шестилетний ребенок все еще требует довольно большого количества материнского участия. Есть данные даже о том, что здесь возврат к прежним характеристикам не завершается и спустя десять лет [34]. Видимо, ученым придется повторить измерения, когда потомству будет лет так двадцать пять. Возможно, объем серого вещества начнет возвращаться к тому, каким он был задолго до путешествия под названием материнство. Или же нет, ведь к тому времени женщина может стать бабушкой, а они, как мы все знаем, в стороне от заботы о детях в семье (даже если не своих) не остаются.
Заключение
На этом рассказ о мозге и материнстве подошел к концу. Мы выяснили, что ключевыми регуляторами процессов, связанных с подготовкой, ожиданием и появлением в семье ребенка, являются гормоны, а часть из них синтезируется в мозге. Фокус некоторых областей мозга смещается на обеспечение безопасности ребенка, что закономерно. Стоит запомнить, что большинство изменений в активности разных частей мозга вскоре возвращается в состояние до беременности и родов, и лишь некоторые перемены остаются с женщинами на годы вперед, например, в объеме серого вещества. И речь здесь не о снижении когнитивных способностей или излишней эмпатии и эмоциональности. Нет, они говорят лишь о том, что отныне материнский мозг должен обеспечить сохранение жизни другому организму, а значит, у него появляется новая, чрезвычайно важная, полная забот и радостей, задача.
Также доказано, что отцовский мозг явно ощущает на себе перемены в семейной жизни, а степень изменений в структурах и функциональной активности напрямую связаны с уровнем вовлеченности родителя в уход за малышом.
Таким образом, родительство — это бесконечное приключение, особенно для нашего мозга, во всех смыслах.
- Tolu Oyelowo. (2007). Menstrual Cycle. Mosby’s Guide to Women’s Health. 11-15;
- Тик-так по-шведски. Нобелевская премия за циркадные ритмы;
- Найдена связь между обменом веществ и циркадным ритмом;
- Снова о циркадных ритмах;
- Nina Lisofsky, Johan Mårtensson, Anne Eckert, Ulman Lindenberger, Jürgen Gallinat, Simone Kühn. (2015). Hippocampal volume and functional connectivity changes during the female menstrual cycle. NeuroImage. 118, 154-162;
- E. Jacobs, M. D’Esposito. (2011). Estrogen Shapes Dopamine-Dependent Cognitive Processes: Implications for Women’s Health. Journal of Neuroscience. 31, 5286-5293;
- Stephanie N. Steinberg, Neami B. Tedla, Erin Hecht, Diana L. Robins, Tricia Z. King. (2022). White matter pathways associated with empathy in females: A DTI investigation. Brain and Cognition. 162, 105902;
- Carolin A. Lewis, Ann-Christin S. Kimmig, Rachel G. Zsido, Alexander Jank, Birgit Derntl, Julia Sacher. (2019). Effects of Hormonal Contraceptives on Mood: A Focus on Emotion Recognition and Reactivity, Reward Processing, and Stress Response. Curr Psychiatry Rep. 21;
- Valerie L. Jentsch, Lisa Pötzl, Oliver T. Wolf, Christian J. Merz. (2022). Hormonal contraceptive usage influences stress hormone effects on cognition and emotion. Frontiers in Neuroendocrinology. 67, 101012;
- Kimberly Albert, Jens Pruessner, Paul Newhouse. (2015). Estradiol levels modulate brain activity and negative responses to psychosocial stress across the menstrual cycle. Psychoneuroendocrinology. 59, 14-24;
- Laura Pritschet, Tyler Santander, Caitlin M. Taylor, Evan Layher, Shuying Yu, et. al.. (2020). Functional reorganization of brain networks across the human menstrual cycle. NeuroImage. 220, 117091;
- D. A. Van Vugt. (2010). Brain imaging studies of appetite in the context of obesity and the menstrual cycle. Human Reproduction Update. 16, 276-292;
- Paula J. Brunton, John A. Russell. (2008). The expectant brain: adapting for motherhood. Nat Rev Neurosci. 9, 11-25;
- Манипулирование. II. Эмбриональное манипулирование;
- Navneet Magon, Pratap Kumar. (2012). Hormones in pregnancy. Niger Med J. 53, 179;
- Laura A. Thompson, Wenda R. Trevathan. (2008). Cortisol reactivity, maternal sensitivity, and learning in 3-month-old infants. Infant Behavior and Development. 31, 92-106;
- Alison J. Douglas, John A. Russell. (2001). Chapter 5 Endogenous opioid regulation of oxytocin and ACTH secretion during pregnancy and parturition. Progress in Brain Research. 67-82;
- Сама неоднозначность: гормон окситоцин;
- Laura Pritschet, Tyler Santander, Caitlin M. Taylor, Evan Layher, Shuying Yu, et. al.. (2020). Functional reorganization of brain networks across the human menstrual cycle. NeuroImage. 220, 117091;
- J.S. Peper, H.E. Hulshoff Pol, E.A. Crone, J. van Honk. (2011). Sex steroids and brain structure in pubertal boys and girls: a mini-review of neuroimaging studies. Neuroscience. 191, 28-37;
- Zenab Amin, C. Neill Epperson, R. Todd Constable, Turhan Canli. (2006). Effects of estrogen variation on neural correlates of emotional response inhibition. NeuroImage. 32, 457-464;
- G.A. van Wingen, L. Ossewaarde, T. Bäckström, E.J. Hermans, G. Fernández. (2011). Gonadal hormone regulation of the emotion circuitry in humans. Neuroscience. 191, 38-45;
- Emma Bränn, Fotios Papadopoulos, Emma Fransson, Richard White, Åsa Edvinsson, et. al.. (2017). Inflammatory markers in late pregnancy in association with postpartum depression—A nested case-control study. Psychoneuroendocrinology. 79, 146-159;
- Серотониновые сети;
- Andrew H. Miller, Ebrahim Haroon, Charles L. Raison, Jennifer C. Felger. (2013). CYTOKINE TARGETS IN THE BRAIN: IMPACT ON NEUROTRANSMITTERS AND NEUROCIRCUITS. Depress Anxiety. 30, 297-306;
- Adam J. Krause, Eti Ben Simon, Bryce A. Mander, Stephanie M. Greer, Jared M. Saletin, et. al.. (2017). The sleep-deprived human brain. Nat Rev Neurosci. 18, 404-418;
- Andrea N. Goldstein, Matthew P. Walker. (2014). The Role of Sleep in Emotional Brain Function. Annu. Rev. Clin. Psychol.. 10, 679-708;
- Paula J. Brunton, John A. Russell. (2008). The expectant brain: adapting for motherhood. Nat Rev Neurosci. 9, 11-25;
- A. E. Hipwell, C. Guo, M. L. Phillips, J. E. Swain, E. L. Moses-Kolko. (2015). Right Frontoinsular Cortex and Subcortical Activity to Infant Cry Is Associated with Maternal Mental State Talk. Journal of Neuroscience. 35, 12725-12732;
- Jennifer Barrett, Kathleen E. Wonch, Andrea Gonzalez, Nida Ali, Meir Steiner, et. al.. (2012). Maternal affect and quality of parenting experiences are related to amygdala response to infant faces. Social Neuroscience. 7, 252-268;
- Irene Sophia Plank, Catherine Hindi Attar, Stefanie L. Kunas, Isabel Dziobek, Felix Bermpohl. (2021). Increased activation in the bilateral anterior insulae in response to others in pain in mothers compared to non-mothers. Sci Rep. 11;
- Emilia F Cárdenas, Autumn Kujawa, Kathryn L Humphreys. (2020). Neurobiological changes during the peripartum period: implications for health and behavior. Social Cognitive and Affective Neuroscience. 15, 1097-1110;
- Magdalena Martínez-García, María Paternina-Die, Erika Barba-Müller, Daniel Martín de Blas, Laura Beumala, et. al.. (2021). Do Pregnancy-Induced Brain Changes Reverse? The Brain of a Mother Six Years after Parturition. Brain Sciences. 11, 168;
- Jurate Aleknaviciute, Tavia E. Evans, Elif Aribas, Merel W. de Vries, Eric A. P. Steegers, et. al.. (2022). Long-term association of pregnancy and maternal brain structure: the Rotterdam Study. Eur J Epidemiol. 37, 271-281;
- Magdalena Martínez-García, María Paternina-Die, Sofia I Cardenas, Oscar Vilarroya, Manuel Desco, et. al.. (2022). First-time fathers show longitudinal gray matter cortical volume reductions: evidence from two international samples. Cerebral Cortex;
- Françoise Diaz-Rojas, Michiko Matsunaga, Yukari Tanaka, Takefumi Kikusui, Kazutaka Mogi, et. al.. (2021). Development of the paternal brain in expectant fathers during early pregnancy. NeuroImage. 225, 117527;
- Paula Duarte-Guterman, Benedetta Leuner, Liisa A.M. Galea. (2019). The long and short term effects of motherhood on the brain. Frontiers in Neuroendocrinology. 53, 100740;
- Anna Ziomkiewicz, Szymon Wichary, Grazyna Jasienska. (2019). Cognitive costs of reproduction: life‐history trade‐offs explain cognitive decline during pregnancy in women. Biol Rev. 94, 1105-1115.