Аксон (от греческого ἄξων áxōn , ось) или нервное волокно (или нервное волокно : см. различия в правописании ) представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия. от тела нервной клетки . Функция аксона заключается в передаче информации к различным нейронам, мышцам и железам. В некоторых сенсорных нейронах ( псевдоуниполярных нейронах ), таких как сенсорные и тепловые, аксоны называются афферентными нервными волокнами .и электрический импульс проходит по ним от периферии к телу клетки и от тела клетки к спинному мозгу по другой ветви того же аксона. Дисфункция аксонов вызывает множество наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна подразделяются на три типа : нервные волокна группы А, нервные волокна группы В и нервные волокна группы С. Группы А и В миелинизированы , а группа С немиелинизированы. Эти группы включают как сенсорные, так и моторные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон представляет собой один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно сохраняют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, тогда как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксонов и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. [1]Ни один нейрон никогда не имеет более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга. [2]
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой . Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями . Набухший конец телодендрона известен как окончание аксона , которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическую связь. Аксоны вступают в контакт с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в местах соединения, называемых синапсами . В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсе . В синапсе мембранааксона вплотную прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через щель. Некоторые синаптические соединения появляются по длине аксона по мере его растяжения — они называются en passant («мимоходными») синапсами, и их может быть сотни или даже тысячи вдоль одного аксона. [3] Другие синапсы появляются в виде терминалов на концах ветвей аксонов.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе [ 4] и пучок в периферической нервной системе . У плацентарных млекопитающих самым большим трактом белого вещества головного мозга является мозолистое тело , состоящее примерно из 200 миллионов аксонов человеческого мозга . [4]
Типичный миелинизированный аксон
Деталь, показывающая микротрубочки на бугорке аксона и начальном сегменте.
TEM миелинизированного аксона в поперечном сечении.
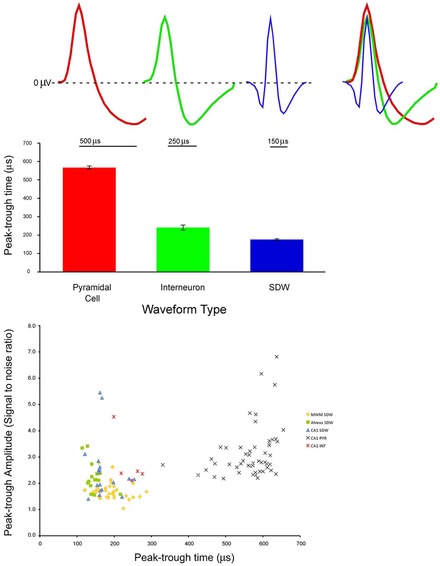
(A) пирамидальная клетка, интернейрон и короткая волна (аксон), наложение трех средних волн;
(B) Средняя и стандартная ошибка времени пика-впадины для интернейронов пирамидных клеток и предполагаемых аксонов;
(C) Диаграмма рассеяния отношения сигнал-шум для отдельных единиц в зависимости от времени пика-впадины для аксонов, пирамидальных клеток (PYR) и интернейронов (INT).
Аксон девятидневной мыши с видимым конусом роста
НЕРВНАЯ ТКАНЬ
Собственно нервную ткань составляют нервные клетки (нейроны) с их отростками и клетки глии. Сосуды и оболочки мозга имеют мезодермальное происхождение. Неврология изучает данные структуры организма.
2.5.1. Историческая справка
Успехи оптики, приведшие к созданию светового микроскопа, и достижения химии, позволившие получить анилиновые и другие красители, привели к возникновению и развитию гистологии. Это позволило во второй половине XVIII в. обнаружить в мозге нервные волокна (Монро А., 1787; Фонтан Ф., 1781; Рейли И., 1796); в 30-х годах XIX в. были описаны и нервные клетки (ЭрснбергХ., в 1833; Пуркинье Я., Шванн Т., в 1838). В 1865 г. О. ДеИтере (1834-1863) и в 1867 г. А.Я. Кожевников доказали, что нервные волокна являются отростками нервных клеток. О. Дейтерс отметил, что один из отростков обычно длинный, остальные — короткие. Эти отростки получили название соответственно аксон (нейрит) и дендриты. В 1887 г. испанский нейроморфолог С. Рамон-и-Кахаль (S. Ramon у Cajal, 1852—1934) сформулировал положения:
- 1) концевые разветвления длинного отростка нервной клетки — аксона свободно оканчиваются в сером веществе мозга и не образуют сетей;
- 2) между отростками нервных клеток существуют контакты;
- 3) в местах контакта волокон или волокна и тела клетки передача нервного импульса происходит по принципу электрических проводников, возможно через индукцию1.
В 1891 г. С. Рамон-и-Кахаль установил закон динамической поляризации нервной клетки: нервный импульс перемещается по клетке и ее отросткам всегда в одном направлении: дендрит —> тело клетки —> аксон. В том же году немецкий исследователь В. Вальдейер (WaldeyerW., 1836—1921) назвал нервную клетку со всеми ее отростками «нейрон» и, опираясь на добытые к тому временем данные о структуре нервной ткани, окончательно сформулировал нейронную теорию ее строения. К тому времени эта теория далеко не всем исследователям представлялась очевидной. Среди ее противников были, в частности, такие видные неврологи, как Ю. Герлах и К. Гольджи — сторонники синцитиального строения мозга.
Уже при макроскопическом осмотре мозга на разрезе выявляется неоднородность составляющей его ткани. В головном и спинном мозге выделяются участки серого и белого вещества. Серое вещество — места скопления тел нервных клеток и протоплазматической астроцитарной глии. Белое вещество состоит в основном из нервных волокон и окружающих их глиальных клеток — главным образом олигодендроцитов и волокнистых астроцитов, при этом белый цвет белого вещества мозга обусловлен цветом миелиновой оболочкой нервных волокон, формирующих проводящие проекционные пути, ко-миссуральные и ассоциативные связи.
2.5.2. Нервная клетка
Нервная клетка (нейрон), признающаяся основной структурной и функциональной единицей нервной системы (рис. 2.3), принципиально отличается от клеток, составляющих другие органы и ткани.
Но функциональная самостоятельность нейрона условна. Так, например, гибель периферических двигательных нервных клеток, расположенных в передних рогах спинного мозга, может лишить смысла активность сопряженных с ними корковых моторных нейронов, так как прерывается путь между двигательными клетками коры и исполнительным органом — в данном случае с определенными поперечнополосатыми мышцами (ситуация, возникающая, к примеру, при эпидемическом полиомиелите). Особенности функции нейронов сказываются на их форме (рис. 2.4) и составе содержащихся в них цито-плазматических органелл.
Каждая нервная клетка (нейрон) имеет тело (перикарион) и отростки. Один из них — маловетвящийся и обычно самый длинный — аксон (нейрит); другие, короткие, имеющие много ответвлений, — дендриты, в типичных случаях характеризующиеся древовидным строением. Форма и размеры нейронов вариабельны. По форме тел их делят на звездчатые, корзинчатые, пирамидные и пр. Размеры тел нейронов варьируют от 4 до 150 мкм в диаметре. Нейроны с большим количеством отростков называют мультиполярными, их большинство. Кроме того, существуют биполярные нейроны с аксоном и одним дендритом, находящиеся главным образом в составе обонятельной, зрительной и слуховой систем, и так называемые псевдоуниполярные клетки, расположенные в спинальных ганглиях и их аналогах, находящихся в составе черепных нервов. Псевдоуниполярные клетки также имеют по два отростка — аксон и дендрит1, но проксимальные части этих отростков прочно прилежат друг к другу, что на препаратах, импрегнированных серебром, создает впечатление униполярности клеток. Принято считать, что только в головном мозге человека насчитывается до 10 млрд нейронов. Возможна классификация нервных клеток и по длине аксонов [клетки с длинными аксонами, выходящими за пределы данного скопления клеток (ядра), называют клетками Гольджи I, клетки с короткими аксонами — клетки Гольджи II). Классифицируются нейроны также и по их функции: сенсорные, моторные, ассоциативные. Особенно значимой для понимания многих клинических проблем является, пожалуй, классификация нейронов по характеру вырабатываемого в них нейромедиатора (нейротранс-миттера). По этому принципу нейроны дифференцируются на холинсргичес-кие, серотонинергические, адреналинергические, ГАМКергические, допами-нергические и т.п.
Тело клетки и ее отростки покрывает непрерывная сдвоенная мембрана (невролемма), представляющая собой липопротеиновый комплекс и выполняющая разграничительную и транспортные функции. Через нее осуществляется пассивный транспорт воды и некоторых низкомолекулярных веществ, а также перенос ионов и органических молекул против градиента концентрации с затратой энергии, возникающей в основном при расщеплении молекул аденозинтрифосфата (АТФ). Последнее свойство мембраны нервной клетки обеспечивает поддержание в ней постоянного мембранного потенциала покоя, а также возникновение возбуждающего или тормозного постсинаптического потенциалов (ВПСП или ТПСП), определяющих формирование нервного импульса в связи с резким изменением проницаемости клеточных мембран для содержащих биоэлектрический заряд ионов.
Нейрон (рис. 2.3) не только обеспечивает проведение импульсов, но и синтезирует белки, липиды, углеводы, а также нейромедиаторы (нейротрансмиттеры). Некоторые нейроны к тому же продуцируют гормоны (вазопрессин, окситоцин, антидиуретический гормон, рилизинг-факторы). В теле нейрона находится цитоплазма и ядро с расположенным в нем ядрышком, а также базофильные органоиды (органеллы): пластинчатый комплекс (комплекс Гольджи), митохондрии, лизосомы, имеющиеся и в соматических клетках, и, кроме того, специфическое для нервных клеток базофильное вещество Ниссля, нейрофибриллы и нейротрубочки. Включениями в цитоплазме нервных клеток могут быть гранулы гликогена, каротиноидов, пигмента и пр.
Ядро нервной клетки относительно большое, слабо окрашивается, содержит много дезоксирибонуклеиновой кислоты (ДНК); его окружает двухслойная мембрана с множеством пор, через которые совершается обмен между цитоплазмой и заполняющей ядро нуклеоплазмой. В ядре происходит синтез рибонуклеиновой кислоты (РНК), которая проникает из него в плазму и участвует в формировании органелл клетки. Заключенное в ядре ядрышко представляет собой лишенное мембраны меняющееся по форме, размеру и химическому составу образование, состоящее из РНК, белков, липидов и находящегося внутри слоя ДНК. Изменчивость ядрышка отражает его высокую физиологическую активность.
Пластинчатый комплекс Гольджи (липохондрии), как и ядрышко, в процессе жизнедеятельности клетки подвергается циклическим изменениям. Он состоит из плотно упакованных двухслойных мембран и гранул, содержит липиды, фос-фатиды, мукополисахариды и участвует в синтезе углеводных полимеров, гормонов.
Рис. 2.3. Нейрон, его отростки: 1 — дендриты, 2 — аксон, 3 — разветвления аксона.
Рис. 2.4. Некоторые виды нейронов (по Бейли).
I — периферический чувствительный нейрон; 2 — короткоаксонный нейрон типа Голь-джи II; 3 — периферический мотонейрон; 4 — обонятельный нейрон; 5 — клетка зернистого слоя мозжечка; 6 — нейрон симпатического узла; 7 — клетка Пуркинье; 8 — пирамидная клетка Беца. Стрелки показывают направление перемещающихся по клетке нервных импульсов.
Митохондрии имеют палочковидную форму, рассеяны по всей цитоплазме нейрона. Особенно много их в наиболее активных частях нейрона: в его теле и окончаниях ветвлений аксона (в пресинаптических пуговках). Митохондрии содержат дыхательные ферменты и играют важную роль в осуществлении дыхания клетки, обеспечивая процесс окислительного фосфорилирования (окисление углеводов и жиров) и участия в гликолизе. Основная функция митохондрий связана с образованием богатой энергией АТФ.
Лизосомы имеют вид вакуолей, содержат гидролитические ферменты (протеиназы, нуклеазы, глюкозидазы, фосфатазы, липазы), расщепляющие различные биополимеры. Основная функция лизосом — расщепление биологических макромолекул внутриклеточного и внеклеточного происхождения на более простые микромолекулы, которые впоследствии могут быть утилизированы в результате происходящего в нейроне биосинтеза более сложных соединений.
Рис. 2.5. Компоненты периферического мотонейрона [По Дж. Шаде и Д. Форду]. I — ядро; 2 — ядрышко; 3 — сателлит ядрышка; 4 — дендрит; 5 — эндоплазматичес-кая сеть с гранулами РНК (вещество Ниссля); 6 — синапс; 7 — ножка астроцита; 8 — гранулы ДНК; 9 — липофусцин; 10 — аппарат Гольджи; 11 — митохондрия; 12 — аксонный холмик; 13 — нейрофибриллы; 14 — аксон; 15 — миелиновая оболочка; 16 — перехват Ранвье; 17 — ядро леммоцита; 18 — леммоцит в области нервно-мышечного синапса; 19 — ядро мышечной клетки; 20 — нервно-мышечное соединение; 21 — мышца.
Базофильное вещество Ниссля (тигроид) составляют базофильные трубчатые структуры и гранулы из РНК, соединенной с белком (РНК-Б). Глыбки вещества Ниссля рассеяны по всей цитоплазме нейрона и участвуют в формировании ее эндоплазматической сети. Измельчаясь, они проникают в его дендриты, однако в аксоне и в той части тела клетки, от которой начинается аксон, базофильное вещество отсутствует. Признано, что оно осуществляет синтез белков, происходящий под контролем генетического аппарата ядра. Количество базофильного вещества в нервной клетке изменчиво и зависит от ее функционального состояния.
Среди включений в нервной клетке особое значение имеет нейромеланин, скопление которого наблюдается в черном веществе (substantia nigra) среднего мозга. Нейромеланин — необходимое звено в процессе образования катехола-минов.
2.5.3. Нервные волокна
Нервное волокно — в большинстве случаев аксон нервной клетки, состоит из осевого цилиндра, покрытого миелиновой оболочкой. Толщина аксона составляет от 0,3 до 20 мкм и зависит главным образом от толщины миелиновой оболочки, которая образуется за счет многократного обертывания фрагментов осевого цилиндра «избыточной» оболочкой прилежащих к нему глиальных клеток, в центральной нервной системе — олигодендроцитов, в периферической нервной системе — шванновских клеток (леммоциты). Образуемая таким образом миелиновая оболочка состоит из слоев, спиралеобразно окружающих осевой цилиндр аксона, число их может быть 100 и более (рис. 2.6). В состав миелиновой оболочки входят холестерин, фосфолипиды, некоторые цереброзиды и жирные кислоты, а также белковые вещества. Между фрагментами миелиновой оболочки, каждый из которых сформирован за счет оболочки ближайшей глиальной клетки, образуются просветы — перехваты Ранвье (см. рис. 2.5). Скорость проведения по волокну нервного импульса прямо пропорциональна толщине его миелиновой оболочки и варьирует от 0,6 до 20 м/с.
Американские физиологи Г. Гассер (Gasser H.S., 1888—1963) и Дж. Эрлан-гер (Erlanger G., 1874—1965) в 1924 г. разделили аксоны на группы А, В и С. Большинство миелиновых волокон относятся к группе А. Группу В составляют белые соединительные ветви, относящиеся к симпатической нервной системе. В группу С входят наиболее тонкие нервные волокна, которые обычно называют безмиелиновыми (безмякотными), однако и они, как правило, имеют хотя бы очень тонкую, однослойную миелиновую оболочку. Волокна группы А делятся по толщине на А-альфа, А-бета и А-гамма. А-альфа наиболее толстые из них1.
Зная толщину миелинового волокна, можно определить скорость проведения по нему нервного импульса. Если волокно толще 1 мкм, можно пользоваться формулой: V (скорость проведения нервного импульса) = диаметр волокна (в мкм), умноженный на 6. Полученное произведение обозначается в м/с.
1 Г. Гассер и Дж. Эрлангер в 1944 г. удостоены Нобелевской премии.
Рис. 2.6. Поперечные срезы нервного волокна на разных этапах процесса его миелинизации (аксон и леммоцит).
а, б, в — стадии формирования мие-линовой оболочки.
Для определения скорости проведения импульсов по волокнам С (диаметр меньше 1 мкм) может быть применена другая формула: V = диаметр волокна (в мкм), умноженный на 2. Полученное произведение обозначается в м/с. Д. Ллойд (D. Lloyd) классифицирует аксоны по их диаметру: 1-я группа — 12—20 мкм; 2-я группа — 6—12 мкм; 3-я группа — 1—6 мкм; 4-я группа — меньше 1 мкм.
2.5.4. Аксоток
Для нейрона характерна исключительно высокая активность метаболических процессов. Биосинтез большинства макромолекул клетки осуществляется в ее теле. Отсюда они распространяются по аксону посредством ортоградного аксонального тока. Различают быстрый ортоградный аксональный ток (аксо-нальный транспорт), или быстрый компонент аксотока, благодаря которому по аксону транспортируются молекулы белка, гликопротеиды и фосфолипиды, некоторые ферменты, необходимые для поддержания текущего метаболизма, со скоростью 200-400 мм/суг. Медленный аксональный ток (аксональный транспорт) обеспечивает перенос из тела клетки к периферии аксона материала для восстановления клеточного каркаса (микротубулярно-нейрофиламен-тарной сети) со скоростью 0,3—1,0 мм/сут и актиносодержащих микрофила-ментов и аксоплазматического матрикса со скоростью 2—4 мм/сут.
Большинство переносимых по аксону молекул включается в метаболизм в пределах нейрона; они обеспечивают восстановление его энергетических затрат, рост и регенерацию аксонов. Часть из них может переходить в постсина-птические структуры, а также в прилежащие глиальные клетки, участвуя таким образом, в частности, и в формировании миелиновой оболочки.
Рис. 2.7. Синаптические процессы в возбужденном синапсе [По Л. Шельцыну, 1980). А — ацетат; X — холин; АХ — ацетилхолин; Хэ — холинэстераза; ВПСП — возбудительный постсинаптический потенциал.
Продукты происходящих в аксоне процессов метаболизма посредством ретроградного аксонального тока со скоростью 150—300 мм/сут перемещаются в тело клетки, где подвергаются дальнейшему разрушению ферментами лизосом до составных элементов, используемых при формировании вновь синтезируемых в теле нейрона макромолекул. Таким образом, ретроградный аксональный ток обеспечивает возможность осуществления в теле клетки процессов вторичной утилизации микромолекул.
2.5.5. Синаптическая передача
Место, где окончание аксона сближается с дендритом или телом следующей в нейронной цепи нервной клетки, по предложению Ч. Шеррингтона (Sherrington Ch., 1857—1952), называется синапсом (от греч. sinapto — застежка, соединение). Конечные ветвления аксона — телодендрии заканчиваются утолщением (пресинаптическая пуговка), в котором содержатся митохондрии и пузырьки с квантами медиатора (рис. 2.7). Участок невролеммы пресинаптической пуговки, особенно близко расположенный к структурам следующего нейрона, называется пресинаптической мембраной. Находящийся в непосредственной близости от него участок невролеммы последующего нейрона называется постсинаптической мембраной. Между пресинаптической и постсинаптической мембранами расположена узкая синаптическая щель (ширина ее приблизительно 200 А, или 0,02 мкм).
Когда нервный импульс доходит до пресинаптической пуговки, из расположенных в ней синаптических пузырьков в синаптическую щель выделяется квант нейромедиатора, который достигает постсинаптической мембраны и меняет ее проницаемость для находящихся вокруг положительно и отрицательно заряженных ионов, вызывая, таким образом, в расположенном по другую сторону синаптической шели нейроне возникновение возбуждающего или тормозного постсинаптического потенциала. В результате нейромедиатор обеспечивает химическую передачу нервного импульса через синаптическую шель и, по сути, служит посредником для передачи нервного импульса от передающего его нейрона к воспринимающему.
Выделившиеся в синаптическую щель кванты медиатора отчасти возвращаются через пресинаптическую мембрану назад (обратный захват) в пресинап-тическую пуговку, отчасти медиатор разрушается в синаптической щели под влиянием определенного фермента. Например, в нервно-мышечном синапсе и в синаптическом аппарате других холинергических нейронов таким ферментом является антихолинэстераза. Функции медиаторов (нейротрансмиттеров) могут выполнять многие биологические вещества, чаще аминокислоты. По влиянию на синаптические аппараты нейротрансмиттеры могут быть разделены на возбуждающие и тормозные. К возбуждающим относится глутамат и аспартат, а к тормозным — ГАМК и глицин. Кроме того, выделяется группа нейротрансмиттеров, состоящая главным образом из моноаминов (дофамин, норадреналин, серторонин), при этом одни и те же нейротрансмиттеры могут, воздействуя на одни нейроны, оказывать возбуждающее действие, тогда как влияние их на другие нейроны может быть тормозным. Так, ацетилхолин нервно-мышечного синаптического аппарата возбуждает мышечные волокна, а ацетилхолин как медиатор стриопаллидарных нейронов обеспечивает тормозное влияние на клетки бледного шара.
Помимо трансмиттеров, на синаптическую передачу могут оказывать усиливающее или ослабляющее действие нейромодуляторы (эндорфины, сома-тостатин, субстанция Р) и нейрогормоны (ангиотензин, вазопрессин и др.), которые, однако, сами по себе не создают деполяризационного эффекта. Нейрогормоны попадают в кровяное русло и разносятся с кровью на большие расстояния. Их действие уступает модуляторам по темпу, но проявляется длительнее.
Синапсы обеспечивают регуляцию потока нервных импульсов и определяют проведение их всегда в одном направлении. Цепи нейронов, по которым определенные нервные импульсы проходят в одном направлении, формируют проводящие пути. Проводящий путь может состоять из гетерогенных по характеру выделяемого медиатора нейронов. Химическая передача нервного импульса через синаптический аппарат была доказана в 1921 г. австрийским нейрофизиологом О. Леви (Loewi О., 1873-1961).
УСЛОВНЫЕ СОКРАЩЕНИЯ
АКТГ – адренокортикотропный гормон
АлдДГ – альдегиддегидрогеназа
АлкДГ – алкогольдегидрогеназа
АНС – автономная нервная система
АПН – алкогольная полиневропатия
АцДГ – ацетальдегид дегидрогеназа
БАС – боковой амиотрофический склероз
ВПГМ – вызванные потенциалы головного мозга
ВПСМ – вызванные потенциалы спинного мозга
ВС – вибростимуляция
ВЦП – время центрального проведения
ВЧД – внутричерепное давление
ГБО – гипербарическая оксигенация
ДЕ – двигательная единица
ДН – диабетическая невропатия
ДПН – диабетическая полиневропатия
ЖКТ – желудочно-кишечный тракт
ИВЛ – искусственная вентиляция легких
КС – коллатеральный спрутинг
КТ – компьютерная томография (томограмма)
ЛФК – лечебная физкультура
МД – магнитная диагностика
МНФ – мозговой нейротрофический фактор
МПД – минимальная пирогенная доза
мРНК – митохондриальная рибонуклеиновая кислота
МРФ – мозговой ростовой фактор
МС – магнитная стимуляция
МТГФР – метилентетрагидрофолатредуктаза
НАДФ – никотинамидадениндинуклеотидфосфат
НМСН – наследственная моторная и сенсорная невропатия
НПВП – нестероидные противовоспалительные препараты
НСВН – наследственная сенсорная и вегетативная невропатия
ОВДП – острая воспалительная демиелинизирующая полирадикулоневропатия
ОмедБ – отдельный медицинский батальон
ОПП – острая перемежающаяся порфирия
ПДЕ – потенциал двигательной единицы
ПНП – полиневропатия
ПНС – периферическая нервная система
ПФ – потенциал фасцикуляций
РНС – рефлекторные неврологические синдромы
PC – регенераторный спрутинг
СД – сахарный диабет
СКР – свободные кислородные радикалы
СМ – спинной мозг
СМТ – синусоидально модулированные токи
СПИ – скорость проведения импульса
СРВ – скорость распространения возбуждения
ССВП – соматосенсорные вызванные потенциалы
УВЧ – токи ультравысокой частоты
ФОС – фосфорорганические соединения
ФРН – фактор роста нерва
ХВДП – хроническая воспалительная демиелинизирующая полирадикулоневропатия
цАМФ – циклический аденозин-3′,5′-монофосфат
ЦСЖ – цереброспинальная жидкость
ЧЭНС – чрескожная электронейростимуляция
ШИК – шифф-йодная кислота
ЭДТА – этилендиаминтетрауксусная кислота
ЭМГ – электромиография (электромиограмма)
ЭНМГ – электронейромиография (электронейромиограмма)
ЯМРТ – ядерно-магнитно-резонансная томография
ADM – мышца, отводящая мизинец (т. abductordigitiminimi)
BDNF – мозговой нейротрофический фактор
CNTF – цилиарный нейротрофический фактор
IL – интерлейкин
MMPI – многофакторный Миннесотский личностный опросник
NGF – фактор роста нервов
POEMS – полиневропатия, органомегалия, эндокринопатия, М-протеин, изменения кожи
ТА – передняя болыпеберцовая мышца (т. tibialisanterior)
TGFB1 – трансформирующий фактор роста нервов В1
ВВЕДЕНИЕ
Изучение клинических проявлений, диагностики, лечения и профилактики заболеваний периферической нервной системы (ПНС) является одной из важных проблем современной неврологии. Патология ПНС составляет 48 % в структуре нервных болезней; ей принадлежит третье место (5,8 %) после гриппа и бытового травматизма в общей структуре заболеваемости населения, а среди хронических заболеваний человека она занимает первое место. 60 – 80 % всех случаев заболеваний ПНС (от 5 до 15 % в общей структуре заболеваемости) приходится на спондилогенные (дискогенные) радикулопатии. Эта патология является самой частой причиной временной и стойкой утраты трудоспособности в период активной трудовой деятельности, причем 10 – 15 % случаев общей нетрудоспособности приходится на пациентов с дегенеративными компрессионными синдромами, что ведет к существенному экономическому ущербу. Это позволяет рассматривать спондилогенные заболевания ПНС как одну из актуальных проблем медицины. В конце XX века рандомизированные исследования английских ученых выявили, что заболевания, проявляющиеся болями в спине (low back pain), составили до 20 % всех случаев заболеваний и стали причиной свыше 50 млн дней нетрудоспособности.
Несмотря на длительный период изучения причин спондилогенных болей и несомненный прогресс в лечении больных с этими неврологическими синдромами, применяемые лечебные комплексы далеко не всегда оказываются достаточно эффективными. Как показывают скрининговые исследования, разнообразная гамма клинических проявлений дегенеративно-дистрофических поражений позвоночника нередко затрудняет дифференциальную диагностику и выбор патогенетически обоснованной лечебной тактики. Наиболее часто из неврологических синдромов остеохондроза встречаются люмбаго и люмбалгия.
Наиболее тяжелой формой поражений ПНС являются полиневропатии. Во-первых, они проявляются более распространенными расстройствами, чем другие клинические формы; во-вторых, нередко приводят к летальным исходам. Особенно это касается острых инфекционно-аллергических полирадикулоневропатий (синдром
Гийена – Барре) и наследственных полиневропатий, которые не поддаются терапии. Более благоприятны в отношении прогноза и возможности коррекции расстройств метаболические полиневропатии. Среди них наиболее актуальны диабетические и алкогольные полиневропатии.
Диабетические невропатии – одно из наиболее часто встречающихся поздних осложнений при сахарном диабете (СД), которое определяет прогноз заболевания (болевая форма полиневропатии, нейротрофические язвы) и смертность: автономная полиневропатия статистически значимо связана с повышенной смертностью от сердечно-сосудистых осложнений. Сведения о частоте развития диабетической полиневропатии (ДПН) противоречивы, что обусловлено различными критериями ее диагностики. По-видимому, более адекватные данные представлены в работах J. Pirart (1978), который выявил признаки невропатии при клиническом обследовании у 8 % больных СД во время установления диагноза и у 50 % пациентов с длительностью заболевания свыше 25 лет.
По данным ЭНЦ РАМН, при поступлении в эндокринологическое отделение 25 % пациентов активно предъявляют невропатические жалобы. После рутинного клинического обследования признаки невропатии обнаруживаются примерно у 50 % больных СД. Более детальное обследование с использованием кардиоваскулярных тестов и ЭНМГ выявляет патологические изменения со стороны сосудистой и нервной системы в 90 % случаев.
Распространенность ДПН в различных этнических популяциях больных СД значительно колеблется. В США и России она, видимо, сопоставима и составляет чуть более 50 %, тогда как в странах, где большинство населения – индусы, она незначительна. Большой разброс распространенности ДПН в различных этнических популяциях может быть обусловлен либо генетической предрасположенностью к ее развитию, либо факторами внешней среды (образ жизни, диета). В пользу первого предположения в последние годы получены данные о роли полиморфизма генов защитной антиоксидантной системы в развитии ДПН на более ранних сроках течения СД 1-го типа. Факторы внешней среды могут иметь большее значение при СД 2-го типа, способствуя развитию метаболического синдрома. Развитие представлений о патофизиологических механизмах, лежащих в основе формирования ДПН при различных типах СД, позволяет определить основные направления ее профилактического лечения, чему в настоящее время, с нашей точки зрения, уделяется недостаточно внимания.
Причиной социальной значимости сахарного диабета является то, что он во многих случаях приводит к ранней инвалидизации и летальности, которая обусловлена наличием поздних осложнений: невропатии, ретинопатии, нефропатии, инфаркта миокарда, энцефалопатии и инсульта, гангрены нижних конечностей. Более 40 % всех не обусловленных травмой ампутаций нижних конечностей проводится в связи с синдромом диабетической стопы и гангреной нижних конечностей. Сенсомоторная полиневропатия (ПНП) и автономная невропатия являются причиной низкого качества жизни, нарушения трудоспособности и инвалидизации у большого числа больных СД. Сахарный диабет и его осложнения – тяжелое бремя для системы здравоохранения. Так, R. J. Rubm и соавт. (1994) указывают, что в 1992 г. все расходы на здравоохранение США составили 720,5 млрд долларов, из них на диагностику и лечение сахарного диабета пришлось 105,2 млрд (14,6 %). При этом до 80 % расходов приходится на борьбу именно с поздними осложнениями, к которым относится ДПН.
Важность изучения патогенеза и возможностей терапии диабетической полиневропатии отражена в рекомендациях ВОЗ. Особенную актуальность изучение поздних осложнений диабета приобретает в связи с достигнутыми успехами в области компенсации гипергликемии, появлением инсулиновых препаратов новых поколений. Это ведет к увеличению средней продолжительности жизни больных СД и относительного количества поздних осложнений у этих пациентов.
Алкогольное поражение ПНС (алкогольная полиневропатия – АПН) возникает в 5 раз чаще, чем поражение ЦНС, и является наиболее частым осложнением острой и хронической алкогольной интоксикации. Доля АПН среди полиневропатических синдромов различной этиологии постепенно возрастает (от 10 – 11 % до 36 – 70 %). Возрастание удельного веса АПН обусловлено как учащением случаев ее возникновения, в связи с ростом заболеваемости алкоголизмом, так и улучшением возможностей диагностики. Анализ заболеваемости, проведенный B. O. Osuntocun (1986), показал, что в развитых странах алкоголь является наиболее частой причиной развития полиневропатического синдрома.
Следует отметить, что в значительной части случаев по социальным мотивам вместо диагноза «алкогольная полиневропатия» ставится диагноз «токсическая полиневропатия». Это отражается на статистических показателях, поэтому данные разных исследователей о частоте развития АПН при алкоголизме разноречивы: от 10 до 100 % случаев. Вариабельность приведенных данных объясняется различным подходом к диагностике. Если грубые клинические проявления АПН обнаруживаются у 10 %, то легкие формы (с учетом незначительных начальных признаков) – у 97 % больных алкоголизмом; латентные (бессимптомные) формы заболевания обнаружены у 100 % больных алкоголизмом при проведении электронейромиографии. Полученные данные позволяют сделать вывод, что АПН следует рассматривать не как осложнение, а как один из симптомов алкоголизма, в ряде случаев протекающий латентно.
В советской медицинской литературе имелась определенная тенденция к искусственному преуменьшению значения проблемы алкоголизма, в связи с чем на фоне большого количества работ зарубежных исследователей труды отечественных ученых представлены относительно скудно. Однако проблема алкоголизма существует, имеет большое социальное и медицинское значение и в настоящее время не может быть отнесена к числу второстепенных. Увеличение приема алкоголя наблюдается во всем мире, особенно в странах Европы, в том числе в России, и США. В России, по официальным данным, насчитывается более 10 млн больных алкоголизмом. В Германии с населением 75 млн человек выявлено 3 млн алкоголиков и 10 млн лиц с алкогольными поражениями внутренних органов. В США от 5 до 10 % населения хронически злоупотребляют алкоголем и нуждаются в медицинском наблюдении.
В настоящее время смертность от алкоголизма и непосредственно связанных с ним заболеваний стоит на третьем месте, уступая только смертности от сердечно-сосудистых заболеваний и новообразований. Общая заболеваемость лиц, злоупотребляющих алкоголем, на 30 – 35 % больше, а продолжительность жизни больных на 15 – 20 лет меньше, чем непьющих. Огромен также экономический ущерб, связанный со злоупотреблением алкоголем. Данная проблема стала особенно актуальной для нашей страны в последние 5 – 6 лет, когда в связи с политическими и экономическими реформами число больных с этим недугом резко увеличилось. По данным ВЦИОМ, ежегодно на каждого россиянина, включая женщин и детей, приходится 180 л выпитой водки.
Высокая распространенность травм ПНС в мирное и особенно в военное время (15 – 100 ‰), длительные сроки стационарного лечения в медицинских учреждениях различного профиля, частая инвалидизация (свыше 29 %) больных с ограниченными возможностями восстановления утраченных функций определяют медико-социальную значимость проблемы травматических невропатий.
В настоящее время огнестрельные повреждения ПНС занимают ведущее место в структуре травматических невропатий по показателям частоты встречаемости, продолжительности лечения и инвалидизации пострадавших (60 %).
Благодаря применению современных высокоинформативных методов нейровизуализации (электронейромиография, исследование вызванных потенциалов мозга) и нейрогистологии достигнуты определенные успехи в изучении патогенетических механизмов травматических невропатий. Тем не менее результаты хирургической и терапевтической коррекции травм ПНС остаются достаточно скромными, несмотря на совершенствование микрохирургической техники, появление новых лекарственных средств и развитие стимуляционных методов лечения.
Исследование травм ПНС имеет неоспоримое теоретическое и огромное практическое значение. Известно, что решающим фактором успеха в изучении патогенетических и молекулярных механизмов развития заболеваний нервной системы, а также в разработке и внедрении новых методов лечения неврологических заболеваний является создание универсальных и воспроизводимых моделей поражения нервной ткани на отдельных клетках, клеточных культурах либо у экспериментальных животных.
Моделирование патологических состояний ПНС доступно пока лишь для сравнительно небольшого круга заболеваний и, в первую очередь, для травматических невропатий (травмы нервов у экспериментальных животных могут вызываться различными патогенными факторами). Поэтому, несмотря на межвидовые различия и невозможность полной экстраполяции полученных закономерностей на человека, результаты экспериментального изучения травм ПНС имеют фундаментальное значение для формирования современных представлений о патофизиологических механизмах заболеваний нервной системы. Тем более что до настоящего времени отсутствуют адекватные модели таких широко распространенных органических поражений мозга, как инсульт, паркинсонизм, рассеянный склероз и др.
Глава 1
СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ
Под периферической нервной системой принято понимать топографически условно выделенную совокупность нервных структур, расположенных за пределами головного и спинного мозга. Она включает задние и передние корешки спинного мозга, спинномозговые узлы, автономные (вегетативные) нервы и их производные. Во взаимодействии с ЦНС периферические нервные образования осуществляют чувствительные, двигательные и трофические функции в соматической и висцеральной сферах организма. В целом функция периферических структур нервной системы состоит, во-первых, в проведении нервных импульсов от всех экстеро- и интерорецепторов в сегментарный аппарат спинного мозга и в соответствующие образования головного мозга; во-вторых, в адресной реализации регулирующих и управляющих нервных импульсов от центральных структур нервной системы.
Разные участки ПНС функционально неравнозначны относительно направленности импульсации. Например, передние корешки спинномозговых нервов, отдельные черепные нервы (лицевой, подъязычный) содержат преимущественно двигательные (эфферентные) нервные волокна, в то время как задние корешки спинномозговых нервов, чувствительная часть тройничного и блуждающего нервов – чувствительные (афферентные) волокна. Несмотря на эти особенности, большая часть периферических нервов содержит одновременно чувствительные, двигательные и вегетативные (автономные) волокна.
Строение нервного волокна. Основным структурным элементом любого участка ПНС является нервное волокно, представляющее собой один из отростков нейрона – аксон (от греч. axis «ось») (цветная вклейка, рис. 1.1). Диаметр его составляет 1 – 20 мкм. Основу цитоскелета аксона составляет сеть нейрофиламентов и нейротубул (микротрубочек), связанных друг с другом, а также с другими внутриклеточными органоидами и аксолеммой (рис. 1.2). Нейрофиламенты представляют собой неветвящиеся волокнистые структуры цилиндрической формы толщиной 8 – 11 нм; максимальная их длина 10 мкм. С помощью моноклональных антител установлено, что нейрофиламенты распределяются исключительно в аксонах, в телах нейронов и в дендритах, в то время как в нейроглии, леммоцитах, фибробластах и соединительной ткани их не обнаружено. В цитоплазме аксона (аксоплазме) имеется также много нитевидных митохондрий и аксоплазматических пузырьков. Рибосомы в аксоплазме встречаются крайне редко, а гранулярный эндоплазматический ретикулум, как правило, отсутствует. Это приводит к тому, что белки поступают в аксон только из тела нейрона, как и гликопротеиды, и ряд макромолекулярных веществ, а также некоторые органеллы, такие как митохондрии, должны перемещаться по аксону из тела клетки. Этот процесс называется аксоплазматическим транспортом (цветная вклейка, рис. 1.3).
Рис. 1.2. Поперечный срез аксона:
1 – нейрофиламенты
Определенные цитоплазматические белки и органоиды движутся вдоль аксона двумя потоками с различной скоростью. Один – медленный поток, движущийся по аксону со скоростью 1 – 3 мм/сут, перемещает лизосомы и некоторые ферменты, необходимые для синтеза нейромедиаторов в окончаниях аксонов. Другой поток – быстрый, также направляется от тела клетки, но его скорость составляет 5 – 10 мм/ч (примерно в 100 раз выше скорости медленного потока). Этот поток транспортирует компоненты, необходимые для осуществления синаптической функции (гликопротеиды, фосфолипиды, митохондрии).
Комплекс нервных волокон, входящих в периферический нерв, окружен общей соединительнотканной капсулой (рис. 1.4).
Кроме того, каждый нервный ствол имеет три собственные оболочки: эпиневрий, периневрий и эндоневрий. Эпиневрий состоит из соединительной ткани, построенной из толстых, ориентированных в разных направлениях пучков коллагеновых волокон, к которым примешиваются и эластические волокна. В эпиневрии находятся скопления жировой клетчатки, фибробласты и тучные клетки, причем вблизи каждого ствола имеется пара питающих сосудов – артерия и вена. Рыхлая соединительная ткань эпиневрия нервного ствола постепенно переходит в более плотную соединительную ткань периневрия. Последний построен по типу многослойного пластинчатого футляра, состоящего из уплощенных периневральных клеток, чередующихся с прослойками коллагеновых волокон.
Рис. 1.4. Поперечный срез периферического нерва
Эндоневрий также состоит из клеточного и волокнистого компонентов. Частью его являются уплощенные клетки, начинающиеся от внутреннего слоя периневрия и разделяющие ствол в виде перепончатых перегородок на множество отдельных пучков нервных волокон. Эти клетки снабжены отростками и тесно связаны между собой. В эндоневрии встречаются редкие фибробласты веретеновидной формы, прилежащие, иногда вплотную, к миелиновым волокнам, а также тучные клетки.
Миелин. Значительная часть аксонов заключена в липопротеиновую оболочку, которая начинается на некотором расстоянии от тела клетки и заканчивается на расстоянии 2 мкм от синаптического окончания (рис. 1.5). Нервные волокна, окруженные такими оболочками, называются миелинизированными. Миелиновые оболочки содержат холестерин, фосфолипиды, некоторые цереброзиды и жирные кислоты, а также белковые вещества, переплетающиеся в виде сети (нейрокреатин). Химическая природа миелина периферических нервных волокон и миелина центральной нервной системы несколько различна. Это связано с тем, что в центральной нервной системе миелин образуется клетками олигодендроглии, а в периферической – леммоцитами. Эти два вида миелина отличаются по своим антигенным свойствам. Миелиновые оболочки нервных волокон не сплошные, а прерываются вдоль волокна промежутками, которые называются перехватами Ранвье (рис. 1.6). У места окончания миелиновой оболочки на уровне перехвата Ранвье наблюдается некоторое сужение аксона, диаметр которого уменьшается на 1/3.
В процессе миелинизации периферического нервного волокна леммоциты формируют отросток цитоплазматической мембраны, который спиралевидно обертывает нервное волокно. Может сформироваться до 100 спиральных слоев миелина правильной пластинчатой структуры, при этом цитоплазма леммоцита вытесняется к ее ядру; таким образом обеспечивается сближение и тесный контакт смежных мембран (цветная вклейка, рис. 1.7).
Рис. 1.5. Аксон нейрона, заключенный в миелиновую оболочку
Рис. 1.6. Миелинизированное нервное волокно в области перехвата Ранвье
Электронно-микроскопически миелин сформированной оболочки состоит из плотных пластинок толщиной около 0,25 нм, которые повторяются в радиальном направлении с периодом 1,2 нм. Между ними находится светлая зона, представляющая собой сильно насыщенное водой пространство между двумя компонентами биомолекулярного липидного слоя. Это пространство доступно для циркуляции ионов. Миелиновая оболочка обеспечивает изолированное, бездекрементное (без снижения амплитуды потенциала) и более быстрое проведение возбуждения вдоль нервного волокна. Имеется прямая зависимость между толщиной этой оболочки и скоростью проведения нервного импульса.
Кровоснабжение нервных волокон. Периферические нервы хорошо васкуляризированы, при этом строение их микроциркуляторного русла достаточно сложно. В эпиневрии оно представляет собой секторные фрагменты по типу модулей. В их пределах различают мелкие, неоднородные (по форме петель) микрососудистые комплексы, образованные в основном капиллярами (рис. 1.8).
Венозное микроциркуляторное русло эпиневрия представлено многоветвистыми посткапиллярами, венулами и венуло-венулярными соустьями. Собирательные венулы модуля формируют сосуды «выхода», которые сопровождают артериолы и впадают в магистральные вены эпиневрия. Вместе с межмодульными коммуникациями сосуды образуют единый сосудистый футляр. Плотность этой сети, наличие большого количества артериоло-артериолярных, артериоловенулярных и венуло-венулярных анастомозов свидетельствуют об активных метаболических процессах в нервных стволах. Эпиневральная кровеносная сеть непосредственно связана с проходящими вдоль нервного ствола крупными артериальными и венозными сосудами, а также с внутриствольным микроциркуляторным руслом. Источниками формирования внутриствольного сосудистого сплетения служат артериолы, которые проникают через периневрий и образуют эндоневральную капиллярную сеть. Диаметр капилляров этой сети варьируется от 4 до 7 мкм. Большинство из них следует вдоль продольной оси ствола, периодически отдавая боковые поперечные веточки.
Рис. 1.8. Кровеносные сосуды, окружающие нервное волокно
Лимфатические сосуды нервных волокон. В эндоневрии и в периневральных футлярах имеются лимфатические щели. Они связаны с лимфатическими сосудами в эпиневрии. Отток лимфы от нерва осуществляется по лимфатическим сосудам, проходящим в эпиневрии вдоль нервного ствола. Лимфатические сосуды нерва впадают в ближайшие крупные лимфатические протоки, которые идут к регионарным лимфатическим узлам. Межтканевые эндоневральные щели, пространства периневральных влагалищ являются путями перемещения внутритканевой жидкости.
Электрофизиология нервного ствола. Электрофизиологические исследования показывают, что в состоянии покоя существует разница в электрическом потенциале на внутренней и внешней сторонах аксональной клеточной мембраны. Внутренняя часть клетки имеет отрицательный заряд 70 – 100 мВ по отношению к интерстициальной жидкости снаружи клетки. Этот потенциал поддерживается различием в концентрации различных ионов.
Калий (и белки) преобладают внутри клетки, в то время как концентрация ионов натрия и хлоридов более высока вне клетки. Натрий постоянно диффундирует в клетку, а калий имеет тенденцию выходить из нее. Дифференциал концентрации натрий-калий поддерживается путем энергозависимого насосного механизма в покоящейся клетке, причем это равновесие существует, когда концентрация положительно заряженных ионов внутри клетки снижена по сравнению с показателем снаружи. Это приводит к отрицательному внутриклеточному заряду. Ионы кальция также вносят вклад в поддержание равновесия в клеточной мембране, и когда их концентрация снижается, возбудимость нерва нарастает.
Под влиянием естественной или вызванной внешними факторами стимуляции аксона происходит нарушение селективной проницаемости клеточной мембраны, что способствует проникновению ионов натрия в клетку и редукции потенциала покоя. Если мембранный потенциал снижается (деполяризуется) до критического уровня (30 – 50 мВ), то возникает потенциал действия, и импульс начинает распространяться вдоль клеточной мембраны как волна деполяризации. Важно отметить, что в немиелинизированных волокнах скорость распространения импульса прямо пропорциональна диаметру аксона, и возбуждение длительно прямолинейно захватывает соседствующие мембраны (рис. 1.9, 1.10).
Проведение импульса в миелинизированных волокнах совершается «сальтаторно», т. е. как бы скачкообразно: импульс или волна деполяризации мембраны скользит от одного перехвата Ранвье до другого, и так далее (цветная вклейка, рис. 1.11). Миелин действует как изолятор и предупреждает возбуждение мембраны клетки аксона, за исключением промежутков на уровне перехватов (узлов) Ранвье. Нарастание проницаемости возбужденной мембраны этого узла для ионов натрия вызывает ионные потоки, которые и являются источником возбуждения в области следующего перехвата Ранвье.
Рис. 1.9. Развитие пика составного потенциала действия нервного ствола
Рис. 1.10. Зависимость ионных токов и мембранного потенциала от времени
Таким образом, в миелинизированных волокнах скорость проведения импульса зависит не только от диаметра аксона и толщины миелинового футляра, но и от дистанции между узлами Ранвье (от «интернодальной» длины).
Физиология синаптической передачи. Информация, передаваемая по нерву, распространяется не только стереотипными электрическими сигналами, но и с помощью химических передатчиков нервного возбуждения – медиаторов или трансмиттеров, высвобождаемых в местах соединения клеток – синапсах. Синапсы – специализированные контакты, через которые осуществляется поляризованная, опосредованная химически, передача из нейрона возбуждающих или тормозящих влияний на другой клеточный элемент. Различают аксодендритические синапсы – аксон оканчивается на дендрите, аксосоматические синапсы – образуется контакт между аксоном и телом нейрона, аксо-аксональные синапсы – контакт устанавливается между аксонами. В окончаниях периферических нервов также имеются нервно-мышечные (мионевральные) синапсы. Примерно половина всей поверхности тела нейрона и почти вся поверхность его дендритов покрыты синаптическими контактами от других нейронов (рис. 1.12; цветная вклейка, рис. 1.13).
Рис. 1.12. Аксосоматические синапсы
В дистальной части нервное волокно лишено миелина, образуя терминальную арборизацию (телодендрон) и пресинаптический терминальный элемент. Этот элемент морфологически характеризуется расширением окончания аксона, что напоминает булаву и нередко именуется «пресинаптический мешок», «терминальная бляшка», «синаптический узелок». Под микроскопом в этой булаве можно увидеть различных размеров – около 0,05 мкм (500 А) – гранулярные пузырьки или синаптические везикулы, содержащие медиаторы (ацетилхолин, катехоламины, пептидные гормоны и др.). Под терминальной бляшкой лежит синаптическая щель размерами 0,2 – 0,5 мкм в поперечнике, в которую из везикул поступают кванты медиатора. Затем следует субсинаптическая (постсинаптическая) мембрана, воздействуя на которую химический передатчик вызывает изменения электрического потенциала в подлежащих клеточных элементах (цветная вклейка, рис. 1.14).
Порядок синаптической передачи (цветная вклейка, рис. 1.15). 1. Импульс подходит к пресинаптической части волокна. Открываются кальциевые каналы, ионы Ca2+ поступают в пресинаптическую цитоплазму.
2. В пресинаптической цитоплазме постоянно находится большое количество синаптических пузырьков – образований, содержащих молекулы вещества-медиатора. Вследствие появления ионов Ca2+ в пресинаптической цитоплазме пузырьки подходят к мембране и выделяют медиатор в синаптическую щель. Попавший в щель медиатор диффундирует на постсинаптическую сторону щели. Этот процесс идет около 0,5 мс и вносит существенный вклад в задержку передачи.
3. Молекулы медиатора улавливаются рецепторами на постсинаптической стороне.
4. Попадание ацетилхолина на рецептор увеличивает проводимость канала в обоих направлениях для ионов Na+ и K+ в равной степени. Открытие каналов на постсинаптической стороне вызывает поток ионов натрия внутрь, а калия – наружу. Возникший ионный ток возбуждает нервный импульс, который распространяется дальше по постсинаптическому волокну.
5. Происходит обратный захват медиатора пресинаптическим окончанием.
Типы нервных волокон. Согласно А. Paintal (1973), периферические нервные волокна по характеру строения, проведению возбуждения, длительности фаз потенциала действия подразделяются на следующие классы:
Класс А: 1. Миелинизированные волокна, афферентные, сенсорные.
Группа I. Волокна диаметром более 20 мкм, со скоростью проведения импульса до 100 м/с. Волокна этой группы несут импульсы от рецепторов мышц (мышечных веретен, интрафузальных мышечных волокон) и рецепторов сухожилий.
Группа II. Волокна диаметром от 5 до 15 мкм, со скоростью проведения импульсов от 20 до 90 м/с. Эти волокна несут импульсы от механорецепторов и вторичных окончаний на мышечных веретенах интрафузальных мышечных волокон.
Группа III. Волокна диаметром от 1 до 7 мкм, со скоростью проведения импульса от 12 до 30 м/с. Их функциями являются болевая рецепция, а также иннервация волосяных рецепторов и сосудов.
2. Миелинизированные волокна, эфферентные, двигательные.
Альфа-волокна. Более 17 мкм в диаметре, скорость проведения импульса от 50 до 100 м/с. Они иннервируют экстрафузальные поперечно-полосатые мышечные волокна, преимущественно стимулируя быстрые сокращения мышц (мышечные волокна 2-го типа) и крайне незначительно – медленные сокращения (мышц 1-го типа).
Бета-волокна. В отличие от альфа-волокон иннервируют мышечные волокна 1-го типа (медленные и тонические сокращения мышц) и частично интрафузальные волокна мышечного веретена.
Гамма-волокна. Размером 2 – 10 мкм в диаметре, скорость проведения импульса 10 – 45 м/с, иннервируют только интрафузальные волокна, т. е. мышечное веретено, тем самым участвуя в спинальной саморегуляции мышечного тонуса и движений (кольцевая связь гамма-петли).
| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»

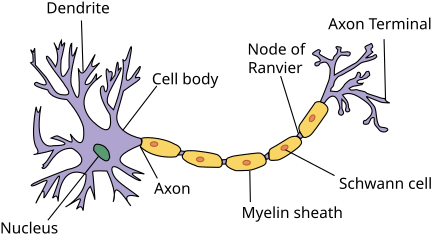

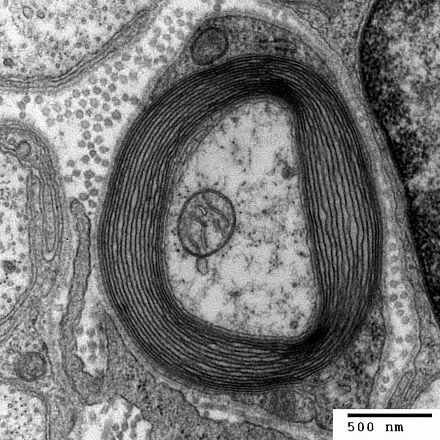
.svg/440px-Myelin_sheath_(1).svg.png)