Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
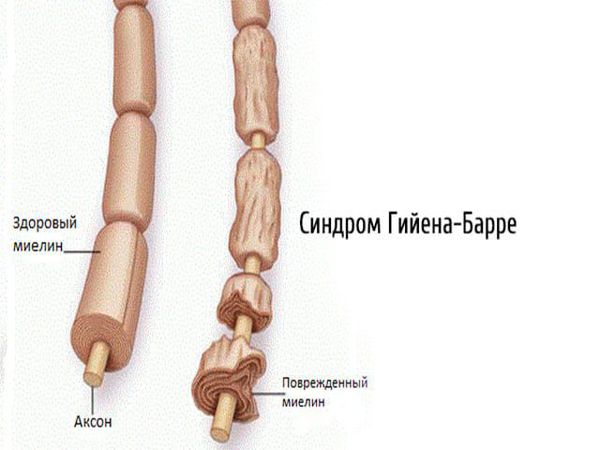
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
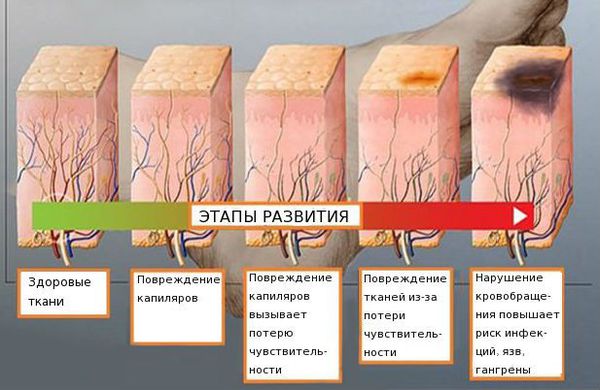
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Аксональные полинейропатии: патогенез и лечение
Как цитировать:
Ковражкина Е.А. Аксональные полинейропатии: патогенез и лечение. Журнал неврологии и психиатрии им. С.С. Корсакова.
2013;113(6):22‑25.
Kovrazhkina EA. Axonal polyneuropathies: pathogenesis and treatment. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(6):22‑25. (In Russ.)

Полинейропатия (ПНП) — заболевание периферической нервной системы, развивающееся в результате диффузного поражения периферических нервов — их аксонов (аксональные полинейропатии), миелиновой оболочки (демиелинизирующие полинейропатии) либо тел нейронов (нейронопатии) [9]. В основе патогенеза полинейропатий аксонального типа лежит генерализованное повреждение осевых цилиндров периферических нервов.
Патогенез. Аксональная дегенерация (аксонопатия) — результат нарушения метаболизма нейрона вследствие недостаточной выработки энергии в митохондриях и/или нарушения аксонального транспорта. Миелиновая оболочка при аксонопатиях страдает вторично (вторичная демилинизация). Миелин может повреждаться в результате ишемии нервов (поражения vasa nevrorum), отложения токсичных для нерва веществ или иммунных комплексов в эндоневрии (что характерно, например, для сахарного диабета, особенно 1-го типа — с высокой гипергликемией и аутоиммунными нарушениями) [4]. Соответственно, среди причин аксонопатии периферических нервов указывают нарушения метаболизма, токсические влияния, ишемию нервных стволов, наследственную предрасположенность и аутоиммунные механизмы [5]. По этиологическому фактору подавляющее большинство аксональных ПНП составляют метаболические и токсические, среди которых первое место занимают диабетическая (до 50% среди пациентов с сахарным диабетом и до 90% поражений нервной системы при диабете [9, 12]) и алкогольная (до 50% среди больных алкоголизмом [2, 9]).
Причиной токсико-метаболических ПНП является экзо- и эндогенные интоксикации. Поступающие извне вещества или собственные его метаболиты, токсичные для периферических нервов, вызывают их повреждение. Тяжесть этого повреждения зависит от степени токсичности данного агента (выделяют острые метаболические ПНП, развивающиеся на фоне тяжелой общей интоксикации, например, ПНП при быстро нарастающих печеночной недостаточности или уремии, при отравлении фосфоорганическими веществами, мышьяком, свинцом, как нежелательный эффект лечения препаратами лития, цитостатиками), длительности его воздействия, собственных генетических особенностей метаболизма нервной ткани, немаловажную роль играет также аутоиммунный фактор [13].
Большинство часто встречающихся в клинике метаболических ПНП являются итогом длительного воздействия эндо- и экзогенного токсического агента (диабетическая, печеночная, уремическая, алкогольная, профессиональная, лекарственная). Результатом такой интоксикации является повреждение осевого цилиндра аксона. Клинически это проявляется не только нарушениями чувствительности и мышечной слабостью (что свойственно и для демиелинизирующих ПНП), но и мышечными гипотрофиями, выраженными трофическими нарушениями. Все эти признаки свидетельствуют о длительном страдании аксонов периферических нервов. При электронейромиографии (ЭНМГ) выявляется снижение (иногда — вплоть до полного отсутствия) амплитуды сенсорных потенциалов и М-ответов периферических нервов. У пациентов с ПНП аксонального типа зачастую в достаточной степени сохранены двигательные функции (отсутствуют выраженные парезы, больные сохраняют способность ходить, часто без дополнительной опоры), тогда как инвалидизирующими являются чувствительные (боли и парестезии) и трофические нарушения. Так, аксональная сенсомоторная ПНП является одним из важных патогенетических факторов развития синдрома диабетической стопы [3]. Аксональное повреждение нервов развивается медленно, исподволь, но при правильном лечении потенциально обратимо.
При массивном воздействии токсичного для периферической нервной системы агента, участии ишемического компонента (за счет страдания vasa nevrorum), аутоиммунных влияний развиваются ПНП аксонально-демиелинизирующего типа такие, например, как уремическая, свинцовая, амиодароновая, вызываемые воздействиями высокотоксичных для нервов веществами [9]. При наиболее распространенной диабетической ПНП, демиелинизирующий компонент максимально представлен при инсулинпотребном сахарном диабете (характеризующимся более высокой гипергликемией), а выраженность демиелинизации периферических нервов нарастает при резких повышениях уровня глюкозы крови [4, 7]. На представленность демиелинизирующего компонента при метаболических ПНП влияют наследственные факторы (генетически обусловленная миелинопатия, которая протекала бы субклинически без дополнительного воздействия токсического агента), аутоиммунное повреждение (например, миелинопатия более выражена при сахарном диабете 1-го типа, при котором иммунокомпетентные клетки повреждают ткань поджелудочной железы) [4, 14].
ПНП аксонально-демиелинизирующего типа протекают более тяжело, с выраженными парезами, сенситивной атаксией, нейропатическим болевым синдромом, но нередко, при своевременном устранении действия токсического фактора, быстро регрессируют. При очень тяжелом и упорном течении заболевания, учитывая роль аутоиммунного механизма в развитии данного типа метаболических ПНП, необходимо кратковременное назначение иммуномодулирующей терапии (чаще глюкокортикоидов, иногда цитостатиков) [9, 11].
Клиническое течение ПНП. Как уже было сказано, при длительном воздействии умеренно токсичного для нервов агента аксонопатия развивается медленно, что не всегда заметно. Преимущественное поражение бедно миелинизированых вегетативных и сенсорных волокон вызывает парестезии, повышенную холодовую чувствительность кистей и стоп, негрубые трофические нарушения. При ЭНМГ не всегда удается выявить характерные признаки сенсорной и моторной аксонопатии — снижение амплитуд сенсорных потенциалов и М-ответов — если исследуются крупные богато миелинизированные нервы, аксоны которых страдают позднее. Быстрее выявляются признаки вторичной миелинопатии, как клинические — присоединение нейропатических болей, парезов, так и миографические — снижение скорости распространения возбуждения (СРВ) по нервам.
При условии адекватной терапевтической стратегии — устранения действия повреждающего периферические нервы фактора, назначение препаратов, влияющих на метаболизм нервной ткани, — наступает ремиелинизация, что отражается и на ЭНМГ в виде нарастания СРВ, и клинически — в виде регресса парезов и нейропатических болей, улучшения чувствительности. Однако, если полинейропатия развивалась в условиях длительного действия токсического агента, поражение аксонов периферических нервов, снижение амплитуд сенсорных потенциалов и М-ответов на ЭНМГ сохраняется, поскольку осевые цилиндры нервов обладают гораздо меньшей способностью к регенерации, чем миелин.
Так, в проведенном исследовании [8], посвященном лечению алкогольной ПНП, ведущим ЭНМГ-признаком поражения периферических нервов у большинства пациентов имелось снижение СРВ. В условиях элиминации токсического фактора (в данном случае приема алкоголя) и лечения препаратом α-липоевой кислоты (берлитион в суточной дозе 600 мг), у пациентов быстро, в течение 1-го месяца, регрессировали ЭНМГ и клинические признаки миелинопатии — уменьшалась выраженность парезов и болевого синдрома (в баллах по визуальной аналоговой шкале с 5,2±1,0 до 2,6±0,5) достоверно (р<0,05) нарастала СРВ (по моторным волокнам n. tibialis с 36,93±1,12 до 42,22±0,8 м/с, по сенсорным волокнам n. suralis c 32,45±0,70 до 38,24±0,50 м/с), но признаки аксонопатии (снижение амплитуд сенсорных и моторных ответов периферических нервов, сенсорные выпадения по полиневритическому типу, трофические нарушения) сохранялись и после 6 нед лечения.
Таким образом, можно представить следующую схему развития и течения метаболических ПНП (см. таблицу): высокотоксичные, высококонцентрированные токсические агенты приводят к развитию полинейропатии аксонально-демиелинизирующего типа (в развитии которых также значительную роль играют наследственный, сосудистый, аутоиммунный факторы), длительно действующие эндо- и экзогенные яды приводят преимущественно к страданию аксонов с умеренно выраженным вторичным поражением миелина (так как постоянно идет процесс ремиелинизации) [7].
Лечение. Аксональное повреждение нервов как первичного, так и вторичного характера, обратимо за счет регенерации поврежденных аксонов и концевого спрутинга сохранившихся аксонов, однако этот процесс протекает медленно (месяцы), часто аксональная регенерация бывает неполной. Для регресса аксонопатии периферических нервов необходимо нивелировать воздействие токсического агента (коррекция метаболических и алиментарных нарушений, детоксикация, влияние на аутоиммунные механизмы), большое значение имеет также патогенетическая терапия, направленная на восстановление нарушенного метаболизма аксонов (митохондриальные нарушения, повреждения, вызванные окислительным стрессом).
Таким образом, в патогенетическом лечении аксональных ПНП, в зависимости от их нозологического и клинико-электрофизиологического варианта, должны присутствовать детоксикация и коррекция метаболических и алиментарных нарушений; сосудистая терапия (дезагреганты, венотоники, пентоксифиллин, вазопростан); препараты, воздействующие на универсальные механизмы поражения аксонов (витамины и витаминоподобные препараты); при необходимости — воздействие на аутоиммунные компоненты (глюкокортикоиды, плазмаферез). В некоторых случаях, когда представленность миелинопатии в структуре поражения периферических нервов велика и трудно отличить токсико-метаболическую полинейропатию от воспалительной (например, синдром Гийена-Барре у пациента с алкоголизмом или дебют хронической воспалительной демиелинизирующей ПНП у больного с сахарным диабетом) необходимо проводить пробную иммуномодулирующую терапию, ее быстрая эффективность позволит высказаться в пользу превалирования у пациента аутоиммуного механизма поражения периферических нервов [7, 11].
В лечении всех метаболических ПНП необходимо устранить (по возможности) поражающий периферические нервы яд и использовать препараты, улучшающие метаболизм нервной ткани периферических нервов. Последние необходимо применять в течение длительного времени, так как первым эффектом данных препаратов будет ускорение ремиелинизации, но для восстановления самих аксонов — а данные ПНП являются аксональными — требуется значительно большее количество времени.
α-липоевая (тиоктовая) кислота — витаминоподобное вещество, эндогенно образующееся в организме, как кофермент участвует в окислительном декарбоксилировании α-кетокислот. Основная функция эндогенной липоевой кислоты в организме — участие в аэробном метаболизме продукта гликолиза пирувата. Тиоктовая кислота является коферментом в окислительном декарбоксилировании пировиноградной кислоты до ацетил-КоА и α-кетоглутаровой до сукцинил-КоА в цикле Кребса. Облегчая превращение молочной кислоты в пировиноградную с последующим декарбоксилированием последней, α-липоевая способствует ликвидации метаболического ацидоза [6]. Тиоктовая кислота обладает сложным комплексным действием: гипогликемическим, липотропным, гепатопротекторным, антиатеросклеротическим, является мощным антиоксидантом. Липоевая кислота может существовать в окисленной (-S-S-) и восстановленной (SH-)-формах, благодаря чему реализуются ее коферментные и антиоксидантные функции. Восстановленная форма, дигидролипоевая кислота, служит донором электронов для восстановления других антиоксидантов (витамины С, Е и глутатион), осуществляет рецикл витамина Е при его истощении. Дигидролипоат повышает интра- и экстрацеллюлярный уровни глутатиона — эндогенного антиоксиданта.
Эффект экзогенно вводимой α-липоевой кислоты в отношении полиневритического синдрома впервые обнаружен при сахарном диабете. Обусловленная сахарным диабетом гипергликемия приводит к отложению глюкозы на матричных протеинах кровеносных сосудов и образованию конечных продуктов прогрессирующего гликозилирования, в результате чего уменьшается эндоневральный кровоток, возникает эндоневральная ишемия. α-липоевая кислота приводит к снижению уровня глюкозы в крови и повышению содержания гликогена в печени, обладает гипогликемическим действием. На фоне воздействия препарата уменьшается выраженность сенсорных симптомов полинейропатии — боли, жжения, ощущения онемения и «ползания мурашек» в конечностях.
Применение α-липоевой кислоты оказывает положительное влияние на универсальные механизмы аксонального повреждения, такие как повреждающее действие окислительного стресса и митохондриальная дисфункция — за счет антиоксидантного действия, повышения содержания глутатиона. Энергокорригирующее действие α-липоевой кислоты, тропное именно к аксонам нервов, способствует, в конечном итоге, быстрейшей регенерации аксонов [18].
Препарат не только редуцирует проявления окислительного стресса, но и оказывает влияние на сосудистый компонент поражения периферических нервов, нормализуя эндоневральный кровоток (что имеет большое значения, например, при дибетической микроангиопатии) [16, 17]. Комплексный механизм действия α-липоевой кислоты объясняет ее эффективность в отношении всех аксональных ПНП, патогенез которых связан с токсико-дисметаболическим и сосудистым факторами. Так, эффективность тиоктовой кислоты показана при уремической и алкогольной ПНП, при поражении периферических нервов, индуцированном цитостатиками [15]. Для регенерации аксонов периферических нервов на фоне токсико-метаболических влияний важны также детоксикационный и гепатопротекторный эффекты α-липоевой кислоты. Положительный эффект препарата отмечен в отношении заболеваний печени, печеночной комы, некоторых интоксикаций, в том числе алкогольной [6, 10].
При значительно выраженной аксонопатии, учитывая медленную скорость регенерации аксонов, необходимо длительное применение достаточно высоких доз α-липоевой кислоты. Обычно ее суточная доза составляет 600 мг. Предпочтительнее начинать лечение с внутривенного капельного введения препарата — 600 мг (24 мл раствора) в разведении на 200 мл физиологического раствора, длительность инфузии составляет от 2 до 4 нед в зависимости от тяжести ПНП. В особо тяжелых случаях препарат вводят внутривенно капельно в дозе 1200 мг в сутки. После переходят на пероральный прием α-липоевой кислоты — в таблетках по 600 мг не менее 2 месяцев [1].
В соответствии с такой клинической потребностью — необходимостью длительного приема достаточно высоких доз α-липоевой кислоты, учитывая потенциально обратимый, но медленный характер аксональной регенерации — разработаны и фармацевтические формы препарата. Например, берлитион 300 и берлитион 600, производимые в виде раствора для внутривенных вливаний по 12 и 24 мл соответственно (для начального этапа лечения ПНП), так и таблеток по 300 и 600 мг (для продолжения терапии).
Соблюдение всех условий патогенетического лечения ПНП — нормализация гликемии, прекращение поступления экзогенного яда, детоксикация, коррекция аутоиммунных нарушений, длительное применение препаратов, нормализующих аксональный метаболизм, способствует постепенной регенерации аксонов, уменьшению выраженности чувствительных и двигательных нарушений, болевого синдрома, парестезий, парезов. Для уточнения динамики различных видов метаболических ПНП на фоне подобного терапевтического подхода необходимы дальнейшие исследования.
Невролог
Cтаж — 17 лет
Кандидат наук
Медицинский центр «TERVE» на проспекте Красноярский рабочий
Лаборатория «Terve Lab»
Дата публикации 11 марта 2020Обновлено 4 августа 2021
Определение болезни. Причины заболевания
Невропатия, или нейропатия (Neuropathy) — повреждение одного или нескольких нервов периферической нервной системы. К ней относятся черепные и спинальные нервы, а также нервы и сплетения вегетативной нервной системы [2][3]. Невропатия проявляется нарушением чувствительности, болью в поражённом участке, судорогами, мышечной слабостью и затруднением движений. Выделяют две основные группы невропатий:
- мононевропатия — повреждение отдельного нерва, например срединного.
- полинейропатия — множественные повреждения нервов при диабетической полинейропатии, диффузной нейропатии, полирадикулопатии, плексопатии.
Распространённость нейропатии среди населения составляет 2-7 %. Риск развития заболевания увеличивается с возрастом: в 40 лет патология встречается в 15 % случаев [4][5][6].
Повреждение периферических нервов может вызывать множество причин. Даже после комплексного обследования выявить их удаётся не всегда. К основным факторам, приводящим к заболеванию, относят:
- Сахарный диабет — невропатией страдает более 70 % пациентов [22].
- Химиотерапия. При лечении токсичными препаратами патология развивается в 15-23 % случаев. Выраженность невропатии зависит от дозы препарата и продолжительности курса лечения [7].
- Васкулит (воспаление кровеносных сосудов). При повреждении отдельных нервов нейропатия бывает первым проявлением васкулита. Но может возникать и при комплексном поражении органов. При системном васкулите нейропатия поражает 60-70 % пациентов. Средний возраст — 58-62 года. Женщины заболевают чаще, чем мужчины [8].
- ВИЧ-инфекция. Распространённость нейропатии среди ВИЧ-инфицированных возросла с 13 % в 1993 году до 42 % в 2006 году. Вероятно, это связано с применяемыми антиретровирусными препаратами.
- Гепатит С. Как и в случае с ВИЧ, к нейропатии приводит приём токсичных для нервной ткани лекарств. Исследование, проведённое во Франции, выявило развитие сенсорной и моторной невропатии у 10 % больных гепатитом С.
- Поражение кишечника в 10 % случаев приводит к центральным и периферическим нарушениям нервной системы.
- Варикозное расширение вен нижних конечностей. Заболевание осложняется нейропатией из-за нарушения кровоснабжения нервной ткани.
- Хроническая почечная недостаточность — в 70 % случаев приводит к нейропатии.
- Ожирение [6][9][10][11][12][13].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы невропатии
Несмотря на то, что нейропатию вызывают различные причины, основные симптомы заболевания схожи [9][14][15][16][17]:
- Двигательные нарушения, слабость мышц. Пациент с трудом выполняет действия, связанные с мелкой моторикой, например застёгивание пуговиц. Возникают проблемы с ходьбой — больной может упасть из-за слабости мышц стопы.
- Сенсорные нарушения — онемение, повышенная тактильная чувствительность, резкая стреляющая боль, подобная удару электрическим током.
- Снижение и выпадение сухожильных рефлексов. Появляются трудности при выполнении повседневных действий, таких как надевание одежды, перемещение предметов.
- Расстройства сердечно-сосудистой системы. Выражается в нестабильности артериального давления и его снижении при резком вставании, проявляется головокружением и потемнением в глазах .
- Расстройства желудочно-кишечного тракта — запоры и кишечная непроходимость, вызванные ухудшением тонуса мышц кишечника.
- Боли в кистях и стопах.
- Нарушение равновесия и координации движений.
- Повышенная потливость.
- Задержка мочеиспускания.
- Сексуальная дисфункция.
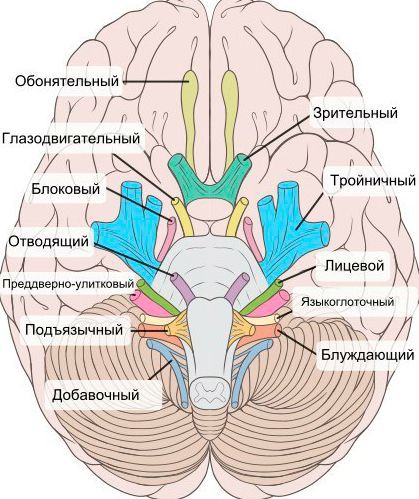
При нейропатии могут поражаться не только нервы конечностей, но и черепно-мозговые нервы:
- невропатия зрительного нерва (оптическая нейропатия) приводит к нечёткости, затуманенности зрения, нарушению цветового восприятия, слепоте;
- поражение глазодвигательного нерва проявляется опущением верхнего века и параличом глазных мышц;
- патология отводящего нерва вызывает сходящееся косоглазие, опущение верхнего века, двоение в глазах;
- лицевого нерва — паралич мимических мышц;
- преддверно-улиткового (слухового нерва) — потерю слуха;
- языкоглоточного нерва — нарушение подвижности языка;
- гортанного нерва — дыхательную недостаточность [15].
На начальных стадиях двигательные расстройства могут не проявляться. Но в дальнейшем нейропатия значительно ограничивает физическую активность пациента [5][7][16][17].
Для повреждения периферической нервной системы характерны основные синдромы:
- Поражение переднего корешка спинного мозга — приводит к ослаблению или параличу мышц. Возможны судороги и подёргивания.
- Поражение заднего корешка спинного мозга — проявляется повышенной тактильной чувствительностью, жжением, нарушением спинальных рефлексов, болью в области поражения.
- Поражение межпозвоночного узла — вызывает жжение, покалывание, снижение болевого порога, интенсивные жгучие боли, обострение герпесвирусной инфекции.
- Поражение спинального нерва — приводит к расстройствам чувствительности и двигательным нарушениям.
- Поражение сплетения периферических нервов — вызывает боль, но менее интенсивную, чем при повреждении корешков [16].
Патогенез невропатии
К нейропатии могут приводить нарушения обмена веществ и иммунной системы, генетические факторы, инфекционное и токсическое воздействие [1].
Развитие заболевания при обменных нарушениях, например при сахарном диабете, вызвано чрезмерным накоплением глюкозы в клетке. Гипергликемия приводит к отложению в нервных клетках продукта обмена — сорбитола. Избыток сорбитола нарушает функции клеток периферических нервов. При этом уменьшается выработка мио-инозитола — соединения, влияющего на передачу сигналов в мозге и защиту нервных клеток от повреждения. Всё это приводит к ухудшению регенеративных способностей нервной ткани и снижению её проводимости [9].
В развитии нейропатии важная роль принадлежит митохондриям (органеллам, обеспечивающих клетку энергией). Они повреждаются при гипергликемии и приёме противоопухолевых препаратов: паклитаксела, бортезомиба, оксалиплатина. Эти лекарства влияют и на другие внутриклеточные структуры (например микротрубочки, поддерживающие форму клетки), негативно воздействуют на клеточные процессы и в результате активируют запрограммированную гибель нейронов [9][15][18]. Схожие нарушения возникают и у ВИЧ-инфицированных пациентов, принимающих антиретровирусные препараты [9][15].
Классификация и стадии развития невропатии
Попытки систематизировать различные виды нейропатии предпринимались многократно как отечественными, так и зарубежными авторами. Но ни одна из классификаций не удовлетворяет всем потребностям клиницистов. Это связано с тем, что к развитию заболевания приводит множество сложных и до конца не изученных факторов [16].
По одной из классификаций, нейропатии разделяют на следующие группы:[19]
I. Мононевропатии (поражение одного нерва).
- Травматические мононевропатии — возникают при травмах, ранениях, электротравмах, химических повреждениях.
- Туннельные синдромы — это ущемление нерва при длительном сдавлении и травматизации в костно-мышечных каналах. К ним относятся: синдром карпального канала (сдавление нерва в области запястья), пронаторный синдром (поражение нерва в плече), синдром кубитального канала (в локте), синдром тарзального канала (сдавление большеберцового нерва), синдром ложа Гийона (сдавление глубокой ветви локтевого нерва) и др.
II. Множественные нейропатии (поражение нескольких отдельных нервов).
- Моторная мультифокальная нейропатия с блоками проведения — аутоиммунное заболевание, проявляющееся слабостью мышц стоп и кистей.
- Моторно-сенсорная невропатия с блоками проведения — вызывает поражение не только моторных, но и сенсорных волокон.
- Множественная невропатия при васкулитах.
III. Полиневропатии (множественные поражения нервной ткани).
1. Наследственные полиневропатии: Шарко — Мари — Тута, синдром Руси — Леви, Дежерина — Сотта и др.
2. Приобретённые полиневропатии.
2.1. Аутоиммунные полиневропатии — возникают при сбое в работе иммунной системы (синдром Гийена — Барре, синдром Миллера — Фишера, хроническая воспалительная демиелинизирующая полинейропатия, парапротеинемические полиневропатии, паранеопластические полинейропатии).
2.2. Метаболические полинейропатии — диабетическая, уремическая, печёночная, при системных заболеваниях. Наиболее часто встречается диабетическая нейропатия.
2.2 Вызванные дефицитом витаминов В1, В6, В12.
2.3 Токсические полинейропатии — вызванная алкоголем, лекарствами, отравлением тяжёлыми металлами. Препараты, способные приводить к нейропатии:
- Оксалиплатин — крайне нейротоксичное средство. Развитие острой нейропатии возникает в 90 % случаев, а хронической — в 50 %. Приём оксалиплатина приводит к жжению, покалыванию, онемению рук, ног и области вокруг рта.
- Таксен (Палитаксел, Доцетаксел) — вызывает нарушение чувствительности, слабость и боль в мышцах, возможны редкие вегетативные симптомы.
- Препараты на основе алкалоидов барвинка (Винбластин, Винорелбин, Виндезин, Винкристин) — нарушают функции мочевого пузыря и кишечника, влияют на чувствительность в руках и ногах, ухудшают мелкую моторику, приводят к мышечной слабости и резкому снижению артериального давления.
- Бортезомиб — нарушает чувствительность, приводит к боли и вегетативным симптомам.
- Иммуномодулирующие препараты (Талидомид) — провоцирует сенсорные нарушения, преимущественно в нижних конечностях, лёгкие двигательные, желудочно-кишечные и сердечно-сосудистые расстройства [15][16][18].
2.4 Инфекционно-токсические — после гриппа, кори, дифтерии, мононуклеоза, поствакцинальные, при ВИЧ-инфекции, лепре.
IV. Поражения сплетений (шейного, верхнего плечевого, нижнего плечевого, пояснично-крестцового).
V. Вертеброгенные поражения нервных корешков (радикулиты).
Несмотря на многообразие причин, вызывающих полинейропатии, по участкам поражения их можно разделить на два вида:
- Аксональные — вовлечены нервы с наиболее длинными отростками (аксонами), к ним относится большинство токсических полинейропатий, аксональный тип наследственной моторно-сенсорной полинейропатии. Характеризуются мышечными атрофиями.
- Демиелинизирующие — вызваны разрушением миелиновой оболочки, окружающей отростки нервных клеток. Проявляются выпадением сухожильных рефлексов, развитием мышечной слабости без мышечных атрофий [19].
Осложнения невропатии
Зачастую нейропатия уже является осложнением какого-либо заболевания, например сахарного диабета. У некоторых пациентов, страдающих диабетом, может развиваться диабетическая амиотрофия — асимметричное поражение проксимальных (близких к туловищу) отделов ног с развитием болей и слабости в мышцах [16][17][19].
Если лечение не начато вовремя, нейропатия стремительно прогрессирует. В результате снижается тонус мускулатуры, наступает атрофия мышц и инвалидность. На фоне мышечной слабости случаются падения и травмы. Пациенты утрачивают способность ходить и обслуживать себя. Иногда последствиями полинейропатии становятся полный паралич конечностей или дыхательная недостаточность.
Диагностика невропатии
Неврологи используют различные шкалы для оценки тяжести нейропатии. Универсального опросника, соответствующего всем потребностям клиницистов, не существует. Это связано с различным прогнозом, проявлениями и причинами нейропатии [21].
Во время обследования оценивают проводимость нерва, учитывая временную динамику [17]. Для диагностики применяют следующие методы:
- Электромиография (ЭМГ) — регистрация электрической активности в мышце при её сокращении. Позволяет определить характер двигательных расстройств, уточняет степень разрушения нерва и выявляет заболевание до появления симптомов. ЭМГ позволяет провести дифференциальную диагностику невропатии с миастенией, миотонией, миоплегией, полимиозитом [16][17].
- Электронейромиография (ЭНМГ) — оценивает прохождение импульса по нервному волокну. ЭНМГ поможет не только выявить расположение поражённых участков, но и определить момент начала патологического процесса [17].
- УЗИ — распространённый метод визуализации периферических нервов. Ультразвук поможет выявить нарушения, которые незаметны при электродиагностике. Оценивается изменение диаметра нерва, непрерывность и ухудшение звукопроводимости. УЗИ позволяет обнаружить опухоли периферических нервов, травматические невромы, разрывы, воспаление, демиелинизирующие процессы.
- МРТ — визуализирует нервы и структуру мягких тканей, выявляет злокачественные опухоли и предоставляет информацию о мышечной атрофии и поражении нервов. МРТ выявляет повреждение нерва в областях, которые трудно исследовать при помощи электродиагностики или ультразвука.
Согласно статистике, УЗИ выявляет мононевропатии или плечевые плексопатии чаще, чем МРТ [20].
Лечение невропатии
Выбор методов лечения нейропатии зависит от вызвавших её причин:
- Метаболические нейропатии, в частности диабетическую нейропатию лечат препаратами альфа-липоевой кислоты. Перспективный препарат для терапии диабетических невропатий — канитин. Однако основное лечение при сахарном диабете заключается в контроле уровня глюкозы [6].
- При комплексной терапии применяют препараты с витаминами. Высокие дозы принимают не более месяца.
- При возникновении болевого синдрома используют противосудорожные препараты, трициклические антидепрессанты. Их противоболевое действие связано с блокированием болевого импульса в головном мозге и устранением болевой «памяти». К физическим методам воздействия относят магнитотерапию, лазеротерапию, электрофорез с прозерином, элетростимуляцию ослабленных мышц, иглотерапию [17][16].
- Для лечения хронической демиелинизирующей полирадикулониейропатии применяют иммуносупрессивные препараты. Иногда при терапии на первый план выходит уменьшение боли.
- При синдроме Гийена — Барре необходима госпитализация в многопрофильную больницу с отделением реанимации и интенсивной терапии, в тяжёлых случаях — вентиляция лёгких, мониторинг ЭКГ и артериального давления, введение гепарина для предупреждения тромбоза глубоких вен и лёгочной эмболии. При выраженных болях вводят опиоидные анальгетики, антиконвульсанты, проводят лечебную физкультуру, организуют рациональное (зондовое) питание. Патогенетическая терапия включает использование плазмафереза, введение иммуноглобулинов, кортикостероидную терапию. При синдроме Гийена — Барре иммунотерапия ускоряет выздоровление, но не влияет на окончательный прогноз [16][17].
- Для достижения долгосрочной ремиссии при системном васкулите, не связанном с вирусами, применяют кортикостероиды и циклофосфамид. Продолжительность терапии кортикостероидами может быть более двух лет [1][17].
- Лечение нейропатий, вызванных приёмом противоопухолевых препаратов, является сложной задачей. Общепризнанной профилактической или лечебной стратегии до сих пор не существует [15][18].
Прогноз. Профилактика
Невропатия зачастую развивается достаточно медленно. Пациенты сообщают о неврологических проявлениях врачу спустя годы после её формирования. О симптомах симметричной полинейропатии лечащий врач узнаёт в среднем через 39 месяцев. В таком случае лечение может быть запоздалым, а повреждение нерва необратимым [5].
При синдроме Гийена — Барре прогноз ухудшают пожилой возраст, быстрое развитие заболевания, потеря аксонов. Восстановление может занять несколько месяцев и быть неполным. Приблизительно у 15 % пациентов с синдромом Гийена — Барре сохраняются остаточные параличи [16][17].
Васкулитная нейропатия развивается с разной скоростью. Заболевание может протекать как в прогрессирующей хронической форме, так и в рецидивирующей с длительными периодами ремиссии.
Прогноз при сахарном диабете зависит от поддержания оптимального уровня сахара в крови. Приверженность лечению позволяют замедлить развитие нейропатии.
Прогноз после травмы периферической нервной системы плохой. При повреждении эндоневральной трубки (внешнего слоя соединительной ткани, окружающей периферические нервы) пациенты редко восстанавливаются полностью [17].
После терапии противоопухолевыми средствами нейропатия может сохраняться несколько лет [18]. Обратимость патологии остаётся под вопросом, особенно при приёме противораковых препаратов на основе платины и таксанов. Для уменьшения тяжести симптомов онкологи могут снизить дозировку или прекратить применение нейротоксических противоопухолевых препаратов [15][18].
Не все нейропатии можно предотвратить. Однако часть нарушений возможно избежать или отсрочить их появление на несколько лет. Это в первую очередь относится к эндокринным нейропатиям, например диабетической, и нейропатии, вызванной дефицитом витаминов в организме.
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.

Главный редактор, заведующий хирургическим отделением
Задать вопрос
Врач-хирург высшей квалификационной категории, доктор медицинских наук, профессор кафедры общей хирургии АГМУ.
Содержание
- Что такое аксональная полинейропатия
- Причины
- Первые признаки
- Симптомы
- Диагностика
- Прогноз
- Профилактика
- Идиопатическая прогрессирующая невропатия
- Лечение
- Госпитализация
- Профилактика
Что такое аксональная полинейропатия
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда аксонально-демиелинизирующая полинейропатия поражает вегетативные волокна, нарушается регуляция сосудистого тонуса. Это приводит к сдавливанию капилляров, что вызывает отек тканей. Скопление жидкости в пораженных участках может привести к значительному увеличению размеров как нижних, так и верхних конечностей. Поскольку при полинейропатии этого типа в этих областях скапливается много крови, вставание может вызывать у пациента постоянное головокружение. Отсутствие трофической функции может также привести к эрозивным и язвенным поражениям на нижних конечностях.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Идиопатическая прогрессирующая невропатия
Полирадикулоневропатии — группа заболеваний периферической нервной системы, характеризующихся диффузным поражением периферических нервных волокон, входящих в состав различных нервов. Клинически полиневропатии проявляются периферическим тетрапарезом, арефлексией, нарушением чувствительности (часто по типу «носков и перчаток») и вегетативной дисфункцией, в частности вазомоторными нарушениями, расстройством потоотделения и другими проявлениями периферической нервной системы. При поражении волокон глубокой чувствительности развивается сенситивная атаксия.
Хроническая идиопатическая аксональная невропатия (ХИАН) — встречается преимущественно в среднем и пожилом возрасте, у детей редко и служит причиной до 3% случаев полиневропатий. Чаще всего она проявляется ощущением жжения и онемением в стопах, иногда легкой вегетативной дисфункцией, слабостью и атрофией мышц дистальных отделов нижних конечностей, а иногда и легкими нарушениями глубокой чувствительности. Течение обычно медленно прогрессирующее.
Хроническая воспалительная демиелинизирующая полирадикулоневропатия (ХВДП) — является причиной 5% полиневропатий. В отличие от синдрома Гийена-Барре характеризуется более медленным развитием, хроническим ремиттирующим или непрерывно прогрессирующим (в течение не менее 2 мес.) течением. Восстановление часто бывает неполным. Эта форма заболевания напоминает болезни мотонейронов. Заболевание встречается в любом возрасте. Предполагается, что в основе патогенеза ХВДП лежат нарушения иммунной системы. Может быть повышен титр антител к ганглиозидам. Слабость в начале отмечается в дистальных отделах ног, затем распространяется на руки и проксимальные отделы ног. Параллельно развиваются арефлексия и нарушения чувствительности. Выраженные парезы редко сопровождаются нарастающей атрофией. В 10% случаев чувствительные нарушения преобладают над двигательными. У части больных поражаются черепные нервы, обычно лицевой и бульбарные, реже глазодвигательные.
Лечение
Тактика лечения
Прежде всего, необходимо проверить, не является ли ХВДП проявлением иного заболевания, и если оно будет найдено — назначить соответствующее лечение. При идиопатической хронической воспалительной демиелинизирующей полирадикулоневропатии применяют кортикостероиды, плазмаферез и азатиоприл. Тактика определяется тяжестью симптоматики и возможностью проведения плазмофереза. С помощью комбинированной, адекватной иммунотерапии удается добиться улучшения у 90% больных ХВДП, однако главная проблема лечения ХВДП заключается в том, чтобы удержать достигнутый положительный результат. В настоящее время существует 3 основных средств лечения ХВДП — кортикостероиды, плазмоферез, внутривенно иммуноглобулин.
Цель лечения: достижение стойкой ремиссии, сохраняющейся после иммунотропных средств, улучшение двигательной активности, увеличение силы и объема активных движений, предупреждение осложнений (контрактур, атрофий), социальная адаптация, улучшение качества жизни.
Немедикаментозное лечение
Диета низкосолевая с высоким содержанием белка, но низким содержанием жира.
Активная реабилитация включает лечебную физкультуру, которая занимает одно из ведущих мест в лечении больных. Основная задача лечебных упражнений в раннем восстановительном периоде — тренировка основных параметров двигательной системы, которая заключается в постепенном и дозированном увеличении силы мышечного сокращения, амплитуды. Применяют пассивные и пассивно-активные упражнения с переходом к активным упражнениям.
Стимулирующий массаж пораженных конечностей, мышц спины.
Физиолечение — магнитотерапия, биоптрон, УВЧ на пораженные сегменты спинного мозга, СМТ паретичных мышц, озокеритовые аппликации, электрофорез с прозерином.
Иглорефлексотерапия.
Медикаментозное лечение
Кортикостероиды. Чаще всего лечение начинают с преднизолона в дозе — длительное назначение в дозе 0,5-1,5 мг/кг/сут. (до 100 мг в день). После достижения эффекта (обычно через 3-4 недели) дозу начинают осторожно снижать, постепенно переходя на прием препарата через день. Эту дозу сохраняют в течение нескольких месяцев — до тех пор, пока не произойдет существенно стойкого регресса неврологического дефицита. В последующем производят снижение дозы на 10 мг в месяц (или 5 мг каждые 2 недели) до 20 мг через день, после чего дозу снижают на 2,5 мг каждые 2-3 недели.
В отсутствии эффекта (10-15% больных) кортикостероиды отменяют гораздо быстрее. Во избежание рецидива прием поддерживающей дозы (5-10 мг через день) продолжают на протяжении нескольких лет. У части больных препарат в конце концов удается отменить, но у других на фоне отмены, состояние вновь ухудшается, и они вынуждены принимать его достаточно длинное время. В тяжелых случаях лечение начинают с высокой дозы метилпреднизолона (1000 мг внутривенно, капельно на 200 мл 5% глюкозы в течение 3-5 дней), после чего переходят на прием преднизолона внутрь, но иногда лечение проводят курсами пульс-терапии метилпреднизолона, повторными каждые 4-8 недель (интервалы между курсами могут постепенно увеличиваться).
На фоне лечения кортикостероидами мышечная сила обычно начинает увеличиваться через 1-2 месяца и может сохраняться до года и более. Для защиты пищеварительной системы следует принимать такие препараты, как ранитидин для H2-рецепторов (150 мг дважды в день) или ингибитор протонной помпы омепразол (20 мг в день). Кроме того, люди, находящиеся на длительной кортикостероидной терапии, должны следить за своим весом, артериальным давлением, уровнем глюкозы в крови, а также уровнем калия. Чтобы минимизировать риски для здоровья, такие как остеопороз и сердечные заболевания, важно соблюдать низкосолевую диету с высоким содержанием белка и низким содержанием жира, а также принимать добавки кальция, бисфосфонаты и, при необходимости, анаболические стероиды. Тем пациентам с идиопатической хронической воспалительной демиелинизирующей полирадикулонейропатией, которые хорошо реагируют на кортикостероиды, для достижения наилучших результатов, скорее всего, потребуется пожизненная поддерживающая доза в 5-20 мг каждый день.
Азатиоприл. При малой эффективности или непереносимости кортикостероидов, а также в тех случаях, когда их дозу не удается снизить, назначают цитостатики (азатиоприн 2,5 мг/кг/сут.). Взрослым азатиоприл назначают по 50 мг 3 раза в сутки; добавляют к кортикостероидам, если не получено улучшение после 3-4 недель лечения, или назначают одновременно с плазмаферезом, если он выбран в качестве основного метода лечения.. В ряде случаев получено улучшение при лечении циклофосфамидом, 1 г/м 2 внутривенно капельно, ежемесячно, или циклоспорин, 4-6 мг/кг/сут.). При тяжелых формах с самого начала используют сочетание азатиоприна с кортикостероидами. Во время лечения необходимо следить за состоянием кроветворения и функции печени.
Плазмаферез. С тем, чтобы избежать длительного приема кортикостероидов и цитостатиков, используют плазмаферез и иммуноглобулин. Циклы плазмафереза проводят в комбинации с медикаментозным лечением иммуносупрессорами. Повторные циклы плазмафереза элиминируют антитела IgG против периферической нервной ткани. Обнаружение последних служит прямым показанием для проведения плазмафереза. Проводят 2 сеанса в неделю, в течение 3 недель, добавляют к кортикостероидам, если они не эффективны в течение первых 1-2 недель.
Иммуноглобулин (октагам, сандоглобуллин, хумаглобин и др.) вводят — внутривенное введение в дозе 0,4 г/кг/сут. в 1 мл физиологического раствора, в течение 3-5 дней подряд (скорость инфузии 6-8 час), если отмечается позитивный клинический эффект, курс введения иммуноглобулина повторяется. Побочные эффекты — головная боль, тошнота, лихорадка. Улучшение проявляется в течение 3 недель и продолжается в среднем 6 недель. Однако продолжительность улучшения не превышает нескольких недель или месяцев, после чего введение иммуноглобулина приходится повторять (1 г/кг в течение 1-2 дней).
В связи с этим разработаны схемы с более плавным прекращением лечения (например, 1 мг/кг/сут., в течение 2 дней, затем ту же дозу вводят через 2 и 4 недели, после чего повторяют ежемесячно на протяжении нескольких месяцев).
При частых рецидивах целесообразно присоединение малых доз преднизолона (0,5 мг/сет). Комбинировать плазмаферез и в/в введение иммуноглобулина не целесообразно. Серьезных побочных эффектов нет, однако пока не установлено, достаточно ли эффективен иммуноглобулин в качестве монотерапии.
В ряде исследований показана эффективность при ХВДП интерферонов (альфа и бета), методов иммуноабсорбции, однако их роль в лечении данного заболевания остается неясной.
Витаминотерапия: витамины группы В — В, В6, В.
Лечение препаратами, действующими на сосудистую систему, улучшающими реологические свойства крови и микроциркуляцию, проводится в виде последовательных курсов, каждый из них длительностью 2-3 недели. Применяются в возрастных дозировках — трентал, кавинтон, танакан.
Препараты, улучшающие метаболизм: церебролизин, актовегин, пирацетам, пиритинол, гинкго-билоба;
Метаболические средства — фолиевая кислота, аевит, оротат калия.
Дальнейшее ведение:
- — диспансерный учет у невропатолога по месту жительства;
- — регулярные занятия ЛФК;
- — соблюдение низкосолевой диеты с высоким содержанием белка, но низким содержанием жира;
- — продолжить прием преднизолона с постепенным снижением дозы, прием ранитидина.
Перечень основных медикаментов:
- Азатиоприн, 50 мг
- Актовегин, ампулы по 80 мг
- Аскорбиновая кислота, таблетки 0,05
- Иммуноглобулин человека для внутривенного введения (хумаглобин), 5 мл (250 мг), 10 мл (500 мг), 20 мл (1000 мг), 50 мл (2500 мг), 100 мл (000 мг)
- Кальций-Д3 Никомед, таблетки 0,5
- Нейромидин, таблетки 20 мг
- Пиридоксин гидрохлорид (витамин В6), ампулы 5% 1 мл
- Преднизолон, ампулы 30 мг
- Преднизолон, таблетки 5 мг
- Ранитидин, таблетки 0,15
- Тиамин бромид (витамин В1), ампулы 5% 1 мл
- Фолиевая кислота, таблетки 0,001
- Цианокобаламин (витамин В12), ампулы 500 мкг
Дополнительные медикаменты:
1. Актовегин, ампулы 2 мл 80 мг
2. Винпоцетин (кавинтон), таблетки 5 мг
3. Калия оротат, таблетки 0,5
4. Метандростенолон, таблетки 0,005
5. Метилпреднизолон (метилпред, солюмедрол), суспензия для инъекций 1 мл, 40 мг
6. Оксибрал, ампулы 2 мл
7. Октагам, флаконы по 50 мл, 100 мл и 200 мл
8. Омепразол, капсулы 20 мг
9. Пентоксифиллин (трентал), таблетки 0,1
10. Пирацетам, ампулы 5 мл
11. Ретоболил, ампулы по 1 мл 5% (50 мг) в масле
12. Танакан, таблетки 40 мг
13. Церебролизин, ампулы 1 мл
14. Циклоспорин (сандиммун), капсулы 10 мг, 25 мг, 100 мг
Индикаторы эффективности лечения:
1. Увеличение мышечной силы, объема активных движений, мышечного тонуса в пораженных конечностях.
2. Улучшение походки.
3. Улучшение трофики паретичных мышц, двигательных функций.
4. Удержание достигнутого положительного результата.
Госпитализация
Показания к госпитализации (плановая): парезы, параличи, нарушение походки, слабость и нарушение чувствительности в конечностях, контрактуры, деформации стоп.
Профилактика
Профилактические мероприятия:
1. Профилактика рецидивов заболевания.
2. Предупреждение контрактур, атрофий, растяжение мышц, ретракции сухожилий, скелетных деформаций — сколиоза, подвывиха и вывиха суставов, эквиноварусной деформации стопы.

Причин, из-за которых может пострадать малоберцовый нерв, может быть несколько, а симптомы заболевания тесно связаны с нарушением проведения нервного импульса через мышечные волокна, что приводит к слабости, онемению и нарушению чувствительности.
В свою очередь, лечение заболеваний малоберцового нерва проходит с применением нескольких способов – традиционных и народных.
Анатомо-физиологическая справка
Малоберцовый нерв – это основная часть крестцового сплетения, волокна которого находятся в составе седалищного нерва, отделяясь от него в отдельную часть нерва, и располагается он в районе подклетной ямки.
После этого нерв проходит через спираль доходя до малоберцовой кости (в данной области он возвышается над костью и покрывается защитным слоем для того, чтобы избежать повреждений при ударе и падениях). Далее фибра распределяется на три равные части – поверхностная, наружная и внутренняя.
Поверхностная и внутренняя фибра получили свое название из-за своего расположения над и под голенью. Первое ответвление нерва 
Защемление той или иной части фибры приводит, как правило, к нарушению ее функционирования.
К примеру, пациенту будет затруднительно разогнуть пальцы на ноге либо может нарушится подвижность правой или левой стопы.
Что нужно знать про малоберцовый нерв, его функции и анатомия:
Причины и разновидности поражения нерва
Причины, которые могут спровоцировать болезни малоберцового нерва:
- травмы стопы и ноги, которые впоследствии привели к нарушению функционирования нерва (это может быть перелом, так как повреждение такого типа чревато защемлением нерва);
- сдавливание нерва также может привести к его серьезному поражению;
- перенапряжение и излишняя физическая нагрузка накладывает довольно серьезный отпечаток на работу не только всего организма, а и на нервных окончаний;
- неврологические заболевания;
- нарушенное кровообращение;
- онкологические заболевания провоцируют сдавливание нерва;
- переохлаждение или перегрев;
- воздействие на организм токсинов.
Первичные и вторичные нарушения
Когтеобразная стопа
Первичный тип поражения малоберцового нерва, развитие которого происходит из-за воспалительной реакции, не зависит от другого патологического процесса, происходящего в организме.
Чаще всего это состояние наблюдается у людей, которые на протяжении длительного времени дают нагрузки только на одну конечность (к примеру, переносят на нее основную часть массы тела или делают упражнения для ног в спортзале по очереди). К этому типу патологий относится неврит малоберцового нерва.
Вторичный тип нарушений нерва характерен осложнением уже существующего у пациента заболевания.
Наиболее частой причиной серьезного поражения малоберцового нерва является его сдавливание, которое характерно для следующих заболеваний:
- остеопатические нарушения;
- доброкачественные новообразования костной ткани;
- синонимические воспаления синовиальной оболочки;
- переломы и вывихи голеностопа;
- ушиб конечности;
- тендовагинит;
- воспаления внутренней суставной оболочки;
- деформирующий остеоартроз — хроническое заболевание хрящевой и суставной тканей;
- бурсит малоберцового нерва – воспаление суставной сумки;
- посттравматический артроз.
Также к данному типу поражения нерва относится: невропатия и невралгия малоберцового нерва.
Клиническая картина
Повреждение малоберцового нерва характерно тем, что при его поражении нарушается не только его чувствительность, а и функционирование конечности в целом. Любое заболевание малоберцового нерва приводит к уменьшению чувствительности, утрате подвижности, резким болям и недомоганию в целом. Заболевание может начать развиваться из-за вышеописанных причин (травма, невралгия и прочие повреждения).
Поражение малоберцового нерва может выступать в роли самостоятельного и смежного заболевания. Также следует учесть, что характерной особенностью повреждения малоберцового нерва является его постепенное развитие.
Диагностические критерии
Диагностирование заболевания происходит с помощью сбора невропатологом всей необходимой информации через первичный осмотр и сбор анализов.
В первую очередь врачу необходимо исследовать рефлексы и провести диагностические тесты, которые смогут указать на местонахождение повреждения и степень его развития.
Анализ чувствительности покажет степень поражения фибры, а ультразвуковое исследование подскажет возможные способы лечения заболевания.
Чем раньше пациент обратится к лечащему врачу за специализированной помощью, тем раньше будет найден способ лечения.
Нейропатия — симптомы и лечение
Нейропатия малоберцового нерва – это воспалительный процесс, который характерен онемением и снижением чувствительности пальцев и кисти в целом. Запущенная стадия данного заболевания приводит к атрофии мышц, что может привести к полному онемению кончиков фаланг.
Симптомы, которые могут указать на то, что у пациента нейропатия малоберцового нерва:
- уменьшение чувствительности конечности, что приводит к отсутствию болевых ощущений;
- нарушение функционирования пальцев и кисти руки;
- онемение конечности, что лишает ее подвижности.
Как правило, поражение берцового нерва довольно часто развивается у профессиональных спортсменов, а вызвано это может быть излишним мышечным перенапряжением, что приводит к защемлению нерва. Нестабильность коленного сустава может найти свой отголосок именно в этой проблеме.
Лечение невропатии включает комплекс следующих методов:
- первым делом пациента помещают в стационар;
- затем назначается прием противовоспалительных обезболивающих медикаментов;
- применяется комплекс физиопроцедур;
- довольно эффективным методом лечения нейропатии считается дезинтоксикационная терапия и прием витаминов для поддержания организма.

Особенности невралгии
Невралгия малоберцового нерва – это патология, которая чаще всего вызвана травмами различного рода или длительным сдавливанием фибры.
Воспалительный процесс проявляется следующими симптомами:
- повышение болевого порога;
- потеря чувствительности в повреждённой области, что приводит к нарушению прохождения импульса к коре головного мозга;
- изменение в работе и функционировании повреждённых мышц.
Лечение заболевания проходит с помощью комплексного подхода, а именно:
- накладывается гипсовая лента, которая фиксирует поврежденную область, что поможет избежать излишнего травмирования;
- если у пациента возникают воспалительные процессы, то ему назначаются нестероидные противовоспалительные средства и обезболивающие для снятия болей и неприятных ощущений;
- для повышения устойчивости организма во время прохождения курса лечения назначается прием витаминов (в том числе категории В и С);
- физиотерапевтические методы терапии также немаловажны — применяются амплипульс и УВЧ;
- также применяются курсы лечебного массажа и гимнастики, которые помогают восстановить чувствительность фибры и убрать защемление нерва.
Аксонопатия малоберцовых нервов – это заболевание периферической нервной системы (невралгия), которое возникает из-за нарушения нейлоновых соединений.
Симптомы и лечение неврита
Неврит малоберцового нерва – это воспалительный процесс, который сопровождается постоянными болевыми ощущениями, онемением конечности и слабостью всей мышцы, другие симптомы поражения:
- ощущение жжения в области нерва;
- отечность конечности розово-фиолетового цвета;
- слабость;
- изменение температуры тела;
- свисание конечности при ее перенапряжении.
Диагностика состоит из следующих этапов:
- невролог проводит первичный осмотр пациента и в зависимости от состояния его здоровья назначается спектр дополнительных диагностических мер;
- дополнительные анализы назначаются для получения полной клинической картины.
Что касается лечения, то оно выглядит следующим образом:
- первым делом пациенту необходимо максимальным образом зафиксировать конечность для предотвращения ее обвисания с помощью специализированной компрессионной повязки и, как правило, при этом рука полностью обездвиживается;
- следующим этапом лечения является ежедневная лечебная гимнастика, прием противовоспалительных и обезболивающих медикаментов, которые облегчат состояние пациента;
- для поддержки применяются методы физиотерапии, лечебная гимнастика и сеансы массажа, которые должны проходить на постоянной основе.
Если для лечения поврежденного нерва не было предпринято каких-либо мер, то это чревато следующими последствиями:
- полная потеря чувствительности и онемение поврежденной области;
- хронические боли.
Для предотвращения повреждений нерва необходимо следить за своим питанием и соблюдать режим дня. Ежедневная лечебная гимнастика также немаловажна в качестве профилактики.
Периодически, приблизительно в 15-20% случаев, по данным «нейронного теста» (аутоантитела к аутоантигенам аксонов и миелиновой оболочки — общий белок миелина) мы выявляем у больных с психическими расстройствами и, в частности, страдающих зависимостью от психоактивных веществ, патологию аксонов, которую можно рассматривать либо как следствие воспалительного процесса, либо демиелинизирующих процессов или аксонопатию метаболического характера.
Патология аксонов, вероятно, может включать в себя: их утрату, пересечение, нарушенный аксональный транспорт, повреждение оболочки, дистального или проксимального отделов этих отростков нейронов. «Незащищенные аксоны» вследствие повреждения или утраты миелиновой оболочки становятся более уязвимыми и восприимчивыми к их дальнейшему повреждению.
В психиатрии мы чаще всего встречаемся с хроническим поражением аксонов, в неврологии, например, при рассеянном склерозе — с острым. Маркерами острого повреждения аксонов считаются: дефосфолирование нейрофиламентов, нарушение аксонального транспорта, экспрессия специфических кальциевых каналов и пересечение аксонов.
Нарушение аксонального транспорта («поперечное повреждение аксонов») можно обнаружить при помощи белков, транспортирующихся по аксонам. Белки аккумулируются в поперечных срезах или в зонах нарушенного транспорта. Одним из таких белков является амилоидный белок предшественник, который синтезируется в нейронах и транспортируется на периферию вдоль аксонального цитоскелета. Некоторые исследователи полагают, что повреждение аксонов происходит при атаке на миелиновую оболочку, что аксонотоксичные компоненты присутствуют среди медиаторов воспаления, повреждающих миелиновый — олигодендроцитарный комплекс. Возможно, аксоны утрачивают трофическую поддержку, получаемую от олигодендроцитов. Скорее всего, основными мишенями аутоиммунного ответа при некоторых психических расстройствах являются олигодендроциты и миелиновые оболочки.
Олигодендроциты более восприимчивы к повреждению вследствие влияния большого числа иммунологических или токсических эффекторов, включая цитокины (TNF-альфа), реактивные виды кислорода или азота, медиаторов возбуждения (глутамат), компонентов комплимента, протеолитических и липолитических энзимов и др. агентов. Целостность аксонов в первую очередь зависит от взаимодействия аксонов и олигодендроцитов, которые являются миелинобразующими клетками и доставляющими к аксону «трофические сигналы выживания». Заключительная фаза разрушения цитоскелета аксонов заключается в притоке в него ионов Ca2+, активирующих широкий спектр протеиназ, например, кальпаина, что и приводит к деинтеграции аксона (этот процесс можно предотвратить с помощью блокады входа в аксон Na+ или Ca+).
Демиелинизирующие заболевания
Демиелинизирующие заболевания – это большая группа болезней, при которых разрушаются миелиновые оболочки структур центральной и периферической нервной системы. Они имеют мультифакториальную природу, возникают при сочетании отягощенной наследственности и внешних факторов риска. Самые распространенные нозологии: рассеянный склероз, разные клинические формы рассеянного энцефаломиелита и полинейропатий. Диагностика демиелинизирующих патологий требует проведения МРТ, нейрофизиологических и иммунологических исследований. Лечение включает гормонотерапию, иммуносупрессию, экстракорпоральную гемокоррекцию, мультидисциплинарную реабилитацию.
Общие сведения
В России зарегистрировано более 500 тыс. больных с разными демиелинизирующими патологиями, из которых 30% составляют люди с рассеянным склерозом. Уровень заболеваемости колеблется в пределах 30-70 случаев на 100 тыс. населения в разных регионах страны. Демиелинизирующие болезни представляют серьезную проблему здравоохранения, поскольку они снижают качество жизни и трудоспособность, требуют больших затрат на лечение. Специалисты в сфере экспериментальной и практической неврологии постоянно работают над новыми методами терапии, которые дают надежду на достижение стойкой ремиссии или полное излечение.
Демиелинизирующие заболевания
Причины
Общепринята мультифакториальная теория демиелинизирующих заболеваний, согласно которой они возникают при сочетании внешних и внутренних провоцирующих факторов. Большинство патологий связаны с наследственными причинами. Лучше всего эти закономерности изучены у больных рассеянным склерозом (РС), за развитие которого отвечают как минимум 2 гена из комплекса HLA. К экзогенным факторам риска относятся следующие:
- Инфекции. Специфический возбудитель рассеянного энцефаломиелита – вирус ОРЭМ. Зачастую демиелинизацию провоцируют вирусы кори, краснухи, инфекционного мононуклеоза. Особого внимания заслуживает ВИЧ-инфекция: энцефалопатия и деменция развиваются у 15-20% больных на стадии СПИДа.
- Метаболические нарушения. Демиелинизирующие процессы по типу миелинолиза развиваются при накоплении продуктов азотистого обмена на фоне ХПН, декомпенсированном сахарном диабете, патологии цикла обмена мочевины.
- Церебральная ишемия. Поражение миелиновых оболочек провоцируется эпизодами нарушения мозгового кровообращения. Они характерны для людей с осложненным течением артериальной гипертензии, повторными гипертензивными кризами, тяжелыми аритмиями.
- Интоксикация. В развитии демиелинизирующих заболеваний играют роль отравления химическими растворителями, лакокрасочной продукцией, угарным газом. К провоцирующим факторам относят передозировки лекарственных препаратов, которые влияют на регуляцию кардиореспираторной деятельности и вызывают гипоксию.
- Вакцинация. Описаны единичные случаи поражения ЦНС после проведения иммунизации АКДС и КПК, при факультативной вакцинации против гриппа и бешенства. Такие патологии вызваны индивидуальной реакцией организма на прививку и чаще развиваются у пациентов с отягощенной наследственностью.
Патогенез
Миелин представляет собой наружную оболочку нервных волокон и состоит из нескольких слоев плазмолеммы. Он обеспечивает электроизоляцию и питание нервов, чтобы импульсы могли быстро достигать разных структур нервной системы. Демиелинизация – патологический процесс утраты миелина при относительной сохранности аксонов. Ее следует отличать от миелинопатий – заболевания, при котором нарушаются первичные процессы образования миелиновых оболочек.
В зависимости от типа повреждения выделяют 4 вида демиелинизации: дизиммуновоспалительная, вирусная, метаболическая и гипоксически-ишемическая. Дизиммуновоспалительные формы встречаются при рассеянном склерозе и близких к нему патологиях. Она проявляется избирательной очаговой деструкцией миелина, появлением липофитов и пролиферацией микроглиоцитов. При этом большинство аксонов в ЦНС продолжают функционировать.
Вирусные демиелинизирующие заболевания развиваются при накоплении в нервной ткани патогенов, которые постепенно разрушают миелиновые оболочки. Гипоксически-ишемическое повреждение сопряжено с хроническими эпизодами гипоперфузии мозга либо с поражением ЦНС нейротоксическими агентами. Метаболическая демиелинизация может быть связана с резкими колебаниями уровня натрия. В этом случае развивается центральный понтинный миелинолиз.
Демиелинизирующие заболевания
Классификация
С учетом этиопатогенеза демиелинизирующие заболевания подразделяются на первичные, которые возникают без четкой причины под влиянием аутоиммунных механизмов, и вторичные – результат повреждающего действия вирусных или токсических агентов. В практической неврологии широко применяется классификация по локализации поражения и клиническому течению. Согласно ей, выделяют такие варианты демиелинизирующих болезней:
1. Поражения ЦНС. В этом случае повреждение локализовано в белом веществе головного и спинного мозга. Заболевания отличаются тяжелым течением, неуклонным прогрессированием и нарушением всех неврологических функций. По скорости развития они подразделяются на подгруппы:
- Острые. К этой категории относят первичный рассеянный энцефаломиелит и его отдельные формы: оптикомиелит, диссеминированный миелит, полиоэнцефалит. Острое течение типично для параинфекционных и вакцинальных энцефалопатий.
- Подострые. Такой тип течения характерен для рассеянного склероза, который проявляется в виде цереброспинальной, церебральной, оптической и других клинических форм.
- Хронические. В эту группу демиелинизирующих заболеваний входят энцефалиты Даусона, Петте-Деринга, диффузный лейкоэнцефалит Шильдера.
2. Поражение периферических нервов. Чаще всего диагностируется первичный полирадикулоневрит при болезни Гийена-Барре. Также к группе периферических демиелинизирующих патологий относят инфекционные и токсические нейропатии, диабетическую полинейропатию.
Симптомы демиелинизирующих заболеваний
Рассеянный склероз
Дебют происходит в молодом возрасте. Начальные симптомы представлены парестезиями в одной или нескольких конечностях, мышечной слабостью в руках и ногах, периодическими нарушениями зрения. Пациенты отмечают легкую дискоординацию движений, неустойчивость походки. Иногда в начале болезни проявляются расстройства функций тазовых органов: недержание мочи, частые позывы на мочеиспускание.
По мере прогрессирования рассеянного склероза возникают парезы или параличи конечностей, нарушаются функции черепно-мозговых нервов (ЧМН), усиливаются поражения чувствительных нервных волокон. Присоединяется спастичность мышц, которая усиливается при вертикализации пациента и во время ходьбы. Для РС типичен синдром диссоциации: несоответствие между поражениями внутренних органов и клиническими симптомами.
Острый рассеянный энцефаломиелит
Клинические проявления демиелинизирующего заболевания соответствуют энцефалопатии. Патология манифестирует нарушениями сознания разной степени тяжести – от оглушенности до комы. Пациентов беспокоят сильные головные боли, тошнота, рвота, которая не приносит облегчение. Неврологическая симптоматика достигает максимума в течение нескольких дней, из-за чего больные госпитализируются в отделение интенсивной терапии.
Очаговые проявления вариабельны и зависят от локализации поражения. Демиелинизирующая патология проявляется нарушениями координации, параличами половины дела, нарушениями зрения, речи и других функций, которые контролируются ЧМН. До 35% случаев сопровождается эпилептическими приступами, около 25% пациентов страдают от корешкового болевого синдрома, дисфункции тазовых органов.
Синдром Гийена-Барре
Главным признаком заболевания является симметричные мышечная слабость, которая начинается в ногах и постепенно распространяется на мышцы туловища, верхних конечностей, лица и шеи. Она сопровождается шаткостью походки, покалыванием в руках и ногах, болями в спине. В процесс вовлекаются мышцы, отвечающие за глотание и артикуляцию, поэтому развивается дисфагия, дизартрия. При параличе дыхательной мускулатуры возможна асфиксия.
Другие виды полинейропатий
Повреждения периферических нервов проявляются сочетанием моторных, сенсорных и вегетативных симптомов. Большинство случаев демиелинизирующего заболевания начинается с мышечной слабости в дистальных отделах конечностей, которая постепенно распространяется на вышележащие отделы тела и может достигать дыхательной мускулатуры. Характерно угнетение или полное отсутствие сухожильных рефлексов.
В дебюте полинейропатии пациенты жалуются на симметричное нарушение чувствительности по типу «носков» и «перчаток». В дистальных отделах наблюдается повышенная болевая и тактильная чувствительность, некоторые больные жалуются на ощущение ползания мурашек и онемение кожи. Постепенно симптомы раздражения сменяются признаками выпадения неврологической функции, нарушается температурная и болевая чувствительность.
Осложнения
Демиелинизирующие болезни сопровождаются неврологическим дефицитом, который неумолимо прогрессирует. На поздних стадиях пациенту устанавливают группу инвалидности из-за двигательных или когнитивных нарушений. При остро протекающих заболеваниях (концентрическом склерозе, рассеянном энцефаломиелите) летальный исход возможен в первые месяцы. Диффузно-диссеминированный склероз завершается смертью через 3-7 лет от появления симптоматики.
Для демиелинизации характерно тотальное поражение мышц, поэтому как минимум у трети больных развивается дыхательная недостаточность, нарушение пережевывания и глотания пищи, расстройства речевой функции. Особенно тяжело протекает бульбарный синдром, вызванный поражением (ЧМН). Присоединяются расстройства вегетативной нервной системы, которые проявляются аритмиями, колебаниями артериального давления. нарушениями перистальтики и работы тазовых органов.
Диагностика
Для выявления демиелинизирующих заболеваний пациенту требуется полное обследование у врача-невролога. На первичной консультации большое внимание уделяется сбору анамнеза, поскольку у 80% людей выявляются факторы риска в виде перенесенных инфекций, ятрогенных вмешательств, интоксикации и прочих экзогенных вредностей. Осмотр дополняется оценкой неврологического статуса. Диагностическая программа состоит из следующих методов:
- Магнитно-резонансная томография. Нейровизуализация головного и спинного мозга является основным методом для диагностики демиелинизации в ЦНС, определения ее топографии и размеров. Внимание врачей привлекает сочетание накапливающих и не накапливающих контрастное вещество очагов в рамках одного МРТ-снимка.
- Нейрофизиологическая диагностика. При судорожном синдроме обязательно проводят классическую электроэнцефалографию и ЭЭГ с депривацией сна для выявления эпилептиформной активности. Признаки патологии периферических нервов требуется выполнение электронейромиографии, которая определяет локализацию патологии и скорость прохождения нервных импульсов.
- Иммунологические анализы. Обязательным при РС считается исследование крови и ликвора на олигоклональные антитела IgG. Чтобы определить возможные провоцирующие факторы, проводится анализ на антитела к нативной ДНК, кардиолипину, волчаночному антикоагулянту. Отличить РС от оптиконевромиелита позволяет исследование на антитела к аквапорину-4.
- Дополнительные методы. Базовая диагностическая программа включает общие анализы крови и мочи, расширенный биохимический анализ крови, определение острофазовых показателей. Для исключения хронических инфекций выполняются серологические и молекулярно-генетические реакции.
- Консультации специалистов. Зрительные нарушения требуют консультации офтальмолога, проведения офтальмоскопии, биомикроскопии глаза и визометрии. При снижении слуха пациента направляют на консультацию к отоларингологу с обязательным проведением аудиометрии, исследованием слуховых вызванных потенциалов.
Дифференциальная диагностика
Дифференциальная диагностика демиелинизирующих процессов сложна из-за разнообразия клинической картины, отсутствия четких клинико-морфологических критериев. При обследовании исключают вирусные и бактериальные энцефалиты, системные болезни соединительной ткани, паранеопластический синдром. В сложных случаях симптоматику дифференцируют с проявлениями митохондриальных заболеваний, для чего назначают биопсию мышц и ДНК-диагностику.
Физическая реабилитация пациентов
Лечение демиелинизирующих заболеваний
Консервативная терапия
Схема лечения подбирается индивидуально для каждого больного с учетом вида заболевания, его стадии, степени тяжести и клинических особенностей. Пациенты с умеренными проявлениями неврологического дефицита и стабильным развитием болезни проходят лечение в домашних условиях под наблюдением врача. При более тяжелых формах требуется госпитализация в неврологический стационар или реанимационное отделение. При демиелинизирующих заболеваниях показано несколько направлений консервативной терапии:
- Иммуносупрессия. Поскольку патология носит аутоиммунный характер, для купирования симптоматики назначают лечение глюкокортикостероидами. Для быстрого купирования обострения показана гормональная пульс-терапия с парентеральным введением лекарств. При их неэффективности применяются цитостатики, интерфероны, моноклональные антитела.
- Коррекция неврологических симптомов. Для ликвидации мышечной спастичности применяются миорелаксанты центрального действия, антиконвульсанты. Чтобы уменьшить координационные нарушения, используют препараты против системного головокружения. Коррекцию психоэмоционального статуса проводят антидепрессантами и анксиолитиками.
- Экстракорпоральные методы. Для удаления циркулирующих антител и иммунных комплексов проводят каскадную фильтрацию плазмы, криоаферез, лимфоцитаферез и другие методы гемоккоррекции. Терапия ускоряет наступление ремиссии и увеличивает ее продолжительность.
При вторичных формах демиелинизирующих процессов, связанных с конкретным этиологическим фактором, по возможности устраняют первопричину. Пациентам назначают противовирусную или антибактериальную терапию нейроинфекций, рациональную гипогликемическую терапию, медикаментозные и экстракорпоральные методы лечения ХПН. При токсических формах полинейропатии необходимо прекратить контакт с ядовитым веществом и ввести соответствующие антидоты.
Экспериментальное лечение
Ведутся клинические испытания блокатора ионов кальция (4-амидопирина) для купирования симптоматики демиелинизирующих процессов в ЦНС. Доказано, что препарат ускоряет проводимость по миелиновым нервным волокнам и уменьшает явления неврологического дефицита. Он действует на кальциевые каналы аксолеммы волокон, благодаря чему регулирует потенциал действия.
В 2017 году группа американских ученых представила уникальный метод генной терапии, который основан на подавлении активности иммунных клеток и ликвидации аутоиммунных повреждений миелина. Исследователи создали безопасный вирус с генетическим кодом MOG, который встраивается в ДНК печени и снижает агрессию Т-киллеров на головной мозг. Терапия находится в стадии разработки и требует длительной подготовки к клиническим исследованиям.
Реабилитация
Пациентам требуется комплексный уход и медико-социальная реабилитация. Эти меры направлены на повышение качества жизни, нормализацию физического и интеллектуального функционирования человека. Лечебная физкультура (ЛФК) улучшает силу скелетной мускулатуры, тренирует сердечно-сосудистую и дыхательную системы. Рекомендованы когнитивные тренировки, занятия с логопедом и клиническим психологом.
Прогноз и профилактика
Несмотря на усовершенствование знаний об этиопатогенезе и возможностях лечения, демиелинизирующие болезни пока представляют неразрешимую проблему для неврологии. Комплексная терапия замедляет или останавливает их прогрессирование, однако методы полного излечения не разработаны. Осторожный оптимизм внушают направления иммунотерапии и генной терапии, которые влияют на первопричину развития заболеваний.
Эффективные меры первичной профилактики отсутствуют. Чтобы снизить риск активации аутоиммунных процессов, пациентам с генетическими факторами риска рекомендуется избегать токсических воздействий, нейроинфекций, полипрагмазии лекарственных препаратов. Необходим рациональный подход к плановой вакцинации, которая предупреждает корь, краснуху и другие инфекции, выступающие триггерами демиелинизирующей болезни.
|
Литература 1. Неврология. Национальное руководство/ под ред. Е.И. Гусева, А.Н. Коновалова, В.И. Скворцовой. – 2018. 2. Редкие демиелинизирующие заболевания центральной нервной системы/ Т.Е. Шмидт// Неврологический журнал. – 2016. – №. 5. 3. Дифференциальная диагностика миелитов при демиелинизирующих заболеваниях/ И.С. Бакулин// Нервные болезни. – 2015. – №. 4. 4. Демиелинизирующие заболевания/ Ю.И. Стаднюк, Д.С. Лезина, О.В. Воробьева// Лечение заболеваний нервной системы. – 2012. – №2. |
Код МКБ-10 G35-G37 |
Демиелинизирующие заболевания — лечение в Москве
Периферическая нейропатия (нейропатия нерва) обозначает повреждение периферической нервной системы, обширной системы коммуникативных нервных волокон, передающей информацию от головного и спинного мозга к любой части тела. Периферические нервы также посылают сенсорную информацию обратно в головной и спинной мозг, информируя о наличии воздействий на ткани (простуда или ожог). При повреждении периферической нервной системы нарушаются эти жизненно важные связи.
Это можно сравнить с нарушением связи на телефонной станции, когда связь между станцией и абонентами нарушается (аналогичные прерывание связи происходит между мозгом и частями тела). Поскольку у каждого периферического нерва есть своя узкоспециализированная функция в определенной части тела, при повреждении нерва может быть различная симптоматика. У некоторых это может проявляться онемением, покалыванием, избыточной чувствительностью к прикосновению (парестезия), или слабостью мышцы. У других могут быть более выраженные симптомы, включая острую боль (особенно ночью), гипотрофия мышцы, паралич, или дисфункция железистой ткани или органа. Люди могут испытывать неспособность нормального переваривания пищи поддержания нормального АД потливость нарушения репродуктивных функций. В наиболее тяжелых случаях могут быть нарушения функции дыхания или органная недостаточность. При некоторых формах невропатии происходит повреждение только одного нерва, и называются эти повреждения мононейропатиями. При поражении большого числа нервов оказывающих влияние на конечности такие повреждении называют полинейропатиями. Иногда бывают поражения двух или более отдельных нервов в определенных областях тела это называют мультифокальным мононевритом. При острых невропатиях, таких как синдром Гийена-Барре, симптомы появляются внезапно , происходит быстрое прогрессирование и восстановление функций происходит медленно так как возникают повреждения нервных волокон. При хронических формах невропатии симптомы появляются постепенно и медленно прогрессируют. У некоторых пациентов периоды ремиссии сменяются периодами обострений. У других состояние может достичь определенного плато, при котором симптомы сохраняются неизменными в течение многих месяцев или лет. Некоторые хронические невропатии прогрессируют в течение долгого времени, но очень немного форм оказываются смертельными, если нет осложнений связанных с другими заболеваниями. Нередко невропатия — симптом другого заболевания.
При наиболее распространенных формах полинейропатии, нервные волокна наиболее удаленные от мозга начинают дисфункционировать в первую очередь. Боль и другие симптомы часто появляются симметрично, например, в обеих ногах, сопровождаемых постепенным прогрессией в обеих ногах. Иногда повреждаются пальцы рук и руки с прогрессированием выше к середине тела. У многих пациентов с диабетической нейропатией- именно такая форма прогрессирования и повреждения нервов.
Классификация периферических невропатий
Существует более 100 типов периферической невропатии, которые были идентифицированы, каждый с характерным симптомокомплексом структурой развития, и прогнозом. Нарушенная функция и симптомы зависят от типа нервов, которые подверглись повреждению (моторные, сенсорные, или вегетативные). Двигательные нервы управляют движениями всех мышц под контролем сознания, такими как ходьба, хватание или речь. Сенсорные нервы передают информацию о процессах восприятия, таких как тактильное чувство или боль вследствие пореза. Пучки вегетативных нервных волокон регулируют биологические действия, которыми выполняются без сознательно, такие как дыхание, переваривание пищи, деятельность сердца или желез секреции. Хотя некоторые невропатии могут оказать влияние на все три типа нервов, чаще всего происходит нарушение функции одного или двух типов нервов. Поэтому, врачи могут использовать термин, такой как преобладающе моторная невропатия, преимущественно сенсорная невропатия, сенсорно-моторная невропатия, или автономная невропатия.
Симптомы и причины
Сенсорное повреждение нервов вызывает более широкий диапазон симптомов, потому что у сенсорных нервов существует целая группа узкоспециализированных функций. Большие сенсорные волокна окружены миелиновой оболочкой и регистрируют вибрацию тактильные ощущения и проприорецепцию. Повреждение больших сенсорных волокон снижает способность чувствовать колебания и прикосновение что в результате дает онемение, особенно в руках и ногах. Люди могут чувствовать ощущения надетых перчаток или чулков. Многие пациенты не различают по прикосновению размер предмета или его форму. Это повреждение сенсорных волокон может способствовать потере рефлексов (также как и при повреждении моторных нервов). Потеря проприорецепции (чувство положения тела в пространстве) усложняет возможность координировать сложные движения или устойчивость с закрытыми глазами. Невропатической болью трудно поддается лечению и может оказывать серьезное влияние на эмоциональное состояние и общее качество жизни. Невропатическая боль часто усиливается ночью, серьезно нарушая сон, что еще больше ведет к эмоциональному дискомфорту.
Меньшие сенсорные волокна без миелиновых оболочек передают боль и температурные ощущения. Повреждение этих волокон может нарушить в способность чувствовать боль или изменения в температуре. Люди могут быть не в состоянии ощутить ранение от пореза или нагноение раны. Другие пациенты, возможно, не чувствуют боли, которая является предупреждающим сигналом при угрожающим жизни сердечном приступе или других острых состояниях. Потеря ощущения боли — особенно серьёзная проблема у пациентов с диабетом, что способствует высокой частоте ампутаций нижней конечности среди этой группы населения. Болевые рецепторы в коже могут также стать сверхчувствительными, так, что пациенты чувствуют сильную боль (allodynia) от воздействий, которые обычно являются безболезненными (например, при проведении тканью по коже или легком касании).
Симптомы повреждения пучков вегетативных нервных волокон разнообразны и зависят от органа иннервируемого ими. Дисфункция вегетативных нервных волокон может быть опасной для жизни и иногда требует экстренной медицинской помощи, особенно когда нарушается дыхание или частота сердцебиения. Общие симптомы повреждения пучков вегетативных нервных волокон включают нарушение потоотделения, которое необходимо при перегревании, нарушение функции мочеотделения которое может привести к недержанию мочи или инфекции мочевого пузыря; и нарушение управления мышцами, отвечающими за сокращениями кровеносных сосудов, что может влиять на поддержание нормального артериального давления. Потеря контроля над кровяным давлением может вызвать головокружение, тошноту, или даже обморок, когда человек внезапно падает при перемене положения тела (состояние известное как постуральная или ортостатическая гипотензия).
Желудочно-кишечные симптомы часто сопровождают вегетативную невропатию. Нервы, управляющие сокращениями мышц кишечника работают со сбоями, приводя к диарее, запору. У многих пациентов возникают также проблемы, связанные с глотанием при повреждении соответствующих нервных волокон.
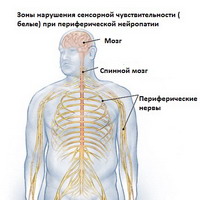
Травматическое повреждение является наиболее распространенной причиной повреждения нерва. Ранение или бытовая травма, от автокатастроф, падений, или связанных с занятиями спортом может привести к разволокнению нервов компрессии нервов растяжению или полному отрыву от спинного мозга. Даже не очень сильные травмы также могут вызвать серьезное повреждение нервов. Сломанные или вывихнувшиеся кости могут оказывать повреждающее давление на соседние нервы, и также при грыжах диска может возникать компрессия нервных корешков.
Системные заболевания — состояния, которые оказывают влияние на все тело и нередко вызывают периферическую невропатию. Эти состояния могут включать: метаболические и эндокринные нарушения. Ткани нерва очень чувствительности к изменениям метаболизма тканей процессам регенерации, которые могут изменяться при системных заболеваниях. Сахарный диабет, характеризующийся хронически высокими уровнями глюкозы в крови, является главной причиной периферической невропатии в некоторых странах (США). Приблизительно у 60 — 70% пациентов с диабетом имеются как умеренные, так и тяжелые формы повреждения нервной системы. Заболевания почек могут привести к избытку токсических веществ в крови, что может серьезно повреждать ткань нервов. У большинства пациентов, с необходимостью диализа из-за почечной недостаточности, развивается полинейропатия. Некоторые заболевания печени также приводит к невропатиям в результате нарушения обмена веществ.
Гормональные дисбалансы могут изменить нормальные метаболические процессы и вызвать невропатии. Например, недостаток гормонов щитовидной железы замедляет метаболизм, приводя к задержке жидкости и отеку тканей, которые могут оказывать давление на периферические нервы. Избыточная выработка соматотропина может привести к акромегалии, состояние, характеризующееся патологическим увеличением многих частей скелета, включая суставы. Нервы, снабжающие эти измененные суставы, часто тоже повреждаются.
Дефициты витамина и хронический алкоголизм могут вызвать необратимые повреждения тканей нерва. Витамины. Витамины Е, B1, B6, B12, и никотиновая кислота очень важны для нормальной функции нервов. Дефицит тиамина, в частности распространен у людей с хроническим алкоголизмом, потому что у этих людей нарушено поступление тиамина с пищей. Дефицит тиамина может вызвать достаточно болезненную невропатию конечностей. Некоторые исследователи полагают, что чрезмерное употребление алкоголя может, само по себе, способствовать непосредственному повреждению нервов, что называются алкогольной невропатией. Сосудистые заболевания и болезни крови могут уменьшить доставку кислорода к периферическим нервам и быстро привести к серьезному повреждению или гибели тканей нерва (к примеру, острая гипоксия мозга приводит к инсульту). Диабет часто приводит к сужению кровеносного сосуда. Различные формы васкулита часто приводят к утолщению стенки сосуда и уменьшения диаметра сосудов за счет рубцовой ткани. Эту категорию повреждения нервов, в котором повреждены изолированные нервы в различных областях, называют мультифокальная мононевропатией.
Заболевания соединительной ткани и хроническое воспаление могут вызвать прямое или косвенное повреждение нервов. Когда окружающие нервы слои тканей находятся в длительном воспалительном процессе, то воспаление может затронуть и непосредственно волокна нерва. Хроническое воспаление также приводит к прогрессивной деструкции соединительной ткани, подвергая волокна нерва, большему риску компрессии и инфицирования. Суставы при воспалении могут отекать и вовлекать нервы, причиняя боль.
Рак и доброкачественные опухоли могут прорастать и оказывать деструктивное действие на нервы. Опухоли также могут образоваться непосредственно из клеток ткани нерва. Достаточно нередко полинейропатия связана с нейрофиброматозом, генетическим заболеваниям, при котором происходит образование множественных доброкачественных опухолей из тканей нерва. Формирование невромы может быть одним элементом из регионального болевого синдрома или синдромом симпатической рефлекторной дистрофии, который может быть вызван травматическими причинами или хирургической травмой. Паранеопластический синдром, группа редких дегенеративных нарушений, которые вызваны реакцией иммунной системы человека на злокачественную опухоль, также может косвенно вызвать множественное повреждение нервов. Повторное стрессовое воздействие часто приводит к компрессионным невропатиям. Кумулятивное повреждение может появиться вследствие повторных чрезмерных движений, которые требуют сгибания любой группы суставов в течение длительного периода времени. В результате таких движений может возникнуть воспаление и отек сухожилия и мышц что может привести к сужению каналов через которые проходят некоторые нервы. Такие повреждения нередки во время беременности, вероятно, потому что увеличение веса и задержка жидкости также сужают каналы нервов.
Токсические вещества могут также вызвать повреждение периферических нервов. У люди, которые подверглись воздействию тяжелых металлов (мышьяк, свинец, ртуть, таллий), производственных токсинов, или экологических токсинов часто развиваются невропатии. У определенных препаратов для лечения от рака, противосудорожных препаратов, противовирусных средств, антибиотиков есть побочные эффекты, которые могут включать повреждение периферических нервов, что иногда является протипоказанием для их длительного применения.
Инфекции и аутоиммунные нарушения могут вызвать периферическую невропатию. Вирусы и бактерии, которые могут воздействовать на ткани нерва, включают опоясывающий лишай, вирус Эпштейн-Барра, вирус цитомегалии, и другие разновидности вирусов герпеса. Эти вирусы избирательно повреждают сенсорные нервы, вызывая приступообразные острые боли. Постгерпетическая невралгия часто встречается после эпизода опоясывающего лишая и может быть очень болезненной.
Вирус иммунодефицита человека (ВИЧ), также вызывает значительное повреждение в центральной и периферической нервной системе. Вирус может вызвать несколько различных форм невропатии, каждая из которых четко связана с определенной стадией иммунодефицита. Быстро прогрессирующая, болезненная полинейропатия, с вовлечением рук и ног, часто является первым клиническим симптомом ВИЧ-инфекции.
Болезнь Лайма, дифтерия, и лепра — бактериальные заболевания, характеризующиеся обширным повреждением периферических нервов. Дифтерия и лепра теперь встречаются достаточно редко, но болезнь Лайма стала встречаться чаще. Болезнь Лайма может вызвать широкий диапазон невропатических нарушений, включая быстрое развитие, болезненной полиневропатии, часто в течение нескольких недель после начального инфицирования во время укуса клеща.
Вирусные и бактериальные инфекции могут также вызвать вторичное повреждение нервов, способствую возникновению вызывая аутоиммунных нарушений, при которых происходит агрессия иммунной системы против собственных тканей. Аутоиммунные процессы, как правило, вызывают деструкцию миелиновых оболочек нервов или аксонов (волокон нерва).
Некоторые невропатии вызваны воспалением, следующим из реакции иммунной системы, а не от прямого повреждения инфекционными агентами. Воспалительные невропатии могут развиваться быстро или медленно, и хронические формы могут иметь периоды как ремиссии, так и рецидива. Острая воспалительная демиелинизирующая полинейропатия, известная как синдром Гийена-Барре, может повредить моторные, сенсорные волокна, и пучки вегетативных нервных волокон. Большинство людей выздоравливает после развития от этого синдрома, но иногда бывают тяжелые формы представляющие угрозу для жизни, хотя тяжелые случаи могут быть опасными для жизни. Мультифокальная моторная невропатия — форма воспалительной невропатии, которая проявляется повреждение исключительно моторных нейронов (может быть как острой, так и хронической).
Наследственные формы периферической невропатии вызваны врожденными сбоями в генетическом коде или мутациями. Некоторые генетические аномалии приводят к умеренным невропатиям с симптомами, которые начинаются в подростков возрасте и потом со временем симптоматика нивелируется. Более тяжелые наследственные невропатии часто появляются в грудном возрасте или в детстве. Наиболее распространенной наследственной невропатией является болезнь Шарот — Мари — Тусс. Эти невропатии возникают из-за нарушения в генах, ответственных за формирование нейронов или миелиновое оболочек. Признаки типичной болезни Шарлот_Мари-Тусс включают чрезвычайное ослабление мышц голени и стопы расстройства походки исчезновения сухожильных рефлексов и онемение в нижних конечностях.
Диагностика
Диагностирование периферической невропатии подчас бывает трудным, в связи с вариабельностью симптомов. Нередко требуется полное неврологическое обследование, включая: симптомы пациента, профессию, социальные привычки, наличие любых токсинов, наличие хронического алкоголизма, возможность наличия ВИЧ или другой инфекционной болезни, и наличие в анамнезе родственников с невропатией, проведение анализов, которые могут идентифицировать причину невропатии, и проведение обследований позволяющих определить степень и тип повреждения нервов.
Общее обследование тесты и анализы могут выявить наличие повреждения нервов вследствие системного заболевания. Анализы крови могут диагностировать диабет, дефицит витаминов, печеночную или почечную недостаточность, другие нарушения обмена веществ, и признаки патологической активности иммунной системы. Экспертиза цереброспинальной жидкости, которая циркулирует в головном и спинном мозге, может выявить патологические антитела, связанные с невропатией. Более узкоспециализированные анализы могут выявить болезни крови или сердечнососудистые заболевания, заболевания соединительных тканей, или злокачественные образования. Тесты на мышечную силу выявление признаком судорожной активности мышц или фасцикуляций могут указывать на повреждение моторных нейронов. Оценка способности пациента восприятия вибрации, мягкого прикосновения, положение тела (проприорецепция), температурную и болевую чувствительность помогает определить повреждение сенсорных волокон как больших, так и малых сенсорных волокон. На основе результатов неврологического осмотра, физического осмотра, подробной истории заболевания может быть назначены дополнительные тесты и обследования для уточнения диагноза.
Компьютерная томография, является атравматичным, безболезненным исследованием, которое дает возможность визуализировать органы костные мягкие ткани. Компьютерной томографии может выявить костные или сосудистые изменения опухоли головного мозга кисты грыжи межпозвоночного диска, энцефалит, спинальный стеноз (сужение спинномозгового канала), и другие нарушения.
Магнитно-резонансная томография (ЯМР или МРТ) может исследовать состояние мышцы ее размер, выявить замену ткани мышцы жировой тканью, и определить, было ли компрессионное воздействие на нервное волокно. Аппараты МРТ создают сильное магнитное поле вокруг тела. Радиоволны проходят через тело и вызывают резонанс, который может быть фиксирован под различными углами в пределах тела. Компьютер обрабатывает этот резонансный эффект и преобразует в трехмерное изображение.
Электромиография (ЭМГ) представляет собой введение тонкой иглы в мышцу для измерения электрической активности мышцы в покое и при сокращении. Анализы ЭМГ могут помочь дифференцировать повреждение самой мышцы и нервных волокон. Скорость проведения импульса по нерву может точно определить степень повреждения в больших нервных волокнах, четко указывая связаны симптомы с дегенерацией миелиновой оболочки или аксона. Во время этого исследование производится электрическая стимуляция волокна, в ответ на которое в нерве возникает ответный импульс. Электрод, помещенный дальше по ходу нерва, измеряет скорость передачи импульса вдоль аксона. Медленная скорость передачи и блокировка импульса, как правило, указывают на повреждение миелиновой оболочки, в то время как снижение уровня импульсов — признак аксональной дегенерации.
Биопсия нерва представляет собой удаление и исследование образца ткани нерва, чаще всего в голени. Хотя этот анализ может давать ценную информацию о степени повреждения нервов, это — инвазивная процедура, достаточно трудная в выполнение и сама вызывающая повреждение нерва и появление признаков невропатии. В большинстве случае эта процедура не показана для диагностики и может самостоятельно вызвать нейропатические побочные эффекты.
Биопсия кожи — анализ, при котором удаляют маленький кусочек кожи и исследуют окончания нервных волокон. Этот метод диагностики имеет преимущества перед ЭМГ и биопсией нерва, когда необходимо диагностировать повреждение в меньших сенсорных волокнах. Кроме того в отличие от обычной биопсии нерва, биопсия кожи менее инвазивна, имеет меньше побочных эффектов, и легче выполняется.
Лечение
Методов лечения наследственных периферических невропатий не существует. Однако есть методы лечения для многих других форм. Вначале проводится лечение причины заболевания и проводится симптоматическое лечение. У периферических нервов есть способность регенерировать, в том случае если сохранена сама нервная клетка. Симптоматику можно нивелировать, и устранение причин определенных форм невропатии часто может предотвратить повторное повреждение.
В общем, если вести здоровый образ жизни — как поддержание оптимального веса, исключение попадание токсинов в организм, правильное питание с наличием достаточного количества витаминов ограничение или исключение приема алкоголя — могут уменьшить физические и эмоциональные эффекты периферической невропатии. Активные и пассивные физические нагрузки могут уменьшить судороги, улучшить эластичность и силу мышц, и предотвратить атрофию мышц в парализованных конечностях. Различные диеты могут улучшить желудочно-кишечные симптомы. Своевременное лечение при травмах может помочь предотвратить необратимые изменения. Бросание курение особенно важно, потому что при курении происходит спазм кровеносных сосудов, которые доставляют питательные вещества в периферические нервы и могут ухудшить симптомы невропатии. Навыки хорошего ухода, такие как тщательный уход, за ногами и ранами при диабете необходимы, потому что у этих пациентов снижена болевая чувствительность. Хороший уход позволяет облегчить симптомы и улучшить качество жизни и стимулировать регенерацию нерва.
Системные заболевания часто требуют более комплексного лечения. Строгий контроль над уровнем глюкозы в крови, как показали исследования, уменьшает нейропатические симптомы и помогает пациентам с диабетической невропатией избежать дальнейшего повреждения нервов. Воспалительные и аутоиммунные заболевания, приводящие к невропатии, можно лечить несколькими способами. Иммунодепрессанты, такие как преднизон, циклоспорин, или имуран могут быть очень эффективными. Процедура плазмофереза, при которой происходит очистка крови от иммунных клеток и антител, может уменьшить воспаление или подавить активность иммунной системы. Большие дозы иммуноглобулинов, которые функционируют как антитела, также могут подавить патологическую активность иммунной системы. Но невропатическая боль трудно поддается лечению. Умеренная боль может иногда облегчаться анальгезирующими средствами. Некоторые препараты (применяемые для лечения других заболеваний) оказались полезными для многих пациентов, страдающих от тяжелых форм хронической невропатической боли. Они включают Мексилитин, лекарство, созданное для лечения нарушения сердечного ритма (но иногда вызывающее выраженные побочные действия); некоторые противоэпилептические средства, включая габапентин, фенитоин, и карбамазепин; и некоторые виды антидепрессантов, включая трициклические, такие как амитриптилин. Инъекции местных анестетиков, таких как лидокаин или использование пластырей, содержащие лидокаин, могут облегчить сильную боль. В самых тяжелых случаях болей можно хирургически разрушить нервы; однако, результаты являются подчас временными, и процедура может привести к осложнениям.
Ортопедические изделия могут помочь уменьшить боль и уменьшить воздействие физической инвалидности. Различные ортезы для руки или ноги могут компенсировать слабость мышцы или уменьшить компрессию нерва. Ортопедическая обувь может улучшить нарушения походки, и помочь предотвратить травмы стопы у людей со снижением восприятия боли.
Хирургическое вмешательство часто может обеспечить непосредственное облегчение при мононейропатиях, вызванных ущемлением нерва или компрессией. Удаление грыжи диска вызывает декомпрессию корешка. При удалении опухолей тоже уменьшается воздействие опухолевой ткани на нервы. Кроме того, декомпрессия нерва может быть достигнута с помощью релизинга связок и сухожилий.
Периферическая нервная система соединяет центральную нервную систему с органами и конечностями. В отличие от центральной нервной системы, периферическая нервная система не защищена костями и не имеет физиологического барьера, отделяющего ее от кровеносной системы. В силу сказанного, периферическая нервная система может быть подвержена механическим повреждениям, на нее легче оказывают действие токсины.
Болезни периферических нервов – это невропатии. Они характеризуются поражением аксонов и миелиновой оболочки нервов. Заболевания нервных стволов и сплетений по распространенности среди населения занимают 2-е место после заболеваний спиномозговых корешков («радикулита»). Поэтому вопросы профилактики, ранней диагностики и последующего лечения невропатий остаются актуальными проблемами.
Типы
- Демиелинизирующие. Нарушается проводимость возбуждения по нейронам. Встречаются при отравлениях свинцом, дифтерии, полирадикулоневропатии, полиневропатии диабетического характера. Восстановление здоровья пациента происходит в течение нескольких недель, если лечение начато своевременно.
- Аксонопатии. В данном случае повреждения касаются аксонов (отростков нервных клеток) – это тяжелые нарушения функций нервов. Как следствие наступает атрофия мышц. Причиной возникновения этих нарушений являются злоупотребление алкоголем и другими токсическими веществами.
Чаще всего встречаются невропатии смешанного генеза. Полное выздоровление и восстановление работы нервов зависит частично от тяжести повреждений.
Если процесс восстановления отсутствует 3 месяца после начала заболевания, то прогноз, чаще всего, неблагоприятный.
Виды невропатии
- Мононевропатии. Травмируется один нерв или определенная часть нервного сплетения. Причинами повреждения могут являться травма, сдавление любых уровней нервного ствола. Также мононевропатии наблюдаются при сахарном диабете, атеросклерозе, поражении сосудов и др. Переохлаждения и герпетические инфекции занимают не последнее место в нарушениях работы одного нерва.
- Многоочаговые невропатии – это синдром частичного поражения отдельных нервных стволов или полное их повреждение. Протекают такие невропатии медленно и последовательно (от нескольких дней до нескольких лет). Причины возникновения: артриты, васкулиты и ряд системных заболеваний соединительной ткани.
- Полиневропатии. Поражения периферических нервов носит множественный характер. При этом процесс распространенный и симметричный. Протекает как остро, так и хронически. Бывает, что поражаются и спинномозговые корешки.
Причинами возникновения заболеваний периферических нервных стволов и сплетений могут быть:
- полученные травмы
- снижение нормальной функции иммунной системы
- наследственные заболевания
- интоксикации разными веществами
- инфекции
- нехватка витаминов
- привычные интоксикации (наркомания и алкоголизм)
- аллергии
Симптомы
При невропатиях симптомы могут быть разными и зависят от зон поражения. Пациенту они доставляют массу неприятных ощущений:
- вялый паралич мышц
- боль в конечностях
- изменение чувствительности кожи (может быть контраст ощущений на одном участке кожи по сравнению с другим)
- отсутствие ощущений боли и не только
- атрофия мышц
- нарушение речи
- чувство онемения лица, конечностей
- мышечная слабость конечностей
- нарушение координации движений
- сухость кожи
- очаговое побледнение
- покраснение и посинение травмированного участка
- может встречаться асимметрия лица (при повреждении лицевых нервов)
Если Вы обнаружили у себя хотя бы один из описанных симптомов, Вам надлежит незамедлительно обратиться за помощью к квалифицированному врачу невропатологу.
Диагностика
Диагностику проводит опытный врач невропатолог. В ходе первичного осмотра он:
- внимательно выслушает жалобы
- соберет полный анамнез (жизни и заболевания)
- проведет осмотр, в т.ч. проверит сохранности рефлексов и уточнит зоны поражения нервов
- при необходимости врач назначит другие виды диагностических исследований
От точности постановки диагноза будет зависеть успешность дальнейшего лечения.
Лечение
В нашей клинике при лечении невропатий используют методы традиционной и нетрадиционной медицины. Комплексное лечение подбирается только индивидуально и полностью зависит от степени поражения нерва(ов).
Первоначальное лечение будет направлено на восстановление функций периферических нервов, следовательно, будет устраняться причина.
В лечении невропатий важен комплексный подход! Наши специалисты учтут все нюансы повреждения и могут назначить:
- лекарственные препараты, улучшающие обмен, кровообращение и восстановительные процессы в нервной ткани. Медикаменты могут применяться и в инъекционной форме, в том числе внутривенно капельно в условиях уютного дневного стационара
- гормональные препараты (стероиды) — в отдельных случаях
- лечебные медикаментозные блокады
- отдельные виды физиотерапевтического лечения
- мануальная терапия (остеопатия)
- классический массаж
Прогноз
Лечение заболеваний периферических нервных стволов и сплетений может длиться достаточно долго, и не всегда результат бывает положительным.
Успешность результата во многом зависит от того, насколько своевременно пациент обратился за врачебной помощью. Чем раньше начнется лечение, тем более благоприятный прогноз можно сделать.
При подозрении на заболевание нервной системы не затягивайте с визитом к врачу неврологу!
Рекомендации и профилактика
Главная профилактика большинства заболеваний нервной системы — это ведение здорового и активного образа жизни, отказ от вредных привычек, своевременное и адекватное лечение инфекционных и неинфекционных заболеваний.
При возникновении каких-либо неврологических симптомов не стоит откладывать обращение к врачу. Ранняя диагностика и своевременное лечение поможет не допустить развития осложнений, удлинения сроков лечения и последствий бесконтрольного приема лекарственных препаратов. Наиболее полную программу профилактических мер составляет врач невролог для каждого конкретного пациента.
Часто задаваемые вопросы
Немеют и болят три пальца на правой руке. Что делать?
Необходимо обратится к врачу неврологу для исключения синдрома «запястного канала» и лечения.
Давно был приступ невралгии тройничного нерва. Надо ли мне принимать что-то для профилактики, чтобы не было еще одного?
Нужно обязательно наблюдаться у врача невролога. Врач подберет Вам препараты, которые необходимо принимать постоянно и назначит профилактические курсы инъекций (при необходимости — капельных в условиях дневного стационара) и таблетированных препаратов.
Появились сильные жгучие боли в правой половине грудной клетки и появились какие-то пузырьки. К какому врачу мне надо обратиться?
Сходные проявления, как Вы описываете, могут наблюдаться при герпетическом ганглионеврите, т.н. опоясывающем лишае. Это заболевание лечится врачом неврологом.
Около 2 месяцев стали неметь и ослабли ноги. Отчего это может быть?
Слабость и нарушения чувствительности в конечностях могут наблюдаться при полиневропатиях различной природы. Например, в результате сахарного диабета или интоксикаций. Для установления причины и подбора адекватной терапии необходимо обратиться к врачу неврологу. Возможно, есть необходимость в дополнительных лабораторных и инструментальных обследованиях.
У меня появилась слабость в правой руке после сна. Это от позвоночника?
Причиной внезапной слабости в руке могут быть и заболевания позвоночника. Однако, нельзя исключить сосудистую причину или сдавление нервного ствола (нервного сплетения). Для выяснения причины и для назначения лечения Вам следует обратиться к врачу-неврологу.
Можно ли вылечить алкогольную невропатию?
Токсические и дисметаболические полинейропатии, в т.ч. алкогольные являются, чаще всего, хроническими заболеваниями. На фоне адекватной терапии возможно достижение длительной и стойкой ремиссии
Истории лечения
Случай №1
Пациентка Ю. 40 лет, обратила внимание внезапно возникшую ассиметрию лица, слезотечение из правого глаза и не полное смыкание его век. Обратилась к неврологу в Клинику ЭКСПЕРТ. Пациентке был диагносцирован острый неврит лицевого нерва и назначено лечение и обследование.
Пациентка прошла курс внутримышечных и внутривенных капельных инъекций в дневном стационаре Клиники ЭКСПЕРТ, курсы лечебной физкультуры и точечного самомассажа. Движения в мимической мускулатуре полностью восстановились.
При обследовании онкологическая природа заболевания была исключена, но была выявлен герпетический ее характер на фоне вторичного иммунодефицитного состояния. После консультации врача-иммунолога пациентке Ю. Был назначен курс иммуномодулирующей терапии.