Краткое описание:
Библиографическая ссылка для цитирования: Сазонов В.Ф. 2_3 Потенциал действия и нервный импульс [Электронный ресурс] // Кинезиолог, 2009-2021: [сайт]. Дата обновления: 21.12.2021. URL: http://kineziolog.su/content/23-potentsial-deistviya-i-nervnyi-impuls (дата обращения: __.__.20__).
__________________Понятие потенциала действия и нервного импульса. Описание графика потенциала действия и механизмов нервного импульса. «Нервный импульс — это волна изменений, движущаяся по мембране нейрона». © 2012-2021 Сазонов В.Ф. © 2012-2021 kineziolog.su
Нервный импульс
Разбираясь в нервных импульсах, мы будем иметь в виду нервное возбуждение, бегущее (=распространяющееся) по мебране нейрона. Строго говоря, движущееся по нейронам и нервам возбуждение представляет собой нервные импульсы, а не потенциалы действия, хотя в физиологической литературе два этих понятия обычно используют как синонимы.
Для того чтобы произвести нервный импульс, нейрон сначала должен создать состояние готовности (потенциал покоя), затем предготовности (локальный потенциал), и, наконец, при достижении порогового уровня локального потенциала (критического уровня деполяризации) — породить бегущий по мембране нервный импульс.
Нервный импульс — это движущаяся волна изменений в состоянии мембраны. Волна включает в себя три вида изменений: структурные (открытие и закрытие мембранных ионных каналов); химические (трансмембранные потоки ионов); электрические (изменения электрического потенциала мембраны) Электрических изменений тоже три: деполяризация, позитивная поляризация (=инверсия, =овершут) и реполяризация. Электрические изменения (проявления) в состоянии мембраны — это потенциал действия. © 2012-2021 Сазонов В.Ф. © 2012-2021 kineziolog.su
Можно сказать короче:
«Нервный импульс — это волна изменений, движущаяся по мембране нейрона». © 2012-2021 Сазонов В.Ф. © 2012-2021 kineziolog.su
Но в физиологической литературе в качестве синонима для нервного импульса принято использовать также и термин «потенциал действия». Хотя потенциал действия — это только электрический компонент нервного импульса.
Потенциал действия – это резкое скачкообразное изменение мембранного потенциала с отрицательного на положительный и обратно.
Сравним два понятия: «нервный импульс» и «потенциал действия».
Нервный импульс — это сложный структурно-электро-химический процесс, распространяющийся по мембране нейрона в виде бегущей волны изменений.
Потенциал действия — это только электрический компонент нервного импульса, характеризующий изменения электрического потенциала на локальном участке мембраны во время прохождения через него нервного импульса. Потенциал мембраны при этом изменяется от -70 до +30 мВ и обратно до -70 мВ — это и есть потенциал действия. (Кликните на изображение слева, чтобы увидеть анимацию.)
Сравните два приведённых выше рисунка (покликайте по ним) и, как говорится, почувствуйте разницу!
Где рождаются нервные импульсы?
Как ни странно, не все студенты, изучившие физиологию возбуждения, могут ответить на этот вопрос. ((
Хотя ответ не сложен. Нервные импульсы рождаются на нейронах всего в нескольких местах:
1) аксонный холмик (это переход тела нейрона в аксон),
2) рецепторное окончание дендрита,
3) первый перехват Ранвье на дендрите (триггерная зона дендрита),
4) постсинаптическая мембрана возбуждающего синапса.
Места возникновения нервных импульсов:
1. Аксонный холмик — главный породитель нервных импульсов
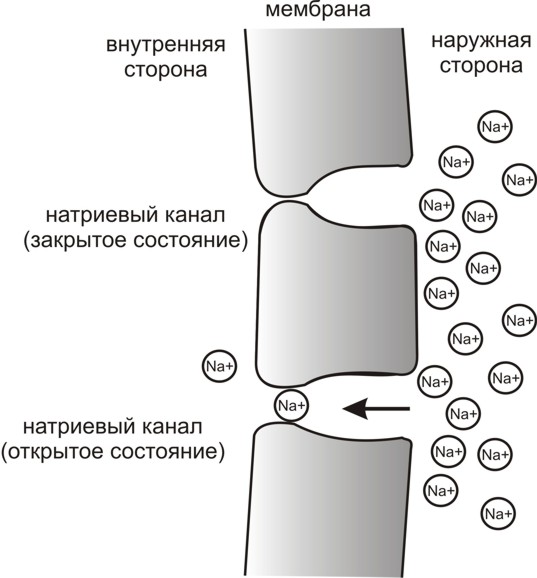
Аксонный холмик — это самое начало аксона, там где он начинается на теле нейрона. Именно аксонный холмик является главным породителем (генератором) нервных импульсов на нейроне. Во всех остальных местах вероятность рождения нервного импульса намного меньше. Дело в том, что у мембраны аксонного холмика повышена чувствительность к возбуждению и понижен критический уровень деполяризации (КУД) по сравнению с остальными участками мембраны. Поэтому, когда на мембране нейрона начинают суммироваться многочисленные возбуждающие постсинаптические потенциалы (ВПСП), которые возникают в самых разных местах на постсинаптических мембранах всех его синаптических контактов, то раньше всего КУД достигается именно на аксонном холмике. Там-то эта сверхпороговая для холмика деполяризация и открывает потенциал-чувствительные натриевые каналы, в которые входит поток ионов натрия, порождающий потенциал действия и нервный импульс.
Итак, аксонный холмик является интегративной зоной на мембране, он интегрирует все возникающие на нейроне локальные потенциалы (возбуждающие и тормозные) — и первый срабатывает на достижение КУД, порождая нервный импульс.
Важно также учесть следующий факт. От аксонного холмика нервный импульс разбегается по всей мембране своего нейрона: как по аксону к пресинаптическоим окончаниям, так и по дендритам к постсинаптическим «начинаниям». Все локальные потенциалы при этом снимаются с мембраны нейрона и со всех его синапсов, т.к. они «перебиваются» потенциалом действия от пробегающего по всей мембране нервного импульса.
2. Рецепторное окончание чувствительного (афферентного) нейрона
Если нейрон имеет рецепторное окончание, то на него может воздействовать адекватный раздражитель и порождать на этом окончании сначала рецепторный потенциал, затем генераторный потенциал, а потом и нервный импульс. Когда генераторный потенциал достигает КУД, то на этом окончании открываются потенциал-зависимые натриевые ионные каналы и рождается потенциал действия и нервный импульс. Нервный импульс бежит по дендриту к телу нейрона, а затем по его аксону к пресинаптическим окончаниям для передачи возбуждения на следующий нейрон. Так работают, к примеру, болевые рецепторы (ноцицепторы), являющиеся дендритными окончаниями болевых нейронов. Нервные импульсы в болевых нейронах вознимают именно на рецепторных окончаниях дендритов.
3. Первый перехват Ранвье на дендрите (триггерная зона дендрита)
Локальные возбуждающие постсинаптические потенциалы (ВПСП) на окончаниях дендрита, которые формируются в ответ на возбуждения, приходящие к дендриту через синапсы, суммируются на первом перехвате Ранвье этого дендрита, если он, конечно, миелинизирован. Там находится участок мембраны с повышенной чувствительностью к возбуждению (пониженным порогом), поэтому именно в этом участке легче всего преодолевается критический уровень деполяризации (КУД), после чего открываются потенциал-управляемые ионные каналы для натрия — и возникает потенциал действия (нервный импульс).
4. Постсинаптическая мембрана возбуждающего синапса
В редких случаях ВПСП на возбуждающем синапсе может быть настолько силён, что прямо там же достигает КУД и порождает нервный импульс. Но чаще это бывает возможно только в результате суммации нескольких ВПСП: или с нескольких соседних синапсов, сработавших одновременно (пространственная суммация), или за счёт того, что на данный синапс пришло несколько импульсов подряд (временная суммация).
Видео: Проведение нервного импульса по нервному волокну
Потенциал действия как нервный импульс
Ниже размещён материал, взятый из учебно-методического пособия автора данного сайта, на который вполне можно ссылаться в своём списке литературы:
Сазонов В.Ф. Понятие и виды торможения в физиологии центральной нервной системы: Учебно-методическое пособие. Ч. 1. Рязань: РГПУ, 2004. 80 с.
Все процессы мембранных изменений, происходящих в ходе распространяющегося возбуждения, достаточно хорошо изучены и описаны в научной и учебной литературе. Но не всегда это описание легко понять, поскольку в данном процессе задействовано слишком много компонентов (с точки зрения обычного студента, а не вундеркинда, конечно).
Для облегчения понимания мы предлагаем рассматривать единый электрохимический процесс распространяющегося динамичного возбуждения с трёх сторон, на трёх уровнях:
-
Электрические явления – развитие потенциала действия.
-
Химические явления – движение ионных потоков.
-
Структурные явления – поведение ионных каналов.
Три стороны процесса распространяющегося возбуждения
1. Потенциал действия (ПД)
Потенциал действия – это скачкообразное изменение постоянного мембранного потенциала с отрицательной поляризации на положительную и обратно.
Обычно мембранный потенциал в нейронах ЦНС изменяется от –70 мВ до +30 мВ, а затем вновь возвращается к исходному состоянию, т.е. к –70 мВ. Как видим, понятие потенциала действия характеризуется через электрические явления на мембране.
На электрическом уровне изменения начинаются как смена поляризованного состояния мембраны на деполяризацию, что означает уменьшение электроотрицательности на внутренней стороне мембраны. Сначала деполяризация иёет в виде локального возбуждающего потенциала. Вплоть до критического уровня деполяризации (примерно –50 мВ) это относительно простое линейное уменьшение электроотрицательности, пропорциональное силе воздействующего раздражителя. А вот потом начинается более крутая самоусиливающаяся деполяризация, она развивается не с постоянной скоростью, а с ускорением. Говоря образно, деполяризация так разгоняется, что в разгону перескакивает через нулевую отметку, не заметив этого, и даже переходит в положительную поляризацию. После достижения пика (обычно +30 мВ) начинается обратный процесс – реполяризация, т.е. восстановление отрицательной поляризации мембраны.
Кратко опишем электрические явления во время течения потенциала действия:
Восходящая ветвь графика:
-
Потенциал покоя – исходное обычное поляризованное электроотрицательное состояние мембраны (–70 мВ).
-
Нарастающий локальный потенциал – пропорциональная раздражителю деполяризация в интервале от –70 мВ до –50 мВ.
-
Критический уровень деполяризации (–50 мВ) запускает резкое ускорение деполяризации за счёт самораскрытия нового вида натриевых каналов (потенциал-управляемых), с этой точки начинается спайк – высокоамплитудная часть потенциала действия.
-
Самоусиливающаяся круто нарастающая деполяризация за счёт автоматического самораскрытия потенциал-управляемых натриевых каналов.
-
Переход нулевой отметки (0 мВ) – смена полярности мембраны. Но новых процессов это событие не вызывает.
-
«Овершут» – положительная поляризация (=инверсия, или =реверсия потенциала мембраны). Электроотрицательность переходит в электроположительность.
-
Пик (+30 мВ) – вершина процесса изменения полярности мембраны, вершина потенциала действия. Открытые потенциал-управляемые натриевые каналы к этому моменту самостоятельно автоматически закрываются изнутри специальными белковыми «пробками», и поступление положительно заряженных ионов натрия в клетку прекращается. Поэтому прекращается нарастание потенциала действия.
Нисходящая ветвь графика:
-
Реполяризация – восстановление прежней исходной электроотрицательности мембраны. Потенциал от +30 мВ опускается вниз. Это происходит благодаря утечке ионов калия из клетки через множество открытых калиевых каналов. Эти ионы выходят из клетки под действием химической силы, из-за разности их концентрации внутри и снаружи клетки. Внутри их много, а снаружи мало, вот они и перемещаются туда, где их мало.
-
Переход нулевой отметки (0 мВ) – обратная смена полярности мембраны на прежнюю, отрицательную. Но ничего принципиально нового здесь не происходит. Разве что с этого момента начинает действовать электрическая сила, затягивающая положительные ионы внутрь клетки и удерживающая те из них, которые уже находятся в клетке. Ионам калия с этого момента становится всё труднее выходить из клетки.
-
Переход критического уровня деполяризации (–50 мВ) – прекращение фазы относительной рефрактерности (невозбудимости) и возврат возбудимости нейрона.
-
Следовые процессы (следовая деполяризация или следовая гиперполяризация).
-
Восстановление потенциала покоя – возврат мембраны к своему нормальному состоянию: –70 мВ.
Итак, сначала – деполяризация, затем – реполяризация. Сначала – утрата электроотрицательности, затем – восстановление электроотрицательности.
2. Ионные потоки
Образно можно сказать, что заряженные ионы – это и есть создатели электрических потенциалов в нервных клетках. Для многих людей звучит странно утверждение, что вода не проводит электрический ток. Но на самом деле это так. Сама по себе вода является диэлектриком, а не проводником. В воде электрический ток обеспечивают не электроны, как в металлических проводах, а заряженные ионы: положительные катионы и отрицательные анионы. В живых клетках основную «электрическую работу» выполняют катионы, так как они более подвижны. Электрические токи в клетках – это потоки ионов.
Итак, важно осознать, что все электрические токи, которые идут через мембрану, являются ионными потоками. Привычного нам из физики тока в виде потока электронов в клетках, как в водных системах, просто нет. Ссылки на потоки электронов будут ошибкой.
На химическом уровне мы, описывая распространяющееся возбуждение, должны рассмотреть, как изменяются характеристики ионных потоков, идущих через мембрану. Главное в этом процессе то, что при деполяризации резко усиливается поток ионов натрия внутрь клетки, а затем он внезапно прекращается на спайке потенциала действия. Входящий поток натрия как раз и вызывает деполяризацию, так как ионы натрия приносят с собой положительные заряды в клетку (чем и снижают электроотрицательность). Затем, после спайка, значительно нарастает выходящий наружу поток ионов калия, что вызывает реполяризацию. Ведь калий, как мы неоднократно говорили, выносит с собой из клетки положительные заряды. Отрицательные заряды остаются внутри клетки в большинстве, и за счет этого усиливается электроотрицательность. Это и есть восстановление поляризации за счет выходящего потока ионов калия. Заметим, что выходящий поток ионов калия возникает практически одновременно с появлением натриевого потока, но нарастает медленно и длится в 10 раз дольше. Несмотря на продолжительность калиевого потока самих ионов расходуется немного – всего одна миллионная доля от запаса калия в клетке (0,000001 часть).
Подведем итоги. Восходящая ветвь графика потенциала действия образуется за счет входа в клетку ионов натрия, а нисходящая – за счет выхода из клетки ионов калия.
3. Ионные каналы
Все три стороны процесса возбуждения – электрическая, химическая и структурная – необходимы для понимания его сущности. Но все-таки все начинается с работы ионных каналов. Именно состояние ионных каналов предопределяет поведение ионов, а поведение ионов в свою очередь сопровождается электрическими явлениями. Начинают процесс возбуждения натриевые каналы.
На молекулярно-структурном уровне происходит открытие мембранных натриевых каналов. Сначала этот процесс идет пропорционально силе внешнего воздействия, а затем становится просто «неудержимым» и массовым. Открытие каналов обеспечивает вход натрия в клетку и вызывает деполяризацию. Затем, примерно через 2-5 миллисекунд, происходит их автоматическое закрытие. Это закрытие каналов резко обрывает движение ионов натрия внутрь клетки, и, следовательно, обрывает нарастание электрического потенциала. Рост потенциала прекращается, и на графике мы видим спайк. Это вершина кривой на графике, дальше процесс пойдет уже в обратном направлении. Конечно, очень интересно разобраться в том, что натриевые каналы имеют двое ворот, и открываются они активационными воротами, а закрываются инактивационными, но это следует обсуждать ранее, в теме «Возбуждение». Мы на этом останавливаться не будем.
Параллельно в открытием натриевых каналов с небольшим отставанием во времени идет нарастающее открытие калиевых каналов. Они медлительные по сравнению с натриевыми. Открытие дополнительных калиевых каналов усиливает выход положительных ионов калия из клетки. Выход калия противодействует «натриевой» деполяризации и вызывает восстановление полярности (восстановление электроотрицательности). Но натриевые каналы опережают калиевые, они срабатывают примерно в 10 раз быстрее. Поэтому входящий поток положительных ионов натрия в клетку опережает компенсирующий выход ионов калия. И поэтому деполяризация развивается опережающими темпами по сравнению с противодействующей ей поляризацией, вызванной утечкой ионов калия. Вот почему, пока натриевые каналы не закроются, восстановление поляризации не начнется.
Пожар как метафора распространяющегося возбуждения
Для того чтобы перейти к пониманию смысла динамичного процесса возбуждения, т.е. к пониманию его распространения вдоль мембраны, надо представить себе, что описанные нами выше процессы захватывают сначала ближайшие, а затем все новые, все более и более отдаленные участки мембраны, пока не пробегут по всей мембране полностью. Если вы видели «живую волну», которую устраивают болельщики на стадионе за счет вставания и приседания, то вам легко будет представить себе мембранную волну возбуждения, которая образуется за счет последовательного протекания в соседних участках трансмембранных ионных токов.
Когда мы искали образный пример, аналогию или метафору, которая может наглядно передать смысл распространяющегося возбуждения, то остановились на образе пожара. Действительно, распространяющееся возбуждение похоже на лесной пожар, когда горящие деревья остаются на месте, а фронт огня распространяется и уходит все дальше и дальше во все стороны от очага возгорания.
Как же в этой метафоре будет выглядеть явление торможения?
Ответ очевиден – торможение будет выглядеть как тушение пожара, как уменьшение горения и затухание огня. Но если огонь распространяется сам по себе, то тушение требует усилий. Из потушенного участка процесс тушения сам по себе не пойдет во все стороны.
Существует три варианта борьбы с пожаром: (1) либо надо ждать, когда все сгорит и огонь истощит все горючие запасы, (2) либо надо поливать водой горящие участки, чтобы они погасли, (3) либо надо поливать заранее ближайшие нетронутые огнем участки, чтобы они не загорелись.
Можно ли «погасить» волну распространяющегося возбуждения?
Вряд ли нервная клетка способна «погасить» этот начавшийся «пожар» возбуждения. Поэтому первый способ подходит только для искусственного вмешательства в работу нейронов (например, в лечебных целях). Но вот «залить водичкой» некоторые участки и поставить блок распространению возбуждения, оказывается, вполне возможно.
© Сазонов В.Ф. Понятие и виды торможения в физиологии центральной нервной системы: Учебно-методическое пособие. Ч. 1. Рязань: РГПУ, 2004. 80 с.
АВТОВОЛНЫ В АКТИВНО-ВОЗБУДИМЫХ СРЕДАХ (АВС)
При распространении волны в активно-возбудимых средах не происходит переноса энергии. Энергия не переносится, а освобождается, когда до участка АВС доходит возбуждение. Можно провести аналогию с серией взрывов зарядов, заложенных на некотором расстоянии друг от друга (например, при тушении лесных пожаров, строительстве, мелиоративных работах), когда взрыв одного заряда вызывает взрыв рядом расположенного и так далее. Лесной пожар также является примером распространения волны в активно- возбудимой среде. Пламя распространяется по области с распределенными запасами энергии — деревья, валежник, сухой мох.
Основные свойства волн, распространяющихся в активно-возбудимых средах (АВС)
Волна возбуждения распространяется в АВС без затухания; прохождение волны возбуждения связано с рефрактерностью — невозбудимостью среды в течение некоторого промежутка времени (периода рефрактерности).
Источник: Антонов В.Ф., 1996.
Смотрите также: Потенциал действия мотонейрона
Видео: Потенциал действия (Action potential)
© 2012-2019 Сазонов В.Ф. © 2016-2019 kineziolog.su.
Потенциал покоя и потенциал действия
Автор статьи Зыбина А.М.
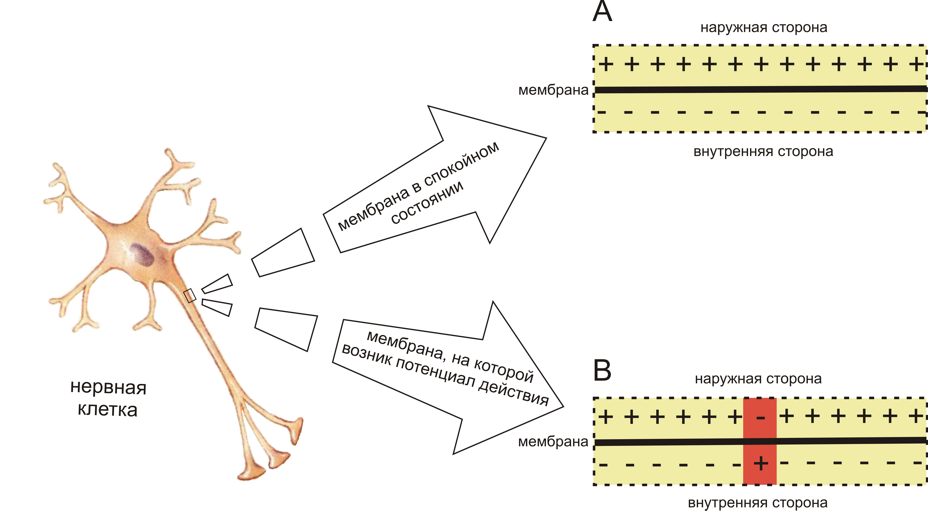
Мембрана всех живых клеток поляризована. Внутренняя сторона мембраны несет отрицательный заряд по сравнению с межклеточным пространством (рис. 1). Величина заряда, который несет мембрана называется мембранным потенциалом (МП). В невозбудимых тканях МП низкий, и составляет около -40 мВ. В возбудимых тканях он высокий, около -60 — -100 мВ и называется потенциалом покоя (ПП).
Потенциал покоя, как и любой мембранный потенциал формируется за счет избирательной проницаемости клеточной мембраны. Как известно, плазмолемма состоит из липидного бислоя, через который движение заряженных молекул затруднено. Белки, встроенные в мембрану, могут избирательно изменять проницаемость мембраны для различных ионов, в зависимости от приходящих стимулов. При этом, для формирования потенциала покоя ведущую роль играют ионы калия, кроме них важны ионы натрия и хлора.
Рис. 1. Концентрации и распределение ионов с внутренней и внешней стороны мембраны.
Большинство ионов распределяются неравномерно с внутренней и внешней стороны клетки (рис. 1). Внутри клетки концентрация ионов калия выше, а натрия и хлора – ниже, чем снаружи. В состоянии покоя мембрана проницаема для ионов калия и практически непроницаема для ионов натрия и хлора. Несмотря на то, что калий может свободно выходить из клетки, его концентрации остаются неизменными благодаря отрицательному заряду на внутренней стороне мембраны. Таким образом, на калий действуют две силы, находящиеся в равновесии: осмотические (градиент концентрации К+) и электрические (заряд мембраны), благодаря чему число входящих в клетку ионов калия равно выходящим. Движение калия осуществляется через калиевые каналы утечки, открытые в состоянии покоя. Величину заряда мембраны, при которой ионы калия находятся в равновесии можно вычислить по уравнению Нернста:
Ем = Ек = RT / nF ln [ K+]н / [ K+]вн
где Ек — равновесный потенциал для К+; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; n — валентность К+ (+1), [К+н] — [К+вн] — наружная и внутренняя концентрации К+.
Если подставить в уравнение значения из таблицы на рис. 43, то мы получим величину равновесного потенциала, равную примерно -95 мВ. Это значение вписывается в диапазон мембранного потенциала возбудимых клеток. Отличия ПП разных клеток (даже возбудимых) могут возникать по трем причинам:
- отличия внутриклеточной и внеклеточной концентраций ионов калия в разных тканях (в таблице приведены данные по среднестатистическому нейрону);
- натрий-калиевая АТФаза может вносить свой вклад в значение заряда, так как она выводит из клетки 3 Na+ в обмен на 2 К+;
- несмотря на минимальную проницаемость мембраны для натрия и хлора, эти ионы все-таки могут попадать в клетки, хоть и от 10 до 100 раз хуже, по сравнению с калием.
Чтобы учесть проникновение других ионов в клетку существует уравнение Нернста-Гольдмана:
Ем = RT / nF ln Pk[ K+]вн +PNa[ Na+]вн +PCl[ Cl—]н / Pk[ K+]н +PNa[ Na+]н + PCl[ Cl—]вн,
, где Еm — мембранный потенциал; R — газовая постоянная; Т — абсолютная температура; F — число Фарадея; РK , PNa и РCl — константы проницаемости мембраны для К+ Na+ и Сl, соответственно; [К+н], [K+вн], [Na+н], [Na+вн], [Сl—н] и [Сl—вн ]- концентрации K+, Na+ и Сl снаружи (н) и внутри (вн) клетки.
Такое уравнение позволяет установить более точную величину ПП. Обычно, мембрана оказывается на несколько мВ менее поляризована, по сравнению с равновесным потенциалом для К+.
Потенциал действия (ПД) может возникать в возбудимых клетках. Если на нерв или мышцу нанести раздражение выше порога возбуждения, то ПП нерва или мышцы быстро уменьшится и на короткий промежуток времени (миллисекунда) произойдет кратковременная перезарядка мембраны: ее внутренняя сторона станет заряженной положительно относительно наружной, после чего восстановится ПП. Это кратковременное изменение ПП, происходящее при возбуждении клетки называется потенциалом действия.
Возникновение ПД возможно благодаря тому, что в отличие от ионов калия, ионы натрия далеки от равновесия. Если подставить в уравнение Нернста натрий вместо калия, то мы получим равновесный потенциал, равный примерно +60 мВ. Во время ПД, происходит кратковременное увеличение проницаемости для Na+. При этом, натрий начнет проникать в клетку под действием двух сил: по градиенту концентрации и по заряду мембраны, стремясь подстроить заряд мембраны под свой равновесный потенциал. Движение натрия осуществляется по потенциал-зависимым натриевым каналам, которые открываются в ответ на смещение мембранного потенциала, после чего сами инактивируются.
Рис. 2. Потенциал действия нервного волокна (А) и изменение проводимости мембраны для ионов натрия и калия (Б).
На записи ПД выглядит как кратковременный пик (рис. 44), имеющий несколько фаз.
- Деполяризация (фаза нарастания) (рис. 44) – увеличение проницаемости для натрия из-за открытия натриевых каналов. Натрий стремится к своему равновесному потенциалу, но не достигает его, так как канал успевает инактивироваться.
- Реполяризация – возвращение заряда к величине потенциала покоя. Помимо калиевых каналов утечки здесь подключаются потенциал-зависимые калиевые каналы (активируются от деполяризации). В это время калий выходит из клетки, возвращаясь к своему равновесному потенциалу.
- Гиперполяризация (не всегда) – возникает в случаях, если равновесный потенциал по калию превышает по модулю ПП. Возвращение к ПП происходит после возвращения к равновесному потенциалу по К+.
Во время ПД происходит изменение полярности заряда мембраны. Фаза ПД, при которой заряд мембраны положителен, называется овершутом (рис. 2).
Для генерации ПД оказывается очень важной система активации и инактивации потенциал-управляемых натриевых каналов (рис. 3). Эти каналы имеют две створки: активационную (М-ворота) и инактивационную (Н-ворота). В состоянии покоя М-ворота открыты, а Н-ворота закрыты. Во время деполяризации мембраны М-ворота быстро открываются, а Н-ворота начинают закрываться. Ток натрия в клетку возможен пока М-ворота уже открыты, а Н-ворота еще не закрылись. Вход натрия приводит к дальнейшей деполяризации клетки, приводя к открытию большего количества каналов и запуская цепочку положительной обратной связи. Деполяризация мембраны будет продолжаться до тех пор, пока все потенциал-управляемые натриевые каналы не окажутся инактивированными, что происходит на пике ПД. Минимальная величина стимула, приводящая к возникновению ПД называется пороговой. Таким образом, возникший ПД будет подчиняться закону «все или ничего» и его величина не будет зависеть от величины стимула, вызвавшего ПД.
Благодаря Н-воротам инактивация канала происходит раньше, чем потенциал на мембране достигнет равновесной величины по натрию. После прекращения поступления натрия в клетку, происходит реполяризация за счет выходящих из клетки ионов калия. При этом к каналам утечки в этом случае подключаются еще и потениал-активируемые калиевые каналы. Во время реполяризации, в быстром натриевом канале быстро закрываются М-ворота. Н-ворота открываются гораздо медленнее и остаются закрытыми еще некоторое время после возвращения заряда к потенциалу покоя. Этот период принято называть периодом рефрактерности.
Рис. 3. Работа потенциал-управляемого натриевого канала.
Концентрации ионов внутри клетки восстанавливает натрий-калиевая АТФаза, которая с затратой энергии в виде АТФ откачивает из клетки 3 иона натрия и закачивает 2 иона калия.
По немиелинизированному волокну или по мембране мышцы потенциал действия распространяется непрерывно. Возникший потенциал действия за счет электрического поля способен деполяризовать мембрану соседнего участка до порогового значения, в результате чего на соседнем участке возникает деполяризация. Главную роль в возникновении потенциала на новом участке мембраны предыдущий участок. При этом на каждом участки сразу после ПД наступает период рефрактерности, за счет которое ПД распространяется однонаправленно. При прочих равных условиях распространение потенциала действия по немиелинизированному аксону происходит тем быстрее, чем больше диаметр волокна. У млекопитающих скорость составляет 1-4 м/с. Поскольку у беспозвоночных животных отсутствует миелин, в гигантских аксонах кальмара скорость ПД может достигать 100 м/c.
По миелинизированному волокну потенциал действия распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах немиелинизированных волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. Потенциал действия, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до порогового значения, что приводит к возникновению в них новых потенциалов действия, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье потенциал действия возбуждает 2-й, 3-й, 4-й и даже 5-й, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Сальтаторное проведение увеличивает скорость проведения ПД 15-20 раз до 120 м/с.
Работа нейронов
Нервная система состоит из нейронов и глиальных клеток. Однако, главную роль в проведении и передаче нервных импульсов играют нейроны. Они получают информацию от множества клеток по дендритам, анализируют ее и передают или не передают на следующий нейрон.
Передача нервного импульса с одной клетки на другую осуществляется с помощью синапсов. Различают два основных типа синапсов: электрические и химические (рис. 4). Задача любого синапса – передать информацию с пресинаптической мембраны (мембрана аксона) на постсинаптическую (мембрана дендрита, другого аксона, мышцы или другого органа-мишени). Большинство синапсов нервной системы образуется между окончанием аксонов и дендритами, которые в области синапса образуют дендритные шипики.
Преимущество электрического синапса состоит в том, что сигнал с одной клетки на другую переходит без задержки. Кроме того, такие синапсы не утомляются. Для этого пре- и постсинаптические мембраны соединены поперечными мостиками, через которые ионы из одной клетки могут перемещаться в другую. Однако, существенным минусом такой системы является отсутствие однонаправленной передачи ПД. То есть, он может передаваться как с пресинаптической мембраны на постсинаптическую, так и наоборот. Поэтому, такая конструкция встречается достаточно редко и в основном – в нервной системе беспозвоночных.
Рис. 4. Схема строения химического и электрического синапсов.
Химический синапс весьма распространен в природе. О устроен сложнее, так как необходима система преобразования электрического импульса в химический сигнал, затем, вновь в электрический импульс. Все это приводит к возникновению синаптической задержки, которая может составить 0,2-0,4 мс. Кроме того, может произойти истощение запасов химического вещества, что приведет к утомлению синапса. Однако, такой синапс обеспечивает однонаправленность передачи ПД, что является его главным преимуществом.
Рис. 5. Схема работы (а) и электронная микрофотография (б) химического синапса.
В состоянии покоя окончание аксона, или пресинаптическое окончание, содержит мембранные пузырьки (везикулы) с нейромедиатором. Поверхность везикул заряжена отрицательно, чтобы предотвратить связывание с мембраной, и покрыта специальными белками, и принимающими участие в высвобождении везикул. В каждом пузырьке находится одинаковое количество химического вещества, которое называется квантом нейромедиатора. Нейромедиаторы весьма разнообразны по химическому строению, однако, большинство из них производятся прямо в окончании. Поэтому, в нем могут находиться системы, для синтеза химического посредника, а также аппарат Гольджи и митохондрии.
Постсинаптическая мембрана содержит рецепторы к нейромедиатору. Рецепторы могут быть в виде как ионных каналов, открывающихся при контакте со своим лигандом (ионотропные), так и мембранными белками, запускающими внутриклеточный каскад реакций (метаботропные). Один нейромедиатор может иметь несколько как ионотропных, так и метаботропных рецепторов. При этом, часть из них может быть возбуждающими, а часть – тормозными. Таким образом, реакцию клетки на нейромедиатор будет определять тип рецептора на ее мембране, и разные клетки могут совершенно по-разному реагировать на одно и то же химическое вещество.
Между пре- и постсинаптической мембраной располагается синаптическая щель, шириной 10-15 нм.
При приходе ПД на пресинаптическое окончание, на нем открываются потенциал-активируемые кальциевые каналы и ионы кальция входят в клетку. Кальций связывается с белками на поверхности везикул, что приводит к их транспортировке к пресинаптической мембране с последующим слиянием мембран. После такого взаимодействия нейромедиатор оказывается в синаптической щели (рис. 5) и может связаться со своим рецептором.
Ионотропные рецепторы – это лиганд-активируемые ионные каналы. Это значит, что канал открывается только в присутствии определенного химического вещества. Для разных нейромедиаторов это могут быть натриевые, кальциевые или хлорные каналы. Ток натрия и кальция вызывает деполяризацию мембраны, поэтому такие рецепторы называют возбуждающими. Хлорный ток приводит к гиперполяризации, что затрудняет генерацию ПД. Следовательно, такие рецепторы называют тормозными.
Метаботропные рецепторы к нейромедиаторам относят к классу рецепторов, ассоцированных с G-белками (GPCR). Эти белки запускают разнообразные внутриклеточные каскады реакций, приводящих в конечном итоге либо к дальнейшей передачи возбуждения, либо к торможению.
После передачи сигнала необходимо быстро удалить нейромедиатор из синаптической щели. Для этого в щели присутствуют либо ферменты расщепляющие, нейромедиатор, либо на пресинаптическом окончании или соседних глиальных клетках могут располагаться транспортеры, закачивающие медиатор в клетки. В последнем случае он может использоваться повторно.
Каждый нейрон получает импульсы от 100 до 100 000 синапсов. Одиночная деполяризация на одном дендрите не приведет к дальнейшей передаче сигнала. На нейрон могут приходит одновременно множество как возбуждающих, так и тормозных стимулов. Все они суммируются на соме нейрона. Такая суммация называется пространственной. Далее, может возникнуть или не возникнуть (в зависимости от пришедших сигналов) ПД в области аксонного холмика. Аксонный холмик – это область аксона, примыкающая к соме и обладающая минимальным порогом ПД. Далее импульс распространяется по аксону, конец которого может сильно ветвиться и образовывать синапсы со множеством клеток. Помимо пространственной, существует временная суммация. Она происходит в случае, поступления часто повторяющихся импульсов от одного дендрита.
Помимо классических синапсов между аксонами и дендритами или их шипиками, существуют также синапсы, модулирующие передачу в других синапсах (рис. 6). К ним относят аксо-аксональные синапсы. Такие синапсы способны усиливать или тормозить синаптическую передачу. То есть, если на окончание аксона, образующего аксо-шипиковый синапс, пришел ПД, а в это время по аксо-аксональному синапсу на него пришел тормозный сигнал, высвобождения нейромедиатора в аксо-шипиковом синапсе не произойдет. Аксо-дендритные синапсы могут изменять проведение мембраной ПД на пути от шипика к соме клетки. Также существуют аксо-соматические синапсы, которые могут влиять на суммацию сигнала в области сомы нейрона.
Таким образом, существует огромное многообразие различных синапсов, отличающихся по составу нейромедиаторов, рецепторов и их местоположению. Все это обеспечивает разнообразие реакций и пластичность нервной системы.
Рис. 6. Разнообразие синапсов в нервной системе.
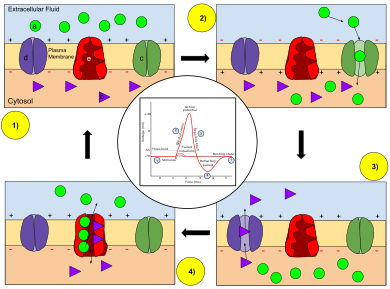
Когда потенциал действия (нервный импульс) движется вниз по аксону, происходит изменение полярности через мембрану аксона. В ответ на сигнал от другого нейрона , управляемые натрием (Na + ) и калием (K + ) ионные каналы открываются и закрываются, когда мембрана достигает своего порогового потенциала . Каналы Na + открываются в начале потенциала действия, и Na + перемещается в аксон, вызывая деполяризацию . Реполяризация происходит, когда каналы K + открываются и K + выходит из аксона, создавая изменение полярности между внешней стороной клетки и внутренней. Импульс движется вниз по аксону только в одном направлении, к концу аксона, где он сигнализирует другим нейронам.
В физиологии , потенциал действия ( AP ) возникает , когда мембранный потенциал конкретного клеточного местоположения быстро поднимается и опускается: эта деполяризация затем вызывает соседние местоположения аналогично деполяризации. Потенциалы действия возникают в нескольких типах клеток животных , называемых возбудимыми клетками, которые включают нейроны , мышечные клетки , эндокринные клетки и некоторые клетки растений .
В нейронах потенциалы действия играют центральную роль в межклеточной коммуникации , обеспечивая — или в отношении скачкообразной проводимости , помогая — распространение сигналов вдоль аксона нейрона к синаптическим бутонам, расположенным на концах аксона; эти сигналы могут затем связываться с другими нейронами в синапсах, или с моторными клетками или железами. В других типах клеток их основная функция — активировать внутриклеточные процессы. В мышечных клетках, например, потенциал действия является первым шагом в цепи событий, ведущих к сокращению. В бета — клетки этих поджелудочной железы , они вызывают высвобождение инсулина . Потенциалы действия в нейронах также известны как « нервные импульсы » или « спайки », а временная последовательность потенциалов действия, генерируемых нейроном, называется его « цепочкой спайков ». Нейрон, излучающий потенциал действия или нервный импульс, часто называют «стреляющим».
Потенциалы действия генерируются специальными типами потенциалзависимых ионных каналов, встроенных в плазматическую мембрану клетки . Эти каналы закрываются, когда мембранный потенциал близок к (отрицательному) потенциалу покоя клетки, но они быстро начинают открываться, если мембранный потенциал увеличивается до точно определенного порогового напряжения, деполяризуя трансмембранный потенциал. Когда каналы открываются, они пропускают внутрь поток ионов натрия , который изменяет электрохимический градиент, что, в свою очередь, вызывает дальнейшее повышение мембранного потенциала до нуля. Это затем приводит к открытию большего количества каналов, создавая больший электрический ток через клеточную мембрану и так далее. Процесс продолжается до тех пор, пока не откроются все доступные ионные каналы, что приводит к значительному скачку мембранного потенциала. Быстрый приток ионов натрия вызывает изменение полярности плазматической мембраны, и ионные каналы затем быстро инактивируются. Когда натриевые каналы закрываются, ионы натрия больше не могут проникать в нейрон, и тогда они активно транспортируются обратно из плазматической мембраны. Калийные каналы затем активируются, и есть наружу ток ионов калия, возвращая электрохимический градиент в состоянии покоя. После возникновения потенциала действия возникает кратковременный отрицательный сдвиг, называемый постгиперполяризацией .
В клетках животных существует два основных типа потенциалов действия. Один тип генерируется потенциалозависимыми натриевыми каналами , другой — потенциалозависимыми кальциевыми каналами. Потенциалы действия на основе натрия обычно длятся менее одной миллисекунды, но потенциалы действия на основе кальция могут длиться до 100 миллисекунд или дольше. В некоторых типах нейронов медленные выбросы кальция обеспечивают движущую силу для длительного всплеска быстро испускаемых выбросов натрия. В клетках сердечной мышцы , с другой стороны, начальный быстрый выброс натрия обеспечивает «праймер», чтобы спровоцировать быстрое начало выброса кальция, которое затем вызывает сокращение мышц.
Обзор
Форма типичного потенциала действия. Мембранный потенциал остается близким к базовому уровню, пока в какой-то момент он не резко возрастает, а затем быстро падает.
Почти все клеточные мембраны животных, растений и грибов поддерживают разницу напряжений между внешней и внутренней частями клетки, называемую мембранным потенциалом . Типичное напряжение на мембране клетки животного составляет -70 мВ. Это означает, что внутри ячейки имеется отрицательное напряжение по отношению к внешней стороне. В большинстве типов клеток мембранный потенциал обычно остается довольно постоянным. Однако некоторые типы элементов являются электрически активными в том смысле, что их напряжение колеблется со временем. В некоторых типах электрически активных клеток, включая нейроны и мышечные клетки, колебания напряжения часто принимают форму быстрого всплеска вверх, за которым следует быстрое падение. Эти восходящие и нисходящие циклы известны как потенциалы действия . В некоторых типах нейронов весь цикл «вверх-вниз» занимает несколько тысячных долей секунды. В мышечных клетках типичный потенциал действия длится около одной пятой секунды. В некоторых других типах клеток и растений потенциал действия может длиться три секунды и более.
Электрические свойства клетки определяются структурой окружающей ее мембраны. Клеточная мембрана состоит из липидного бислой молекул , в которых заделаны крупные молекулы белка. Липидный бислой очень устойчив к движению электрически заряженных ионов, поэтому он действует как изолятор. Напротив, крупные встроенные в мембрану белки обеспечивают каналы, через которые ионы могут проходить через мембрану. Потенциалы действия управляются белками каналов, конфигурация которых переключается между закрытым и открытым состояниями в зависимости от разницы напряжений между внутренней и внешней частью клетки. Эти чувствительные к напряжению белки известны как ионные каналы с регулируемым напряжением .
Процесс в типичном нейроне
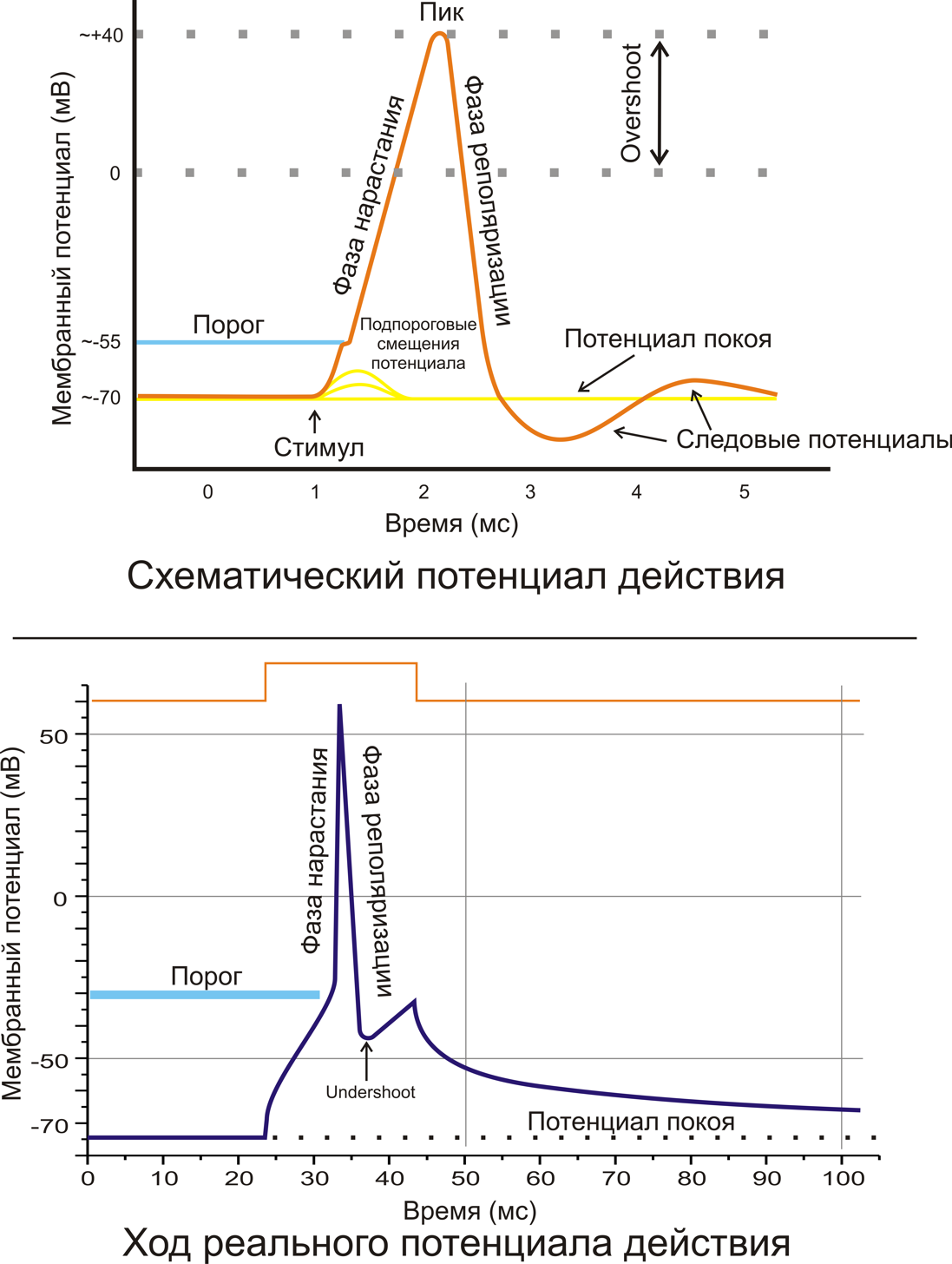
Приблизительный график типичного потенциала действия показывает его различные фазы, когда потенциал действия проходит через точку на клеточной мембране . Мембранный потенциал начинается примерно с -70 мВ в нулевой момент времени. Стимул применяется в момент времени = 1 мс, что поднимает мембранный потенциал выше -55 мВ (пороговый потенциал). После применения стимула мембранный потенциал быстро возрастает до пикового значения +40 мВ за время = 2 мс. Так же быстро потенциал затем падает и перескакивает до -90 мВ во время = 3 мс, и, наконец, потенциал покоя -70 мВ восстанавливается во время = 5 мс.
Все клетки в тканях тела животных электрически поляризованы — другими словами, они поддерживают разность напряжений на плазматической мембране клетки , известную как мембранный потенциал . Эта электрическая поляризация является результатом сложного взаимодействия между белковыми структурами, встроенными в мембрану, называемыми ионными насосами и ионными каналами . В нейронах типы ионных каналов в мембране обычно различаются в разных частях клетки, что придает дендритам , аксонам и телу клетки разные электрические свойства. В результате некоторые части мембраны нейрона могут быть возбудимыми (способны генерировать потенциалы действия), тогда как другие — нет. Недавние исследования показали, что наиболее возбудимая часть нейрона — это часть после бугорка аксона (точка, где аксон выходит из тела клетки), которая называется начальным сегментом, но аксон и тело клетки также в большинстве случаев возбудимы. .
Каждый возбудимый участок мембраны имеет два важных уровня мембранного потенциала: потенциал покоя , который представляет собой значение, которое мембранный потенциал поддерживает до тех пор, пока ничто не беспокоит клетку, и более высокое значение, называемое пороговым потенциалом . На бугорке аксона типичного нейрона потенциал покоя составляет около -70 милливольт (мВ), а пороговый потенциал составляет около -55 мВ. Синаптические входы в нейрон вызывают деполяризацию или гиперполяризацию мембраны ; то есть они вызывают повышение или понижение мембранного потенциала. Потенциалы действия срабатывают, когда накапливается достаточно деполяризации, чтобы довести мембранный потенциал до порогового значения. Когда срабатывает потенциал действия, мембранный потенциал резко поднимается вверх, а затем столь же резко возвращается вниз, часто заканчиваясь ниже уровня покоя, где он остается в течение некоторого периода времени. Форма потенциала действия стереотипна; это означает, что подъем и спад обычно имеют примерно одинаковую амплитуду и ход во времени для всех потенциалов действия в данной клетке. (Исключения обсуждаются далее в статье). В большинстве нейронов весь процесс происходит примерно за тысячную долю секунды. Многие типы нейронов постоянно излучают потенциалы действия со скоростью до 10–100 в секунду. Однако некоторые типы намного тише и могут длиться минуты или дольше, не испуская никаких потенциалов действия.
Биофизическая основа
Потенциалы действия возникают из-за наличия в клеточной мембране особых типов потенциалзависимых ионных каналов . Потенциально-зависимый ионный канал — это трансмембранный белок, обладающий тремя ключевыми свойствами:
- Он способен принимать более одной конформации.
- По крайней мере, одна из конформаций создает канал через мембрану, проницаемый для определенных типов ионов.
- На переход между конформациями влияет мембранный потенциал.
Таким образом, потенциал-зависимый ионный канал имеет тенденцию быть открытым для одних значений мембранного потенциала и закрытым для других. Однако в большинстве случаев взаимосвязь между мембранным потенциалом и состоянием канала является вероятностной и включает временную задержку. Ионные каналы переключаются между конформациями в непредсказуемое время: мембранный потенциал определяет скорость переходов и вероятность в единицу времени каждого типа перехода.
Распространение потенциала действия по аксону
Управляемые напряжением ионные каналы способны создавать потенциалы действия, потому что они могут вызывать петли положительной обратной связи : мембранный потенциал контролирует состояние ионных каналов, но состояние ионных каналов контролирует мембранный потенциал. Таким образом, в некоторых ситуациях повышение мембранного потенциала может вызвать открытие ионных каналов, тем самым вызывая дальнейшее повышение мембранного потенциала. Когда этот цикл положительной обратной связи ( цикл Ходжкина ) развивается взрывно, возникает потенциал действия . Время и амплитуда траектории потенциала действия определяются биофизическими свойствами потенциалзависимых ионных каналов, которые его создают. Существует несколько типов каналов, способных производить положительную обратную связь, необходимую для создания потенциала действия. Управляемые напряжением натриевые каналы отвечают за быстрые потенциалы действия, участвующие в нервной проводимости. Потенциалы более медленного действия в мышечных клетках и некоторых типах нейронов генерируются потенциалозависимыми кальциевыми каналами. Каждый из этих типов имеет несколько вариантов с разной чувствительностью к напряжению и разной временной динамикой.
Наиболее интенсивно изучаемый тип потенциалзависимых ионных каналов — это натриевые каналы, участвующие в быстрой нервной проводимости. Они иногда известны как натриевые каналы Ходжкина-Хаксли , потому что они впервые были характерны Алана Ходжкина и Эндрю Хаксли в своих Нобель призовое исследований биофизики потенциала действия, но может быть более удобно упоминается как Na V каналов. («V» означает «напряжение».) Канал Na V имеет три возможных состояния: деактивирован , активирован и деактивирован . Канал проницаем только для ионов натрия, когда он находится в активированном состоянии. При низком мембранном потенциале канал большую часть времени находится в деактивированном (закрытом) состоянии. Если мембранный потенциал поднимается выше определенного уровня, канал показывает повышенную вероятность перехода в активированное (открытое) состояние. Чем выше мембранный потенциал, тем больше вероятность активации. После активации канал в конечном итоге переходит в неактивное (закрытое) состояние. Затем он имеет тенденцию оставаться неактивным в течение некоторого времени, но, если мембранный потенциал снова становится низким, канал в конечном итоге переходит обратно в деактивированное состояние. Во время потенциала действия большинство каналов этого типа проходят цикл: деактивировано → активировано → деактивировано → деактивировано . Однако это только среднее поведение населения — отдельный канал в принципе может осуществить любой переход в любое время. Однако вероятность перехода канала из неактивированного состояния непосредственно в активированное состояние очень мала: канал в неактивированном состоянии является невосприимчивым до тех пор, пока он не перейдет обратно в деактивированное состояние.
Результатом всего этого является то, что кинетика каналов Na V управляется переходной матрицей, скорости которой сложным образом зависят от напряжения. Поскольку эти каналы сами по себе играют важную роль в определении напряжения, глобальную динамику системы может быть довольно сложно определить. Ходжкин и Хаксли подошли к проблеме, разработав систему дифференциальных уравнений для параметров, которые управляют состояниями ионных каналов, известных как уравнения Ходжкина-Хаксли . Эти уравнения были значительно изменены более поздними исследованиями, но они составляют отправную точку для большинства теоретических исследований биофизики потенциала действия.
Движение ионов при потенциале действия.
Обозначения: а ) Ион натрия (Na + ). б ) Ион калия (K + ). в) Натриевый канал. г) Калиевый канал. д) Натрий-калиевый насос.
На стадиях потенциала действия проницаемость мембраны нейрона изменяется. В состоянии покоя (1) ионы натрия и калия имеют ограниченную способность проходить через мембрану, и у нейрона есть чистый отрицательный заряд внутри. Как только потенциал действия запускается, деполяризация (2) нейрона активирует натриевые каналы, позволяя ионам натрия проходить через клеточную мембрану в клетку, что приводит к появлению в нейроне чистого положительного заряда по сравнению с внеклеточной жидкостью. После достижения пика потенциала действия нейрон начинает реполяризацию (3), при этом натриевые каналы закрываются, а калиевые каналы открываются, позволяя ионам калия пересекать мембрану во внеклеточную жидкость, возвращая мембранный потенциал к отрицательному значению. Наконец, существует рефрактерный период (4), в течение которого потенциал-зависимые ионные каналы инактивируются, в то время как ионы Na + и K + возвращаются в свое распределение состояния покоя через мембрану (1), и нейрон готов повторить процесс для следующего потенциала действия.
По мере увеличения мембранного потенциала каналы ионов натрия открываются, позволяя ионам натрия проникать в клетку. После этого открываются каналы для ионов калия, через которые ионы калия выходят из клетки. Входящий поток ионов натрия увеличивает концентрацию положительно заряженных катионов в клетке и вызывает деполяризацию, при которой потенциал клетки выше, чем потенциал покоя клетки . Натриевые каналы закрываются на пике потенциала действия, в то время как калий продолжает покидать клетку. Отток ионов калия снижает мембранный потенциал или гиперполяризует клетку. При небольшом увеличении напряжения из состояния покоя ток калия превышает ток натрия, и напряжение возвращается к своему нормальному значению в состоянии покоя, обычно -70 мВ. Однако, если напряжение превышает критический порог, обычно на 15 мВ выше, чем значение в состоянии покоя, преобладает натриевый ток. Это приводит к неуправляемому состоянию, при котором положительная обратная связь от натриевого тока активирует еще больше натриевых каналов. Таким образом, клетка срабатывает , создавая потенциал действия. Частота, с которой нейрон вырабатывает потенциалы действия, часто называется скоростью возбуждения или скоростью возбуждения нейронов .
Токи, возникающие при открытии управляемых по напряжению каналов в ходе действия потенциала действия, обычно значительно превышают начальный стимулирующий ток. Таким образом, амплитуда, продолжительность и форма потенциала действия в значительной степени определяются свойствами возбудимой мембраны, а не амплитудой или продолжительностью стимула. Это свойство потенциала действия по принципу « все или ничего» отличает его от градуированных потенциалов, таких как рецепторные потенциалы , электротонические потенциалы , подпороговые колебания мембранного потенциала и синаптические потенциалы , которые масштабируются с величиной стимула. Различные типы потенциала действия существуют во многих типах клеток и клеточных компартментах, что определяется типами управляемых напряжением каналов, каналов утечки , распределением каналов, концентрацией ионов, емкостью мембраны, температурой и другими факторами.
Основными ионами, участвующими в потенциале действия, являются катионы натрия и калия; Ионы натрия попадают в клетку, а ионы калия уходят, восстанавливая равновесие. Относительно небольшое количество ионов должно пересечь мембрану, чтобы напряжение на мембране резко изменилось. Ионы, обмениваемые во время потенциала действия, поэтому вызывают незначительное изменение внутренней и внешней концентрации ионов. Немногочисленные пересекающиеся ионы снова откачиваются за счет непрерывного действия натрий-калиевого насоса , который вместе с другими переносчиками ионов поддерживает нормальное соотношение концентраций ионов через мембрану. Катионы кальция и анионы хлорида участвуют в нескольких типах потенциалов действия, таких как потенциал действия на сердце и потенциал действия в одноклеточной водоросли Acetabularia , соответственно.
Хотя потенциалы действия генерируются локально на участках возбудимой мембраны, результирующие токи могут запускать потенциалы действия на соседних участках мембраны, ускоряя распространение, подобное домино. В отличие от пассивного распространения электрических потенциалов ( электротонический потенциал ), потенциалы действия генерируются заново вдоль возбудимых участков мембраны и распространяются без распада. Миелинизированные участки аксонов не возбудимы и не производят потенциалов действия, а сигнал передается пассивно как электротонический потенциал . Регулярно расположенные немиелинизированные пятна, называемые узлами Ранвье , генерируют потенциалы действия для усиления сигнала. Этот тип распространения сигнала, известный как скачкообразная проводимость , обеспечивает благоприятный компромисс между скоростью сигнала и диаметром аксона. Деполяризация окончаний аксонов , как правило, запускает выброс нейромедиатора в синаптическую щель . Кроме того, потенциалы действия обратного распространения были зарегистрированы в дендритах пирамидных нейронов , которые повсеместно встречаются в неокортексе. Считается, что они играют роль в пластичности, зависящей от времени спайков .
В модели емкости мембраны Ходжкина-Хаксли скорость передачи потенциала действия не была определена, и предполагалось, что соседние области становятся деполяризованными из-за высвобождающейся ионной интерференции с соседними каналами. Измерения диффузии ионов и радиусов с тех пор показали, что это невозможно. Более того, противоречивые измерения изменений энтропии и времени оспаривают модель емкости как действующую в одиночку. С другой стороны, гипотеза адсорбции Гилберта Линга утверждает, что мембранный потенциал и потенциал действия живой клетки обусловлены адсорбцией подвижных ионов на адсорбционные участки клеток.
Созревание электрических свойств потенциала действия
А нейрона способность «сек генерировать и распространять действие , возможные изменения в процессе развития . Насколько мембранный потенциал нейрона изменяется в результате импульса тока, зависит от входного сопротивления мембраны . По мере роста клетки к мембране добавляется больше каналов , вызывая уменьшение входного сопротивления. Зрелый нейрон также претерпевает более короткие изменения мембранного потенциала в ответ на синаптические токи. Нейроны из латерального коленчатого ядра хорька имеют большую постоянную времени и большее отклонение напряжения в точке P0, чем в точке P30. Одним из следствий уменьшения продолжительности потенциала действия является то, что точность сигнала может быть сохранена в ответ на высокочастотную стимуляцию. Незрелые нейроны более склонны к синаптической депрессии, чем к потенциации после высокочастотной стимуляции.
На раннем этапе развития многих организмов потенциал действия фактически изначально переносится кальциевым, а не натриевым током . Открытия и закрытие кинетики кальциевых каналов во время развития медленнее , чем у напряжения закрытого натриевых каналов , которые будут осуществлять потенциал действия в зрелых нейронах. Более длительное время открытия кальциевых каналов может привести к тому, что потенциалы действия будут значительно ниже, чем у зрелых нейронов. Первоначально нейроны Xenopus обладают потенциалом действия, который составляет 60–90 мс. В процессе разработки это время уменьшается до 1 мс. Это резкое снижение объясняется двумя причинами. Во-первых, входящий ток в основном переносится по натриевым каналам. Во- вторых, задержанный выпрямителя , А калиевый канал тока, увеличивается до 3,5 раз по сравнению с начальной прочностью.
Для перехода от кальций-зависимого потенциала действия к натрий-зависимому потенциалу действия в мембрану должны быть добавлены новые каналы. Если нейроны Xenopus выращиваются в среде с ингибиторами синтеза РНК или белка , этот переход предотвращается. Даже электрическая активность самой клетки может играть роль в экспрессии каналов. Если потенциалы действия в миоцитах Xenopus заблокированы, типичное увеличение плотности тока натрия и калия предотвращается или задерживается.
Это созревание электрических свойств наблюдается у всех видов. Потоки натрия и калия Xenopus резко возрастают после того, как нейрон проходит заключительную фазу митоза . Плотность натриевого тока корковых нейронов крыс увеличивается на 600% в течение первых двух постнатальных недель.
Нейротрансмиссия
Анатомия нейрона
| Нейрон |
|---|
|
Дендрит Сома Аксон Ядро Узел Аксон терминал Шванновская ячейка Миелиновой оболочки |
Некоторые типы клеток поддерживают потенциал действия, такие как клетки растений, мышечные клетки и специализированные клетки сердца (в которых возникает потенциал действия сердца ). Однако главной возбудимой клеткой является нейрон , у которого также есть простейший механизм потенциала действия.
Нейроны представляют собой электрически возбудимые клетки, состоящие, как правило, из одного или нескольких дендритов, одной сомы , одного аксона и одного или нескольких окончаний аксона . Дендриты — это клеточные проекции, основная функция которых — принимать синаптические сигналы. Их выступы, известные как дендритные шипы , предназначены для захвата нейротрансмиттеров, выделяемых пресинаптическим нейроном. Они имеют высокую концентрацию ионных каналов, управляемых лигандами . Эти шипы имеют тонкую шейку, соединяющую луковичный выступ с дендритом. Это гарантирует, что изменения, происходящие внутри позвоночника, с меньшей вероятностью повлияют на соседние позвоночники. Дендритный отросток может, за редким исключением (см. ДП ), действовать как самостоятельная единица. Дендриты отходят от сомы, в которой находится ядро , и многие из «нормальных» эукариотических органелл. В отличие от шипов, поверхность сомы населена ионными каналами, активируемыми напряжением. Эти каналы помогают передавать сигналы, генерируемые дендритами. Из сомы выходит аксонный бугорок . Эта область характеризуется очень высокой концентрацией активируемых напряжением натриевых каналов. В общем, это считается зоной инициирования всплеска для потенциалов действия, то есть зоной срабатывания . Здесь сходятся многочисленные сигналы, генерируемые позвоночником и передаваемые сомой. Сразу после бугорка аксона находится аксон. Это тонкий трубчатый выступ, отходящий от сомы. Аксон изолирован миелиновой оболочкой. Миелин состоит либо из шванновских клеток (в периферической нервной системе), либо из олигодендроцитов (в центральной нервной системе), которые являются типами глиальных клеток . Хотя глиальные клетки не участвуют в передаче электрических сигналов, они общаются и обеспечивают важную биохимическую поддержку нейронов. Точнее говоря, миелин несколько раз оборачивается вокруг аксонального сегмента, образуя толстый жировой слой, который не позволяет ионам проникать в аксон или выходить из него. Эта изоляция предотвращает значительное затухание сигнала, а также обеспечивает более высокую скорость сигнала. Эта изоляция, однако, имеет ограничение, заключающееся в том, что на поверхности аксона не может быть никаких каналов. Таким образом, существуют регулярно расположенные участки мембраны, которые не имеют изоляции. Эти узлы Ранвье можно рассматривать как «бугорки мини-аксонов», так как их цель — усилить сигнал, чтобы предотвратить значительное затухание сигнала. На самом дальнем конце аксон теряет изоляцию и начинает разветвляться на несколько окончаний аксона . Эти пресинаптические окончания или синаптические бутоны представляют собой специализированную область в аксоне пресинаптической клетки, которая содержит нейротрансмиттеры, заключенные в небольшие мембраносвязанные сферы, называемые синаптическими пузырьками .
Посвящение
Прежде чем рассматривать распространение потенциалов действия вдоль аксонов и их прекращение на синаптических выступах, полезно рассмотреть методы, с помощью которых потенциалы действия могут быть инициированы на бугорке аксона . Основное требование — чтобы напряжение на мембране на бугре было выше порога выстрела. Эта деполяризация может происходить несколькими путями.
Когда потенциал действия достигает конца пресинаптического аксона (вверху), он вызывает высвобождение молекул нейротрансмиттера , которые открывают ионные каналы в постсинаптическом нейроне (внизу). Комбинированные возбуждающие и тормозные постсинаптические потенциалы таких входов могут начать новый потенциал действия в постсинаптическом нейроне.
Динамика
Потенциалы действия чаще всего инициируются возбуждающими постсинаптическими потенциалами пресинаптического нейрона. Обычно молекулы нейротрансмиттеров высвобождаются пресинаптическим нейроном . Затем эти нейротрансмиттеры связываются с рецепторами постсинаптической клетки. Это связывание открывает различные типы ионных каналов . Это открытие имеет дополнительный эффект изменения локальной проницаемости клеточной мембраны и, таким образом, мембранного потенциала. Если связывание увеличивает напряжение (деполяризует мембрану), синапс становится возбуждающим. Однако, если связывание снижает напряжение (гиперполяризует мембрану), оно является тормозящим. Независимо от того, увеличивается или уменьшается напряжение, изменение пассивно распространяется на близлежащие области мембраны (как описано уравнением кабеля и его уточнениями). Обычно стимул напряжения спадает экспоненциально с расстоянием от синапса и со временем от связывания нейромедиатора. Некоторая часть возбуждающего напряжения может достигать бугорка аксона и может (в редких случаях) деполяризовать мембрану в достаточной степени, чтобы вызвать новый потенциал действия. Более типично, возбуждающие потенциалы от нескольких синапсов должны работать вместе в почти то же самое время , чтобы спровоцировать новый потенциал действия. Однако их совместным усилиям может помешать противодействие тормозным постсинаптическим потенциалам .
Нейротрансмиссия также может происходить через электрические синапсы . Благодаря прямой связи между возбудимыми клетками в виде щелевых контактов , потенциал действия может передаваться напрямую от одной клетки к другой в любом направлении. Свободный поток ионов между клетками обеспечивает быструю передачу, не опосредованную химическими веществами. Выпрямляющие каналы гарантируют, что потенциалы действия движутся только в одном направлении через электрический синапс. Электрические синапсы присутствуют во всех нервных системах, включая человеческий мозг, хотя их меньшинство.
Принцип «все или ничего»
Амплитуда потенциала действия не зависит от величины тока , который произвел его. Другими словами, большие токи не создают больших потенциалов действия. Следовательно, потенциалы действия называются сигналами « все или ничего» , поскольку они либо проявляются полностью, либо не возникают вовсе. Это контрастирует с рецепторными потенциалами , амплитуда которых зависит от интенсивности стимула. В обоих случаях частота потенциалов действия коррелирует с интенсивностью стимула.
Сенсорные нейроны
В сенсорных нейронах внешний сигнал, такой как давление, температура, свет или звук, связан с открытием и закрытием ионных каналов , которые, в свою очередь, изменяют ионную проницаемость мембраны и ее напряжение. Эти изменения напряжения могут снова быть возбуждающими (деполяризующими) или тормозящими (гиперполяризационными), а в некоторых сенсорных нейронах их комбинированные эффекты могут деполяризовать бугорок аксона в достаточной степени, чтобы вызвать потенциалы действия. Некоторые примеры у людей включают нейрон обонятельного рецептора и тельце Мейснера , которые имеют решающее значение для обоняния и осязания , соответственно. Однако не все сенсорные нейроны преобразуют свои внешние сигналы в потенциалы действия; у некоторых нет даже аксона. Вместо этого они могут преобразовывать сигнал в высвобождение нейротрансмиттера или в непрерывные градиентные потенциалы , каждый из которых может стимулировать последующий нейрон (ы) на запуск потенциала действия. Для иллюстрации, в человеческом ухе , клетки волос преобразует поступающий звук в открытие и закрытие механически закрытых ионных каналов , которые могут вызвать нейромедиатора молекулы , которые будут освобождены. Аналогичным образом в сетчатке человека исходные фоторецепторные клетки и следующий слой клеток (включающий биполярные клетки и горизонтальные клетки ) не производят потенциалов действия; только некоторые амакриновые клетки и третий слой, ганглиозные клетки , производят потенциалы действия, которые затем перемещаются по зрительному нерву .
Возможности кардиостимулятора
В сенсорных нейронах потенциалы действия возникают в результате внешнего раздражителя. Однако некоторым возбудимым клеткам не нужен такой стимул для срабатывания: они спонтанно деполяризуют бугорки аксонов и запускают потенциалы действия с регулярной скоростью, как внутренние часы. Следы напряжения таких клеток известны как потенциалы кардиостимулятора . В кардиостимулятор клетки синусового узла в сердце дают хороший пример. Хотя у таких кардиостимуляторов есть естественный ритм , он может регулироваться внешними раздражителями; например, частота сердечных сокращений может быть изменена фармацевтическими препаратами, а также сигналами симпатических и парасимпатических нервов. Внешние стимулы не вызывают повторяющихся срабатываний клетки, а просто изменяют время их действия. В некоторых случаях регулирование частоты может быть более сложным, что приводит к паттернам потенциалов действия, таким как взрыв .
Фазы
Ход потенциала действия можно разделить на пять частей: фаза нарастания, фаза пика, фаза спада, фаза недорега и рефрактерный период. Во время фазы роста мембранный потенциал деполяризуется (становится более положительным). Точка, в которой прекращается деполяризация, называется фазой пика. На этом этапе мембранный потенциал достигает максимума. Вслед за этим наступает фаза падения. На этом этапе мембранный потенциал становится более отрицательным, возвращаясь к потенциалу покоя. Фаза недостаточного выброса или постгиперполяризации — это период, в течение которого мембранный потенциал временно становится более отрицательно заряженным, чем в состоянии покоя (гиперполяризован). Наконец, время, в течение которого последующий потенциал действия невозможно или трудно задействовать, называется рефрактерным периодом , который может перекрываться с другими фазами.
Ход потенциала действия определяется двумя связанными эффектами. Во-первых, чувствительные к напряжению ионные каналы открываются и закрываются в ответ на изменение мембранного напряжения V m . Это изменяет проницаемость мембраны для этих ионов. Во-вторых, согласно уравнению Гольдмана , это изменение проницаемости изменяет равновесный потенциал E m и, таким образом, мембранное напряжение V m . Таким образом, мембранный потенциал влияет на проницаемость, которая затем дополнительно влияет на мембранный потенциал. Это создает возможность для положительной обратной связи , которая является ключевой частью фазы роста потенциала действия. Осложняющим фактором является то, что один ионный канал может иметь несколько внутренних «ворот», которые реагируют на изменения V m противоположным образом или с разной скоростью. Например, хотя повышение V m открывает большинство ворот в чувствительном к напряжению натриевом канале, оно также закрывает «ворота инактивации» канала, хотя и медленнее. Следовательно, когда V m внезапно повышается, натриевые каналы сначала открываются, но затем закрываются из-за более медленной инактивации.
Напряжения и токи потенциала действия во всех его фазах были смоделированы точно, Алан Ллойд Ходжкин и Эндрю Хаксли в 1952 году, за что они были удостоены Нобелевской премии по физиологии и медицине в 1963 году Однако, их модель учитывает только два типа чувствительные к напряжению ионные каналы, и делает несколько предположений о них, например, что их внутренние ворота открываются и закрываются независимо друг от друга. На самом деле существует много типов ионных каналов, и они не всегда открываются и закрываются независимо друг от друга.
Фаза стимуляции и подъема
Типичный потенциал действия начинается на бугре аксона с достаточно сильной деполяризации, например, стимула, увеличивающего V m . Эта деполяризация часто вызывается введением в клетку дополнительных катионов натрия ; эти катионы могут поступать из самых разных источников, таких как химические синапсы , сенсорные нейроны или потенциалы кардиостимуляторов .
Для нейрона в состоянии покоя существует высокая концентрация ионов натрия и хлорида во внеклеточной жидкости по сравнению с внутриклеточной жидкостью , в то время как во внутриклеточной жидкости наблюдается высокая концентрация ионов калия по сравнению с внеклеточной жидкостью. Разница в концентрациях, которая заставляет ионы переходить от высокой к низкой концентрации , и электростатические эффекты (притяжение противоположных зарядов) ответственны за движение ионов внутрь и из нейрона. Внутренняя часть нейрона имеет отрицательный заряд по отношению к внешней части клетки из-за движения K + из клетки. Мембрана нейрона более проницаема для K +, чем для других ионов, что позволяет этому иону выборочно перемещаться из клетки, вниз по градиенту его концентрации. Этот градиент концентрации вместе с каналами утечки калия, присутствующими на мембране нейрона, вызывает отток ионов калия, делая потенциал покоя близким к E K ≈ –75 мВ. Поскольку ионы Na + находятся в более высоких концентрациях вне клетки, разница в концентрации и напряжении заставляет их проникать в клетку, когда каналы Na + открываются. Деполяризация открывает как натриевые, так и калиевые каналы в мембране, позволяя ионам проникать в аксон и выходить из него соответственно. Если деполяризация мала (скажем, увеличение V m с -70 мВ до -60 мВ), выходящий калиевый ток подавляет входящий натриевый ток, и мембрана реполяризуется обратно к своему нормальному потенциалу покоя около -70 мВ. Однако, если деполяризация достаточно велика, входящий натриевой ток увеличивается больше, чем выходящий калиевый ток, и возникает условие разгона ( положительная обратная связь ): чем больше входящий ток, тем больше увеличивается V m , что, в свою очередь, еще больше увеличивает входящий ток. Текущий. Достаточно сильная деполяризация (увеличение V m ) вызывает открытие чувствительных к напряжению натриевых каналов; увеличение проницаемости для натрия приближает V m к равновесному напряжению натрия E Na ≈ +55 мВ. Повышение напряжения, в свою очередь, вызывает открытие еще большего количества натриевых каналов, что еще больше подталкивает V m к E Na . Эта положительная обратная связь продолжается до тех пор, пока натриевые каналы не откроются полностью и V m не приблизится к E Na . Резкий рост V m и проницаемости для натрия соответствует возрастающей фазе потенциала действия.
Критическое пороговое напряжение для этого состояния разгона обычно составляет около -45 мВ, но оно зависит от недавней активности аксона. Клетка, которая только что активировала потенциал действия, не может немедленно запустить другую, поскольку каналы Na + не восстановились из неактивированного состояния. Период, в течение которого не может быть запущен новый потенциал действия, называется периодом абсолютной рефрактерности . В более длительные периоды времени, после восстановления некоторых, но не всех ионных каналов, аксон может быть стимулирован для создания другого потенциала действия, но с более высоким порогом, требующим гораздо более сильной деполяризации, например, до -30 мВ. Период, в течение которого необычно трудно вызвать потенциалы действия, называется относительным рефрактерным периодом .
Пиковая фаза
Положительная обратная связь нарастающей фазы замедляется и прекращается, когда каналы ионов натрия становятся максимально открытыми. На пике потенциала действия проницаемость для натрия максимальна, и напряжение на мембране V m почти равно равновесному напряжению натрия E Na . Однако то же повышенное напряжение, которое первоначально открывало натриевые каналы, также медленно закрывает их, закрывая поры; натриевые каналы становятся неактивными . Это снижает проницаемость мембраны для натрия по сравнению с калием, возвращая напряжение на мембране к исходному значению. В то же время повышенное напряжение открывает чувствительные к напряжению калиевые каналы; увеличение проницаемости калия мембраны приводит в V м в направлении E K . Вместе эти изменения проницаемости для натрия и калия приводят к быстрому падению V m , реполяризации мембраны и возникновению «фазы падения» потенциала действия.
После гиперполяризации
Деполяризованное напряжение открывает дополнительные зависимые от напряжения калиевые каналы, и некоторые из них не закрываются сразу же, когда мембрана возвращается к своему нормальному напряжению покоя. Кроме того, дополнительные калиевые каналы открываются в ответ на приток ионов кальция во время потенциала действия. Внутриклеточная концентрация ионов калия является транзиторно необычно низкой, в результате чего мембрана напряжения V м еще ближе к калиевой равновесного напряжения Е К . Мембранный потенциал опускается ниже мембранного потенциала покоя. Следовательно, существует недоработка или гиперполяризация , называемая постгиперполяризацией , которая сохраняется до тех пор, пока проницаемость мембраны для калия не вернется к своему обычному значению, восстанавливая мембранный потенциал до состояния покоя.
Период отражения
За каждым потенциалом действия следует рефрактерный период , который можно разделить на абсолютно рефрактерный период , в течение которого невозможно вызвать другой потенциал действия, и затем на относительный рефрактерный период , в течение которого требуется более сильный, чем обычно, стимул. Эти два рефрактерных периода вызваны изменениями состояния молекул натриевого и калиевого каналов. При закрытии после потенциала действия натриевые каналы переходят в «инактивированное» состояние , в котором их нельзя заставить открыться независимо от мембранного потенциала — это приводит к возникновению периода абсолютной рефрактерности. Даже после того, как достаточное количество натриевых каналов перешло обратно в состояние покоя, часто случается, что часть калиевых каналов остается открытой, что затрудняет деполяризацию мембранного потенциала и, таким образом, вызывает относительный рефрактерный период. Поскольку плотность и подтипы калиевых каналов могут сильно различаться между разными типами нейронов, продолжительность относительного рефрактерного периода сильно варьируется.
Абсолютный рефрактерный период в значительной степени отвечает за однонаправленное распространение потенциалов действия вдоль аксонов. В любой данный момент участок аксона позади активно развивающейся части является рефрактерным, но участок впереди, не активировавшийся в последнее время, способен стимулироваться деполяризацией от потенциала действия.
Распространение
Потенциал действия, генерируемый на бугорке аксона, распространяется как волна вдоль аксона. Токи, текущие внутрь в точке аксона во время потенциала действия, распространяются вдоль аксона и деполяризуют соседние участки его мембраны. Если эта деполяризация достаточно сильна, она вызывает аналогичный потенциал действия на соседних участках мембраны. Этот основной механизм был продемонстрирован Аланом Ллойдом Ходжкином в 1937 году. После раздавливания или охлаждения нервных сегментов и, таким образом, блокировки потенциалов действия, он показал, что потенциал действия, приходящий на одну сторону блока, может спровоцировать другой потенциал действия на другой, при условии, что заблокированный сегмент был достаточно коротким.
Как только на участке мембраны проявился потенциал действия, мембранному участку требуется время для восстановления, прежде чем он сможет снова выстрелить. На молекулярном уровне этот период абсолютной рефрактерности соответствует времени, необходимому для активации активируемых напряжением натриевых каналов, чтобы восстановиться после инактивации, то есть вернуться в свое закрытое состояние. В нейронах существует много типов калиевых каналов, активируемых напряжением. Некоторые из них деактивируются быстро (токи типа А), а некоторые инактивируются медленно или не деактивируются совсем; эта изменчивость гарантирует, что всегда будет доступный источник тока для реполяризации, даже если некоторые калиевые каналы инактивированы из-за предшествующей деполяризации. С другой стороны, все нейронные активируемые напряжением натриевые каналы инактивируются в течение нескольких миллисекунд во время сильной деполяризации, что делает последующую деполяризацию невозможной до тех пор, пока значительная часть натриевых каналов не вернется в свое закрытое состояние. Хотя он ограничивает частоту возбуждения, абсолютный рефрактерный период гарантирует, что потенциал действия движется только в одном направлении вдоль аксона. Токи, протекающие из-за потенциала действия, распространяются в обоих направлениях вдоль аксона. Однако только незажженная часть аксона может отвечать потенциалом действия; часть, которая только что сработала, не реагирует, пока потенциал действия не выйдет за пределы допустимого диапазона, и не сможет рестимулировать эту часть. При обычной ортодромной проводимости потенциал действия распространяется от бугорка аксона к синаптическим выступам (концам аксонов); распространение в противоположном направлении — известное как антидромная проводимость — очень редко. Однако, если лабораторный аксон стимулируется в его середине, обе половины аксона остаются «свежими», т. Е. Необожженными; тогда будут генерироваться два потенциала действия: один движется к бугорку аксона, а другой — к синаптическим выступам.
Миелиновая и скачкообразная проводимость
При скачкообразной проводимости потенциал действия в одном узле Ранвье вызывает внутренние токи, которые деполяризуют мембрану в следующем узле, провоцируя там новый потенциал действия; потенциал действия, кажется, «перепрыгивает» от узла к узлу.
Чтобы обеспечить быструю и эффективную передачу электрических сигналов в нервной системе, определенные нейрональные аксоны покрыты миелиновыми оболочками. Миелин — это многослойная мембрана, которая охватывает аксон сегментами, разделенными интервалами, известными как узлы Ранвье . Он вырабатывается специализированными клетками: шванновскими клетками исключительно периферической нервной системы и олигодендроцитами исключительно центральной нервной системой . Миелиновая оболочка снижает емкость мембраны и увеличивает сопротивление мембраны в межузловых интервалах, тем самым обеспечивая быстрое скачкообразное движение потенциалов действия от узла к узлу. Миелинизация встречается в основном у позвоночных , но аналогичная система была обнаружена у нескольких беспозвоночных, таких как некоторые виды креветок . Не все нейроны у позвоночных миелинизированы; например, аксоны нейронов, составляющих автономную нервную систему, обычно не миелинизированы.
Миелин предотвращает попадание ионов в аксон или его выход из миелинизированных сегментов. Как правило, миелинизация увеличивает скорость проведения потенциалов действия и делает их более энергоэффективными. Независимо от того, скачкообразно или нет, средняя скорость проведения потенциала действия колеблется от 1 метра в секунду (м / с) до более 100 м / с и, как правило, увеличивается с увеличением диаметра аксона.
Потенциалы действия не могут распространяться через мембрану в миелинизированных сегментах аксона. Однако ток переносится цитоплазмой, чего достаточно для деполяризации первого или второго последующего узла Ранвье . Вместо этого ионный ток от потенциала действия в одном узле Ранвье провоцирует другой потенциал действия в следующем узле; это очевидное «скачкообразное изменение» потенциала действия от узла к узлу известно как скачкообразная проводимость . Хотя механизм скачкообразной проводимости был предложен в 1925 году Ральфом Лилли, первые экспериментальные доказательства скачкообразной проводимости были получены от Ичиджи Тасаки и Тайджи Такеучи, а также от Эндрю Хаксли и Роберта Стэмпфли. Напротив, в немиелинизированных аксонах потенциал действия провоцирует другой потенциал в мембране, непосредственно прилегающей к нему, и непрерывно движется вниз по аксону, как волна.
Сравнение скоростей проводимости миелинизированных и немиелинизированных аксонов у кошек . Скорость проводимости v миелинизированных нейронов изменяется примерно линейно с диаметром аксона d (то есть v ∝ d ), тогда как скорость немиелинизированных нейронов изменяется примерно как квадратный корень ( v ∝ √ d ). Красная и синяя кривые соответствуют экспериментальным данным, а пунктирные линии — их теоретическим экстраполяциям.
Миелин имеет два важных преимущества: высокая скорость проводимости и энергоэффективность. Для аксонов больше минимального диаметра (примерно 1 микрометр ) миелинизация увеличивает скорость проводимости потенциала действия, как правило, в десять раз. И наоборот, для данной скорости проводимости миелинизированные волокна меньше, чем их немиелинизированные аналоги. Например, потенциалы действия движутся примерно с одинаковой скоростью (25 м / с) в миелинизированном аксоне лягушки и немиелинизированном гигантском аксоне кальмара , но аксон лягушки имеет примерно в 30 раз меньший диаметр и в 1000 раз меньшую площадь поперечного сечения. . Кроме того, поскольку ионные токи ограничиваются узлами Ранвье, гораздо меньше ионов «просачивается» через мембрану, экономя метаболическую энергию. Эта экономия является значительным селективным преимуществом , поскольку нервная система человека использует примерно 20% метаболической энергии организма.
Длина миелинизированных сегментов аксонов важна для успеха скачкообразной проводимости. Они должны быть как можно более длинными, чтобы максимизировать скорость проведения, но не настолько длинными, чтобы приходящий сигнал был слишком слабым, чтобы вызвать потенциал действия в следующем узле Ранвье. В природе миелинизированные сегменты обычно достаточно длинные для того, чтобы пассивно распространяемый сигнал прошел по крайней мере два узла, сохраняя при этом достаточную амплитуду, чтобы запустить потенциал действия во втором или третьем узле. Таким образом, коэффициент безопасности скачкообразной проводимости высок, что позволяет передаче обходить узлы в случае травмы. Однако потенциалы действия могут преждевременно заканчиваться в определенных местах, где коэффициент безопасности низкий, даже в немиелинизированных нейронах; распространенным примером является точка ветвления аксона, где он делится на два аксона.
Некоторые заболевания разрушают миелин и нарушают скачкообразную проводимость, снижая скорость проведения потенциалов действия. Самым известным из них является рассеянный склероз , при котором расщепление миелина нарушает скоординированные движения.
Теория кабеля
Упрощенный вид нейронного волокна в теории кабеля. Связанные RC-цепи соответствуют соседним сегментам пассивного нейрита . Внеклеточные сопротивления r e (аналоги внутриклеточных сопротивлений r i ) не показаны, поскольку они обычно пренебрежимо малы; можно предположить, что внеклеточная среда имеет одинаковое напряжение повсюду.
Поток токов внутри аксона может быть количественно описан теорией кабеля и ее разработками, такими как компартментальная модель. Теория кабеля была разработана в 1855 году лордом Кельвином для моделирования трансатлантического телеграфного кабеля и была показана Ходжкином и Раштоном в 1946 году для нейронов . В простой теории кабеля нейрон рассматривается как электрически пассивный, идеально цилиндрический передающий кабель, который можно описать уравнением в частных производных
где V ( x , t ) — напряжение на мембране в момент времени t и положение x по длине нейрона, и где λ и τ — характерная длина и временные масштабы, на которых эти напряжения спадают в ответ на стимул. . Обращаясь к принципиальной схеме справа, эти масштабы можно определить по сопротивлению и емкости на единицу длины.
Эти масштабы времени и длины можно использовать для понимания зависимости скорости проводимости от диаметра нейрона в немиелинизированных волокнах. Например, временной масштаб τ увеличивается как с сопротивлением мембраны r m, так и с емкостью c m . По мере увеличения емкости для получения заданного трансмембранного напряжения необходимо передать больше заряда (по уравнению Q = CV ); по мере увеличения сопротивления в единицу времени передается меньше заряда, что замедляет уравновешивание. Аналогичным образом, если внутреннее сопротивление на единицу длины r i ниже в одном аксоне, чем в другом (например, потому что радиус первого больше), длина пространственного распада λ становится больше, а скорость проводимости потенциала действия должен увеличиваться. Если трансмембранное сопротивление r m увеличивается, это снижает средний ток «утечки» через мембрану, аналогично увеличивая λ , увеличивая скорость проводимости.
Прекращение
Химические синапсы
В общем, потенциалы действия, которые достигают синаптических выступов, вызывают выброс нейротрансмиттера в синаптическую щель. Нейротрансмиттеры — это небольшие молекулы, которые могут открывать ионные каналы в постсинаптической клетке; большинство аксонов имеют один и тот же нейромедиатор на всех концах. Прибытие потенциала действия открывает чувствительные к напряжению кальциевые каналы в пресинаптической мембране; приток кальция заставляет везикулы, заполненные нейротрансмиттером, мигрировать к поверхности клетки и высвобождать свое содержимое в синаптическую щель . Этот сложный процесс подавляется нейротоксинами, тетаноспазмином и ботулиническим токсином , которые вызывают столбняк и ботулизм соответственно.
Электрические синапсы
Некоторые синапсы обходятся без «посредника» нейротрансмиттера и соединяют вместе пресинаптические и постсинаптические клетки. Когда потенциал действия достигает такого синапса, ионные токи, текущие в пресинаптическую клетку, могут пересекать барьер двух клеточных мембран и проникать в постсинаптическую клетку через поры, известные как коннексоны . Таким образом, ионные токи пресинаптического потенциала действия могут напрямую стимулировать постсинаптическую клетку. Электрические синапсы обеспечивают более быструю передачу, потому что они не требуют медленной диффузии нейротрансмиттеров через синаптическую щель. Таким образом, электрические синапсы используются всякий раз , когда быстрая реакция и координация времени имеют решающее значение, так как в эвакуационных рефлексов , в сетчатке из позвоночных , и сердце .
Нервно-мышечные соединения
Особый случай химического синапса является нервно — мышечного соединения , в котором аксон о наличии двигательных нейронов оканчивается на мышечных волокон . В таких случаях высвобождаемый нейротрансмиттер представляет собой ацетилхолин , который связывается с рецептором ацетилхолина, интегральным мембранным белком в мембране ( сарколемме ) мышечного волокна. Однако ацетилхолин не остается связанным; скорее, он диссоциирует и гидролизуется ферментом ацетилхолинэстеразой , расположенным в синапсе. Этот фермент быстро снижает раздражение мышц, что позволяет деликатно регулировать степень и время мышечного сокращения. Некоторые яды инактивируют ацетилхолинэстеразу, чтобы предотвратить этот контроль, например, нервно-паралитические агенты зарин и табун , а также инсектициды диазинон и малатион .
Другие типы клеток
Потенциалы сердечного действия
Фазы сердечного действия. Резкое повышение напряжения («0») соответствует притоку ионов натрия, тогда как два спада («1» и «3», соответственно) соответствуют инактивации натриевых каналов и реполяризующему оттоку ионов калия. Характерное плато («2») является результатом открытия чувствительных к напряжению кальциевых каналов.
Потенциал сердечного действия отличается от потенциала действия нейронов наличием расширенного плато, при котором мембрана удерживается под высоким напряжением в течение нескольких сотен миллисекунд, прежде чем будет реполяризована током калия, как обычно. Это плато происходит из-за действия более медленного открытия кальциевых каналов и удержания напряжения на мембране около их равновесного потенциала даже после того, как натриевые каналы инактивированы.
Потенциал сердечного действия играет важную роль в координации сердечных сокращений. Сердечные клетки синоатриального узла обеспечивают потенциал кардиостимулятора, который синхронизирует работу сердца. Потенциалы действия этих клеток распространяются в атриовентрикулярный узел (АВ-узел) и через него, который обычно является единственным проводящим путем между предсердиями и желудочками . Потенциалы действия от АВ-узла проходят через пучок Гиса и оттуда к волокнам Пуркинье . И наоборот, аномалии потенциала сердечной деятельности — будь то из-за врожденной мутации или травмы — могут привести к патологиям человека, особенно к аритмиям . Некоторые противоаритмические препараты действуют на потенциал сердечного действия, такие как хинидин , лидокаин , бета-блокаторы и верапамил .
Потенциалы мышечного действия
Потенциал действия в нормальной клетке скелетных мышц аналогичен потенциалу действия в нейронах. Потенциалы действия возникают в результате деполяризации клеточной мембраны ( сарколеммы ), которая открывает чувствительные к напряжению натриевые каналы; они инактивируются, и мембрана реполяризуется за счет выходящего тока ионов калия. Потенциал покоя перед потенциалом действия обычно составляет -90 мВ, что несколько более отрицательно, чем у типичных нейронов. Потенциал действия мышцы длится примерно 2–4 мс, абсолютный рефрактерный период составляет примерно 1–3 мс, а скорость проводимости по мышце составляет примерно 5 м / с. Потенциал действия высвобождает ионы кальция , которые высвобождают тропомиозин и позволяют мышцам сокращаться. Потенциалы мышечного действия провоцируются прибытием пресинаптического нейронального потенциала действия в нервно-мышечное соединение , которое является общей мишенью для нейротоксинов .
Потенциалы действия растений
Клетки растений и грибов также электрически возбудимы. Принципиальное отличие от потенциалов действий животных является то , что деполяризация в растительных клетках не достигается путем поглощения положительных ионов натрия, но выделение отрицательных хлоридных ионов. В 1906 году Дж. К. Бозе опубликовал первые измерения потенциалов действия у растений, которые ранее были обнаружены Бурдоном-Сандерсоном и Дарвином. Увеличение количества ионов кальция в цитоплазме может быть причиной выброса анионов в клетку. Это делает кальций предшественником движений ионов, таких как приток отрицательных ионов хлора и отток положительных ионов калия, как это видно на листьях ячменя.
Первоначальный приток ионов кальция также вызывает небольшую клеточную деполяризацию, вызывая открытие потенциал-зависимых ионных каналов и позволяя полной деполяризации распространяться ионами хлорида.
Некоторые растения (например, Dionaea muscipula ) используют каналы, управляемые натрием, для управления движениями и, по сути, «счета». Dionaea muscipula , также известная как венерина мухоловка, встречается в субтропических болотах Северной и Южной Каролины. Когда в почве мало питательных веществ, мухоловка полагается на диету из насекомых и животных. Несмотря на исследования этого растения, отсутствует понимание молекулярной основы венерианских мухоловок и хищных растений в целом.
Тем не менее, было проведено множество исследований потенциалов действия и того, как они влияют на движение и часовой механизм венерианской мухоловки. Для начала, мембранный потенциал покоя венерианской мухоловки (-120 мВ) ниже, чем у животных клеток (обычно от -90 до -40 мВ). Более низкий потенциал покоя облегчает активацию потенциала действия. Таким образом, когда насекомое попадает в ловушку растения, оно запускает механорецептор, похожий на волосы. Затем этот рецептор активирует потенциал действия, который длится около 1,5 мс. В конечном итоге это вызывает увеличение количества положительных ионов кальция в клетке, слегка деполяризуя ее.
Однако мухоловка не закрывается после одного срабатывания. Вместо этого требуется активация 2 или более волосков. Если срабатывает только один волос, активация выдается как ложное срабатывание. Кроме того, вторые волосы должны быть активированы в течение определенного интервала времени (0,75 — 40 с), чтобы они зарегистрировались при первой активации. Таким образом, начинается накопление кальция и медленно спадает с первого триггера. Когда второй потенциал действия срабатывает в пределах временного интервала, он достигает порога кальция, чтобы деполяризовать клетку, закрывая ловушку на добыче за доли секунды.
Вместе с последующим высвобождением положительных ионов калия потенциал действия у растений включает осмотическую потерю соли (KCl). Принимая во внимание, что потенциал действия животных осмотически нейтрален, потому что равные количества поступающего натрия и выходящего калия осмотически компенсируют друг друга. Взаимодействие электрических и осмотических отношений в растительных клетках, по-видимому, возникло из-за осмотической функции электрической возбудимости у общих одноклеточных предков растений и животных в условиях меняющегося засоления. Кроме того, настоящая функция быстрой передачи сигнала рассматривается как новое достижение клеток многоклеточных животных в более стабильной осмотической среде. Вероятно, что известная сигнальная функция потенциалов действия у некоторых сосудистых растений (например, Mimosa pudica ) возникла независимо от таковой в возбудимых клетках многоклеточных животных.
В отличие от фазы подъема и пика, фаза спада и постгиперполяризация, по-видимому, в первую очередь зависят от катионов, которые не являются кальцием. Чтобы инициировать реполяризацию, клетке требуется перемещение калия из клетки посредством пассивного транспорта по мембране. Это отличается от нейронов, потому что движение калия не влияет на снижение мембранного потенциала; Фактически, для полной реполяризации растительной клетке требуется энергия в форме АТФ, чтобы способствовать высвобождению водорода из клетки — с использованием транспортера, широко известного как Н + -АТФаза.
Таксономическое распространение и эволюционные преимущества
Потенциалы действия обнаруживаются во всех многоклеточных организмах , включая растения , беспозвоночных, таких как насекомые , и позвоночных, таких как рептилии и млекопитающие . Губки , по-видимому, являются основным типом многоклеточных эукариот , который не передает потенциалы действия, хотя некоторые исследования показали, что эти организмы также имеют форму передачи электрических сигналов. Потенциал покоя, а также размер и продолжительность потенциала действия не сильно менялись с эволюцией, хотя скорость проводимости действительно сильно меняется в зависимости от диаметра аксона и миелинизации.
| Животное | Тип ячейки | Потенциал покоя (мВ) | Увеличение АД (мВ) | Длительность AP (мс) | Скорость проводимости (м / с) |
|---|---|---|---|---|---|
| Кальмар ( Лолиго ) | Гигантский аксон | −60 | 120 | 0,75 | 35 год |
| Дождевой червь ( Lumbricus ) | Срединное гигантское волокно | −70 | 100 | 1.0 | 30 |
| Таракан ( Periplaneta ) | Гигантское волокно | −70 | 80–104 | 0,4 | 10 |
| Лягушка ( Рана ) | Аксон седалищного нерва | От -60 до -80 | 110–130 | 1.0 | 7–30 |
| Кот ( Фелис ) | Спинальный мотонейрон | От -55 до -80 | 80–110 | 1–1,5 | 30–120 |
Учитывая его сохранение на протяжении эволюции, потенциал действия, кажется, дает эволюционные преимущества. Одна из функций потенциалов действия — это быстрая передача сигналов на большие расстояния внутри организма; скорость проводимости может превышать 110 м / с, что составляет одну треть скорости звука . Для сравнения, молекула гормона, переносимая кровотоком, движется со скоростью примерно 8 м / с в крупных артериях. Частью этой функции является тесная координация механических событий, таких как сокращение сердца. Вторая функция — это вычисление, связанное с его генерацией. Будучи сигналом «все или ничего», который не затухает с увеличением расстояния передачи, потенциал действия имеет те же преимущества, что и цифровая электроника . Интеграция различных дендритных сигналов на бугорке аксона и их пороговая обработка для формирования сложной последовательности потенциалов действия — это еще одна форма вычислений, которая используется биологически для формирования центральных генераторов паттернов и имитируется в искусственных нейронных сетях .
Считается, что общий предок прокариот / эукариот, который жил около четырех миллиардов лет назад, имел каналы, управляемые напряжением. Эта функциональность, вероятно, в какой-то более поздний момент была перекрестной для обеспечения механизма связи. Даже современные одноклеточные бактерии могут использовать потенциалы действия для связи с другими бактериями в той же биопленке.
Экспериментальные методы
Изучение потенциалов действия потребовало разработки новых экспериментальных методов. Первоначальная работа, до 1955 г., была выполнена в основном Аланом Ллойдом Ходжкином и Эндрю Филдингом Хаксли , которые вместе с Джоном Кэрью Экклзом были удостоены Нобелевской премии 1963 г. по физиологии и медицине за их вклад в описание ионной основы нервной системы. проводимость. Он был сосредоточен на трех целях: изолировать сигналы от отдельных нейронов или аксонов, разработать быструю, чувствительную электронику и уменьшить электроды, достаточные для регистрации напряжения внутри одной клетки.
Первая проблема была решена путем изучения гигантских аксонов, обнаруженных в нейронах кальмаров ( Loligo forbesii и Doryteuthis pealeii , в то время классифицированных как Loligo pealeii ). Эти аксоны настолько большие в диаметре (примерно на 1 мм, или в 100 раз больше, чем у типичного нейрона), что их можно увидеть невооруженным глазом, что позволяет легко извлекать их и манипулировать ими. Однако они не являются репрезентативными для всех возбудимых клеток, и многие другие системы с потенциалами действия были изучены.
Вторая проблема была решена с помощью решающей разработки зажима напряжения , который позволил экспериментаторам изучать ионные токи, лежащие в основе потенциала действия изолированно, и устранил ключевой источник электронного шума , ток I C, связанный с емкостью C мембраны. . Поскольку ток равен C, умноженному на скорость изменения трансмембранного напряжения V m , решение заключалось в разработке схемы, которая поддерживала бы V m фиксированным (нулевая скорость изменения) независимо от токов, протекающих через мембрану. Таким образом, ток, необходимый для поддержания постоянного значения V m, является прямым отражением тока, протекающего через мембрану. Другие достижения в области электроники включали использование клеток Фарадея и электроники с высоким входным сопротивлением , так что само измерение не влияло на измеряемое напряжение.
Третья проблема — получение электродов, достаточно малых, чтобы регистрировать напряжения в пределах одного аксона, не нарушая его, — была решена в 1949 году с изобретением стеклянного микропипеточного электрода, который быстро был принят другими исследователями. Усовершенствования этого метода позволяют изготавливать наконечники электродов толщиной до 100 Å (10 нм ), что также обеспечивает высокий входной импеданс. Потенциалы действия также могут быть зарегистрированы с помощью небольших металлических электродов, размещенных рядом с нейроном, с помощью нейрочипов, содержащих EOSFET , или оптически с помощью красителей, чувствительных к Ca 2+ или к напряжению.
Как показал электрод патч-зажим , ионный канал имеет два состояния: открытый (высокая проводимость) и закрытый (низкая проводимость).
В то время как стекло микропипетки электроды измеряют сумму токов , проходящих через множество ионных каналов, изучение электрических свойств одного ионного канала стало возможным в 1970 — х с развитием зажима патч с помощью Erwin Neher и Берт Сакман . За это открытие они были удостоены Нобелевской премии по физиологии и медицине в 1991 году. Фиксация пластыря подтвердила, что ионные каналы имеют дискретные состояния проводимости, такие как открытые, закрытые и инактивированные.
В последние годы были разработаны оптические технологии визуализации для измерения потенциалов действия либо путем одновременной записи на нескольких участках, либо с ультрапространственным разрешением. С помощью чувствительных к напряжению красителей потенциалы действия были оптически записаны с крошечного участка мембраны кардиомиоцитов .
Нейротоксины
Некоторые нейротоксины , как естественные, так и синтетические, предназначены для блокирования потенциала действия. Тетродотоксин из Pufferfish и сакситоксина от Gonyaulax (в динофлагеллятном роде , ответственном за « красные приливы ») потенциалов действия блока путем ингибирования напряжения чувствительного натриевых каналов; аналогично, дендротоксин из черного мамба змея подавляет напряжение-чувствительных калиевых каналов. Такие ингибиторы ионных каналов служат важной исследовательской цели, позволяя ученым по желанию «отключать» определенные каналы, тем самым изолируя вклад других каналов; они также могут быть полезны для очистки ионных каналов с помощью аффинной хроматографии или для анализа их концентрации. Однако такие ингибиторы также вырабатывают эффективные нейротоксины и рассматриваются для использования в качестве химического оружия . Нейротоксины, нацеленные на ионные каналы насекомых, оказались эффективными инсектицидами ; Одним из примеров является синтетический перметрин , который продлевает активацию натриевых каналов, участвующих в потенциалах действия. Ионные каналы насекомых достаточно отличаются от своих собратьев у человека, поэтому у людей мало побочных эффектов.
История
Роль электричества в нервной системе животных впервые была обнаружена в расчлененных лягушка от Луиджи Гальвани , который изучал его с 1791 по 1797 результатам Гальвани стимулируется Алессандро Вольта развивать груду Voltaic -The раннего известного электрического аккумулятор -с , который он изучал электричество животных (например, электрические угри ) и физиологические реакции на приложенное напряжение постоянного тока .
Ученые XIX века изучали распространение электрических сигналов по целым нервам (т. Е. Пучкам нейронов ) и продемонстрировали, что нервная ткань состоит из клеток , а не из взаимосвязанной сети трубок ( ретикулума ). Карло Маттеуччи продолжил исследования Гальвани и продемонстрировал, что клеточные мембраны имеют напряжение на себе и могут производить постоянный ток . Работа Маттеуччи вдохновила немецкого физиолога Эмиля дю Буа-Реймона , который открыл потенциал действия в 1843 году. Скорость проведения потенциалов действия была впервые измерена в 1850 году другом дю Буа-Реймона, Германом фон Гельмгольцем . Чтобы установить, что нервная ткань состоит из отдельных клеток, испанский врач Сантьяго Рамон-и-Кахаль и его ученики использовали краситель, разработанный Камилло Гольджи, чтобы выявить бесчисленные формы нейронов, которые они тщательно визуализировали. За свои открытия Гольджи и Рамон-и-Кахаль были удостоены Нобелевской премии по физиологии 1906 года . Их работа разрешила давние противоречия в нейроанатомии 19 века; Сам Гольджи выступал за сетевую модель нервной системы.
ХХ век был важной эпохой для электрофизиологии. В 1902 и 1912 годах Юлиус Бернштейн выдвинул гипотезу о том, что потенциал действия является результатом изменения проницаемости аксональной мембраны для ионов. Гипотезу Бернштейна подтвердили Кен Коул и Ховард Кертис, которые показали, что проводимость мембраны увеличивается во время потенциала действия. В 1907 году Луи Лапик предположил, что потенциал действия генерируется при превышении порога, что позже будет показано как продукт динамических систем ионных проводимостей. В 1949 году Алан Ходжкин и Бернард Кац уточнили гипотезу Бернштейна, посчитав, что аксональная мембрана может иметь разную проницаемость для разных ионов; в частности, они продемонстрировали решающую роль проницаемости для натрия для потенциала действия. Они сделали первую фактическую запись электрических изменений мембраны нейронов, которые опосредуют потенциал действия. Кульминацией этого направления исследований стали пять работ Ходжкина, Каца и Эндрю Хаксли 1952 года , в которых они применили метод фиксации напряжения для определения зависимости проницаемости аксональной мембраны для ионов натрия и калия от напряжения и времени, на основании чего они смогли количественно реконструировать потенциал действия. Ходжкин и Хаксли коррелировали свойства своей математической модели с дискретными ионными каналами, которые могли существовать в нескольких различных состояниях, включая «открытые», «закрытые» и «инактивированные». Их гипотезы были подтверждены в середине 1970-х и 1980-х Эрвином Неером и Бертом Сакманном , которые разработали метод фиксации заплат для исследования состояний проводимости отдельных ионных каналов. В 21-м веке исследователи начинают понимать структурную основу этих состояний проводимости и селективности каналов для их разновидностей ионов с помощью кристаллических структур с атомным разрешением , измерений расстояния флуоресценции и исследований криоэлектронной микроскопии .
Юлиус Бернштейн был также первым, кто ввел уравнение Нернста для потенциала покоя через мембрану; это было обобщено Дэвидом Э. Голдманом до одноименного уравнения Голдмана в 1943 году. Натрий-калиевый насос был идентифицирован в 1957 году, и его свойства постепенно выяснились, что привело к определению его структуры атомного разрешения с помощью рентгеновской кристаллографии . Кристаллические структуры соответствующих ионных насосов также были решены, что дает более широкое представление о том, как работают эти молекулярные машины .
Количественные модели
Эквивалентная электрическая схема для модели потенциала действия Ходжкина – Хаксли. I m и V m представляют собой ток через небольшой участок мембраны и напряжение на небольшом участке мембраны соответственно. С т представляет собой емкость мембранного пластыря, тогда как четыре г» ы представляет проводимости четыре типов ионов. Две проводимости слева, для калия (K) и натрия (Na), показаны стрелками, указывающими на то, что они могут изменяться в зависимости от приложенного напряжения, что соответствует чувствительным к напряжению ионным каналам . Две проводимости справа помогают определить мембранный потенциал покоя .
Математические и вычислительные модели необходимы для понимания потенциала действия и предлагают прогнозы, которые могут быть проверены на экспериментальных данных, обеспечивая строгую проверку теории. Самой важной и точной из ранних нейронных моделей является модель Ходжкина – Хаксли , которая описывает потенциал действия с помощью совокупности четырех обыкновенных дифференциальных уравнений (ОДУ). Хотя модель Ходжкина-Хаксли может быть упрощением с некоторыми ограничениями по сравнению с реалистической нервной мембраны , как она существует в природе, ее сложность вдохновила несколько четно-более-упрощенные модели, такие как модель Морриса-Lecar и модели ФитцХью-Нагумо , оба из которых имеют только два связанных ODE. Свойства моделей Ходжкина – Хаксли и ФитцХью – Нагумо и их родственников, таких как модель Бонхёффера – Ван дер Поля, хорошо изучены в математике, вычислениях и электронике. Однако простые модели генераторного потенциала и потенциала действия не могут точно воспроизвести околопороговую частоту и форму нервных импульсов , особенно для механорецепторов, таких как тельца Пачини . Более современные исследования были сосредоточены на более крупных и интегрированных системах; объединяя модели потенциала действия с моделями других частей нервной системы (например, дендритов и синапсов), исследователи могут изучать нейронные вычисления и простые рефлексы , такие как рефлексы бегства и другие, контролируемые центральными генераторами паттернов .
Смотрите также
- Возбуждение разрыва анода
- Биоэлектричество
- Биологическая модель нейрона
- Разрыв
- Центральный генератор шаблонов
- Хронакси
- Батарея лягушки
- Нейронная аккомодация
- Единичная запись
- Солитонная модель в нейробиологии
Примечания
- ^ В общем, хотя это простое описание инициирования потенциала действия является точным, оно не объясняет такие явления, как блокировка возбуждения (способность препятствовать тому, чтобы нейроны вызывали потенциалы действия, стимулируя их большими шагами тока) и способность вызывать потенциалы действия с помощью кратковременно гиперполяризует мембрану. Однако, анализируя динамику системы натриевых и калиевых каналов в мембранном участке с использованием компьютерных моделей , эти явления легко объяснимы.
- ^ Обратите внимание, что эти волокна Пуркинье являются мышечными волокнами и не связаны с клетками Пуркинье , которые представляют собой нейроны, обнаруженные в мозжечке .
использованная литература
Сноски
журнальные статьи
Книги
- Андерсон JA, Розенфельд E, ред. (1988). Нейрокомпьютеры: основы исследований . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-01097-9. LCCN 87003022 . OCLC 15860311 .
- Бернштейн Дж (1912). Elektrobiologie, die Lehre von den elektrischen Vorgängen im Organismus auf moderner Grundlage dargestellt [ Электробиология, изучение электрических процессов в организме, представленных на современной основе ]. Брауншвейг: Vieweg und Sohn. LCCN 12027986 . OCLC 11358569 .
- Бауэр Дж. М., Биман Д. (1995). Книга GENESIS: Изучение реалистичных нейронных моделей с помощью общей системы нейронной симуляции . Санта-Клара, Калифорния: TELOS. ISBN 978-0-387-94019-9. LCCN 94017624 . OCLC 30518469 .
- Бразье М.А. (1961). История электрической активности мозга . Лондон: Питман. LCCN 62001407 . OCLC 556863 .
- Баллок TH , Хорридж Г.А. (1965). Строение и функции нервной системы беспозвоночных . Серия книг по биологии. Сан-Франциско: WH Freeman. LCCN 65007965 . OCLC 558128 .
- Баллок Т.Х. , Орканд Р., Гриннелл А. (1977). Введение в нервные системы . Серия книг по биологии. Сан-Франциско: WH Freeman. ISBN 978-0-7167-0030-2. LCCN 76003735 . OCLC 2048177 .
- Поле J, изд. (1959). Справочник по физиологии: критическое, всестороннее изложение физиологических знаний и концепций: Раздел 1: Нейрофизиология . 1 . Вашингтон, округ Колумбия: Американское физиологическое общество. LCCN 60004587 . OCLC 830755894 .
- Ганонг, ВФ (1991). Обзор медицинской физиологии . Обзор медицинской физиологии Ганонга (15-е изд.). Норуолк, штат Коннектикут: Эпплтон и Ланге. ISBN 978-0-8385-8418-7. ISSN 0892-1253 . LCCN 87642343 . OCLC 23761261 .
- Guckenheimer J, Holmes P, ред. (1986). Нелинейные колебания, динамические системы и бифуркации векторных полей . Прикладные математические науки. 42 (2-е изд.). Нью-Йорк: Springer Verlag. ISBN 978-0-387-90819-9. OCLC 751129941 .
- Хоппенстедт (1986). Введение в математику нейронов . Кембриджские исследования по математической биологии. 6 . Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-31574-6. LCCN 85011013 . OCLC 12052275 .
- Юнге Д. (1981). Возбуждение нервов и мышц (2-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-410-2. LCCN 80018158 . OCLC 6486925 .
- Кеттенманн Х., Грантин Р., ред. (1992). Практические электрофизиологические методы: руководство для исследований in vitro в нейробиологии позвоночных . Нью-Йорк: Вили. ISBN 978-0-471-56200-9. LCCN 92000179 . OCLC 25204689 .
- Кейнс RD , Эйдли DJ (1991). Нерв и мышцы (2-е изд.). Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-41042-7. LCCN 90015167 . OCLC 25204483 .
- Кох С , Сегев I, ред. (1989). Методы нейронного моделирования: от синапсов к сетям . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-11133-1. LCCN 88008279 . OCLC 18384545 .
- Lavallée M, Schanne OF, Hébert NC, eds. (1969). Стеклянные микроэлектроды . Нью-Йорк: Вили. ISBN 978-0-471-51885-3. LCCN 68009252 . OCLC 686 .
- Маккалок WS (1988). Воплощения разума . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-63114-3. LCCN 88002987 . OCLC 237280 .
- McHenry LC, Garrison FH (1969). История неврологии Гарнизона . Спрингфилд, Иллинойс: Чарльз С. Томас. OCLC 429733931 .
- Silverthorn DU (2010). Физиология человека: комплексный подход (5-е изд.). Сан-Франциско: Пирсон. ISBN 978-0-321-55980-7. LCCN 2008050369 . OCLC 268788623 .
- Spanswick RM, Lucas WJ, Dainty J, ред. (1980). Растительный мембранный транспорт: актуальные концептуальные вопросы . Разработки в биологии растений. 4 . Амстердам: Elsevier Biomedical Press. ISBN 978-0-444-80192-0. LCCN 79025719 . OCLC 5799924 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, Williams SM (2001). «Освобождение передатчиков из синаптических пузырьков» . Неврология (2-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-742-4. LCCN 00059496 . OCLC 806472664 .
- Purves D, Augustine GJ, Fitzpatrick D, Hall WC, Lamantia AS, McNamara JO, White LE (2008). Неврология (4-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-697-7. LCCN 2007024950 . OCLC 144771764 .
- Рике Г.Н., Познанский Р.Р., Спорнс О., Розенберг-младший, Линдси К.А., ред. (2005). Моделирование в нейронауках: от биологических систем до нейромиметической робототехники . Бока-Ратон, Флорида: Тейлор и Фрэнсис. ISBN 978-0-415-32868-5. LCCN 2005298022 . OCLC 489024131 .
- Шмидт-Нильсен К. (1997). Физиология животных: адаптация и окружающая среда (5-е изд.). Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-57098-5. LCCN 96039295 . OCLC 35744403 .
- Шванн HP, изд. (1969). Биологическая инженерия . Межвузовская серия электроники. 9 . Нью-Йорк: Макгроу-Хилл. ISBN 978-0-07-055734-5. LCCN 68027513 . OCLC 51993 .
- Стивенс CF (1966). Нейрофизиология: Учебник . Нью-Йорк: Джон Уайли и сыновья. ISBN 9780471824367. LCCN 66015872 . OCLC 1175605 .
- Ваксман С.Г., изд. (2007). Молекулярная неврология . Берлингтон, Массачусетс: Elsevier Academic Press. ISBN 978-0-12-369509-3. LCCN 2008357317 . OCLC 154760295 .
- Worden FG, Swazey JP, Adelman G, ред. (1975). Неврология, Пути открытий . Кембридж, Массачусетс: MIT Press. ISBN 978-0-262-23072-8. LCCN 75016379 . OCLC 1500233 .
веб-страница
дальнейшее чтение
- Эйдли DJ, Stanfield PR (1996). Ионные каналы: молекулы в действии . Кембридж: Издательство Кембриджского университета. ISBN 978-0-521-49882-1.
- Медведь М.Ф., Коннорс Б.В., Парадизо, Массачусетс (2001). Неврология: изучение мозга . Балтимор: Липпинкотт. ISBN 0-7817-3944-6.
- Клей-младший (май 2005 г.). «Еще раз о возбудимости аксонов» . Прогресс в биофизике и молекулярной биологии . 88 (1): 59–90. DOI : 10.1016 / j.pbiomolbio.2003.12.004 . PMID 15561301 .
- Deutsch S, Micheli-Tzanakou E (1987). Нейроэлектрические системы . Нью-Йорк: Издательство Нью-Йоркского университета. ISBN 0-8147-1782-9.
- Хилле Б. (2001). Ионные каналы возбудимых мембран (3-е изд.). Сандерленд, Массачусетс: Sinauer Associates. ISBN 978-0-87893-321-1.
- Джонстон Д., Ву С.М. (1995). Основы клеточной нейрофизиологии . Кембридж, Массачусетс: Книга Брэдфорда, MIT Press. ISBN 0-262-10053-3.
- Кандел Э. Р. , Шварц Дж. Х., Джессел Т. М. (2000). Принципы нейронологии (4-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-8385-7701-6.
- Миллер C (1987). «Как работают белки ионных каналов». В Качмарек Л.К., Левитан И.Б. (ред.). Нейромодуляция: биохимический контроль возбудимости нейронов . Нью-Йорк: Издательство Оксфордского университета. С. 39–63. ISBN 978-0-19-504097-5.
- Нельсон Д.Л., Кокс М.М. (2008). Принципы биохимии Ленингера (5-е изд.). Нью-Йорк: WH Freeman. ISBN 978-0-7167-7108-1.
внешние ссылки
Этот аудиофайл был создан на основе редакции этой статьи от 22 июня 2005 г. и не отражает последующих правок.
- Ионный поток в потенциалах действия в Blackwell Publishing
- Распространение потенциала действия в миелинизированных и немиелинизированных аксонах в Blackwell Publishing
- Генерация AP в клетках сердца и генерация AP в нейронных клетках
- Мембранный потенциал покоя из Life: The Science of Biology , WK Purves, D Sadava, GH Orians и HC Heller, 8-е издание, Нью-Йорк: WH Freeman, ISBN 978-0-7167-7671-0 .
- Ионное движение и напряжение Гольдмана для произвольных концентраций ионов в Университете Аризоны
- Мультфильм, иллюстрирующий потенциал действия
- Распространение потенциала действия
- Создание потенциала действия: моделирование ограничения тока и напряжения
- Программное обеспечение с открытым исходным кодом для моделирования нейрональных и сердечных потенциалов действия на SourceForge.net
- Introduction to the Action Potential , Neuroscience Online (электронный учебник неврологии, подготовленный Медицинской школой UT в Хьюстоне)
- Khan Academy: Электротоника и потенциал действия
Потенциал действия — волна возбуждения, перемещающаяся по мембране живой клетки в процессе передачи нервного сигнала. По сути своей представляет электрический разряд — быстрое кратковременное изменение потенциала на небольшом участке мембраны возбудимой клетки (нейрона, мышечного волокна или железистой клетки), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к соседним участкам мембраны, тогда как его внутренняя поверхность становится положительно заряженной по отношению к соседним участкам мембраны. Потенциал действия является физической основой нервного или мышечногоимпульса, играющего сигнальную (регуляторную) роль.
Рис. 1. Схема распределения зарядов по разные стороны мембраны возбудимой клетки в спокойном состоянии (A) и при возникновении потенциала действия (B) (см. объяснения в тексте)
Потенциалы действия могут различаться по своим параметрам в зависимости от типа клетки и даже на различных участках мембраны одной и той же клетки. Наиболее характерный пример различий: потенциал действия сердечной мышцыи потенциал действия большинства нейронов. Тем не менее, в основе любого потенциала действия лежат следующие явления:
- Мембрана живой клетки поляризована — её внутренняя поверхность заряжена отрицательно по отношению к внешней благодаря тому, что в растворе возле её внешней поверхности находится бо́льшее количество положительно заряженных частиц (катионов), а возле внутренней поверхности — бо́льшее количество отрицательно заряженных частиц (анионов).
- Мембрана обладает избирательной проницаемостью — её проницаемость для различных частиц (атомов или молекул) зависит от их размеров, электрического заряда и химических свойств.
- Мембрана возбудимой клетки способна быстро менять свою проницаемостъ для определённого вида катионов, вызывая переход положительного заряда с внешней стороны на внутреннюю (Рис.1).
Первые два свойства характерны для всех живых клеток. Третье же является особенностью клеток возбудимых тканей и причиной, по которой их мембраны способны генерировать и проводить потенциалы действия.
- Фазы потенциала действия
- Предспайк — процесс медленной деполяризации мембраны до критического уровня деполяризации (местное возбуждение, локальный ответ).
- Пиковый потенциал, или спайк, состоящий из восходящей части (деполяризация мембраны) и нисходящей части (реполяризация мембраны).
- Отрицательный следовой потенциал — от критического уровня деполяризации до исходного уровня поляризации мембраны (следовая деполяризация).
- Положительный следовой потенциал — увеличение мембранного потенциала и постепенное возвращение его к исходной величине (следовая гиперполяризация).
Общие положения
Поляризация мембраны живой клетки обусловлена отличием ионного состава с её внутренней и наружной стороны. Когда клетка находится в спокойном (невозбуждённом) состоянии, ионы по разные стороны мембраны создают относительно стабильную разность потенциалов, называемую потенциалом покоя. Если ввести внутрь живой клетки электрод и измерить мембранный потенциал покоя, он будет иметь отрицательное значение (порядка −70 — −90 мВ). Это объясняется тем, что суммарный заряд на внутренней стороне мембраны существенно меньше, чем на внешней, хотя с обеих сторон содержатся и катионы, и анионы. Снаружи — на порядок больше ионов натрия, кальция и хлора, внутри — ионов калия и отрицательно заряженных белковыхмолекул, аминокислот, органических кислот, фосфатов, сульфатов. Надо понимать, что речь идёт именно о заряде поверхности мембраны — в целом среда и внутри, и снаружи клетки заряжена нейтрально.
Потенциал мембраны может изменяться под действием различных стимулов. Искусственным стимулом может служить электрический ток, подаваемый на внешнюю или внутреннюю сторону мембраны через электрод. В естественных условиях стимулом часто служит химический сигнал от соседних клеток, поступающий черезсинапс или путём диффузной передачи через межклеточную среду. Смещение мембранного потенциала может происходить в отрицательную (гиперполяризация) или положительную (деполяризация) сторону.
В нервной ткани потенциал действия, как правило, возникает при деполяризации — если деполяризация мембраны нейрона достигает некоторого порогового уровня или превышает его, клетка возбуждается, и от её тела к аксонам и дендритам распространяется волна электрического сигнала. (В реальных условиях на теле нейрона обычно возникают постсинаптические потенциалы, которые сильно отличаются от потенциала действия по своей природе — например, они не подчиняются принципу «всё или ничего». Эти потенциалы преобразуются в потенциал действия на особом участке мембраны — аксонном холмике, так что потенциал действия не распространяется на дендриты).
Это обусловлено тем, что на мембране клетки находятся ионные каналы — белковые молекулы, образующие в мембране поры, через которые ионы могут проходить с внутренней стороны мембраны на наружную и наоборот. Большинство каналов ионоспецифичны — натриевый канал пропускает практически только ионы натрия и не пропускает другие (это явление называют селективностью). Мембрана клеток возбудимых тканей (нервной и мышечной) содержит большое количество потенциал-зависимых ионных каналов, способных быстро реагировать на смещение мембранного потенциала. Деполяризация мембраны в первую очередь вызывает открытие потенциал-зависимых натриевых каналов. Когда одновременно открывается достаточно много натриевых каналов, положительно заряженные ионы натрия устремляются через них на внутреннюю сторону мембраны. Движущая сила в данном случае обеспечивается градиентом концентрации (с внешней стороны мембраны находится намного больше положительно заряженных ионов натрия, чем внутри клетки) и отрицательным зарядом внутренней стороны мембраны (см. Рис. 2). Поток ионов натрия вызывает ещё бо́льшее и очень быстрое изменение мембранного потенциала, которое и называют потенциалом действия (в специальной литературе обозначается ПД).
Рис. 3. Простейшая схема, демонстрирующая мембрану с двумя натриевыми каналами в открытом и закрытом состоянии, соответственно
Согласно закону «всё-или-ничего» мембрана клетки возбудимой ткани либо не отвечает на стимул совсем, либо отвечает с максимально возможной для неё на данный момент силой. То есть, если стимул слишком слаб и порог не достигнут, потенциал действия не возникает совсем; в то же время, пороговый стимул вызовет потенциал действия такой же амплитуды, как и стимул, превышающий пороговый. Это отнюдь не означает, что амплитуда потенциала действия всегда одинакова — один и тот же участок мембраны, находясь в разных состояниях, может генерировать потенциалы действия разной амплитуды.
После возбуждения нейрон на некоторое время оказывается в состоянии абсолютной рефрактерности, когда никакие сигналы не могут его возбудить снова, затем входит в фазу относительной рефрактерности, когда его могут возбудить исключительно сильные сигналы (при этом амплитуда ПД будет ниже, чем обычно). Рефрактерный период возникает из-за инактивации быстрого натриевого тока, то есть инактивации натриевых каналов (см. ниже).
Распространение потенциала действия
Распространение потенциала действия по немиелинизированным волокнам
По немиелинизированному волокну ПД распространяется непрерывно. Проведение нервного импульса начинается с распространением электрического поля. Возникший ПД за счет электрического поля способен деполяризовать мембрану соседнего участка до критического уровня, в результате чего на соседнем участке генерируются новые ПД. Сами ПД не перемещаются, они исчезают там же, где возникают. Главную роль в возникновении нового ПД играет предыдущий.
Если внутриклеточным электродом раздражать аксон посередине, то ПД будет распространяться в обоих направлениях. Обычно же ПД распространяется по аксону в одном направлении (от тела нейрона к нервным окончаниям), хотя деполяризация мембраны происходит по обе стороны от участка, где в данный момент возник ПД. Одностороннее проведение ПД обеспечивается свойствами натриевых каналов — после открывания они на некоторое время инактивируются и не могут открыться ни при каких значениях мембранного потенциала (свойство рефрактерности). Поэтому на ближнем к телу клетки участке, где до этого уже «прошел» ПД, он не возникает.
При прочих равных условиях распространение ПД по аксону происходит тем быстрее, чем больше диаметр волокна. По гигантским аксонам кальмара ПД может распространяться почти с такой же скоростью, как и по миелинизированным волокнам позвоночных (около 100 м/c).
Распространение потенциала действия по миелинизированным волокнам
По миелинизированному волокну ПД распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье ПД возбуждает 2-ой, 3-ий, 4-ый и даже 5-ый, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Это увеличивает скорость распространения ПД по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения ПД, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.
Чтобы представить, насколько эффективно может быть увеличена скорость проведения за счёт миелиновой оболочки, достаточно сравнить скорость распространения импульса по немиелинизированным и миелинизированным участкам нервной системы человека. При диаметре волокна около 2 µм и отсутствии миелиновой оболочки скорость проведения будет составлять ~1 м/с, а при наличии даже слабой миелинизации при том же диаметре волокна — 15-20 м/с. В волокнах большего диаметра, обладающих толстой миелинововой оболочкой, скорость проведения может достигать 120 м/с.
Скорость распространения потенциала действия по мембране отдельно взятого нервного волокна отнюдь не является постоянной величиной — в зависимости от различных условий, эта скорость может очень значительно уменьшаться и, соответственно, увеличиваться, возвращаясь к некоему исходному уровню.
Активные свойства мембраны
Активные свойства мембраны, обеспечивающие возникновение потенциала действия, основываются главным образом на поведении потенциалзависимых натриевых (Na+) и калиевых (K+) каналов. Начальная фаза ПД формируется входящим натриевым током, позже открываются калиевые каналы и выходящий K+-ток возвращает потенциал мембраны к исходному уровню. Исходную концентрацию ионов затем восстанавливает натрий-калиевый насос.
Схема строения мембраны клетки
По ходу ПД каналы переходят из состояния в состояние: у Na+ каналов основных состояний три — закрытое, открытое и инактивированное (в реальности дело сложнее, но этих трёх достаточно для описания), у K+ каналов два — закрытое и открытое.
Поведение каналов, участвующих в формировании ПД, описывается через проводимость и высчиляется черезкоэффициенты переноса (трансфера).
Коэффициенты переноса были выведены Ходжкиным и Хаксли.
Проводимость для калия GK на единицу площади [S/cm²]
Проводимость для натрия GNa на единицу площади [S/cm²]
рассчитывается сложнее, поскольку, как уже было сказано, у потенциал-зависимых Na+ каналов, помимо закрытого/открытого состояний, переход между которыми описывается параметром 
 , , |
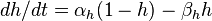 , , |
| где: | где: |
 – коэффициент трансфера из закрытого в открытое состояние для Na+ каналов [1/s]; – коэффициент трансфера из закрытого в открытое состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из инактивированного в не-инактивированное состояние для Na+ каналов [1/s]; – коэффициент трансфера из инактивированного в не-инактивированное состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из открытого в закрытое состояние для Na+ каналов [1/s]; – коэффициент трансфера из открытого в закрытое состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из не-инактивированного в инактивированное состояние для Na+ каналов [1/s]; – коэффициент трансфера из не-инактивированного в инактивированное состояние для Na+ каналов [1/s]; |
 – фракция Na+ каналов в открытом состоянии; – фракция Na+ каналов в открытом состоянии; |
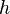 – фракция Na+ каналов в не-инактивированном состоянии; – фракция Na+ каналов в не-инактивированном состоянии; |
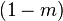 – фракция Na+ каналов в закрытом состоянии – фракция Na+ каналов в закрытом состоянии |
 – фракция Na+ каналов в инактивированном состоянии. – фракция Na+ каналов в инактивированном состоянии. |
Материал из Википедии — свободной энциклопедии