ДАП, зачастую, ведет к коме, в результате которой человек может перейти в вегетативное состояние.
Диффузия головного мозга чаще происходит с молодыми людьми, которые попадают в дорожно-транспортные происшествия, становятся жертвами драк и избиений с повреждением головного мозга, а также детьми, у которых и кома намного глубже, и неврологические нарушения грубее.
Вариант этой ЧМТ был впервые описан в 1956 за рубежом, а само название появилось в 1982 году. Состояние при ДАП тяжелое, протекающее в длительной коме, которая сразу возникает после травмы и характеризуется длительным течением.
Аксоны, поврежденные или разорванные в результате ЧМТ, и мелкие кровоизлияния равномерно распределяются по церебральным структурам, при этом нарушается иннервация всех зависимых органов. Самые распространенные места повреждений:
- ствол мозга;
- белое вещество;
- мозольное тело;
- волокна перивентрикулярные.
Диффузная травма головного мозга – это всегда серьезнейшее состояние с перспективой перехода в вегетативное состояние, нередок и смертельный исход.
Причины и морфология ДАП
Самые распространенные причины ЧМТ при ДАП:
- сильный ушиб о лобовые стекла в ДТП;
- падение;
- удар тяжелым предметом;
- синдром сотрясения у детей, при котором мозг подвергается сильному ушибу впоследствии резкой тряски, а также избиения, падения.
Синдром ДАП является результатом ушибов, вызванных угловым ускорением головы. При этом может и не быть прямого столкновения с объектом травмы.
Вследствие этого у некоторых пациентов не наблюдается переломов черепа и других видимых ранений, что несколько затрудняет диагностику. Статистика говорит о том, что именно повреждение по косой ведет к повреждению аксонов и возникновению ДАП.
Морфологически для этой травмы характерны три следующих очага повреждения:
- головной мозг;
- мозольное тело;
- стволовой мозг и диффузно распределенные разрывы.
Первые два очаговых признака – макроскопические, которые располагаются в виде гематомы до пяти мм, выглядящие как надорванная ткань с окровавленными краями. Через несколько дней после ЧМТ, очаг пигментируется и затем рубцуется. Рана в мозолистом теле может разрешиться образованием сосудистой кисты.
Аксональные нарушения при травме
Особенности клинической картины
Кома при диффузном повреждении головного мозга продолжается до трех недель и проявляется следующими симптомами:
- рефлекс зрачка нарушается;
- происходит паралич взгляда;
- дыхательный ритм меняется;
- повышается тонус мышц;
- появляется парез ног и рук;
- диагностируется гипертония;
- появляется фебрильная или субфебрильная температура и другие вегетативные расстройства.
Когда пациент с ДАП выходит из комы, он оказывается в вегетативном состоянии со следующими симптомами:
- глаза открываются на раздражители или самостоятельно;
- взгляд не сконцентрирован и не следует за движущимися предметами.
Вегетативное состояние, сопровождающееся нарушением рефлексов и симптомами разъединения функций мозговых полушарий, может продолжаться, в среднем, от нескольких дней до нескольких лет. Чем больше нахождение в нем, тем скорее появляются такие признаки полиневропатии, как:
- ослабление кистей рук;
- хаотическое движение мышц;
- расстройства нейротрофики;
- учащение пульса;
- отеки;
- тахипноэ и др.
После выхода из вегетативного состояния личность выпадает. Основные признаки нарушений после выхода:
- экстрапирамидные расстройства;
- расстройства психики, проявляющиеся отсутствием интереса к окружающей пациента действительности, агрессия, амнезия, слабоумие.
Степени поражения
Диффузное аксональное повреждение головного мозга бывает трех степеней тяжести:
- легкой – продолжительность комы от 6 до 24 часов, ЧМТ незначительна;
- средней– кома больше 24 часов, но черепно-мозговая травма умеренная;
- тяжелой – длительная кома, поражения значительные, происходит сдавливание мозга.
Тяжелая степень характеризуется массовым повреждением аксонов, которое приводят к кровоизлияниям в мозг. ДАП при этом может приводить к коме, продолжающейся годами и летальному исходу.
Начальное состояние мозга после выхода из такой комы восстановить не представляется возможным, единицы вернулись к более-менее нормальной жизни после таких повреждений.
Постановка диагноза
Диагноз диффузное поражение головного мозга ставится после компьютерной томографии, результаты которой в остром периоде отличаются увеличением объема мозговых полушарий, уменьшением или сдавливанием боковых расстояний и основания мозга. В белом веществе, стволе и мозолистом теле находятся мелкие кровоизлияния.
При обследовании наблюдается молниеносное развитие признаков ДАП и дегенерации.
ЭЭГ при синдроме ДАП выявляет изменения в подкорке и стволе мозга, диэнцефальный синдром. В анализе крови отмечается резкое повышение серотонина, значительное уменьшение дофамина и скачок адреналина, что предполагает терапию, направленную на снижение симпатико-адреналиновых симптомов.
В результате КТ определяют повышено внутричерепное давление или, наоборот, понижено либо отсутствует. В таком случае подключают датчик. Если на КТ отток ликвора в норме, то и внутричерепное давление будет в норме.

Поддержка состояния пострадавшего
После диффузной травмы головного мозга нередко диагностируются субдуральные ликворные скопления над большими полушариями мозга, которые в дальнейшем рассасываются, удалять хирургически их не надо.
Аксональное повреждение головного мозга чаще всего лечится консервативно. Нейрохирургическая операция проводится при сочетании разрывов и повреждений аксонов с очаговыми повреждениями, усиливающими сдавливание и провоцирующими гидроцефальный синдром.
В коме пациента подключают к ИВЛ, кормят парентерально и вводят следующие лекарства:
- для установления правильного кислотно-щелочного и водно-электролитного баланса;
- ноотропные и вазоактивные;
- устраняющие гипертензию или гипотонию;
- антибиотики для исключения сопутствующих инфекций.
Для возобновления психэмоциональной сферы вводят прием психостимуляторов.
После выхода из комы:
- вводят ноотропы и сосудистые лекарства для нормализации и улучшения состояния ЦНС, ноотропы также важны для последующей реабилитации;
- назначают препараты для улучшения метаболизма и биостимуляторы;
- проводят лечебную физкультуру для профилактики парезов;
- пациент занимается с логопедом.
Гормональные препараты при ДАП не назначают по ненадобности. После операции, если она все же состоялась (произошло сдавление головного мозга при сопутствующих травмах), вводят препараты, препятствующие образованию отеков, сосудистые средства, ноотропы, антихолинэстеразные, психотропные (во избежание развития агрессии и депрессии) и нейромедиаторы.
В период восстановления проводится такая же терапия, как и после выхода из комы.
Исход тяжелой травмы и ее последствия
Прогноз и последствия диффузного аксонального повреждения зависит от степени поражения аксонов головного мозга и тяжести вторичных признаков, таких как повышенное внутричерепное давление, гипергидроз, разбухание мозговых оболочек, психические нарушения, развитие слабоумия и т. д.
Исход также зависит от того как помогают лечебные методы, направленные на ликвидацию последствий ДАП – вторичные повреждения и осложнения.
Прогноз предполагает, что чем больше человек находился в коматозном состоянии, тем более риск развития неблагоприятных поражений, вплоть до летального исхода. Шансов на восстановление будет также минимум.

Но, к сожалению, чаще у выживших людей последующее течение синдрома ДАП может идти по двум сценариям:
- выход из коматозного состояния;
- переход в вегетативное состояние.
При первом варианте глаза больного открываются, и происходит слежение за предметами и фиксация взгляда на объекте. Это может иметь как спонтанный выход, так и направляемый организованными раздражителями, звуком и болевыми манипуляциями.
Затем пациент восстанавливает сознание, выполняет обращенные к нему просьбы, словесный багаж расширяется, он начинает общаться. Неврологические патологии при этом медленно регрессируют.
У больных, которые вышли из вегетативного состояния, развиваются экстрапирамидальные симптомы, сопровождающиеся психическими нарушениями (слабоумие, лабильность настроения, аспонтанность, спутанность сознания). При втором варианте летальный исход через определенное время неизбежен из-за истощения нейромедиаторов и соматических осложнений.
Современные исследования подтверждают регенерацию аксонов у детей и молодых людей, у которых мозг еще не завершил формирование. Происходит восстановление неврологических и психических процессов. При продолжительной коме оно проблематично, инвалидизация гарантирована.
Узнать больше о заболеваниях на букву «Д»:
Дебильность,
Двухволновый вирусный менингоэнцефалит,
Деменция с тельцами Леви,
Депрессивный невроз,
Дермальный синус,
Детский церебральный паралич,
Джексоновская эпилепсия,
Диастематомиелия (дипломиелия),
Дискогенная миелопатия,
Дистрофическая миотония Россолимо-Штейнерта-Куршмана,
Диабетическая энцефалопатия,
Дисциркуляторная энцефалопатия,
Диффузное аксональное повреждение головного мозга,
Доброкачественная роландическая эпилепсия.

Диагностирует состояние невролог при помощи стандартной и функциональной магнитно-резонансной томографии. Избавиться от состояния комы возможно в первую очередь с помощью искусственной вентиляции легких, а также интенсивной терапии. Обычно после выхода из комы врачи назначают ряд препаратов разной направленности для полного восстановления организма. К ним относятся ноотропные, сосудистые и метаболические препараты.
Еще одно обязательное требование, которое должен соблюдать пациент — это лечебные упражнения. Другими словами, физкультура, воздействие на психику и восстановление полноценной речи благодаря помощи логопедов и специальных упражнений.
Общие сведения
Впервые среди черепно-мозговых травм диффузное аксональное повреждение мозга было признано отдельным видом заболевания с 1956 года. Официальное название, которое оно сохранило до сегодняшнего момента, появилось только в 1982 году. Состояние, испытываемое человеком в процессе нахождения в коме, имеет специальное название — коматозное.
Рассеянно расположенные разрывы аксонов и мелкие очаги кровоизлияния среди церебральных структур — это морфологический субстрат коматозного состояния.
Существует разделение ДАП на несколько видов, в зависимости от тяжести:
- Легкая степень. Кома длится в промежуток 6-24 часа.
- Умеренная степень. Кома длится около суток. Отсутствуют стволовые повреждения, или есть их незначительное наличие.
- Тяжелая степень. Для нее свойственно длительное время нахождения в коме, при котором возможны децеребрация и декортикация.
Вне зависимости от степени ДАП данное заболевание несет с собой большую угрозу для человека, которая грозит вегетативным состоянием или, в худшем из случаев, летальным исходом. Поэтому совершенно очевидно, что многие области науки и медицины, такие как неврология и травматология, заинтересованы в постановке наиболее эффективных способов лечения.
Причины и морфология
У многих больных отсутствуют перелом черепа или какие-либо другие визуальные повреждения в связи с тем, что такая травма не всегда сопровождается непосредственным контактом головы с твердым предметом.

Самые подвижные полушария, как показала статистика, проявляются в ротации, в то время как фиксированные стволовые отделы подвергаются перекручиванию. Достаточно частое явление при таких травмах — взаимное смещение отдельных слоев или частей̆ головного мозга. К частичному или полному разрыву мелких сосудов и аксонов может привести даже незначительное смещение церебральных структур.
Выделяют три основном симптома диффузного аксонального повреждения:
- очаг травмы в мозолистом теле;
- очаг в стволе мозга;
- диффузные аксональные разрывы.
Очаг повреждения в мозолистом теле, также, как и очаг в стволе мозга сначала выглядят микроскопическими травмами и проявляются в кровоизлиянии, размер которого̆ равен примерно 5 мм. Нередко встречаются случаи, когда такие очаги выглядят как надрывы ткани, у которой̆ края пропитаны кровью.
Через некоторое время (около 2-3 дней̆) такие места превращаются в пигментированные участки, цвет которых напоминает ржавчину, а затем из них сформировываются болезненные рубцы. Кроме того, очаги в мозолистом теле могут сопровождаться таким явлением, как образование кисты.
Главным вопросом является выявление диффузных аксональных повреждений, которое проводится путем специальных микроскопических исследований тканей̆ мозга. К таким исследованиям относят иммуно-гистохимическим методом и путем импрегнации серебром.
Такие исследования позволяют увидеть множественные аксональные шары, которые располагаются в местах разрыва нервных волокон. Все последующие изменения будут выражаться в макрофагальной̆ реакции с появлением реактивных микроглиоцитов и астроцитов.
ДАП сильно отличается от простого ушиба головного мозга, его отличие заключается в отсутствии сегментоядерных элементов. Через 2-4 недели к симптомам болезни прибавятся фрагментация и демиелинизация поврежденных аксонов.
Симптомы
Особенностью ДАП, которая отличает его от всех других видов черепно-мозговых травм, является моментальный переход в кому. В основном она имеет продолжительный, умеренно-спокойный или глубокий характер. Она наступает сразу после получения травмы.
Если рассматривать статистику по взрослым людям, то случаи умеренной комы 63% против 37% глубокой. У детей же показания разнятся гораздо меньше: 43% к 57%. Что касается среднего количества времени, которое человек проводит в коме, то оно составляет от 3 до 13 суток.
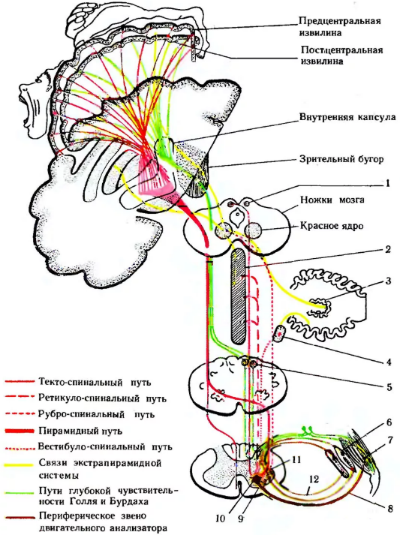
К стволовым симптомам относятся:
- нарушение дыхательного процесса и его ритма;
- анизокория;
- разное месторасположение зрачков относительно горизонтали и уменьшение;
- полное отсутствие фотореакции и рефлексов роговицы.
В области неврологии к симптомам комы относятся:
- изменчивый и непостоянный нистагм;
- отсутствие реакции мышц затылка;
- раздражение мозговых оболочек, то есть симптом Кернига.
Вегетативные симптомы имеют множество разных проявлений, самые частые из них гиперсаливация, гипергидроз и артериальная гипертензия.
ДАП характеризуется также значительными расстройствами в двигательных функциях. Самое частое их проявление — это пирамидно-экстрапирамидный тетрасиндром. Это вызвано тем, что в основном руки пациентов лежат в положении, имеющим название «лапки кенгуру» — руки со свисающими кистями приложены к телу больного и согнуты в локтях.
Неудивительно, что сухожильные рефлексы снижаются, а затем и вовсе могут исчезнуть, несмотря на то, что в начале они завышены. Также для комы свойственны стопные знаки, носящие патологический характер. Расстройства в динамике тела и мышечного тонус у каждого пациента могут сильно отличаться: от генерализованной гипотонии до горметонии. В процессе комы они часто меняются и не отличаются стабильностью. Для мышечного тонуса характерен асимметричный и диссоциативный характер.
Варианты исходов
Если пациенту удается выжить при диффузном аксональном повреждении, то его болезнь может развиваться только в двух разных направлениях:
- Выход из комы. В этом случае выход из болезни сопровождается открыванием глаз, однако, при этом присутствует слежение и фиксация взора. Это явление может происходить как спонтанно, так и благодаря посторонним факторам, звуковым или болевым раздражителям. Со временем состояние пациента нормализуется, восстанавливается сознание, а также постепенно становится возможным выполнение каких-либо простых инструкций и действий, развивается словесный контакт. Кроме того, такие процессы обязательно сопровождаются медленным регрессом неврологических проявлений.
- Переход в вегетативное состояние. Нахождение в длительной̆ коме приводит к переходу в вегетативное состояние. Продолжительность может составлять от 1-2 дней̆ до нескольких месяцев. Такое положение имеет стойкий̆ и транзиторный̆ характер. О вегетативном состоянии можно судить по открытию глаз без слежения и какой-либо фиксации взора. При этом проявляются вариабельные, изменяющиеся очаговые симптомы — разобщение стволовых и полушарных структур. При продолжительном и стойком вегетативном состоянии начинают проявляться вегето-висцеральные нарушения, такие как тахикардия, гипертермия, гиперемия лица. Чаще всего появление таких симптомов обусловлено поражением соматических органов и интеркуррентными инфекциями. Также при вегетативном состоянии развиваются нейротрофические расстройства, в основном пролежни.
Диагностика
Существует ряд признаков, по которым специалистам удается определять диффузное аксональное повреждение у пациентов:
- механизм полученной̆ черепно-мозговой̆ травмы с угловым ускорением падения;
- наступление комы сразу после травмы;
- характерные особенности клинических симптомов;
- отсутствие застойных изменений дисков зрительных нервов.
Несмотря на перечисленные признаки, врачи испытывают большие трудности при определении данной̆ болезни.
Кроме того, нередко болезнь сопровождается скоплением жидкости над лобными долями. Наибольшую сложность представляет диагностика легких и средних степеней̆ диффузных аксональных повреждений, при которых, как правило, отсутствуют какие-либо видимые патологии: микроскопические признаки, не наблюдаются, отек мозга, а также геморрагии незначительны.
Если МРТ головного мозга не отличается от картины здорового человека, специалисты руководствуются типичной̆ томографической динамикой̆, то есть регресс геморрагий и отека с тенденцией̆ к расширению желудочков, после чего следует вентрикуломегалия, а также нарастание диффузной̆ атрофии церебральных структур.
Лечение
Основные методы лечения, в которых нуждаются пациенты с диффузным аксональным повреждением — это постоянная искусственная вентиляция легких, пути питания, которые не подразумевают использование кишечно-желудочного тракта, и интенсивная терапия. Ее целью является поддержка и восстановление гомеостаза, устранение отека мозга, а также всех основных систем и функций организма. Естественно такая терапия должна предотвращать появление любых инфекционных болезней. Существуют случаи сильного осложнения в работе моторных функций. Тогда врачи прибегают к использованию наркоза.
Первое, что необходимо сделать после выхода из состояния комы — это ускоренное уменьшение отклонений, связанных с психическим и эмоциональным здоровьем. Этого можно достичь с помощью психостимулотерапии.

Восстановление центральной нервной системы происходит с помощью принятия предназначенных для этого препаратов: ноотропных и сосудистых.
К первым относятся пирацетам, ницерголин, кортексин и гамма-аминомасляная кислота, ко вторым — циннаризин и винпоцетин. Если у пациента есть определенные особенности протекания восстановительного периода, то ему в лечение добавляют нейромедиаторы (левадоп и пирибедил) и антихолинэстеразные средства (галантамин и неостигмин).
Что касается противопоказаний, то категорически не рекомендуются хирургические процедуры. Врачи допускают вмешательство хирургического лечения только при наличии опасности сдавливания головного мозга. Такая угроза может возникнуть в связи с внутричерепными травмами, например, очаги размозжения, внутричерепные или субдуральные гематомы, вдавленные переломы черепа.
Прогноз
Последствия после диффузного аксонального повреждения и окончательный исход зависят в первую очередь от степени тяжести болезни. На основе многих исследований в последнее время большую популярность приобрела теория о том, что существует регенерация аксонов у детей, подростков, пострадавших молодого возраста. Такое предположение связано с нередким частичным восстановлением неврологических и психических функций у представителей более молодого возраста.

Резидуальными остаточными явлениями после перенесения диффузного аксонального повреждения являются:
- парезы;
- параличи;
- мнестические нарушения;
- психические расстройства;
- нарушения речи;
- бульбарный синдром;
- экстрапирамидные расстройства.
Выход из вегетативного состояния, как правило, сопровождается экстрапирамидной симптоматикой, которая выражается в вторичном паркинсонизме и мелкой гиперкинезы. Последнее сопровождается выраженными нарушениями психики.
К сожалению, в связи с истощением нейромедиаторных реакций и возникновением осложнений соматического характера, стойкое вегетативное состояние практически всегда приводит к летальному исходу.
Автор: Кокунин Алексей, врач-рентгенолог, эксперт MRT-v-MSK
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Аксональные полинейропатии: патогенез и лечение
Как цитировать:
Ковражкина Е.А. Аксональные полинейропатии: патогенез и лечение. Журнал неврологии и психиатрии им. С.С. Корсакова.
2013;113(6):22‑25.
Kovrazhkina EA. Axonal polyneuropathies: pathogenesis and treatment. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(6):22‑25. (In Russ.)

Полинейропатия (ПНП) — заболевание периферической нервной системы, развивающееся в результате диффузного поражения периферических нервов — их аксонов (аксональные полинейропатии), миелиновой оболочки (демиелинизирующие полинейропатии) либо тел нейронов (нейронопатии) [9]. В основе патогенеза полинейропатий аксонального типа лежит генерализованное повреждение осевых цилиндров периферических нервов.
Патогенез. Аксональная дегенерация (аксонопатия) — результат нарушения метаболизма нейрона вследствие недостаточной выработки энергии в митохондриях и/или нарушения аксонального транспорта. Миелиновая оболочка при аксонопатиях страдает вторично (вторичная демилинизация). Миелин может повреждаться в результате ишемии нервов (поражения vasa nevrorum), отложения токсичных для нерва веществ или иммунных комплексов в эндоневрии (что характерно, например, для сахарного диабета, особенно 1-го типа — с высокой гипергликемией и аутоиммунными нарушениями) [4]. Соответственно, среди причин аксонопатии периферических нервов указывают нарушения метаболизма, токсические влияния, ишемию нервных стволов, наследственную предрасположенность и аутоиммунные механизмы [5]. По этиологическому фактору подавляющее большинство аксональных ПНП составляют метаболические и токсические, среди которых первое место занимают диабетическая (до 50% среди пациентов с сахарным диабетом и до 90% поражений нервной системы при диабете [9, 12]) и алкогольная (до 50% среди больных алкоголизмом [2, 9]).
Причиной токсико-метаболических ПНП является экзо- и эндогенные интоксикации. Поступающие извне вещества или собственные его метаболиты, токсичные для периферических нервов, вызывают их повреждение. Тяжесть этого повреждения зависит от степени токсичности данного агента (выделяют острые метаболические ПНП, развивающиеся на фоне тяжелой общей интоксикации, например, ПНП при быстро нарастающих печеночной недостаточности или уремии, при отравлении фосфоорганическими веществами, мышьяком, свинцом, как нежелательный эффект лечения препаратами лития, цитостатиками), длительности его воздействия, собственных генетических особенностей метаболизма нервной ткани, немаловажную роль играет также аутоиммунный фактор [13].
Большинство часто встречающихся в клинике метаболических ПНП являются итогом длительного воздействия эндо- и экзогенного токсического агента (диабетическая, печеночная, уремическая, алкогольная, профессиональная, лекарственная). Результатом такой интоксикации является повреждение осевого цилиндра аксона. Клинически это проявляется не только нарушениями чувствительности и мышечной слабостью (что свойственно и для демиелинизирующих ПНП), но и мышечными гипотрофиями, выраженными трофическими нарушениями. Все эти признаки свидетельствуют о длительном страдании аксонов периферических нервов. При электронейромиографии (ЭНМГ) выявляется снижение (иногда — вплоть до полного отсутствия) амплитуды сенсорных потенциалов и М-ответов периферических нервов. У пациентов с ПНП аксонального типа зачастую в достаточной степени сохранены двигательные функции (отсутствуют выраженные парезы, больные сохраняют способность ходить, часто без дополнительной опоры), тогда как инвалидизирующими являются чувствительные (боли и парестезии) и трофические нарушения. Так, аксональная сенсомоторная ПНП является одним из важных патогенетических факторов развития синдрома диабетической стопы [3]. Аксональное повреждение нервов развивается медленно, исподволь, но при правильном лечении потенциально обратимо.
При массивном воздействии токсичного для периферической нервной системы агента, участии ишемического компонента (за счет страдания vasa nevrorum), аутоиммунных влияний развиваются ПНП аксонально-демиелинизирующего типа такие, например, как уремическая, свинцовая, амиодароновая, вызываемые воздействиями высокотоксичных для нервов веществами [9]. При наиболее распространенной диабетической ПНП, демиелинизирующий компонент максимально представлен при инсулинпотребном сахарном диабете (характеризующимся более высокой гипергликемией), а выраженность демиелинизации периферических нервов нарастает при резких повышениях уровня глюкозы крови [4, 7]. На представленность демиелинизирующего компонента при метаболических ПНП влияют наследственные факторы (генетически обусловленная миелинопатия, которая протекала бы субклинически без дополнительного воздействия токсического агента), аутоиммунное повреждение (например, миелинопатия более выражена при сахарном диабете 1-го типа, при котором иммунокомпетентные клетки повреждают ткань поджелудочной железы) [4, 14].
ПНП аксонально-демиелинизирующего типа протекают более тяжело, с выраженными парезами, сенситивной атаксией, нейропатическим болевым синдромом, но нередко, при своевременном устранении действия токсического фактора, быстро регрессируют. При очень тяжелом и упорном течении заболевания, учитывая роль аутоиммунного механизма в развитии данного типа метаболических ПНП, необходимо кратковременное назначение иммуномодулирующей терапии (чаще глюкокортикоидов, иногда цитостатиков) [9, 11].
Клиническое течение ПНП. Как уже было сказано, при длительном воздействии умеренно токсичного для нервов агента аксонопатия развивается медленно, что не всегда заметно. Преимущественное поражение бедно миелинизированых вегетативных и сенсорных волокон вызывает парестезии, повышенную холодовую чувствительность кистей и стоп, негрубые трофические нарушения. При ЭНМГ не всегда удается выявить характерные признаки сенсорной и моторной аксонопатии — снижение амплитуд сенсорных потенциалов и М-ответов — если исследуются крупные богато миелинизированные нервы, аксоны которых страдают позднее. Быстрее выявляются признаки вторичной миелинопатии, как клинические — присоединение нейропатических болей, парезов, так и миографические — снижение скорости распространения возбуждения (СРВ) по нервам.
При условии адекватной терапевтической стратегии — устранения действия повреждающего периферические нервы фактора, назначение препаратов, влияющих на метаболизм нервной ткани, — наступает ремиелинизация, что отражается и на ЭНМГ в виде нарастания СРВ, и клинически — в виде регресса парезов и нейропатических болей, улучшения чувствительности. Однако, если полинейропатия развивалась в условиях длительного действия токсического агента, поражение аксонов периферических нервов, снижение амплитуд сенсорных потенциалов и М-ответов на ЭНМГ сохраняется, поскольку осевые цилиндры нервов обладают гораздо меньшей способностью к регенерации, чем миелин.
Так, в проведенном исследовании [8], посвященном лечению алкогольной ПНП, ведущим ЭНМГ-признаком поражения периферических нервов у большинства пациентов имелось снижение СРВ. В условиях элиминации токсического фактора (в данном случае приема алкоголя) и лечения препаратом α-липоевой кислоты (берлитион в суточной дозе 600 мг), у пациентов быстро, в течение 1-го месяца, регрессировали ЭНМГ и клинические признаки миелинопатии — уменьшалась выраженность парезов и болевого синдрома (в баллах по визуальной аналоговой шкале с 5,2±1,0 до 2,6±0,5) достоверно (р<0,05) нарастала СРВ (по моторным волокнам n. tibialis с 36,93±1,12 до 42,22±0,8 м/с, по сенсорным волокнам n. suralis c 32,45±0,70 до 38,24±0,50 м/с), но признаки аксонопатии (снижение амплитуд сенсорных и моторных ответов периферических нервов, сенсорные выпадения по полиневритическому типу, трофические нарушения) сохранялись и после 6 нед лечения.
Таким образом, можно представить следующую схему развития и течения метаболических ПНП (см. таблицу): высокотоксичные, высококонцентрированные токсические агенты приводят к развитию полинейропатии аксонально-демиелинизирующего типа (в развитии которых также значительную роль играют наследственный, сосудистый, аутоиммунный факторы), длительно действующие эндо- и экзогенные яды приводят преимущественно к страданию аксонов с умеренно выраженным вторичным поражением миелина (так как постоянно идет процесс ремиелинизации) [7].
Лечение. Аксональное повреждение нервов как первичного, так и вторичного характера, обратимо за счет регенерации поврежденных аксонов и концевого спрутинга сохранившихся аксонов, однако этот процесс протекает медленно (месяцы), часто аксональная регенерация бывает неполной. Для регресса аксонопатии периферических нервов необходимо нивелировать воздействие токсического агента (коррекция метаболических и алиментарных нарушений, детоксикация, влияние на аутоиммунные механизмы), большое значение имеет также патогенетическая терапия, направленная на восстановление нарушенного метаболизма аксонов (митохондриальные нарушения, повреждения, вызванные окислительным стрессом).
Таким образом, в патогенетическом лечении аксональных ПНП, в зависимости от их нозологического и клинико-электрофизиологического варианта, должны присутствовать детоксикация и коррекция метаболических и алиментарных нарушений; сосудистая терапия (дезагреганты, венотоники, пентоксифиллин, вазопростан); препараты, воздействующие на универсальные механизмы поражения аксонов (витамины и витаминоподобные препараты); при необходимости — воздействие на аутоиммунные компоненты (глюкокортикоиды, плазмаферез). В некоторых случаях, когда представленность миелинопатии в структуре поражения периферических нервов велика и трудно отличить токсико-метаболическую полинейропатию от воспалительной (например, синдром Гийена-Барре у пациента с алкоголизмом или дебют хронической воспалительной демиелинизирующей ПНП у больного с сахарным диабетом) необходимо проводить пробную иммуномодулирующую терапию, ее быстрая эффективность позволит высказаться в пользу превалирования у пациента аутоиммуного механизма поражения периферических нервов [7, 11].
В лечении всех метаболических ПНП необходимо устранить (по возможности) поражающий периферические нервы яд и использовать препараты, улучшающие метаболизм нервной ткани периферических нервов. Последние необходимо применять в течение длительного времени, так как первым эффектом данных препаратов будет ускорение ремиелинизации, но для восстановления самих аксонов — а данные ПНП являются аксональными — требуется значительно большее количество времени.
α-липоевая (тиоктовая) кислота — витаминоподобное вещество, эндогенно образующееся в организме, как кофермент участвует в окислительном декарбоксилировании α-кетокислот. Основная функция эндогенной липоевой кислоты в организме — участие в аэробном метаболизме продукта гликолиза пирувата. Тиоктовая кислота является коферментом в окислительном декарбоксилировании пировиноградной кислоты до ацетил-КоА и α-кетоглутаровой до сукцинил-КоА в цикле Кребса. Облегчая превращение молочной кислоты в пировиноградную с последующим декарбоксилированием последней, α-липоевая способствует ликвидации метаболического ацидоза [6]. Тиоктовая кислота обладает сложным комплексным действием: гипогликемическим, липотропным, гепатопротекторным, антиатеросклеротическим, является мощным антиоксидантом. Липоевая кислота может существовать в окисленной (-S-S-) и восстановленной (SH-)-формах, благодаря чему реализуются ее коферментные и антиоксидантные функции. Восстановленная форма, дигидролипоевая кислота, служит донором электронов для восстановления других антиоксидантов (витамины С, Е и глутатион), осуществляет рецикл витамина Е при его истощении. Дигидролипоат повышает интра- и экстрацеллюлярный уровни глутатиона — эндогенного антиоксиданта.
Эффект экзогенно вводимой α-липоевой кислоты в отношении полиневритического синдрома впервые обнаружен при сахарном диабете. Обусловленная сахарным диабетом гипергликемия приводит к отложению глюкозы на матричных протеинах кровеносных сосудов и образованию конечных продуктов прогрессирующего гликозилирования, в результате чего уменьшается эндоневральный кровоток, возникает эндоневральная ишемия. α-липоевая кислота приводит к снижению уровня глюкозы в крови и повышению содержания гликогена в печени, обладает гипогликемическим действием. На фоне воздействия препарата уменьшается выраженность сенсорных симптомов полинейропатии — боли, жжения, ощущения онемения и «ползания мурашек» в конечностях.
Применение α-липоевой кислоты оказывает положительное влияние на универсальные механизмы аксонального повреждения, такие как повреждающее действие окислительного стресса и митохондриальная дисфункция — за счет антиоксидантного действия, повышения содержания глутатиона. Энергокорригирующее действие α-липоевой кислоты, тропное именно к аксонам нервов, способствует, в конечном итоге, быстрейшей регенерации аксонов [18].
Препарат не только редуцирует проявления окислительного стресса, но и оказывает влияние на сосудистый компонент поражения периферических нервов, нормализуя эндоневральный кровоток (что имеет большое значения, например, при дибетической микроангиопатии) [16, 17]. Комплексный механизм действия α-липоевой кислоты объясняет ее эффективность в отношении всех аксональных ПНП, патогенез которых связан с токсико-дисметаболическим и сосудистым факторами. Так, эффективность тиоктовой кислоты показана при уремической и алкогольной ПНП, при поражении периферических нервов, индуцированном цитостатиками [15]. Для регенерации аксонов периферических нервов на фоне токсико-метаболических влияний важны также детоксикационный и гепатопротекторный эффекты α-липоевой кислоты. Положительный эффект препарата отмечен в отношении заболеваний печени, печеночной комы, некоторых интоксикаций, в том числе алкогольной [6, 10].
При значительно выраженной аксонопатии, учитывая медленную скорость регенерации аксонов, необходимо длительное применение достаточно высоких доз α-липоевой кислоты. Обычно ее суточная доза составляет 600 мг. Предпочтительнее начинать лечение с внутривенного капельного введения препарата — 600 мг (24 мл раствора) в разведении на 200 мл физиологического раствора, длительность инфузии составляет от 2 до 4 нед в зависимости от тяжести ПНП. В особо тяжелых случаях препарат вводят внутривенно капельно в дозе 1200 мг в сутки. После переходят на пероральный прием α-липоевой кислоты — в таблетках по 600 мг не менее 2 месяцев [1].
В соответствии с такой клинической потребностью — необходимостью длительного приема достаточно высоких доз α-липоевой кислоты, учитывая потенциально обратимый, но медленный характер аксональной регенерации — разработаны и фармацевтические формы препарата. Например, берлитион 300 и берлитион 600, производимые в виде раствора для внутривенных вливаний по 12 и 24 мл соответственно (для начального этапа лечения ПНП), так и таблеток по 300 и 600 мг (для продолжения терапии).
Соблюдение всех условий патогенетического лечения ПНП — нормализация гликемии, прекращение поступления экзогенного яда, детоксикация, коррекция аутоиммунных нарушений, длительное применение препаратов, нормализующих аксональный метаболизм, способствует постепенной регенерации аксонов, уменьшению выраженности чувствительных и двигательных нарушений, болевого синдрома, парестезий, парезов. Для уточнения динамики различных видов метаболических ПНП на фоне подобного терапевтического подхода необходимы дальнейшие исследования.
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Ефимов А.А.
1
Савенкова Е.Н.
1
Алексеев Ю.Д.
1
Райкова К.А.
1
Коротина О.С.
1
Корсак В.О.
1
1 ФГБОУ ВО «Саратовский государственный медицинский университет им. В.И. Разумовского Минздрава России»
Диффузное аксональное повреждение (ДАП) головного мозга остается предметом исследования с позиций разных специальностей и не теряет своей актуальности, как вариант тяжелой формы черепно-мозговой травмы. Проблема судебно-медицинской диагностики ДАП в настоящее время требует обобщения и анализа теоретических данных для их практического применения и выработки алгоритма постановки диагноза этой сложной патологии. Несоответствие тяжести состояния пострадавшего и морфологических проявлений при отсутствии стандартизированных критериев судебно-медицинской верификации диктует необходимость дальнейшего изучения данного вопроса. В обзоре представлены современные сведения о механизме, патоморфологической и клинической картине, а также существующих методах судебно-медицинской диагностики ДАП. Проанализирована возможность использования различных веществ в качестве индикаторов повреждения головного мозга (таких как β-APP белки, белок S-100, нейрон-специфическая енолаза, глиальный фибриллярный кислый протеин, альфа-II-спектрин, расщепленный тау-белок). Представленные данные научных работ свидетельствуют о необходимости комплексного применения различных методов исследования (анализ клинической картины, морфологических, гистологических изменений и биомаркеров) в случаях с подозрением на ДАП. Это позволит повысить обоснованность судебно-медицинской диагностики данной патологии в случаях тяжелых черепно-мозговых травм.
диффузное аксональное повреждение
черепно-мозговая травма
судебно-медицинская экспертная оценка дап
1. Арефьева Е.Г., Гатин Д.В., Мошнегуц С.В., Рохленко О.В., Ушаков А.В., Шалякин К.Л. Диффузное аксональное повреждение: кт-картина и клинические наблюдения// Медицинская визуализация. 2012. № 1. С. 45-50.
2. Арушанян М.Ю. Диффузное аксональное повреждение головного мозга // Евразийское Научное Объединение. 2019. № 6-3 (52). С. 173-176.
3. Лихтерман Л.Б. Диффузное аксональное повреждение головного мозга // Неврология и ревматология. Приложение к журналу ConsiliumMedicum. 2016. № 1. С. 44-51.
4. Храпов Ю.В., Поройский С.В. Роль биомаркеров повреждения вещества головного мозга в диагностике, оценке эффективности лечения и прогнозировании исходов тяжелой черепно-мозговой травмы. // Волгоградский научно-медицинский журнал. 2013. № 3(39). C. 10–20.
5. SenuakovaO.V., GalanineV.E., KrylovA.S., PetraikinA.V., AkhadovT.A., SidorinS.V. Diffuseaxonalinjurylesionsegmentationusingcontouringalgorithm. In: ProceedingsofGraphiCon. 2011. P 84–87.
6. Vieira R.М., Paiva, W.S., Oliveira D. V., Teixeira M. J., Andrade A. F. Diffuse Axonal Injury: Epidemiology.Outcome and Associated Risk Factors. Frontiers in Neurology. 2016. vol. 7.no. 178. Р. 1-12.
7. Xie Y., Tao X. White matter lesion segmentation using machine learning and weakly labeled MR images. In: Proceeding of SPIE. 2011.no. 7962. P. 132-141.
8. Петряйкин А.В., Ахадов Т.А., Сенюкова О.В., Крылов А.С. Алгоритм идентификации очагов диффузно-аксонального повреждения у больных с черепно-мозговой травмой //Нейроимиджинг и магнитоэнцефалография: фундаментальные исследования и клиническая практика: сборник трудов международного симпозиума. М., 2012. С 92–94.
9. Сафронова Е.С. Диффузное аксональное повреждение мозга — современные представления о патогенетических механизмах и перспективах фармакотерапии // Забайкальский медицинский вестник. 2013. № 1. С. 206-213.
10. Сафронова Е.С., Юнцев С.В., Белозерцев Ю.А. Поиск противосудорожных средств с многофакторным нейропротекторным действием для терапии диффузной аксональной травмы мозга // Вестник Забайкальского государственного университета. 2013. № 4. С. 59-65.
11. Сафронова Е.С., Белозерцев Ю.А., Юнцов С.В. Нейропротекторные свойства снотворных средств при диффузном аксональном повреждении мозга // Сибирский медицинский журнал (Иркутск). 2016. Т. 145. № 6. С. 19-22.
12. Колударова Е.М., Тучик Е.С. Аспекты посмертной диагностики диффузного аксонального повреждения мозга // Вестник судебной медицины. 2019. Т. 8. № 3. С. 44-49.
13. Chen X.H., Siman R., Iwata A., Meaney D.F., Trojanowski J.Q., Smith D.H. Long-term accumulation of amyloid-beta, beta-secretase, presenilin-1, and caspase-3 in damaged axons following brain trauma. Am. J. Pathol. 2004. vol. 165.no. 2. P. 357-371.
14. Netto C.B., Conte S., Leite M.C., Pires C., Martins T.L., Vidal P., Benfato M.S., Giugliani R., Gonçalves C.A. Serum S100B protein is increased in fasting rats. Arch. Med. Res. 2006. vol. 37. no. 5. P. 683–686.
15. Hostiuc S., Pirici D., Negoi I., Ion D.A., Ceausu M. Detection of diffuse axonal injury in forensic pathology. Romanian Journal of Legal Medicine. 2014. vol. 22. no. 3. P. 145-152.
16. Adams J.H., Graham D.I., Murray L.S., Scott G. Diffuse axonal injury due to nonmissile head injury in humans: an analysis of 45 cases. Ann. Neurol. 1982. vol. 12. no. 6. P. 557-563.
17. Strich S.J. Diffuse degeneration of the cerebral white matter in severe dementia following head injury. J. Neurol.NeurosurgPsychiat. 1956. vol. 19. no. 69. P. 163-185.
18. Holbourn A.H. Mechanics of Head Injury. Lancet. 1943. vol. 2. no. 242. P. 438-441.
19. Pudenz R.H., SheldenC.H. Craniel trauma and brain movement. J. Neurosurg. 1946. vol. 3. P. 487-505.
20. Пашинян Г.А., Касумова С.Ю., Добровольский Г.Ф., Ромодановский П.О. Патоморфология и экспертная оценка повреждений головного мозга при черепно-мозговой травме. Москва, Ижевск.: Изд-во «Экспертиза». 1994. 134 с.
21. Gennarelli T.A., Thibault L.E., Adams J.H., Graham D.I., Thompson C.J., Marcincin R.P. Diffuse axonal injury and traumatic coma in the primate Ann. Neurol. 1982. vol. 12. no. 6. P. 564-574.
22. Povlishock J.T., Christman C.W., The Pathobiology of Traumatically Induced Axonal Injury in Animals and Humans: A Review of Current Thoughts. Journal of neurotrauma. 1995. vol. 12. no. 4. P. 555-564.
23. Dolinak D., Matshes E.W., Lew E.O. Forensic Pathology: Principles and Practice (1stedn). USA: Elsevier Academic Press. 2005. P. 442-446.
24. Adams J.H., Doyle D., Graham D.I., Lawrence A.E., McLellan D.R.. Diffuse axonal injury in head injuries caused by a fall. Lancet. 1984. vol. 324. no.8417. P. 1420-1422.
25. Graham D.I., Clark J.C., Adams J.H., Gennarelli T.A. Diffuse axonal injury caused by assault. J.Clin.Pathol. 1992. vol. 45. no. 9. P. 840–841.
26. Niess C, Grauel U, Toennes S.W., Bratzke H. Incidence of axonal injury in human brain tissue. ActaNeuropathol. 2002. vol. 104. no. 1. P. 79-84.
27. Shkrum M.J., Ramsay D.A. Forensic Pathology of Trauma: Common Problems for the Pathologists. (1stedn). Totowa New Jersey: Humana Press. 2007. P. 558-565.
28. Ромодановский П.О. Некоторые аспекты диффузного аксонального повреждения мозга при травме головы // Судебно-медицинская экспертиза. 2013. №3. С. 18-20.
29. Davceva N., Basheska N., Balazic J.DiffuseAxonalInjury – ADistinctClinicopathologicalEntity in Closed Head Injuries. J. Forensic Med Pathol. 2015. vol. 36. no. 3. P. 127-133.
30. Peerless S.J., Rewcastle N.B. Shear Injuries of the Brain. The Canadian Medical Association. 1967. vol. 96. no. 10. P. 577-582.
31. Kaur B., Rutty G.N., Timperley W.R. The possible role of hypoxia in the formation of axonal bulbs. J. Clin. Pathol. 1999. vol. 52. no. 3. P. 203–209.
32. Papa L., Robinson G. Use of biomarkers for diagnosis and management of traumatic brain injury patients.Expert Opinion on Medical Diagnostics. 2008. vol. 2. no. 8. P. 937-945.
33. Frati A.,Cerretani D., Fiaschi A.I.,Frati P., Gatto V.,Russa R.,Pesce A., Pinchi E., Santurro A., Fraschetti F.,Fineschi V. Diffuse Axonal Injury and Oxidative Stress: A Comprehensive Review. Int. J. Mol. Sci. 2017. vol. 18. no. 2. P. 1-20.
34. Lambri M., Djurovic V., Kibble M., Cairns N., Al-Sarraj S. Specificity and sensitivity of beta APP in head injury. Clin. Neuropathol. 2001. vol. 20. № 6. P. 263–271.
35. Reichard R.R., Smith C., Graham D.I. The significance of beta-APP immunoreactivity in forensic practice. Neuropathol. Appl. Neurobiol. 2005. vol. 31. no. 3. P. 304–313.
36. Beaudeux J., Dequen L., Foglietti M.Pathophysiologic aspects of S-100beta protein: a new biological marker of brain pathology. Ann. de biologie Clinique. 1999. vol. 57. no. 3. P. 261-272.
37. Isgro A., Bottoni P., Scatena R. NeuronSpecific Enolase as a Biomarker: Biochemical and Clinical Aspects. Adv. Exp. Med. Biol. 2015. vol. 867. P. 125-143.
38. Thelin E.P., Nelson D.W., Bellander B.M. Utilityofneuron-specificenolaseintraumaticbraininjury;relationstoS100Blevels,outcome,andextracranialinjuryseverity.CriticalCare.2016.vol. 20.no. 1. P. 1-15.
39. Papa L., Lewis L.M., Falk J.L., Zhang Z., Silvestri S., Giordano P., Brophy G.M., Demery J.A., Dixit N.K., Ferguson I., Liu M.C., Mo J., Akinyi L., Schmid K., Mondello S., Robertson C.S., Tortella F.C., Hayes R.L., Wang K.K. Elevated levels of serum glial fibrillary acidic protein breakdown products in mild and moderate traumatic brain injury are associated with intracranial lesions and neurosurgical intervention. Annals of Emergency Medicine. 2012. vol. 59. no. 6. P. 471-483.
40. Краснов А.В. Астроцитарные белки головного мозга: структура, функции, клиническое значение // Неврологический журнал. 2012. №17. С. 37-42.
41. Mondello S., Robicsek S.A., Gabrielli A., Brophy G. M., Papa L., Tepas J., Robertson G., Buki A., Scharf D., Mo J., Akinyi L., Muller U., Wang K.K.W., Hayes R. L. αII-spectrin breakdown products (SBDPs): diagnosis and outcome in severe traumatic brain injury patients. Journal of Neurotrauma. 2011. vol. 27. no. 7. P. 1203-1213.
42. Yokobori S., Hosein K., Burks S., Sharma I., Gajavelli S., Bullock R. Biomarkers for the Clinical Differential Diagnosis in Traumatic Brain Injury-A Systematic Review. CNS Neuroscience & Therapeutics. 2013. vol. 19.no. 8. Р. 556-565.
Диффузное аксональное повреждение (ДАП) как отдельная группа тяжелой черепно-мозговой травмы (ЧМТ) на протяжении многих лет привлекает внимание исследователей разных клинических специальностей [1-3]. Причиной этому отчасти служит отсутствие специфических критериев диагностики данной патологии, лабораторных маркеров этого патологического процесса. Меняется и подход к оценке тяжести и диагностики ДАП, использование шкалы комы Глазго и компьютерной томографии головного мозга в последнее время получили широкое внедрение в клиническую практику [4-6]. Появились работы по созданию алгоритмов формирования общей картины повреждений вещества головного мозга при ДАП с использованием программного обеспечения и вычислительной техники [7; 8]. Ведутся поиски различных вариантов фармакотерапии этой тяжелой формы травматического повреждения вещества головного мозга [9-11]. Несоответствие скудных морфологических проявлений и тяжести клинического состояния осложняет использование этого вида ЧМТ в практике судебно-медицинского эксперта, несмотря на достаточно изученный механизм травмы, приводящий к разрыву аксонов [12]. Пациентам с субдуральными, эпидуральными гематомами и другими формами ЧМТ диагноз ДАП не выставляется, несмотря на возможное повреждение аксональных трактов в этих случаях.
В настоящее время значительное количество работ, посвященных поиску различных биомаркеров-индикаторовДАП,в большинстве своем выполнены на животных,поэтомуих результаты при экстраполяции для применения в клинической практике необходимо интерпретировать с осторожностью [13; 14].
Следует отметить, что основная масса публикаций зарубежных и отечественных научных работ по этой тематике приходится на конец XX – начало XXI века. Были изучены клинические проявления ДАП, механизм травмы, макро- и микроскопическая картина при разных степенях тяжести и на различных сроках после получения травмы, начались исследования биомаркеров, позволяющих диагностировать травму головы, в том числе и повреждения аксонов. В последнее десятилетие интенсивность исследований по проблеме ДАП существенно снизилась. Появляющиеся единичные, в основном зарубежные, публикации, посвященные выявлению маркеров – индикаторов повреждения белого вещества головного мозга, служат целям клинической диагностики ДАП.
Чаще всего ДАП встречается при дорожно-транспортных происшествиях [15]. Поэтому в разрезе судебно-медицинских экспертных исследований проблема ДАП остается не до конца решенной. И принципиальным является не диагностика ДАП как основной или единственной составляющей черепно-мозговой травмы в рамках вопроса о причине смерти, а необходимость верифицировать ДАП при травме головы с переломами черепа, внутричерепными гематомами, ушибами мозга. К сожалению, в экспертной практике при наличии указанных тяжелых ЧМТ этому вопросу уделяется недостаточное внимание, при том что решение этого вопроса позволит экспертам более детально раскрыть механизм повреждений мозгового вещества и конкретизировать условия и этапытравмирования, что часто является ключевым при производстве таких экспертиз.Условия образования ДАП при различных механизмах травмы головы, скудность морфологической картины повреждения мозговой ткани при выраженной тяжести клинического течения посттравматического периода практически с момента травмы определяют необходимость в проведении углубленного анализа сведений и взглядов на ДАП с судебно-медицинских позиций для выработки алгоритма постановки диагноза при данной патологии.
Цель исследования: провести анализ зарубежных и отечественных публикацийпо проблеме диагностики ДАП в контексте возможности комплексного использования различных методик и биомаркеровв судебно-медицинских экспертных целях.
Материал и методы исследования.При подготовке публикации авторы использовали интернет-ресурсы: научная электронная библиотека (elibrary), SciVerse (ScienceDirect), Scopus, PubMed, GoogleScholar, BioMedSearch и Discover. Поиск публикаций осуществлялся по ключевым словам: диффузное аксональное повреждение, механизм ДАП, клиника ДАП, патоморфологическая картина при ДАП, гистологическая картина при ДАП, биомаркеры ДАП, diffuseaxonalinjury, themechanismoftheDAI, theDAIsymptoms, pathomorphologicalchangesintheDAI, histologicalchangesintheDAI, theDAIbiomarkers.После подборки научных публикаций описательным методом проводили обобщение и анализ информации о механизмах возникновения, диагностических критериях, клинических формах, вариантах течения, морфологической картине и биомаркерах ДАП.
Результаты исследования и их обсуждение.Термин «диффузное аксональное повреждение» был предложен в 1982 годуJ.H.Adamsс соавт. [16]. Они же описали характерные изменения в головном мозге при ДАП в виде местных повреждений, расположенных в мозолистом теле и (или) в дорсолатеральных квадрантах ростральных отделов мозга, а также диффузные изменения аксонов.
Однако первые описания дегенерации белого вещества головного мозга появились еще в 1940-х годах. Пионером в исследовании и описании этой патологии былаSabinaStrich [17], которая в 1956 году подробно описала морфологическую картину ЧМТ погибших после длительного пребывания в посттравматическом вегетативном состоянии с грубыми неврологическими нарушениями. Макроскопические признаки ЧМТ отсутствовали (за исключением одного пострадавшего с переломом костей черепа), что не соответствовало тяжести состояния, однако в ходе гистологического исследования была выявлена диффузная дегенерация белого вещества головного мозга, причиной которойявилось первичное физическое повреждение аксонов в момент травмы. Свои выводы S.Strich основывала на теоретических и экспериментальных работах A. Holbourn [18] и R.Pudenz, C.Shelden [19].
A.Holbourn, используя желатиновую модель головного мозга, воспроизводил вращательные движения в различных плоскостях (сагиттальной, вертикальной, горизонтальной). Он пришел к выводу, что формирующиеся в результате ускорения вращения«сдвиговые деформации»являются ведущим фактором, который вызывает разрыв синапсов, нервных волокон и кровеносных сосудов головного мозга. Важную рольвозникновения этого феномена авторотводитнесжимаемостии низкой ригидности вещества головного мозга при высокой ригидности черепа.
R.Pudenz,C.Sheldenзаменяли у приматов часть костей черепа прозрачной пластинкой инаносили удары с помощью специального аппарата на основе сжатого воздуха. В ходе исследования было установлено, что в момент удара мозг совершает вращательные и скользящие движения, направление которых зависит от точкиприложения силы. Движения мозговых полушарий наблюдались преимущественно в сагиттальной плоскости. Было отмечено, что удары в лобно-затылочном направленииприводят к смещению мозговых структур в сагиттальной плоскости, а на перемещение мозга при травматическом воздействии существенно влияла подвижность головы. Максимальные изменения отмечались при нефиксированной голове.
В то же времяГ.А.Пашинянс соавторами в монографии «Патоморфология и экспертная оценка повреждений головного мозга при черепно-мозговой травме» [20] утверждали, что повреждение чаще всего затрагивает плоскости между тканями различной плотности (соединение серого и белого вещества) и центр вращения мозга (ростральный отдел ствола). Локализация повреждения аксонов в стволе объясняется, прежде всего, тем, что головной мозг не фиксирован, поэтому при травматическом воздействии происходит некоторое его смещение. В свою очередь спинной мозг фиксирован корешками, что делает его устойчивым при вращении. На границе головного и спинного мозга располагается ствол, и это объясняет его преимущественное повреждение.
T.Gennarelliс соавт. [21] установили, что движение головы во фронтальной плоскости чаще приводит к серьезным аксональным повреждениям, тогда как движение ее в сагиттальной плоскости приводит к мягкому, в крайнем случае умеренному повреждению аксонов.
Несмотря на то что все вышеуказанные исследователи говорили о мгновенном разрыве аксонов под воздействием травмы, более поздниеработыJ. Povlishockс соавт. [22], как с участием экспериментальных животных, так и с использованием данных, полученных при аутопсии потерпевших с ЧМТ, показали, что патогенез травматически индуцированного аксонального повреждения является более сложным, чем первоначально предполагалось. Во многих случаях наблюдался каскад интрааксональных изменений, приводящий к прогрессивному набуханию аксонов и последующему разрыву в период с 12 до 24 часов.D.Dolinak с соавт.[23] с помощью гистохимического и других гистологических методов выяснили, что в момент травмы аксоны не рассекаются. Растяжение аксона приводит к его функциональному повреждению, которое заключается в травме микротрубочек и структуры нейрофиламентов. Цепь химических реакций в функционально поврежденном аксоне приводит к его постепенному отеку и разъединению. В частности, увеличивается проницаемость аксолеммы, и приток кальция запускает кальций-зависимые протеазы. Этот процесс еще сильнее повреждает аксон, что приводит к накоплению аксонального содержимого в месте разрушения. Сначала это приводит к набуханию (аксональные утолщения), а затем к полному разъединению и формированию аксональных шаров.
Наибольшие предпосылки для реализации указанных механизмов имеются при высокоскоростных дорожно-транспортных происшествиях, что определяет значимость изучения ДАП для реконструкции событий при проведении судебно-медицинских экспертиз. Однако имеются данные, свидетельствующие об ином механизме получения данного повреждения: в результате падения с большой высоты; повреждения, полученные при разбойном нападении [24; 25]. C. Niessс соавт.[26] приводят случай повреждения аксонов в результате передозировки наркотическими препаратами, когда при вскрытии была диагностирована субдуральная гематома, при отсутствии переломов костей черепа. В этом случае, по мнению авторов,причиной повреждения аксонов явилась гипоксия при действии на дыхательный центр наркотических веществ. Хотя эти данные представляются весьма сомнительными, так как авторы не приводят сведения катамнеза, исключающие травму, однако исследования, опровергающие указанный механизм образования повреждений аксонов,отсутствуют.
M.J. Shkrum, D.A.Ramsay [27] считают нехарактерным обнаружение контактных повреждений при ДАП, но отмечают, что в некоторых случаяхвстречаются повреждения волосистой части головы, трещиныкостей черепа, субдуральные и субарахноидальные кровоизлияния или ушиб коры головного мозга. По мнению авторов, для ДАП более характерны очаговые кровоизлияния, расположенные в глубоких отделах белого вещества головного мозга (мозолистое тело, внутренняя капсула, верхние ножки мозжечка).При тяжелой степени ДАП взаимное движение между различными участками мозга приводит к разрыву аксонов вместе с мелкими кровеносными сосудами что, в свою очередь, ведет к множественным петехиальным кровоизлияниям в головном мозге, преимущественно локализующимся в белом веществе лобной доли. Это явление носит название «диффузный васкулярный ушиб», отражает тяжесть диффузной травмы мозга и имеет короткий период выживаемости (от нескольких минут до нескольких часов).
Изменение патоморфологической картиныв головном мозгев зависимости от срока, прошедшего после получения травмы, нашло отражение в работе П.О.Ромодановского [28]. Так, при смерти в течение первыхтрех суток отмечается набухание мозга, мелкоочаговые и очаговые кровоизлияния в мозолистом теле, базальных ядрах, семиовальном центре, реже в стволе. При смерти спустя 1 неделю после травмы появляются признаки давности геморрагий в глубинные отделы.Спустя месяц обнаруживаютсябурые кисты в области первичного повреждения белого вещества. А при сроке более 3 месяцев обнаруживаются признаки атрофии мозга, вентрикуломегалии, расширение субарахноидальных пространств.
Для гистологической верификации ДАП автор предлагает комплекс методов окраски, которыми следует пользоваться с учетом сроков посттравматического периода. Основными из них являются методики, позволяющие обнаружить изменения осевых цилиндров (импрегнация серебром по Бильшовскому или Глису), миелиновых оболочек (импрегнация осмием по Марки для выявления ранней демиелинизации, окраска по Шпильмейеру для обнаружения поздней демиелинизации).
N.Davceva с соавт.[29] выделяют два основных признака, на основании которых можно поставить диагноз ДАП. Первый — это наличие диффузного повреждения аксонов белого вещества, и второй — широкая распространенность данного повреждения таким образом, что хотя бы одна поврежденная область располагается выше и одна ниже Tentorium cerebelli, обращая особое внимание на аксональные тракты (мозолистое тело, внутренняя капсула).
Исследования, проведенные S.J.Peerless, N.B.Rewcastle [30], показали, что для ДАП характерным является обнаружение поврежденных аксонов – аксональных утолщений или аксональных шаров – при микроскопическом исследовании. Аксональные утолщения обусловлены удлинением аксонов без разрыва и характеризуются участками утолщения аксонов, разделенными истонченными участками. Аксональные шары (шары Марки, терминальные, ретрагированные шары) встречаются в ранние сроки, после травмы (впервые их можно увидеть в течение двух часов после травмы, а максимального развития они достигают спустя 4 часа). Механизм их возникновения авторы объясняютвытеканием аксоплазмы из обоих концов поврежденного участка нервного волокна при разрыве с формированием булавовидных утолщений. На дистальном сегменте аксональные шары регистрируются лишь в течение 5-7 дней, тогда как на проксимальном сегменте регулярно встречаются в течение многих месяцев и даже лет после травмы, в том случае, если тело клетки выживает. Однако,по мнению B.Kaur с соавт.[31], аксональные шары не являются строго специфичными для травматического генеза повреждения аксонов. Их появление возможно, например, при гипоксии и отсутствии травмы головы.
В работе Г.А. Пашиняна с соавт. [20] отмечается, что с 5-го дня после травмы определялись участки ранней дегенерации белого вещества в областях первичных повреждений. Со второй недели выявлялись выраженные дегенеративные изменения в зонах повреждений и начальные признаки вторичной посттравматической дегенерации с образованием зернистых шаров. При сроке более двух недель появлялись выраженные дегенеративные изменения нервной ткани как в зонах повреждения белого вещества, так и на отдалении. При сроке более месяца в зонах первичных повреждений определялась демиелинизация аксональных структур. При переживании травмы более 3 месяцев наблюдалась диффузная вторичная дегенерация нервной ткани, спинного мозга и в периферической нервной системе.
Помимо вышеуказанных, высокоинформативным методом диагностики (прижизненным и посмертным) является определение биомаркеров повреждения головного мозга. Исходя из анализа исследований, посвященных биомаркерам, проведенного L.Papa, G. Robinson[32], можно сделать вывод, что специфических маркеров ДАП до сих пор не найдено, а результаты многочисленных исследований противоречивы. Но, несмотря на это, исследователи утверждают, что простота использования, точная ранняя диагностика как прижизненно, так и посмертно диктует необходимость в продолжении исследований в отношении биомаркеров повреждения мозга.
X.H.Chen с соавт. [13] и A. Fratiс соавт. [33] предлагают «золотым стандартом» диагностики ДАП считать выявление β-APP белков. Предшественники бета-амилоида(amyloidprecursorprotein, АРР) — это трансмембранные белки, в больших количествах локализующиеся в синаптических мембранах.Их функция пока остается неизвестной. В результате их протеолиза образуются амилоид-β1–40 и амилоид-β1–42. После ЧМТ продукты протеолизаAPP и активированная капсаза-3, а также другие протеолитические ферменты обнаруживаются в аксонах и теле нейрона. Иммуногистохимическим (ИГХ) методом, с помощью антител к β-APP, идентифицируют пораженные аксоны уже через 2-3 часа после травмы. Они остаются видимыми при ИГХ-исследовании длительное время -до 6 месяцев. Следует отметить, что,по данным M. Lambriс соавт. [34] и R. Reichardс соавт.[35], имеются определенные морфологические закономерности распределения иммунореактивных аксонов, позволяющие на микроскопическом уровне отличить травматическое повреждение аксонов от других видов повреждения (гипоксия и т.д.).
J. Beaudeux с соавт. [36] описывает другой примербиомаркера повреждения мозга — белок S-100. Это кальций-связывающий белок, секретируемый преимущественно глиальными клетками. Структурное повреждение этих клеток вызывает утечку этого белка во внеклеточное пространство, затем в спинномозговую жидкость и его дальнейшее поступление в кровоток. Таким образом, повышение концентрации белка S-100 было предложено в качестве индекса повреждения ткани головного мозга.В настоящее времяобсуждается возможность синтеза данного белка другими тканями (например, адипоцитами) [14].
Были обнаружены предиктивные способности нейрон-специфической енолазы – внутриклеточного фермента центральной нервной системы, локализующегося в клетках нейроэктодермального происхождения. Это делает его высокоспецифичным маркером повреждения таких клеток. Однако чаще его используют в диагностике различных злокачественных новообразований [37].
E. Thelinс соавт.[38] обратили внимание, что изменение концентрации белка S-100 было лучшим предиктором травмы головного мозга по сравнению с изменением концентрации нейрон-специфической енолазы. Несмотря на это, оба биомаркера обладают предиктивной способностью независимо друг от друга; способности нейрон-специфической енолазы ограничены при наличии белка S-100, т.к. между ними имеется высокая зависимость. Более того, нейрон-специфическая енолаза в большей степени коррелирует с мультитравмой, однако эффект экстрацеребральной травмы, по-видимому, ограничен первыми 48 часами. Из вышесказанного можно сделать вывод, что хотя оба биомаркера независимо коррелируют с ЧМТ, белокS-100 является более точным предиктором травмы головного мозга и, возможно, более клинически полезным биомаркером, чем нейрон-специфическая енолаза.
В качестве биомаркера повреждения L.Papaс соавт. [39] в своих исследованиях рассматривают глиальный фибриллярный кислый протеин (GFAP). GFAP – это член семейства белков цитоскелета, промежуточный филамент в зрелых астроцитах. Появление его в сыворотке крови является предиктором поражения различных структур мозгового вещества. Помимо этого, стабильно высокий уровень GFAP в течение 2 дней после травмы значительно повышает риск летального исхода у пациентов.
Еще одним предиктором повреждения ткани мозга является альфа-II-спектрин. Альфа-II-спектрин – это компонент цитоскелета нейронов коры головного мозга, субстрат для кальций-активируемых цистеиновыхпротеиназ (калпаин, капсаза-3). Обнаруживается также в пресинаптических окончаниях или в субаксолемномкомпартменте аксонов. Протеиназы являются основными факторами, вызывающими некротические и апоптотические процессы в клетках при ишемии и травме головного мозга, соответственно. Они активируются после травмы и расщепляют спектрин, в результате в цереброспинальной жидкости и тканях мозга значительно повышается концентрация спектрина и продуктов его распада (SBDPs145 – производное калпаина, SBDPs120 – производное каспазы-3). Средняя концентрация SBDPs145 достигает своего пика рано (в течение 6часов после травмы) и снижается медленно (в течение 7 дней). SBDPs120 показывает устойчивый подъем, который сохраняется в течение как минимум 7 дней, тогда как пик концентрации приходится на 5-е сутки. На 2-3-е сутки после ЧМТ уровень альфа-II-спектрина достигает максимума [40; 41].
Рассматривается возможность применения расщепленного тау-белка (MAP-tau) в качестве биомаркера повреждения мозга.Он представляет собой фосфопротеин, ассоциированный с микротрубочками. Чаще всего встречается в нейронах ЦНС, локализуется в аксональном компартменте. В результате повреждения аксонов MAP-tau подвергается протеолизу и получает доступ к спинномозговой жидкости и сыворотке крови. В течение первых 24 часов уровень MAP-tau достигает своего пика, затем постепенно снижается в течение 7 суток [42].
Другие потенциальные биомаркеры при ЧМТ: убиквинтин С-терминальная гидролаза L1 (ubiquitin C-terminalhydrolase, UCH-1), воспалительные цитокины и др., изучены недостаточно и не являются диагностически значимыми.
Заключение
Таким образом, проведенный анализ публикаций результатов исследований ДАП показал отсутствие сформированного, научнообоснованного алгоритма применения клинико-морфологических критериев судебно-медицинской диагностики данной патологии в случаях тяжелой черепно-мозговой травмы. Это свидетельствует о необходимости проведения исследований для поиска комплексного решения данного вопроса с применением различныхметодов исследования (анализ клинической картины, морфологических, гистологических изменений и биомаркеров) в случаях с подозрением на ДАП в судебно-медицинской практике.
Библиографическая ссылка
Ефимов А.А., Савенкова Е.Н., Алексеев Ю.Д., Райкова К.А., Коротина О.С., Корсак В.О. ДИФФУЗНОЕ АКСОНАЛЬНОЕ ПОВРЕЖДЕНИЕ МОЗГА С СУДЕБНО-МЕДИЦИНСКИХ ПОЗИЦИЙ // Современные проблемы науки и образования. – 2020. – № 5.
;
URL: https://science-education.ru/ru/article/view?id=30140 (дата обращения: 06.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Периодически, приблизительно в 15-20% случаев, по данным «нейронного теста» (аутоантитела к аутоантигенам аксонов и миелиновой оболочки — общий белок миелина) мы выявляем у больных с психическими расстройствами и, в частности, страдающих зависимостью от психоактивных веществ, патологию аксонов, которую можно рассматривать либо как следствие воспалительного процесса, либо демиелинизирующих процессов или аксонопатию метаболического характера.
Патология аксонов, вероятно, может включать в себя: их утрату, пересечение, нарушенный аксональный транспорт, повреждение оболочки, дистального или проксимального отделов этих отростков нейронов. «Незащищенные аксоны» вследствие повреждения или утраты миелиновой оболочки становятся более уязвимыми и восприимчивыми к их дальнейшему повреждению.
В психиатрии мы чаще всего встречаемся с хроническим поражением аксонов, в неврологии, например, при рассеянном склерозе — с острым. Маркерами острого повреждения аксонов считаются: дефосфолирование нейрофиламентов, нарушение аксонального транспорта, экспрессия специфических кальциевых каналов и пересечение аксонов.
Нарушение аксонального транспорта («поперечное повреждение аксонов») можно обнаружить при помощи белков, транспортирующихся по аксонам. Белки аккумулируются в поперечных срезах или в зонах нарушенного транспорта. Одним из таких белков является амилоидный белок предшественник, который синтезируется в нейронах и транспортируется на периферию вдоль аксонального цитоскелета. Некоторые исследователи полагают, что повреждение аксонов происходит при атаке на миелиновую оболочку, что аксонотоксичные компоненты присутствуют среди медиаторов воспаления, повреждающих миелиновый — олигодендроцитарный комплекс. Возможно, аксоны утрачивают трофическую поддержку, получаемую от олигодендроцитов. Скорее всего, основными мишенями аутоиммунного ответа при некоторых психических расстройствах являются олигодендроциты и миелиновые оболочки.
Олигодендроциты более восприимчивы к повреждению вследствие влияния большого числа иммунологических или токсических эффекторов, включая цитокины (TNF-альфа), реактивные виды кислорода или азота, медиаторов возбуждения (глутамат), компонентов комплимента, протеолитических и липолитических энзимов и др. агентов. Целостность аксонов в первую очередь зависит от взаимодействия аксонов и олигодендроцитов, которые являются миелинобразующими клетками и доставляющими к аксону «трофические сигналы выживания». Заключительная фаза разрушения цитоскелета аксонов заключается в притоке в него ионов Ca2+, активирующих широкий спектр протеиназ, например, кальпаина, что и приводит к деинтеграции аксона (этот процесс можно предотвратить с помощью блокады входа в аксон Na+ или Ca+).
Диффузное аксональное повреждение головного мозга (ДАП) – это травма с поражением аксонов. При таком повреждении нарушается целостность аксонов, передающих нервные сигналы от клеточных тел к иннервируемым органам и другим нейронам.
Последствия черепно-мозговой травмы (ЧМТ) с диффузным повреждением аксонов очень серьезные. Человек практически сразу впадает в кому, которая грозит переходом в вегетативное состояние. Непосредственной причиной являются надрывы и разрывы аксонов – нейритов, представляющих собой длинные цилиндрические отростки нервных клеток. Помимо этого, в структурах мозга образуются мелкоочаговые кровоизлияния.
При ДАП-синдроме поражаются, как правило, следующие зоны:
- ствол головного мозга;
- белое вещество полушарий;
- мозолистое тело;
- перивентрикулярные зоны мозга.
Аксональное повреждение головного мозга наиболее часто встречается у детей, включая новорожденных, и молодежи. В детском возрасте неврологический дефицит более выражен, а кома более глубокая.
Причины
Синдром диффузного повреждения мозга возникает в результате травм, которые обусловлены боковым ускорением черепа. Для этого не требуется прямой удар по голове, поэтому переломы и видимые раны часто отсутствуют.
Если траектория головы в момент травмы вертикальная, повреждаются преимущественно сосуды с формированием гематом в мозговом веществе. Ускорение в угловой и боковой плоскости приводит к диффузному повреждению аксонов мозга.
Диффузное поражение вызывают травмы, полученные в ДТП, при падении с высоты и резком изменении внешнего давления (подводные погружения, взрывы, падение давления в барокамере, некорректное применение ИВЛ и пр.).
Перечисленные виды травм предполагают боковое ускорение головы с поворотами более подвижных полушарий мозга и перекручиванием более стабильных. Не исключен также сдвиг отдельных мозговых слоев или отделов, который может спровоцировать надрыв или разрыв аксонов и мелких капилляров. Достаточно незначительного смещения церебральных структур для нарушения целостности нейритов и сосудов.
Агишев Дамир Адгемович
врач – невролог
Запишитесь на онлайн-консультацию, если ваш близкий человек попал в беду и находится в коме. Наши врачи дистанционно – по телефону или видеосвязи – изучат историю болезни и расскажут, чем вы можете ему помочь. При необходимости порекомендуют профильную клинику. Консультации проводятся круглосуточно.
Online консультация
Симптомы
Типичным симптомом диффузного аксонального повреждения головного мозга является кома. Она может быть умеренной или глубокой, но всегда возникает в первые минуты после травмы.
В большинстве случаев кома переходит в вегетативное состояние, при котором надолго останавливается деятельность коры головного мозга. В среднем кома длится около недели.
Для диффузии головного мозга характерны хаотичные телодвижения пациента, возникающие внезапно на фоне общей обездвиженности. Снижается или пропадает зрачковый рефлекс, отмечается разный диаметр зрачков (анизокория), которые часто находятся не на одной горизонтальной линии.
У пациентов с диффузным аксональным поражением мозга нарушается частота и ритм дыхания, твердеют затылочные мышцы. Отмечается симптом Кернига, при котором пострадавший не может полностью разогнуть ногу.
Клиника ДАП включает ряд вегетативных проявлений:
- повышенное кровяное давление;
- потливость;
- слюнотечение.
У многих получивших травму согнутые в локтях руки прижаты к телу, кисти свободно свисают, подобно лапкам грызунов или кенгуру. Сухожильные рефлексы сначала повышаются, но после снижаются или исчезают вовсе.
Нарушается тонус мышц, что может проявиться в виде приступов мышечного гипертонуса в руках или ногах. Конечности плотно прижимаются к телу или хаотично сгибаются-разгибаются.
3 степени тяжести
|
Степень тяжести |
Длительность комы |
Интенсивность симптоматики |
|
1 – легкая |
От 6 часов до суток |
Симптомы слабовыраженные |
|
2 – средняя (умеренная) |
Больше суток |
Грубые стволовые признаки отсутствуют |
|
3 – тяжелая |
Продолжительная кома, которая может длиться годами |
Тяжелый неврологический дефицит, высокий риск летальности |
Лечится ли диффузное состояние
Все зависит от степени тяжести заболевания. В последние годы появилось мнение, что у детей и молодых людей аксоны способны саморегенерироваться. Это подтверждается частичным восстановлением неврологических функций у пациентов с диффузным повреждением аксонов мозга.
Диффузное аксональное повреждение головного мозга в детском и молодом возрасте более распространено, по сравнению со взрослыми. Учитывая анатомо-физиологические особенности детского организма, процессы, протекающие после черепно-мозговых травм, имеют значительные отличия.
Пример из практики:
Женщина 28 лет госпитализирована в отделение травматологии в бессознательном состоянии крайней степени тяжести. Она пострадала в автомобильной аварии, ее машина несколько раз переворачивалась. Диагноз при поступлении – тяжелый ушиб головного мозга. Назначено лечение, пациентка пришла в сознание через 27 часов после ДТП. Данные МРТ соответствуют классическим признакам диффузного аксонального повреждения мозга средней степени тяжести.
У детей чаще восстанавливается сознание, хотя бы на время, после сравнительно легких ЧМТ, и более вероятно быстрое улучшение состояния. Помимо этого, прогноз у них благоприятнее, чем можно предположить с учетом исходного неврологического дефицита.
Тем не менее, риск тяжелой инвалидизации тем выше, чем дольше продолжается кома, и чем выраженнее неврологические симптомы. Если, конечно, пострадавший выживает.
Диффузное аксональное поражение мозга с комой продолжительностью не больше недели прогностически довольно благоприятно. Восстановление идет хорошо, инвалидизация умеренная.
Если кома длится больше 8 дней, высок риск тяжелой инвалидности либо перехода в вегетативное состояние.
Последствия
У людей, получивших ЧМТ по типу диффузии, возможно 2 исхода:
- Выход из коматозного состояния.
- Переход в вегетативное состояние.
Выход из комы
Если пациент открывает глаза, способен фиксировать взгляд на лицах и предметах, а также следить за ними глазами, это означает выход из комы. Спровоцировать его может все, что угодно – звук, яркий свет, боль.
Внимание! Сознание постепенно проясняется, к пациенту возвращается способность выполнять простейшие действия и разговаривать. Параллельно с этим регрессирует неврологическая симптоматика.
Переход в вегетативное состояние
Продолжительная кома чаще всего ведет к переходу в вегетативное состояние, которое может быть стойким или иметь эпизодический характер. В последнем случае его длительность составляет от 1 дня до нескольких месяцев.
В медицине вегетативное состояние определяется, прежде всего, по открыванию глаз с отсутствием фокусирования взгляда. Долговременное пребывание в вегетативном состоянии сопровождается такими симптомами, как:
- учащение сердечного ритма;
- повышенная температура тела;
- частое поверхностное дыхание – тахипноэ;
- образование пролежней;
- полиорганная недостаточность;
- застойная пневмония, сепсис, почечные инфекции с развитием пиелонефрита.
В результате диффузного аксонального повреждения в мозге возникают необратимые изменения, влекущие за собой остаточные явления, среди которых могут быть:
- парезы и параличи;
- частичная потеря памяти;
- психические отклонения;
- речевые дефекты;
- симптомы бульбарного синдрома – нарушение глотания, кашель и поперхивание во время приема пищи, слабость голоса, гнусавость;
- двигательные расстройства (тики, мышечные спазмы, тремор конечностей и т. д.).
При выходе из вегетативного состояния серьезно страдает психика: развивается слабоумие, лабильность настроения, апатичность, появляются трудности с запоминанием текущих событий.
Продолжительное вегетативное состояние заканчивается летально.
Агишев Дамир Адгемович
врач – невролог
Запишитесь на онлайн-консультацию, если ваш родственник или близкий человек находится в коме или вегетативном состоянии. Наши врачи на дистанционной консультации расскажут, как вести себя с пострадавшим, и что можно для него сделать. Специалисты на связи круглосуточно.
Online консультация
Частые вопросы
Лечится ли травма головного мозга с повреждением аксонов хирургически?
+
Оперативное вмешательство имеет строгие показания и проводится при обнаружении гематом и размозжения, компрессионных переломов черепных костей.
Какие препараты назначают при диффузных изменениях сосудов?
+
Такие препараты входят в стандартную схему терапии и включают Винпоцетин, Циннаризин.
Какие исследования проводятся для подтверждения диагноза ДАП?
+
Наиболее информативными являются компьютерная и магнитно-резонансная томография.
Как лечат пациентов в коме?
+
Пострадавших обязательно подключают к аппарату искусственной вентиляции легких, они получают питание парентерально. Интенсивное лечение направлено на поддержание работы внутренних органов, ликвидацию отека мозга, предотвращение инфекций. Избыточная двигательная активность является показанием к применению наркоза.
Заключение эксперта
При обследовании пострадавших важно учитывать характер травмы (резкое ускорение или торможение головы, приводящее к натяжению и разрыву аксонов), продолжительность комы и имеющиеся симптомы, а также данные МРТ. От точности диагностики зависит правильность назначения и исход лечения.