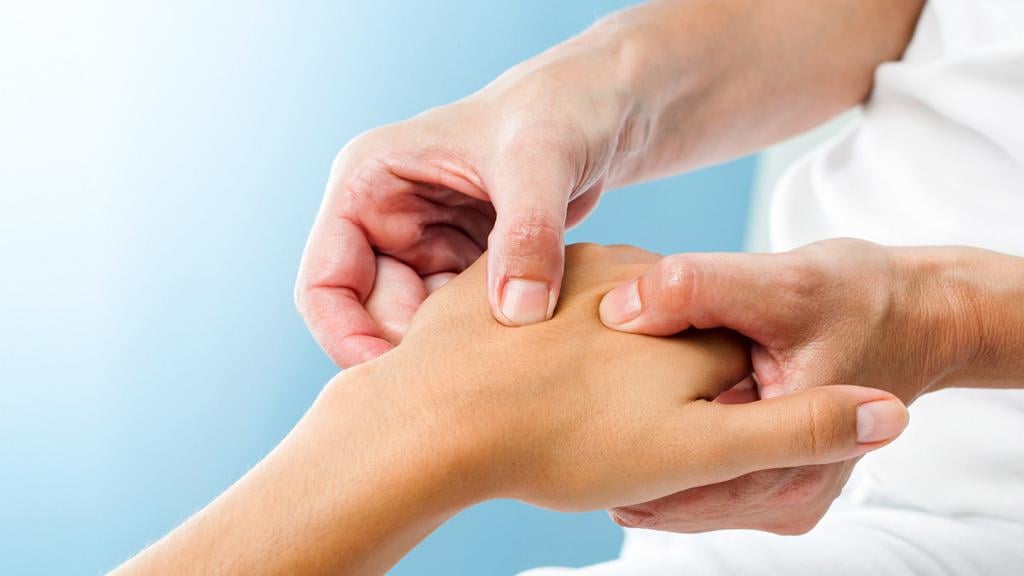
ДАП, зачастую, ведет к коме, в результате которой человек может перейти в вегетативное состояние.
Диффузия головного мозга чаще происходит с молодыми людьми, которые попадают в дорожно-транспортные происшествия, становятся жертвами драк и избиений с повреждением головного мозга, а также детьми, у которых и кома намного глубже, и неврологические нарушения грубее.
Вариант этой ЧМТ был впервые описан в 1956 за рубежом, а само название появилось в 1982 году. Состояние при ДАП тяжелое, протекающее в длительной коме, которая сразу возникает после травмы и характеризуется длительным течением.
Аксоны, поврежденные или разорванные в результате ЧМТ, и мелкие кровоизлияния равномерно распределяются по церебральным структурам, при этом нарушается иннервация всех зависимых органов. Самые распространенные места повреждений:
- ствол мозга;
- белое вещество;
- мозольное тело;
- волокна перивентрикулярные.
Диффузная травма головного мозга – это всегда серьезнейшее состояние с перспективой перехода в вегетативное состояние, нередок и смертельный исход.
Причины и морфология ДАП
Самые распространенные причины ЧМТ при ДАП:
- сильный ушиб о лобовые стекла в ДТП;
- падение;
- удар тяжелым предметом;
- синдром сотрясения у детей, при котором мозг подвергается сильному ушибу впоследствии резкой тряски, а также избиения, падения.
Синдром ДАП является результатом ушибов, вызванных угловым ускорением головы. При этом может и не быть прямого столкновения с объектом травмы.
Вследствие этого у некоторых пациентов не наблюдается переломов черепа и других видимых ранений, что несколько затрудняет диагностику. Статистика говорит о том, что именно повреждение по косой ведет к повреждению аксонов и возникновению ДАП.
Морфологически для этой травмы характерны три следующих очага повреждения:
- головной мозг;
- мозольное тело;
- стволовой мозг и диффузно распределенные разрывы.
Первые два очаговых признака – макроскопические, которые располагаются в виде гематомы до пяти мм, выглядящие как надорванная ткань с окровавленными краями. Через несколько дней после ЧМТ, очаг пигментируется и затем рубцуется. Рана в мозолистом теле может разрешиться образованием сосудистой кисты.
Аксональные нарушения при травме
Особенности клинической картины
Кома при диффузном повреждении головного мозга продолжается до трех недель и проявляется следующими симптомами:
- рефлекс зрачка нарушается;
- происходит паралич взгляда;
- дыхательный ритм меняется;
- повышается тонус мышц;
- появляется парез ног и рук;
- диагностируется гипертония;
- появляется фебрильная или субфебрильная температура и другие вегетативные расстройства.
Когда пациент с ДАП выходит из комы, он оказывается в вегетативном состоянии со следующими симптомами:
- глаза открываются на раздражители или самостоятельно;
- взгляд не сконцентрирован и не следует за движущимися предметами.
Вегетативное состояние, сопровождающееся нарушением рефлексов и симптомами разъединения функций мозговых полушарий, может продолжаться, в среднем, от нескольких дней до нескольких лет. Чем больше нахождение в нем, тем скорее появляются такие признаки полиневропатии, как:
- ослабление кистей рук;
- хаотическое движение мышц;
- расстройства нейротрофики;
- учащение пульса;
- отеки;
- тахипноэ и др.
После выхода из вегетативного состояния личность выпадает. Основные признаки нарушений после выхода:
- экстрапирамидные расстройства;
- расстройства психики, проявляющиеся отсутствием интереса к окружающей пациента действительности, агрессия, амнезия, слабоумие.
Степени поражения
Диффузное аксональное повреждение головного мозга бывает трех степеней тяжести:
- легкой – продолжительность комы от 6 до 24 часов, ЧМТ незначительна;
- средней– кома больше 24 часов, но черепно-мозговая травма умеренная;
- тяжелой – длительная кома, поражения значительные, происходит сдавливание мозга.
Тяжелая степень характеризуется массовым повреждением аксонов, которое приводят к кровоизлияниям в мозг. ДАП при этом может приводить к коме, продолжающейся годами и летальному исходу.
Начальное состояние мозга после выхода из такой комы восстановить не представляется возможным, единицы вернулись к более-менее нормальной жизни после таких повреждений.
Постановка диагноза
Диагноз диффузное поражение головного мозга ставится после компьютерной томографии, результаты которой в остром периоде отличаются увеличением объема мозговых полушарий, уменьшением или сдавливанием боковых расстояний и основания мозга. В белом веществе, стволе и мозолистом теле находятся мелкие кровоизлияния.
При обследовании наблюдается молниеносное развитие признаков ДАП и дегенерации.
ЭЭГ при синдроме ДАП выявляет изменения в подкорке и стволе мозга, диэнцефальный синдром. В анализе крови отмечается резкое повышение серотонина, значительное уменьшение дофамина и скачок адреналина, что предполагает терапию, направленную на снижение симпатико-адреналиновых симптомов.
В результате КТ определяют повышено внутричерепное давление или, наоборот, понижено либо отсутствует. В таком случае подключают датчик. Если на КТ отток ликвора в норме, то и внутричерепное давление будет в норме.

Поддержка состояния пострадавшего
После диффузной травмы головного мозга нередко диагностируются субдуральные ликворные скопления над большими полушариями мозга, которые в дальнейшем рассасываются, удалять хирургически их не надо.
Аксональное повреждение головного мозга чаще всего лечится консервативно. Нейрохирургическая операция проводится при сочетании разрывов и повреждений аксонов с очаговыми повреждениями, усиливающими сдавливание и провоцирующими гидроцефальный синдром.
В коме пациента подключают к ИВЛ, кормят парентерально и вводят следующие лекарства:
- для установления правильного кислотно-щелочного и водно-электролитного баланса;
- ноотропные и вазоактивные;
- устраняющие гипертензию или гипотонию;
- антибиотики для исключения сопутствующих инфекций.
Для возобновления психэмоциональной сферы вводят прием психостимуляторов.
После выхода из комы:
- вводят ноотропы и сосудистые лекарства для нормализации и улучшения состояния ЦНС, ноотропы также важны для последующей реабилитации;
- назначают препараты для улучшения метаболизма и биостимуляторы;
- проводят лечебную физкультуру для профилактики парезов;
- пациент занимается с логопедом.
Гормональные препараты при ДАП не назначают по ненадобности. После операции, если она все же состоялась (произошло сдавление головного мозга при сопутствующих травмах), вводят препараты, препятствующие образованию отеков, сосудистые средства, ноотропы, антихолинэстеразные, психотропные (во избежание развития агрессии и депрессии) и нейромедиаторы.
В период восстановления проводится такая же терапия, как и после выхода из комы.
Исход тяжелой травмы и ее последствия
Прогноз и последствия диффузного аксонального повреждения зависит от степени поражения аксонов головного мозга и тяжести вторичных признаков, таких как повышенное внутричерепное давление, гипергидроз, разбухание мозговых оболочек, психические нарушения, развитие слабоумия и т. д.
Исход также зависит от того как помогают лечебные методы, направленные на ликвидацию последствий ДАП – вторичные повреждения и осложнения.
Прогноз предполагает, что чем больше человек находился в коматозном состоянии, тем более риск развития неблагоприятных поражений, вплоть до летального исхода. Шансов на восстановление будет также минимум.

Но, к сожалению, чаще у выживших людей последующее течение синдрома ДАП может идти по двум сценариям:
- выход из коматозного состояния;
- переход в вегетативное состояние.
При первом варианте глаза больного открываются, и происходит слежение за предметами и фиксация взгляда на объекте. Это может иметь как спонтанный выход, так и направляемый организованными раздражителями, звуком и болевыми манипуляциями.
Затем пациент восстанавливает сознание, выполняет обращенные к нему просьбы, словесный багаж расширяется, он начинает общаться. Неврологические патологии при этом медленно регрессируют.
У больных, которые вышли из вегетативного состояния, развиваются экстрапирамидальные симптомы, сопровождающиеся психическими нарушениями (слабоумие, лабильность настроения, аспонтанность, спутанность сознания). При втором варианте летальный исход через определенное время неизбежен из-за истощения нейромедиаторов и соматических осложнений.
Современные исследования подтверждают регенерацию аксонов у детей и молодых людей, у которых мозг еще не завершил формирование. Происходит восстановление неврологических и психических процессов. При продолжительной коме оно проблематично, инвалидизация гарантирована.
Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Аксональные полинейропатии: патогенез и лечение
Как цитировать:
Ковражкина Е.А. Аксональные полинейропатии: патогенез и лечение. Журнал неврологии и психиатрии им. С.С. Корсакова.
2013;113(6):22‑25.
Kovrazhkina EA. Axonal polyneuropathies: pathogenesis and treatment. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2013;113(6):22‑25. (In Russ.)

Полинейропатия (ПНП) — заболевание периферической нервной системы, развивающееся в результате диффузного поражения периферических нервов — их аксонов (аксональные полинейропатии), миелиновой оболочки (демиелинизирующие полинейропатии) либо тел нейронов (нейронопатии) [9]. В основе патогенеза полинейропатий аксонального типа лежит генерализованное повреждение осевых цилиндров периферических нервов.
Патогенез. Аксональная дегенерация (аксонопатия) — результат нарушения метаболизма нейрона вследствие недостаточной выработки энергии в митохондриях и/или нарушения аксонального транспорта. Миелиновая оболочка при аксонопатиях страдает вторично (вторичная демилинизация). Миелин может повреждаться в результате ишемии нервов (поражения vasa nevrorum), отложения токсичных для нерва веществ или иммунных комплексов в эндоневрии (что характерно, например, для сахарного диабета, особенно 1-го типа — с высокой гипергликемией и аутоиммунными нарушениями) [4]. Соответственно, среди причин аксонопатии периферических нервов указывают нарушения метаболизма, токсические влияния, ишемию нервных стволов, наследственную предрасположенность и аутоиммунные механизмы [5]. По этиологическому фактору подавляющее большинство аксональных ПНП составляют метаболические и токсические, среди которых первое место занимают диабетическая (до 50% среди пациентов с сахарным диабетом и до 90% поражений нервной системы при диабете [9, 12]) и алкогольная (до 50% среди больных алкоголизмом [2, 9]).
Причиной токсико-метаболических ПНП является экзо- и эндогенные интоксикации. Поступающие извне вещества или собственные его метаболиты, токсичные для периферических нервов, вызывают их повреждение. Тяжесть этого повреждения зависит от степени токсичности данного агента (выделяют острые метаболические ПНП, развивающиеся на фоне тяжелой общей интоксикации, например, ПНП при быстро нарастающих печеночной недостаточности или уремии, при отравлении фосфоорганическими веществами, мышьяком, свинцом, как нежелательный эффект лечения препаратами лития, цитостатиками), длительности его воздействия, собственных генетических особенностей метаболизма нервной ткани, немаловажную роль играет также аутоиммунный фактор [13].
Большинство часто встречающихся в клинике метаболических ПНП являются итогом длительного воздействия эндо- и экзогенного токсического агента (диабетическая, печеночная, уремическая, алкогольная, профессиональная, лекарственная). Результатом такой интоксикации является повреждение осевого цилиндра аксона. Клинически это проявляется не только нарушениями чувствительности и мышечной слабостью (что свойственно и для демиелинизирующих ПНП), но и мышечными гипотрофиями, выраженными трофическими нарушениями. Все эти признаки свидетельствуют о длительном страдании аксонов периферических нервов. При электронейромиографии (ЭНМГ) выявляется снижение (иногда — вплоть до полного отсутствия) амплитуды сенсорных потенциалов и М-ответов периферических нервов. У пациентов с ПНП аксонального типа зачастую в достаточной степени сохранены двигательные функции (отсутствуют выраженные парезы, больные сохраняют способность ходить, часто без дополнительной опоры), тогда как инвалидизирующими являются чувствительные (боли и парестезии) и трофические нарушения. Так, аксональная сенсомоторная ПНП является одним из важных патогенетических факторов развития синдрома диабетической стопы [3]. Аксональное повреждение нервов развивается медленно, исподволь, но при правильном лечении потенциально обратимо.
При массивном воздействии токсичного для периферической нервной системы агента, участии ишемического компонента (за счет страдания vasa nevrorum), аутоиммунных влияний развиваются ПНП аксонально-демиелинизирующего типа такие, например, как уремическая, свинцовая, амиодароновая, вызываемые воздействиями высокотоксичных для нервов веществами [9]. При наиболее распространенной диабетической ПНП, демиелинизирующий компонент максимально представлен при инсулинпотребном сахарном диабете (характеризующимся более высокой гипергликемией), а выраженность демиелинизации периферических нервов нарастает при резких повышениях уровня глюкозы крови [4, 7]. На представленность демиелинизирующего компонента при метаболических ПНП влияют наследственные факторы (генетически обусловленная миелинопатия, которая протекала бы субклинически без дополнительного воздействия токсического агента), аутоиммунное повреждение (например, миелинопатия более выражена при сахарном диабете 1-го типа, при котором иммунокомпетентные клетки повреждают ткань поджелудочной железы) [4, 14].
ПНП аксонально-демиелинизирующего типа протекают более тяжело, с выраженными парезами, сенситивной атаксией, нейропатическим болевым синдромом, но нередко, при своевременном устранении действия токсического фактора, быстро регрессируют. При очень тяжелом и упорном течении заболевания, учитывая роль аутоиммунного механизма в развитии данного типа метаболических ПНП, необходимо кратковременное назначение иммуномодулирующей терапии (чаще глюкокортикоидов, иногда цитостатиков) [9, 11].
Клиническое течение ПНП. Как уже было сказано, при длительном воздействии умеренно токсичного для нервов агента аксонопатия развивается медленно, что не всегда заметно. Преимущественное поражение бедно миелинизированых вегетативных и сенсорных волокон вызывает парестезии, повышенную холодовую чувствительность кистей и стоп, негрубые трофические нарушения. При ЭНМГ не всегда удается выявить характерные признаки сенсорной и моторной аксонопатии — снижение амплитуд сенсорных потенциалов и М-ответов — если исследуются крупные богато миелинизированные нервы, аксоны которых страдают позднее. Быстрее выявляются признаки вторичной миелинопатии, как клинические — присоединение нейропатических болей, парезов, так и миографические — снижение скорости распространения возбуждения (СРВ) по нервам.
При условии адекватной терапевтической стратегии — устранения действия повреждающего периферические нервы фактора, назначение препаратов, влияющих на метаболизм нервной ткани, — наступает ремиелинизация, что отражается и на ЭНМГ в виде нарастания СРВ, и клинически — в виде регресса парезов и нейропатических болей, улучшения чувствительности. Однако, если полинейропатия развивалась в условиях длительного действия токсического агента, поражение аксонов периферических нервов, снижение амплитуд сенсорных потенциалов и М-ответов на ЭНМГ сохраняется, поскольку осевые цилиндры нервов обладают гораздо меньшей способностью к регенерации, чем миелин.
Так, в проведенном исследовании [8], посвященном лечению алкогольной ПНП, ведущим ЭНМГ-признаком поражения периферических нервов у большинства пациентов имелось снижение СРВ. В условиях элиминации токсического фактора (в данном случае приема алкоголя) и лечения препаратом α-липоевой кислоты (берлитион в суточной дозе 600 мг), у пациентов быстро, в течение 1-го месяца, регрессировали ЭНМГ и клинические признаки миелинопатии — уменьшалась выраженность парезов и болевого синдрома (в баллах по визуальной аналоговой шкале с 5,2±1,0 до 2,6±0,5) достоверно (р<0,05) нарастала СРВ (по моторным волокнам n. tibialis с 36,93±1,12 до 42,22±0,8 м/с, по сенсорным волокнам n. suralis c 32,45±0,70 до 38,24±0,50 м/с), но признаки аксонопатии (снижение амплитуд сенсорных и моторных ответов периферических нервов, сенсорные выпадения по полиневритическому типу, трофические нарушения) сохранялись и после 6 нед лечения.
Таким образом, можно представить следующую схему развития и течения метаболических ПНП (см. таблицу): высокотоксичные, высококонцентрированные токсические агенты приводят к развитию полинейропатии аксонально-демиелинизирующего типа (в развитии которых также значительную роль играют наследственный, сосудистый, аутоиммунный факторы), длительно действующие эндо- и экзогенные яды приводят преимущественно к страданию аксонов с умеренно выраженным вторичным поражением миелина (так как постоянно идет процесс ремиелинизации) [7].
Лечение. Аксональное повреждение нервов как первичного, так и вторичного характера, обратимо за счет регенерации поврежденных аксонов и концевого спрутинга сохранившихся аксонов, однако этот процесс протекает медленно (месяцы), часто аксональная регенерация бывает неполной. Для регресса аксонопатии периферических нервов необходимо нивелировать воздействие токсического агента (коррекция метаболических и алиментарных нарушений, детоксикация, влияние на аутоиммунные механизмы), большое значение имеет также патогенетическая терапия, направленная на восстановление нарушенного метаболизма аксонов (митохондриальные нарушения, повреждения, вызванные окислительным стрессом).
Таким образом, в патогенетическом лечении аксональных ПНП, в зависимости от их нозологического и клинико-электрофизиологического варианта, должны присутствовать детоксикация и коррекция метаболических и алиментарных нарушений; сосудистая терапия (дезагреганты, венотоники, пентоксифиллин, вазопростан); препараты, воздействующие на универсальные механизмы поражения аксонов (витамины и витаминоподобные препараты); при необходимости — воздействие на аутоиммунные компоненты (глюкокортикоиды, плазмаферез). В некоторых случаях, когда представленность миелинопатии в структуре поражения периферических нервов велика и трудно отличить токсико-метаболическую полинейропатию от воспалительной (например, синдром Гийена-Барре у пациента с алкоголизмом или дебют хронической воспалительной демиелинизирующей ПНП у больного с сахарным диабетом) необходимо проводить пробную иммуномодулирующую терапию, ее быстрая эффективность позволит высказаться в пользу превалирования у пациента аутоиммуного механизма поражения периферических нервов [7, 11].
В лечении всех метаболических ПНП необходимо устранить (по возможности) поражающий периферические нервы яд и использовать препараты, улучшающие метаболизм нервной ткани периферических нервов. Последние необходимо применять в течение длительного времени, так как первым эффектом данных препаратов будет ускорение ремиелинизации, но для восстановления самих аксонов — а данные ПНП являются аксональными — требуется значительно большее количество времени.
α-липоевая (тиоктовая) кислота — витаминоподобное вещество, эндогенно образующееся в организме, как кофермент участвует в окислительном декарбоксилировании α-кетокислот. Основная функция эндогенной липоевой кислоты в организме — участие в аэробном метаболизме продукта гликолиза пирувата. Тиоктовая кислота является коферментом в окислительном декарбоксилировании пировиноградной кислоты до ацетил-КоА и α-кетоглутаровой до сукцинил-КоА в цикле Кребса. Облегчая превращение молочной кислоты в пировиноградную с последующим декарбоксилированием последней, α-липоевая способствует ликвидации метаболического ацидоза [6]. Тиоктовая кислота обладает сложным комплексным действием: гипогликемическим, липотропным, гепатопротекторным, антиатеросклеротическим, является мощным антиоксидантом. Липоевая кислота может существовать в окисленной (-S-S-) и восстановленной (SH-)-формах, благодаря чему реализуются ее коферментные и антиоксидантные функции. Восстановленная форма, дигидролипоевая кислота, служит донором электронов для восстановления других антиоксидантов (витамины С, Е и глутатион), осуществляет рецикл витамина Е при его истощении. Дигидролипоат повышает интра- и экстрацеллюлярный уровни глутатиона — эндогенного антиоксиданта.
Эффект экзогенно вводимой α-липоевой кислоты в отношении полиневритического синдрома впервые обнаружен при сахарном диабете. Обусловленная сахарным диабетом гипергликемия приводит к отложению глюкозы на матричных протеинах кровеносных сосудов и образованию конечных продуктов прогрессирующего гликозилирования, в результате чего уменьшается эндоневральный кровоток, возникает эндоневральная ишемия. α-липоевая кислота приводит к снижению уровня глюкозы в крови и повышению содержания гликогена в печени, обладает гипогликемическим действием. На фоне воздействия препарата уменьшается выраженность сенсорных симптомов полинейропатии — боли, жжения, ощущения онемения и «ползания мурашек» в конечностях.
Применение α-липоевой кислоты оказывает положительное влияние на универсальные механизмы аксонального повреждения, такие как повреждающее действие окислительного стресса и митохондриальная дисфункция — за счет антиоксидантного действия, повышения содержания глутатиона. Энергокорригирующее действие α-липоевой кислоты, тропное именно к аксонам нервов, способствует, в конечном итоге, быстрейшей регенерации аксонов [18].
Препарат не только редуцирует проявления окислительного стресса, но и оказывает влияние на сосудистый компонент поражения периферических нервов, нормализуя эндоневральный кровоток (что имеет большое значения, например, при дибетической микроангиопатии) [16, 17]. Комплексный механизм действия α-липоевой кислоты объясняет ее эффективность в отношении всех аксональных ПНП, патогенез которых связан с токсико-дисметаболическим и сосудистым факторами. Так, эффективность тиоктовой кислоты показана при уремической и алкогольной ПНП, при поражении периферических нервов, индуцированном цитостатиками [15]. Для регенерации аксонов периферических нервов на фоне токсико-метаболических влияний важны также детоксикационный и гепатопротекторный эффекты α-липоевой кислоты. Положительный эффект препарата отмечен в отношении заболеваний печени, печеночной комы, некоторых интоксикаций, в том числе алкогольной [6, 10].
При значительно выраженной аксонопатии, учитывая медленную скорость регенерации аксонов, необходимо длительное применение достаточно высоких доз α-липоевой кислоты. Обычно ее суточная доза составляет 600 мг. Предпочтительнее начинать лечение с внутривенного капельного введения препарата — 600 мг (24 мл раствора) в разведении на 200 мл физиологического раствора, длительность инфузии составляет от 2 до 4 нед в зависимости от тяжести ПНП. В особо тяжелых случаях препарат вводят внутривенно капельно в дозе 1200 мг в сутки. После переходят на пероральный прием α-липоевой кислоты — в таблетках по 600 мг не менее 2 месяцев [1].
В соответствии с такой клинической потребностью — необходимостью длительного приема достаточно высоких доз α-липоевой кислоты, учитывая потенциально обратимый, но медленный характер аксональной регенерации — разработаны и фармацевтические формы препарата. Например, берлитион 300 и берлитион 600, производимые в виде раствора для внутривенных вливаний по 12 и 24 мл соответственно (для начального этапа лечения ПНП), так и таблеток по 300 и 600 мг (для продолжения терапии).
Соблюдение всех условий патогенетического лечения ПНП — нормализация гликемии, прекращение поступления экзогенного яда, детоксикация, коррекция аутоиммунных нарушений, длительное применение препаратов, нормализующих аксональный метаболизм, способствует постепенной регенерации аксонов, уменьшению выраженности чувствительных и двигательных нарушений, болевого синдрома, парестезий, парезов. Для уточнения динамики различных видов метаболических ПНП на фоне подобного терапевтического подхода необходимы дальнейшие исследования.
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Периодически, приблизительно в 15-20% случаев, по данным «нейронного теста» (аутоантитела к аутоантигенам аксонов и миелиновой оболочки — общий белок миелина) мы выявляем у больных с психическими расстройствами и, в частности, страдающих зависимостью от психоактивных веществ, патологию аксонов, которую можно рассматривать либо как следствие воспалительного процесса, либо демиелинизирующих процессов или аксонопатию метаболического характера.
Патология аксонов, вероятно, может включать в себя: их утрату, пересечение, нарушенный аксональный транспорт, повреждение оболочки, дистального или проксимального отделов этих отростков нейронов. «Незащищенные аксоны» вследствие повреждения или утраты миелиновой оболочки становятся более уязвимыми и восприимчивыми к их дальнейшему повреждению.
В психиатрии мы чаще всего встречаемся с хроническим поражением аксонов, в неврологии, например, при рассеянном склерозе — с острым. Маркерами острого повреждения аксонов считаются: дефосфолирование нейрофиламентов, нарушение аксонального транспорта, экспрессия специфических кальциевых каналов и пересечение аксонов.
Нарушение аксонального транспорта («поперечное повреждение аксонов») можно обнаружить при помощи белков, транспортирующихся по аксонам. Белки аккумулируются в поперечных срезах или в зонах нарушенного транспорта. Одним из таких белков является амилоидный белок предшественник, который синтезируется в нейронах и транспортируется на периферию вдоль аксонального цитоскелета. Некоторые исследователи полагают, что повреждение аксонов происходит при атаке на миелиновую оболочку, что аксонотоксичные компоненты присутствуют среди медиаторов воспаления, повреждающих миелиновый — олигодендроцитарный комплекс. Возможно, аксоны утрачивают трофическую поддержку, получаемую от олигодендроцитов. Скорее всего, основными мишенями аутоиммунного ответа при некоторых психических расстройствах являются олигодендроциты и миелиновые оболочки.
Олигодендроциты более восприимчивы к повреждению вследствие влияния большого числа иммунологических или токсических эффекторов, включая цитокины (TNF-альфа), реактивные виды кислорода или азота, медиаторов возбуждения (глутамат), компонентов комплимента, протеолитических и липолитических энзимов и др. агентов. Целостность аксонов в первую очередь зависит от взаимодействия аксонов и олигодендроцитов, которые являются миелинобразующими клетками и доставляющими к аксону «трофические сигналы выживания». Заключительная фаза разрушения цитоскелета аксонов заключается в притоке в него ионов Ca2+, активирующих широкий спектр протеиназ, например, кальпаина, что и приводит к деинтеграции аксона (этот процесс можно предотвратить с помощью блокады входа в аксон Na+ или Ca+).
Lindsey R. FISCHER, Jonathan D. GLASS, Departments of Neurology, and Pathology and Laboratory Medicine, Emory University School of Medicine, Atlanta, GA, USA
Резюме
Данные, полученные при исследовании бокового амиотрофического склероза у животных и людей, все больше подтверждают предположение о том, что дистальная дегенерация аксонов при этом заболевании начинается на исключительно ранних стадиях. Это происходит гораздо раньше появления первых признаков гибели двигательных нейронов и возникновения отчетливой симптоматики. Причина аксональной дегенерации в настоящее время не выяснена. Возможно, что сочетание нескольких процессов приводит к развитию данного состояния. Вовлечение местных повреждающих факторов и резкое уменьшение трофической поддержки по причине изменения метаболизма окружающих тканей являются обязательными компонентами при развитии данной патологии. Совершенно понятно, что аксон по своей природе не является простым придатком тела нейрона, его дегенерация и гибель подчиняются тем же законам и правилам. Эти данные подтверждаются рядом исследований, в которых использовались объекты с искусственно созданным состоянием амиотрофического латерального склероза. При анализе указанных данных, связанных с методами защиты двигательных нейронов от любых травмирующих факторов, было установлено, что они не привели к сколько-нибудь значимым изменениям симптоматики или удлинению времени нормального функционирования исследуемых нейронов. Аналогичные данные были получены при попытке использовать технологии по защите непосредственно аксона, исследуемой клетки. В настоящей статье приводится развернутый анализ состояний ранней аксональной дегенерации при боковом амиотрофическом склерозе и обсуждаются возможные механизмы развития данного состояния с акцентированием внимания на процессы оксидативного стресса. Обсуждается первичное значение аксональной дегенерации как возможного механизма развития данного заболевания двигательных нейронов. Кроме того, предлагаются к рассмотрению факторы, предупреждающие развитие аксональной дегенерации, как важный аспект терапии данного состояния.
Ключевые слова
боковой амиотрофический склероз, аксональная дегенерация, нейромышечная связь, супероксиддисмутаза, оксидантный стресс
Введение
Аксональная дегенерация является одним из основных клинических и патологических факторов развития бокового амиотрофического склероза (БАС). Аксональная дегенерация в основном заканчивается дисфункцией клетки или ее гибелью, связанной с валлеровской или подобной дегенерацией. Сейчас опубликовано множество работ, касающихся экспериментальных данных, которые говорят, что любая защита тел мотонейронов от внешних воздействий имеет исключительно малую эффективность по отношению к скорости развития симптомов БАС. Фактически даже генетические вмешательства, которые, казалось, могли бы полностью изменить скорость развития патологического состояния в мотонейронах спинного мозга, до сих пор не в состоянии предотвратить или замедлить ослабление и гибель животных в экспериментальной модели заболевания мотонейронов. Этот кажущийся парадокс может быть объяснен тем, что невозможно уберечь тела нейронов от патологических процессов, которые уже развились в их аксонах. Прямым следствием повреждения аксонов является дегенеративный процесс, развивающийся в мышечной ткани. Указанные факты еще раз подчеркивают выдвинутую не так давно идею о том, что дегенерация аксонов двигательных нейронов не является прямым следствием дегенерации и гибели тела родительского нейрона. Кроме того, подчеркивается, что даже незначительных изменений в аксональном метаболизме будет достаточно для формирования клинической картины. Именно поэтому предупреждение аксональной дегенерации является важным с терапевтической точки зрения. Успех в достижении этой цели даст возможность улучшить терапию БАС и других нейродегенеративных заболеваний.
Аксональная дегенерация при раннем БАС
Что общего между аксональной дегенерацией двигательных нейронов при моделировании БАС и аналогичными состояниями у человека?
Моделирование на животных
Развитие патологического процесса, сопровождающегося нейрональной дегенерацией, в настоящее время широко исследуется на животных при моделировании данной патологии. Важную роль занимают также исследования, проводимые на пациентах с нейродистрофической патологией и с невропатией двигательных нейронов спинного мозга в частности. В подавляющем большинстве случаев развитие нейродистрофии является первичным процессом, обусловливающим недостаточность функции нейронов и проявление симптомов заболевания. При этом даже весьма выраженные парезы сопровождаются неожиданно легкими изменениями двигательных нейронов. Данные явления некоторые авторы объясняют изменениями в генетическом аппарате клеток, обусловливающими выраженные изменения их функций с легкими морфологическими отклонениями. Аксональная дегенерация, несомненно, является следствием аналогичных патологических процессов, приводящих к гибели нейрона, что, в свою очередь, вызывает денервацию соответствующей мышцы. Данные, касающиеся экспериментальных моделей, на которых производился анализ описанных ситуаций, приведены ниже.
Для анализа наследственного БАС наиболее широко используется моделирование на мутантных линиях мышей по Cu,Zn-супероксиддисмутазе. Высокая степень копирования мутантной SOD1 вызывает появление слабости на 80–90-й день и гибель животного на 130–140-й день. Оригинальные исследования показывают, что начало развития клинической картины у таких животных совпадает по времени с началом частичной гибели мотонейронов спинного мозга. При этом сопутствующие физиологические и патофизиологические исследования выявляют начало денервации мышц задних конечностей задолго до появления характерных симптомов заболевания. Для установления пространственно-временных особенностей развития процессов, приводящих к гибели мотонейрона, было проведено количественное исследование патологических процессов от конечной до начальной точки их развития. Значительные явления мышечной дегенерации появились на 47-й день, задолго до появления первых симптомов заболевания. На момент появления первых клинических признаков (80-й день исследования) две трети аксонов вентральных корешков уже были подвергнуты дегенерации. До момента развития ярких симптомов заболевания не встречалось ни одного случая выявления гибели тел мотонейронов. Аналогичные данные были представлены и другими лабораториями, которые работают с мутантными линиями мышей различных подтипов.
В серии работ использовались животные со специфической миссенс-мутацией, сопровождающейся дефектом синтеза тубулина в нейронах, что приводило к прогрессирующей моторной невропатии. У таких животных развитие слабости происходило в течение первых трех недель жизни, и гибель животных происходила на шестой неделе. Гибель мотонейронов или даже развитие дегенерации дистальной части аксонов не отмечались на фазе развития явных патологических проявлений. В конечной стадии развития данной патологии гибель мотонейронов встречалась не более чем в 40 % всех случаев. Электрофизиологические исследования показали некоторые изменения структуры потенциала действия в моторных нейронах, иннервирующих мускулатуру головы и задних конечностей животного. При этом прослеживались временные зависимости нарастания указанных изменений. Причем самые выраженные изменения наблюдались задолго до тринадцатого дня исследования. Очевидные патологические изменения, свидетельствующие о денервации указанных мышц, наблюдались после пятнадцатого дня исследования. Таким образом, можно сделать вывод об исключительно малой корреляции между выраженностью патологического процесса и клиническими проявлениями у данных животных.
Группа животных с моделированной спинальной мышечной атрофией, вызванной искусственным удалением седьмого экзона гена Smn, характеризовалась ранней развивающейся моторной деградацией и гибелью животного в возрасте около четырех недель. Патоморфологический анализ данных животных выявил, что было потеряно только около 30 % поясничных двигательных нейронов за тридцатидневный период. Кроме того, 49 % аксонов передних рогов сегментов L4–L5 подверглись деструкции в первые пятнадцать дней. Данный показатель вырос до 78 % к тридцатому дню. Денервация закономерно сопровождалась выраженным накоплением фосфорилированных нейрофиламентов в нейромышечных синапсах. Во всех случаях не было обнаружено явлений терминального прорастания, что может быть связано с сопровождающимся дефектом аксонального роста и пластичности. Анализируя спинальный уровень у данных животных, можно с уверенностью заключить, что дистальные аксональные дефекты были гораздо более выраженными по сравнению с деструкцией, происходящей в спинном мозге.
Во всех моделях большая часть двигательных нейронов была морфологически интактна в момент появления первых клинических признаков. Именно этот факт дает возможность предложить потенциально эффективное направление по предотвращению ухудшения состояния. При этом использование данных принципов у человека с БАС может помочь сохранить тела двигательных нейронов и при дальнейшей реиннервации улучшить состояние пациента.
БАС у людей
Аксональная дегенерация длительное время считалась единственной особенностью БАС у людей. При этом электромиографические исследования были основными в диагностике данных состояний. Такие особенности миограммы, как спонтанная фибрилляция и фастикуляция потенциалов, были наиболее важными в диагностике. Реиннервация при данном заболевании направлена на поддержание нормальной функции мышечной системы. Такое явление закономерно при БАС. Однако реиннервация не в состоянии адекватно компенсировать начавшуюся денервацию, которая и вызывает внезапную слабость соответствующих мышц. Денервацию традиционно приписывали формирующейся дисфункции и гибели мотонейронов. Помимо этого, реиннервация считалась следствием прорастания аксона моторного нейрона, лежащего в непосредственной близости от погибшего. Данные предположения не могли быть проверены на людях до момента смерти пациента с БАС.
Эти предположения поддерживаются еще и гипотезами о том, что БАС у людей начинается с дистальной дегенерации аксонов двигательных нейронов. Bradley с соавт. использовали количественные методики морфометрии для демонстрации проксимально-дистального градиента аксональной патологии в периферических нервах у людей с БАС. В нашем случае имелась редкая возможность оценить клинические, а затем патоморфологические данные у пациента с БАС, который умер во время оперативных вмешательств, не имеющих отношения к основному заболеванию. Клинический диагноз был установлен и прослежена клиника в течение не менее полугода с момента появления первых симптомов. Аутопсия подтвердила значительную денервацию и изменения в процессах реиннервации, которые были показаны миографически. Однако в данном случае не удалось выявить признаков, свидетельствующих об изменениях в мотонейронах спинного мозга.
В клинической практике исследователи использовали технологию определения числа моторных единиц для выявления количественных параметров процессов денервации и реиннервации. Данная технология позволила предположить, что уровень прогрессирования БАС у людей прямо зависит от денервации и потери функционирующих моторных единиц у пациента. Эти данные были проверены на линии мутантных мышей по супероксиддисмутазе-1. Технология подсчета моторных единиц использовалась и в этом случае. в ходе исследования получена важнейшая информация об уменьшении числа моторных единиц за несколько месяцев до начала формирования клинической картины. Для расширения спектра исследования использовалась методика порогового трекинга, которая позволяет выявить изменения аксональной возбудимости, что дало возможность получить также незаменимую информацию, касающуюся особенностей электрофизиологических изменений у пациентов с БАС. Явления резкого повышения натриевого тока и уменьшения калиевой проводимости наблюдались в двух популяциях пациентов. Особенностью этого состояния было значительное его усугубление в дистальных отделах аксонов. Несомненно, что ни одно из этих исследований не позволяет полностью раскрыть особенности течения БАС у людей. Однако в сочетании с данными, полученными на животных, можно с уверенностью говорить о том, что такое состояние является патологией дистальных отделов аксонов.
Последние исследования дали информацию еще об одном факторе, который может играть важную роль в формировании БАС. Именно информация о генетических изменениях при данной патологии заставляет все больше обращать на нее внимание. Говоря о генетических факторах, клиницисты должны иначе посмотреть на происхождение БАС. Из известных 43 мутаций, которые приводят к изменению двигательных нейронов, 14 причастны к формированию амиотрофического латерального склероза. Все мутации, имеющие место при БАС, влияют на такие принципиально важные моменты нейрональной биологии, как изменение цитоскелета нейронов, повреждение и трансформация медиаторных везикул, критические изменения аксонального транспорта. К роме того, важную роль в формировании патологического процесса играют нарушения ферментативных систем. Некоторые другие мутации вовлекают не только нейроны. В таких случаях причиной аномальной работы нервной клетки является дефект шванновских клеток. Роль этого типа глии сложно переоценить. Непосредственное участие в нейрональной передаче информации, в частности по моторным нейронам, осуществляется именно с помощью этих клеток. Все многообразие нарушений обмена клеток спинного мозга и окружающих тканей обусловливает постепенное развитие аксональной дегенерации, приводящей к моторной невропатии. Несмотря на все то обилие информации о явлениях, сопутствующих БАС, мы не можем сейчас более или менее четко сформировать стройную схему развития данной патологии. В наших силах проводить дополнительные исследования и подвергать более глубокому анализу уже полученные материалы.
Вовлечение сенсорных аксонов
Аксональная патология не ограничивается формированием БАС в эфферентном отделе ЦНС. Изменения в аксонах вовлекают и чувствительную часть нервной системы. Симптомы нарушения афферентных нейронов менее заметны и приводят к не настолько выраженным состояниям. Однако те изменения, которые встречаются у пациентов с БАС, также требуют коррекции. По усредненным данным, пациенты с БАС имеют снижение количества миелинизированных волокон в крупных нервных стволах до 70 % от исходного уровня. При этом количество данных волокон дорсальных корешков сегмента L5 уменьшается на 27 %. Изменения в телах нейронов, находящихся в околопозвоночных ганглиях на уровне 3–5-го поясничных сегментов, приводят к 54 % уменьшению их размеров. При анализе скорости проведения по сенсорным волокнам у пациентов с БАС выявляется значительное ее уменьшение в сравнении с контрольными группами пациентов. Исследования на мутантных животных выявили характерную особенность, которая заключалась в практически одновременном снижении количества моторных и сенсорных волокон при формировании БАС.
При анализе спинальной мышечной атрофии, вызванной прогрессированием БАС, выявлено, что имеет место снижение скорости проведения по смешанным нервам. При этом степень снижения колебалась от умеренной до выраженной. Одновременно проведенная биопсия выявила выраженное истончение нервных волокон. Гистологический анализ нервно-мышечных соединений у мутантных животных с БАС показал, что синаптические бляшки на соматической мускулатуре умеренно истончены, а данные, касающиеся анализа сенсорных волокон, свидетельствовали о практически полном исчезновении чувствительных нервных окончаний в верхних слоях кожи. В ходе анализа культуры нейронов, полученной от данных мышей, выявлялось, что их дендриты были значительно короче по сравнению с нормальными клетками. Аксональный холмик имел невыраженную структуру, количество т-РНК и м-РНК резко снижено в дистальных отделах аксонов. Обобщая полученные результаты, можно говорить об аналогичных процессах, происходящих в моторных и сенсорных нейронах, с учетом того, что в последних степень выраженности изменений несколько ниже.
Дегенерация сенсорных волокон при БАС не является прямым доказательством того, что именно двигательные нейроны являются местом развития всех патологических процессов при этом состоянии. Понимание причин того, что дегенеративные процессы развиваются в моторных аксонах при БАС с огромной скоростью и при этом сенсорные волокна остаются относительно интактными, дает ключ к дальнейшим изысканиям. Обнаружение причин и механизмов этих различий является первым шагом к лечению БАС. Больший размер двигательных нейронов, увеличенная метаболическая нагрузка, анатомическая организация, контакт с мышцами и другие отличия в структуре и функции двигательных нейронов рассматривались как причины формирования этой патологии. По нашим данным, прямые сравнения между чувствительностью моторных и сенсорных нейронов к действию таких потенциальных триггеров заболевания, как оксидативный стресс и экспрессия мутантной супероксиддисмутазы, проведены не были.
Механизмы аксональной дегенерации
При анализе литературы, касающейся влияния мутантной супероксиддисмутазы на дегенеративные процессы в аксонах, четкого описания этих процессов найдено не было. Кроме того, первичное место повреждения нервной системы также неизвестно. Отмирание части аксона может являться прямым следствием влияния травмирующего фактора на его дистальные отделы. Изучается и возможность перехода патологического процесса с тела нейрона на отростки. Системный или локальный принцип формирования БАС также рассматривался при анализе причин аксональной дегенерации. В данном разделе будут описаны механизмы дегенерации, присущие именно аксонам, а также будет рассмотрена возможность дистантного формирования БАС за счет использования мутантной супероксиддисмутазы как триггера аксональной дегенерации.
Аксональная дегенерация не зависит от гибели клеток
Очевидным является то, что аксональная дегенерация не является пассивным процессом. Она может быть лишь проявлением неизвестных нам процессов, часть из которых запрограммированна на гибель клетки. Например, удаление или уменьшение количества факторов роста нервной ткани из культуры клеток вызывает гибель тел клеток и их отростков. В опыте с мутантной линией мышей проводилось удаление проапоптотического гена, что вызвало сохранение двигательных нейронов у мышей с БАС. Однако денервация и дегенерация аксонов проявились вне зависимости от данной манипуляции. Все представленное выше подтверждает предположение о том, что аксональная дегенерация может происходить независимо от молекулярных процессов, контролирующих гибель клетки.
Концепция аксональной независимости была пересмотрена после открытия явления медленной валлеровской дегенерации, которая вызвана особым видом спонтанной мутации. Отличительной чертой в данном случае является удлиненная продолжительность жизни пораженных аксонов. Суть данного состояния сводится к тому, что мутантный ген обусловливает синтез нового химерного белка, имеющего протективное действие против химических и антигенных факторов, вызывающих аксональную дегенерацию. Несмотря на достаточно высокую эффективность данного белка, он все же не способен предотвратить дегенерацию или гибель клетки. Само существование такого агента, как химерный белок, имеющего уникальные свойства, свидетельствует о регулируемом процессе дегенерации клеток. Кроме этого, подтверждается гипотеза о различных механизмах клеточной и аксональной гибели. Эти данные позволяют предположить, что именно поиск в указанном направлении поможет найти инструмент для контроля за дегенеративными процессами в нервной ткани.
Эксперименты, проводящиеся на мутантных мышах с изменением в генотипе, подразумевающем наличие валлеровской дегенерации и прогрессирующей моторной невропатии, дали неоценимо важную информацию о разнонаправленности процессов сохранения тел и отростков нейронов. Мыши контрольной группы показали раннее развитие аксональной дегенерации в моторных нервах на сороковой день жизни. Введение дополнительной мутации, связанной с валлеровской дегенерацией, дало очень важный результат — неожиданно выраженное сохранение двигательных нейронов не только до сорокового дня, но и исключительно медленное развитие дегенеративных изменений, продолжавшихся до двух месяцев. Кроме этого, получены данные о том, что именно состояние аксонов прямо влияет на сохранность тела нейрона. Аналогичным образом проводилось тестирование групп мышей с мутацией по супероксиддисмутазе. Однако, к сожалению, при таком подходе было выявлено лишь незначительное изменение прогрессирования дегенерации, причем замедление этого процесса отмечалось только на первых этапах работы. Дополнительное исследование, проведенное с учетом всех поставленных задач, дало возможность достоверно предполагать, что протективные свойства атипичного белка, образующегося при валлеровской дегенерации, действенны первые две недели развития процесса. В последующие несколько месяцев сам химерный белок начинает работать как фактор, усугубляющий течение аксональной дегенерации. С учетом этих особенностей исследуемого белка был сделан вывод о возможности частичной приостановки подобного процесса дегенеративных изменений аксонов мотонейронов, который стремительно наблюдается при прогрессирующей моторной невропатии. К сожалению, использование этого же белка не имеет смысла в лечении хронической или вялотекущей дегенерации нервной ткани. Механизм действия протективного фактора, образующегося при валлеровской дегенерации, на сегодня не известен, однако его терапевтические эффекты могут найти применение в лечении огромного спектра патологических состояний. Определение гена или совокупности генов, ответственных за синтез протективного фактора при медленно прогрессирующей валлеровской дегенерации, не привело к успеху. Сейчас возможно его получение только при изменении достаточно крупного участка ДНК животного.
Роль кальпаина в развитии аксональной дегенерации
Исследования молекулярного механизма аксональной дегенерации поддерживают идею о неапоптотической программе гибели, развивающейся в аксоне. Практически при всех состояниях, ведущих к дегенеративным изменениям нервной клетки, первичными проявлениями являются замедление аксонального транспорта, митохондриальная дисфункция, увеличение концентрации кальция в клетке, что в конечном итоге приводит к активации системы кальпаинов. Кальпаины представляют собой группу нейтральных протеаз, активируемых кальцием. Их роль в формировании различных патологических процессов достаточно полно описана. Моделирование патологических состояний, проводившееся на животных и отдельных клетках, четко демонстрирует дегенерацию белков цитоскелета и мембраны клетки, вызванную кальпаином. При моделировании ишемических, травматических, токсических и других состояний результаты в отношении роли кальпаиновой системы были аналогичными. Ингибирование кальпаинов при периферической невропатии приводит к заметному снижению травмирующего влияния этих ферментов на клеточные элементы как в эксперименте на животном, так и на культуре клеток. Ингибирование кальпаинов также приводит к сохранению цитоскелета в нервно-мышечном соединении в модели острой аутоиммунной нервно-мышечной дегенерации. Полученные данные о роли кальпаинов при развитии нейрональной дегенерации подтверждаются многими авторами. Кроме того, в значительной части случаев ингибиторы кальпаинов предупреждают или замедляют развитие патологических процессов в нервной клетке. Однако принципиальным отличием данных работ является то, что акцент делается именно на гибель тела нейрона. Изменения, проходившие в отростках этих клеток, во внимание не принимались. Как бы там ни было, применение ингибиторов кальпаинов при лечении аксональной дегенерации может действительно оказаться тем фактором, который будет играть решающую роль.
Чем обусловлена аксональная дегенерация при амиотрофическом латеральном склерозе?
Причина или несколько причин аксональной дегенерации при БАС у мутантной линии мышей по супероксиддисмутазе не выяснена. Некоторые ученые рассматривают ее токсическое действие на клеточные элементы. Механизмы токсического влияния включают в себя агрегацию мутантных протеинов, поломку митохондриальных систем и токсическое действие глутамата. Все перечисленные факторы в отдельности или ассоциированно с факторами, вызывающими запуск апоптоза, приводят к характерным изменениям в клетке. Каждый из этих процессов достаточно хорошо изучен в отдельности и применительно к спинальным мотонейронам. Однако комплексный анализ с учетом особенностей процессов, протекающих в дистальных отделах аксонов, не проводился.
Дефекты аксонального транспорта
Процесс ухудшения работы быстрого антероградного аксонального транспорта у мутантных мышей по супероксиддисмутазе и у людей с БАС достаточно глубоко изучен. Заметное снижение скорости антероградного транспорта по аксонам с накоплением нейрофиламентов в проксимальной части нейрона описано у мутантных мышей и людей с БАС. При этом в спинном мозге признаки такого явления появляются в среднем за полгода до первых клинических проявлений заболевания. Замедление ретроградного транспорта также замечено в моторных нейронах мутантных мышей с 13-го дня эмбрионального развития. Такие явления, как изменение скорости транспорта веществ по отросткам нейрона, могут быть прямой причиной нарушения ее функции, а также следствием и симптомом такого нарушения. Выяснение истинной роли изменения скорости аксонального транспорта в аксональной дистрофии еще предстоит выяснить. Недавно были идентифицированы мутации, проявляющиеся в изменении комплекса белковых молекул с динеин/динактином, которые являются характерными именно для пораженных двигательных нейронов у мышей и людей. Нормализуя аксональный транспорт, достаточно часто удавалось пролонгировать жизнедеятельность клетки. Указанные данные свидетельствуют о том, что активность и состоятельность аксонального транспорта является еще одним критическим звеном в цепи патогенеза аксонального амиотрофического склероза.
Оксидативный стресс
При описании БАС и некоторых других нейродегенеративных процессов традиционно указывается на роль оксидативного повреждения как фактора, обусловливающего старение клетки и/или организма. Абсолютно очевидно, что в трупных тканях оксидативный процесс в отношении белков, липидов и ДНК при БАС выражен исключительно сильно. Однако какова роль перекисного окисления в формировании ранних стадий заболевания, на сегодня не выяснено. Аналогично выявлена роль оксидативного повреждения клеток у линии мутантных мышей. Абсолютно очевидно повышение интенсивности перекисного окисления в клетках спинного мозга после месячного периода развития симптомов болезни. Информация, касающаяся интенсивности оксидативного повреждения клеток в период, предшествующий появлению яркой симптоматики, является весьма скудной. Исходя из того, что абсолютное большинство клеточных элементов, белков, частей цитоскелета и др. попадают в дистальные части аксонов за счет аксонального транспорта, логично предположить, что именно дистальная часть отростка нейрона содержит наиболее «старые» клеточные единицы. Эти части клетки в большей мере подвергались травмирующему действию перекисного окисления, вследствие чего резервы и «запас прочности» у таких элементов снижены, а это значит, что дегенерация и дисфункция этих компонентов наиболее вероятна.
Несомненно то, что нейромышечные соединения могут быть уязвимы для повреждения окислительными процессами, активными у животных с мутацией по супероксиддисмутазе. До тех пор, пока у них не развивается дистрофия двигательных нейронов, значительных симптомов заболевания не наблюдается. И только после развития выраженной моторной аксонопатии происходит резкое ускорение процессов старения и появление мышечной атрофии. Миографические исследования показывают спонтанную активность пораженных мышц, что свидетельствует о начавшейся денервации. Среди миографических симптомов данного состояния встречаются фибрилляции и сложные комплексные разряды. Анализируя материалы гистологического исследования, можно сказать о начинающейся денервации дистальных отделов конечностей на втором месяце заболевания, и к концу первого полугодия формируется комбинация атрофии мышечных волокон и их гипертрофии. Кроме того, среди характерных признаков наблюдается группирование мышечных волокон, что указывает на хроническую моторную невропатию.
Предложена гипотеза о том, что клиническое и патофизиологическое сходство между разными группами мутантных мышей, отличавшихся только степенью выраженности экспрессии генов, кодирующих супероксиддисмутазу, заключается лишь в выраженности симптомов. Главный смысл состоит в том, что оксидативный стресс играет основную роль в аксональной дегенерации, наблюдающейся у животных данных групп. Интенсивность оксидативного стресса может быть достаточной для формирования или запуска процессов аксональной патологии. Например, увеличение размера митохондрий в нейромышечном соединении становится заметным на 25-й день развития патологического процесса в нервной ткани. Это указывает на значительное повреждение митохондриальной структуры. Оксидативное повреждение митохондрий нарушает динамику электронов, тем самым угнетая синтез АТФ, вплоть до его остановки. Это является еще одним фактором, замедляющим аксональный энергозависимый транспорт. Недостаточность энергетического снабжения транспортных систем нейрона приводит к остановке двустороннего обмена между телом и отростками нейрона. Замедление транспорта является нормальным проявлением старения нервных клеток. Как было описано, включается «порочный круг», связанный с увеличением оксидативного влияния на органеллы. АТФ также является жизненно важным компонентом для работы Na+/K+-АТФазы. Дисфункция этого фермента влечет за собой накопление натрия в аксоне. Повышение концентрации данного иона приводит к реверсу натрий-кальциевого транспорта с входом и накоплением кальция в аксоне. Как было описано выше, кальций является прямым активатором кальпаиновой системы, что резко ускоряет дегенеративные процессы в аксональных структурах. Помимо повреждения митохондрий, оксидативный стресс влияет на жизнедеятельность других клеточных компонентов, содержащихся в аксоне. Накопление гиперфосфорилированных нейрофиламентов в дистальных отделах аксонов — типичное явление для пациентов с БАС. Этот феномен является типичным для состояний, связанных с повышением активности Cdk5, встречающимся при оксидативном стрессе. В дополнение к огромному количеству эффектов, к которым приводит оксидативный стресс, свободные радикалы резко снижают эффективность выделения медиаторов из пресинапса моторных терминалей. Эксперименты, модулирующие аналогичные состояния за счет применения ботулина, имели стандартный и закономерный результат, заключающийся в повреждении дистальных отделов моторных аксонов, и даже приводили к гибели двигательных нейронов.
Влияние свободных радикалов на компоненты клеток невероятно многообразно. Оно проявляется в изменении свойств белковых и липидных молекул, что вызывает различные дегенеративные процессы. Перекисное окисление мутантной супероксиддисмутазы, как известно, приводит к прекращению функционирования этого фермента. Действие перекисного окисления на убиквитин-карбокси-терминальную гидролазу аналогично ее полной элиминации из клетки. Вследствие этого возникает так называемая грациллярная аксональная дистрофия. Обращает на себя внимание то, что нейрофиламенты исключительно чувствительны к оксидативному повреждению. Экспозиция очищенных нейрофиламентов в супероксиддисмутазе и пероксиде водорода вызывает дозозависимую агрегацию указанных белков. Агрегированные нейрофиламенты за счет действия любого из возможных факторов перекисного окисления, в частности аскорбата трихлористого железа, становятся более чувствительными к действию кальпаинов. Это, в свою очередь, приводит к заметному увеличению скорости дегенерации. В клетках нейробластомы человека высокие дозы аскорбата вызывают дегенерацию нейрофиламентов, имеющую дозозависимый эффект, что впоследствии приводит к гибели клетки. В отличие от нейрофиламентов тубулин и актин не подвергаются агрегации в такой модели перекисного окисления. Это означает, что нейрофиламенты имеют практически уникальную чувствительность к оксидативному стрессу. Такая их особенность может быть связана с наличием специфических локусов, сопряженных с лизином и пролином. Эти части белковой молекулы теоретически становятся мишенью для модификации свободными радикалами, что приводит к альтерации и изменению вторичной структуры белка. В модели цитоскелета свободные радикалы приводят к таким критическим изменениям белковых структур, которые вызывают его деструкцию. Данные состояния могут быть предупреждены или уменьшены введением витаминов Е и С.
Особенности проявления аксональной дегенерации указывают на исключительную важность оксидативных процессов в ее формировании. Так, денервация моторных соединений у больных мышей происходит по определенной закономерности. Первыми дегенерируют нейроны и их отростки, имеющие малый и средний уровень резервов. Медленные моторные единицы в меньшей степени подвержены дегенерации. Кроме того, в них быстрее происходит регенерация и восстановление отростков. Общая картина развития нейромышечных заболеваний отражает естественные процессы старения. Единственное отличие — скорость развития этих состояний. Интересным фактом является то, что наиболее уязвимы для оксидативного стресса клетки, в которых уровень окислительного фосфорилирования не слишком высок. Обычно именно в таких клетках количество элементов антиоксидантной системы гораздо ниже. Соответственно склонность к дегенеративным процессам нервной ткани может быть диагностирована по количеству и активности антиоксидантов в данном организме. Еще одним интересным наблюдением является то, что клетки, находящиеся в непосредственной близости к поврежденным элементам, увеличиваются в объеме. Также проявляется увеличенное количество мышечных элементов, компенсаторно иннервируемое ими. Предполагаемой причиной развития дисбаланса между процессами перекисного окисления и антиоксидантной системой может быть слишком быстрая экспрессия мутантного гена, кодирующего синтез супероксиддисмутазы, сдвигающее равновесие систем в сторону перекисного окисления и оксидативного стресса.
Многочисленные антиоксиданты тестировались при выполнении данного исследования. Некоторые из них проявили значительную антиоксидантную активность. Как результат удалось пролонгировать выживаемость мутантных мышей до двух раз относительно контрольной группы. При этом назначение антиоксидантов проводилось в период скрытого, бессимптомного течения заболевания. Тестирование активности антиоксидантных систем организма на пациентах, по результатам метаанализа, не принесло статистически значимого результата. Вследствие того, что измерение степени оксидативного стресса на сегодняшний день не представляется возможным, не удается установить причину отсутствия результата назначение антиоксидантной терапии пациентам. Так, неэффективность лечения может быть связана и с повышением степени окислительных реакций, и с недостаточной эффективностью предлагаемой терапии. Даже если оксидативный процесс играет одну из основных ролей в запуске цепочки реакций, приводящих к аксональной дегенерации, мы не можем с помощью медикаментов предотвратить этот процесс. Таким образом, для разработки эффективной методики лечения оксидативных повреждений при БАС нам необходимо еще более глубокое исследование цепочки патологических процессов, приводящих к этим изменениям.
Роль других клеток
В предшествующих разделах обсуждались явления в нейроне и его частях, которые могут играть важную роль в аксональной дегенерации. Несмотря на несомненно важную роль процессов, происходящих непосредственно в самой клетке, однозначным является то, что дегенеративные изменения при БАС не проходят изолированно только в нейронах. Реакции глиальных клеток также являются достаточно важным прогностическим критерием и признаком степени изменений, уже произошедших в ЦНС. Менее известны феномены, происходящие в клетках, находящихся в непосредственной близости от дистальных участков аксонов. К таким клеточным элементам можно отнести шванновские, мышечные и даже иммунные клетки.
Шванновские клетки являются наиболее крупными глиальными клетками, находящимися в ЦНС. Они имеют контакт с аксонами нервных клеток на огромной площади. Эти участки превосходят места контактов нейронов с астроцитами в несколько десятков раз. Не следует упускать из виду то, что эти клетки являются еще и значительными источниками трофической поддержки и физической защиты нейронов. Таким образом, можно считать, что именно шванновские клетки и нейроглиальные союзы являются наиболее подходящими объектами исследования для выяснения природы гибели нейронов. Мутантная супероксиддисмутаза обнаруживается в шванновских клетках мышей мутантной линии в первые дни постнатального периода. В терминальных шванновских клетках в острый период дегенерации нейронов наблюдается резкое повышение аксонального фактора семафорина-3А. Этот факт означает попытки шванновских клеток противостоять травмирующим факторам за счет синтеза ингибиторов перекисного окисления, проявляющих свойства стимуляторов регенерации. Таким образом, эти клетки глии на некоторое время задерживают начинающуюся дисфункцию нейромышечного соединения и замедляют развитие симптомов БАС.
При аналогичном анализе скелетной мускулатуры в миоцитах также обнаруживается высокий уровень мутантной супероксиддисмутазы, которая аналогичным образом действует на нейромышечное соединение. Некоторые авторы считают, что роль миоцитов заключается в запуске патологических реакций, направленных на дегенерацию нейромышечного соединения. Именно мышечная часть этого образования является причиной данной патологии. Однако достоверных данных, подтверждающих эту теорию, получено не было. Увеличение синтеза фактора роста и ветвления дендритов у пациентов с БАС и у животных мутантных линий вызвало создание гипотезы о возможной роли миоцитов в ингибировании регенеративных процессов дистальных отделов аксонов. В подтверждение этой гипотезы можно привести следующие факты: при ингибировании рядом ферментов указанных факторов роста дендритов увеличение продолжительности жизни мутантных мышей составило порядка 25 дней.
Последние несколько исследований были направлены на выяснение действительной роли миоцитов в формировании дегенерации нейронов у мутантных мышей. Отделение миоцитов из нейромышечного соединения не показало достоверных изменений продолжительности жизни животных мутантных линий. Кроме того, результатом данной работы было лишь незначительное снижение мутантных белков в исследуемых нейронах. Необходимо проведение дополнительных серий экспериментов, которые уточнят роль мышечных клеток в патологии двигательных нейронов. Кроме того, необходимо определить дальнейшие направления исследования для выяснения возможности использования компонентов миоцитов в лечении БАС.
Заключение
В результате масштабных исследований получены очевидные данные, касающиеся патогенеза нейрональной дегенерации. Неоспорим тот факт, что процессы аксональной дегенерации и изменения, происходящие в теле нейрона, наблюдаются независимо друг от друга. Поэтому чрезвычайно важно помнить, что мероприятия, направленные на поддержание жизнедеятельности тела нейрона, не повлияют на клинические проявления БАС и продолжительность жизни. С другой стороны, были выявлены критические зоны развивающейся патологии. С точки зрения авторов именно на них должна быть направлена терапия при дегенеративных состояниях нейронов. Механизм развития аксональной дегенерации до настоящего времени остается неизвестным. Однако с уверенностью можно сказать, что одной из важных фаз развития данных состояний является оксидативный стресс. Множество связанных с ним факторов могут внезапно спровоцировать резкое увеличение реакций перекисного окисления, что вызовет процессы ускоренного старения и, как следствие, дегенерации нервной ткани. В дополнение можно сказать, что роль шванновских клеток в развитии дегенеративных процессов нельзя недооценивать. Это связано именно со свойством данных клеток стимулировать регенеративные процессы в нейронах. Дальнейшие исследования, несомненно, дадут новые факты, которые позволят с иной стороны подойти к рассмотрению патогенеза дегенеративных заболеваний нервной ткани, в частности, к амиотрофическому латеральному склерозу.
Литература
1. Glass J.D. Wallerian degeneration as a window to peripheral neuropathy // J. Neurol. Sci. 2004; 220: 123-124.
2. Gould T.W., Buss R.R., Vinsant S., Prevette D. et al. Complete dissociation of motor neuron death from motor dysfunction by Bax deletion in a mouse model of ALS // J. Neurosci. 2006; 26: 8774-8786.
3. Kostic V., Jackson-Lewis V., de Bilbao F., Dubois-Dauphin M., Przedborski S. Bcl-2: prolonging life in a transgenic mouse model of familial amyotrophic lateral sclerosis // Science 1997; 277: 559-562.
4. Li M., Ona V.O., Guegan C., Chen M., Jackson-Lewis V. et al. Functional role of caspase-1 and caspase-3 in an ALS transgenic mouse model // Science 2000; 288: 335-339.
5. Sagot Y., Dubois-Dauphin M., Tan S.A., de Bilbao F. et al. Bcl-2 overexpression prevents motoneuron cell body loss but not axonal degeneration in a mouse model of a neurodegenerative disease // J. Neurosci. 1995; 15: 7727-7733.
6. Klivenyi P., Ferrante R.J., Matthews R.T., Bogdanov M.B. et al. Neuroprotective effects of creatine in a transgenic animal model of amyotrophic lateral sclerosis // Nat. Med. 1999; 5: 347-350.
7. Chiu A.Y., Zhai P., Dal Canto M.C., Peters T.M. et al. Age-dependent penetrance of disease in a transgenic mouse model of familial amyotrophic lateral sclerosis // Mol. Cell. Neurosci. 1995; 6: 349-362.
8. Kennel P.F., Finiels F., Revah F., Mallet J. Neuromuscular function impairment is not caused by motor neuron loss in PALS mice: an electromyographic study // Neuroreport. 1996; 7: 1427-1431.
9. Frey D., Schneider C., Xu L., Borg J., Spooren W., Caroni P. Early and selective loss of neuromuscular synapse subtypes with low sprouting competence in motoneuron diseases // J. Neurosci. 2000; 20: 2534-2542.
10. Fischer L.R., Culver D.G., Tennant P., Davis A.A. et al. Amyotrophic lateral sclerosis is a distal axonopathy: evidence in mice and man // Exp. Neurol. 2004; 185: 232-240.
11. Pun S., Santos A.F., Saxena S., Xu L., Caroni P. Selective vulnerability and pruning of phasic motoneuron axons in motoneuron disease alleviated by CNTF // Nat. Neurosci. 2006; 9: 408-419.
12. Schaefer A.M., Sanes J.R., Lichtman J.W. A compensatory subpopulation of motor neurons in a mouse model of amyotrophic lateral sclerosis // J. Comp. Neurol. 2005; 490: 209-219.
13. Bommel H., Xie G., Rossoll W., Wiese S., Jablonka S., Boehm T., Sendtner M. Missense mutation in the tubulin-specific chaperone E (Tbce) gene in the mouse mutant progressive motor neuronopathy, a model of human motoneuron disease // J. Cell. Biol. 2002; 159: 563-569.
14. Martin N., Jaubert J., Gounon P., Salido E., Haase G., Szatanik M., Guenet J.L. A missense mutation in Tbce causes progressive motor neuronopathy in mice // Nat. Genet. 2002; 32: 443-447.
15. Holtmann B., Zielasek J., Tokya K.V., Sendtner M. Comparative analysis of motoneuron loss and functional deficits in PMN mice: implications for human motoneuron disease // J. Neurol. Sci. 1999; 169: 140-147.
16. Sendtner M., Schmalbruch H., Stockli K.A. et al. Ciliary neurotrophic factor prevents degeneration of motor neurons in mouse mutant progressive motor neuronopathy // Nature 1992; 358: 502-504.
17. Cifuentes-Dias C., Nicole S., Velasco M.E. et al. Neurofilament accumulation at the motor endplate and lack of axonal sprouting in a spinal muscular atrophy mouse model // Hum. Mol. Genet. 2002; 11: 1439-1447.
18. Hansen S., Ballantyne J.P. A quantitative electrophysiological study of motor neuron disease // J. Neurol. Neurosurg. Psychiatry 1978; 41: 773-783.
19. Bradley W.G., Good P., Rasool C.G., Adelman L.S. Morphometric and biochemical studies of peripheral nerves in amyotrophic lateral sclerosis // Ann. Neurol. 1983; 14: 267-277.
20. Shefner J.M. Motor unit number estimation in human neurological diseases and animal models // Clin. Neurophysiol. 2001; 112: 955-964.
21. Armon C., Brandstater M.E. Motor unit number estimate-based rates of progression of ALS predict patient survival // Muscle Nerve 1999; 22: 1571-1575.
22. Yuen E.C., Olney R.K. Longitudinal study of fiber density and motor unit number estimate in patients with amyotrophic lateral sclerosis // Neurology 1997; 49: 573-578.
23. Shefner J.M., Cudkowicz M., Brown R.H. Jr. Motor unit number estimation predicts disease onset and survival in a transgenic mouse model of amyotrophic lateral sclerosis // Muscle Nerve 2006; 34: 603-607.
24.Aggarwal A., Nicholson G. Detection of pre-clinical motor neurone loss in SOD1 mutation carriers using motor unit number estimation // J. Neurol. Neurosurg. Psychiatry 2002; 73: 199-201.
25. Kanai K., Kuwabara S., Misawa S., Tamura N. et al. Altered axonal excitability properties in amyotrophic lateral sclerosis: impaired potassium channel function related to disease stage // Brain 2006; 129: 953-962.
26.Vucic S., Kiernan M.C. Axonal excitability properties in amyotrophic lateral sclerosis // Clin. Neurophysiol. 2006; 117: 1458-1466.
27. Nakata M., Kuwabara S., Kanai K., Misawa S. et al. Distal excitability changes in motor axons in amyotrophic lateral sclerosis // Clin. Neurophysiol. 2006; 117: 1444-1448.
28. Pasinelli P., Brown R.H. Molecular biology of amyotrophic lateral sclerosis: insights from genetics // Nat. Rev. Neurosci. 2006; 7: 710-723.
29. Heads T., Pollock M., Robertson A., Sutherland W.H.F., Allpress S. Sensory nerve pathology in amyotrophic lateral sclerosis // Acta Neuropathol. 1991; 82: 316-320.
30. Kawamura Y., Dyck P.J., Shimono M., Okazaki H., Tateishi J., Doi H. Morphometric comparison of the vulnerability of peripheral motor and sensory neurons in amyotrophic lateral sclerosis // J. Neuropathol. Exp. Neurol. 1981; 40: 667-675.
31. Shefner J.M., Tyler R., Krarup C. Abnormalities in the sensory action potential in patients with amyotrophic lateral sclerosis // Muscle Nerve 1991; 14: 1242-1246.
32. Theys P.A., Peelers E., Robberecht W. Evolution of motor and sensory deficits in amyotrophic lateral sclerosis estimated by neurophysiological techniques // J. Neurol. 1999; 246: 438-442.
33. Fischer L.R., Culver D., Davis A.A., Tennant P. et al. The WldS gene modestly prolongs survival in the SOD1-G93A fALS mouse // Neurobiol. Dis. 2005; 19: 293-300.
34. Anagnostou E., Miller S.P., Guiot M.C., Karpati G. et al. Type I spinal muscular atrophy can mimic sensory-motor axonal neuropathy // J. Child Neurol. 2005; 20: 147-150.
35. Rudnik-Schoneborn S., Goebel H.H., Schlote W. et al. Classical infantile spinal muscular atrophy with SMN deficiency causes sensory neuronopathy // Neurology 2003; 60: 983-987.
36. Jablonka S., Karle K., Sandner B., Andreassi C., von Au K., Sendtner M. Distinct and overlapping alterations in motor and sensory neurons in a mouse model of spinal muscular atrophy // Human Mol. Genet. 2006; 15: 511-518.
37. Finn J.T., Weil M., Archer F., Siman R., Srinivasan A., Raff M.C. Evidence that Wallerian degeneration and localized axon degeneration induced by local neurotrophin deprivation do not involve caspases // J. Neurosci. 2000; 20: 1333-1341.
38. Sagot Y., Vejsada R., Kato A. Clinical and molecular aspects of motoneurone diseases: animal models, neurotrophic factors and Bcl-2 oncoprotein // Trends Pharmacol. Sci. 1997; 18: 330-337.
39. Lunn E.R., Perry V.H., Brown M.C., Rosen H., Gordon S. Absence of Wallerian degeneration does not hinder regeneration in peripheral nerve // Eur. J. Neurosci. 1989; 1: 27-33.
40. Conforti L., Tarlton A., Mack T.G.A., Mi W. et al. A Ufd2/D4Colele chimeric protein and overexpression of Rbp7 in the slow Wallerian degeneration (Wld s ) mouse // Proc. Natl. Acad. Sci. USA 2000; 97: 11377-11382.
41. Wang M.S., Davis A.A., Culver D.G., Glass J.D. WldS mice are resistant to paclitaxel (taxol) neuropathy // Ann. Neurol. 2002; 52: 442-447.
42. Wang M.S., Fang G., Culver D.G., Davis A.A., Rich M.M., Glass J.D. The Wld s protein protects against axonal degeneration: a model of gene therapy for peripheral neuropathy // Ann. Neurol. 2001; 50: 773-779.
43. Wang M.S., Wu Y., Culver D.G., Glass J.D. The gene for slow Wallerian degeneration (Wld s ) is also protective against vincristine neuropathy // Neurobiol. Dis. 2001; 8: 155-161.
44.Ferri A., Sanes J.R., Coleman M.P., Cunningham J.M., Kato A.C. Inhibiting axon degeneration and synapse loss attenuates apoptosis and disease progression in a mouse model of motoneuron disease // Curr. Biol. 2003; 13: 669-673.
45. Samsam M., Mi W., Wessig C., Zielasek J. et al. The Wlds mutation delays robust loss of motor and sensory axons in a genetic model for myelin-related axonopathy // J. Neurosci. 2003; 23: 2833-2839.
46. Deckwerth T.L., Johnson J., Eugene M. Neurites can remain viable after destruction of the neuronal soma by programmed cell death (apoptosis) // Dev. Biol. 1994; 165: 63-72.
47. Adalbert R., Nogradi A., Szabo A., Coleman M.P. The slow Wallerian degeneration gene in vivo protects motor axons but not their cell bodies after avulsion and neonatal axotomy // Eur. J. Neurosci. 2006; 24: 2163-2168.
48. Coleman M. Axon degeneration mechanisms: commonality amid diversity // Nat. Rev. Neurosci. 2005; 6: 889-898.
49. Raff M.C., Whitmore A.V., Finn J.T. Axonal self-destruction and neurodegeneration // Science 2002; 296: 868-871.
50. Coleman M.P., Perry V.H. Axon pathology in neurological disease: a neglected therapeutic target // Trends Neurosci. 2002; 25: 532-537.
51. Vande Velde C., Garcia M.L., Yin X., Trapp B.D., Cleveland D.W. The neuroprotective factor Wlds does not attenuate mutant SODl-mediated motor neuron disease // Neuromolecular Med. 2004; 5: 193-203.
52. Crawford T.O., Hsieh S.T., Schryer B.L., Glass J.D. Prolonged axonal survival in transected nerves of C57BL/Ola mice is independent of age // J. Neurocytol. 1995; 24: 333-340.
53. Gillingwater T.H., Thomson D., Mack T.G.A. et al. Age-dependent synapse withdrawal at axotomised neuromuscular junctions in Wld s mutant and Ube4b/Nmnat transgenic mice // J. Physiol. 2002; 543: 739-755.
54.Araki T., Sasaki Y., Millbrandt J. Increased nuclear NAD biosynthesis and SIRT1 activation prevent axonal degeneration // Science 2004; 305: 1010-1013.
55. Wang J., Zhai Q., Chen Y., Lin E., Gu W., McBurney M.W., He Z. A local mechanism mediates NAD-dependent protection of axon degeneration // J. Cell. Biol. 2005; 170: 349-355.
56. Conforti L., Fang G., Beirowski B., Wang M.S. et al. NAD(+) and axon degeneration revisited: Nmnatl cannot substitute for Wld(S) to delay Wallerian degeneration // Cell Death Differ. 2007; 14: 116-127.
57. Bartus R., Elliott P., Hayward N. Calpain as a novel target for treating acute neurodegenerative disorders // Neurol. Res. 1995; 17: 249-258.
58. Wang M.S., Wu Y., Culver D., Glass J.D. Pathogenesis of axonal degeneration: parallels between Wallerian degeneration and vincris-tine neuropathy // J. Neuropathol. Exp. Neurol. 2000; 59: 599-606.
59. Wang M.S., Davis A.A., Culver D.G., Wang Q., Powers J.C., Glass J.D. Calpain inhibition protects against Taxol-induced sensory neuropathy // Brain 2004; 127: 671-679.
60. O’Hanlon G.M., Humphreys P.D., Goldman R.S. et al. Calpain inhibitors protect against axonal degeneration in a model of anti-ganglioside antibody-mediated motor nerve terminal injury // Brain 2003; 126: 2497-2509.
61. Adamec E., Mohan P., Vonsattel J.P., Nixon R.A. Calpain activation in neurodegenerative diseases: confocal immunofluorescence study with antibodies specifically recognizing the active form of calpain 2 // Acta Neuropathol. 2002; 104: 92-104.
62. Nixon R.A., Saito K.I., Grynspan F., Griffin W.R. et al. Calcium-activated neutral proteinase (calpain) system in aging and Alzheimer’s disease // Ann. NY Acad. Sci. 1994; 747: 77-91.
63. Kieran D., Greensmith L. Inhibition of cal-pains, by treatment with leupeptin, improves motoneuron survival and muscle function in models of motoneuron degeneration // Neuroscience 2004; 125: 427-439.
64. Li J., Nixon R.A., Messer A., Berman S., Bursztajn S. Altered gene expression for calpain/calpastatin system in motor neuron degeneration (Mnd) mutant mouse brain and spinal cord // Brain Res. Mol. Brain Res. 1998; 53: 174-186.
65. Brown J., Robert H. Superoxide dismutase in familial amyotrophic lateral sclerosis: models for gain of function // Curr. Opin. Neurobiol. 1995; 5: 841-846.
66. Cleveland D.W., Rothstein J.D. From Charcot to Lou Gehrig: deciphering selective motor neuron death in ALS // Nat. Rev. Neurosci. 2001; 2: 806-819.
67. Boillee S., Vande Velde C., Cleveland D.W. ALS: a disease of motor neurons and their nonneuronal neighbors // Neuron 2006; 52: 39-59.
68. Williamson T.L., Cleveland D.W. Slowing of axonal transport is a very early event in the toxicity of ALS-linked SOD1 mutants to motor neurons // Nat. Neurosci. 1999; 2: 50-56.
69. Zhang B., Tu P.H., Abtahian F., Trojanowski J.Q., Lee V.M.Y. Neurofilaments and orthograde transport are reduced in ventral root axons of transgenic mice that express human SOD1 with a G93A mutation // J. Cell. Biol. 1997; 139: 1307-1315.
70. Warita H., Itoyama Y., Abe K. Selective impairment of fast anterograde axonal transport in the peripheral nerves of asymptomatic transgenic mice with a G93A mutant SOD1 gene // Brain Res. 1999; 819: 120-131.
71. Sasaki S., Iwata M. Impairment of fast axonal transport in the proximal axons of anterior horn neurons in amyotrophic lateral sclerosis // Neurology 1996; 47: 535-540.
72. Murakami T., Nagano I., Hayashi T., Manabe Y. et al. Impaired retrograde axonal transport of adenovirus-mediated E. coli LacZ gene in the mice carrying mutant SOD1 gene // Neurosci. Lett. 2001; 308: 149-152.
73. Kieran D., Hafezparast M., Bohnert S. et al. A mutation in dynein rescues axonal transport defects and extends the life span of ALS mice // J. Cell. Biol. 2005; 169: 561-567.
74. Hafezparast M., Klocke R., Ruhrberg C. et al. Mutations in dynein link motor neuron degeneration to defects in retrograde transport // Science 2003; 300: 808-812.
75. LaMonte B., Wallace K.E., Holloway B.A. et al. Disruption of dynein/dynactin inhibits axonal transport in motor neurons causing late-onset progressive deterioration // Neuron 2002; 34: 715-727.
76. Puls I., Jonnakuty C., LaMonte B., Holzbaur E.L.F. et al. Mutant dynactin in motor neuron disease // Nat. Genet. 2003; 33: 455-456.
77. Balaban R.S., Nemoto S., Finkel T. Mitochondria, oxidants, and aging // Cell 2005; 120: 483-495.
78. Barber S.C., Mead R.J., Shaw P.J. Oxidative stress in ALS: a mechanism of neurodegeneration and a therapeutic target // Biochim. Biophys. Acta 2006; 1762: 1051-1067.
79. Hall E.D., Andrus P.K., Oostveen J.A., Fleck T.J., Gurney M.E. Relationship of oxygen radical-induced lipid peroxidative damage to disease onset and progression in a transgenic model of familial ALS // J. Neurosci. Res. 1998; 53: 66-77.
80. Shefner J.M., Reaume A.G., Flood D.G. et al. Mice lacking cytosolic copper/zinc superoxide dismutase display a distinctive motor axonopathy // Neurology 1999; 53: 1239-1246.
81. Muller P.L., Song W., Liu Y. et al. Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy // Free Radic. Biol. Med. 2006; 40: 1993-2004.
82. Flood D.G., Reaume A.G., Gruner J.A., Hoffman E.K. et al. Hindlimb motor neurons require Cu/Zn superoxide dismutase for maintenance of neuromuscular junctions // Am. J. Pathol. 1999; 155: 663-672.
83. Echtay K.S., Roussel D., St-Pierre J., Jekabsons M.B. et al. Superoxide activates mitochondrial uncoupling proteins // Nature 2002; 415: 96-99.
84. Fernandez H.L., Hodges-Savola C.A. Axoplasmic transport of calcitonin gene-related peptide in rat peripheral nerve as a function.of age // Neurochem. Res. 1994; 19: 1369-1377.
85.Frolkis V.V., Tanin S.A., Gorban Y.N. Age-related changes in axonal transport // Exp. Gerontol. 1997; 32: 441-450.
86. Shea T.B., Zheng Y.L., Ortiz D., Pant H.C. Cyclin-dependent kinase 5 increases perikaryal neurofilament phosphorylation and inhibits neurofilament axonal transport in response to oxidative stress // J. Neurosci. Res. 2004; 76: 795-800.
87. Giniatullin A.R., Darios F., Shakirzyanova A., Davletov B., Giniatullin R. SNAP25 is a pre-synaptic target for the depressant action of reactive oxygen species on transmitter release // J. Neurochem. 2006; 98: 1789-1797.
88. Berliocchi L., Fava E., Leist M., Horvat V., Dinsdale D., Read D., Nicotera P. Botulinum neurotoxin C initiates two different programs for neurite degeneration and neuronal apoptosis // J. Cell Biol. 2005; 168: 607-618.
89. Hodgson E.K., Fridovich I. The interaction of bovine erythrocyte superoxide dismutase with hydrogen peroxide: inactivation of the enzyme // Biochemistry 1975; 14: 5294-5299.
90. Poon H.P., Hensley K., Thongboonkerd V., Merchant M.L. et al. Redox proteomics analysis of oxidatively modified proteins in G93A-SOD1 transgenic mice — a model of familial amyotrophic lateral sclerosis // Free Radic. Biol. Med. 2005; 39: 453-462.
91. Saigoh K., Wang Y.L., Suh J.G., Yamanishi T., Sakai Y. et al. Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice // Nat. Genet. 1999; 23: 47-51.
92. Kim N.H., Jeong M.S., Choi S.Y., Hoon Kang J. Oxidative modification of neurofilament-L by the Cu,Zn-superoxide dismutase and hydrogen peroxide system // Biochimie 2004; 86: 553-559.
93. Troncoso J.C., Costello A.C., Kim J.H., Johnson G.V. Metal-catalyzed oxidation of bovine neurofilaments in vitro // Free Radic. Biol. Med. 1995; 18: 891-899.
94. Cookson M.R., Thatcher N.M., Ince P.G., Shaw P.J. Selective loss of neurofilament proteins after exposure of differentiated human IMR-32 neuroblastoma cells to oxidative stress // Brain Res. 1996; 738: 162-166.
95. Gelinas S., Chapados C., Beauregard M., Gosselin I., Martinoli M.G. Effect of oxidative stress on stability and structure of neurofilament proteins // Biochem. Cell Biol. 2000; 78: 667-674.
96. Counterman A.E., D’Onofrio T.G., Andrews A.M., Weiss P.S. A physical model of axonal damage due to oxidative stress // Proc. Natl. Acad. Sci. USA 2005; 103: 5262-5266.
97. Gordon T., Hegedus J., Tarn S.L. Adaptive and maladaptive motor axonal sprouting in aging and motoneuron disease // Neurol. Res. 2004; 26: 174-185.
98. Luff A.R. Age-associated changes in the innervation of muscle fibers and changes in the mechanical properties of motor units // Ann. NY Acad. Sci. 1998; 854: 92-101.
99. Hollander J., Fiebig R., Gore M., Bejma J., Ookawara T., Ohno H., Ji L.L. Superoxide dismutase gene expression in skeletal muscle: fiber-specific adaptation to endurance training // Am. J. Physiol. 1999; 277: R856-R862.
100. Crow J.P., Calingasan N.Y., Chen J., Hill J.L., Beal M.F. Manganese porphyrin given at symptom onset markedly extends survival of ALS mice // Ann. Neurol. 2005; 58: 258-265.
101. Liu R., Li B., Flanagan S.W., Oberley L.W., Gozal D., Qiu M. Increased mitochondrial antioxidative activity or decreased oxygen free radical propagation prevent mutant SOD1-mediated motor neuron cell death and increase amyotrophic lateral sclerosis-like transgenic mouse survival // J. Neurochem. 2002; 80: 488-500.
102. Orrell R.W., Lane R.J., Ross M. Antioxidant treatment for amyotrophic lateral sclerosis/motor neuron disease // Cochrane Database Syst. Rev. 2005; 1: CD002829.
103. Lino M.M., Schneider C., Caroni P. Accumulation of SOD1 mutants in postnatal moto-neurons does not cause motoneuron pathology or motoneuron disease // J. Neurosci. 2002; 22: 4825-4832.
104. Pramatarova A., Laganiere J., Roussel J., Brisebois K., Rouleau G.A. Neuron-specific expression of mutant superoxide dismutase 1 in transgenic mice does not lead to motor impairment // J. Neurosci. 2001; 21: 3369-3374.
105. Boillee S., Yamanaka K., Lobsiger C.S., Copeland N.G. et al. Onset and progression in inherited ALS determined by motor neurons and microglia // Science 2006; 312: 1389-1392.
106. Clement A., Nguyen M., Roberts E., Garcia M. et al. Wild-type nonneuronal cells extend survival of SOD1 mutant motor neurons in ALS mice // Science 2003; 302: 113-117.
107. Hall E.D., Oostveen J.A., Gurney M.E. Relationship of microglial and astrocytic activation to disease onset and progression in a transgenic model of familial ALS // Glia 1998; 23: 249-256.
108. Howland D.S., Liu J., She Y. et al. Focal loss of the glutamate transporter EAAT2 in a transgenic rat model of SOD1 mutant-mediated amyotrophic lateral sclerosis (ALS) // Proc. Natl. Acad. Sci. USA 2002; 99: 1604-1609.
109. Di Giorgio F.P., Carrasco M.A., Siao M.C., Maniatis T., Eggan K. Non-cell autonomous effect of glia on motor neurons in an embryonic stem cell-based ALS model // Nat. Neurosci. 2007; 10: 608-614.
110. Nagai M., Re D.B., Nagata T., Chalazonitis A. et al. Astrocytes expressing ALS-linked mutated SOD1 release factors selectively toxic to motor neurons // Nat. Neurosci. 2007; 10: 615-622.
111. De Winter F., Vo T., Stam F.J., Wisman L.A. et al. The expression of the chemorepellent Semaphorin 3A is selectively induced in terminal Schwann cells of a subset of neuromuscular synapses that display limited anatomical plasticity and enhanced vulnerability in motor neuron disease // Mol. Cell. Neurosci. 2006; 32: 102-117.
112. Turner B.J., Lopes E.C., Cheema S.S. Neuromuscular accumulation of mutant superoxide dismutase 1 aggregates in a transgenic mouse model of familial amyotrophic lateral sclerosis // Neurosci. Lett. 2003; 350: 132-136.
113. Taylor A.R., Gifondorwa D.J., Newbern J.M, Robin-son M.B. et al. Astrocyte and muscle-derived secreted factors differentially regulate motoneuron survival // J. Neurosci. 2007; 27: 634-644.
114. Dupuis L., Gonzalez de Aguilar J.L., di Scala F., Rene F., de Tapia M. et al. Nogo provides a molecular marker for diagnosis of amyotrophic lateral sclerosis // Neurobiol. Dis. 2002; 10: 358-365.
115. Jokic N., Gonzalez de Aguilar J.L., Dimou L. et al. The neurite outgrowth inhibitor Nogo-A promotes denervation in an amyotrophic lateral sclerosis model // EMBO Rep. 2006; 7: 1162-1167.
116. Miller T.M., Kim S.H., Yamanaka K. et al. Gene transfer demonstrates that muscle is not a primary target for non-cell-autonomous toxicity in familial amyotrophic lateral sclerosis // Proc. Natl. Acad. Sci. USA 2006; 103: 19546-19551.
117. Holzbaur E.L., Howland D.S., Weber N. et al. Myostatin inhibition slows muscle atrophy in rodent models of amyotrophic lateral sclerosis // Neurobiol. Dis. 2006; 23: 697-707.
118. Dobrowolny G., Giacinti C., Pelosi L., Nicoletti C. et al. Muscle expression of a local Igf-1 isoform protects motor neurons in an ALS mouse model // J. Cell. Biol. 2005; 168: 193-199.
119. Cifuentes-Diaz C., Frugier T., Tiziano F.D., Lacene E. et al. Deletion of murine SMN exon 7 directed to skeletal muscle leads to severe muscular dystrophy // J. Cell. Biol. 2001; 152: 1107-1114.
120. Rosen D., Siddique T., Patterson D., Figlewicz D., Sapp P. et al. Mutations in Cu/Zn superoxide dismutase gene are associated with familial amyotrophic lateral sclerosis // Nature 1993; 362: 59-62.
121. Ranta S., Zhang Y., Ross B., Lonka L., Takkunen E. et al. The neuronal ceroid lipofuscinoses in human EPMR and mnd mutant mice are associated with mutations in CLN8 // Nat. Genet. 1999; 23: 233-236.
122. Lefebvre S., Burglen L., Reboullet S., Clermont O. et al. Identification and characterization of a spinal muscular atrophy-determining gene // Cell 1995; 80: 155-165.
123. McWhorter M.L., Monani U.R., Burghes A.H., Beat-tie C.E. Knockdown of the survival motor neuron (Smn) protein in zebrafish causes defects in motor axon outgrowth and pathfinding // J. Cell. Biol. 2003; 162: 919-931.
124. Rich M.M., Wang X., Cope T.C., Pinter M.J. Reduced neuromuscular quantal content with normal synaptic release time course and depression in canine motor neuron disease // J. Neurophysiol. 2002; 88: 3305-3314.
125. La Spada A.R., Wilson E.M., Lubahn D.B., Harding A.E., Fischbeck K.H. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy // Nature 1991; 352: 77-79.
126. Katsuno M., Adachi H., Minamiyama M., Waza M. et al. Reversible disruption of dynactin 1-mediated retrograde axonal transport in polyglutamine-induced motor neuron degeneration // J. Neurosci. 2006; 26: 12106-12117.
127. Chambers D.M., Peters J., Abbott C.M. The lethal mutation of the mouse wasted (wst) is a deletion that abolishes expression of a tissue-specific isoform of translation elongation factor lalpha, encoded by the Eefla2 gene // Proc. Natl. Acad. Sci. USA 1998; 95: 4463-4468.
128. Newbery H.J., Gillingwater T.H., Dharmasaroja P. et al. Progressive loss of motor neuron function in wasted mice: effects of a spontaneous null mutation in the gene for the eEF1 A2 translation factor // J. Neuropathol. Exp. Neurol. 2005; 64: 295-303.
129. Schmitt-John T., Drepper C., Mussmann A., Hahn P. et al. Mutation of Vps54 causes motor neuron disease and defective spermiogenesis in the wobbler mouse // Nat. Genet. 2005; 37: 1213-1215.
130. Blondet B., Carpentier G., Ait-Ikhlef A., Murawsky M., Rieger F. Motoneuron morphological alterations before and after the onset of the disease in the wobbler mouse // Brain Res. 2002; 930: 53-57.
131. Oosthuyse B., Moons L., Storkebaum E., Beck H. et al. Deletion of the hypoxia-response element in the vascular endothelial growth factor promoter causes motor neuron degeneration // Nat. Genet. 2001; 28: 131-138.
132. Miura H., Oda K., Endo C., Yamazaki K., Shibasaki H., Kikuchi T. Progressive degeneration of motor nerve terminals in GAD mutant mouse with hereditary sensory axonopathy // Neuropathol. Appl. Neurobiol. 1993; 19: 41-51.
133. Liedtke W., Leman E.E., Fyffe R.E., Raine C.S., Schubart U.K. Stathmin-deficient mice develop an age-dependent axonopathy of the central and peripheral nervous systems // Am. J. Pathol. 2002; 160: 469-480.
134. Dewil M., dela Cruz V.F., Van Den Bosch L., Robberecht W. Inhibition of p38 mitogen activated protein kinase activation and mutant SOD1G93A -induced motor neuron death // Neurobiol. Dis. 2007; 26: 332-341.
135. Rouaux C., Panteleeva I., Rene F., Gonzalez de Aguilar J.L. et al. Sodium valproate exerts neuroprotective effects in vivo through CREB-binding protein-dependent mechanisms but does not improve survival in an amyotrophic lateral sclerosis mouse model // J. Neurosci. 2007; 27: 5535-5545.
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.

Главный редактор, заведующий хирургическим отделением
Задать вопрос
Врач-хирург высшей квалификационной категории, доктор медицинских наук, профессор кафедры общей хирургии АГМУ.
Содержание
- Что такое аксональная полинейропатия
- Причины
- Первые признаки
- Симптомы
- Диагностика
- Прогноз
- Профилактика
- Идиопатическая прогрессирующая невропатия
- Лечение
- Госпитализация
- Профилактика
Что такое аксональная полинейропатия
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда аксонально-демиелинизирующая полинейропатия поражает вегетативные волокна, нарушается регуляция сосудистого тонуса. Это приводит к сдавливанию капилляров, что вызывает отек тканей. Скопление жидкости в пораженных участках может привести к значительному увеличению размеров как нижних, так и верхних конечностей. Поскольку при полинейропатии этого типа в этих областях скапливается много крови, вставание может вызывать у пациента постоянное головокружение. Отсутствие трофической функции может также привести к эрозивным и язвенным поражениям на нижних конечностях.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Идиопатическая прогрессирующая невропатия
Полирадикулоневропатии — группа заболеваний периферической нервной системы, характеризующихся диффузным поражением периферических нервных волокон, входящих в состав различных нервов. Клинически полиневропатии проявляются периферическим тетрапарезом, арефлексией, нарушением чувствительности (часто по типу «носков и перчаток») и вегетативной дисфункцией, в частности вазомоторными нарушениями, расстройством потоотделения и другими проявлениями периферической нервной системы. При поражении волокон глубокой чувствительности развивается сенситивная атаксия.
Хроническая идиопатическая аксональная невропатия (ХИАН) — встречается преимущественно в среднем и пожилом возрасте, у детей редко и служит причиной до 3% случаев полиневропатий. Чаще всего она проявляется ощущением жжения и онемением в стопах, иногда легкой вегетативной дисфункцией, слабостью и атрофией мышц дистальных отделов нижних конечностей, а иногда и легкими нарушениями глубокой чувствительности. Течение обычно медленно прогрессирующее.
Хроническая воспалительная демиелинизирующая полирадикулоневропатия (ХВДП) — является причиной 5% полиневропатий. В отличие от синдрома Гийена-Барре характеризуется более медленным развитием, хроническим ремиттирующим или непрерывно прогрессирующим (в течение не менее 2 мес.) течением. Восстановление часто бывает неполным. Эта форма заболевания напоминает болезни мотонейронов. Заболевание встречается в любом возрасте. Предполагается, что в основе патогенеза ХВДП лежат нарушения иммунной системы. Может быть повышен титр антител к ганглиозидам. Слабость в начале отмечается в дистальных отделах ног, затем распространяется на руки и проксимальные отделы ног. Параллельно развиваются арефлексия и нарушения чувствительности. Выраженные парезы редко сопровождаются нарастающей атрофией. В 10% случаев чувствительные нарушения преобладают над двигательными. У части больных поражаются черепные нервы, обычно лицевой и бульбарные, реже глазодвигательные.
Лечение
Тактика лечения
Прежде всего, необходимо проверить, не является ли ХВДП проявлением иного заболевания, и если оно будет найдено — назначить соответствующее лечение. При идиопатической хронической воспалительной демиелинизирующей полирадикулоневропатии применяют кортикостероиды, плазмаферез и азатиоприл. Тактика определяется тяжестью симптоматики и возможностью проведения плазмофереза. С помощью комбинированной, адекватной иммунотерапии удается добиться улучшения у 90% больных ХВДП, однако главная проблема лечения ХВДП заключается в том, чтобы удержать достигнутый положительный результат. В настоящее время существует 3 основных средств лечения ХВДП — кортикостероиды, плазмоферез, внутривенно иммуноглобулин.
Цель лечения: достижение стойкой ремиссии, сохраняющейся после иммунотропных средств, улучшение двигательной активности, увеличение силы и объема активных движений, предупреждение осложнений (контрактур, атрофий), социальная адаптация, улучшение качества жизни.
Немедикаментозное лечение
Диета низкосолевая с высоким содержанием белка, но низким содержанием жира.
Активная реабилитация включает лечебную физкультуру, которая занимает одно из ведущих мест в лечении больных. Основная задача лечебных упражнений в раннем восстановительном периоде — тренировка основных параметров двигательной системы, которая заключается в постепенном и дозированном увеличении силы мышечного сокращения, амплитуды. Применяют пассивные и пассивно-активные упражнения с переходом к активным упражнениям.
Стимулирующий массаж пораженных конечностей, мышц спины.
Физиолечение — магнитотерапия, биоптрон, УВЧ на пораженные сегменты спинного мозга, СМТ паретичных мышц, озокеритовые аппликации, электрофорез с прозерином.
Иглорефлексотерапия.
Медикаментозное лечение
Кортикостероиды. Чаще всего лечение начинают с преднизолона в дозе — длительное назначение в дозе 0,5-1,5 мг/кг/сут. (до 100 мг в день). После достижения эффекта (обычно через 3-4 недели) дозу начинают осторожно снижать, постепенно переходя на прием препарата через день. Эту дозу сохраняют в течение нескольких месяцев — до тех пор, пока не произойдет существенно стойкого регресса неврологического дефицита. В последующем производят снижение дозы на 10 мг в месяц (или 5 мг каждые 2 недели) до 20 мг через день, после чего дозу снижают на 2,5 мг каждые 2-3 недели.
В отсутствии эффекта (10-15% больных) кортикостероиды отменяют гораздо быстрее. Во избежание рецидива прием поддерживающей дозы (5-10 мг через день) продолжают на протяжении нескольких лет. У части больных препарат в конце концов удается отменить, но у других на фоне отмены, состояние вновь ухудшается, и они вынуждены принимать его достаточно длинное время. В тяжелых случаях лечение начинают с высокой дозы метилпреднизолона (1000 мг внутривенно, капельно на 200 мл 5% глюкозы в течение 3-5 дней), после чего переходят на прием преднизолона внутрь, но иногда лечение проводят курсами пульс-терапии метилпреднизолона, повторными каждые 4-8 недель (интервалы между курсами могут постепенно увеличиваться).
На фоне лечения кортикостероидами мышечная сила обычно начинает увеличиваться через 1-2 месяца и может сохраняться до года и более. Для защиты пищеварительной системы следует принимать такие препараты, как ранитидин для H2-рецепторов (150 мг дважды в день) или ингибитор протонной помпы омепразол (20 мг в день). Кроме того, люди, находящиеся на длительной кортикостероидной терапии, должны следить за своим весом, артериальным давлением, уровнем глюкозы в крови, а также уровнем калия. Чтобы минимизировать риски для здоровья, такие как остеопороз и сердечные заболевания, важно соблюдать низкосолевую диету с высоким содержанием белка и низким содержанием жира, а также принимать добавки кальция, бисфосфонаты и, при необходимости, анаболические стероиды. Тем пациентам с идиопатической хронической воспалительной демиелинизирующей полирадикулонейропатией, которые хорошо реагируют на кортикостероиды, для достижения наилучших результатов, скорее всего, потребуется пожизненная поддерживающая доза в 5-20 мг каждый день.
Азатиоприл. При малой эффективности или непереносимости кортикостероидов, а также в тех случаях, когда их дозу не удается снизить, назначают цитостатики (азатиоприн 2,5 мг/кг/сут.). Взрослым азатиоприл назначают по 50 мг 3 раза в сутки; добавляют к кортикостероидам, если не получено улучшение после 3-4 недель лечения, или назначают одновременно с плазмаферезом, если он выбран в качестве основного метода лечения.. В ряде случаев получено улучшение при лечении циклофосфамидом, 1 г/м 2 внутривенно капельно, ежемесячно, или циклоспорин, 4-6 мг/кг/сут.). При тяжелых формах с самого начала используют сочетание азатиоприна с кортикостероидами. Во время лечения необходимо следить за состоянием кроветворения и функции печени.
Плазмаферез. С тем, чтобы избежать длительного приема кортикостероидов и цитостатиков, используют плазмаферез и иммуноглобулин. Циклы плазмафереза проводят в комбинации с медикаментозным лечением иммуносупрессорами. Повторные циклы плазмафереза элиминируют антитела IgG против периферической нервной ткани. Обнаружение последних служит прямым показанием для проведения плазмафереза. Проводят 2 сеанса в неделю, в течение 3 недель, добавляют к кортикостероидам, если они не эффективны в течение первых 1-2 недель.
Иммуноглобулин (октагам, сандоглобуллин, хумаглобин и др.) вводят — внутривенное введение в дозе 0,4 г/кг/сут. в 1 мл физиологического раствора, в течение 3-5 дней подряд (скорость инфузии 6-8 час), если отмечается позитивный клинический эффект, курс введения иммуноглобулина повторяется. Побочные эффекты — головная боль, тошнота, лихорадка. Улучшение проявляется в течение 3 недель и продолжается в среднем 6 недель. Однако продолжительность улучшения не превышает нескольких недель или месяцев, после чего введение иммуноглобулина приходится повторять (1 г/кг в течение 1-2 дней).
В связи с этим разработаны схемы с более плавным прекращением лечения (например, 1 мг/кг/сут., в течение 2 дней, затем ту же дозу вводят через 2 и 4 недели, после чего повторяют ежемесячно на протяжении нескольких месяцев).
При частых рецидивах целесообразно присоединение малых доз преднизолона (0,5 мг/сет). Комбинировать плазмаферез и в/в введение иммуноглобулина не целесообразно. Серьезных побочных эффектов нет, однако пока не установлено, достаточно ли эффективен иммуноглобулин в качестве монотерапии.
В ряде исследований показана эффективность при ХВДП интерферонов (альфа и бета), методов иммуноабсорбции, однако их роль в лечении данного заболевания остается неясной.
Витаминотерапия: витамины группы В — В, В6, В.
Лечение препаратами, действующими на сосудистую систему, улучшающими реологические свойства крови и микроциркуляцию, проводится в виде последовательных курсов, каждый из них длительностью 2-3 недели. Применяются в возрастных дозировках — трентал, кавинтон, танакан.
Препараты, улучшающие метаболизм: церебролизин, актовегин, пирацетам, пиритинол, гинкго-билоба;
Метаболические средства — фолиевая кислота, аевит, оротат калия.
Дальнейшее ведение:
- — диспансерный учет у невропатолога по месту жительства;
- — регулярные занятия ЛФК;
- — соблюдение низкосолевой диеты с высоким содержанием белка, но низким содержанием жира;
- — продолжить прием преднизолона с постепенным снижением дозы, прием ранитидина.
Перечень основных медикаментов:
- Азатиоприн, 50 мг
- Актовегин, ампулы по 80 мг
- Аскорбиновая кислота, таблетки 0,05
- Иммуноглобулин человека для внутривенного введения (хумаглобин), 5 мл (250 мг), 10 мл (500 мг), 20 мл (1000 мг), 50 мл (2500 мг), 100 мл (000 мг)
- Кальций-Д3 Никомед, таблетки 0,5
- Нейромидин, таблетки 20 мг
- Пиридоксин гидрохлорид (витамин В6), ампулы 5% 1 мл
- Преднизолон, ампулы 30 мг
- Преднизолон, таблетки 5 мг
- Ранитидин, таблетки 0,15
- Тиамин бромид (витамин В1), ампулы 5% 1 мл
- Фолиевая кислота, таблетки 0,001
- Цианокобаламин (витамин В12), ампулы 500 мкг
Дополнительные медикаменты:
1. Актовегин, ампулы 2 мл 80 мг
2. Винпоцетин (кавинтон), таблетки 5 мг
3. Калия оротат, таблетки 0,5
4. Метандростенолон, таблетки 0,005
5. Метилпреднизолон (метилпред, солюмедрол), суспензия для инъекций 1 мл, 40 мг
6. Оксибрал, ампулы 2 мл
7. Октагам, флаконы по 50 мл, 100 мл и 200 мл
8. Омепразол, капсулы 20 мг
9. Пентоксифиллин (трентал), таблетки 0,1
10. Пирацетам, ампулы 5 мл
11. Ретоболил, ампулы по 1 мл 5% (50 мг) в масле
12. Танакан, таблетки 40 мг
13. Церебролизин, ампулы 1 мл
14. Циклоспорин (сандиммун), капсулы 10 мг, 25 мг, 100 мг
Индикаторы эффективности лечения:
1. Увеличение мышечной силы, объема активных движений, мышечного тонуса в пораженных конечностях.
2. Улучшение походки.
3. Улучшение трофики паретичных мышц, двигательных функций.
4. Удержание достигнутого положительного результата.
Госпитализация
Показания к госпитализации (плановая): парезы, параличи, нарушение походки, слабость и нарушение чувствительности в конечностях, контрактуры, деформации стоп.
Профилактика
Профилактические мероприятия:
1. Профилактика рецидивов заболевания.
2. Предупреждение контрактур, атрофий, растяжение мышц, ретракции сухожилий, скелетных деформаций — сколиоза, подвывиха и вывиха суставов, эквиноварусной деформации стопы.