Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Стаховская Л.В.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Сердюк А.В.
ФГБОУ ВО «Российский национальный медицинский исследовательский университет им. Н.И. Пирогова», Москва, Россия
Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний
Авторы:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В.
Как цитировать:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В. Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний. Журнал неврологии и психиатрии им. С.С. Корсакова.
2018;118(5):143‑149.
Kovrazhkina EA, Stakhovskaya LV, Razinskaia OD, Serdyuk AV. Inhibitors of CNS regeneration, their physiological role and participation in pathogenesis of diseases. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2018;118(5):143‑149. (In Russ.)
https://doi.org/10.17116/jnevro201811851143

Функциональное восстановление ЦНС после повреждений ограничено неспособностью нейронов и аксонов к регенерации. При этом аксоны периферической нервной системы (ПНС) регенерируют достаточно хорошо и полно, аксоны ЦНС — в минимальной степени [1—3]. Необратимая дегенерация аксонов нейронов головного и спинного мозга — ведущая причина неизлечимости тяжелых повреждений ЦНС, а также нейродегенеративных заболеваний.
Дегенерация аксонов является анатомической основой патогенеза многих заболеваний ЦНС и ПНС, с ней связан неврологический дефицит, а его регресс — с возможностью регенерации осевых цилиндров. Вторичная демиелинизация развивается как типовая реакция на повреждение нервной ткани и способствует углублению аксонального повреждения. Демиелинизированные аксоны еще хуже проводят нервный импульс, т. е. вторичная демиелинизация ухудшает течение аксонопатии и способствует углублению неврологического дефицита. Однако миелин ЦНС и ПНС различен: в ЦНС это продукт клеток олигодендроглии, в ПНС — шванновских. Различаются и регенераторные возможности: если периферические нервы относительно быстро и полно регенерируют, то проводящие пути ЦНС (например, кортикоспинальные тракты) восстанавливаются медленно и неполно. Одна из причин этого — наличие в ЦНС ингибиторов аксонального роста, связанных с миелином, глией и межклеточным матриксом. Молекулы-ингибиторы аксонального роста играют важную роль в эмбриогенезе и развитии ЦНС млекопитающих, но у взрослых препятствуют регенерации аксонов. В настоящее время молекулы-ингибиторы аксонального роста являются объектом углубленного изучения, разрабатываются лекарственные препараты, нейтрализующие эти влияния.
Известно, что неспособностью к регенерации обладают только аксоны ЦНС взрослых высших млекопитающих, у более примитивных животных, а также на ранних стадиях онтогенеза у плодов эта способность сохранена [2, 4, 5]. Хорошей нейропластичностью после повреждений и заболеваний ЦНС обладают дети, причем тем лучшей, чем в более раннем возрасте получено данное повреждение. Потеря способности аксонов ЦНС к регенерации совпадает по времени с дифференцировкой клеток глии [2, 5]. Непосредственное окружение нейронов и аксонов (олигодендро- и астроцитарная глия, а также миелин) содержат молекулы-ингибиторы роста аксонов, к которым относятся миелинассоциированные ингибиторы роста аксонов [6] и сульфатированные сахара экстрацеллюлярного матрикса [7].
Настоящий обзор посвящен ингибиторам роста аксонов в ЦНС, их роли в норме и при различных видах патологии.
Rho-ROCK сигнальный путь
Аксональная регенерация в ЦНС ограничена множеством ингибиторных молекул, связанных с глией и миелином. Эти ингибиторы стимулируют внутриклеточный сигнальный Rho-механизм — единый путь торможения регенерации аксонов в ЦНС, «запускаемый» повреждениями аксонов и глии [8, 9]. Все ингибиторные молекулы действуют именно через этот механизм.
RhoA — малая ГТФаза, активированная форма которой представляет собой серин/тирозинпротеинкиназу (RhoA-киназа, ROCK). Rho-ROCK-механизм связан с такими функциями нейронов, как миграция, рост дендритов и аксонов, нейропластичность, причем оказывает на них именно тормозящее действие. Этот механизм играет важную роль в патогенезе повреждений спинного и головного мозга, а также нейродегенеративных заболеваний [8—10].
В последние годы проясняется физиологическая роль Rho-ROCK [11], связанная с локомоциями клеток. Локомоция клеток осуществляется посредством псевдоподиальной активности и представляет собой координированный циклический процесс, включающий выпячивание (протрузия) псевдоподий на переднем крае клетки, их прикрепление к внеклеточному матриксу, центростремительное натяжение прикрепившихся псевдоподий, освобождение от контактов с матриксом задней (хвостовая) части клетки. Движущаяся клетка приобретает «локомоторный фенотип»: она сильно поляризована, ее передняя часть имеет вид широкой и тонкой пластинки, по краю которой непрерывно образуются псевдоподии, противоположная часть клетки ретрактирована. Образование псевдоподий обусловлено полимеризацией актиновых микрофиламентов на концах, обращенных к плазматической мембране клетки, наращивание которых создает толкающую силу, «выпячивающую» участок мембраны в виде широкой ламеллоподии или нитевидной филоподии. Важную роль в локомоции клеток выполняют также микротрубочки, по ним к псевдоподии транспортируются вещества, необходимые для роста актиновых микрофиламентов, они также способствуют «разбору» слишком увеличившихся в размерах фокальных контактов, что позволяет мигрирующим клеткам ликвидировать старые участки прикрепления [12].
Для передвижения клеток необходимо воздействие специфических цитокинов — факторов роста и связывания интегриновых рецепторов с внеклеточным матриксом. Передача сигналов от рецепторов факторов роста и интегринов контролирует не только пролиферацию клеток, но и их локомоцию, поэтому многие факторы роста являются митогенами-мотогенами. К митогенам-мотогенам относятся тромбоцитарный и эпидермальный факторы роста (PDGF и EGF), фактор роста фибробластов (FGF), «рассеивающий» фактор (scatter factor, HGF/SF) и др. Связывание митогенов-мотогенов со своими рецепторами включает как митогенную Ras-Raf-МАР-киназную сигнальную цепь, так и «морфогеную» сигнальную цепь от активированного Ras, в которой сигнал передается через фосфатидилинозит-3-киназу (PI3K) на группу белков, играющих ключевую роль в контроле над организацией и динамикой цитоскелетных систем, актиновых микрофиламентов и микротрубочек. Это G-белки, или малые ГТФазы, семейства Rho, действующие как молекулярные «двусторонние переключатели», попеременно то переходя в активное состояние при связывании с ГТФ, то теряя активность в результате гидролиза ГТФ до ГДФ. В активном состоянии G-белки семейства Rho участвуют в передаче сигналов от рецепторов факторов роста и интегриновых. Активация малых ГТФаз стимулирует сборку актиновых микрофиламентов, усиливает их контрактильность, способствует формированию стресс-фибрилл и связанных с ними фокальных контактов (белок Rho), стимулирует полимеризацию актина на плюс-концах разветвляющихся микрофиламентов, что создает толкающую силу, формирующую ламеллоподию (белок Racl) [12—14].
Таким образом, суперсемейство малых ГТФаз является одним из ключевых регуляторов множества сигнальных путей у эукариот [15]. К нему относится и семейство Rho ГТФаз, играющих важную роль в эмбриогенезе и регенерации ЦНС. К настоящему времени в семействе Rho насчитывают 20 белков, разделяемых на восемь подсемейств. Rho ГТФазы участвуют в различных физио- и патологических процессах — эмбрио-, митогенезе, росте и дифференцировке клеток, фокальных контактах регенерации, контракции. Соответственно высока клиническая важность изучения Rho ГТФазы — с их функционированием связаны гипертонус гладких и скелетных мышц (при артериальной и хронической легочной гипертензии, вариантной стенокардии, глаукоме и др.), нарушения клеточной дифференцировки (при новообразованиях), проблемы регенерации клеток (в частности, при повреждениях нервной ткани и нейродегенеративных заболеваниях) [16, 17]. При повреждениях ЦНС и нейродегенерациях активация RhoA и ROCK является ключевым элементом прекращения роста аксонов, тормозит элонгацию конуса аксона, блокирует спратинг нейритов [18]. Экспериментально доказано [19], что химическая блокада Rho-ROCK-механизма меняет ингибиторные эффекты ROCK in vitro и способствует аксональной регенерации in vivo.
Миелинассоциированные протеины
Рост аксонов осуществляется конусами роста — расширениями терминалей нервных волокон. Их ультраструктура отличается очень высокой концентрацией ряда органелл (микротрубочки, микрофиламенты, митохондрии, гранулярный ретикулум, лизо- и рибосомы), включает многочисленные вакуоли, что является показателем активного пиноцитоза экзогенных белков. Направление роста аксонов определяется процессом узнавания, который реализуется посредством избирательного адгезивного взаимодействия между конусами роста и окружающим их субстратом. Узнавание обеспечивают молекулы адгезии, которые встроены в плазмолемму ламелло- и филоподий и взаимодействуют с комплементарными молекулами во внеклеточном матриксе. Рост аксонов происходит по градиенту концентрации специфических химических факторов, вырабатываемых в органах-мишенях. Соответственно рост аксонов направляется и регулируется в том числе молекулами экстрацеллюлярного матрикса [19].
В 1985 г. М. Schwab и Н. Thoenen [20] изучали различия в процессах восстановления: культивировали симпатические и сенсорные нейроны в обогащенной ростовыми факторами среде и регистрировали рост отростков нейритов. Они зафиксировали рост волокон седалищного (принадлежат ПНС), но не зрительного (относятся к ЦНС) нерва. Авторы предположили, что в ЦНС содержатся ингибиторные молекулы, тормозящие регенерацию аксонов. М. Schwab и D. Bartholdi [21] продолжили поиски молекул, ингибирующих рост аксонов в ЦНС, учитывая, что наиболее ярким отличием повреждений ЦНС от ПНС является активация астро- и олигодендроцитов с формированием глиального рубца, в состав которого входят потенциально ингибиторные молекулы (например, NG2-хондроитин-сульфат-протеогликан).
В 1988 г. Р. Caroni и М. Schwab [22] обнаружили ген Nogo, продуктом которого является белок, ингибирующий регенерацию аксонов. Белок Nogo существует в трех изоформах, но только Nogo-A, экспрессируемый олигодендроцитами, связан с миелином ЦНС. Nogo-A имеет молекулярную массу 220—250 кД, является нормальным компонентом миелина олигодендроцитов и играет в норме ведущую роль в направлении аксонального роста в процессе онтогенеза и подавлении нейропластичности. Структурно-функциональные особенности Nogo-A включают два ингибиторных домена: N-терминальный, отсутствующий у изоформ Nogo-B и -C, и 66-аминокислотный конец (Nogo-66), присутствующий у всех трех изоформ. Оба этих сегмента белка Nogo-A потенциально могут участвовать в ингибировании аксонального роста, но Nogo-66 работает именно при повреждении миелина и олигодендроцитов [21, 23—25]. У нокаутных по Nogo-A мышей одни авторы [26] обнаружили «драматический» эффект регенерации аксонов, однако другие [27, 28] — не выявили подобного эффекта. Это заставило предполагать, что Nogo-A является не единственным ингибитором роста аксонов.
В дополнение к Nogo-A были выделены еще два миелинассоциированных ингибитора роста аксонов — миелинассоциированный гликопротеин (myelin-associated glycoprotein — MAG) и олигодендроцит-миелиновый гликопротеин (oligodendrocyte-myelin glycoprotein — OMgp). MAG был выделен в 1994 г. независимо в лабораториях M. Filbin и L. McKerracher [29—31]; он очень активно ингибирует рост аксонов in vitro, но нокаутные по MAG мыши также не показывают значимый регенерации аксонов [32—34].
Важным моментом в понимании механизмов регенерации аксонов стало обнаружение рецептора Nogo-66 (NgR) А. Fournier и соавт. [35, 36]. NgR располагается на поверхности аксонов, дополнительно поддерживается трансмембранными белками, например трансмембранный протеин p75 является рецептором для семейства нейротрофинов и специфически взаимодействует с NgR [23, 34, 35]. NgR, p75 и Lingo-1 (еще один трансмембранный протеин) формируют рецепторный комплекс для ингибиторной активности компонентов миелина. Три основные связанные с миелином молекулы, ингибирующие рост аксонов (Nogo-A, MAG и ОМ гликопротеины), действуют через этот рецепторный комплекс [32—34]. Его сигнальный эффект активирует малую ГТФазу Rho (через Nogo-66 рецептор NgR и трансмембранные рецепторы нейротрофинов). Через этот рецепторный комплекс миелинассоциированные протеины, другие ингибиторные молекулы экстрацеллюлярного матрикса и сам компактный миелин стимулируют экспрессию генов, вызывают активацию MAP-киназы и ROCK [36]. Результатом является влияние на цитоскелет аксона и торможение роста аксонального конуса [6, 11].
Ингибиторные молекулы межклеточного матрикса
В дальнейшем, помимо миелинассоциированных протеинов, были идентифицированы и другие ингибиторные молекулы экстрацеллюлярного матрикса, обладающие свойством ограничивать рост нейритов: эфрины, семафорины, протеогликаны и др. [34]. На торможение роста аксонов и элонгацию аксонального конуса влияют и сам миелин, и сульфатированные сахара — хондроитин- и кератансульфатные протеогликаны [6]. Остатки миелина и протеогликаны являются основными компонентами глиальных рубцов [7, 18]. Их биологическое действие также осуществляется через Rho-ROCK-сигнальный путь.
Физиологическая роль ингибиторов регенерации ЦНС
Роль миелинассоциированных ингибиторов роста аксонов в патологии, особенно при травмах и повреждениях спинного мозга, изучена в многочисленных экспериментальных исследованиях — на культурах клеток и животных моделях. Физиологическая роль миелинассоциированных протеинов и Rho-ROCK-сигнального пути только начинает проясняться. Ингибиторы регенерации в ЦНС регулируют развитие миелина, электрическую и механическую стабильность аксонов, способствуют организации нейронных сетей, лимитируют синаптические контакты [11]. Миелинассоциированные ингибиторы также ограничивают обусловленную опытом пластичность, спраутинг нейритов и установление новых межнейронных связей в здоровой взрослой ЦНС, т. е. ограничивают анатомические изменения в ЦНС в норме и патологии, что делает их ведущими в фундаментальных исследованиях нейропластичности [8]. Нарушение функции миелинассоциированных ингибиторов связано с проблемами развития мозга, нейропсихиатрическими расстройствами, нейропатической болью [6, 11, 37].
Миелин обеспечивает быстрое и точное проведение нервного импульса по длинным аксонам, осуществляет метаболическую поддержку аксонов и обладает нейропротективными свойствами [38]. Недавние исследования [39, 40] показывают, что существуют механизмы регуляции активности нейронов, влияющие на степень миелинизации ЦНС. Предполагают, что адаптивная миелинизация является еще недостаточно изученной формой зависимой от активности пластичности нервной системы.
В процессе развития молекулы окружения аксонов участвуют в образовании сложных нейронных сетей. После своего образования нейронные сети «настраиваются» в течение короткого периода повышенной пластичности («критический период»), по окончании которого приобретают зрелую форму. Синаптические контакты в зрелом мозге стабильны в течение длительного времени, но имеет место и ограниченное структурное ремоделирование, что формирует клеточную основу обучения, памяти и нейропластичности [41]. Зависящая от активности модификация синаптических контактов может быть достигнута посредством динамической регуляции окружения аксонов. Ингибиторы регенерации ЦНС укрепляют нейронную архитектуру в конце критических периодов [42, 43]. Так, получены доказательства [44] вовлечения Nogo-A в ограничение нейрональной пластичности в зрительной системе грызунов. Важная физиологическая функция ингибиторов регенерации ЦНС заключается в консолидации нейронной архитектуры, созданной в конце критического периода.
Ингибиторы регенерации ЦНС экспрессируются глией и нейронами. Nogo-A, OMgp, NgR1-рецептор для Nogo-66, хондроитинсульфатные протеогликаны присутствуют в пре- и постсинаптических фракциях, выделенных из гиппокампа [29, 42, 45]. Ингибиторы регенерации ЦНС влияют на структуру и плотность синапсов [46]. В гиппокампе нокаутных мышей NgR1-дендритные шипы имеют менее зрелый профиль распределения, чем у мышей «дикого» типа, по-видимому, NgR1 необходим для правильного развития зрелых шипов [47]. Исследования показали, что потеря всех трех членов семейства NgR (NgR1, NgR2 и NgR3) увеличивает синаптическую плотность в молодом гиппокампе, указывая на то, что NgR функционируют как отрицательные регуляторы синаптогенеза. В недавних исследованиях[6] показано, что NgR1 является ключевой молекулой для ограничения ветвления дендритов в соматосенсорной коре взрослых мышей и пирамидальных нейронах гиппокампа.
Взаимодействие между ингибиторами регенерации ЦНС и факторами роста (например, BDNF) обеспечивает нейрональную пластичность и стабильность нейронных сетей после завершения критических периодов [45]. Многие нейропсихиатрические расстройства связаны с дефектами структуры или функции синапсов и могут быть вызваны сдвигом в возбуждающем/ингибиторном балансе. Учитывая, что ингибиторы регенерации ЦНС играют важную роль в регуляции этих процессов, их измененная экспрессия может способствовать развитию нарушений в работе мозга. В старческом мозге экспрессия в гиппокампе нескольких ингибиторов регенерации ЦНС увеличивается и коррелирует с дефицитом пространственного обучения и памяти, что показано в экспериментах на трансгенных животных [48, 49]. При этом крысы с пониженной экспрессией Nogo-A демонстрируют нарушения в социальном поведении [50]. Интересно, что мутации в NgR1 и Nogo-A у человека связаны с шизофренией [51].
Спинальная травма
Наиболее изучена роль миелинассоциированных ингибиторов роста и Rho-ROCK-механизма при спинальных повреждениях. Эффективность лечения этой патологии невелика. В недавнем обзоре P. Stahel и соавт. [52] перечислены все существующие терапевтические подходы: применение стероидов в острейшем периоде и стабилизация повреждений позвоночника в ближайшие 24 ч после травмы помогают ограничить вторичные повреждения; поддержание жизненно важных функций (дыхание, артериальное давление, борьба с кровопотерей) в острейшем и остром периодах и как можно более ранняя мобилизация пациента также позволяют предотвратить осложнения. Однако наибольшую надежду в плане именно восстановления неврологического дефицита сейчас возлагают на экспериментальные препараты, блокирующие молекулы — ингибиторы роста аксонов [52].
Аксональную регенерацию после спинальных травм блокируют окружающие место повреждения ткани. Аксональные контакты и восстановление в ЦНС блокируют остатки миелина, нейровоспаление и клеточная гибель в месте повреждения. Хондроитинсульфатные протеогликаны экстрацеллюлярного матрикса образуют глиальный рубец и периневральный барьер для аксонального роста и спрутинга [53—55]. Соответственно спонтанное восстановление после спинальной травмы, небольшие степени которого все же наблюдаются в клинике и эксперименте, зависит от присутствия миелинассоциированных протеинов-ингибиторов роста, воспалительного компонента в поврежденной нервной ткани, гиперактивации сигнального Rho-пути [56].
На экспериментальных животных моделях было показано [57, 58], что после селективного пересечения волокон кортикоспинального тракта на среднем грудном уровне терапевтическое введение антител против ингибиторного протеина Nogo-A способствует более быстрому и полному восстановлению двигательных функций, при этом отдаленная регенерация поврежденных аксонов отмечена только после Nogo-нейтрализации. Также после двустороннего пересечения кортикоспинального тракта в присутствии Nogo-A-нейтрализующих антител было показано увеличение коллатералей руброспинального тракта, иннервирующих шейный отдел спинного мозга, что коррелировало с клиническим улучшением и демонстрировало возможность для параллельных, анатомически обособленных систем по меньшей мере частично компенсировать повреждение другой системы [58].
В экспериментальных работах показана значимая роль в данной патологии миелинассоциированного протеина Nogo-A [56], липидов миелина [54], хондроитинсульфатных протеогликанов [53]. На культурах клеток в среде, лишенной этих молекул, аксонотомированные нейроны демонстрировали элонгацию аксонального конуса, животные нокаутных по генам миелинассоциированных протеинов линий лучше восстанавливались после экспериментальных спинальных повреждений. В экспериментах обнаружены динамические изменения экспрессии гена и синтеза Nogo-A после повреждения спинного мозга (низкая через 24 ч после травмы, продолжает понижаться далее до 3 дней, затем быстро повышается до пика около 7 дней, и постепенно снова снижается после 14 дней) [59], а также роль относительно сохранных надсегментарных проводников при спонтанном восстановлении у нокаутных по Rho-ROCK животных — имеет значение сохранность руброфугальных и руброспинальных путей с образованием de novo связей между красным ядром и ядром шва [56]. Эти данные очень важны для реабилитации пациентов со спинальными повреждениями, но наибольший интерес вызывают препараты — блокаторы ингибиторных молекул.
Нейродегенерации
Компонент аксональной дегенерации очень важен в патогенезе нейродегенеративных заболеваний. Сами зрелые нейроны практически не способны к регенерации (за исключением отдельных зон ЦНС), но аксоны обладают способностью к спраутингу и элонгации. На развернутых стадиях большинства нейродегенеративных заболеваний потеря тел нейронов всегда сопровождается потерей аксонов и нарушением способности к нейропластичности. Проблеме соотношения между дегенерацией тел нейронов и аксонов посвящен один из недавних обзоров, показавший, что молекулярные механизмы дегенерации аксонов различны с таковыми для тел нейронов, что делает воздействия на аксональный компонент нейродегенерации одним из возможных терапевтических подходов к данной патологии [60].
Гиперактивация Rho-ROCK-механизма описана при болезни Паркинсона, боковом амиотрофическом склерозе, спинальных амиотрофиях [60—64]. Особенно много внимания исследователей в последнее время привлечено к роли микроглиального окружения в дегенерации нейронов ЦНС. Важная роль астро- и микроглии и активации глиальной ROCK показана при боковом амиотрофическом склерозе [64] и болезни Паркинсона [62], особенно серьезное нейротоксическое и провоспалительное действие оказывает глиальное окружение нейронов на поздних стадиях нейродегенераций. Показано также [61], что активация ROCK усиливает присущую нейродегенеративным заболеваниям абнормальную белковую агрегацию (например, α-синуклеин при болезни Паркинсона), а препараты — ингибиторы ROCK могут ее понижать.
Другие заболевания
Гиперактивация Rho-ROCK-сигнального пути под воздействием миелинассоциированных ингибиторов влияет и на восстановление после инсульта [65, 66]. Миелинассоциированные протеины — ингибиторы роста аксонов синтезируются также некоторыми субпопуляциями клеток сетчатки и оказывают влияние на восстановление после повреждений зрительных нервов [67].
Ингибиторы RhoA и другие потенциальные лекарственные средства
Учитывая значительную роль Rho-ROCK-сигнального пути и «миелинассоциированных ингибиторов в торможении регенерации аксонов ЦНС, в последние годы велик интерес исследователей к поиску потенциальных терапевтических агентов — веществ, блокирующих Rho-ROCK-механизм и усиливающих нейропротекцию и стимуляцию регенерации. Особое значение приобретает поиск таких потенциальных лекарств для пациентов со спинальными повреждениями и нейродегенеративными заболеваниями.
В настоящее время выделен класс веществ — ингибиторов RhoA (C3-exoenzmye, fasudil, Y-27632, ibuprofen, siRhoA, p21), активно изучаемых в экспериментах на клеточных культурах и моделях животных [8, 9, 53, 55, 68, 69]. Ингибиторы RhoA селективно блокируют ее без влияния на другие ГТФ (С3-трансферазы), к веществам этой группы относится, например, активно сейчас изучаемый (проходит I/IIa фазы клинических испытаний) cethrin [55, 68]. Существуют и другие химические агенты, селективно «связывающие» RhoA, например collapsing response mediator protein 4 (CRMP4), образующий комплекс CRMP4b/RhoA и блокирующий тормозящий эффект на рост аксонов; блокируют Rho-ROCK-механизм и антагонисты АТФ-рецепторов P2Y12 и P2Y13 [37].
Исследования на животных показывают терапевтическую эффективность ингибиторов RhoA. Большинство подобных испытаний проведено на моделях спинальной травмы. Так, в одном из недавних исследований [9] 120 крыс разделили на три группы: 40 — ложно оперированные (только ламинэктомия, без рассечения спинного мозга), 40 — ламинэктомия и спинальная, получение физиологического раствора, 40 — ламинэктомия и спинальная транссекция, введение лекарства. Показано достоверно лучшее восстановление у животных, получавших fasudil (по шкале Basso—Beattie—Bresnahan), а также достоверное снижение экспрессии RhoA мРНК в ткани спинного мозга животных опытной группы. Выявлены положительное влияние ингибитора RhoA Y-27632 на элонгацию аксонального конуса в обогащенной протеогликанами среде [18] и регресс неврологического дефицита у перенесших рассечение спинного мозга на уровне СIV—СV позвонков крыс [8], положительное влияние ингибиторов АТФ-рецепторов P2Y12 и P2Y13 на нейропатическую боль при спинальных повреждениях [37].
Тем не менее в большинстве экспериментальных исследований на животных с ингибиторами RhoA не доказана их эффективность. В недавнем крупном метаанализе [69] изучалась эффективность различных PhoA/ROCK-ингибиторов на моделях животных повреждения спинного мозга (геми-, транссекция, контузия). Работы, опубликованные в базах PubMed, EMBASE, Web of Science и соответствующие критериям включения (экспериментальная спинальная торакальная травма, лечение ингибиторами PhoA/ROCK, оценка двигательного восстановления по протоколам Basso, Beattie, and Bresnahan score или Basso Mouse Scale for Locomotion), оценивались двумя независимыми исследователями по девяти пунктам. Метаанализ включил 30 работ (всего 725 животных) и обнаружил эффективность ингибиторов PhoA/ROCK в 15% случаев. В некоторых работах, сообщавших об эффективности ингибиторов PhoA/ROCK, было обнаружено нарушение методологии; эти данные не включались в окончательный анализ.
Ингибиторы PhoA/ROCK (facudil) показали свою эффективность на моделях церебрального инсульта и нейродегенеративных заболеваний [61, 66]. Так, ингибитор RhoA facudil изучался на мышиной СОД1-модели бокового амиотрофического склероза (линия G93A), где вызывал торможение дегенерации мотонейронов и замедление прогрессирования заболевания. Препарат предотвращал гибель мотонейронов у G93A мышей, подавлял нарастание ROCK-активности, редуцировал фосфорилирование актина, индуцированное СОД1. В другом исследовании in vivo [63] у G93A-мышей при пероральном приеме facudil также удлинялись сроки выживания и улучшались двигательные функции, а применение facudil in vitro увеличивало выживаемость поврежденных мотонейронов. Facudil исследовался и на модели болезни Паркинсона, показав положительное влияние на выживаемость нейронов черной субстанции и даже уменьшение патологической агрегации α-синуклеина [61].
С целью возможного терапевтического влияния на рост и регенерацию аксонов изучали антагонисты к рецептору Nogo-66 (NgR1) [70], ингибитор гликозилирования хондроитинсульфатных протеогликанов PTPσ [53], моноклональные антитела против миелинассоциированных протеинов-ингибиторов аксонального роста. В недавнем исследовании [65] эффект моноклонального антитела GSK249320 против миелинассоциированного гликопротеина (MAG) показан на модели кортикального ишемического инсульта: у приматов, получавших GSK249320, к 16-му дню заболевания функциональное восстановление было достоверно лучше, чем в контрольной группе. Важно, что функциональное преимущество опытной группы было получено не за счет периинфарктной области и прилегающей премоторной зоны, что было продемонстрировано нейрофизиологическим — картированием двигательных зон (представительство вентральной премоторной зоны в экспериментальной группе было меньше, чем в контроле).
Таким образом, ингибиторную активность миелина ЦНС можно нейтрализовать с помощью антител к миелинассоциированным протеинам (например, анти Nogo-A), делеции генов Nogo, MAG и OMgp, введения растворимых NgR-фрагментов и NgR-блокирующих пептидов, торможения поступления кальция во внутриклеточное пространство, использования высоких концентраций цАМФ, применения ингибиторов RhoA или ROCK [71]. In vivo показаны нейтрализующий эффект моноклональных IgM-антител к Nogo (IN-1), умеренно выраженное, но достоверное улучшение восстановления после спинального повреждения у нокаутных по Nogo-A мышей, эффективность пептидов, взаимодействующих с активным 66-аминокислотным С-концом Nogo (например, NEP1−40), связывающихся с Nogo, но не активирующих его. Активно изучаются и нейтрализующие эффекты вторичных мессенджеров ингибиторной активности миелина: инактивирующих Rho-энзимов (например, С3-трансфераза), ингибиторов ROCR (например, Y27632,), эффекты нейтрализации активности Nogo и MAG продемонстрированы при инфузии in vivo аналогов цАМФ, а также медиатора p75 [71—73]. Представленный подход к управлению регенерацией аксонов кажется физиологически обоснованным и потенциально эффективным, однако решение данной проблемы далеко от завершения, необходимы дальнейшие исследования.
В заключение еще раз отметим, что ингибиторы регенерации ЦНС, работающие через Rho-ROCK-сигнальный путь, играют важную физиологическую роль не только в развитии ЦНС, но и по окончании критических периодов — в стабилизации нейронных сетей, ограничении ветвления дендиритов, структуре и функционировании синаптических контактов, работая в противоположном факторам роста направлении. Нестабильное функционирование нейронных сетей является основой многих нейропсихиатрических заболеваний. При повреждениях ЦНС, травмах, нейродегенеративных заболеваниях, старении избыточная экспрессия связанных с миелином ингибиторов регенерации ЦНС тормозит рост аксонов, играет отрицательную роль для реабилитационного потенциала. Изучение аксон-миелиновых отношений, роли окружения аксонов в их дегенерации и регенерации важно для развития подходов к лечению ряда заболеваний и повреждений ЦНС.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: elekov2@yandex.ru
Similarly, the regenerating axons from nerves of the limb stump become differentially myelinated by their associated Schwann cells, which are in turn guided by the fibroblast progenitors of the endo- and perineurium to produce the large nerves of the limb.
From: Reference Module in Biomedical Sciences, 2017
Regeneration of Neural Tissues
David L. Stocum, in Regenerative Biology and Medicine (Second Edition), 2012
E Fish, Amphibians and Lizards are Good Comparative Models of Adult Neurogenesis and Axon Regeneration
The amphibian, fish and lizard spinal cord, whether regenerating axons across a gap, or neurons after tail amputation, are underused model systems with significant potential for identifying regeneration-permissive factors that can be applied to the non-regenerating mammalian spinal cord. For example, molecular comparisons could be made between the regenerating axolotl cord and the regeneration-deficient adult frog cord, or between axolotl and adult mouse. Given the prominent role of apoptosis in tail regeneration of early Xenopus tadpoles and fish, and the requirement for proton efflux for regeneration of Xenopus tails, it would be of interest to investigate the role of these two processes in amphibian and lizard tail regeneration as well to determine whether this is a phylogenetically conserved feature that is obligatory in all species that exhibit tail regeneration.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123848604000046
Nerve Repair: Biomaterials
O. Jordan, … P. Aebischer, in Encyclopedia of Materials: Science and Technology, 2001
3.2 Engineered Matrix
Besides the ability to engineer the tube that guides the regenerating axons, a matrix can be designed for prefilling the tube to aid regeneration. Experimenters have preloaded the tube with biological materials such as fibronectin, laminin, collagen, and glycosaminoglycans which are naturally occurring extracellular matrix molecules. Prefilling the tube speeds up regeneration (Madison et al. 1985) and supports regeneration across longer gaps because the initial matrix and its components that would first need to be formed or synthesized within the tube are already present. Besides its biological characteristics, the physical characteristics of the matrix play an important role in promoting regeneration. It should not be too dense and should have wide enough pores to allow for neurite growth. Orienting the porosity may also favor axonal growth towards distal stump.
Work has been undertaken to design biomimetic artificial extracellular matrices. Inert hydrogels can be used as scaffolds upon which other active molecules are attached, enhancing the neurite growth through these preformed matrices. The specific cellular attachment peptide sequence of nine amino acids taken from the large 900 kD biomolecule laminin has been chemically bound into an agarose hydrogel and preloaded into the nerve-guidance channel before implantation (Borkenhagen et al. 1998). The peptides act as anchorage posts for the neurites’ filipodia to gain traction, thereby enhancing nerve regeneration. In another case, fibrin has been used as the underlying structure upon which to build. Fibrin is normally one of the first matrix components to enter the guidance channel from the plasma and exudate of the cut ends of the nerve. Fibrin has been derivatized with different peptide sequences (Schense and Hubbell 1999) that have been shown to enhance the neurite extension in vitro.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B0080431526010780
Tissue engineering of the nervous system
Paul D. Dalton, … Alan R. Harvey, in Tissue Engineering (Third Edition), 2023
17.3.4 Use of nerve guides (tubes) in the lesioned PNS
An off-the-shelf alternative for injury-induced gaps of PN (typically less than 10 mm but up to 70 mm) are nerve guides which function by acting as a conduit between the severed proximal and distal nerve stumps. Hollow tubes (nerve guides or nerve conduits) have successful outcomes that are comparable to the autograft in certain clinical situations. Fig. 17.2 schematically shows the general sequence of regeneration. After implantation, fibrin from damaged blood vessels and cytokines (including neurotrophic factors) primarily generated by the Schwann cells builds up within the nerve guide (Fig. 17.2a). Within 7 days, an oriented fibrin scaffold is formed, and cells from the perineurium penetrate into the nerve guide, while axonal debris is removed by Schwann cells and macrophages in the distal stump (Fig. 17.2b). From 7 to 14 days, migrating endothelial cells, Schwann cells, and regenerating axons penetrate into the nerve guide using the newly formed fibrin scaffold as a substrate (Fig. 17.2c). Between 14 and 56 days, Schwann cells remyelinate the regenerating larger diameter axons that exit the nerve guide, directed by the Bands of Büngner in the distal nerve stump to their targets.
Figure 17.2. Progression of regeneration within a nerve guide: (a) hours, (b) days, (c) weeks, and (d) months after injury. (e) Critical gap defect (Lc) and regenerative capability. An empty nerve guide (f) increases (g) its Lc value with (h) oriented matrices, (i) degrading polymers, (j) fiber inclusion, or (k) Schwann cell transplantation.
(e) From Zhang, M., Yannas, I.V., 2005. Peripheral nerve regeneration. Adv Biochem Eng Biotechnol. 94, 67–89.
Currently, there are several nerve guides on the medical device market, as shown in Table 17.1. Their performance is reviewed in depth by Deumens et al.,2. All of these hollow nerve guides are biodegradable and provide a protective semipermeable membrane which separates the injury site from surrounding tissues and through which nerve regeneration and tissue repair are supported. Current research focuses on filling the lumen of nerve guides with matrices, scaffolds, cells, and/or drug delivering therapies to increase the efficiency of tissue repair.3,4
Table 17.1. Commercially available and FDA approved nerve conduits.
| Product name | Composition | Diameter | Length | Degradation time | Manufacturer |
|---|---|---|---|---|---|
| Neurotube | Poly(glycolic acid) | 2–8 mm | 4 cm | 3 months | Synovis Micro Companies Alliance, Birmingham, AL |
| NeuroMatrix Neuroflex Neuromend |
Type 1 collagen | 2–6 mm | 2.5 cm | 7 months | Collagen Matrix Inc., Franklin Lakes, NJ |
| Neurolac | Poly(lactide-co-caprolactone) | 1.5–10 mm | 3 cm | 16 months | Polyganics BV, Netherlands |
| NeuraGen | Type 1 collagen | 2–7 mm | 2 cm | 4 years | Integra Neuroscience, Plainsboro, NJ |
| SaluBridge | Salubria (poly (vinyl alcohol) hydrogel) | 2–10 mm | 6.35 cm | No degradation | SaluMedica LLC, Atlanta, GA |
| Advance | Decellularized human nerve allograft | 1–5 mm | 7 cm | No data, but expected to resorb | Axogen Corp., Alachua, FL |
Adapted from Schlosshauer, B. et al., 2006. Synthetic nerve guide implants in humans: a comprehensive survey. Neurosurgery 59 (4), 740–747; discussion 747–748.
Bands of Büngner
Although the critical gap length (Lc) for humans is approximately 30 mm, once the regenerating axons bridge this defect, there is a natural scaffold prepared in the distal segment of the peripheral nerve. Axons will travel distances well above the critical gap length along Schwann cell–containing tubular basal lamina, which are termed “Bands of Büngner” after the German neurologist Otto von Büngner (1858–1905) and are often described as “Schwann cell columns.” After PNI, the cytoskeleton of the severed axon is degraded and Schwann cells, which were previously wrapped around the axons, dispense with their myelin sheath and clear debris, adopting a repair phenotype. The Schwann cells partly clear the myelin while increasing numbers of macrophages in the distal stump complete the task. Throughout such Wallerian degeneration, the basal lamina tubes that support these cells remain and act as specific tracts that channel the regenerating axons to the final targets.
With the development and optimization of microsurgical techniques for peripheral nerve repair, the success of end-to-end suturing greatly depends on the alignment of the fascicles. Therefore, the penetration of a sensory axon down a basal lamina tube previously filled with an axon from a motor neuron (and vice versa) is an ineffective (but frequent) result. Nevertheless, the bands of Büngner are the naturally occurring substrate for regeneration over long distances distal to the PN injury.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128244593000172
Degradable conjugated conducting polymers and nerve guidance
M. Asplund, in Biosynthetic Polymers for Medical Applications, 2016
12.2 Material challenges in neural engineering
A highly desired target in tissue engineering is to present a solution for the repair of severed nerves. Tubes, or porous cylindrical scaffolds, could potentially offer guidance and support for regenerating axons and ensure that fibrous tissue does not infiltrate and interfere with the healing process. In many cases, however, passive support is not sufficient for successful regeneration, but there is a need for actively encouraging and steering this process. The presentation of bioactive species patterned throughout the 3D scaffold, together with electrical stimulation, accordingly offers a promising strategy for extending the possibilities of neural repair. For supporting continuous stimulation of the tissue, the scaffold would therefore have to be either a 3D porous conductor or at least comprise conductive domains. The ideal scaffold would in addition have to be bioresorbable, offering guidance and support during healing but progressively degrading without further interference with the regenerated tissue.
From the requirements listed above it is obvious that conventional metallic conducting materials cannot offer a full solution. For this reason, CPs have since the early 1990s gained significant attention as candidates for electrically conducting nerve-guidance structures.27,46,80,81,96,97 The versatility of these polymers and their composites make it possible to address all points on the wish list. After nearly two decades of research within this field, a broad set of techniques developed and refined for processing conducting polymers into scaffolds and channels with topographical and biochemical guidance cues for nerve regeneration can be found in the literature. Biodegradability has been addressed with various strategies, aiming for decomposition of either the separate components of a composite material or the polymer backbone itself.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781782421054000122
Biomaterials and scaffolds for the treatment of spinal cord injury
Xiaoxiao Wen, … Lei Yang, in Biomaterials in Translational Medicine, 2019
6.2.2 Establishing 3D fibrous guidance channels
To date, most electrospun scaffolds have been fabricated into hollow cylindrical conduits for application in neural tissue engineering. However, inappropriate target reinnervation may occur after the implantation of hollow conduits, due to the regenerating axons being randomly dispersed in the lumen or axons originating from the same neuron connecting to different targets [45]. In order to solve the problem, researchers began to establish three-dimensional (3D) fibrous guidance channels. Liu et al. prepared spiral shaped scaffolds by rolling electrospun collagen mats into tubes of four to five layers [46]. The scaffolds were used to treat acute SCI in a rat hemisection model. 30 days after implantation, the aligned electrospun scaffolds appeared more structurally intact. The result of neurofilament staining demonstrated that there were neural fibers sprouting as early as 10 days after implantation. Astrocytes were only observed at the boundary of the lesion site. Moreover, in the implantation area, no astrocyte aggregations were found at any time points. Zamani et al. fabricated a 3D electrospun nanofiber scaffold using the method combined with a water vortex and a two nozzle system [35]. The core of the scaffolds was composed of microstrands of aligned fibers and the sheath of the scaffolds was composed of dense fibrous mat with aligned structure covering the inner part, as shown in Fig. 6.2. The neural cells can adhere and proliferate on the outer layer of the scaffolds and then penetrate into the inner layer of the scaffolds, growing along the fiber orientation.
Figure 6.2. (A) Scanning electron micrographs of 3D PLGA scaffolds. (B) Schematic representation of the PLGA scaffolds with nanorough sheath and aligned core consisting of nanofibers.
Abbreviations: 3D, three-dimensional; PLGA, poly(lactic-co-glycolic acid).
Reprinted with permission from [35].
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128134771000062
Tissue Engineering of the Nervous System
Paul D. Dalton, … Giles W. Plant, in Tissue Engineering (Second Edition), 2014
17.3.9 Summary
SCI initiates a plethora of destructive events. Some of the cells and molecules present at the site of injury may contribute to protection and repair, but the ultimate outcome is loss of tissue and loss of function in motor and sensory systems. One of the main obstacles for regenerating axons in the injured spinal cord is the presence of a glial scar at the site of injury or, in the case of an intraspinal transplant, at the transplant–host spinal cord interface. Unlike the PNS and the use of peripheral nerve autografts and nerve bridges, there is currently no reproducible, successful clinical therapy for SCI. Cell transplantation, combined with supportive matrices and scaffolds or neurotrophic factors, has been the predominant focus of TE strategies. The emphasis has been on neuroprotection, enhanced tissue sparing, and reestablishment of continuity across an injury site. Future objectives include increasing the number of damaged ascending and descending axons that regenerate, improving the remyelination of these regenerating axons, and the guidance of regenerating axons back to their appropriate target regions in the brain or spinal cord. The development of new techniques involving gene therapy and ex vivo manipulation of cells prior to transplantation will provide additional, and economically sustainable, tools that should improve therapeutic outcomes in injured patients.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780124201453000171
Neuronal Tissue Engineering
Isaac P. Clements, … Ravi V. Bellamkonda, in Biomaterials Science (Third Edition), 2013
Peripheral Nervous System
Neurons of the PNS connect the CNS with sensory and motor targets. The cell body of each PNS neuron is located in or near the spinal cord or base of the brain. From this cell body, a long axon extends uninterrupted to the tissue it innervates (up to one meter or more). A single peripheral nerve can contain thousands of motor and sensory axons, enveloped along with other cell types within flexible tubes of collagen and other supporting extracellular matrix (ECM) components.
The glial cells of the PNS are Schwann cells, which wrap around the axons in concentric layers to form insulating sheaths rich in the protein myelin. These myelin sheaths enhance the speed of signal conduction down the length of the axon. Schwann cells also provide trophic support to the axons and play a major role in injury response.
Peripheral Nerve Injury
When a peripheral nerve is damaged such that axons within it are severed, the portions of the affected axons lying distal to the injury site are cut off from the centrally located cell body. These distal axon segments subsequently degrade, and the resulting debris is cleared away by macrophages and Schwann cells as part of a process termed Wallerian degeneration. The Schwann cells proliferate and take on a pro-regenerative phenotype, rearranging themselves into aligned tracts called “bands of Bungner” and secreting factors conducive to the in-growth of regenerating axons.
Meanwhile, the portions of the injured neurons proximal to the damage site prepare for regeneration. The cell body of each injured axon undergoes major metabolic changes and initiates a program of protein synthesis to support axonal regeneration. At the tip of each injured axon, a growth cone develops which leads the regenerating axon through the intact structure of the distal nerve segment and back toward its original target, at the approximate rate of 1–3 mm per day (Gutmann et al., 1942).
Treatment for Nerve Injury
The process of peripheral nerve regeneration occurs spontaneously, as long as the injury does not result in an extended gap in the nerve. In cases where a small gap exists, the two nerve stumps can be surgically re-apposed. However, when the nerve gap is longer, this procedure creates unacceptable tension on the nerve. In these cases, an autografted segment of nerve is the clinical gold standard for treatment. Healthy segments of nerve are harvested from elsewhere in the body, and used to bridge the gap across the injury site. Unfortunately, this technique comes with several drawbacks, including the need for an additional surgery and a loss-of-function at the site from which the donor nerves are taken. Furthermore, patient recovery after autograft treatment is less than ideal.
For these reasons, much research has been devoted to developing a biomaterials-based implant as an alternative to an autograft. The goal of this research has been to engineer a construct that can be implanted across an injury gap in place of a nerve graft to provide support and guidance to regenerating cells and axons. Such a construct would employ biomaterials to recreate a pro-regenerative environment, similar to that which is found in the distal segment of injured nerve. For example, the bands of Bungner found in the distal nerve segment provide a physically aligned surface topography containing oriented tracks of adhesive molecules. Diffusible biochemical trophic and signaling factors are also released by cells in the distal nerve stump. In the following sections, we will see how appropriately selected biomaterials can be employed to recreate these types of natural physical and chemical cues, for the purpose of guiding migrating cells and regenerating axons across the nerve gap, and into the distal nerve segment (Figure II.6.14.1).
FIGURE II.6.14.1. (A) Summary of biological constraints to peripheral nerve regeneration. (B) Capacity of biomaterials-based constructs to alleviate biological constraints and promote regeneration.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080877808001224
Regenerative Medicine of Neural Tissues
David L. Stocum, in Regenerative Biology and Medicine (Second Edition), 2012
b Schwann and Olfactory Ensheathing Cells
Suspensions of Schwann cells and olfactory ensheathing cells have been used to induce axon regeneration after SCI. Rat and human Schwann cells have been isolated and expanded in vitro and implanted into SCI rats (Guest et al., 1997; Bunge, 2002). A common model has been to fill a PVC tube with a Schwann cell suspension and implant this construct into the spinal cord lesions of adult rats (reviewed by Bunge, 2002). These implants supported the regeneration of axons across SCI lesions with modest recovery of function (Chen et al., 1996). Significant axon regeneration was reported in rat SCI after transplanting collagen-imbedded Schwann cells genetically modified to hypersecrete NGF (Weidner et al., 1999). The major problem noted with Schwann cell grafts is that supraspinal axons typically fail to re-enter the cord after crossing the bridge, perhaps because CSPGs are present at a higher concentration at the caudal graft/host interface (Plant et al., 2001).
Olfactory ensheathing cells are receiving increasing attention as therapeutic agents for spinal cord injury because of their ability to promote growth of regenerating axons that extends beyond the lesion (Boyd et al., 2003; Franklin, 2003; Richter and Roskams, 2008). Many investigators have reported that OECs alone, injected directly into or rostral and caudal to SCI lesions in rodents promote axon regeneration across the lesions, accompanied by partial functional recovery (Li et al., 1998; Ramon-Cueto et al., 2000; Lu et al., 2001; Nash et al., 2002; Santos-Benito and Ramon-Cueto, 2003; Andrews and Stelzner, 2004) (Fig. 11.6). DeLucia et al. (2003) tested a homogeneous OEC clonal cell line, immortalized by the SV40 large T cell antigen, for its ability to survive and support functional recovery in SCI rats. These cells produced nearly all of the same neurotrophic factors in vitro as primary cell cultures. Immortalized OECs transplanted into thoracic hemisection lesions supported the functional recovery of tactile sense and proprioceptive functions required to walk a grid without missing the wires.
Figure 11.6. Promotion of axon regeneration by olfactory ensheathing glia (OEG) in rat spinal cord lesioned at the T8 level. (A) OEG were injected into both stumps of the completely transected cord. Green = corticospinal axons, red = brainstem axons. (B) OEG promoted regeneration of corticospinal (green label) and brainstem axons (red label) through the glial scar. (C) Section showing corticospinal axons (red) that regenerated to the L5 level (3 cm, the longest distance analyzed). (D) Photograph of an OEG-transplanted paraplegic rat 7 months after spinal cord transection, showing that the rat can properly place its paws on the rungs of the climbing grid and support its body weight with its hindlimbs.
Reproduced with permission from Santos-Benito and Ramon-Cueto, Olfactory ensheathing glia transplantation: A therapy to promote repair in the mammalian central nervous system. Anat Rec (Part B: New Anat) 271B:77–85. Copyright 2003, Wiley-Liss.
OECs have also been used in combinatorial cell transplants. Culture-expanded OECs injected on either side of a Schwann cell-containing Matrigel bridge induced axon extension beyond the border of the bridge in rat SCIs (Ramon-Cueto et al., 1998, 2000). Glial scar formation was not inhibited, but the regenerating axons were able to penetrate the scar, and there was partial functional recovery. The effectiveness of OEC transplants was further increased by the inclusion of olfactory nerve fibroblasts, suggesting that interactions with fibroblasts are important for OEC function (Barnett and Chang, 2004). Axon regeneration and partial recovery was also demonstrated in combination with neural precursor cells (Wang et al., 2010). A number of studies suggest that OECs are neuroprotective through their secretion of neurotrophic factors, promote axon extension through their expression of adhesion molecules, prevent cavitation, enhance vascularization, and promote branching of neighboring intact axons (Verdu et al., 2003; Ramer et al., 2004; Chua et al., 2004; Richter and Roskams, 2008).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123848604000113
Regeneration of Appendages
David L. Stocum, in Regenerative Biology and Medicine (Second Edition), 2012
2 Interaction of the Nerve with Wound Epidermis is Essential for Blastema Formation
Denervation by transection of the brachial nerves at the level of the shoulder, or preventing the formation of a wound epidermis by inserting the amputated limb tip into the coelom or grafting full thickness skin over the amputation surface inhibits formation of the accumulation blastema (Goss 1956a,b; Mescher, 1976; Tassava and Garling, 1979; Loyd and Tassava, 1980, Fig. 8.8). Thus both nerve and AEC are required for the formation of the accumulation blastema. Furthermore, it has long been recognized that maintenance of the AEC is dependent on innervation by regenerating axons (Trampusch, 1964), but the nature of this dependency has not been clear. In experiments making a wound in the skin of axolotl limbs, the wound epidermis developed a thickening comparable to the AEC that subsequently regressed. However, if a nerve was deviated into the wound, the epidermal thickening was maintained and a blastema-like growth was formed from the underlying tissues (Endo et al., 2004, Fig. 8.9). This growth is equivalent to a blastema formed by amputation in terms of morphology and expression of MMP-9, Msx-2, Hox A-13, Prx-1, and Tbx-5 (Satoh et al., 2007), and in nerve-induced expression of the zinc finger transcription factor Sp9 in the wound epithelium (Satoh et al., 2008). Collectively, the results imply that in a neurogenic limb the AEC forms independently of the nerve, but that AEC structure and function cannot be maintained unless the AEC becomes innervated by regenerating axons, an implication that fits the timing of AEC formation and regeneration of axons into the AEC 2–3 days post-amputation.
Figure 8.8. Diagram to illustrate failure of blastema formation and lack of regeneration when the forelimb limb is either denervated (star) or deprived of epidermis (E), BN=brachial nerves.
Figure 8.9. Maintenance of the AEC is dependent on an interaction with nerve. (A) A wound was made in the limb skin of an axolotl (outlined by arrows). A thickening of the epidermis resembling the AEC was initially formed that subsequently regressed. E=epidermis; D=dermis. (B) Same experiment as in (A), except that a nerve was deviated under the epidermis. The epidermal thickening was maintained and a blastema-like growth (Bl) was formed.
After Endo et al., 2004.
Dependence on the nerve for regeneration arises during limb development. Urodele limb buds regenerate in the absence of axons until digital stages when the limb bud becomes heavily innervated whereupon regeneration becomes nerve-dependent (Brockes, 1987). Nerve dependence is not acquired, however, if the limb never becomes innervated (Yntema, 1959a,b). This was shown by parabiosing two early embryos and excising the neural tube from one of them so that the fully differentiated limbs were aneurogenic. These limbs require only the wound epidermis/AEC to regenerate normally. Aneurogenic limbs can be oscillated between nerve-independent and dependent states. When grafted in place of normal host limbs they become innervated and nerve-dependent for regeneration by 10–13 days post-transplantation, but nearly half of the cases become nerve-independent again if maintained in a denervated state for 30 days (Thornton and Thornton, 1970).
The acquisition of nerve dependency by both limb buds and aneurogenic limbs transplanted to neurogenic hosts can be interpreted in a variety of ways (Brockes, 1987), but a simple idea is that the outgrowth-promoting function of the limb bud apical epidermis (Tschumi, 1957) is either autonomous or depends on signals from the subjacent mesoderm as observed for chick limb buds (Sun et al., 2002). When a neurogenic limb differentiates, a neural-epidermal relationship is created in which the epidermis becomes dependent on neural factors to acquire and maintain its original outgrowth-promoting function. This dependency never occurs in aneurogenic limbs and the AEC maintains its original function after limb amputation (Fig. 8.10).
Figure 8.10. Diagram showing that the dependence of the wound epidermis on nerve for limb regeneration arises due to innervation during development. (A) During development of the forelimb, it becomes progressively more innervated by the brachial nerves (BN) and their branches. Regeneration fails when the limb is amputated following denervation (X). (B) A limb rendered aneurogenic by parabiosing two early embryos and removing the neural tube from one member of the pair. Such a limb develops without innervation. The wound epidermis never acquires a dependence on the nerve for its function and the limb regenerates perfectly when amputated.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123848604000083
Volume 1
A.E. Ting, S.A. Busch, in Encyclopedia of Biomedical Engineering, 2019
Spinal Cord Injury
Spinal cord injury (SCI) results in disruption of the blood–brain barrier and initiates a cascade of inflammatory processes leading to infiltration of immune cells and secondary cell death that extends beyond the site of initial injury (Silver and Miller, 2004). This reactive process of secondary injury takes place in the days and weeks following SCI, and can result in exacerbation of neurological dysfunction. An additional cause of spinal cord regeneration failure is the formation of the glial scar, which involves activation of astrocytes in an attempt to restore the blood–brain barrier. These astrocytes produce inhibitory chondroitin sulfate proteoglycan, a major barrier to regenerating axons. Other potential inhibitors in the glial scar are myelin-associated proteins, which also inhibit neurite outgrowth and hinder repair.
BMSC therapy has been proposed to treat both acute and chronic SCI through multiple potential mechanisms of action (Wright et al., 2011). The immunosuppressive properties of BMSCs may reduce the acute inflammatory response to SCI, reducing secondary injury and cavitation. Direct transplantation of BMSCs after injury has been shown to increase preservation of spinal cord tissue and decrease neuropathic pain. Direct transplantation of BMSCs into the cord may modify activation of astrocytes or encourage axonal regeneration through downregulation of inhibitory components in the glial scar. BMSCs produce a number of growth factors, including nerve growth factor (NGF) and vascular endothelial growth factor (VEGF), which could promote axonal outgrowth even in an inhibitory environment. Additionally, some reports suggest that BMSCs could act as bridges, guiding regenerating axons across the injury cavity. BMSCs produce molecules including laminin, fibronectin, and collagen, which could decrease cavitation and provide a permissive environment for growing axons (Ankeny et al., 2004).
As in most injury situations, some degree of inflammation is a necessary and beneficial component of the recovery process after SCI (David and Kroner, 2011). Macrophages are known to phagocytose the myelin debris, clearing the way for functional regeneration, and to produce some protective cytokines and growth factors, which could enhance regeneration. Two subtypes of macrophages have been described with regards to their phenotype and activity: classically activated macrophages (M1) and alternatively activated (M2). M1 macrophages are typically considered to be the product of activation with proinflammatory cytokines IFNγ and TNFα. Alternatively, activated macrophages are the product of activation with the cytokines interleukin-4 (IL-4) and IL-13, and possess enhanced phagocytic capabilities and antiinflammatory activities, which are thought to contribute to their beneficial effects after SCI. BMSCs and related cell types have been shown to drive macrophages toward the alternatively activated M2 phenotype and concurrently promote white matter sparing and reduce the effects of the inhibitory glial scar (Busch et al., 2011b; Nakajima et al., 2012).
To date, the majority of cell therapy-focused clinical trials for SCI have utilized whole mononuclear cell preparations (MCPs) from bone marrow, not cultured adherent BMSCs (Wright et al., 2011). MCPs are generally administered alongside granulocyte-macrophage colony stimulating factor to mobilize the migration of these cells into the lesioned spinal cord and induce activation resulting in the secretion of neurotrophic cytokines at the site of injury. Modest increases in neurological function have been reported, but as relatively few patients have been treated thus far, it is difficult to determine if these results are due to an intrinsic recovery process or directly attributable to the treatment itself.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383000556
Сегодня известно, что на процесс регенерации аксонов , в частности, ее стабилизацию, влияет UNC-70 бета спектрин. Обнаружены гены необходимы для активации и ингибиции регенерации, но , в конечном итоге, идентифицированы толь клоны RNAi , ингибирующие регенерацию у unc-70 мутантов. Блокада в unc-70 фоне показала улучшение процесса регенерации после аксотомии у мутантов одного поколения. Отмечено, что для регенерации аксонов необходим кратковременный поток кальция.
Травма аксонов ЦНС обычно не сопровождается заметной регенераций , в то время, как после аксотомии периферических аксонов , напротив, мы можем наблюдать функциональное восстановление. Представление о молекулярных механизмов этого процесса остается непонятным. Травма периферических нервов индуцирует изменения в молекулярных программах травмированных нейронов , включая регуляцию и влияние «ранних генов», например, таких , как GAP-43.
Центральным звеном в гене, регулирующим работу нейронных сетей являются транскрипционные факторы (TFs). C-JUN был первым TF, который был идентифицирован в сети большой когорты генов , ассоциированных с процессами регенерации ( large cohort of regeneration-associated genes — RAG ) (Herdegen et.al., 1991; Jenkins and Hunt., 1991). Данный ген играет важную роль в качественной регенерации мотонейронов лицевого нерва (Raivich et al., 2004). Позже, были идентифицированы дополнительные TFs, связанные с регенерацией, включая: ATF3, SOX11, CREB, p53, STAT3, KLF4 и SMAD1 (Schwaiger et.al., 2000; Tsujino et al., 2000; Gao et al., 2004; Di Giovanni et al., 2006; Jankowski et al., 2006; Seijffers et al., 2006; Moore et al., 2009; Zou et al., 2009 ). Некоторые из этих TFs теперь признаны важными регуляторами определенных субсетов RAGs. Например, C-JUN индуцирует экспрессию Itga7 (с Itgb1 рецептор для ламинина), молекула клеточной адгезии Cd44 и нейропептида GAL (Raivich et al., 2004), а также ATF3 индуцирует экспрессию к-Jun, белок теплового шока Hsp27 и Sprr1a (маркер, специфичный для регенеративного роста аксона; Seijffers и др., 2007). Ключевым вопросом теперь является то, какой из этих TFs является фактическим регулятором сети нейронов , чтобы “повторно программировать” поврежденные нейроны так, чтобы они приобрели сеть RAG, которая ускоряет темп регенерации травмированных центральных нейронов?
Категория сообщения в блог:
Р.Ф. МАСГУТОВ, А.А. РИЗВАНОВ, А.А. БОГОВ (мл.), А.Р. ГАЛЛЯМОВ, А.П. КИЯСОВ, А.А. БОГОВ
Республиканская клиническая больница МЗ РТ, г. Казань
Казанский (Приволжский) федеральный университет
Масгутов Руслан Фаридович
старший научный сотрудник Травматологического центра
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. 8-950-314-02-93, е-mail: [email protected]
В обзоре освещены современные методы терапии травмы периферических нервов в сочетании с классическими хирургическими способами лечения данной патологии. Представлены потенциальные стимуляторы посттравматической регенерации периферических нервов, ключевыми из которых являются сосудистый эндотелиальный фактор роста и основной фактор роста фибробластов, играющих роль узловых молекул в патофизиологии нейрорегенерации.
Ключевые слова: травма периферического нерва, нейротрофические факторы.
R.F. MASGUTOV, A.A. RIZVANOV, A.A. BOGOV (JR.), A.R. GALLYAMOV, A.P. KIYASOV, A.A. BOGOV
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Kazan (Volga region) Federal University
Current trends for treatment of peripheral nerves injuries
The review describes current treatment methods of peripheral nerve injuries in combination with classical surgical treatments of this pathology. Are presented potential stimulators of posttraumatic regeneration of peripheral nerves, where the key stimulators are vascular endothelial growth factor and basic fibroblast growth factor, which are basic molecules in the pathophysiology of neuroregeneration.
Key words: peripheral nerve injury, neurotrophic factors
Повреждения периферических нервов остаются одной из актуальных проблем современной травматологии и составляют 3-10% от всех травм опорно-двигательного аппарата [1]. Между тем травмы и заболевания периферической нервной системы приводят к стойкой утрате трудоспособности у 60-63% пациентов, более того, почти 80% этой группы составляют лица молодого трудоспособного возраста [2]. Повреждения периферических нервов оказывают существенное влияние на качество жизни в связи с потерей функции и повышения риска развития вторичной инвалидности от падений, переломов и других травм.
В представленном обзоре литературе дан анализ исследований последних лет, которые открывают новую страницу в понимании патофизиологии посттравматической регенерации периферического нерва и направляют как специалистов фундаментальных направлений, так и практикующих врачей на изучение и возможности клинического применения ростовых факторов, которые непосредственно принимают участие в восстановлении периферического нерва после его травмы.
Патогенез травмы периферического нерва
При повреждении нерва основным звеном патогенеза является деструкция нейронов.
Нейроны, формирующиеся в процессе развития, соединены в сложные коммуникационные сети для передачи информации от периферических рецепторов сенсорных нейронов в ЦНС (головного и спинного мозга), а также для передачи команд из центральной нервной системы на эффекторные органы, такие как скелетные мышцы, иннервируемые мотонейронами.
Периферический нерв состоит из аксона нейрона, Шванновских клеток, фибробластов, а также элементов кровоснабжения нерва. Соединительная ткань известная как эндоневрий окружает периферические аксоны. В периферических нервах аксоны сгруппированы в фасцикулы, окруженные соединительной тканью. Ключевой клеткой для периферических нервов является Шванновская клетка. Шванновские клетки образуют осевые цилиндры, их мембрана богата липидами, которые покрывают аксон и называется миелиновой оболочкой. Шванновские клетки с миелиновой оболочкой аксонов поддерживают и направляют аксоны во время регенерации нерва после его травмы. Тело нервной клетки является местом синтеза практически всех белков и органелл в клетке. Сложный процесс, известный как антероградный транспорт, непрерывно транспортирует вещества из тела клетки нейрона через аксон к его периферическому концу — в синапс. Эти транспортируемые вещества включают нейротрансмиттеры, которые обеспечивают связь между нейроном и тканями органа по узкой синаптической щели или, как в случае иннервации двигательных нейронов мышц, нервно-мышечном синапсе. С другой стороны, клетки-мишени, например, миоциты, экспрессируют вещества, которые действуют как нейротрофические факторы. Некоторые из этих веществ упаковываются и передаются путем ретроградного транспорта от синапса через аксон к телу нейрона. Таким образом, нейрон и его клетка-мишень постоянно информированы о статусе связи между ними. Было высказано предположение, что информация от клеток-мишеней принимает форму факторов, которые поддерживают существующие соединения нейронов и способствуют регенерации поврежденных нервных клеток. Несмотря на регенерацию, обширные травмы периферического нерва могут привести к параличам всей конечности или дистальных отделов конечностей. Прогноз восстановления при травмах периферических нервов лучше там, где повреждение Шванновских клеток минимально [3].
Нейротрофические факторы в механизме регенерации периферического нерва
За полвека исследований выявлено, что нейротрофические факторы способствуют выживанию и процессу роста нейронов. Восстановление нейрона критически зависит от количества нейротрофического фактора. После травмы нервов, периферическая нервная система млекопитающих реагирует путем экспрессии нейротрофических факторов, которые доступны из аутокринных или паракринных источников. Известны три основные группы нейротрофических факторов: 1) нейротрофины; 2) нейротрофические факторы семейства GDNF (англ. Glial cell line-derived neurotrophic factor) и 3) нейротрофические цитокины [4].
Повреждение периферического нерва вызывает ретроградную дегенерацию спинальных ганглиев, что сказывается преимущественно на кожных нейронах малого диаметра. Результаты исследований показывают, что кожные нейроны более чувствительны к повреждениям периферического нерва, чем мышечные, но их регенеративные способности не отличаются друг от друга [5].
Выживаемость нейронов после аксотомии является необходимым условием для регенерации, которой способствуют множество трофических факторов из нескольких источников, в том числе нейротрофины, нейропоэтические цитокины, инсулиноподобный фактор роста (англ. Insulin Growth Factor, IGF), факторы из глиальных клеток — семейства GDNF и др.
Так, после перерезки нерва увеличивается количество нейронов, экспрессирующих м-РНК мозгового нейротрофического фактора (англ. Brain Derived Neurotrophic Factor [6]. Выработка м-РНК BDNF в ответ на травму нерва показана не только в нейронах, но и в клетках-сателлитах [7].
После лигирования спинномозговых нервов уровень м-РНК фактора роста нервов (англ. Nerve Growth Factor, NGF) в спинальных ганглиях возрастает в 4 раза и поддерживается в течение 3 недель [8]. При этом подъем уровня м-РНК BDNF длится не более трех суток и менее выражен по сравнению с NGF.
Трансформирующий фактор роста β (TGFβ) служит митогеном для шванновских клеток и нейротрофическим фактором для некоторых дифференцирующихся нейронов. В интактных спинальных ганглиях TGFβ и его рецептор экспрессируются преимущественно в малых нейронах и в клетках-сателлитах, окружающих средние и большие нейроны [7]. После повреждения седалищного нерва крысы в эксперименте в клетках-сателлитах увеличивается экспрессия TGFβ, что сопровождается возрастанием уровня экспрессии его рецепторов практически во всех субпопуляциях нейронов [7].
In vitro GDNF стимулирует рост аксонов чувствительных нейронов, преимущественно малых, не экспрессирующих рецепторы нейротрофинов и выявляемых при помощи изолектин-B4 [9]. Эти авторы установили, что в той же культуре GDNF поддерживает выживание чувствительных нейронов, но не выявили их принадлежности к конкретным субпопуляциям (табл. 1).
Таблица 1.
Влияние нейротрофических факторов на выживание чувствительных нейронов в постнатальном периоде
|
Нейротрофический фактор |
Наличие (+) или отсутствие (–) эффекта |
Авторы |
|
NGF |
+ – |
Horie, Akahori, 1994;Lindsay, 1996 |
|
BDNF |
– + |
Lindsay, 1996;Acheson et al., 1995 |
|
NT-3 |
+ |
Acheson et al., 1995 |
|
GDNF |
+ |
Leclere et al., 1997 |
Установлено, что часть нейронов, экспрессирующих trkA и реагирующих, таким образом, на NGF, в конце эмбрионального и в постнатальном периоде перепрограммируется на действие другого нейротрофического фактора, а именно GDNF. В нейронах этой субпопуляции начинают экспрессироваться оба компонента рецептора GDNF — GFRa и тирозинкиназа c-ret [10]. Происходит ли подобное перепрограммирование при регенерации чувствительных нейронов, остается неясным.
Регенераторный рост центральных отростков нейронов различного фенотипа поддерживают конкретные нейротрофические факторы. Так, рост аксонов, экспрессирующих NF200 и принадлежащих субпопуляции больших проприоцептивных нейронов, стимулирует только один представитель семейства нейротрофинов — нейротрофин-3 (NT-3) [11] (табл. 2). Из тех же нейротрофинов только NGF поддерживает рост аксонов пептидергических ноцицептивных нейронов. И только один нейротрофический фактор является универсальным стимулятором роста аксонов больших, малых пептидергических и малых непептидергических нейронов. Этим фактором является GDNF [11].
Таблица 2.
Экспрессия нейротрофинов и их рецепторов нейронами спинальных ганглиев (по результатам экспериментов на нокаутных мышах [12]
|
Нейротрофин/ Рецептор |
Численность популяции нейронов в % |
Модальность |
|
NGF |
80 |
Ноцицепторы, терморецепторы, низкопороговые механорецепторы |
|
trkA |
80 |
Ноцицепторы, терморецепторы, низкопороговые механорецепторы |
|
trkB |
30 |
Механорецепторы (Майсснера) |
|
NT-3 |
60 |
Проприорецепторы, рецепторы волос и механорецепторы |
|
trkC |
20-30 |
Проприорецепторы |
После перерезки седалищного нерва усиливается экспрессия рецептора GDNF, но количество нейронов, реагирующих на этот нейротрофический фактор, не изменяется [13]. При этом объем популяции нейронов, содержащих trkA и отвечающих на действие NGF, после перерезки нерва уменьшается. Эти данные указывают на различный характер регуляции активности генов рецепторов нейротрофических факторов в субпопуляциях нейронов спинальных ганглиев в ответ на аксотомию.
Для судьбы отдельных нейронов важно присутствие нейротрофических факторов, которые способны активировать антиапоптозные внутриклеточные пути [14]. В списке факторов, влияющих на регенерацию нервных волокон, важное место занимают цитокины. Имеются данные о нейропротекторном действии интерлейкина-1b в отношении нейронов коры, которое может реализоваться через влияние этого цитокина на выработку нейротрофических факторов, например, NGF [15]. С другой стороны, in vitro показано, что интерлейкин-1b не влияет на выживание нейронов спинальных ганглиев, но ускоряет рост их отростков [16] и вместе с оксидом азота поддерживает в пептидергических нейронах экспрессию циклооксигеназы-2, что усиливает секрецию вещества «Р» [17]. Высказано предположение, что данный цитокин стимулирует секрецию нейротрофических факторов ненервными (Шванновскими) клетками [16], расположенными в потенциальном пространстве роста аксонов.
Представление об активации интерлейкином-1b регенерации нервных проводников основано на данных о стимулирующем влиянии продуцируемого макрофагами интерлейкина-1 на образование NGF шванновскими клетками in vitro и in vivo. Шванновские клетки in vitro и в регенерирующем нерве сами синтезируют интерлейкины и экспрессируют их рецепторы, что свидетельствует о возможной аутокринной регуляции. Нейроны также способны синтезировать цитокины. У интактных крыс до 80% нейронов спинального ганглия экспрессируют интерлейкин-1b [18]. Это преимущественно большие и средние нейроны. Данный цитокин экспрессируется в незначительной части малых пептидергических нейронов. Присутствие рецепторов интерлейкина-1 выявлено в большинстве нейронов спинального ганглия, а также в окружающих нейроны клетках-сателлитах [18], что свидетельствует об участии интерлейкина-1b в ауто/паракринной регуляции функции чувствительных нейронов.
Травмированные нейроны должны перейти от режима передачи к режиму роста и начать продуцировать белки, такие как, например, GAP-43 (англ. Growth Associated Protein), тубулин и актин, а также другие нейропептиды и цитокины, которые имеют потенциал для стимуляции аксональной регенерации. Аксоны должны достигать дистального отрезка нерва при условии, когда поддержка их роста осуществляется в достаточной степени. Шванновские клетки в дистальном отрезке нерва проходят через фенотипические изменения, которые должны быть благоприятны для аксональной регенерации. Шванновские клетки играют незаменимую роль в содействии регенерации за счет увеличения ими синтеза поверхностных молекул клеточной адгезии, таких как N-CAM (англ. Neural Cell Adhesion Molecule), Ng-CAM/L1 (англ. Neuron Glia Cell Adhesion Molecule), N-кадгерин и L2/HNK-1, путем изменения базальной мембраны, которая содержит многие белки внеклеточного матрикса, таких как ламинин, фибронектин и тенасцин. Аксональной регенерации могут способствовать факторы, которые повышают потенциал роста аксонов нейронов и оптимизируют регенерацию дистального конца нерва в сочетании с его оперативным лечением [19].
Основные методы лечения повреждения нервов являются: нейрорафия, нейрорафия с последующей дистракцией нерва, аутонервная пластика, эндопротезирование биодеградирующими материалами (например: neuragen® nerve guide).
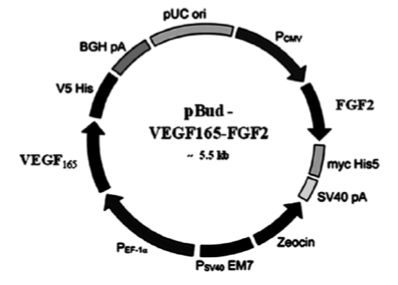
Перспективными потенциальными стимуляторами регенерации периферических нервов являются сосудистый эндотелиальный фактор роста (англ. Vascular Endothelial Growth Factor, VEGF), основной фактор роста фибробластов (англ. basic Fibroblast Growth Factor, bFGF или FGF2) и NGF.
Эффект NGF иллюстрирует исследование по трансплантации в поврежденный седалищный нерв крысы микрокапсул, содержащих NGF в чистом виде. В группе с NGF количество восстановленных аксонов было большим, расположение нервных волокон было более упорядоченным, проводимость нерва восстанавливалась в разы быстрее, чем в контрольной группе. Также в сравнении с контрольной группой животных было отмечено, что в послеоперационном периоде раны заживали значительно быстрее [20].
Основной фактор роста фибробластов считается мощным средством для улучшения восстановления после повреждения нейронов, однако экзогенно применяемый bFGF неэффективен из-за кратковременного эффекта. Для усиления эффекта в естественных условиях разработана новая система доставки потенциальных стимуляторов путем внедрения bFGF в желатин гидрогель, который медленно биодеградирует. В этом исследовании эффекты bFGF-гидрогеля при травматическом повреждении лицевого нерва были исследованы на морских свинках. Лицевой нерв был обнажен и зажат в вертикальной части с использованием микрощипцов. Животные были подвергнуты одной из следующих трех процедур: группа А — контроль, без введения bFGF; группа В, одноразовое введение bFGF в нерв; группа С, применение bFGF-гидрогеля. Шесть недель спустя функции лицевого нерва были оценены тремя тестами: наблюдения за мимикой, электрофизиологические тестирования и гистологические исследования. Результаты показали, что одноразовое применение bFGF не влияло посттравматическое восстановление нерва. В группе с применением гидрогеля достигнуты лучшие результаты во всех тестах [21].
Местное применение VEGF индуцирует, по крайней мере, два события: пролиферацию Шванновских клеток и образование новых сосудов, которые играют важную роль в процессе регенерации нервов. Однако результаты показывают, что эффект от предварительной обработки факторами роста является локальным и ограниченным и не влияет на синтез нейропептидов [22].
Преодоление диастаза периферического с помощью биодеградирующией трубки из политетрафторэтилена (ПТФЭ) является относительно новым, но хорошо зарекомендовавшим хирургическим подходом для восстановления дефектов нервных стволов до 4 см между его концами на разных уровнях верхней конечности [23].
Восстановление периферического нерва с помощью трубки из ПТФЭ и введением факторов роста фибробластов также подтверждается в другом исследовании. В данном исследовании bFGF был помещен в эндопротез для седалищного нерва крысы. Кроме того, в послеоперационном периоде, животные системно получали 1 мг/кг/сут FK506 (такролимус) — мощный иммунодепрессант с нейротрофическими свойствами. Регенерация нерва оценивалась с помощью стандартных двигательных (индекс седалищного нерва) тестов и тестов на чувствительность, начиная со 2-й недели после операции. Животные, которые получали bFGF и FK506, показали значительно более быстрое восстановление после травмы, чем у контрольной группы [24].
После повреждения периферического нерва Шванновские клетки начинают экспрессировать bFGF, что нехарактерно для интактного нерва. Данный фактор рассматривается в качестве узловой молекулы в патофизиологии травмы периферических нервов [25].
В исследовании по восстановлению лицевого нерва после его перерезки и дальнейшего сшивания на крысах было показано, что у животных с введением bFGF восстановление нерва произошло раньше, а количество миелинизированных волокон было большим, чем у животных без введения bFGF [26].
Кроме того, на модели преодоления диастаза седалищного нерва крысы при помощи аутонервной вставки показано, что введение мультицистронной плазмиды pBUD-VEGF-FGF2 (Рис 1), экспрессирующей клонированные гены VEGF и bFGF человека, в центральный и периферический отрезки нерва, а также непосредственно в аутонервную вставку стимулирует реваскуляризацию и регенерацию периферического нерва. В эксперименте с аутонервной вставкой введение pBUD-VEGF-FGF2 в область повреждения нерва приводит к двукратному увеличению количества S100-иммунопозитивных (Шванновских) клеток в прилежащих к диастазу участке периферического отрезка нерва [27, 28].
Рисунок 1.
Плазмида, содержащая сосудистый эндотелиальный фактор роста (VEGF) и основной фактор роста фибробластов (FGF2).
Масгутов Р.Ф. и др., Клеточная трансплантология и тканевая инженерия, 2011
Заключение
Таким образом, сочетание классических хирургических способов восстановления нервных стволов и методов прямой терапии ростовыми факторами ускоряет аксональный рост, стимулирует реваскуляризацию нерва, что подтверждается многочисленными экспериментальными исследованиями и, в итоге, улучшает результаты посттравматического восстановления функции реиннервации поврежденного органа или ткани.
Благодарность
Выполнение данного научного исследования финансируется за счет темы государственного автономного учреждения здравоохранения «Республиканская клиническая больница Министерства здравоохранения Республики Татарстан» «Усовершенствование и разработка новых методов лечения у больных с повреждением плечевого сплетения и периферических нервов».
ЛИТЕРАТУРА
1. Берснев В.П. Хирургия позвоночника, спинного мозга и периферических нервов / Е.А. Давыдов, Е.Н. Кондаков // Специальная литература. — СПб, 1998. — С. 368.
2. Кубицкий А.А. Хирургическое лечение повреждений периферических нервов верхней конечности методами тракционного удлинения и аутонервной пластики: автореф. дис. … канд. мед. наук / А.А. Кубицкий. — Казань, 2002. — 24 с.
3. Massing M.W., Robinson G.A., Marx C.E., Alzate O., Madison R.D. Frontiers in Neuroscience. Alzate O., editor // Source Neuroproteomics. — Boca Raton (FL): CRC Press; 2010. — Chapter 15.
4. Boyd J.G., Gordon T. Neurotrophic factors and their receptors in axonal regeneration and functional recovery after peripheral nerve injury // Mol Neurobiol. — 2003 Jun. — Vol. 27, № 3. — Р. 277-324.
5. Welin D., Novikova L.N., Wiberg M., Kellerth J.O., Novikov L.N. Survival and regeneration of cutaneous and muscular afferent neurons after peripheral nerve injury in adult rats // Exp Brain Res. — 2008 Mar. — Vol. 186, № 2. — Р. 315-23.
6. Zhou X.F. et al. Injured primary sensory neurons switch phenotype for brain-derived neurotrophic factor in the rat // Neuroscience. — 1999. — Vol. 92, № 3. — P. 841 853.
7. Zhou X.F. et al. Satellite-cell-derived nerve growth factor and neurotrophin-3 are involved in noradrenergic sprouting in the dorsal root ganglia following peripheral nerve injury in the rat // Eur. J. Neurosci. — 1999. — Vol. 11, № 5. — P. 1711 1722.
8. Shen H., Chung J., Chung K. Expression of neurotrophin mRNAs in the dorsal root ganglion after spinal nerve injury // Brain Res. Mol. — 1999. — Vol. 64. — P. 186 192.
9. Leclere P. et al. Effects of glial cell line-derived neurotrophic factor on axonal growth and apoptosis in adult mammalian sensory neurons in vitro. Neuroscience. — 1997. — Vol. 5. — P. 545 558.
10. Molliver D.C. et al. IB4 binding DRG neurons switch from NGF to GDNF dependence in early postnatal life // Neuron. — 1997. — Vol. 19, № 4. — P. 4849 4861.
11. Ramer M., Priestley J., McMahon S. Functional regeneration of sensory axons into adult spinal cord // Nature. — 2000. — Vol. 403. — P. 312 316.
12. Farinas I., Cano-Jaimeza M., Bellmunta E., Soriano M. Regulation of neurogenesis by neurotrophins in developing spinal sensory ganglia // Brain Research Bulletin. — 2002. — Vol. 57, № 6. — P. 809 816.
13. Kashiba H., Hyon B., Senba E. Glial cell line-derived neurotrophic factor and nerve growth factor receptor mRNAs are expressed in distinct subgroups of dorsal root ganglion neurons and are differentially regulated by peripheral axotomy in the rat // Neuroscience Letters. — 1998. — Vol. 4. — P. 107 110.
14. Mattson M.P., Lindvall O. Neurotrophic factor and cytokine signaling in the aging brain // Greenwich. JAI Press. — 1997. — P. 299 345.
15. Strijbos P., Rothwell N. Interleukin-1 beta attenuates excitatory amino acid-induced neurodegeneration in vitro: Involvement of nerve growth factor // J. Neurosci. — 1995. — Vol. 15, № 5. — P. 3468 3474.
16. Horie H., Sakai I., Akahori Y., Kadoya T. IL-1 beta enhances neurite regeneration from transected-nerve terminals of adult rat DRG // Neuroreport. — 1997. — Vol. 8, № 8. — P. 1955-1959.
17. Morioka N. et al. Nitric oxide synergistically potentiates interleukin-1 beta-induced increase of cyclooxygenase-2 mRNA levels, resulting in the facilitation of substance P release from primary afferent neurons: involvement of cGMP-independent mechanisms // Neuropharmacology. — 2002. — Vol. 43, № 5 10. — P. 868 876.
18. Copray J.C. et al. Expression of interleukin-1 beta in rat dorsal root ganglia // Neuroimmunology. — 2001. — Vol. 118, № 8. — P. 203 211.
19. Fu S.Y., Gordon T. The cellular and molecular basis of peripheral nerve regeneration // Mol Neurobiol. — 1997. — Vol. 1-2. 67-116.
20. Song M., Chen S.Z., Han H., Xiong Y. An experimental study on repair of peripheral nerve injury by transplantation of microcapsulated NGF-expressing NIH 3T3 cells // Zhonghua Zheng Xing Wai Ke Za Zhi. — 2005. — Vol. 1. — Р. 53-7.
21. Komobuchi H., Hato N., Teraoka M., Wakisaka H., Takahashi H., Gyo K., Tabata Y., Yamamoto M. Basic fibroblast growth factor combined with biodegradable hydrogel promotes healing of facial nerve after compression injury: an experimental study // Acta Otolaryngol. — 2010. — Vol. 130, № 1. — Р. 173-8.
22. Sondell M., Lundborg G., Kanje M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularization of acellular nerve grafts // Brain Res. — 1999 Nov 6. — Vol. 846, № 2. — Р. 219-28.
23. Stanec S., Stanec Z. Reconstruction of upper-extremity peripheral-nerve injuries with ePTFE conduits // J Reconstr Microsurg. — 1998 May. — Vol. 14, № 4):227-32.
24. Lanzetta M., Gal A., Wright B., Owen E. Effect of FK506 and basic fibroblast growth factor on nerve regeneration using a polytetrafluoroethylene chamber for nerve repair // Int Surg. 2003. — Vol. 88, № 1. — Р. 47-51.
25. Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. — 2010 Apr. — Vol. 31, № 3. — Р. 498-505.
26. Toledo R.N., Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. 2010. — Vol. 31, № 3. — Р. 498-505.
27. Масгутов Р.Ф., Салафутдинов И.И., Богов А.А. (мл.), Трофимова А.А., Ханнанова И.Г., Муллин Р.И., Исламов Р.Р., Челышев Ю.А., Богов А.А., Ризванов А.А. Стимуляция посттравматической регенерации седалищного нерва крысы с помощью плазмиды, экспрессирующей сосудистый эндотелиальный фактор роста фибробластов. Клеточная трансплантология и тканевая регенерация. — 2011. — Т. VI, № 3.
28. Челышев Ю.А., Мухамедшина Я.О., Шаймарданова Г.Ф., Николаев С.И. Прямая доставка терапевтических генов для стимулирования посттравматической нейрорегенерации // Неврологический вестник. — 2012. — T. XLIV, вып. 1. — С. 76-83.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Тутуров А.О.
1
1 СамГМУ
Исследование современных технологий в восстановлении протяжённых дефектов нервов является важной фундаментальной задачей нейрохирургии и травматологии. Данные повреждения дифференцируются по сумме вовлеченных в патологический процесс окружающих тканей и компонентов нерва. Наиболее сложного, объёмного и, часто, безрезультатного лечения требуют именно травмы, приводящие к формированию больших диастазов, нервов. Причиной этому служит сочетание сразу нескольких ключевых деталей: полное пересечение нервного ствола, потеря направляющего канала для регенерации, и, в дальнейшем, создание условий для образования посттравматической невромы. Тотальный разрыв всей полости, иначе говоря, невротмезис, приводит к утрате сообщения между нервными волокнами проксимального и дистального участка нерва, нарушает целостность миелиновой оболочки и соединительнотканных элементов. Вследствие разобщения волокон , потери направляющего канала – эпиневрия и утраты его внутренней среды регенерация не наступает. Все эти процессы приводят к образованию соединительнотканных колбовидных утолщений – невром, что указывает на терминальную стадию повреждения нерва – прекращения его функционирования в дистальном отделе. Исходя из анатомического обоснования сформированного диастаза ушивание дефекта эпиневральными швами не возможно, так как это неминуемо приведет к его перенатяжению или расслоению. Начиная с 1910-ых годов, многие нейрохирурги поставили перед собой задачу лечения данных травм. Развитие технологий направило исследования на создание кондуитов — искусственных проводников, помещаемых в диастаз нерва и создающих необходимые условия для регенерации нервных волокон в заданном направлении, за счет искусственной внутренней среды. С тех пор восстановление протяженных дефектов нервов стало возможным и получило широкое применение и развитие по всему миру. В обзоре проанализированы различные варианты кондуитов с их уникальной внутренней средой, а также смежные с ними разработки, показывающие использование регенераторного потенциала нервной ткани, для выявления наиболее верного направления в развитии технологий восстановления протяжённых дефектов нервов.
невротмезис
повреждение нерва
протяженные дефекты
кондуиты
регенераторный потенциал.
1. Берснев В.П. Хирургия позвоночника, спинного мозга и периферических нервов / Е.А. Давыдов, Е.Н. Кондаков // Специальная литература. — СПб, 1998. — С. 368.
2. Кубицкий А.А. Хирургическое лечение повреждений периферических нервов верхней конечности методами тракционного удлинения и аутонервной пластики: автореф. дис. … канд. мед. наук / А.А. Кубицкий.— Казань, 2002. — 24 с.
3. Козлов А. В., Афанасьев Л. М., Якушин О. А., Молочков Е. В. Хирургическая тактика лечения больных с повреждениями нервов // III съезд нейрохирургов России : материалы съезда. – СПб., 2002. – С. 526–527.
4. Бабаханов, Ф.Х. Микрохирургические реконструктивно-восстановительные операции при массивных повреждениях периферических нервов / Ф.Х.Бабаханов, А.К.Муминов, Д.Б.Якубов, Б.А.Абдушукуров // Материалы III съезда нейрохирургов России. М., 2002. — С. 52.
5. Патент РФ № 2153295. Способ аутонейропластики.
6. Патент РФ № 2179828. Способ выделения и отсечения икроножного нерва с образующими его ветвями и инструмент для его осуществления
7. Патент РФ №2154431. Способ лечения обширных повреждений лучевого нерва на плече.
8. Патент РФ №99107088/14. Способ восстановления чувствительности на стопе.
9. Борода Ю.И. Хирургия дефектов нервных стволов конечностей / Ю.И. Борода, В.П. Берснев // Мат. III съезда нейрохирургов России СПб, 2002. — С. 524525.
10.BY №10011. Способ восстановления нервного ствола.
11.Патент РФ №2471435. Способ восстановления поврежденного нерва при дефектах на большом протяжении.
12. Патент РФ №2176482. Способ пластики дефекта нервного ствола.
13. Senoglu M., Nacitarhan V., Kurutas E.B. Intraperitoneal Alpha-Lipoic Acid to prevent neural damage after crush injury to the rat sciatic nerve / M. Senoglu [etc.] // J Brachial Plex Peripher Nerve Inj. — 2009. — P. 22.
14. Патент РФ №2347539. Способ лечения повреждения периферического нерва.
15. SU №1204197. Способ восстановления нервного ствола.
16. Foramitti C. Zur technik der nervennaht / C. Foramitti [etc.] // Arch Klin Chir. — 1904. — P. 643–648.
17. Tang J.B., Gu Y.Q., Song Y.S. Repair of digital nerve defect with autogenous vein graft during flexor tendon surgery in zone 2 / J. B. Tang [etc.] // J Hand Surg Br. — 1993. — P. 449-453.
18. Chiu D.T., Strauch B. A prospective clinical evaluation of autogenous vein grafts used as a nerve conduit for distal sensory nerve defects of 3 cm or less / D.T. Chiu [etc.] // Plast Reconstr Surg. — 1990. — P. 928-934.
19. Walton R.L., Brown R.E., Matory W.E. Autogenous vein graft repair of digital nerve defects in the finger: a retrospective clinical study / R.L. Walton[etc.] // Plast Reconstr Surg. – 1989. – P. 944-949.
20.Pateman C. J., Harding A. J., Glen A. Nerve guides manufactured from photocurable polymers to aid peripheral nerve repair / C. J. Pateman [etc.] // Biomaterials. – 2015. — Vol. 49. – Р. 77-89.
21.Yamanaka T., Hosoi H., Murai T. Regeneration of the Nerves in the Aerial Cavity with an Artificial Nerve Conduit -Reconstruction of Chorda Tympani Nerve Gaps / T. Yamanaka [etc.] // PLOS ONE. – 2014. – Vol. 9, №4. — P. 1-7.
22. Rotshenker S. Wallerian degeneration: the innate-immune response to traumatic nerve injury / S. Rotshenker [etc.] // J Neuroinflammation. — 2011. — P. 109.
23. Wilson A.D., Hart A., Brännström T. Delayed acetyl-L-carnitine administration and its effect on sensory neuronal rescue after peripheral nerve injury / A.D. Wilson [etc.] // J Plast Reconstr Aesthet Surg. — 2007. – P. 114-118.
24. Dokkaew J. Vitamin E reduces sensory neuronal loss and improves nerve regeneration after sciatic nerve injury / J. Dokkaew [etc.] // Asian Biomed. — 2013. — P. 649-655.
25. Azizi S., Heshmatian B., Amini K. Alpha-lipoic acid loaded in chitosan conduit enhances sciatic nerve regeneration in rat / S. Azizi [etc.] // Iran J Basic Med Sci. — 2015. — Vol. 18, №3. –– Р. 229-234.
26. Leighton J., Mansukhani S., Estes L. Decalcifiied eggshell membrane, a supporting substrate for electron microscopic cross sections of monolayers of epithelial cell line MDCK / J. Leighton [etc.] // In Vitro. – 1971 – P. 251-252.
27. Ruff K.J., Winkler A., Jackson R.W. Eggshell membrane in the treatment of pain and stiffness from osteoarthritis of the knee: a randomized, multicenter, double-blind, placebo-controlled clinical study / K.J. Ruff [etc.] // Clin Rheumatol. – 2009. – P. 907-914.
28. Cordeiro C.M., Hincke M.T. Recent patents on eggshell: shell and membrane applications / C.M. Cordeiro [etc.] // Recent Pat Food Nutr Agric. – 2011. – P. 1-8.
29. Jia J., Duan Y.Y., Yu J. Preparation and immobilization of soluble eggshell membrane protein on the electrospun nanofibers to enhance cell adhesion and growth // J. Jia [etc.] // J Biomed Mater Res A. – 2008. – P. 346-373.
30. Arias J.I., Gonzalez A., Fernandez Ms. Eggshell membrane as a biodegradable bone regeneration inhibitor / J.I. Arias [etc.] // J Tissue Regen Med. – 2008, — P. 228-235.
31.Farjah Gh, Heshmatian B, Karimipour M, Saberi A. Using Eggshell Membrane as Nerve Guide Channels in Peripheral Nerve Regeneration / Gh.Farjah [etc.] // Iran J Basic Med. — 2013. Sci. Vol.16, №8. – P. 901-905.
32. United States Patent №20120150205 A1. Silk nanofiber nerve conduit and method for producing thereof.
33. United States Patent №20050013844 A1. Neural regeneration conduit.
34. Zhang J., Sheng L., Jin C. Liquid Metal as Connecting or Functional Recovery Channel for the Transected Sciatic Nerve / J. Zhang [etc.] // Beijing, China. – 2014.
http://medicalxpress.com/news/2014-04-beijing-explore-liquid-metal-reconnect.html
35. Патент РФ №2471435. Способ восстановления поврежденного нерва при дефектах на большом протяжении.
36. United States Patent №20120109167 A1. Nerve guide conduit containing carbon nanotubes.
37. United States Patent №20030176876 A1. Multi-channel bioresorbable nerve regeneration conduit and process for preparing the same.
1. Введение
Проблема лечения больных с повреждениями периферических нервов является одной из ведущих в травматологии и нейрохирургии. Нарушения целостности нервов сопровождают 3-10% от всех травм опорно-двигательного аппарата и приводят к стойкой утрате трудоспособности у 60-63% пациентов, более того, почти 80% этой группы составляют лица молодого трудоспособного возраста [1, 2]. В большинстве случаев травма нервов, вследствие специфики анатомо-топографических взаимоотношений, редко бывает изолированной [3].
Рубцовые изменения, а так же дополнительные повреждения нервов при неквалифицированном хирургическом вмешательстве, ущемления между костными отломками и другие обстоятельства приводят к возникновению большого диастаза между фрагментами поврежденного нерва. К их числу чаще относятся травмы в диафизарных отделах конечностей, где различные методы сгибания соответствующих суставов с целью уменьшения натяжения нерва при его сшивании не дают результатов [4].
Современные методы восстановления протяженных дефектов нервов, можно разделить на три большие группы, дифференцированные по виду хирургического вмешательства и особенностей его технологии:
1- Аутотрансплантация нерва;
2- Аутотрансплантация тканей для создания направления регенерации нерва;
3- Создание искусственных проводников и (или) ксенотрансплантатов для создания направления регенерации нерва
Выбор оптимального вида реконструктивного вмешательства по восстановлению непрерывности нервного ствола должен базироваться не только на величине дефекта нерва, но также учитывать совокупность факторов, среди которых локализация повреждения, способ сближения его концов и объективная оценка степени натяжения в зоне шва.
2. Аутотрансплантация нервов и тканей для создания направления регенерации нерва.
В связи с решением перечисленных вопросов разработаны многие методики, являющиеся смежными по отношению к основной теме обзора. Например, способ сшивания концов нерва, позволяющий уменьшить натяжение в зоне шва, с помощью эпиневральных лоскутов. Данный способ аутопластики дефекта нервного ствола заключается в расположении трансплантатов между концами нерва с учетом их анатомического строения, сближении и фиксации концов нерва за эпиневральные лоскуты к подлежащим тканям, а также обкладывании трансплантатов фрагментами подкожно-жировой клетчатки на сосудистой ножке [5]. Трансплантаты готовятся с помощью специальных устройств, позволяющих выделять и отсекать участки икроножного нерва с образующими его ветвями [6]. Широко применяется метод лечения повреждений нервов посредством восстановления их функций за счёт подшивания повреждённого нерва через аутотрансплантат к нормально функционирующим нервам той же части конечности [7-9].
Довольно интересной считается методика[10], по мнению авторов которой сшивание концов нерва с наложением поперечных насечек эпиневрия и периневрия в шахматном порядке или циркулярно, позволяет обеспечить зону восстановления нерва необходимыми трофическими ресурсами.
Известен способ пластики дефекта нервного ствола [11], который заключается в том, что в сосудисто-нервный комплекс с манжетой из выкроенного из подлежащей собственной фасции голени фасциально-клетчаточного островкового лоскута включают икроножный нерв с малой подкожной веной в одном блоке. Таким образом, за счет перемещения целой системы тканей в посттравматический диастаз, можно говорить о создании сложного кондуита. Данную разработку практически повторяет метод [12], в котором, как проводник используется выделенный трансплантат в виде сосудисто-нервного комплекса из икроножного нерва с малой подкожной веной в одном блоке, перенесенный в дефект нерва.
Но, не смотря на вышеперечисленные работы, при травме с дефектом длины нервных стволов, а также при реконструкции по поводу застарелых повреждений, для сближения концов требуется: 1) значительное его натяжение; 2) сгибание в смежных суставах; и как альтернатива — 3) аутонервная пластика. Частыми осложнениями аутопластики являются: натяжение нерва, приводящее к «прорезыванию швов»; сгибание в смежных суставах, вследствие которого развиваются контрактуры в послеоперационном периоде и вторичное повреждение нервов при разработке движений; ротация нервных волокон в различных плоскостях, что препятствует их обособлению в пучки. Более того, при аутонервной пластике приходится использовать нерв с другого участка тела, что приводит к излишней анестезии в зоне иннервации, формированию дополнительной полости с возможными осложнениями, а также затрате времени на хирургическое вмешательство. Все это значительно ухудшает результаты восстановления функции нервного ствола, причем регенераторный потенциал в вышеперечисленных методиках используется не полностью.[13]
3. Создание искусственных проводников и (или) ксенотрансплантатов для создания направления регенерации нерва
Одной из исследовательских работ, оказавших влияние на развитие создания искусственных проводников, на наш взгляд, может стать способ лечения повреждения периферического нерва [14], который заключается в формировании изолирующего кондуита, выполненного из тонкостенной силиконовой трубки. Длину силиконовой трубки выбирают такой, чтобы она была на 4-5 см больше размера восстановленного дефекта нервного ствола. После восстановления целостности поврежденного нерва, а именно ушивания дефекта, изолирующую муфту продвигают проксимально до перекрытия изолирующей муфтой на 4-5 см места соединения проксимального и дистального концов нерва. В данном исследовании нет указания на использование силикона, как кондуита, помещенного в диастаз посттравматического нерва для направления регенерации, но идея использования трубки из инородной ткани, как изолятор для регенерации сшитого нерва, может считаться первой ступенью на пути к дальнейшему развитию нового направления в восстановительной медицине.
Совершенно новым методом восстановления протяженных дефектов нервных стволов является замещение диастаза нерва проводником, содержащим внутреннюю среду, повторяющую естественные условия регенерации.
Одним из прорывных трудов в развитии данного направления стал “Способ восстановления нервного ствола” [15], который заключается в соединении проксимального и дистального концов повреждённого нерва с трансплантированным сосудом. С целью ускорения восстановления целостности и достижения полноты регенерации, в качестве трансплантата авторы использовали артериальный сосуд донора, заполненный гомогенатом леммоцитов. В просвет трансплантата с двух сторон вводили концы нервного ствола и соединяли биоклеем их эпиневральные оболочки с краями трансплантата. Клетки Шванна обеспечивают направленных рост регенерирующих аксонов перерезанного нерва от проксимального конца к дистальному. Они образуют, так называемые “мостики регенерации”, по которым и происходит продвижение регенераторного процесса.
В современной врачебной практике в качестве транплантата между отрезками нерва более широкое применение получили – венозные проводники [16]. Удовлетворительные функциональные результаты были получены в случае лечения дистальных чувствительных нервных дефектов до 3 мм. Выявлены несколько преимуществ использования вены, как проводника между концами пересечённого нерва (Chiu etc. 1982): базальная мембрана, которая образует эндотелий вены, богата ламинином, а адвентиция состоит в основном из коллагена; стенки вен являются достаточно упругими, чтобы действовать в качестве барьера против рубцового разрастания и имеют проницаемость, чтобы обеспечить диффузию питательных веществ внутрь (Wang etc., 1993; Tseng etc. 2003). Сторонники данного вида проводников отмечают достаточный запас для выбора венозных шунтов из многих областей тела, низкой стоимости и относительно малой степенью дополнительного повреждения в сравнении с нервными трансплантатами. Кроме того, вены неиммуногенны, практически не вызывают воспалительную реакцию, и доступны в широком разнообразии размеров. Они могут обеспечить механическую поддержку регенерирующих аксонов, предлагая защищенную биохимическую среду, вдали от окружающих тканей (Allet др., 2003).
Но венозные кондуиты имеют и существенные недостатки. В течение процесса регенерации, они оказались нестойкими, что приводило к перегибам или распадам стенки трубки [17-19]. По этой причине их использование становится невозможным при восстановлении больших промежутков диастаза нерва. Чиу с соавторами были проведены исследования, доказавшие тот факт, что вена, как проводник, может использоваться лишь при немногих травмах нервов, в частности, при диастазах длиной менее 3 мм [18].
В настоящее время развивается совершенно новое направление в восстановлении протяженных дефектов нервов, а именно создание искусственных проводников. Это направление исследований считается более перспективным, чем аутотрансплантация, поскольку их результатом станет разработка метода восстановления протяжённых повреждений нервного ствола. Исследования направлены на разработку новых возможностей при конструировании кондуита, в которые входят подборка индивидуального диаметра и анатомической формы под стать поврежденному нерву, использование биоразлагаемых материалов, применение всякого рода направляющих борозд в его стенке для более точного сопоставления нервных волокон и контроля регенераторных процессов.
Ученые Университета Шеффилда разработали и испытали метод изготовления проводника с помощью микростереолитографии. Это технология 3D-печати, позволяющая точно воссоздать микроструктуру нерва. Испытание изготовленного устройства было проведено на мышах со значительной травмой нерва: животному восстановили нервное волокно длиной около 3 мм за 21 день. Для изготовления устройства был использован полиэтиленгликоль, который одобрен для клинического использования. Материал не является биоразлагаемым, что создаёт некоторые трудности при применении данного типа кондуита. Стоит упомянуть о двух важных особенностях, а именно: наличие на внутренней поверхности стенки проводника особых насечек, которые способствуют более точному направлению нервных волокон в трубке, и свойстве данного материал проводить нервный импульс, что даёт право отнести его к биоинертным[20].
Итак, как отмечено выше, для создания направляющих кондуитов лучше всего подойдут биоразлагаемые материалы. Наиболее перспективным представляется использование коллагена, полигликолевой кислоты (ПГК) и их конгломерата.
Очень интересным не только с точки зрения конструкции кондуита, но и его содержимого является сочетание данных материалов. База трубки была изготовлена из цилиндрически тканой ПГК сетки, внешняя и внутренняя поверхности которой были покрыты аморфным слоем коллагена. Просвет трубки был наполнен 3D-губчатой коллагеновой матрицей. Губчатый коллаген обеспечивает благоприятную микросреду для восстановления нерва (регенерации аксонов, клеточной пролиферации и заживления тканей). Несмотря на то, что коллаген имеет тенденцию растворяться в организме, ПГК-кондуит позволяет сохранять его форму в течение достаточно долгого времени для полной регенерации нерва.
ПГК-коллаген трубка была 30 мм в длину и 0,7 мм в диаметре, что позволило перекрыть дефект нерва с небольшим запасом для наложения эпиневральных швов нерв-кондуит.[21]
Как было сказано выше, коллаген является хорошим материалом не только для создания направляющей трубки при повреждениях нерва, но и искусственных условий регенерации нервной ткани, т.е. внутренней среды для кондуита. Кроме него целесообразным считается использование альфа-липоевой кислоты(АЛК).
Известно, что повреждение нерва связано с окислительным стрессом. Увеличение уровня свободных радикалов кислорода и снижение деятельности ферментов антиоксидантной защиты наблюдаются после травмы нерва. Антиоксиданты, такие как ацетил-L-карнитин, витамин Е, АЛК успешно используются в лечении экспериментального пересечения нерва. Однако, эффект АЛК в регенерации периферических нервов до конца не выяснены.[22-24]
Совсем недавно исследовали два совершенно новых материала для создания кондуитов. Это хитозан и мембрана яичной скорлупы.
Хитозан – это аминосахар, производное линейного полисахарида, одним из источников получения которого служат панцири ракообразных. Успешным применением данного материала служит исследование с заполнением просвета хитозанового проводника альфа-липоевой кислотой (обоснование её использования указаны выше)[25].
Мембрана яичной скорлупы оказалась невероятно подходящим материалом для формирования трубки. Путём многократной обработки яичной скорлупы: сделав отверстие в скорлупе, вынуть содержимое; промыть изнутри, погрузить в 5% уксусную кислоту на 8 дней, далее в фосфатно-солевой буфер ph 7.4 на 30 минут; надеть на тефлоновую трубку; высушить 37 градусов 24 часа в стерильном ламинарном боксе; [26] была получена тонкая пленка. Данная мембрана сохраняет белок и предотвращает проникновение бактерий. Мембрана яичной скорлупы является естественным источником комбинированных глюкозамина, хондроитина и гиалуроновой кислоты, [27] имеют высокое содержание биологически активных компонентов, а также способности к удержанию влаги, которые имеют потенциальную пользу.[28] Мембрана яичной скорлупы является нетоксичной [29] и биологически разлагаемой [30]. Это может иметь большой потенциал для восстановления нервов в исследованиях регенерации аксонов в периферической нервной системе [28].
Положительным результатом использования мембраны послужили следующие факты: отсутствие послеоперационных смертей, клинических признаков раневой инфекции. Операции были хорошо перенесены животными. Нет клинических признаков инфекции, болей или дискомфорта во время регенеративного периода. [31]
3.1. Кондуиты для восстановления повреждений многопучковых нервов
Развитие создания проводников из искусственных материалов привело исследователей к мысли о восстановления многопучковых нервов, например, седалищного. Идея заключается в помещении не одного кондуита, общего для всех нервных пучков, в диастаз нерва, а именно, нескольких пучковых проводников, заключенных в одну общую муфту. Также, как оказалось, вышеперечисленные материалы не являются финальной точкой в исследованиях, например, появился способ восстановления нервного ствола с помощью кондуита из шелковых нановолокон. Кондуит создавали путем электроформования волокнистого прядильного раствора в цилиндре, смазанного изнутри полиэтиленоксидом. Электроформование — это процесс создания волокон, который отличается определенной гибкостью, позволяющей задавать конечные характеристики и структуру нановолокнам под стать параметрам нервного ствола.[32]
Говоря о параметрах и структуре изготавливаемых кондуитов, нельзя не упомянуть о способе восстановления нерва с помощью кондуита, имеющего спиралевидную геометрию.[33] Регенерация при выполнении данной методики осуществляется благодаря наличию различных клеток и биовеществ на каждом из слоёв скрученного из плоского листа кондуита, что также направляет разобщенные нервные волокна.
Немного другим подходом к решению поставленной задачи воспользовались авторы способа восстановления нерва [34] с помощью установки кондуита из жидкого сплава селена, галия и индия с формированием микроканальной структуры для направленного продвижения нервных волокон. К сожалению, наличие жидкого металла в структуре нерва отрицательно сказывается на его физиологии. Учтя это, выдвинули свои методы и другие группы ученых. Итогом исследований стало создание способа восстановления поврежденного нерва при дефектах на большом протяжении.[35] Восстановление происходит путём имплантации электропроводящих элементов из металла или полимерного токопроводящего материала, которые вводят в пучок нерва на 3-4 мм в оба конца диастаза нерва, далее весь диастаз укрывают кондуитом. Данная разработка чем-то напоминает взгляды на регенерацию нерва китайских исследователей, но использование кондуита выводит разработку российских авторов на качественно новый уровень.
На наш взгляд, способ восстановления нервного волокна [36], который заключается в создании проводника, имеющего две поверхности: внешнюю – силиконовую, и внутреннюю – из углеродных нанотрубок, мог бы стать вершиной восстановления нервов посредством кондуитов, но способ восстановления нервного ствола [37], который заключается в создании кондуита из пористого многоканального биоразлагаемого кондуита, помещаемого вместо диастаза нерва, внес свою весомую лепту в историю развития проводников между проксимальными и дистальными концами поврежденных нервов. По нашему мнению, данная форма кондуита универсальна и наиболее физиологична для восстановления нервного ствола. Остается только подобрать нужную ткань для его создания.
Безусловно, направление каждого пучка отдельно от других является наиболее верным методом восстановления повреждённого нерва и, определенно, через некоторое время он вытеснит все вышеперечисленные варианты использования регенераторного потенциала нерва.
Заключение
Итого, регенераторный потенциал нервного волокна можно использовать в искусственной среде, направляя и стимулируя его процессы.
В дальнейшем, технологию восстановления протяженных дефектов нервов с помощью биоразлагаемого кондуита можно направить и на восстановление спинного мозга, а, возможно, и — головного. К примеру, одно из самых частых осложнений при операции по удалению менингиомы — доброкачественной опухоли головного мозга, является повреждение обонятельного нерва, проходящего вблизи опухоли. При успехе данного метода, можно свести на нет один из рисков данной операции. И это лишь один из многих примеров прямого участия данного способа восстановления нервов.
В заключении хотелось бы сказать, что данная методика восстановления протяженных дефектов нервных волокон является прорывом в современной медицине и может найти широкое применение не только в нейрохирургии, но и травматологии, трансплантологии и других отраслях медицины
Библиографическая ссылка
Тутуров А.О. СОВРЕМЕННЫЕ ТЕНДЕНЦИИ В ВОССТАНОВЛЕНИИ ПРОТЯЖЁННЫХ ДЕФЕКТОВ НЕРВОВ. РАЗВИТИЕ ТЕХНОЛОГИЙ ИСПОЛЬЗОВАНИЯ РЕГЕНЕРАТОРНОГО ПОТЕНЦИАЛА НЕРВНЫХ ВОЛОКОН, ИХ СУЩНОСТЬ, НЕДОСТАТКИ И ПРЕИМУЩЕСТВА. // Международный студенческий научный вестник. – 2017. – № 1.
;
URL: https://eduherald.ru/ru/article/view?id=16825 (дата обращения: 06.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
13 Ноября 2013
Как помочь регенерации отростков нейронов
Найден ключ к восстановлению аксонов
NanoNewsNet по материалам Washington University School of Medicine: Scientists identify clue to regrowing nerve cells
Ученые из Школы медицины Вашингтонского университета в Сент-Луисе идентифицировали цепную реакцию, ответственную за восстановление поврежденных аксонов – открытие, способное оказать значительную помощь в разработке эффективных методов лечения повреждений нервов, приводящих к потере чувствительности или параличу. Статья об исследовании опубликована в журнале Cell (Cho et al., Injury-Induced HDAC5 Nuclear Export Is Essential for Axon Regeneration).
Кроме того, американские исследователи доказали, что одно из звеньев этой цепной реакции в нервных клетках как головного, так и спинного мозга потеряно. Выпадение этого звена – белка HDAC5 – может объяснить, почему эти клетки не проявляют способности к самостоятельному восстановлению потерянных отростков. Новое исследование дает основания предположить, что активация HDAC5 в центральной нервной системе может стать триггером регенерации отростков нервных клеток.
«Мы знали, что вклад в восстановление отростков этих нервных клеток, называемых аксонами, вносят несколько генов, но что активирует экспрессию этих генов, а значит, и процесс восстановления, до сих пор оставалось неизвестным», – говорит руководитель исследования Валерия Кавалли (Valeria Cavalli), PhD, доцент кафедры нейробиологии. «Наше открытие приближает нас к тому, что в один прекрасный день мы сможем разработать методы лечения, делающие регенерацию аксонов более эффективной».
Аксоны – отростки нервных клеток, отправляющие сообщения. Как правило, они намного длиннее и более подвержены повреждениям, чем дендриты, выполняющие другую функцию – получение сообщений.
В периферической нервной системе – сети нервных клеток вне головного и спинного мозга – регенерация поврежденных аксонов иногда происходит естественным путем, чего, к сожалению, нельзя сказать о центральной нервной системе, где поврежденные аксоны, как правило, не восстанавливаются.
Работая с выращенными в лаборатории клетками периферической нервной системы, Юнчеол Чо (Yongcheol Cho), PhD, научный сотрудник лаборатории доктора Кавалли, отсекал части аксонов. Как оказалось, это вызывает волну перемещения кальция вдоль оставшейся части аксона к телу клетки. Эта волна является первой ступенью каскада реакций, активизирующих механизмы регенерации отростка.
Для изучения реакции нервных клеток на повреждение их аксонов ученые Вашингтонского университета
выращивают их в виде «пятен», получающихся в результате обработки поверхности клетки специфическими антителами.
(Фото: Yongcheol Cho, PhD)
В клетках периферической нервной системы одним из наиболее важных звеньев этой цепной реакция является высвобождение из центрального компартмента клетки – ее ядра – белка HDAC5. Как установили исследователи, после выхода из ядра HDAC5 активирует ряд генов, вовлеченных в процесс регенерации. Кроме того, HDAC5 мигрирует к месту повреждения, где участвует в синтезе микротрубочек – жестких опорных структур, помогающих воссоздать архитектуру регенерирующего аксона.
Схема из статьи в Cell – ВМ
Когда исследователи модифицировали ген HDAC5 таким образом, что его белок не мог выходить из ядер периферических нервных клеток, аксоны в клеточных культурах не восстанавливались. В то же время обработка растущих в культуре аксонов препаратами, помогающими HDAC5 покинуть ядро, стимулировало регенерацию. Результаты этих экспериментов были воспроизведены и в опытах на животных.
Совсем другую картину ученые наблюдали при изучении той же цепной реакции в клетках центральной нервной системы: HDAC5 никогда не покидал ядра и не мигрировал к месту повреждения. По мнению исследователей, неспособность HDAC5 – важнейшего в этой «пьесе» действующего лица – к выходу из ядра может быть одной из главных причин отсутствия регенерации аксонов клеток центральной нервной системы.
«Результаты нашего исследования можно признать весьма обнадеживающими. Если нам удастся найти способы манипулирования этой системой в нейронах головного и спинного мозга, мы сможем помочь клеткам центральной нервной системы в восстановлении потерянных отростков», – подводит итог доктор Кавалли. «Именно над этим мы сейчас и работаем».
Портал «Вечная молодость» http://vechnayamolodost.ru
13.11.2013
Синаптическая и нейрональная пластичность при различных функциональных состояниях нервной системы
NovaInfo 57, с.35-52, скачать PDF
Опубликовано 21 декабря 2016
Раздел: Биологические науки
Язык: Русский
Просмотров за месяц: 75
CC BY-NC
Аннотация
В обзорной статье представлены сведения о пластичности синапсов центральной и периферической нервной системы в нормальных физиологических условиях и при неврологических дисфункциях, а также пластичности нейронов и их отростков при различных функциональных состояниях нервной системы.
Ключевые слова
ПАТОФИЗИОЛОГИЧЕСКИЕ ПРОЦЕССЫ, ФИЗИОЛОГИЧЕСКИЕ ПРОЦЕССЫ, НЕЙРОНАЛЬНАЯ ПЛАСТИЧНОСТЬ, СИНАПТИЧЕСКАЯ ПЛАСТИЧНОСТЬ
Текст научной работы
Пластичность синапсов центральной и периферической нервной системы в нормальных физиологических условиях и при неврологических дисфункциях. Передача возбуждения между нейронами, а также от нейронов к мышечным клеткам происходит благодаря наличию специализированных межклеточных контактов. Синапс формируется пресинаптической клеткой, обладающей способностью выделять химический посредник, синаптической щелью, в которой происходит диффузия медиатора, и постсинаптической клеткой, чувствительной к действию медиатора благодаря наличию рецепторов. При этом медиатор выделяется порциями определенного размера – квантами, в специализированных участках пресинаптической мембраны – активных зонах.
Важным и неотъемлемым свойством химических синапсов как в центральной, так и периферической нервной системе является пластичность. Синаптическая пластичность (СП) является составляющей нейропластичности и рассматривается как способность синапсов к функциональным и морфологическим перестройкам в процессе активности. Именно благодаря этому свойству синапсы выполняют множество разнообразных физиологических функций в организме. Н.Н. Боголепов с коллегами [1], M. Manto с коллегами [2] определяют СП как свойство синапсов реагировать на физиологические и патологические воздействия изменением эффективности транссинаптической передачи информации.
Выделяются следующие виды пластичности синапсов [3]:
- эволюционная, которая обеспечивает развитие простых нейронных сетей в сверхсложные мультимодульные сети, способные осуществлять высшие психические функции;
- онтогенетическая, связанная с индивидуальным развитием и обеспечивающая приспособление организма к внешней и внутренней среде;
- физиологическая, связанная с физиологической активацией функциональных систем;
- реактивная, которая проявляется краткосрочной активацией синапсов после патологического воздействия на них различных факторов (ишемия, гипоксия, токсины);
- адаптационная, связанная с длительной активацией существующих функциональных систем мозга и появлением новых функциональных систем мозга в процессе адаптации организма к окружающей среде;
- репаративная, которая обеспечивает восстановление функциональных систем мозга после их повреждения и реализуется всем спектром повышения эффективности синаптического пула, от активации сохранившихся синапсов до неосинаптогенеза и роста нервных отростков.
Выделяют кратковременные формы СП, которые длятся секунды и минуты, а также долговременные формы, которые продолжаются часы, месяцы и годы. Долговременные виды пластичности формируются на основе кратковременных воздействий, и лежат, в частности, в основе когнитивных функций нервной системы. Кратковременная СП проявляется в виде изменения величины секреции медиатора, и может проявляться либо в облегчении (увеличении), либо в депрессии (уменьшении). Указывается, что кратковременная СП выполняет важную физиологическую роль в нервной системе. Помимо участия в простых формах обучения и памяти, кратковременная СП обеспечивает обработку информации в нейронных сетях, участвует в активации «молчащих» синапсов и, как уже указывалось, индукции долговременных форм синаптической пластичности. В нервно-мышечном синапсе кратковременная СП участвует в управлении движениями, как у позвоночных, так и беспозвоночных животных [4].
Установлено, что в основе кратковременных форм СП лежат разнообразные пресинаптические механизмы, связанные с повышением концентрации и изменением динамики спада внутриклеточного Са, изменениями величины входящего кальциевого тока, удлинением временного хода секреции, нарушением соотношения между тратой и восполнением запаса медиатора [5-7]. При этом важную роль в развитии кратковременных форм СП играет структурно-функциональная организация активных зон нервных окончаний. При разрушении активных зон под действием фармакологических агентов способность синапсов к пластичности практически исчезает [5]. Помимо пресинаптических, существуют также и постсинаптические механизмы кратковременной СП, связанные с повышением (потенциацией), либо снижением (десенситизацией) чувствительности постсинаптических рецепторов к медиатору. В зависимости от выраженности тех или иных процессов при различных параметрах активности и условиях функционирования синапса преобладает либо облегчение, либо депрессия секреции медиатора [8].
Долговременная СП может выражаться в виде долговременной потенциации или долговременной депрессии. Наиболее выражены эти процессы в отделе головного мозга, играющем ключевую роль в формировании памяти – гиппокампе. Инициация долговременных форм СП происходит в результате активации глутаматных NMDA-рецепторов (им отводится особая роль в регуляции нейрональной возбудимости и СП), которые открываются при деполяризации мембраны в процессе ритмической активности и пропускают ионы кальция в клетку [9, 10]. При этом известно, что ионы Са избирательно регулируют активность многочисленных белков и ферментов в нервных терминалях центральных и периферических синапсов. К их числу принадлежат, в частности, кальмодулин, кальмодулинкиназы, протеинкиназы С [11]. Повышение внутриклеточной концентрации ионов Са приводит к активации внутриклеточных протеинкиназ (кальций-кальмодулинзависимые киназы и др.) и фосфорилированию определенных белков. Эти процессы приводят к различным перестройкам в клетке, в том числе и морфологическим. Структурные изменения заключаются в росте и ветвлении пресинаптических нервных окончаний, изменении количества рецепторов на постсинаптической мембране, образовании новых синапсов. Таким образом, синаптическая активность в нервной системе приводит к изменению силы синаптической передачи и морфофункциональных свойств как пре-, так и постсинаптических клеток, которые сохраняются в течение минут, часов, месяцев, десятков лет [12].
Следует отметить, что реорганизация синаптических связей имеет немаловажное значение в процессе адаптивного формирования нейронных ансамблей. Структурная реорганизация синапсов относится к тем формам пластичности, которые наиболее существенную роль играют в процессе онтогенетического развития мозга. Структурные изменения у взрослых были первоначально обнаружены при определенных видах нейропатологических нарушений. Однако структурные перестройки могут иметь отношение также и к долговременной пластичности, и к процессам обучения и памяти. Структурная реорганизация синапсов является сложным биохимическим процессом, который сопровождается переносом уже существующих [13] и увеличением экспрессии вновь образованных белков [14]. Отмечается, что в процессе обучения тонким движениям в моторной коре обнаружены синаптогенез, увеличение ветвления дендритов и числа шипиков, экспрессия fos-генов, выполняющих ряд важных функций, связанных с клеточной дифференцировкой, пролиферацией, а также с целым рядом стрессовых реакций, увеличение содержания белка в нейронах и усиление внутрикорковых горизонтальных связей в слоях II-III [15].
Многими отечественными и зарубежными исследователями рассматриваются особенности СП мозга при его функциональных нарушениях [2, 16-18] (A.C. Shakesby et al., 2002; З.А. Алексанян с соавт., 2003; Б.Х. Базиян, Е.Л. Казакова, 2003; M. Manto et al., 2006 и др.). В частности, в работах [2, 16] указывается, что к основным механизмам проявления пластичности относятся изменения функциональной активности синапсов, количества, протяженности и конфигурации их активных зон, числа шипиков дендритов и синапсов на них, формирование новых синапсов, сопряженное с аксональным или дендритным спрутингом, длительное потенцирование или подавление, регулирующее эффективность синаптической передачи, изменение порога возбудимости потенциалзависимых мембранных каналов, компенсаторные возможности метаболизма на мембранном и молекулярном уровнях.
Установлено, например, что при церебральной ишемии мозга происходит существенная реорганизация межнейрональных взаимоотношений, активация синаптогенеза и изменение эффективности функционирующих синапсов [1, 3]. Результаты экспериментальных исследований, основанных на ультраструктурных методиках, подтверждают наличие нейропластических изменений при церебральных повреждениях в виде увеличения плотности дендритов в корковых отделах, при повторных двигательных заданиях — в виде увеличения числа синапсов в моторной коре [19]. Имеет значение и образование новых сосудов (ангиогенез) [20].
Основу современных представлений о нейропластичности составляет изучение пластических перестроек периферических синапсов. Представление о том, что нервно-мышечное соединение не является застывшей, статичной структурой, сложилось постепенно, по мере накопления данных о структурной и функциональной неоднородности нервно-мышечного синапса (НМС) скелетных мышц позвоночных. В процессе научных изысканий были изучены сезонные и возрастные изменения морфологии и функции синапса холоднокровных [21], выявлены различия между проксимальными и дистальными участками нервной терминали по ряду характеристик, определяющих секрецию ацетилхолина (АХ) [22]. Гистохимические изыскания ряда авторов [23-25], основанные на выявлении активности ацетилхолинэстеразы (АХЭ), позволяют достоверно отразить структурно-функциональное состояние НМС. Вместе с тем, энзимохимические свойства системы «двигательное окончание-мышечное волокно» изучались в ходе постнатального онтогенеза [26], а также в условиях воздействия ряда экзогенных факторов [27]. При этом в ряде работ рассматривается изменение вызванной секреции медиатора в НМС при использовании одиночных, парных, либо кратковременных высокочастотных пачек импульсов, а также в ходе длительной высокочастотной активности НМС. Такой подход, в частности, объясняется тем, что основной формой функционирования НМС является проведение не одиночных, а достаточно высокочастотных серий импульсов. В естественных условиях частота импульсации мотонейронов может достигать нескольких десятков импульсов в секунду. Такая высокочастотная активность сопровождается изменениями амплитуды постсинаптического ответа, напрямую связанной с количеством выбрасываемого медиатора, которое, в свою очередь, может меняться как в сторону увеличения, так и в сторону уменьшения. Эти изменения вызванной секреции и носят название СП. При этом выраженность и кинетика СП определяется не только исходной величиной секреции медиатора, но и частотой импульсации мотонейронов. В свою очередь отмечается, что действие выброшенного в синаптическую щель АХ кратковременно. Временно возникающий на постсинаптической мембране комплекс «АХ-рецептор» после прохождения каждого импульса разрушается ферментом АХЭ. Запасов АХ в нервном окончании достаточно для проведения примерно 10000 импульсов. При длительной импульсации мотонейронов, несмотря на постоянный синтез АХ, его содержание в концевых веточках может постепенно уменьшаться. В результате этого возможны нарушения передачи возбуждения в НМС – пресинаптический нервно-мышечный блок. В процессе напряженной и длительной мышечной работы АХ может не успевать разрушаться и накапливается в синаптической щели. Способность постсинаптической мембраны к генерации потенциала концевой пластинки при этом уменьшается и развивается частичный или полный постсинаптический нервно-мышечный блок. В этом случае сократительные свойства мышечных волокон снижаются.
Ряд работ посвящен процессу синаптогенеза, классической моделью которого являются процессы формирования и удаления НМС, происходящие на скелетных мышечных волокнах в период реиннервации мышцы прорастающим к ней двигательным нервом после его повреждения [28, 29]. Известно, что прорастающие моторные аксоны образуют на волокне избыточное количество контактов, из которых большинство вскоре «замолкают», то есть перестают секретировать медиатор, а вслед за этим отторгаются, элиминируются. В результате на волокне сохраняется один синапс, а полисинаптическая иннервация сменяется на одиночную, моносинаптическую. Однако, несмотря на актуальность и длительную историю изучения этого вопроса, сведения о механизмах и процессах, приводящих к подавлению избыточных синапсов и их последующей элиминации, остаются немногочисленными [30].
Таким образом, вышеизложенные факты свидетельствуют об определяющей роли СП в функционировании центральной и периферической нервной системы, а также ее двигательных структур в различных условиях, в том числе, патологических, когда происходит включение ее резервных возможностей [31].
Проявление признаков пластичности нейронов и их отростков при различных функциональных состояниях нервной системы. Признаки проявления нейропластичности обусловлены либо физиологическими, либо патологическими изменениями. В связи с чем, нейропластичность может рассматриваться как процесс постоянной регенерации в случае естественного или патологического повреждения, адаптирующий нервную клетку к новым функциональным условиям. Вместе с тем нейропластичность представляется как постоянная адаптация клетки к различным условиям функционирования, в том числе, к нормальным физиологическим, например, при вовлечении нервной ткани в процессы обучения и формирования навыков, или в результате реабилитационных мероприятий [32-53].
В свою очередь, наряду с нейропластичностью к наиболее значимым нейробиологическим процессам относят нейротрофику, нейропротекцию и нейрогенез. Они формируют эндогенную защитную активность, призванную противостоять патофизиологическим процессам. В частности, нейротрофика – это естественный процесс, подразумевающий пролиферацию, миграцию, дифференциацию и выживание нервных клеток. Нейропротекция – комплекс механизмов, противодействующих повреждающим факторам. Нейрогенез – формирование из стволовых клеток новых клеток нервной ткани (нейронов, астроцитов и олигодендроцитов). Конечным назначением нейрогенеза является образование новых нейронов. Такие фундаментальные биологические процессы не имеют четко различимых границ, их механизмы сходны и взаимосвязаны. Следует отметить, что при каждом повреждении нервной системы после определенного латентного периода запускаются эндогенные нейропротективные реакции. Целью нейропротекции является предотвращение смерти нейронов, клеток глии и эндотелиальных клеток, то есть нейроваскулярной единицы. Локальное повреждение ткани мозга также приводит к активации механизмов реактивной и репаративной нейропластичности. Первая является непосредственным ответом на патологическое воздействие сохранившихся нейронов, в то время как при репаративной включаются компенсаторно-восстановительные механизмы. Процессы нейропротекции и нейропластичности, регулирующиеся нейротрофическими факторами, во многом являются последовательными реакциями [54].
Пластичность нейрона и нервной ткани предполагает различные механизмы сохранения информации. В их числе и пластичность нейроглиальных взаимоотношений. В частности, по аналогии с другими тканями возможны реципрокные взаимодействия. В такой модели предполагается, что динамика активности нейрона в соответствии с изменением его стимуляции может существенно варьировать его взаимодействие с окружающими глиальными структурами, что вторично меняет их активность, стимулируя синтетические процессы, выработку биологически активных факторов, аналогичную в ходе нейрогенеза. Это может быть фактором, обеспечивающим формирование новых межнейронных контактов и функциональных связей нервных клеток, обеспечивающих следовую память.
Нейроглиальные взаимоотношения чрезвычайно важны для нормальной функции ЦНС. Модуляция нейроглии в центральной и периферической нервной системе динамична в ходе индивидуального развития, формирует разнообразные эффекты, в том числе пластичность. Важной неврологической проблемой является влияние стрессовых воздействий на развитие и функционирование нервной системы. Сильное повреждение (в том числе и опосредованное через периферические органы) может вести к функциональным и структурным изменениям не только головного мозга, но и нервной системы в целом. Физиологические стрессорные воздействия, тем не менее, в целом активизируют деятельность и развитие мозга, и стресс может служить гомеостатическим фоном для повышения нейрональной функции. Глиальные клетки влияют на нормальную синаптическую передачу и на ее нарушения при нервных заболеваниях. За ними закреплена функция повышения пластичности при нарушениях в нервной системе. Отдаленные сроки после экстремальных воздействий и при непосредственных повреждениях мозга характеризуются динамикой в первую очередь именно глиально-трофического окружения. Реакции собственно самих нейронов проявляются в поздние сроки, в виде очаговой гибели нервных клеток и компенсаторной гипертрофии с гиперплазией отростков оставшихся клеток.
Ранее упоминалось, что идея пластичности легла в основу теории, определяющей роль обучения в формировании синаптических связей в коре больших полушарий и объясняющей морфологические особенности обучения. Получение информации влечет за собой модуляцию синаптических контактов. Посредством суммирования совпадающих по времени входных сигналов нейроны связываются друг с другом, образуя функциональные динамические системы, причем контакты между входными и выходными нейронами усиливаются дублирующимися волокнами и обратными связями. Благодаря этим ассоциативным процессам клетки связываются в функциональные единицы памяти — «клеточные ансамбли».
Основными путями реализации пластичности нервной системы и обеспечения хранения информации признаются модификация количества, конфигурации, свойств синапсов, а также изменение структуры (длина, ветвистость) отростков нейрона. В этой связи следует отметить, что исключительно важную роль в реализации процессов пластичности играют, в том числе, нейротрофины, модулирующие структуру дендритов и плотность синапсов, принимая, тем самым, участие в процессах созревания нормального мозга и реализации обучения [55], а также хемокины, внесинаптическая нейротрансмиссия [56].
Особенности строения дендритного древа нейронов коры больших полушарий определяются сложностью выполняемых ими задач, характером и интенсивностью нагрузок. Так, нейронные ансамбли соматосенсорной зоны коры, обеспечивающие деятельность пальцев кисти, имеют более сложное строение, чем нейроны, связанные с мускулатурой туловища. Различия максимальны в случае, когда трудовая деятельность связана с тонкими дифференцированными движениями кисти (машинопись, работа с тонкими инструментами). Установлено увеличение размера двигательного нейронального представительства мышц кисти при интенсивной тренировке пальцев на пианино [57], а также у лиц, играющих на струнных музыкальных инструментах [58], расширение сенсомоторной зоны коры «считывающего» пальца у слепых, пользующихся методом Брайля, причем вовлеченная зона коры варьировала в зависимости от интенсивности нагрузок [59]. Вместе с тем, исследование кортико-моторных проекций мышц кисти у профессиональных бадминтонистов в сравнении с любителями выявило смещение двигательной проекционной области мышц кисти для «играющей» руки у всех профессионалов в отличие от лиц, не ассоциированных со спортом [60].
В многочисленных исследованиях показано также, что пластические изменения в моторной коре происходят и после травмы мозга или инсульта, выражаются в уменьшении площади проекции мышц пораженного полушария по сравнению с контралатеральной стороной, тогда как в результате реабилитационной тренировки отмечается повышение возбудимости нейрональных сетей в пораженной зоне, достоверное увеличение проекционной области ипсилатеральных мышц наряду с некоторым уменьшением их контралатерального коркового представительства [61]. При этом установлено, что реорганизация кортико-моторных центров после инсульта протекает достаточно быстро. По некоторым данным, пластическая перестройка моторной коры происходит уже в течение месяца от момента катастрофы. В большинстве исследований, проведенных через 2-4 месяца от начала болезни, реорганизация моторной коры является обычной находкой. Преходящие изменения проекционных областей разных мышц в моторной коре в норме и при патологии подтверждены исследованиями с использованием транскраниальной магнитной стимуляции (ТМС) [59]. Ряд приведенных наблюдений лишний раз подчеркивает быстроту формирования и лабильность пластических изменений в коре головного мозга под влиянием внешних условий.
Высказываются различные гипотезы о возможных механизмах, лежащих в основе пластических реорганизаций кортикальных областей. Прежде всего, реорганизация границ корковых моторных представительств может объясняться демаскировкой уже существующих нисходящих кортикальных влияний за счет изменения их возбудимости под влиянием сигналов с периферии. При этом пороги вызова движений в ответ на магнитную стимуляцию соответственно снижаются или повышаются, обеспечивая наблюдаемые изменения функциональной топографии. Также, по-видимому, имеет место непосредственное изменение эффективности нисходящих связей за счет СП. Другая возможность заложена в наличии в коре мозга разветвленных горизонтальных межкорковых связей между моторной и соматосенсорной, а также другими областями коры [62].
Среди клеточных механизмов двигательной пластичности важную роль играет возбудимость мотонейронного пула спинного мозга и ее изменчивость при различных функциональных условиях. Известно, что уровень рефлекторной возбудимости α-мотонейронов скелетных мышц обусловливает функциональное состояние нейромоторного аппарата. Многочисленные собственные исследования показывают изменение возбудимости спинальных α-мотонейронов скелетных мышц под влиянием физических нагрузок [33-35, 37-50]. В исследованиях Т.В. Балтиной [63] изучалась активность мотонейронов спинного мозга в ответ на афферентные влияния. В этой связи следует обратить внимание на следующий аспект. Хорошо известно, что сенсорные I-а волокна создают как моносинаптические, так и олигосинаптические связи с α-мотонейронами в вентральных рогах, они включены в рефлекторную дугу и используют глютамат для передачи нервного возбуждения. В спинном мозге глютамат активирует два основных типа ионотропных рецепторов: NMDA- и AMPA-рецепторы. Сначала предполагалось, что эти два типа глютаматных ионотропных рецепторов играют различную роль в синаптической передаче рефлексов. Первоначальные работы показали, что NMDA-рецепторы были вовлечены в передачу полисинаптических рефлексов, а AMPA-рецепторы были вовлечены в передачу моносинаптических рефлексов; как бы то ни было, последующие за ними исследования установили, что это не было так [64]. Дальнейшие исследования показали, что функция NMDA рецепторов является принципиально важной для пластичности. Например, в экспериментах, поставленных in vitro, Fields с коллегами [65] культивировал спинальные мотонейроны 13-дневных зародышей мышей в 3-камерной клеточно-культурной системе и электрически стимулировал сенсорные афференты мотонейронов одной камеры. Таким образом, было показано, что мотонейроны, которые были объектом хронической стимуляции, развивали устойчивые синаптические связи с афферентными волокнами в периоды получения больших возбуждающих постсинаптичских потециалов в сравнении с не подвергающимися воздействию камерами сенсорных афферентов. Следовательно, эти экспериментальные модели подсказали, что возрастание сенсорных входов на спинальные мотонейроны может увеличивать эффективность этой синаптической связи. Такие индуцированные стимуляцией изменения в сенсорной афферентной эффективности были уменьшены аппликацией антанонистов NMDA [65], подсказывая, таким образом, что сенсорные входы на мотонейроны запускают морфологические изменения через активацию NMDA-рецепторов. Тела клеток и дендриты вначале растут в размере и количественно, но после этого начального роста они показывают регресс до тех пор, пока не достигнут окончательно созревшей конфигурации. NMDA-рецепторы играют роль в этом дендритном росте и их сокращении. Аппликация NMDA-антагониста во время первых трёх недель после рождения существенно уничтожает мотонейронный и дендритный рост у новорождённых хомяков: в то время как у взрослых NMDA-блокада не продемонстрировала влияния на морфологию мотонейронов. В заключение, хотя NMDA-глютаматные рецепторы не играли значительной роли в сигнальной передаче рефлексов, NMDA-рецепторы имели важное влияние на индуцирование пластических изменений в спинальных мотонейронах.
Интересно, что NMDA-рецепторы могут быть обнаружены повсюду в сером веществе спинного мозга (вентральные и дорзальные рога) на самых ранних стадиях развития, но во время взросления они существенно ликвидируются (исчезают) из всех частей спинного мозга за исключением желатинозной субстанции. NMDA-рецепторы желатинозной субстанции играют роль в модификации входов от сенсорных волокон, таких как А-дельта (кожные афференты температуры и боли). Эксперименты на спинном мозге крыс показали, что низкочастотная стимуляция А-дельта волокон может запускать NMDA-зависимую долговременную депрессию в желатинозной субстанции. В патологических условиях, таких как нарушение возбуждения (эксцитотоксия), активация этих рецепторов в ЦНС даёт вклад в процесс нейрональной деструкции. Аналогичным образом NMDA-рецепторы могут вовлекаться в возникновение нейропатической боли [66].
Многие исследователи оценивали также состояние мотонейронного пула в условиях деафферентации. Выраженная в той или иной степени деафферентация может наблюдаться, например, в условиях гравитационной разгрузки, клинической гипокинезии, при неврологических заболеваниях, включая, в том числе, спинальный травматизм, при травмах опорно-двигательного аппарата (ОДА) и др. Последнее, например, очень распространено в спортивной среде и объясняется тем, что современная подготовка высококвалифицированных спортсменов требует напряженных режимов тренировки и предъявляет высокие требования к организму спортсмена, в частности, к ОДА с развитием перенапряжения и, как следствие, повышением травматизма [33, 34, 48, 67-69].
Отмечается, что в условиях гравитационной разгрузки, возникающих, например, в результате ограничения подвижности в течение строгого постельного режима или во время космического полета, уменьшается количество миофибриллярных белков, мышечных ядер и количество нервно-мышечных синапсов. При этом следует отметить, феномены мышечной пластичности в данных условиях в настоящее время могут объясняться с позиции молекулярной сигнализации или сигналлинга [70].
В работе Н.А. Чухаревой [71] сообщается, что в эксперименте на животных деафферентация вызывается путём перерезки задних корешков в одном или нескольких сегментах спинного мозга. Синдром деафферентации, например задней конечности у крысы или собаки, тотчас после операции выражается в явлениях паралича. Это возникает вследствие выключения механизма обратной связи оперированной конечности со спинным мозгом. Выключается информация, получаемая спинным мозгом и вышележащими отделами ЦНС от проприорецепторов мышц и других рецепторов. В дальнейшем движения оперированной конечности восстанавливается за счёт регулирующих влияний со стороны здоровых конечностей и вышележащих отделов ЦНС. Эти влияния передаются через вставочные нейроны на мотонейроны деафферентированной конечности. Однако восстановление движений деафферентированной конечности происходит не полностью. Сокращения её мышц становятся слишком резкими, тонус мускулатуры ослаблен. Животное, лишённое ощущений с деафферентированной конечности, относится к ней как к постороннему телу [71].
Установлено, что снижение или выключение поступления афферентной стимуляции к мотонейронам и, как результат, деафферентация нейрона происходит в условиях повреждения периферического нерва [72]. Однако полной она не бывает, так как нейроны ЦНС обладают огромным количеством афферентных входов. Повреждение аксона при поражении периферического нерва приводит к изменению вида соматической клетки мотонейрона – нейрон разбухает, округляется, меняют своё положение некоторые составляющие. Происходит увеличение количества рибонуклеиновой кислоты, которая в дальнейшем используется для синтеза белков, необходимых для процесса «ремонта» аксона. В некоторых экспериментах такие изменения имели место не только в двигательных, но и в чувствительных нейронах. Стирается разница между деафферентированными мотонейронами, иннервирующими быстрые и медленносокращающиеся волокна, а после реиннервации вновь становится очевидной. Экспериментально на людях и животных установлено, что указанные изменения мотонейронов, а также спинальных ганглиев и глиальные реакции наблюдаются не только на поврежденной (ипсилатеральной) стороне, но и контралатерально [6, 7, 33, 34].
Изложенные факты указывают на процессы нейропластичности, в которых важную роль играют также и глиоциты. В литературе неоднократно отмечается тот факт, что, помимо прочего, за глиальными клетками закреплена функция повышения пластичности при нарушениях в ЦНС, которая проявляется в синтезе глиоцитов и усилении трофических процессов [73].
Некоторые опубликованные работы поддерживают точку зрения, что ЦНС в состоянии осуществлять значимую пластичность после повреждения спинного мозга (ПСМ) и что реабилитационные вмешательства после ПСМ влияют на эту пластичность на нескольких уровнях [74]:
- поведенчески (восстановление чувствительных, двигательных или автономных функций);
- физиологически (нормализацией рефлексов, усилением двигательных вызванных потенциалов);
- структурно/анатомически (аксональный спраутинг, дендритный спраутинг, генезис нервной ткани);
- клеточно (синаптогенез, синаптическое усиление);
- молекулярно (усиление регуляции нейротрансмиттеров и нейротрофических факторов, альтерация в экспрессии генов).
Базируясь по большей части на результатах исследований, полученных на моделях животных, реорганизация ЦНС, включая СП, аксональный спраутинг и клеточную пролиферацию, как было давно показано, самопроизвольно случается вслед за ПСМ [75]. Такая реорганизация случается в спинномозговой цепи ниже – каудально к повреждению в спинномозговой цепи, вокруг повреждения, в спинном мозге рострально к повреждению и в супраспинальных структурах.
Кроме того, при изучении мышц в условиях денервации у крыс Р.Р. Исламовым и В.В. Валиуллиным [76] было установлено, что после одностороннего повреждения седалищного нерва как в быстрой, так и в медленной мышцах происходит увеличение доли медленных мышечных волокон. Обнаруженный авторами феномен «замедления» мышц контралатеральной конечности после одностороннего повреждения нерва может быть объяснен компенсаторной билатеральной активацией спинальных двигательных центров в этих условиях. Вместе с тем, выдвинуто предположение, что импульсы от поврежденных афферентных волокон через мозжечок и ретикулярную формацию по восходящим путям переправляются на гамма-мотонейроны, возбуждающие интрафузальные мышечные волокна контралатеральной стороны. Это возбуждение по восходящим путям через мозжечок и красное ядро возвращается на α-мотонейроны той же стороны, что, в свою очередь, повышает тонус экстрафузальных мышечных волокон мышц конечностей контралатеральной стороны и вызывает возрастание в них относительного содержания медленных волокон. Таким образом, результаты этих исследований позволили авторам заключить, что экстрапирамидная система модулирует фенотип мышечных волокон через α-мотонейроны спинного мозга, причем компенсаторная активация экстрапирамидной системы проявляется выраженным «замедлением» как быстрой, так и медленной мышц контралатеральной конечности.
С учетом вышеизложенного следует отметить, что активация симметричных нейромоторных систем представляется одной из важнейших реакций ЦНС на периферическое повреждение. Процессы, происходящие при этом в «интактных» парных мышцах, связаны, очевидно, с изменением состояния спинальных двигательных центров, а также структур, осуществляющих по отношению к этим центрам интегративную функцию [77]. Однако литературные данные свидетельствуют о том, что исследованию центральных механизмов билатеральных компенсаторных реакций, возникающих после одностороннего повреждения нервов, уделяется значительно меньше внимания, чем исследованиям периферической части травмированной двигательной системы. Во многом неясными и противоречивыми остаются данные о механизмах билатеральных изменений нейромоторного аппарата при одностороннем нарушении нервного контроля [77]. В результате экспериментальных исследований А.А. Еремеева [77] были получены сведения о взаимосвязи ипси- и контралатерального двигательного центра, опосредуемой различными внутриспинальными связями, в частности, латентными в норме и активирующимися после одностороннего пережатия седалищного нерва.
Литературные сведения свидетельствуют также о том, что если перерезать периферический нерв, возникает дегенерация аксона к периферии от места перерезки и регенерация его конца, связанного с клеткой перерезанного нерва [71]. Если центральные и периферические концы перерезанного нерва отодвинуты далеко от друга, регенерирующие концы аксонов не достигают шванновских клеток периферического конца перерезанного нерва и полная регенерация не наступает. Одним из важных процессов при регенерации аксонов нервных клеток в этом случае является образование на их концах колбовидных утолщений, пуговок. Если количество этих утолщений велико (например, после травмы толстого смешанного нерва), то на концах перерезанного нерва образуется опухолевидное разрастание — неврома. Окружающие ткани раздражают эти окончания чувствительных нервов и вызывают резкие болевые ощущения, называемые каузальными [71]. При перерезке нервных стволов, соединяющих ткань с ЦНС, происходит децентрализация ткани. После перерождения перерезанных нервных волокон ткань называется денервированной. Скелетные мышцы после денервации атрофируются, в них происходят глубокие изменения всех видов обмена, меняется их возбудимость и другие физиологические свойства. Изменения эти необратимы, если иннервация ткани не будет восстановлена [71].
В свою очередь, дегенерация аксонов в периферических нервах может быть вызвана травмами ОДА, токсическими воздействиями, дефектами образования миелина, нарушениями аксонного транспорта, гипоксией и многими другими факторами. Наиболее часто встречаются травматические повреждения периферических нервных стволов, сопутствующие производственному, транспортному, спортивному и бытовому травматизму. Нарушение анатомической целостности нервного ствола приводит к полному выпадению функции нерва. Повреждения отростков двигательных и чувствительных нейронов вызывают паралич иннервируемых мышц и анестезию, а дегенерация аксонов вегетативных нейронов сопровождается сосудодвигательными расстройствами.
Восстановление поврежденных аксонов, то есть их регенерация с соответствующим восстановлением миелина – ремиелинизация – происходит в условиях сохранности трофического центра – тела нейрона. Двигательный нерв регенерирует и снова соединяется с мышцей. Этот процесс стимулируется сигналами из мотонейрона, который в условиях деафферентации не получает сигналов от мышцы путем некоторых факторов, перемещающихся в сохранном аксоне по направлению к соме мотонейрона [78]. Регенерированные аксоны, тем не менее, оказываются тоньше обычных. Перехваты Ранвье в регенерированных нервах располагаются ближе друг к другу, что обусловлено пролиферацией шванновских клеток, имеющей место во время нервной регенерации. Эти особенности приводят к снижению скорости распространения импульса по нервному волокну, поскольку она прямо пропорциональна диаметру осевого цилиндра, а также зависит от изолирующих свойств миелиновой оболочки [78].
В случае частичной денервации, сохранившиеся двигательные аксоны выпускают отростки и устанавливают синаптические связи с денервированными мышечными волокнами. Это явление называется коллатеральной реиннервацией или коллатеральным спраутингом или локальным спраутингом. Отмечается, что явление коллатерального спраутинга свидетельствует об обмене информацией между нейронами: сигнал о выпадении функции аксона и непоступлении через него трофических факторов с иннервированной структуры передается соседним нейронам и стимулирует рост аксона [34].
Следует учитывать, что аксональная регенерация и коллатеральная реиннервация не являются взаимоисключающими друг друга восстановительными процессами. Наоборот, они протекают одновременно при любом обратимом нервно-мышечном расстройстве, характеризующимся неполной мышечной денервацией [7].
В заключении следует отметить, что имеющийся в литературе материал, посвященный вопросу пластичности элементов нервной системы, не исчерпывается представленными сведениями. Однако была предпринята попытка обсудить некоторые аспекты в рамках рассматриваемой темы. В целом, представленные результаты научно-исследовательской работы многих специалистов с применением молекулярно-биологических методов исследования, совмещенных с методами классической и клеточной физиологии свидетельствуют о том, что концепция нейропластичности имеет важное значение для понимания закономерностей протекания различных процессов (физиологических, патологических) в нервной системе, как в центральных, так и периферических ее отделах. В данном направлении проводятся активные исследования, касающиеся изучения влияния эндогенных и экзогенных факторов. При этом одной из задач, которую ставят перед собой как нейрофизиологи, так и клиницисты является выявление способов повышения нейрональной и глиальной активности, увеличения продолжительности жизни нервной клетки, стимулирования аксонального роста и развития новых межнейрональных связей.
Читайте также
-
Психоневрологические расстройства и качество жизни больных остеохондрозом позвоночника
- Ланская О.В.
-
Уровень физического развития детей младшего школьного возраста с нарушением зрения
- Ланская О.В.
- Рощина Л.В.
-
Нейропластичность как основа восстановления после инсульта и двигательная реабилитация постинсультных больных
- Ланская О.В.
-
Психофизиологические особенности представителей различных видов спорта
- Ланская О.В.
-
Изменение иммунорезистентного профиля у баскетболистов в течение годичного тренировочно-соревновательного цикла
- Ланская О.В.
Список литературы
- Боголепов, Н.Н. Закономерности реализации механизмов синаптогенеза в коре большого мозга взрослых крыс после кратковременной тотальной остановки системного кровотока / Н.Н. Боголепов, В.В. Семченко, С.С. Степанов // Структурно-функциональные и нейрохимические закономерности асимметрии и пластичности мозга. — М., 2005. — 51-54.
- Manto, M. Modulation of excitability as an early change leading to structural adaptation in the motor cortex / M. Manto, N. Oulad ben Taib, A.R. Luft // J. Neuro. Sci. Res. — 2006. — № 83(2). – Р. 177-180.
- Семченко, В.В. Синаптическая пластичность головного мозга (фундаментальные и прикладные аспекты) / В.В. Семченко, С.С. Степанов, Н.Н. Боголепов. — Омск, 2008. –408 с.
- Fortune, E.S. Short-term synaptic plasticity as a temporal filter / E.S. Fortune, G.J. Rose // Trends Neurosci. 2001. — V. 24. — P. 381-385.
- Зефиров, А.Л. Синаптическая пластичность как основа когнитивной функции нервной системы / А.Л. Зефиров // Материалы 1-й Российской конференции по когнитивной науке, Казань, 9-12 октября 2004. – С. 94-96.
- Тупякова, О.В. Модуляция двигательных рефлексов при компрессии пояснично-крестцовых спинномозговых корешков и сопутствующие изменения электролитов сыворотки крови: автореф. дисс. … канд. биол. наук. – Ульяновск, 2008. – 21 с.
- Тупякова, О.В. Модуляция двигательных рефлексов при компрессии пояснично-крестцовых спинномозговых корешков и сопутствующие изменения электролитов сыворотки крови: дисс. … канд. биол. наук. – Великие Луки, 2008. – 126 с.
- Beutner, D. Calcium dependence of exocytosis and endocytosis at the cochlear inner hair cell afferent synapse / D. Beutner, T. Voets, E. Neher, T. Moser // Neuron. — 2001. — V. 29. — P. 681-690.
- Liang, H. Unified mechanisms of Ca2+ regulation across the Ca2+ channel family / H. Liang, C.D. DeMaria, M.G. Erickson et al. // Neuron. — 2003. — V. 39. — P. 951-960.
- Алтынбаев, Р.Ш. Молчащие синапсы: роль в синаптической пластичности / Р.Ш. Алтынбаев, А.С. Хахалин, М.Г. Шерозия, Л.Л. Воронин // Рос. физиол. журн. им. И.М. Сеченова. – 2004. – Т. 90. — №8. – С. 228.
- Wong, M.Y. Presynaptic Ryanodine Receptor-CamKII Signaling is Required for Activity-dependent Capture of Transiting Vesicles / M.Y. Wong, D. Shakiiyanova, E.S. Levitan // J Mol Neurosci. – 2009. — V. 37. — P. 146-150.
- Брежестовский, П.Д. Физиология синапса: от молекулярных модулей до ретроградной модуляции / П.Д. Брежестовский // Российский физиологический журнал. — 2010. — N 9. — С.841-860.
- Krucker, T. Dynamic actin filaments are required for stable long-term potentiation (LTP) in area CA1 of the hippocampus / T. Krucker, G.R. Sigging, S. Halpain // Proc. Natl. Acad. Sci. USA, 2000. – V. 97. – P. 6856-6861.
- Behnisch, T. Imaging of gene expression during long-term potentiation / T. Behnisch, S. Matsushita, T. Knopfel // Neuroreport. – 2004. – V. 15. – P. 2039-2043.
- Иоффе, М.Е. Пластичность двигательных структур мозга и двигательное обучение / М.Е. Иоффе // Физиология мышц и мышечной деятельности. Материалы III Всероссийской школы-конференции. – М., ФФМ МГУ, 2005. – С. 48.
- Shakesby, A.C. Overcoming the effects of stress on synaptic plasticity in the intact hippocampus: rapid actions of serotonergic and antide pressant agents / A.C. Shakesby et al. // J. Neurosci. — 2002. — № 22. – Р. 3638-3644.
- Алексанян, З.А. Изометрическое усилие как индикатор пластических перестроек в центральной нервной системе под действием лекарственной терапии / З.А. Алексанян, Е.Б. Лысков, С.П. Романов // Фундаментальные и клинические аспекты интегративной деятельности мозга. Материалы международных чтений, посвященных 100-летию со дня рождения члена-корреспондента АН СССР, академика АН АрмСССР Э.А. Асратяна. – Издательство ООО «МАКС Пресс», 2003. — С. 35-38.
- Базиян, Б.Х. Исследование координации движений глаз и руки в норме и при болезни Паркинсона / Б.Х. Базиян, Е.Л. Казакова // Фундаментальные и клинические аспекты интегративной деятельности мозга. Материалы международных чтений, посвященных 100-летию со дня рождения члена-корреспондента АН СССР, академика АН АрмСССР Э.А. Асратяна. – Издательство ООО «МАКС Пресс», 2003. — С. 50-52.
- Tillerson, J.L. Forced limb-use and recovery following brain injury / J.L. Tillerson, G.W. Miller // Neuroscientist. 2002; 8: 574-585.
- Wei, L. Collateral growth and angiogenesis around cortical stroke / L. Wei, J.P. Erinjeri, C.M. Rovainen, T.A. Woolsey // Stroke. 2001; 32: 2179-2184.
- Dobretsov, M.G. The formation of nerve endings in the phasic muscles of the frog / M.G. Dobretsov, A.L. Zefirov, R.S. Kurtasanov, I.A. Khalilov, I.M. Vinogradova // Neirofiziologiia. — 1990;22(1): 99-107.
- Tremblay, Y. Regulation of the gene for estrogenic 17-ketosteroid reductase lying on chromosome 17cen-q25 / Y. Tremblay, G.E. Ringler, Y. Morel, T.K. Mohandas, F. Labrie, J.F. Strauss, W.L. Miller // J. Biol Chem. — 1989 Dec 5;264(34):20458-62.
- Tabuchi, M. Histochemistry of acetylcholine receptors and acetylcholinesterase during the formation of neuromuscular junction in the urodele Hynoblus nigrescens / M. Tabuchi, K. Fujikura, S. Inone // J.Morphol. — 1991. — V.207, №1. – Р. 1-8.
- Koizumi, S. Characterization of elementary Ca2+ release signals in NGF-differentiated PC 12 cells and hippocampal neurons / S. Koizumi, and others // Neuron. — 1999. — V. 22. — №1. — Р. 125-137.
- Зефиров, А.Л. Молекулярные механизмы квантовойсекреции медиатора в синапсе / А.Л. Зефиров, С.Ю. Черанов // Успехи физиол. наук. — 2000. — Т.31. — № 3. — С. 3-22.
- Огнетов, С.Ю. Нейромышечный синапс: органная характеристика, возрастные преобразования / С.Ю. Огнетов, Н.Е. Сабельников, В.М. Чучков. — Ижевск, 2002. – 163 с.
- Ардашев, А.Е. Возрастная динамика двигательных окончаний некоторых мышц головы и шеи в условиях дефицита симпатической иннервации: Автореф. дис. канд. мед. наук. — Уфа, 2002. — 22с.
- Burden, S.J. Building the vertebrate neuromuscular synapse / S.J. Burden // J. Neurobiol. — 2002. — V. 53 (4). — P. 501-511.
- Lomo, T. What controls the position, number, size, and distribution of neuromuscular junctions on rat muscle fibers? Review / T. Lomo // J. Neurocytol. — 2003. — V. 32 (5-8). — P. 835-848.
- Santafe, M.M. Protein kinase C activity affects neurotransmitter release at polyinnervated neuromuscular synapses / M.M. Santafe, N. Garcia, M.A. Lanuza, J. Tomas // J. Neurosci Res. – 2007. — V. 85. — P. 1449-1457.
- Дамянович, Е.В. Компенсаторные изменения мозга человека при повреждении проводящих путей кожно-двигательного анализатора / Е.В. Дамянович, Т.В. Орлова // Росс. физиол. журн. им. И.И. Сеченова. — Т. 90, №8. – СПб, 2004. – С. 204.
- Ланская Е.В. Структурно-функциональная организация кортико-спинального тракта и его роль в регуляции движений (научный обзор) // NovaInfo.Ru (Электронный журнал.) – 2016 г. – Том 1, № 56. – С. 20-29; URL: http://novainfo.ru/article/9119
- Ланская, О.В. Нейрофизиологические механизмы функциональной пластичности спинальных систем двигательного контроля: автореф. дисс. … д-ра биол. наук. – Москва, 2014. – 50 с.
- Ланская, О.В. Нейрофизиологические механизмы функциональной пластичности спинальных систем двигательного контроля: дисс. … д-ра биол. наук. – Великие Луки, 2014. – 388 с. (с приложениями).
- Ланская О.В., Андриянова Е.Ю. Физиологические механизмы функциональной пластичности спинальных систем двигательного контроля при занятиях спортом: Монография. – Великие Луки, 2013. – 268 с.
- Ланская О.В. Возрастные особенности изменений двигательных рефлексов мышц нижних конечностей человека // Альманах «Новые исследования». – 2011. — № 1 (26). – С. 15-21.
- Ланская О.В., Андриянова Е.Ю. Исследование спинально-моторных проекций мышц нижних конечностей под влиянием долговременной адаптации к спортивной деятельности // Лечебная физкультура и спортивная медицина. – 2011. — №6. – С. 34-39.
- Ланская О.В., Андриянова Е.Ю. Электронейромиографическая пластичность спинальных систем двигательного контроля при занятиях различными видами спорта // Лечебная физкультура и спортивная медицина. – 2012. — №11(107). – С. 16-23.
- Ланская О.В., Андриянова Е.Ю. Изучение билатеральных моносинаптических рефлексов мышц верхних и нижних конечностей у представителей циклического и игрового видов спорта // Альманах «Новые исследования». – 2012. — №4 (33). – С. 5-12.
- Андриянова Е.Ю., Ланская О.В. Механизмы двигательной пластичности спинномозговых нервных цепей на фоне долговременной адаптации к спортивной деятельности // Физиология человека. – 2014. – Т. 40, №3. – С. 73-85.
- Ланская О.В., Андриянова Е.Ю. Выявление признаков пластичности спинально-мотонейронных пулов мышц верхних и нижних конечностей у представителей различных видов спорта // Ульяновский медико-биологический журнал. – 2014. — №3. – С. 106-113.
- Ланская, О.В. Мультисегментарные ответы мышц нижних конечностей у представителей спортивных игр с различным функциональным статусом опорно-двигательного аппарата / О.В. Ланская // Лечебная физкультура и спортивная медицина. – 2014. — №6(126). – С. 42-47.
- Ланская О.В., Андриянова Е.Ю., Ланская Е.В. Двигательная пластичность спинного мозга при занятиях различными видами спорта // Наука и спорт: современные тенденции. – 2015. — №2 (Том 7). – С. 64-70.
- Ланская, О.В. Пластичность шейных и пояснично-крестцовых спинальных нейрональных сетей двигательного контроля при занятиях спортом / О.В. Ланская, Е.Ю. Андриянова, Е.В. Ланская // Теория и практика физической культуры. – 2015. — №6. – С. 14-16.
- Ланская, Е.В. Функциональное состояние центральных и периферических звеньев нейромоторной системы у спортсменов, адаптированных к нагрузкам разной направленности / Е.В. Ланская, О.В. Ланская, Д.А. Гладченко // Ежемесячный научный журнал «Международный научный институт «Educatio». – 2015. — №4(11). – С. 127-129.
- Ланская, Е.В. Пластичность спинальных и соответствующих нервно-мышечных структур под влиянием долговременной спортивной деятельности разной направленности / Е.В. Ланская, О.В. Ланская // Лечебная физкультура и спортивная медицина. – 2015. — №5(131). – С. 22-26.
- Ланская, Е.В. Физиологические механизмы пластичности центральных и периферических звеньев нейромоторной системы как результат адаптации к повышенной активности скелетных мышц / Е.В. Ланская, О.В. Ланская, Е.Ю. Андриянова // Вестник Санкт-Петербургского университета. Серия 3. Биология. – 2015. — Выпуск 4. – С. 79-92.
- Lanskaya O.V., Andriyanova E.Yu. Electrophysiological Mechanisms of the Plasticity of the Spinal Systems in Musculoskeletal System Dysfunctions // Neuroscience and Behavioral Physiology. — 2015, November. — Volume 45, Issue 9. – Р. 1010-1018.
- Изучение уровня возбудимости кортико-спинальных и нервно-мышечных структур у представителей различных видов спорта / О.В. Ланская, Е.В. Ланская, Е.Ю. Андриянова // Ульяновский медико-биологический журнал. – 2015. — № 3. – С. 101-107.
- Ланская, Е.В. Механизмы нейропластичности кортико-спинального тракта при занятиях спортом / Е.В. Ланская, О.В. Ланская, Е.Ю. Андриянова // Ульяновский медико-биологический журнал. – 2016. — №1. – С. 127-136.
- Ланская Е.В., Ланская О.В. ИЗУЧЕНИЕ ЭЛЕКТРОНЕЙРОМИОГРАФИЧЕСКИХ ПАРАМЕТРОВ ВЫЗВАННЫХ ПОТЕНЦИАЛОВ МЫШЦ ВЕРХНИХ И НИЖНИХ КОНЕЧНОСТЕЙ У ПРЕДСТАВИТЕЛЕЙ ВИДОВ СПОРТА С БЛИЗКОЙ ПО СТРУКТУРЕ ДВИГАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТЬЮ // NovaInfo.Ru (Электронный журнал.) – 2016 г. – № 56, том 1. – С. 8-14; URL: http://novainfo.ru/article/9100
- Ланская О.В. ОСОБЕННОСТИ НЕЙРОДИНАМИЧЕСКИХ СВОЙСТВ И КАЧЕСТВА ЖИЗНИ СПОРТСМЕНОВ С ТРАВМАМИ И ПОСТТРАВМАТИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ОПОРНО-ДВИГАТЕЛЬНОГО АППАРАТА // NovaInfo.Ru (Электронный журнал.) – 2016 г. – № 56, том 2. — С. 11-24; URL: http://novainfo.ru/article/9159
- Ланская О.В., Сазонова Л.А. КОМПЛЕКСНАЯ ОЦЕНКА ЭФФЕКТИВНОСТИ АДАПТИВНО-ФИЗИЧЕСКОЙ РЕАБИЛИТАЦИИ СПОРТСМЕНОВ ПОСЛЕ ТРАВМ СУСТАВОВ НИЖНИХ КОНЕЧНОСТЕЙ // NovaInfo.Ru (Электронный журнал.) – 2016 г. – № 56, том 3. — С. 38-51; URL: http://novainfo.ru/article/9301
- Muresanu, D.F. Neurotrophic factors — from bed to bench in dementia treatment; a short overview of some original data / D.F. Muresanu // Second joint congress of GCNN and SSNN. — 2009. – Р. 96.
- Rocamora, N. Upregulation of BDNF mRNA expression in the barrel cortex of adult mice after sensory stimulation / N. Rocamora, E. Welker, M. Pascual, E. Soriano // J Neurosci 1996; 16: 4411-4419.
- Bajetto, А. Characterization of chemokines and their receptors in the central nervous system: physiopathological implications / А. Bajetto, R. Bonavia, S. Barbero, G. Schettini // J Neurochem 2002; 102: 82: 6: 1311-1320.
- Pascual-Leone, A. Modulation of muscle responses evoked by transkranial magnetic stimulation during the acquisition of new fine motor skills / A. Pascual-Leone, D. Nguyet, L.G. Cohen, J.P. Brasil-Neto, A. Cammarota, M. Hallet / J. Neurophysiol. 1995; 74: 1037-1045.
- Elbert, T. Increased cortical representation of the fingers of the left hand in string players / T. Elbert, C. Pantev, C. Wienbruch et al. // Science 1995; 270: 305-307.
- Pascual-Leone, A. Modulation of cortical motor output maps during development of implicit and explicit knowledge / A. Pascual-Leone, J. Grafman, M. Hallett // Science 1994; 263: 1287-1289.
- Pearce, A.J. Functional reorganization of the corticomotor projection to the hand in skilled racquet players / A.J. Pearce, G.W. Thickbroom, M.L. Byrnes [et al.] // Exp. Brain Res. 2000; 130(2): 238-243.
- Liepert, J. Treatment-induced cortical reorganization after stroke in humans / J. Liepert, H. Bauder, H.R. Wolfgang // Stroke 2000; 31(6): 1210-1216.
- Вольнова, А.Б. Корковое управление движениями и его пластические изменения у взрослых и развивающихся белых крыс: … д-ра биол. наук / А.Б. Вольнова. – Санкт-Петербург, 2003. – 382 с.
- Балтина, Т.В. Возбудимость импульсирующего мотонейрона при различных изменениях афферентного притока / Т.В. Балтина // Системные и клеточные механизмы в физиологии двигательной системы. Материалы VI Всероссийской с международным участием школы-конференции по физиологии мышц и мышечной деятельности. Москва, 1-4 февраля 2011 г. – М.: Графика-Сервис, 2011. – С. 46.
- Farkas, S. Participation of NMDA and non-NMDA excitatory amino acid receptors in the mediation of spinal reflex potentials in rats: an in vivo study / S. Farkas, H. Ono // British Journal of Pharmacology.1995;114(6):1193–1205.
- Fields, R.D. Calcium, network activity, and the role of NMDA channels in synaptic plasticity in vitro / R.D. Fields, C. Yu, P.G. Nelson // Journal of Neuroscience. 1991;11(1):134–146.
- Laughlin, T.M. Spinally administered dynorphin A produces long-lasting allodynia: involvement of NMDA but not opioid receptors / T.M. Laughlin, T.W. Vanderah et al. // Pain. 1997;72(1-2):253–260.
- Ланская О.В., Андриянова Е.Ю. Исследование особенностей моторной организации мышц голени у спортсменов c травматическими повреждениями коленного сустава // Лечебная физкультура и спортивная медицина. – 2012. — №1(97). – С. 19-23.
- Ланская О.В., Андриянова Е.Ю. Изучение параметров моносинаптического тестирования двигательных рефлексов на фоне остеохондроза позвоночника и травматических нарушений функции коленного сустава // Вестник Санкт-Петербургского государственного университета. – Серия 11 (Медицина). – Выпуск 4. – 2012. – С. 89-98.
- Ланская О.В., Андриянова Е.Ю. Электрофизиологические механизмы пластичности спинальных систем при дисфункциях опорно-двигательной системы // Российский физиологический журнал им. И.М. Сеченова. – 2014. – Т. 100, №4. – С. 487-502.
- Григорьев, А.И. Скелетная мышца в безопорном мире / А.И. Григорьев, Б.С. Шенкман // Вестник РАН. – 2008. – Т. 78(4). – С. 337-345.
- Чухарева, Н.А. Электромиографические корреляты реактивности и пластичности центральных и периферических нейромоторных структур у лиц с последствиями позвоночно-спинномозговой травмы: дис. … кандидата биол. наук / Н.А. Чухарева. – Челябинск, 2007. – 180 с.
- Павлова, Н.В. Морфо-функциональное исследование роли афферентов задних конечностей в восстановлении локомоции на модели спинальных крыс / Н.В. Павлова, Н.В. Зеленкова, Т.Р. Мошонкина, Ю.П. Герасименко // Системные и клеточные механизмы в физиологии двигательной системы. Материалы VI Всероссийской с международным участием школы-конференции по физиологии мышц и мышечной деятельности. Москва, 1-4 февраля 2011 г. – М.: Графика-Сервис, 2011. – С. 63.
- Pascual-Leone, A. The plastic human brain cortex // A. Pascual-Leone, A. Amedi, F. Fregni, L.B. Merabet // Annu Rev Neurosci 28: 377–401, 2005.
- Edgerton, V.R. Plasticity of the spinal neural circuitry after injury / V.R. Edgerton, N.J. Tillakaratne, A.J. Bigbee et al. // Annu Rev Neurosci. 2004;27:145–67.
- Zai, L.J. Cell proliferation and replacement following contusive spinal cord injury / L.J. Zai, J.R. Wrathall // Glia.2005;50(3):247–57.
- Исламов, Р.Р. Роль экстрапирамидной системы в регуляции фенотипа скелетных мышц / Р.Р. Исламов, В.В. Валиуллин // Физиология мышц и мышечной деятельности. Материалы III Всероссийской школы-конференции. – М., ФФМ МГУ, 2005. – С. 18.
- Еремеев, А.А. Влияние механического повреждения седалищного нерва на нейро-моторный аппарат парных трехглавых мышц голени крысы: дисс. … канд. биол. наук / А.А. Еремеев. – Казань, 2002. – 143 с.
- Мак Комас, А.Дж. Скелетные мышцы / А. Дж. Мак Комас. – Киев: Олимпийская литература, 2001. – 406 с.
Цитировать
Ланская, О.В. Синаптическая и нейрональная пластичность при различных функциональных состояниях нервной системы / О.В. Ланская. — Текст : электронный // NovaInfo, 2016. — № 57. — С. 35-52. — URL: https://novainfo.ru/article/9730 (дата обращения: 06.04.2023).