From Wikipedia, the free encyclopedia
In neuroscience, nerve conduction velocity (CV) is the speed at which an electrochemical impulse propagates down a neural pathway. Conduction velocities are affected by a wide array of factors, which include age, sex, and various medical conditions. Studies allow for better diagnoses of various neuropathies, especially demyelinating diseases as these conditions result in reduced or non-existent conduction velocities. CV is an important aspect of nerve conduction studies.
Normal conduction velocities[edit]
Ultimately, conduction velocities are specific to each individual and depend largely on an axon’s diameter and the degree to which that axon is myelinated, but the majority of ‘normal’ individuals fall within defined ranges.[1]
Nerve impulses are extremely slow compared to the speed of electricity, where the electric field can propagate with a speed on the order of 50–99% of the speed of light; however, it is very fast compared to the speed of blood flow, with some myelinated neurons conducting at speeds up to 120 m/s (432 km/h or 275 mph).
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated muscle fibers |
|---|---|---|---|---|---|
| α | Aα | 13–20 μm | Yes | 50-60 m/s[2][3] | Extrafusal muscle fibers |
| γ | Aγ | 5–8 μm | Yes | 4–24 m/s [4][5] | Intrafusal muscle fibers |
Different sensory receptors are innervated by different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers, and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated sensory receptors |
|---|---|---|---|---|---|
| Ia | Aα | 13–20 μm | Yes | 80–120 m/s[6] | Responsible for proprioception |
| Ib | Aα | 13–20 μm | Yes | 80–120 m/s | Golgi tendon organ |
| II | Aβ | 6–12 μm | Yes | 33–75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1–5 μm | Thin | 3–30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2–1.5 μm | No | 0.5–2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 μm | Yes | 3–15 m/s |
| postganglionic fibers | C | 0.2–1.5 μm | No | 0.5–2.0 m/s |
| Nerve | Conduction velocity[2][3] |
|---|---|
| Median sensory | 45–70 m/s |
| Median motor | 49–64 m/s |
| Ulnar sensory | 48–74 m/s |
| Ulnar motor | 49+ m/s |
| Peroneal motor | 44+ m/s |
| Tibial motor | 41+ m/s |
| Sural sensory | 46–64 m/s |
Normal impulses in peripheral nerves of the legs travel at 40–45 m/s, and those in peripheral nerves of the arms at 50–65 m/s.[7]
Largely generalized, normal conduction velocities for any given nerve will be in the range of 50–60 m/s.[8]
Testing methods[edit]
Nerve conduction studies[edit]
Nerve conduction velocity is just one of many measurements commonly made during a nerve conduction study (NCS). The purpose of these studies is to determine whether nerve damage is present and how severe that damage may be.
Nerve conduction studies are performed as follows:[8]
- Two electrodes are attached to the subject’s skin over the nerve being tested.
- Electrical impulses are sent through one electrode to stimulate the nerve.
- The second electrode records the impulse sent through the nerve as a result of stimulation.
- The time difference between stimulation from the first electrode and pick-up by the downstream electrode is known as the latency. Nerve conduction latencies are typically on the order of milliseconds.
Although conduction velocity itself is not directly measured, calculating conduction velocities from NCS measurements is trivial. The distance between the stimulating and receiving electrodes is divided by the impulse latency, resulting in conduction velocity.
NCV = conduction distance / (proximal latency-distal latency)
Many times, Needle EMG is also performed on subjects at the same time as other NCS procedures because they aid in detecting whether muscles are functioning properly in response to stimuli sent via their connecting nerves.[8] EMG is the most important component of electrodiagnosis of motor neuron diseases as it often leads to the identification of motor neuron involvement before clinical evidence can be seen.[9]
Micromachined 3D electrode arrays[edit]
Typically, the electrodes used in an EMG are stuck to the skin over a thin layer of gel/paste.[8] This allows for better conduction between electrode and skin. However, as these electrodes do not pierce the skin, there are impedances that result in erroneous readings, high noise levels, and low spatial resolution in readings.[10]
To address these problems, new devices are being developed, such as 3-dimensional electrode arrays. These are MEMS devices that consist of arrays of metal micro-towers capable of penetrating the outer layers of skin, thus reducing impedance.[10]
Compared with traditional wet electrodes, multi-electrode arrays offer the following:[10]
- Electrodes are about 1/10 the size of standard wet surface electrodes
- Arrays of electrodes can be created and scaled to cover areas of almost any size
- Reduced impedance
- Improved signal power
- Higher amplitude signals
- Allow better real-time nerve impulse tracking
Causes of conduction velocity deviations[edit]
Anthropometric and other individualized factors[edit]
Baseline nerve conduction measurements are different for everyone, as they are dependent upon the individual’s age, sex, local temperatures, and other anthropometric factors such as hand size and height.[2][11] It is important to understand the effect of these various factors on the normal values for nerve conduction measurements to aid in identifying abnormal nerve conduction study results. The ability to predict normal values in the context of an individual’s anthropometric characteristics increases the sensitivities and specificities of electrodiagnostic procedures.[2]
Age[edit]
Normal ‘adult’ values for conduction velocities are typically reached by age 4. Conduction velocities in newborns and toddlers tend to be about half the adult values.[1]
Nerve conduction studies performed on healthy adults revealed that age is negatively associated with the sensory amplitude measures of the Median, Ulnar, and Sural nerves. Negative associations were also found between age and the conduction velocities and latencies in the Median sensory, Median motor, and Ulnar sensory nerves. However, conduction velocity of the Sural nerve is not associated with age. In general, conduction velocities in the upper extremities decrease by about 1 m/s for every 10 years of age.[2]
Sex[edit]
Sural nerve conduction amplitude is significantly smaller in females than males, and the latency of impulses is longer in females, thus a slower conduction velocity.[2]
Other nerves have not been shown to exhibit any gender biases.[citation needed]
Temperature[edit]
In general, the conduction velocities of most motor and sensory nerves are positively and linearly associated with body temperature (low temperatures slow nerve conduction velocity and higher temperatures increase conduction velocity).[1]
Conduction velocities in the Sural nerve seem to exhibit an especially strong correlation with the local temperature of the nerve.[2]
Height[edit]
Conduction velocities in both the Median sensory and Ulnar sensory nerves are negatively related to an individual’s height, which likely accounts for the fact that, among most of the adult population, conduction velocities between the wrist and digits of an individual’s hand decrease by 0.5 m/s for each inch increase in height.[2] As a direct consequence, impulse latencies within the Median, Ulnar, and Sural nerves increases with height.[2]
The correlation between height and the amplitude of impulses in the sensory nerves is negative.[2]
Hand factors[edit]
Circumference of the index finger appears to be negatively associated with conduction amplitudes in the Median and Ulnar nerves. In addition, people with larger wrist ratios (anterior-posterior diameter : medial-lateral diameter) have lower Median nerve latencies and faster conduction velocities.[2]
Medical conditions[edit]
Myasthenia gravis[edit]
Amyotrophic lateral sclerosis (ALS)[edit]
Amyotrophic lateral sclerosis is a progressive and inevitably fatal neurodegenerative disease affecting the motor neurons.[9] Because ALS shares many symptoms with other neurodegenerative diseases, it can be difficult to diagnose properly. The best method of establishing a confident diagnosis is via electrodiagnostic evaluation. To be specific, motor nerve conduction studies of the Median, Ulnar, and peroneal muscles should be performed, as well as sensory nerve conduction studies of the Ulnar and Sural nerves.[9]
In patients with ALS, it has been shown that distal motor latencies and slowing of conduction velocity worsened as the severity of their muscle weakness increased. Both symptoms are consistent with the axonal degeneration occurring in ALS patients.[9]
Carpal tunnel syndrome[edit]
Carpal tunnel syndrome (CTS) is a form of nerve compression syndrome caused by the compression of the median nerve at the wrist. Typical symptoms include numbness, tingling, burning pains, or weakness in the hand.[12][13] CTS is another condition for which electrodiagnostic testing is valuable.[12][14] However, before subjecting a patient to nerve conduction studies, both Tinel’s test and Phalen’s test should be performed. If both results are negative, it is very unlikely that the patient has CTS, and further testing is unnecessary.[13]
Carpal tunnel syndrome presents in each individual to different extents. Measurements of nerve conduction velocity are critical to determining the degree of severity.[14][15]
These levels of severity are categorized as:[12][13]
- Mild CTS: Prolonged sensory latencies, very slight decrease in conduction velocity. No suspected axonal degeneration.
- Moderate CTS: Abnormal sensory conduction velocities and reduced motor conduction velocities. No suspected axonal degeneration.
- Severe CTS: Absence of sensory responses and prolonged motor latencies (reduced motor conduction velocities).
- Extreme CTS: Absence of both sensory and motor responses.
One common electrodiagnostic measurement includes the difference between sensory nerve conduction velocities in the pinkie finger and index finger. In most instances of CTS, symptoms will not present until this difference is greater than 8 m/s.[12][13]
Guillain–Barré syndrome[edit]
Guillain–Barré syndrome (GBS) is a peripheral neuropathy involving the degeneration of myelin sheathing and/or nerves that innervate the head, body, and limbs.[7] This degeneration is due to an autoimmune response typically initiated by various infections.
Two primary classifications exist: demyelinating (Schwann cell damage) and axonal (direct nerve fiber damage).[7][16] Each of these then branches into additional sub-classifications depending on the exact manifestation. In all cases, however, the condition results in weakness or paralysis of limbs, the potentially fatal paralysis of respiratory muscles, or a combination of these effects.[7]
The disease can progress very rapidly once symptoms present (severe damage can occur within as little as a day).[7] Because electrodiagnosis is one of the fastest and most direct methods of determining the presence of the illness and its proper classification, nerve conduction studies are extremely important.[16] Without proper electrodiagnostic assessment, GBS is commonly misdiagnosed as polio, West Nile virus, tick paralysis, various toxic neuropathies, CIDP, transverse myelitis, or hysterical paralysis.[7] Two sets of nerve conduction studies should allow for proper diagnosis of Guillain–Barré syndrome. It is recommended that these be performed within the first 2 weeks of symptom presentation and again sometime between 3 and 8 weeks.[16]
Electrodiagnostic findings that may implicate GBS include:[3][7][16]
- Complete conduction blocks
- Abnormal or absent F waves
- Attenuated compound muscle action potential amplitudes
- Prolonged motor neuron latencies
- Severely slowed conduction velocities (sometimes below 20 m/s)
Lambert–Eaton myasthenic syndrome[edit]
Lambert–Eaton myasthenic syndrome (LEMS) is an autoimmune disease in which auto-antibodies are directed against voltage-gated calcium channels at presynaptic nerve terminals. Here, the antibodies inhibit the release of neurotransmitters, resulting in muscle weakness and autonomic dysfunctions.[17]
Nerve conduction studies performed on the Ulnar motor and sensory, Median motor and sensory, Tibial motor, and Peroneal motor nerves in patients with LEMS have shown that the conduction velocity across these nerves is actually normal. However, the amplitudes of the compound motor action potentials may be reduced by up to 55%, and the duration of these action potentials decreased by up to 47%.[17]
Peripheral diabetic neuropathy[edit]
At least half the population with diabetes mellitus is also affected with diabetic neuropathy, causing numbness and weakness in the peripheral limbs.[18] Studies have shown that the Rho/Rho-kinase signaling pathway is more active in individuals with diabetes and that this signaling activity occurs mainly in the nodes of Ranvier and Schmidt-Lanterman incisures.[18] Therefore, over-activity of the Rho/Rho-kinase signaling pathway may inhibit nerve conduction.
Motor nerve conduction velocity studies revealed that conductance in diabetic rats was about 30% lower than that of the non-diabetic control group. In addition, activity along the Schmidt-Lanterman incisures was non-continuous and non-linear in the diabetic group, but linear and continuous in the control. These deficiencies were eliminated after the administration of Fasudil to the diabetic group, implying that it may be a potential treatment.[18]
See also[edit]
- Nerve conduction study
- Electrodiagnosis
- Electromyography
References[edit]
- ^ a b c «Nerve conduction velocity». National Institutes of Health. 31 October 2013. Retrieved 13 November 2013.
- ^ a b c d e f g h i j k Stetson, PhD, Diana S.; James W. Albers; Barbara A. Silverstein; Robert A. Wolfe (October 1992). «Effects of Age, Sex, and Anthropometric Factors on Nerve Conduction Measures» (PDF). Muscle & Nerve. 15 (10): 1095–1104. doi:10.1002/mus.880151007. hdl:2027.42/50152. PMID 1406766. S2CID 9508325.
- ^ a b c Sedano, Maria J.; Canga, Ana; Pablos, Carmen; Polo, Jose M.; Berciano, Jose (31 January 2013). «Muscle MRI in severe Guillain–Barré syndrome with motor nerve inexcitability». Journal of Neurology. 260 (6): 1624–1630. doi:10.1007/s00415-013-6845-y. PMID 23370612. S2CID 9763303.
- ^ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ^ Russell NJ (1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». J Physiol. 298: 347–360. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Siegel, Allan; Sapru, Hreday (2005). Essential Neuroscience. p. 257. ISBN 978-0781750776.
- ^ a b c d e f g Parry, Gareth J. (2007). Guillain–Barré Syndrome. New York, NY: Demos Medical Publishing. pp. 1–9. ISBN 978-1-932603-56-9.
- ^ a b c d «Nerve Conduction Study (NCS)». Johns Hopkins Medicine. Retrieved 17 November 2013.
- ^ a b c d Joyce, Nanette C.; Carter, Gregory T. (May 2013). «Electrodiagnosis in Persons With Amyotrophic Lateral Sclerosis». PM&R. 5 (5, Supplement): S89–S95. doi:10.1016/j.pmrj.2013.03.020. PMC 4590769. PMID 23523708.
- ^ a b c Rajaraman, Swaminathan; Bragg, Julian A.; Ross, James D.; Allen, Mark G. (30 June 2011). «Micromachined three-dimensional electrode arrays for transcutaneous nerve tracking». Journal of Micromechanics and Microengineering. 21 (8): 085014. Bibcode:2011JMiMi..21h5014R. doi:10.1088/0960-1317/21/8/085014. S2CID 53482527.
- ^ Thanakiatpinyo, MD, Thanitta; Gulapar Srisawasdi (2013). «Effect of Hand Size on the Stimulation Intensities Required for Median and Ulnar Sensory Nerve Conduction Studies». Archives of Physical Medicine and Rehabilitation. 94 (5): 925–929. doi:10.1016/j.apmr.2012.11.029. PMID 23201426.
- ^ a b c d Werner, Robert A.; Andary, Michael (October 2011). «Electrodiagnostic evaluation of carpal tunnel syndrome» (PDF). Muscle & Nerve. 44 (4): 597–607. doi:10.1002/mus.22208. hdl:2027.42/87013. PMID 21922474. S2CID 18623599.
- ^ a b c d Ntani, Georgia; Palmer, Keith T.; Linaker, Cathy; Harris, E Clare; Van der Star, Richard; Cooper, Cyrus; Coggon, David (15 August 2013). «Symptoms, signs and nerve conduction velocities in patients with suspected carpal tunnel syndrome». BMC Musculoskeletal Disorders. 14 (1): 242. doi:10.1186/1471-2474-14-242. PMC 3765787. PMID 23947775.
- ^ a b Inukai, Tomoo; Uchida, Kenzo; Kubota, Chikara; Takamura, Takaharu; Nakajima, Hideaki; Baba, Hisatoshi (24 October 2013). «Second lumbrical-interossei nerve test predicts clinical severity and surgical outcome of carpal tunnel syndrome». Journal of Clinical Neuroscience. 20 (9): 1224–1227. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ Robinson, Lawrence, R.; Strakowski, Jeffrey; Kennedy, David J. (May 2013). «Is the Combined Sensory (Robinson) Index Routinely Indicated for All Cases of Suspected Carpal Tunnel Syndrome Undergoing Electrodiagnostic Evaluation?». PM&R. 5 (5): 433–437. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ a b c d Shahrizaila, Nortina; Goh, Khean Jin; Abdullah, Suhailah; Kuppusamy, Rishikesan; Yuki, Nobuhiro (8 February 2013). «Two sets of nerve conduction studies may suffice in reaching a reliable electrodiagnosis in Guillain–Barré syndrome». Clinical Neurophysiology. 124 (7): 1456–1459. doi:10.1016/j.clinph.2012.12.047. PMID 23395599. S2CID 33925550.
- ^ a b Crone, Clarissa; Christiansen, Ingelise; Vissing, John (3 May 2013). «Myopathic EMG findings and type II muscle fiber atrophy in patients with Lambert-Eaton myasthenic syndrome». Clinical Neurophysiology. 124 (9): 1889–1892. doi:10.1016/j.clinph.2013.02.115. PMID 23643575. S2CID 25526831.
- ^ a b c Kanazawa, Yasushi; Junko Takahashi-Fujigasaki; Sho Ishizawa; Naoko Takabayashi; Kumiko Ishibashi; Keiichiro Matoba; Daiji Kawanami; Tamotsu Yokota; Naoko Tajima; Kazunori Utsunomiya (September 2013). «The Rho-kinase inhibitor fasudil restores normal motor nerve conduction velocity in diabetic rats by assuring the proper localization of adhesion-related molecules in myelinating Schwann cells». Experimental Neurology. 247: 438–446. doi:10.1016/j.expneurol.2013.01.012. PMID 23337773. S2CID 3004517.
External links[edit]
- Virtual NCS training and other educational tools Archived 2016-03-12 at the Wayback Machine
Axonal excitability is a general term used to encompass the processes of activation of ion channels and energy-dependent pumps critical for the generation of an action potential and that subsequently restore the local environment such that the axon can maintain impulse conduction.
From: Handbook of Clinical Neurology, 2013
Impulse Conduction: Molecular Perspectives
M.C. Kiernan, in Encyclopedia of the Neurological Sciences (Second Edition), 2014
Fluctuations in Axonal Excitability Associated with Impulse Conduction
Axonal excitability reflects the activity of the previously mentioned ion channels and energy-dependent pumps that are activated during an action potential and then restore excitability so that the axon can maintain an impulse train. Following the conduction of a single action potential, the axon is initially refractory, so that it cannot produce further action potentials regardless of stimulus strength. This refractory period can vary between 0.7 and 4.5 ms and is dependent on fiber size: the smaller the fiber, the longer the duration of refractoriness. The refractory period is followed by a superexcitable phase, characterized by a marked reduction in threshold occurring over a 10–15 ms interval. Finally, the recovery of an axon after activation terminates in a phase of subexcitability, ending at approximately 100 ms. These changes in threshold, referred to as the recovery cycle, are associated with measurable changes in latency. Latency is initially increased during the refractory period, decreased during superexcitability, and increased during the late phase of subexcitability.
The established interpretation of the refractory period is that it results from inactivation of transient Na+ channels. The refractory period is prolonged by cooling due to slowed channel kinetics. It increases with membrane depolarization due to inactivation of Na+ channels and decreases with membrane hyperpolarization because approximately 30% of Na+ channels are inactivated at resting membrane potential. Consequently, the refractory period can be used as an indicator of membrane potential.
The superexcitable period is related to a depolarizing afterpotential, resulting from the capacitative charging of the internode by the action potential, with subsequent discharge occurring through or under the myelin sheath. The superexcitable period changes reciprocally with membrane potential through effects on paranodal K+ channels, decreasing with membrane depolarization and increasing with membrane hyperpolarization. As a result, the superexcitable period reflects the status of the internodal membrane and can also be used as an indicator of membrane potential. The final late subexcitable period reflects a corresponding membrane hyperpolarization and probably results from the activation of a nodal slow K+ conductance.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123851574000609
Peripheral Nerve Disorders
Matthew C. Kiernan, Ryuji Kaji, in Handbook of Clinical Neurology, 2013
Fluctuations in excitability with impulse transmission
Axonal excitability is a general term used to encompass the processes of activation of ion channels and energy-dependent pumps critical for the generation of an action potential and that subsequently restore the local environment such that the axon can maintain impulse conduction. Following transmission of a single nerve impulse, axons are initially refractory, so that no further action potentials can be transmitted (Hodgkin and Huxley, 1952). This refractory period lasts less than 5 ms and is dependent on fiber size, with the smaller the fiber, the longer the duration of refractoriness (Bergmans, 1968; Kimura et al., 1978). The refractory period is followed by a superexcitable phase, characterized by a marked reduction in threshold occurring over a 15 ms interval (Kiernan et al., 1996; Lin et al., 2000). Finally, the recovery of an axon after activation terminates in a phase of subexcitability, ending around 100 ms (Baker et al., 1987).
These changes in threshold, collectively referred to as the recovery cycle of excitability (Fig. 4.2), are associated with measurable changes in latency (Stys and Ashby, 1990). Latency is initially increased during the refractory period, decreases during superexcitability, and finally increases during the late phase of subexcitability.
Fig. 4.2. Stimulus patterns utilized to generate the recovery cycle waveforms, colored to correspond to the relevant points on the recovery cycle curve (left panels). Recovery cycle plot illustrating the relative refractory period, superexcitability, and subexcitability (middle panel), with derived excitability parameters from the recovery cycle listed on the right. The recovery cycle parameters are voltage-sensitive, with the curve shifting upwards with depolarization (depicted in red) and downwards with hyperpolarization (in blue).
In terms of underlying physiological processes, the refractory period results from inactivation of transient Na+ channels (Hodgkin and Huxley, 1952). As such, the refractory period may be prolonged by cooling, due to slowed channel kinetics (Kiernan et al., 2001b). Refractoriness increases with membrane depolarization, due to inactivation of Na+ channels and decreases with membrane hyperpolarization (Kiernan and Bostock, 2000), since approximately 30% of Na+ channels are inactivated at resting membrane potential (Hodgkin and Huxley, 1952; Schwarz et al., 1995). Consequently, the refractory period can be used as an indicator of membrane potential.
The superexcitable (or supernormal) period has been related to a depolarizing after-potential, resulting from the capacitative charging of the internode by the action potential, with subsequent discharge occurring through or under the myelin sheath (Barrett and Barrett, 1982). The superexcitable period changes reciprocally with membrane potential, through effects mediated by paranodal K+ channels, decreasing with membrane depolarization and increasing with membrane hyperpolarization (Kiernan and Bostock, 2000). As a result, the superexcitable period reflects the status of the internodal membrane and can also be used as an indicator of membrane potential. The final late subexcitable period reflects a corresponding membrane hyperpolarization and probably results from activation of nodal slow K+ conductances (Barrett and Barrett, 1982).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444529022000047
Motor Unit Number Estimation (MUNE) and Quantitative EMG
Gerhard H. Visser, Joleen H. Blok, in Supplements to Clinical Neurophysiology, 2009
4.2 Stimulus intensity (SI)
Standard nerve conduction tests at best address axonal excitability globally at the site of stimulation. Yet, it is known that excitability measures may provide diagnostically relevant information (Kiernan et al., 2000; Nodera and Kaji, 2006). Part of this information can be collected with the scan. From each scan, we extracted the following features that are related to excitability:
- •
-
S0: SI marking the low end of the scan, which we defined as the SI at which the scan reaches the predefined, small value of 50 µV.
- •
-
S50: the SI at which the recorded CMAP equals 50% of the maximum CMAP.
- •
-
S100: SI marking the high end of the scan, where it reaches its maximum value or a high percentage of the maximum CMAP (e.g., 99%).
- •
-
S100–S0: SI range (absolute range width).
- •
-
(S100–S0)/S50: a corrected, relative SI range width.
Changes in any of the above measures reflect changes in axonal excitability at the stimulus site. The relative width compensates to some extent for overall shifts in the curve that are due to differences in nerve proximity, conductive properties of the intermediate tissue, or changes in stimulus duration. As such, it reduces the influence of suboptimal stimulation position on the SI range variable.
Finally, in the case of a step that can be ascribed to a contribution of a single MU with reasonable certainty (such as in Fig. 6.2), the excitability properties of this MU can be studied separately. Its so-called recruitment range width is deduced from the SI at which the MU is always active (right end of the step “floor”) minus the SI at which the MU is first activated (the recruitment threshold and left end of the step “ceiling”).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S1567424X08000068
Motor Unit Number Estimation (MUNE) and Quantitative EMG
Lora A. Major, … Kelvin E. Jones, in Supplements to Clinical Neurophysiology, 2009
2.2.4 Manipulation of axon excitability by polarization
To test for the effect of changes in axonal excitability on MUNE, we carried out an additional statistical MUNE protocol, identical to QSM, but with application of 20 ms of ±1 mA constant current preceding each stimulus pulse. The polarizing current was maintained during the stimulus pulse and for 30 ms afterward – a total of 50 ms constant current conditioning per stimulus.
In this QTrac protocol the two MUNE tests were run concurrently, alternating between stimuli using positive (depolarizing) and negative (hyperpolarizing) bias conditions. This interleaved polarization strategy was implemented to circumvent any cumulative effects of the polarizing current on axonal membrane excitability. In the absence of cumulative polarization effects, the effect of each polarization treatment on axon excitability was assumed to be independent of conditioning effects induced previously within the same polarized MUNE test. SR curves were recorded with both positive and negative polarization prior to starting the concurrent polarized MUNE tests.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S1567424X08000020
Contribution of Axons to Short-Term Dynamics of Neuronal Communication
Dirk Bucher, in Axons and Brain Architecture, 2016
12.3 Spike Conduction Velocity and Delay
Before considering the potential impact of changes in axonal excitability on spike propagation, it is important to understand what determines spike velocity and delay. The speed of spike propagation in an axon, i.e., the conduction velocity, depends on the specific properties of the axonal membrane and cytosol, and on the diameter of the axon. These relationships were defined relatively early on (Del Castillo and Moore, 1959; Hodgkin, 1954; Hodgkin and Huxley, 1952a,b; Waxman, 1975). Once a spike is initiated, passive spread of current depolarizes the membrane ahead of the active site. The larger the distance over which this depolarization is sufficient to bring the membrane voltage to threshold, the faster the spike propagates along the axon. This distance is determined by the axon’s passive properties, namely the length constant and time constant (Hodgkin and Rushton, 1946; Rall, 1969). The length constant depends on diameter and specific membrane and axial resistances, and describes the distance over which steady-state voltage changes can spread. The time constant describes how much this change in membrane potential is delayed by the capacitance of the axonal membrane. The latter is important because for fast transient signals it prevents reaching the full voltage change predicted by the length constant, therefore slowing spike propagation.
In unmyelinated axons, propagation is continuous and velocity is essentially limited by the parameters described above. Under the assumption of identical specific membrane and cytosolic properties, conduction velocity in unmyelinated axons is proportional to the square root of the diameter (Hodgkin, 1954). The giant axon of the squid, with a diameter of 1 mm, can propagate spikes at ~25 m/s (Rosenthal and Bezanilla, 2000). Small diameter unmyelinated axons like hippocampal mossy fibers or slow cutaneous C-fibers show conduction velocities far below 1 m/s (Kress et al., 2008; Weidner et al., 1999).
Not only in vertebrates but also in some annelids and crustaceans (Hartline and Colman, 2007; Roots, 2008), many axons projecting over larger distances are myelinated. The mode of spike propagation in myelinated axons is discontinous, which is referred to as saltatory conduction (Huxley and Stampfli, 1949). Voltage-gated channels are mostly restricted to the regions in and directly adjacent to the Nodes of Ranvier (i.e., interruptions in the myelin sheath formed by glia cells tightly wrapped around the axon). The low abundance of ion channels and the myelin sheath of the internodal axon serve to significantly increase electrical resistance and therefore the length constant, and to reduce capacitance and therefore the time constant. Consequently, near-instantaneous passive spread of potentials is substantially increased, and impulses jump from node to node, the only regions where channel gating processes significantly take up time. Under the assumption of otherwise identical properties, conduction velocity in myelinated axons increases linearly with diameter, and for larger diameters is much faster than in unmyelinated axons of the same size. However, conduction velocity in myelinated axons does not just depend on diameter but also on myelin thickness and internodal distances (Waxman, 1980). The largest classes of mammalian peripheral sensory and motor axons reach about 20 μm in diameter and show conduction velocities of 120 m/s (Manzano et al., 2008), similar to those found in some large cortico-spinal axons (Evarts, 1965). Conduction velocity in myelinated axons of shrimp can even reach 200 m/s (Xu and Terakawa, 1999).
Conduction velocity on its own says very little about functional aspects of neuronal communication. What really matters is conduction delay, which of course depends on both spike conduction velocity and axonal length. Very long axons like vertebrate peripheral motor axons, or invertebrate axons involved in escape responses, have evolved to propagate spikes rapidly and minimize delay out of behavioral necessity, either through myelination or large diameters (Hartline and Colman, 2007). However, delay in itself can have important functional implications for neural coding, for example, in the computation of time differences representing spatial information in sensory systems (Konishi, 2003). Both the summation and activity-dependent plasticity of synaptic signals critically depend on spike intervals or synchrony of converging inputs, and are therefore vulnerable to changes in axonal conduction delays (Izhikevich, 2006). In consequence, it is important to note that the changes in axonal excitability discussed in the following only matter in terms of changes to the temporal patterns that they ultimately cause. Even large percentage changes in conduction velocities may have little effect if the average conduction delay is very small. In this sense, one can speculate that the evolution of fast spike propagation should be viewed not only in the context of minimizing delay but also in the context of increasing temporal precision (Wang, 2008).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128013939000128
Katz, Bernard
G.J. Augustine, in Encyclopedia of the Neurological Sciences (Second Edition), 2014
Action Potential Mechanisms
As a student at Hill’s laboratory, Katz began his pursuit of neurophysiology by analyzing axonal excitability in an isolated frog sciatic nerve preparation. His experiments identified two fundamental properties of neuronal excitability: local subthreshold responses that underlie action potential initiation and refractoriness that follows generation of an action potential.
After returning from Australia, Katz resumed his studies of neuronal excitation. One of his most important findings was that action potentials of axons (from crab, in this case) were abolished by removal of external ions. This led to the hypothesis that action potentials are due to changes in membrane ionic permeability. Katz tested this idea by turning to the squid giant axon, which the British neurophysiologists and biophysicists Alan Hodgkin (1914–1998) and Andrew Huxley (1917–2012) had previously demonstrated was an excellent experimental system for direct intracellular measurement of action potential properties. In collaboration with Hodgkin, Katz showed that the amplitude of the action potential overshoot depends on the extracellular sodium concentration. This provided the first evidence that action potentials arise from a selective increase in membrane permeability to sodium, which remains one of the most fundamental insights into how action potentials are generated.
Subsequent work by Katz, in collaboration with Hodgkin and Huxley, demonstrated that the voltage clamp technique could be applied to the squid giant axon to measure voltage-dependent ionic currents. This work yielded the first description of such currents and revealed that membrane depolarization causes the now-familiar pattern of initial inward sodium currents that are followed by outward potassium currents. These initial efforts set the stage for Hodgkin and Huxley to make a detailed analysis of the role of voltage-dependent membrane conductances in action potential generation; this was extremely important work for which Hodgkin and Huxley were awarded the Nobel Prize in Physiology or Medicine in 1963.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123851574009283
Encephalomyelopathies
Eric Lancaster, in The Autoimmune Diseases (Fifth Edition), 2014
Voltage-Gated Potassium Channel Complex (VGKC)
The VGKC contained Kv1.1/Kv1.2, “Kv1,” and regulates, voltage-gated potassium channels, and thus the excitability of neurons, shaping action potential discharge and synaptic transmission, and controlling axonal excitability (Robbins and Tempel, 2012). Kv1 channels are homo- or hetero meric tetramers of α subunits, along with four associated β subunits, allowing for functional diversity. Antibodies to the VGKC complex were first detected in patients with Isaacs’ syndrome, an autoimmune disorder of acquired peripheral nerve hyperexcitability (Hart et al., 1997). Patients with Isaacs’ syndrome have the subacute onset of muscle twitching, cramps, and stiffness, sometimes accompanied by hyperhidrosis, and electrodiagnostic testing showed abnormal spontaneous action potential discharges originating from peripheral nerve axons (Isaacs, 1961, 1967). Some patients were found to have thymomas and some responded to plasmapheresis, suggesting an antibody-mediated pathogenesis (Sinha et al., 1991; Shillito et al., 1995). Due to the resemblance of Isaacs’ syndrome to poisoning with the Kv1 toxin α-dendrotoxin, it seemed plausible that patients might have autoantibodies to the VGKC complex. A test for VGKC complex antibodies was therefore designed based on the ability of patients’ IgG to immunoprecipitate Kv1 channels labeled with 125I-α-dendrotoxin. Over the last 15 years hundreds of patients have been reported with these antibodies (Apiwattanakul et al., 2010; Irani et al., 2010). These patients may have peripheral nerve hyperexcitability, encephalitis, or both encephalitis and peripheral nerve hyperexcitability (Morvan’s syndrome) (Tan et al., 2008). Several other less common clinical accompaniments, such as unexplained epilepsy and pain syndromes, have also been reported.
While the autoantibodies were initially thought to directly target Kv1 subunits (Kleopa et al., 2006), recent work has shown that other members of the VGKC complex are actually the primary autoantigens, such as leucine-rich glioma-inactivated 1 (LGI1) and contactin-associated protein-like 2 (Caspr2) (Irani et al., 2010; Lai et al., 2010). A small fraction of those with anti-VGKC may have autoantibodies that directly target Kv1 subunits. Another small group of patients have antibodies reactive with contactin-2 but, since many also have antibodies to LGI or Caspr2, the clinical significance of this finding is uncertain (Irani et al., 2010). It should be noted that in a considerable fraction of cases with antibodies to the VGKC complex, particularly those with solely peripheral nervous system manifestations, the target autoantigens are unknown. Since the 125I-α-dendrotoxin assay detects most, but not all, patients with LGI1 and Caspr2 antibodies, it is often used as a screening test. Specific detection of LGI1 or Caspr2 antibodies is done with indirect immunofluorescence of sera or CSF against cells transfected to express the proteins.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123849298000575
Effects of subthreshold stimuli on the excitability of axonal membrane
Javier Urriza, in Neurophysiology in Neurosurgery (Second Edition), 2020
8.1 Introduction
The action potential, initiated by the depolarization of the axonal membrane, has classically been described as having periods of both hypo- and hyperexcitability [1–3]. Historically, most investigations related to axonal excitability [4,5] use paired stimuli by first applying a test stimulation pulse (usually of suprathreshold intensity) and then a conditioning stimulus pulse (a percentage of that test stimulus) [6].
Bostock and Trevillion have described that subthreshold or near threshold electrical stimuli applied to a peripheral nerve can cause an increase in axonal excitability [7–9]. This effect is very well known, but it still constitutes the poorly understood phenomenon of the integrative action of peripheral nerve axonal membranes, and its role in the practice of clinical neurophysiology has not been very well explored. This subthreshold superexcitability phenomenon of peripheral nerve axonal membranes was investigated using paired pulse stimuli at different interstimulus intervals (ISIs). Similar results have been shown to occur when applying these stimuli patterns to central nervous system axons in rabbits [10,11]. Interestingly, the effect of superexcitability has a longer lasting effect on the axons of the central nervous system when compared to peripheral nerve fibers.
Bostock has shown that if the conditioning stimulus evokes a response, the stimulation intensity needed by the second stimulus to depolarize the axon again, producing a second response (test stimulus), decreases as much as 28%. Yet, even in the case where the first stimulus does not cause the membrane to depolarize, the stimulation intensity needed to generate an action potential from the second stimuli decreases to around 4%–9% [9]. More research needs to be done focusing on these superexcitability phenomena to better understand its role in intraoperative neuromonitoring (ION), especially the effects of subthreshold short trains of stimuli on membrane excitability.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128150009000083
Neuron–glial interactions and neurotransmitter signaling to cells of the oligodendrocyte lineage
C.L. Call, … D.E. Bergles, in Patterning and Cell Type Specification in the Developing CNS and PNS (Second Edition), 2020
36.7 Conclusions/future directions
Oligodendrocytes serve the critical function of insulating axons to facilitate nerve impulse conduction. However, mounting evidence suggests that they also participate in white matter ionic homeostasis, metabolic support of underlying axons, and control of axonal excitability. This, together with evidence that myelination is plastic and shaped by nerve impulses suggests that mechanisms to sense neuronal activity may be critical for ensuring proper oligodendrocyte, and neuronal circuit, function. Pathological insults that damage white matter can have devastating consequences, highlighting the need to understand the factors that regulate oligodendrocyte generation and myelination during both development and disease.
Neurotransmitter signaling is a particularly intriguing medium for neuron–glial interchange because it could allow glial cells to decode subtly different patterns of neural activity and rapidly adapt their behavior according to the shifting demands of neurons. Oligodendrocyte lineage cells exhibit intimate associations with neurons and express neurotransmitter receptors, yet remarkably little is known about the in vivo role of neurotransmitter signaling to these ubiquitous glial cells in both the healthy brain and in disease states.
OPCs play an indispensable role in developmental oligodendrocyte generation and may support ongoing myelin turnover, and both of these functions could be usefully informed by neuronal activity. However, it is also possible that OPCs carry out additional functions within the CNS. The specificity of OPC synaptic partners, the capacity for dynamic modification of these synapses, and the temporal accuracy afforded by synaptic signaling seem to represent an excessive degree of precision for the task of timing progenitor maturation. Furthermore, the persistence of these progenitors and their synapses throughout the gray and white matter, and their reactivity to injury, raise the possibility that OPCs and their synaptic communication with neurons may be involved in some aspect of brain homeostasis or circuit function. Further in vivo studies will be required to determine what roles OPCs play in the normal CNS.
A wealth of experiments has provided important hypotheses about how neurotransmitter signaling affects oligodendrocyte lineage cells. However, attempts to study these receptors in vivo have been complicated by the fact that neurons express the same receptors, and global pharmacological or genetic manipulations will affect both neurons and glia. Nonetheless, advances in transgenic approaches and transcriptional profiling have yielded new insight into the diverse array of receptors expressed by these cells and improved cell type–specific manipulations that will allow the functions of these signaling pathways to be evaluated in vivo. We can now employ genetic strategies to selectively block glutamatergic and GABAergic neuron–OPC synaptic signaling and determine whether this communication plays a role in oligodendrocyte generation or influences some entirely independent function of OPCs. Genetic strategies that block AMPARs, NMDARs, mGluRs, cholinergic receptors, and purinergic receptors within the oligodendrocyte lineage will help clarify the role that signaling through these receptors plays in guiding the behavior of OPCs and their oligodendrocyte progeny. Finally, optogenetic strategies (Gibson et al., 2014) and transgenic expression of artificial receptors (Mitew et al., 2018) are now being used to drive specific patterns of activity within subsets of neurons in vivo to refine our understanding of how neural activity influences the behavior of oligodendrocyte lineage cells in both health and disease contexts. Given that glioblastoma cells have very similar characteristics to OPCs, insights into signaling mechanisms that inhibit proliferation or induce differentiation might be used to develop therapeutic interventions to prevent tumor growth.
OPCs can be induced to differentiate in the adult CNS, allowing myelin sheaths to be repaired and perhaps also allowing functional plasticity of these circuits. Moreover, recent studies indicate that interneuron axons in the cortex are myelinated, and that many axons are discontinuously myelinated, raising new questions about the mechanisms that mobilize OPCs to allow the creation of such complex myelination patterns. Experiments aimed at preventing myelination of specific subsets of axons, and specific portions of axons, will begin to reveal how circuits utilize myelination of different neuronal subtypes, and determine how circuit function is altered in the context of demyelinating disease.
While we now understand better the origins of OPCs, the factors governing oligodendrocyte lineage progression, and functions of mature oligodendrocytes, many questions remain. How functionally diverse is the OPC population? Is the wide diversity among oligodendrocyte morphologies and physiology due to microenvironmental differences or OPC heterogeneity? Experiments addressing these questions may help explain phenomena such as the highly divergent myelin patterns between different cortical areas, despite the consistent density of OPCs. How do premyelinating oligodendrocytes select axons for myelination? While axon diameter has long been known to influence the probability of myelination, to what extent do other factors such as neurotransmitter signaling, cell surface protein expression, or patterns of activity contribute? Finally, if myelination is a substrate for nervous system plasticity, what feedback mechanisms exist to tune the extent and pattern of myelination to the needs of a particular circuit? Further insight into this question will guide our understanding of how activity-dependent myelination and other functions of OPCs in the adult brain alter neural circuit computations.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128144053000369
Nerve Excitability
Matthew C. Kiernan, Cindy Shin Yi Lin, in Aminoff’s Electrodiagnosis in Clinical Neurology (Sixth Edition), 2012
Threshold and axonal membrane potential
Measurements of peripheral nerve excitability using threshold tracking protocols are sensitive to membrane potential at the site of stimulation and thereby may provide complementary information to conventional nerve conduction studies. With the refinement of threshold tracking techniques and the development of automatic testing protocols, evaluation of axonal excitability has been employed in a number of clinical settings.1,2,12 A set of useful indices of axonal excitability collectively may provide insights into the mechanisms responsible for membrane polarization, ion channel function, and activity of ionic pumps to help understanding of the pathophysiology of human neuropathies. The measurement and implications of these excitability indices are described in detail in the following section.
Although it is not possible to measure membrane potential directly in intact human axons, it is possible to obtain indirect evidence about membrane potential through the identification of coherent changes in a number of excitability indices. In this setting, the stimulus intensity required to produce a compound potential of a fixed size of maximal response may be defined as threshold, as used in the context of nerve excitability studies. Consequently, when the membrane depolarizes, the threshold current required to elicit the target potential decreases, and conversely increases when the membrane hyperpolarizes. Therefore, threshold is often used as a surrogate marker of membrane potential. However, there are circumstances when axonal excitability does not precisely parallel membrane potential and, particularly in these cases, ambiguity may be resolved by measuring other indices of axonal excitability. The measurement of these excitability indices and subsequent interpretation are provided in the following sections.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9781455703081000157
ФИЗИКА ЖИЗНЕННЫХ ПРОЦЕССОВ
АКСОН И НЕРВНЫЙ ИМПУЛЬС
Генерация и распространение нервного импульса в организмах животных, возбуждение нервных и мышечных клеток — важнейшие мембранные явления. Мембранная теория возбуждения была сформулирована Бернштейном еще в 1902 г. [1]. Согласно его теории, возбуждение определяется электрохимическими процессами, локализованными в мембранах нервных и мышечных клеток. Эти процессы сводятся к перемещению малых ионов. Позднее Лазарев опубликовал монографию об ионной природе нервного возбуждения [2]. Исследования, проведенные Ходжки- ном, Катцем, Хаксли, Тасаки и другими учеными [3—6], раскрыли принципиальные механизмы генерации нервного импульса и его распространения (см. также [7—9]).
Нервное возбуждение распространяется по нервным волокнам— аксонам. Принято разделять нервную систему высших организмов на центральную и периферическую. Периферическая система содержит аксоны, служащие для передачи сигналов, а также ганглии вегетативной нервной системы. Аксоны являются коммуникациями для афферентных сообщений от органов чувств, направляемых в центральную систему, и для эфферентных сигналов, направляющихся от центральной системы к мышцам. Аксоны представляют собой отростки центрально расположенных клеток. Нервная система беспозвоночных имеет иное строение, но она также содержит коммуникационные аксоны.
Исследование генерации нервного импульса и его распространения в аксоне — старая и традиционная проблема биофизики/ Уже Гельмгольц измерял скорость распространения нервного возбуждения/В настоящее время решены важные физические задачи, относящиеся к функции аксона. Напротив, современное состояние науки позволяет лишь формально моделировать работу центральной нервной системы и мы еще далеки от понимания физической природы высших ее функций — памяти и мышления.
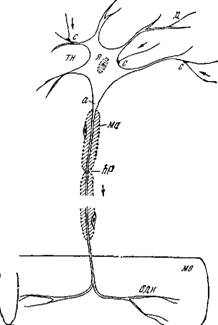
На рис. 4.1, заимствованном из [5], представлена схема строения нервной клетки, именуемой иначе нейроном. Нейрон полу
чает сообщения от многих других нейронов через их тонкие ответвления, образующие контакты — синапсы — с телом клетки и его короткими отростками — дендритами. Аксон имеет макроскопические протяженность и сечение. Длины аксонов в теле крупных животных достигают нескольких метров.
Контакты с другими клетками образуются не только в синапсах.^ Боль — шая часть поверхности нейрона покрыта прилегающими к нему глиальными, или иіванновскими, клетками^ роль которых пока не выяснена. С другой стороны^из мембран шванновских клеток образуется миелиновая оболочка миелинизирован — ных аксонов, показанная ^схематически на рис. 4.1. ^Оболочка прерывается через каждые 1—2 мм длины аксона перехватами Ранвье, имеющими протяженность /Т около 1 мкм. В области перехватов мембрана аксона непосредственно контактирует с окружающей средойЛ^
Немиелинизированные во — ЛОКНа могут быть объеди — Рис. 4.1. Схема строения нервной клетки нены одной шванновской (двигательный нейрон).
К-ТТР. ТКПЙ чтп ППКЯ1ЯНП R гр — і тн~тел0 нейрона,1Ца — аксои1Смо — миелиновая клеткой, ЧТО UOKdJdHU В се ~ оболочка, перехват Ранвье^д-дендрит,
ЧЄНИИ на рис. 4.2. Погру — X*— ядро,^с —синапсыЛодн—окончание двига о г — г тельного нерва,мв — мышечное волокно.
Женныи в шванНЬвскую 1
Клетку аксон создает глубокую инвагинацию мембраны шванновской клетки, причем образуется мезаксон — две шванновские мембраны, расположенные рядом^В правом нижнем углу схематически показана двойная мембрана, разделяющая цитоплазму шванновской клетки и цитоплазму аксона, аксоплазму [9].
Герен [10] установила, что миелиновая оболочка аксона образована многократным спиральным закручиванием мембраны шванновской клетки вокруг аксоиаГМиелин представляет собой, — т-а«им~ойразом,/многослойную (доЧїбО слоев) мембрану, строение которой наблюдается с помощью электронного микроскопа. Миелии защищает мембрану аксона от окружающей среды.
6 М. В. Волькеиштейн
Структура миелина была детально изучена методом рентгенографии с разрешением 10 А [11]. Определены профили электронной плотности миелина седалищного нерва кролика и лягушки и миелина зрительного нерва кролика. На рнс. 4.3 показаны эти кривые для нервных волокон кролика и схема структуры миелина, соответствующая данным кривым. Миелин построен асимметрично, холестерин сосредоточен преимущественно на стороне
Рис. 4.2. Схема строения немиелинизированнного нервного волокна позвоночного.
А — аксон, м — мезаксон— шванновская клетка.
Миелина, соприкасающейся с мембраной аксона. Схема согласуется с липидным составом миелина млекопитающих, установленным ранее [12]. Белковые слои граничных областей миелина содержат йоду. Внутренняя область построена из гибких углевОдорОдных «хвостов» липидов.
/Уже давно установлено, что нервы и мышцы способны генерировать электродвижущие силы, биопотенциалы. Электрическая активность клеток проявляется в форме коротких разрядов, каждый из которых длится около 1 мс. Современная экспериментальная техника позволяет усиливать эти сигналы и регистрировать их с помощью осциллографа или другим путем. Установлено, что активность нерва всегда сопровождается электрическими явлениями — и при внешнем возбуждении и при посылке сигнала мозгом в соответствующем аксоне наблюдаются электрические импульсы. На рис. 4.4 показаны импульсы в зрительном нервном волокні краба Limulus, вызванные вспышкой света длительностью 1 с [13]. Частота и характер последовательности импульсов, имеющие несомненное информационное значе
ние, зависят от интенсивности и спектрального состава света [14, 15] (см. гл. 7) .1 Величина и длительность отдельного импульса не зависят отТгрироды и силы раздражения.»
О 20 40А
-J 1 1 1 1
0 0 .::•:
»w0#0
^ V J 1 O^^-v^.p..
Г У. Го 0
Внугрен^/7о/тярже=Стероид щ^Гибх/гя ^Стероид ^//плярная Внешний
Нийбеяоцт. группы^ +ягесткая цепь +жесткая белок
+еоЗа ‘— » цепь — цепь — —~ +вода углеводороды
Рис. 4.3. Схема миелиновой мембранной структуры.
Вверх* — профили электронной плотности для глазного (пунктир) н седалищного (сплошная
Лнння) нервов кролика.
Электрический сигнал, отвечающий отдельному импульсу, распространяющемуся вдоль аксона, называется потенциалом действия или спайком. Это — основная единица информации, передаваемой по нервному волокну.
Скорость распространения импульса по аксону равна по порядку величины 1—100 м/с, она меньше для немиелинизиро — ванных и больше для миелинизированных аксонов.
0,01
0,001
Рис. 4.4. Импульсы в зрительном нервном волокне Limulus, вызванные вспышкой света длительностью I с.
Цифры справа указывают относительную интенсивность вспышки. Период освещения указан разрывом верхней белой линии, отметка времени на нижней белой линии 0,2 с.
В табл. 4.1 [3] приведены некоторые данные. Проведение нервного возбуждения есть проведение электрического импульса. Несмотря на то, что аксоплазма представляет
Таблица 4.1
Скорость проведения возбуждения в нервном н мышечном волокнах
|
Волокно |
Температура, °С |
Диаметр волокна мкм |
Скорость проведения, м/с |
|
Миелинизированные нервные волок |
38 |
2-20 |
10-100 |
|
На кошки |
|||
|
Немиелинизированные нервные во |
38 |
0,3-1,3 |
0,7—2,3 |
|
Локна кошки |
|||
|
Миелинизированные нервные волок |
20 |
3-16 |
6-32 |
|
На лягушки |
35 |
||
|
Миелинизированные нервные во |
20 |
20 |
|
|
Локна креветки |
|||
|
Немиелинизированные нервные во |
20 |
30 |
5 |
|
Локна краба |
|||
|
Гигантский аксон кальмара (немие- |
20 |
500 |
Около 25 |
|
Линизированное волокно) |
|||
|
Мышечное волокно лягушки |
20 |
60 |
1,6 |
‘) Для миелинизированных волокон указаны значения наружного диа^ метра миелиновой оболочки.
Собой раствор электролитов, никоим образом нельзя считать, что ионный ток в ней определяет распространение импульса. («Удельное сопротивление аксоплазмы равно по порядку величины 10—100 Ом-см. Следовательно, сопротивление на единицу длины волокна диаметром 1 мкм составляет 109—Ю10Ом-см, т. е. превышает сопротивление медного провода того же диаметра в 108 раз. В таком проводнике очень велики потери и утечки. Между тем аксон передает первичный импульс на расстояния свыше метра б^а-затухания. и без иска^кения.^.
В нейрофизиологии и в биофизике нервнЪ’го»»возбуждения сыграло большую роль развитие методов работы на изолированных аксонах, техники введения микроэлектродов в аксон и метода перфузии, т. е. выдавливания аксоплазмы из волокна и ее замены искусственными растворамиДОсобенно удобна работа на гигантских аксонах кальмара, имеющих диаметр до 0,5 мм (см. табл. 4.1 ^Элементарный опыт состоит во введении в аксон двух микроэлектродов: первый служит для электрической стимуляции возбуждения, второй-^- для измерения генерируемого потенциала (рис. 4.5) [4]./Опыт показывает, что «»величина и временной ход токов действия совершенно не зависят от величины стимулирующего тока и что потенциал действия не возникает, если электрический стимул не достигает некоторого порогового потенциала. Тем самым, нервное волокно
Гл. 4. нервный импульс
Подчиняется закону «все или ничего». Иными словами, потенциал действия постоянной величины либо возникает, либо не возникает вовсе.
Для возбуждения аксона необходимо некоторое минимальное количество электричества.,’ Соответственно по мере уменьшения
Раздражение Осцилмерар
ЕЖЖ^,..»,, ,
Аксон
Рис. 4.5. Схема исследования нервного импульса при помощи двух микроэлектродов.
Длительности At подаваемого импульса необходимо увеличивать силу тока / — эти две величины обратно пропорциональны. Для длительных прямоугольных импульсов существует минимальная
Сила тока, достаточная для возбуждения; более слабый ток неэффективен при любой длительности.
Fta рис. 3/S показана кривая зависимости силы порогового тока от длительности импульса. Кривая имеет гиперболическую форму. Было предложено описывать ее эмпирической формулой
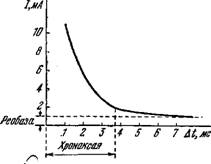
/п = а/At — f b,
Где Іп— пороговый ток, At— длительность импульса, b — так называемая реобаза — минимальное значение возбуждающего тока при At-> оо. При очень коротких импульсах, т. е. при At—>-0 /п = а/At, т. е. произведение IaAt есть константа, характеризующая пороговое значение количества электричества при коротких импульсах. Из приведенной формулы следует, что при /п = 2b получим А^хр = а/Ь. В действительности, однако, оказалось, что при At = ajb /п~1,4Ь и простая эмпирическая формула несправедлива во всем интервале значений A^.j
166
Рисі 4.6. Зависимость силы порогового тока от длительности импульса.
Если сообщить волокну два последовательных стимула, разделенных некоторым интервалом времени, то возникающая ситуация зависит от этого интервала. Немедленно после генерации импульса данное место волокна находится в абсолютном
Рефрактерном состоянии, т. е. не может быть возбуждено вновь. Затем следует относительное рефрактерное состояние. В таком состоянии заметно увеличено значение порогового потенциала и может возникнуть лишь медленно распространяющийся импульс. Продолжительность всего рефрактерного состояния варьирует от одной до нескольких миллисекунд.
В состоянии покоя аксоплазма имеет отрицательный заряд по отношению к внешней среде, характеризуемый потенциалом покоя около 80 мВ. Пороговое возбуждение при этом имеет потенциал, примерно равный —50 мВ, а потенциал действия при надпороговом возбуждении равен потенциалу противоположного знака, составляющему около 40 мВ. Это изображено схематически на рис. 4.7 [4].
Прохождение импульса определяется изменением состояния мембраны аксона при ее стимуляции. Как уже говорилось, в состоянии покоя клеточной мембраны в результате активного транспорта ионов концентрация ионов К+ в цитоплазме (аксо — плазме) значительно превосходит их концентрацию во внешней среде, а для ионов Na+ ситуация противоположна^ В табл. 4.2 [3] приведен состав аксоплазми аксонов Loligo и состав плазмы крови, характерный для внешней среды, и близкий к нему состав морской воды.
Таблица 4.2 Концентрация нонов н других веществ в аксонах Loligo
Концентрация, ммоль на 1 кг НаО
|
Вещество |
Морская |
||
|
Аксоплазма |
Кровь |
Вода |
|
|
К+ |
400 |
20 |
10 |
|
Na+ |
50 |
440 |
460 |
|
Сг |
40—150 |
560 |
540 |
|
Са++ |
0,4 |
10 |
10 |
|
Mg++ |
10 |
54 |
53 |
|
Изэтионовая кислота |
250 |
— |
— |
|
Аспарагнновая кислота |
75 |
— |
— |
|
Глутаминовая кислота |
12 |
— |
— |
|
Янтарная н фумаровая кислоты |
17 |
— |
— |
|
Ортофосфат |
2,5-9 |
— |
— |
|
АТФ |
0,7—1,7 |
— |
— |
|
Аргннннфосфат |
1,8-5,7 865 г/кг |
— |
— |
|
Вода |
870 г/кг |
966 г/кг |
При наложении на мембрану стимулирующего потенциала вначале увеличивается ее проницаемость для ионов Na+, в состоянии покоя значительно меньшая проницаемости для ионов К+. Ионы Na+ входят в аксон, в результате чего внутренняя поверхность мембраны изменяет знак своего заряда с отрицательного на положительный. Иными словами, происходит деполяризация мембраныЛЕсли воспользоваться для выражения разности потенциалов на двух сторонах мембраны аксона формулой (3.105)
+ + (4.1)
^ РКСК + PNacNa + РС1сС ‘
То состояние покоя мембраны характеризуется следующим отношением ионных проницаемостей:
Рк ■ ^Na •’ Реї = 1 : 0,04:0,45.
В состоянии возбуждения, отвечающем генерации потенциала действия, имеем
Рк: Pnа: Ра = 1 :20: 0,45.
Подчеркнем, что истолкование возбуждения как результата изменения ионных проницаемостей является феноменологическим и не раскрывает молекулярный механизм процесса.
Наружная среда
Активный участок
+ + + — — — — + + + + +
Импульс Э-
Электрические токи, возникающие при деполяризации мембраны аксона.
При деполяризации мембраны возникают токи, замыкающиеся через наружную проводящую среду (рис. 4.8) [5]. Они возбуждают следующий участок аксона.
Таким образом, согласно мембранной теории при генерации импульса в мембране аксона открывается некий «канал», сквозь который ионы Na+ проникают внутрь аксона, вызывая деполяризацию мембраны. Во время генерации импульса натриевый канал закрывается и открывается калиевый канал. Ионы К+ выходят наружу, что приводит к восстановлению нормального отрицательного заряда на внутренней стороне мембраны. Происходит реполяризация мембраны. После прохождения рефрактерного периода мембрана приобретает способность передавать новый импульс (рис. 4.9) (4].
+40 О
-за
3
Оотенциол действия
Птещиал пот
+ к — — у + + + + + + + + + + + +
Їфі TtII ‘МрЖ. 111111
+ T —+ + + + + + + + + + + ®
+40
О
+ + + + + + + + І » + + + + + + + + + + + + + + ї—+ + + + + +
+40 О
-ВО
Рис. 4.9. Распространение нервного импульса сопровождается изменениями нонной проницаемости мембранного аксона.
Наружный раствор
/ / і ±
А/гсоплаэма
Рнс. 4.10. Эквивалентная схема элемента возбудимой мембраны аксона.
Как видно из рис. 4.8, суммарный продольный ток через сечение аксона и окружающую среду равен нулю — в любом месте внутренние токи равны по силе и противоположны по направлению. Но плотность продольного тока и продольная разность потенциалов между двумя точками внутри аксона иные, чем снаружи.
Мембрана аксона имеет сопротивление 1000 Ом-см2, ее емкость равна 1 мкФ/см2, что соответствует бимолекулярному липидному слою толщиной 50 А с диэлектрической проницаемостью е=5 и удельным сопротивлением 2-Ю9 Ом-см. Во время генерации импульса проводимость мембраны увеличивается примерно в 1000 раз. Можно моделировать электрические свойства мембраны эквивалентной схемой, показанной на рис. 4.10 [3]. Рисунок изображает лишь один элемент мембраны, и следует представить себе длинную линейную последовательность таких элементов, моделирующих непрерывный кабель. Сопротивление R характеризует аксоплазму, наружный раствор имеется в большом избытке и изображается проводником без сопротивления. Натриевая и калиевая «батареи» и S’k,
Определяют генерацию импульса, добавочная «батарея» Sy ответственна за движение других ионов, не изменяющееся при возбуждении.
Таким образом, распространение импульса представляет собой самоподдерживающийся процесс, подобный горению бикфордова шнура. Очевидно, что процесс этот сводится к превращению химической энергии в электрическую.
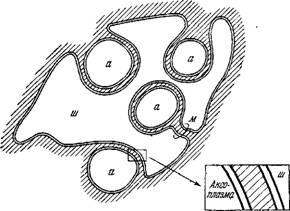
Как уже сказано, распространение импульса в миелинизированном волокне происходит быстрее, чем в немиелинизированном. Доказано, что в миелинизированном аксоне проведение импульса является сальтаторным, т. е. происходит путем перескока импульса от одного перехвата Ранвье к другому. Калиевые и натриевые каналы открываются и закрываются только в перехватах Ранвье — миелинизированные участки хорошо изолированы. Миелин имеет малую емкость, чем и объясняется большая скорость проведения импульса. Схема сальтаторного проведения импульса показана на рис. 4.11. ^
РирГ 4.Т7Т^ Схема сальтаторного проведения импульса. пР—перехват Ранвье, л —миелин, а — аксо-
Прямые доказательства сальтаторной їеории, впервые предложенной Лилли [16], были получены в работах Кубо, Оно и Юге (см. [17]). В одиночном нервно-мышечном препарате, погруженном в раствор Рингера, пороговая величина стиму
лирующего тока зависит от расстояния между стимулирующим микрозлектродом и перехватом Ранвье. Она имеет наименьшее значение, если микрозлектрод помещен непосредственно в перехвате. Количественная теория этого эффекта была развита Та — саки (см. [6]).
Обозначим потенциалы трех последовательных перехватов — 1, 0 и 1 буквами ifi_i, if)0 и ij)j. Если миелин представляет собой идеальный изолятор, то ток, протекающий внутри аксона от 1 к 0, пропорционален if>i— if>o, от 0 к —1 — пропорционален ■ф-i — if>o. Через перехват 0 идет ток І, пропорциональный (грі — ij)0) — f (j)_i — %,). Имеем
‘ = І{(+-,-*о) + (+,-+о)}. (4.2)
Где R — сопротивление между двумя соседними перехватами (оно равно примерно 20 МОм).
Расстояния между микроэлектродом и перехватами 0, 1 и —1 равны Хо, Х, х-. Разность потенциалов, создаваемая микроэлектродом, дающим ток I, равна
Где р — удельное сопротивление среды (для раствора Рингера оно равно 100 Ом-см). Из (4.2) и (4.3) получаем
TOC o «1-3» h z i = Ч (4-4)
4яR х0 х х-1 ) 4 ‘
И если микроэлектрод очень близок к перехвату 0, т. е. Хи Х-1 » *0, то
= (4-5)
В опытах варьировалось расстояние х0 и при каждом значении Хо определялась величина /, отвечающая критическому значению і — іс. Опытные данные действительно согласуются с линейной зависимостью I от х0
І= — Ісх0. (4.6)
Установлено, что факторы, блокирующие распространение импульса (кокаин, уретан, ультрафиолетовое облучение), действуют именно на перехваты Ранвье, но не на участки между ними.
Прямые и строгие доказательства сальтаторной теории получены в работах Тасаки и его сотрудников [6, 18, 19]. Основной опыт ставился на одиночном волокне, лежащем в трех каплях раствора Рингера, разделенных двумя воздушными промежутками, расстояние между которыми равнялось приблизительно 1 мм (рис. 4.12) [3]. В первом опыте (рис. 4.12, а) в средней капле находилась только миелинизированная часть аксона, во втором (рис. 4.12,6)—в средней капле находился перехват Ранвье. Измерялся радиальный ток. Через сопротивление R проходит ток, равный il2— г23, где i2— ток, текущий в наружной цепи от капли 1 к капле 2, і23— от капли 2 к капле 3. Эта разность равна току, входящему в волокно из капли 2.
1ме 1ма
Рис. 4.12. Мембранный ток:
А—через участок аксона, расположенный между перехватами Раивье, б —через перехват Ранвье. Отклонение осциллограммы вверх соответствует выходящему току.
В первом опыте радиальный ток направлен наружу, что объясняется пассивным разрядом миелинизированного участка через перехват. Правый перехват разряжается позже левого, соответственно на осциллограмме видны два пика. Во втором опыте первая фаза тока направлена наружу, что означает пассивную деполяризацию перехвата. Во второй фазе ток направлен внутрь — перехват Ранвье находится в активном состоянии. Эти опыты однозначно подтверждают теорию (дальнейшие подробности см. в [3, 6, 18, 19]).
Мембранная теория в целом непосредственно подтверждается опытами с перфузией аксонов. Оказалось возможным выдавить аксоплазму из гигантского аксона Loligo без повреждения мембраны и заменить аксоплазму искусственными растворами (см. [3, 6, 20—22]). Перфузированные аксоны способны проводить до 105—106 импульсов в течение нескольких часов.
Потенциал покоя исчезает при равенстве наружной и внутренней концентраций калия. При замене в аксоплазме КС1 на NaCl потенциал покоя падает до нуля. В то же время потенциал покоя малочувствителен к концентрациям К+, меньшим 20 мМ (см. также § 3.6). Перфузионные опыты показывают, что потенциал покоя действительно регулируется ионами калия.
При указанной замене К. С1 на NaCl и значительном увеличении концентрации К (до 600 мМ) создается положение, обратное нормальному, и внутренняя часть волокна заряжается положительно, а не отрицательно по отношению к наружной среде. И в самом деле, при заполнении волокна, погруженного в изотонический раствор КС1, таким же раствором NaCl внутренний раствор заряжен положительно по отношению к наружному и <р составляет 50—60 мВ.
Прямые опыты с мечеными атомами показывают, что проведение импульса связано с возрастанием скорости движения калия и натрия по градиентам концентрации. В гигантском аксоне каракатицы Sepia при каждом импульсе наблюдается входящий поток Na+, равный 10,3-Ю-12 моль/см2, и выходящий поток 6,6-Ю-12 моль/см2. Чистый вход Na+ 3,7-Ю-12 моль/см2 за импульс примерно равен выходу К+. Действительно, для изменения напряжения конденсатора емкостью 1 мкФ на 120 мВ нужен заряд 0,12-Ю-6 Кл, что эквивалентно 1,3-Ю-12 моль/см2 одновалентного катиона. Таким образом, измеренный вход Na+ более чем достаточен для возникновения потенциала действия.
За один импульс в немиелинизированном аксоне через 1 мкм2 поверхности проходит около 20 000 ионов Na+. В миелинизиро — ванном аксоне за один импульс через каждый перехват Ранвье входит 6-Ю6 ионов Na+. Площадь мембраны в перехвате примерно равна 20 мкм2, следовательно, через 1 мкм2 проходит 300 000 ионов Na+. Плотность ионного тока в перехвате примерно в 10 раз больше, чем в немиелинизированных гигантских аксонах.
Мембранная теория встречается, однако, с трудностями при попытках объяснить тепловые явления в нерве. Согласно мембранной теории генерация импульса происходит за счет свободной энергии, определяемой градиентом концентрации ионов Na+. Если перенос ионов адиабатичен, то система, совершая электрическую работу, должна охлаждаться. Однако оказалось, что во время генерации импульса сначала происходит нагревание нерва, за которым следует охлаждение [23]. Аналогичное явление наблюдается при разряде электрического органа угря на внешнее сопротивление [24]. Эти тепловые явления до сих пор не объяснены. Несомненно, что мембрана аксона представляет собой диссипативную систему, и можно думать, что к рассмотрению генерации нервного импульса применима неравновесная термодинамика. Соответствующая теория еще не построена, она должна описать и теплопродукцию нерва. Подлинное объяснение этих явлений требует, однако, раскрытия их молекулярных механизмов.
В заключение приведем электрические характеристики мие- линизированного нервного волокна лягушки (табл. 4.3) [3].
Таблица 4.3
Электрические характеристики аксона
|
Диаметр волокна |
14 мкм |
|
Толщина миелиновой оболочки |
2 мкм |
|
Расстояние между перехватами Ранвье |
2 мм |
|
Площадь мембраны в перехвате Ранвье |
22 мкм2 |
|
Сопротивление на единицу длины осевого ци |
140 МОм/см |
|
Линдра |
110 Ом • см |
|
Удельное сопротивление аксоплазми |
|
|
Емкость на единицу длины миелиновой оболочки |
10—16 пФ/см |
|
Емкость на едниицу площади миелиновой обо |
0,0025—0,005 мкФ/см2 |
|
Лочки |
|
|
Диэлектрическая проницаемость миелиновой обо |
5-10 |
|
Лочки |
|
|
Удельное сопротивление миелиновой оболочки |
500—800 МОм/см |
|
Емкость перехвата Ранвье |
0,6-1,5 пФ |
|
Емкость на единицу площади перехвата Ранвье |
3—7 мкФ/см2 |
|
Сопротивление перехвата Ранвье в покое |
40—80 МОм |
|
Сопротивление, умноженное на единицу площади |
10-20 Ом-см2 |
|
Мембраны в перехвате Ранвье |
|
|
Потенциал действия |
116 мВ |
|
Потенциал покоя |
71 мВ |
|
Максимальная плотность входящего тока |
20 мА/см2 |
|
Скорость проведения |
23 м/с |
В биологии особое значение имеют автокаталитические химические системы. Достаточно указать, что авторепродукция КДеток и организмов эквивалентна автокатализу. Вернемся сначала к феноменологическому термодинамическому рассмотрению. Как мы видели, для химических процессов критерий …
Неотъемлемой особенностью биологических объектов — клеток и организмов — является их историчность, т. е. возникновение и развитие изучаемой системы в конечном интервале времени. Развитие биологической системы всегда необратимо, и в …
Самые общие соображения показывают, что перенос электрона, сдвиг электронной плотности в конденсированной ср. еде должны сопровождаться изменениями положений атомов, атомных ядер среды. Все степени свободы молекулярной системы, т. е. системы, …
Трансмиссия
потенциала действия.
Момент
времени 1: Электрический ток, возникший в результате открытия
потенциал-зависимых натриевых каналов на участке 1, возбуждает соседние участки
мембраны.
Момент
времени 2: В результате этого возбуждения на участке 2 открываются
потенциал-зависимые натриевые каналы и возникает потенциал действия, который, в
свою очередь, возбуждает соседние участки мембраны. На участке 1 открылись
потенциал-зависимые калиевые каналы, восстанавливающие мембранный потенциал
после прохождения потенциала действия.
Момент
времени 3: Электрический ток, возникший в результате открытия
потенциал-зависимых натриевых каналов на участке 2, вызвал открытие таких же
каналов на участке 3, и потенциал действия перешел туда. На участке 1
потенциал-зависимые натриевые каналы не смогли открыться, несмотря на
электрическое возбуждение от участка 2, так как они были временно
инактивированы после создания потенциала действия. На участке 2 открылись
потенциал-зависимые калиевые каналы, восстанавливающие мембранный потенциал
покоя после прохождения потенциала действия.
Мы
уже знаем, что отростки нейронов могут быть покрыты обернутыми вокруг них
клетками нейроглии, или миелиновой оболочкой. Именно она делает аксон похожим
на вытянутую цепочку сосисок. Передача потенциала возбуждения по «голым», не
покрытым миелиновыми клетками, нервным волокнам отличается от его прохождения
по миелинизированному аксону. При сравнении заметны существенные преимущества,
предоставляемые обернутыми вокруг аксона клетками нейроглии:
Потенциал действия
в миелиновом волокне.
1.
Экономичность. Мембрана аксона под миелином не имеет каналов для пропускания
ионов, создающих потенциал действия. Каналы существуют только в узких
промежутках между глиальными клетками, которые называют перехваты Ранвье, и
только на этих узких участках аксона возникает потенциал действия. Концентрация
ионных каналов в этих перехватах в 100 раз выше, чем в мембранах безмиелиновых
волокон, тем не менее для того, чтобы обеспечить их работу, требуется
значительно меньше энергии по сравнению с тем, сколько энергии потребовалось бы
для обеспечения ионных каналов, расположенных по всей поверхности «голого»
аксона. Кроме того, такая экономичность позволяет быстрее «перезаряжать» аксон
для проведения следующего потенциала действия, поэтому миелинизированные
волокна способны передавать сигналы более высокой частоты.
2.
Скорость. По «голому» аксону сигнал передается в каждой его точке. Ионные
каналы открываются в каждой точке его поверхности, один за другим, что
напоминает тщательное, скрупулезное вчитывание в текст.
В
миелинезированном аксоне потенциал действия, возникший в одном перехвате
Ранвье, своим электрическим полем дотягивается до соседних перехватов, что
приводит к возникновению в них новых потенциалов действия. То есть возбуждение
переходит скачкообразно, от одного перехвата к другому. В случае повреждения
одного перехвата Ранвье потенциал действия возбуждает следующий после
поврежденного перехват, а в случае необходимости даже третий, четвертый и пятый
по счету. Распространение электрического поля на такую длину возможно из-за
электроизоляции, создаваемой миелиновыми муфтами: она уменьшает рассеивание
электрического поля, которое неизбежно для безмиелиновых волокон.
Таким
образом, скорость распространения потенциала действия по миелинизированным
волокнам намного выше по сравнению с немиелинизированными. Ведь за один и тот
же отрезок времени потенциал действия на «голом» аксоне возбудит лишь
находящийся непосредственно рядом участок, а потенциал действия на
миелинизированном волокне перепрыгнет на расстояние, равное расстоянию между
одним или несколькими перехватами Ранвье:
Диапазон
скоростей передачи потенциала действия в различных миелинизированных волокнах
очень широк: от нескольких метров в секунду до «мирового рекорда»,
установленного аксоном креветки: он проводит возбуждение со скоростью,
превышающей 200 м/с.
Чтобы
представить, насколько эффективно может быть увеличена скорость проведения
потенциала действия за счёт миелиновой оболочки, достаточно сравнить скорость
его распространения по немиелинизированным и миелинизированным волокнам
нейронов человека. Если взять скорость проведения импульса в одинаково тонких
волокнах, то в безмиелиновом волокне она составит примерно 1 м/с, а в
миелинизированном 15—20 м/с. В толстых аксонах человека, покрытых миелиновой
оболочкой, скорость проведения может достигать 120 м/с.
Скорость нервной проводимости (CV) является важным аспектом исследований нервной проводимости. Это скорость, с которой электрохимический импульс распространяется по нервному пути. На скорость проводимости влияет широкий спектр факторов, включая возраст, пол и различные заболевания. Исследования позволяют лучше диагностировать различные невропатии, особенно демиелинизирующие заболевания, поскольку эти состояния приводят к снижению или отсутствию скорости проводимости.

Содержание
- 1 Нормальные скорости проводимости
- 2 Методы тестирования
- 2.1 Исследования нервной проводимости
- 2.1.1 Микрообработанные 3D-наборы электродов
- 2.1 Исследования нервной проводимости
- 3 Причины отклонений скорости проводимости
- 3.1 Антропометрические и другие индивидуализированные факторы
- 3.1.1 Возраст
- 3.1.2 Пол
- 3.1.3 Температура
- 3.1.4 Рост
- 3.1.5 Факторы рук
- 3.2 Медицинские условия
- 3.2.1 Боковой амиотрофический склероз (БАС)
- 3.2.2 Синдром запястного канала
- 3.2.3 Синдром Гийена-Барре
- 3.2.4 Миастенический синдром Ламберта-Итона
- 3.2.5 Периферическая диабетическая нейропатия
- 3.1 Антропометрические и другие индивидуализированные факторы
- 4 См. Также
- 5 Ссылки
- 6 Внешние ссылки
Нормальные скорости проводимости
В конечном итоге скорости проводимости индивидуальны для каждого человека и в значительной степени зависят от аксона диаметр и степень миелинизации этого аксона, но большинство «нормальных» людей попадают в определенные пределы.
Нервные импульсы чрезвычайно медленны по сравнению со скоростью электрического icity, где электрическое поле может распространяться со скоростью порядка 50–99% скорости света; однако это очень быстро по сравнению со скоростью кровотока, при этом некоторые миелинизированные нейроны проводят скорость до 120 м / с (432 км / ч или 275 миль в час).
| Тип | Эрлангер-Гассер. Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13–20 μm | Да | 80–120 м / с | Экстрафузальные мышечные волокна |
| γ | Aγ | 5–8 мкм | Да | 4–24 м / с | Внутрифузальные мышечные волокна |
Различные сенсорные рецепторы иннервируются разными типами нервных волокон. Проприорецепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III, а ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Гассер. Классификация | Диаметр | Миелин | Скорость проводимости | Ассоциированные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13–20 мкм | Да | 80–120 м / с | Ответственный за проприоцепцию |
| Ib | Aα | 13–20 мкм | Да | 80–120 м / с | Сухожильный орган Гольджи |
| II | Aβ | 6–12 μm | Да | 33–75 м / с | Вторичные рецепторы мышечного веретена. Все кожные механорецепторы |
| III | Aδ | 1–5 μm | Тонкие | 3 –30 м / с | Свободные нервные окончания прикосновения и давления. Ноцицепторы неоспиноталамического тракта. Холодные терморецепторы |
| IV | C | 0,2–1,5 μm | No | 0,5–2,0 м / с | Ноцицепторы палеоспиноталамического тракта. Тепловые рецепторы |
| Тип | Эрлангер -Газер. Классификация | Диаметр | Миелин | Скорость проводимости |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 μm | Да | 3 –15 м / с |
| постганглионарные волокна | C | 0. 2–1,5 μm | No | 0,5–2,0 м / с |
| Нерв | Скорость проводимости |
|---|---|
| Медиана Сенсорная | 45–70 м / с |
| Средний мотор | 49–64 м / с |
| Ульнар Сенсорный | 48–74 м / с |
| Ульнарский мотор | 49+ м / с |
| Малоберцовый Мотор | 44+ м / с |
| Большеберцовый Мотор | 41+ м / с |
| Сурал Сенсорный | 46–64 м / с |
Нормальные импульсы в периферических нервах ног распространяются со скоростью 40–45 м / с и 50–65 м / с в периферических нервах рук. В целом, нормальная скорость проводимости для любого данного нерва будет в диапазоне 50–60 м / с.
Методы тестирования
Исследования нервной проводимости
Скорость нервной проводимости — лишь один из многие измерения обычно выполняются во время исследования нервной проводимости (NCS). Цель этих исследований — определить, присутствует ли повреждение нерва и насколько серьезным оно может быть.
Исследования нервной проводимости выполняются следующим образом:
- Два электрода прикрепляются к коже субъекта над исследуемым нервом.
- Электрические импульсы передаются через один электрод для стимуляции нерва.
- Второй электрод регистрирует импульс, посланный через нерв в результате стимуляции.
- Разница во времени между стимуляцией от первого электрода и захватом нижним электродом известна как задержка. Задержки нервной проводимости обычно составляют порядка миллисекунд.
Хотя скорость проводимости непосредственно не измеряется, вычисление скорости проводимости на основе измерений NCS является тривиальным. Расстояние между стимулирующим и принимающим электродами делится на задержку импульса, в результате чего получается скорость проведения.
Много раз ЭМГ с иглой также проводится с субъектами одновременно с другими процедурами NCS, поскольку они помогают определить, правильно ли функционируют мышцы в ответ на стимулы, посылаемые через их соединительные нервы. ЭМГ является наиболее важным компонентом электродиагностики заболеваний двигательных нейронов, поскольку она часто приводит к выявлению вовлечения двигательных нейронов до того, как станут доступны клинические доказательства.
Массивы трехмерных электродов с микромашинной обработкой
Обычно электроды, используемые в ЭМГ, приклеиваются к коже через тонкий слой геля / пасты. Это обеспечивает лучшую проводимость между электродом и кожей. Однако, поскольку эти электроды не протыкают кожу, существуют импедансы , которые приводят к ошибочным показаниям, высоким уровням шума и низкому пространственному разрешению показаний.
Чтобы Для решения этих проблем разрабатываются новые устройства, такие как трехмерные электродные матрицы. Это устройства MEMS, которые состоят из массивов металлических микробашен, способных проникать через внешние слои кожи, тем самым снижая импеданс.
По сравнению с традиционными мокрыми электродами, многоэлектродные массивы предлагают следующее:
- Размер электродов составляет примерно 1/10 размера стандартных электродов с мокрой поверхностью
- Можно создавать массивы электродов и масштабировать их для покрытия областей почти любого размера
- Пониженное сопротивление
- Повышенная мощность сигнала
- Сигналы с большей амплитудой
- Обеспечивают лучшее отслеживание нервных импульсов в реальном времени
Причины отклонений скорости проводимости
Антропометрические и другие индивидуализированные факторы
Базовые измерения нервной проводимости у всех разные, так как они зависят от возраста, пола, местных температур и других антропометрических факторов, таких как размер и рост руки. Важно понимать влияние этих различных факторов на нормальные значения измерений нервной проводимости, чтобы помочь в выявлении результатов исследования аномальной нервной проводимости. Способность предсказывать нормальные значения в контексте антропометрических характеристик человека увеличивает чувствительность и специфичность электродиагностических процедур.
Возраст
Нормальные «взрослые» значения скорости проводимости обычно достигаются к 4 годам. Скорость проводимости у новорожденных и детей ясельного возраста, как правило, составляет примерно половину от значений взрослых.
Исследования нервной проводимости, проведенные на здоровых взрослых, показали, что возраст отрицательно связан с измерениями сенсорной амплитуды Срединный, локтевой и суральный нервы. Отрицательные ассоциации были также обнаружены между возрастом и скоростью проведения и латентностью в срединном сенсорном, срединном двигательном и локтевом сенсорных нервах. Однако скорость проводимости икроножного нерва не связана с возрастом. В целом, скорость проводимости в верхних конечностях снижается примерно на 1 м / с на каждые 10 лет.
Пол
Амплитуда проводимости по икроножному нерву у женщин значительно меньше, чем у мужчин, и латентность импульсов больше у женщин, следовательно, более низкая скорость проведения.
Другие нервы не проявляют никаких гендерных предубеждений.
Температура
В общем, скорости проводимости большинства моторных и сенсорных нервов прямо и линейно связаны с температурой тела (низкие температуры замедляют скорость нервной проводимости, а более высокие температуры увеличивают скорость проводимости).
Скорости проводимости в икроножном нерве, по-видимому, особенно сильно коррелируют с местной температурой нерва.
Высота
Скорости проводимости как в срединном сенсорном нерве, так и в локтевом сенсорном нерве являются отрицательно связано с ростом человека, что, вероятно, объясняет тот факт, что у большей части взрослого населения скорость проводимости между запястьем и пальцами руки человека уменьшается на 0,5 м / с на каждый дюйм увеличения роста. Как прямое следствие, латентность импульсов в срединных, локтевых и икроножных нервах увеличивается с ростом.
Корреляция между высотой и амплитудой импульсов в сенсорных нервах отрицательная.
Факторы рук.
Окружность указательного пальца отрицательно связана с амплитудами проводимости в срединном и локтевом нервах. Кроме того, люди с большим соотношением запястий (передне-задний диаметр: медиально-боковой диаметр) имеют меньшую латентность срединного нерва и более высокую скорость проводимости.
Медицинские условия
боковой амиотрофический склероз (БАС)
Боковой амиотрофический склероз (БАС), также известный как «болезнь Лу Герига», является прогрессирующим и неизбежно фатальным нейродегенеративным заболеванием, поражающим двигательные нейроны. Поскольку БАС имеет много общих симптомов с другими нейродегенеративными заболеваниями, его бывает трудно правильно диагностировать. Лучший метод установления достоверного диагноза — это электродиагностическая оценка. В частности, необходимо провести исследования моторной нервной проводимости срединных, локтевых и малоберцовых мышц, а также исследования сенсорной нервной проводимости локтевых и икроножных нервов.
У пациентов с БАС это было показано. что латентные двигатели в дистальных отделах и замедление скорости проводимости ухудшались по мере увеличения тяжести их мышечной слабости. Оба симптома соответствуют дегенерации аксонов у пациентов с БАС.
Синдром канала запястья
Синдром канала запястья (CTS) — это форма синдрома компрессии нерва, вызванного сдавление срединного нерва на запястье. Типичные симптомы включают онемение, покалывание, жгучие боли или слабость в руке. CTS — еще одно состояние, при котором ценно электродиагностическое тестирование. Однако перед тем, как подвергнуть пациента исследованиям нервной проводимости, следует провести как тест Тинеля, так и тест Фалена. Если оба результата отрицательны, очень маловероятно, что у пациента есть CTS, и дальнейшее тестирование не требуется.
Синдром запястного канала проявляется у каждого человека в разной степени. Измерения скорости нервной проводимости имеют решающее значение для определения степени тяжести. Эти уровни тяжести классифицируются как:
- Легкая CTS: длительные латентные сенсорные реакции, очень незначительное снижение скорости проведения. Нет подозрений на дегенерацию аксонов.
- Умеренная CTS: аномальные скорости сенсорной проводимости и снижение скорости моторной проводимости. Нет подозрения на дегенерацию аксонов.
- Тяжелая CTS: отсутствие сенсорных реакций и длительные моторные задержки (снижение скорости моторной проводимости).
- Extreme CTS: отсутствие как сенсорных, так и моторных реакций.
One Обычное электродиагностическое измерение включает разницу между скоростью проведения сенсорных нервов в мизинце и указательном пальце. В большинстве случаев CTS симптомы не проявляются, пока разница не превышает 8 м / с.
Синдром Гийена-Барре
Синдром Гийена-Барре (СГБ) — это периферическая невропатия, включающая дегенерация миелиновой оболочки и / или нервов, иннервирующих голову, тело и конечности. Эта дегенерация происходит из-за аутоиммунного ответа, обычно инициируемого различными инфекциями.
Существуют две основные классификации: демиелинизирующие (повреждение шванновских клеток) и аксональные (прямое повреждение нервных волокон). Каждая из них затем разветвляется на дополнительные подклассы в зависимости от точного проявления. Однако во всех случаях заболевание приводит к слабости или параличу конечностей, потенциально смертельному параличу дыхательных мышц или сочетанию этих эффектов.
Заболевание может прогрессировать очень быстро при появлении симптомов (серьезное повреждение может происходят в течение всего дня). Поскольку электродиагностика является одним из самых быстрых и прямых методов определения наличия заболевания и его правильной классификации, исследования нервной проводимости имеют чрезвычайно важное значение. Без надлежащей электродиагностической оценки GBS обычно ошибочно диагностируется как полиомиелит, вирус Западного Нила, клещевой паралич, различные токсические невропатии, CIDP, Поперечный миелит или Истерический паралич. Два набора исследований нервной проводимости должны позволить правильно диагностировать синдром Гийена – Барре. Рекомендуется проводить их в течение первых 2 недель с момента появления симптомов и снова через 3-8 недель.
Результаты электродиагностики, которые могут указывать на GBS, включают:
- полные блокады проводимости
- Аномальные или отсутствующие F-волны
- Ослабленные амплитуды потенциала действия сложных мышц
- Увеличенные латентные периоды мотонейронов
- Сильно замедленные скорости проводимости (иногда ниже 20 м / с)
Ламберт- Миастенический синдром Итона
Миастенический синдром Ламберта-Итона (LEMS) — это аутоиммунное заболевание, при котором аутоантитела направлены против потенциалзависимых кальциевых каналов в пресинаптических нервных окончаниях. Здесь антитела подавляют высвобождение нейротрансмиттеров, что приводит к мышечной слабости и вегетативной дисфункции.
Исследования нервной проводимости, проводимые на локтевых моторных и сенсорных, срединных моторных и сенсорных, большеберцовых моторных и малоберцовых моторных нервах у пациентов с LEMS показали, что скорость проводимости по этим нервам на самом деле нормальная. Однако амплитуды составных потенциалов двигательного действия могут быть уменьшены до 55%, а продолжительность этих потенциалов действия уменьшена до 47%.
Периферическая диабетическая невропатия
По крайней мере половина населения с сахарным диабетом также страдает диабетической невропатией, вызывающей онемение и слабость в периферических конечностях. Исследования показали, что сигнальный путь Rho / Rho-kinase более активен у людей с диабетом, и что эта сигнальная активность происходит в основном в узлах Ранвье и Шмидта-Лантермана. резцы. Следовательно, чрезмерная активность сигнального пути Rho / Rho-киназы может подавлять нервную проводимость.
Исследования скорости проводимости по двигательному нерву показали, что проводимость у крыс с диабетом была примерно на 30% ниже, чем в контрольной группе без диабета. Кроме того, активность вдоль разрезов Шмидта-Лантермана была непостоянной и нелинейной в группе диабетиков, но линейной и непрерывной в контроле. Эти недостатки были устранены после введения Фасудила диабетической группе, что означает, что это может быть потенциальное лечение.
См. Также
- Исследование нервной проводимости
- Электродиагностика
- Электромиография
Ссылки
Внешние ссылки
- Обучение виртуальному NCS и другие образовательные инструменты