Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
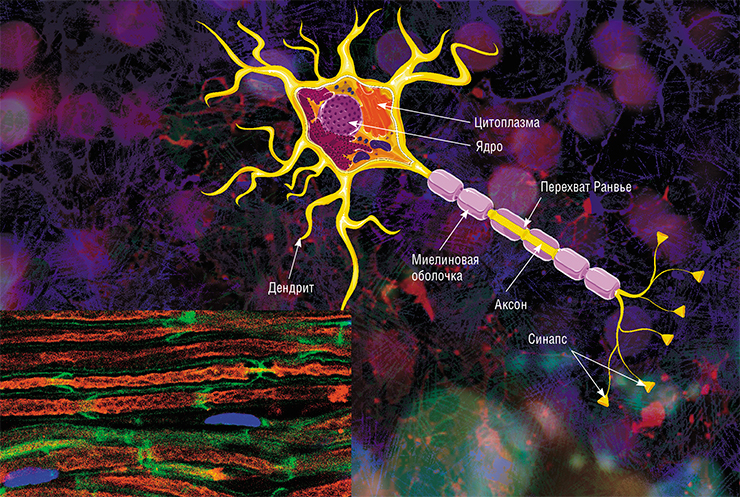
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
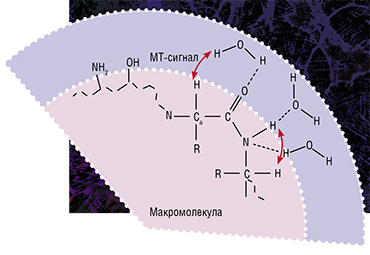
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
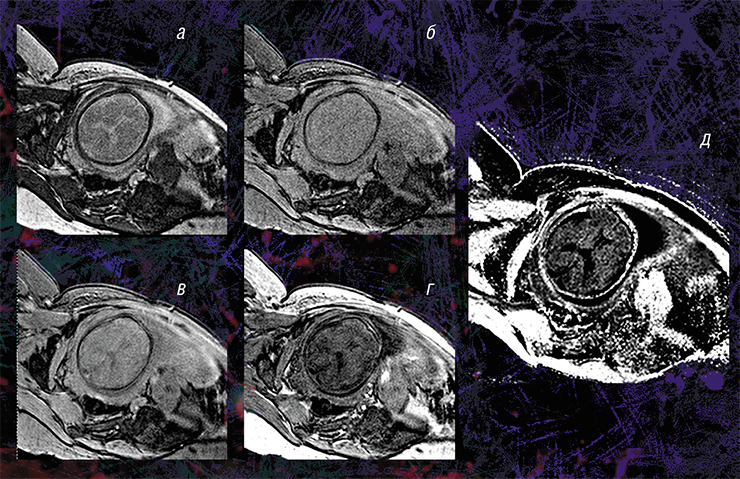
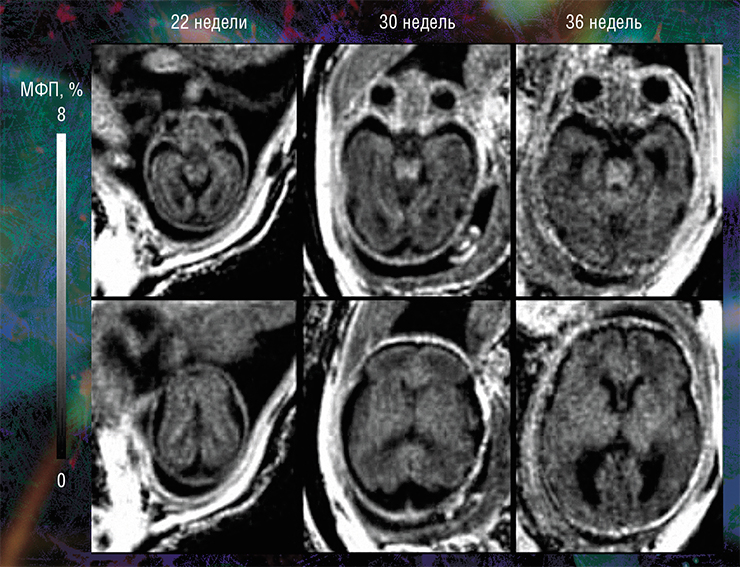
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
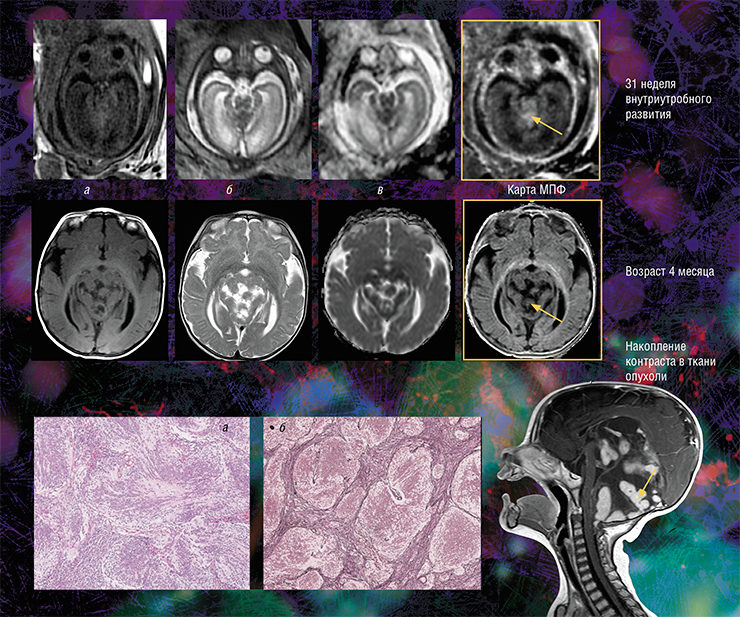
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Нормальная миелинизация
Основа формирования нормальной миелинизации изложенное Барковичем – ее начало на 5 месяце эмбрионального периода и продолжение в течение всей жизни. Миелинизация начинается с черепных нервов, что имеет смысл, поскольку чувствительность необходима для выживания. Так же стоит учитывать, что миелинизация структур происходит в направлении снизу вверх, от задних структур к передним и от центра к периферии. Логично, что ствол мозга и мозжечок миелинизируются раньше полушарий, а базальные ядра и таламус – раньше белого вещества. Кроме того, задняя ножка внутренней капсулы миелинизируется раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов.
Профессор Серена Каунселл с коллегами описали миелинизацию у сильно недоношенных новорожденных и подтвердили миелинизацию червя мозжечка, вестибулярных ядер, ножек мозжечка, зубчатых ядер, медиального продольного пучка, медиальных коленчатых тел, субталамических ядер, нижних ядер оливы, вентролатеральных ядер таламуса, медиальной и латеральной петель, нижних холмов четверохолмия, а также клиновидного и тонкого пучков. Исследователи не обнаружили никаких новых сайтов миелинизации между 28 и 36 неделями, после чего снова появились новые миелиновые участки в задней ножке внутренней капсулы, лучистом венце и кортикоспинальных трактах предцентральной и постцентральной извилины.
Гистологические исследования демонстрируют миелинизацию при рождении в стволе мозга, белом веществе мозжечка и задней ножке внутренней капсулы с распространением на таламус и базальные ганглии.
Профессор Берд с коллегами проанализировали 60 пациентов и обнаружили значительные различия в скорости и начале появления изменений, связанных с миелинизацией. Исследователи изучали сайты-маркеры для определенных возрастов при определении нормального миелина. Так, при рождении наблюдалась миелинизация задней ножки внутренней капсулы, ножек мозжечка и лучистого венца вокруг центральной борозды. Исследователи снова последовательно подтвердили сроки миелинизации: в задней ножке раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов у всех субъектов.
Томас Паус (2001) описал 3 паттерна развития, наблюдаемые в отношении дифференциации серого-белого вещества в первые 12-24 месяца жизни.
- младенческий паттерн – менее чем за 6 месяцев; картина, противоположная картине взрослого мозга,
- изометрический паттерн (8-12 месяцев), в котором наблюдается плохая дифференциация между серым и белым веществом
- ранний взрослый паттерн (более 12 месяцев), в которых сигнал от серого вещества выше, чем от белого, на Т2-ВИ и ниже на Т1-ВИ.
Валик мозолистого тела миелинизируется примерно к 3 месяцу, тело – к 4-5 месяцу, а колено – к 6 месяцу. На протяжении развития (в первый год) наблюдаются изменения и в форме, и в толщине. У новорожденного утолщение начинается с колена (со 2-3 месяца), затем утолщается валик (с 5-6 месяца), достигая толщины колена к 7 месяцу. Мозолистое тело увеличивается до 12 месяца. На Т1-ВИ валик мозолистого тела имеет повышенную интенсивность сигнала в 4 месяца, когда как колено – в 5-6 месяцев.
Терминальные зоны миелинизации
Последней зоной миелинизации на МРТ является перитригональная зона. Эта область поддерживает постоянную гиперинтенсивность на T2-ВИ, но не интенсивнее серого вещества. Параццини с коллегами описали терминальные зоны миелинизации в лобно-теменных субкортикальных регионах. Было показано, что данная область характеризуется гиперинтенсивным сигналом на Т2-ВИ в течение первых 36-40 месяцев жизни. Что касается идиопатической задержки развития, Маричич с коллегами изучили 93 ребенка и не обнаружил определенных доказательств корреляции между идиопатической задержкой развития и задержкой при миелинизации на Т2-взвешенных изображениях.
: 30 окт 2020 , Братство кольца , том 88,
№3
МИЕЛИНовая защита нейрона: все начинается до рождения
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом – миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз – хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей – через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода – сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18—20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
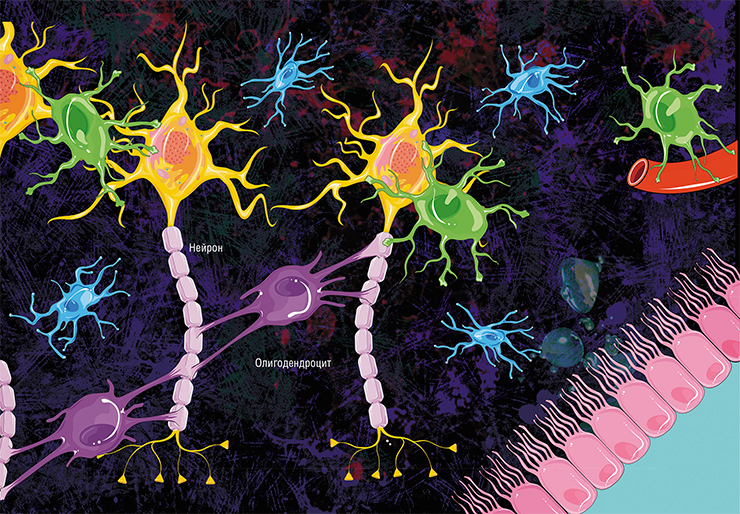
Не все знают, что миелин – это множество слоев клеточной мембраны, много раз «намотанных» на аксон. Формируется миелин плоскими выростами «служебных» глиальных клеток, цитоплазма в которых практически отсутствует. Миелиновая оболочка не непрерывна, а дискретна, с промежутками (перехватами Ранвье). Поэтому аксон обладает более быстрой скачкообразной проводимостью: скорость прохождения сигнала по волокнам с миелином и без него может отличаться в сотни раз. Что касается молекулярного состава «изолятора», то он, как и все клеточные мембраны, состоит преимущественно из липидов и белков
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) – биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин – в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы – врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Литература
Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635
Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH)
: 30 окт 2020 , Братство кольца , том 88,
№3
Myelination
UELI SUTER, RUDOLF MARTINI, in Peripheral Neuropathy (Fourth Edition), 2005
Regulation of Myelin Genes
Myelination during development and after demyelination demands an extremely high synthesis rate of myelin proteins and lipids within a short period of time. To accomplish this precisely regulated task, the myelination process is guided by the coordinated expression of genes that encode myelin components.185 The principal control of the system is governed by transcription factors. Some of these are present ubiquitously in many cell types, including Schwann cells, whereas others are more specifically expressed. Together, these factors are responsible for the cell type–specific and differentiation stage–specific gene expression, including the regulation of myelination.197 In addition to the pivotal roles of transcription factors in orchestrating the myelination process, additional regulation at the posttranscriptional level by altering mRNA stability is likely, but this possibility has not yet been thoroughly explored experimentally in the PNS. Recent evidence suggests a particularly important role for the close interaction between neurons (axons) and the ensheathing Schwann cells in the regulatory network governing myelination.104,157 This finding may be part of the reason why the use of transcription factors by Schwann cells is quite different from that by oligodendrocytes, the myelinating counterpart in the CNS.197
Several parallel strategies have been employed to examine myelin gene regulation in the PNS. Major efforts have focused on the identification of transcription factors expressed by Schwann cells that might be master regulators of myelin gene expression, as has been found during muscle development (MyoD).20 This hunt has proved to be difficult, but some candidates have been identified. In particular, suppressed cyclic AMP (cAMP)–inducible POU protein (SCIP, Tst-1, Oct-6) plays a critical role in the regulation of PNS myelination because SCIP-deficient mice are characterized by severe congenital hypomyelination of peripheral nerves. However, the defect is transient and the nerves are close to normal at 3 months of age.81 Similarly, the zinc-finger family protein Egr2 (Krox20) appears to be required for the normal development of the myelinating Schwann cell phenotype. Transgenic mice carrying a null mutation in the egr2 gene display severe defects in Schwann cell development resulting in hyperproliferation and presumed differentiation arrest at the premyelination stage.186 Egr2 also regulates the expression of genes involved in PNS myelination.119 In line with these findings, different mutations affecting Egr2 are associated with CMT disease type 1, the Déjèrine-Sottas syndrome, and congenital hypomyelinating neuropathy (see Chapter 72).119,194
Additional transcription factors that may affect late steps in the differentiation of Schwann cells include Pax3, Krox24, and Brn5.157,199 Of particular importance is the transcription factor Sox10, which has been identified as a common transcriptional modulator for SCIP, Krox20, and Pax3. It was suggested that Sox10 is responsible for cell-type specificity by interacting with these transcription factors in developing and mature glia.87 Furthermore, a crucial role of Sox10 in early Schwann cell development has been demonstrated23,126 and reviewed by Lobsiger and colleagues.100 With regard to PNS myelination, Sox10 regulates MPZ (P0) and GJB1 (Cx32) gene expression.19,132 Mutations in each of these genes are responsible for distinct forms of CMT disease (see Chapter 71). Sox10 mutations are associated with Shah-Wardenburg syndrome (WS4), a neurocristopathy with intestinal aganglionosis, pigmentation defects, sensorineural deafness, and, in specific cases, alterations in myelination in the PNS and CNS.80,125,138 These Sox10 mutants are unable to activate the Cx32 promoter and, conversely, a specific mutation in the Cx32 promoter, previously described in a patient with CMT disease, impairs Sox10 function directly.19 This elegant series of studies provides a direct genetic link between the regulation of myelin gene expression by the transcription factors Egr2 and Sox10 and myelin deficiencies in inherited peripheral neuropathies. It suggests that factors involved in the regulation of myelin gene expression should be generally considered as candidates involved in the etiology of peripheral neuropathies. Furthermore, a general concept emerges that correct myelination, myelin maintenance, and axonal maintenance are crucially dependent on the correct expression levels of myelin proteins.13,104
Besides studying the role of transcription factors and their modulators, myelination-related, cell type–specific control can also be elucidated by the identification and characterization of cis-acting control elements of genes encoding myelin components.196 Transfection experiments in cultured Schwann cells have been used as a standard assay in this regard, followed by classic footprinting and bandshift assays to identify the sequences that are bound by transcription factors.24 However, there are limitations with this assay system because Schwann cells that have been kept in culture do not express myelin genes up to the rates that are observed in vivo during development and in regeneration. Co-culturing with neurons is required for myelination, but because of technical restrictions, this system is not well suited for gene transfer analysis. Transgenic mice, however, provide an excellent assay system to examine myelin gene regulation because numerous developmental and physiologic signals for correct interactions are present. Such a strategy has recently led to the identification of Schwann cell–specific enhancers that mediate axonal regulation in SCIP,106 MBP,59 Egr2,69 and PMP22103 genes. Initial results of studies with similar aims have been reported for the 2′,3′-cyclic nucleotide 3′-phosphodiesterase gene,30,73 the P0 gene,52 and the proteolipid protein gene.105 Apart from providing important insights into the molecular basis of the regulation of myelin genes, these studies have also generated important tools to target transgenic expression of genes of choice to Schwann cells.53,143 PMP22, the dosage-sensitive culprit gene of CMT disease type 1A and hereditary neuropathy with liability to pressure palsies, was reviewed by Suter and Snipes.176 Studies on PMP22 gene regulation during myelination may also provide the basis for future therapies.77,207
What are the signal transduction events that regulate Schwann cell myelination, and by which transcriptional effectors? Examination of the role of different signaling pathways in Schwann cell differentiation using Schwann cell–neuron co-cultures revealed that, at early stages, inhibition of phosphatidylinositol 3 (PI3)-kinase, but not myelin-associated protein (MAP) kinase, blocked Schwann cell elongation and subsequent myelination.113 After Schwann cells established a one-to-one relationship with axon segments, inhibition of PI3-kinase did not block myelin formation, but the myelin segments were shorter and the rate of myelin protein accumulation was decreased. PI3-kinase inhibition had no detectable effect on the maintenance of myelin sheaths in mature myelinated co-cultures. Interestingly, glial growth factor (GGF), a neuregulin-1 isoform, significantly inhibited myelination in the same system by preventing axonal segregation and ensheathment.208 Treatment of established myelinated cultures with GGF resulted in striking demyelination. The neuregulin receptors ErbB2 and ErbB3 are expressed on ensheathing and myelinating Schwann cells and are rapidly activated by GGF treatment. GGF treatment of myelinating cultures also induced phosphorylation of PI3-kinase, MAP kinase, and a 120-kDa protein. Thus neuronal mitogens, including neuregulins, may inhibit myelination during development, and activation of mitogen signaling pathways may contribute to the initial demyelination and subsequent Schwann cell proliferation observed in various pathologic conditions.
Surprisingly, functional information about the downstream transcriptional effectors mediating the events described above is still scarce.196 Several AP-1 (dimeric transcription factors of the Jun, Fos, and ATF family of basic leucine zipper proteins) binding sites have been found in putative regulatory regions of myelin genes. However, although c-Jun is expressed by Schwann cells, a direct functional role of AP-1 transcription factors in regulating PNS myelination remains unclear.174 Similarly, the transcription factor CREB (which becomes activated through phosphorylation) is found in Schwann cells, and a protein kinase A–dependent increase of CREB phosphorylation was observed after axonal stimulation and the elevation of cAMP, intracellular calcium, platelet-derived growth factor, or endothelins. Furthermore, β-neuregulin treatment causes sustained CREB phosphorylation, and this effect appears to be mainly dependent on the MAP kinase pathway.179 Although this is strong evidence for a function of CREB in the regulation of Schwann cells, a direct link to myelination has not yet been described. Such a link has been established for progesterone that promotes the myelination of sciatic nerves during regeneration after a cryolesion.86 Progesterone triggers a strong upregulation of Egr1 (Krox24), Egr2, Egr3, and FosB in cultured Schwann cells, most likely at the transcriptional level via the interaction of the hormone with its cognate receptor. Furthermore, neuroactive steroids are able to upregulate the mRNA levels of PMP22 and P0 and, thus, specific receptor ligands or antagonists may be promising candidates for therapeutic approaches in demyelinating inherited neuropathies.101,166
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780721694917500223
Structure, Function, and Development of the Nervous System
Mish Shoykhet, Robert S.B. Clark, in Pediatric Critical Care (Fourth Edition), 2011
Myelination
Myelination in the human CNS begins 1 to 2 months prior to birth in the visual system and extends to the other sensory systems over the first year of life.96 Further myelination of subcortical and cortical tracts continues in the posterior to anterior direction well into the third decade of life, consistent with the time course of maturation of cognitive functions in children and adolescents.87 Myelination is initiated by the preoligodendrocytes, which are exquisitely sensitive to injury by hypoxia and inflammation. Oligodendrocyte injury, with resulting disruption in axonal myelination, contributes significantly to the development of periventricular leukomalacia in preterm infants.97
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323073073100576
Myelination Events
Hannah C. Kinney, Joseph J. Volpe, in Volpe’s Neurology of the Newborn (Sixth Edition), 2018
Abstract
Myelination is characterized by the acquisition of the highly specialized myelin membrane around axons. It begins before birth within the caudal brain stem and progresses rostrally to the forebrain, with the most rapid and dramatic period of human central myelination within the first 2 years of postnatal life. It is during this critical period that myelin is initially laid down in virtually all white matter tracts, with the last site to myelinate intracortical fibers of the cerebral cortex, where myelination extends steadily into the third decade. The process of myelination begins with proliferation of oligodendroglia, which align along axons. The plasma membranes of the oligodendroglia become elaborated as the myelin membrane. The progression of the oligodendroglial lineage proceeds through four basic stages, beginning with the oligodendroglial progenitor and continuing successively with the preoligodendrocyte, immature oligodendrocyte, and mature oligodendrocyte. The molecular determinants of myelination include growth factors, hormones, cytokines, surface receptors, and secreted ligands. The process of myelination follows orderly, predictable sequences in which different fiber tracts begin to myelinate before or after birth, and progress at different rates, with tracts that are “fast,” “intermediate,” and “slow” myelinators relative to each other. Three principal mechanisms are considered in disorders of myelination: (1) arrested or abnormal development of oligodendrocyte precursors; (2) oligodendroglial dysfunction leadling to myelin breakdown; and (3) primary axonal disorders causing aberrant signaling and impaired trophic interactions with developing oligodendrocytes. Impairment in myelination occurs in a variety of disorders, including leukodystrophies, neuronal degenerations, amino acid and organic acidopathies, mitochondrial and peroxisomal disorders, and infections, among others.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323428767000089
Nervous System, Neuroembryology of
H.B Sarnat, L. Flores-Sarnat, in Encyclopedia of the Neurological Sciences (Second Edition), 2014
Myelination
Myelination of axons is not absolutely required for neuronal function, and many axons normally remain unmyelinated throughout life. Examples are many autonomic, especially sympathetic, nerves and more than half of the axons of the corpus callosum. Nevertheless, myelination greatly increases speed of conduction, and synaptic blocks may result from inadequate myelination. Myelin sheaths of axons are produced by oligodendrocytes, specialized glial cells derived from the neuroepithelium, in the CNS and by Schwann cells, derived from neural crest, in the peripheral nervous system (PNS). The transition from oligodendrocytes to Schwann cells forming continuous myelin sheaths can be seen at spinal and cranial nerve roots.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123851574010484
Epilepsy
Gregory L. Holmes, … Olivier Dulac, in Handbook of Clinical Neurology, 2012
Developmental changes in myelination
Myelination is an important developmental process that begins during the fifth fetal month with myelination of the cranial nerves, and continues throughout life. The major changes in myelination occur from 3 weeks to 1 year for all brain regions. Myelination appears to occur earliest in the posterior fossa, with the middle cerebellar peduncle identifiable by age 3 months. By the age of 1 year, all major white matter tracts including the corpus callosum, subcortical white matter, and the internal capsule are well defined. In contrast to the high rate of myelination in the first year, the changes between 1 and 2 years are more subtle, although changes in radial diffusivity on diffusion tensor imaging suggest a pruning process. The development of white matter begins from the center to the periphery and from the occipital to the frontal lobes (Gao et al., 2009).
During the first year of life, the magnetic resonance imaging (MRI) white matter signal on T2 changes from hyperintense to hypointense, and vice versa on T1 (Barkovich, 2000). Like other membranes, myelin is composed of a bilayer of lipids with several large proteins, most of which span the bilayer (including myelin basic protein and proteolipid protein). The outer lipid layers are composed mainly of cholesterol and glycolipids, whereas the inner portion of the lipid bilayer is composed mainly of phospholipids. It is thought that the high signal intensity seen on T1-weighted images with the maturation of white matter results from T1 shortening caused by the cholesterol, glycolipids, and possibly the proteins in the outer lipid layers of the membrane, whereas it is thought that the diminishing signal intensity seen on the T2-weighted images with maturation results from a decreased number of water molecules caused by development of the hydrophobic phospholipid inner layer (Svennerholm and Vanier, 1978; Svennerholm et al., 1978; Holland et al., 1986; Barkovich et al., 1988).
The changes in signal intensity in myelin with age may make interpretation of MRI scans in children with epilepsy difficult. Distinguishing leukoencephalopathies from normal age-dependent changes in myelination can be challenging. In addition, how well cortical dysplasias are seen on the MRI may be related to the degree of myelination. In some cortical dysplasias the lesion may be seen better on MRI before extensive myelination occurs (Eltze et al., 2005). However, in some cases cortical dysplasias may be more evident with increased myelination (Yoshida et al., 2008).
In addition to myelination affecting the clinical and EEG features of seizures, epilepsy and its causes may alter myelination. For example, delays in myelination have been seen in children with infantile spasms (Muroi et al., 1996; Natsume et al., 1996; Takano et al., 2007). Children with prenatally or perinatally acquired brain lesions appear to have more severe delays of myelination (Schropp et al., 1994). The mechanism by which seizures alter the rate of myelination is not known.
The myelination pattern may also have a significant role in when infantile spasms begin. Koo et al. (1993) reviewed 93 cases of infantile spasms with focal cerebral lesions confined to frontal, centrotemporoparietal, or occipital regions. The mean age of onset of infantile spasms was around 3 months in patients with occipital lesions, versus 6 months in those with centrotemporoparietal lesions, and 10 months in those with frontal lesions. It is therefore of considerable interest that myelination occurs in the occipital lobe and moves forward into the temporal, parietal, and frontal lobes. The age distribution pattern of spasm onset according to localization of cortical lesion was therefore closely correlated with that of the normal sequence of brain maturation, suggesting that myelination may be necessary for the seizures to occur.
With greater myelination of the frontal lobes there is a greater likelihood of seeing spike–wave discharges arising frontally. Lennox–Gastaut syndrome, with frontal predominantly slow spike–wave discharges, typically does not begin in the first year of life but may evolve from West syndrome as the brain myelinates more fully. Likewise, the development of epilepsy with myoclonic–astatic seizures is an age-related phenomenon, occurring in toddlers but not in infants (Doose, 1992).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780444528988000070
Disorders of myelin
Benjamin L.L. Clayton, … Paul J. Tesar, in Neurodevelopmental Disorders, 2020
13.2.3 Myelin plasticity in learning and memory
Myelination has also been reported to function in nervous system plasticity with the intriguing hypothesis that myelination in response to neuronal activity could be a form of myelin plasticity involved in learning and memory. CNS myelination is noncontinuous with sections of unmyelinated axon that could be the substrate for activity-dependent myelination (Tomassy et al., 2014). OPCs and oligodendrocytes in the CNS respond to neuronal activity. Optogenetic stimulation of neuronal circuits in awake mice leads to increased OPC proliferation followed by increased oligodendrogenesis and increased myelin thickness resulting in changes in motor behavior. Importantly, this oligodendrocyte and myelin-specific responses to neuronal activity could be blocked by pharmacological inhibition of oligodendrocyte differentiation (Gibson et al., 2014). Moreover, mice that are genetically unable to form new oligodendrocytes and myelin fail to learn a complex motor task, suggesting that motor skill learning requires de novo oligodendrocyte and myelin formation (McKenzie et al., 2014). This is an exciting new role for myelin that will be further clarified by ongoing and future research. Nevertheless, the role of myelin plasticity in learning and memory further highlights the importance of myelination for proper nervous system function.
These myelin functions, and new functions that await discovery, clearly refute the idea of myelinating glia as simply passive actors in the function of the nervous system. Instead, the many roles played by myelinating glia highlight the necessity for properly functioning oligodendrocytes and Schwann cells and explain the severity of the myelin disorders that will be the focus of this chapter.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128144091000136
Pediatric Disorders of Language
Wanda G. Webb PhD, CCC-SLP, in Neurology for the Speech-Language Pathologist (Sixth Edition), 2017
Myelination for Language
Myelination has been considered one of the more significant indexes of brain maturation and is often a prime correlate of speech and language. Myelination allows more rapid transmission of neural information along neural fibers and is particularly critical in a cerebral nervous system dependent on several long axon connections between hemispheres, lobes, and cortical and subcortical structures. Lack of maturation of myelin in language association fibers and language centers has frequently been suggested as a cause for developmental delays in language. Immaturity of myelogenesis has not been definitely proved as a demonstrable cause in speech-language delay, but the available data suggest it as a likely factor.
Myelogenesis is a cyclic process in which certain neural regions and systems appear to begin the process early and others much later. In some instances the myelogenetic cycle is short and in other cases much longer. Clear differences in rate of myelogenesis exist between different pathways. Myelination of the cortical end of the auditory projections extends beyond the first year, whereas myelination of the cortical end of the visual projections is complete soon after birth. A similar discrepancy exists between myelination of the auditory geniculotemporal radiations and visual geniculocalcarine radiations. These myelogenetic cycles appear to underlie the early visual maturity and slowly developing auditory maturity of the infant. Myelination cycles can be roughly correlated with the milestones of speech and language development, but because no behavioral way exists of assessing myelogenetic maturation in the living brain of the child with language delay, the concepts have little or no clinical utility for the speech-language pathologist (SLP).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323100274000130
Neurons and Their Properties
David L. Felten MD, PhD, … Mary Summo Maida PhD, in Netter’s Atlas of Neuroscience (Third Edition), 2016
1.16 Development of Myelination and Axon Ensheathment
Myelination requires a cooperative interaction between the neuron and its myelinating support cell. Unmyelinated peripheral axons are invested with a single layer of Schwann cell cytoplasm. When a peripheral axon at least 1 to 2 µm in diameter triggers myelination, a Schwann cell wraps many layers of tightly packed cell membrane around a single segment of that axon. In the CNS, an oligodendroglia cell extends several arms of cytoplasm, which then wrap multiple layers of tightly packed membrane around a single segment of each of several axons (or occasionally two autonomic preganglionic axons). Although myelination is a process that occurs most intensely during development, Schwann cells may remyelinate peripheral axons following injury, and oligodendroglial cells may proliferate and remyelinate injured or demyelinated central axons in diseases such as multiple sclerosis.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323265119000011
Language Mechanisms in the Developing Brain
Russell J. Love Ph.D., Wanda G. Webb Ph.D., in Neurology for the Speech-Language Pathologist, 1992
Myelination for Language
Myelination has been considered one of the more significant indices of brain maturation and often a prime correlate of speech and language, as indicated in Chapter 1. Myelination allows for more rapid transmission of neural information along neural fibers and is particularly critical in a cerebral nervous system that is dependent on several long axon connections between hemispheres, lobes, and cortical and subcortical structures. Lack of maturation of myelin in language association fibers and language centers had frequently been suggested as a cause for developmental delays in language. Immaturity of myelogenesis had not been definitely proved as a demonstrable cause in speech-language delay, but the available data suggest it as a likely factor.
Myelogenesis is a cyclic process in which certain neural regions and systems appear to begin the process early and others much later. In some instances the myelogenetic cycle is short, in other cases much longer. Clear differences in rate of myelogenesis exist between different pathways. Myelination of the cortical end of the auditory projections extends beyond the first year, whereas myelination of the cortical end of the visual projections is complete soon after birth. There is a similar discrepancy between myelination of the auditory geniculotemporal radiations and visual geniculocalcarine radiations. These myelogenetic cycles appear to underlie the early visual maturity and slowly developing auditory maturity of the infant. Myelination cycles can be roughly correlated with the milestones of speech and language development, but since there is no behavioral way of assessing myelogenetic maturation in the living brain of the child with language delay, the concepts have little or no clinical utility for the present-day speech-language pathologist.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780750690768500174
Structural brain development
Stefanie C. Bodison, … Elizabeth R. Sowell, in Neural Circuit and Cognitive Development (Second Edition), 2020
14.2.2 Myelination
Myelination of axonal projections by oligodendroglia is also a prominent component of early brain development. This process begins in utero, continues rapidly through the first 5 years of life, and remarkably extends—although at a slower rate—through young adulthood. Intracortical histological preparations by Kaes in 1907 were some of the first to demonstrate this prolonged trajectory of myelination and also its striking regional variability in timing (Kaes, 1907; Kemper, 1994). These slides not only demonstrated earlier trajectories in some areas (posterior temporal, precentral, and postcentral cortex) than others (superior parietal, anterior temporal, anterior frontal cortex) but also showed that regions with a more protracted developmental trajectory have more pronounced changes during older age. This has helped to form the “first-in-last-out” theory of aging (Davis et al., 2009), which suggests that higher-order cognitive manifestations (e.g., problem solving and logical reasoning)—some of the last to develop (Luna et al., 2004)—are some of the first to degenerate in old age. Furthermore, the visible spread of myelin outward into the cortex results in an apparent cortical thinning, which suggests that normal developmental decreases in cortical thickness (discussed later) may be due, in part, to this progressive increase in myelin and not simply due to regressive changes such as synaptic pruning and cell loss.
These initial observations in intracortical tissue were extended to the white matter in pioneering work performed by Yakovlev and Lecours in the 1960s. They demonstrated that white matter myelination begins in utero during the second trimester of pregnancy and continues throughout young adulthood (Yakovlev and Lecours, 1967). Additionally, they extended the earlier observations of regional variations in the timing of myelination and described a general posterior-to-anterior trend in the timing of white matter myelination during development that has also been replicated in other samples (Kinney et al., 1988). Later independent research targeting the hippocampal formation has also noted striking increases in myelination, with a 95% increase observed in the extent of myelination relative to brain weight during the first two decades of life. Surprisingly, the authors noted that expanding myelination continued even through the fourth to sixth decades of life (Benes et al., 1994). Taken together, these observations suggest that structural white matter development, in the form of advancing myelination, proceeds in tune with overall cognitive development—with areas involved in lower-order sensory and motor function myelinating earlier than areas involved with higher-order executive function. This correlated timing implies that there may be some relationship between advancing brain function and increased myelination; however, postmortem studies are limited from investigating this directly.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128144114000147
From Wikipedia, the free encyclopedia
Myelinogenesis is the formation and development of myelin sheaths in the nervous system, typically initiated in late prenatal neurodevelopment and continuing throughout postnatal development.[1] Myelinogenesis continues throughout the lifespan to support learning and memory via neural circuit plasticity as well as remyelination following injury.[2] Successful myelination of axons increases action potential speed by enabling saltatory conduction, which is essential for timely signal conduction between spatially separate brain regions, as well as provides metabolic support to neurons.[3]
Stages[edit]
Myelin is formed by oligodendrocytes in the central nervous system and Schwann cells in the peripheral nervous system. Therefore, the first stage of myelinogenesis is often defined as the differentiation of oligodendrocyte progenitor cells or Schwann cell progenitors into their mature counterparts,[4] followed by myelin formation around axons.[5]
The oligodendrocyte lineage can be further classified into four stages based on their relation to the onset of myelination:[6]
- Differentiation: OPCs exit their proliferative, self-renewing state and begin to express genes and proteins associated with oligodendrocyte fate commitment.
- Preoligodendrocyte: These cells express the O4 antigen and develop multiple processes which extend radially with no particular organization.[7]
- Immature oligodendrocyte: Sometimes referred to as premyelinating oligodendrocytes, these cells extend «pioneer processes» which contact axons and anchor premyelinating oligodendrocytes to neurons such that they are poised to commence myelinogenesis in response to axonal signals. These pioneer processes grow longitudinally along their target axons.[7]
- Mature oligodendrocyte: After myelinogenesis, mature oligodendrocytes surround axons in organized, multilamellar myelin sheaths that contain myelin basic protein (MBP) and myelin proteolipid protein (PLP).
Myelinogenesis thus encompasses the process of transition between phases 3 and 4.[6] Upon initiation of myelinogenesis, each pioneer process forms lamellar extensions which extend and elaborate circumferentially around the target axon. This forms the first turn of the myelin sheath.[7] The sheath continues to expand along the length of the target axon while new membrane is synthesized at the leading edge of the inner tongue of the developing myelin sheath, which begins to take on a spiral cross-sectional structure.
To drive proper assembly of membrane layers, PLP is inserted into the membrane to stabilize interactions between external leaflets of the myelin membranes; MBP is locally translated and inserted into the cytoplasmic membrane leaflets to strengthen myelin membranes internally.[8] In concert with the formation of axonal nodes of Ranvier, the myelin sheath’s edges form paranodal loops.[9]
Mechanism[edit]
Neuron with oligodendrocyte and myelin sheath showing cytoskeletal structures at a node of Ranvier
The basic helix–loop–helix transcription factor OLIG1 plays an integral role in the process of oligodendrocyte myelinogenesis by regulating expression of myelin-related genes. OLIG1 is necessary in order to initiate myelination by oligodendrocytes in the brain, but is somewhat dispensable in the spinal cord.[10]
Axon-derived signals regulate the onset of myelinogenesis. Researchers studied regenerating PNS axons for 28 weeks in order to investigate whether or not peripheral axons stimulate oligodendrocytes to begin myelination. Experimental induction of myelination by regenerating peripheral axons demonstrated that Schwann cells and oligodendrocytes have a shared mechanism to stimulate myelination.[11] A similar study working to provide evidence for neuronal regulation of myelinogenesis suggested that myelin formation was due to Schwann cells that were controlled by an undefined property of an associated axon.[11]
Recent research in rats has suggested that apotransferrin and thyroid hormone act both separately and synergistically to promote myelinogenesis, as apotransferrin promotes expression of thyroid hormone receptor alpha.[12]
Peripheral myelinogenesis[edit]
1. Axon 2. Nucleus of Schwann cell 3. Schwann cell 4. Myelin sheath 5. Neurilemma
Peripheral myelinogenesis is controlled by the synthesis of proteins P1, P2, and P0.[13] By using SDS-PAGE, researchers revealed distinct bands with band sizes of 27,000 Daltons (P1), 19,000 Daltons (P2), and 14,000 Daltons (P0). Studies have also shown that P1 and P2 are active before P0 since this protein comes from the peripheral nervous system.[13] In the process of regeneration, Schwann cells re-synthesize proteins associated with myelin-specific proteins when axonal presence is re-established. Synthesis of myelin-specific proteins only occurs in Schwann cells associated with axons.[13] Furthermore, membrane-membrane interactions between axons may be required to promote the synthesis of P1, P2, and P0.
Myelinogenesis in the optic nerve[edit]
The process and mechanistic function of myelinogenesis has traditionally been studied using ultrastructure and biochemical techniques in rat optic nerves. The implementation of this method of study has long allowed for experimental observation of myelinogenesis in a model organism nerve that consists entirely of unmyelinated axons. Furthermore, the use of the rat optic nerve helped provide insight for early myelinogenesis researchers into improper and atypical courses of myelinogenesis.[14]
One early study showed that in the developing rat optic nerves, formation of oligodendrocytes and subsequent myelination occurs postnatal. In the optic nerve, the oligodendrocyte cells divided for the final time at five days, with the onset of myelin formation occurring on or around day 6 or 7. However, the exact process by which the oligodendrocytes were stimulated to produce myelin was not yet fully understood, but early myelination in the optic nerve has been linked to a rise in the production of various lipids – cholesterol, cerebroside, and sulfatide.[14]
As researchers began to do postnatal research, they found that myelinogenesis in the rat optic nerve initially commences with axons the largest diameters before proceeding to the remaining smaller axons. In the second week postnatal, oligodendrocyte formation slowed – at this point, 15% of axons have been myelinated – however, myelinogenesis continued to rapidly increase. During the fourth week postnatal, nearly 85% of the axons in the rat optic had been myelinated.[14] During the fifth week and onward toward week sixteen, the myelination decelerated and the remaining unmyelinated axons were ensheathed in myelin.[15] Through the rat optic nerve, early research made significant contributions to knowledge in the field of myelinogenesis.
Role of sulfatides[edit]
Studies on the developing optic nerve revealed that galactocerebroside (which forms sulfatide) appeared on the 9th post-natal day and reached a peak on the 15th post-natal day.[14] This expression was similar to a period where the optic nerve showed a maximal myelination period of the axon. As the activity of axon myelination decreased, and one could conclude that the activity of the enzyme is paralleled with the incorporation of sulfate ([35S]) into sulfatide in vivo.
The studies on a rat optic nerve revealed that 15 days post-natal is when an increase in myelination is observed. Before this time period, most of the axons, roughly about 70%, are not myelinated. At this time, [35S] Sulfate was incorporated into sulfatide and the activity of cerebroside, sulfotransferase reached a peak in enzyme activity. This time frame also showed a period of maximal myelination based on the biochemical data.[14]
In the CNS, sulfatide, sulfated glycoproteins, and sulfated mucopolysaccharides appear to be associated with neurons rather than myelin. When graphing the amount of sulfatide made from [35S] and the activity of sulfotransferase, we get to distinguished peaks.[14] The peaks occur on the 15th post-natal day. These peaks corresponded with the maximal myelination period of the optic nerve that has been seen throughout the experiment.[14]
In conclusion, the early phase of myelination was correlated with the increases synthesis of lipids, cholesterol, cerebroside, and sulfatide.[14] It is likely that these compounds are synthesized and packaged in the Golgi Apparatus of oligodendroglia.[14] Even though the transport of these lipids is unknown, it appears that myelination is delayed without their synthesis.
Clinical significance[edit]
Because myelin forms an electrically insulating layer that surrounds the axon of some nerve cells, any demyelinating disease can affect the functioning of the nervous system. One such disease is multiple sclerosis (MS), where demyelination occurs in the central nervous system (CNS).[16] Although research is being conducted on protecting oligodendrocytes and promoting remyelination in MS,[17] current therapies mainly address the role of the immune system in demyelination.[18]
Research History[edit]
Another researcher, Paul Flechsig spent most of his career studying and publishing the details of the process in the cerebral cortex of humans. This takes place mostly between two months before and after birth. He identified 45 separate cortical areas and, in fact, mapped the cerebral cortex by the myelination pattern. The first cortical region to myelinate is in the motor cortex (part of Brodmann’s area 4), the second is the olfactory cortex and the third is part of the somatosensory cortex (BA 3,1,2).
The last areas to myelinate are the anterior cingulate cortex (F#43), the inferior temporal cortex (F#44) and the dorsolateral prefrontal cortex (F#45).
In the cerebral convolutions, as in all other parts of the central nervous system, the nerve-fibres do not develop everywhere simultaneously, but step by step in a definite succession, this order of events being particularly maintained in regard to the appearance of the medullary substance. In the convolutions of the cerebrum the investment with medullary substance (myelinisation) has already begun in some places three months before the maturity of the foetus, whilst in other places numerous fibres are devoid of medullary substance even three months after birth. The order of succession in the convolutions is governed by a law identical with the law which I have shown holds good for the spinal cord, the medulla oblongata, and the mesocephalon, and which may be stated somewhat in this way- that, speaking approximately, equally important nerve-fibres are developed simultaneously, but those of dissimilar importance are developed one after another in a succession defined by an imperative law (Fundamental Law of Myelogenesis). The formation of medullary substance is almost completed in certain convolutions at a time when in some it is not even begun and in others has made only slight progress.[19]
References[edit]
- ^ Eilam, R.; Bar-Lev, D.D.; Levin-Zaidman, S.; Tsoory, M.; LoPresti, P.; Sela, M.; Arnon, R.; Aharoni, R. (2014). «Oligodendrogenesis and myelinogenesis during postnatal development effect of glatiramer acetate». Glia. 62 (4): 649–665. doi:10.1002/glia.22632. PMID 24481644. S2CID 25559134.
- ^ Williamson JM, Lyons DA (2018). «Myelin Dynamics Throughout Life: An Ever-Changing Landscape?». Front Cell Neurosci. 12: 424. doi:10.3389/fncel.2018.00424. PMC 6252314. PMID 30510502.
- ^ Philips T, Rothstein JD (2017). «Oligodendroglia: metabolic supporters of neurons». J Clin Invest. 127 (9): 3271–3280. doi:10.1172/JCI90610. PMC 5669561. PMID 28862639.
- ^ Serrano-Regal MP, Luengas-Escuza I, Bayón-Cordero L, Ibarra-Aizpurua N, Alberdi E, Pérez-Samartín A; et al. (2020). «Oligodendrocyte Differentiation and Myelination Is Potentiated via GABAB Receptor Activation». Neuroscience. 439: 163–180. doi:10.1016/j.neuroscience.2019.07.014. PMID 31349008. S2CID 198934117.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Watkins, T., Mulinyawe, S., Emery, B., Barres, B. (2008). Distinct Stages of Myelination Regulated by Y-Secretase and Astrocytes in a Rapidly Myelinating CNS Coculture System. 555-569
- ^ a b Kinney, H. C., & Volpe, J. J. (2018). Myelination Events. Volpe’s Neurology of the Newborn, 176–188. doi:10.1016/b978-0-323-42876-7.00008-9
- ^ a b c Friedrich, VL., Hardy, RJ., (1996). Progressive Remodeling of the Oligodendrocyte Process Arbor during Myelinogenesis. 243-54.
- ^ Baron W, Hoekstra D (2010). «On the biogenesis of myelin membranes: sorting, trafficking and cell polarity». FEBS Lett. 584 (9): 1760–70. doi:10.1016/j.febslet.2009.10.085. PMID 19896485.
- ^ Snaidero N, Möbius W, Czopka T, Hekking LH, Mathisen C, Verkleij D; et al. (2014). «Myelin membrane wrapping of CNS axons by PI(3,4,5)P3-dependent polarized growth at the inner tongue». Cell. 156 (1–2): 277–90. doi:10.1016/j.cell.2013.11.044. PMC 4862569. PMID 24439382.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ^ Xin, M. (2005). Myelinogenesis and Axonal Recognition by Oligodendrocytes in Brain Are Uncoupled in Olig1-Null Mice. Journal of Neuroscience, 25(6), 1354-1365. doi:10.1523/jneurosci.3034-04.2005
- ^ a b Weinberg, E., & Spencer, P. (1979). Studies on the control of myelinogenesis. 3. Signaling of oligodendrocyte myelination by regenerating peripheral axons. Brain Research, 162(2), 273-279. doi:10.1016/0006-8993(79)90289-0
- ^ Marziali, L.N., Garcia, C.I., Pasquini, J.M. (2015). Transferrin and thyroid hormone converge in the control of myelinogenesis. Experimental Neurology. Vol 265. 129–141.
- ^ a b c Politis, MJ, N. Sternberger, Kathy Ederle, and Peter S. Spencer. «Studies on the Control of Myelinogenesis.» The Journal of Neuroscience 2.9 (1982): 1252-266.
- ^ a b c d e f g h i Tennekoon, GI., Cohen, SR., Price, DL., McKhann, GM. (1977). Myelinogenesis in optic nerve. A morphological, autoradiographic, and biochemical analysis. Journal of Cell Biology, 72(3), 604-616.
- ^ Dangata, Y., Kaufman, M. (1997). Myelinogenesis in the Optic Nerve of (C57BL x CBA) F1 Hybrid Mice: A Morphometric Analysis.European Journal of Morphology, 35(1), 3-18.
- ^ «NINDS Multiple Sclerosis Information Page». National Institute of Neurological Disorders and Stroke. 19 November 2015. Archived from the original on 13 February 2016. Retrieved 6 March 2016.
- ^ Rodgers, Jane M.; Robinson, Andrew P.; Miller, Stephen D. (2013). «Strategies for protecting oligodendrocytes and enhancing remyelination in multiple sclerosis». Discovery Medicine. 86 (86): 53–63. PMC 3970909. PMID 23911232.
- ^ Cohen JA (July 2009). «Emerging therapies for relapsing multiple sclerosis». Arch. Neurol. 66 (7): 821–8. doi:10.1001/archneurol.2009.104. PMID 19597083.
- ^ Flechsig, Paul (1901-10-19). «Developmental (myelogenetic) localisation of the cerebral cortex in the human subject». The Lancet. 158 (4077): 1028. doi:10.1016/s0140-6736(01)01429-5.
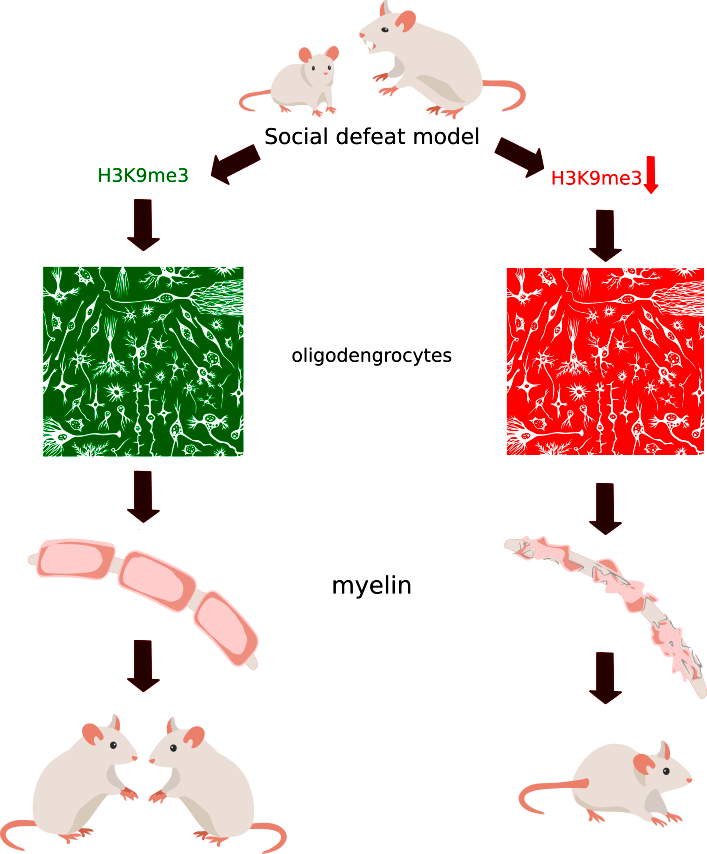
Статья на конкурс «био/мол/текст»: В недавней работе Валентины Боннефил и коллег были получены новые данные касательно молекулярных и опосредованных ими морфологических различий в мозге. По предположениям исследователей, именно они обусловливают различия реакций на сильный стресс. Для изучения этого явления была использована модель социального поражения, когда к испытуемой мыши подводят агрессивную мышь. После десяти дней исследуемые грызуны начинают вести себя по-разному — одни продолжают проявлять интерес к общению с другими особям, в то время как другие «замыкаются» в себе. Авторы работы показали, что вторая группа мышей характеризуется более высоким уровнем нарушений в нервной ткани из-за медленного ее восстановления, что, по-видимому, связано с эпигенетическими особенностями.
Согласно опросу 2017 года, проведенному Американской психологической ассоциацией, три из четырех американцев сообщают о симптомах стресса в течение тридцати дней, предшествующих опросу [1]. Мы сталкиваемся со всевозможными стрессами — личными, финансовыми, карьерными, новостными и т.д. — все чаще и чаще. Более того, с популярностью интернета появляются и новые виды потребностей и связанных с ними стрессов, например, в 2016 году было проведено исследование по изучению «синдрома упущенной выгоды» (fear of missing out) у подростков. Результаты показали, что увеличившаяся потребность в популярности связана с возросшим использованием Facebook и что эта связь опосредована страхом пропустить какое-либо событие. Появление этого страха, в свою очередь, вызывает повышение уровня стресса [2].
Но растет научное понимание влияния избыточного стресса в долгосрочной перспективе. Исследования показывают, что воздействие стрессовых факторов, начиная от физического насилия и заканчивая социальными конфликтами, значительно увеличивает риск возникновения нарушений психики, таких как депрессия или посттравматическое стрессовое расстройство (ПТСР).
Однако люди по-разному реагируют на один и тот же уровень стресса: некоторые могут проявить устойчивость и быстро восстановиться, в то время как другие борются за выживание и ощущают себя подавленными и потерянными. Механизмы этого различия всё еще вызывают вопросы. Кроме того, исследователи всё еще оценивают, как развиваются долгосрочные последствия индивидуального воздействия стресса.
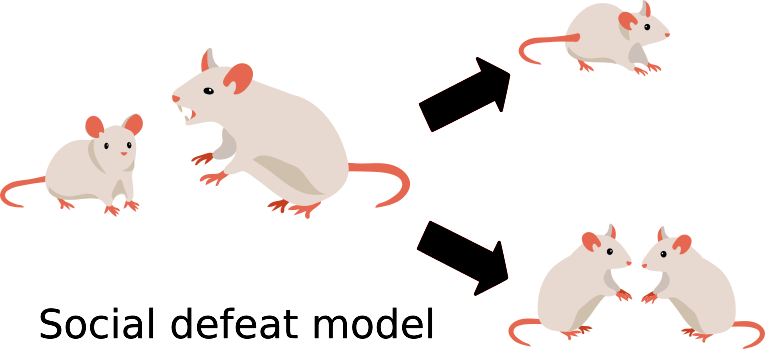
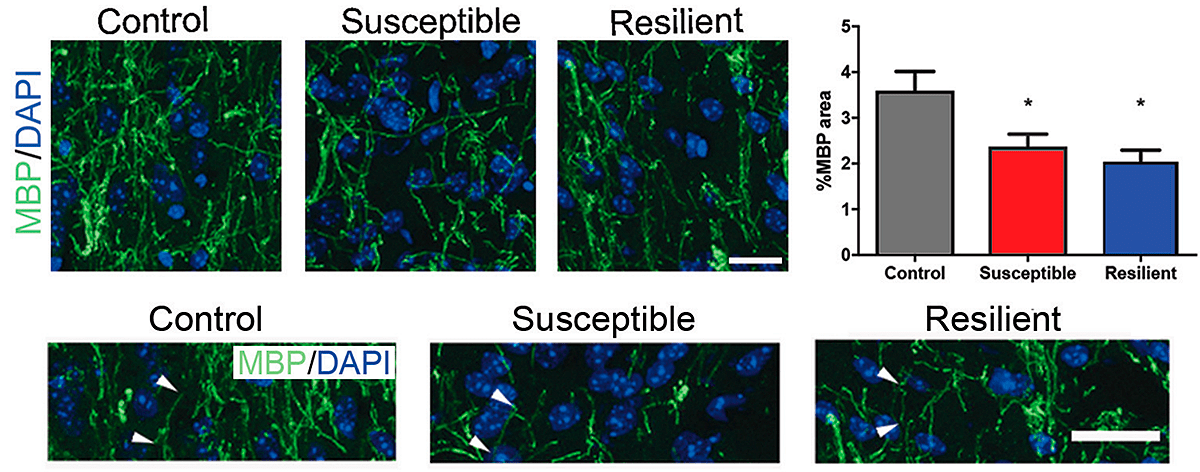
В работе Валентины Боннефил и коллег 2019 года показано, что поведение, характерное для депрессии, может быть выявлено после социального поражения (рис. 1) в виде повторных атак агрессивных мышей по пять минут в день в течение десяти дней, а также после очаговой демиелинизации в медиальной префронтальной коре [3].
Миелин — защитное покрытие из отростков ненервных клеток (олигодендроцитов), которое изолирует нейроны, а также способствует увеличению скорости проведения сигнала между ними. Разрушение миелина (иначе — демиелинизация) связывают с прогрессией нарушения координации и равновесия и многими другими заболеваниями. Подробнее можно почитать в статье на «Биомолекуле» «Обертка для аксона» [4].
Рисунок 1. Модель социального поражения основана на различной реакции мышей на агрессора.
иллюстрация автора статьи
Ученые, в основном сосредоточившись на роли нейронов, давно проводят исследования того, как различия в реакции на стресс могут найти объяснение в биологических процессах. Тем не менее нейроны представляют собой только один тип клеток головного мозга, и появляется все больше доказательств того, что взаимодействия между нейронными и ненейронными клетками играют важную роль в ответе на стресс.
Исследования выявили, что умеренный уровень ацетилирования гистонов требуется для дифференцировки олигодендроцитов, в то время как высокие уровни ацетилирования гистонов связаны с нарушением миелинизации (из-за отсутствия молодых олигодендроцитов, создающих миелин) [5], [6]. Позднее обнаружили, что уровень миелинизации связан с приспосабливаемостью к изменяющимся условиям (в статье — к социальной изоляции) [7]. В той же работе показано, что истончение миелина связано с незрелым ядерным хроматином, а также повышенным уровнем ацетилирования и пониженным уровнем метилирования. Все изменения в данном исследовании были зафиксированы в префронтальной коре.
Что было сделано?
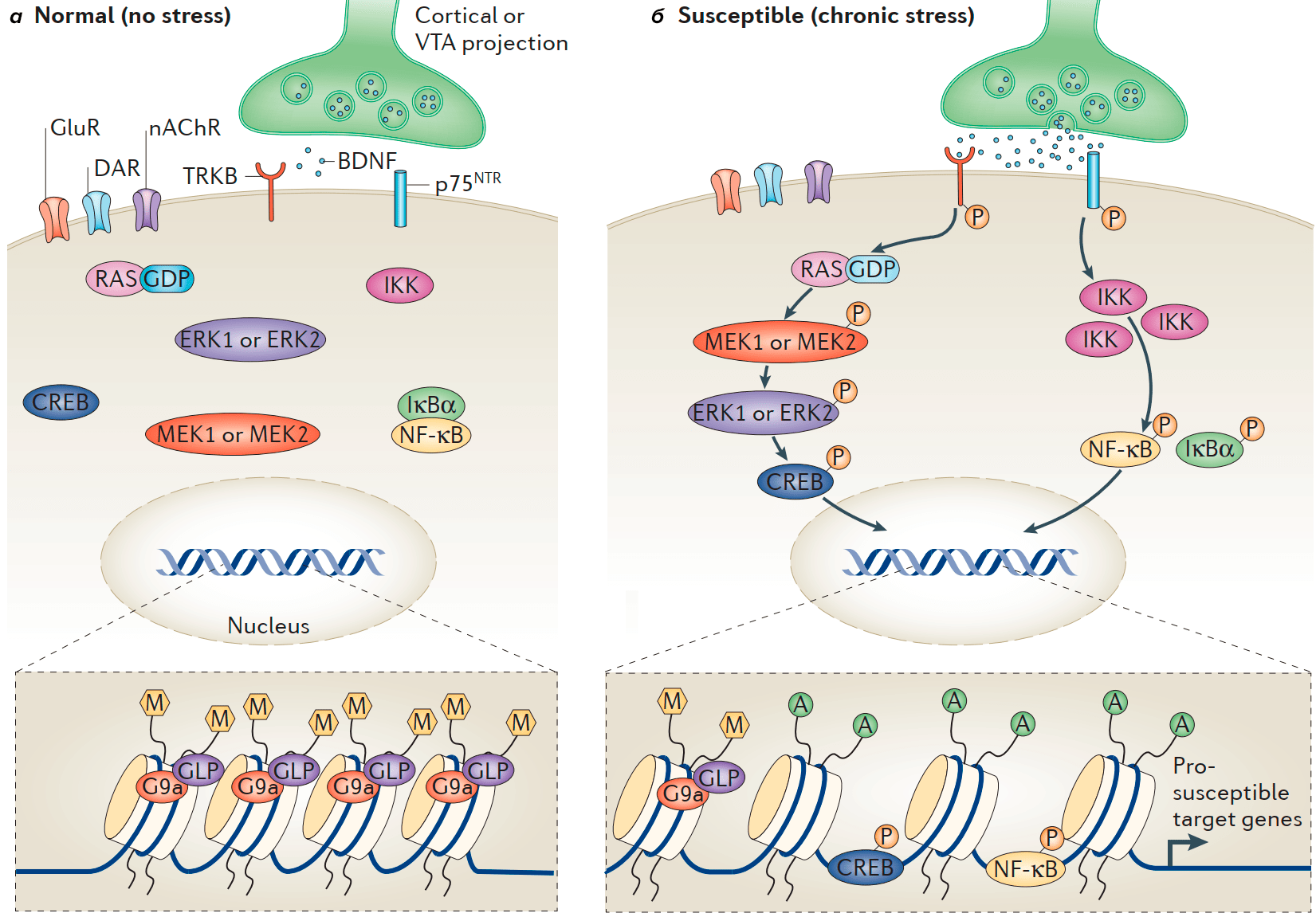
Сотрудники Центра перспективных научных исследований (ASRC) выяснили, что олигодендроциты, которые образуют миелиновые оболочки в центральной нервной системе, являются ключевыми факторами, определяющими, влияет ли на нас стресс. Эпигенетика позволяет объяснить всё больше вещей, которые ранее не смогла объяснить генетика (подробнее в статье «Эпигенетика: невидимый командир генома» [8]). И дифференцировка олигодендроцитов может зависеть от понижения уровня метилирования (а конкретно, метки H3K9me3 — метилирования гистона H3 в положении 9), сопряженного с разрыхлением (снижением плотности) хроматина и запуском экспрессии генов, специфичных для взрослых олигодендроцитов [9].
Исследователи подвергли мышей (10 — в экспериментальной группе; и 8 — в контрольной) воздействию социального поражения [3]. В итоге мышь либо оставалась социально вовлеченной (активно контактировала с другими особями) и потому была классифицирована как «устойчивая», либо избегала социальных контактов после встречи с агрессором, что позволяло отнести ее к группе «восприимчивых» животных. При этом невосприимчивые мыши были практически неотличимы от контрольной группы, которая не контактировала с агрессором.
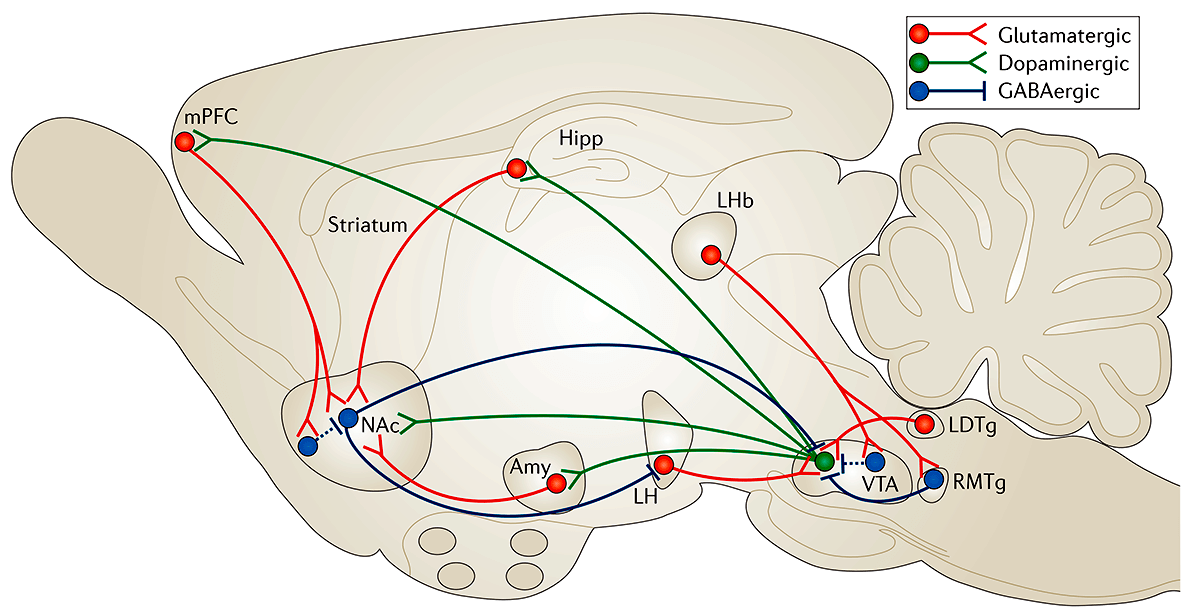
Пристальное внимание было уделено прилежащему ядру (NAc) и медиальной префронтальной коре (mPFC), поскольку результаты предыдущих исследований свидетельствуют, что именно эти зоны определяют реакцию на стресс [10].
Что это за области мозга и что про них известно?
Прилежащее ядро является частью взаимосвязанной системы вентральной области — прилежащего ядра (VTA—NAc). Эта система имеет решающее значение для получения «наград» за счет выделения дофамина. VTA-дофаминергические нейроны также иннервируют несколько областей префронтальной коры (PFC), центральной миндалины, базолатеральной миндалины (BLA) и гиппокампа, а также другие области (рис. 2). Все эти так называемые области вознаграждения мозга сложным образом взаимосвязаны: например, NAc получает плотную глутаматергическую иннервацию из PFC, миндалины и гиппокампа; PFC, миндалина и гиппокамп образуют взаимные глутаматергические связи друг с другом. Функциональный выход каждой из этих областей модулируется несколькими типами ГАМКергических интернейронов.
Рисунок 2. Схема системы вознаграждения вентральной области — прилежащего ядра (VTA—NAc). Упрощенная схема основных дофаминергических, глутаматергических и ГАМКергических связей вокруг вентральной области (VTA) и прилежащего ядра (NAc) в головном мозге грызунов. Первичная схема системы вознаграждения включает дофаминергические связи из VTA в NAc, которые высвобождают дофамин в ответ на стимулы, связанные с вознаграждением (и в некоторых случаях стимулы, связанные с отвращением). Есть также ГАМКергические проекции от NAc до VTA; NAc также получает плотную иннервацию из глутаматергических моносинаптических контуров медиальной префронтальной коры (mPFC), гиппокампа (Hipp) и миндалины (Amy), а также из других областей. VTA получает глутаматергические стимулы от латерального дорсального сегмента (LDTg), латерального поводка эпиталамуса (LHb) и латерального гипоталамуса (LH). Эти различные глутаматергические входы контролируют аспекты восприятия и памяти, связанные с вознаграждением. Пунктирные линии показывают внутренние тормозные проекции. Красные линии — глутаматергические связи; зеленые — дофаминергические; синие — ГАМКергические.
Выделение дофамина в прилежащее ядро — это способ, с помощью которого мозг получает сигналы удовольствия. Чувство удовольствия побуждает нас повторять поведение, жизненно важное для выживания [11], а нарушения в получении дофаминовой награды связаны с такими симптомами, как ангедония и нарушение восприятия и воспоминаний, связанных с вознаграждением [12].
Медиальная префронтальная кора — часть префронтальной коры, которая также связана с системой вознаграждений, как было показано выше. Согласно результатам исследований, пациенты с депрессией имеют меньший объем коры, включая уменьшенный объем белого вещества в этой области, что и ведет к нарушению восприятия событий, которые раньше приносили радость [13].
Что обнаружили и какие сделали выводы?
В обсуждаемой работе было показано, что поведение, связанное с социальным избеганием, может быть выявлено после социального поражения, а также после очаговой демиелинизации в mPFC, и поэтому может быть вызвано гипомиелинизацией. Обнаружили также, что миелин в прилежащем ядре истончается у обеих групп мышей (рис. 3). Но только у «восприимчивых» мышей выявили меньшее количество зрелых олигодендроцитов, а охват миелином оказался короче и тоньше.
Рисунок 3. Изображения с конфокального микроскопа и количественные оценки, показывающие иммуногистохимию основного белка миелина (МВР), контрастирующего с DAPI (4′,6-диамидино-2-фенилидолом, флюоресцентным красителем), 20-кратное увеличение. Control — контрольная группа; susceptible — «восприимчивая» группа; resilient — «устойчивая» группа. Статистический анализ проведен по одностороннему ANOVA с тестом Тьюки.
Более того, исследователи обнаружили снижение уровня метилирования гистонов (а именно метки H3K9me3, связанной с дифференцировкой незрелых олигодендроцитов) в предшественниках олигодендроцитов у «восприимчивых» мышей.
Метилирование гистонов представляет собой присоединение метильных групп к положительно заряженной аминокислоте лизину или аргинину с целью нейтрализации заряда. Связывание происходит с помощью фермента гистонметилтрансферазы. Это универсальный эпигенетический механизм, так как он приводит к активации или репрессии гена в зависимости от функции последнего. Метилирование гистонов в разных остатках служит маркером для связывания различных белковых активаторов/репрессоров, которые регулируют экспрессию гена.
Снижение уровня метилирования гистонов у предшественников олигодендроцитов, по-видимому, указывает на то, что эпигенетическая модификация может быть как причиной нарушения программы дифференцировки, так и ее следствием. Полученные данные позволяют нам говорить только о корреляции этих двух наблюдений, но не о причинно-следственной связи. Авторы говорят о возможности существования механизма эпигенетического переключения. Согласно этой концепции, стресс способен влиять на эпигенетическую модификацию предшественников олигодендроцитов, контролируя их развитие, а также отражается в миелиновых паттернах человека. В пользу этого говорит тот факт, что при образовании нового миелина его характеристики возвращаются к норме. Это свидетельствует о том, что изменения в результате этого стресса зачастую не вызывают повреждения ДНК, а только (обратимые) эпигенетические изменения.
Однако наличие причинно-следственной связи показано между истончением миелинового волокна и стремлением уклониться от социальных контактов. Был проведен эксперимент по введению лизолецитина , что повлекло за собой ожидаемое истончение миелина и последующее возникновение реакции социального избегания. Спустя три недели после этого структура волокна пришла в норму, и поведение мышей стало неотличимо от контрольной группы.
Лизолецитин (иначе — лизофосфатидилхолин) является сильнодействующим растворяющим мембрану химическим веществом, которое обычно вводят в белое вещество мозга в виде 1%-ного раствора, чтобы вызвать очаговую демиелинизацию. В 1972 г. Сьюзан Холл была первой, кто продемонстрировал использование лизолецитина для создания демиелинизирующих поражений в белом веществе спинного мозга взрослой мыши [14].
Таким образом, мы можем говорить о том, что дефектная миелинизация воспринимается как дезадаптивный механизм (нарушение адаптации), возникающий только у «восприимчивых» мышей после воздействия повторяющегося социального стресса. Ранее было обнаружено, что дефекты миелинизации появляются у социально изолированных взрослых мышей еще до проявлений поведения социального избегания, что связано с нарушениями в системе получения удовольствия, вплоть до ангедонии [7].
Ангедония — неспособность чувствовать удовольствие, по определению французского физиолога Теодюля Рибо [15]. Сейчас определение включает также пониженную мотивацию к действиям, которые раньше вызывали радость [16]. Это различие важно, например, для животных моделей ангедонии, в которых эмоциональный опыт удовольствия сложно измерить, но мотивацию получения вознаграждения гораздо легче исследовать [17]. Ангедонию встречают у людей с различными психическими заболеваниями и состояниями — депрессией, шизофренией, болезнью Альцгеймера; она также играет важную роль в посттравматическом стрессовом синдроме и расстройствах пищевого поведения.
Почему у мышей различная устойчивость к стрессу?
По-видимому, потому что у них различно число зрелых олигодендроцитов. Снижение уровня метилирования гистонов в предшественниках олигодендроцитов связано с нарушением дифференцировки (превращению в функциональные клетки), которая связана (коррелирует, по неподтвержденной гипотезе, ведет к) с истончением миелиновых волокон, что, в свою очередь, приводит к отсутствию адаптации к стрессу. Вот картинки с одной из гипотез о том, как все устроено (рис. 4).
Рисунок 4. Возможная схема различий реакции на социальное поражение, когда у одних мышей наблюдается пониженный уровень метилирования гистона H3 в положении 9, сниженный уровень зрелых олигодендроцитов и истончение миелина, а потому и избегание контактов с другими особями. В это же время другие мыши имели неотличимый от контрольных уровень метилирования гистона, их миелин не подвергся сильным изменениям, и они продолжали выражать интерес к общению с другими мышами. Social defeat model — модель социального поражения; oligodendrocytes — олигодендроциты; myelin — миелин.
иллюстрация автора статьи
Устойчивость к стрессу может возникнуть в результате активных стратегий преодоления, а не пассивного бездействия, определяемого как отсутствие адаптивного ответа. Одна из возможностей образования нового миелина в качестве стратегии преодоления связана с повышенной нейронной активностью у устойчивых мышей в нейронах префронтальной коры после социального поражения. Было показано, что оптогенетическая стимуляция префронтальной коры помогает формированию «устойчивого» фенотипа у мышей с социальным поражением.
Оптогенетическая стимуляция — использование света для контроля клеток на участке нервной ткани. Подконтрольные клетки предварительно генетически модифицированы для экспрессии светочувствительных ионных каналов. Метод позволяет осуществить оптическую модуляцию нейронной активности с высокой временной и пространственной разрешающей способностью, доходящей до размера единичного нейрона.
В то же время снижение качества и количества олигодендроцитов не является постоянным. Это говорит о том, что также вовлечен какой-то другой механизм, помимо обусловленного генетически, который централизованно регулирует развитие олигодендроцитов.
Молекулярная основа устойчивости была тщательно изучена в контексте нейронных клеток, иммунной и нейроэндокринной систем [18]. Авторы обсуждаемой статьи предлагают альтернативное, хотя и не исключающее существующие, объяснение, ставящее в центр миелинизирующую глию . Возможность образования нового миелина (как стратегия преодоления) связана с повышенной нейронной активностью у устойчивых мышей, о чем свидетельствует большая степень экспрессии определенных белков в глутаматергических нейронах mPFC устойчивых мышей после социального поражения [19].
Глия — ненейронные клетки нервной системы, осуществляющие поддержание гомеостаза нейронов, обеспечивая их защиту и питание, а также формирование миелина. В центральной нервной системе к глиальным клеткам относят, например, олигодендроциты, астроциты и микроглию.
А что про воспаление, связанное со стрессом?
Альтернативный механизм может быть основан на различиях в воспалительных компонентах между двумя группами. Изучение интерлейкинов при расстройствах настроения ведется уже более двадцати лет [20]. Центральный вопрос заключается в том, в какой из частей нервной системы — периферической или центральной — синтезируются цитокины, играющие главную роль в формировании воспалительного компонента расстройств настроения.
Интерлейкины — группа цитокинов, изначально известных как часть иммунного воспалительного ответа; но также найдено, что они регулируют нейронную функцию в центральной и периферической нервных системах.
Анализ маркеров периферического воспаления последовательно выявляет увеличение интерлейкинов-6 (IL-6), интерлейкинов-1β (IL-1β) и фактора некроза опухолей-α (TNFα) у пациентов с расстройствами настроения. Измененные центральные уровни этих факторов также были определены.
Известно, что снижение уровня синтеза IL-6 во всем организме или только в лейкоцитах способствует развитию «устойчивого» фенотипа [21]. Используя компьютерное моделирование, Скотт Руссо с коллегами показал, что одновременная тревожность, уменьшение объема гиппокампа и повышение уровня системного интерлейкина-6 характеризовали восприимчивый фенотип, у которого развились поведенческие и нейробиологические нарушения после социального поражения [22].
Однако следует учесть, что системные изменения IL-6 не могут объяснить регион-специфические различия в миелинизации у «восприимчивых» и «устойчивых» мышей. Интерлейкин-6 (IL-6) может продуцироваться глией центральной нервной системы [23], а предшественники олигодендроцитов экспрессируют рецепторы IL-6. Авторы обсуждаемой статьи предполагают, что уровень IL-6 может быть повышен в структурах, влияющих на дифференцировку предшественника олигодендроцитов и образование нового миелина в специфических областях мозга взрослого человека. В клетках запускаются каскады биохимических реакций, которые опосредуют эти эффекты. Например, ядерный фактор κB (NF-κB) представляет собой фактор транскрипции , наиболее известный своей ролью в периферических иммунных и воспалительных реакциях. Но он также является хорошо известной нисходящей мишенью для интерлейкина-6, интерлейкина-1β и TNFα в головном мозге и периферических тканях. Последние данные свидетельствуют о том, что сигнальный путь NF-κB регулирует систему вознаграждения в моделях депрессии [24].
Транскрипционный фактор — белок, связывающий ДНК в особых участках и регулирующий или инициирующий транскрипцию гена.
Например, в гиппокампе активация NF-κB участвует в нарушении нейрогенеза и индукции ангедонии [25]. В NAc хронический стресс после социального поражения увеличивает уровни киназы ингибитора NF-κB (IKK), что способствует активации NF-κB, который связывается с ДНК и изменяет транскрипцию группы генов. Одновременно меняется и эпигенетика — снижается уровень метилирования и повышается уровень ацетилирования. Это стимулирует образование новых незрелых шипиков на дендритах NAc. Данный процесс происходит только у восприимчивых животных, но не наблюдается у устойчивых особей (рис. 5). Прямое ингибирование IKK в NAc «обрезает» эти новые синапсы и обращает вспять связанные с ними депрессивные фенотипы [26]. Текущие исследования фокусируются на внутриклеточных сигнальных путях, посредством которых цитокины регулируют активность NF-κB, связанную со стрессом, а также нацелены на выявление транскрипционных мишеней NF-κB, которые опосредуют эти эффекты.
Шипики — выросты мембраны дендритов, играют важную роль в формировании и регуляции глутаматного синапса.
Рисунок 5. Пониженная устойчивость к стрессу через изменение транскрипции в NAc. Повышенная уязвимость к депрессии вследствие хронического социального поражения происходит отчасти благодаря передаче сигналов нейротрофического фактора мозга (BDNF) в прилежащем ядре (NAc). В контрольных условиях (а) активация рецепторной тирозинкиназы TRKB с помощью BDNF ограничена. Однако после предшествующего стимула, который увеличивает восприимчивость (например, повторный стресс — б), передача сигналов BDNF—TRKB в NAc увеличивается, вызывая повышение уровня фосфорилирование (обозначено P) и активность нескольких нижестоящих посредников передачи сигналов, включая циклический АМФ-чувствительный элемент-связывающий белок (CREB). Этот дезадаптивный ответ происходит не только через повышенное высвобождение BDNF в NAc из вентральной области (VTA), но также через эпигенетические модификации, которые дополнительно стимулируют сигнальные каскады BDNF. Например, хронический стресс увеличивает синтез RAS в NAc восприимчивых животных, вызывая снижение уровня репрессивного H3K9me2. На рисунке также показана индукция другого пути, опосредованного BDNF, включая ядерный фактор κB (NF-κB) и киназу ингибитора NF-κB (IKK) в NAc после хронического социального поражения стрессом у восприимчивых животных. Условные обозначения: А — ацетилирование; DAR — дофаминовый рецептор; ERK — внеклеточная сигнальная регулируемая киназа; IκBα — ингибитор NF-κB-α; MEK — ERK/MAPK киназа.
Другим механизмом, связывающим воспаление с развитием депрессивной симптоматики, является влияние цитокинов на гипоталамо-гипофизарную ось (HPA). Цитокины могут действовать на глюкокортикоидные рецепторы и косвенно активировать синтез кортикотропин-рилизинг-гормона (CRH), адренокортикотропного гормона (ACTH) и кортизола [27]. Степень, в которой цитокины индуцируют высвобождение ACTH и кортизола, является прогностическим фактором развития симптомов депрессии [28]. Это означает, что чувствительность оси HPA к воспалительной стимуляции особенно важна для развития аффективно-когнитивных симптомов депрессии.
Заключение
Отцом исследований стресса считают Ганса Селье, который определял стресс как «неспецифическую реакцию организма на любую потребность» и впервые предположил о наличии связи между стрессом и развитием заболеваний. Сейчас исследования стресса базируются на стыке фармакологии, патологии и нейронаук и направлены на изучение на молекулярном уровне.
Понимание изменений, которые вызывают стресс в организме, позволяет исследователям начать составлять карту потенциальных клинических вмешательств с конечной целью снижения его негативных последствий и предотвращения психических расстройств. Большинство современных методов лечения фокусируются на здоровье нейронов, но это исследование подтверждает возможность вмешательства в глиальные клетки, по крайней мере, в случае психических заболеваний, связанных со стрессом.
Несмотря на то, что данная статья добавляет ясности в наше понимание формирования двух групп в реакциях на социальное поражение, при переносе результатов на людей мы должны помнить о невозможности полностью смоделировать депрессию у животного по ряду причин. Во-первых, депрессия у людей — это не одно заболевание, а очень неоднородный синдром. Во-вторых, ключевые симптомы человеческой депрессии (то есть вина, суицидальность и грусть) не могут быть оценены (и могут не существовать вовсе в зависимости от того, как мы эти эмоции определяем [29]) у животных. И в-третьих, биология, лежащая в основе многих типов человеческой депрессии, остается плохо изученной. Однако ясно, что воздействие стресса увеличивает риск депрессии у людей, и, следовательно, большинство моделей депрессии грызунов полагаются на стрессовые факторы окружающей среды, чтобы вызвать симптомы, подобные депрессии, которые можно изучать механически.
Важное предостережение в отношении работы, описанной в этой статье (и в большинстве работ, использующих мышиные модели), заключается в том, что было использовано небольшое количество мышей, недостаточное для высокой достоверности результатов. Более того, исследование проводили исключительно на самцах грызунов, несмотря на тот факт, что в человеческом мире женщины в два раза чаще страдают расстройством настроения, чем мужчины [30]. И модели грызунов демонстрируют, что особи женского пола испытывают более депрессивное поведение после хронического стресса [31]. Было высказано предположение, что различия в развитии связанных с вознаграждением нейронных цепей могут предрасполагать женщин к депрессии [32]. Кроме того, прямое воздействие циркулирующих половых гормонов на систему вознаграждения может изменить чувствительность женщины к стрессу во время менструального цикла [33]. Исследования на грызунах действительно показали, что гормоны яичников изменяют пороги вознаграждения за стимуляцию мозга, что означает, что во время определенных фаз эстрального цикла женщины более склонны к ангедонии [34]. Это должно быть чрезвычайно высоким приоритетом для будущих исследований; мы должны определить, в какой степени рассмотренные выше механизмы применимы к моделям женской депрессии.
Важно также помнить, что наши реакции часто обусловлены опытом наших предков, который закодирован в эпигеноме (на «Биомолекуле» этому посвещена статья «Эпигенетика поведения: как бабушкин опыт отражается на ваших генах» [35]), что позволяет напомнить о важности поддержания психического здоровья во всех поколениях. И самый простой, ставший почти скучным совет (который все еще работает): достаточное количество сна, отдых и режим питания — это то, что мы уже сейчас можем сделать для улучшения своей эпигенетики.
- Winerman L. (2017). By the numbers: Our stressed-out nation. Monitor on Psychology. 11, 80;
- Ine Beyens, Eline Frison, Steven Eggermont. (2016). “I don’t want to miss a thing”: Adolescents’ fear of missing out and its relationship to adolescents’ social needs, Facebook use, and Facebook related stress. Computers in Human Behavior. 64, 1-8;
- Valentina Bonnefil, Karen Dietz, Mario Amatruda, Maureen Wentling, Antonio V Aubry, et. al.. (2019). Region-specific myelin differences define behavioral consequences of chronic social defeat stress in mice. eLife. 8;
- Обёртка для аксона;
- Siming Shen, Juan Sandoval, Victoria A Swiss, Jiadong Li, Jeff Dupree, et. al.. (2008). Age-dependent epigenetic control of differentiation inhibitors is critical for remyelination efficiency. Nat Neurosci. 11, 1024-1034;
- Feng Ye, Ying Chen, ThaoNguyen Hoang, Rusty L Montgomery, Xian-hui Zhao, et. al.. (2009). HDAC1 and HDAC2 regulate oligodendrocyte differentiation by disrupting the β-catenin–TCF interaction. Nat Neurosci. 12, 829-838;
- Jia Liu, Karen Dietz, Jacqueline M DeLoyht, Xiomara Pedre, Dipti Kelkar, et. al.. (2012). Impaired adult myelination in the prefrontal cortex of socially isolated mice. Nat Neurosci. 15, 1621-1623;
- Эпигенетика: невидимый командир генома;
- Dario Nicetto, Greg Donahue, Tanya Jain, Tao Peng, Simone Sidoli, et. al.. (2019). H3K9me3-heterochromatin loss at protein-coding genes enables developmental lineage specification. Science. 363, 294-297;
- Mitra Heshmati, Hossein Aleyasin, Caroline Menard, Daniel J. Christoffel, Meghan E. Flanigan, et. al.. (2018). Cell-type-specific role for nucleus accumbens neuroligin-2 in depression and stress susceptibility. Proc Natl Acad Sci USA. 115, 1111-1116;
- Md Sahab Uddin, Sadeeq Muhammad Sheshe. (2017). Hijacking the Progress of Addiction: Looking at β-Arrestin 1 and β-Arrestin 2 to Cognize Drugs of Abuse. J Psychiatry. 21;
- Scott J. Russo, Eric J. Nestler. (2013). The brain reward circuitry in mood disorders. Nat Rev Neurosci. 14, 609-625;
- Sheila C. Caetano, Simerjit Kaur, Paolo Brambilla, Mark Nicoletti, John P. Hatch, et. al.. (2006). Smaller Cingulate Volumes in Unipolar Depressed Patients. Biological Psychiatry. 59, 702-706;
- Hall S.M. (1972). The effect of injections of lysophosphatidyl choline into white matter of the adult mouse spinal cord. J. Cell Sci. 2, 535–546;
- Ribot T. La psychologie des sentiments. L’Harmattan, 1896. — 450 p.;
- Michael T. Treadway, David H. Zald. (2011). Reconsidering anhedonia in depression: Lessons from translational neuroscience. Neuroscience & Biobehavioral Reviews. 35, 537-555;
- Masud Husain, Jonathan P. Roiser. (2018). Neuroscience of apathy and anhedonia: a transdiagnostic approach. Nat Rev Neurosci. 19, 470-484;
- Scott J Russo, James W Murrough, Ming-Hu Han, Dennis S Charney, Eric J Nestler. (2012). Neurobiology of resilience. Nat Neurosci. 15, 1475-1484;
- M. L. Lehmann, M. Herkenham. (2011). Environmental Enrichment Confers Stress Resiliency to Social Defeat through an Infralimbic Cortex-Dependent Neuroanatomical Pathway. Journal of Neuroscience. 31, 6159-6173;
- Andrew H. Miller. (1998). NEUROENDOCRINE AND IMMUNE SYSTEM INTERACTIONS IN STRESS AND DEPRESSION. Psychiatric Clinics of North America. 21, 443-463;
- Yekta Dowlati, Nathan Herrmann, Walter Swardfager, Helena Liu, Lauren Sham, et. al.. (2010). A Meta-Analysis of Cytokines in Major Depression. Biological Psychiatry. 67, 446-457;
- Carla Nasca, Caroline Menard, Georgia Hodes, Benedetta Bigio, Catherine Pena, et. al.. (2019). Multidimensional Predictors of Susceptibility and Resilience to Social Defeat Stress. Biological Psychiatry. 86, 483-491;
- María Erta, Albert Quintana, Juan Hidalgo. (2012). Interleukin-6, a Major Cytokine in the Central Nervous System. Int. J. Biol. Sci.. 8, 1254-1266;
- Daniel J Christoffel, Sam A Golden, Mitra Heshmati, Ami Graham, Shari Birnbaum, et. al.. (2012). Effects of Inhibitor of κB Kinase Activity in the Nucleus Accumbens on Emotional Behavior. Neuropsychopharmacol. 37, 2615-2623;
- J. W. Koo, S. J. Russo, D. Ferguson, E. J. Nestler, R. S. Duman. (2010). Nuclear factor- B is a critical mediator of stress-impaired neurogenesis and depressive behavior. Proceedings of the National Academy of Sciences. 107, 2669-2674;
- D. J. Christoffel, S. A. Golden, D. Dumitriu, A. J. Robison, W. G. Janssen, et. al.. (2011). I B Kinase Regulates Social Defeat Stress-Induced Synaptic and Behavioral Plasticity. Journal of Neuroscience. 31, 314-321;
- Charles L. Raison, Andrew H. Miller. (2003). When Not Enough Is Too Much: The Role of Insufficient Glucocorticoid Signaling in the Pathophysiology of Stress-Related Disorders. AJP. 160, 1554-1565;
- Lucile Capuron, Charles L. Raison, Dominique L. Musselman, David H. Lawson, Charles B. Nemeroff, Andrew H. Miller. (2003). Association of Exaggerated HPA Axis Response to the Initial Injection of Interferon-Alpha With Development of Depression During Interferon-Alpha Therapy. AJP. 160, 1342-1345;
- Ralph Adolphs, Leonard Mlodinow, Lisa Feldman Barrett. (2019). What is an emotion?. Current Biology. 29, R1060-R1064;
- Darlene Deecher, Terrance H. Andree, Diane Sloan, Lee E. Schechter. (2008). From menarche to menopause: Exploring the underlying biology of depression in women experiencing hormonal changes. Psychoneuroendocrinology. 33, 3-17;
- Jennifer Joeyen-Waldorf, Nicole Edgar, Etienne Sibille. (2009). The roles of sex and serotonin transporter levels in age- and stress-related emotionality in mice. Brain Research. 1286, 84-93;
- Mary C. Blehar. (2006). Women’s Mental Health Research: The Emergence of a Biomedical Field. Annu. Rev. Clin. Psychol.. 2, 135-160;
- E Young, A Korszun. (2010). Sex, trauma, stress hormones and depression. Mol Psychiatry. 15, 23-28;
- Elizabeth P. Bless, Kelley A. McGinnis, Amy L. Mitchell, Amy Hartwell, John B. Mitchell. (1997). The effects of gonadal steroids on brain stimulation reward in female rats. Behavioural Brain Research. 82, 235-244;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?.