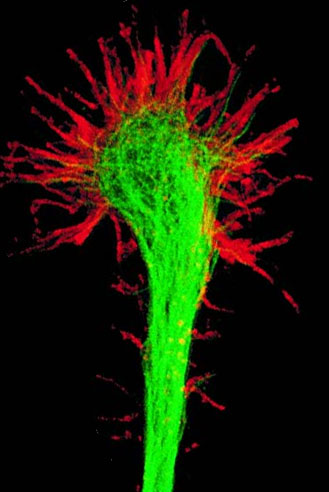
Развитие и рост нейрона Конус роста
Нейрон развивается
из небольшой клетки-предшественницы,
которая перестаёт делиться ещё до того,
как выпустит свои отростки. (Однако,
вопрос о делении нейронов в настоящее
время остаётся дискуссионным.) Как
правило, первым начинает расти аксон,
а дендриты образуются позже. На конце
развивающегося отростка нервной клетки
появляется утолщение неправильной
формы, которое и прокладывает путь через
окружающую ткань. Это утолщение называется
конусом роста
нервной клетки.
Он состоит из уплощенной части отростка
нервной клетки с множеством тонких
шипиков. Микрошипики имеют толщину от
0,1 до 0,2 мкм и могут достигать 50 мкм в
длину, широкая и плоская область конуса
роста имеет ширину и длину около 5 мкм,
хотя форма её может изменяться. Промежутки
между микрошипиками конуса роста покрыты
складчатой мембраной. Микрошипики
находятся в постоянном движении —
некоторые втягиваются в конус роста,
другие удлиняются, отклоняются в разные
стороны, прикасаются к субстрату и могут
прилипать к нему.
Конус роста заполнен
мелкими, иногда соединёнными друг с
другом, мембранными пузырьками
неправильной формы. Непосредственно
под складчатыми участками мембраны и
в шипиках находится плотная масса
перепутанных актиновых филаментов.
Конус роста содержит также митохондрии,
микротрубочки и нейрофиламенты, имеющиеся
в теле нейрона.
Вероятно,
микротрубочки и нейрофиламенты удлиняются
главным образом за счёт добавления
вновь синтезированных субъединиц у
основания отростка нейрона. Они
продвигаются со скоростью около
миллиметра в сутки, что соответствует
скорости медленного аксонного транспорта
в зрелом нейроне. Поскольку примерно
такова и средняя скорость продвижения
конуса роста, возможно, что во время
роста отростка нейрона в его дальнем
конце не происходит ни сборки, ни
разрушения микротрубочек и нейрофиламентов.
Новый мембранный материал добавляется,
видимо, у основания. Конус роста — это
область быстрого экзоцитоза и эндоцитоза,
о чём свидетельствует множество
находящихся здесь пузырьков. Мелкие
мембранные пузырьки переносятся по
отростку нейрона от тела клетки к конусу
роста с потоком быстрого аксонного
транспорта. Мембранный материал, видимо,
синтезируется в теле нейрона, переносится
к конусу роста в виде пузырьков и
включается здесь в плазматическую
мембрану путём экзоцитоза, удлиняя
таким образом отросток нервной клетки.
Росту аксонов и
дендритов обычно предшествует фаза
миграции нейронов, когда незрелые
нейроны расселяются и находят себе
постоянное место.
Конус роста,
удлинение аксона и роль актина
Кончик растущего
аксона удлиняется, образуя конус роста.
Рамон-и-Кахаль первым обнаружил, что
конус роста является частью аксона,
ответственной за навигацию и удлинение
его в направлении конечной цели. Конус
роста удлиняется и сокращается за счет
широких пластинок, называемых
ламмелиподиями,
и тонких, остроконечных выпячиваний,
называемых филоподиями.
Филоподии достигают размеров в несколько
десятков микрометров и могут удлиняться
и сокращаться, как бы ощупывая субстрат
во всех направлениях. Филоподии адгезируют
к определенному субстрату и тянут конус
роста в этом направлении.
Актин играет
ключевую роль в подвижности конуса
роста. Как ламеллиподии, так и филоподии
богаты филаментным актином и веществами,
ингибирующими полимеризацию актина,
такими как грибной токсин цитохалазин
В, обездвиживающий конусы роста.
Выпячивание и ретракция ламеллиподий
и филоподий, а также движение вперед
самого конуса роста, скорее всего,
управляется двумя процессами: (1)
полимеризацией и разборкой актиновых
филаментов и (2) зависимой от миозина
транслокацией актиновых филаментов
прочь от ведущего края конуса роста.
Миозин, связанный
с микротрубочками, обеспечивает движение
актиновых филаментов в направлении
назад, в то время как в филаментах
постоянно происходит процесс полимеризации
со стороны ведущего края конуса роста
и деполимеризация в центре.
Полимеризация актина в этом случае
приводит к продвижению конуса роста, в
то время как миозин обеспечивает движение
микротрубочек вперед, продвигая
центральный домен конуса роста.
Оба процесса
используют энергию гидролиза АТФ и
могут управляться белками, связывающими
актин. Кальций, протеинкиназы и другие
внутриклеточные вторичные посредники
управляют активностью актин-связывающих
белков. Например, остановка роста и
ретракция конуса роста, два частых
события в процессе роста аксонов, связаны
с входящим током кальция и увеличением
частоты кратковременных повышений
концентрации кальция в цитоплазме
клетки.
Молекулы адгезии
клетки и внеклеточного матрикса и рост
аксона
Молекулы клеточной
адгезии управляют ростом аксона,
обеспечивая наиболее благоприятное
окружение для вытягивания конуса роста.
Клеточные молекулы адгезии представляют
собой трансмембранные или связанные с
мембраной гликопротеины. Фрагменты
этих макромолекул
во многом гомологичны постоянным
фрагментам иммуноглобулинов. Эти
молекулы обеспечивают адгезию клеток
друг к другу посредством связей между
гликопротеинами.
Дополнительно присутствующей везде
молекулой клеточной адгезии является
молекула N-кадгерина, которая обеспечивает
кальций-зависимую адгезию между клетками.
В культуре клеток
синтез N-кадгерина приводит к их агрегации,
вытягиванию аксонов в сторону клеточных
субстратов, а также соединению отдельных
растущих аксонов в пучки (фасцикулы,
fascicles). Стимуляция роста аксонов молекулами
клеточной адгезии не обеспечивается
просто «липкостью» субстрата; она
управляется активацией рецепторов,
связанных с тирозинкиназой, например
рецептора к фактору роста фибробластов
(fibroblast growth factor, FGF).
Рецептор FGF включает внутриклеточный
каскад, связанный с фосфорилированием
тирозина, что приводит к удлинению
аксона. Исследования при помощи
специальных блокирующих антител
показывают, что конусы роста редко
используют только один субстрат для
своего движения; несколько типов молекул
адгезии клетки и внеклеточного матрикса
могут обеспечивать рост нервных отростков
у определенных типов нейронов. Например,
для полного ингибирования роста аксонов
в сторону шванновской клетки необходимо
применять одновременно антитела к
нескольким факторам роста.
Итак, рост аксона,
его движение вдоль клеток определяется
различными ростовыми и ингибирующими
факторами, которые синтезируются
клетками и встраиваются в их мембраны.
, но каким же образом регулируется
направление роста аксонов? В этой
проблеме пока больше вопросов, чем
ответов, хотя некоторые факты уже можно
считать установленными. Оказалось, что
когда расстояние между телом нейрона
и его мишенью очень короткое конусы
роста аксонов следуют по градиенту
концентрации некоторых молекул,
вырабатываемых клетками-мишенями.
В противоположность
этому, способность аксонов, например,
спинальных мотонейронов расти в
направлении конечностей не зависит от
наличия мышечной клетки-мишени. Это
было показано путем удаления в раннем
периоде сомита, из которого развивается
мускулатура конечностей. Аксоны
мотонейронов направляются нормально
из спинного мозга, врастают в конечность
и образуют мышечные нервы, даже в
отсутствие мышцы. Таким образом, факторы,
которые управляют ростом аксонов
мотонейронов к определенной мишени на
конечности, не выделяются мышцами, с
которыми аксоны в конечном итоге образуют
связи. Когда
дистанция от нейрона до его цели
составляет больше чем несколько сотен
микрон, его путь обозначен специальными
промежуточными целями. Например, конус
роста, идущий от сенсорной клетки
конечностей у развивающегося кузнечика,
делает несколько резких поворотов на
своем пути в ЦНС). Эти повороты происходят
в тот момент, когда конус роста касается
так называемых клеток-ориентиров.
Такое поведение указывает на наличие
взаимодействия с клетками-ориентирами,
ответственными за перенаправление
конусов роста. Этими клетками чаше всего
являются незрелые нейроны. Эти
взаимодействия можно продемонстрировать
при помощи удаления клеток-ориентиров
лучом лазера до того, как их достигнет
конус роста. В этом случае не происходит
соответствующего изменения в траектории
движения конуса роста. Установлено, что
аксоны образуют кратковременные
синаптические контакты с клетками-ориентирами
во время развития. Например, аксоны
нейронов из ядра ЛКТ в зрительной системе
млекопитающих достигают развивающуюся
корковую пластинку раньше, чем образуются
их синаптические мишени — пирамидные
клетки слоя 4. Поэтому аксоны ядра ЛКТ
образуют синапсы с нейронами подпластинки,
которые образуются в раннем эмбриогенезе.
Нейроны подпластинки лежат под
развивающейся корковой пластинкой, и
им суждено исчезнуть вскоре после
рождения. Через нескольких недель, когда
пирамидные клетки слоя 4 достигают
своего месторасположения в коре, аксоны
из ЛКТ разрывают свои связи с нейронами
подпластинки и направляются в кору,
чтобы образовать связи, характерные
для взрослого животного. Если нейроны
подпластинки удалить в раннем периоде
развития местной аппликацией нейротоксинов,
аксоны ядра ЛКТ прорастают за пределы
развивающейся зрительной коры и не
могут образовать синаптических связей
со своими мишенями.
Гибель нейронов
Удивительной
особенностью развития нервной системы
является то, что многим ее нейронам
суждено погибнуть во время развития. У
беспозвоночных интенсивная гибель
нейронов сопровождается стремительными
изменениями, происходящими во время
метаморфоза, и регулируется гормонами.
Однако в развивающейся ЦНС как позвоночных,
так и беспозвоночных гибель клеток
происходит также и в отсутствие
значительных морфологических изменений.
Эксперименты,
выполненные Гамбургером и Леви-Монтальчини,
впервые выявили запрограммированную
гибель нейронов эмбрионов позвоночных,
а также показали, что степень гибели
клеток может зависеть от размеров
ткани-мишени. Они показали, например,
что в развивающейся конечности в то
время, когда формируются первые
синаптические связи с миофибриллами,
от 40 до 70 % мотонейронов, которые послали
аксоны в эту конечность, погибают.
Имплантация дополнительной конечности
уменьшает долю погибающих мотонейронов,
а удаление одного из зачатков конечностей
приводит к увеличению числа гибнущих
клеток, что дает основания для
предположения, что мотонейроны конкурируют
за некие трофические вещества, выделяемые
тканью-мишенью.
Избыточная продукция
нейронов, после которой следует период
гибели клеток, является характерной
чертой развития нервной системы
позвоночных. Некоторые из нейронов,
которые погибают, возможно, не смогли
образовать синапсов, или образовали их
с неподходящей клеткой-мишенью. В
подобных случаях гибель клеток связана
с особенностью иннервации. Однако
большинство клеток, которые гибнут,
достигают и иннервируют правильные
клетки-мишени. Таким образом, гибель
клеток является основным механизмом,
который поддерживает равновесие между
количеством нейронов и их мишеней.
Неожиданной
находкой явилось то, что ингибиторы
образования м-РНК или синтеза белка в
нейронах предотвращали их гибель.
Результаты этих и более поздних
экспериментов показали, что гибель
нейронов типично происходит путем
апоптоза. Апоптоз
— это процесс, который активирует
внутреннюю «суицидальную» программу
клетки, которая приводит к упорядоченному
(запрограммированному) распаду ДНК и
белков в клетке. Существенно, что для
этого необходим предварительный синтез
протеолитических ферментов или их
активаторов.
Развитие синапсов
Многие исследования
функции и формирования синапсов были
сфокусированы на нейромышечных синапсах
— синапсах между двигательными нейронами
и скелетными мышцами, из-за их относительной
доступности и простоты. Они показали,
что формирование синапсов нуждается в
сложном обмене информацией между
нейроном и его мишенью, это делает
возможным взаимное распознавание и
инициирует сигнальные каскады, которые
ведут к дифференцировке и формированию
пресинаптических и постсинаптических
участков мембраны со всем комплексом
структур, необходимых для передачи
импульса возбуждения. Полученная
информация с достоверностью показала,
что принципиальной разницы между
процессами формирования нервномышечных
и центральных синапсов нет. Следовательно
нейромышечные синапсы могут рассматриваться
как хорошая модель синапсов.
Во время развития
аксоны от двигательных нейронов выходят
из спинного мозга и проводятся к своим
мишеням с помощью клеточных и молекулярных
сигналов, которые могут или привлекать
или отталкивать их. Оказавшись в
непосредственно близи к мишени, аксон
замедляет рост и в конечном итоге
останавливается. Кончик аксона
контактирует с мишенью и тем самым
инициируется дифференцировка
пресинаптических окончаний.
Комплекс
последовательных событий запускается
уже при первом контакте врастающего
аксона с растущей мышцей. Когда аксон
впервые достигает мышечной массы,
миобласты всё ещё сливаются вместе,
заканчивая формирование первичных и
вторичных миобибрилл. Одним из наиболее
важных событий, которое следует сразу
после контакта аксона с дифференцирующимся
мышечным волокном, является быстрый
сбор (в течение минут) до этого
диспергированных ацетилхолиновых
рецепторов под формирующимся нервным
окончанием. Эта быстрая агрегация
холинорецепторов является характерной
особенностью образования синапса.
Установлено, что
синаптическая базальная мембрана
содержит в виде различных белков всю
информацию, необходимую для запуска и
управления всеми аспектами образования
синапса. Одним из белков, запускающих
агрегацию холинорецепторов, является
агрин.
Этот белок синтезируется и в мышцах и
нервах, секретируется и проникает в
базальную мембрану. Описано несколько
форм агрина, однако только тот, который
синтезируется в двигательных нейронах
эффективно собирает холинорецепторы
постсинаптической мембраны точно на
вершинах складок постсинаптической
мембраны в непосредственной близости
от места выделения медиатора, так же
собирает в комплексы натриевые каналы,
активирует синтез холинэстеразы.
Уменьшение числа
связей и исчезновение полинейрональной
иннервации
После того как
популяция нейронов, иннервирующих
определенную мишень, уменьшается
благодаря гибели клеток, оставшиеся
нейроны конкурируют друг с другом за
синаптическую территорию. Это
конкурирование обычно приводит к потере
некоторых первично образованных веточек
и синапсов («обрезка»). Уменьшение числа
связей обеспечивает механизм для
формирования правильной и полной
иннервации мишени определенной популяцией
нейронов. В некоторых случаях механизм
уменьшения числа связей также обеспечивает
механизмы коррекции ошибок; в других
случаях он отражает стратегию поиска
пути аксоном.
Особо яркий пример
конкурентного уменьшения числа связей
можно увидеть в развивающейся скелетной
мышце. У взрослых животных каждый
мотонейрон иннервирует группу до 300
мышечных волокон, формируя двигательную
единицу , но каждое мышечное волокно
иннервируется только одним аксоном.
Однако в развивающейся мышце мотонейроны
бурно ветвятся, так что каждое мышечное
волокно в итоге иннервируется аксонами
от нескольких мотонейронов, что называется
полинейрональной иннервацией. В каждом
развивающемся мышечном волокне
синаптические окончания всех аксонов
разбросаны вокруг одного участка, вблизи
скоплений рецепторов АХ и других
компонентов постсинаптического аппарата.
По мере развития веточки аксонов
исчезают, что приводит в конечном итоге
к формированию взрослого паттерна. Этот
процесс не вызывает гибель клетки
(которая обычно происходит на более
ранних стадиях развития), а только
уменьшение количества мышечных волокон,
иннервируемых каждым из мотонейронов.
НЕРВНЫЕ ЦЕНТРЫ
— совокупность
нервных клеток, «ансамбль» нейронов,
которые включаются в регуляцию
определенной функции или в осуществление
конкретного рефлекторного акта.
Свойства нервных
центров мы подробно разберем позднее,
а пока отметим лишь функциональное
значение центров. В нервном центре
происходит интеграция всей
поступающей по афферентным путям
информации, а из центра поступает
команда к действию.
Центры рефлексов
могут быть расположены в любом отделе
ЦНС. В
зависимости от расположения нервных
центров
различают рефлексы СПИНАЛЬНЫЕ — нервные
центры находятся в сегментах спинного
мозга, БУЛЬБАРНЫЕ — в продолговатом
мозге, МЕЗЭНЦЕФАЛЬНЫЕ — в структурах
среднего мозга, КОРТИКАЛЬНЫЕ — в
различных областях коры большого
мозга. Например, одергивание руки при
ожоге – спинальный рефлекс.
В соответствии
с выполняемой функцией
среди нервных центров можно выделить
чувствительные центры, центры вегетативных
функций, двигательные центры. Кроме
того, можно выделить структурно
организованные центры, которые регулируют
определенную функцию: сосудодвигательный
центр, дыхательный центр, центр
слюноотделения. Центры регуляции
вегетативных функций представлены в
таблице 3.
Таблица 3
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
30.03.201543.08 Mб39Марк Бирс Руководство по медицине.djvu
- #
- #
- #
- #
- #
- #
- #
Введение в нейробиологию
7. Нейроны
7.1. Развитие и рост нейрона Конус роста
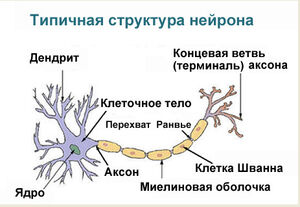
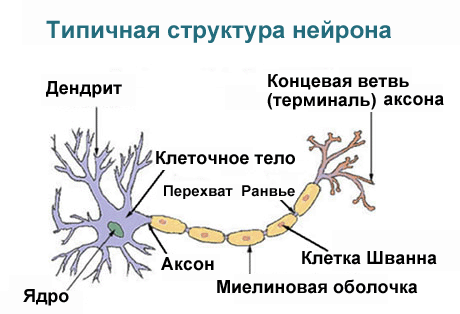
Развитие и рост нейрона Конус роста Вопрос о делении нейронов в настоящее время остаётся дискуссионным. По одной из версий нейрон развивается из небольшой клетки-предшественницы, которая перестаёт делиться ещё до того, как выпустит свои отростки. Первым начинает расти аксон, а дендриты образуются позже. На конце развивающегося отростка нервной клетки появляется утолщение, которое прокладывает путь через окружающую ткань. Это утолщение называется конусом роста нервной клетки. Он состоит из уплощенной части отростка нервной клетки с множеством тонких шипиков. Микрошипики имеют толщину от 0,1 до 0,2 мкм и могут достигать 50 мкм в длину, широкая и плоская область конуса роста имеет ширину и длину около 5 мкм, хотя форма её может изменяться. Промежутки между микрошипиками конуса роста покрыты складчатой мембраной. Микрошипики находятся в постоянном движении — некоторые втягиваются в конус роста, другие удлиняются, отклоняются в разные стороны, прикасаются к субстрату и могут прилипать к нему. Конус роста заполнен мелкими, иногда соединёнными друг с другом, мембранными пузырьками неправильной формы. Под складчатыми участками мембраны и в шипиках находится плотная масса перепутанных актиновых филаментов. Конус роста содержит также митохондрии, микротрубочки и нейрофиламенты, аналогичные имеющимся в теле нейрона. Микротрубочки и нейрофиламенты удлиняются главным образом за счёт добавления вновь синтезированных субъединиц у основания отростка нейрона. Они продвигаются со скоростью около миллиметра в сутки, что соответствует скорости медленного аксонного транспорта в зрелом нейроне. Поскольку примерно такова и средняя скорость продвижения конуса роста, возможно во время роста отростка нейрона в его дальнем конце не происходит ни сборки, ни разрушения микротрубочек и нейрофиламентов. Новый мембранный материал добавляется у окончания. Конус роста — это область быстрого экзоцитоза и эндоцитоза, о чём свидетельствует множество находящихся здесь пузырьков. Мелкие мембранные пузырьки переносятся по отростку нейрона от тела клетки к конусу роста с потоком быстрого аксонного транспорта. Мембранный материал, синтезируется в теле нейрона, переносится к конусу роста в виде пузырьков и включается здесь в плазматическую мембрану путём экзоцитоза, удлиняя таким образом отросток нервной клетки. Росту аксонов и дендритов обычно предшествует фаза миграции нейронов, когда незрелые нейроны расселяются и находят себе постоянное место.
| Axon | |
|---|---|

An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
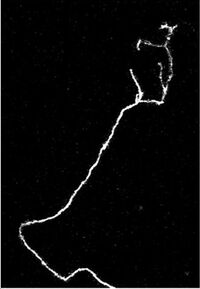
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%81%D0%BE%D0%BD
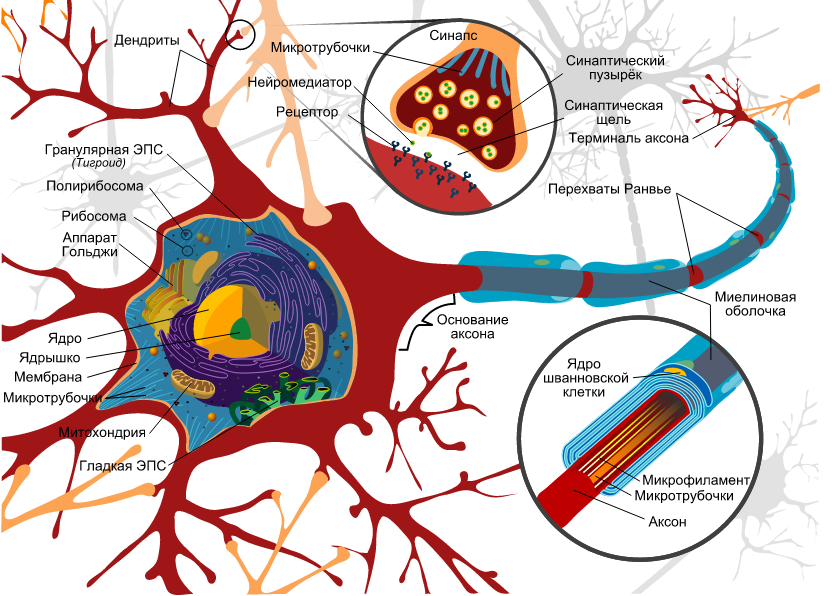
Нейрон состоит из одного аксона, тела и нескольких дендритов,
Аксон (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Строение нейрона
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная(гладкая)эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[1]
Анатомия
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[2]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня. Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в матеоиале — например, волокна автономной нервной системы
Двигательная функция
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[3][4] | Intrafusal muscle fibers |
Сенсорная функция
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[5] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона
Нейрон
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [6].
См. также
- Сенсорные нервы
- Сенсорный рецептор
- Нейрон
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс |
Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор |
Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия |
Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань |
Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Оболочки мозга |
Нейрон. Строение нервной клетки
Нейрон (от др.-греч. νεῦρον — волокно, нерв) — это структурно-функциональная единица нервной системы. Эта клетка имеет сложное строение, высоко специализирована и по структуре содержит ядро, тело клетки и отростки. В организме человека насчитывается более ста миллиардов нейронов.
Обзор
Сложность и многообразие функций нервной системы определяются взаимодействием между нейронами, которое, в свою очередь, представляют собой набор различных сигналов, передаваемых в рамках взаимодействия нейронов с другими нейронами или мышцами и железами. Сигналы испускаются и распространяются с помощью ионов, генерирующих электрический заряд, который движется вдоль нейрона.
Строение
Тело клетки
Тело нервной клетки состоит из протоплазмы (цитоплазмы и ядра), снаружи ограничена мембраной из двойного слоя липидов(билипидный слой). Липиды состоят из гидрофильных головок и гидрофобных хвостов, расположены гидрофобными хвостами друг к другу, образуя гидрофобный слой, который пропускает только жирорастворимые вещества (напр. кислород и углекислый газ). На мембране находятся белки: на поверхности (в форме глобул), на которых можно наблюдать наросты полисахаридов (гликокаликс), благодаря которым клетка воспринимает внешнее раздражение, и интегральные белки, пронизывающие мембрану насквозь, в которых находятся ионные каналы.
Типичная структура нейрона
Нейрон состоит из тела диаметром от 3 до 130 мкм, содержащего ядро (с большим количеством ядерных пор) и органеллы (в том числе сильно развитый шероховатый ЭПР с активными рибосомами, аппарат Гольджи), а также из отростков. Выделяют два вида отростков: дендриты и аксоны. Нейрон имеет развитый и сложный цитоскелет, проникающий в его отростки. Цитоскелет поддерживает форму клетки, его нити служат «рельсами» для транспорта органелл и упакованных в мембранные пузырьки веществ (например, нейромедиаторов). Цитоскелет нейрона состоит из фибрилл разного диаметра: Микротрубочки (Д = 20-30 нм) — состоят из белка тубулина и тянутся от нейрона по аксону, вплоть до нервных окончаний. Нейрофиламенты (Д = 10 нм) — вместе с микротрубочками обеспечивают внутриклеточный транспорт веществ. Микрофиламенты (Д = 5 нм) — состоят из белков актина и миозина, особенно выражены в растущих нервных отростках и в нейроглии. В теле нейрона выявляется развитый синтетический аппарат, гранулярная ЭПС нейрона окрашивается базофильно и известна под названием «тигроид». Тигроид проникает в начальные отделы дендритов, но располагается на заметном расстоянии от начала аксона, что служит гистологическим признаком аксона.
Различается антероградный (от тела) и ретроградный (к телу) аксонный транспорт.
Дендриты и аксон
Аксон — обычно длинный отросток, приспособленный для проведения возбуждения от тела нейрона. Дендриты — как правило, короткие и сильно разветвлённые отростки, служащие главным местом образования влияющих на нейрон возбуждающих и тормозных синапсов (разные нейроны имеют различное соотношение длины аксона и дендритов). Нейрон может иметь несколько дендритов и обычно только один аксон. Один нейрон может иметь связи со многими (до 20-и тысяч) другими нейронами.
Дендриты делятся дихотомически, аксоны же дают коллатерали. В узлах ветвления обычно сосредоточены митохондрии.
Дендриты не имеют миелиновой оболочки, аксоны же могут её иметь. Местом генерации возбуждения у большинства нейронов является аксонный холмик — образование в месте отхождения аксона от тела. У всех нейронов эта зона называется триггерной.
Схема строения нейрона
Синапс
Си́напс (греч. σύναψις, от συνάπτειν — обнимать, обхватывать, пожимать руку) — место контакта между двумя нейронами или между нейроном и получающей сигнал эффекторнойклеткой. Служит для передачи нервного импульса между двумя клетками, причём в ходе синаптической передачи амплитуда и частота сигнала могут регулироваться. Одни синапсывызывают деполяризацию нейрона, другие — гиперполяризацию; первые являются возбуждающими, вторые — тормозными. Обычно для возбуждения нейрона необходимо раздражение от нескольких возбуждающих синапсов.
Термин был введён в 1897 г. английским физиологом Чарльзом Шеррингтоном.
Классификация
Структурная классификация
На основании числа и расположения дендритов и аксона нейроны делятся на безаксонные, униполярные нейроны, псевдоуниполярные нейроны, биполярные нейроны и мультиполярные (много дендритных стволов, обычно эфферентные) нейроны.
Безаксонные нейроны — небольшие клетки, сгруппированы вблизи спинного мозга в межпозвоночных ганглиях, не имеющие анатомических признаков разделения отростков на дендриты и аксоны. Все отростки у клетки очень похожи. Функциональное назначение безаксонных нейронов слабо изучено.
Униполярные нейроны — нейроны с одним отростком, присутствуют, например в сенсорном ядре тройничного нерва в среднем мозге.
Биполярные нейроны — нейроны, имеющие один аксон и один дендрит, расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях.
Мультиполярные нейроны — нейроны с одним аксоном и несколькими дендритами. Данный вид нервных клеток преобладает в центральной нервной системе.
Псевдоуниполярные нейроны — являются уникальными в своём роде. От тела отходит один отросток, который сразу же Т-образно делится. Весь этот единый тракт покрыт миелиновой оболочкой и структурно представляет собой аксон, хотя по одной из ветвей возбуждение идёт не от, а к телу нейрона. Структурно дендритами являются разветвления на конце этого (периферического) отростка. Триггерной зоной является начало этого разветвления (то есть находится вне тела клетки). Такие нейроны встречаются в спинальных ганглиях.
Функциональная классификация
По положению в рефлекторной дуге различают афферентные нейроны (чувствительные нейроны), эфферентные нейроны (часть из них называется двигательными нейронами, иногда это не очень точное название распространяется на всю группу эфферентов) и интернейроны (вставочные нейроны).
Афферентные нейроны (чувствительный, сенсорный или рецепторный). К нейронам данного типа относятся первичные клетки органов чувств и псевдоуниполярные клетки, у которых дендриты имеют свободные окончания.
Эфферентные нейроны (эффекторный, двигательный или моторный). К нейронам данного типа относятся конечные нейроны — ультиматные и предпоследние — не ультиматные.
Ассоциативные нейроны (вставочные или интернейроны) — группа нейронов осуществляет связь между эфферентными и афферентными, их делят на интризитные, комиссуральные и проекционные.
Секреторные нейроны — нейроны, секретирующие высокоактивные вещества (нейрогормоны). У них хорошо развит комплекс Гольджи, аксон заканчивается аксовазальными синапсами.
Морфологическая классификация
Морфологическое строение нейронов многообразно. В связи с этим при классификации нейронов применяют несколько принципов:
- учитывают размеры и форму тела нейрона;
- количество и характер ветвления отростков;
- длину нейрона и наличие специализированных оболочек.
По форме клетки, нейроны могут быть сферическими, зернистыми, звездчатыми, пирамидными, грушевидными, веретеновидными, неправильными и т. д. Размер тела нейрона варьирует от 5 мкм у малых зернистых клеток до 120—150 мкм у гигантских пирамидных нейронов. Длина нейрона у человека составляет от 150 мкм до 120 см.
По количеству отростков выделяют следующие морфологические типы нейронов:
- униполярные (с одним отростком) нейроциты, присутствующие, например, в сенсорном ядре тройничного нерва в среднем мозге;
- псевдоуниполярные клетки, сгруппированные вблизи спинного мозга в межпозвоночных ганглиях;
- биполярные нейроны (имеют один аксон и один дендрит), расположенные в специализированных сенсорных органах — сетчатке глаза, обонятельном эпителии и луковице, слуховом и вестибулярном ганглиях;
- мультиполярные нейроны (имеют один аксон и несколько дендритов), преобладающие в ЦНС.
Развитие и рост нейрона
Нейрон развивается из небольшой клетки-предшественницы, которая перестаёт делиться ещё до того, как выпустит свои отростки. (Однако, вопрос о делении нейронов в настоящее время остаётся дискуссионным) Как правило, первым начинает расти аксон, а дендриты образуются позже. На конце развивающегося отростка нервной клетки появляется утолщение неправильной формы, которое, видимо, и прокладывает путь через окружающую ткань. Это утолщение называется конусом роста нервной клетки. Он состоит из уплощенной части отростка нервной клетки с множеством тонких шипиков. Микрошипики имеют толщину от 0,1 до 0,2 мкм и могут достигать 50 мкм в длину, широкая и плоская область конуса роста имеет ширину и длину около 5 мкм, хотя форма её может изменяться. Промежутки между микрошипиками конуса роста покрыты складчатой мембраной. Микрошипики находятся в постоянном движении — некоторые втягиваются в конус роста, другие удлиняются, отклоняются в разные стороны, прикасаются к субстрату и могут прилипать к нему.
Конус роста нейрона
Конус роста заполнен мелкими, иногда соединёнными друг с другом, мембранными пузырьками неправильной формы. Непосредственно под складчатыми участками мембраны и в шипиках находится плотная масса перепутанных актиновых филаментов. Конус роста содержит также митохондрии, микротрубочки и нейрофиламенты, имеющиеся в теле нейрона.
Вероятно, микротрубочки и нейрофиламенты удлиняются главным образом за счёт добавления вновь синтезированных субъединиц у основания отростка нейрона. Они продвигаются со скоростью около миллиметра в сутки, что соответствует скорости медленного аксонного транспорта в зрелом нейроне. Поскольку примерно такова и средняя скорость продвижения конуса роста, возможно, что во время роста отростка нейрона в его дальнем конце не происходит ни сборки, ни разрушения микротрубочек и нейрофиламентов. Новый мембранный материал добавляется, видимо, у окончания. Конус роста — это область быстрого экзоцитоза и эндоцитоза, о чём свидетельствует множество находящихся здесь пузырьков. Мелкие мембранные пузырьки переносятся по отростку нейрона от тела клетки к конусу роста с потоком быстрого аксонного транспорта. Мембранный материал, видимо, синтезируется в теле нейрона, переносится к конусу роста в виде пузырьков и включается здесь в плазматическую мембрану путём экзоцитоза, удлиняя таким образом отросток нервной клетки.
Росту аксонов и дендритов обычно предшествует фаза миграции нейронов, когда незрелые нейроны расселяются и находят себе постоянное место.
Материал из Википедии — свободной энциклопедии