Нервные импульсы распространяются при перемещении ионов через мембрану нервной клетки и передаются из одной нервной клетки в другую с помощью нейромедиаторов.
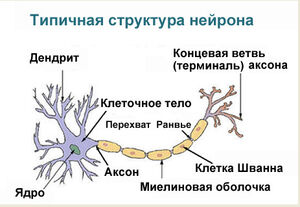
В результате эволюции нервной системы человека и других животных возникли сложные информационные сети, процессы в которых основаны на химических реакциях. Важнейшим элементом нервной системы являются специализированные клетки нейроны. Нейроны состоят из компактного тела клетки, содержащего ядро и другие органеллы. От этого тела отходит несколько разветвленных отростков. Большинство таких отростков, называемых дендритами, служат точками контакта для приема сигналов от других нейронов. Один отросток, как правило самый длинный, называется аксоном и передает сигналы на другие нейроны. Конец аксона может многократно ветвиться, и каждая из этих более мелких ветвей способна соединиться со следующим нейроном.
Во внешнем слое аксона находится сложная структура, образованная множеством молекул, выступающих в роли каналов, по которым могут поступать ионы — как внутрь, так и наружу клетки. Один конец этих молекул, отклоняясь, присоединяется к атому-мишени. После этого энергия других частей клетки используется на то, чтобы вытолкнуть этот атом за пределы клетки, тогда как процесс, действующий в обратном направлении, вводит внутрь клетки другую молекулу. Наибольшее значение имеет молекулярный насос, который выводит из клетки ионы натрия и вводит в нее ионы калия (натрий-калиевый насос).
Когда клетка находится в покое и не проводит нервных импульсов, натрий-калиевый насос перемещает ионы калия внутрь клетки и выводит ионы натрия наружу (представьте себе клетку, содержащую пресную воду и окруженную соленой водой). Из-за такого дисбаланса разность потенциалов на мембране аксона достигает 70 милливольт (приблизительно 5% от напряжения обычной батарейки АА).
Однако при изменении состояния клетки и стимуляции аксона электрическим импульсом равновесие на мембране нарушается, и натрий-калиевый насос на короткое время начинает работать в обратном направлении. Положительно заряженные ионы натрия проникают внутрь аксона, а ионы калия откачиваются наружу. На мгновение внутренняя среда аксона приобретает положительный заряд. При этом каналы натрий-калиевого насоса деформируются, блокируя дальнейший приток натрия, а ионы калия продолжают выходить наружу, и исходная разность потенциалов восстанавливается. Тем временем ионы натрия распространяются внутри аксона, изменяя мембрану в нижней части аксона. При этом состояние расположенных ниже насосов меняется, способствуя дальнейшему распространению импульса. Резкое изменение напряжения, вызванное стремительными перемещения ионов натрия и калия, называют потенциалом действия. При прохождении потенциала действия через определенную точку аксона, насосы включаются и восстанавливают состояние покоя.
Потенциал действия распространяется довольно медленно — не более доли дюйма за секунду. Для того чтобы увеличить скорость передачи импульса (поскольку, в конце концов, не годится, чтобы сигнал, посланный мозгом, достигал руки лишь через минуту), аксоны окружены оболочкой из миелина, препятствующей притоку и оттоку калия и натрия. Миелиновая оболочка не непрерывна — через определенные интервалы в ней есть разрывы, и нервный импульс перескакивает из одного «окна» в другое, за счет этого скорость передачи импульса возрастает.
Когда импульс достигает конца основной части тела аксона, его необходимо передать либо следующему нижележащему нейрону, либо, если речь идет о нейронах головного мозга, по многочисленным ответвлениям многим другим нейронам. Для такой передачи используется абсолютно иной процесс, нежели для передачи импульса вдоль аксона. Каждый нейрон отделен от своего соседа небольшой щелью, называемой синапсом. Потенциал действия не может перескочить через эту щель, поэтому нужно найти какой-то другой способ для передачи импульса следующему нейрону. В конце каждого отростка имеются крошечные мешочки, называющие (пресинаптическими) пузырьками, в каждом из которых находятся особые соединения — нейромедиаторы. При поступлении потенциала действия из этих пузырьков высвобождаются молекулы нейромедиаторов, пересекающие синапс и присоединяющиеся к специфичным молекулярным рецепторам на мембране нижележащих нейронов. При присоединении нейромедиатора равновесие на мембране нейрона нарушается. Сейчас мы рассмотрим, возникает ли при таком нарушении равновесия новый потенциал действия (нейрофизиологи продолжают искать ответ на этот важный вопрос до сих пор).
После того как нейромедиаторы передадут нервный импульс от одного нейрона на следующий, они могут просто диффундировать, или подвергнуться химическому расщеплению, или вернуться обратно в свои пузырьки (этот процесс нескладно называется обратным захватом). В конце XX века было сделано поразительное научное открытие — оказывается, лекарства, влияющие на выброс и обратный захват нейромедиаторов, могут коренным образом изменять психическое состояние человека. Прозак (Prozac*) и сходные с ним антидепрессанты блокируют обратный захват нейромедиатора серотонина. Складывается впечатление, что болезнь Паркинсона взаимосвязана с дефицитом нейромедиатора допамина в головном мозге. Исследователи, изучающие пограничные состояния в психиатрии, пытаются понять, как эти соединения влияют на человеческий рассудок.
По-прежнему нет ответа на фундаментальный вопрос о том, что же заставляет нейрон инициировать потенциал действия — выражаясь профессиональным языком нейрофизиологов, неясен механизм «запуска» нейрона. В этом отношении особенно интересны нейроны головного мозга, которые могут принимать нейромедиаторы, посланные тысячей соседей. Об обработке и интеграции этих импульсов почти ничего не известно, хотя над этой проблемой работают многие исследовательские группы. Нам известно лишь, что в нейроне осуществляется процесс интеграции поступающих импульсов и выносится решение, следует или нет инициировать потенциал действия и передавать импульс дальше. Этот фундаментальный процесс управляет функционированием всего головного мозга. Неудивительно, что эта величайшая загадка природы остается, по крайней мере сегодня, загадкой и для науки!
См. также:
From Wikipedia, the free encyclopedia
In neuroscience, nerve conduction velocity (CV) is the speed at which an electrochemical impulse propagates down a neural pathway. Conduction velocities are affected by a wide array of factors, which include age, sex, and various medical conditions. Studies allow for better diagnoses of various neuropathies, especially demyelinating diseases as these conditions result in reduced or non-existent conduction velocities. CV is an important aspect of nerve conduction studies.
Normal conduction velocities[edit]
Ultimately, conduction velocities are specific to each individual and depend largely on an axon’s diameter and the degree to which that axon is myelinated, but the majority of ‘normal’ individuals fall within defined ranges.[1]
Nerve impulses are extremely slow compared to the speed of electricity, where the electric field can propagate with a speed on the order of 50–99% of the speed of light; however, it is very fast compared to the speed of blood flow, with some myelinated neurons conducting at speeds up to 120 m/s (432 km/h or 275 mph).
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated muscle fibers |
|---|---|---|---|---|---|
| α | Aα | 13–20 μm | Yes | 50-60 m/s[2][3] | Extrafusal muscle fibers |
| γ | Aγ | 5–8 μm | Yes | 4–24 m/s [4][5] | Intrafusal muscle fibers |
Different sensory receptors are innervated by different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers, and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity | Associated sensory receptors |
|---|---|---|---|---|---|
| Ia | Aα | 13–20 μm | Yes | 80–120 m/s[6] | Responsible for proprioception |
| Ib | Aα | 13–20 μm | Yes | 80–120 m/s | Golgi tendon organ |
| II | Aβ | 6–12 μm | Yes | 33–75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1–5 μm | Thin | 3–30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2–1.5 μm | No | 0.5–2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
| Type | Erlanger–Gasser classification |
Diameter | Myelin | Conduction velocity |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 μm | Yes | 3–15 m/s |
| postganglionic fibers | C | 0.2–1.5 μm | No | 0.5–2.0 m/s |
| Nerve | Conduction velocity[2][3] |
|---|---|
| Median sensory | 45–70 m/s |
| Median motor | 49–64 m/s |
| Ulnar sensory | 48–74 m/s |
| Ulnar motor | 49+ m/s |
| Peroneal motor | 44+ m/s |
| Tibial motor | 41+ m/s |
| Sural sensory | 46–64 m/s |
Normal impulses in peripheral nerves of the legs travel at 40–45 m/s, and those in peripheral nerves of the arms at 50–65 m/s.[7]
Largely generalized, normal conduction velocities for any given nerve will be in the range of 50–60 m/s.[8]
Testing methods[edit]
Nerve conduction studies[edit]
Nerve conduction velocity is just one of many measurements commonly made during a nerve conduction study (NCS). The purpose of these studies is to determine whether nerve damage is present and how severe that damage may be.
Nerve conduction studies are performed as follows:[8]
- Two electrodes are attached to the subject’s skin over the nerve being tested.
- Electrical impulses are sent through one electrode to stimulate the nerve.
- The second electrode records the impulse sent through the nerve as a result of stimulation.
- The time difference between stimulation from the first electrode and pick-up by the downstream electrode is known as the latency. Nerve conduction latencies are typically on the order of milliseconds.
Although conduction velocity itself is not directly measured, calculating conduction velocities from NCS measurements is trivial. The distance between the stimulating and receiving electrodes is divided by the impulse latency, resulting in conduction velocity.
NCV = conduction distance / (proximal latency-distal latency)
Many times, Needle EMG is also performed on subjects at the same time as other NCS procedures because they aid in detecting whether muscles are functioning properly in response to stimuli sent via their connecting nerves.[8] EMG is the most important component of electrodiagnosis of motor neuron diseases as it often leads to the identification of motor neuron involvement before clinical evidence can be seen.[9]
Micromachined 3D electrode arrays[edit]
Typically, the electrodes used in an EMG are stuck to the skin over a thin layer of gel/paste.[8] This allows for better conduction between electrode and skin. However, as these electrodes do not pierce the skin, there are impedances that result in erroneous readings, high noise levels, and low spatial resolution in readings.[10]
To address these problems, new devices are being developed, such as 3-dimensional electrode arrays. These are MEMS devices that consist of arrays of metal micro-towers capable of penetrating the outer layers of skin, thus reducing impedance.[10]
Compared with traditional wet electrodes, multi-electrode arrays offer the following:[10]
- Electrodes are about 1/10 the size of standard wet surface electrodes
- Arrays of electrodes can be created and scaled to cover areas of almost any size
- Reduced impedance
- Improved signal power
- Higher amplitude signals
- Allow better real-time nerve impulse tracking
Causes of conduction velocity deviations[edit]
Anthropometric and other individualized factors[edit]
Baseline nerve conduction measurements are different for everyone, as they are dependent upon the individual’s age, sex, local temperatures, and other anthropometric factors such as hand size and height.[2][11] It is important to understand the effect of these various factors on the normal values for nerve conduction measurements to aid in identifying abnormal nerve conduction study results. The ability to predict normal values in the context of an individual’s anthropometric characteristics increases the sensitivities and specificities of electrodiagnostic procedures.[2]
Age[edit]
Normal ‘adult’ values for conduction velocities are typically reached by age 4. Conduction velocities in newborns and toddlers tend to be about half the adult values.[1]
Nerve conduction studies performed on healthy adults revealed that age is negatively associated with the sensory amplitude measures of the Median, Ulnar, and Sural nerves. Negative associations were also found between age and the conduction velocities and latencies in the Median sensory, Median motor, and Ulnar sensory nerves. However, conduction velocity of the Sural nerve is not associated with age. In general, conduction velocities in the upper extremities decrease by about 1 m/s for every 10 years of age.[2]
Sex[edit]
Sural nerve conduction amplitude is significantly smaller in females than males, and the latency of impulses is longer in females, thus a slower conduction velocity.[2]
Other nerves have not been shown to exhibit any gender biases.[citation needed]
Temperature[edit]
In general, the conduction velocities of most motor and sensory nerves are positively and linearly associated with body temperature (low temperatures slow nerve conduction velocity and higher temperatures increase conduction velocity).[1]
Conduction velocities in the Sural nerve seem to exhibit an especially strong correlation with the local temperature of the nerve.[2]
Height[edit]
Conduction velocities in both the Median sensory and Ulnar sensory nerves are negatively related to an individual’s height, which likely accounts for the fact that, among most of the adult population, conduction velocities between the wrist and digits of an individual’s hand decrease by 0.5 m/s for each inch increase in height.[2] As a direct consequence, impulse latencies within the Median, Ulnar, and Sural nerves increases with height.[2]
The correlation between height and the amplitude of impulses in the sensory nerves is negative.[2]
Hand factors[edit]
Circumference of the index finger appears to be negatively associated with conduction amplitudes in the Median and Ulnar nerves. In addition, people with larger wrist ratios (anterior-posterior diameter : medial-lateral diameter) have lower Median nerve latencies and faster conduction velocities.[2]
Medical conditions[edit]
Myasthenia gravis[edit]
Amyotrophic lateral sclerosis (ALS)[edit]
Amyotrophic lateral sclerosis is a progressive and inevitably fatal neurodegenerative disease affecting the motor neurons.[9] Because ALS shares many symptoms with other neurodegenerative diseases, it can be difficult to diagnose properly. The best method of establishing a confident diagnosis is via electrodiagnostic evaluation. To be specific, motor nerve conduction studies of the Median, Ulnar, and peroneal muscles should be performed, as well as sensory nerve conduction studies of the Ulnar and Sural nerves.[9]
In patients with ALS, it has been shown that distal motor latencies and slowing of conduction velocity worsened as the severity of their muscle weakness increased. Both symptoms are consistent with the axonal degeneration occurring in ALS patients.[9]
Carpal tunnel syndrome[edit]
Carpal tunnel syndrome (CTS) is a form of nerve compression syndrome caused by the compression of the median nerve at the wrist. Typical symptoms include numbness, tingling, burning pains, or weakness in the hand.[12][13] CTS is another condition for which electrodiagnostic testing is valuable.[12][14] However, before subjecting a patient to nerve conduction studies, both Tinel’s test and Phalen’s test should be performed. If both results are negative, it is very unlikely that the patient has CTS, and further testing is unnecessary.[13]
Carpal tunnel syndrome presents in each individual to different extents. Measurements of nerve conduction velocity are critical to determining the degree of severity.[14][15]
These levels of severity are categorized as:[12][13]
- Mild CTS: Prolonged sensory latencies, very slight decrease in conduction velocity. No suspected axonal degeneration.
- Moderate CTS: Abnormal sensory conduction velocities and reduced motor conduction velocities. No suspected axonal degeneration.
- Severe CTS: Absence of sensory responses and prolonged motor latencies (reduced motor conduction velocities).
- Extreme CTS: Absence of both sensory and motor responses.
One common electrodiagnostic measurement includes the difference between sensory nerve conduction velocities in the pinkie finger and index finger. In most instances of CTS, symptoms will not present until this difference is greater than 8 m/s.[12][13]
Guillain–Barré syndrome[edit]
Guillain–Barré syndrome (GBS) is a peripheral neuropathy involving the degeneration of myelin sheathing and/or nerves that innervate the head, body, and limbs.[7] This degeneration is due to an autoimmune response typically initiated by various infections.
Two primary classifications exist: demyelinating (Schwann cell damage) and axonal (direct nerve fiber damage).[7][16] Each of these then branches into additional sub-classifications depending on the exact manifestation. In all cases, however, the condition results in weakness or paralysis of limbs, the potentially fatal paralysis of respiratory muscles, or a combination of these effects.[7]
The disease can progress very rapidly once symptoms present (severe damage can occur within as little as a day).[7] Because electrodiagnosis is one of the fastest and most direct methods of determining the presence of the illness and its proper classification, nerve conduction studies are extremely important.[16] Without proper electrodiagnostic assessment, GBS is commonly misdiagnosed as polio, West Nile virus, tick paralysis, various toxic neuropathies, CIDP, transverse myelitis, or hysterical paralysis.[7] Two sets of nerve conduction studies should allow for proper diagnosis of Guillain–Barré syndrome. It is recommended that these be performed within the first 2 weeks of symptom presentation and again sometime between 3 and 8 weeks.[16]
Electrodiagnostic findings that may implicate GBS include:[3][7][16]
- Complete conduction blocks
- Abnormal or absent F waves
- Attenuated compound muscle action potential amplitudes
- Prolonged motor neuron latencies
- Severely slowed conduction velocities (sometimes below 20 m/s)
Lambert–Eaton myasthenic syndrome[edit]
Lambert–Eaton myasthenic syndrome (LEMS) is an autoimmune disease in which auto-antibodies are directed against voltage-gated calcium channels at presynaptic nerve terminals. Here, the antibodies inhibit the release of neurotransmitters, resulting in muscle weakness and autonomic dysfunctions.[17]
Nerve conduction studies performed on the Ulnar motor and sensory, Median motor and sensory, Tibial motor, and Peroneal motor nerves in patients with LEMS have shown that the conduction velocity across these nerves is actually normal. However, the amplitudes of the compound motor action potentials may be reduced by up to 55%, and the duration of these action potentials decreased by up to 47%.[17]
Peripheral diabetic neuropathy[edit]
At least half the population with diabetes mellitus is also affected with diabetic neuropathy, causing numbness and weakness in the peripheral limbs.[18] Studies have shown that the Rho/Rho-kinase signaling pathway is more active in individuals with diabetes and that this signaling activity occurs mainly in the nodes of Ranvier and Schmidt-Lanterman incisures.[18] Therefore, over-activity of the Rho/Rho-kinase signaling pathway may inhibit nerve conduction.
Motor nerve conduction velocity studies revealed that conductance in diabetic rats was about 30% lower than that of the non-diabetic control group. In addition, activity along the Schmidt-Lanterman incisures was non-continuous and non-linear in the diabetic group, but linear and continuous in the control. These deficiencies were eliminated after the administration of Fasudil to the diabetic group, implying that it may be a potential treatment.[18]
See also[edit]
- Nerve conduction study
- Electrodiagnosis
- Electromyography
References[edit]
- ^ a b c «Nerve conduction velocity». National Institutes of Health. 31 October 2013. Retrieved 13 November 2013.
- ^ a b c d e f g h i j k Stetson, PhD, Diana S.; James W. Albers; Barbara A. Silverstein; Robert A. Wolfe (October 1992). «Effects of Age, Sex, and Anthropometric Factors on Nerve Conduction Measures» (PDF). Muscle & Nerve. 15 (10): 1095–1104. doi:10.1002/mus.880151007. hdl:2027.42/50152. PMID 1406766. S2CID 9508325.
- ^ a b c Sedano, Maria J.; Canga, Ana; Pablos, Carmen; Polo, Jose M.; Berciano, Jose (31 January 2013). «Muscle MRI in severe Guillain–Barré syndrome with motor nerve inexcitability». Journal of Neurology. 260 (6): 1624–1630. doi:10.1007/s00415-013-6845-y. PMID 23370612. S2CID 9763303.
- ^ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ^ Russell NJ (1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». J Physiol. 298: 347–360. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Siegel, Allan; Sapru, Hreday (2005). Essential Neuroscience. p. 257. ISBN 978-0781750776.
- ^ a b c d e f g Parry, Gareth J. (2007). Guillain–Barré Syndrome. New York, NY: Demos Medical Publishing. pp. 1–9. ISBN 978-1-932603-56-9.
- ^ a b c d «Nerve Conduction Study (NCS)». Johns Hopkins Medicine. Retrieved 17 November 2013.
- ^ a b c d Joyce, Nanette C.; Carter, Gregory T. (May 2013). «Electrodiagnosis in Persons With Amyotrophic Lateral Sclerosis». PM&R. 5 (5, Supplement): S89–S95. doi:10.1016/j.pmrj.2013.03.020. PMC 4590769. PMID 23523708.
- ^ a b c Rajaraman, Swaminathan; Bragg, Julian A.; Ross, James D.; Allen, Mark G. (30 June 2011). «Micromachined three-dimensional electrode arrays for transcutaneous nerve tracking». Journal of Micromechanics and Microengineering. 21 (8): 085014. Bibcode:2011JMiMi..21h5014R. doi:10.1088/0960-1317/21/8/085014. S2CID 53482527.
- ^ Thanakiatpinyo, MD, Thanitta; Gulapar Srisawasdi (2013). «Effect of Hand Size on the Stimulation Intensities Required for Median and Ulnar Sensory Nerve Conduction Studies». Archives of Physical Medicine and Rehabilitation. 94 (5): 925–929. doi:10.1016/j.apmr.2012.11.029. PMID 23201426.
- ^ a b c d Werner, Robert A.; Andary, Michael (October 2011). «Electrodiagnostic evaluation of carpal tunnel syndrome» (PDF). Muscle & Nerve. 44 (4): 597–607. doi:10.1002/mus.22208. hdl:2027.42/87013. PMID 21922474. S2CID 18623599.
- ^ a b c d Ntani, Georgia; Palmer, Keith T.; Linaker, Cathy; Harris, E Clare; Van der Star, Richard; Cooper, Cyrus; Coggon, David (15 August 2013). «Symptoms, signs and nerve conduction velocities in patients with suspected carpal tunnel syndrome». BMC Musculoskeletal Disorders. 14 (1): 242. doi:10.1186/1471-2474-14-242. PMC 3765787. PMID 23947775.
- ^ a b Inukai, Tomoo; Uchida, Kenzo; Kubota, Chikara; Takamura, Takaharu; Nakajima, Hideaki; Baba, Hisatoshi (24 October 2013). «Second lumbrical-interossei nerve test predicts clinical severity and surgical outcome of carpal tunnel syndrome». Journal of Clinical Neuroscience. 20 (9): 1224–1227. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ Robinson, Lawrence, R.; Strakowski, Jeffrey; Kennedy, David J. (May 2013). «Is the Combined Sensory (Robinson) Index Routinely Indicated for All Cases of Suspected Carpal Tunnel Syndrome Undergoing Electrodiagnostic Evaluation?». PM&R. 5 (5): 433–437. doi:10.1016/j.pmrj.2013.04.007. PMID 23701980. S2CID 31973259.
- ^ a b c d Shahrizaila, Nortina; Goh, Khean Jin; Abdullah, Suhailah; Kuppusamy, Rishikesan; Yuki, Nobuhiro (8 February 2013). «Two sets of nerve conduction studies may suffice in reaching a reliable electrodiagnosis in Guillain–Barré syndrome». Clinical Neurophysiology. 124 (7): 1456–1459. doi:10.1016/j.clinph.2012.12.047. PMID 23395599. S2CID 33925550.
- ^ a b Crone, Clarissa; Christiansen, Ingelise; Vissing, John (3 May 2013). «Myopathic EMG findings and type II muscle fiber atrophy in patients with Lambert-Eaton myasthenic syndrome». Clinical Neurophysiology. 124 (9): 1889–1892. doi:10.1016/j.clinph.2013.02.115. PMID 23643575. S2CID 25526831.
- ^ a b c Kanazawa, Yasushi; Junko Takahashi-Fujigasaki; Sho Ishizawa; Naoko Takabayashi; Kumiko Ishibashi; Keiichiro Matoba; Daiji Kawanami; Tamotsu Yokota; Naoko Tajima; Kazunori Utsunomiya (September 2013). «The Rho-kinase inhibitor fasudil restores normal motor nerve conduction velocity in diabetic rats by assuring the proper localization of adhesion-related molecules in myelinating Schwann cells». Experimental Neurology. 247: 438–446. doi:10.1016/j.expneurol.2013.01.012. PMID 23337773. S2CID 3004517.
External links[edit]
- Virtual NCS training and other educational tools Archived 2016-03-12 at the Wayback Machine
https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%81%D0%BE%D0%BD
Нейрон состоит из одного аксона, тела и нескольких дендритов,
Аксон (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Строение нейрона
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная(гладкая)эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[1]
Анатомия
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[2]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня. Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в матеоиале — например, волокна автономной нервной системы
Двигательная функция
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[3][4] | Intrafusal muscle fibers |
Сенсорная функция
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[5] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона
Нейрон
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [6].
См. также
- Сенсорные нервы
- Сенсорный рецептор
- Нейрон
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс |
Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор |
Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия |
Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань |
Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Оболочки мозга |