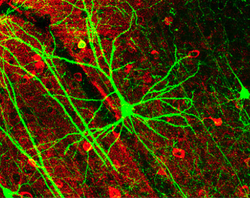
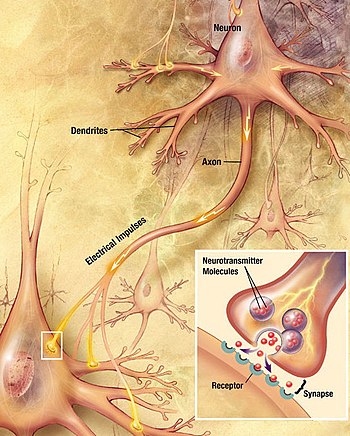
Нейрон представляет собой нервную клетку, которая является основным строительным материалом нервной системы. Нейроны похожи на другие клетки в организме человека, но есть одно ключевое различие между нейронами и другими клетками. Нейроны специализируются на передачи информации по всему телу, нервная клетка воспринимает, хранит, перерабатывает и извлекает информацию.
Есть также несколько различных типов нейронов, ответственных за различные задачи в организме человека. Сенсорные нейроны передают информацию от рецепторов сенсорных клеток по всему организму к мозгу. Моторные нейроны передают информацию от мозга к мышцам тела. Интернейроны несут ответственность за обмена информацией между различными нейронами в организме.
В отличие от других клеток организма, нейроны перестают воспроизводиться вскоре после рождения человека. Из-за этого некоторые участки головного мозга имеют больше нейронов при рождении, чем в более позднем возрасте. В то время как сами количество самих нейронов не увеличивается, однако исследования показали, что новые связи между нейронами образуются на протяжении всей жизни человека.
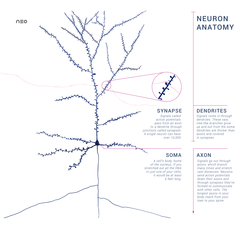
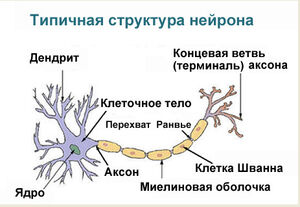
Нейроны имеют мембрану, которая предназначена для передачи информации в другие клетки. Аксоны и дендриты (отростки на нейроне) предназначены для передачи и приема информации. Связи между клетками называются синапсами. Для того чтобы обмениваться сигналами, нейроны используют специальные вещества – нейромедиаторы.
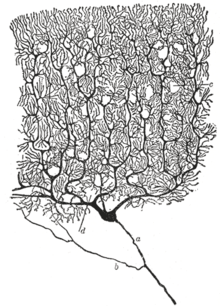
Существуют три основные части нейрона: дендриты, тело клетки и аксон. Тем не менее, все нейроны могут несколько отличаться по размеру, форме и характеристикам в зависимости от функции и роли нейронов. Некоторые нейроны имеют несколько дендритных ветвей, а другие сильно разветвлены для того чтобы получать большой объем информации. Некоторые нейроны имеют короткие аксоны, в то время как другие могут быть довольно длинными. Самый длинный аксон в организме человека простирается от нижней части позвоночника к большому пальцу, средняя длина такого аксона около 90 сантиметров.
Как нейроны передают и получают информацию? Для того, чтобы нейроны взаимодействовали, они должны передавать информацию как внутри нейрона, так и от одного нейрона к другому. Дендриты нейронов получают информацию от рецепторов или других нейронов. Эта информация затем передается в тело клетки и на аксон. После того как информация прибывает в аксон, она путешествует по всей длине аксона в виде электрического сигнала, известного как потенциал действия.
Как только электрический импульс достигает конца аксона, информация должна быть передана через синаптическую щель к дендритам соседних нейронов. Электрический сигнал может почти мгновенно преодолеть расстояние между нейронами и продолжать свой путь.
В других случаях необходимы нейромедиаторы для передачи информации от одного нейрона к другому. Нейромедиаторы это химические вещества, с помощью которых осуществляется передача электрического импульса с нервной клетки между нейронами через синаптическое пространство, так они достигают рецепторы других нейронов. В процессе известном как обратный захват, эти нейромедиаторы связываются с рецепторами и поглощаются нейроном для повторного использования (поглощение нейронами или обратный захват).Обратный захват это обратное поглощение нейромедиатора через пресинаптические нейроны, после того как он уже выполнил свою функцию передачи электрического импульса. Например, антидепрессанты типа СИОЗС — селективные ингибиторы обратного захвата серотонина — блокируют возврат серотонина обратно в пресинаптическую клетку, клетку, посылающую нервный импульс, и это действие увеличивает концентрацию серотонина в синаптической щели между нервными клетками, усиливая стимуляцию постсинаптической, принимающей импульс, клетки.
Хотя точно не известно, сколько нейромедиаторов существуют, ученые обнаружиои уже более ста нейромедиаторов.
Какое влияние каждый из этих нейромедиаторов оказывает на организм? Что происходит, когда болезнь или лекарства вмешиваются в этот посреднический путь нейромедиаторов? Некоторые из основных нейромедиаторов:
Ацетилхолин: связан с памятью, мышечными сокращениями и обучением. Отсутствие ацетилхолина в мозге связаны с болезнью Альцгеймера.
Эндорфины: связаны с эмоциями и восприятием боли. Организм вырабатывает эндорфины в ответ на страх или на травмы. Эти химические курьеры похожи на опиаты, такие как морфин, но эндорфин значительно мощнее.
Дофамин: связан с мышлением и приятными эмоциями. Болезнь Паркинсона является одним из заболеваний, связанным с дефицитом дофамина, а шизофрения связана с превышением уровня дофамина в головном мозге.
consulty.ru
Not to be confused with Neutron.
| Neuron | |
|---|---|

Anatomy of a multipolar neuron |
|
| Identifiers | |
| MeSH | D009474 |
| NeuroLex ID | sao1417703748 |
| TA98 | A14.0.00.002 |
| TH | H2.00.06.1.00002 |
| FMA | 54527 |
| Anatomical terms of neuroanatomy
[edit on Wikidata] |
A neuron, neurone, or nerve cell is an electrically excitable cell that fires electric signals called action potentials. Neurons communicate with other cells via synapses — specialized connections that commonly use minute amounts of chemical neurotransmitters to pass the electric signal from the presynaptic neuron to the target cell through the synaptic gap. The neuron is the main component of nervous tissue in all animals except sponges and placozoa. Non-animals like plants and fungi do not have nerve cells.
Neurons are typically classified into three types based on their function. Sensory neurons respond to stimuli such as touch, sound, or light that affect the cells of the sensory organs, and they send signals to the spinal cord or brain. Motor neurons receive signals from the brain and spinal cord to control everything from muscle contractions to glandular output. Interneurons connect neurons to other neurons within the same region of the brain or spinal cord. When multiple neurons are functionally connected together, they form what is called a neural circuit.
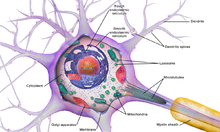
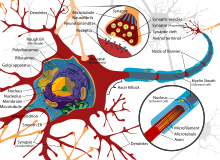
A typical neuron consists of a cell body (soma), dendrites, and a single axon. The soma is a compact structure, and the axon and dendrites are filaments extruding from the soma. Dendrites typically branch profusely and extend a few hundred micrometers from the soma. The axon leaves the soma at a swelling called the axon hillock and travels for as far as 1 meter in humans or more in other species. It branches but usually maintains a constant diameter. At the farthest tip of the axon’s branches are axon terminals, where the neuron can transmit a signal across the synapse to another cell. Neurons may lack dendrites or have no axon. The term neurite is used to describe either a dendrite or an axon, particularly when the cell is undifferentiated.
Most neurons receive signals via the dendrites and soma and send out signals down the axon. At the majority of synapses, signals cross from the axon of one neuron to a dendrite of another. However, synapses can connect an axon to another axon or a dendrite to another dendrite.
The signaling process is partly electrical and partly chemical. Neurons are electrically excitable, due to maintenance of voltage gradients across their membranes. If the voltage changes by a large enough amount over a short interval, the neuron generates an all-or-nothing electrochemical pulse called an action potential. This potential travels rapidly along the axon and activates synaptic connections as it reaches them. Synaptic signals may be excitatory or inhibitory, increasing or reducing the net voltage that reaches the soma.
In most cases, neurons are generated by neural stem cells during brain development and childhood. Neurogenesis largely ceases during adulthood in most areas of the brain.
Nervous system[edit]
Schematic of an anatomically accurate single pyramidal neuron, the primaryious excitatory neuron of cerebral cortex, with a synaptic connection from an incoming axon onto a dendritic spine
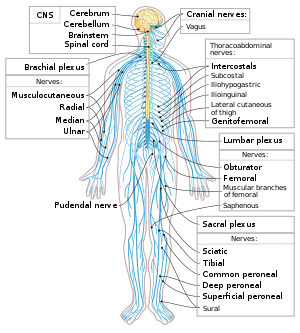
Neurons are the primary components of the nervous system, along with the glial cells that give them structural and metabolic support.[1] The nervous system is made up of the central nervous system, which includes the brain and spinal cord, and the peripheral nervous system, which includes the autonomic and somatic nervous systems.[2] In vertebrates, the majority of neurons belong to the central nervous system, but some reside in peripheral ganglia, and many sensory neurons are situated in sensory organs such as the retina and cochlea.
Axons may bundle into fascicles that make up the nerves in the peripheral nervous system (like strands of wire make up cables). Bundles of axons in the central nervous system are called tracts.
Anatomy and histology[edit]
Diagram of the components of a neuron
Neurons are highly specialized for the processing and transmission of cellular signals. Given their diversity of functions performed in different parts of the nervous system, there is a wide variety in their shape, size, and electrochemical properties. For instance, the soma of a neuron can vary from 4 to 100 micrometers in diameter.[3]
- The soma is the body of the neuron. As it contains the nucleus, most protein synthesis occurs here. The nucleus can range from 3 to 18 micrometers in diameter.[4]
- The dendrites of a neuron are cellular extensions with many branches. This overall shape and structure are referred to metaphorically as a dendritic tree. This is where the majority of input to the neuron occurs via the dendritic spine.
- The axon is a finer, cable-like projection that can extend tens, hundreds, or even tens of thousands of times the diameter of the soma in length. The axon primarily carries nerve signals away from the soma and carries some types of information back to it. Many neurons have only one axon, but this axon may—and usually will—undergo extensive branching, enabling communication with many target cells. The part of the axon where it emerges from the soma is called the axon hillock. Besides being an anatomical structure, the axon hillock also has the greatest density of voltage-dependent sodium channels. This makes it the most easily excited part of the neuron and the spike initiation zone for the axon. In electrophysiological terms, it has the most negative threshold potential.
- While the axon and axon hillock are generally involved in information outflow, this region can also receive input from other neurons.
- The axon terminal is found at the end of the axon farthest from the soma and contains synapses. Synaptic boutons are specialized structures where neurotransmitter chemicals are released to communicate with target neurons. In addition to synaptic boutons at the axon terminal, a neuron may have en passant boutons, which are located along the length of the axon.
The accepted view of the neuron attributes dedicated functions to its various anatomical components; however, dendrites and axons often act in ways contrary to their so-called main function.[5]
Diagram of a typical myelinated vertebrate motor neuron
Axons and dendrites in the central nervous system are typically only about one micrometer thick, while some in the peripheral nervous system are much thicker. The soma is usually about 10–25 micrometers in diameter and often is not much larger than the cell nucleus it contains. The longest axon of a human motor neuron can be over a meter long, reaching from the base of the spine to the toes.
Sensory neurons can have axons that run from the toes to the posterior column of the spinal cord, over 1.5 meters in adults. Giraffes have single axons several meters in length running along the entire length of their necks. Much of what is known about axonal function comes from studying the squid giant axon, an ideal experimental preparation because of its relatively immense size (0.5–1 millimeter thick, several centimeters long).
Fully differentiated neurons are permanently postmitotic[6] however, stem cells present in the adult brain may regenerate functional neurons throughout the life of an organism (see neurogenesis). Astrocytes are star-shaped glial cells. They have been observed to turn into neurons by virtue of their stem cell-like characteristic of pluripotency.
Membrane[edit]
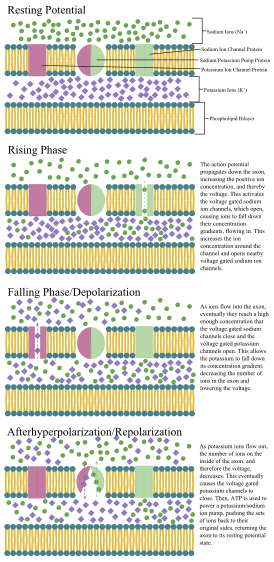
Like all animal cells, the cell body of every neuron is enclosed by a plasma membrane, a bilayer of lipid molecules with many types of protein structures embedded in it.[7] A lipid bilayer is a powerful electrical insulator, but in neurons, many of the protein structures embedded in the membrane are electrically active. These include ion channels that permit electrically charged ions to flow across the membrane and ion pumps that chemically transport ions from one side of the membrane to the other. Most ion channels are permeable only to specific types of ions. Some ion channels are voltage gated, meaning that they can be switched between open and closed states by altering the voltage difference across the membrane. Others are chemically gated, meaning that they can be switched between open and closed states by interactions with chemicals that diffuse through the extracellular fluid. The ion materials include sodium, potassium, chloride, and calcium. The interactions between ion channels and ion pumps produce a voltage difference across the membrane, typically a bit less than 1/10 of a volt at baseline. This voltage has two functions: first, it provides a power source for an assortment of voltage-dependent protein machinery that is embedded in the membrane; second, it provides a basis for electrical signal transmission between different parts of the membrane.
Histology and internal structure[edit]
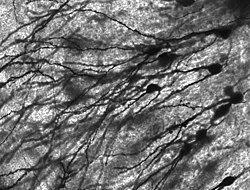
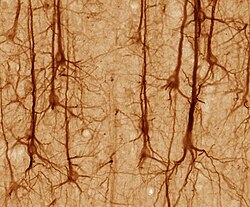
Golgi-stained neurons in human hippocampal tissue
Actin filaments in a mouse cortical neuron in culture
Numerous microscopic clumps called Nissl bodies (or Nissl substance) are seen when nerve cell bodies are stained with a basophilic («base-loving») dye. These structures consist of rough endoplasmic reticulum and associated ribosomal RNA. Named after German psychiatrist and neuropathologist Franz Nissl (1860–1919), they are involved in protein synthesis and their prominence can be explained by the fact that nerve cells are very metabolically active. Basophilic dyes such as aniline or (weakly) haematoxylin[8] highlight negatively charged components, and so bind to the phosphate backbone of the ribosomal RNA.
The cell body of a neuron is supported by a complex mesh of structural proteins called neurofilaments, which together with neurotubules (neuronal microtubules) are assembled into larger neurofibrils.[9] Some neurons also contain pigment granules, such as neuromelanin (a brownish-black pigment that is byproduct of synthesis of catecholamines), and lipofuscin (a yellowish-brown pigment), both of which accumulate with age.[10][11][12] Other structural proteins that are important for neuronal function are actin and the tubulin of microtubules. Class III β-tubulin is found almost exclusively in neurons. Actin is predominately found at the tips of axons and dendrites during neuronal development. There the actin dynamics can be modulated via an interplay with microtubule.[13]
There are different internal structural characteristics between axons and dendrites. Typical axons almost never contain ribosomes, except some in the initial segment. Dendrites contain granular endoplasmic reticulum or ribosomes, in diminishing amounts as the distance from the cell body increases.
Classification[edit]
Neurons vary in shape and size and can be classified by their morphology and function.[15] The anatomist Camillo Golgi grouped neurons into two types; type I with long axons used to move signals over long distances and type II with short axons, which can often be confused with dendrites. Type I cells can be further classified by the location of the soma. The basic morphology of type I neurons, represented by spinal motor neurons, consists of a cell body called the soma and a long thin axon covered by a myelin sheath. The dendritic tree wraps around the cell body and receives signals from other neurons. The end of the axon has branching axon terminals that release neurotransmitters into a gap called the synaptic cleft between the terminals and the dendrites of the next neuron.[citation needed]
Structural classification[edit]
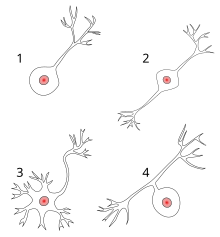
Polarity[edit]
Most neurons can be anatomically characterized as:[citation needed]
- Unipolar: single process
- Bipolar: 1 axon and 1 dendrite
- Multipolar: 1 axon and 2 or more dendrites
- Golgi I: neurons with long-projecting axonal processes; examples are pyramidal cells, Purkinje cells, and anterior horn cells
- Golgi II: neurons whose axonal process projects locally; the best example is the granule cell
- Anaxonic: where the axon cannot be distinguished from the dendrite(s)
- Pseudounipolar: 1 process which then serves as both an axon and a dendrite
Other[edit]
Some unique neuronal types can be identified according to their location in the nervous system and distinct shape. Some examples are:[citation needed]
- Basket cells, interneurons that form a dense plexus of terminals around the soma of target cells, found in the cortex and cerebellum
- Betz cells, large motor neurons
- Lugaro cells, interneurons of the cerebellum
- Medium spiny neurons, most neurons in the corpus striatum
- Purkinje cells, huge neurons in the cerebellum, a type of Golgi I multipolar neuron
- Pyramidal cells, neurons with triangular soma, a type of Golgi I
- Renshaw cells, neurons with both ends linked to alpha motor neurons
- Unipolar brush cells, interneurons with unique dendrite ending in a brush-like tuft
- Granule cells, a type of Golgi II neuron
- Anterior horn cells, motoneurons located in the spinal cord
- Spindle cells, interneurons that connect widely separated areas of the brain
Functional classification[edit]
Direction[edit]
- Afferent neurons convey information from tissues and organs into the central nervous system and are also called sensory neurons.
- Efferent neurons (motor neurons) transmit signals from the central nervous system to the effector cells.
- Interneurons connect neurons within specific regions of the central nervous system.
Afferent and efferent also refer generally to neurons that, respectively, bring information to or send information from the brain.
Action on other neurons[edit]
A neuron affects other neurons by releasing a neurotransmitter that binds to chemical receptors. The effect upon the postsynaptic neuron is determined by the type of receptor that is activated, not by the presynaptic neuron or by the neurotransmitter. A neurotransmitter can be thought of as a key, and a receptor as a lock: the same neurotransmitter can activate multiple types of receptors. Receptors can be classified broadly as excitatory (causing an increase in firing rate), inhibitory (causing a decrease in firing rate), or modulatory (causing long-lasting effects not directly related to firing rate).[citation needed]
The two most common (90%+) neurotransmitters in the brain, glutamate and GABA, have largely consistent actions. Glutamate acts on several types of receptors, and has effects that are excitatory at ionotropic receptors and a modulatory effect at metabotropic receptors. Similarly, GABA acts on several types of receptors, but all of them have inhibitory effects (in adult animals, at least). Because of this consistency, it is common for neuroscientists to refer to cells that release glutamate as «excitatory neurons», and cells that release GABA as «inhibitory neurons». Some other types of neurons have consistent effects, for example, «excitatory» motor neurons in the spinal cord that release acetylcholine, and «inhibitory» spinal neurons that release glycine.[citation needed]
The distinction between excitatory and inhibitory neurotransmitters is not absolute. Rather, it depends on the class of chemical receptors present on the postsynaptic neuron. In principle, a single neuron, releasing a single neurotransmitter, can have excitatory effects on some targets, inhibitory effects on others, and modulatory effects on others still. For example, photoreceptor cells in the retina constantly release the neurotransmitter glutamate in the absence of light. So-called OFF bipolar cells are, like most neurons, excited by the released glutamate. However, neighboring target neurons called ON bipolar cells are instead inhibited by glutamate, because they lack typical ionotropic glutamate receptors and instead express a class of inhibitory metabotropic glutamate receptors.[16] When light is present, the photoreceptors cease releasing glutamate, which relieves the ON bipolar cells from inhibition, activating them; this simultaneously removes the excitation from the OFF bipolar cells, silencing them.[citation needed]
It is possible to identify the type of inhibitory effect a presynaptic neuron will have on a postsynaptic neuron, based on the proteins the presynaptic neuron expresses. Parvalbumin-expressing neurons typically dampen the output signal of the postsynaptic neuron in the visual cortex, whereas somatostatin-expressing neurons typically block dendritic inputs to the postsynaptic neuron.[17]
Discharge patterns[edit]
Neurons have intrinsic electroresponsive properties like intrinsic transmembrane voltage oscillatory patterns.[18] So neurons can be classified according to their electrophysiological characteristics:
- Tonic or regular spiking. Some neurons are typically constantly (tonically) active, typically firing at a constant frequency. Example: interneurons in neurostriatum.
- Phasic or bursting. Neurons that fire in bursts are called phasic.
- Fast spiking. Some neurons are notable for their high firing rates, for example some types of cortical inhibitory interneurons, cells in globus pallidus, retinal ganglion cells.[19][20]
Neurotransmitter[edit]
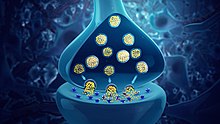
Synaptic vesicles containing neurotransmitters
Neurotransmitters are chemical messengers passed from one neuron to another neuron or to a muscle cell or gland cell.
- Cholinergic neurons – acetylcholine. Acetylcholine is released from presynaptic neurons into the synaptic cleft. It acts as a ligand for both ligand-gated ion channels and metabotropic (GPCRs) muscarinic receptors. Nicotinic receptors are pentameric ligand-gated ion channels composed of alpha and beta subunits that bind nicotine. Ligand binding opens the channel causing influx of Na+ depolarization and increases the probability of presynaptic neurotransmitter release. Acetylcholine is synthesized from choline and acetyl coenzyme A.
- Adrenergic neurons – noradrenaline. Noradrenaline (norepinephrine) is released from most postganglionic neurons in the sympathetic nervous system onto two sets of GPCRs: alpha adrenoceptors and beta adrenoceptors. Noradrenaline is one of the three common catecholamine neurotransmitter, and the most prevalent of them in the peripheral nervous system; as with other catecholamines, it is synthesised from tyrosine.
- GABAergic neurons – gamma aminobutyric acid. GABA is one of two neuroinhibitors in the central nervous system (CNS), along with glycine. GABA has a homologous function to ACh, gating anion channels that allow Cl− ions to enter the post synaptic neuron. Cl− causes hyperpolarization within the neuron, decreasing the probability of an action potential firing as the voltage becomes more negative (for an action potential to fire, a positive voltage threshold must be reached). GABA is synthesized from glutamate neurotransmitters by the enzyme glutamate decarboxylase.
- Glutamatergic neurons – glutamate. Glutamate is one of two primary excitatory amino acid neurotransmitters, along with aspartate. Glutamate receptors are one of four categories, three of which are ligand-gated ion channels and one of which is a G-protein coupled receptor (often referred to as GPCR).
-
- AMPA and Kainate receptors function as cation channels permeable to Na+ cation channels mediating fast excitatory synaptic transmission.
- NMDA receptors are another cation channel that is more permeable to Ca2+. The function of NMDA receptors depend on glycine receptor binding as a co-agonist within the channel pore. NMDA receptors do not function without both ligands present.
- Metabotropic receptors, GPCRs modulate synaptic transmission and postsynaptic excitability.
- Glutamate can cause excitotoxicity when blood flow to the brain is interrupted, resulting in brain damage. When blood flow is suppressed, glutamate is released from presynaptic neurons, causing greater NMDA and AMPA receptor activation than normal outside of stress conditions, leading to elevated Ca2+ and Na+ entering the post synaptic neuron and cell damage. Glutamate is synthesized from the amino acid glutamine by the enzyme glutamate synthase.
- Dopaminergic neurons—dopamine. Dopamine is a neurotransmitter that acts on D1 type (D1 and D5) Gs-coupled receptors, which increase cAMP and PKA, and D2 type (D2, D3, and D4) receptors, which activate Gi-coupled receptors that decrease cAMP and PKA. Dopamine is connected to mood and behavior and modulates both pre- and post-synaptic neurotransmission. Loss of dopamine neurons in the substantia nigra has been linked to Parkinson’s disease. Dopamine is synthesized from the amino acid tyrosine. Tyrosine is catalyzed into levodopa (or L-DOPA) by tyrosine hydroxlase, and levodopa is then converted into dopamine by the aromatic amino acid decarboxylase.
- Serotonergic neurons—serotonin. Serotonin (5-Hydroxytryptamine, 5-HT) can act as excitatory or inhibitory. Of its four 5-HT receptor classes, 3 are GPCR and 1 is a ligand-gated cation channel. Serotonin is synthesized from tryptophan by tryptophan hydroxylase, and then further by decarboxylase. A lack of 5-HT at postsynaptic neurons has been linked to depression. Drugs that block the presynaptic serotonin transporter are used for treatment, such as Prozac and Zoloft.
- Purinergic neurons—ATP. ATP is a neurotransmitter acting at both ligand-gated ion channels (P2X receptors) and GPCRs (P2Y) receptors. ATP is, however, best known as a cotransmitter. Such purinergic signalling can also be mediated by other purines like adenosine, which particularly acts at P2Y receptors.
- Histaminergic neurons—histamine. Histamine is a monoamine neurotransmitter and neuromodulator. Histamine-producing neurons are found in the tuberomammillary nucleus of the hypothalamus.[21] Histamine is involved in arousal and regulating sleep/wake behaviors.
Multimodel classification[edit]
Since 2012 there has been a push from the cellular and computational neuroscience community to come up with a universal classification of neurons that will apply to all neurons in the brain as well as across species. This is done by considering the three essential qualities of all neurons: electrophysiology, morphology, and the individual transcriptome of the cells. Besides being universal this classification has the advantage of being able to classify astrocytes as well. A method called Patch-Seq in which all three qualities can be measured at once is used extensively by the Allen Institute for Brain Science.[22]
Connectivity[edit]
A signal propagating down an axon to the cell body and dendrites of the next cell
Neurons communicate with each other via synapses, where either the axon terminal of one cell contacts another neuron’s dendrite, soma or, less commonly, axon. Neurons such as Purkinje cells in the cerebellum can have over 1000 dendritic branches, making connections with tens of thousands of other cells; other neurons, such as the magnocellular neurons of the supraoptic nucleus, have only one or two dendrites, each of which receives thousands of synapses.
Synapses can be excitatory or inhibitory, either increasing or decreasing activity in the target neuron, respectively. Some neurons also communicate via electrical synapses, which are direct, electrically conductive junctions between cells.[23]
When an action potential reaches the axon terminal, it opens voltage-gated calcium channels, allowing calcium ions to enter the terminal. Calcium causes synaptic vesicles filled with neurotransmitter molecules to fuse with the membrane, releasing their contents into the synaptic cleft. The neurotransmitters diffuse across the synaptic cleft and activate receptors on the postsynaptic neuron. High cytosolic calcium in the axon terminal triggers mitochondrial calcium uptake, which, in turn, activates mitochondrial energy metabolism to produce ATP to support continuous neurotransmission.[24]
An autapse is a synapse in which a neuron’s axon connects to its own dendrites.
The human brain has some 8.6 x 1010 (eighty six billion) neurons.[25] Each neuron has on average 7,000 synaptic connections to other neurons. It has been estimated that the brain of a three-year-old child has about 1015 synapses (1 quadrillion). This number declines with age, stabilizing by adulthood. Estimates vary for an adult, ranging from 1014 to 5 x 1014 synapses (100 to 500 trillion).[26]
An annotated diagram of the stages of an action potential propagating down an axon including the role of ion concentration and pump and channel proteins
Nonelectrochemical signaling[edit]
Beyond electrical and chemical signaling, studies suggest neurons in healthy human brains can also communicate through:
- force generated by the enlargement of dendritic spines[27]
- the transfer of proteins – transneuronally transported proteins (TNTPs)[28][29]
They can also get modulated by input from the environment and hormones released from other parts of the organism,[30] which could be influenced more or less directly by neurons. This also applies to neurotrophins such as BDNF. The gut microbiome is also connected with the brain.[31]
Neurons also communicate with microglia, the brain’s main immune cells via specialised contact sites, called «somatic junctions». These connections enable microglia to constantly monitor and regulate neuronal functions, and exert neuroprotection, when needed.[32]
Mechanisms for propagating action potentials[edit]
In 1937 John Zachary Young suggested that the squid giant axon could be used to study neuronal electrical properties.[33] It is larger than but similar to human neurons, making it easier to study. By inserting electrodes into the squid giant axons, accurate measurements were made of the membrane potential.
The cell membrane of the axon and soma contain voltage-gated ion channels that allow the neuron to generate and propagate an electrical signal (an action potential). Some neurons also generate subthreshold membrane potential oscillations. These signals are generated and propagated by charge-carrying ions including sodium (Na+), potassium (K+), chloride (Cl−), and calcium (Ca2+).
Several stimuli can activate a neuron leading to electrical activity, including pressure, stretch, chemical transmitters, and changes of the electric potential across the cell membrane.[34] Stimuli cause specific ion-channels within the cell membrane to open, leading to a flow of ions through the cell membrane, changing the membrane potential. Neurons must maintain the specific electrical properties that define their neuron type.[35]
Thin neurons and axons require less metabolic expense to produce and carry action potentials, but thicker axons convey impulses more rapidly. To minimize metabolic expense while maintaining rapid conduction, many neurons have insulating sheaths of myelin around their axons. The sheaths are formed by glial cells: oligodendrocytes in the central nervous system and Schwann cells in the peripheral nervous system. The sheath enables action potentials to travel faster than in unmyelinated axons of the same diameter, whilst using less energy. The myelin sheath in peripheral nerves normally runs along the axon in sections about 1 mm long, punctuated by unsheathed nodes of Ranvier, which contain a high density of voltage-gated ion channels. Multiple sclerosis is a neurological disorder that results from demyelination of axons in the central nervous system.
Some neurons do not generate action potentials, but instead generate a graded electrical signal, which in turn causes graded neurotransmitter release. Such non-spiking neurons tend to be sensory neurons or interneurons, because they cannot carry signals long distances.
Neural coding[edit]
Neural coding is concerned with how sensory and other information is represented in the brain by neurons. The main goal of studying neural coding is to characterize the relationship between the stimulus and the individual or ensemble neuronal responses, and the relationships among the electrical activities of the neurons within the ensemble.[36] It is thought that neurons can encode both digital and analog information.[37]
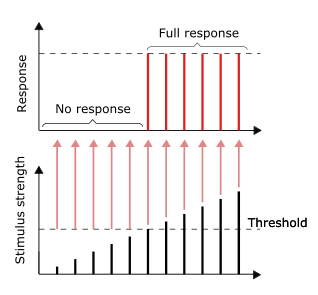
All-or-none principle[edit]
As long as the stimulus reaches the threshold, the full response would be given. Larger stimulus does not result in a larger response, vice versa.[38]: 31
The conduction of nerve impulses is an example of an all-or-none response. In other words, if a neuron responds at all, then it must respond completely. Greater intensity of stimulation, like brighter image/louder sound, does not produce a stronger signal, but can increase firing frequency.[38]: 31 Receptors respond in different ways to stimuli. Slowly adapting or tonic receptors respond to steady stimulus and produce a steady rate of firing. Tonic receptors most often respond to increased intensity of stimulus by increasing their firing frequency, usually as a power function of stimulus plotted against impulses per second. This can be likened to an intrinsic property of light where greater intensity of a specific frequency (color) requires more photons, as the photons can’t become «stronger» for a specific frequency.
Other receptor types include quickly adapting or phasic receptors, where firing decreases or stops with steady stimulus; examples include skin which, when touched causes neurons to fire, but if the object maintains even pressure, the neurons stop firing. The neurons of the skin and muscles that are responsive to pressure and vibration have filtering accessory structures that aid their function.
The pacinian corpuscle is one such structure. It has concentric layers like an onion, which form around the axon terminal. When pressure is applied and the corpuscle is deformed, mechanical stimulus is transferred to the axon, which fires. If the pressure is steady, stimulus ends; thus, typically these neurons respond with a transient depolarization during the initial deformation and again when the pressure is removed, which causes the corpuscle to change shape again. Other types of adaptation are important in extending the function of a number of other neurons.[39]
Etymology and spelling[edit]
The German anatomist Heinrich Wilhelm Waldeyer introduced the term neuron in 1891,[40] based on the ancient Greek νεῦρον neuron ‘sinew, cord, nerve’.[41]
The word was adopted in French with the spelling neurone. That spelling was also used by many writers in English,[42] but has now become rare in American usage and uncommon in British usage.[43][41]
History[edit]
The neuron’s place as the primary functional unit of the nervous system was first recognized in the late 19th century through the work of the Spanish anatomist Santiago Ramón y Cajal.[44]
To make the structure of individual neurons visible, Ramón y Cajal improved a silver staining process that had been developed by Camillo Golgi.[44] The improved process involves a technique called «double impregnation» and is still in use.
In 1888 Ramón y Cajal published a paper about the bird cerebellum. In this paper, he stated that he could not find evidence for anastomosis between axons and dendrites and called each nervous element «an absolutely autonomous canton.»[44][40] This became known as the neuron doctrine, one of the central tenets of modern neuroscience.[44]
In 1891, the German anatomist Heinrich Wilhelm Waldeyer wrote a highly influential review of the neuron doctrine in which he introduced the term neuron to describe the anatomical and physiological unit of the nervous system.[45][46]
The silver impregnation stains are a useful method for neuroanatomical investigations because, for reasons unknown, it stains only a small percentage of cells in a tissue, exposing the complete micro structure of individual neurons without much overlap from other cells.[47]
Neuron doctrine[edit]
The neuron doctrine is the now fundamental idea that neurons are the basic structural and functional units of the nervous system. The theory was put forward by Santiago Ramón y Cajal in the late 19th century. It held that neurons are discrete cells (not connected in a meshwork), acting as metabolically distinct units.
Later discoveries yielded refinements to the doctrine. For example, glial cells, which are non-neuronal, play an essential role in information processing.[48] Also, electrical synapses are more common than previously thought,[49] comprising direct, cytoplasmic connections between neurons. In fact, neurons can form even tighter couplings: the squid giant axon arises from the fusion of multiple axons.[50]
Ramón y Cajal also postulated the Law of Dynamic Polarization, which states that a neuron receives signals at its dendrites and cell body and transmits them, as action potentials, along the axon in one direction: away from the cell body.[51] The Law of Dynamic Polarization has important exceptions; dendrites can serve as synaptic output sites of neurons[52] and axons can receive synaptic inputs.[53]
Compartmental modelling of neurons[edit]
Although neurons are often described of as «fundamental units» of the brain, they perform internal computations. Neurons integrate input within dendrites, and this complexity is lost in models that assume neurons to be a fundamental unit. Dendritic branches can be modeled as spatial compartments, whose activity is related due to passive membrane properties, but may also be different depending on input from synapses. Compartmental modelling of dendrites is especially helpful for understanding the behavior of neurons that are too small to record with electrodes, as is the case for Drosophila melanogaster.[54]
Neurons in the brain[edit]
The number of neurons in the brain varies dramatically from species to species.[55] In a human, there are an estimated 10–20 billion neurons in the cerebral cortex and 55–70 billion neurons in the cerebellum.[56] By contrast, the nematode worm Caenorhabditis elegans has just 302 neurons, making it an ideal model organism as scientists have been able to map all of its neurons. The fruit fly Drosophila melanogaster, a common subject in biological experiments, has around 100,000 neurons and exhibits many complex behaviors. Many properties of neurons, from the type of neurotransmitters used to ion channel composition, are maintained across species, allowing scientists to study processes occurring in more complex organisms in much simpler experimental systems.
Neurological disorders[edit]
Charcot–Marie–Tooth disease (CMT) is a heterogeneous inherited disorder of nerves (neuropathy) that is characterized by loss of muscle tissue and touch sensation, predominantly in the feet and legs extending to the hands and arms in advanced stages. Presently incurable, this disease is one of the most common inherited neurological disorders, affecting 36 in 100,000 people.[57]
Alzheimer’s disease (AD), also known simply as Alzheimer’s, is a neurodegenerative disease characterized by progressive cognitive deterioration, together with declining activities of daily living and neuropsychiatric symptoms or behavioral changes.[58] The most striking early symptom is loss of short-term memory (amnesia), which usually manifests as minor forgetfulness that becomes steadily more pronounced with illness progression, with relative preservation of older memories. As the disorder progresses, cognitive (intellectual) impairment extends to the domains of language (aphasia), skilled movements (apraxia), and recognition (agnosia), and functions such as decision-making and planning become impaired.[59][60]
Parkinson’s disease (PD), also known as Parkinsons, is a degenerative disorder of the central nervous system that often impairs motor skills and speech.[61] Parkinson’s disease belongs to a group of conditions called movement disorders.[62] It is characterized by muscle rigidity, tremor, a slowing of physical movement (bradykinesia), and in extreme cases, a loss of physical movement (akinesia). The primary symptoms are the results of decreased stimulation of the motor cortex by the basal ganglia, normally caused by the insufficient formation and action of dopamine, which is produced in the dopaminergic neurons of the brain. Secondary symptoms may include high level cognitive dysfunction and subtle language problems. PD is both chronic and progressive.
Myasthenia gravis is a neuromuscular disease leading to fluctuating muscle weakness and fatigability during simple activities. Weakness is typically caused by circulating antibodies that block acetylcholine receptors at the post-synaptic neuromuscular junction, inhibiting the stimulative effect of the neurotransmitter acetylcholine. Myasthenia is treated with immunosuppressants, cholinesterase inhibitors and, in selected cases, thymectomy.
Demyelination[edit]
Demyelination is the act of demyelinating, or the loss of the myelin sheath insulating the nerves. When myelin degrades, conduction of signals along the nerve can be impaired or lost, and the nerve eventually withers. This leads to certain neurodegenerative disorders like multiple sclerosis and chronic inflammatory demyelinating polyneuropathy.
Axonal degeneration[edit]
Although most injury responses include a calcium influx signaling to promote resealing of severed parts, axonal injuries initially lead to acute axonal degeneration, which is the rapid separation of the proximal and distal ends, occurring within 30 minutes of injury.[63] Degeneration follows with swelling of the axolemma, and eventually leads to bead-like formation. Granular disintegration of the axonal cytoskeleton and inner organelles occurs after axolemma degradation. Early changes include accumulation of mitochondria in the paranodal regions at the site of injury. Endoplasmic reticulum degrades and mitochondria swell up and eventually disintegrate. The disintegration is dependent on ubiquitin and calpain proteases (caused by the influx of calcium ion), suggesting that axonal degeneration is an active process that produces complete fragmentation. The process takes about roughly 24 hours in the PNS and longer in the CNS. The signaling pathways leading to axolemma degeneration are unknown.
Neurogenesis[edit]
Neurons are born through the process of neurogenesis, in which neural stem cells divide to produce differentiated neurons. Once fully differentiated neurons are formed, they are no longer capable of undergoing mitosis. Neurogenesis primarily occurs in the embryo of most organisms.
Adult neurogenesis can occur and studies of the age of human neurons suggest that this process occurs only for a minority of cells, and that the vast majority of neurons in the neocortex forms before birth and persists without replacement. The extent to which adult neurogenesis exists in humans, and its contribution to cognition are controversial, with conflicting reports published in 2018.[64]
The body contains a variety of stem cell types that have the capacity to differentiate into neurons. Researchers found a way to transform human skin cells into nerve cells using transdifferentiation, in which «cells are forced to adopt new identities».[65]
During neurogenesis in the mammalian brain, progenitor and stem cells progress from proliferative divisions to differentiative divisions. This progression leads to the neurons and glia that populate cortical layers. Epigenetic modifications play a key role in regulating gene expression in differentiating neural stem cells, and are critical for cell fate determination in the developing and adult mammalian brain. Epigenetic modifications include DNA cytosine methylation to form 5-methylcytosine and 5-methylcytosine demethylation.[66] These modifications are critical for cell fate determination in the developing and adult mammalian brain. DNA cytosine methylation is catalyzed by DNA methyltransferases (DNMTs). Methylcytosine demethylation is catalyzed in several stages by TET enzymes that carry out oxidative reactions (e.g. 5-methylcytosine to 5-hydroxymethylcytosine) and enzymes of the DNA base excision repair (BER) pathway.[66]
At different stages of mammalian nervous system development two DNA repair processes are employed in the repair of DNA double-strand breaks. These pathways are homologous recombinational repair used in proliferating neural precursor cells, and non-homologous end joining used mainly at later developmental stages[67]
Intercellular communication between developing neurons and microglia is also indispensable for proper neurogenesis and brain development.[68]
Nerve regeneration[edit]
Peripheral axons can regrow if they are severed,[69] but one neuron cannot be functionally replaced by one of another type (Llinás’ law).[18]
See also[edit]
- Artificial neuron
- Bidirectional cell
- Biological neuron model
- Compartmental neuron models
- Connectome
- Dogiel cell
- List of animals by number of neurons
- List of neuroscience databases
- Neuronal galvanotropism
- Neuroplasticity
- Growth cone
- Sholl analysis
References[edit]
- ^ >Moore, Keith; Dalley, Arthur (2005). Clinically Oriented Anatomy (5th ed.). LWW. pp. 47. ISBN 0-7817-3639-0.
A bundle of nerve fibers (axons) connecting neighboring or distant nuclei of the CNS is a tract.
- ^ «What are the parts of the nervous system?». Retrieved 2022-07-08.
- ^ Davies, Melissa (2002-04-09). «The Neuron: size comparison». Neuroscience: A journey through the brain. Retrieved 2009-06-20.
- ^ Chudler EH. «Brain Facts and Figures». Neuroscience for Kids. Retrieved 2009-06-20.
- ^ «16.7: Nervous System». Biology LibreTexts. 2021-01-14. Retrieved 2022-02-28.
- ^ Herrup K, Yang Y (May 2007). «Cell cycle regulation in the postmitotic neuron: oxymoron or new biology?». Nature Reviews. Neuroscience. 8 (5): 368–78. doi:10.1038/nrn2124. PMID 17453017. S2CID 12908713.
- ^ Giménez, C. (February 1998). «[Composition and structure of the neuronal membrane: molecular basis of its physiology and pathology]». Revista de Neurologia. 26 (150): 232–239. ISSN 0210-0010. PMID 9563093.
- ^ State Hospitals Bulletin. State Commission in Lunacy. 1897. p. 378.
- ^ «Medical Definition of Neurotubules». www.merriam-webster.com.
- ^ Zecca L, Gallorini M, Schünemann V, Trautwein AX, Gerlach M, Riederer P, Vezzoni P, Tampellini D (March 2001). «Iron, neuromelanin and ferritin content in the substantia nigra of normal subjects at different ages: consequences for iron storage and neurodegenerative processes». Journal of Neurochemistry. 76 (6): 1766–73. doi:10.1046/j.1471-4159.2001.00186.x. PMID 11259494. S2CID 31301135.
- ^ Herrero MT, Hirsch EC, Kastner A, Luquin MR, Javoy-Agid F, Gonzalo LM, Obeso JA, Agid Y (1993). «Neuromelanin accumulation with age in catecholaminergic neurons from Macaca fascicularis brainstem». Developmental Neuroscience. 15 (1): 37–48. doi:10.1159/000111315. PMID 7505739.
- ^ Brunk UT, Terman A (September 2002). «Lipofuscin: mechanisms of age-related accumulation and influence on cell function». Free Radical Biology & Medicine. 33 (5): 611–9. doi:10.1016/s0891-5849(02)00959-0. PMID 12208347.
- ^ Zhao B, Meka DP, Scharrenberg R, König T, Schwanke B, Kobler O, Windhorst S, Kreutz MR, Mikhaylova M, Calderon de Anda F (August 2017). «Microtubules Modulate F-actin Dynamics during Neuronal Polarization». Scientific Reports. 7 (1): 9583. Bibcode:2017NatSR…7.9583Z. doi:10.1038/s41598-017-09832-8. PMC 5575062. PMID 28851982.
- ^ Lee WC, Huang H, Feng G, Sanes JR, Brown EN, So PT, Nedivi E (February 2006). «Dynamic remodeling of dendritic arbors in GABAergic interneurons of adult visual cortex». PLOS Biology. 4 (2): e29. doi:10.1371/journal.pbio.0040029. PMC 1318477. PMID 16366735.
- ^ Al, Martini, Frederic Et (2005). Anatomy and Physiology’ 2007 Ed.2007 Edition. Rex Bookstore, Inc. p. 288. ISBN 978-971-23-4807-5.
- ^ Gerber U (January 2003). «Metabotropic glutamate receptors in vertebrate retina». Documenta Ophthalmologica. Advances in Ophthalmology. 106 (1): 83–7. doi:10.1023/A:1022477203420. PMID 12675489. S2CID 22296630.
- ^ Wilson NR, Runyan CA, Wang FL, Sur M (August 2012). «Division and subtraction by distinct cortical inhibitory networks in vivo». Nature. 488 (7411): 343–8. Bibcode:2012Natur.488..343W. doi:10.1038/nature11347. hdl:1721.1/92709. PMC 3653570. PMID 22878717.
- ^ a b Llinás RR (2014-01-01). «Intrinsic electrical properties of mammalian neurons and CNS function: a historical perspective». Frontiers in Cellular Neuroscience. 8: 320. doi:10.3389/fncel.2014.00320. PMC 4219458. PMID 25408634.
- ^ Kolodin YO, Veselovskaia NN, Veselovsky NS, Fedulova SA. Ion conductances related to shaping the repetitive firing in rat retinal ganglion cells. Acta Physiologica Congress. Archived from the original on 2012-10-07. Retrieved 2009-06-20.
- ^ «Ionic conductances underlying excitability in tonically firing retinal ganglion cells of adult rat». Ykolodin.50webs.com. 2008-04-27. Retrieved 2013-02-16.
- ^ Scammell TE, Jackson AC, Franks NP, Wisden W, Dauvilliers Y (January 2019). «Histamine: neural circuits and new medications». Sleep. 42 (1). doi:10.1093/sleep/zsy183. PMC 6335869. PMID 30239935.
- ^ «Patch-seq technique helps depict the variation of neural cells in the brain». News-medical.net. 3 December 2020. Retrieved 26 August 2021.
{{cite web}}: CS1 maint: url-status (link) - ^ Macpherson, Gordon (2002). Black’s Medical Dictionary (40 ed.). Lanham, MD: Scarecrow Press. pp. 431–434. ISBN 0810849844.
- ^ Ivannikov MV, Macleod GT (June 2013). «Mitochondrial free Ca²⁺ levels and their effects on energy metabolism in Drosophila motor nerve terminals». Biophysical Journal. 104 (11): 2353–61. Bibcode:2013BpJ…104.2353I. doi:10.1016/j.bpj.2013.03.064. PMC 3672877. PMID 23746507.
- ^ Herculano-Houzel S (November 2009). «The human brain in numbers: a linearly scaled-up primate brain». Frontiers in Human Neuroscience. 3: 31. doi:10.3389/neuro.09.031.2009. PMC 2776484. PMID 19915731.
- ^ Drachman DA (June 2005). «Do we have brain to spare?». Neurology. 64 (12): 2004–5. doi:10.1212/01.WNL.0000166914.38327.BB. PMID 15985565. S2CID 38482114.
- ^ Ucar, Hasan; Watanabe, Satoshi; Noguchi, Jun; Morimoto, Yuichi; Iino, Yusuke; Yagishita, Sho; Takahashi, Noriko; Kasai, Haruo (December 2021). «Mechanical actions of dendritic-spine enlargement on presynaptic exocytosis». Nature. 600 (7890): 686–689. Bibcode:2021Natur.600..686U. doi:10.1038/s41586-021-04125-7. ISSN 1476-4687. PMID 34819666. S2CID 244648506.
Lay summary:
«Forceful synapses reveal mechanical interactions in the brain». Nature. 24 November 2021. doi:10.1038/d41586-021-03516-0. Retrieved 21 February 2022. - ^ «Researchers discover new type of cellular communication in the brain». The Scripps Research Institute. Retrieved 12 February 2022.
- ^ Schiapparelli, Lucio M.; Sharma, Pranav; He, Hai-Yan; Li, Jianli; Shah, Sahil H.; McClatchy, Daniel B.; Ma, Yuanhui; Liu, Han-Hsuan; Goldberg, Jeffrey L.; Yates, John R.; Cline, Hollis T. (25 January 2022). «Proteomic screen reveals diverse protein transport between connected neurons in the visual system». Cell Reports. 38 (4): 110287. doi:10.1016/j.celrep.2021.110287. ISSN 2211-1247. PMC 8906846. PMID 35081342.
- ^ Levitan, Irwin B.; Kaczmarek, Leonard K. (2015). «Electrical Signaling in Neurons». The Neuron. Oxford University Press. pp. 41–62. doi:10.1093/med/9780199773893.003.0003. ISBN 978-0-19-977389-3.
- ^ O’Leary, Olivia F.; Ogbonnaya, Ebere S.; Felice, Daniela; Levone, Brunno R.; C. Conroy, Lorraine; Fitzgerald, Patrick; Bravo, Javier A.; Forsythe, Paul; Bienenstock, John; Dinan, Timothy G.; Cryan, John F. (1 February 2018). «The vagus nerve modulates BDNF expression and neurogenesis in the hippocampus». European Neuropsychopharmacology. 28 (2): 307–316. doi:10.1016/j.euroneuro.2017.12.004. ISSN 0924-977X. PMID 29426666. S2CID 46819013.
- ^ Cserép C, Pósfai B, Lénárt N, Fekete R, László ZI, Lele Z (January 2020). «Microglia monitor and protect neuronal function through specialized somatic purinergic junctions». Science. 367 (6477): 528–537. Bibcode:2020Sci…367..528C. doi:10.1126/science.aax6752. PMID 31831638. S2CID 209343260.
- ^ Chudler EH. «Milestones in Neuroscience Research». Neuroscience for Kids. Retrieved 2009-06-20.
- ^ Patlak J, Gibbons R (2000-11-01). «Electrical Activity of Nerves». Action Potentials in Nerve Cells. Archived from the original on August 27, 2009. Retrieved 2009-06-20.
- ^ Harris-Warrick, RM (October 2011). «Neuromodulation and flexibility in Central Pattern Generator networks». Current Opinion in Neurobiology. 21 (5): 685–92. doi:10.1016/j.conb.2011.05.011. PMC 3171584. PMID 21646013.
- ^ Brown EN, Kass RE, Mitra PP (May 2004). «Multiple neural spike train data analysis: state-of-the-art and future challenges». Nature Neuroscience. 7 (5): 456–61. doi:10.1038/nn1228. PMID 15114358. S2CID 562815.
- ^ Thorpe SJ (1990). «Spike arrival times: A highly efficient coding scheme for neural networks» (PDF). In Eckmiller R, Hartmann G, Hauske G (eds.). Parallel processing in neural systems and computers. North-Holland. pp. 91–94. ISBN 9780444883902. Archived from the original (PDF) on 2012-02-15.
- ^ a b Kalat, James W (2016). Biological psychology (12 ed.). Australia. ISBN 9781305105409. OCLC 898154491.
- ^ Eckert R, Randall D (1983). Animal physiology: mechanisms and adaptations. San Francisco: W.H. Freeman. p. 239. ISBN 978-0-7167-1423-1.
- ^ a b Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Ramon y Cajal’s first paper on the Golgi stain was on the bird cerebellum, and it appeared in the Revista in 1888. He acknowledged that he found the nerve fibers to be very intricate, but stated that he could find no evidence for either axons or dendrites undergoing anastomosis and forming nets. He called each nervous element ‘an absolutely autonomous canton.’
- ^ a b Oxford English Dictionary, 3rd edition, 2003, s.v.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (January 2020). «Grey Matter Etymology and the neuron(e)». Brain. 143 (1): 374–379. doi:10.1093/brain/awz367. PMC 6935745. PMID 31844876.
- ^ «Google Books Ngram Viewer». books.google.com. Retrieved 19 December 2020.
- ^ a b c d López-Muñoz F, Boya J, Alamo C (October 2006). «Neuron theory, the cornerstone of neuroscience, on the centenary of the Nobel Prize award to Santiago Ramón y Cajal». Brain Research Bulletin. 70 (4–6): 391–405. doi:10.1016/j.brainresbull.2006.07.010. PMID 17027775. S2CID 11273256.
- ^ Finger, Stanley (1994). Origins of neuroscience : a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
… a man who would write a highly influential review of the evidence in favor of the neuron doctrine two years later. In his paper, Waldeyer (1891), … , wrote that nerve cells terminate freely with end arborizations and that the ‘neuron’ is the anatomical and physiological unit of the nervous system. The word ‘neuron’ was born this way.
- ^ «Whonamedit — dictionary of medical eponyms». www.whonamedit.com.
Today, Wilhelm von Waldeyer-Hartz is remembered as the founder of the neurone theory, coining the term «neurone» to describe the cellular function unit of the nervous system and enunciating and clarifying that concept in 1891.
- ^ Grant G (October 2007). «How the 1906 Nobel Prize in Physiology or Medicine was shared between Golgi and Cajal». Brain Research Reviews. 55 (2): 490–8. doi:10.1016/j.brainresrev.2006.11.004. PMID 17306375. S2CID 24331507.
- ^ Witcher MR, Kirov SA, Harris KM (January 2007). «Plasticity of perisynaptic astroglia during synaptogenesis in the mature rat hippocampus». Glia. 55 (1): 13–23. CiteSeerX 10.1.1.598.7002. doi:10.1002/glia.20415. PMID 17001633. S2CID 10664003.
- ^ Connors BW, Long MA (2004). «Electrical synapses in the mammalian brain». Annual Review of Neuroscience. 27 (1): 393–418. doi:10.1146/annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Guillery RW (June 2005). «Observations of synaptic structures: origins of the neuron doctrine and its current status». Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 360 (1458): 1281–307. doi:10.1098/rstb.2003.1459. PMC 1569502. PMID 16147523.
- ^ Sabbatini RM (April–July 2003). «Neurons and Synapses: The History of Its Discovery». Brain & Mind Magazine: 17.
- ^ Djurisic M, Antic S, Chen WR, Zecevic D (July 2004). «Voltage imaging from dendrites of mitral cells: EPSP attenuation and spike trigger zones». The Journal of Neuroscience. 24 (30): 6703–14. doi:10.1523/JNEUROSCI.0307-04.2004. hdl:1912/2958. PMC 6729725. PMID 15282273.
- ^ Cochilla AJ, Alford S (March 1997). «Glutamate receptor-mediated synaptic excitation in axons of the lamprey». The Journal of Physiology. 499 (Pt 2): 443–57. doi:10.1113/jphysiol.1997.sp021940. PMC 1159318. PMID 9080373.
- ^ Gouwens NW, Wilson RI (2009). «Signal propagation in Drosophila central neurons». Journal of Neuroscience. 29 (19): 6239–6249. doi:10.1523/jneurosci.0764-09.2009. PMC 2709801. PMID 19439602.
- ^ Williams RW, Herrup K (1988). «The control of neuron number». Annual Review of Neuroscience. 11 (1): 423–53. doi:10.1146/annurev.ne.11.030188.002231. PMID 3284447.
- ^ von Bartheld CS, Bahney J, Herculano-Houzel S (December 2016). «The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting». The Journal of Comparative Neurology. 524 (18): 3865–3895. doi:10.1002/cne.24040. PMC 5063692. PMID 27187682.
- ^ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (July 2000). «Neurological dysfunction and axonal degeneration in Charcot-Marie-Tooth disease type 1A». Brain. 123 (7): 1516–27. doi:10.1093/brain/123.7.1516. PMID 10869062.
- ^ «About Alzheimer’s Disease: Symptoms». National Institute on Aging. Archived from the original on 15 January 2012. Retrieved 28 December 2011.
- ^ Burns A, Iliffe S (February 2009). «Alzheimer’s disease». BMJ. 338: b158. doi:10.1136/bmj.b158. PMID 19196745. S2CID 8570146.
- ^ Querfurth HW, LaFerla FM (January 2010). «Alzheimer’s disease». The New England Journal of Medicine. 362 (4): 329–44. doi:10.1056/NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ «Parkinson’s Disease Information Page». NINDS. 30 June 2016. Archived from the original on 4 January 2017. Retrieved 18 July 2016.
- ^ «Movement Disorders». The International Neuromodulation Society.
- ^ Kerschensteiner M, Schwab ME, Lichtman JW, Misgeld T (May 2005). «In vivo imaging of axonal degeneration and regeneration in the injured spinal cord». Nature Medicine. 11 (5): 572–7. doi:10.1038/nm1229. PMID 15821747. S2CID 25287010.
- ^ Kempermann G, Gage FH, Aigner L, Song H, Curtis MA, Thuret S, Kuhn HG, Jessberger S, Frankland PW, Cameron HA, Gould E, Hen R, Abrous DN, Toni N, Schinder AF, Zhao X, Lucassen PJ, Frisén J (July 2018). «Human Adult Neurogenesis: Evidence and Remaining Questions». Cell Stem Cell. 23 (1): 25–30. doi:10.1016/j.stem.2018.04.004. PMC 6035081. PMID 29681514.
- ^ Callaway, Ewen (26 May 2011). «How to make a human neuron». Nature. doi:10.1038/news.2011.328.
By transforming cells from human skin into working nerve cells, researchers may have come up with a model for nervous-system diseases and perhaps even regenerative therapies based on cell transplants. The achievement, reported online today in Nature, is the latest in a fast-moving field called transdifferentiation, in which cells are forced to adopt new identities. In the past year, researchers have converted connective tissue cells found in skin into heart cells, blood cells, and liver cells.
- ^ a b Wang Z, Tang B, He Y, Jin P (March 2016). «DNA methylation dynamics in neurogenesis». Epigenomics. 8 (3): 401–14. doi:10.2217/epi.15.119. PMC 4864063. PMID 26950681.
- ^ Orii KE, Lee Y, Kondo N, McKinnon PJ (June 2006). «Selective utilization of nonhomologous end-joining and homologous recombination DNA repair pathways during nervous system development». Proceedings of the National Academy of Sciences of the United States of America. 103 (26): 10017–22. Bibcode:2006PNAS..10310017O. doi:10.1073/pnas.0602436103. PMC 1502498. PMID 16777961.
- ^ Cserép, Csaba; Schwarcz, Anett D.; Pósfai, Balázs; László, Zsófia I.; Kellermayer, Anna; Környei, Zsuzsanna; Kisfali, Máté; Nyerges, Miklós; Lele, Zsolt; Katona, István (September 2022). «Microglial control of neuronal development via somatic purinergic junctions». Cell Reports. 40 (12): 111369. doi:10.1016/j.celrep.2022.111369. PMC 9513806. PMID 36130488. S2CID 252416407.
- ^ Yiu G, He Z (August 2006). «Glial inhibition of CNS axon regeneration». Nature Reviews. Neuroscience. 7 (8): 617–27. doi:10.1038/nrn1956. PMC 2693386. PMID 16858390.
Further reading[edit]
- Bullock TH, Bennett MV, Johnston D, Josephson R, Marder E, Fields RD (November 2005). «Neuroscience. The neuron doctrine, redux». Science. 310 (5749): 791–3. doi:10.1126/science.1114394. PMID 16272104. S2CID 170670241.
- Kandel ER, Schwartz JH, Jessell TM (2000). Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 0-8385-7701-6.
- Peters A, Palay SL, Webster HS (1991). The Fine Structure of the Nervous System (3rd ed.). New York: Oxford University Press. ISBN 0-19-506571-9.
- Ramón y Cajal S (1933). Histology (10th ed.). Baltimore: Wood.
- Roberts A, Bush BM (1981). Neurones without Impulses. Cambridge: Cambridge University Press. ISBN 0-521-29935-7.
- Snell RS (2010). Clinical Neuroanatomy. Lippincott Williams & Wilkins. ISBN 978-0-7817-9427-5.
External links[edit]
- Neurobiology at Curlie
- IBRO (International Brain Research Organization). Fostering neuroscience research especially in less well-funded countries.
- NeuronBank an online neuromics tool for cataloging neuronal types and synaptic connectivity.
- High Resolution Neuroanatomical Images of Primate and Non-Primate Brains.
- The Department of Neuroscience at Wikiversity, which presently offers two courses: Fundamentals of Neuroscience and Comparative Neuroscience.
- NIF Search – Neuron via the Neuroscience Information Framework
- Cell Centered Database – Neuron
- Complete list of neuron types according to the Petilla convention, at NeuroLex.
- NeuroMorpho.Org an online database of digital reconstructions of neuronal morphology.
- Immunohistochemistry Image Gallery: Neuron
- Khan Academy: Anatomy of a neuron
- Neuron images
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
- Электрофизиология
- Ганглиозное возвышение
- Гигантская аксональная нейропатия
- Нейронное отслеживание
- Пионерный аксон
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »
https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%81%D0%BE%D0%BD
Нейрон состоит из одного аксона, тела и нескольких дендритов,
Аксон (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Строение нейрона
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная(гладкая)эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[1]
Анатомия
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[2]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня. Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в матеоиале — например, волокна автономной нервной системы
Двигательная функция
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[3][4] | Intrafusal muscle fibers |
Сенсорная функция
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[5] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона
Нейрон
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [6].
См. также
- Сенсорные нервы
- Сенсорный рецептор
- Нейрон
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс |
Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор |
Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия |
Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань |
Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Оболочки мозга |
Эта статья про тип ячейки. Для использования в других целях см. Нейрон (значения).
| Нейрон | |
|---|---|

Анатомия многополярный нейрон |
|
| Идентификаторы | |
| MeSH | D009474 |
| НейроЛекс Я БЫ | sao1417703748 |
| TA98 | A14.0.00.002 |
| TH | H2.00.06.1.00002 |
| FMA | 54527 |
| Анатомические термины нейроанатомии
[редактировать в Викиданных ] |
Схема анатомически точного одиночного пирамидного нейрона, первичного возбуждающего нейрона коры головного мозга, с синаптическим соединением от входящего аксона к дендритному отростку.
А нейрон или же нервная клетка является электрически возбудимый клетка[1] который связывается с другими ячейками через специализированные соединения, называемые синапсы. Это главный компонент нервная ткань в целом животные Кроме губки и плакозоа. Растения и грибы не имеют нервных клеток. Произношение нейрон стало редкостью.[2]
Нейроны обычно делятся на три типа в зависимости от их функции. Сенсорные нейроны ответить на стимулы такие как прикосновение, звук или свет, которые влияют на клетки органы чувств, и они посылают сигналы в спинной или головной мозг. Моторные нейроны получать сигналы от головного и спинного мозга для управления всем от мышечные сокращения к железистый вывод. Интернейроны соединяют нейроны с другими нейронами в той же области головного или спинного мозга. Группа связанных нейронов называется нейронная цепь.
Типичный нейрон состоит из тела клетки (сома ), дендриты, и один аксон. Сома обычно компактная. Аксон и дендриты — это нити, которые выходят из него. Дендриты обычно обильно разветвляются и выходят на несколько сотен микрометров от сомы. Аксон покидает сому в виде опухоли, называемой аксональный бугорок, и путешествует на расстояние до 1 метра у людей или более у других видов. Он разветвляется, но обычно имеет постоянный диаметр. На самом дальнем конце ветвей аксона находятся терминалы аксонов, где нейрон может передавать сигнал через синапс в другую камеру. Нейроны могут не иметь дендритов или аксонов. Период, термин нейрит используется для описания дендрита или аксон, особенно когда ячейка недифференцированный.
Большинство нейронов получают сигналы через дендриты и сомы и посылают сигналы по аксону. В большинстве синапсов сигналы переходят от аксона одного нейрона к дендриту другого. Однако синапсы могут соединять аксон с другим аксоном или дендрит с другим дендритом.
Сигнальный процесс частично электрический, а частично химический. Нейроны электрически возбудимы из-за поддержания Напряжение градиенты по их мембраны. Если напряжение изменяется на достаточно большую величину за короткий промежуток времени, нейрон генерирует все или ничего электрохимический пульс называется потенциал действия. Этот потенциал быстро распространяется по аксону и активирует синаптические связи, когда достигает их. Синаптические сигналы могут быть возбуждающий или же тормозящий, увеличивая или уменьшая сетевое напряжение, которое достигает сомы.
В большинстве случаев нейроны генерируются нервные стволовые клетки во время развития мозга и в детстве. Нейрогенез в значительной степени прекращается во взрослом возрасте в большинстве областей мозга. Однако убедительные доказательства подтверждают генерацию значительного числа новых нейронов в гиппокамп и обонятельная луковица.[3][4]
Нервная система
Схема нервной системы человека, показывающая взаимосвязь между головным и спинным мозгом и остальными нервами в теле.
Нейроны являются основными компонентами нервной системы, наряду с глиальные клетки которые оказывают им структурную и метаболическую поддержку. Нервная система состоит из Центральная нервная система, который включает мозг и спинной мозг, а периферическая нервная система, который включает автономный и соматическая нервная система. У позвоночных большинство нейронов принадлежит к Центральная нервная система, но некоторые находятся в периферийных ганглии, и многие сенсорные нейроны расположены в органах чувств, таких как сетчатка и улитка.
Аксоны могут объединяться в пучки которые составляют нервы в периферическая нервная система (например, жилы из проволоки составляют кабели). Связки аксонов в центральной нервной системе называются трактаты.
Анатомия и гистология
| Нейрон (периферическая нервная система ) |
|---|
|
Дендрит Сома Аксон Ядро Узел Аксон терминал Шванновская ячейка Миелиновой оболочки |
Нейроны очень специализированы для обработки и передачи сотовых сигналов. Учитывая разнообразие их функций, выполняемых в разных частях нервной системы, существует большое разнообразие их формы, размера и электрохимических свойств. Например, сома нейрона может варьироваться от 4 до 100 микрометры в диаметре.[5]
- В сома это тело нейрона. Поскольку он содержит ядро, наиболее синтез белка происходит здесь. Диаметр ядра может составлять от 3 до 18 микрометров.[6]
- В дендриты нейрона — это клеточные продолжения с множеством ответвлений. Эта общая форма и структура образно называют дендритным деревом. Здесь большая часть ввода в нейрон происходит через дендритный позвоночник.
- В аксон представляет собой более тонкий, похожий на кабель выступ, который может увеличиваться в десятки, сотни или даже десятки тысяч раз больше диаметра сомы. Аксон в первую очередь несет нервные сигналы далеко от сомы и несет обратно к ней некоторые типы информации. Многие нейроны имеют только один аксон, но этот аксон может — и обычно будет — подвергаться обширному ветвлению, обеспечивая связь со многими клетками-мишенями. Часть аксона, в которой он выходит из сомы, называется аксональный бугорок. Помимо анатомической структуры, аксонный бугорок также имеет наибольшую плотность напряжение-зависимые натриевые каналы. Это делает его наиболее легко возбуждаемой частью нейрона и зоной инициации спайков для аксона. В электрофизиологическом отношении он имеет самые отрицательные пороговый потенциал.
- Хотя аксон и бугорок аксона обычно участвуют в оттоке информации, эта область также может получать входные данные от других нейронов.
- В аксонный терминал находится на конце аксона, наиболее удаленном от сомы, и содержит синапсы. Синаптические бутоны — это специализированные структуры, в которых нейротрансмиттер химические вещества высвобождаются для связи с целевыми нейронами. Помимо синаптических бутонов на конце аксона, нейрон может иметь мимоходом бутоны, которые расположены по длине аксона.
Тело нейронной клетки
Общепринятая точка зрения на нейрон приписывает определенные функции его различным анатомическим компонентам; однако дендриты и аксоны часто действуют не так, как их так называемая основная функция.[нужна цитата ]
Схема типичного миелинизированного двигательного нейрона позвоночного
Аксоны и дендриты в центральной нервной системе обычно имеют толщину всего около одного микрометра, в то время как некоторые в периферической нервной системе намного толще. Сома обычно имеет диаметр около 10–25 микрометров и часто ненамного больше ядра клетки, которое она содержит. Самый длинный аксон человека двигательный нейрон может быть более метра в длину и простираться от основания позвоночника до пальцев ног.
Сенсорные нейроны могут иметь аксоны, идущие от пальцев ног к задний столбец спинного мозга более 1,5 метра у взрослых. Жирафы имеют одиночные аксоны длиной в несколько метров, идущие по всей длине шеи. Многое из того, что известно о функции аксонов, получено в результате изучения гигантский аксон кальмара, идеальный экспериментальный препарат из-за его относительно огромных размеров (0,5–1 миллиметр в толщину, несколько сантиметров в длину).
Полностью дифференцированные нейроны постоянно постмитотический[7] однако стволовые клетки, присутствующие во взрослом мозге, могут регенерировать функциональные нейроны на протяжении всей жизни организма (см. нейрогенез ). Астроциты в форме звезды глиальные клетки. Было замечено, что они превращаются в нейроны в силу их сходных со стволовыми клетками характеристик плюрипотентность.
Мембрана
Как и все клетки животных, тело каждого нейрона окружено плазматическая мембрана, бислой липид молекулы, в которые встроено множество типов белковых структур. Липидный бислой — это мощный электрический изолятор, но в нейронах многие из белковых структур, встроенных в мембрану, электрически активны. К ним относятся ионные каналы, которые позволяют электрически заряженным ионам проходить через мембрану, и ионные насосы, которые химически переносят ионы с одной стороны мембраны на другую. Большинство ионных каналов проницаемы только для определенных типов ионов. Некоторые ионные каналы стробированный по напряжению, что означает, что они могут переключаться между открытым и закрытым состояниями, изменяя разность напряжений на мембране. Другие являются химически закрытыми, что означает, что они могут переключаться между открытым и закрытым состояниями посредством взаимодействия с химическими веществами, которые диффундируют через внеклеточную жидкость. В ион материалы включают натрий, калий, хлористый, и кальций. Взаимодействие между ионными каналами и ионными насосами создает разность напряжений на мембране, обычно немного меньше 1/10 вольта на исходном уровне. Это напряжение выполняет две функции: во-первых, оно обеспечивает источник энергии для ряда зависимых от напряжения белковых механизмов, встроенных в мембрану; во-вторых, он обеспечивает основу для передачи электрического сигнала между различными частями мембраны.
Гистология и внутреннее строение
Нейроны, окрашенные по Гольджи, в ткани гиппокампа человека
Актиновые филаменты в корковом нейроне мыши в культуре
Многочисленные микроскопические комки, называемые Тела Nissl (или вещество Ниссля) наблюдаются, когда тела нервных клеток окрашиваются базофильным («любящим основание») красителем. Эти структуры состоят из шероховатой эндоплазматической сети и связанные рибосомная РНК. Назван в честь немецкого психиатра и невропатолога. Франц Ниссль (1860–1919), они участвуют в синтезе белка, и их значимость можно объяснить тем фактом, что нервные клетки очень метаболически активны. Базофильные красители, такие как анилин или (слабо) гематоксилин [8] выделяют отрицательно заряженные компоненты и таким образом связываются с фосфатным остовом рибосомной РНК.
Тело клетки нейрона поддерживается сложной сеткой структурных белков, называемых нейрофиламенты, которые вместе с нейротрубочками (нейрональными микротрубочками) собираются в более крупные нейрофибриллы.[9] Некоторые нейроны также содержат гранулы пигмента, например нейромеланин (коричневато-черный пигмент, являющийся побочным продуктом синтеза катехоламины ), и липофусцин (желтовато-коричневый пигмент), оба из которых накапливаются с возрастом.[10][11][12] Другие структурные белки, которые важны для функции нейронов: актин и тубулин из микротрубочки. Β-тубулин класса III находится почти исключительно в нейронах. Актин преимущественно находится на концах аксонов и дендритов во время развития нейронов. Там динамика актина может модулироваться посредством взаимодействия с микротрубочками.[13]
Между аксонами и дендритами существуют разные внутренние структурные характеристики. Типичные аксоны почти никогда не содержат рибосомы, кроме некоторых в начальном сегменте. Дендриты содержат гранулированный эндоплазматический ретикулум или рибосомы, количество которых уменьшается по мере увеличения расстояния от тела клетки.
Классификация
Нейроны различаются по форме и размеру и могут быть классифицированы по их морфология и функция.[15] Анатом Камилло Гольджи сгруппированы нейроны в два типа; тип I с длинными аксонами, используемый для перемещения сигналов на большие расстояния, и тип II с короткими аксонами, которые часто можно спутать с дендритами. Клетки типа I можно дополнительно классифицировать по расположению сомы. Основная морфология нейронов I типа, представленных спинномозговой двигательные нейроны, состоит из тела клетки, называемого сомой, и длинного тонкого аксона, покрытого миелиновой оболочки. Дендритное дерево обвивает тело клетки и получает сигналы от других нейронов. Конец аксона имеет разветвление терминалы аксонов которые высвобождают нейротрансмиттеры в щель, называемую синаптическая щель между терминалами и дендритами следующего нейрона.
Структурная классификация
Полярность
Большинство нейронов анатомически можно охарактеризовать как:
- Униполярный: одиночный процесс
- Биполярный: 1 аксон и 1 дендрит
- Многополярный: 1 аксон и 2 или более дендритов
- Гольджи I: нейроны с выступающими аксональными отростками; примерами являются пирамидные клетки, клетки Пуркинье и клетки переднего рога.
- Гольджи II: нейроны, аксональный процесс которых проецируется локально; лучший пример — гранулярная клетка
- Анаксонический: где аксон нельзя отличить от дендрита (ов)
- Псевдоуниполярный: 1 процесс, который затем служит и аксоном, и дендритом
Другой
Некоторые уникальные типы нейронов можно идентифицировать по их расположению в нервной системе и отличной форме. Вот несколько примеров:
- Ячейки корзины, интернейроны, которые образуют плотное сплетение терминалей вокруг сомы клеток-мишеней, обнаруженных в коре и мозжечок
- Клетки Беца, большие двигательные нейроны
- Клетки Лугаро, интернейроны мозжечка
- Средние шиповатые нейроны, большинство нейронов в полосатое тело
- Клетки Пуркинье, огромные нейроны в мозжечке, тип многополярного нейрона Гольджи I.
- Пирамидные клетки, нейроны с треугольной сомой, тип Гольджи I
- Клетки Реншоу, нейроны, оба конца которых связаны с альфа двигательные нейроны
- Униполярные щеточные клетки, интернейроны с уникальным дендритом, заканчивающимся щеткообразным пучком
- Гранулярные клетки, тип нейрона Гольджи II
- Передний рог клетки мотонейроны расположен в спинном мозге
- Веретенообразные клетки, интернейроны, которые соединяют широко разделенные области мозга
Функциональная классификация
Направление
- Афферентные нейроны передают информацию из тканей и органов в центральную нервную систему и также называются сенсорные нейроны.
- Эфферентные нейроны (двигательные нейроны) передают сигналы от центральной нервной системы к эффекторным клеткам.
- Интернейроны соединяют нейроны в определенных областях центральной нервной системы.
Афферентный и эфферентный также обычно относятся к нейронам, которые, соответственно, передают информацию или отправляют информацию от мозга.
Воздействие на другие нейроны
Нейрон влияет на другие нейроны, высвобождая нейротрансмиттер, который связывается с химические рецепторы. Воздействие на постсинаптический нейрон определяется типом рецептора, который активируется, а не пресинаптическим нейроном или нейромедиатором. Нейромедиатор можно рассматривать как ключ, а рецептор — как замок: один и тот же нейротрансмиттер может активировать несколько типов рецепторов. Рецепторы можно в общих чертах классифицировать как возбуждающий (вызывая увеличение скорострельности), тормозящий (вызывая снижение скорости стрельбы), или модулирующий (вызывая длительные эффекты, не связанные напрямую со скоростью стрельбы).
Два наиболее распространенных (90% +) нейротрансмиттеров в головном мозге, глутамат и ГАМК, имеют в основном последовательные действия. Глутамат действует на несколько типов рецепторов и оказывает возбуждающее действие на ионотропные рецепторы и модулирующий эффект при метаботропные рецепторы. Точно так же ГАМК действует на несколько типов рецепторов, но все они обладают ингибирующим действием (по крайней мере, у взрослых животных). Из-за такой последовательности нейробиологи обычно называют клетки, которые выделяют глутамат, «возбуждающими нейронами», а клетки, которые выделяют ГАМК, — «тормозящими нейронами». Некоторые другие типы нейронов обладают постоянными эффектами, например, «возбуждающие» мотонейроны в спинном мозге, которые высвобождают ацетилхолин, и «тормозной» спинномозговые нейроны этот выпуск глицин.
Различие между возбуждающими и тормозящими нейротрансмиттерами не является абсолютным. Скорее, это зависит от класса химических рецепторов, присутствующих в постсинаптическом нейроне. В принципе, один нейрон, высвобождая единственный нейротрансмиттер, может оказывать возбуждающее действие на одни мишени, ингибирующее действие на другие и модулирующее воздействие на другие. Например, фоторецепторные клетки в сетчатке постоянно выделяется нейромедиатор глутамат в отсутствие света. Так называемый OFF биполярные клетки как и большинство нейронов, возбуждаются высвобожденным глутаматом. Однако соседние нейроны-мишени, называемые ON-биполярными клетками, вместо этого ингибируются глутаматом, поскольку у них отсутствуют типичные ионотропный рецепторы глутамата и вместо этого выразить класс тормозящих метаботропный рецепторы глутамата.[16] Когда присутствует свет, фоторецепторы перестают выделять глутамат, который освобождает ON биполярные клетки от ингибирования, активируя их; это одновременно снимает возбуждение с выключенных биполярных клеток, заставляя их замолчать.
На основе белков, экспрессируемых пресинаптическим нейроном, можно определить тип тормозящего эффекта, который пресинаптический нейрон будет оказывать на постсинаптический нейрон. Парвальбумин -экспрессирующие нейроны обычно ослабляют выходной сигнал постсинаптического нейрона в зрительная кора, в то время как соматостатин -экспрессирующие нейроны обычно блокируют дендритные входы в постсинаптический нейрон.[17]
Образцы разряда
Нейроны обладают внутренними свойствами электроотклика, такими как внутреннее трансмембранное напряжение. колебательный узоры.[18] Таким образом, нейроны можно классифицировать по их электрофизиологический характеристики:
- Тоник или обычная добавка. Некоторые нейроны обычно постоянно (тонически) активны, как правило, с постоянной частотой. Пример: интернейроны в нейростриатуме.
- Фазовый или взрывной. Нейроны, которые стреляют очередями, называются фазическими.
- Быстрый скачок. Некоторые нейроны отличаются высокой скоростью возбуждения, например, некоторые типы корковых тормозных интернейронов, клетки в бледный шар, ганглиозные клетки сетчатки.[19][20]
Нейротрансмиттер
Синаптические везикулы, содержащие нейротрансмиттеры
- Холинергические нейроны — ацетилхолин. Ацетилхолин высвобождается из пресинаптических нейронов в синаптическую щель. Он действует как лиганд для обоих ионных каналов, управляемых лигандом, и метаботропный (GPCR) мускариновые рецепторы. Никотиновые рецепторы представляют собой ионные каналы, управляемые пентамерными лигандами, состоящие из альфа- и бета-субъединиц, которые связываются никотин. Связывание лиганда открывает канал, вызывая приток Na+ деполяризация и увеличивает вероятность высвобождения пресинаптического нейромедиатора. Ацетилхолин синтезируется из холин и ацетилкофермент А.
- ГАМКергические нейроны—гамма-аминомасляная кислота. ГАМК — один из двух нейроингибиторов в Центральная нервная система (ЦНС) вместе с глицином. ГАМК выполняет гомологичную функцию АЧ, блокирующие анионные каналы, которые позволяют Cl− ионы поступают в постсинаптический нейрон. Cl− вызывает гиперполяризацию внутри нейрона, уменьшая вероятность срабатывания потенциала действия по мере того, как напряжение становится более отрицательным (для срабатывания потенциала действия необходимо достичь положительного порога напряжения). ГАМК синтезируется из нейротрансмиттеров глутамата ферментом глутаматдекарбоксилаза.
- Глутаматергические нейроны — глутамат. Глутамат является одним из двух основных нейротрансмиттеров возбуждающих аминокислот, наряду с аспартат. Рецепторы глутамата относятся к одной из четырех категорий, три из которых представляют собой ионные каналы, управляемые лигандами, а одна из которых — рецептор, связанный с G-белком (часто называемый GPCR).
-
- AMPA и Каинате рецепторы функционируют как катион каналы проницаемые для Na+ катионные каналы, обеспечивающие быструю возбуждающую синаптическую передачу.
- NMDA рецепторы — еще один катионный канал, который более проницаем для Ca2+. Функция рецепторов NMDA зависит от связывания рецептора глицина в качестве ко-агонист внутри поры канала. Рецепторы NMDA не функционируют без присутствия обоих лигандов.
- Метаботропные рецепторы, GPCR, модулируют синаптическую передачу и постсинаптическую возбудимость.
- Глутамат может вызывать эксайтотоксичность, когда кровоток в мозг прерывается, что приводит к повреждение мозга. Когда кровоток подавлен, глутамат высвобождается из пресинаптических нейронов, вызывая большую активацию рецепторов NMDA и AMPA, чем обычно, вне стрессовых условий, что приводит к повышению Ca2+ и Na+ попадание в постсинаптический нейрон и повреждение клеток. Глутамат синтезируется из аминокислоты глутамина ферментом глутамат-синтаза.
- Дофаминергические нейроны—дофамин. Дофамин представляет собой нейротрансмиттер, который действует на рецепторы типа D1 (D1 и D5), связанные с Gs, которые увеличивают цАМФ и PKA, и рецепторы типа D2 (D2, D3 и D4), которые активируют рецепторы, связанные с Gi, которые снижают цАМФ и PKA. Дофамин связан с настроением и поведением и модулирует как пре-, так и постсинаптическую нейротрансмиссию. Потеря дофаминовых нейронов в черная субстанция был связан с болезнь Паркинсона. Дофамин синтезируется из аминокислоты тирозин. Тирозин превращается в левадопу (или L-ДОПА ) к тирозингидрокслаза, а затем левадопа превращается в дофамин ароматической аминокислотой декарбоксилаза.
- Серотонинергические нейроны—серотонин. Серотонин (5-гидрокситриптамин, 5-HT) может действовать как возбуждающее или тормозящее действие. Из четырех классов рецепторов 5-HT 3 являются GPCR, а 1 — лиганд-зависимым катионным каналом. Серотонин синтезируется из триптофан к триптофангидроксилаза, а затем декарбоксилазой. Недостаток 5-HT в постсинаптических нейронах был связан с депрессией. Препараты, блокирующие пресинаптическое переносчик серотонина используются для лечения, например Прозак и Золофт.
- Гистаминергические нейроны—гистамин. Гистамин это моноаминный нейромедиатор и нейромодулятор. Нейроны, продуцирующие гистамин, находятся в туберомаммиллярное ядро из гипоталамус.[21] Гистамин участвует в возбуждение и регулирование поведения во сне / бодрствовании.
Связь
Сигнал, распространяющийся по аксону к телу клетки и дендритам следующей клетки.
Химический синапс
Нейроны общаются друг с другом через синапсы, где либо аксонный терминал одной клетки контактирует с дендритом, сомой или, реже, аксоном другого нейрона. Нейроны, такие как клетки Пуркинье в мозжечке, могут иметь более 1000 дендритных ветвей, соединяющихся с десятками тысяч других клеток; другие нейроны, такие как магноклеточные нейроны супраоптическое ядро, имеют только один или два дендрита, каждый из которых получает тысячи синапсов.
Синапсы могут быть возбуждающий или же тормозящий, увеличивая или уменьшая активность целевого нейрона, соответственно. Некоторые нейроны также общаются через электрические синапсы, которые являются прямыми, электрически проводящими перекрестки между ячейками.[22]
Когда потенциал действия достигает терминала аксона, он открывается. потенциалзависимые кальциевые каналы, позволяя ионы кальция для входа в терминал. Кальций причины синаптические везикулы заполнены молекулами нейротрансмиттеров, которые сливаются с мембраной, высвобождая их содержимое в синаптическую щель. Нейромедиаторы диффундируют через синаптическую щель и активируют рецепторы постсинаптического нейрона. Высокий цитозольный кальций в аксонный терминал вызывает поглощение кальция митохондриями, что, в свою очередь, активирует митохондриальную энергетический обмен производить АТФ для поддержки непрерывной нейротрансмиссии.[23]
An autapse это синапс, в котором аксон нейрона соединяется с его собственными дендритами.
В человеческий мозг имеет примерно 8,6 х 1010 (восемьдесят шесть миллиардов) нейронов.[24] Каждый нейрон имеет в среднем 7000 синаптических связей с другими нейронами. Было подсчитано, что в мозгу трехлетнего ребенка около 1015 синапсы (1 квадриллион). Это число снижается с возрастом и стабилизируется к зрелому возрасту. Оценки варьируются для взрослого: от 1014 до 5 х 1014 синапсов (от 100 до 500 триллионов).[25]
Аннотированная диаграмма этапов распространения потенциала действия по аксону, включая роль концентрации ионов и белков насоса и канала.
Механизмы распространения потенциалов действия
В 1937 г. Джон Закари Янг предложил, чтобы гигантский аксон кальмара может быть использован для изучения электрических свойств нейронов.[26] Он больше, чем нейроны человека, но похож на него, что упрощает его изучение. Вставив электроды в аксоны гигантских кальмаров, были произведены точные измерения мембранный потенциал.
Клеточная мембрана аксона и сомы содержит управляемые по напряжению ионные каналы, которые позволяют нейрону генерировать и распространять электрический сигнал (потенциал действия). Некоторые нейроны также генерируют подпороговые колебания мембранного потенциала. Эти сигналы генерируются и распространяются несущими заряд ионы в том числе натрий (Na+), калий (K+), хлорид (Cl−), и кальций (Ca2+).
Несколько стимулов могут активировать нейрон, приводя к электрической активности, в том числе: давление, растяжение, химические передатчики и изменения электрического потенциала на клеточной мембране.[27] Стимулы заставляют определенные ионные каналы внутри клеточной мембраны открываться, что приводит к потоку ионов через клеточную мембрану, изменяющему мембранный потенциал. Нейроны должны поддерживать определенные электрические свойства, которые определяют их тип нейрона.[28]
Тонким нейронам и аксонам требуется меньше метаболический затраты на производство и перенос потенциалов действия, но более толстые аксоны передают импульсы быстрее. Чтобы свести к минимуму метаболические затраты при сохранении быстрой проводимости, многие нейроны имеют изолирующие оболочки из миелин вокруг своих аксонов. Оболочки образованы глиальный клетки: олигодендроциты в центральной нервной системе и Клетки Шванна в периферической нервной системе. Оболочка позволяет потенциалам действия перемещаться Быстрее чем в немиелинизированных аксонах того же диаметра, при этом потребляя меньше энергии. Миелиновая оболочка периферических нервов обычно проходит вдоль аксона участками длиной около 1 мм, перемежающимися без оболочки. узлы Ранвье, которые содержат высокую плотность потенциалзависимых ионных каналов. Рассеянный склероз это неврологическое заболевание, которое возникает в результате демиелинизации аксонов в центральной нервной системе.
Некоторые нейроны не генерируют потенциалы действия, а вместо этого генерируют ступенчатый электрический сигнал, что, в свою очередь, вызывает постепенное высвобождение нейромедиаторов. Такой нейроны без всплесков обычно являются сенсорными нейронами или интернейронами, поскольку они не могут передавать сигналы на большие расстояния.
Нейронное кодирование
Нейронное кодирование занимается тем, как сенсорная и другая информация представлена в мозге нейронами. Основная цель изучения нейронного кодирования — охарактеризовать взаимосвязь между стимул и человек или ансамбль нейронные ответы и отношения между электрической активностью нейронов в ансамбле.[29] Считается, что нейроны могут кодировать как цифровой и аналог Информация.[30]
Принцип все или ничего
Пока стимул достигает порога, будет дан полный ответ.Более сильный стимул не приводит к большей реакции, наоборот.[31]:31
Проведение нервных импульсов является примером все или ничего отклик. Другими словами, если нейрон вообще отвечает, то он должен отвечать полностью. Более интенсивная стимуляция, например более яркое изображение / более громкий звук, не дает более сильного сигнала, но может увеличить частоту возбуждения.[31]:31 Рецепторы по-разному реагируют на раздражители. Медленно адаптируется или тонические рецепторы реагировать на устойчивый раздражитель и производить стабильную стрельбу. Тонические рецепторы чаще всего реагируют на повышенную интенсивность стимула увеличением своей частоты срабатывания, обычно как силовая функция стимула в зависимости от количества импульсов в секунду. Это можно сравнить с внутренним свойством света, когда для большей интенсивности определенной частоты (цвета) требуется больше фотонов, поскольку фотоны не могут стать «сильнее» для определенной частоты.
Другие типы рецепторов включают быстро адаптирующиеся или фазовые рецепторы, у которых возбуждение уменьшается или прекращается при постоянном раздражении; примеры включают кожа который при прикосновении вызывает срабатывание нейронов, но если объект поддерживает равномерное давление, нейроны перестают активироваться. Нейроны кожи и мышц, которые реагируют на давление и вибрацию, имеют фильтрующие вспомогательные структуры, которые помогают им функционировать.
В пачинское тельце одна из таких структур. Он имеет концентрические слои, как у луковицы, которые образуются вокруг окончания аксона. Когда прикладывается давление и тельце деформируется, механический стимул передается аксону, который срабатывает. Если давление устойчиво, стимул прекращается; таким образом, обычно эти нейроны отвечают временной деполяризацией во время начальной деформации и снова, когда давление снимается, что заставляет тельце снова изменять форму. Другие типы адаптации важны для расширения функций ряда других нейронов.[32]
Этимология и орфография
Немецкий анатом Генрих Вильгельм Вальдейер ввел термин нейрон в 1891 г.,[33] на основе древнегреческий νεῦρον нейрон «сухожилие, пуповина, нерв».[34]
Слово было принято во французском языке с написанием нейрон. Это написание также использовалось многими английскими писателями,[35] но сейчас он стал редкостью в использовании в Америке и в Великобритании.[2][34]
История
Рисунок клетки Пуркинье в кора мозжечка сделано Сантьяго Рамоном-и-Кахалем, демонстрируя способность метода окрашивания Гольджи выявлять мелкие детали
Место нейрона как основной функциональной единицы нервной системы было впервые признано в конце 19 века благодаря работам испанского анатома. Сантьяго Рамон-и-Кахаль.[36]
Чтобы сделать видимой структуру отдельных нейронов, Рамон-и-Кахаль улучшил процесс окрашивания серебром который был разработан Камилло Гольджи.[36] Усовершенствованный процесс включает технику, называемую «двойной пропиткой», и все еще используется.
В 1888 году Рамон-и-Кахаль опубликовал статью о мозжечке птиц. В этой статье он заявил, что не может найти доказательств для анастомоз между аксонами и дендритами и назвал каждый нервный элемент «абсолютно автономным кантоном».[36][33] Это стало известно как учение о нейронах, один из центральных постулатов современного нейробиология.[36]
В 1891 году немецкий анатом Генрих Вильгельм Вальдейер написал очень влиятельный обзор нейронной доктрины, в котором он ввел термин нейрон для описания анатомической и физиологической единицы нервной системы.[37][38]
Пятна от импрегнированного серебра — полезный метод для нейроанатомический исследований, потому что по неизвестным причинам он окрашивает только небольшой процент клеток в ткани, обнажая полную микроструктуру отдельных нейронов без значительного перекрытия с другими клетками.[39]
Доктрина нейронов
Доктрина нейронов — это теперь фундаментальная идея о том, что нейроны являются основными структурными и функциональными единицами нервной системы. Теория была выдвинута Сантьяго Рамоном-и-Кахалем в конце 19 века. Он считал, что нейроны — это отдельные клетки (не связанные в сеть), действующие как метаболически отдельные единицы.
Более поздние открытия внесли уточнения в доктрину. Например, глиальные клетки, которые не являются нейронными, играют важную роль в обработке информации.[40] Кроме того, электрические синапсы встречаются чаще, чем считалось ранее.[41] включающий прямые цитоплазматические связи между нейронами. Фактически, нейроны могут образовывать еще более тесные связи: гигантский аксон кальмара возникает в результате слияния нескольких аксонов.[42]
Рамон-и-Кахаль также постулировал Закон динамической поляризации, который гласит, что нейрон получает сигналы от своих дендритов и тела клетки и передает их в виде потенциалов действия вдоль аксона в одном направлении: от тела клетки.[43] Закон динамической поляризации имеет важные исключения; дендриты могут служить в качестве синаптических выходных участков нейронов[44] и аксоны могут получать синаптические входы.[45]
Компартментное моделирование нейронов
Хотя нейроны часто называют «фундаментальными единицами» мозга, они выполняют внутренние вычисления. Нейроны интегрируют входные данные в дендриты, и эта сложность теряется в моделях, которые предполагают, что нейроны являются фундаментальной единицей. Дендритные ветви можно моделировать как пространственные компартменты, активность которых связана из-за пассивных свойств мембраны, но также может быть различной в зависимости от входных сигналов от синапсов. Компартментное моделирование дендритов особенно полезен для понимания поведения нейронов, которые слишком малы для записи с помощью электродов, как в случае Drosophila melanogaster.[46]
Нейроны в головном мозге
Количество нейронов в головном мозге сильно варьируется от вида к виду.[47] У человека примерно 10–20 миллиардов нейронов кора головного мозга и 55–70 миллиардов нейронов в мозжечок.[48] Напротив, нематода червь Caenorhabditis elegans всего 302 нейрона, что делает его идеальным модельный организм поскольку ученые смогли нанести на карту все ее нейроны. Плодовая муха Drosophila melanogaster, обычный объект в биологических экспериментах, насчитывает около 100 000 нейронов и демонстрирует множество сложных форм поведения. Многие свойства нейронов, от типа используемых нейромедиаторов до состава ионных каналов, сохраняются у разных видов, что позволяет ученым изучать процессы, происходящие в более сложных организмах, в гораздо более простых экспериментальных системах.
Неврологические расстройства
|
|
Эта статья нужны дополнительные цитаты для проверка. Пожалуйста помоги улучшить эту статью к добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален. |
Болезнь Шарко – Мари – Зуба (CMT) — гетерогенное наследственное заболевание нервов (невропатия ), который характеризуется потерей мышечной ткани и ощущения прикосновения, преимущественно в ступнях и ногах, с переходом к кистям и рукам на поздних стадиях. В настоящее время неизлечимое заболевание является одним из наиболее распространенных наследственных неврологических расстройств, которым страдают 36 из 100 000 человек.[49]
Болезнь Альцгеймера (AD), также известный как Болезнь Альцгеймера, это нейродегенеративное заболевание характеризуется прогрессивным познавательный ухудшение, вместе со снижением активности повседневной жизни и психоневрологический симптомы или изменения в поведении.[50] Самый яркий ранний симптом — потеря кратковременной памяти (амнезия ), которая обычно проявляется в виде незначительной забывчивости, которая становится все более выраженной по мере прогрессирования болезни при относительном сохранении старых воспоминаний. По мере прогрессирования расстройства когнитивные (интеллектуальные) нарушения распространяются на языковые области (афазия ), умелые движения (апраксия ), и признание (агнозия ), и нарушаются такие функции, как принятие решений и планирование.[51][52]
болезнь Паркинсона (PD), также известный как болезнь Паркинсона, это дегенеративное заболевание центральной нервной системы, которое часто приводит к нарушению моторики и речи.[53] Болезнь Паркинсона относится к группе состояний, называемых двигательные расстройства.[54] Для него характерна ригидность мышц, тремор, замедление физического движения (брадикинезия ), а в крайних случаях — потеря физического движения (акинезия ). Основные симптомы — это результат снижения стимуляции моторная кора посредством базальный ганглий, обычно вызывается недостаточным образованием и действием дофамина, который вырабатывается дофаминергическими нейронами головного мозга. Вторичные симптомы могут включать высокий уровень когнитивная дисфункция и тонкие языковые проблемы. БП бывает хроническим и прогрессирующим.
Миастения нервно-мышечное заболевание, приводящее к колебаниям мышечная слабость и утомляемость при несложных занятиях. Слабость обычно вызвана циркулирующей антитела этот блок рецепторы ацетилхолина в постсинаптическом нервно-мышечном соединении, подавляя стимулирующий эффект нейромедиатора ацетилхолина. Миастения лечится иммунодепрессанты, холинэстераза ингибиторы и, в отдельных случаях, тимэктомия.
Демиелинизация
Синдром Гийена-Барре — демиелинизация
Демиелинизация это акт демиелинизации, или потеря миелиновой оболочки, изолирующей нервы. Когда миелин разлагается, передача сигналов по нерву может быть нарушена или потеряна, и в конечном итоге нерв увядает. Это приводит к определенным нейродегенеративным расстройствам, таким как рассеянный склероз и хроническая воспалительная демиелинизирующая полинейропатия.
Дегенерация аксонов
Хотя большинство реакций на травмы включают передачу сигналов притока кальция для повторного закрытия оторванных частей, повреждения аксонов первоначально приводят к острой дегенерации аксонов, то есть быстрому разделению проксимального и дистального концов, происходящему в течение 30 минут после травмы. Дегенерация сопровождается набуханием аксолемма, и в конечном итоге приводит к образованию бусинок. Гранулярный распад аксона цитоскелет и внутренний органеллы возникает после деградации аксолеммы. Ранние изменения включают накопление митохондрии в паранодальных областях на месте травмы. Эндоплазматический ретикулум разрушается, митохондрии набухают и в конечном итоге распадаются. Распад зависит от убиквитин и Кальпаин протеазы (вызвано притоком иона кальция), предполагая, что дегенерация аксонов — это активный процесс, который вызывает полную фрагментацию. Этот процесс занимает около 24 часов в ПНС и дольше в ЦНС. Сигнальные пути, ведущие к дегенерации аксолеммы, неизвестны.
Нейрогенез
Нейроны рождаются в процессе нейрогенеза, в котором нервные стволовые клетки делить, чтобы произвести дифференцированные нейроны. После формирования полностью дифференцированных нейронов они больше не могут подвергаться митоз. Нейрогенез в основном происходит в эмбрионе большинства организмов.
Нейрогенез может возникнуть у взрослого позвоночное животное мозг, открытие, которое вызвало споры в 1999 году.[3] Более поздние исследования возраста нейронов человека показывают, что этот процесс происходит только для меньшинства клеток, и подавляющее большинство нейронов, составляющих неокортекс формируется до рождения и сохраняется без замены.[4] Степень, в которой нейрогенез у взрослых существует у людей, и его вклад в познание спорны, и в 2018 году были опубликованы противоречивые отчеты.[55]
Тело содержит множество типов стволовых клеток, которые способны дифференцироваться в нейроны. Исследователи нашли способ трансформировать клетки кожи человека в нервные клетки с помощью трансдифференцировка, в котором «клетки вынуждены принимать новые идентичности».[56]
В течение нейрогенез в головном мозге млекопитающих клетки-предшественники и стволовые клетки прогрессируют от пролиферативных делений к дифференцированным. Эта прогрессия приводит к нейронам и глии, которые населяют корковые слои. Эпигенетический модификации играют ключевую роль в регулировании экспрессия гена в различении нервные стволовые клетки, и имеют решающее значение для определения судьбы клеток в мозге развивающихся и взрослых млекопитающих. Эпигенетические модификации включают: Метилирование цитозина ДНК формировать 5-метилцитозин и Деметилирование 5-метилцитозина.[57] Эти модификации имеют решающее значение для определения судьбы клеток в мозге развивающихся и взрослых млекопитающих. Метилирование цитозина ДНК катализируется ДНК-метилтрансферазы (ДНМТ). Деметилирование метилцитозина в несколько стадий катализируется Ферменты TET которые проводят окислительные реакции (например, 5-метилцитозин к 5-гидроксиметилцитозин ) и ферменты ДНК базовая эксцизионная пластика (BER) путь.[57]
На разных стадиях развития нервной системы млекопитающих при восстановлении двухцепочечных разрывов ДНК используются два процесса репарации ДНК. Эти пути гомологичный рекомбинационный ремонт, используемый в пролиферирующих клетках-предшественниках нейронов, и негомологичное соединение концов используется в основном на более поздних стадиях развития[58]
Регенерация нервов
Периферические аксоны могут вырасти заново, если их оторвать,[59] но один нейрон не может быть функционально заменен другим типом (Закон Ллинаса ).[18]
Смотрите также
- Искусственный нейрон
- Двунаправленная ячейка
- Биологическая модель нейрона
- Клетка Догеля
- Список животных по количеству нейронов
- Список баз данных нейробиологии
- Нейронный гальванотропизм
- Нейропластичность
- Конус роста
- Анализ Шолля
Рекомендации
- ^ Рутецкий П.А. (апрель 1992 г.). «Возбудимость нейронов: напряжение-зависимые токи и синаптическая передача». Журнал клинической нейрофизиологии. 9 (2): 195–211. Дои:10.1097/00004691-199204010-00003. PMID 1375602.
- ^ а б «Нейрон против нейрона». Google Книги nGrams.
- ^ а б Уэйд, Николас (1999-10-15). «Мозг может выращивать новые клетки ежедневно». Нью-Йорк Таймс.
- ^ а б Новаковский Р.С. (август 2006 г.). «Стабильное количество нейронов от колыбели до могилы». Труды Национальной академии наук Соединенных Штатов Америки. 103 (33): 12219–20. Bibcode:2006ПНАС..10312219Н. Дои:10.1073 / pnas.0605605103. ЧВК 1567859. PMID 16894140.
- ^ Дэвис, Мелисса (2002-04-09). «Нейрон: сравнение размеров». Неврология: путешествие по мозгу. Получено 2009-06-20.
- ^ Чудлер Э. «Мозговые факты и цифры». Неврология для детей. Получено 2009-06-20.
- ^ Херруп К., Ян Й (май 2007 г.). «Регуляция клеточного цикла в постмитотическом нейроне: оксюморон или новая биология?». Обзоры природы. Неврология. 8 (5): 368–78. Дои:10.1038 / nrn2124. PMID 17453017. S2CID 12908713.
- ^ Бюллетень государственных больниц. Государственная комиссия по безумию. 1897. с. 378.
- ^ «Медицинское определение нейротрубочек». www.merriam-webster.com.
- ^ Zecca L, Gallorini M, Schünemann V, Trautwein AX, Gerlach M, Riederer P, Vezzoni P, Tampellini D (март 2001 г.). «Содержание железа, нейромеланина и ферритина в черной субстанции здоровых людей в разном возрасте: последствия для хранения железа и нейродегенеративных процессов». Журнал нейрохимии. 76 (6): 1766–73. Дои:10.1046 / j.1471-4159.2001.00186.x. PMID 11259494. S2CID 31301135.
- ^ Herrero MT, Hirsch EC, Kastner A, Luquin MR, Javoy-Agid F, Gonzalo LM, Obeso JA, Agid Y (1993). «Накопление нейромеланина с возрастом в катехоламинергических нейронах ствола мозга Macaca fascicularis». Развитие нейробиологии. 15 (1): 37–48. Дои:10.1159/000111315. PMID 7505739.
- ^ Brunk UT, Terman A (сентябрь 2002 г.). «Липофусцин: механизмы возрастного накопления и влияние на функцию клеток». Свободная радикальная биология и медицина. 33 (5): 611–9. Дои:10.1016 / s0891-5849 (02) 00959-0. PMID 12208347.
- ^ Чжао Б., Мека Д.П., Шарренберг Р., Кениг Т., Шванке Б., Коблер О., Виндхорст С., Кройц М.Р., Михайлова М., Кальдерон де Анда Ф. (август 2017 г.). «Микротрубочки модулируют динамику F-актина во время поляризации нейронов». Научные отчеты. 7 (1): 9583. Bibcode:2017НатСР … 7.9583Z. Дои:10.1038 / s41598-017-09832-8. ЧВК 5575062. PMID 28851982.
- ^ Ли У.К., Хуанг Х., Фенг Дж., Санес-младший, Браун ЭН, Со ПТ, Недиви Э. (февраль 2006 г.). «Динамическое ремоделирование дендритных ветвей в ГАМКергических интернейронах зрительной коры взрослого». PLOS Биология. 4 (2): e29. Дои:10.1371 / journal.pbio.0040029. ЧВК 1318477. PMID 16366735.
- ^ Ал, Мартини, Фредерик Эт. Анатомия и физиология ‘2007 г., издание 2007 г.. Rex Bookstore, Inc. стр. 288. ISBN 978-971-23-4807-5.
- ^ Гербер У (январь 2003 г.). «Метаботропные рецепторы глутамата в сетчатке позвоночных». Documenta Ophthalmologica. Достижения в офтальмологии. 106 (1): 83–7. Дои:10.1023 / А: 1022477203420. PMID 12675489. S2CID 22296630.
- ^ Уилсон Н.Р., Рунян К.А., Ван Флорида, Сур М. (август 2012 г.). «Разделение и вычитание отдельными кортикальными тормозными сетями in vivo». Природа. 488 (7411): 343–8. Bibcode:2012 Натур.488..343Вт. Дои:10.1038 / природа11347. HDL:1721.1/92709. ЧВК 3653570. PMID 22878717.
- ^ а б Llinás RR (01.01.2014). «Внутренние электрические свойства нейронов млекопитающих и функции ЦНС: историческая перспектива». Границы клеточной неврологии. 8: 320. Дои:10.3389 / fncel.2014.00320. ЧВК 4219458. PMID 25408634.
- ^ Колодин Ю.О., Веселовская Н.Н., Веселовский Н.С., Федулова С.А. Ионная проводимость, связанная с формированием повторяющейся активации ганглиозных клеток сетчатки крысы. Конгресс Acta Physiologica. Архивировано из оригинал на 2012-10-07. Получено 2009-06-20.
- ^ «Ионные проводимости, лежащие в основе возбудимости в тонически активированных ганглиозных клетках сетчатки взрослой крысы». Ykolodin.50webs.com. 2008-04-27. Получено 2013-02-16.
- ^ Скаммелл Т.Э., Джексон А.С., Фрэнкс Н.П., Висден В., Довилье Ю. (январь 2019 г.). «Гистамин: нейронные цепи и новые лекарства». Спать. 42 (1). Дои:10.1093 / сон / zsy183. ЧВК 6335869. PMID 30239935.
- ^ Макферсон, Гордон (2002). Медицинский словарь Блэка (40 изд.). Лэнхэм, Мэриленд: Scarecrow Press. С. 431–434. ISBN 0810849844.
- ^ Иванников М.В., Маклеод Г.Т. (июнь 2013 г.). «Уровни свободного Ca²⁺ в митохондриях и их влияние на энергетический метаболизм в двигательных нервных окончаниях дрозофилы». Биофизический журнал. 104 (11): 2353–61. Bibcode:2013BpJ … 104.2353I. Дои:10.1016 / j.bpj.2013.03.064. ЧВК 3672877. PMID 23746507.
- ^ Herculano-Houzel S (ноябрь 2009 г.). «Человеческий мозг в числах: линейно увеличенный мозг приматов». Границы нейробиологии человека. 3: 31. Дои:10.3389 / нейро.09.031.2009. ЧВК 2776484. PMID 19915731.
- ^ Драхман Д.А. (июнь 2005 г.). «У нас есть лишние мозги?». Неврология. 64 (12): 2004–5. Дои:10.1212 / 01.WNL.0000166914.38327.BB. PMID 15985565. S2CID 38482114.
- ^ Чудлер Э. «Вехи в исследованиях в области нейробиологии». Неврология для детей. Получено 2009-06-20.
- ^ Патлак Дж., Гиббонс Р. (2000-11-01). «Электрическая активность нервов». Возможности действия в нервных клетках. Архивировано из оригинал 27 августа 2009 г.. Получено 2009-06-20.
- ^ Харрис-Уоррик, РМ (октябрь 2011 г.). «Нейромодуляция и гибкость в сетях центрального генератора шаблонов». Текущее мнение в нейробиологии. 21 (5): 685–92. Дои:10.1016 / j.conb.2011.05.011. ЧВК 3171584. PMID 21646013.
- ^ Brown EN, Kass RE, Mitra PP (май 2004 г.). «Анализ данных множественных нейронных спайков: современное состояние и будущие задачи». Природа Неврология. 7 (5): 456–61. Дои:10.1038 / nn1228. PMID 15114358. S2CID 562815.
- ^ Торп SJ (1990). «Время прихода пиков: высокоэффективная схема кодирования для нейронных сетей» (PDF). В Eckmiller R, Hartmann G, Hauske G (ред.). Параллельная обработка в нейронных системах и компьютерах. Северная Голландия. С. 91–94. ISBN 9780444883902. Архивировано из оригинал (PDF) 15 февраля 2012 г.
- ^ а б Калат, Джеймс В (2016). Биологическая психология (12-е изд.). Австралия. ISBN 9781305105409. OCLC 898154491.
- ^ Эккерт Р., Рэндалл Д. (1983). Физиология животных: механизмы и адаптации. Сан-Франциско: W.H. Фримен. п.239. ISBN 978-0-7167-1423-1.
- ^ а б Палец, Стэнли (1994). Истоки нейробиологии: история исследований функций мозга. Издательство Оксфордского университета. п. 47. ISBN 9780195146943. OCLC 27151391.
Первая статья Рамона-и-Кахала о пятне Гольджи была на мозжечке птицы, и она появилась в Revista в 1888 г. Он признал, что обнаружил, что нервные волокна очень сложны, но заявил, что не может найти никаких доказательств того, что аксоны или дендриты проходят анастомоз и образуют сети. Он называл каждый нервный элемент «абсолютно автономным кантоном».
CS1 maint: ref = harv (связь) - ^ а б Оксфордский словарь английского языка, 3-е издание, 2003 г., s.v.
- ^ Mehta AR, Mehta PR, Anderson SP, MacKinnon BL, Compston A (январь 2020 г.). «Этимология серого вещества и нейрон (е)». Мозг. 143 (1): 374–379. Дои:10.1093 / мозг / awz367. ЧВК 6935745. PMID 31844876.
- ^ а б c d Лопес-Муньос Ф., Бойя Дж., Аламо К. (октябрь 2006 г.). «Теория нейронов, краеугольный камень нейробиологии, к столетию со дня присуждения Нобелевской премии Сантьяго Рамону-и-Кахалу». Бюллетень исследований мозга. 70 (4–6): 391–405. Дои:10.1016 / j.brainresbull.2006.07.010. PMID 17027775. S2CID 11273256.
- ^ Палец, Стэнли (1994). Истоки нейробиологии: история исследований функций мозга. Издательство Оксфордского университета. п. 47. ISBN 9780195146943. OCLC 27151391.
… человек, который два года спустя напишет весьма влиятельный обзор доказательств в пользу доктрины нейронов. В своей статье Валдейер (1891) … писал, что нервные клетки свободно оканчиваются ветвями на концах и что «нейрон» является анатомической и физиологической единицей нервной системы. Так родилось слово «нейрон».
CS1 maint: ref = harv (связь) - ^ «Whonamedit — словарь медицинских эпонимов». www.whonamedit.com.
Сегодня Вильгельма фон Вальдейера-Харца помнят как основателя теории нейронов, который ввел термин «нейрон» для описания клеточной функциональной единицы нервной системы и сформулировал и разъяснил эту концепцию в 1891 году.
- ^ Грант G (октябрь 2007 г.). «Как Нобелевская премия по физиологии и медицине 1906 года была разделена между Гольджи и Кахалем». Обзоры исследований мозга. 55 (2): 490–8. Дои:10.1016 / j.brainresrev.2006.11.004. PMID 17306375. S2CID 24331507.
- ^ Ведьмак М.Р., Киров С.А., Харрис К.М. (январь 2007 г.). «Пластичность перисинаптической астроглии во время синаптогенеза в гиппокампе зрелой крысы». Глия. 55 (1): 13–23. CiteSeerX 10.1.1.598.7002. Дои:10.1002 / glia.20415. PMID 17001633. S2CID 10664003.
- ^ Коннорс Б.В., Лонг Массачусетс (2004). «Электрические синапсы в мозгу млекопитающих». Ежегодный обзор нейробиологии. 27 (1): 393–418. Дои:10.1146 / annurev.neuro.26.041002.131128. PMID 15217338.
- ^ Гилери Р.В. (июнь 2005 г.). «Наблюдения за синаптическими структурами: истоки нейронной доктрины и ее текущее состояние». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 360 (1458): 1281–307. Дои:10.1098 / rstb.2003.1459. ЧВК 1569502. PMID 16147523.
- ^ Саббатини Р.М. (апрель – июль 2003 г.). «Нейроны и синапсы: история открытия». Журнал Brain & Mind: 17.
- ^ Джуришич М., Антич С., Чен В. Р., Зечевич Д. (июль 2004 г.). «Визуализация напряжения от дендритов митральных клеток: зоны затухания ВПСП и спайковых триггеров». Журнал неврологии. 24 (30): 6703–14. Дои:10.1523 / JNEUROSCI.0307-04.2004. HDL:1912/2958. ЧВК 6729725. PMID 15282273.
- ^ Кочилла А.Дж., Олфорд С. (март 1997 г.). «Опосредованное глутаматным рецептором синаптическое возбуждение в аксонах миноги». Журнал физиологии. 499 (Pt 2): 443–57. Дои:10.1113 / jphysiol.1997.sp021940. ЧВК 1159318. PMID 9080373.
- ^ Гоувенс Н.В., Уилсон Р.И. (2009). «Распространение сигнала в центральных нейронах дрозофилы». Журнал неврологии. 29 (19): 6239–6249. Дои:10.1523 / jneurosci.0764-09.2009. ЧВК 2709801. PMID 19439602.
- ^ Уильямс Р. У., Херруп К. (1988). «Контроль числа нейронов». Ежегодный обзор нейробиологии. 11 (1): 423–53. Дои:10.1146 / annurev.ne.11.030188.002231. PMID 3284447.
- ^ фон Бартельд CS, Bahney J, Herculano-Houzel S (декабрь 2016 г.). «Поиск истинного количества нейронов и глиальных клеток в человеческом мозге: обзор 150-летнего подсчета клеток». Журнал сравнительной неврологии. 524 (18): 3865–3895. Дои:10.1002 / cne.24040. ЧВК 5063692. PMID 27187682.
- ^ Krajewski KM, Lewis RA, Fuerst DR, Turansky C, Hinderer SR, Garbern J, Kamholz J, Shy ME (июль 2000 г.). «Неврологическая дисфункция и дегенерация аксонов при болезни Шарко-Мари-Тута типа 1А». Мозг. 123 (7): 1516–27. Дои:10.1093 / мозг / 123.7.1516. PMID 10869062.
- ^ «О болезни Альцгеймера: симптомы». Национальный институт старения. В архиве из оригинала 15 января 2012 г.. Получено 28 декабря 2011.
- ^ Бернс А., Илифф С. (февраль 2009 г.). «Болезнь Альцгеймера». BMJ. 338: b158. Дои:10.1136 / bmj.b158. PMID 19196745. S2CID 8570146.
- ^ Querfurth HW, LaFerla FM (январь 2010 г.). «Болезнь Альцгеймера». Медицинский журнал Новой Англии. 362 (4): 329–44. Дои:10.1056 / NEJMra0909142. PMID 20107219. S2CID 205115756.
- ^ «Информационная страница о болезни Паркинсона». NINDS. 30 июня 2016 г. В архиве из оригинала 4 января 2017 г.. Получено 18 июля 2016.
- ^ «Двигательные расстройства». Международное общество нейромодуляции.
- ^ Кемперманн Г., Гейдж Ф. Х., Айгнер Л., Сонг Х., Кертис М. А., Турет С., Кун Х. Г., Джессбергер С., Франкланд П. У., Камерон Х. А., Гулд Э, Хен Р., Аброус Д. Н., Тони Н., Шиндер А. Ф., Чжао Х, Лукассен П. Дж. , Фризен Дж. (Июль 2018 г.). «Нейрогенез взрослого человека: доказательства и оставшиеся вопросы». Стволовая клетка. 23 (1): 25–30. Дои:10.1016 / j.stem.2018.04.004. ЧВК 6035081. PMID 29681514.
- ^ Каллавей, Юэн (26 мая 2011 г.). «Как сделать нейрон человека». Природа. Дои:10.1038 / новости.2011.328.
Преобразовывая клетки кожи человека в рабочие нервные клетки, исследователи, возможно, придумали модель заболеваний нервной системы и, возможно, даже регенеративные методы лечения, основанные на трансплантации клеток. Достижение, опубликованное сегодня в сети Природа, является последним в быстро развивающейся области, называемой трансдифференцировкой, в которой клетки вынуждены принимать новые идентичности. В прошлом году исследователи преобразовали клетки соединительной ткани, обнаруженные в коже, в клетки сердца, клетки крови и клетки печени.
- ^ а б Ван З, Тан Би, Хэ И, Джин П (март 2016 г.). «Динамика метилирования ДНК в нейрогенезе». Эпигеномика. 8 (3): 401–14. Дои:10.2217 / epi.15.119. ЧВК 4864063. PMID 26950681.
- ^ Ории К.Е., Ли Й., Кондо Н., Маккиннон П.Дж. (июнь 2006 г.). «Избирательное использование негомологичных путей репарации концевых соединений и гомологичной рекомбинации ДНК во время развития нервной системы». Труды Национальной академии наук Соединенных Штатов Америки. 103 (26): 10017–22. Bibcode:2006PNAS..10310017O. Дои:10.1073 / pnas.0602436103. ЧВК 1502498. PMID 16777961.
- ^ Ю Г, Хе З (август 2006 г.). «Глиальное подавление регенерации аксонов ЦНС». Обзоры природы. Неврология. 7 (8): 617–27. Дои:10.1038 / nrn1956. ЧВК 2693386. PMID 16858390.
дальнейшее чтение
- Баллок Т.Х., Беннетт М.В., Джонстон Д., Джозефсон Р., Мардер Э., Филдс Р.Д. (ноябрь 2005 г.). «Неврология. Учение о нейронах, редукция». Наука. 310 (5749): 791–3. Дои:10.1126 / science.1114394. PMID 16272104. S2CID 170670241.
- Кандел Э. Р., Шварц Дж. Х., Джессел Т. М. (2000). Принципы нейронологии (4-е изд.). Нью-Йорк: Макгроу-Хилл. ISBN 0-8385-7701-6.
- Петерс А., Палай С.Л., Вебстер Х.С. (1991). Тонкая структура нервной системы (3-е изд.). Нью-Йорк: Издательство Оксфордского университета. ISBN 0-19-506571-9.
- Рамон-и-Кахал С. (1933). Гистология (10-е изд.). Балтимор: Вуд.
- Робертс А., Буш Б.М. (1981). Нейроны без импульсов. Кембридж: Издательство Кембриджского университета. ISBN 0-521-29935-7.
- Снелл RS (2010). Клиническая нейроанатомия. Липпинкотт Уильямс и Уилкинс. ISBN 978-0-7817-9427-5.
внешняя ссылка
- Нейробиология в Керли
- IBRO (Международная организация исследования мозга). Содействие исследованиям в области нейробиологии, особенно в менее финансируемых странах.
- НейронБанк онлайн-инструмент нейромики для каталогизации типов нейронов и синаптических связей.
- Нейроанатомические изображения высокого разрешения мозга приматов и не приматов.
- В Кафедра неврологии в Викиверситет, который в настоящее время предлагает два курса: Основы неврологии и Сравнительная неврология.
- Поиск NIF — Нейрон через Информационная структура по неврологии
- Клеточно-центрированная база данных — Neuron
- Полный список типов нейронов в соответствии с соглашением Петиллы, на НейроЛекс.
- NeuroMorpho.Org онлайн-база данных цифровых реконструкций морфологии нейронов.
- Галерея изображений иммуногистохимии: Neuron
- Khan Academy: Анатомия нейрона
- Нейронные изображения
Metal nanoparticles for neurodegenerative diseases
Shagufta Haque, Chitta Ranjan Patra, in Nanomedical Drug Delivery for Neurodegenerative Diseases, 2022
3.2.3 Neuroregeneration approach
The incompetent neurons face a major challenge of restoring injured neurofibrils as well as regeneration of nerve sheath (Mukherjee et al., 2020). Thus, to address the issue of degeneration followed by the process of restoration of neuronal activity, regeneration is required. Regeneration involves the preservation of neuronal functions such as maintaining the number of neuronal cells, their growth, etc. Many metal nanoparticles have been employed to restore or accomplish the activity of these compromised neurons (Mukherjee et al., 2020). For example, Marino et al. developed gelatin/cerium oxide nanocomposites for scavenging free radicals and have antioxidant properties that aid in neurite outgrowth (Marino et al., 2017). The nanoceria are known to have antioxidant properties acting as scavengers for reactive oxygen species along with increasing neural sprouting and decreasing senescence. The formed nanomaterials were characterized through various analytical tools, and their antioxidant capacities were measured through a total antioxidant capacity assay kit that quantifies the amount in the reduction of Cu2 + to Cu+. Later, the scaffolds were made out by incorporation of gelatin and electrospun method. The gelatin/cerium oxide nanofibers were tested for antioxidant property. In Fig. 7, the confocal and scanning electron microscopy (SEM) images demonstrate the differentiation of the SH-SY5Y cells on different substrates where red corresponds to f-actin, blue to nucleic, and green to β-3 tubulin. From Fig. 7A, it was derived that the β-3 tubulin differentiation was much better and aligned on the nanoscaffold substrates containing nanoceria as compared to the other substrates. Even the SEM images corroborate the results of the confocal demonstrating fine aligned neurites on the anisotropic substrates as well as well neuronal outgrowth induced by the nanocerium containing scaffolds which are proregenerative in nature (Marino et al., 2017).
Fig. 7. Confocal and SEM imaging of SH-SY5Y cells differentiated on the different substrates. (A) Confocal 3D rendering of SH-SY5Y derived neurons stained for f-actin (in red), β-3 tubulin (in green), and nuclei (in blue). (B) SEM imaging confirms a strong cell polarization in both the “aligned” and “aligned + NC” substrates.
Reprinted with permission from Marino, A., Tonda-Turo, C., De Pasquale, D., Ruini, F., Genchi, G., Nitti, S., et al. (2017). Gelatin/nanoceria nanocomposite fibers as antioxidant scaffolds for neuronal regeneration. Biochim. Biophys. Acta Gen. Subj. 1861(2), 386–395. https://doi.org/10.1016/j.bbagen.2016.11.022. Copyright 2016 Elsevier B.V.
Metal nanoparticles have a profound effect on the differentiation of neuronal stem cells that accelerate the repair of damaged brain tissues. In another work, Yuan et al. produced gold nanoparticle-superparamagnetic iron oxide modified with nerve growth factor that enhanced the induction of the neuronal growth under the influence of an external and dynamic magnetic field (Yuan et al., 2018). The nanoparticles displayed advantages such as equal quasi-spherical forms, narrow size, increased stability, and decreased toxicity (the viability of the cells was found to be more than 96% for 5 days). The cellular uptake of the nanoparticles increased after conjugation with the nerve growth factor. The induction and orientation of neuronal growth was examined theoretically on the cytoskeletal force model and experimentally on PC-12 cells. Fig. 8 through the TEM images shows more cellular uptake of the nerve growth factor conjugated nanoparticle as compared to the only nanoparticles inside the endosomal components of the cytoplasm. The whole formulated nanoparticle was found in more clusters inside the cytoplasm as compared to the only nanoparticles at the same concentration (Yuan et al., 2018). There are reports of biologically synthesized nanoparticles being for neuron regeneration. In this context, Dayem et al. biosynthesized silver nanoparticles (30 nm) by employing a bacterial E. coli-based templating process. The nanoparticles helped in the induction of the SH‐SY5Y cells to neuronal differentiation. According to the published literature, human SH‐SY5Y cells can be retained in an undifferentiated position or initiated into neuron‐like phenotype differentiation in vitro by some differentiation‐inducing molecules. The biosynthesized silver nanoparticles changed the morphology of the cell with increase in length of the neuritis as well as more expression of the β‐tubulin III, Map‐2, synaptophysin, Gap‐43, neurogenin‐1, and Drd‐2 which are regarded as the neuronal differentiation markers. Moreover, there was enhanced expression of reactive oxygen species, followed by the activation of kinases such as AKT and ERK and decreased expression of dual‐specificity phosphatases (DUSPs) in the nanoparticle-treated cells (Dayem et al., 2014).
Fig. 8. TEM images show the cellular uptake of PC-12 cells. (A) and (B) PC-12 cells treated with NPs only; (C) and (D) PC-12 cells treated with NGF-NPs. (B) and (D) Enlarged images of areas shown inside the dashed circles in (A) and (C). Scale bar = 500 nm.
Reprinted with permission from Yuan, M., Wang, Y., Qin, Y.-X. (2018). Promoting neuroregeneration by applying dynamic magnetic fields to a novel nanomedicine: superparamagnetic iron oxide (SPIO)-gold nanoparticles bounded with nerve growth factor (NGF). Nanomedicine 14(4), 1337–1347. https://doi.org/10.1016/j.nano.2018.03.004 (Epub 2018 Apr 5). Copyright 2018 Elsevier Inc.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323855440000125
Recent trends of extracellular vesicles for therapeutic intervention of brain-related diseases
Mayank Handa, … Munindra Ruwali, in Nanomedical Drug Delivery for Neurodegenerative Diseases, 2022
5.1 Alzheimer’s diseases (AD)
Alzheimer’s disease is one of the neurodegenerative disorders related to CNS and the most common cause of dementia. It involves protein aggregates, i.e., amyloid (senile) plaques and tangles of neurofibrils that direct toward progressive neurodegeneration and fatality (Singh et al., 2020). Production of senile plaques leads to amyloid beta (Aβ) accumulation in the form of peptide fibrils in the brain of humans with core constituents composed of filaments of the helix in pair for the creation of neurofibrillary tangles in filamentous structures. Moreover, increasing evidence indicates that exosomes have linkage with Tau and Aβ protein spread but the role of these in AD progression is controversial. Studies done by various researchers predict that due to the presence of these, exosomes innervate transport of above proteins that promote decay of neuronal microtubule and affect axonal transport with instances of neuron loss and cell death. Exosomes play a major role in neuroinflammation by exchanging information between the neurons. Aβ associated with exosomes results in the spreading of disease due to cell—cell communication in EVs eventually resulting in neuroinflammation (Gupta and Pulliam, 2014).
Exosomes act as neurotoxic agents due to the spreading of dead brain cells to healthy neurons. Hypersecretion of exosomes can enhance inflammation progression. Oxidative stress is one of the causes of AD, it leads to neuroinflammation and the formation of neurofibrillary tangles (Cai et al., 2011). Aβ accumulation enhances oxidative stress by increasing the β and γ secretases (Bonda et al., 2014). Various researchers demonstrated the origin of exosomes from multivesicular bodies and the promotion of oxidative stress that leads to the prognosis of many neurodegenerative disorders (Tsanova et al., 2014). However, some studies demonstrated that exosomes have the ability to decrease the levels of Aβ levels in the brain by microglia ingestion. Exosomes also provide transmission of neuroprotective cellular components in cells. Aβ is taken by microglial cells for its clearance and reducing the toxicity in AD. Exosomes treated with the sphingomyelin synthase 2 (SMS2) siRNA help in the uptake of Aβ by microglial cells and are subjected to lysosomes followed by degradation of Aβ (Yuyama et al., 2012). Mesenchymal cells derived from stem cells which are isolated from bone marrow and adipose tissue secrete extracellular vesicles which contain neprilysin, an enzyme that helps in the degradation of Aβ in AD (Katsuda et al., 2015). Exosomes obtained from neuroblastoma cells are injected exogenously into the brain of the mouse which results in association and internalization of Ab into phagocyte microglia, moreover, it suggests that glycosphingolipids rich in exosomes are important for binding of Aβ and its association results in the clearance of Aβ (Yuyama et al., 2014). Exosomes can cross BBB and can be used as delivering agents of therapeutic moieties for neurodegenerative diseases. It shows that exosomes obtained from mesenchymal stromal cells have a neuroprotective role and can be used for treating neurological disorders like Alzheimer’s disease (Xin et al., 2013).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323855440000071
Alzheimer diseases∗
Alena V. Savonenko, … Tong Li, in Neurobiology of Brain Disorders (Second Edition), 2023
Index case and development of AD diagnosis
AD is named after Dr. Alois Alzheimer, who first observed the disease in 1901 in a 51-year-old woman named Augusta D, who experienced excessive feelings of jealousy toward her husband as one of the first signs: “Very soon she showed rapidly increasing memory impairments; she was disoriented, carrying objects to and fro in her flat and hid them. Sometimes she felt that someone wanted to kill her and began to scream loudly.… After 4.5 years of sickness she died.”10 Postmortem investigation of the brain revealed a high concentration of protein plaques and NFTs. Alzheimer reported peculiar changes in the neurofibrils: “In the center of an otherwise almost normal cell there stands out one or several fibrils due to their characteristic thickness and peculiar impregnability”10 He also described the typical plaques: “Numerous small miliary foci are found in the superior layers. They are determined by the storage of a peculiar material in the cortex.”10
In the decade after Alzheimer’s case report dozens of articles described observations of senile plaques and NFTs in a variety of patients with dementing diseases, including posttraumatic stress dementia, amyotrophic lateral sclerosis, Down syndrome, toxic conditions, and dementia pugilistica. Diagnostic classifications, however, were confusing because senile plaques and NFTs were also found in the brains of older individuals who had shown no signs of dementia. Similar modern histo-pathological reports of “silent plaques” attracted much attention.11 In the first version of the Diagnostic and Statistical Manual of Mental Disorders (DSM) in 1952, the term “Alzheimer’s disease” was mainly used for cases with presenile onset, whereas “chronic organic brain syndrome” was used more frequently for senile brain disease. The diagnosis of AD reemerged in the late 1960s because of the unprecedented increase in the number of people who were living to be 85 and older. Increased human lifespan in the twentieth century revealed a new “epidemic” of aging-related neurodegenerative diseases. The DSM-IV, published in 1994, referred to AD as the most common cause of dementia. In the 21st century, this trend has been further amplified by aging “baby-boomers,” who make up the most rapidly growing part of the population.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780323856546000228
Aetiology and pathophysiology of neurodegenerative disorders
Rakesh Kumar Sahoo, … Umesh Gupta, in Nanomedical Drug Delivery for Neurodegenerative Diseases, 2022
3.5 Pick’s disease
In 1892, Arnold Pick first detailed Pick’s disease and the first case examined was of August H., who was 71 years old. The brain manifests lopsided atrophy and memory impairment. There is a confusion between senile dementia with atrophy. He observed some similar symptoms to AD (neurofibril tangles) such as neuronal inclusions and contusions. Pick’s bodies are also called FTLD and FTLD, which are further classified as frontotemporal dementia (FTD), progressive aphasia (PA), and semantic dementia (SD). FTD is identified by a change in behavior as well as nature and temperament. SD is identified by dysfluency in fluent speech and problems in identification. PA is characterized by increased dysfluency in speech. Pick’s disease is defined as a major neurodegenerative disease that includes insanity, derangement, and senile dementia, which mostly affect the brain and cause dysfluency in fluent speech along with the expansion of tau proteins in neurons (Takeda et al., 2012; Dickson, 2001). Pick’s bodies consist of 10–15 nm undeviated thread or filament in the form of bundles that are assorted with the PHF-130 to 160 nm predictor. Pick’s bodies and NFT in part of the diffused α,β deposits are also found in 30% of cases. In the cerebral cortex and subcortical area, the frontal and temporal lobe are less effective. Mainly, Pick’s bodies occur in the dentate gyrus, basal ganglia, and amygdala. About 25% of patients form Pick’s bodies in this syndrome. An estimation of the prevalence from statistical data is 15–22 per 100,000 and 2.1–4.1 per 100,000 people caused by FTD and Pick’s disease, respectively (Hodges, 2001; Kertesz and Munoz, 2002).
The pathogenesis of Pick’s disease depends upon the major factor, that is, the neurotic and glial tau pathology. Recent findings show that the major constructional constituents are the unusual tau protein disposition. Tau immunoreactive glial inclusions are also found in Pick’s disease (Gustafson, 1987; Gherardi et al., 2001). The maximum amount of deterioration of neurons occurs in the limbic system. Neurons are shielded with the neurocortical Pick’s bodies, which are located in the dentate gyrus. Similarly, ballooned neurons are also present in the temporal lobe similar to CBD and DLDH along with its complex form and there is neuronal degeneration in the cerebral cortex (Delobel et al., 2002). Pick’s inclusions are generally observed in the area of the CA1, subiculum, entorhinal, and frontal lobe. Frontal and temporal degeneration occurs with TDP-43 positive inclusions CA2.3 and Pick’s bodies in the hippocampus. The DNA binding protein TDP-43 and the RNA transactive response binding protein are recognized as the major binding proteins responsible for FTD. They have been associated with numerous gene expressions of different subsets of FTD (Falcon et al., 2018).
Pick’s disease has the second most common etiology of FTD, and it generally occurs at 40–80 years. Three genes named MAPT, GRN, and C9 or F72 are mainly responsible for Pick’s disease (Giannakopoulos et al., 2001; Constantinidis et al., 1974). Some other genes are also included but their prevalence is very low. Some researchers have found that there are many disorders that finally develop into Pick’s disease such as diabetes mellitus, hypertension, smoking, and obesity.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978032385544000006X
Histophysiology
Jahangir Moini, Pirouz Piran, in Functional and Clinical Neuroanatomy, 2020
Neurons
The neuron is the basic structural and functional unit of the nervous system. They are generally large, highly specialized cells. Neurons are able to provide electrical impulses along their axons, and their structures are different than the structures of glial cells.
Functional characteristics of neurons
Most neurons live much longer than glial cells and have a high metabolic rate. These cells have excitable plasma membranes, similar to skeletal muscle cells. A large amount of energy in the neuron is required due to the generation and propagation of action potentials (see below). During the functions of neurons, much energy is used to synthesize and secrete chemical compounds needed to send information between neurons. In active neurons, mitochondria produce a large amount of energy.
Most neurons do not have centrioles, which are organelles that function in mitosis. The centrioles help organize the microtubules that move chromosomes, and the cytoskeleton. Therefore, the lack of centrioles in the neurons of the CNS prevents them from dividing. Since they cannot divide, they cannot be replaced if lost to injury or disease.
The structure of neurons
Neurons have many shapes and are mostly located in the CNS. A neuron has four basic regions: a large cell body; multiple short, branched dendrites; one long axon; and terminal axon branches called telodendria.
The cell body
The cell body is also called the soma. It contains a large, round nucleus with an obvious nucleolus. The nucleus is usually centrally located within the cell body and contains genes. The perikaryon is the cytoplasm that surrounds the nucleus. The nucleus is surrounded by a plasma membrane. Mature neurons do not duplicate their chromosomes, but only function in gene expression. The chromosomes are uncoiled, instead of being compacted. The nucleolus assists in synthesizing ribosomal ribonucleic acid (rRNA) and in assembling ribosome subunits. The size of the nucleolus is large due to high rates of protein synthesis.
The nuclear envelope is a specialized region of the rough endoplasmic reticulum (RER) in the cytoplasm. The envelope has two layers, fine nuclear pores, and allows materials to diffuse in and out of the nucleus. Ribosomal subunits, once formed, easily pass through the nuclear pores into the cytoplasm.
The cytoplasm has both granular and agranular endoplasmic reticulum. The cytoplasm also includes Nissl bodies (also called Nissl substance), the Golgi apparatus (or complex), mitochondria, microfilaments, microtubules, lysosomes, centrioles, lipofuscin, melanin, glycogen, and lipid. The Nissl bodies (named for German neurologist Franz Nissl) synthesize proteins and give a gray color to the areas that contain neuron cell bodies—the gray matter. Nissl bodies are distributed through the cytoplasm, except for near the axon, which is called the axon hillock (“little hill”).
The Golgi apparatus in the cytoplasm is a network of irregular threads around the nucleus. It has flattened cisternae and small vesicles of smooth endoplasmic reticulum. The Nissl bodies’ protein is transferred inside of the Golgi complex via transport vesicles, and is stored there. Carbohydrates may be added to the protein to form glycoproteins. The Golgi complex also assists in producing lysosomes and in synthesizing cell membranes. The synthesis of cell membranes is very important in the formation of synaptic vesicles at axon terminals.
The spherical- or rod-shaped mitochondria are scattered through the cell body, dendrites, and axons. They have a double membrane, with the inner membrane having folds or cristae that project into their centers. Mitochondria are important in the production of energy. The numerous mitochondria, free and fixed ribosomes, and membranes give the perikaryon a coarse, grainy appearance. Mitochondria generate adenosine triphosphate (ATP) to meet neuronal energy demand. The ribosomes and RER synthesize proteins. Some areas of the perikaryon contain clusters of RER and free ribosomes. These regions, which stain darkly with cresyl violet, are the Nissl bodies.
The cytoskeleton of the perikaryon contains neurofilaments and neurotubules. These are similar to intermediate filaments and microtubules found in other types of cells. The main component of the cytoskeleton is formed by neurofilaments. Neurofibrils are bundles of neurofilaments that extend into the dendrites and axon, and provide internal support to them. Neurofibrils are numerous and run parallel to each other. The perikaryon contains organelles that provide energy and synthesize organic materials, especially the chemical neurotransmitters that are important in cell-to-cell communication.
Actin microfilaments are located beneath the plasma membrane of neurons and form a dense network. Along with the microtubules, the microfilaments assist in forming new cell processes and removing old ones. The microtubules extend through the cell body and its processes. In an axon, microtubules are parallel to each other, with the proximal end pointing to the cell body, and the distal end pointing away from it.
Lysosomes are vesicles bound to the plasma membrane. They contain hydrolytic enzymes, and are formed by budding off of the Golgi complex. The function of lysosomes is to digest myelin, pigments, and lipid. Centrioles inside immature, dividing nerve cells are small and exist in pairs. The pigment material known as lipofuscin consists of yellow-brown granules in the cytoplasm. It accumulates with aging, but is a harmless by-product of metabolism. Melanin granules exist in cell cytoplasm as well as in the brain, such as in the substantia nigra of the midbrain. They are related to the neurons’ ability to synthesize catecholamine. These neurons’ transmitter is dopamine. Table 1.2 summarizes the structures and functions of nerve cell bodies.
Table 1.2. Structures and functions of nerve cell bodies.
| Structures | Functions |
|---|---|
| Nucleus | Controls cell activities |
| Perikaryon (cytoplasm) | Surrounds the nucleus and occupies the entire cell body |
| Ribosomes | Synthesis of proteins |
| Nissl bodies | Synthesis of proteins |
| Golgi complex | Adds carbohydrates to protein; forms products to be transported to nerve terminals; forms cell membranes |
| Mitochondria | Form chemical energy |
| Neurofibrils | Determine shape of neuron |
| Microfilaments | Help to form and retract cell processes; assist in cellular transport |
| Microtubules | Aid in cellular transport |
| Lysosomes | Digest melanin, pigment, and lipid |
| Centrioles | Aid in cell division and maintenance of microtubules |
| Lipofuscin | A harmless metabolic byproduct |
| Melanin | Related to formation of dopa, which is the precursor of the neurotransmitter dopamine |
Neuron processes
Around the cell body are variable processes that include dendrites, axons, and telodendria. Dendrites are thin, sensitive, and branched extensions. They are important for intercellular communication. Typical dendrites have many branches, some of which have fine, long, and spiked projections called dendritic spines, which function in synapses. Neurons of the CNS receive information from other neurons mostly at the dendritic spines, which may make up 80%–90% of the neuron’s total surface area.
The dendrites of motor neurons are short and tapered. They usually have hundreds of stick-like dendrites that are near the cell body. Almost all organelles in the cell body are also found in dendrites. The dendrites are the primary input regions creating a large surface area that receives signals from other neurons. In many parts of the brain, thinner dendrites are highly specialized to collect information. Dendrites bring incoming messages toward cell bodies in the form of short-distance electrical signals called graded potentials.
An axon is a single, long cytoplasmic process that may be as much as a meter in length. A good example is the axon that extends from the lumbar spine to the big toe, which is up to 4 ft. in length. Therefore, axons are some of the longest cells in the human body. A long axon is also called a nerve fiber. There is only one axon per neuron. A nerve is made of several axons. Axons are able to propagate an electrical impulse known as an action potential away from the cell body. The axoplasm contains lysosomes, mitochondria, neurofibrils, neurotubules, small vesicles, and various enzymes. The axolemma surrounds the axoplasm. In the CNS, the axolemma may be exposed to interstitial fluid or covered by neuroglial cellular processes. The initial segment of an axon in a common neuron joins its cell body at the thick, cone-shaped axon hillock. The axon narrows, forming a thin process of the same diameter over the remainder of its length. Some neurons have axons that are either extremely short or completely absent. Other neurons have axons that make up nearly all of the length of the neuron.
Axons may be branched along their lengths. This produces side branches called collaterals, which allow a single neuron to share information with several other cells. The primary axon trunk and collaterals terminate in fine extensions called telodendria, or terminal branches. Neurons may have > 10,000 terminal branches, which are also called terminal arborizations. The actual end point of an axon is called its terminus. The telodendria end at knob-like axon terminals (synaptic terminals), which assist in communication with another cell. A synapse is the location in which a neuron communicates with another cell, which may be another neuron.
Axonal (axoplasmic) transport is the movement of materials between the cell body and axon terminals. Materials travel along the axon on neurotubules in the axoplasm. They are pulled by proteins that act as molecular motors, which are called kinesin and dynein, and use ATP. Some materials move slowly, only a few millimeters per day. This type of transport is called “slow stream.” Some vesicles move quicker, traveling as a “fast stream,” up to 1000 mm/day.
Axonal transport occurs in both directions at the same time. The flow of materials from the cell body to the axon terminal is carried by kinesin, and called anterograde flow. Simultaneously, various substances are moved by dynein from the axon terminal toward the cell body. This process is called retrograde flow. Materials flow in both directions along the axon by the anterograde flow and retrograde flow. However, the action potential only travels away from the cell body in one direction. Debris or unusual substances appearing in the axon terminal are quickly delivered to the cell body by retrograde flow. Once in the cell body, they may change cell activity by activating or inactivating specific genes.
Focus on deprivation of oxygen in neurons
When neurons are deprived of oxygen, their nuclei shrink. Affected neurons change shape and then disintegrate. Ischemia, hypoxemia, or toxins may cause oxygen deficiency. Toxins may block aerobic respiration, preventing neurons from using oxygen.
The classification of neurons
Neurons are classified either by their structures or by their functions. Therefore, understanding these classifications helps in easily remembering the concepts of neurons.
Structural classification
Neurons are classified based on relationships between their dendrites, cell body, and axons, as follows: anaxonic, bipolar, unipolar, and multipolar (Fig. 1.3):
Fig. 1.3. Structural classifications of neurons. (A) Multipolar neuron: neuron with multiple extensions from the cell body. (B) Bipolar neuron: neuron with exactly two extensions from the cell body. (C) (Pseudo-) unipolar neuron: neuron with only one extension from the cell body. The central process is an axon; the peripheral process is a modified axon with branched dendrites at its extremity. (The red arrows show the direction of impulse travel.)
- •
-
Anaxonic neurons are small, with numerous dendrites and no obvious axons. Their axons are not easily seen, even under a microscope. Anaxonic neurons are found in the brain and special sense organs. Their functions are not completely understood.
- •
-
Multipolar neurons have two or more dendrites and one axon. They are the most common CNS neurons. All motor neurons that control skeletal muscles are multipolar neurons. Their longest axons carry motor commands from the spinal cord to small muscles of the toes.
- •
-
Bipolar neurons have one dendrite and one axon—with the cell body between these two structures. Bipolar neurons are not common. They are located only in the special sense organs. They transmit information about sight, smell, or hearing. Bipolar neurons are relatively small.
- •
-
In a unipolar neuron, or pseudounipolar neuron, the dendrites and axon are continuous with each other, with the cell body located on one side. The base of the neuron lies where the dendrites meet. The remaining process, considered an axon, carries action potentials. The majority of the sensory neurons of the PNS are unipolar. Their axons are very long, 1 m or more, and end at synapses in the CNS. The longest unipolar axons carry sensations from the toes to the spinal cord.
Functional classification
Neurons can also be classified by function as: (1) sensory neurons, (2) motor neurons, and (3) interneurons. These classifications are based on the direction that nerve impulses of neurons travel, to and from the CNS.
Sensory neurons
Sensory neurons form the afferent division of the PNS. They transmit impulses from sensory receptors in the skin or internal organs toward the CNS. A ganglion is a group of neuron cell bodies located in the PNS. Cell bodies in the brain and spinal cord (CNS) form nuclei. Examples include the trigeminal nuclei. Sensory neurons are unipolar. Virtually all of their cell bodies are located in peripheral sensory ganglia. The processes of sensory neurons are known as afferent fibers. They extend between sensory receptors and the CNS. Information moves from sensory receptors to the spinal cord or brain. There are about 10 million sensory neurons in the body, each collecting information about the external and internal environments. Somatic sensory neurons monitor the external environment. Visceral sensory neurons monitor the internal environment and organ systems. In the peripheral nerves the somatic fibers innervate skin, muscle, joints, and body walls. Similarly, the visceral fibers innervate the blood vessels and internal organs.
Sensory fibers are called afferent and motor fibers are called efferent. Sensory receptors may be classified into three groups:
- •
-
Interoceptors monitor the cardiovascular, digestive, reproductive, respiratory, and urinary systems. They provide signals to contract or distend visceral structures. General visceral afferent fibers carry interoceptive data from the receptors of visceral organs.
- •
-
Exteroceptors provide pressure, temperature, and touch information, and the senses of equilibrium (balance), hearing, sight, smell, and taste.
- •
-
Proprioceptors monitor skeletal muscle and joint movement and positioning.
Somatic afferent fibers carry data from proprioceptors and exteroceptors.
Motor neurons
Motor neurons form the efferent division of the PNS. There are approximately 500,000 motor neurons carrying information from the CNS to peripheral effectors in peripheral tissues and organ systems. Efferent fibers are the axons of motor neurons that carry information away from the CNS. The two primary efferent systems are the SNS and the autonomic (visceral) nervous system (ANS).
The SNS includes the somatic motor neurons, which innervate skeletal muscles. The SNS is under conscious control. The cell bodies of somatic motor neurons are located within the CNS. Their axons run within peripheral nerves, innervating skeletal muscle fibers at neuromuscular junctions.
The ANS is not consciously controlled. Visceral motor neurons stimulate all peripheral effectors except for skeletal muscles. They innervate the cardiac muscle, smooth muscle, adipose tissue, and glands. Visceral motor axons of the CNS innervate additional visceral motor neurons in peripheral autonomic ganglia. Here, the neuronal cell bodies innervate and control peripheral effectors. Preganglionic fibers are the axons that extend from the CNS to an autonomic ganglion. Postganglionic fibers are the axons that connect the ganglion cells with the peripheral effectors.
Interneurons
Interneurons are situated between sensory and motor neurons. There are approximately 20 billion interneurons, or association neurons. Most are found in the brain and the spinal cord, and others are within the autonomic ganglia. Interneurons make up > 99% of all the neurons in the body. The primary function of interneurons is integration. They carry sensory information and regulate motor activity. More interneurons are activated when a response to stimuli is required to be complex. Interneurons are utilized in all higher functions, including learning, memory, cognition, and planning. Nearly all interneurons are multipolar. However, they are of many different sizes and have different patterns of fiber branches.
Section review
- 1.
-
How are neurons classified?
- 2.
-
What are the differences between afferent and efferent fibers?
- 3.
-
What are the functions of interneurons?
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B978012817424100001X
Role of caspases, apoptosis and additional factors in pathology of Alzheimer’s disease
Anil Gupta, in Human Caspases and Neuronal Apoptosis in Neurodegenerative Diseases, 2022
Role of synaptic loss in Alzheimer’s disease
Alzheimer’s disease is associated with the reduction in density of cortical neurons. Latest studies were conducted utilizing [18F]-fluorodeoxyglucose positron emission tomography (1⁸F-FDG) (a radiopaque compound used in medical imaging) to have images of the brain regions. The study indicated a reduction in the use of 2-deoxy-2-[fluorine-18]fluoro-d-glucose by the neurons as revealed in the positron emission tomography. It is suggestive of loss of neuronal synapses in brain regions of patients (Mosconi et al., 2010).
Authors claimed that loss of synapses occurs much before (nearly 20–30 years) the clinical manifestations of cognitive dysfunction and Alzheimer’s disease (Jack and Holtzman, 2013; Jack et al., 2013).
Several studies claim the potential of synaptic loss in the impairment of cognitive function associated with Alzheimer’s disease.
The study was conducted involving 18 patients (Terry et al., 1981) with Alzheimer’s senile dementia. With the help of microscopy, counts of glial and neuronal perikarya were estimated in the midfrontal region and superior temporal gyrus of the participants with senile dementia, and findings were compared with 12 age-matched normal participants (Terry et al., 1981).
Terry et al. (1981) reported the presence of an 8% reduction in brain weight in participants with senile dementia.
The reduction of 46% neurons in the temporal region and 40% neuronal reduction in the frontal cortex were reported (Terry et al., 1981).
Furthermore, the thickness of senile plaques was inconsistent with the reduction in brain weight and neuronal count in different regions of the brain in patients with senile dementia.
Additionally, apoptosis and neuronal death are incriminated in the pathology of Alzheimer’s disease by several researchers (Araki et al., 2000; Abe et al., 2003; Benaki et al., 2005).
But, apoptosis and neuronal death are not primarily associated with cognitive impairment in Alzheimer’s disease.
The neocortical synaptic loss is closely implicated in the pathology of cognitive function in Alzheimer whose occurrence has been reported much earlier than the manifestation of the reduced count of cortical neurons, apoptosis, and neuronal death in Alzheimer’s (Terry, 2000).
It is assumed that the loss of hundreds of axonal terminals in the cortical neurons results in synaptic loss, consequently leading to clinical manifestations of Alzheimer’s. Despite the loss of axonal terminals, the cell bodies still survive. But the pronounced loss of synapses in the cortical neurons is followed by the impaired release of neurotransmitters, disturbed impulse conduction, deficiency of trophic factors leading to apoptosis, and death of cell bodies (Terry, 2000).
A study by Kidd (1963) and Gonatas et al. (1967) reported the presence of abnormal neurofibrils (helices) in the dendritic processes and postsynaptic processes in neurons in the brains of patients with Alzheimer. Another study by Luse and Smith (1964) reported enlarged axon terminals in the senile plaques containing large and dense vesicles and fibrils.
Furthermore, a study by Gonatas et al. (1967) showed alterations in the axons, presynaptic nerve endings, postsynaptic nerve endings, and dendritic processes in the senile plaques.
The aforementioned studies suggest the implication of altered synapses in the pathogenesis of impaired cognitive function in Alzheimer’s.
Another study by Terry et al. (1991) provided the physical factor in the impaired cognitive function in Alzheimer’s disease and proved that loss of synapses was significantly associated with the cognitive dysfunction in Alzheimer’s. In the study by Terry et al. (1991), 15 patients with Alzheimer’s disease and nine healthy participants were selected.
The authors reported a poor correlation among the presence of tangles and senile plaques with the psychometric indices. Moreover, a strong correlation was reported among the density of neocortical synapses with tangles and senile plaques with the psychometric indices.
Thus, the study revealed that a reduction in the density of synapses in the cortical region is associated with higher chances of cognitive dysfunction in Alzheimer’s disease.
Still another study by Jacobsen et al. (2006) predicted early-onset of synaptic deficits and altered behavioral patterns in a mouse model of Alzheimer’s disease.
Jacobsen et al. (2006) studied the advancement of neuronal dysfunction in terms of morphological, functional, and behavioral expressions in the Tg2576 mouse model of Alzheimer’s disease.
Authors reported a reduction in density of the dendritic spine, disturbed long-term potentiation, and behavioral alterations that were observed to occur much earlier than the formation of senile plaques (Jacobsen et al., 2006).
The authors further elaborated the time duration for the expression of several defects in the brain regions in the mouse model of Alzheimer’s (Jacobsen et al., 2006). The reduction in dendritic spine density was identified at age of 4 months, while the decrease in long-term potentiation was reported at 5 months old in the Tg2576 mouse model of Alzheimer’s disease (Jacobsen et al., 2006).
Surprisingly, the rise in the ratio between Aβ42 and Aβ40 was reported during 4–5 months old (Jacobsen et al., 2006). Furthermore, the formation of plaques containing β-amyloids was reported at the age of 14 months in the Tg2576 mouse model of Alzheimer’s disease.
Thus, synaptic loss and dysfunction are closely implicated in the pathology of cognitive dysfunction associated with Alzheimer’s disease (Bastrikova et al., 2008).
The dendritic spine represents the small protrusion from the dendrite of the neuron. It receives a signal from the axon at the synapse. It functions to transmit a signal to the cell body of neurons (Alvarez and Sabatini, 2007). The major cytoskeleton named as filamentous actin (F-actin) maintains the shape and function of dendritic spines.
Furthermore, loss of the dendritic spine is the early characteristic of Alzheimer’s disease.
A study was conducted by Kommaddi et al. (2018) in APPswe/PS1ΔE9 male mice (a mouse model of Alzheimer’s disease) and determined the neurotoxic effect of β-amyloid on the F-actin disassembly in dendritic spines and its potential in the pathology of cognitive dysfunction in Alzheimer’s disease.
Kommaddi et al. (2018) reported depolymerization of synaptosomal filamentous-actin and a rise in the concentration of globular-actin (G-actin). These events were observed at age of 1 month in the AD model of a male mouse suggesting the role of equilibrium between the levels of F-actin and G-actin optimal behavior.
Furthermore, Kommaddi et al. (2018) identified that depolymerization process involving F-actin in dendritic spines results in the disruption of the normal organization of outwardly oriented F-actin rods in cortical neurons in the mouse model, APPswe/PS1ΔE9.
Thus, it can be inferred that cytoskeletal protein, F-actin, is helpful in supporting the normal structure and function of synapses in the brain. The altered state of F-actin is responsible for the loss of dendritic spines and synaptic loss in specific regions of the brain in Alzheimer’s.
Thus, synaptic loss and dysfunction constitute the basis of cognitive impairment associated with Alzheimer’s disease.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128201220000017
Neurons and neuroglia
J.L. Wilkinson OBE, MD, FRCS, in Neuroanatomy for Medical Students (Second Edition), 1992
Cytology (Fig. 2.4)
The cell membrane is a bilaminar phospholipid structure with an external layer of glycoprotein. A mosaic of specialized protein molecules within the membrane provides channels which are individually selective for the passage of sodium (Na+), potassium (K+) or chloride (Cl–) ions. Some of these channels are open, others are gated. There are two types of gating. Channels associated with synapses are opened when a neurotransmitter binds to a receptor on the soma or dendrite: this is ligand gating (the substance that binds is the ligand). Other channels, mostly on the axon, are voltage-gated, being actively opened or closed by changes in the electrical potential of the membrane; the soma has relatively few of these. In the resting state, the concentration of intracellular K+ is high and that of Na+ low, relative to extracellular fluid and this is maintained by an adenosine triphosphate (ATP)-driven sodium-potassium pump. Potassium ions tend to diffuse out through ungated channels. Unequal distribution of ions across the membrane creates a negative resting potential of about −70 mV. Synaptic excitation produces depolarization, a reduction of membrane potential, brought about by a neurotransmitter-mediated opening of sodium channels, allowing a sudden influx of Na+. When a critical threshold is reached, an all or none response, the action potential, begins in the initial segment of the axon. The presence of voltage-gated sodium channels here and throughout the axon allows the action potential to develop in the initial segment and then, as a wave of depolarization, to become a self-propagating nerve impulse. Multiple sub-threshold synaptic stimuli can summate to trigger an action potential. The impulse, lasting about 5 ms, is followed by a return to the resting potential and then by a refractory period during which the cell is unresponsive to stimuli. Inhibitory synaptic stimuli cause hyperpolarization or increased potential in the cell membrane, for example by opening ligand-gated chloride channels.
Fig. 2.4. Diagram of the fine structure of a neuron.
The nucleus has a double membrane with pores. Its chromatin consists of large molecules of deoxyribonucleic acid (DNA), which regulates ribonucleic acid (RNA) synthesis; RNA probably leaves via the nuclear pores and controls cell protein synthesis in the ribosomes. There is usually a single nucleolus. In females there is a nucleolar satellite (Barr body) of sex chromatin. Some binucleate somata appear in sympathetic ganglia.
Cytoplasmic organelles
Nissl bodies (chromatin granules), intensely basophilic and stained by cresyl violet and similar dyes, occupy the perikaryon and dendrites but not the axon hillock (Figs 2.1 and 2.3). They are more prominent in motor than in sensory neurons, amounts varying with cell activity. With electron microscopy they are seen to consist of granular (rough) endoplasmic reticulum, groups of cisternae with attached and free ribosomes containing RNA and concerned in production of proteins necessary for cell metabolism and structural maintenance; some neurons synthesize peptide neurotransmitters or hormones.
Fig. 2.3. Giant pyramidal (Betz) cell of cerebral motor cortex. (Cresyl violet stain, × 520.)
Golgi complexes, which are clusters of flattened cisternae near the nucleus and similar in appearance to agranular (smooth) endoplasmic reticulum, enclose glycoprotein in membrane-bound vesicles for axonal transport. They also produce lysosomes, which are membrane-bound enzymes, able to destroy intracellular bacteria or other foreign material and to dispose of effete intracellular organelles.
Mitochondria, numerous throughout the soma, dendrites and axon, are spherical, ovoid or filamentous, with a double membrane folded internally into cristae. Regarded as the ‘powerhouse’ of cells, they store energy in ATP. They are particularly evident at sites of metabolic activity, for example near synapses, motor and sensory endings.
Electron microscopy reveals prominent microtubules, neurotubules, 20–30 nm in diameter and composed of the protein tubulin, running through the perikaryon into the neurites; these are concerned with the transport of large molecules along the neurites in either direction. In addition there are neurofilaments, about 10 nm thick. Neurofilaments aggregate in silver-stained preparations to form the ‘neurofibrils’ which are visible in light microscopy.
Centrosomes (centrioles), usually a feature of dividing cells, have been observed in mature neurons incapable of division; they may be associated with the formation or maintenance of neurotubules.
In addition to organelles, cytoplasmic inclusions may appear in neurons. Melanin, most evident in the substantia nigra, increases in amount up to puberty, then remains constant; it is chemically related to the neurotransmitter dopamine which is utilized by neurons located there. The pontine nucleus ceruleus (caeruleus = dark blue) contains melanin and copper. With increasing age, most neurons develop yellowish-brown lipofuscin (‘age pigment’) granules.
Dendrites and axons
Dendrites are slender extensions from the soma which greatly increase its receptive field and contain the same organelles. They commonly have numerous branches whose configurations characterize neuron types (see Fig. 12.1), for example the Purkinje cells of the cerebellar cortex have a dendritic field arranged in one plane (see Fig. 7.6). Frequently their surface area is extended by synaptic dendritic spines.
A single axon, generally the longest neurite, usually arises from an axon hillock; this narrows into an initial segment, beyond which the diameter remains uniform. Axons thicker than 1 μm generally have a myelin sheath which commences after the initial segment and is interrupted at intervals by the nodes of Ranvier (see p. 35). In the central nervous system myelin sheaths are formed by neuroglia (oligodendrocytes), in peripheral nerves by neurolemmal cells of Schwann. At the nodes, the bare axolemma is exposed to ionic exchange, while the myelinated segments (internodes) are insulated; this arrangement is the structural basis for ‘saltatory conduction’, by which action potentials ‘jump’ from node to node. The speed of conduction is proportional to the thickness of the axon and its sheath. Slender axons are non-myelinated. Collateral branches arise at nodes, a recurrent collateral recurving towards the parent soma and synapsing with nearby neurons. The axon terminals have presynaptic expansions (boutons terminaux), or a row of many such swellings (boutons de passage). The axoplasm contains neuro tubules, neurofilaments, agranular (smooth) endoplasmic reticulum and mitochondria; RNA and ribosomes, concerned with protein synthesis, are usually absent from the axoplasm.
Axoplosmic transport
Products synthesized in the soma travel along the axon in the orthograde direction in two modes. Bulk flow of axoplasm undergoes slow transport at about 1–3 mm/day, the mechanism for which is unknown. Rapid transport of membrane-bound vesicles, including neurotransmitters, has a velocity of about 400 mm/day (2800 mm/day in the hypothalamo-hypophyseal tract); this transport probably occurs on the external surfaces of the neurotubules. Retrograde transport provides a feedback whereby information on peripheral activity is relayed to the soma. It is used experimentally in axon-tracing, as with HRP, and has clinical implications in centripetal invasion by neurotoxic and infective agents (e.g. tetanus toxin and rabies).
Synapses (Fig. 2.5)
Each neuron is an anatomical unit; this was proposed by Ramón y Cajal (1900, 1908), but was finally proven only by electron microscopy. Unidirectional communication occurs between neurons at foci of specialized contact, the synapses, generally sited between the axon of one neuron and the cell surface of another. Myelinated axons lose their sheaths near their terminals. Each axon may have thousands of boutons; similarly each neuron may be contacted by a few terminals or by thousands, some excitatory, some inhibitory (Fig. 2.6). This general pattern provides for discrete, convergent or divergent transmission of information. Commonly the synapses are between an axon and the soma or dendrites of another neuron (axosomatic, axodendritic); synapses from one axon to another (axoaxonic) are inhibitory. Synapses also occur between dendrites in areas of complex activity. There is continuous turnover and remodelling of synapses, for example, in the cerebral cortex (Jones, 1988). Neurons also synapse with effectors at neuromuscular and neuroglandular junctions.
Fig. 2.5. Diagram of a chemical synapse.
Fig. 2.6. Section through α ventral horn neuron showing numerous nerve endings on its cell body and on one of its dendrites, from a cat spinal cord. (Cajal silver stain.)
(From Young, J.Z. (1978) Programs of the Brain, Oxford University Press, Oxford, by kind permission of the author and publisher.)
In the central nervous system most synapses are of the type called chemical synapses, in which the presynaptic and postsynaptic membranes are separated by a synaptic cleft about 20 nm wide. The presynaptic membrane may have local thickenings, the postsynaptic membrane a dense subsynaptic web; these, together with other variable factors, such as width of cleft or type and shape of vesicles, are used in classifying synapses. A presynaptic terminal, has synaptic vesicles which contain a chemical neurotransmitter. Neurotransmitters, released from the presynaptic terminal, have a transient action of a few milliseconds because specific mechanisms exist to remove them from the synaptic cleft. Many peptides are neuroactive, but have a longer action, sometimes because there is no mechanism for rapidly terminating this. They may co-exist with, and modulate the effects of neurotransmitters, and are termed neuromodulators (see Chapter 15). Low molecular weight neurotransmitters may be synthesized at terminals but peptide production is dependent upon the mechanisms of protein synthesis located in ribosomes of the cell body.
Arrival of nerve impulses at a terminal creates an influx of calcium ions, which causes release of neurotransmitter by exocytosis into the synaptic cleft, where it binds to receptors of the postsynaptic membrane. Each receptor comprises a binding component which protrudes into the cleft and a neurotransmitter-activated ionic channel through the cell membrane. In excitatory synapses, Na+ channels open and depolarization follows; in inhibitory synapses, K+ or Cl– channels open and hyperpolarization of the postsynaptic membrane occurs. The neurotransmitter acetylcholine is inactivated in the cleft by acetylcholinesterase. Catecholamines such as noradrenaline are located in dense-cored vesicles, and the duration of their postsynaptic effect is limited by their re-uptake to the presynaptic terminal as well as by enzymatic means and diffusion. Monoamine oxidase, an intraneuronal enzyme produced by mitochondria, degrades catecholamines. Monoamine oxidase inhibitors may be used clinically in treating depressive illness. Other transmitters include: monoamines such as noradrenaline, dopamine and 5–HT; amino acids such as gamma-aminobutyric acid (GABA), glycine and glutamate; and many peptides, including enkephalin and substance P.
Electrical synapses, common in invertebrates, also occur in the sensory nervous system of lower vertebrates. A narrow gap junction, 2 nm wide, contains small channels between apposed membranes, which effect rapid direct transmission of impulses by ionic flow; this can be bi-directional. Gap junctions are like those in cardiac and non-striated muscle.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780750614474500062
ACETYLCHOLINE SYSTEM AND NEURAL DEVELOPMENT
Guido Filogamo, Pier Carlo Marchisio, in Neurosciences Research, 1971
B NERVOUS CENTERS
Unlike muscular tissue, all the components of the ACh system may be found in developing nervous structures.
Data in the literature and many results obtained in our laboratory point to very early detection of an ACh system in developing nervous tissue. However, the earliest positivity for AChE was undoubtedly found by Zacks (1954) in the area of Hensen’s node and in the anterior crescent in chick embryos; such an activity of presumptive areas may be rather unspecific since it is coincident with high activity of the enzymes of carbohydrate metabolism (Moog, 1952). In many populations of neuroblasts, the first unambiguous AChE positivity appears between the fifty-second and the seventy-second hour of development. At this stage, the neuroblasts of a given population are still in their very initial phase of differentiation and are actively migrating according to their pattern of organization. That is to say, they are in free growth phase and probably undergo mutual influences only within their own population.
In all the neuroblast populations we have studied, AChE positivity never failed to be detected, and its appearance coincided clearly with the beginning of other differentiative phenomena. The cellular localization of the early AChE is peculiar: initial AChE positivity is predominantly localized around the nucleus, i.e., in the perikaryon cytoplasm, and there is good evidence that, at least at earlier stages, AChE does not diffuse into processes (Filogamo, 1960a; Cantino, 1970; Tennyson and Brzin, 1970).
Such a cellular localization supports the idea of involvement of the ACh system in certain aspects of cell metabolism (see below).
Obviously, AChE positivity could not be considered as proof of the contemporary existence of all ACh system components. That this is the case seems very likely, however, since Giacobini (1970a,b) found that the high ChAc activity in myotomes could be accounted for by the presence of free-growing motor fibers in 4-day chick embryos. In other areas of the developing system, ChAc could not be measured before the sixth day, possibly because the biochemical methods employed are not sensitive enough (Marchisio and Giacobini, 1969).
This series of observations encourages us to claim that the presence of an ACh system is an intrinsic property of the early neuroblast. The nervous destiny of an embryonic cell is as biochemically specified by the onset of the components of the ACh system as it is morphologically specified by the appearance of neurofibrils responsible for Ramon y Cajal’s neurofibrillar reaction.
The presence of the ACh system in early neuroblasts does not imply that the same neuroblasts will necessarily give rise to cholinergic neurons. The following examples provide evidence for the latter statement: (1) presence of AChE may be demonstrated in chick and rabbit olfactory neuroblasts which do not correspond to cholinergic neurons in adult animals (Filogamo, 1963b, 1969); (2) a transient positive reaction for AChE is found in embryonic ganglia and amacrine cells of chick embryo retina (Shen et al., 1956) which lack any positivity after achieving maturity; (3) histochemical positivity for AChE (Strumia and Baima-Bollone, 1964) and high activity of ChAc (Marchisio and Consolo, 1968) and AChE (Giacobini et al., 1970) were found in spinal ganglion neuroblasts, the majority of which give rise to noncholinergic neurons; (4) Purkinje cells of the embryonic cerebellum are intensely AChE active, but activity disappears when approaching maturity (Csillik et al., 1964).
At stages of development which vary according to different populations, the ACh system progressively disappears from neuroblasts, and this event is chronologically coincident with the achievement of neuronal maturation. It would seem at this point in the life cycle of each neuroblast that the ACh system has probably lost one of the functions which has been tentatively proposed for the system (see below).
It must be added here that at this stage, young neurons have established their definite connections and have suitable machinery for elaborating their own transmitters which may be either ACh itself or other substances. As far as one can infer from the study of the ACh system, the ability of each neuron to synthesize adequate quantities of its own transmitter, i.e., enough for starting synaptic functions, occurs concomitantly with the attainment of maturity.
At this point in our discussion we feel justified in reporting one further experiment. In our laboratory, Torre (1970) has recently tested DFP toxicity in chick embryos (Fig. 15). Chick embryos were given a standard dose of the drug into the yolk sac, and the mortality rate was recorded 30 hours after treatment in more than 10 embryos per stage. Up to the seventh day of incubation, DFP was not significantly more toxic than the solvent alone (1,2-propandiol); DFP toxicity steadily increased thereafter, and death of embryos invariably occurred after the tenth day. This experiment likely means that attainment of maturity with resultant adequate synthesis of synaptic ACh is an essential condition for DFP to exert its lethal effect when acutely administered.
FIG. 15. Percent mortality occurring after a single administration of a standard dose of DFP to chick embryo (solid line). No death was recorded until the fifth day; then mortality progressively increased to 100% after the ninth day. Dashed line represents the percent mortality after administration of the DFP solvent 1,2-propandiol. Each point represents results obtained from 10 or more treated embryos.
(Courtesy of Dr. C. Torre, unpublished.)
In the course of neuronal development, it seems that the ACh system occurs in two successive phases whose distinctive properties are listed in Table I; whether there are more important distinctive properties is not known at present. While the later phase begins and persists only in cholinergic neurons, the earlier one reflects a basic characteristic which probably endows all neuroblasts.
TABLE I. DISTINCTIVE PROPERTIES OF EARLIER AND LATER PHASES OF THE ACh SYSTEM IN DEVELOPING NERVOUS STRUCTURES
| Earlier or “neuroblast” ACh system |
|
| Later or “neuron” ACh system |
|
It must be emphasized that the early differentiation of all the components of the ACh system (and not only of AChE, as in myoblasts) is an ontogenetic event which marks the nervous destiny of an undifferentiated cell and occurs independently of any influence of the surrounding environment. Very early, however, transneuronal correlations are established between different neuroblast populations, and the early ACh system of one given population may exert effects in a planned fashion upon other populations by means of freely growing exploring fibers (Filogamo, 1960b). This does not mean that the related populations are connected by synapses; on the contrary, connections are largely modifiable at this stage and represent the morphological background of the so-called transneuronal trophic effects.
At present the chemical phenomena which are the basis of transneuronal trophic effects are not known. Rather, it is known that development proceeds by means of sequential syntheses of a large variety of new materials according to a pattern of organization very precisely planned both in space and in time. It does not seem too speculative to believe that the early ACh system may be one of the pathways involved in some way in the complex process of nervous development through mechanisms which are not yet adapted to synaptic transmission.
One possible transneuronal mechanism may involve an early release of ACh which may affect membrane permeability of other neuronal populations and facilitate exchange of nutrients. Such a mechanism has the advantage of not requiring the postulation of new roles for ACh, since facilitation of membrane permeability is the actual function of ACh at synapses.
An alternative possibility is that ACh is directly involved in the gearing of neuroblast synthetic processes, a role which is unusual but seems to be supported by some observations. Kasa et al. (1966) envisaged involvement of ACh in the process of protein synthesis within developing nervous cells. In an earlier paper from this laboratory (Marchisio and Consolo, 1968), it was tentatively proposed that ACh could regulate the synthesis of some phospholipid components of the neuroblast membranes. Finally, the suggestive similarity reported above (Larrabee et al., 1969) between the patterns of protein, RNA, and ACh synthesis stimulated us to propose the working hypothesis of a relationship between neural histogenesis and the ACh system.
Transneuronal correlations mediated either by an early ACh system or by other unknown mechanisms as in the optic pathway are probably responsible for the critical maturation of the neuron. Their effects control the maturation of the neuroblast with regard to many morphological features, and there is ample evidence that synaptization starts when the postsynaptic neuron has achieved most of its mature properties (Filogamo, 1960b). At the very moment of maturational process, the neuron acquires its definite transmitter system.
Thus, we believe that the later developing phase of the ACh system is not, as the earlier one, an “inborn” property of each neuroblast but is the final result of a long-lasting process of interplay between transneuronal influences and intrinsic properties of each neuron.
Each neuron, being a cell supplied with a complete set of genes, possesses the potential ability of synthesizing the complete enzymatic machinery for a given transmitter substance. That a maturing neuron emerges at the end of its differentiation as a cholinergic neuron and not an adrenergic one is regulated by external factors which very likely determine the expression of the proper genetic mechanism. The external factors are conveyed by the growing nerve fibers which probably release unknown specific inducers upon target cells.
At this point in its development, the neuron is highly plastic as far as its future physiological properties are concerned. When embryonic development ends, plasticity tends to disappear, and the fate of each neuron is now assured. Under a particular set of experimental conditions, neuronal plasticity may again be revealed even in tissues already containing mature nervous supply (Koslow and Giacobini, 1971).
From the above considerations, it may be inferred that the neuronal ACh system is only one of several mechanisms which may be adopted by the neuron for transmitting interneuronal information.
The “neuroblast” ACh system, on the contrary, represents a more rigid, though temporary, property, which is a typical feature of undifferentiated embryonic nerve cells.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780125125048500081
The interplay between the pineal complex and the habenular nuclei in lower vertebrates in the context of the evolution of cerebral asymmetry
Vittorio Guglielmotti, Luigia Cristino, in Brain Research Bulletin, 2006
In the first report on the habenular asymmetry in R. esculenta [75], the study of the HN was based on reduced-silver staining for neurofibrils (the Bodian protargol method). This approach pointed out the lack of argentophily in the neuropil of the medial subnucleus in the left dorsal habenula (Fig. 2A) and in the pineal organ. However, a fine net of thin fibers was stained both in the right nucleus and in the lateral subnucleus of the left habenula. The same result was obtained with another protocol for the impregnation of neurofibrils, the silver block-staining method of Foley (Fig. 2B) (unpublished data). Staining of the pineal complex in the frog with silver impregnation methods was not successful in our experience. In general, silver impregnation used successfully in the retina turned out to be ineffective for the study of the pineal organ of lower vertebrates [128].
Fig. 2. Photomicrographs of transverse (A–C) and horizontal (D) sections through the left dorsal habenula in Rana esculenta. (A and B) Bodian protargol staining (A) and Foley staining (B), which are silver impregnation protocols. Note the lack of argentophily in the neuropil of the medial subnucleus (M) in the left dorsal habenula, while staining is evident in the neuropil of the lateral subnucleus (L). (C) Labeling of cells and fibers in the left dorsal habenula after injection of the retrograde tracer horseradish peroxidase in the interpeduncular nucleus. Note the different size and shape of cells in the medial subnucleus (M) with respect to the lateral subnucleus (L). (D) Calretinin immunolabeling of cells and fibers in both the medial subnucleus of the habenula (M; arrow) and in the pineal organ (PO, a portion of which is indicated by the arrowhead) in the developing animal during the metamorphosis period. Note the topographical proximity and the cytological similarities of the pineal and habenular regions. III: third ventricle. The following figures are modified from: (C) ref. [56], (D) ref. [55] and reproduced with permission from Elsevier.
Read full article
URL:
https://www.sciencedirect.com/science/article/pii/S0361923006001080
Alzheimer’s disease and oxidative stress: implications for novel therapeutic approaches
Christian Behl, in Progress in Neurobiology, 1999
In 1907, Alois Alzheimer described a “peculiar disease of the cortex”, stating that in sections that have been silver-stained, he found “strange alterations of the neurofibrils” and “foci which are build up by a peculiar substance” “spread over the whole cortex” (Alzheimer, 1907). Ninety years later, the structures found by Alzheimer are well-known as neurofibrillary tangles (NFTs) and as senile plaques loaded mainly with amyloid β protein (Aβ) (Glenner, 1988; Kang et al., 1987; Braak and Braak, 1991) (Fig. 1). To date, many neurobiologists all over the world are still concentrating on these two major histopathological hallmarks of AD in order to study the pathogenetic mechanisms of this deadly neurodegenerative disease. AD is predominantly a disorder of the brain region that controls the human central nervous system (CNS), the cerebral cortex. This structure shows the pathological changes characteristic for AD and it appears that the neurodegeneration spreads out from there (Braak and Braak, 1991). In the affected cortical and subcortical brain areas, a continually ongoing sequence of degenerative changes can be found (Brun and Gustafson 1976, 1978; Mann, 1985; Hyman et al., 1990; Braak and Braak, 1991). In a preclinical phase, already mild pathological alterations are detectable before the appearance of clear clinical symptoms. Clinically, AD is characterized by a progressive mental deterioration and significant changes in the personality with great individual differences with respect to the speed of the intellectual decay (Reisberg et al., 1989). While the episodic memory is lost very early, the short-term or working memory is preserved until very late in the course of AD development. Therefore, impairment of memory is an early feature of AD. A diagnostic test for AD is still not available and, therefore, despite the progress made in psychological testing and improved imaging techniques, the diagnosis `AD’ remains a diagnosis of exclusion of other causes. Still, only the post mortem analysis can, ultimately, demonstrate, whether a diseased patient really suffered from AD or a similar neurodegenerative disorder. The most prominent histopathological hallmarks of AD remain to be the extracellular and intracellular accumulation of insoluble fibrous material, which can normally not be found in the CNS (Alzheimer, 1907; Terry, 1985; Price, 1986).
Fig. 1. Histopathology of AD: senile plaques (big arrows) and neurofibrillary tangles (small arrows) in the frontal cortex of an AD brain. The specimen shown was kindly provided by Dr Matthias Weber of the historical archives of the Max Planck Institute of Psychiatry
Read full article
URL:
https://www.sciencedirect.com/science/article/pii/S0301008298000550
22 ноября 2021 (обновлено: 22 июня 2022)
10 минут на чтение
Нервный синапс: строение, типы и функции, роль в создании нейронной сети
Поскольку нейроны образуют сеть электрической активности, они каким-то образом должны быть связаны между собой. Эта связь не является простой частью цитоплазмы, каждый нейрон имеет электрическую связь со всеми другими, но связан не просто мембранными контактами. Передача информации осуществляется очень специализированными и сложными структурами, называемыми синапсами.
Синапс – это место, где два нейрона соединяются таким образом, что сигнал может передаваться от одной нервной клетки к другой.
Типичным и наиболее распространенным типом синапсов является тот, в котором аксон (длинный отросток) одного нейрона активирует второй нейрон, образуя синапс с одним из его дендритов или с телом клетки.
Что такое синапс: зачем они нейронам
Синапс – это место, где нейроны обмениваются информацией. Это не физический компонент клетки, а скорее название промежутка между двумя клетками:
- пресинаптической клеткой (отдающей сигнал)
- постсинаптической клеткой (принимающей сигнал).
В синапсе возможны два типа реакций – химическая или электрическая. Во время химической реакции биохимическое вещество, называемое нейротрансмиттером (передатчиком), выделяется из одной клетки в другую. В электрической реакции на заряд одной ячейки влияет заряд соседней ячейки. Электрический ответ нейрона распространяется на несколько синаптических входов, нейрон передает информацию окружающим.
Классификация синапсов
В межнейрональных синапсах возможны два типа реакций: химическая реакция или электрическая реакция. Соответственно, выделяют химические и электрические виды синапсов.
Во время химической реакции нейротрансмиттеры (например, ацетилхолин) помогают передавать информацию от клетки к клетке.
В электрической реакции на электрический заряд одной клетки влияет другая, соседняя, от которой поступает информация.
Хотя электрические синапсы вызывают более быстрые реакции, химические синапсы приводят к более сильным и сложным изменениям постсинаптической клетки. Например, холинергические синапсы помогают поддерживать когнитивные функции мозга (внимание, память).
Строение синапса
Все синапсы имеют несколько общих отделов:
Пресинаптическая мембрана:
специализированная область в аксоне дающей клетки, которая передает информацию дендриту принимающей клетки.
Синаптическая щель:
небольшое пространство в синапсе, которое принимает нейротрансмиттеры.
Рецепторы, сопряженные с G-белком:
они воспринимают сигналы вне клетки и тем самым активируют работу самого нейрона.
Ионные каналы:
рецепторы, которые открываются или закрываются в ответ на связывание нейротрансмиттера (например, ацетилхолина).
Постсинаптическая мембрана:
специализированная область в дендрите принимающей клетки, которая содержит рецепторы, предназначенные для обработки нейротрансмиттеров.
Механизм передачи информации: электрический синапс
Этапы электрической реакции в синапсе следующие:
Потенциал отдыха.
Если клетка не активна, с каждой стороны ее мембраны будет одинаковое количество отрицательных и положительных ионов. Причем, отрицательные (минусовые) ионы сконцентрированы внутри, положительные снаружи оболочки.
Деполяризация.
Поступающий сигнал приводит к изменению заряда на мембране, плюсовые ионы снаружи клетки через открывающиеся «дверцы» (ионные каналы) перетекают внутрь, из-за чего клетка возбуждается – меняется полярность – снаружи будет «минус», а внутри – «плюс». Этот процесс и передает сигнал от клетки к клетке.
Реполяризация.
Постепенно происходит обратный процесс – минусовые ионы возвращаются внутрь клетки, а плюсовые – на наружную часть.
Рефрактерная фаза.
Рефрактерная фаза — это короткий период времени после стадии реполяризации. Она нужна, чтобы клетка пришла в исходное состояние. Во время рефрактерной фазы конкретная область мембраны нервной клетки не может быть деполяризована; клетка не может быть возбуждена. Другими словами – она не передает новый сигнал.
Работа химического синапса
Особые свойства химических синапсов (например, ацетилхоинового) формируют другой принцип работы. Процесс химической реакции в синапсе имеет некоторые важные отличия от электрической реакции. Химические синапсы намного сложнее электрических, что делает их более медленными, но также позволяет им создавать более глобальные результаты. Так, они участвуют в двигательных актах, формировании когнитивных функциях.
Как и электрические реакции, работа химического синапса включают электрические модификации (смены плюса на минус и обратно) в области постсинаптической мембраны, но химические реакции также требуют для работы биохимических посредников, таких как нейротрансмиттеры. Разберем на примере ацетилхолинового синапса.
Основная химическая реакция в синапсе проходит несколько дополнительных этапов:
Потенциал действия (который возникает, как описано выше) проходит вдоль мембраны пресинаптической клетки, пока не достигнет синапса. Открываются специальные «дверцы», пропускающие только «плюсовые» ионы. Они проходят через пресинаптическую мембрану, быстро увеличивая свою концентрацию внутри.
Из-за накопления плюсовых ионов активируются белки, прикрепленные к везикулам (небольшие мембранные пузырьки, содержащие химический нейротрансмиттер – ацетилхолин). Эти белки изменяют форму, и открывают пузырьки, которые высвобождают ацетилхолин в синаптическую щель, узкое пространство между мембранами пре- и постсинаптических клеток.
Нейромедиатор проникает в щель. Он связывается с химическими рецепторными молекулами, расположенными на мембране постсинаптической клетки. Связывание нейромедиатора заставляет рецептор особым образом активироваться – возбуждаться (так как ацетилхолин возбуждающий медиатор).
Возможны несколько типов активации, в зависимости от того, какой нейромедиатор был выпущен. Бывают стимулирующие (возбуждающие) и тормозящие нейромедиаторы.
Глиатилин
После того, как ацетилхолин сделал свое дело, передал информацию к соседним клеткам, он либо всасывается обратно пресинаптической клеткой и переупаковывается для будущего высвобождения, либо метаболически расщепляется. То есть, с каждой передачей сигнала число ацетилхолина уменьшается. Чтобы синапсы работали без сбоев, организму нужно постоянное поступление холина. Если мозг работает усиленно, холина нужно еще больше. Поэтому, людям, которые испытывают большие умственные нагрузки, пережили инсульт или травмы мозга, стоит посоветовать препараты, которые пополняют запасы холина. Наиболее эффективным будет Глиатилин, он содержит. Это наиболее эффективный способ доставки холина в головной мозг.
Глиатилин — уникальный донатор ацетилхолина, который способен максимально сохранять ткань головного мозга в критический период. Это позволяет синапсам работать с максимальной отдачей.
Различия между электрическими и химическими синапсами
Электрические синапсы работают быстрее, чем химические, потому что рецепторам не нужно распознавать химические посланники. Синаптическая задержка для химического синапса обычно составляет около 2 миллисекунд, в то время как синаптическая задержка для электрического синапса может составлять около 0,2 миллисекунды. Поскольку электрические синапсы не связаны с нейротрансмиттерами, электрическая нейротрансмиссия меньше поддается модификации, чем химическая нейротрансмиссия. То есть, за счет электрических синапсов организм передает информацию быстро, но это самые простые данные. А за счет химических синапсов мозг обучается, формируется нейропластичность.
Нейронные сети
Нейронные сети состоят из ряда взаимосвязанных нейронов, образуют многочисленные синаптические связи и служат интерфейсом для нейронов, чтобы общаться друг с другом. Связи между нейронами образуют очень сложную сеть. Основными видами связи между нейронами являются химические синапсы и электрические щелевые соединения, посредством которых между нейронами передаются химические или электрические импульсы. Цепь, посредством которой нейроны взаимодействуют с соседними нейронами, обычно состоит из нескольких окончаний аксонов, соединяющихся через синапсы с дендритами других нейронов.
Если стимул создает достаточно сильный входной сигнал в нервной клетке, нейрон посылает потенциал действия и передает этот сигнал по своему аксону. Аксон нервной клетки отвечает за передачу информации на относительно большие расстояния, поэтому большинство нервных путей состоит из аксонов. Некоторые аксоны заключены в миелиновую оболочку, покрытую липидами, из-за чего они кажутся ярко-белыми; другие, у которых отсутствуют миелиновые оболочки (т.е. немиелинизированные), имеют более темный цвет, который обычно называют серым.
Нейроны взаимодействуют с другими нейронами, посылая сигнал или импульс вдоль своего аксона и через синапс к дендритам соседнего нейрона. Некоторые нейроны отвечают за передачу информации на большие расстояния.
Двигательные нейроны, которые перемещаются от спинного мозга к мышцам, у людей могут иметь аксоны длиной до метра. Самый длинный аксон в человеческом теле почти два метра в длину у высоких людей и проходит от большого пальца ноги до продолговатого мозга ствола мозга.
Сети, образованные взаимосвязанными группами нейронов, способны выполнять широкий спектр функций, включая обнаружение признаков, генерацию шаблонов и синхронизацию, запоминание, анализ и синтез информации. На самом деле сложно установить ограничения на типы обработки информации, которые могут выполняться нейронными сетями. Учитывая, что отдельные нейроны могут независимо генерировать сложные временные шаблоны активности, диапазон возможностей даже для небольших групп нейронов, находится за пределами нынешнего понимания. Однако мы знаем, что у нас есть нейронные сети, которые мы должны благодарить за большую часть наших когнитивных функций.
Понравилась статья? Оцените ее
1
0
0
14 Декабря 2017
Нейроны для «чайников»
Нейроны – особая группа клеток организма, распространяющих информацию по всему телу. Используя электрические и химические сигналы, они помогают мозгу координировать все жизненно необходимые функции.
Если упростить, задачи нервной системы – собрать сигналы, поступающие из окружающей среды или из организма, оценить ситуацию, принять решение, как на них отреагировать (например, изменить частоту сердечных сокращений), а также подумать о происходящем и запомнить это. Основной инструмент для выполнения этих задач – нейроны, сплетенные по всему организму сложной сетью.
По средним оценкам, количество нейронов в головном мозге составляет 86 миллиардов, каждый из них связан еще с 1000 нейронов. Это создает невероятную сеть взаимодействия. Нейрон – основная единица нервной системы.
Нейроны (нервные клетки) составляют около 10% мозга, остальное – глиальные клетки и астроциты, функция которых заключается в поддержании и питании нейронов.
Как выглядит нейрон?
В строении нейрона можно выделить три части:
· Тело нейрона (сома) – получает информацию. Содержит ядро клетки.
· Дендриты – короткие отростки, принимающие информацию от других нейронов.
· Аксон – длинный отросток, несет информацию от тела нейрона в другие клетки. Чаще всего аксон оканчивается синапсом (контактом) с дендритами других нейронов.
Схема строения нейрона (здесь и далее рисунки из Википедии).
Дендриты и аксоны называют нервными волокнами.
Аксоны сильно варьируют по длине, от нескольких миллиметров до метра и более. Самыми длинными являются аксоны спинномозговых ганглиев.
Типы нейронов
Классификацию нейронов можно провести по нескольким параметрам, например, по строению или выполняемой функции.
Типы нейронов в зависимости от функции:
· Эфферентные (двигательные) нейроны – несут информацию от центральной нервной системы (головного и спинного мозга) к клеткам других частей тела.
· Афферентные (чувствительные) нейроны – собирают информацию от всего организма и несут ее в центральную нервную систему.
· Вставочные нейроны – передают информацию между нейронами, чаще в пределах центральной нервной системы.
Как нейроны передают информацию?
Нейрон, получая информацию от других клеток, накапливает ее до тех пор, пока она не превысит определенный порог. После этого нейрон посылает по аксону электрический импульс – потенциал действия.
Потенциал действия формируется движением электрически заряженных частиц через мембрану аксона.
В состоянии покоя электрический заряд внутри нейрона отрицательный относительно окружающей его межклеточной жидкости. Эта разница называется мембранным потенциалом. Обычно он составляет 70 милливольт.
Когда тело нейрона получает достаточно заряда, и он «выстреливает», в соседнем участке аксона происходит деполяризация – мембранный потенциал быстро растет, а затем падает примерно за 1/1000 секунды. Этот процесс запускает деполяризацию соседнего участка аксона, и так далее, пока импульс не пройдет по всей длине аксона. После процесса деполяризации наступает гиперполяризация – кратковременное состояние отдыха, в этот момент передача импульса невозможна.

Потенциал действия чаще всего генерируют ионы калия (К+) и натрия (Na+), которые по ионным каналам перемещаются из межклеточной жидкости внутрь клетки и обратно, меняя заряд нейрона и делая его сначала положительным, а затем снижая его.
Потенциал действия обеспечивает работу клетки по принципу «все или ничего», то есть импульс или передается, или нет. Слабые сигналы будут накапливаться в теле нейрона до тех пор, пока их заряда не будет достаточно для передачи по отросткам.
Миелин
Миелин – это белое густое вещество, покрывающее большинство аксонов. Это покрытие обеспечивает электроизоляцию волокна и повышает скорость прохождения импульса по нему .
Миелинизированное волокно в сравнении с немиелинизированным.
Миелин вырабатывается шванновскими клетками на периферии и олигодендроцитами в центральной нервной системе. По ходу волокна миелиновая оболочка прерывается – это перехваты Ранвье. Потенциал действия перемещается от перехвата к перехвату, что обеспечивает быструю передачу импульса.
Такое распространенное и серьезное заболевание, как рассеянный склероз, вызвано разрушением миелиновой оболочки.
Как работают синапсы
Нейроны и ткани, которым они передают импульс, физически не соприкасаются, между клетками всегда существует пространство – синапс.
В зависимости от способа передачи информации, синапсы могут быть химическими и электрическими.
Химический синапс
После того как сигнал, передвигаясь по отростку нейрона, достигает синапса, происходит высвобождение химических веществ – нейромедиаторов (нейротрансмиттеров) в пространство между двумя нейронами. Это пространство называют синаптической щелью.
Схема строения химического синапса.
Нейромедиатор из передающего (пресинаптического) нейрона, попадая в синаптическую щель, взаимодействует с рецепторами на мембране принимающего (постсинаптического) нейрона, запуская целую цепь процессов.
Виды химических синапсов:
· глютаматэргический – медиатором является глютаминовая кислота, обладает возбуждающим эффектом на синапс;
· ГАМК-эргический – медиатором является гамма-аминомасляная кислота (ГАМК), обладает тормозящим эффектом на синапс;
· холинергический – медиатором является ацетилхолин, осуществляет нервно-мышечную передачу информации;
· адренергический – медиатором является адреналин.
Электрические синапсы
Электрические синапсы встречаются реже, распространены в центральной нервной системе. Клетки сообщаются посредством особых белковых каналов. Пресинаптическая и постсинаптическая мембраны в электрических синапсах расположены близко друг к другу, поэтому импульс способен проходить непосредственно от клетки к клетке.
Скорость передачи импульса по электрическим синапсам гораздо выше, чем по химическим, поэтому они расположены преимущественно в тех отделах, где необходима быстрая реакция, например, отвечающих за защитные рефлексы.
Еще одно отличие двух типов синапсов в направлении передачи информации: если химические синапсы могут передавать импульс только в одном направлении, то электрические в этом смысле универсальны.
Заключение
Нейроны – это, пожалуй, самые необычные клетки организма. Каждое действие, которое осуществляет тело человека, обеспечивается работой нейронов. Сложная нейронная сеть формирует личность и сознание. Они отвечают как за самые примитивные рефлексы, так и за самые сложные процессы, связанные с мышлением.
Аминат Аджиева, портал «Вечная молодость» http://vechnayamolodost.ru по материалам Medical News Today: Neurons: The basics.