Александра Коростышевская, Андрей Савелов, Ирина Приходько, Яна Исаева, Василий Ярных
«Наука из первых рук» № 3(88), 2020
С детства мы слышим, что нервные клетки не восстанавливаются. И хотя вопрос о возможности образования новых нейронов во взрослом мозге до сих пор открыт, уже есть данные, что процесс нейрогенеза у человека продолжается до глубокой старости. Любые нарушения в развитии нервных клеток могут приводить к серьезным, иногда необратимым патологиям. Одним из таких нарушений являются дефекты в защитной изоляционной оболочке (миелине) отростков нервных клеток, которые могут формироваться у человека еще до его рождения. Их практически невозможно диагностировать с помощью традиционных методов визуализации.
Об авторах
|
Александра Михайловна Коростышевская — доктор медицинских наук, ведущий научный сотрудник лаборатории МРТ-технологий, заведующая диагностическим отделением института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 70 научных работ. |
|
Андрей Александрович Савелов — кандидат физико-математических наук, старший научный сотрудник лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор более 90 научных работ. |
|
Ирина Юрьевна Приходько — инженер-программист лаборатории МРТ-технологий института «Международный томографический центр» Сибирского отделения РАН. Автор и соавтор 3 научных работ. |
|
Яна Олеговна Исаева — студентка Института медицины и психологии им. В. Зельмана Новосибирского государственного университета. |
|
Василий Леонидович Ярных — кандидат химических наук, заведующий лабораторией отделения радиологии, профессор университета Вашингтона (Сиэтл, США) и Томского государственного университета. Автор и соавтор более 70 научных работ, в том числе 5 патентов. |
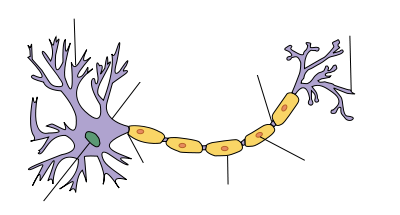
В мозге человека в среднем содержится около 100 млрд нейронов, которые принимают, хранят, обрабатывают и передают информацию с помощью электрических и химических сигналов. Взаимодействие между нейроном и другими нервными клетками и органами происходит с помощью коротких (дендриты) и длинного (аксон) отростков.
Каждый аксон, подобно проводу, покрыт изоляционным материалом — миелиновой оболочкой, которая обеспечивает более высокую скорость прохождения нервных импульсов и защищает нервные волокна от повреждений. Кроме того, эта оболочка несет опорную функцию, а также, по последним данным, служит для аксона, нуждающегося в большом количестве энергии, своего рода «заправочной станцией».
Все повреждения миелиновой оболочки или дефекты, возникшие в период ее формирования, приводят к серьезным, иногда неизлечимым заболеваниям. Среди них наиболее известен рассеянный склероз — хроническое аутоиммунное заболевание, поражающее преимущественно молодых людей.
Разрушается миелин и при инсультах, которые встречаются не только у взрослых (в первую очередь, как принято считать, у пожилых людей), но и у детей, включая нерожденных. Внутриутробный инсульт чаще всего случается после 28-й недели беременности, у детей — через месяц после рождения. Инсульт у плода приводит к развитию пороков головного мозга, а у детей может вызвать детский церебральный паралич в раннем возрасте.
При этом о «качестве» миелинизации головного мозга конкретного человека мы сегодня судим лишь по косвенным клиническим симптомам или данным магнитно-резонансной томографии (МРТ), с помощью которой обычно удается обнаруживать дефекты миелина уже на поздней, часто необратимой стадии.
Дефекты нервной «изоляции»
Развитие мозга плода — сложный процесс, при котором происходят быстрые перестройки морфологии и микроструктуры нервной ткани. В некоторых зонах мозга процесс формирования миелина начинается уже с 18–20-й недели беременности, а продолжается приблизительно до десятилетнего возраста.
Именно нарушения миелинизации часто лежат в основе задержек физического и умственного развития ребенка, а также служат причиной формирования ряда неврологических и психиатрических патологий. Помимо заболеваний, таких как инсульт, задержки развития головного мозга плода с нарушением миелинизации иногда наблюдаются и при многоплодной беременности. При этом десинхронизацию в развитии мозга близнецов оценить «на глаз» довольно сложно.
Но как выявить дефекты миелина в период внутриутробного развития? В настоящее время акушеры-гинекологи пользуются только биометрическими показателями (например, размером мозга), однако они обладают высокой изменчивостью и не дают полной картины. В педиатрии даже при наличии явных функциональных отклонений в мозговой деятельности ребенка традиционные изображения МРТ или нейросонографии (ультразвукового исследования головного мозга новорожденных) часто не показывают структурные отклонения.
Поэтому поиск точных количественных критериев оценки формирования миелина во время беременности является актуальной задачей, которую к тому же нужно решить с помощью неинзвазивных диагностических методов, уже апробированных в акушерстве. Специалисты из новосибирского Международного томографического центра СО РАН предложили использовать для этих целей новый метод количественной нейровизуализации, уже адаптированный для дородовых (пренатальных) исследований.
На обычном томографе
Любая патология головного мозга плода, которую подозревают врачи во время ультразвукового обследования беременной, обычно является показанием к проведению МРТ; подобные исследования проводятся в МТЦ СО РАН уже более десяти лет. Результаты МРТ могут подтвердить, уточнить, опровергнуть либо вообще изменить предварительный диагноз и, соответственно, тактику ведения беременности.
Дело в том, что количество миелина и размеры отдельных структур головного мозга у эмбриона настолько малы, что любые измерения очень сложны и трудоемки. К тому же плод постоянно шевелится, что очень затрудняет получение качественных изображений и достоверных количественных данных. Поэтому нужна технология, позволяющая получать изображения быстро и с высокой разрешающей способностью даже на маленьких объектах.
Именно таким оказался метод быстрого картирования макромолекулярной протонной фракции (МПФ) — биофизического параметра, который описывает долю протонов в макромолекулах тканей, вовлеченных в формирование МРТ-сигнала, тогда как обычно источником сигнала являются протоны, содержащиеся в воде (Yarnykh, 2012; Yarnykh et al., 2015).
В основе метода лежит специализированная процедура математической обработки МРТ-изображений, которая позволяет вычленить компоненты сигнала, связанные с МПФ клеточных мембран. А в головном мозге человека и животных основная их часть содержится именно в миелине. Реконструируются карты МПФ на основе исходных данных, которые могут быть получены практически на любом клиническом томографе.
Для реконструкции карт МПФ используются четыре исходных изображения, полученные различными традиционными методами МРТ. Правильность такого подхода подтвердили результаты его апробации на лабораторных животных в Томском государственном университете: у мышей, которым вводили раствор, вызывающий разрушение миелина, результаты МПФ-картирования совпали с данными гистологического исследования тканей (Khodanovich et al., 2017).
Миелин — в норме и патологии
Пилотные исследования, выполненные в рамках клинических диагностических МРТ-обследований эмбрионов возрастом от 20 недель и старше, показали, что новая технология позволяет за небольшое (менее 5 мин.) время сканирования выявить очень малые количества миелина.
Они также подтвердили способность метода надежно оценивать пространственно-временные «траектории развития» миелина в различных структурах мозга. Судя по результатам исследования, в центральных структурах (стволовых, таламусе, мозжечке) процесс миелинизации начинается раньше, а ее степень пропорциональна возрасту. При этом в белом веществе полушарий головного мозга миелин в дородовом периоде практически не обнаруживается (Yarnykh, Prihod’ko, Savelov et al., 2018). Полученные новым неивазивным методом результаты хорошо согласуются с уже известными патоморфологическими данными.
Кроме того, оказалось, что изображения, полученные с помощью новой технологии, являются наиболее информативными для внутриутробной диагностики одного из видов медуллобластомы — врожденной злокачественной опухоли мозжечка. У плода опухоль не удалось отчетливо выявить с помощью традиционного МРТ-обследования, однако она хорошо прослеживалась с использованием количественного метода МПФ.
Дело в том, что у плода показатель МПФ для ткани медуллобластомы вдвое выше значений для окружающей здоровой ткани из-за более высокого содержания в опухоли фибриллярного белка коллагена соединительной ткани, которая широко представлена в этом виде опухоли. После рождения и до полутора лет эти различия сглаживались из-за нарастающей миелинизации мозжечка, в то время как значения МПФ в опухоли оставались практически неизменными.
Эти результаты говорят о том, что диагностическая значимость метода МПФ наиболее высока именно во внутриутробном периоде. И это очень важно, так как после рождения ребенка арсенал МРТ (в том числе с использованием контрастирующих средств), который позволяет визуализировать все детали злокачественного поражения, значительно расширяется (Korostyshevskaya, Savelov, Papusha et al., 2018).
В течение последнего десятилетия для изучения внутриутробного периода созревания мозга использовались различные количественные методы МРТ. Но оказалось, что среди всех известных на сегодня методов наиболее чувствительным к содержанию миелина в мозге взрослого человека и плода оказался метод картирования МПФ.
С его помощью новосибирским специалистам впервые удалось разработать количественные критерии нормальной внутриутробной миелинизации, на основании которых можно оценить своевременность формирования внутренней структуры мозга от второго триместра до рождения ребенка. Эти критерии в дальнейшем можно использовать в клинической практике. Кроме того, в некоторых случаях новый метод помогает диагностировать врожденный порок развития головного мозга еще до рождения, что бывает затруднительно с использованием только традиционных методов МРТ.
Исследование поддержано Министерством образования и науки Российской Федерации (госзадание 18.2583.2017/4.6.), Российским научным фондом (проект № 19-75-20142) и Национальными институтами здравоохранения США (National Institutes of Health, NIH).
Литература
1. Коростышевская А. М., Савелов А. А., Цыденова Д. В и др. Количественный анализ структурной зрелости головного мозга плода по данным диффузионно-взвешенной МРТ // Вест. Новосиб. гос. ун-та. Серия: Биология, клиническая медицина. 2015. Т. 13. № 4. С. 27–32.
2. Коростышевская А. М., Василькив Л. М., Цыденова Д. В. и др. Количественный анализ пре- и постнатальной структурной зрелости головного мозга в норме и при вентрикуломегалии по данным диффузионно-взвешенной МРТ // Мультидисциплинарный научный журнал «Архивариус». 2016. Т. 22. № 10(14). С. 33–41.
3. Korostyshevskaya A. M., Prihod’ko I. Y., Savelov A. A. et al. Direct comparison between apparent diffusion coefficient and macromolecular proton fraction as quantitative biomarkers of the human fetal brain maturation // J. Magn. Reson. Imaging. 2019. N. 50. P. 52–61. DOI: 10.1002/jmri.26635.
4. Korostyshevskaya A. M., Savelov A. A., Papusha L. I. et al. Congenital medulloblastoma: fetal and postnatal longitudinal observation with quantitative MRI // Clinical imaging. 2018. N. 52. P. 172–176.
5. Yarnykh V., Korostyshevskaya A. Implementation of fast macromolecular proton fraction mapping on 1.5 and 3 Tesla clinical MRI scanners: preliminary experience // J. Phys.: Conf. Ser. 2017. V. 886. P. 1–5.
6. Yarnykh V. L., Savelov A., Prihod’ko I. Y. et al. Quantitative assessment of normal fetal brain myelination using fast macromolecular proton fraction mapping // Am. J. of Neuroradiology. 2018. V. 39(7). P. 1341–1348.
Нормальная миелинизация
Основа формирования нормальной миелинизации изложенное Барковичем – ее начало на 5 месяце эмбрионального периода и продолжение в течение всей жизни. Миелинизация начинается с черепных нервов, что имеет смысл, поскольку чувствительность необходима для выживания. Так же стоит учитывать, что миелинизация структур происходит в направлении снизу вверх, от задних структур к передним и от центра к периферии. Логично, что ствол мозга и мозжечок миелинизируются раньше полушарий, а базальные ядра и таламус – раньше белого вещества. Кроме того, задняя ножка внутренней капсулы миелинизируется раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов.
Профессор Серена Каунселл с коллегами описали миелинизацию у сильно недоношенных новорожденных и подтвердили миелинизацию червя мозжечка, вестибулярных ядер, ножек мозжечка, зубчатых ядер, медиального продольного пучка, медиальных коленчатых тел, субталамических ядер, нижних ядер оливы, вентролатеральных ядер таламуса, медиальной и латеральной петель, нижних холмов четверохолмия, а также клиновидного и тонкого пучков. Исследователи не обнаружили никаких новых сайтов миелинизации между 28 и 36 неделями, после чего снова появились новые миелиновые участки в задней ножке внутренней капсулы, лучистом венце и кортикоспинальных трактах предцентральной и постцентральной извилины.
Гистологические исследования демонстрируют миелинизацию при рождении в стволе мозга, белом веществе мозжечка и задней ножке внутренней капсулы с распространением на таламус и базальные ганглии.
Профессор Берд с коллегами проанализировали 60 пациентов и обнаружили значительные различия в скорости и начале появления изменений, связанных с миелинизацией. Исследователи изучали сайты-маркеры для определенных возрастов при определении нормального миелина. Так, при рождении наблюдалась миелинизация задней ножки внутренней капсулы, ножек мозжечка и лучистого венца вокруг центральной борозды. Исследователи снова последовательно подтвердили сроки миелинизации: в задней ножке раньше передней, валик мозолистого тела раньше колена, а центральные участки лучистого венца – раньше субкортикальных регионов у всех субъектов.
Томас Паус (2001) описал 3 паттерна развития, наблюдаемые в отношении дифференциации серого-белого вещества в первые 12-24 месяца жизни.
- младенческий паттерн – менее чем за 6 месяцев; картина, противоположная картине взрослого мозга,
- изометрический паттерн (8-12 месяцев), в котором наблюдается плохая дифференциация между серым и белым веществом
- ранний взрослый паттерн (более 12 месяцев), в которых сигнал от серого вещества выше, чем от белого, на Т2-ВИ и ниже на Т1-ВИ.
Валик мозолистого тела миелинизируется примерно к 3 месяцу, тело – к 4-5 месяцу, а колено – к 6 месяцу. На протяжении развития (в первый год) наблюдаются изменения и в форме, и в толщине. У новорожденного утолщение начинается с колена (со 2-3 месяца), затем утолщается валик (с 5-6 месяца), достигая толщины колена к 7 месяцу. Мозолистое тело увеличивается до 12 месяца. На Т1-ВИ валик мозолистого тела имеет повышенную интенсивность сигнала в 4 месяца, когда как колено – в 5-6 месяцев.
Терминальные зоны миелинизации
Последней зоной миелинизации на МРТ является перитригональная зона. Эта область поддерживает постоянную гиперинтенсивность на T2-ВИ, но не интенсивнее серого вещества. Параццини с коллегами описали терминальные зоны миелинизации в лобно-теменных субкортикальных регионах. Было показано, что данная область характеризуется гиперинтенсивным сигналом на Т2-ВИ в течение первых 36-40 месяцев жизни. Что касается идиопатической задержки развития, Маричич с коллегами изучили 93 ребенка и не обнаружил определенных доказательств корреляции между идиопатической задержкой развития и задержкой при миелинизации на Т2-взвешенных изображениях.
Нервная система выполняет важнейшие функции в организме. Она отвечает за все действия и мысли человека, формирует его личность. Но вся эта сложная работы была бы невозможна без одной составляющей — миелина.
Миелин – это вещество, образующее миелиновую (мякотную) оболочку, которая отвечает за электроизоляцию нервных волокон и скорость передачи электрического импульса.
Анатомия миелина в строении нерва
Главная клетка нервной системы – нейрон. Тело нейрона называется сома. Внутри нее находится ядро. Тело нейрона окружено короткими отростками, которые называются дендриты. Они отвечают за связь с другими нейронами. От сомы отходит один длинный отросток – аксон. Он несет импульс от нейрона к другим клеткам. Чаще всего на конце он соединяется с дендритами других нервных клеток.
Всю поверхность аксона покрывает миелиновая оболочка, которая представляет собой отросток клетки Шванна, лишенный цитоплазмы. По сути, это несколько слоев клеточной мембраны, обернутые вокруг аксона.
Шванновские клетки, обволакивающие аксон, разделяются перехватами Ранвье, в которых отсутствует миелин.
Функции
Основными функциями миелиновой оболочки являются:
- изоляция аксона;
- ускорение проведения импульса;
- экономия энергии за счет сохранения ионных потоков;
- опора нервного волокна;
- питание аксона.
Как работают импульсы
Нервные клетки изолированы благодаря своей оболочке, но все же взаимосвязаны между собой. Участки, в которых клетки соприкасаются, называются синапсы. Это место, где встречаются аксон одной клетки и сома или дендрит другой.
Электрический импульс может передаваться внутри одной клетки или от нейрона к нейрону. Это сложный электрохимический процесс, который основан на перемещении ионов через оболочку нервной клетки.
В спокойном состоянии внутрь нейрона попадают только ионы калия, а ионы натрия остаются снаружи. В момент возбуждения они начинаются меняться местами. Аксон положительно заряжается изнутри. Затем натрий перестает поступать через мембрану, а отток калия не прекращается.
Изменение напряжения из-за движения ионов калия и натрия называется «потенциал действия». Он распространяется медленно, но миелиновая оболочка, обволакивающая аксон, ускоряет это процесс, препятствуя оттоку и притоку ионов калия и натрия из тела аксона.
Проходя через перехват Ранвье, импульс перескакивает с одного участка аксона на другой, что и позволяет ему двигаться быстрее.
После того, как потенциал действия пересекает разрыв в миелине, импульс останавливается, и возвращается состояние покоя.
Такой способ передачи энергии характерен для ЦНС. Что касается вегетативной нервной системы, в ней часто встречаются аксоны, покрытые малым количеством миелина или вообще не покрытые им. Скачки между шванновскими клетками не осуществляются, и импульс проходит гораздо медленнее.
Состав
Миелиновый слой состоит из двух слоев липидов и трех слоев белка. Липидов в нем гораздо больше (70-75%):
- фосфолипиды (до 50%);
- холестерин (25%);
- глактоцереброзид (20%) и др.
Большое содержание жиров обусловливает белый цвет миелиновой оболочки, благодаря чему нейроны, покрытые ей, называются «белым веществом».
Белковые слои тоньше липидных. Содержание белка в миелине – 25-30%:
- протеолипид (35-50%);
- основной белок миелина (30%);
- белки Вольфграма (20%).
Существуют простые и сложные белки нервной ткани.
Роль липидов в строении оболочки
Липиды играют ключевую роль в строении мякотной оболочки. Они являются структурным материалом нервной ткани и защищают аксон от потери энергии и ионных потоков. Молекулы липидов обладают способностью восстанавливать ткани мозга после повреждений. Липиды миелина отвечают за адаптацию зрелой нервной системы. Они выступают в роли рецепторов гормонов и осуществляют коммуникацию между клетками.
Роль белков
Немаловажное значение в строении миелинового слоя имеют молекулы белков. Они наряду с липидами выступают в роли строительного материала нервной ткани. Их главной задачей является транспортировка питательных веществ в аксон. Также они расшифровывают сигналы, поступающие в нервную клетку и ускоряют реакции в ней. Участие в обмене веществ – важная функция молекул белка миелиновой оболочки.
Дефекты миелинизации
Разрушение миелинового слоя нервной системы – очень серьезная патология, из-за которой происходит нарушение передачи нервного импульса. Она вызывает опасные заболевания, зачастую несовместимые с жизнью. Существуют два типа факторов, влияющие на возникновение демиелинизации:
- генетическая предрасположенность к разрушению миелина;
- воздействие на миелин внутренних или внешних факторов.
- Демиелизация делится на три вида:
- острая;
- ремиттирующая;
- острая монофазная.
Почему происходит разрушение
Наиболее частыми причинами разрушения мякотной оболочки являются:
- ревматические болезни;
- существенное преобладание белков и жиров в питании;
- генетическая предрасположенность;
- бактериальные инфекции;
- отравление тяжелыми металлами;
- опухоли и метастазы;
- продолжительные сильные стрессы;
- плохая экология;
- патологии иммунной системы;
- длительный прием нейролептиков.
Заболевания вследствие демиелинизации
Демиелинизирующие заболевания центральной нервной системы:
- Болезнь Канавана – генетическое заболевание, возникающее в раннем возрасте. Его характеризуют слепота, проблемы с глотанием и приемом пищи, нарушение моторики и развития. Также следствием этой болезни являются эпилепсия, макроцефалия и мышечная гипотония.
- Болезнь Бинсвангера. Чаще всего вызвана артериальной гипертонией. Больных ожидают расстройства мышления, слабоумие, а также нарушения ходьбы и функций тазовых органов.
- Рассеянный склероз. Может вызвать поражения нескольких частей ЦНС. Ему сопутствуют парезы, параличи, судороги и нарушение моторики. Также в качестве симптомов рассеянного склероза выступают поведенческие расстройства, ослабление лицевых мышц и голосовых связок, нарушение чувствительности. Зрение нарушается, меняется восприятие цвета и яркости. Рассеянный склероз также характеризуется расстройствами тазовых органов и дистрофией ствола мозга, мозжечка и черепных нервов.
- Болезнь Девика – демиелинизация в зрительном нерве и спинном мозге. Болезнь характеризуют нарушения координации, чувствительности и функций тазовых органов. Ее отличают серьезные нарушения зрения и даже слепота. В клинической картине также наблюдаются парезы, мышечная слабость и вегетативная дисфункция.
- Синдром осмотической демиелинизации. Возникает из-за недостатка натрия в клетках. Симптомами выступают судороги, нарушения личности, потери сознания вплоть до комы и смерти. Следствием заболевания являются отек головного мозга, инфаркт гипоталамуса и грыжа ствола мозга.
- Миелопатии – различные дистрофические изменения в спинном мозге. Их характеризуют мышечные нарушения, сенсорные расстройства и дисфункция тазовых органов.
- Лейкоэнцефалопатия – разрушение миелиновой оболочки в подкорке головного мозга. Больных мучают постоянная головная боль и эпилептические припадки. Также наблюдаются нарушения зрения, речи, координации и ходьбы. Снижается чувствительность, наблюдаются расстройства личности и сознания, прогрессирует слабоумие.
- Лейкодистрофия – генетическое нарушение метаболизма, вызывающее разрушение миелина. Течение болезни сопровождают мышечные и двигательные расстройства, параличи, нарушение зрения и слуха, прогрессирующее слабоумие.
Демиелинизирующие заболевания периферической нервной системы:
- Синдром Гийена-Барре – острая воспалительная демиелинизация. Она характеризуется мышечными и двигательными нарушениями, дыхательной недостаточностью, частичным или полным отсутствием сухожильных рефлексов. Больные страдают заболеваниями сердца, нарушением работы пищеварительной системы и тазовых органов. Парезы и нарушения чувствительности так же являются признаками этого синдрома.
- Невральная амиотрофия Шарко-Мари-Тута – наследственная патология миелиновой оболочки. Ее отличают нарушения чувствительности, дистрофия конечностей, деформация позвоночника и тремор.
Это лишь часть заболеваний, возникающих из-за разрушения миелинового слоя. Симптомы в большинстве случаев схожи. Точный диагноз можно поставить лишь после проведения компьютерной или магнитно-резонансной томографии. Немаловажную роль в постановке диагноза играет уровень квалификации врача.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
Прогноз по заболеваниям
В настоящее время лечение демиелинизации не дает стопроцентного результата, но учеными активно ведутся разработки лекарственных средств, направленных на восстановление мякотной оболочки. Исследования проводятся по следующим направлениям:
- Стимуляция олигодендроцитов. Это клетки, производящие миелин. В организме, пораженном демиелинизацией, они не работают. Искусственная стимуляция этих клеток поможет запустить процесс восстановления разрушенных участков миелиновой оболочки.
- Стимуляция стволовых клеток. Стволовые клетки могут превращаться в полноценную ткань. Есть вероятность, что они могут заполнять и мякотную оболочку.
- Регенерация гематоэнцефалического барьера. При демиелинизации этот барьер разрушается и позволяет лимфоцитам негативно влиять на миелин. Его восстановление защищает миелиновый слой от атаки иммунной системы.
Возможно, в скором времени заболевания, связанные с разрушением миелина, перестанут быть неизлечимыми.
У нервных клеток есть два вида отростков — небольшие и чрезвычайно разветвлённые дендриты, с помощью которых нейрон собирает импульсы от других нервных клеток, и очень длинные аксоны, которые отправляют импульсы дальше. Почти все аксоны в центральной нервной системе (то есть в головном и спинном мозге) покрыты миелином — светлой субстанцией, состоящей преимущественно из липидов. Миелинизированных нервных волокон также много в периферической нервной системе, то есть в нервах, которые выходят из головного и спинного мозга и идут к другим органам.
Олигодендроцит и миелиновая оболочка. Один олигодендроцит формирует миелиновую оболочку сразу на нескольких аксонах, но на каждом из них он создаёт только один сегмент оболочки (от одного перехвата Ранвье до другого). Иллюстрация: Holly Fischer/Wikimedia Commons/CC BY 3.0.
‹
›
Миелин одновременно ускоряет электрохимические импульсы, бегущие по аксонам, и изолирует их друг от друга, не допуская «короткого замыкания» между нейронными «проводами». Чтобы понять, как миелин ускоряет импульсы, нужно вспомнить, что любой импульс в нейроне — это перегруппировка ионов между наружной и внутренней стороной клеточной мембраны. Когда на каком-то участке мембраны открываются ионные каналы, то такие же ионные потоки сразу открываются на соседнем участке мембраны, потом — на участке чуть подальше и т. д. Электрические свойства мембраны последовательно меняются вдоль нейронного отростка — это и есть бегущий импульс. Миелин окутывает аксоны не всплошную с начала и до конца. В миелиновой обмотке есть пробелы, где мембрана не покрыта миелином, — перехваты Ранвье (названные так в честь открывшего их французского физиолога Луи Антуана Ранвье). И когда импульс распространяется по аксону, то перегруппировка ионов происходит как раз на перехватах Ранвье. То есть импульс не переползает медленно между участками, которые находятся вплотную друг к другу, а скачет от одного перехвата к другому. И если в аксоне без миелина импульс бежит со скоростью 0,5—10 м/с, то в таком же аксоне, но с миелином, скорость импульса достигает 150 м/с.
Скопления аксонов, обмотанных миелином, выглядят светлее, поэтому области в мозге, где преобладают аксонные «провода», называют белым веществом. (Скопления дендритов, которые обходятся без миелина, образуют серое вещество. Поскольку дендриты намного короче аксонов, они не передают импульсы на большие расстояния и скорость для них не так важна.) Нейроны не сами вырабатывают миелин, для того есть специальные клетки — олигодендроциты в центральной нервной системе и шванновские клетки в периферических нервах. И те и другие относятся к глие, или нейроглие — так называют совокупность различных клеток нервной системы, которые обслуживают нейроны, создавая им условия для работы. В последнее время появляется всё больше данных о том, что глиальные клетки не просто обслуживают нейроны, но напрямую вмешиваются в их работу (см. статью «Иммунные ”электрики” мозга», «Наука и жизнь» № 8, 2020 г.). Задача олигодендроцитов и шванновских клеток — сделать нейронам миелиновую обмотку. Олигодендроцит или шванновская клетка выпячивают собственную мембрану и обхватывают аксон, мембрана нарастает — и в итоге вокруг аксона получается слоистый липидный рулон. Глиальная клетка остаётся живой и поддерживает целостность миелиновой обмотки на том участке аксона, за который она отвечает.
Разрушение миелиновой оболочки приводит к неврологическим симптомам различного вида и различной степени тяжести. Есть много заболеваний, связанных с утратой миелина на аксонах, и рассеянный склероз среди них — самое известное. Это одна из аутоиммунных болезней, когда иммунитет по какой-то причине атакует собственные клетки и молекулы организма. При рассеянном склерозе срабатывают разные иммунные механизмы, в которых участвуют как иммунные клетки мозга, так и иммунные клетки, вошедшие в мозг из крови. Но, так или иначе, заканчивается всё тем, что миелиновая оболочка вокруг аксонов разрушается, а иногда разрушаются и сами аксоны. В очаг болезни приходят астроциты — так называется ещё одна разновидность глиальных клеток. Их задача — поддерживать и питать нейроны, а также залечивать повреждения; именно это они и делают, стараясь зарубцевать больной участок и формируя характерную бляшку. Стоит добавить, что обычно рассеянный склероз поражает центральную нервную систему; периферические нервы страдают от него редко.
Assessment |
Biopsychology |
Comparative |
Cognitive |
Developmental |
Language |
Individual differences |
Personality |
Philosophy |
Social |
Methods |
Statistics |
Clinical |
Educational |
Industrial |
Professional items |
World psychology |
Biological:
Behavioural genetics ·
Evolutionary psychology ·
Neuroanatomy ·
Neurochemistry ·
Neuroendocrinology ·
Neuroscience ·
Psychoneuroimmunology ·
Physiological Psychology ·
Psychopharmacology
(Index, Outline)
| Myelin sheath |
|---|
|
Dendrite Soma Axon Nucleus Node of Axon Terminal Schwann cell Myelin sheath |
| Structure of a typical neuron |
Myelin is a dielectric (electrically insulating) material that forms a layer, the myelin sheath, usually around only the axon of a neuron. It is essential for the proper functioning of the nervous system. Myelin is an outgrowth of a glial cell: Schwann cells supply the myelin for peripheral neurons, whereas oligodendrocytes, specifically of the interfascicular type, myelinate the axons of the central nervous system. Myelin is considered a defining characteristic of the (gnathostome) vertebrates, but it has also arisen by parallel evolution in some invertebrates.[1] Myelin was discovered in 1854 by Rudolf Virchow [2].
Composition of myelin
Myelin made by different cell types varies in chemical composition and configuration, but performs the same insulating function. Myelinated axons are white in appearance, hence the «white matter» of the brain.
Myelin is composed of about 80% lipid and about 20% protein. Some of the proteins that make up myelin are myelin basic protein (MBP), myelin oligodendrocyte glycoprotein (MOG), and proteolipid protein (PLP). Myelin is made up primarily of a glycolipid called galactocerebroside. The intertwining of the hydrocarbon chains of sphingomyelin serve to strengthen the myelin sheath.
Function of myelin layer
File:Myelinated neuron.jpg Transmission electron micrograph of a myelinated axon. Generated at the Electron Microscopy Facility at Trinity College, Hartford, CT.
The main purpose of a myelin layer (or sheath) is to increase in the speed at which impulses propagate along the myelinated fiber. Along unmyelinated fibers, impulses move continuously as waves, but, in myelinated fibers, they hop or «propagate by saltation.» Myelin increases electrical resistance across the cell membrane by a factor of 5,000 and decreases capacitance by a factor of 50.[How to reference and link to summary or text] Thus, myelination helps prevent the electrical current from leaving the axon.
When a peripheral fiber is severed, the myelin sheath provides a track along which regrowth can occur. Unmyelinated fibers and myelinated axons of the mammalian central nervous system do not regenerate.
Demyelination and dysmyelination
- Further information: Demyelinating disease
Demyelination is the loss of the myelin sheath insulating the nerves, and is the hallmark of some neurodegenerative autoimmune diseases, including multiple sclerosis, acute disseminated encephalomyelitis, transverse myelitis, chronic inflammatory demyelinating polyneuropathy, Guillain-Barré Syndrome, central pontine myelinosis, inherited demyelinating diseases such as Leukodystrophy, and Charcot Marie Tooth. Sufferers of pernicious anaemia can also suffer nerve damage if the condition is not diagnosed quickly. Sub-acute combined degeneration of the spinal cord secondary to pernicious anaemia can lead to anything from slight peripheral nerve damage to severe damage to the central nervous system affecting speech, balance and cognitive awareness. When myelin degrades, conduction of signals along the nerve can be impaired or lost and the nerve eventually withers.
The immune system may play a role in demyelination associated with such diseases, including inflammation causing demyelination by overproduction of cytokines via upregulation of tumor necrosis factor (TNF)[3] or interferon.
Research to repair damaged myelin sheaths is ongoing. Techniques include surgically implanting oligodendrocyte precursor cells in the central nervous system and inducing myelin repair with certain antibodies. While there have been some encouraging results in mice (via stem cell transplantation), it is still unknown whether this technique can be effective in replacing myelin loss in humans.[4]
Symptoms of demyelination
Demyelination (i.e., the destruction or loss of the myelin sheath) results in diverse symptoms determined by the functions of the affected neurons. It disrupts signals between the brain and other parts of the body; symptoms differ from patient to patient, and have different presentations upon clinical observation and in laboratory studies.
Typical symptoms include:
- blurriness in the central visual field that affects only one eye; may be accompanied by pain upon eye movement;
- double vision;
- odd sensation in legs, arms, chest, or face, such as tingling or numbness (neuropathy);
- weakness of arms or legs;
- cognitive disruption including speech impairment and memory loss;
- heat sensitivity (symptoms worsen, reappear upon exposure to heat such as a hot shower);
- loss of dexterity;
- difficulty coordinating movement or balance disorder;
- difficulty controlling bowel movements or urination;
- fatigue.
It is associated with the following conditions:
|
v·d·e Multiple sclerosis and other demyelinating diseases of CNS (G35–G37, 340–341) |
||||
|---|---|---|---|---|
| Signs and symptoms |
|
|||
| Diagnosis and evolution following |
|
|||
| Investigation |
|
|||
| Treatment |
|
|||
| Borderline forms |
(Guillain-Barré syndrome and CIDP are PNS) |
|||
| Other |
|
|||
| {| class=»navbox collapsible nowraplinks» style=»margin:auto; » | ||||
|
[. v]·[. d]·[. e]
|
||||
|
|}
Dysmyelination
Dysmyelination is characterized by a defective structure and function of myelin sheaths; unlike demyelination, it does not produce lesions. Such defective sheaths often arise from genetic mutations affecting the biosynthesis and formation of myelin. The shiverer mouse represents one animal model of dysmyelination. Human diseases where dysmyelination has been implicated include leukodystrophies (Pelizaeus–Merzbacher disease, Canavan disease, phenylketonuria) and schizophrenia.[5][6][7]
Remyelination
- Main article: Remyelination
Remyelination is a term for the re-generation of the nerve’s myelin sheath, damaged in many diseases such as multiple sclerosis (MS) and the leukodystrophies.
Myelin repair
Research to repair damaged myelin sheaths is ongoing. Techniques include surgically implanting oligodendrocyte precursor cells in the central nervous system and inducing myelin repair with certain antibodies. While results in mice have been encouraging (via stem cell transplantation), whether this technique can be effective in replacing myelin loss in humans is still unknown.[8] Cholinergic treatments, such as acetylcholinesterase inhibitors (AChEIs), may have beneficial effects on myelination, myelin repair, and myelin integrity. Increasing cholinergic stimulation also may act through subtle trophic effects on brain developmental processes and particularly on oligodendrocytes and the lifelong myelination process they support. By increasing oligodendrocyte cholinergic stimulation, AChEIs, and other cholinergic treatments, such as nicotine, possibly could promote myelination during development and myelin repair in older age.[9]
Glycogen synthase kinase 3β inhibitors such as Lithium Chloride have been found to promote myelination in mice with damaged facial nerves[10]
See also
- The Myelin Project, project to re-generate myelin
- Myelinogenesis, order of myelination of central nervous system.
- Myelinopathies
- Myelin Repair Foundation, a non-profit medical research foundation accelerating drug discovery in myelin repair for multiple sclerosis.
References
- ↑ Invertebrate Myelin
- ↑ [Virchow R (1854) Über das ausgebreitete Vorkommen einer dem Nervenmark analogen Substanz in den tierischen Geweben. Virchows Arch. Pathol. Anat. 6:562-572.]
- ↑ [1] Ledeen R.W., Chakraborty G., «Cytokines, Signal Transduction, and Inflammatory Demyelination: Review and Hypothesis» Neurochemical Research, Volume 23, Number 3, March 1998, pp. 277-289(13)
- ↑ [2] FuturePundit January 20, 2004
- ↑ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia. J. Neurosci. 26 (45): 11743–52.
- ↑ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). Canavan disease: studies on the knockout mouse. Adv. Exp. Med. Biol. 576: 77–93; discussion 361–3.
- ↑ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia. Int. J. Neuropsychopharmacol. 10 (4): 557–63.
- ↑ [3] FuturePundit January 20, 2004
- ↑ Bartzokis, G (2007-08-15). Acetylcholinesterase inhibitors may improve myelin integrity.. Biological Psychiatry 62 (4): 294–301.
- ↑ Makouji J, Belle M, Meffre D, Stassart R, Grenier J, Shackleford G G, Fledrich R, Fonte C, Branchu J, Goulard M, de Waele C, Charbonnier F, Sereda M W, Baulieu E, Schumacher M, Bernard S, Massad C. Lithium enhances remyelination of peripheral nerves. Proceedings of the National Acadmey of Sciences of the United States of America.
- Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA. (2006 Nov 8). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». J Neurosci. 26(45):11743-52.PMID: 17093095
- Matalon R, Michals-Matalon K, Surendran S, Tyring SK. (2006). «Canavan disease: studies on the knockout mouse». Adv Exp Med Biol.; 576:77-93.PMID: 16802706
- Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S. (2007 Aug). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». Int J Neuropsychopharmacol. 10(4):557-63.PMID: 17291371
Also see
Relating to diabetes
- Vlassara H, Brownlee M, Cerami A. (1985 Jun); «Recognition and uptake of human diabetic peripheral nerve myelin by macrophages.» Diabetes. 34(6):553-7. PMID: 4007282
- Thornalley PJ. (2002); «Glycation in diabetic neuropathy: characteristics, consequences, causes, and therapeutic options.» Int Rev Neurobiol. 50:37-57. PMID: 12198817
Relating to myelin’s geometry, and its fibre-optic potentiality
- Donaldson, H.H. & Hoke, G.W. (1905). «The areas of the axis cylinder and medullary sheath as seen in cross sections of the spinal nerves of vertebrates». Journal of Comparative Neurology. 15, 1- — [Early evidence of approximately-constant ratio of myelin-thickness to axon diameter].
- Duncan, D. (1934). «A relation between axone diameter and myelination determined by measurement of myelinated spinal root fibres». Journal of Comparative Neurology. 60, 437-471. — [another historic paper on the myelin/axon ratio].
- Rushton, W.A.H. (1951). «A theory of the effects of fibre size in medullated nerve». J.Physiology, 115, 101-122. [Calculation of best geometry for saltatory conduction.]
- Traill, R.R. (1977/1980/2006) Toward a theoretical explanation of electro-chemical interaction in memory-use. Monograph #24, Cybernetics Department, Brunel University.[4], or as Part B of Thesis.[5] — [showing that other extra signal-modes are possible for such «coaxials», which could make myelin even more important].
- Traill, R.R. (1988). «The case that mammalian intelligence is based on sub-molecular memory-coding and fibre-optic capabilities of myelinated nerve axons». Speculations in Science and Technology. 11(3), 173-181.
- optic nerve, physiology subsection; — [applies some of this theory].
External links
- The Myelin Project
- Athabasca University Biological Psychology Website
- The MS Information Sourcebook, Myelin
- The Myelin Repair Foundation
- H & E Histology
- Luxol Fast Blue: Modified Kluver’s Method to stain for Myelin Sheath
- Radiology and Pathology of Myelin the MedPix Medical Image Database
|
v·d·e Histology: nervous tissue |
|
|---|---|
| Neurons (gray matter) |
soma, axon (axon hillock, axoplasm, axolemma, neurofibril/neurofilament), dendrite (Nissl body, dendritic spine, apical dendrite, basal dendrite) |
| Afferent nerve/Sensory nerve/Sensory neuron |
GSA, GVA, SSA, SVA, fibers (Ia, Ib or Golgi, II or Aβ, III or Aδ or fast pain, IV or C or slow pain) |
| Efferent nerve/Motor nerve/Motor neuron |
GSE, GVE, SVE, Upper motor neuron, Lower motor neuron (α motorneuron, γ motorneuron) |
| Synapses |
neuropil, synaptic vesicle, neuromuscular junction, electrical synapse — Interneuron (Renshaw) |
| Sensory receptors |
Free nerve ending, Meissner’s corpuscle, Merkel nerve ending, Muscle spindle, Pacinian corpuscle, Ruffini ending, Olfactory receptor neuron, Photoreceptor cell, Hair cell, Taste bud |
| Glial cells |
astrocyte, oligodendrocyte, ependymal cells, microglia, radial glia |
| Myelination (white matter) |
Schwann cell, oligodendrocyte, nodes of Ranvier, internode, Schmidt-Lanterman incisures, neurolemma |
| Related connective tissues |
epineurium, perineurium, endoneurium, nerve fascicle, meninges |
Template:Structures of the cell membrane