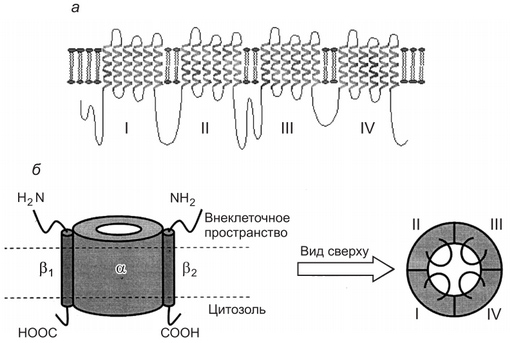
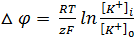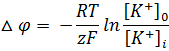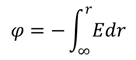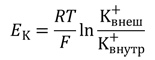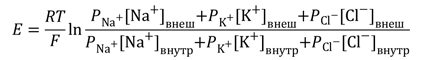Intermediate Filament Proteins
Philip Grant, Harish C. Pant, in Methods in Enzymology, 2016
2 Squid Giant Fiber System
The giant axon is the largest of 8–10 third-order giant axons arising in the stellate ganglion that innervate the circular muscles of the mantle, contractions of which underlie the rapid jet propulsion mode of squid swimming behavior (Fig. 1A). Each giant axon originates from the fusion of many axons of small neurons in the GFL (Martin, 1965; Young, 1939) thereby increasing axon diameter (up to 1 mm) to facilitate rapid impulse transmission essential to the escape response (Otis & Gilly, 1990; Young, 1938). Giant axons receive input via axon-axonal synapses within a giant synapse in the ganglion from second-order giant fibers in the squid brain (Martin & Miledi, 1975; Williamson & Chrachri, 2004; Young, 1973).
Figure 1. Squid giant fiber system: (A) Diagram of Loligo stellate ganglion showing giant axons, GF3, exiting the ganglion in stellate nerves (S.N.) to innervate mantle muscles (M). Axons of small cells in giant fiber lobe (GFL) fuse to form giant axons. Second-order giant fibers (GF2), from the brain, in the pallial nerve (P.N.) enter the ganglion where they synapse with giant axons in the giant synapse region (SYN). (B) Stellate ganglion with stubs of attached giant axons (a.) appearing as clear areas in stellate nerves (S.N.). GIS is neuropil region of the ganglion showing how cell bodies of the giant fiber lobe (GFL) are dissected from the body of the ganglion.
Panel (A) modified after Young (1939), fig. 11. Panel (B) modified after Tytell et al. (1990), fig. 1, Wiley-Liss.
Three major cytoskeletal structures contribute to the cytoskeletal scaffolding underlying the axonal architecture, MTs, MFs, and NFs. In addition, MAPs, myosins, and the various molecular motors kinesin and dynein contribute to the dynamics of axonal transport and function. Fast and slow axon transport include vesicular cargos of transmitters, modulators, receptor proteins, and ion channels, while larger oligomers of tubulin and NFs exchange slowly with a stable MT–NF lattice core (Adams & Gillespie, 1988; Allen et al., 1982; Brady, Lasek, & Allen, 1982; Brady et al., 1985; Galbraith, Reese, Schlief, & Gallant, 1999). Mitochondria are the largest organelles transported from cell body to the neuromuscular synapses in mantle muscle (Brinley & Tiffert, 1978; Pratt, 1986).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0076687915005510
Glial Cells: Invertebrate☆
J.A. Coles, in Reference Module in Biomedical Sciences, 2015
Possible role of glial cells in homeostasis of extracellular K+ around the giant axon of the squid
The giant axon of the squid (a cephalopod) is unmyelinated but achieves a high conduction velocity by having a large diameter, which can exceed 500 μm. It is surrounded by a thin continuous sheath composed of Schwann glial cells, each approximately 2 μm thick, 20 μm wide, and 100–600 μm long. This sheath is further surrounded by connective tissue. The ion channels of both the axon and the Schwann cells are well characterized.
Two Schwann cell conductances have been described – an L-type Ca2 + conductance and an outwardly rectifying K+ conductance activated by entry of Ca2 +. These currents are functionally almost identical to conductances found on mammalian Schwann cells. Although propagation of action potentials along the axon causes release of K+ through the axon membrane, little increase in [K+] in the periaxonal space is observed in healthy squid nerves. The K+ conductances of the Schwann cells are not suited to clearing K+. Possibly, [K+] does not rise excessively simply because the extracellular space is large.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383046134
Cytoskeleton and Intracellular Motility
Merri Lynn Casem BA, PhD, in Case Studies in Cell Biology, 2016
Methods
Preparation of dissociated axoplasm
The giant axon was dissected from the squid L. pealeii in running seawater. Axons were stored in liquid nitrogen. To make a dissociated axoplasm preparation, an axon was thawed and the axoplasm extruded onto a glass coverslip. 20 μL of motility buffer containing 2 mM ATP was added and a second glass coverslip was placed on top of the sample and light pressure was applied.
Preparation of vesicles and supernatant from axoplasm
Axoplasm from 6–8 axons was placed in 50 μL of cold motility buffer supplemented with a protease inhibitor cocktail and homogenized by pipetting multiple times, using a 200 μL pipette. The homogenate was centrifuged at 10,000g for 4 min at 4°C, and the supernatant was carefully collected. The pellet was resuspended in 60 μL of the same homogenization buffer and centrifuged as before. Supernatants were combined to form the S1 supernatant.
The S1 supernatant was treated with 20 μM taxol and 1 mM GTP for 25 min at 23°C to induce MT polymerizastion. The taxol-treated S1 supernatant was then layered onto sucrose gradient and centrifuged at 150,000g for 60 min at 4°C using a swinging bucket rotor. The top 50 μL of the gradient, containing the S2 high-speed supernatant, was collected with a 200 μL pipette and kept on ice. Vesicles gathered at the 35% sucrose interface and were collected by puncturing the side of the tube. The MT fraction was discarded.
Preparation of squid optic lobe microtubules
Optic lobes were dissected from 8–10 squid and placed in a buffer containing a protease inhibitor cocktail and homogenized using a Dounce homogenizer. The homogenate was centrifuged at 30,000g for 30 min at 4°C. The supernatant was collected and centrifuged for 140,000g for 90 min at 4°C. The final supernatant was collected and mixed with taxol and GTP to a final concentration of 20 μM and 1 mM, respectively. The mixture was incubated for 20 min at 23°C to promote MT polymerization followed by centrifugation through a 15% sucrose cushion at 27,000g for 1 h. The pellet was gently resuspended in buffer containing taxol and GTP. To remove MT-associated proteins (MAPs) 1 mL of the taxol pellet was incubated with 0.5 mL of a 3 M NaCl solution in buffer containing taxol and GTP for 15 min at 23°C. Salt-extracted MTs were then pelleted by centrifugation at 35,000g for 30 min at 4°C. The pellet was washed with buffer and resuspended as described previously.
In vitro motility assay
Salt-washed squid optic lobe MTs (1 μL from a 500 μg/mL stock) were added to a glass coverslip followed by the addition of 3 μL of the S2 supernatant. If MT motility was being assayed, then a second coverslip was placed on top of the sample and motility was analyzed with video microscopy.
For assaying organelle motility, 4 μL of the organelle fraction was added to 1 μL of salt-washed MTs in the presence or absence of the S2 supernatant. Organelle motility was measured using video microscopy. The influence of various inhibitors was tested by adding 2 μL of a concentrated stock solution to the organelle mix.
Movement of carboxylated latex beads was assayed using coverslips that were treated overnight with poly-d-lysine, to adhere the MTs to the coverslip surface. Beads were diluted in motility buffer and mixed with S2 supernatant in a ratio of one part beads to four parts S2 and incubated for 5 min on ice. MTs and S2-treated beads were added to the poly-d-lysine–coated coverslips and observed using video microscopy.
Electron microscopy
Negative stain images of MTs and vesicles were made by applying one drop of MT, supernatant, or organelle fractions onto a formvar-coated copper grid for 30 s. The grid was washed with several drops of motility buffer and placed on a drop of 1% uranyl acetate for 30 s, then dried with filter paper. Specimens were examined using a transmission electron microscope.
- ■
-
Speculate on the reason for including a mixture (cocktail) of protease inhibitors in the motility buffer.
- ■
-
Create a flow chart that outlines the steps required to obtain the S2 supernatant used in these experiments.
- ■
-
What was the final concentration of NaCl used to remove MT-associated proteins (MAPs) from the surface of squid optic lobe MTs?
- ■
-
Characterize the nature of the MT–MT-associated protein interactions given that they can be disrupted by high salt concentration.
- ■
-
What concentration of MT protein is used in the in vitro motility assay?
- ■
-
Discuss how negative stain EM images differ from more traditional EM images.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128013946000063
Volume 2
Mark O. Bevensee, Walter F. Boron, in Seldin and Giebisch’s The Kidney (Fifth Edition), 2013
Involvement of K+ and HCO3−; Energetics
In the squid giant axon dialyzed with a fluid containing K+, but lacking Na+ and Cl−, the cotransporter moves K+ and HCO3− out of the axon, eliciting a pHi decrease.265 Under the appropriate conditions, the K+/HCO3− cotransporter can also operate in the forward direction, moving HCO3− into the squid giant axon.268,269 Exposing axons dialyzed with a fluid devoid of K+, Na+, and Cl− to an artificial seawater containing K+ and CO2/HCO3− elicits a pHi decrease (due to CO2 entry), followed by a pHi increase (due to K+/HCO3− influx). The HCO3− fluxes mediated by K+/HCO3− cotransporter can be enhanced by using out-of-equilibrium CO2/HCO3− solutions to introduce HCO3− exclusively to either the inside or outside of the axon.268,270
As mentioned above, two independent groups have also reported DIDS-sensitive, K+-coupled HCO3− transport in the medullary thick ascending limb (mTAL), either from tubule suspensions266 or perfused tubules.267 In the perfused-tubule study,267 luminal DIDS increased transepithelial HCO3− reabsorption—a finding consistent with DIDS-sensitive K+-coupled HCO3− transport opposing HCO3− reabsorption.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123814623000525
Ion Channels of Excitable Cells
John G. Starkus, Martin D. Rayner, in Methods in Neurosciences, 1994
Advantages and Disadvantages of the Crayfish Giant Axon Preparation
The crayfish medial giant axon preparation offers substantial advantages for axial-wire voltage-clamp studies on axonal sodium channels in their native membrane. Crayfish are inexpensive and readily available on a year-round basis, either by catching them oneself (if you live in the right climate) or by purchasing them from commercial farms in California and Louisiana. They are easy to maintain in the laboratory and allow one to avoid the bureaucratic problems which arise with use of vertebrate preparations. More significantly, however, crayfish medial giant axons offer two technical advantages which make this a premium preparation for detailed biophysical studies: (i) the axoplasm is fluid and easily washed out of the axon when the internal perfusate is driven by a very low hydrostatic pressure head (see below), to yield a “clean” membrane preparation without requiring either dialysis, or enzymatic or roller techniques for axoplasm removal; (ii) the Schwann cell sheath is permeated by a tubular lattice with openings into the periaxonal space every ∼0.2 μ m (as opposed to the 5- to 13-μm intervals between Schwann cell clefts in squid axons); see Shrager et al. (1). Thus, the crayfish Schwann cells permit very rapid reequilibration of periaxonal ion concentrations (some 25-fold faster than that in squid axons (1)). Furthermore, the close spacing of the tubule lattice openings reduces the possibility that microscopic space clamp errors can arise from the lateral resistance of the Frankenhaeuser-Hodgkin space, as described for squid axons by Stimers et al. (2). In almost 15 years of gating current recording we have never seen a gating current “rising phase” which outlasts the clamp rise time in a crayfish axon, an observation which tends to confirm that such rising phases are an artifact arising from microscopic space-clamp errors induced by the geometry of the squid’s periaxonal space (2). Finally, the relatively faster kinetics of crayfish axons (even at 6 to 8°C) makes the gating currents in this preparation seem relatively larger and, therefore, easier to record (3).
Against the advantages described above, there is the disadvantage of the smaller diameter of crayfish giant axons. We find that the “best” axons fall between 180 and 250 μm in diameter; axons larger than this (we have seen axons as large as 400 μ m) are often of variable diameter and are discarded for this reason. However, the small size of our best axons limits the diameter of the axial wire, makes electrode placement more difficult (our success rate rarely exceeds ∼80%), and raises questions with respect to both electrode polarization and potential space-clamp errors which we address below.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121852870500119
Anemonia Sulcata Toxin II☆
M. Cataldi, in Reference Module in Biomedical Sciences, 2015
Neuronal excitability
Studies performed on crayfish giant axon showed that ATX II significantly prolongs action potential duration by slowing membrane repolarization and that this effect can be partially inhibited by depolarising currents (Romey et al., 1976; Warashina et al., 1981). In the presence of the toxin, the action potential duration in the giant axons of the crustacean abdominal nerve cord can be longer than 1 s (Rathmayer and Beress, 1976). The ATX II effect is reversible upon washout (Rathmayer and Beress, 1976). The ATX II slowing effect on nerve action potential is also observed in frog myelinated fibers (Bergman et al., 1976) and in cultured neuroblastoma cells (Lazdunski et al., 1979). Upon exposure to ATX II (1 μM for 3 h) c-fos expression greatly increases in cultured rat striatal neurons (Falk et al., 2008). A significant increase in recovery time from seizure-like activity induced by electroshock was observed in Drosophila larvae fed with ATX II and this toxin also induced an increase in Na+ persistent current in motorneurons from these insects (Marley and Baines, 2011).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383994790
Neurons
Constance Hammond, in Cellular and Molecular Neurophysiology (Fourth Edition), 2015
The pioneer living preparation
The squid’s giant axon is most commonly used for these observations since its axoplasm can easily be extruded and a translucent cylinder of axoplasm devoid of its membrane is thus obtained. This living extruded axon keeps its transport properties for several hours. The absence of plasma membrane allows precise control of the experimental conditions and entry into the axoplasm of several components that cannot usually pass through the membrane barrier in vivo (e.g. antibodies). The improvement of video techniques applied to light microscopy allowed the first observations of the movement of a multitude of small particles along the microtubules in a living extruded axon.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123970329000017
Membrane Potential and Action Potential
David A. McCormick, in From Molecules to Networks, 2004
The membrane of the squid giant axon, at rest, is most permeable to K+ ions, less so to Cl−, and least permeable to Na+. (Chloride appears to contribute considerably less to the determination of the resting potential of mammalian neurons.) These results indicate that the resting membrane potential is determined by the resting permeability of the membrane to K+, Na+, and Cl−. In theory, this resting membrane potential may be anywhere between EK (e.g., −76 mV) and ENa (+55 mV). For the three ions at 20°C, the equation is
Vm = 58.2 log{(1.20 + 0.04.440 + 0.45.40)/(1.400 + 0.04.50 + 0.45.560)} = −62 mV.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121486600500068
Sodium Channels
KATSUSHIGE ONO, MAKOTO ARITA, in Heart Physiology and Pathophysiology (Fourth Edition), 2001
2. Macroscopic Na+ Current
The classical description of ionic currents in the squid giant axon by Hodgkin and Huxley (20, 21) has been widely used for other electrically excitable membranes. In the Hodgkin–Huxley equations for the Na+ current, the term m3·h is considered to be the probability of an open sodium channel. The symbol m denotes the activation variable, h the inactivation variable, and the kinetics of m and h are described by first-order differential equations. Therefore, the current relaxation at a given membrane potential is specified by the parameters m∞ (steady-state activation variable), h∞ (steady-state inactivation variable), τm (time constant of Na+ activation), and τh (time constant of Na+ inactivation). The steady-state properties of activation and inactivation have been discussed for a long time and can be summarized as follows. Hodgkin and Huxley observed the onset of the Na+ current as a sigmoidal form after a voltage step, so that they postulated that activation was a multistep process or the result of three independent events with the probability m, yielding the probability of opening of m3. Therefore the voltage dependence of the activation process itself would be the cubic root of the peak conductance. The decay of INa represented the accumulation of channels in the inactivation state. Because they observed that INa decayed with a single time constant, they described inactivation as only a single transition with the probability of (1 – h). These parameters of activation (m3) and inactivation (h) in cardiac myocytes are plotted as a function of membrane potential (Fig. 3) (22). Overlap between the activation and the inactivation curve is independent of the assumed resting potential. The “window” between the m3∞ and h∞ curves (shaded area in Fig. 3) is of particular interest because it may reflect the potential range in which steady-state Na+ currents can be observed. The amplitude of these stationary currents may be proportional to m3∞ h∞.
FIGURE 3. Steady-state parameters m∞, m3∞, and h∞ of Na+ current activation and inactivation in a single myocardial mouse cell (22).
In the classical Hodgkin–Huxley equations described earlier, the probability of an open Na+ channel was formulated by the product of the probabilities of a channel being activated (m3) and not being inactivated (h): the transient Na+ current was proportional to m3·h. Therefore, it was assumed that the two gating processes of Na+ activation and inactivation proceed independently of each other. This concept has long been supported by experiments in which strong modification of Na+ inactivation had only a small effect on Na+ activation. However, some experiments have provided evidence that activation and inactivation are functionally coupled (23, 24). This bold hypothesis has been confirmed by mutagenesis studies involving mutations in the outer S4 segment of domain IV. Replacing charged arginine residues with cysteines markedly slows the rate of fast inactivation during depolarization in the Na+ channel in skeletal muscle. In the cardiac counterpart, naturally occurring mutations in the domain IV-S4 segment are implicated in both skeletal muscle myopathies (25) and the long QT syndrome (described later) (26). It is therefore concluded that the domain IV-S4 charged segment serves as the voltage sensor for both activation and inactivation and that outward motion of this segment is a prerequisite to normal inactivation gating. Studies also suggest that the charged S4 segments in all four domains contribute to both activation and inactivation (26, 27), indicating that the classical Hodgkin–Huxley model is probably wrong and a reinterpretation of the activation/inactivation gate is required based on the molecular function (28).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780126569759500146
Axonal and Dendritic Transport by Dyneins and Kinesins in Neurons
L.S.B. Goldstein, in Encyclopedia of Neuroscience, 2009
Kinesins
Kinesin molecular motor proteins were originally discovered in the giant axon of the squid. Although not recognized at the time, this new type of molecular motor protein, although biochemically distinct from myosins and dyneins, is the founding member of a diverse but related collection of molecular motor proteins that were deployed for many different functions in eukaryotic cells. The founding member of this family, originally called conventional kinesin, and now called kinesin-1, is a heterotetrameric protein composed of two kinesin heavy chains (KHCs) and two kinesin light chains (KLCs) (Figure 4). The motor activity of kinesin-1 resides in KHC in an N-terminal region of approximately 350 amino acids. This protein domain has been shown to be capable of generating adenosine 5′-triphosphate (ATP)-dependent movements along microtubules in vitro, has been crystallized and solved structurally, and has proven to be conserved and shared among all kinesin-related motor proteins. The nonmotor portion of KHC has two structural domains. One structural domain is an alpha-helical coiled coil that mediates KHC dimerization. The other region is of unknown structure and complexes with the KLCs to form the so-called tail or cargo binding domain of kinesin-1. KLC has a short coiled coil domain at its N-terminus that may mediate the dimerization and/or association with KHC, and then has a region of six relatively well-conserved tetratricopeptide repeat (TPR) units, whose structure has been solved in other proteins and which are predicted to form a triple alpha-helical groove composed of three TPR units. Thus, KLC is predicted to have two of these triple alpha-helical grooves that may be important in cargo binding and kinesin regulation.
Figure 4. Schematic diagram of kinesin-1 structure. Kinesin-1 is a heterotetramer consisting of two kinesin heavy chain (KHC) subunits and two kinesin light chain (KLC) subunits. KHC contains the motor domain, the dimerization domain, and a short terminal domain that interacts with the KLC subunits. Cargo binding may be mediated by KHC and KLC together or individually. KLC also plays roles in regulating KHC motor domain activity. ATP, adenosine 5′-triphosphate; TPR, tetratricopeptide repeat.
The sequence of the KHC motor domain led to the discovery that eukaryotic genomes encode many different kinesin motor proteins. These proteins are all predicted to share a common motor domain but to have a variety of structurally diverse ‘tail’ domains attached that may harness force-generating activities by kinesins to a variety of cargoes in various cellular types and functions (Figure 5). Although the initial expectation was that all these predicted motor proteins would be plus end-directed motor proteins, a surprising degree of diversity in behavior was discovered. Some of these kinesin motor proteins mediate minus end-directed movements, and some may not be motor proteins at all and may mediate the rapid depolymerization of microtubules. Both of these types of proteins nonetheless couple ATP hydrolysis to their activities. Some kinesins may have other functional activities in the motor domain, but these have not yet been clearly elucidated. While many kinesins appear to play roles in nonneuronal cells, in particular in the process of cell division, a number are shared between neurons and nonneuronal cells. Many kinesins are specific only to neurons, where they may be involved in axonal or dendritic transport processes. For example, in mammals, on the order of 10–15 of the known kinesins among the 50 or so predicted to be encoded in the genome are specialized for cell division. In Drosophila, because of the smaller genome, proportionally fewer are used in mitosis and in neurons. A key question is which motor proteins move which types of vesicles and organelles in each type of neuron.
Figure 5. Principles of kinesin and dynein diversification. Kinesins appear to have evolved by gene duplication and divergence such that a conserved motor (shaded ovals) has become harnessed to a wide array of diverse tail domains. The location of the motor domain in the heavy chain polypeptide allows kinesin motors to be divided into several groups: an N-terminal group, a central group, and a C-terminal group. In addition, N-terminal kinesins have been found as homodimers, heterodimers, homotetramers, and monomers. Cytoplasmic dyneins appear to have conserved the bulk of their principal motor polypeptide and have generated far fewer divergent genes. Accessory chain diversification may be the principal mechanism for functional specialization. Reproduced with permission from Goldstein LS and Yang Z (2000) Microtubule-based transport systems in neurons: The roles of kinesins and dyneins. Annual Review of Neuroscience 23: 39–71.
In neurons, although there is a large diversity of different kinesin motor proteins and cargoes, some simple principles have begun to emerge. For example, kinesin-1 appears to play roles in the anterograde transport of a number of different types of vesicles whose contents are needed along the axonal membrane and at the synapse, such as vesicles containing the amyloid precursor protein (APP), whose processing may cause Alzheimer’s disease. Kinesin-1 also appears to play a role in the transport of neurofilaments, which are required for radial growth of axons, and in the movement of mitochondria. It is interesting to note that recent work suggests that mitochondrial movement by kinesin-1 may be mediated by a special form of kinesin-1 in which KLC is replaced by another protein, whose name is Milton. A second prominent class of kinesins, referred to as kinesin-3, appears to play roles in the movement of protein components of synaptic vesicles and may also play a role in the movement of mitochondria. Other kinesins may move mRNA particles, components of postsynaptic complexes and postsynaptic receptors, as well as other organelles, including peroxisomes, elements of endoplasmic reticulum, and the Golgi apparatus. An important and unresolved question is whether the movements of nonmembrane particles and proteins are mediated by direct interactions with the motor proteins or by binding to vesicle or organelle membranes and hitchhiking.
Another type of kinesin used for movements in some types of neurons is called kinesin-2. This kinesin is generally a heterotrimer of two nonidentical motor subunits associated with a third nonmotor domain protein, which may form part of the tail. This class of motor protein has been found to be used primarily for movement of materials in cilia and is thus necessary for the construction of cilia and perhaps for signaling mediated by cilia. In neurons in particular, this class of kinesin appears to be used most prominently in sensory neurons of various types, which often use modified cilia as their sensory endings within which receptors for odors or chemical molecules are bound and signals are transmitted. Vertebrate photoreceptors have a modified cilium as their light-sensing domain, the so-called outer segment, and this modified cilium also appears to require the use of this kinesin-2 type of motor protein for the movement of photoreceptive components such as opsin.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469007087
В основе представлений о процессе генерации нервного импульса лежат исследования, выполненные на гигантских нервных волокнах кальмара А. Ходжкиным, А. Хаксли и Б. Катцем. Для измерения потенциала действия внутри аксона вводят тонкий стеклянный капилляр с диаметром кончика менее 0,5 мкм, заполненный концентрированным раствором КС1, что не оказывает заметного влияния на активность аксона. [c.166]
У многих животных обнаружены гигантские нервные волокна, т. е. волокна особенно большого диаметра. Про гигантский аксон кальмара мы уже много говорили. Но гигантские волокна обнаружены и у дождевых червей, и у пиявок, и у речного рака, и у других животных, В чем же роль этих волокон [c.147]
У дождевых червей и пиявок их гигантские нервные волокна управляют продольными мышцами тела, обеспечивая быстрое укорочение тела животного отдергивание у пиявки, быстрое втягивание в норку у дождевого червя. Тут нервные волокна обеспечивают защитные реакции. [c.147]
У кальмара гигантские нервные волокна управляют сокращением мантии. К заднему концу мантии идут более толстые аксоны, а к переднему — несколько более тонкие. В результате такого устройства сигналы, выходящие из ганглия кальмара, управляющего его плаванием, приходят к разным участкам мантии практически одновременно, обеспечивая мощный выброс воды из мантийной полости через воронку и быстрое движение кальмара в воде. [c.147]
Чем объясняется остальная часть синаптической задержки Ответ был получен в результате исследования контакта между двумя перекрещивающимися гигантскими нервными волокнами кальмара. Эти волокна достаточно велики для того, чтобы можно было ввести микроэлектроды как в пре-, так и в постсинаптические элементы, что невозможно в большинстве центральных синапсов (вот почему наши представления столь сильно опираются на знание периферических соединений). Площадь контакта огромна— 150 000 мкм . На этом гигантском синапсе было идентифицировано несколько этапов с определенным следованием во времени. Оказалось, что большая часть всей синаптической задержки падает на открывание Са +-каналов и что реальный интервал между появлением входящего Са +-тока в пресинаптической мембране и появлением постсинаптического [c.209]
Эксперименты по блокированию солями четвертичного аммония позволили получить более точные данные о структуре и свойствах обеих функций калиевого канала. Ионы тетраэтиламмония (ТЭА) блокируют выходящий калиевый ток. В гигантском аксоне кальмара подобный эффект наблюдался только при попадании ТЭА внутрь нервного волокна во время перфузии аксона. Отсюда следует, что канал пронизывает мембрану асимметрично. Еще более интересно то [27], что блокирующая способность ионов четвертичного аммония увеличивается при замене одной из этиловых групп более длинной гидрофобной боковой цепью (рис. 6.8). Эти производные не просто блокируют, они инактивируют уже начавшийся калиевый ток (рис. 6.9), как бы проникая в открытый канал. [c.156]
В 1936 г. английский специалист по головоногим моллюскам Дж. Юнг обнаружил у кальмаров нервное волокно, диаметр которого доходил до миллиметра, т. е. по клеточным масштабам гигантское, хотя сам моллюск вовсе не был гигантским. Такое волокно, выделенное из организма и помещенное в морскую воду, не погибало. Наконец-то появилась живая клетка, в которую можно было проникнуть, с которой можно было работать. - [c.67]
Тревога поднялась только в 1939 г. Одновременно две группы исследователей в двух местах — Кол и Кертис, работавшие на морской станции Океанологического института в Вудс-Холе (США), и Ходжкин и Хаксли,, работавшие на морской станции в Плимуте (Англия),— измерили ПД и ПП на самом совершенном уровне тогдашней экспериментальной техники они взяли гигантский аксон кальмара, т. е. одиночное нервное волокно, ввели электрод внутрь волокна и смогли таким образом непосредственно измерить разность потенциалов между внутренней и внешней сторонами мембраны одной клетки, а не на пучке волокон. [c.81]
Микроэлектродный метод дал возможность измерить биопотенциалы не только на гигантском аксоне кальмара, но и на клетках нормальных размеров нервных волокнах других животных, клетках скелетных мышц, клетках миокарда и других. [c.69]
Наивысшая скорость проведения нервных импульсов была достигнута благодаря возникновению гигантских волокон, которые проводят быстрее вследствие их большого диаметра и незначительного количества синаптических связей, а следовательно, благодаря меньшему количеству препятствий на пути импульса по сравнению с обычным нервным волокном. Эти характерные черты центральной нервной системы были найдены у аннелид, моллюсков, членистоногих, у которых они используются в защитных реакциях, таких, как, например, энергичное отбрасывание собственного хвоста омарами. В связи с этими тенденциями развития центральная нервная система в процессе эволюции глубже погружалась внутрь тела, где она была защищена различными опорными тканями. В таких относительно глубоких местах она стала центром, к которому стекаются волокна от различных частей тела. [c.38]
Многие беспозвоночные умеют избегать опасности, внезапно совершая быстрое движение. Эта реакция, запускаемая внешним раздражителем, состоит в резком одновременном сокращении особых быстрых мышц, благодаря которому животное удаляется от источника опасности. Такая форма поведения встречается у самых различных беспозвоночных, например у дождевых червей, раков и кальмаров (а также и у некоторых позвоночных см. ниже). Оказалось, что важнейшим звеном нервного пути, обеспечивающего такое отскакивание , служит гигантский аксон. Это вполне естественно, так как скорость проведения нервных импульсов в волокне тем выше, чем оно толще (см. гл. 7). Ясно, что реакция избегания должна быть прежде всего быстрой. (Подробнее свойства гигантского аксона кальмара рассматривались в гл. 7.) [c.54]
При возбуждении клеток происходит резкое уменьшение их электрического сопротивления и у крупных растительных клеток водоросли нителлы падает от 100 ООО до 500 ом/см , а у гигантского нервного волокна кальмара—от 1000 до 25 OMj M (Коул и Кертис, 1938). По данным Синюхина [c.285]
Если увеличить силу электрического удара, то сила проходящего по нерву импульса тоже увеличится до известного предела. Это говорит о том, что реакция нерва может изменяться. Нерв лягушки состоит из тысячи мелких нервных волокон, плотно связанных между собой в пучок. Много лет назад некоторые физиологи предположили, что различная реакция может быть просто следствием того, что в процесс включается разное число волокон. Они полагали, что отдельное волокно реагирует, вероятно, по закону все или ничего — как спичка, которой мы чиркаем о спичечную коробку. Ясно, что этот вопрос можно было разрешить только путем изучения реакции одиночного, изолированного нервного волокна. Среди первых, кто проделал это, были Э. Эдриан, Б. Мэтьюс и Д. Бронк, которым удалось изолировать одиночное волокно под препаровальной лупой. Позже было установлено, что у некоторых животных, и в частности у кальмара, имеются гигантские нервные волокна, которые еще удобнее изучать. А затем Р. Джерард и его коллеги в Чикагском университете разработали остроумную методику для изучения реакций одиночных волокон без сложного препарирования и выделения. Они использовали в качестве электродов микропипетки, которые можно ввести в отдельное тонкое волокно. [c.238]
Маутнеровская клетка интересна во многих отношениях. На клеточном уровне она служит примером важной роли дендри-тов в интеграции различных синаптических влияний. Кроме того, она иллюстрирует стратегическое значение тех синапсов, которые расположены на начальном сегменте аксона и держат под своим контролем аксонный выход клетки. На поведенческом уровне реакция испуга сходна с реакцией избегания у рака обе они обладают многими особенностями комплексов фиксированных действий. В обоих случаях для осуществления специфического двигательного акта природа удивительно удачно приспособила гигантские нервные волокна. [c.60]
Вернемся теперь к нервам. Электрическую структуру нервного волокона в принципе угадал еще Гальвани. (Правда, он рассуждал о целом нерве, а не о составляющих его отдельных нервных волокнах.) Он писал, что внутри нерва имеется проводящая среда, окруженная изолирующей оболочкой, подобно проводу от электрической машины, заизолированному воском. С помощью специальных химических экспериментов Гальвани пришел к правильному выводу, что изоляция нерва образована жироподобными веществами. Дальнейшее изучение строения уже отдельных нервных волокон подтвердило догадку Гальвани. А в 1946 г. Ходжкин и Раштон экспериментально показали, что такие одиночные волокна, как гигантский аксон кальмара, ведут себя подобно бесконечному кг-белю, т. е. к ним полностью применима теория Томсона. Они вводили в аксон микроэлектрод и пропускали черс з него ток, создавая в этой точке изменение мембранно о потенциала. С помощью второго микроэлектрода мною-кратно измеряли разность потенциалов на мембране па разных расстояниях от первого электрода (рис. 33, а). Потенциал действительно спадал по экспоненте. Константу затухания можно найти непосредственно по графику спада потенциала (рис. 33, б). Оказалось, что длина аксона кальмара во много раз больше его константы затухания. После этого Ходжкин и Раштон провели расчеты, которые были, так сказать, обратной задачей по сравнению с первым приложением теории Томсона. При расчете трансатлантического кабеля нужно было, зная удельные сопротивления материалов жилы и изоляции кабеля, рассчитать его параметры (диаметр жилы, толщину изоляции). Здесь же был готовый кабель — аксон, но удельные сопротивления его оболочки — мембраны и жилы — аксоплазмы былинеиз- [c.130]
Например, у дождевых червей вдоль всего тела проходят гигантские аксоны (их диаметр достигает 60 мкм, что очень много для дождевого червя). Как видите, они не такие гигантские, как у кальмара, да и устроены они иначе. На самом деле это не аксон, т. е. не отросток одной клетки. Этот аксон состоит из множества цилиндрических кусочков. В каждом сегменте тела есть нервная клетка, которая отращивает такой кусочек затем торцевые мембраны этих цилиндров соединяются коннексона-ми, так что получается кабель с перегородками, пронизанными каналами коннексонов (рис. 41,е). В результате импульс бежит по этому составному аксону как по обычному толстому нервному волокну. Эти волокна вызывают быстрое сокращение тела червя, обеспечивая реакции отдергивания от раздражителя или быстрого втягивания в норку. При химических синапсах эта реакция занимала бы несколько десятых долей секунды ведь задержка между сегментами в ХС холоднокровного составляет несколько миллисекунд, а сегментов может быть несколько десятков и даже сотня задержка на ЭО составляет всего 0,01 мс ясно, что тут за счет ЭС обеспечивается жизненно важная экономия времени. Такие же аксоны есть и у речного рака когда опасность грозит спереди, они обеспечивают быстрое подгибание брюшка (эта реакция называ- [c.169]
Культуры, приготовленные непосредственно из тканей организма, с использованием первичного этапа фракционирования клеток и без оного, называют первичными культурами. В большинстве случаев клетки первичной культуры можно перенести из культуральной чашки и использовать для получения большого количества вторичных культур, которые можно последовательно перевивать в течение недель или месяцев. Часто эти клетки сохраняют признаки дифференцировки тех тканей, из которых они были получены. Так, фибробласты продолжают синтезировать коллаген, клетки скелетных мышц эмбриона сливаются, образуя гигантские мышечные волокна, которые спонтанно сокращаются в чашках для культуры тканей у нервных клеток возникают аксоны, характеризующиеся электровозбудимостью и способностью формировать синапсы с другими нервными клетками клетки эпителия формируют обширные слои, сохраняющие многие свойства интактного эпителия. Поскольку все эти события можно наблюдать при росте клеток в культуре, для их изучения используют многие методы, недоступные при работе с интактными тканями. [c.204]
Для восприятия раздражений имеются разные виды рецепторов. Некоторые из них специализируются на восприятии осязательных и болевых раздражений, ощущении давления и в целом образуют примитивную соматосенсорную систему, регистрирующую раздражение поверхности тела или стенок тела (см. гл. 13). Имеются также рецепторы, обеспечивающие чувство равновесия (статоцисты), рецепторы для обнаружения химических веществ (хеморецепторы) и для восприятия света (фоторецепторы). У некоторых видов фоторецепторы сосредоточены в четко обозначенных глазах. В моторном отношении кольчатые черви способны к выполнению разнообразных движений, среди которых — рытье ходов, ползанье (либо за счет перистальтических сокращений, либо с помощью параподий), ходьба с помощью присосок (как у пиявок) и плаванье. Эти движения оказываются более точными н сильными, чем у плоских червей, так как мышцы могут использовать в качестве опоры сегменты целома, образующего внутренний гидростатический скелет. Более подробно эти движения и управляющие ими нейронные механизмы будут рассматриваться в главе 21. У некоторых червей (например, у дождевого червя) существует система гигантских нервных волокон, которые идут продольно через все тело и позволяют осуществлять быстрые рефлексы типа вздрагивания или реакции избегания. Как упоминалось в начале этой главы, именно эти волокна — очень удобный объект для изучения механизмов нервного импульса. [c.44]
Большую скорость распространения нервного импульса по аксону кальмара обеспечивает их гигантский по сравнению с аксонами позвоночных диаметр. У позвоночных большая скорость передачи возбуждения в нервных волокнах достигает другими способами. Аксоны позвоночных снабжены миелиновой оболочкой, которая увеличивает сопротивление мембраны и ее толш,ину. [c.89]
Биологические модели представляют собой биологические объекты, удобные для экспериментальных исследований, на которых изучаются свойства, закономерности биофизических процессов в реальных сложных объектах. Например, закономерности возникновения и распространения потенциала действия в нервных волокнах были изучены только после нахождения такой удачной биологической модели, как гигантский аксон кальмара. Опыт Уссинга, доказывающий существование активного транспорта, был проведен на биологической модели — коже лягушки, которая моделировала свойство биологической мембраны осуществлять активный транспорт. Закономерности сократимости миокарда устанавливают на основе модельных экспериментов на папиллярной мышце. [c.165]
Живые существа жизненно заинтересованы в высокой скорости проведения нервного импульса по нерву, а значит, в высоких величинах «к. Повлиять на рд трудно, так как оно зависит от электролитного состава протоплазмы, который примерно одинаков у всех видов животных. Головоногие моллюски пошли по пути увеличения радиуса нервного волокна г, создав гигантские аксоны. Позвоночные изобрели миелиновое волокно. Миелин содержит много холестерина и мало белка его удельное сопротивление выше удельного сопротивления других биологических мембран. Кроме того, толщина миелиновой оболочки I в сотни раз превышает толщину обычной клеточной мембраны. Это обеспечивает высокие значения Я- в миелиновых нервных волокнах и сальтаторное (скачкообразное) распространение потенциала по ним от одного перехвата Ранвье к другому. Нарушение миелиновых оболочек при миелиновых болезнях приводит к нарушениям распространения нервного возбуждения по нервам и тяжелым расстройствам в функционировадии нервной системы животных и человека. [c.172]
При нормальных физиологических условиях изолированные грудной и брюшной отделы центрального нервного ствола сохраняют в течение многих часов непрерывный ритмический фон спонтанных юрвных импульсов. Если этот анатомо-физиологический препарат имеет не-отчлененные церки, то раздражение центрального нерва электрическим током будет вызывать нормальную пост-синаптическую реакцию в гигантских волокнах брюшной области. Если брюшной раздел нервного ствола непосредственно раздражать током, то можно наблюдать аксональное раздражение гигантских волокон. Обработка такого препарата 10 М раствором ТЭПФ приводит в течение 30 мин. к полному блокированию пост-синаптических реакций на раздражение церков. В то же время спонтанная активность весьма сильно повышается на короткое время, а затем внезапно блокируется в течение менее 1 мин. Прямое раздражение аксона не приводит к снижению физиологической реакции. Если нервную цепочку оставить в первоначальном растворе ТЭПФ, то спонтанная активность остается в той или иной степени блокированной и лишь изредка возвращается к норме в течение 15 лшн. Однако если раствор ТЭПФ удалить и промыть цепочку 4—5 раз свежим Ю М раствором ТЭПФ, то спонтанная активность быстро (обычно в течение 2—5 мин.) восстанавливается Восстановившаяся активность является в общем нормальной и не изменяется в течение по крайней мере 5 час. Реакция на раздражение аксона в течение этого времени нормальная, но постсинаптическая реакция на раздражение церков, блокированная первым раствором ТЭПФ, не восстанавливается. [c.152]
Подобно тому как гигантский аксон кальмара является образцом] нервлого волокна, образцом нервной клетки является мотонейрон кошки (рис. 51). Эта клетка имеет относительно большие размеры (около 30 мкм) и позтому наиболее детально изучена. Мотонейрон (МН) имеет тело и дендриты, на которых расположены около 10 ООО синапсов, образованных окончаниями других нервных клеток. От тела МН отходит выходной отросток — ак-сон представляющий собой миелинизированное волокно, У его основания имеется особая структура — аксонный холмик это часть МН, имеющая мембрану с наиболее низким порогом. Аксоны МН могут быть очень длинными, например, у кошки — сантиметров 25, а у слона или жирафа — и несколько метров. В конце аксон МН разделяется на веточки — терминали, которые оканчиваются на мышечных волокнах. Кроме того, еще внутри спинного мозга, где лежат МН, аксон отдает боковые веточки (кол-латерали) которые идут к другим нервным клеткам. [c.206]
Как отмечалось, в механизме проведения сигналов по нерву посредством волны деполяризации источником необходимой энергии служит неравновесное состояние градиентов концентрации катионов — калия, натрия, кальция. Скорость проведения нервного импульса зависит от скорости изменения этих градиентов, т. е. от быстроты конформационной перестройки мембранных компонентов. По мнению Катца [130], скорость распространения волны деполяризации зависит от продольной электропроводности внутренней области аксона и поэтому она тесно коррелирует с толщиной волокна. Как известно, один из способов увеличения скорости передачи сигналов состоит в уменьщении осевого сопротивления кабеля путем увеличения диаметра волокна. Именно это ре-щенпе избрала природа для удовлетворения потребности в высокоскоростной передаче импульсов у некоторых беспозвоночных. Например, быстрое движение кальмара при бегстве от опасности контролируется небольшим числом гигантских аксонов, иннервирующих обширную мускулатуру его мантии, которая действует как реактивный двигатель. Однако для животного, которому по-М1ИМ0 быстроты реакции необходимо и наличие огромного числа каналов для передачи множества сенсорных сообщений и обеспечения двигательных реакций, гигантские аксоны оказались бы непригодными. Ясно, например, что в з,рительном нерве, где должно находиться больше миллиона параллельных аксонов для передачи зрительной информации просто не хватило бы места для большого числа гигантских волокон. Решением, найденным нервной системой позвоночных, явилось образование миелинизиро-ванного аксона, в котором кабельные потери сильно снижены благодаря миелиновой оболочке (130, с. 114). [c.207]
А — ранние стадии гигантская клетка, образование двух дочерних клеток и образование четырех дочерних клеток, Б. По-лусхематическое изображение функционирующей щетинки I — сочленовный бугорок, 2 — трихогенная клетка, 8 — щетинка, 4 — кутикула, I клетка бугорка, в — волокно, идущее к щетинке, 7 — волокно, идущее в центральную нервную систему, 8 — шванновская клетка, 9 — нервная клетка. [c.14]
Статья на конкурс «био/мол/текст»: Тайна того, каким образом «работает» человеческий мозг, мучила философов и естествоиспытателей с древнейших времен. Современные ученые постепенно подходят к ее разгадке, приближая тот час, когда мы сможем полностью понять, как и с помощью чего мы на самом деле думаем. Именно сейчас развитие вычислительной техники и последние достижения в нейробиологии сделали реальным то, что раньше казалось недостижимым. Появились компьютеры, способные понимать речь, ориентироваться в пространстве и даже писать научные статьи. Работа таких машин частично основана на принципах работы головного мозга. Каким образом они работают, что такое мышление и где оно происходит? Обо всем этом мы попытаемся рассказать.
Клетки-деревья
Общеизвестно, что наш мозг состоит из нейронов (по крайней мере, именно они отвечают за мыслительный процесс). Морфологически эти клетки похожи на деревья с корнями-дендритами и стволом-аксоном. На дендритах суммируются электрические сигналы, поступающие от других нейронов, и в зависимости от этого нейрон «принимает решение», формировать ли ему потенциал действия (т.е. нервный импульс). Потенциалом действия называется волна токов ионов натрия и калия, которая быстро проходит через мембрану и распространяется без затухания по аксону к другим нейронам. Именно это свойство позволяет нейронам передавать сигнал без потери информации на большие расстояния. Так, потенциал действия, сформированный в коре головного мозга, может достичь нейронов в позвоночнике, а затем в руке, за считанные миллисекунды. В окончании аксона находятся синапсы, из которых после прохождения потенциала действия высвобождаются особые вещества — нейромедиаторы. Именно они передают сигнал к следующему нейрону, и так далее, по цепочке [14].
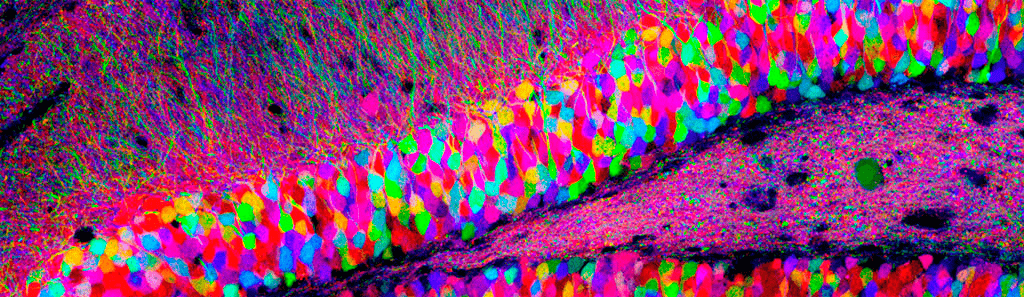
Однако один нейрон сам по себе не способен обеспечить сложное поведение, характерное для животных и тем более самого умного из них — человека. По оценкам ученых, в человеческом мозге около 100 миллиардов нервных клеток, которые соединены в сложнейшую сеть со 100 триллионами синаптических контактов между ними (рис. 1). При виде таких чисел в пору отчаяться и бросить попытки разобраться в том, как функционирует этот сложнейший природный объект. К счастью, ученые — люди не робкого десятка и продолжают упорно двигаться вперед.
Рисунок 1. Множество нейронов в срезе гиппокампа крысы. Клетки помечены различными флуоресцентными белками с помощью технологии Brainbow.
Моделирование вместо опыта
Один из главных вопросов изучения биологических нейронных сетей — каким образом при соединении нейронов относительно простое поведение отдельной единицы трансформируется в сложное поведение сети в целом. Однако полностью разобраться в этом мешают ограниченные возможности эксперимента: в настоящей нейронной сети практически невозможно измерить все сигналы со всех 100 миллиардов нейронов и отследить все процессы, происходящие в ней. Тут-то на помощь ученым и приходит компьютерное моделирование. Математические модели всегда помогали исследователям отвечать на подобного рода сложные вопросы. А после появления вычислительных машин возможности в этой области постоянно расширяются.
Одним из последних достижений в этой области является проект Blue Brain, возглавляемый Генри Маркромом [2], [3]. В рамках этой инициативы ученые пытаются воспроизвести поведение одной колонки кортекса, состоящей из сотен тысяч клеток, которые моделируются с максимальной степенью детализации. Колонки в новой коре являются ее важнейшим функциональным элементом, на уровне которых, по мнению многих ученых, происходят вычисления, которые являются основой высших психических функций, включая мышление. Именно поэтому детальное изучение этих структур является крайне важным.
Первая модель работы нейрона была создана еще в 1907 году французским физиологом Льюисом Лаписиком [4] — задолго до того, как был изучен механизм формирования нейроном потенциала действия [5]. Модель была очень простой: согласно ей нейрон как конденсатор накапливает напряжение до определенного порогового значения, после чего генерирует потенциал действия. Стоит отметить, что концепция работы нейрона как порогового интегратора почти не изменилась после публикации работы Льюиса Лаписика, но было выяснено множество важнейших деталей.
Нобелевская премия за кальмара
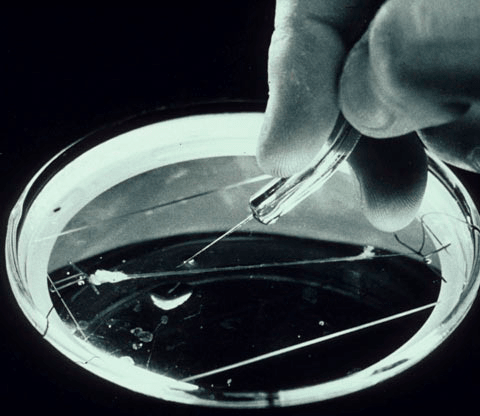
Однако наибольшее распространение получила модель Ходжкина-Хаксли, построенная на основе экспериментов с гигантским аксоном кальмара [5] (рис. 2). Тут мы позволим себе небольшое отступление, чтобы рассказать о том, почему нейроны именно этого живого организма оказались такими удобными для исследований.
Рисунок 2. Гигантский аксон кальмара в чашке Петри. Может быть, на первый взгляд он и не кажется таким уж большим, но по сравнению с аксонами нейронов головного мозга, которые невозможно увидеть невооруженным глазом, он просто огромен.
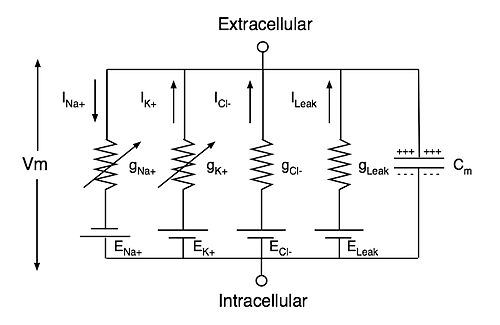
Модель Ходжкина-Хаксли (рис. 3) описывает поведение нейрона, представляя его в виде достаточно простой электрической цепи, где мембрана является конденсатором, ионные каналы — проводимостями (величина, обратная сопротивлению, измеряемая в Сименсах), градиенты ионов натрия, калия и хлора на мембране (то есть, разница между концентрацией ионов внутри и снаружи) — источниками напряжения. При этом активируемые каналы для ионов калия, натрия и хлора описываются нелинейными проводимостями gK, gNa и gCl, а каналы утечки, которые открыты всегда, — постоянной проводимостью gL (от англ. leak — «утечка»). Полученная модель работы нейрона оказалась применима не только для кальмара, но и для млекопитающих, в том числе для человека. Поэтому авторы исследования — британцы Алан Ходжкин и Эндрю Хаксли — получили в 1963 году Нобелевскую премию по физиологии и медицине.
Рисунок 3. Схема электрической цепи модели Ходжкина—Хаксли гигантского аксона кальмара, за которую была получена Нобелевская премия в 1963 году. Cm — емкость мембраны нейрона, ENa+, EK+, ECl− и ELeak — потенциалы реверсии токов натрия, калия, хлора и утечки, а gNa+, gK+, gCl− и gLeak — соответствующие проводимости ионных каналов. Vm — трансмембранный потенциал.
От подневольного труда к искусственному интеллекту
Первые упоминания об искусственных разумных существах можно обнаружить еще в греческой мифологии. Согласно легендам, Гефест по просьбе Зевса создал бронзового гиганта Талоса (рис. 4), который охранял Елену на острове Крит. В средние века появились предания о гомункулусах и Големе — созданных человеком разумных существах.
Рисунок 4. Бронзовый гигант Талос — пожалуй, первый робот в мифологическом фольклоре (кадр из фильма «Ясон и аргонавты», 1965 год).
С конца XIX века искусственные живые существа стали неотъемлемой частью культуры, начиная с «Франкенштейна» Мэри Шелли и пьесы Карела Чапека (рис. 5) «R.U.R.» («Россумские Универсальные Роботы»). Кстати, именно в этой пьесе Чапек впервые использовал придуманное с братом Йозефом слово «робот» (по-чешски robota означает «подневольный труд»).
Рисунок 5. Монстр Франкенштейна (а), Карел Чапек (б) и Алан Тьюринг (в)
До середины XX века разговоры о разумных машинах носили чисто теоретический характер, но уже в 1956 году разработка искусственного интеллекта приобрела статус научной дисциплины. Произошло это благодаря появлению электронных вычислительных машин, а также прорыву в нейробиологии. Наука о мозге помогла понять, что нервная система функционирует благодаря обмену нейронов электрическими импульсами, а вычислительные машины позволили описывать эти процессы с помощью программ.
Вскоре стало понятно, что создание искусственного интеллекта требует как минимум понимания значений слов «искусственный» и «интеллект». Алан Тьюринг нашел элегантный выход: вместо того, чтобы пытаться сформулировать, что же такое «интеллект», он предложил определять, есть он у машины или нет, способом, который получил название «Тест Тьюринга» [8].
Идея теста заключается в том, что экзаменатор общается в текстовом режиме с двумя испытуемыми, один из которых — машина, а другой — человек. Цель экзаменатора — определить, кто есть кто. Тест считается успешным, если машине удается обмануть эксперта. Несмотря на кажущуюся простоту, ни одной программе до сих пор не удалось его пройти.
Хотя настоящего думающего робота создать пока не удалось, различные современные подходы позволяют непрерывно расширять область задач, которые способны решать компьютеры, даже в тех сферах, которые всегда считались доступными лишь людям — например, работа с символами и написание научных статей.
Символьный подход
Первые достижения в создании искусственного интеллекта были связаны с использованием возможностей математической логики. Уже в 1956 году была создана программа с говорящим названием Logic Theorist, которая смогла доказать 38 из 52 теорем, описанных в книге Бертрана Рассела и Альберта Уайтхэда «Основания математики», причем для некоторых из них она смогла найти новые, более простые доказательства. В это же время были созданы программы, способные правдоподобно имитировать переписку с живым человеком (правда, недостаточно хорошо для прохождения теста Тьюринга), и многие другие.
Все эти программы основывались на предположении, что интеллект заключается в осуществлении операций над различными символами по законам логики. На этом принципе были основаны первые коммерчески успешные программы искусственного интеллекта — экспертные системы. Они позволяли частично заменить работу реального эксперта — например, оценить риск организации при предоставлении кредита клиенту. Такая программа работает с базой знаний (набором фактов и правил, формализующих работу экспертов в данной области) по определенным логическим законам. Но далеко не все проблемы могут быть решены в рамках строгой логики, поэтому зачастую в таких программах используется нечеткая или вероятностная логика. Ее особенностью является то, что вместо 0 и 1 — «да» или «нет» — в ней используются все значения между 0 и 1, — например, 0.2 или 0.7: «скорее да», «скорее нет».
Весьма ограниченный успех логического подхода продемонстрировал одну важную вещь: интеллект — это не только способность логически мыслить. Поэтому для решения сложно формализуемых задач (например, распознавания образов) пришлось отказаться от красоты и стройности формальной логики.
Нейронные сети
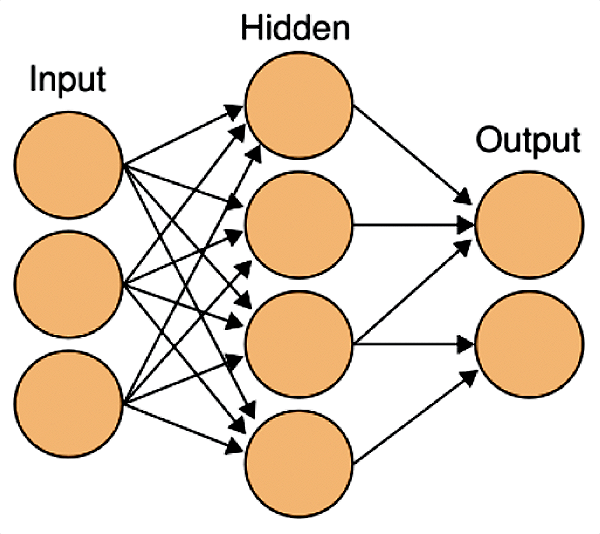
Разработчики искусственных нейронных сетей были вдохновлены работой настоящих нейронов в мозге. Только вместо реальных клеток в сетях используются уравнения, моделирующие их работу (рис. 6).
Рисунок 6. Схема искусственной нейронной сети. На входные нейроны подается стимул, затем он обрабатывается в нейронах скрытого слоя (таких слоев может быть несколько) и результаты предоставляются на выходных нейронах.
Первыми в нейронной сети получают информацию входные нейроны. Именно они получают сигналы от внешнего стимула, который может быть всем, чем угодно: изображения, отдельные звуки и даже человеческая речь. Но для того, чтобы передать полученную информацию, входным нейронам необходимо перевести сигнал стимула на их «язык». Это уже работа другого вида клеток — рецепторов, которые преобразуют информацию о стимуле в нервные импульсы. Биологическим примером таких рецепторов являются палочки и колбочки в сетчатке глаза. Подобные рецепторы есть и в искусственных нейронных сетях: при обработке изображений это фотоэлементы, звуков — микрофоны.
Конечным этапом обработки информации в нейросети являются выходные нейроны, активность которых интерпретируется как результат: преобразованный входными нейронами сигнал от рецепторов попадает в сеть, затем переходит к следующим нейронам и преобразуется за счет взаимодействий между ними через синапсы. Например, если сеть занимается распознаванием букв алфавита, то после успешного обучения на выходе будут активны нейроны, соответствующие этим буквам.
Для того чтобы сеть могла правильным образом классифицировать входной сигнал, связи между нейронами должны быть правильно подобраны. В 1943 году нейрофизиолог Фрэнк Розенблатт создал модель, которая называется перцептрон (от лат. perceptio — восприятие) [9]. Она работает следующим образом: в начале обучения связи между нейронами являются одинаковыми, затем сети предъявляются различные буквы по нескольку раз, и если буквы классифицируются на выходных нейронах правильно, то связи, приводящие к правильной классификации, усиливаются, а если нет, то ослабляются [13]. Таким образом, после предъявления большого количества стимулов сеть учится их распознавать. При этом, чем больше букв необходимо выучить сети, тем бóльшим должно быть количество нейронов. В качестве результата сеть может распознавать буквы, которые лишь отдаленно напоминают те, которые использовались при обучении. Более того, буквы могут быть повреждены или написаны другим шрифтом, но сеть все равно будет способна их распознать!
На самом деле многие программы в компьютере используют такой подход: например, программа Fine Reader, которая распознает изображение и переводит его в текст, использует в своей работе нейросети. По такому же принципу работает распознавание рукописного ввода на смартфонах и планшетах.
Генетические алгоритмы
Еще одним подходом в программировании, вдохновленным биологией, являются эволюционные алгоритмы (рис. 7). В рамках этого подхода занимаются моделированием процесса биологической эволюции, только вместо живых организмов используются программы [10]. На первый взгляд у алгоритмов и животных мало общего, но, если присмотреться, можно увидеть похожее.
Под алгоритмом в общем случае подразумевают последовательный набор действий, который приводит к желаемому результату за конечное число ходов. Например, чтобы прийти в университет, необходимо: 1) проснуться, 2) умыться, 3) одеться, 4) позавтракать, 5) собраться, 6) пойти. Конечно, детали алгоритмов могут быть разными: например, кому-то не нужно собирать вещи, потому что они были собраны вчера. Но важным является то, что в любом случае выполняется последовательность действий, приводящая к нужному результату.
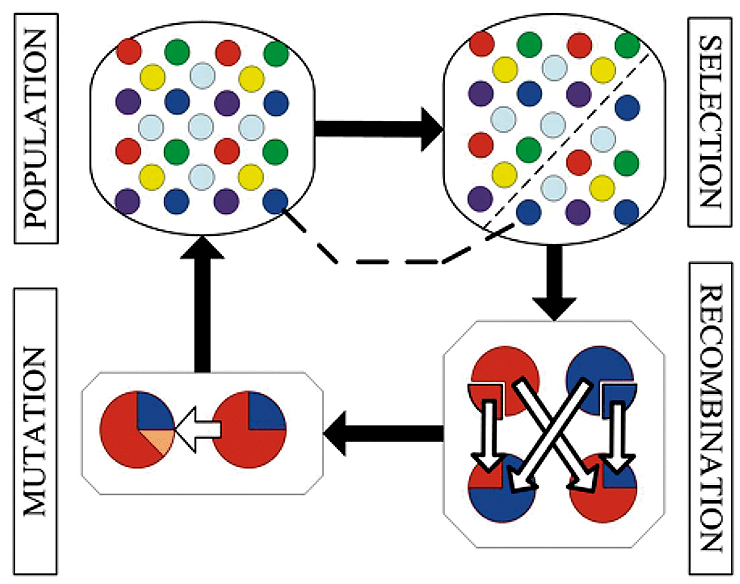
Рисунок 7. Принцип работы генетических алгоритмов. В начале рассматривается популяция алгоритмов, которые выполняют определенную задачу. Затем вводится правило, в соответствии с которым селективно выбираются только те из них, которые способны выполнить задачу лучше других. Затем алгоритмы обмениваются отдельными частями, чтобы получить новые на этапе рекомбинации. После этого на этапе мутаций в алгоритмы вносятся небольшие случайные изменения, чтобы увеличитель их разнообразие. Затем процедура выбора алгоритмов повторяется много раз, и на завершающем этапе остаются только те алгоритмы, которые выполняют задачу наилучшим образом.
Для того, чтобы алгоритмы могли эволюционировать, их разделяют на отдельные части, которые можно менять между собой. Например:
- проснуться—умыться—одеться—позавтракать—собраться—пойти;
- проснуться—собраться—одеться—позавтракать—умыться—пойти и т.д.
Также необходимо отказаться от невозможных вариантов: к примеру, алгоритм «одеться→позавтракать→проснуться→…» невозможен по понятным причинам.
После этого оценивают работу каждого алгоритма и выбирают наилучший. К примеру, в случае с походом в университет лучшим алгоритмом будет самый быстрый. Затем производится обмен их частей между собой и внесение мутаций (добавление и/или видоизменение действий), после чего появляются новые алгоритмы, которые снова оцениваются. Таким образом, через несколько поколений отбираются именно те, которые справляются с задачей лучше всего. Такие алгоритмы часто используют в биоинформатике, инженерном деле и многих других приложениях, чтобы находить наилучшие решения.
Во что играть против робота?
В 1994 году программа Chinook стала чемпионом мира по шашкам, впоследствии защитив этот титул в 1996 году. В 2007 году команда разработчиков Chinook закончила полный анализ всех возможных комбинаций этой игры, и Chinook стала непобедимой. На сегодняшний день шашки — самая сложная полностью проанализированная игра; в ней имеется 5×1020 возможных комбинаций фигур на игровом поле.
Но не стоит отчаиваться, потому что все еще существуют игры, в которых человек легко побеждает компьютер [11]. Например, к ним относится китайская игра го (рис. 8). Выглядит она достаточно просто: поле состоит из сетки 19×19 и двух видов шашек: черных и белых. Целью игры является захват территории — это чем-то напоминает игру в точки. Однако, несмотря на простоту правил, ней существует огромное количество возможных комбинаций. Если в шахматах после четвертого хода от начала партии может возникнуть несколько сотен тысяч различных вариантов, то в го их число превышает шестнадцать миллиардов. Так что пока человек все еще непобедимый соперник в некоторых играх против компьютера.
Рисунок 8. Игра го считается одной из наиболее сложных логических игр для освоения компьютером. Уже средние игроки легко побеждают любые существующие на данный момент компьютерные программы.
Заменят ли роботы ученых?
Казалось бы, кому, как не ученым, меньше всего стоит бояться того, что машины смогут конкурировать с ними? Не тут-то было: программисты из Массачусетского технологического института создали программу под названием SCIgen, способную «писать» тексты, посвященные разработке новых компьютерных алгоритмов, с иллюстрациями, графиками, ссылками и всеми остальными необходимыми атрибутами [12]! Правда, эти тексты похожи на научные статьи лишь по форме, а их осмысленность стремится к нулю.
Авторы создали эту программу для того, чтобы вывести на чистую воду конференции, которые публикуют присылаемые на них тезисы не глядя, и им это удалось. Тексты, сгенерированные программой, были приняты к публикации в сборниках тезисов сразу нескольких конференций. Группа российских ученых решила проверить, насколько тщательно подходят к отбору статей в отечественных журналах, и перевела текст, сгенерированный SCIgen, на русский язык. В итоге «статья» под названием «Корчеватель: Алгоритм типичной унификации точек доступа и избыточности» была опубликована в «Журнале научных публикаций аспирантов и докторантов»!
Разумные роботы уже рядом
Итак, полным ходом идет работа над созданием искусственного интеллекта — программ, обладающих, хотя бы частично, свойствами человеческого интеллекта. Пока что лучше всего ученым удается решение конкретных специализированных задач, таких как распознавание образов, автоматизированное написание финансовых отчетов или описание итогов спортивных игр на основе статистических данных о ходе игры.
Однако создание так называемого «сильного» искусственного интеллекта, то есть полноценного искусственного сознания, до сих пор представляется трудно достижимой целью. Тем не менее попытки его создания чрезвычайно полезны, так как позволяют лучше понять, что такое человеческий разум. Сегодня основная работа направлена на создание алгоритмов, позволяющих компьютерам осуществлять логические размышления, собирать, систематизировать и оперировать знаниями об окружающем мире, ставить цели и искать оптимальные пути их достижения, обучаться, распознавать речь и многое другое. «Сильный» искусственный интеллект должен объединять все эти алгоритмы и осуществлять взаимодействие между ними. При этом современные тенденции развития в этой области свидетельствуют о том, что, если «сильный» искусственный интеллект будет создан, большую роль в его создании будут играть нейронные сети, а значит, мы вряд ли будем знать в точности, как он работает. Стоит также отметить любопытное явление: многие успехи в развитии искусственного интеллекта, которые казались невозможными ранее, после их достижения не воспринимаются как «О, это же действительно искусственный разум!» Так что вполне возможно, что мы просто не заметим появление разумных роботов.
Статья написана в соавторстве с Антоном Сабанцевым. Частично материалы статьи были опубликованы в журнале «Я — Леонардо» (лето—осень 2013).
- Jean Livet, Tamily A. Weissman, Hyuno Kang, Ryan W. Draft, Ju Lu, et. al.. (2007). Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature. 450, 56-62;
- Henry Markram. (2006). The Blue Brain Project. Nat Rev Neurosci. 7, 153-160;
- Blue Brain Project: как все связано?;
- Nicolas Brunel, Mark C. W. van Rossum. (2007). Lapicque’s 1907 paper: from frogs to integrate-and-fire. Biol Cybern. 97, 337-339;
- A. L. Hodgkin, A. F. Huxley. (1952). A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117, 500-544;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- Формирование мембранного потенциала покоя;
- Alan M. Turing. (2009). Computing Machinery and Intelligence. Parsing the Turing Test. 23-65;
- F. Rosenblatt. (1958). The perceptron: A probabilistic model for information storage and organization in the brain.. Psychological Review. 65, 386-408;
- Barricelli N.A. (1957). Symbiogenetic evolution processes realized by artificial methods. Methodos. 9, 143–182;
- Johnson G. (1997). To test a powerful computer, play an ancient game. The New York Times;
- Cyril Labbé, Dominique Labbé. (2013). Duplicate and fake publications in the scientific literature: how many SCIgen papers in computer science?. Scientometrics. 94, 379-396;
- Hebb D.O. The organization of behavior: A neuropsychological theory. Psychology Press, 2002;
- Kandel E.R. et al. Principles of neural science. NY: McGraw-Hill, 2000.
Все живые клетки при действии различных
раздражителей (химических, механических,
температурных и пр.) способны переходить
в возбужденное состояние. Опыт показывает,
что возбужденный участок становится
электроотрицательным по отношению к
покоящемуся, что является показателем
перераспределения ионных потоков в
возбужденном участке. Реверсия потенциала
при возбуждении кратковременна, и после
окончания возбуждения через некоторое
время вновь восстанавливается исходный
потенциал покоя. Общее изменение разности
потенциалов на мембране, происходящее
при возбуждении клеток, называется
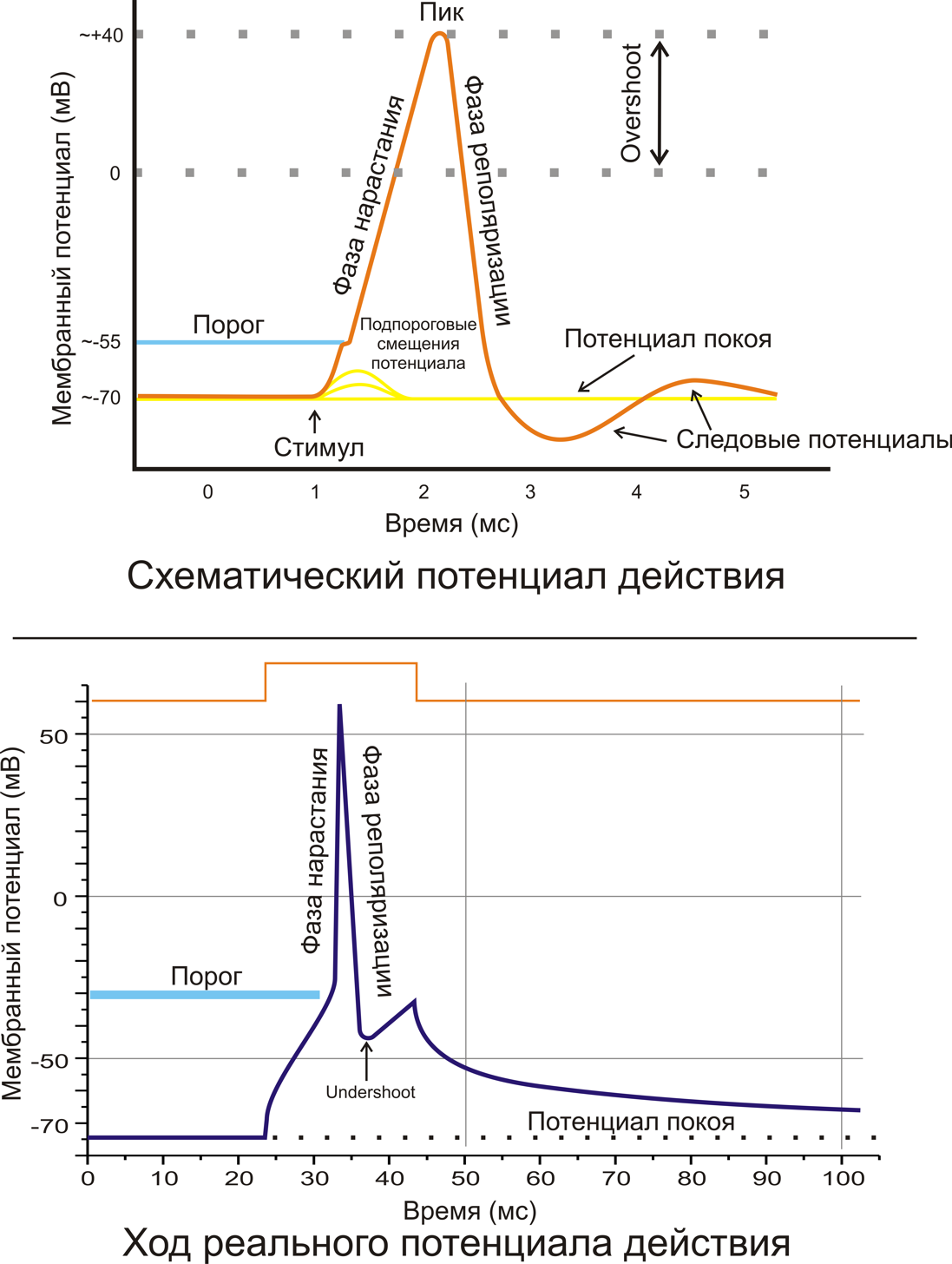
потенциалом действия. На рис. 11.17
представлен потенциал действия
гигантского аксона кальмара, обозначены
отдельные стадии изменения потенциала.
В частности, для клетки характерен так
называемый запаздывающий потенциал,
когда в течение некоторого времени на
мембране существует даже меньший
потенциал, чем потенциал покоя.
Было показано, что возбуждение связано
с увеличением электропроводности
клеточной мембраны. При этом временная
зависимость электропроводимости
повторяла форму потенциала действия.
Чтобы решить вопрос, для каких ионов
изменяется проницаемость м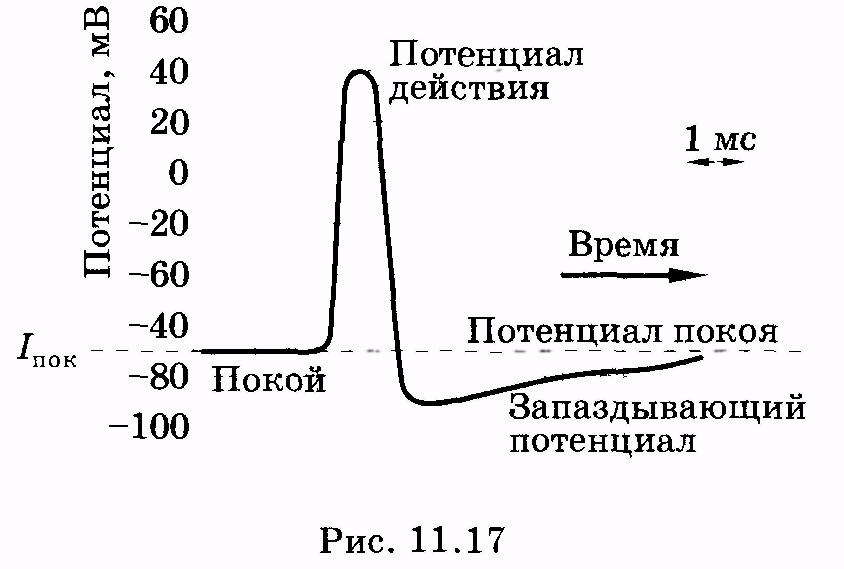
следует обратить внимание, что потенциал
действия приводит к кратковременному
возрастанию потенциала внутри клетки
(см. рис. 11.17). Отрицательный относительно
внешней среды потенциал становится
положительным. Если по уравнению Нернста
(11.38) вычислить равновесные потенциалы
на мембране аксона кальмара, то получим
соответственно для ионов К+, Na+ и Сl—величины -90, +46 и -29 мВ. Так как при
изменении проницаемости мембраны для
какого-либо иона этот ион будет проникать
через нее, стремясь создать равновесное
состояние, то числовые данные показывают,
что внутрь клетки проникают ионы Na+,
создавая там положительный потенциал.
Следовательно, при возбуждении клетки
в начальный период увеличивается
проницаемость мембран именно для ионов
натрия. «Натриевая теория» возникновения
потенциала действия была предложена,
разработана и экспериментально
подтверждена А. Ходжкином и А. Хаксли,
за что в 1963 г. они были удостоены
Нобелевской премии.
Измерить проницаемость мембран для
какого-либо иона (иначе говоря,
электропроводимость или сопротивление
мембраны для этого иона) можно, если на
основании закона Ома найти отношение
тока к напряжению, или наоборот.
Практическая реализация такой задачи
осложняется тем, что проницаемость
(электрическое сопротивление) мембраны
при возбуждении изменяется со временем.
Это приводит к перераспределению
электрического напряжения в цепи, и
разность потенциалов на мембране
изменяется. Ходжкин, Хаксли и Катц смогли
создать опыт с фиксацией определенного
значения разности потенциала на мембране.
Это позволило им провести измерение
ионных токов и, следовательно, проницаемости
(сопротивления) мембран для ионов.
Оказалось, что отношение проницаемостей
мембраны для ионов натрия и калия
практически повторяет форму потенциала
действия. Кроме того, были получены
кривые временной зависимости ионных
токов через мембрану (рис. 11.18). На этом
рисунке кривая1соответствует
временной зависимости суммарного
ионного тока через мембрану гигантского
аксона кальмара, полученного при
изменении потенциала на мембране до
+56 мВ (потенциал покоя равен60
мВ). Вначале направление тока отрицательно,
что соответствует прохождению
положительных ионов через мембрану
клетки. Было установлено, что ток этот
обусловлен прохождением ионов натрия
внутрь клетки, где концентрация их
значительно меньше, чем снаружи.
Естественно, что при таком нарушении
равновесия ионы калия начнут перемещаться
наружу, где их концентрация существенно
меньше. Для того чтобы выяснить, какая
часть тока «натриевая», а какая «калиевая»,
можно провести то же возбуждение, но в
искусственных условиях, когда в среде,
окружающей аксон, нет натрия. В этом
случае (см. кривую 2) ток обусловливается
только выходом ионов калия наружу из
клетки. Разница значений тока для двух
кривых показана на кривой3: кривая3есть разность кривых1и2.
Она дает зависимость от времени ионного
тока натрия. На этой кривой частьасоответствует открыванию натриевых
каналов, аб— их закрытию
(инактивации).
В целом
последовательность событий, происходящих
на клеточной мембране при возбуждении,
выглядит следующим образом. При
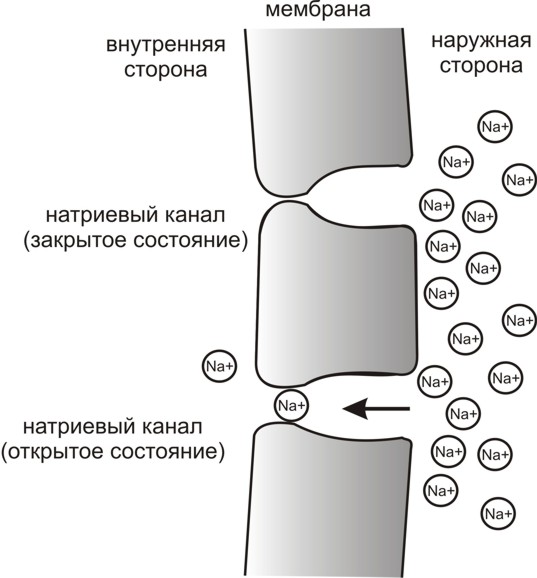
возбуждении в мембране открываются
каналы для ионов натрия (проницаемость
мембраны возрастает более чем в 5000 раз).
В результате отрицательный заряд с
внутренней стороны мембраны становится
положительным, что соответствует пику
мембранного потенциала (фаза деполяризации
мембраны). Затем поступление натрия из
внешней среды прекращается. В это время
натриевые каналы закрываются, но
открываются калиевые. Калий проходит
в соответствии с градиентом концентрации
из клетки до тех пор, пока не восстановится
первоначальный отрицательный заряд на
мембране и мембранный потенциал не
достигнет своего первоначального
значения (фаза реполяризации). На самом
деле выход ионов калия из клетки
продолжается дольше, чем это требуется
для восстановления потенциала покоя.
В результате за пиком потенциала действия
следует небольшой минимум (запаздывающий
потенциал).
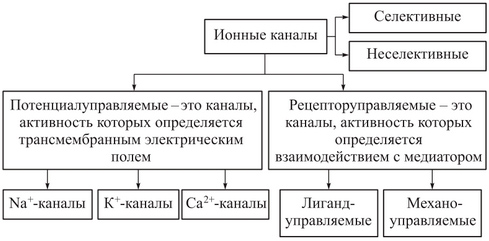
Ионные
каналы имеют белковое происхождение
(см. рис. 11.3 и 11.13). Они селективно
(выборочно) пропускают ионы разного
вида. Канал может быть «закрыт»
(блокирован) молекулами ядов, его
пропускная способность зависит от
действия некоторых лекарственных
средств. Поэтому теория ионных каналов
в мембранах является важной частью
молекулярной фармакологии.
Механизм распространения потенциала
действия в деталях рассматривается в
курсе нормальной физиологии. Мы же
рассмотрим лишь некоторые основные
положения. Распространение потенциала
действия вдоль нервного волокна (аксона)
обусловлено возникновением так называемыхлокальных токов, образующихся
между возбужденным и невозбужденным
участками клетки. На рис. 11.19 схематично
указаны отдельные стадии возникновения
и распространения потенциала действия.
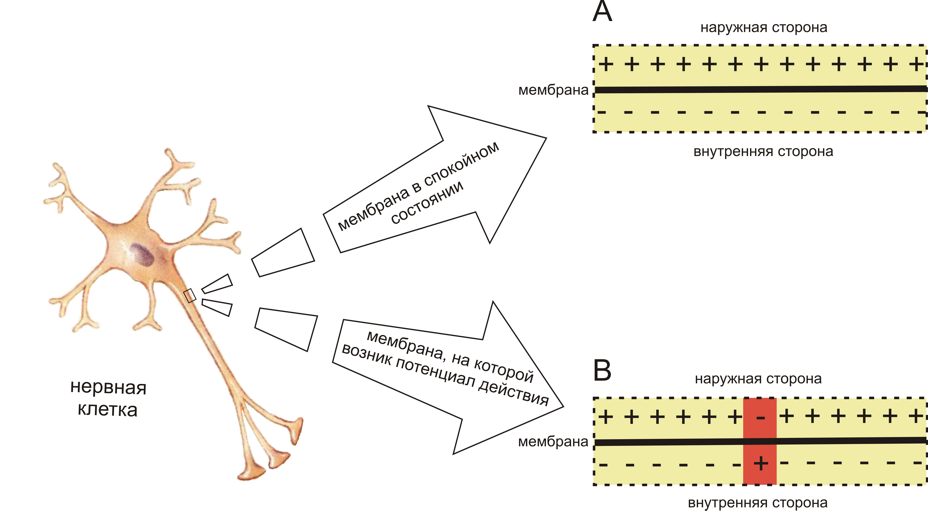
В состоянии покоя (рис. 11.19, а) внешняя
поверхность клеточной мембраны имеет
положительный потенциал, а внутренняя
— отрицательный. В момент возбуждения
полярность мембраны меняется на
противоположную (рис. 11.19,б). В
результате этого между возбужденным и
невозбужденным участками мембраны
возникает разность потенциалов. Наличие
разности потенциалов и приводит к
появлению между этими участкамилокальных
токов. На поверхности клетки локальный
ток течет от невозбужденного участка
к возбужденному; внутри клетки он течет
в обратном направлении (рис. 11.19, в).
Локальный ток, как и любой электрический
ток, раздражает соседние невозбужденные
участки и вызывает увеличение проницаемости
мембраны. Это приводит к возникновению
потенциалов действия в соседних участках.
В то же время в ранее возбужденном
участке происходят восстановительные
процессы реполяризации. Вновь возбужденный
участок в свою очередь становится
электроотрицательным и возникающий
локальный ток раздражает следующий
за ним участок. Этот процесс многократно
повторяется и обусловливает распространение
импульсов возбуждения по всей длине
клетки в обоих направлениях (рис. 11.19,г). В нервной системе импульсы
проходят лишь в определенном
направлении из-за наличия синапсов,
обладающих односторонней проводимостью.
По
электрическим свойствам аксон напоминает
кабель с проводящей сердцевиной и
изолирующей оболочкой. Однако для того
чтобы в кабеле не было значительных
потерь энергии при протекании
тока, сопротивление его должно быть
малым, а сопротивление
изоляции — очень большим. В аксоне
проводящим веществом
служит аксоплазма, т. е. раствор
электролита, удельноесопротивление
которого в миллионыраз
больше, чем у меди или алюминия,
из которых изготавливают обычные
кабели. Удельное сопротивление биомембран
достаточно велико, но вследствие их
малой толщины сопротивление изоляции
«аксонного кабеля» в сотни тысяч раз
меньше, чем у технического кабеля. По
этой причине однородное н
волокно не может проводить электрический
сигнал на далекое расстояние, интенсивность
сигнала быстро затухает. Расчеты
показывают, что напряжение на мембране
волокна будет экспоненциально уменьшаться
по мере удаления от места возбуждения
(рис. 11.20). Если величина потенциала
действия в месте возбуждения была равна mах,
то на расстоянии l
от этого места потенциал на мембране
будет равен:
(11.40)
где
—
постоянная
длины нервного
волокна, которая определяет степень
затухания сигнала в аксоне по
экспоненциальному закону. Эту величину
можно рассчитать по следующей приближеннойформуле:
(11.41)
где
d
— диаметр
волокна, R
— поверхностное
сопротивление мембраны
в Ом • м2
(т. е. сопротивление 1 м2
ее поверхности) и
— удельное сопротивление аксоплазмы
в Ом • м.
Расчеты,
проведенные для аксона кальмара,
показывают, что на
конце аксона величина сигнала должна
быть ничтожно малой. Однако
существование локальных токов приводит
к тому, что возбуждение
передается по нервному волокну без
затухания. Это объясняется тем, что
локальные токи лишь деполяризуют
мембрану до
критического уровня, а потенциалы
действия в каждом участке
мембраны поддерживаются независимыми
ионными потоками, перпендикулярными
к направлению распространения возбуждения.
Из
(11.40) видно, что с увеличением
степень затухания сигнала
уменьшается. Было показано, что при этом
возрастает скорость проведения импульса,
а это очень важно для жизнедеятельности
любого организма. Величины
и
примерно одинаковы
для всех животных
клеток, и поэтому увеличения постоянной
длины
можно добиться путем увеличения диаметра
d
аксона. Именно
поэтому у кальмаров аксоны достигают
«гигантских» размеров (диаметр до 0,5
мм), что обеспечивает кальмару достаточно
быстрое проведение нервного импульса
и, следовательно, быстроту реакции
на внешние раздражители.
У
нервной системой
толстые волокна оказываются неэкономичными,
и затухание сигнала предотвращается
другим способом. Мембраны аксонов у них
покрытымиелином — веществом,
содержащим много холестерина и мало
белка (рис. 11.21). Удельное сопротивление
миелина значительно
выше удельного сопротивления других
биологических мембран. Помимо этого,
толщина миелиновой оболочки во много
раз больше толщины обычной мембраны,
что приводит к возрастанию диаметра
волокна и соответственно величины.
Как видно из рис. 11.21, миелиновая оболочка
не полностью покрывает
все волокно; оно разделено на отдельные
сегменты, между которыми на участках
длиной около 1 мкм мембрана аксона
непосредственно соприкасается с
внеклеточным раствором. Области, вкоторых мембрана
контактирует с раствором, называют
перехватами Ранвье. В связи с
большим сопротивлением миелиновой
оболочки по поверхности
аксона токи протекать не могут, и
затухание сигнала резко уменьшается.
При возбуждении одного узла возникают
токи между ним и другими узлами. Ток,
подошедший к другому узлу, возбуждает
его, вызывает появление в этом местепотенциала действия,
и процесс распространяется по всему
волокну. Затраты энергии на
распространение сигнала по волокну,покрытому миелином,
значительно меньше, чем по
немиелинизированному, так как общее
количество ионов натрия, проходящих
через мембрану
в области узлов, значительно меньше,
чем если бы они проходили через всю
поверхность мембраны. При некоторых
заболеваниях структура миелиновых
оболочек нарушается, и это
приводит к нарушению проведения нервного
возбуждения. При блокировании узлов
нервного волокна анестезирующими
средствами, например ядом кураре,
сопротивление аксона возрастает и
прохождение сигналов по нерву замедляется
или совсемпрекращается.
Поскольку
узлы замыкаются через аксоплазму и
внеклеточную
среду, то можно предположить, что при
увеличении сопротивления внешней среды
скорость проведения нервного импульса
уменьшится. Это предположение было
проверено на опыте. Нервные
волокна сначала помещали в морскую
воду, а затем в масло с большим удельным
сопротивлением. Скорость проведения
импульса во втором случае уменьшалась
в 1,5—2 раза (в зависимости от диаметра
волокна).
Существует
некоторая формальная аналогия между
распространением потенциала действия
по нервному волокну и электромагнитной
волной в двухпроводной линии или
коаксиальном кабеле. Однако между этими
процессами имеется существенное
различие.Электромагнитная
волна, распространяясь в среде, ослабевает,
так как растрачивает свою энергию.
Волна возбуждения, проходящая
по нервному волокну, не затухает, получая
энергию в самой
среде (энергию заряженной мембраны).
Волны, получающие энергию из среды
в процессе распространения, называютавтоволнами,
а среду —
активно-возбудимой
средой (ABC).
В § 11.9
будут рассмотрены более подробно
свойства авто волн, распространяющихся
в ABC.
Соседние файлы в папке лекции 2008-09
- #
- #
- #
- #
- #
- #
- #
Уравнение бернштейна для мембранного потенциала
Разность потенциалов, измеренная между внутренней и наружной поверхностями клеточной мембраны в состоянии физиологического покоя клетки, называется потенциалом покоя.
Потенциал покоя у разных клеток имеет величину от 50 до 100 мВ. Согласно современным взглядам, потенциал покоя по своей природе является мембранным потенциалом. Наличие мембраны приводит к возникновению потенциалов клеток, как в покое, так и при возбуждении. Причина их возникновения – неравномерное распределение ионов калия и натрия между содержимым клеток и межклеточной средой.Концентрация ионов калия внутри клеток в 20—40 раз превышает их содержание в окружающей клетку жидкости. Напротив, концентрация натрия в межклеточной жидкости в 10—20 раз выше, чем внутри клеток. Такое неравномерное распределение ионов обусловлено активным переносом ионов—работой натрий-калиевого насоса.
В 1905 г Бернштейн выдвинул гипотезу возникновения мембранного потенциала в покое. Он утверждал, что разность потенциалов на мембране обусловлена:
1. наличием разности концентраций ионов К + и Na + в цитоплазме клетки и снаружи.
2. В покое мембрана проницаема только для ионов К + .
В связи с этим был выведен равновесный калиевый потенциал, который определяется из уравнения Нернста
Исходя из гипотезы Бернштейна для мышечных волокон мембранный потенциал равен (-110) мВ, а экспериментальные данные давали (-90) мВ. Причина в расхождении в том, что гипотеза Бернштейна не учитывала проницаемость мембраны для других ионов, таких как Na + и Cl – .
Для более точного вычисления потенциала покоя необходимо учитывать не только диффузию ионов калия, но и диффузию натрия и хлора. Уравнение Нернста позволяет описывать мембранный потенциал только в первом приближении; для более точного определения потенциала применяют обобщенное уравнение Гольдмана-Ходжкина-Хаксли:
Е = (RT/ z F)·ln[( Рк·[K.]i + PNa·[Na]i + PCl·[Cl]e) / ( Рк·[K.]e + PNa·[Na]e + PCl·[Cl]i)
где Pk, PNa, PCl — коэффициенты проницаемости мембраны для ионов калия, натрия и хлора; [К], [Na], [Cl] — их активности внутри (i) и вне (е)клетки. Уравнение Гольдмана-Ходжкина-Хаксли позволяет определять мембранный потенциал не только в состоянии покоя, но и при возбуждении клетки. Для этого необходимо знание коэффициентов проницаемости для ионов. По данным Ходжкина и Катца (1949), для аксона кальмара в состоянии покоя отношение коэффициентов проницаемости Рк: Рnа : РCl= 1 : 0,04 : 0,45.
30. Потенциал действия. Изменение проницаемости мембраны для ионов Na+ и К+ при генерировании потенциала действия.
Потенциал действия – это скачкообразное изменение постоянного мембранного потенциала с отрицательной поляризации на положительную и обратно.
Потенциал действия — это возбуждение клетки, быстрое колебание мембранного потенциала вследствие диффузии ионов в клетку и из клетки.
В основе потенциала действия лежат последовательно развивающиеся во времени изменения ионной проницаемости клеточной мембраны.
Как отмечалось, в состоянии покоя проницаемость мембраны для калия превышает ее проницаемость для натрия. Вследствие этого поток К’+ из цитоплазмы во внешний раствор превышает противоположно направленный поток Na+ Поэтому наружная сторона мембраны в покое имеет положительный потенциал по отношению к внутренней.
При действии на клетку раздражителя проницаемость мембраны для Na+ резко повышается и в конечном итоге становится примерно в 20 раз больше проницаемости для К’+. Поэтому поток Na+ из внешнего раствора в цитоплазму начинает превышать направленный наружу калиевый ток. Это приводит к изменению знака (реверсии) мембранного потенциала: внутреннее содержимое клетки становится заряженным положительно по отношению к ее наружной поверхности. Указанное изменение мембранного потенциала соответствует восходящей фазе потенциала действия (фаза деполяризации).
Повышение проницаемости мембраны для Na + продолжается лишь очень короткое время. Вслед за этим проницаемость мембраны для Na + вновь понижается, а для К + возрастает.
Процесс, ведущий к понижению ранее увеличенной натриевой проницаемости мембраны, назван натриевой инактивацией. В результате инактивации поток Na + внутрь цитоплазмы резко ослабляется. Увеличение же калиевой проницаемости вызывает усиление потока К + из цитоплазмы во внешний раствор. В итоге этих двух процессов и происходит реполяризация мембраны: внутреннее содержимое клетки вновь приобретает отрицательный заряд по отношению к наружному раствору. Этому изменению потенциала соответствует нисходящая фаза потенциала действия (фаза реполяризации).
Одним из важных аргументов в пользу натриевой теории происхождения потенциалов действия был факт тесной зависимости его амплитуды от концентрации Na + во внешнем растворе. Опыты на гигантских нервных волокнах, перфузируемых изнутри солевыми растворами, позволили получить прямое подтверждение правильности натриевой теории. Установлено, что при замене аксоплазмы солевым раствором, богатым К + , мембрана волокна не только удерживает нормальный потенциал покоя, но в течение длительного времени сохраняет способность генерировать сотни тысяч потенциалов действия нормальной амплитуды. Если же К + во внутриклеточном растворе частично заменить на Na + и тем самым снизить градиент концентрации Nа + между наружной средой и внутренним раствором, амплитуда потенциала действия резко понижается. При полной замене К + на Na + волокно утрачивает способность генерировать потенциалы действия.
Эти опыты не оставляют сомнения в том, что поверхностная мембрана действительно является местом возникновения потенциала как в покое, так и при возбуждении. Становится очевидным, что разность концентраций Nа + и К + внутри и вне волокна является источником электродвижущей силы, обусловливающей возникновение потенциала покоя и потенциала действия.
На рис. 6 показаны изменения натриевой и калиевой проницаемости мембраны во время генерации потенциала действия в гигантском аксоне кальмара. Аналогичные отношения имеют место в других нервных волокнах, телах нервных клеток, а также в скелетных мышечных волокнах позвоночных животных. В скелетных мышцах ракообразных животных и гладких мышцах позвоночных в генезе восходящей фазы потенциала действия ведущую роль играют ионы Са 2+ . В клетках миокарда начальный подъем потенциала действия связан с повышением проницаемости мембраны для Nа + , а плато потенциала действия обусловлено повышением проницаемости мембраны и для ионов Са 2+
31. Потенциал-зависимые ионные каналы мембраны для К+ и Na+. Структура, особенности функционирования. Изменения проницаемости мембраны для К + и Na+ в различные фазы потенциала действия.
Состояние проницаемости клеточных мембран для различных веществ и, в частности, для минеральных ионов имеет исключительно важное значение в жизнедеятельности клетки и особенно в механизмах восприятия, преобразования, передачи сигналов от клетки к клетке и на внутриклеточные структуры.
Определяющую роль в состоянии проницаемости мембран клетки имеют их ионные каналы, которые формируются каналообразующими белками. Открытие и закрытие этих каналов могут контролироваться величиной разности потенциалов между наружной и внутренней поверхностями мембраны, множеством сигнальных молекул (гормонов, нейромедиаторов, сосудоактивных веществ) вторичными посредниками передачи внутриклеточных сигналов, минеральными ионами.
Ионный канал — несколько субъединиц (интегральных мембранных белков, содержащих трансмембранные сегменты, каждый из которых имеет а-спиральную конфигурацию), обеспечивающих перенос ионов через мембрану.
Рис. 1. Классификация ионных каналов
Современные представления о строении и функции ионных каналов стали возможными благодаря разработке методов регистрации электрических токов, протекающих через изолированный участок мембраны, содержащий одиночные ионные каналы, а также благодаря выделению и клонированию отдельных генов, контролирующих синтез белковых макромолекул, способных формировать ионные каналы. Это позволило искусственно модифицировать структуру таких молекул, встраивать их в мембраны клеток и изучать роль отдельных пептидных участков для выполнения функций каналов. Оказалось, что каналообразующие белковые молекулы всех ионных каналов имеют некоторые общие признаки строения и обычно представлены большими трансмембранными белками с молекулярными массами выше 250 кД.
Они состоят из нескольких субъединиц. Обычно важнейшие свойства каналов определяются их а-субъединнней. Эта субъединица принимает участие в формировании ионоселективной норы, сенсорного механизма трансмембранной разности потенциалов — ворот канала и имеет места связывания для экзогенных и эндогенных лигандов. Другие субъединицы, входящие в структуру ионных каналов, играют вспомогательную роль, модулирующую свойства каналов (рис. 2).
Каналообразующая белковая молекула представлена внемембранными аминокислотными петлями и внутримембранными спирализованными участками-доменами, образующими субъединицы ионных каналов. Белковая молекула сворачивается в плоскости мембраны так, что между контактирующими друг с другом доменами и формируется собственно ионный канал (см. рис. 2, внизу справа).
Каналообразующая молекула белка располагается в цитоплазматической мембране так, что ее трехмерная пространственная структура формирует устья канала, обращенные к наружной и внутренней сторонам мемораны, пору, заполненную водой, и «ворота». Последние образуются участком пептидной цепи, который может легко изменять свою конформацию и определять открытое или закрытое состояние канала. От размеров поры и ее заряда зависят селективность и проницаемость ионного канала. Проницаемость канала для данного иона определяется также его размерами, величиной заряда и гидратной оболочкой.
Рис. 2. Строение Na+ -ионного канала клеточной мембраны: а — двухмерное строение а-еубъединицы ионного канала клеточной .мембраны; б — слева — натриевый канал, состоящий из а-субъединнцы и двух Р-субъединнн (вид сбоку); справа — вил натриевого канала сверху. Цифрами I. II. III. IV отмечены домены а-субъединицы
Типы ионных каналов
Описано более 100 разновидностей ионных каналов, для классификации которых используют различные подходы. Один из них основан на учете различий в строении каналов и в механизмах функционирования. При этом ионные каналы можно разделить на несколько типов:
§ пассивные ионные каналы, или каналы покоя;
§ каналы щелевых контактов;
§ каналы, состояние которых (открытое или закрытое) контролируется влиянием на их воротный механизм механических факторов (механочувствительные каналы), разности потенциалов на мембране (потенциалзависимые каналы) или лигандов, связывающихся с каналообразующим белком на внешней или внутренней стороне мембраны (лигандзависимые каналы).
Натриевые каналы
В клетках организма широко представлены потенциалзависимые, потенциалнезависимые (лигандзависимые, механочувствительные, пассивные и др.) натриевые каналы.
Формирование мембранного потенциала покоя
- 62855
- 36,8
- 30
- 30
Потенциал покоя. В мембране открыты калиевые ионные каналы постоянного тока, закрыты натриевые каналы, работает насос-обменник (Na + /K + -АТФаза).
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Потенциал покоя — это важное явление в жизни всех клеток организма, и важно знать, как он формируется. Однако это сложный динамический процесс, трудный для восприятия целиком, особенно для студентов младших курсов (биологических, медицинских и психологических специальностей) и неподготовленных читателей. Впрочем, при рассмотрении по пунктам, вполне возможно понять его основные детали и этапы. В работе вводится понятие потенциала покоя и выделяются основные этапы его формирования с использованием образных метафор, помогающих понять и запомнить молекулярные механизмы формирования потенциала покоя.
«Био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
Мембранные транспортные структуры — натрий-калиевые насосы — создают предпосылки для возникновения потенциала покоя. Предпосылки эти — разность в концентрации ионов на внутренней и наружной сторонах клеточной мембраны. Отдельно проявляет себя разность концентрации по натрию и разность концентрации по калию. Попытка ионов калия (K + ) выровнять свою концентрацию по обе стороны мембраны приводит к его утечке из клетки и потере вместе с ними положительных электрических зарядов, за счёт чего значительно усиливается общий отрицательный заряд внутренней поверхности клетки. Эта «калиевая» отрицательность составляет бóльшую часть потенциала покоя (−60 мВ в среднем), а меньшую его часть (−10 мВ) составляет «обменная» отрицательность, вызванная электрогенностью самого ионного насоса-обменника.
Давайте разбираться подробнее.
Зачем нам нужно знать, что такое потенциал покоя и как он возникает?
Вы знаете, что такое «животное электричество»? Откуда в организме берутся «биотоки»? Как живая клетка, находящаяся в водной среде, может превратиться в «электрическую батарейку» и почему она моментально не разряжается?
На эти вопросы можно ответить только в том случае, если узнать, как клетка создаёт себе разность электрических потенциалов (потенциал покоя) на мембране.
Совершенно очевидно, что для понимания того, как работает нервная система, необходимо вначале разобраться, как работает её отдельная нервная клетка — нейрон. Главное, что лежит в основе работы нейрона — это перемещение электрических зарядов через его мембрану и появление вследствие этого на мембране электрических потенциалов. Можно сказать, что нейрон, готовясь к своей нервной работе, вначале запасает энергию в электрической форме, а затем использует ее в процессе проведения и передачи нервного возбуждения.
Таким образом, наш самый первый шаг к изучению работы нервной системы — это понять, каким образом появляется электрический потенциал на мембране нервных клеток. Этим мы и займёмся, и назовём этот процесс формированием потенциала покоя.
Определение понятия «потенциал покоя»
В норме, когда нервная клетка находится в физиологическом покое и готова к работе, у неё уже произошло перераспределение электрических зарядов между внутренней и наружной сторонами мембраны. За счёт этого возникло электрическое поле, и на мембране появился электрический потенциал — мембранный потенциал покоя.
Как известно из физики, электрические заряды (движущиеся и неподвижные) формируют в пространстве электромагнитное поле, которое влияет на тела, обладающие электрическим зарядом. С точки зрения электромагнетизма клеточную мембрану можно представить как плоский конденсатор, заполненный однородным диэлектриком из неполярных молекул. Если конденсатор заряжен, то внутри него возникает электрическое поле, обусловленное поверхностной плотностью заряда. На поверхности мембраны возникают некомпенсированные заряды: положительные у «отрицательной» поверхности и отрицательные — у «положительной» [6].
Таким образом, мембрана оказывается поляризованной. Это означает, что она имеет разный электрический потенциал наружной и внутренней поверхностей. Разность между этими потенциалами вполне возможно зарегистрировать.
В этом можно убедиться, если ввести внутрь клетки микроэлектрод, соединённый с регистрирующей установкой. Как только электрод попадает внутрь клетки, он мгновенно приобретает некоторый постоянный электроотрицательный потенциал по отношению к электроду, расположенному в окружающей клетку жидкости. Величина внутриклеточного электрического потенциала у нервных клеток и волокон, например, гигантских нервных волокон кальмара, в покое составляет около −70 мВ. Эту величину называют мембранным потенциалом покоя (МПП). Во всех точках аксоплазмы этот потенциал практически одинаков.
Ноздрачёв А.Д. и др. Начала физиологии [5].
Ещё немного физики. Макроскопические физические тела, как правило, электрически нейтральны, т.е. в них в равных количествах содержатся как положительные, так и отрицательные заряды. Зарядить тело можно, создав в нем избыток заряженных частиц одного вида, например, трением о другое тело, в котором при этом образуется избыток зарядов противоположного вида. Учитывая наличие элементарного заряда (e), полный электрический заряд любого тела можно представить как q = ±N×e, где N — целое число.
Потенциал электростатического поля φ определяется как отношение потенциальной энергии W пробного заряда q к величине этого заряда: φ = W/q, откуда следует, что потенциал численно равен потенциальной энергии, которой обладает в данной точке поля единичный положительный заряд. Единицей измерения потенциала служит вольт (1 В) [4]. В некоторых случаях потенциал электрического поля нагляднее определяется как физическая величина, численно равная работе внешних сил против сил электрического поля E при перемещении единичного положительного точечного заряда из бесконечности в данную точку. Последнее определение удобно записать следующим образом:
В электрофизиологии кроме потенциала покоя рассматриваются и другие электрические потенциалы: локальные постсинаптические и рецепторные потенциалы (возбуждающие и тормозные), электротонические и следовые потенциалы, миниатюрные потенциалы концевой пластинки, концентрационный потенциал и потенциал действия [5].
Потенциал покоя — это разность электрических потенциалов, имеющихся на внутренней и наружной сторонах мембраны, когда клетка находится в состоянии физиологического покоя. Его величина измеряется изнутри клетки, она отрицательна и составляет в среднем −70 мВ (милливольт), хотя в разных клетках может быть различной: от −35 мВ до −90 мВ.
Важно учитывать, что в нервной системе электрические заряды представлены не электронами, как в обычных металлических проводах, а ионами — химическими частицами, имеющими электрический заряд. И вообще в водных растворах в виде электрического тока перемещаются не электроны, а ионы. Поэтому все электрические токи в клетках и окружающей их среде — это ионные токи.
Итак, изнутри клетка в покое заряжена отрицательно, а снаружи — положительно. Это свойственно всем живым клеткам, за исключением, разве что, эритроцитов, которые, наоборот, заряжены отрицательно снаружи. Если говорить конкретнее, то получается, что снаружи вокруг клетки будут преобладать положительные ионы (катионы Na + и K + ), а внутри — отрицательные ионы (анионы органических кислот, не способные свободно перемещаться через мембрану, как Na + и K + ).
Теперь нам всего лишь осталось объяснить, каким же образом всё получилось именно так. Хотя, конечно, неприятно сознавать, что все наши клетки кроме эритроцитов только снаружи выглядят положительными, а внутри они — отрицательные.
Термин «отрицательность», который мы будем применять для характеристики электрического потенциала внутри клетки, пригодится нам для простоты объяснения изменений уровня потенциала покоя. В этом термине ценно то, что интуитивно понятно следующее: чем больше отрицательность внутри клетки — тем ниже в отрицательную сторону от нуля смещён потенциал, а чем меньше отрицательность — тем ближе отрицательный потенциал к нулю. Это намного проще понять, чем каждый раз разбираться в том, что же именно означает выражение «потенциал возрастает» — возрастание по абсолютному значению (или «по модулю») будет означать смещение потенциала покоя вниз от нуля, а просто «возрастание» — смещение потенциала вверх к нулю. Термин «отрицательность» не создаёт подобных проблем неоднозначности понимания.
Сущность формирования потенциала покоя
Попробуем разобраться, откуда берётся электрический заряд нервных клеток, хотя их никто не трёт, как это делают физики в своих опытах с электрическими зарядами.
Здесь исследователя и студента поджидает одна из логических ловушек: внутренняя отрицательность клетки возникает не из-за появления лишних отрицательных частиц (анионов), а, наоборот, из-за потери некоторого количества положительных частиц (катионов)!
Так куда же деваются из клетки положительно заряженные частицы? Напомню, что это покинувшие клетку и скопившиеся снаружи ионы натрия — Na + — и калия — K + .
Главный секрет появления отрицательности внутри клетки
Сразу откроем этот секрет и скажем, что клетка лишается части своих положительных частиц и заряжается отрицательно за счёт двух процессов:
- вначале она обменивает «свой» натрий на «чужой» калий (да-да, одни положительные ионы на другие, такие же положительные);
- потом из неё происходит утечка этих «наменянных» положительных ионов калия, вместе с которыми из клетки утекают положительные заряды.
Эти два процесса нам и надо объяснить.
Первый этап создания внутренней отрицательности: обмен Na + на K +
В мембране нервной клетки постоянно работают белковые насосы-обменники (аденозинтрифосфатазы, или Na + /K + -АТФазы), встроенные в мембрану. Они меняют «собственный» натрий клетки на наружный «чужой» калий.
Но ведь при обмене одного положительного заряда (Na + ) на другой такой же положительный заряд (K + ) никакого дефицита положительных зарядов в клетке возникать не может! Правильно. Но, тем не менее, из-за этого обмена в клетке остаётся очень мало ионов натрия, потому что они почти все ушли наружу. И в то же время клетка переполняется ионами калия, которые в неё накачали молекулярные насосы. Если бы мы могли попробовать на вкус цитоплазму клетки, мы бы заметили, что в результате работы насосов-обменников она превратилась из солёной в горько-солёно-кислую, потому что солёный вкус хлорида натрия сменился сложным вкусом довольно-таки концентрированного раствора хлорида калия. В клетке концентрация калия достигает 0,4 моль/л. Растворы хлорида калия в пределах 0,009–0,02 моль/л имеют сладкий вкус, 0,03–0,04 — горький, 0,05–0,1 — горько-солёный, а начиная с 0,2 и выше — сложный вкус, состоящий из солёного, горького и кислого [8].
Важно здесь то, что обмен натрия на калий — неравный. За каждые отданные клеткой три иона натрия она получает всего два иона калия. Это приводит к потере одного положительного заряда при каждом акте ионного обмена. Так что уже на этом этапе за счёт неравноценного обмена клетка теряет больше «плюсов», чем получает взамен. В электрическом выражении это составляет примерно −10 мВ отрицательности внутри клетки. (Но помните, что нам надо ещё найти объяснение для оставшихся −60 мВ!)
Чтобы легче было запомнить работу насосов-обменников, образно можно выразиться так: «Клетка любит калий!» Поэтому клетка и затаскивает калий к себе, несмотря на то, что его и так в ней полно. И поэтому она невыгодно обменивает его на натрий, отдавая 3 иона натрия за 2 иона калия. И поэтому она тратит на этот обмен энергию АТФ. И как тратит! До 70% всех энергозатрат нейрона может уходить на работу натрий-калиевых насосов. (Вот что делает любовь, пусть она даже и не настоящая!)
Кстати, интересно, что клетка не рождается с готовым потенциалом покоя. Ей его ещё надо создать. Например, при дифференцировке и слиянии миобластов потенциал их мембраны изменяется от −10 до −70 мВ, т.е. их мембрана становится более отрицательной — поляризуется в процессе дифференцировки. А в экспериментах на мультипотентных мезенхимальных стромальных клетках костного мозга человека искусственная деполяризация, противодействующая потенциалу покоя и уменьшающая отрицательность клеток, даже ингибировала (угнетала) дифференцировку клеток [1].
Образно говоря, можно выразиться так: Создавая потенциал покоя, клетка «заряжается любовью». Это любовь к двум вещам:
- любовь клетки к калию (поэтому клетка насильно затаскивает его к себе);
- любовь калия к свободе (поэтому калий покидает захватившую его клетку).
Механизм насыщения клетки калием мы уже объяснили (это работа насосов-обменников), а механизм ухода калия из клетки объясним ниже, когда перейдём к описанию второго этапа создания внутриклеточной отрицательности. Итак, результат деятельности мембранных ионных насосов-обменников на первом этапе формирования потенциала покоя таков:
- Дефицит натрия (Na + ) в клетке.
- Избыток калия (K + ) в клетке.
- Появление на мембране слабого электрического потенциала (−10 мВ).
Можно сказать так: на первом этапе ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад) концентрации, между внутриклеточной и внеклеточной средой.
Второй этап создания отрицательности: утечка ионов K + из клетки
Итак, что начинается в клетке после того, как с ионами поработают её мембранные натрий-калиевые насосы-обменники?
Из-за образовавшегося дефицита натрия внутри клетки этот ион при каждом удобном случае норовит устремиться внутрь: растворённые вещества всегда стремятся выровнять свою концентрацию во всём объёме раствора. Но это у натрия получается плохо, поскольку ионные натриевые каналы обычно закрыты и открываются только при определённых условиях: под воздействием специальных веществ (трансмиттеров) или при уменьшении отрицательности в клетке (деполяризации мембраны).
В то же время в клетке имеется избыток ионов калия по сравнению с наружной средой — потому что насосы мембраны насильно накачали его в клетку. И он, тоже стремясь уравнять свою концентрацию внутри и снаружи, норовит, напротив, выйти из клетки. И это у него получается!
Ионы калия K + покидают клетку под действием химического градиента их концентрации по разные стороны мембраны (мембрана значительно более проницаема для K + , чем для Na + ) и уносят с собой положительные заряды. Из-за этого внутри клетки нарастает отрицательность.
Тут ещё важно понять то, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов надо по отдельности рассматривать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию по калию внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это, бывает, делается в учебниках.
По закону выравнивания химических концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку; туда же его влечёт и электрическая сила (как мы помним, цитоплазма заряжена отрицательно). Хотеть-то он хочет, но не может, так как мембрана в обычном состоянии плохо его пропускает. Натриевые ионные каналы, имеющиеся в мембране, в норме закрыты. Если все же его заходит немножко, то клетка сразу же обменивает его на наружный калий с помощью своих натрий-калиевых насосов-обменников. Получается, что ионы натрия проходят через клетку как бы транзитом и не задерживаются в ней. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Он выходит наружу через особые каналы в мембране — «калиевые каналы утечки», которые в норме открыты и выпускают калий [5, 7].
К + -каналы утечки постоянно открыты при нормальных значениях мембранного потенциала покоя и проявляют взрывы активности при сдвигах мембранного потенциала, которые длятся несколько минут и наблюдаются при всех значениях потенциала. Усиление К + -токов утечки ведёт к гиперполяризации мембраны, тогда как их подавление — к деполяризации. . Однако, существование канального механизма, ответственного за токи утечки, долгое время оставалось под вопросом. Только сейчас стало ясно, что калиевая утечка — это ток через специальные калиевые каналы.
Зефиров А.Л. и Ситдикова Г.Ф. Ионные каналы возбудимой клетки (структура, функция, патология) [7].
От химического — к электрическому
А теперь — ещё раз самое главное. Мы должны осознанно перейти от движения химических частиц к движению электрических зарядов.
Калий (K + ) положительно заряжен, и поэтому он, когда выходит из клетки, выносит из неё не только самого себя, но и положительный заряд. За ним изнутри клетки к мембране тянутся «минусы» — отрицательные заряды. Но они не могут просочиться через мембрану — в отличие от ионов калия — т.к. для них нет подходящих ионных каналов, и мембрана их не пропускает. Помните про оставшиеся необъяснёнными нами −60 мВ отрицательности? Это и есть та самая часть мембранного потенциала покоя, которую создаёт утечка ионов калия из клетки! И это — большая часть потенциала покоя.
Для этой составной части потенциала покоя есть даже специальное название — концентрационный потенциал [5]. Концентрационный потенциал — это часть потенциала покоя, созданная дефицитом положительных зарядов внутри клетки, образовавшимся за счёт утечки из неё положительных ионов калия.
Ну, а теперь немного физики, химии и математики для любителей точности.
Электрические силы связаны с химическими по уравнению Гольдмана. Его частным случаем является более простое уравнение Нернста, по формуле которого можно рассчитать трансмембранную диффузионную разность потенциалов на основе различной концентрации ионов одного вида по разные стороны мембраны. Так, зная концентрацию ионов калия снаружи и внутри клетки, можно рассчитать калиевый равновесный потенциал EK:
где Ек — равновесный потенциал, R — газовая постоянная, Т — абсолютная температура, F — постоянная Фарадея, К + внеш и K + внутр — концентрации ионов К + снаружи и внутри клетки, соответственно. По формуле видно, что для расчёта потенциала между собой сравниваются концентрации ионов одного вида — K + .
Более точно итоговая величина суммарного диффузионного потенциала, который создаётся утечкой нескольких видов ионов, рассчитывается по формуле Гольдмана-Ходжкина-Катца. В ней учтено, что потенциал покоя зависит от трех факторов: (1) полярности электрического заряда каждого иона; (2) проницаемости мембраны Р для каждого иона; (3) [концентраций соответствующих ионов] внутри (внутр) и снаружи мембраны (внеш). Для мембраны аксона кальмара в покое отношение проводимостей РK : PNa :PCl = 1 : 0,04 : 0,45 [5].
Заключение
Итак, поте нциал покоя состоит из двух частей:
- −10 мВ, которые получаются от «несимметричной» работы мембранного насоса-обменника (ведь он больше выкачивает из клетки положительных зарядов (Na + ), чем закачивает обратно с калием).
- Вторая часть — это всё время утекающий из клетки калий, уносящий положительные заряды. Его вклад — основной: −60 мВ. В сумме это и дает искомые −70 мВ.
Что интересно, калий перестанет выходить из клетки (точнее, его вход и выход уравниваются) только при уровне отрицательности клетки −90 мВ. В этом случае сравняются химические и электрические силы, проталкивающие калий через мембрану, но направляющие его в противоположные стороны. Но этому мешает постоянно подтекающий в клетку натрий, который несёт с собой положительные заряды и уменьшает отрицательность, за которую «борется» калий. И в итоге в клетке поддерживается равновесное состояние на уровне −70 мВ.
Вот теперь мембранный потенциал покоя окончательно сформирован.
Схема работы Na + /K + -АТФазы наглядно иллюстрирует «несимметричный» обмен Na + на K + : выкачивание избыточного «плюса» в каждом цикле работы фермента приводит к отрицательному заряжению внутренней поверхности мембраны. Чего в этом ролике не сказано, так это того, что АТФаза ответственна за менее чем 20% потенциала покоя (−10 мВ): оставшаяся «отрицательность» (−60 мВ) появляется за счет выхода из клетки через «калиевые каналы утечки» ионов K + , стремящихся выровнять свою концентрацию внутри клетки и вне нее.
Потенциал покоя. Уравнение Нернста. Уравнение Гольдмана-Ходжкина-Катца
Потенциал покоя (ПП, мембранный потенциал покоя). ПП называется разность потенциалов между внутренней и наружной сторонами клеточной мембраны, возникающей в состоянии покоя клетки. У живых клеток в покое между внутренним содержимым клетки и наружным раствором существует отрицательная разность потенциалов (ПП) порядка 60—90 мВ, которая локализована на поверхностной мембране. Внутренняя сторона мембраны заряжена электроотрицательно по отношению к наружной. ПП обусловлен избирательной проницаемостью покоящейся мембраны для ионов К + (Ю. Бернштейн, 1902, 1912. А. Ходжкин и Б. Катц, 1947).
Предположим, что клетку с мембраной, проницаемой только для ионов калия, поместили в электролит, где их концентрация меньше, чем внутри клетки. Сразу после соприкосновения мембраны с раствором ионы калия начнут выходить из клетки наружу, как выходит газ из надутого шара. Но каждый ион несет с собой положительный электрический заряд, и чем больше ионов калия покинет клетку, тем более электроотрицательным станет ее содержимое. Поэтому на каждый ион калия, выходящий из клетки, будет действовать электрическая сила, препятствующая его движению наружу. В конце концов, установится равновесие, при котором электрическая сила, действующая на ион калия в канале мембраны, будет равна силе, обусловленной различием концентраций ионов калия внутри и вне клетки. Очевидно, что в результате такого равновесия между внутренним и наружным растворами появится разность потенциалов. При этом, если за нуль потенциала принять потенциал внешнего раствора, то потенциал внутри клетки будет отрицательным. Эта разность потенциалов – самое простое из наблюдаемых биоэлектрических явлений – носит название «потенциал покоя» клетки. В первом приближении величину ПП можно рассчитать с помощью формулы Нернста:

где 

Подставляя численные значения в формулу Нернста, получим значение ПП порядка -87 мВ, что весьма близко к экспериментально измеренному значению ПП. Дальнейшие исследования показали, что вклад в формирование ПП вносят не только ионы калия, но и ионы натрия и хлора.
Концентрация К + в протоплазме примерно в 50 раз выше, чем во внеклеточной жидкости, поэтому, диффундируя из клетки, ионы выносят на наружную сторону мембраны положительные заряды, при этом внутренняя сторона мембраны, практически не проницаемой для крупных органических анионов, приобретает отрицательный потенциал. Поскольку проницаемость мембраны в покое для Na + примерно в 100 раз ниже, чем для К + , диффузия натрия из внеклеточной жидкости (где он является основным катионом) в протоплазму мала и лишь незначительно снижает ПП, обусловленный ионами К + .
В скелетных мышечных волокнах в возникновении потенциала покоя важную роль играют также ионы Cl – , диффундирующие внутрь клетки. Следствием ПП является ток покоя, регистрируемый между поврежденным и интактным участками нерва или мышцы при приложении отводящих электродов. Мембраны нервных и мышечных клеток (волокон) способны изменять ионную проницаемость в ответ на сдвиги мембранного потенциала. При увеличении ПП (гиперполяризация мембраны) проницаемость поверхностных клеточных мембран для Na + и К + падает, а при уменьшении ПП (деполяризация) она возрастает, причём скорость изменений проницаемости для Na + значительно превышает скорость увеличения проницаемости мембраны для К + . Более точные значения для ПП вычисляются по формуле Гольдмана-Ходжкина-Катца (ГХК), которая учитывает проницаемость КМ в покое не только для ионов калия, но и для ионов натрия и хлора:

где PK, PNa, PCl – проницаемость КМ для ионов калия, натрия и хлора, выражения […]i и […]0 обозначают концентрации соответствующих молекул внутри и вне клетки.
В качестве примера вычислим величину ПП для гигантского аксона кальмара. Концентрации ионов внутри и вне аксона приведены ниже (см. таблицу).
| Ион | Концентрация (моль на 1 кг воды) |
| Внутри (i) | Вне (0) |
| Na + | |
| K + | |
| Cl – |
В состоянии покоя при физиологических условиях соотношение коэффициентов проницаемости равно:
Диффузия ионов калия и хлора идет через КМ в обе стороны. Натрий за счет механизма пассивного транспорта проникает внутрь аксона и за счет активного транспорта выносится из клетки. Следовательно, основной вклад в формирование ПП вносят ионы калия и хлора. Подставив численные значения проницаемостей и концентраций для ионов калия хлора в формулу Гольдмана-Ходжкина-Катца для температуры t=30 0 C вычислим:
Значение ПП, вычисленное по формуле Нернста, равно:
Формула Нернста дает несколько заниженное значение потенциала покоя, а формула ГХК приводит к более реалистичным значениям ПП, измеренным экспериментально на крупных клетках.
Следует также отметить, что ни формула Нернста, ни формула ГХК не учитывают механизма активного транспорта.
Формула Томаса для ПП учитывает работу электрогенных ионных Na-K- насосов и имеет вид:

где m – отношение количества ионов натрия к количеству ионов калия, переносимых натрий-калиевым насосом через КМ. Наиболее распространенный режим работы Na + -K + -АТФ-азы наблюдается при m=3/2. В уравнении Томаса отсутствуют члены PCl[Cl – ], так как нет активного транспорта для ионов хлора через КМ.
Численное значение ПП по формуле Томаса равно:

Коэффициент m, применяемый в уравнении Томаса, усиливает вклад градиента концентрации ионов калия в формирование ПП. Поэтому ПП, рассчитанный по формуле Томаса, по абсолютному значению меньше ПП, рассчитанного по формуле ГХК. Значение ПП, полученное с помощью формулы Томаса, хорошо совпадает со значениями ПП, измеренными экспериментально на мелких клетках.
источники:
http://biomolecula.ru/articles/formirovanie-membrannogo-potentsiala-pokoia
http://megalektsii.ru/s23176t4.html
Потенциал действия — волна возбуждения, перемещающаяся по мембране живой клетки в процессе передачи нервного сигнала. По сути своей представляет электрический разряд — быстрое кратковременное изменение потенциала на небольшом участке мембраны возбудимой клетки (нейрона, мышечного волокна или железистой клетки), в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к соседним участкам мембраны, тогда как его внутренняя поверхность становится положительно заряженной по отношению к соседним участкам мембраны. Потенциал действия является физической основой нервного или мышечногоимпульса, играющего сигнальную (регуляторную) роль.
Рис. 1. Схема распределения зарядов по разные стороны мембраны возбудимой клетки в спокойном состоянии (A) и при возникновении потенциала действия (B) (см. объяснения в тексте)
Потенциалы действия могут различаться по своим параметрам в зависимости от типа клетки и даже на различных участках мембраны одной и той же клетки. Наиболее характерный пример различий: потенциал действия сердечной мышцыи потенциал действия большинства нейронов. Тем не менее, в основе любого потенциала действия лежат следующие явления:
- Мембрана живой клетки поляризована — её внутренняя поверхность заряжена отрицательно по отношению к внешней благодаря тому, что в растворе возле её внешней поверхности находится бо́льшее количество положительно заряженных частиц (катионов), а возле внутренней поверхности — бо́льшее количество отрицательно заряженных частиц (анионов).
- Мембрана обладает избирательной проницаемостью — её проницаемость для различных частиц (атомов или молекул) зависит от их размеров, электрического заряда и химических свойств.
- Мембрана возбудимой клетки способна быстро менять свою проницаемостъ для определённого вида катионов, вызывая переход положительного заряда с внешней стороны на внутреннюю (Рис.1).
Первые два свойства характерны для всех живых клеток. Третье же является особенностью клеток возбудимых тканей и причиной, по которой их мембраны способны генерировать и проводить потенциалы действия.
- Фазы потенциала действия
- Предспайк — процесс медленной деполяризации мембраны до критического уровня деполяризации (местное возбуждение, локальный ответ).
- Пиковый потенциал, или спайк, состоящий из восходящей части (деполяризация мембраны) и нисходящей части (реполяризация мембраны).
- Отрицательный следовой потенциал — от критического уровня деполяризации до исходного уровня поляризации мембраны (следовая деполяризация).
- Положительный следовой потенциал — увеличение мембранного потенциала и постепенное возвращение его к исходной величине (следовая гиперполяризация).
Общие положения
Поляризация мембраны живой клетки обусловлена отличием ионного состава с её внутренней и наружной стороны. Когда клетка находится в спокойном (невозбуждённом) состоянии, ионы по разные стороны мембраны создают относительно стабильную разность потенциалов, называемую потенциалом покоя. Если ввести внутрь живой клетки электрод и измерить мембранный потенциал покоя, он будет иметь отрицательное значение (порядка −70 — −90 мВ). Это объясняется тем, что суммарный заряд на внутренней стороне мембраны существенно меньше, чем на внешней, хотя с обеих сторон содержатся и катионы, и анионы. Снаружи — на порядок больше ионов натрия, кальция и хлора, внутри — ионов калия и отрицательно заряженных белковыхмолекул, аминокислот, органических кислот, фосфатов, сульфатов. Надо понимать, что речь идёт именно о заряде поверхности мембраны — в целом среда и внутри, и снаружи клетки заряжена нейтрально.
Потенциал мембраны может изменяться под действием различных стимулов. Искусственным стимулом может служить электрический ток, подаваемый на внешнюю или внутреннюю сторону мембраны через электрод. В естественных условиях стимулом часто служит химический сигнал от соседних клеток, поступающий черезсинапс или путём диффузной передачи через межклеточную среду. Смещение мембранного потенциала может происходить в отрицательную (гиперполяризация) или положительную (деполяризация) сторону.
В нервной ткани потенциал действия, как правило, возникает при деполяризации — если деполяризация мембраны нейрона достигает некоторого порогового уровня или превышает его, клетка возбуждается, и от её тела к аксонам и дендритам распространяется волна электрического сигнала. (В реальных условиях на теле нейрона обычно возникают постсинаптические потенциалы, которые сильно отличаются от потенциала действия по своей природе — например, они не подчиняются принципу «всё или ничего». Эти потенциалы преобразуются в потенциал действия на особом участке мембраны — аксонном холмике, так что потенциал действия не распространяется на дендриты).
Это обусловлено тем, что на мембране клетки находятся ионные каналы — белковые молекулы, образующие в мембране поры, через которые ионы могут проходить с внутренней стороны мембраны на наружную и наоборот. Большинство каналов ионоспецифичны — натриевый канал пропускает практически только ионы натрия и не пропускает другие (это явление называют селективностью). Мембрана клеток возбудимых тканей (нервной и мышечной) содержит большое количество потенциал-зависимых ионных каналов, способных быстро реагировать на смещение мембранного потенциала. Деполяризация мембраны в первую очередь вызывает открытие потенциал-зависимых натриевых каналов. Когда одновременно открывается достаточно много натриевых каналов, положительно заряженные ионы натрия устремляются через них на внутреннюю сторону мембраны. Движущая сила в данном случае обеспечивается градиентом концентрации (с внешней стороны мембраны находится намного больше положительно заряженных ионов натрия, чем внутри клетки) и отрицательным зарядом внутренней стороны мембраны (см. Рис. 2). Поток ионов натрия вызывает ещё бо́льшее и очень быстрое изменение мембранного потенциала, которое и называют потенциалом действия (в специальной литературе обозначается ПД).
Рис. 3. Простейшая схема, демонстрирующая мембрану с двумя натриевыми каналами в открытом и закрытом состоянии, соответственно
Согласно закону «всё-или-ничего» мембрана клетки возбудимой ткани либо не отвечает на стимул совсем, либо отвечает с максимально возможной для неё на данный момент силой. То есть, если стимул слишком слаб и порог не достигнут, потенциал действия не возникает совсем; в то же время, пороговый стимул вызовет потенциал действия такой же амплитуды, как и стимул, превышающий пороговый. Это отнюдь не означает, что амплитуда потенциала действия всегда одинакова — один и тот же участок мембраны, находясь в разных состояниях, может генерировать потенциалы действия разной амплитуды.
После возбуждения нейрон на некоторое время оказывается в состоянии абсолютной рефрактерности, когда никакие сигналы не могут его возбудить снова, затем входит в фазу относительной рефрактерности, когда его могут возбудить исключительно сильные сигналы (при этом амплитуда ПД будет ниже, чем обычно). Рефрактерный период возникает из-за инактивации быстрого натриевого тока, то есть инактивации натриевых каналов (см. ниже).
Распространение потенциала действия
Распространение потенциала действия по немиелинизированным волокнам
По немиелинизированному волокну ПД распространяется непрерывно. Проведение нервного импульса начинается с распространением электрического поля. Возникший ПД за счет электрического поля способен деполяризовать мембрану соседнего участка до критического уровня, в результате чего на соседнем участке генерируются новые ПД. Сами ПД не перемещаются, они исчезают там же, где возникают. Главную роль в возникновении нового ПД играет предыдущий.
Если внутриклеточным электродом раздражать аксон посередине, то ПД будет распространяться в обоих направлениях. Обычно же ПД распространяется по аксону в одном направлении (от тела нейрона к нервным окончаниям), хотя деполяризация мембраны происходит по обе стороны от участка, где в данный момент возник ПД. Одностороннее проведение ПД обеспечивается свойствами натриевых каналов — после открывания они на некоторое время инактивируются и не могут открыться ни при каких значениях мембранного потенциала (свойство рефрактерности). Поэтому на ближнем к телу клетки участке, где до этого уже «прошел» ПД, он не возникает.
При прочих равных условиях распространение ПД по аксону происходит тем быстрее, чем больше диаметр волокна. По гигантским аксонам кальмара ПД может распространяться почти с такой же скоростью, как и по миелинизированным волокнам позвоночных (около 100 м/c).
Распространение потенциала действия по миелинизированным волокнам
По миелинизированному волокну ПД распространяется скачкообразно (сальтаторное проведение). Для миелинизированных волокон характерна концентрация потенциалзависимых ионных каналов только в областях перехватов Ранвье; здесь их плотность в 100 раз больше, чем в мембранах безмиелиновых волокон. В области миелиновых муфт потенциалзависимых каналов почти нет. ПД, возникший в одном перехвате Ранвье, за счет электрического поля деполяризует мембрану соседних перехватов до критического уровня, что приводит к возникновению в них новых ПД, то есть возбуждение переходит скачкообразно, от одного перехвата к другому. В случае повреждения одного перехвата Ранвье ПД возбуждает 2-ой, 3-ий, 4-ый и даже 5-ый, поскольку электроизоляция, создаваемая миелиновыми муфтами, уменьшает рассеивание электрического поля. Это увеличивает скорость распространения ПД по миелинизированным волокнам по сравнению с немиелинизированными. Кроме того, миелинизированные волокна толще, а электрическое сопротивление более толстых волокон меньше, что тоже увеличивает скорость проведения импульса по миелинизированным волокнам. Другим преимуществом сальтаторного проведения является его экономичность в энергетическом плане, так как возбуждаются только перехваты Ранвье, площадь которых меньше 1 % мембраны, и, следовательно, необходимо значительно меньше энергии для восстановления трансмембранных градиентов Na+ и K+, расходующихся в результате возникновения ПД, что может иметь значение при высокой частоте разрядов, идущих по нервному волокну.
Чтобы представить, насколько эффективно может быть увеличена скорость проведения за счёт миелиновой оболочки, достаточно сравнить скорость распространения импульса по немиелинизированным и миелинизированным участкам нервной системы человека. При диаметре волокна около 2 µм и отсутствии миелиновой оболочки скорость проведения будет составлять ~1 м/с, а при наличии даже слабой миелинизации при том же диаметре волокна — 15-20 м/с. В волокнах большего диаметра, обладающих толстой миелинововой оболочкой, скорость проведения может достигать 120 м/с.
Скорость распространения потенциала действия по мембране отдельно взятого нервного волокна отнюдь не является постоянной величиной — в зависимости от различных условий, эта скорость может очень значительно уменьшаться и, соответственно, увеличиваться, возвращаясь к некоему исходному уровню.
Активные свойства мембраны
Активные свойства мембраны, обеспечивающие возникновение потенциала действия, основываются главным образом на поведении потенциалзависимых натриевых (Na+) и калиевых (K+) каналов. Начальная фаза ПД формируется входящим натриевым током, позже открываются калиевые каналы и выходящий K+-ток возвращает потенциал мембраны к исходному уровню. Исходную концентрацию ионов затем восстанавливает натрий-калиевый насос.
Схема строения мембраны клетки
По ходу ПД каналы переходят из состояния в состояние: у Na+ каналов основных состояний три — закрытое, открытое и инактивированное (в реальности дело сложнее, но этих трёх достаточно для описания), у K+ каналов два — закрытое и открытое.
Поведение каналов, участвующих в формировании ПД, описывается через проводимость и высчиляется черезкоэффициенты переноса (трансфера).
Коэффициенты переноса были выведены Ходжкиным и Хаксли.
Проводимость для калия GK на единицу площади [S/cm²]
Проводимость для натрия GNa на единицу площади [S/cm²]
рассчитывается сложнее, поскольку, как уже было сказано, у потенциал-зависимых Na+ каналов, помимо закрытого/открытого состояний, переход между которыми описывается параметром 
 , , |
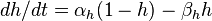 , , |
| где: | где: |
 – коэффициент трансфера из закрытого в открытое состояние для Na+ каналов [1/s]; – коэффициент трансфера из закрытого в открытое состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из инактивированного в не-инактивированное состояние для Na+ каналов [1/s]; – коэффициент трансфера из инактивированного в не-инактивированное состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из открытого в закрытое состояние для Na+ каналов [1/s]; – коэффициент трансфера из открытого в закрытое состояние для Na+ каналов [1/s]; |
 – коэффициент трансфера из не-инактивированного в инактивированное состояние для Na+ каналов [1/s]; – коэффициент трансфера из не-инактивированного в инактивированное состояние для Na+ каналов [1/s]; |
 – фракция Na+ каналов в открытом состоянии; – фракция Na+ каналов в открытом состоянии; |
 – фракция Na+ каналов в не-инактивированном состоянии; – фракция Na+ каналов в не-инактивированном состоянии; |
 – фракция Na+ каналов в закрытом состоянии – фракция Na+ каналов в закрытом состоянии |
 – фракция Na+ каналов в инактивированном состоянии. – фракция Na+ каналов в инактивированном состоянии. |
Материал из Википедии — свободной энциклопедии
Моллюски — сверхуспешный проект матушки-природы. Ведь многие из них, мало изменившись, пережили сотни миллионов лет. Но в качестве модельных объектов (которым мы посвящаем этот спецпроект) мы любим их не за это — их нервная система содержит клетки, видимые простым глазом: они достигают миллиметровых размеров и имеют сопоставимые по диаметру отростки. Зарождающаяся нейрофизиология справедливо сочла такие огромные, притом возбудимые, клетки чудом природы. Так моллюски переехали из морей, прудов и садов в лаборатории, где на славу послужили и продолжают служить нейронаукам.
Двенадцать модельных организмов
Привет! Меня зовут Сергей Мошковский. Дорогая редакция «Биомолекулы», выпустив настенный календарь о модельных организмах на 2020 год, заказала было мне лонгрид, который должен был, как суровый конвой, сопровождать календарь на сайте. Минутная слабость — сколько их было в жизни! — и я уже соглашаюсь. Но как писать? Ведь о каждой модельной скотинке, нарисованной на календаре, — как и о нескольких десятках не поместившихся туда, — написаны тома научной и даже популярной литературы. Придется писать не по-журналистски, из головы — как бы не вышло чего-то вроде поэмы «Москва — Петушки», где вместо станций — модельные организмы. Я и еще несколько авторов представляем вам на суд собранье пестрых глав — они будут выходить в течение всего 2020 года. Читатель, прости! Ты знаешь, кого за это винить!
Толстые провода — Ученые из непростых семей — Съедобная модель — Большому слизню — большие нейроны — Живая микросхема — Ядовитые конусы
Моллюски — крупнейший тип беспозвоночных, по биоразнообразию уступающий только членистоногим. Организмы этой группы уже 500 миллионов лет процветают в морях и чуть меньше на суше. Представителей типа, содержащих три больших класса — головоногих, брюхоногих и двустворчатых, — объединяет наличие особого анатомического образования — мантии, в полости которой находятся жизненно важные органы. Также для большинства видов характерна раковина из органического каркаса, укрепленного карбонатом кальция. А для нашего интереса к модельным организмам в моллюсках важно другое — особенности эволюции их нервной системы. Если во многих группах животных усовершенствование нервной системы происходит за счет увеличения числа элементов — нейронов, — то у моллюсков произошло укрупнение самих нервных клеток и их отростков. Вот поэтому эти гигантские клетки привлекли внимание экспериментаторов: с ними гораздо проще работать, чем, например, с небольшими по размеру нейронами насекомых или млекопитающих.
Нервы как канаты
Кальмары движутся по реактивному принципу, мощно выталкивая струю воды из мантийной полости. Мышечный аппарат, выполняющий эту работу, иннервируется гигантским аксоном — эфферентным (то есть центробежным) отростком гигантской же нервной клетки — нейрона. Уточним, что гигантский аксон — это тяж диаметром от половины до полутора миллиметров.
Внимание нейрофизиологов к этому объекту в обыкновенном кальмаре (Loligo vulgaris) привлек в 1930-е годы авторитетный британский зоолог Джон Захария Янг. Спустя пару десятилетий физиологи Алан Ллойд Ходжкин и Эндрю Филдинг Хаксли, экспериментируя с гигантским аксоном длинноперого кальмара (Doryteuthis pealeii), создали модель распространения по нему потенциала действия (то есть нервного импульса). Электровозбудимые клетки характеризуются зарядом на мембране — потенциалом покоя [1], поддерживаемым за счет различия в концентрациях ионов вне и внутри клетки. В самом простом представлении, концентрация ионов натрия во внеклеточном пространстве выше, чем внутри клетки, а с ионами калия — всё наоборот. Такое состояние поддерживается активно: клетка тратит на это энергию. При приложении к возбудимой клетке электрического напряжения выше порогового значения открываются потенциал-чувствительные ионные каналы — специально сконструированные для этого эволюцией трансмембранные белковые комплексы. Сопротивление мембраны преодолевается, и поток ионов натрия устремляется внутрь клетки — возникает и распространяется более амплитудный, чем потенциал покоя, потенциал действия . Ходжкин и Хаксли выделяли гигантский аксон кальмара, в который они могли поместить неуклюжие и большие электроды того времени, и моделировали процесс передачи сигнала. Эти эксперименты — классическое использование модельного объекта, когда экспериментаторам совершенно неважно, откуда они получили аксон, лишь бы он был совместим с доступными экспериментальными условиями.
Подробнее о потенциале действия, аксоне кальмара, электродах и экспериментах с ними можно прочитать в статье «Нейробиология» [2] нашего цикла «12 методов в картинках».
Использовав результаты измерений электрохимических параметров передачи импульса на гигантском аксоне и предложив электрическую схему этого объекта, Ходжкин и Хаксли создали математическую модель передачи электрического сигнала в нервной системе, в целом верно описывающую этот процесс (рис. 1) [3]. Модель стала одним из примеров, когда биология успешно конвертировалась в точную науку, к чему она с разной степенью успешности стремится до сих пор. Впоследствии модель уточняли — первоначально в ней были только переменные, относящиеся к токам натрия и калия. Исследователям повезло: аксон моллюска не имеет миелиновой оболочки, характерной для нервной ткани челюстных позвоночных, — непроводящего слоя с проводящими перемычками. Наличие этой оболочки ускоряет передачу сигнала, но могло бы усложнить создание модели.
Рисунок 1. Биология здорового человека. Скриншот из статьи Ходжкина и Хаксли 1952 года.
Ходжкин и Хаксли — исследователи из непростых семей. Дедом Эндрю Хаксли, как это ни парадоксально звучит, был Томас Гексли (1825–1895), сподвижник Дарвина, прозванный даже его «бульдогом» за яростную защиту эволюционизма. Один из старших братьев нейрофизиолога — знаменитый писатель Олдос Хаксли. Самой известной его книгой считается антиутопия «О дивный новый мир», воплощение многих эпизодов которой в реальность мы можем наблюдать в наши дни. Одним из предков Алана Ходжкина был знаменитый английский врач Томас Ходжкин (1798–1866), чье имя запечатлено в открытом им заболевании крови — лимфоме Ходжкина.
Традиция транслитерации английских фамилий была разной в XIX и XX веках, отсюда и это анекдотичное разночтение. Почему, как недавно было сказано, доктор — Ватсон, а Эмма — Уотсон?
Ходжкину и Хаксли было, в общем, не важно, чей аксон они использовали в своей работе. А между тем кальмары рода Loligo, как и все головоногие моллюски в целом, очень примечательные существа. Эта рано обособленная группа моллюсков может по праву считаться одной из вершин эволюции беспозвоночных. Среди головоногих известны виды, отличающиеся необычайно сложным поведением. Мой друг, морской биолог, например, не ест осьминогов, считая их «приматами моря» [4]. Кстати, нужно заметить, что кальмар лолиго — единственный съедобный и промысловый вид в нашем календаре. Конечно, грызуны и приматы тоже временами употребляются в пищу человеком, но не в таком масштабе.
Возникает закономерный вопрос: почему аксон кальмара гигантский, а у кошки, например, или собаки — такого нет? Это объясняется общим стилем морфологии нервной системы моллюсков. Ее функциональность обеспечивается не умножением числа нервных клеток, а увеличением их размера. Например, по огромным отросткам нейронов скорее передается сигнал.
Слизень размером с зайца
Особо крупные нейроны характерны и для следующего модельного объекта, нарисованного на странице календаря (а страница эта приведена на рисунке 4), — морского слизня калифорнийской аплизии. Слизни и улитки — это, как известно, брюхоногие моллюски. В школьном учебнике, кажется, жил большой прудовик — пресноводная легочная улитка, вернувшаяся к водному образу жизни. «А что, бывают морские улитки и слизни?» — спросят московские дети. На самом деле брюхоногих моллюсков, по разным оценкам, от 15 до 25 тысяч видов, из них более двух третей — морские [5]. При этом, для сравнения, млекопитающих насчитывается не более 5,5 тысяч видов. Аплизия — это род крупных брюхоногих моллюсков с редуцированной раковиной, которых также называют морскими зайцами. Средиземноморские аплизии известны с античности, и именно у них в начале прошлого века обнаружили примечательные особенности строения нервной системы [6]. Самые крупные представители рода достигают огромных размеров. Например, Aplysia vaccaria с тихоокеанского побережья Северной Америки может достигать до 1 м в длину и до 15 кг веса. Другой родственный вид — калифорнийскую аплизию (Aplysia californica) — научились держать в морских аквариумах, условия которых она хорошо переносит. К тому же травоядных аплизий проще кормить в неволе, чем хищные виды моллюсков.
В девяти ганглиях центральной нервной системы аплизии содержится не более 20 тысяч нейронов, причем они достигают сравнительно большого размера. Например, нейрон под обозначением R2, по выражению исследователей, имеет гаргантюанский размер — он достигает 1 мм в диаметре, что соответствует величине целого мозга мушки дрозофилы. Кстати, нервная система этого модельного насекомого содержит примерно 135 тысяч нейронов! Как я уже говорил в рассказе о кальмаре, стратегия моллюсков заключается не в умножении числа элементов в нервной системе, а в увеличении их размера. Отмечается, что каждый гигантский нейрон аплизии способен работать в различных режимах, как нервный узел [6].
Гаргантюа — огромный и добрый обжора, герой сатирического романа французского писателя XVI века Франсуа Рабле «Гаргантюа и Пантагрюэль».
Это свойство сделало брюхоногих моллюсков прекрасной моделью для подведения электродов к отдельным нейронам. Их можно было стимулировать и регистрировать их возбуждение во время таких важных механизмов работы нервной системы, как обучение, краткосрочная и долгосрочная память. Аплизия выступала как живая микросхема, которую можно перепаивать с помощью электродов. Многие нейроны ее ганглиев морфологически и функционально картировали, в связи с чем получили постоянные буквенные обозначения.
Выдающийся вклад в исследование рефлексов аплизии внес австро-американский нейробиолог Эрик Кандель. В частности, он подробно изучил работу отдельных нейронов во время осуществления рефлекса втягивания жабры моллюска (рис. 2) [7]. Здесь аплизия выступала настоящей моделью — позднее многие принципы работы ее нервных контуров подтвердились в инструментально более сложных опытах на позвоночных.
Рисунок 2а. От устройства нейронных контуров гигантского слизня… (схема манипуляций с отдельными нейронами из обзора Эрика Канделя)
Рисунок 2б. …к работе мозга человека (в фантазиях иллюстратора советского журнала «Техника — молодежи»)
Советская нейробиология, по понятным причинам, имела ограниченный доступ к калифорнийским аплизиям. Поэтому модельным организмом в нашей стране традиционно выступает более простой в содержании наземный моллюск — виноградная улитка (Helix pomatia). На этом объекте воспроизвели и дополнили многие исследования [8], проведенные на аплизии. Отличие, выгодное для исследования аплизии, касается тех случаев, когда к классической нейрофизиологии добавляются молекулярные исследования: морской заяц — один из немногих брюхоногих моллюсков с хорошо изученным (хотя все равно не до конца отсеквенированным) геномом. Геномы этих беспозвоночных с трудом подлежат расшифровке — они содержат много повторов, и обычные инструменты, отработанные на геномах других групп, часто не срабатывают.
Интересная особенность гигантских нейронов аплизии и других улиток — невероятная выраженность полиплоидии. Геном этих клеток в процессе развития претерпевает эндомитоз — умножается в ядре без деления всей клетки. Кажется фантастикой, но гигантский нейрон R2 может содержать до 600 тысяч единичных геномов! По-видимому, правильное функционирование огромного нейрона с такими же гигантскими отростками требует использования множества копий генома. Кроме того, предполагают, что это защищает неделящиеся клетки от накопления соматических мутаций: делаются своего рода резервные копии генома.
Мир брюхоногих моллюсков затягивает, хочется думать и писать о них бесконечно. Для человека важна еще одна огромная группа морских улиток — надсемейство конусовидных (Conoidae) с шестью тысячами описанных видов (рис. 3) [9]. Конусы ведут хищный образ жизни, и некоторые из них способны убивать жертву ядом. Роговая терка — радула — в их ротовой полости превратилась в хищный зуб-гарпун, который резко выбрасывается, вонзаясь в тело жертвы и впрыскивая яд из специальной железы (см. видео). Последний содержит коктейль нервно-паралитических токсинов белковой природы, в основном, ингибирующих ионные каналы в нервных клетках жертвы. Крупные рыбоядные конусы, например, Conus geographicus с побережья Филиппин, способны укусить человека, иногда даже со смертельным исходом. Токсины, особенно, способные действовать на человека, привлекают не только зоологов, но и разработчиков лекарств . Например, один из пептидов-конотоксинов яда большого конуса Conus magus стал прототипом нового обезболивающего препарата — зиконотида (торговое название — «Приалт»), доступного для пациентов с 2005 года. Искусственный конотоксин вводят в спинномозговую жидкость, что неудобно, но зато он действует в тысячу раз сильнее морфина и не вызывает пристрастия.
Подобные смеси токсинов невероятно привлекают исследователей. В частности, изучают их и в Институте биоорганической химии РАН, рассматривая конотоксины как высокоспецифичные лиганды ацетилхолиновых рецепторов никотинового типа. В этих исследованиях принимают участие и теоретики, с помощью компьютерных расчетов предсказывая мутации в этих небольших пептидах, еще более повышающие их сродство к своим рецепторам [10].
Рисунок 3. Локальное разнообразие моллюсков надсемейства Conoidea мелководного рифа окрестностей Punta-Engana, Центральные Филиппины
Александр Федосов (сбор образцов и фото)
Видео. Охота морской улитки конуса
Молекулярные исследования конусов осложняются традиционной для моллюсков проблемой, о которой я уже упоминал, — очень сложными для секвенирования геномами с огромным количество повторов. Биоинформатики, которые пытаются собрать их целые последовательности из отдельных считываний секвенаторов, в сердцах называют ДНК конусов «геномами из ада».
Остановите меня кто-нибудь! Я хочу и дальше писать о брюхоногих моллюсках! Скажу напоследок, что в мире есть много увлеченных коллекционированием их раковин людей — конхиофилов. Некоторые из них так преуспевают в этом деле, что становятся зоологами-любителями, или, как называют специалистов по моллюскам, — малакологами, описывают новые виды и финансируют научные экспедиции. Вот такая популяризация науки получается.
Рисунок 4. Морские моллюски как герои календаря «Биомолекулы». Этот календарь мы сделали в 2019 году и даже провели на него весьма успешный краудфандинг. На тех, кто успел приобрести календарь, фаг уже взирает со стенки, ну а с прочими мы делимся хайрезом этого листа — скачивайте, печатайте и вешайте на стенку! Ну а кто все же хочет приобрести бумажный экземпляр — приглашаем в интернет-магазин «Планеты.ру»!
Благодарность
Автор признателен своему другу — исследователю ядовитых конусов Александру Федосову (Институт проблем экологии и эволюции имени А.Н. Северцова), который рассказал много интересного о морских брюхоногих моллюсках и предоставил оригинальное фото собственных сборов раковин с Филиппин.
- Формирование мембранного потенциала покоя;
- 12 методов в картинках: нейробиология;
- A. L. Hodgkin, A. F. Huxley. (1952). A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117, 500-544;
- Сай Монтгомери: «Душа осьминога: Удивительное путешествие в тайны сознания». Рецензия;
- Philippe Bouchet, Jean-Pierre Rocroi, Bernhard Hausdorf, Andrzej Kaim, Yasunori Kano, et. al.. (2017). Revised Classification, Nomenclator and Typification of Gastropod and Monoplacophoran Families. Malacologia. 61, 1-526;
- Leonid L. Moroz. (2011). Aplysia. Current Biology. 21, R60-R61;
- E. R. Kandel. (2001). The Molecular Biology of Memory Storage: A Dialogue Between Genes and Synapses. Science. 294, 1030-1038;
- Pavel M. Balaban, Alia Kh. Vinarskaya, Alena B. Zuzina, Victor N. Ierusalimsky, Aleksey Yu. Malyshev. (2016). Impairment of the serotonergic neurons underlying reinforcement elicits extinction of the repeatedly reactivated context memory. Sci Rep. 6;
- Jawad Abdelkrim, Laetitia Aznar-Cormano, Alexander E Fedosov, Yuri I Kantor, Pierre Lozouet, et. al.. (2018). Exon-Capture-Based Phylogeny and Diversification of the Venomous Gastropods (Neogastropoda, Conoidea). Molecular Biology and Evolution. 35, 2355-2374;
- Igor E. Kasheverov, Anton O. Chugunov, Denis S. Kudryavtsev, Igor A. Ivanov, Maxim N. Zhmak, et. al.. (2016). High-Affinity α-Conotoxin PnIA Analogs Designed on the Basis of the Protein Surface Topography Method. Sci Rep. 6.
From Wikipedia, the free encyclopedia
The squid giant synapse is a chemical synapse found in squid. It is the largest chemical junction in nature.
Anatomy[edit]
The squid giant synapse (Fig 1) was first recognized by John Zachary Young in 1939. It lies in the stellate ganglion on each side of the midline, at the posterior wall of the squid’s muscular mantle. Activation of this synapse triggers a synchronous contraction of the mantle musculature, causing the forceful ejection of a jet of water from the mantle. This water propulsion allows the squid to move rapidly through the water and even to jump through the surface of the water (breaking the air-water interface) to escape predators.
The signal to the mantle is transmitted via a chain consisting of three giant neurons organized in sequence. The first is located in the ventral magnocellular lobe, central to the eyes. It serves as a central integrating manifold that receives all sensory systems and consists of two symmetrical neurons (I).
They, in turn, contact secondary neurons (one in each side) in the dorsal magnocellular lobe and (II) and in turn contact the tertiary giant axons in the stellate ganglion (III, one in each side of the mantle). These latter are the giant axons that the work of Alan Hodgkin and Andrew Huxley made famous. Each secondary axon branches at the stellate ganglion and contacts all the tertiary axons; thus, information concerning relevant sensory input is relayed from the sense organs in the cephalic ganglion (the squid’s brain) to the contractile muscular mantle (which is activated directly by the tertiary giant axons).
Fig 1. Upper left, side view of a squid. Upper right, the area inside the black square is enlarged in the diagram below, showing the giant neuronal system with the first (red) second (green) and third giant neuronal elements (brown). The arrows indicate the direction of transmission flow from the head ganglion towards the mantle. The light blue funnel is the site for water flow following rapid water expulsion when the mantle contracts (Modified from Llinás 1999).[page needed]
Electrophysiology[edit]
Many essential elements of how all chemical synapses function were first discovered by studying the squid giant synapse. Early electrophysiological studies demonstrated the chemical nature of transmission at this synapse by making simultaneous intracellular recording from the presynaptic and postsynaptic terminals in vitro (Bullock & Hagiwara 1957, Hagiwara & Tasaki 1958, Takeuchi & Takeuchi 1962). Classical experiments later on demonstrated that, in the absence of action potentials, transmission could occur (Bloedel et al. 1966, Katz & Miledi 1967, Kusano, Livengood & Werman 1967). The calcium hypothesis for synaptic transmission was directly demonstrated in this synapse by showing that at the equilibrium potential for calcium, no transmitter is released (Katz & Miledi 1967). Thus, calcium entry and not the change in the transmembrane electric field per se is responsible for transmitter release (Llinás et al. 1981,[not specific enough to verify] Augustine, Charlton & Smith 1985). This preparation continues to be the most useful for the study of the molecular and cell biological basis for transmitter release. Other important new mammalian preparations are now available for such studies such as the calyx of Held.
Fig 2. Upper left image: Enlarged picture of the squid stellate ganglion showing the giant synapse. Intracellular dye injection was used to stain the presynaptic axon green and the postsynaptic axon red. The presynpatic fiber has seven branches, each for one giant tertiary axon. Only the last postsynaptic axon on the right is colored. Lower left image: A) Simultaneous intracellular recording from the presynaptic fiber (pre) and the postsynaptic axon (post). The synaptic action potential releases a transmitter substance (glutamate) that acts on the postsynaptic receptors and activates the postsynaptic action potential. B & C) Synaptic transmission can be evoked with either a square voltage pulse (B) or an artificial action potential wave form (C) these are delivered to a command amplifier as shown in D. D. Diagram of a command amplifier (CO) and current injection amplifier (I) with a feedback control via presynaptic voltage (Pre V). The response to these stimuli is recorded as a current (Im) and displayed in green in E and F. E) Synaptic transmission and calcium current (ICa, green) evoked by a square voltage pulse (Pre). F) Calcium current (green) and postsynaptic potential (Post) evoked by an artificial action potential (Pre). Note that in F the calcium curren starts during the down swing of the presynaptic action potential (modified from Llinás 1999).[page needed] Middle Image: Left, Voltage clamp records illustrating the relation between transmembrane voltage in mV (square wave at the bottom of each record) Calcium current amplitude in nA (middle record) and postsynaptic potential in mV. Time mark one ms. The voltage steps are generates from a holding potential of -170mV. (Llinás et al. 1981).[not specific enough to verify] Right image: Relation between voltage and current for the “on” (red plot) and “tail” (white plot) calcium current. Voltage in mV current in nA (modified from Llinás 1999).[page needed]
See also[edit]
- Squid giant axon
References[edit]
- Young, John Z. (25 May 1939). «Fused neurons and synaptic contacts in the giant nerve fibers of cephalopods». Philosophical Transactions of the Royal Society B: Biological Sciences. 229 (564): 465–503. Bibcode:1939RSPTB.229..465Y. doi:10.1098/rstb.1939.0003.
- Bullock, Theodore H.; Hagiwara, Susumu (20 March 1957). «Intracellular recording from the giant synapse of the squid». Journal of General Physiology. 40 (4): 565–577. doi:10.1085/jgp.40.4.565. PMC 2147642. PMID 13416531.
- Hagiwara, S.; Tasaki, I. (29 August 1958). «A study on the mechanism of impulse transmission across the giant synapse of the squid». Journal of Physiology. 143 (1): 114–137. doi:10.1113/jphysiol.1958.sp006048. PMC 1356715. PMID 13576464.
- Takeuchi, Akira; Takeuchi, Noriko (July 1962). «Electrical changes in the pre and postsynaptic axons of the giant synapse of Loligo». Journal of General Physiology. 45 (6): 1181–1193. doi:10.1085/jgp.45.6.1181. PMC 2195243. PMID 13919241.
- Bloedel, J.R.; Gage, P.W.Q.; Llinás, R.; Quastel, D.M.J. (October 1966). «Transmitter release at the squid giant synapse in the presence of tetrodotoxin». Nature. 212 (5057): 49–50. Bibcode:1966Natur.212…49B. doi:10.1038/212049a0. PMID 5965569. S2CID 4185178.
- Katz, B.; Miledi, R. (September 1967). «A study of synaptic transmission in the absence of nerve impulses». Journal of Physiology. 192 (2): 407–436. doi:10.1113/jphysiol.1967.sp008307. PMC 1365564. PMID 4383089.
- Kusano, Kiyoshi; Livengood, David R.; Werman, Robert (December 1967). «Correlation of transmitter release with membrane properties of the presynaptic fiber of the squid giant synapse». Journal of General Physiology. 50 (11): 2579–2601. doi:10.1085/jgp.50.11.2579. PMC 2225670. PMID 4296572.
- Llinás, Rodolfo; Steinberg, Izchak Z.; Walton, Kerry (August 1976). «Presynaptic calcium currents and their relation to synaptic transmission. Voltage clamp study in the squid giant synapse and theoretical model for the calcium gate». Proceedings of the National Academy of Sciences of the United States of America. 73 (8): 2918–2922. Bibcode:1976PNAS…73.2918L. doi:10.1073/pnas.73.8.2918. PMC 430802. PMID 183215.
- Llinás, R.; Steinberg, I.Z.; Walton, K. (March 1981a). «Presynaptic calcium currents in the squid giant synapse». Biophysical Journal. 33 (3): 289–321. Bibcode:1981BpJ….33..289L. doi:10.1016/S0006-3495(81)84898-9. PMC 1327433. PMID 7225510.
- Llinás, R.; Steinberg, I.Z.; Walton, K. (March 1981b). «Relationship between presynaptic calcium current and postsynaptic potential in squid giant synapse». Biophysical Journal. 33 (3): 323–352. Bibcode:1981BpJ….33..323L. doi:10.1016/S0006-3495(81)84899-0. PMC 1327434. PMID 6261850.
- Augustine, G.J.; Charlton, M.P.; Smith, S.J. (October 1985). «Calcium entry into voltage clamped presynaptic terminals of squid». J. Physiol. 367 (1): 163–181. doi:10.1113/jphysiol.1985.sp015819. PMC 1193058. PMID 2865362.
- Llinás, Rodolfo R. (1999). The squid Giant Synapse. New York: Oxford University Press. ISBN 978-0-19-511652-6. OCLC 934117310.
На фото — нервная система ювенильного кальмара, видимая в поле конфокального микроскопа. Снимок попал в категорию Images of Distinction международного конкурса микрофотографии Nikon Small World 2017. Двужаберные, или колеоидеи (Coleoidea), к которым относятся кальмары вместе с каракатицами и осьминогами, это подкласс головоногих моллюсков — обладателей самой развитой нервной системы среди беспозвоночных.
Головоногие моллюски возникли около 530 миллионов лет назад. Первоначально все они имели твердую наружную раковину, но примерно 350 миллионов лет назад от основного эволюционного ствола головоногих отделились колеоидеи, у которых раковина переместилась внутрь тела и в значительной степени редуцировалась. К колеоидеям относятся современные кальмары, каракатицы и осьминоги. Существенное различие в морфологии было сопряжено с освоением отличающихся сред обитания, что сказалось на эволюции нервной системы. Колеоидеи не были ограничены в движении жесткой раковиной. Осьминоги и кальмары способны перемещаться как по горизонтали, так и по вертикали. За всю жизнь мигрирующие кальмары преодолевают более 2000 километров со средней скоростью около 20 километров в день.
Развитие сложного адаптивного поведения способствовало развитию нервной системы. Мозг кальмара представлен окологлоточным скоплением ганглиев, которое находится над и под пищеводом. Мозг включает крупные зрительные доли (зрение у кальмаров развито прекрасно), вертикальные доли, отвечающие за обучение и память, доли, контролирующие движение моллюска, питание, управление щупальцами. На главном фото мозг отчетливо не заметен, возможно из-за того, что он не такой плотный и массивный, как у человека, более ажурный и «воздушный» (посмотрите это видео его трехмерной реконструкции).
От мозга в мантийную полость направлено два толстых мантийных нерва — гигантские аксоны (см. Squid giant axon; на главном фото они окрашены голубым цветом), которые идут к крупным звездчатым ганглиям, они отлично видны на фото — от них веерообразно расходятся нервы, идущие к многочисленным мускульным волокнам мантии. Звездчатые ганглии иннервируют мускульную мантию, отвечая за ее сокращение во время реактивного движения моллюска. В плавники идут два толстых нерва, которые разветвляются на множество более тонких (они видны в задней части главного фото), они, собственно, отвечают за сокращение мышц плавников. Плавники кальмар использует во время спокойного передвижения, а реактивное движение — когда охотится или уходит от опасности.
Колеоидеи известны своим удивительным адаптивным камуфляжем. В их коже расположены многочисленные хроматофоры — клетки с пигментом, окруженные мышечными волокнами. Хроматофорные мотонейроны расположены в головном мозге, и их активация позволяет животному быстро и динамично менять цвет и рисунок (см. Технология попиксельного наблюдения за кожей каракатиц поможет понять, как они управляют своей окраской, «Элементы», 22.10.2018). Сигнал от мозга поступает через гигантские аксоны и звездчатые ганглии. Многочисленные нервные отростки пронизывают и щупальца, что позволяет тонко контролировать их.
Усложнению нервной системы колеоидей способствовала уникальная организация регуляторных участков генома. В структуре их геномов появились сотни тесно связанных и эволюционно уникальных генных кластеров (микросинтений). Свойством геномов многоклеточных животных является то, что локальный порядок генов, или микросинтения, сохраняется даже между отдаленно родственными видами. У колеоидей локальный порядок генов изменился: объединились ранее несцепленные гены. Также исследователи обнаружили, что у кальмаров есть механизм редактирования РНК в нервных клетках, который работает быстрее именно в них.
Процессы, называемые редактированием РНК, могут изменять нуклеотидную последовательность молекул матричной РНК после транскрипции. При редактировании одни нуклеотиды заменяются на другие и в некоторых случаях это приводит к замене аминокислоты, а значит, и к изменениям в белке. Такая способность создавать ряд белков из одной последовательности ДНК помогает организмам адаптироваться, меняться.
При исследовании интенсивности редактирования в нервных клетках кальмара ученые обнаружили, что почти 60% РНК было изменено после транскрипции. Активность редактирования РНК кальмаров на несколько порядков выше, чем у любых других изученных животных. Помимо этого более 70% всех сайтов редактирования кальмара наиболее активно редактируются в гигантском аксоне. Эти механизмы, вероятно, и позволили головоногим обрести уникальные способности, отсутствующие у других моллюсков.
Новые объединения генов и динамичные изменения в последовательности матричной РНК позволяют экспрессировать разные изоформы одного и того же белка, которые будут отличаться друг от друга функционально. Это позволяет головоногим моллюскам быстрее реагировать на изменяющиеся условия среды.
Автор выражает благодарность Александру Мироненко за помощь в подготовке статьи.
Фото © Nat Clarke с сайта nikonsmallworld.com, снимок сделан с помощью конфокального микроскопа, увеличение 135×.
Элина Стоянова