| Axon | |
|---|---|

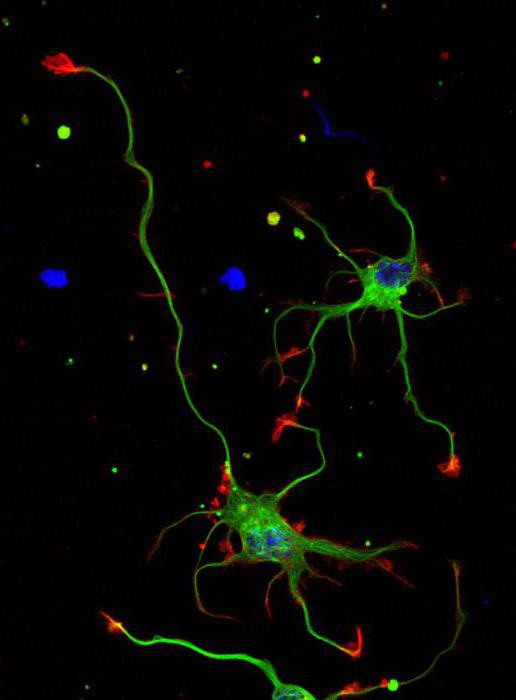
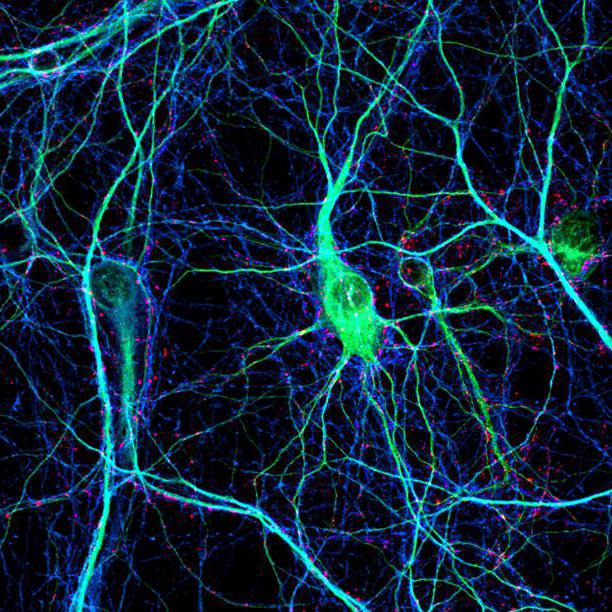
An axon of a multipolar neuron |
|
| Identifiers | |
| MeSH | D001369 |
| FMA | 67308 |
| Anatomical terminology
[edit on Wikidata] |
An axon (from Greek ἄξων áxōn, axis), or nerve fiber (or nerve fibre: see spelling differences), is a long, slender projection of a nerve cell, or neuron, in vertebrates, that typically conducts electrical impulses known as action potentials away from the nerve cell body. The function of the axon is to transmit information to different neurons, muscles, and glands. In certain sensory neurons (pseudounipolar neurons), such as those for touch and warmth, the axons are called afferent nerve fibers and the electrical impulse travels along these from the periphery to the cell body and from the cell body to the spinal cord along another branch of the same axon. Axon dysfunction can be the cause of many inherited and acquired neurological disorders that affect both the peripheral and central neurons. Nerve fibers are classed into three types – group A nerve fibers, group B nerve fibers, and group C nerve fibers. Groups A and B are myelinated, and group C are unmyelinated. These groups include both sensory fibers and motor fibers. Another classification groups only the sensory fibers as Type I, Type II, Type III, and Type IV.
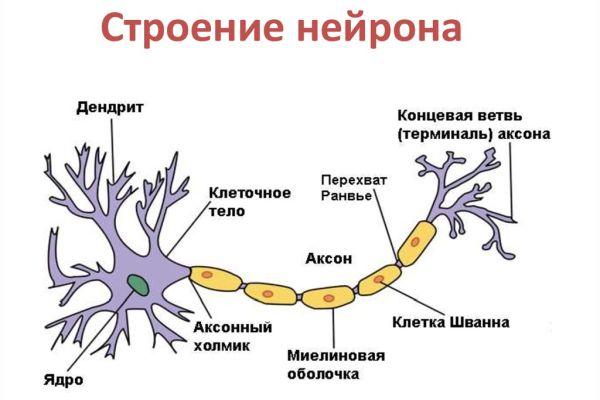
An axon is one of two types of cytoplasmic protrusions from the cell body of a neuron; the other type is a dendrite. Axons are distinguished from dendrites by several features, including shape (dendrites often taper while axons usually maintain a constant radius), length (dendrites are restricted to a small region around the cell body while axons can be much longer), and function (dendrites receive signals whereas axons transmit them). Some types of neurons have no axon and transmit signals from their dendrites. In some species, axons can emanate from dendrites known as axon-carrying dendrites.[1] No neuron ever has more than one axon; however in invertebrates such as insects or leeches the axon sometimes consists of several regions that function more or less independently of each other.[2]
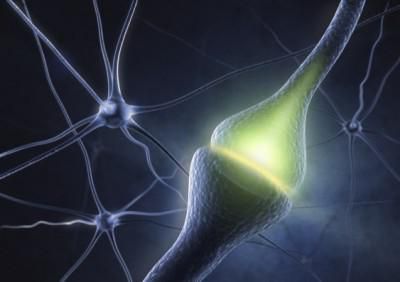
Axons are covered by a membrane known as an axolemma; the cytoplasm of an axon is called axoplasm. Most axons branch, in some cases very profusely. The end branches of an axon are called telodendria. The swollen end of a telodendron is known as the axon terminal which joins the dendron or cell body of another neuron forming a synaptic connection. Axons make contact with other cells – usually other neurons but sometimes muscle or gland cells – at junctions called synapses. In some circumstances, the axon of one neuron may form a synapse with the dendrites of the same neuron, resulting in an autapse. At a synapse, the membrane of the axon closely adjoins the membrane of the target cell, and special molecular structures serve to transmit electrical or electrochemical signals across the gap. Some synaptic junctions appear along the length of an axon as it extends; these are called en passant («in passing») synapses and can be in the hundreds or even the thousands along one axon.[3] Other synapses appear as terminals at the ends of axonal branches.
A single axon, with all its branches taken together, can innervate multiple parts of the brain and generate thousands of synaptic terminals. A bundle of axons make a nerve tract in the central nervous system,[4] and a fascicle in the peripheral nervous system. In placental mammals the largest white matter tract in the brain is the corpus callosum, formed of some 200 million axons in the human brain.[4]
Anatomy[edit]
A typical myelinated axon
Axons are the primary transmission lines of the nervous system, and as bundles they form nerves. Some axons can extend up to one meter or more while others extend as little as one millimeter. The longest axons in the human body are those of the sciatic nerve, which run from the base of the spinal cord to the big toe of each foot. The diameter of axons is also variable. Most individual axons are microscopic in diameter (typically about one micrometer (µm) across). The largest mammalian axons can reach a diameter of up to 20 µm. The squid giant axon, which is specialized to conduct signals very rapidly, is close to 1 millimeter in diameter, the size of a small pencil lead. The numbers of axonal telodendria (the branching structures at the end of the axon) can also differ from one nerve fiber to the next. Axons in the central nervous system (CNS) typically show multiple telodendria, with many synaptic end points. In comparison, the cerebellar granule cell axon is characterized by a single T-shaped branch node from which two parallel fibers extend. Elaborate branching allows for the simultaneous transmission of messages to a large number of target neurons within a single region of the brain.
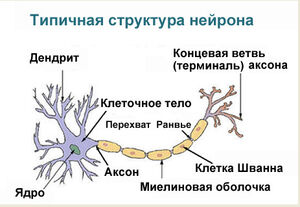
There are two types of axons in the nervous system: myelinated and unmyelinated axons.[5] Myelin is a layer of a fatty insulating substance, which is formed by two types of glial cells: Schwann cells and oligodendrocytes. In the peripheral nervous system Schwann cells form the myelin sheath of a myelinated axon. Oligodendrocytes form the insulating myelin in the CNS. Along myelinated nerve fibers, gaps in the myelin sheath known as nodes of Ranvier occur at evenly spaced intervals. The myelination enables an especially rapid mode of electrical impulse propagation called saltatory conduction.
The myelinated axons from the cortical neurons form the bulk of the neural tissue called white matter in the brain. The myelin gives the white appearance to the tissue in contrast to the grey matter of the cerebral cortex which contains the neuronal cell bodies. A similar arrangement is seen in the cerebellum. Bundles of myelinated axons make up the nerve tracts in the CNS. Where these tracts cross the midline of the brain to connect opposite regions they are called commissures. The largest of these is the corpus callosum that connects the two cerebral hemispheres, and this has around 20 million axons.[4]
The structure of a neuron is seen to consist of two separate functional regions, or compartments – the cell body together with the dendrites as one region, and the axonal region as the other.
Axonal region[edit]
The axonal region or compartment, includes the axon hillock, the initial segment, the rest of the axon, and the axon telodendria, and axon terminals. It also includes the myelin sheath. The Nissl bodies that produce the neuronal proteins are absent in the axonal region.[3] Proteins needed for the growth of the axon, and the removal of waste materials, need a framework for transport. This axonal transport is provided for in the axoplasm by arrangements of microtubules and intermediate filaments known as neurofilaments.
Axon hillock[edit]
Detail showing microtubules at axon hillock and initial segment.
The axon hillock is the area formed from the cell body of the neuron as it extends to become the axon. It precedes the initial segment. The received action potentials that are summed in the neuron are transmitted to the axon hillock for the generation of an action potential from the initial segment.
Axonal initial segment[edit]
The axonal initial segment (AIS) is a structurally and functionally separate microdomain of the axon.[6][7] One function of the initial segment is to separate the main part of an axon from the rest of the neuron; another function is to help initiate action potentials.[8] Both of these functions support neuron cell polarity, in which dendrites (and, in some cases the soma) of a neuron receive input signals at the basal region, and at the apical region the neuron’s axon provides output signals.[9]
The axon initial segment is unmyelinated and contains a specialized complex of proteins. It is between approximately 20 and 60 µm in length and functions as the site of action potential initiation.[10][11] Both the position on the axon and the length of the AIS can change showing a degree of plasticity that can fine-tune the neuronal output.[10][12] A longer AIS is associated with a greater excitability.[12] Plasticity is also seen in the ability of the AIS to change its distribution and to maintain the activity of neural circuitry at a constant level.[13]
The AIS is highly specialized for the fast conduction of nerve impulses. This is achieved by a high concentration of voltage-gated sodium channels in the initial segment where the action potential is initiated.[13] The ion channels are accompanied by a high number of cell adhesion molecules and scaffolding proteins that anchor them to the cytoskeleton.[10] Interactions with ankyrin G are important as it is the major organizer in the AIS.[10]
Axonal transport[edit]
The axoplasm is the equivalent of cytoplasm in the cell. Microtubules form in the axoplasm at the axon hillock. They are arranged along the length of the axon, in overlapping sections, and all point in the same direction – towards the axon terminals.[14] This is noted by the positive endings of the microtubules. This overlapping arrangement provides the routes for the transport of different materials from the cell body.[14] Studies on the axoplasm has shown the movement of numerous vesicles of all sizes to be seen along cytoskeletal filaments – the microtubules, and neurofilaments, in both directions between the axon and its terminals and the cell body.
Outgoing anterograde transport from the cell body along the axon, carries mitochondria and membrane proteins needed for growth to the axon terminal. Ingoing retrograde transport carries cell waste materials from the axon terminal to the cell body.[15] Outgoing and ingoing tracks use different sets of motor proteins.[14] Outgoing transport is provided by kinesin, and ingoing return traffic is provided by dynein. Dynein is minus-end directed.[15] There are many forms of kinesin and dynein motor proteins, and each is thought to carry a different cargo.[14] The studies on transport in the axon led to the naming of kinesin.[14]
Myelination[edit]
TEM of a myelinated axon in cross-section.
In the nervous system, axons may be myelinated, or unmyelinated. This is the provision of an insulating layer, called a myelin sheath. The myelin membrane is unique in its relatively high lipid to protein ratio.[16]
In the peripheral nervous system axons are myelinated by glial cells known as Schwann cells. In the central nervous system the myelin sheath is provided by another type of glial cell, the oligodendrocyte. Schwann cells myelinate a single axon. An oligodendrocyte can myelinate up to 50 axons.[17]
The composition of myelin is different in the two types. In the CNS the major myelin protein is proteolipid protein, and in the PNS it is myelin basic protein.
Nodes of Ranvier[edit]
Nodes of Ranvier (also known as myelin sheath gaps) are short unmyelinated segments of a myelinated axon, which are found periodically interspersed between segments of the myelin sheath. Therefore, at the point of the node of Ranvier, the axon is reduced in diameter.[18] These nodes are areas where action potentials can be generated. In saltatory conduction, electrical currents produced at each node of Ranvier are conducted with little attenuation to the next node in line, where they remain strong enough to generate another action potential. Thus in a myelinated axon, action potentials effectively «jump» from node to node, bypassing the myelinated stretches in between, resulting in a propagation speed much faster than even the fastest unmyelinated axon can sustain.
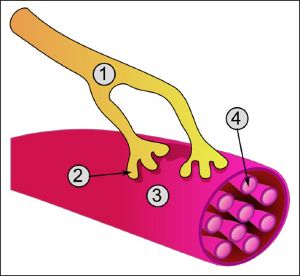
Axon terminals[edit]
An axon can divide into many branches called telodendria (Greek for ‘end of tree’). At the end of each telodendron is an axon terminal (also called a synaptic bouton, or terminal bouton). Axon terminals contain synaptic vesicles that store the neurotransmitter for release at the synapse. This makes multiple synaptic connections with other neurons possible. Sometimes the axon of a neuron may synapse onto dendrites of the same neuron, when it is known as an autapse.
Action potentials[edit]
| Structure of a typical chemical synapse |
|---|
|
Postsynaptic Voltage- Synaptic Neurotransmitter Receptor Neurotransmitter Axon terminal Synaptic cleft Dendrite |
Most axons carry signals in the form of action potentials, which are discrete electrochemical impulses that travel rapidly along an axon, starting at the cell body and terminating at points where the axon makes synaptic contact with target cells. The defining characteristic of an action potential is that it is «all-or-nothing» – every action potential that an axon generates has essentially the same size and shape. This all-or-nothing characteristic allows action potentials to be transmitted from one end of a long axon to the other without any reduction in size. There are, however, some types of neurons with short axons that carry graded electrochemical signals, of variable amplitude.
When an action potential reaches a presynaptic terminal, it activates the synaptic transmission process. The first step is rapid opening of calcium ion channels in the membrane of the axon, allowing calcium ions to flow inward across the membrane. The resulting increase in intracellular calcium concentration causes synaptic vesicles (tiny containers enclosed by a lipid membrane) filled with a neurotransmitter chemical to fuse with the axon’s membrane and empty their contents into the extracellular space. The neurotransmitter is released from the presynaptic nerve through exocytosis. The neurotransmitter chemical then diffuses across to receptors located on the membrane of the target cell. The neurotransmitter binds to these receptors and activates them. Depending on the type of receptors that are activated, the effect on the target cell can be to excite the target cell, inhibit it, or alter its metabolism in some way. This entire sequence of events often takes place in less than a thousandth of a second. Afterward, inside the presynaptic terminal, a new set of vesicles is moved into position next to the membrane, ready to be released when the next action potential arrives. The action potential is the final electrical step in the integration of synaptic messages at the scale of the neuron.[5]
(A) pyramidal cell, interneuron, and short durationwaveform (Axon), overlay of the three average waveforms;
(B) Average and standard error of peak-trough time for pyramidal cells interneurons, and putative axons;
(C) Scatter plot of signal to noise ratios for individual units againstpeak-trough time for axons, pyramidal cells (PYR) and interneurons (INT).
Extracellular recordings of action potential propagation in axons has been demonstrated in freely moving animals. While extracellular somatic action potentials have been used to study cellular activity in freely moving animals such as place cells, axonal activity in both white and gray matter can also be recorded. Extracellular recordings of axon action potential propagation is distinct from somatic action potentials in three ways: 1. The signal has a shorter peak-trough duration (~150μs) than of pyramidal cells (~500μs) or interneurons (~250μs). 2. The voltage change is triphasic. 3. Activity recorded on a tetrode is seen on only one of the four recording wires. In recordings from freely moving rats, axonal signals have been isolated in white matter tracts including the alveus and the corpus callosum as well hippocampal gray matter.[19]
In fact, the generation of action potentials in vivo is sequential in nature, and these sequential spikes constitute the digital codes in the neurons. Although previous studies indicate an axonal origin of a single spike evoked by short-term pulses, physiological signals in vivo trigger the initiation of sequential spikes at the cell bodies of the neurons.[20][21]
In addition to propagating action potentials to axonal terminals, the axon is able to amplify the action potentials, which makes sure a secure propagation of sequential action potentials toward the axonal terminal. In terms of molecular mechanisms, voltage-gated sodium channels in the axons possess lower threshold and shorter refractory period in response to short-term pulses.[22]
Development and growth[edit]
Development[edit]
The development of the axon to its target, is one of the six major stages in the overall development of the nervous system.[23] Studies done on cultured hippocampal neurons suggest that neurons initially produce multiple neurites that are equivalent, yet only one of these neurites is destined to become the axon.[24] It is unclear whether axon specification precedes axon elongation or vice versa,[25] although recent evidence points to the latter. If an axon that is not fully developed is cut, the polarity can change and other neurites can potentially become the axon. This alteration of polarity only occurs when the axon is cut at least 10 μm shorter than the other neurites. After the incision is made, the longest neurite will become the future axon and all the other neurites, including the original axon, will turn into dendrites.[26] Imposing an external force on a neurite, causing it to elongate, will make it become an axon.[27] Nonetheless, axonal development is achieved through a complex interplay between extracellular signaling, intracellular signaling and cytoskeletal dynamics.
[edit]
The extracellular signals that propagate through the extracellular matrix surrounding neurons play a prominent role in axonal development.[28] These signaling molecules include proteins, neurotrophic factors, and extracellular matrix and adhesion molecules.
Netrin (also known as UNC-6) a secreted protein, functions in axon formation. When the UNC-5 netrin receptor is mutated, several neurites are irregularly projected out of neurons and finally a single axon is extended anteriorly.[29][30][31][32] The neurotrophic factors – nerve growth factor (NGF), brain-derived neurotrophic factor (BDNF) and neurotrophin-3 (NTF3) are also involved in axon development and bind to Trk receptors.[33]
The ganglioside-converting enzyme plasma membrane ganglioside sialidase (PMGS), which is involved in the activation of TrkA at the tip of neutrites, is required for the elongation of axons. PMGS asymmetrically distributes to the tip of the neurite that is destined to become the future axon.[34]
Intracellular signaling[edit]
During axonal development, the activity of PI3K is increased at the tip of destined axon. Disrupting the activity of PI3K inhibits axonal development. Activation of PI3K results in the production of phosphatidylinositol (3,4,5)-trisphosphate (PtdIns) which can cause significant elongation of a neurite, converting it into an axon. As such, the overexpression of phosphatases that dephosphorylate PtdIns leads into the failure of polarization.[28]
Cytoskeletal dynamics[edit]
The neurite with the lowest actin filament content will become the axon. PGMS concentration and f-actin content are inversely correlated; when PGMS becomes enriched at the tip of a neurite, its f-actin content is substantially decreased.[34] In addition, exposure to actin-depolimerizing drugs and toxin B (which inactivates Rho-signaling) causes the formation of multiple axons. Consequently, the interruption of the actin network in a growth cone will promote its neurite to become the axon.[35]
Growth[edit]
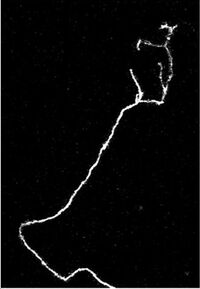
Axon of nine-day-old mouse with growth cone visible
Growing axons move through their environment via the growth cone, which is at the tip of the axon. The growth cone has a broad sheet-like extension called a lamellipodium which contain protrusions called filopodia. The filopodia are the mechanism by which the entire process adheres to surfaces and explores the surrounding environment. Actin plays a major role in the mobility of this system. Environments with high levels of cell adhesion molecules (CAMs) create an ideal environment for axonal growth. This seems to provide a «sticky» surface for axons to grow along. Examples of CAMs specific to neural systems include N-CAM, TAG-1 – an axonal glycoprotein[36] – and MAG, all of which are part of the immunoglobulin superfamily. Another set of molecules called extracellular matrix-adhesion molecules also provide a sticky substrate for axons to grow along. Examples of these molecules include laminin, fibronectin, tenascin, and perlecan. Some of these are surface bound to cells and thus act as short range attractants or repellents. Others are difusible ligands and thus can have long range effects.
Cells called guidepost cells assist in the guidance of neuronal axon growth. These cells that help axon guidance, are typically other neurons that are sometimes immature. When the axon has completed its growth at its connection to the target, the diameter of the axon can increase by up to five times, depending on the speed of conduction required.[37]
It has also been discovered through research that if the axons of a neuron were damaged, as long as the soma (the cell body of a neuron) is not damaged, the axons would regenerate and remake the synaptic connections with neurons with the help of guidepost cells. This is also referred to as neuroregeneration.[38]
Nogo-A is a type of neurite outgrowth inhibitory component that is present in the central nervous system myelin membranes (found in an axon). It has a crucial role in restricting axonal regeneration in adult mammalian central nervous system. In recent studies, if Nogo-A is blocked and neutralized, it is possible to induce long-distance axonal regeneration which leads to enhancement of functional recovery in rats and mouse spinal cord. This has yet to be done on humans.[39] A recent study has also found that macrophages activated through a specific inflammatory pathway activated by the Dectin-1 receptor are capable of promoting axon recovery, also however causing neurotoxicity in the neuron.[40]
Length regulation[edit]
Axons vary largely in length from a few micrometers up to meters in some animals. This emphasizes that there must be a cellular length regulation mechanism allowing the neurons both to sense the length of their axons and to control their growth accordingly. It was discovered that motor proteins play an important role in regulating the length of axons.[41] Based on this observation, researchers developed an explicit model for axonal growth describing how motor proteins could affect the axon length on the molecular level.[42][43][44][45] These studies suggest that motor proteins carry signaling molecules from the soma to the growth cone and vice versa whose concentration oscillates in time with a length-dependent frequency.
Classification[edit]
The axons of neurons in the human peripheral nervous system can be classified based on their physical features and signal conduction properties. Axons were known to have different thicknesses (from 0.1 to 20 µm)[3] and these differences were thought to relate to the speed at which an action potential could travel along the axon – its conductance velocity. Erlanger and Gasser proved this hypothesis, and identified several types of nerve fiber, establishing a relationship between the diameter of an axon and its nerve conduction velocity. They published their findings in 1941 giving the first classification of axons.
Axons are classified in two systems. The first one introduced by Erlanger and Gasser, grouped the fibers into three main groups using the letters A, B, and C. These groups, group A, group B, and group C include both the sensory fibers (afferents) and the motor fibers (efferents). The first group A, was subdivided into alpha, beta, gamma, and delta fibers – Aα, Aβ, Aγ, and Aδ. The motor neurons of the different motor fibers, were the lower motor neurons – alpha motor neuron, beta motor neuron, and gamma motor neuron having the Aα, Aβ, and Aγ nerve fibers, respectively.
Later findings by other researchers identified two groups of Aa fibers that were sensory fibers. These were then introduced into a system that only included sensory fibers (though some of these were mixed nerves and were also motor fibers). This system refers to the sensory groups as Types and uses Roman numerals: Type Ia, Type Ib, Type II, Type III, and Type IV.
Motor[edit]
Lower motor neurons have two kind of fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (meters/second) |
Associated muscle fibers |
|---|---|---|---|---|---|
| Alpha (α) motor neuron | Aα | 13–20 | Yes | 80–120 | Extrafusal muscle fibers |
| Beta (β) motor neuron | Aβ | ||||
| Gamma (γ) motor neuron | Aγ | 5-8 | Yes | 4–24[46][47] | Intrafusal muscle fibers |
Sensory[edit]
Different sensory receptors innervate different types of nerve fibers. Proprioceptors are innervated by type Ia, Ib and II sensory fibers, mechanoreceptors by type II and III sensory fibers and nociceptors and thermoreceptors by type III and IV sensory fibers.
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin | Conduction velocity (m/s) |
Associated sensory receptors | Proprioceptors | Mechanoceptors | Nociceptors and thermoreceptors |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13–20 | Yes | 80–120 | Primary receptors of muscle spindle (annulospiral ending) | ✔ | ||
| Ib | Aα | 13–20 | Yes | 80–120 | Golgi tendon organ | |||
| II | Aβ | 6–12 | Yes | 33–75 | Secondary receptors of muscle spindle (flower-spray ending). All cutaneous mechanoreceptors |
✔ | ||
| III | Aδ | 1–5 | Thin | 3–30 | Free nerve endings of touch and pressure Nociceptors of lateral spinothalamic tract Cold thermoreceptors |
✔ | ||
| IV | C | 0.2–1.5 | No | 0.5–2.0 | Nociceptors of anterior spinothalamic tract Warmth receptors |
Autonomic[edit]
The autonomic nervous system has two kinds of peripheral fibers:
| Type | Erlanger-Gasser Classification |
Diameter (µm) |
Myelin[48] | Conduction velocity (m/s) |
|---|---|---|---|---|
| preganglionic fibers | B | 1–5 | Yes | 3–15 |
| postganglionic fibers | C | 0.2–1.5 | No | 0.5–2.0 |
Clinical significance[edit]
In order of degree of severity, injury to a nerve can be described as neurapraxia, axonotmesis, or neurotmesis.
Concussion is considered a mild form of diffuse axonal injury.[49] Axonal injury can also cause central chromatolysis. The dysfunction of axons in the nervous system is one of the major causes of many inherited neurological disorders that affect both peripheral and central neurons.[5]
When an axon is crushed, an active process of axonal degeneration takes place at the part of the axon furthest from the cell body. This degeneration takes place quickly following the injury, with the part of the axon being sealed off at the membranes and broken down by macrophages. This is known as Wallerian degeneration.[50] Dying back of an axon can also take place in many neurodegenerative diseases, particularly when axonal transport is impaired, this is known as Wallerian-like degeneration.[51] Studies suggest that the degeneration happens as
a result of the axonal protein NMNAT2, being prevented from reaching all of the axon.[52]
Demyelination of axons causes the multitude of neurological symptoms found in the disease multiple sclerosis.
Dysmyelination is the abnormal formation of the myelin sheath. This is implicated in several leukodystrophies, and also in schizophrenia.[53][54][55]
A severe traumatic brain injury can result in widespread lesions to nerve tracts damaging the axons in a condition known as diffuse axonal injury. This can lead to a persistent vegetative state.[56] It has been shown in studies on the rat that axonal damage from a single mild traumatic brain injury, can leave a susceptibility to further damage, after repeated mild traumatic brain injuries.[57]
A nerve guidance conduit is an artificial means of guiding axon growth to enable neuroregeneration, and is one of the many treatments used for different kinds of nerve injury.
History[edit]
German anatomist Otto Friedrich Karl Deiters is generally credited with the discovery of the axon by distinguishing it from the dendrites.[5] Swiss Rüdolf Albert von Kölliker and German Robert Remak were the first to identify and characterize the axon initial segment. Kölliker named the axon in 1896.[58] Louis-Antoine Ranvier was the first to describe the gaps or nodes found on axons and for this contribution these axonal features are now commonly referred to as the nodes of Ranvier. Santiago Ramón y Cajal, a Spanish anatomist, proposed that axons were the output components of neurons, describing their functionality.[5] Joseph Erlanger and Herbert Gasser earlier developed the classification system for peripheral nerve fibers,[59] based on axonal conduction velocity, myelination, fiber size etc. Alan Hodgkin and Andrew Huxley also employed the squid giant axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential, leading to the formulation of the Hodgkin–Huxley model. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963. The formulae detailing axonal conductance were extended to vertebrates in the Frankenhaeuser–Huxley equations. The understanding of the biochemical basis for action potential propagation has advanced further, and includes many details about individual ion channels.
Other animals[edit]
The axons in invertebrates have been extensively studied. The longfin inshore squid, often used as a model organism has the longest known axon.[60] The giant squid has the largest axon known. Its size ranges from 0.5 (typically) to 1 mm in diameter and is used in the control of its jet propulsion system. The fastest recorded conduction speed of 210 m/s, is found in the ensheathed axons of some pelagic Penaeid shrimps[61] and the usual range is between 90 and 200 meters/s[62] (cf 100–120 m/s for the fastest myelinated vertebrate axon.)
In other cases as seen in rat studies an axon originates from a dendrite; such axons are said to have «dendritic origin». Some axons with dendritic origin similarly have a «proximal» initial segment that starts directly at the axon origin, while others have a «distal» initial segment, discernibly separated from the axon origin.[63] In many species some of the neurons have axons that emanate from the dendrite and not from the cell body, and these are known as axon-carrying dendrites.[1] In many cases, an axon originates at an axon hillock on the soma; such axons are said to have «somatic origin». Some axons with somatic origin have a «proximal» initial segment adjacent the axon hillock, while others have a «distal» initial segment, separated from the soma by an extended axon hillock.[63]
See also[edit]
- Electrophysiology
- Ganglionic eminence
- Giant axonal neuropathy
- Neuronal tracing
- Pioneer axon
References[edit]
- ^ a b Triarhou LC (2014). «Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues». Frontiers in Neuroanatomy. 8: 133. doi:10.3389/fnana.2014.00133. PMC 4235383. PMID 25477788.
- ^ Yau KW (December 1976). «Receptive fields, geometry and conduction block of sensory neurones in the central nervous system of the leech». The Journal of Physiology. 263 (3): 513–38. doi:10.1113/jphysiol.1976.sp011643. PMC 1307715. PMID 1018277.
- ^ a b c Squire, Larry (2013). Fundamental neuroscience (4th ed.). Amsterdam: Elsevier/Academic Press. pp. 61–65. ISBN 978-0-12-385-870-2.
- ^ a b c Luders E, Thompson PM, Toga AW (August 2010). «The development of the corpus callosum in the healthy human brain». The Journal of Neuroscience. 30 (33): 10985–90. doi:10.1523/JNEUROSCI.5122-09.2010. PMC 3197828. PMID 20720105.
- ^ a b c d e Debanne D, Campanac E, Bialowas A, Carlier E, Alcaraz G (April 2011). «Axon physiology» (PDF). Physiological Reviews. 91 (2): 555–602. doi:10.1152/physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Nelson AD, Jenkins PM (2017). «Axonal Membranes and Their Domains: Assembly and Function of the Axon Initial Segment and Node of Ranvier». Frontiers in Cellular Neuroscience. 11: 136. doi:10.3389/fncel.2017.00136. PMC 5422562. PMID 28536506.
- ^ Leterrier C, Clerc N, Rueda-Boroni F, Montersino A, Dargent B, Castets F (2017). «Ankyrin G Membrane Partners Drive the Establishment and Maintenance of the Axon Initial Segment». Frontiers in Cellular Neuroscience. 11: 6. doi:10.3389/fncel.2017.00006. PMC 5266712. PMID 28184187.
- ^ Leterrier C (February 2018). «The Axon Initial Segment: An Updated Viewpoint». The Journal of Neuroscience. 38 (9): 2135–2145. doi:10.1523/jneurosci.1922-17.2018. PMC 6596274. PMID 29378864.
- ^ Rasband MN (August 2010). «The axon initial segment and the maintenance of neuronal polarity». Nature Reviews. Neuroscience. 11 (8): 552–62. doi:10.1038/nrn2852. PMID 20631711. S2CID 23996233.
- ^ a b c d Jones SL, Svitkina TM (2016). «Axon Initial Segment Cytoskeleton: Architecture, Development, and Role in Neuron Polarity». Neural Plasticity. 2016: 6808293. doi:10.1155/2016/6808293. PMC 4967436. PMID 27493806.
- ^ Clark BD, Goldberg EM, Rudy B (December 2009). «Electrogenic tuning of the axon initial segment». The Neuroscientist. 15 (6): 651–68. doi:10.1177/1073858409341973. PMC 2951114. PMID 20007821.
- ^ a b Yamada R, Kuba H (2016). «Structural and Functional Plasticity at the Axon Initial Segment». Frontiers in Cellular Neuroscience. 10: 250. doi:10.3389/fncel.2016.00250. PMC 5078684. PMID 27826229.
- ^ a b Susuki K, Kuba H (March 2016). «Activity-dependent regulation of excitable axonal domains». The Journal of Physiological Sciences. 66 (2): 99–104. doi:10.1007/s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ a b c d e Alberts B (2004). Essential cell biology: an introduction to the molecular biology of the cell (2nd ed.). New York: Garland. pp. 584–587. ISBN 978-0-8153-3481-1.
- ^ a b Alberts B (2002). Molecular biology of the cell (4th ed.). New York: Garland. pp. 979–981. ISBN 978-0-8153-4072-0.
- ^ Ozgen, H; Baron, W; Hoekstra, D; Kahya, N (September 2016). «Oligodendroglial membrane dynamics in relation to myelin biogenesis». Cellular and Molecular Life Sciences. 73 (17): 3291–310. doi:10.1007/s00018-016-2228-8. PMC 4967101. PMID 27141942.
- ^ Sadler, T. (2010). Langman’s medical embryology (11th ed.). Philadelphia: Lippincott William & Wilkins. p. 300. ISBN 978-0-7817-9069-7.
- ^ Hess A, Young JZ (November 1952). «The nodes of Ranvier». Proceedings of the Royal Society of London. Series B, Biological Sciences. Series B. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. doi:10.1098/rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Robbins AA, Fox SE, Holmes GL, Scott RC, Barry JM (November 2013). «Short duration waveforms recorded extracellularly from freely moving rats are representative of axonal activity». Frontiers in Neural Circuits. 7 (181): 181. doi:10.3389/fncir.2013.00181. PMC 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian and Jin-Hui Wang* (2011) Molecular Brain 4(19), 1~11
- ^ Rongjing Ge, Hao Qian, Na Chen and Jin-Hui Wang* (2014) Molecular Brain 7(26):1-16
- ^ Chen N, Yu J, Qian H, Ge R, Wang JH (July 2010). «Axons amplify somatic incomplete spikes into uniform amplitudes in mouse cortical pyramidal neurons». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO…511868C. doi:10.1371/journal.pone.0011868. PMC 2912328. PMID 20686619.
- ^ Wolpert, Lewis (2015). Principles of development (5th ed.). pp. 520–524. ISBN 978-0-19-967814-3.
- ^ Fletcher TL, Banker GA (December 1989). «The establishment of polarity by hippocampal neurons: the relationship between the stage of a cell’s development in situ and its subsequent development in culture». Developmental Biology. 136 (2): 446–54. doi:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Jiang H, Rao Y (May 2005). «Axon formation: fate versus growth». Nature Neuroscience. 8 (5): 544–6. doi:10.1038/nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Goslin K, Banker G (April 1989). «Experimental observations on the development of polarity by hippocampal neurons in culture». The Journal of Cell Biology. 108 (4): 1507–16. doi:10.1083/jcb.108.4.1507. PMC 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (November 2002). «Mechanical tension can specify axonal fate in hippocampal neurons». The Journal of Cell Biology. 159 (3): 499–508. doi:10.1083/jcb.200207174. PMC 2173080. PMID 12417580.
- ^ a b Arimura N, Kaibuchi K (March 2007). «Neuronal polarity: from extracellular signals to intracellular mechanisms». Nature Reviews. Neuroscience. 8 (3): 194–205. doi:10.1038/nrn2056. PMID 17311006. S2CID 15556921.
- ^ Neuroglia and pioneer neurons express UNC-6 to provide global and local netrin cues for guiding migrations in C. elegans
- ^ Serafini T, Kennedy TE, Galko MJ, Mirzayan C, Jessell TM, Tessier-Lavigne M (August 1994). «The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6». Cell. 78 (3): 409–24. doi:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Hong K, Hinck L, Nishiyama M, Poo MM, Tessier-Lavigne M, Stein E (June 1999). «A ligand-gated association between cytoplasmic domains of UNC5 and DCC family receptors converts netrin-induced growth cone attraction to repulsion». Cell. 97 (7): 927–41. doi:10.1016/S0092-8674(00)80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (January 1990). «The unc-5, unc-6, and unc-40 genes guide circumferential migrations of pioneer axons and mesodermal cells on the epidermis in C. elegans». Neuron. 4 (1): 61–85. doi:10.1016/0896-6273(90)90444-K. PMID 2310575. S2CID 23974242.
- ^ Huang EJ, Reichardt LF (2003). «Trk receptors: roles in neuronal signal transduction». Annual Review of Biochemistry. 72: 609–42. doi:10.1146/annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ a b Da Silva JS, Hasegawa T, Miyagi T, Dotti CG, Abad-Rodriguez J (May 2005). «Asymmetric membrane ganglioside sialidase activity specifies axonal fate». Nature Neuroscience. 8 (5): 606–15. doi:10.1038/nn1442. PMID 15834419. S2CID 25227765.
- ^ Bradke F, Dotti CG (March 1999). «The role of local actin instability in axon formation». Science. 283 (5409): 1931–4. Bibcode:1999Sci…283.1931B. doi:10.1126/science.283.5409.1931. PMID 10082468.
- ^ Furley AJ, Morton SB, Manalo D, Karagogeos D, Dodd J, Jessell TM (April 1990). «The axonal glycoprotein TAG-1 is an immunoglobulin superfamily member with neurite outgrowth-promoting activity». Cell. 61 (1): 157–70. doi:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Alberts, Bruce (2015). Molecular biology of the cell (Sixth ed.). p. 947. ISBN 9780815344643.
- ^ Kunik D, Dion C, Ozaki T, Levin LA, Costantino S (2011). «Laser-based single-axon transection for high-content axon injury and regeneration studies». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO…626832K. doi:10.1371/journal.pone.0026832. PMC 3206876. PMID 22073205.
- ^ Schwab ME (February 2004). «Nogo and axon regeneration». Current Opinion in Neurobiology. 14 (1): 118–24. doi:10.1016/j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Gensel JC, Nakamura S, Guan Z, van Rooijen N, Ankeny DP, Popovich PG (March 2009). «Macrophages promote axon regeneration with concurrent neurotoxicity». The Journal of Neuroscience. 29 (12): 3956–68. doi:10.1523/JNEUROSCI.3992-08.2009. PMC 2693768. PMID 19321792.
- ^ Myers KA, Baas PW (September 2007). «Kinesin-5 regulates the growth of the axon by acting as a brake on its microtubule array». The Journal of Cell Biology. 178 (6): 1081–91. doi:10.1083/jcb.200702074. PMC 2064629. PMID 17846176.
- ^ Rishal I, Kam N, Perry RB, Shinder V, Fisher EM, Schiavo G, Fainzilber M (June 2012). «A motor-driven mechanism for cell-length sensing». Cell Reports. 1 (6): 608–16. doi:10.1016/j.celrep.2012.05.013. PMC 3389498. PMID 22773964.
- ^ Karamched BR, Bressloff PC (May 2015). «Delayed feedback model of axonal length sensing». Biophysical Journal. 108 (9): 2408–19. Bibcode:2015BpJ…108.2408K. doi:10.1016/j.bpj.2015.03.055. PMC 4423051. PMID 25954897.
- ^ Bressloff PC, Karamched BR (2015). «A frequency-dependent decoding mechanism for axonal length sensing». Frontiers in Cellular Neuroscience. 9: 281. doi:10.3389/fncel.2015.00281. PMC 4508512. PMID 26257607.
- ^ Folz F, Wettmann L, Morigi G, Kruse K (May 2019). «Sound of an axon’s growth». Physical Review E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. doi:10.1103/PhysRevE.99.050401. PMID 31212501. S2CID 118682719.
- ^ Andrew BL, Part NJ (April 1972). «Properties of fast and slow motor units in hind limb and tail muscles of the rat». Quarterly Journal of Experimental Physiology and Cognate Medical Sciences. 57 (2): 213–25. doi:10.1113/expphysiol.1972.sp002151. PMID 4482075.
- ^ Russell NJ (January 1980). «Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat». The Journal of Physiology. 298: 347–60. doi:10.1113/jphysiol.1980.sp013085. PMC 1279120. PMID 7359413.
- ^ Pocock G, Richards CD, et al. (2004). Human Physiology (2nd ed.). New York: Oxford University Press. pp. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 August 2017). «Traumatic Brain Injury (TBI) — Definition, Epidemiology, Pathophysiology». Medscape. Archived from the original on 12 June 2018. Retrieved 14 July 2018.
- ^ Trauma and Wallerian Degeneration Archived 2 May 2006 at the Wayback Machine, University of California, San Francisco
- ^ Coleman MP, Freeman MR (1 June 2010). «Wallerian degeneration, wld(s), and nmnat». Annual Review of Neuroscience. 33 (1): 245–67. doi:10.1146/annurev-neuro-060909-153248. PMC 5223592. PMID 20345246.
- ^ Gilley J, Coleman MP (January 2010). «Endogenous Nmnat2 is an essential survival factor for maintenance of healthy axons». PLOS Biology. 8 (1): e1000300. doi:10.1371/journal.pbio.1000300. PMC 2811159. PMID 20126265.
- ^ Krämer-Albers EM, Gehrig-Burger K, Thiele C, Trotter J, Nave KA (November 2006). «Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia». The Journal of Neuroscience. 26 (45): 11743–52. doi:10.1523/JNEUROSCI.3581-06.2006. PMC 6674790. PMID 17093095.
- ^ Matalon R, Michals-Matalon K, Surendran S, Tyring SK (2006). «Canavan disease: studies on the knockout mouse». N-Acetylaspartate. Adv. Exp. Med. Biol. Advances in Experimental Medicine and Biology. Vol. 576. pp. 77–93, discussion 361–3. doi:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Tkachev D, Mimmack ML, Huffaker SJ, Ryan M, Bahn S (August 2007). «Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia». The International Journal of Neuropsychopharmacology. 10 (4): 557–63. doi:10.1017/S1461145706007334. PMID 17291371.
- ^ «Brain Injury, Traumatic». Medcyclopaedia. GE. Archived from the original on 26 May 2011. Retrieved 20 June 2018.
- ^ Wright DK, Brady RD, Kamnaksh A, Trezise J, Sun M, McDonald SJ, et al. (October 2019). «Repeated mild traumatic brain injuries induce persistent changes in plasma protein and magnetic resonance imaging biomarkers in the rat». Scientific Reports. 9 (1): 14626. Bibcode:2019NatSR…914626W. doi:10.1038/s41598-019-51267-w. PMC 6787341. PMID 31602002.
- ^ Finger S (1994). Origins of neuroscience: a history of explorations into brain function. Oxford University Press. p. 47. ISBN 9780195146943. OCLC 27151391.
Kölliker would give the «axon» its name in 1896.
- ^ Grant G (December 2006). «The 1932 and 1944 Nobel Prizes in physiology or medicine: rewards for ground-breaking studies in neurophysiology». Journal of the History of the Neurosciences. 15 (4): 341–57. doi:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Hellier, Jennifer L. (16 December 2014). The Brain, the Nervous System, and Their Diseases [3 volumes]. ABC-CLIO. ISBN 9781610693387. Archived from the original on 14 March 2018.
- ^ Hsu K, Terakawa S (July 1996). «Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction». Journal of Neurobiology. 30 (3): 397–409. doi:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. PMID 8807532.
- ^ Salzer JL, Zalc B (October 2016). «Myelination». Current Biology. 26 (20): R971–R975. doi:10.1016/j.cub.2016.07.074. PMID 27780071.
- ^ a b Höfflin F, Jack A, Riedel C, Mack-Bucher J, Roos J, Corcelli C, et al. (2017). «Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex». Frontiers in Cellular Neuroscience. 11: 332. doi:10.3389/fncel.2017.00332. PMC 5684645. PMID 29170630.
External links[edit]
- Histology image: 3_09 at the University of Oklahoma Health Sciences Center – «Slide 3 Spinal cord»
Intermediate Filament Proteins
Philip Grant, Harish C. Pant, in Methods in Enzymology, 2016
2 Squid Giant Fiber System
The giant axon is the largest of 8–10 third-order giant axons arising in the stellate ganglion that innervate the circular muscles of the mantle, contractions of which underlie the rapid jet propulsion mode of squid swimming behavior (Fig. 1A). Each giant axon originates from the fusion of many axons of small neurons in the GFL (Martin, 1965; Young, 1939) thereby increasing axon diameter (up to 1 mm) to facilitate rapid impulse transmission essential to the escape response (Otis & Gilly, 1990; Young, 1938). Giant axons receive input via axon-axonal synapses within a giant synapse in the ganglion from second-order giant fibers in the squid brain (Martin & Miledi, 1975; Williamson & Chrachri, 2004; Young, 1973).
Figure 1. Squid giant fiber system: (A) Diagram of Loligo stellate ganglion showing giant axons, GF3, exiting the ganglion in stellate nerves (S.N.) to innervate mantle muscles (M). Axons of small cells in giant fiber lobe (GFL) fuse to form giant axons. Second-order giant fibers (GF2), from the brain, in the pallial nerve (P.N.) enter the ganglion where they synapse with giant axons in the giant synapse region (SYN). (B) Stellate ganglion with stubs of attached giant axons (a.) appearing as clear areas in stellate nerves (S.N.). GIS is neuropil region of the ganglion showing how cell bodies of the giant fiber lobe (GFL) are dissected from the body of the ganglion.
Panel (A) modified after Young (1939), fig. 11. Panel (B) modified after Tytell et al. (1990), fig. 1, Wiley-Liss.
Three major cytoskeletal structures contribute to the cytoskeletal scaffolding underlying the axonal architecture, MTs, MFs, and NFs. In addition, MAPs, myosins, and the various molecular motors kinesin and dynein contribute to the dynamics of axonal transport and function. Fast and slow axon transport include vesicular cargos of transmitters, modulators, receptor proteins, and ion channels, while larger oligomers of tubulin and NFs exchange slowly with a stable MT–NF lattice core (Adams & Gillespie, 1988; Allen et al., 1982; Brady, Lasek, & Allen, 1982; Brady et al., 1985; Galbraith, Reese, Schlief, & Gallant, 1999). Mitochondria are the largest organelles transported from cell body to the neuromuscular synapses in mantle muscle (Brinley & Tiffert, 1978; Pratt, 1986).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/S0076687915005510
Glial Cells: Invertebrate☆
J.A. Coles, in Reference Module in Biomedical Sciences, 2015
Possible role of glial cells in homeostasis of extracellular K+ around the giant axon of the squid
The giant axon of the squid (a cephalopod) is unmyelinated but achieves a high conduction velocity by having a large diameter, which can exceed 500 μm. It is surrounded by a thin continuous sheath composed of Schwann glial cells, each approximately 2 μm thick, 20 μm wide, and 100–600 μm long. This sheath is further surrounded by connective tissue. The ion channels of both the axon and the Schwann cells are well characterized.
Two Schwann cell conductances have been described – an L-type Ca2 + conductance and an outwardly rectifying K+ conductance activated by entry of Ca2 +. These currents are functionally almost identical to conductances found on mammalian Schwann cells. Although propagation of action potentials along the axon causes release of K+ through the axon membrane, little increase in [K+] in the periaxonal space is observed in healthy squid nerves. The K+ conductances of the Schwann cells are not suited to clearing K+. Possibly, [K+] does not rise excessively simply because the extracellular space is large.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383046134
Cytoskeleton and Intracellular Motility
Merri Lynn Casem BA, PhD, in Case Studies in Cell Biology, 2016
Methods
Preparation of dissociated axoplasm
The giant axon was dissected from the squid L. pealeii in running seawater. Axons were stored in liquid nitrogen. To make a dissociated axoplasm preparation, an axon was thawed and the axoplasm extruded onto a glass coverslip. 20 μL of motility buffer containing 2 mM ATP was added and a second glass coverslip was placed on top of the sample and light pressure was applied.
Preparation of vesicles and supernatant from axoplasm
Axoplasm from 6–8 axons was placed in 50 μL of cold motility buffer supplemented with a protease inhibitor cocktail and homogenized by pipetting multiple times, using a 200 μL pipette. The homogenate was centrifuged at 10,000g for 4 min at 4°C, and the supernatant was carefully collected. The pellet was resuspended in 60 μL of the same homogenization buffer and centrifuged as before. Supernatants were combined to form the S1 supernatant.
The S1 supernatant was treated with 20 μM taxol and 1 mM GTP for 25 min at 23°C to induce MT polymerizastion. The taxol-treated S1 supernatant was then layered onto sucrose gradient and centrifuged at 150,000g for 60 min at 4°C using a swinging bucket rotor. The top 50 μL of the gradient, containing the S2 high-speed supernatant, was collected with a 200 μL pipette and kept on ice. Vesicles gathered at the 35% sucrose interface and were collected by puncturing the side of the tube. The MT fraction was discarded.
Preparation of squid optic lobe microtubules
Optic lobes were dissected from 8–10 squid and placed in a buffer containing a protease inhibitor cocktail and homogenized using a Dounce homogenizer. The homogenate was centrifuged at 30,000g for 30 min at 4°C. The supernatant was collected and centrifuged for 140,000g for 90 min at 4°C. The final supernatant was collected and mixed with taxol and GTP to a final concentration of 20 μM and 1 mM, respectively. The mixture was incubated for 20 min at 23°C to promote MT polymerization followed by centrifugation through a 15% sucrose cushion at 27,000g for 1 h. The pellet was gently resuspended in buffer containing taxol and GTP. To remove MT-associated proteins (MAPs) 1 mL of the taxol pellet was incubated with 0.5 mL of a 3 M NaCl solution in buffer containing taxol and GTP for 15 min at 23°C. Salt-extracted MTs were then pelleted by centrifugation at 35,000g for 30 min at 4°C. The pellet was washed with buffer and resuspended as described previously.
In vitro motility assay
Salt-washed squid optic lobe MTs (1 μL from a 500 μg/mL stock) were added to a glass coverslip followed by the addition of 3 μL of the S2 supernatant. If MT motility was being assayed, then a second coverslip was placed on top of the sample and motility was analyzed with video microscopy.
For assaying organelle motility, 4 μL of the organelle fraction was added to 1 μL of salt-washed MTs in the presence or absence of the S2 supernatant. Organelle motility was measured using video microscopy. The influence of various inhibitors was tested by adding 2 μL of a concentrated stock solution to the organelle mix.
Movement of carboxylated latex beads was assayed using coverslips that were treated overnight with poly-d-lysine, to adhere the MTs to the coverslip surface. Beads were diluted in motility buffer and mixed with S2 supernatant in a ratio of one part beads to four parts S2 and incubated for 5 min on ice. MTs and S2-treated beads were added to the poly-d-lysine–coated coverslips and observed using video microscopy.
Electron microscopy
Negative stain images of MTs and vesicles were made by applying one drop of MT, supernatant, or organelle fractions onto a formvar-coated copper grid for 30 s. The grid was washed with several drops of motility buffer and placed on a drop of 1% uranyl acetate for 30 s, then dried with filter paper. Specimens were examined using a transmission electron microscope.
- ■
-
Speculate on the reason for including a mixture (cocktail) of protease inhibitors in the motility buffer.
- ■
-
Create a flow chart that outlines the steps required to obtain the S2 supernatant used in these experiments.
- ■
-
What was the final concentration of NaCl used to remove MT-associated proteins (MAPs) from the surface of squid optic lobe MTs?
- ■
-
Characterize the nature of the MT–MT-associated protein interactions given that they can be disrupted by high salt concentration.
- ■
-
What concentration of MT protein is used in the in vitro motility assay?
- ■
-
Discuss how negative stain EM images differ from more traditional EM images.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128013946000063
Volume 2
Mark O. Bevensee, Walter F. Boron, in Seldin and Giebisch’s The Kidney (Fifth Edition), 2013
Involvement of K+ and HCO3−; Energetics
In the squid giant axon dialyzed with a fluid containing K+, but lacking Na+ and Cl−, the cotransporter moves K+ and HCO3− out of the axon, eliciting a pHi decrease.265 Under the appropriate conditions, the K+/HCO3− cotransporter can also operate in the forward direction, moving HCO3− into the squid giant axon.268,269 Exposing axons dialyzed with a fluid devoid of K+, Na+, and Cl− to an artificial seawater containing K+ and CO2/HCO3− elicits a pHi decrease (due to CO2 entry), followed by a pHi increase (due to K+/HCO3− influx). The HCO3− fluxes mediated by K+/HCO3− cotransporter can be enhanced by using out-of-equilibrium CO2/HCO3− solutions to introduce HCO3− exclusively to either the inside or outside of the axon.268,270
As mentioned above, two independent groups have also reported DIDS-sensitive, K+-coupled HCO3− transport in the medullary thick ascending limb (mTAL), either from tubule suspensions266 or perfused tubules.267 In the perfused-tubule study,267 luminal DIDS increased transepithelial HCO3− reabsorption—a finding consistent with DIDS-sensitive K+-coupled HCO3− transport opposing HCO3− reabsorption.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123814623000525
Ion Channels of Excitable Cells
John G. Starkus, Martin D. Rayner, in Methods in Neurosciences, 1994
Advantages and Disadvantages of the Crayfish Giant Axon Preparation
The crayfish medial giant axon preparation offers substantial advantages for axial-wire voltage-clamp studies on axonal sodium channels in their native membrane. Crayfish are inexpensive and readily available on a year-round basis, either by catching them oneself (if you live in the right climate) or by purchasing them from commercial farms in California and Louisiana. They are easy to maintain in the laboratory and allow one to avoid the bureaucratic problems which arise with use of vertebrate preparations. More significantly, however, crayfish medial giant axons offer two technical advantages which make this a premium preparation for detailed biophysical studies: (i) the axoplasm is fluid and easily washed out of the axon when the internal perfusate is driven by a very low hydrostatic pressure head (see below), to yield a “clean” membrane preparation without requiring either dialysis, or enzymatic or roller techniques for axoplasm removal; (ii) the Schwann cell sheath is permeated by a tubular lattice with openings into the periaxonal space every ∼0.2 μ m (as opposed to the 5- to 13-μm intervals between Schwann cell clefts in squid axons); see Shrager et al. (1). Thus, the crayfish Schwann cells permit very rapid reequilibration of periaxonal ion concentrations (some 25-fold faster than that in squid axons (1)). Furthermore, the close spacing of the tubule lattice openings reduces the possibility that microscopic space clamp errors can arise from the lateral resistance of the Frankenhaeuser-Hodgkin space, as described for squid axons by Stimers et al. (2). In almost 15 years of gating current recording we have never seen a gating current “rising phase” which outlasts the clamp rise time in a crayfish axon, an observation which tends to confirm that such rising phases are an artifact arising from microscopic space-clamp errors induced by the geometry of the squid’s periaxonal space (2). Finally, the relatively faster kinetics of crayfish axons (even at 6 to 8°C) makes the gating currents in this preparation seem relatively larger and, therefore, easier to record (3).
Against the advantages described above, there is the disadvantage of the smaller diameter of crayfish giant axons. We find that the “best” axons fall between 180 and 250 μm in diameter; axons larger than this (we have seen axons as large as 400 μ m) are often of variable diameter and are discarded for this reason. However, the small size of our best axons limits the diameter of the axial wire, makes electrode placement more difficult (our success rate rarely exceeds ∼80%), and raises questions with respect to both electrode polarization and potential space-clamp errors which we address below.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121852870500119
Anemonia Sulcata Toxin II☆
M. Cataldi, in Reference Module in Biomedical Sciences, 2015
Neuronal excitability
Studies performed on crayfish giant axon showed that ATX II significantly prolongs action potential duration by slowing membrane repolarization and that this effect can be partially inhibited by depolarising currents (Romey et al., 1976; Warashina et al., 1981). In the presence of the toxin, the action potential duration in the giant axons of the crustacean abdominal nerve cord can be longer than 1 s (Rathmayer and Beress, 1976). The ATX II effect is reversible upon washout (Rathmayer and Beress, 1976). The ATX II slowing effect on nerve action potential is also observed in frog myelinated fibers (Bergman et al., 1976) and in cultured neuroblastoma cells (Lazdunski et al., 1979). Upon exposure to ATX II (1 μM for 3 h) c-fos expression greatly increases in cultured rat striatal neurons (Falk et al., 2008). A significant increase in recovery time from seizure-like activity induced by electroshock was observed in Drosophila larvae fed with ATX II and this toxin also induced an increase in Na+ persistent current in motorneurons from these insects (Marley and Baines, 2011).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780128012383994790
Neurons
Constance Hammond, in Cellular and Molecular Neurophysiology (Fourth Edition), 2015
The pioneer living preparation
The squid’s giant axon is most commonly used for these observations since its axoplasm can easily be extruded and a translucent cylinder of axoplasm devoid of its membrane is thus obtained. This living extruded axon keeps its transport properties for several hours. The absence of plasma membrane allows precise control of the experimental conditions and entry into the axoplasm of several components that cannot usually pass through the membrane barrier in vivo (e.g. antibodies). The improvement of video techniques applied to light microscopy allowed the first observations of the movement of a multitude of small particles along the microtubules in a living extruded axon.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780123970329000017
Membrane Potential and Action Potential
David A. McCormick, in From Molecules to Networks, 2004
The membrane of the squid giant axon, at rest, is most permeable to K+ ions, less so to Cl−, and least permeable to Na+. (Chloride appears to contribute considerably less to the determination of the resting potential of mammalian neurons.) These results indicate that the resting membrane potential is determined by the resting permeability of the membrane to K+, Na+, and Cl−. In theory, this resting membrane potential may be anywhere between EK (e.g., −76 mV) and ENa (+55 mV). For the three ions at 20°C, the equation is
Vm = 58.2 log{(1.20 + 0.04.440 + 0.45.40)/(1.400 + 0.04.50 + 0.45.560)} = −62 mV.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780121486600500068
Sodium Channels
KATSUSHIGE ONO, MAKOTO ARITA, in Heart Physiology and Pathophysiology (Fourth Edition), 2001
2. Macroscopic Na+ Current
The classical description of ionic currents in the squid giant axon by Hodgkin and Huxley (20, 21) has been widely used for other electrically excitable membranes. In the Hodgkin–Huxley equations for the Na+ current, the term m3·h is considered to be the probability of an open sodium channel. The symbol m denotes the activation variable, h the inactivation variable, and the kinetics of m and h are described by first-order differential equations. Therefore, the current relaxation at a given membrane potential is specified by the parameters m∞ (steady-state activation variable), h∞ (steady-state inactivation variable), τm (time constant of Na+ activation), and τh (time constant of Na+ inactivation). The steady-state properties of activation and inactivation have been discussed for a long time and can be summarized as follows. Hodgkin and Huxley observed the onset of the Na+ current as a sigmoidal form after a voltage step, so that they postulated that activation was a multistep process or the result of three independent events with the probability m, yielding the probability of opening of m3. Therefore the voltage dependence of the activation process itself would be the cubic root of the peak conductance. The decay of INa represented the accumulation of channels in the inactivation state. Because they observed that INa decayed with a single time constant, they described inactivation as only a single transition with the probability of (1 – h). These parameters of activation (m3) and inactivation (h) in cardiac myocytes are plotted as a function of membrane potential (Fig. 3) (22). Overlap between the activation and the inactivation curve is independent of the assumed resting potential. The “window” between the m3∞ and h∞ curves (shaded area in Fig. 3) is of particular interest because it may reflect the potential range in which steady-state Na+ currents can be observed. The amplitude of these stationary currents may be proportional to m3∞ h∞.
FIGURE 3. Steady-state parameters m∞, m3∞, and h∞ of Na+ current activation and inactivation in a single myocardial mouse cell (22).
In the classical Hodgkin–Huxley equations described earlier, the probability of an open Na+ channel was formulated by the product of the probabilities of a channel being activated (m3) and not being inactivated (h): the transient Na+ current was proportional to m3·h. Therefore, it was assumed that the two gating processes of Na+ activation and inactivation proceed independently of each other. This concept has long been supported by experiments in which strong modification of Na+ inactivation had only a small effect on Na+ activation. However, some experiments have provided evidence that activation and inactivation are functionally coupled (23, 24). This bold hypothesis has been confirmed by mutagenesis studies involving mutations in the outer S4 segment of domain IV. Replacing charged arginine residues with cysteines markedly slows the rate of fast inactivation during depolarization in the Na+ channel in skeletal muscle. In the cardiac counterpart, naturally occurring mutations in the domain IV-S4 segment are implicated in both skeletal muscle myopathies (25) and the long QT syndrome (described later) (26). It is therefore concluded that the domain IV-S4 charged segment serves as the voltage sensor for both activation and inactivation and that outward motion of this segment is a prerequisite to normal inactivation gating. Studies also suggest that the charged S4 segments in all four domains contribute to both activation and inactivation (26, 27), indicating that the classical Hodgkin–Huxley model is probably wrong and a reinterpretation of the activation/inactivation gate is required based on the molecular function (28).
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780126569759500146
Axonal and Dendritic Transport by Dyneins and Kinesins in Neurons
L.S.B. Goldstein, in Encyclopedia of Neuroscience, 2009
Kinesins
Kinesin molecular motor proteins were originally discovered in the giant axon of the squid. Although not recognized at the time, this new type of molecular motor protein, although biochemically distinct from myosins and dyneins, is the founding member of a diverse but related collection of molecular motor proteins that were deployed for many different functions in eukaryotic cells. The founding member of this family, originally called conventional kinesin, and now called kinesin-1, is a heterotetrameric protein composed of two kinesin heavy chains (KHCs) and two kinesin light chains (KLCs) (Figure 4). The motor activity of kinesin-1 resides in KHC in an N-terminal region of approximately 350 amino acids. This protein domain has been shown to be capable of generating adenosine 5′-triphosphate (ATP)-dependent movements along microtubules in vitro, has been crystallized and solved structurally, and has proven to be conserved and shared among all kinesin-related motor proteins. The nonmotor portion of KHC has two structural domains. One structural domain is an alpha-helical coiled coil that mediates KHC dimerization. The other region is of unknown structure and complexes with the KLCs to form the so-called tail or cargo binding domain of kinesin-1. KLC has a short coiled coil domain at its N-terminus that may mediate the dimerization and/or association with KHC, and then has a region of six relatively well-conserved tetratricopeptide repeat (TPR) units, whose structure has been solved in other proteins and which are predicted to form a triple alpha-helical groove composed of three TPR units. Thus, KLC is predicted to have two of these triple alpha-helical grooves that may be important in cargo binding and kinesin regulation.
Figure 4. Schematic diagram of kinesin-1 structure. Kinesin-1 is a heterotetramer consisting of two kinesin heavy chain (KHC) subunits and two kinesin light chain (KLC) subunits. KHC contains the motor domain, the dimerization domain, and a short terminal domain that interacts with the KLC subunits. Cargo binding may be mediated by KHC and KLC together or individually. KLC also plays roles in regulating KHC motor domain activity. ATP, adenosine 5′-triphosphate; TPR, tetratricopeptide repeat.
The sequence of the KHC motor domain led to the discovery that eukaryotic genomes encode many different kinesin motor proteins. These proteins are all predicted to share a common motor domain but to have a variety of structurally diverse ‘tail’ domains attached that may harness force-generating activities by kinesins to a variety of cargoes in various cellular types and functions (Figure 5). Although the initial expectation was that all these predicted motor proteins would be plus end-directed motor proteins, a surprising degree of diversity in behavior was discovered. Some of these kinesin motor proteins mediate minus end-directed movements, and some may not be motor proteins at all and may mediate the rapid depolymerization of microtubules. Both of these types of proteins nonetheless couple ATP hydrolysis to their activities. Some kinesins may have other functional activities in the motor domain, but these have not yet been clearly elucidated. While many kinesins appear to play roles in nonneuronal cells, in particular in the process of cell division, a number are shared between neurons and nonneuronal cells. Many kinesins are specific only to neurons, where they may be involved in axonal or dendritic transport processes. For example, in mammals, on the order of 10–15 of the known kinesins among the 50 or so predicted to be encoded in the genome are specialized for cell division. In Drosophila, because of the smaller genome, proportionally fewer are used in mitosis and in neurons. A key question is which motor proteins move which types of vesicles and organelles in each type of neuron.
Figure 5. Principles of kinesin and dynein diversification. Kinesins appear to have evolved by gene duplication and divergence such that a conserved motor (shaded ovals) has become harnessed to a wide array of diverse tail domains. The location of the motor domain in the heavy chain polypeptide allows kinesin motors to be divided into several groups: an N-terminal group, a central group, and a C-terminal group. In addition, N-terminal kinesins have been found as homodimers, heterodimers, homotetramers, and monomers. Cytoplasmic dyneins appear to have conserved the bulk of their principal motor polypeptide and have generated far fewer divergent genes. Accessory chain diversification may be the principal mechanism for functional specialization. Reproduced with permission from Goldstein LS and Yang Z (2000) Microtubule-based transport systems in neurons: The roles of kinesins and dyneins. Annual Review of Neuroscience 23: 39–71.
In neurons, although there is a large diversity of different kinesin motor proteins and cargoes, some simple principles have begun to emerge. For example, kinesin-1 appears to play roles in the anterograde transport of a number of different types of vesicles whose contents are needed along the axonal membrane and at the synapse, such as vesicles containing the amyloid precursor protein (APP), whose processing may cause Alzheimer’s disease. Kinesin-1 also appears to play a role in the transport of neurofilaments, which are required for radial growth of axons, and in the movement of mitochondria. It is interesting to note that recent work suggests that mitochondrial movement by kinesin-1 may be mediated by a special form of kinesin-1 in which KLC is replaced by another protein, whose name is Milton. A second prominent class of kinesins, referred to as kinesin-3, appears to play roles in the movement of protein components of synaptic vesicles and may also play a role in the movement of mitochondria. Other kinesins may move mRNA particles, components of postsynaptic complexes and postsynaptic receptors, as well as other organelles, including peroxisomes, elements of endoplasmic reticulum, and the Golgi apparatus. An important and unresolved question is whether the movements of nonmembrane particles and proteins are mediated by direct interactions with the motor proteins or by binding to vesicle or organelle membranes and hitchhiking.
Another type of kinesin used for movements in some types of neurons is called kinesin-2. This kinesin is generally a heterotrimer of two nonidentical motor subunits associated with a third nonmotor domain protein, which may form part of the tail. This class of motor protein has been found to be used primarily for movement of materials in cilia and is thus necessary for the construction of cilia and perhaps for signaling mediated by cilia. In neurons in particular, this class of kinesin appears to be used most prominently in sensory neurons of various types, which often use modified cilia as their sensory endings within which receptors for odors or chemical molecules are bound and signals are transmitted. Vertebrate photoreceptors have a modified cilium as their light-sensing domain, the so-called outer segment, and this modified cilium also appears to require the use of this kinesin-2 type of motor protein for the movement of photoreceptive components such as opsin.
Read full chapter
URL:
https://www.sciencedirect.com/science/article/pii/B9780080450469007087
Мало какое животное сыграло такую важную роль в развитии нейробиологии, как кальмар. А точнее — гигантский аксон в его мантии, аксон нейрона, который отвечает (в том числе), за реактивную систему кальмара. Этот аксон достигает в диаметре до полутора миллиметров (обычно полмиллиметра). Его открывали дважды: сначала аксон описал в 1909 году Леонард Уорчестер Уильямс, но открытие не заметили и забыли — и только через 27 лет британец Джон Юнг заново открыл его, и знаменитые Ходжкин и Хаксли получили материал, при помощи которого они построили модель потенциала действия и получили свою Нобелевскую премию 1963 года.
«Можно утверждать, что введение Юнгом в 1936 году препарата аксона кальмара имело для науки об аксоне большее значение, чем какое-либо другое открытие, сделанное за последние 40 лет. Один выдающийся нейрофизиолог заметил недавно во время ужина на одном из конгрессов (не самым тактичным образом, должен признать): «Если честно, Нобелевскую премию нужно было присвоить кальмару»», — вспоминал Ходжкин.
Нам попалось видео, в котором вы можете увидеть анатомирование кальмара и Тот Самый Аксон. А анатомирование проводит Тот Самый Джон Янг, «один из самых влиятельных биологов ХХ века».
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
- Электрофизиология
- Ганглиозное возвышение
- Гигантская аксональная нейропатия
- Нейронное отслеживание
- Пионерный аксон
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »
6.6.1. Быстрые ВПСП
Ацетилхолиновые (АХ) ВПСП вызываются активацией íèêî-
тинового АХ-рецептора, который открывает канал для катионов Na+, K+ è Ca2+. Потенциал реверсии этого тока около –5 мВ. Эти ВПСП регистрируются в нейронах ЦНС, спинном мозге (в клетках Реншоу), вегетативной нервной системе (в постганглионарных нейронах), ске-
летных мышцах.
Глютаматные ВПСП вызываются активацией трех типов глютаматных рецепторов, имеющих свои специфические агонисты: (1) AMPA,
(2)каиновая кислота и (3) NMDA.
AMPA- и каиновые рецепторы открывают каналы для катионов
Na+, K+ и иногда Ca2+. Потенциал реверсии этого тока около –0 мВ. При ПП (-75 мВ) NMDA-рецептор блокирован ионами Mg2+; ïðè
деполяризации блок снимается, и через канал течет Na+/K+/Ca2+-ток, вызывающий продолжительную деполяризацию. Активация NMDAрецептора может вызвать продолжительный ток, лежащий в основе долговременной потенциации.
6.6.2. Быстрые ТПСП
ÃÀÌÊ-ТПСП вызываются активацией ÃÀÌÊA-рецепторов, которые открывают канал для Cl—. Потенциал реверсии Cl—-тока составляет около –75 мВ. Cl—-ток обеспечивает быстрое торможение, например, пирамидных клеток коры и гиппокампа, вызываемое тормозными ин-
тернейронами через коллатеральные тормозные пути.
ÃÀÌÊA— è ÃÀÌÊÑ—рецепторы управляют Cl—-проводимостью в дендритах колбочковых и палочковых биполяров сетчатки позвоночных,
соответственно.
Глициновые ТПСП вызываются активацией глициновых рецепторов, которые так же, как ÃÀÌÊÀ(Ñ)-рецепторы, открывают канал для Cl—.
6.6.3. Медленные тормозные эффекты
Увеличение Ê+-проводимости обеспечивается действием многих медиаторов, например, ацетилхолина, норадреналина, серотонина, ГАМК, дофамина, аденозина, соматостатина, энкефалинов. Пирамид-
ные клетки гиппокампа отвечают на серотонин, ГАМК (при участии метаботропных ÃÀÌÊ—рецепторов) и аденозин увеличением Ê+-ïðî-
водимости. Функциональное значение увеличения К+-проводимости состоит в торможении, в результате которого вероятность генерации ПД в нейроне уменьшается.
150
Уменьшение Ca2+-проводимости. АХ, норадреналин, серотонин и ГАМК могут уменьшать Ca2+-ток в пресинаптических мембранах. Уменьшение этого тока рассматривается как отрицательная обратная связь, которая регулирует уровень выделившегося в синаптическую щель медиатора. Поскольку выделение медиатора обеспечивается входом Ca2+ в аксонную терминаль, уменьшение входящего Ca2+-тока уменьшает количество выделившегося медиатора.
6.6.4.Медленные возбудительные эффекты (уменьшение Ê+-проводимости)
Âмембранах нейронов обнаружены потенциал-зависимые К+-òîêè
(параграф 6.8.10), которые блокируются рядом медиаторов. Уменьшение IAHP (Ê+-ток следовой гиперполяризации) показано
при действии ряда медиаторов — норадреналина, ацетилхолина, серотонина, гистамина, глютамата. Этот ток регулируется через систему вторичных посредников при участии цАМФ и обеспечивает адаптацию частоты спайковых разрядов, т.е. постепенное ее уменьшение до устранения ПД. При уменьшении IAHP адаптация устраняется (ослабевает), что приводит к продолжительной импульсации нейронов в течение всего времени действия стимула. Функциональное значение этого тока состоит в увеличении отношения «сигнал-шум» в ответе нейрона на
стимул.
Уменьшение IÌ (мускариновый К+-ток) обеспечивается мускариновыми АХ-рецепторами. Этот ток так же, как и IAHP , участвует в адаптации спайковых разрядов, активируется при деполяризации выше
–65 мВ и, в отличие от IAHP , не проявляется при ПП. IÌ уменьшается при активации различных рецепторов, включая серотонинэргические,
глутаматэргические, а также некоторые пептидные рецепторы.
6.7. Проведение локальных потенциалов
Пассивные электрические свойства нейронов (сопротивление и емкость мембраны, а также сопротивление цитоплазмы) играют важную роль в распространении электрических потенциалов по нейронным сетям. В периферических рецепторах потенциалы возникают при действии раздражителей различной физической природы (рецепторные потенциалы), в постсинаптических мембранах потенциалы возникают в результате ионной проводимости при синаптической передаче (постсинаптические потенциалы). Амплитуда таких потенциалов градуально изменяется в зависимости от амплитуды токов, протекающих
151
через мембраны периферических рецепторов и нейронов. В органах чувств через градуальные потенциалы происходит генерация импульса в ответ на сенсорный стимул; в аксоне они способствуют распространению нервного импульса; в постсинаптических нейронах такие потенциалы возникают на многочисленных синаптических входах и суммируются, определяя тем самым вероятность генерации ПД в нейроне.
В данном разделе рассмотрено распространение потенциалов по нервным волокнам с постоянным диаметром, т.е. по цилиндрическим проводникам, и в условиях, когда в мембранах не активируются потен- циал-зависимые каналы, изменяющие сопротивление мембраны.
6.7.1. Кабельные свойства нервных и мышечных волокон
Нервное волокно состоит из тех же компонентов, что и обычный электрический кабель. Роль проводящей среды в нервном волокне выполняет раствор солей, обладающий плохой проводимостью в отличие от металлических проводников. Мембрана клетки является изолятором, но из-за малой толщины обладает высокой емкостью. Из-за таких электрических особенностей потенциал, приложенный к нервному волокну, распространяется только на незначительное расстояние. С некоторыми упрощениями продольное распространение тока по волокну подчиняется закону Ома, согласно которому ток i, проходя через сопротивление r, создает напряжение v = ir.
6.7.1.1. Входное сопротивление и постоянная длины
Прямое электрическое раздражение волокна вызывает потенциал, который пассивно распространяется по волокну, как по кабелю. По мере удаления от места возникновения амплитуда потенциала падает по экспоненциальному закону (рис. 6.14). Эквивалентная электрическая схема мембраны на рисунке 6.15 объясняет падение амплитуды потенциала. Формально мембрана состоит из дискретных контуров cm— rm и дискретных продольных сопротивлений ri. Сопротивление мембраны rm представляет собой сопротивление стенки цилиндра, а продольное сопротивление ri соответствует внутреннему сопротивлению участка аксоплазмы между цилиндрами.
По мере увеличения продольного сопротивления (в результате последовательной суммации ri) ток уменьшается, так как при последовательном соединении сопротивления складываются, и по закону Ома ток будет уменьшаться (I = U/R). Поскольку все сопротивления rm в контуре одинаковы, потенциалы на них будут пропорционально умень-
152
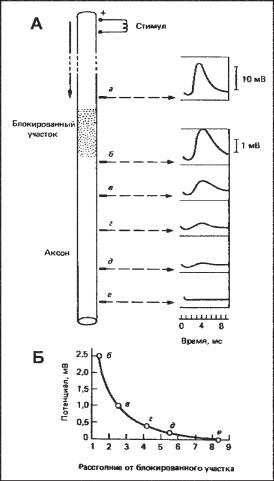
шаться, так как через них проходит уменьшающийся ток. В результате трансмембранная разность потенциалов уменьшается по мере удаления от источника.
Ðèñ. 6.14. (А) Пассивное распространение возбуждения по аксону кальмара. Участок волокна блокировали локальным охлаждением, чтобы предотвратить генерацию ПД. Потенциал преодолевает блокированный участок, существенно уменьшаясь по амплитуде. При распространении далее по волокну амплитуда потенциала градуально снижается. (Б) График зависимости амплитуды потенциала от расстояния от блокированного участка.
153
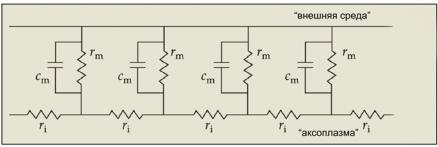
Ðèñ. 6.15. Эквивалентная электрическая схема мембраны. Электрические характеристики локального участка волокна: ri — внутреннее продольное сопротивление, rm — поперечное сопротивление, cm — емкость мембраны.
Падение амплитуды потенциала носит экспоненциальный характер, так что потенциал (Vx) при данном значении расстояния õ равен:
Vx = V0e-x/λ
Максимальный потенциал V0 определяется величиной стимулирующего тока. Уменьшение потенциала определяется константой λ, называемой постоянной длины волокна. λ — это расстояние, на котором потенциал снижается в å раз, т.е. до 37% от максимального значения.
6.7.1.2. Сопротивление мембраны и продольное сопротивление
Постоянная длины волокна λ зависит как от rm , òàê è îò ri :
λ = (rm/ri)½
Исходя из формулы, λ возрастает с увеличением сопротивления мембраны, препятствующего утечке тока во внеклеточное пространство, и, напротив, снижается с увеличением внутреннего сопротивления, которое затрудняет продольное протекание тока по аксоплазме.
Еще одна важная кабельная характеристика проводника — входное сопротивление мембраны — также зависит от обоих параметров:
rinput = 1/2(rm/ri)1/2
Коэффициент 1/2 в формуле объясняется тем, что аксон простирается в двух направлениях от места инъекции тока и каждая его половина обладает своими сопротивлениями. Измерив в эксперименте rinput è λ, можно рассчитать rm è ri.
154
6.7.1.3. Удельное сопротивление
Рассчитанные значения rm è ri, характеризуют сопротивление модельного цилиндрического сегмента аксона длиной 1 см. Однако эти характеристики не предоставляют точной информации о сопротивлении мембраны и аксоплазмы, поскольку последние зависят от размера волокна. Сопротивление мембраны нервного волокна обратно зависит от общего числа ионных каналов, которое определяется их плотностью и площадью поверхности сегмента аксона.
Чтобы сопоставить между собой мембраны разных волокон, нужно знать величину удельного сопротивления Rm, которое отражает сопротивление мембраны площадью 1 см2 и измеряется в Ом см2. Отрезок аксона длиной 1 см и радиусом α обладает площадью поверхности 2πα ñì2. Сопротивление мембраны rm такого отрезка составляет Rm/2πα, откуда Rm=2πα rm.
В большинстве типов нейронов Rm определяется главным образом К+— è Cl–-проводимостями мембраны в покое. Среднее значение Rm, аксона омара составляет около 2000 Ом см2. Значения Rm, полученные на других объектах, варьировали в диапазоне от 1000 Ом см2 äî 50000 Îì ñì2 в зависимости от плотности ионных каналов.
Удельным сопротивлением аксоплазмы Ri считают внутреннее продольное сопротивление сегмента аксона длиной 1 см и площадью сече- ния 1 см2.
Поскольку с увеличением площади сечения цилиндра его продольное сопротивление уменьшается, то ri = Ri/πα2, откуда Ri = πα2ri.
Величина Ri измеряется в Ом см, и ее значение для аксона кальмара составляет около 30 Ом см. Ri обратно зависит от концентрации ионов в аксоплазме. У животных с более низкой ионной концентрацией в аксонах Ri составляет около 125 Ом см (у млекопитающих) и около 250 Ом см (у земноводных).
6.7.1.4. Влияние диаметра кабеля на его характеристики
На основе уравнений, приведенных выше, можно определить входное сопротивление волокна как:
rinput = 1/2( RmRi /2π2α3)1/2
Следовательно, входное сопротивление волокна снижается как 3/2 степень его радиуса.
155
Так же постоянная длины волокна λ определяется соотношением его поперечных и продольных удельных сопротивлений (Rm è Ri) и его радиусом α:
λ = (αRm/2Ri)1/2
Таким образом, λ возрастает с увеличением радиуса. Измеряя сопротивления и радиусы разных волокон, можно сопоставить их кабельные свойства. Так, значения постоянной длины волокна аксона кальмара (диаметром до 1 мм), мышечного волокна лягушки (диаметром 50 мкм) и нервного волокна млекопитающих (диаметром 1 мкм) составляли, соответственно, 13, 1,4 и 0,3 мм.
Итак, кабельные свойства проводника rinput и λ определяют амплитуду сигнала, генерируемого нервным волокном, и его декремент с расстоянием. Например, при равных условиях синаптического воздействия величи-
на ВПСП в тонком дендрите (с более высоким rinput) будет больше, чем в толстом. С другой стороны, в толстом дендрите из-за большего значения λ
потенциал будет меньше затухать с расстоянием, чем в тонком.
6.7.1.5. Постоянная времени
Мембрана обладает свойством емкости, накапливая заряд на своей внешней и внутренней поверхности. Как у конденсатора, два слоя жидкости по обе стороны мембраны являются обкладками, а сама мембрана представляет собой изолирующую прослойку. При толщине мембраны 5 нм она способна накапливать достаточно большой заряд. Обычно емкость мембраны нервных клеток составляет 1 мкФ/см2. Емкость мембраны приводит к тому, что фаза роста амплитуды потенциала, возникающего на мембране в результате приложения к ней тока, развивается по экспоненте в соответствии с уравнением:
Vt = V0(1-e-t/τ),
ãäå t — время от начала импульса, Vt — амплитуда потенциала в момент времени t, V0 — максимальная амплитуда потенциала, τ — постоянная времени, равная произведению удельного сопротивления и удельной емкости мембраны (RmCm). Постоянная времени отражает время, за которое потенциал достигает 63% (1–1/е) от максимального значения амплитуды. Спад потенциала после выключения также происходит по экспоненте с той же постоянной времени.
Постоянная времени мембраны не зависит от размера клетки или волокна. Увеличение радиуса (и площади поверхности мембраны) приводит не только к увеличению удельной емкости, но и к
156
снижению удельного сопротивления мембраны. При такой обратной зависимости этих параметров от размера волокна τ, как их произведение, (RmCm) не меняется. Постоянная времени, наряду с входным сопротивлением и постоянной длины, является параметрам, от которого зависят свойства аксона как проводника. Диапазон значений постоянной времени в различных типах нервных и мышечных клеток составляет от 1 до 20 мс.
Емкость мембраны приводит к замедлению поляризации мембраны в результате действия на нее тока. Поскольку при параллельном соединении мембранных модулей их суммарная емкость увеличивается, то по мере удаления от места раздражения время заряда емкости также увеличивается. Поэтому чем дальше от места раздражения развивается потенциал, тем τ больше, и фазы роста и спада потенциалов замедляются.
Еще одно существенное влияние мембранной емкости на потенциалы заключается в том, что кратковременные токи, активирующие мембрану, распространяются на более короткие расстояния, чем длительные. В случае продолжительного сигнала потенциал достигает своего максимального значения и емкость заряжается полностью. В результате пространственное распределение потенциала определяется только сопротивлениями мембраны и цитоплазмы (Vx = V0e-x/λ). При действии коротких сигналов (например, синаптический потенциал) ток прекращается еще до того, как емкость успевает полностью зарядиться. Это выражается в уменьшении расстояния, на которое потенциал распространяется вдоль волокна.
6.7.2. Влияние кабельных свойств на возбудимость нейронов
Кабельные свойства нейронов и их отростков во многом предопределяют их реакции на синаптические воздействия. Величина порогового тока у разных нейронов варьирует в широком диапазоне — 10-7–10-10 А. Оказалось, что величина порогового тока обратно зависит от входного сопротивления мембраны нейрона. Зависимость порогового тока от сопротивления описывается гиперболой (рис. 6.16), из чего следует, что пороговый ток определяется входным сопротивлением, а пороговый потенциал является постоянным для электровозбудимых мембраны нейронов. Таким образом, эффективность синапсов, вызывающих токи в мембранах, зависит от входного сопротивления дендрита.
Входное сопротивление волокна увеличивается с уменьшением его радиуса, что было подтверждено специальными измерениями (рис. 6.17).
157
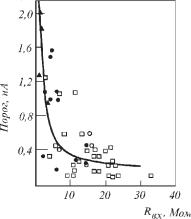
Из этого следует, что более тонкие дистальные дендриты обладают большим входным сопротивлением и, соответственно, меньшие токи могут сдвигать мембранный потенциал к пороговому уровню генерации ПД. Поэтому эффективность синапсов, активирующих дистальные дендриты, может значительно превышать эффективность синапсов на близких к соме дендритах. Из этого также следует важный вывод о том, что синаптические влияния на мелкие нейроны больше, чем на крупные.
Ðèñ. 6.16. График зависимости порога возбуждения мембран нейронов моторной коры кошки от входного сопротивления. Экспериментальные точки аппроксимированы методом наименьших квадратов.
6.7.3. Проведение потенциалов по сложным нейронным отросткам
Самой простой моделью нейрона является гипотетический сфери- ческий нейрон, который представлен множеством параллельно соединенных RC-элементов (рис. 6.18). Все участки в такой модели включе- ны параллельно, поскольку сопротивление цитоплазмы и внешней среды пренебрежимо мало по сравнению с сопротивлением мембраны. Принимая во внимание такое упрощение, эквивалентная электрическая схема сферического нейрона совпадает со схемой единичного элемента мембраны. При стимуляции такого простого RC-элемента по-
тенциал на мембране будет изменяться по экспоненте с постоянной времени τ = RC.
158

Ðèñ. 6.17. Входные сопротивления в теле и дендритах мотонейрона кошки. Числа указывают входное сопротивление (мОм) при удельном сопротивлении мембраны 50 Ом см.
Ðèñ. 6.18. Эквивалентная электрическая схема элемента мембраны (А) и сферического нейрона. Ñ — емкость мембраны, R — сопротивление мембраны, R’ — сопротивление протоплазмы R’’ — сопротивление наружной среды, Ì — мембрана. У шаровидной клетки R’ è R’’ << R.
159
From Wikipedia, the free encyclopedia
In neurobiology, the length constant (λ) is a mathematical constant used to quantify the distance that a graded electric potential will travel along a neurite via passive electrical conduction. The greater the value of the length constant, the farther the potential will travel. A large length constant can contribute to spatial summation—the electrical addition of one potential with potentials from adjacent areas of the cell.
The length constant can be defined as:
where rm is the membrane resistance (the force that impedes the flow of electric current from the outside of the membrane to the inside, and vice versa), ri is the axial resistance (the force that impedes current flow through the axoplasm, parallel to the membrane), and ro is the extracellular resistance (the force that impedes current flow through the extracellular fluid, parallel to the membrane).[1] In calculation, the effects of ro are negligible,[1] so the equation is typically expressed as:
The membrane resistance is a function of the number of open ion channels, and the axial resistance is generally a function of the diameter of the axon. The greater the number of open channels, the lower the rm. The greater the diameter of the axon, the lower the ri.
The length constant is used to describe the rise of potential difference across the membrane
The fall of voltage can be expressed as:
Where voltage, V, is measured in millivolts, x is distance from the start of the potential (in millimeters), and λ is the length constant (in millimeters).
Vmax is defined as the maximum voltage attained in the action potential, where:
where rm is the resistance across the membrane and I is the current flow.
Setting for x = λ for the rise of voltage sets V(x) equal to .63 Vmax. This means that the length constant is the distance at which 63% of Vmax has been reached during the rise of voltage.
Setting for x = λ for the fall of voltage sets V(x) equal to .37 Vmax, meaning that the length constant is the distance at which 37% of Vmax has been reached during the fall of voltage.
By resistivity[edit]
Expressed with resistivity rather than resistance, the constant λ is (with negligible ro):[2]
Where 
The radius and number 2 come from these equations:
Expressed in this way, it can be seen that the length constant increases with increasing radius of the neuron.
See also[edit]
- Isopotential muscle
- Time constant
References[edit]
- ^ a b Meffin, Hamish; Kameneva, Tatiana (2011-04-01). «The electrotonic length constant: A theoretical estimate for neuroprosthetic electrical stimulation». Biomedical Signal Processing and Control. 6 (2): 105–111. doi:10.1016/j.bspc.2010.09.005. ISSN 1746-8094 – via ScienceDirect.
- ^ Page 202 in: Walter F., PhD. Boron (2003). Medical Physiology: A Cellular And Molecular Approach. Elsevier/Saunders. p. 1300. ISBN 1-4160-2328-3.
Длинная проекция на нейрон, который отводит сигналы
| Аксон | |
|---|---|
 Аксон многополярного нейрона Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология [редактировать в Викиданных ] |
аксон (от греческого ἄξων áxōn, ось) или нервное волокно (или нерв волокно : см. орфографические различия ), представляет собой длинный тонкий выступ нервной клетки или нейрона у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия, от тела нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В некоторых сенсорных нейронах (псевдоуниполярных нейронах ), таких как нейроны прикосновения и тепла, аксоны называются афферентными нервными волокнами, и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу вдоль другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицируются на три типа — нервные волокна группы A, нервные волокна группы B и нервные волокна группы C. Группы A и B являются миелинизированными, а группа C немиелинизированными. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматических выступов из тела клетки нейрона; другой тип — дендрит . Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны. Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.
Аксоны покрыты мембраной, известной как аксолемма ; цитоплазма аксона называется аксоплазмой. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендриями. Набухший конец телодендрона известен как окончание аксона, которое соединяется с дендроном или телом клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсами. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к аутапсу. В синапсе мембрана аксона плотно прилегает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются по всей длине аксона по мере его расширения — они называются проходящими («проходящими») синапсами и могут быть сотнями или даже тысячами вдоль одного аксона. Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Один аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерировать тысячи синаптических окончаний. Пучок аксонов образует нервный тракт в центральной нервной системе и пучок в периферической нервной системе. У плацентарных млекопитающих самым большим белым веществом трактом в головном мозге является мозолистое тело, образованное примерно из 200 миллионов аксонов в человеческом мозге.
Содержание
- 1 Анатомия
- 1.1 Аксональная область
- 1.1.1 Аксональный бугор
- 1.1.2 Начальный сегмент
- 1.2 Аксональный транспорт
- 1.3 Миелинизация
- 1.4 Узлы Ранвье
- 1.5 Терминалы аксонов
- 1.1 Аксональная область
- 2 Потенциалы действия
- 3 Развитие и рост
- 3.1 Развитие
- 3.1.1 Внеклеточная передача сигналов
- 3.1.2 Внутриклеточная передача сигналов
- 3.1.3 Динамика цитоскелета
- 3.2 Рост
- 3.3 Регулирование длины
- 3.1 Развитие
- 4 Классификация
- 4.1 Двигательная
- 4.2 Сенсорная
- 4.3 Вегетативная
- 5 Клиническая значимость
- 6 Анамнез
- 7 Другие животные
- 8 См. Также
- 9 Ссылки
- 10 Внешние ссылки
Анатомия


Аксоны являются основными линии передачи нервной системы, и в виде пучков они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — это аксоны седалищного нерва, которые проходят от основания спинного мозга до большого пальца каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов имеют микроскопический диаметр (обычно около одного микрометра (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. Гигантский аксон кальмара, который специализируется на очень быстрой передаче сигналов, имеет диаметр, близкий к 1 миллиметру, то есть размер небольшого грифеля карандаша. Количество аксональных телодендрий (разветвляющихся структур на конце аксона) также может различаться от одного нервного волокна к другому. Аксоны в центральной нервной системе (ЦНС) обычно показывают множественные телодендрии с множеством синаптических конечных точек. Для сравнения, аксон гранулярных клеток мозжечка характеризуется одним Т-образным узлом ответвления, от которого отходят два параллельных волокна. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
В нервной системе есть два типа аксонов: миелинизированные и немиелинизированные аксоны. Миелин представляет собой слой жирового изолирующего вещества, которое образовано двумя типами глиальных клеток шванновских клеток и олигодендроцитов. В периферической нервной системе шванновские клетки образуют миелиновую оболочку миелинизированного аксона. В центральной нервной системе олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон через равные промежутки времени возникают промежутки в миелиновой оболочке, известные как узлы Ранвье. Миелинизация обеспечивает особенно быстрый режим распространения электрического импульса, называемый скачкообразной проводимостью.
Миелинизированные аксоны от кортикальных нейронов образуют основную часть нервной ткани, называемую белым веществом в мозг. Миелин придает белый цвет ткани в отличие от серого вещества коры головного мозга, которое содержит тела нейрональных клеток. Подобное расположение наблюдается в мозжечке. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссурами. Самым крупным из них является мозолистое тело, которое соединяет два полушария головного мозга, и у него около 20 миллионов аксонов.
Структура нейрона, как видно, состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона и терминалы аксона. Он также включает миелиновую оболочку. тельца Ниссля, которые продуцируют нейрональные белки, отсутствуют в аксональной области. Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочек и промежуточных филаментов, известных как нейрофиламентов.
Аксональный холмик

бугорок аксона — это область, образованная из тела клетки нейрона, которая расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые суммируются в нейроне, передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
начальный сегмент аксона (AIS) представляет собой структурно и функционально отдельный микродомен аксона. Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать. Обе эти функции поддерживают нейрон клеточную полярность, в которой дендриты (и в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области — аксон нейрона обеспечивает выходные сигналы.
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия. Как положение на аксоне, так и длина AIS могут меняться, показывая степень пластичности, которая может точно настраивать нейрональный выход. Более длинный AIS связан с большей возбудимостью. Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.
AIS очень специализирован для быстрого проведения нервных импульсов. Это достигается за счет высокой концентрации потенциал-управляемых натриевых каналов в начальном сегменте, где возникает потенциал действия. Ионные каналы сопровождаются большим количеством молекул клеточной адгезии и каркасных белков, которые прикрепляют их к цитоскелету. Взаимодействие с анкирином G важно, поскольку он является основным организатором в AIS.
Аксональный транспорт
аксоплазма эквивалентна цитоплазма в ячейке. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона. Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки. Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламентов, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки. Исходящие и входящие треки используют разные наборы моторных белков. Исходящий транспорт обеспечивается kinesin, а входящий обратный трафик обеспечивается dynein. Динеин направлен на минус-конец. Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз. Исследования транспорта в аксоне привели к названию кинезина.
Миелинизация


В нервной системе аксоны могут быть миелинизированы, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким отношением липидов к белку.
В аксоны периферической нервной системы миелинизируются глиальные клетки, известные как клетки Шванна. В центральной нервной системе миелиновая оболочка представлена другим типом глиальных клеток, олигодендроцитом. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.
Состав миелина этих двух типов различается. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС — основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известные как миелиновая оболочка промежутки) представляют собой короткие немиелинизированные сегменты миелинизированного аксона, которые периодически встречаются между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре. Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразной проводимости электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы аксона
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрона находится окончание аксона (также называемое синаптическим бутоном или терминальным бутоном). Терминалы аксонов содержат синаптические пузырьки, в которых хранится нейромедиатор для высвобождения в синапсе. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда это известно как аутапс.
Потенциалы действия
| Структура типичного химического синапса |
|---|
 Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит Постсинаптическая. плотность Напряжение -. закрытый Ca. канал Синаптический. везикула Нейротрансмиттер. транспортер Рецептор Нейротрансмиттер Аксонный терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалов действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчиваясь в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Результирующее увеличение внутриклеточной концентрации кальция приводит к тому, что синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные химическим веществом нейромедиатор, сливаются с мембраной аксона и выводят их содержимое во внеклеточное пространство.. Нейромедиатор высвобождается из пресинаптического нерва посредством экзоцитоза. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или изменении ее метаболизма каким-либо образом. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.

Внеклеточные записи распространения потенциала действия в аксонах были продемонстрированы у свободно движущихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно движущихся животных, таких как клетки места, аксональная активность как в белом, так и в сером веществе также может быть записано. Внеклеточные записи распространения потенциала действия аксонов отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую длительность спада пика (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.
Фактически, генерация потенциалов действия в vivo является последовательным по своей природе, и эти последовательные всплески составляют цифровые коды в нейронах. Хотя предыдущие исследования указывают на аксональное происхождение одного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.
Помимо распространения потенциалов действия на аксоны. терминалов, аксон способен усиливать потенциалы действия, что обеспечивает безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, потенциал-управляемые натриевые каналы в аксонах обладают более низким порогом и более коротким рефрактерным периодом в ответ на кратковременные импульсы.
Развитие и рост
Развитие
Развитие аксона до его мишени — одна из шести основных стадий в общем развитии нервной системы. Исследования, проведенные на культивируемых нейронах гиппокампа, предполагают, что нейроны изначально продуцируют несколько нейритов, которые эквивалентны, но только одному из этих нейритов суждено стать аксоном. Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот, хотя недавние данные указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. Послетого, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, все остальные нейриты, включая исходный аксон, превратятся в дендриты. Наложение внешней силы на нейрит, заставляющее его удлиняться, превращает его в аксон. Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелетной динамикой.
Внеклеточная передача сигналов
Внеклеточные сигналы, которые распространяются через внеклеточный матрикс, окружающие нейроны, играют важную роль в развитии аксонов. Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6), секретируемый белок, участвует в образовании аксонов. Когда рецептор нетрина UNC-5 мутируется, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон вытягивается вперед. Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов. и связываются с рецепторами Трк.
. ганглиозид -превращающий фермент ганглиозид плазматической мембраны алидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.
Внутриклеточная передача сигналов
Во время развития аксонов активности PI3K увеличивается в кончик предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к производству фосфатидилинозитол (3,4,5) -трисфосфата (PtdIns), который может вызвать значительное удлинение нейрита, превращая его в аксон. Таким образом, сверхэкспрессия фосфатаз, вызывающих нарушение поляризации, приводит к нарушению поляризации.
Цитоскелетная динамика
Нейрит с самым низким актиновым филаментом контент станет аксоном. Концентрация PGMS и содержание f-актина обратно коррелированы; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина снижается. Кроме того, воздействие лекарств, деполимеризующих актин, и токсина B (который инактивирует сигналы передачи Rho ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет производить ее нейрита в аксон.
Рост

Растущие аксоны проходят через их окружение через конус роста , который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиумом, содержит выступы, называемые филоподиями. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует нашу среду. Актин играет важную роль в подвижности этой системы. Среда с высоким уровнем молекулы клеточной адгезии (CAM) идеальная среда для роста аксонов. Похоже, это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают N-CAM, TAG-1 — аксональный гликопротеин — и MAG, все из которых являются частью суперсемейства иммуноглобулинов. Другой набор молекул, называемый внеклеточный матрикс — молекулы адгезии, также обеспечивает липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь длительного длительного действия.
Клетки, называемые направляющими клетками, дают в первую ростом аксонов нейронов. Эти клетки, которые обеспечивают наведению аксонов, обычно представляют собой другие нейроны, иногда являющиеся незрелыми. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до раз, в зависимости от требуемой скорости проводимости.
Он также имеет исследованиям было обнаружено, что если аксоны нейрона были повреждены, пока сома (тело клетки нейрона ) не повреждена, аксоны будут регенерировать и воссоздавать синаптические связи с нейронами с помощью ячеек указателя. Это также называется нейрорегенерацией.
Nogo-A — это тип компонента, ингибирующего отрастание нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов центральной нервной системы взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях. Недавнее исследование также показало, что макрофаги, активируемые специфическим воспалительным процессом, активируемым рецептором дектина-1, способным восстановлением аксонов, однако также вызывают нейротоксичность в нейроне.
Регулировка длины
Аксоны в степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что аксонует механизм регулирования длины клетки, позволяющий нейронам ощущать длину своихонов и соответственно должен контролировать их рост. Было обнаружено, что играет важную роль в регулировании длины аксонов. Основываясь на этом наблюдении, исследователи разработали модель роста аксонов, описывающую, как моторные белки, увеличивающие длину аксона на молекулярном уровне. Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, колеблется во времени с параметрами, зависящей от длины.
Классификация
Аксоны нейронов задней части периферической системы можно классифицировать на основе их физических характеристик и свойств проводимости сигнала. Известно, что эти аксоны имеют разную толщину (от 0,1 до 20 мкм), считалось, что эти аксоны связаны со скоростью, определяющей потенциал действия может перемещаться по аксону — скорость его проводимости. Эрлангер и Гассер подтвердили эти гипотезу и идентифицировали несколько типов волокон, установив связь между аксона и его скоростью проводимости нерва. Они опубликовали свои открытия в 1941 году, дав первую класси установкуонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна три основных, используя буквы A, B и C. Эти группы: группа A, группа B и группа C включает как сенсорные волокна (афференты ), так и моторные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторными нейронами различных моторных волокон были нижние мотонейроны — альфа-мотонейрон, бета-мотонейрон и гамма-мотонейрон <55.>Имеющий нервные волокна Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, включающую только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние мотонейроны имеют два типа волокон:
Типы моторных волокон
| Тип | Эрлангер-Гассер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Связанные мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | Да | 80–120 | Экстрафузальные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | Да | 4–24 | Внутрифузальные мышечные волокна |
Сенсорные
Различные сенсорные рецепторы иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторами сенсорными волокнами типа II и III и ноцицепторами и терморецепторами сенсорными волокнами III и IV типа.
Типы сенсорных волокон
| Тип | Эрлангер-Газсер. Классификация | Диаметр. (мкм) | Миелин | Проводимость. скорость (м / с) | Ассоциированные сенсорные рецепторы | Проприорецепторы | Механоцепторы | Ноцицепторы и. терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | Да | 80–120 | Первичные рецепторы мышечного веретена (кольцевидное окончание) | ✔ | ||
| Иб | Aα | 13-20 | Да | 80–120 | Сухожильный орган Гольджи | |||
| II | Aβ | 6-12 | Да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей).. Все кожные механорецепторы | ✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давление. Ноцицепторы бокового спиноталамического тракта. Холодные терморецепторы | ✔ | ||
| IV | C | 0,2- 1,5 | No | 0,5-2,0 | Ноцицепторы переднего спинного мозга. Тепловые рецепторы |
вегетативные
вегетативная нервная система имеет два вида периферического волокна s:
Типы волокна
| Тип | Erlanger-Gasser. Классификация | Диаметр. (мкм) | Myelin | Проводимость. скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | Да | 3–15 |
| постганглионарные волокна | C | 0,2–1,5 | No | 0,5–2, 0 |
Клиническая значимость
По степени тяжести повреждение нерва может быть описана как нейропраксия, аксонотмезис или невротмезис. Сотрясение мозга считается легкой формой диффузного повреждения аксонов. Поражение аксонов также может вызывать центральный хроматолиз. Дисфункция аксонов в нервной системе является одной из причин многих наследственных неврологических расстройств, которые поражают периферические, так и центральные нейроны.
Когда аксон разрушается, активный процесс дегенерация аксона происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как валлеровское вырождение. Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, известно как дегенерация, подобная валлеровской. Исследования показывают, что аксональный белок NMNAT2 не может достичь всего аксона.
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация — это аномальное образование миелиновой оболочки. Это связано с использованием лейкодистрофиями, а также с шизофренией.
Тяжелая черепно-мозговая травма может привести к обширным пораженным нервным путям, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к устойчивому вегетативному состоянию. В исследованиих на крысе было показано, что повреждение аксонов в результате повреждения однократной черепно-мозговой травмы может привести к дальнейшему повреждению после повторных легких черепно-мозговых травм.
A канал для направления нервов является искусственным средством управления ростом аксонов для обеспечения нейрорегенерации и одним из многих методов лечения, используется для травм нерва.
История
Немецкий анатом Отто Фридриху Карлу Дейтерсу обычно приписывают открытие аксона, отличив его от дендритов. Швейцарский Рюдольф Альберт фон Келликер и немец Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Кёлликер назвал аксон в 1896 году. Луи-Антуан Ранвье был первым, кто описал промежутки или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлами Ранвье. Сантьяго Рамон-и-Кахал, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции. Джозеф Эрлангер и Герберт Гассер ранее разработали классификацию система для периферических нервных волокон, основанная на скорости аксональной проводимости, миелинизации, размере волокон и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциала действия, что привело к формулировке модели Ходжкина-Хаксли. Ходжкин и Хаксли были совместно удостоены Нобелевской премии за эту работу в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхейзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает множество деталей об отдельных ионных каналах.
других животных
Аксоны у беспозвоночных были тщательно изучены. прибрежный кальмар, часто используемый в качестве модельного организма, имеет самый длинный из известных аксонов. гигантский кальмар имеет самый большой известный аксон. Его размер составляет от половины (обычно) до одного миллиметра в диаметре, и он используется для управления его системой реактивного движения. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических креветок Penaeid, а обычный диапазон составляет от 90 до 200 м / с (cf 100– 120 м / с для самого быстрого аксона миелинизированных позвоночных.)
В других случаях, как видно из исследований на крысах, аксон происходит из дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона. У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны. Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы расширенным бугорком аксона.
См. Также
- Электрофизиология
- Ганглиозное возвышение
- Гигантская аксональная нейропатия
- Нейронное отслеживание
- Пионерный аксон
Ссылки
Внешние ссылки
- Изображение гистологии: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг »
Нервная система состоит из нейронов (специфических клеток, имеющих отростки) и нейроглии (она заполняет пространство между нервными клетками в ЦНС). Главное отличие между ними заключается в направлении передачи нервного импульса. Дендриты – это принимающие ответвления, по ним сигнал идет к телу нейрона. Передающие клетки – аксоны – проводят сигнал от сомы к принимающим. Это могут быть не только отростки нейрона, но и мышцы.
Отличия аксонов и дендритов
Какова же разница между ними? Рассмотрим.
- Дендрит нейрона короче передающего отростка.
- Аксон всего один, принимающих ответвлений может быть много.
- Дендриты сильно ветвятся, а передающие отростки начинают разделяться ближе к концу, образуя синапс.
- Дендриты истончаются по мере удаления от тела нейрона, толщина аксонов практически неизменна по всей длине.
- Аксоны покрыты миелиновой оболочкой, состоящей из липидных и белковых клеток. Она выполняет роль изолятора и защищает отросток.
Поскольку нервный сигнал передается в виде электрического импульса, клеткам необходима изоляция. Её функции выполняет миелиновая оболочка. Она имеет мельчайшие разрывы, способствующие более быстрой передаче сигнала. Дендриты – это безоболочечные отростки.
Определение
Мозговое вещество – высокоорганизованная структура, образованная нервными клетками, от которых отходят аксоны. Из нервных клеток состоит мозговая ткань. Аксон в переводе с греческого означает «ось» – это такой отросток, элемент мозгового вещества, который обеспечивает взаимодействие между клетками разного типа (нейроны, клетки иннервируемых органов), что ассоциируется с тонким, четким управлением работой органов и систем. Функции ткани ЦНС:
- Воспринимает раздражения, преобразуя их в импульсы.
- Поддерживает передачу импульсов от управляющих отделов мозга к исполнительным органам.
- Формирует ответную реакцию на раздражающее воздействие.
- Обеспечивает взаимодействие в работе систем и органов, поддерживает интеграцию структурных единиц организма.
- Обеспечивает взаимосвязь организма с внешней средой.
Согласно определению в биологии, аксон (англ. axon) – удлиненный отросток, по которому идут импульсы от тела нейрона к другим нервным клеткам и структурным элементам всех тканей организма. Мозговая ткань в период внутриутробного развития образуется из нервной пластины. Края пластинки прогибаются, что приводит к формированию валиков и желобка. В результате смыкания краев валиков возникает нервная трубка – основа ЦНС.
Дифференциация клеток, образующих трубку, приводит к появлению нейробластов и спонгиобластов. Первые служат основой для формирования нейронов, вторые – для образования нейроглии. Нейроны (анат.) – основные структурные элементы мозгового вещества. Они характеризуются отсутствием функции деления, что приводит к постепенному уменьшению их численности. Тело нейрона состоит из ядра и цитоплазмы. В зависимости от типа нейронов меняется геометрическая форма тела, которая бывает круглая, овальная, пирамидальная и другая.
Цитоскелет, состоящий из микротрубочек и нейрофибриллов, обеспечивает опорную и трофическую функцию. Цитоскелет поддерживает форму нейрона, обеспечивает транспорт веществ и органелл. От тела ответвляются отростки – единичный аксон и множественные дендриты. Аксон нейрона почти не ветвится, иногда образует коллатеральные (обходные) сегменты. Концевые сегменты (окончания) разветвляются, называются терминали.
Терминали взаимосвязаны с окончаниями других нейронов и с клетками, образующими паренхиму (ткань) рабочих органов – мышц, желез. Количество дендритов варьируется от 1 до нескольких. Тонкие ответвления дендритов оканчиваются небольшими шипами, где сосредоточены терминали аксональных отростков многих тысяч других клеток. Дендриты воспринимают раздражения или потенциалы действия от других клеток и передают их по волокнам к телу своего нейрона.
Рост аксона зависит от особенностей строения и жизнедеятельности нейрона, который поддерживает функцию питания отростка. К примеру, если перерезать аксональный ствол, сегмент, связанный с телом, остается жизнеспособным и продолжает деятельность, участок, утративший связь с телом, отмирает. Аксоны образуют нервы, что предполагает сложную структурно-морфологическую организацию ЦНС.
Синапс
Место, в котором происходит контакт между ответвлениями нейронов или между аксоном и принимающей клеткой (например, мышечной), называется синапсом. В нем может участвовать всего по одному ответвлению от каждой клетки, но чаще всего контакт происходит между несколькими отростками. Каждый вырост аксона может контактировать с отдельным дендритом.
Сигнал в синапсе может передаваться двумя способами:
- Электрическим. Это происходит только в случае, когда ширина синаптической щели не превышает 2 нм. Благодаря такому маленькому разрыву импульс проходит через него, не задерживаясь.
- Химическим. Аксоны и дендриты вступают в контакт благодаря разнице потенциалов в мембране передающего отростка. С одной ее стороны частицы имеют положительный заряд, с другой – отрицательный. Это обусловлено разной концентрацией ионов калия и натрия. Первые находятся внутри мембраны, вторые – снаружи.
При прохождении заряда увеличивается проницаемость мембраны, и натрий входит в аксон, а калий выходит из него, восстанавливая потенциал.
Сразу после контакта отросток становится невосприимчивым к сигналам, через 1 мс способен к передаче сильных импульсов, через 10 мс возвращается в исходное состояние.
Дендриты – это принимающая сторона, передающая импульс от аксона телу нервной клетки.
Особенности, характерные для типичных дендритов и аксонов
⇐ ПредыдущаяСтр 3 из 14Следующая ⇒
| Дендриты | Аксоны |
| От тела нейрона отходит несколько дендритов | У нейрона имеется только один аксон |
| Длина редко превышает 700 мкм | Длина может достигать 1 м |
| По мере удаления от тела клетки диаметр быстро уменьшается | Диаметр сохраняется на значительном расстоянии |
| Образовавшиеся в результате деления ветви локализуются возле тела | Терминали располагаются далеко от тела клетки |
| Имеются шипики | Шипики отсутствуют |
| Не содержат синаптических пузырьков | Содержат в большом числе синаптические пузырьки |
| Содержат рибосомы | Рибосомы могут обнаруживаться в незначительном числе |
| Лишены миелиновой оболочки | Часто окружены миелиновой оболочкой |
Терминали дендритов чувствительных нейронов образуют чувствительные окончания. Основной функцией дендритов является получение информации от других нейронов. Дендриты проводят информацию к телу клетки, а затем к аксонному холмику.
Аксон. Аксоны образуют нервные волокна, по которым передается информация от нейрона к нейрону или к эффекторному органу. Совокупность аксонов образует нервы.
Общепринято подразделение аксонов на три категории: А, В и С. Волокна группы А и В являются миелинизированными, а С – лишены миелиновой оболочки. Диаметр волокон группы А, которые составляют большинство коммуникаций центральной нервной системы, варьирует от 1 до 16 мкм, а скорость проведения импульсов равна их диаметру, умноженному на 6. Волокна типа А подразделяются на Аa, Аb, Аl, Аs. Волокна Аb, Аl, Аs имеют меньший диаметр, чем волокна Аa, меньшую скорость проведения и более длительный потенциал действия. Волокна Аb и Аs являются преимущественно чувствительными волокнами, которые проводят возбуждение от различных рецепторов в ЦНС. Волокна Аl – это волокна, которые проводят возбуждение от клеток спинного мозга к интрафузальным мышечным волокнам. В-волокна являются характерными для преганглионарных аксонов вегетативной нервной системы. Скорость проведения 3-18 м/с, диаметр 1-3 мкм, продолжительность потенциала действия 1-2 мс, нет фазы следовой деполяризации, а есть длительная фаза гиперполяризации (более 100 мс). Диаметр С-волокон от 0,3 до 1,3 мкм, и скорость проведения импульсов в них несколько меньше величины диаметра, умноженного на 2, и равняется 0,5-3 м/с. Длительность потенциала действия этих волокон составляет 2 мс, отрицательный следовой потенциал равняется 50-80 мс, а положительный следовой потенциал – 300-1000 мс. Большинство С-волокон являются постганглионарными волокнами вегетативной нервной системы. В миелинизированных аксонах скорость проведения импульсов выше, чем в немиелизированных.
Аксон содержит аксоплазму. У крупных нервных клеток ей принадлежит около 99% всей цитоплазмы нейрона. Цитоплазма аксонов содержит микротрубочки, нейрофиламенты, митохондрии, агранулярный эндоплазматический ретикулум, везикулы и мультивезикулярные тела. В разных частях аксона существенно меняются количественные отношения между этими элементами.
У аксонов, как миелинизированных, так и немиелизированных, есть оболочка – аксолемма.
В зоне синаптического контакта мембрана получает ряд дополнительных цитоплазматических соединений: плотные выступы, ленты, субсинаптическая сеть и др.
Начальный участок аксона (от его начала до того места, где наступает сужение до диаметра аксона) носит название аксонного холмика. От этого места и появления миелиновой оболочки простирается начальный сегмент аксона. В немиелинизированных волокнах эта часть волокна определяется с трудом, а некоторые авторы считают, что начальный сегмент присущ только тем аксонам, которые покрыты миелиновой оболочкой. Он отсутствует, например, у клеток Пуркинье в мозжечке.
В месте перехода аксонного холмика в начальный сегмент аксона под аксолеммой появляется характерный электронноплотный слой, состоящий из гранул и фибрилл, толщиной 15 нм. Этот слой не связан с плазматической мембраной, а отделен от нее промежутками до 8 нм.
В начальном сегменте по сравнению с телом клетки резко уменьшается количество рибосом. Остальные компоненты цитоплазмы начального сегмента – нейрофиламенты, митохондрии, везикулы – переходят из аксонного холмика сюда, не изменяясь ни по внешнему виду, ни по взаиморасположению. На начальном сегменте аксона описаны аксо-аксональные синапсы.
Часть аксона, покрытая миелиновой оболочкой, обладает только ей присущими функциональными свойствами, которые связаны с проведением нервных импульсов с большой скоростью и без декремента (затухания) на значительные расстояния. Миелин является продуктом жизнедеятельности нейроглии. Проксимальной границей у миелинизированного аксона служит начало миелиновой оболочки, а дистальной – утрата ее. Далее следуют более или менее длинные терминальные отделы аксона. В этой части аксона отсутствует гранулярный эндоплазматический ретикулум и очень редко встречаются рибосомы. Как в центральных отделах нервной системы, так и на периферии аксоны окружены отростками глиальных клеток.
Миелинизированная оболочка имеет сложное строение. Ее толщина варьирует от долей до 10 мкм и более. Каждая из концентрически расположенных пластинок состоит из двух наружных плотных слоев, образующих главную плотную линию, и двух светлых бимолекулярных слоев липидов, разделенных промежуточной осмиофильной линией. Промежуточная линия аксонов периферической нервной системы представляет собой соединение наружных поверхностей плазматических мембран шванновской клетки. Каждый аксон сопровождается большим числом шванновских клеток. Место, где шванновские клетки граничат между собой, лишено миелина и называется перехватом Ранвье. Между длиной межперехватного участка и скоростью проведения нервных импульсов есть прямая зависимость.
Перехваты Ранвье составляют сложную структуру миелинизированных волокон и играют важную функциональную роль в проведении нервного возбуждения.
Протяженность перехвата Ранвье миелинизированных аксонов периферических нервов находится в пределах 0,4-0,8 мкм, в центральной нервной системе перехват Ранвье достигает 14 мкм. Длина перехватов довольно легко изменяется под действием различных веществ. В области перехватов, помимо отсутствия миелиновой оболочки, наблюдаются значительные изменения структуры нервного волокна. Диаметр крупных аксонов, например, уменьшается наполовину, мелкие аксоны изменяются меньше. Аксолемма имеет обычно неправильные контуры, и под ней лежит слой электронноплотного вещества. В перехвате Ранвье могут быть синаптические контакты как с прилежащими к аксону дендритами (аксо-дендритические), так и с другими аксонами.
Коллатерали аксонов. С помощью коллатералей происходит распространение нервных импульсов на большее или меньшее число последующих нейронов.
Аксоны могут делиться дихотомически, как, например, у зернистых клеток мозжечка. Очень часто встречается магистральный тип ветвления аксонов (пирамидные клетки коры мозга, корзинчатые клетки мозжечка). Коллатерали пирамидных нейронов могут быть возвратными, косоидущими и горизонтальными. Горизонтальные ответвления пирамид простираются иногда на 1-2 мм, объединяя пирамидные и звездчатые нейроны своего слоя. От горизонтально распространяющегося (в поперечном направлении к длинной оси извилины мозга) аксона корзинчатой клетки образуются многочисленные коллатерали, которые заканчиваются сплетениями на телах крупных пирамидных клеток. Подобные аппараты, так же как и окончания на клетках Реншоу в спинном мозге, являются субстратом для осуществления процессов торможения.
Коллатерали аксонов могут служить источником образования замкнутых нейронных цепей. Так, в коре больших полушарий все пирамидные нейроны имеют коллатерали, которые принимают участие во внутрикорковых связях. За счет существования коллатералей обеспечивается в процессе ретроградной дегенерации сохранность нейрона в том случае, если повреждается основная ветвь его аксона.
Терминали аксонов. К терминалям относятся дистальные участки аксонов. Они лишены миелиновой оболочки. Протяженность терминалей значительно варьирует. На светооптическом уровне показано, что терминали могут быть либо одиночными и иметь форму булавы, сетевидной пластинки, колечка, либо множественными и походить на кисть, чашевидную, моховидную структуру. Размер всех этих образований изменяется от 0,5 до 5 мкм и более.
Тонкие разветвления аксонов в местах контакта с другими нервными элементами нередко имеют веретеновидные или бусинковидные расширения. Как показали электронно-микроскопические исследования, именно в этих участках имеются синаптические соединения. Одна и та же терминаль дает возможность одному аксону устанавливать контакт с множеством нейронов (например, параллельные волокна в коре головного мозга) (рис. 1.2).
Функции нервных волокон
Распространение возбуждения в нервных волокнах.Изменения мембранного потенциала, вызываемые электрическим током, подразделяются на пассивные и активные.
Пассивные, или электротонические, изменения мембранного потенциала определяются физическими (электрическими) параметрами как самой мембраны, так и всей клетки (волокна) в целом.
Пассивные сдвиги мембранного потенциала возникают при действии на возбудимые образования электрического тока любой силы, формы или направления. Однако если при гиперполяризующем (анодном) и слабом деполяризующем (катодном) токах пассивные изменения потенциала могут наблюдаться в чистом (неосложненном) виде, то при близких к порогу и сверхпороговых деполяризующих стимулах они сопровождаются активными сдвигами потенциала: локальным ответом и потенциалом действия, связанными с изменениями ионной проницаемости мембраны.
Пассивные свойства мембраны и всего волокна в целом в значительной мере определяют условия возникновения и распространения возбуждения в нервном волокне.
Исследования показывают, что в однородно поляризуемом, однородном участке нервного волокна изменения мембранного потенциала при приложении прямоугольного толчка гиперполяризующего или слабого деполяризующего тока нарастают по экспоненте:
,
где RC = τ
– постоянная времени мембраны, т.е. время, в течение которого потенциал нарастает до 63% от своей конечной величины. При выключении тока потенциал возвращается к исходному уровню по экспоненте с той же постоянной времени
τ
. Такие изменения мембранного потенциала принято называть пассивными или электротоническими, в отличие от активных, связанных с повышением или снижением ионных проводимостей мембраны.
Подобные изменения наблюдаются на сферических клетках (на соме). Описание цилиндрической клетки, в частности аксона, более сложно. В этом случае уже нельзя считать внутренний проводник эквипотенциальным по всей длине. Внешний проводник можно считать эквипотенциальным за счет увеличения объема внеклеточной жидкости. Потенциал на такой мембране зависит не только от времени включения тока, но и от расстояния х
по отношению к месту приложения тока:
,
где а
– радиус волокна,
R
– удельное сопротивление аксоплазмы,
CМ
и
RМ
– емкость и сопротивление на единицу площади мембраны. Левая часть уравнения описывает плотность тока через каждую точку мембраны, которая равна сумме плотностей емкостного ()и омического () токов, стоящих в правой части уравнения.
Через длительное время (намного большего постоянной времени t = RМ CМ
) после включения импульса емкость мембраны полностью зарядится и емкостный ток станет равным нулю. Уравнение примет вид:
.
Его решение:
,
где V0
– потенциал в начале кабеля (
х
= 0),
l
– постоянная длины волокна.
Постоянная длины характеризует крутизну затухания потенциала вдоль волокна. Чем больше l
, тем дальше по волокну проходит сигнал. Скорость электротонического распространения пропорциональна удвоенной величине константы длины волокна
l
и обратно пропорциональна постоянной времени
t = RМ CМ
. Величина
l
может быть выражена через сопротивление мембраны
RМ
, сопротивление внутренней среды – аксоплазмы
Ri
и диаметра волокна
d
:
.
Кабельные свойства нервных волокон оказывают существенное влияние не только на развитие электротонических потенциалов, но и на характер активных ответов – величину порога, амплитуду, крутизну нарастания и длительность потенциала действия.
В настоящее время можно считать строго доказанным, что проведение потенциала действия (ПД) вдоль нервного волокна осуществляется с помощью локальных токов, возникающих между возбужденным и покоящимся участками мембраны. Локальный ток изменяет величину мембранного потенциала покоя в покоящемся участке до критического уровня деполяризации, что и является причиной возникновения потенциала действия.
Многочисленными исследованиями было показано, что скорость проведения пропорциональна постоянной длины волокна l
и обратно пропорциональна постоянной времени мембраны
t
(Чайлохян Л.М., 1962). Поскольку в безмякотных нервных волокнах
l
пропорциональна квадратному корню из диаметра волокна
,
скорость проведения при прочих равных условиях также пропорциональна корню квадратному из диаметра волокна.
В миелинизированных нервных волокнах проведение происходит сальтаторно – от перехвата Ранвье к перехвату Ранвье. Длина межперехватного участка примерно пропорциональна диаметру волокна, поэтому скорость проведения в этих волокнах пропорциональна не корню квадратному из диаметра волокна, а просто его диаметру.
Принято считать, что скорость проведения зависит от величины так называемого фактора безопасности (гарантийности) Ф
, т.е. отношения амплитуды распространяющегося ПД к пороговому потенциалу. Пороговый потенциал – это та величина, на которую нужно изменить мембранный потенциал, чтобы достичь критического уровня деполяризации.
,
где Vs
– амплитуда ПД,
Vt
– пороговый потенциал.
При Ф = Vt
распространения возбуждения нет. Для аксона краба это отношение равно 7.
Было показано, что пороговый потенциал Vt
находится в тесной зависимости от чувствительности системы натриевой проницаемости мембраны к деполяризации. Чем выше эта чувствительность, т.е. чем на большую величину повышается
PNa
и, соответственно, натриевый входящий ток
INa
при данном сдвиге потенциала, тем ниже порог, и наоборот. Изменение состояния системы калиевой проницаемости на величину порогового потенциала практически не оказывает влияния. Точно так же очень мало влияет на пороговый потенциал проводимость токов «утечки». При постоянном потенциале покоя фактор безопасности должен возрастать при воздействиях на нервное волокно, которые повышают чувствительность натриевой системы к деполяризации, например, снижение концентрации ионов кальция в окружающей среде. Значительное снижение фактора безопасности вызывают агенты, усиливающие исходную инактивацию натриевой системы или уменьшающие натриевую проводимость, поскольку в этом случае амплитуда потенциала действия падает, а пороговый потенциал растет. Такие изменения проведения возбуждения наблюдал Тасаки (1957) и другие исследователи при воздействии на нервное волокно анестетиков и наркотиков в малых концентрациях, недостаточных для полного подавления потенциала действия.
Сложное влияние на фактор безопасности оказывает уровень потенциала покоя. Кратковременная подпороговая деполяризация мембраны, не изменяющая существенным образом критического потенциала и амплитуды потенциала действия, повышает фактор безопасности, так как Vt = Eo – Ek
. При сильной же деполяризации амплитуда спайка падает, критический потенциал растет, поэтому фактор безопасности уменьшается.
Наряду с фактором безопасности существенное влияние на скорость проведения возбуждения оказывает крутизна восходящей фазы распространяющегося потенциала действия. Крутизна этой фазы зависит как от пассивных, так и активных свойств мембраны.
Примерно 1/3 восходящей фазы распространяющегося ПД связана с пассивной деполяризацией мембраны нервного волокна током локальной цепи. Скорость же этой деполяризации при данной силе локального тока определяется постоянной времени мембраны t = RM CM
. Чем эта величина меньше, тем быстрее нарастает деполяризация и, следовательно, круче поднимается спайк. Инактивация натриевой системы, или снижение проницаемости для натрия (активные свойства мембраны), резко уменьшает крутизну восходящей фазы. Таким образом, при большинстве воздействий изменения скорости нарастания восходящей фазы ПД по своему направлению совпадают с изменениями фактора безопасности.
Согласно теории локальных токов, амплитуда распространяющегося потенциала действия Vs
, в отличие от мембранного спайка, зависит не только от ЭДС возбужденной мембраны
Е
, но и от соотношения входных сопротивлений возбужденного
R1
и невозбужденного (сопротивление нагрузки
R2
) участков волокна:
. (1)
Чем отношение выше, тем в большей мере амплитуда распространяющегося ПД приближается к величине Е
, тем, следовательно, выше фактор безопасности, и наоборот. Из чего вытекает, что снижение сопротивления мембраны (повышение ее ионной проводимости) при критической деполяризации не только ведет к возникновению спайка, но и способствует увеличению фактора безопасности, а значит, и скорости проведения.
Из формулы (1) ясно, что при проведении возбуждения по геометрически неоднородным возбудимым проводникам амплитуда распространяющегося спайка должна существенно зависеть от того, насколько близко находится возбужденный в данный момент участок волокна к месту его ветвления или расширения.
При расширении нервного волокна, например, в месте перехода его в тело клетки или в области ветвления аксона, суммарная площадь сечения волокон и общая площадь их мембраны увеличивается, а следовательно, R2
падает. Уменьшение
R2
снижает фактор безопасности и, соответственно, скорость проведения. При некоторых условиях уменьшение
R2
может привести к полному блокированию нервного импульса.
Расчеты показали, что потенциал действия легко проходит трехкратное расширение, с трудом пятикратное и полностью блокируется при шестикратном. Причиной развития блока является резкое снижение амплитуды распространяющегося ПД вблизи области расширения волокна.
Трофическая функция нервных волокон.Трофической функцией обладают афферентные и эфферентные волокна.
Афферентные нервы обладают двумя нейротрофическими, неимпульсными функциями. Можно различить прямое морфогенетическое и трофическое влияние на периферические органы и регуляторную функцию с обратной связью, зависящую, вероятно, от внутриаксональных центростремительных импульсов. Нейротрофическое морфогенетическое влияние доказано наличием: а) зависимости структуры вкусовых почек от вкусовых нервов; б) стимулирования регенерации конечности у амфибий чувствительными нервами посредством специфического, стимулирующего рост вещества немедиаторной природы; в) дифференцировки и поддержания рецепторов. После деафферентации в некоторых органах развиваются трофические нарушения. Первичный «трофический» нейрон для мышцы – это нейрон моторный. Нельзя забывать также, что во всех нервах проходят эфферентные адренергические волокна, вкоторых нейросекреты (катехоламины) транспортируются аксоплазматическим током к периферическим органам.
Аксональный транспорт.Описаны две системы аксонального транспорта – медленный, со скоростью 1-3 мм/день, и быстрый, со скоростью примерно 400 мм/день.
Аксональный транспорт поддерживает непрерывность аксона и синаптических мембран и восстанавливает белки, гликопротеины, ферменты и другие вещества, исчезающие в ходе локального расщепления, экзоцитоза в синаптическую щель и ретроградной миграции к нейрону. Все это происходит благодаря быстрому транспорту, на который не оказывают влияния процессы возбуждения. Транспорт продолжается после блокады потенциалов действия и не повышается при усиленной активности нерва. Аксональный транспорт осуществляется в обоих направлениях; центростремительный ток контролирует, по-видимому, синтез белков в нейроне и играет также роль «сигнала» для хроматолиза после аксотомии. Различные вещества, ферменты, передатчики и макромолекулы передвигаются в аксоне с разной скоростью.
Аксоплазматический транспорт можно зарегистрировать по накоплению веществ после нарушения непрерывности аксона и по наблюдению за продвижением меченых соединений после введения их в нейрон.
Белки, синтезируемые в теле клетки, синаптические медиаторные вещества и низкомолекулярные факторы спускаются по аксону к нервной терминали вместе с клеточными органеллами, в частности митохондриями. Для большинства веществ и органелл обнаружен ретроградный транспорт (по аксону к телу клетки): вирус полиомиелита, вирус герпеса, столбнячный токсин, а также ферменты – пероксидаза хрена, которая широко используется в нейроанатомии в качестве маркиратора. Ретроградный транспорт, видимо, является главным фактором регуляции синтеза белка в клетке. После перерезки аксона через несколько дней в соме начинается хроматолиз, что свидетельствует о нарушении синтеза белка. Быстрый аксонный транспорт зависит от достаточного снабжения метаболической энергии. Возможность транспорта создают микротрубочки диаметром 25 мкм, состоящие из белка тубулина, и некоторые нейрофибриллы, состоящие из белка актина, образующие транспортные нити. Транспортные нити скользят вдоль микротрубочек. При этом они взаимодействуют с выступами микротрубочек, происходит расщепление АТФ, которое и обеспечивает энергию для транспорта. Более медленно транспортируются крупные белки. Но считают, что сам транспортный механизм не является более медленным, однако вещества время от времени попадают в клеточные компартменты, которые не участвуют в транспорте. Медленный ток имеет, по-видимому, также отношение к аксональному росту. Аксоплазматический ток прекращается колхицином, что объясняется влиянием этого вещества на микротрубочки.
Физиология синапсов
Синапс (от греч. synapsis) обозначает соединение, связь – это специализированная зона контакта между нейронами или нейронами и другими возбудимыми образованиями, обеспечивающая передачу возбуждения с сохранением, изменением или исчезновением ее информационного значения. Данный термин был предложен Ч. Шеррингтоном (1897) для обозначения функционального контакта между нейронами. Справедливости ради нужно отметить, что еще в 60-х годах XIX столетия И.М. Сеченов подчеркивал, что вне межклеточной связи нельзя объяснить происхождение даже самых простых рефлексов.
Синапсы различают: 1) по их местоположению; 2) по способу передачи сигналов.
1) По местоположению выделяют синапсы центральные и периферические. Центральные синапсы – это синапсы, которые осуществляют контакт между нейронами в центральной нервной системе. К ним относятся аксо-аксональные синапсы, аксо-дендритические, аксо-соматические, дендро-дендритические (обнаружены гистологически; функциональное значение не вполне ясно). Центральные синапсы классифицируют также по знаку их действия – возбуждающие и тормозные. Кроме того, распространено деление синапсов по тому медиатору (передатчику), который осуществляет посредничество: адренергические синапсы, холинергические синапсы и др.
К периферическим синапсам относят нервно-мышечные, синапсы вегетативных ганглиев (синапсы, образованные преганглионарными и постганглионарными волокнами).
2) По способу передачи синапсы классифицируются как химические и электрические.
Для всех этих образований характерно наличие пресинаптической мембраны, синаптической щели (10-50 нм), постсинаптической мембраны. Пресинаптическая мембрана является мембраной пресинаптического окончания отростка нейрона (чаще всего аксона).
У человека и высших позвоночных животных наибольшее распространение получили химические синапсы. Химические синапсы в пресинаптическом окончании содержат везикулы с медиатором, химическим передатчиком. Ширина синаптической щели в среднем составляет 20 нм. На постсинаптической мембране содержатся рецепторы к данному медиатору, ферменты, разрушающие данный медиатор. Таким образом, постсинаптическая мембрана является рецепторной частью синапса, ею может быть специфически дифференцированный участок дендрита, тела нейрона и его аксона.
В электрическом синапсе не вырабатывается медиатор. Синаптическая щель несколько меньше, чем у химического синапса (2-4 нм). В синаптической щели между пре- и постсинаптической мембранами имеются белковые мостики-каналы шириной 1-2 нм, где движутся ионы и небольшие молекулы. Это способствует более низкому, чем у пресинаптической мембраны, сопротивлению постсинаптической мембраны. Поэтому возбуждение от пресинаптической мембраны к постсинаптической мембране в электрических синапсах передается электрическим путем, т.е. осуществляется эфаптическая передача. В отличие от химических синапсов, электрические синапсы отличаются большей скоростью проведения возбуждения, высокой надежностью передачи, возможностью двустороннего проведения.
Электрические синапсы обнаружены у крыс в вестибулярном ядре продолговатого мозга, в структурах дыхательного центра продолговатого мозга (при этом обсуждается их роль в механизмах автоматического ритмогенеза дыхания); у кошки электрические синапсы обнаружены между нейронами нижних олив, в структурах таламуса, между фоторецепторами сетчатки и горизонтальными клетками у рыб и др.
Но все-таки наибольшее распространение в процессе эволюции получили химические синапсы. Это обусловлено рядом свойств этих образований, которые имеют большое значение в организации деятельности нервной системы (рис. 1.4).
Рис. 1.4.
Синапс (рисунок взят из книги: Мозг / под ред. П.В. Симонова. М.: Мир, 1984)
⇐ Предыдущая3Следующая ⇒
Рекомендуемые страницы:
Функционирование нервной системы
Нормальное функционирование нервной системы зависит от передачи импульса и химических процессов в синапсе. Не менее важную роль играет создание нервных связей. Способность к обучению присутствует у людей именно благодаря возможности организма формировать новые соединения между нейронами.
Любое новое действие на стадии изучения требует постоянного контроля со стороны мозга. По мере его освоения образуются новые нейронные связи, со временем действие начинает выполняться автоматически (например, умение ходить).
Дендриты – это передающие волокна, составляющие примерно треть всей нервной ткани организма. Благодаря их взаимодействию с аксонами люди имеют возможность обучаться.
| Аксон | |
|---|---|

Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология
[редактировать в Викиданных ] |
An аксон (от греч. ἄξων áxōn, ось), или нервное волокно (или же нерв волокно: видеть орфографические различия ), представляет собой длинный тонкий выступ нервной клетки, или нейрон, у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия подальше от тело нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В определенных сенсорные нейроны (псевдоуниполярные нейроны ), например аксоны прикосновения и тепла, аксоны называются афферентные нервные волокна и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу по другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицированный на три типа — нервные волокна группы А, нервные волокна группы B, и нервные волокна группы C. Группы A и B являются миелинизированный, и группа C немиелинизированы. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматический выступы из тела клетки нейрона; другой тип — это дендрит. Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны.[1] Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.[2]
Аксоны покрыты мембраной, известной как аксолемма; цитоплазма аксона называется аксоплазма. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендрия. Распухший конец телодендрона известен как терминал аксона который присоединяется к дендрону или телу клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсы. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к autapse. В синапсе мембрана аксона близко примыкает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются вдоль аксона по мере его расширения — они называются мимоходом («попутно») синапсов и может быть сотнями или даже тысячами вдоль одного аксона.[3] Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Отдельный аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерируют тысячи синаптических окончаний. Связка аксонов делает нервный тракт в Центральная нервная система,[4] и пучок в периферическая нервная система. В плацентарные млекопитающие самый большой белое вещество тракт в головном мозге мозолистое тело, образованный примерно из 200 миллионов аксонов в человеческий мозг.[4]
Анатомия
Типичный миелинизированный аксон
Аксоны — это основные линии передачи нервная система, и как пучки они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — аксоны седалищный нерв, которые идут от основания спинной мозг к большому пальцу каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов микроскопические в диаметре (обычно около одного микрометр (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. В гигантский аксон кальмара, который специализируется на очень быстром проведении сигналов, близок к 1 миллиметр в диаметре, размером с грифель карандаша. Количество аксональных телодендрий (разветвленных структур на конце аксона) также может отличаться от одного нервного волокна к другому. Аксоны в Центральная нервная система (ЦНС) обычно показывают несколько телодендрий с множеством синаптических конечных точек. Для сравнения: гранулярная клетка мозжечка аксон характеризуется одним Т-образным узлом ветви, от которого два параллельные волокна продлевать. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
Есть два типа аксонов в нервная система: миелинизированный и немиелинизированный аксоны.[5] Миелин представляет собой слой изолирующего жирового вещества, который образован двумя типами глиальные клетки Клетки Шванна и олигодендроциты. в периферическая нервная система Шванновские клетки образуют миелиновую оболочку миелинизированного аксона. в Центральная нервная система олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон пробелы в миелиновой оболочке, известные как узлы Ранвье происходят через равные промежутки времени. Миелинизация обеспечивает особенно быстрый режим распространения электрических импульсов, называемый скачкообразное проведение.
Миелинизированные аксоны из корковые нейроны образуют основную часть нервной ткани, называемой белое вещество в мозгу. Миелин придает белому цвету ткань в отличие от серое вещество коры головного мозга, содержащей тела нейрональных клеток. Аналогичное расположение можно увидеть на мозжечок. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссур. Самый крупный из них — мозолистое тело что соединяет два полушария головного мозга, а это около 20 миллионов аксонов.[4]
Видно, что структура нейрона состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона, а также терминалы аксона. Он также включает миелиновую оболочку. В Тела Nissl которые продуцируют нейрональные белки, отсутствуют в аксональной области.[3] Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочки и промежуточные нити известный как нейрофиламенты.
Аксонный бугорок
Деталь, показывающая микротрубочки на бугорке аксона и начальном сегменте.
В аксональный бугорок это область, образованная клеточным телом нейрона по мере того, как она расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые подведены в нейроне передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
В аксональный начальный сегмент (AIS) представляет собой структурно и функционально отдельный микродомен аксона.[6][7] Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать потенциалы действия.[8] Обе эти функции поддерживают нейрон полярность ячейки, в котором дендриты (а в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области аксон нейрона обеспечивает выходные сигналы.[9]
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия.[10][11] Как положение на аксоне, так и длина AIS могут изменяться, показывая степень пластичности, которая может точно настроить вывод нейронов.[10][12] Более длинный AIS связан с большей возбудимостью.[12] Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.[13]
AIS узкоспециализирована для быстрого проведения нервные импульсы. Это достигается за счет высокой концентрации напряжение-управляемые натриевые каналы в начальном сегменте, где возникает потенциал действия.[13] Ионные каналы сопровождаются большим количеством молекулы клеточной адгезии и каркасные белки, которые прикрепляют их к цитоскелету.[10] Взаимодействие с Анкирин Г важны, так как это главный организатор в САИ.[10]
Аксональный транспорт
В аксоплазма эквивалентен цитоплазма в клетка. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона.[14] Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки.[14] Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламенты, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки.[15] Исходящие и входящие треки используют разные наборы моторные белки.[14] Исходящий транспорт обеспечивает кинезин, а входящий обратный трафик обеспечивается динеин. Динеин направлен на минус-конец.[15] Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз.[14] Исследования транспорта в аксоне привели к названию кинезина.[14]
Миелинизация
ТЕМ миелинизированного аксона в поперечном сечении.
В нервной системе аксоны могут быть миелинизированный, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким соотношением липидов к белку.[16]
В периферической нервной системе аксоны миелинизируются глиальные клетки известный как Клетки Шванна. В центральной нервной системе миелиновую оболочку представляют глиальные клетки другого типа, олигодендроцит. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.[17]
Состав миелина у этих двух типов разный. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС это основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известен как щели миелиновой оболочки) — короткие немиелинизированные сегменты миелинизированный аксон, которые находятся периодически вкраплениями между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре.[18] Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразное проведение электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы Axon
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрон является аксонный терминал (также называемый синаптическим бутоном или терминальным бутоном). Терминалы Axon содержат синаптические везикулы которые хранят нейротрансмиттер для выпуска в синапс. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда он известен как autapse.
Потенциалы действия
| Структура типового химический синапс |
|---|
|
Постсинаптический Напряжение- Синаптический Нейротрансмиттер Рецептор Нейротрансмиттер Аксон терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалы действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчивая в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Возникающее в результате повышение концентрации внутриклеточного кальция вызывает синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные нейротрансмиттер химикат, чтобы сливаться с мембраной аксона и выводить их содержимое во внеклеточное пространство. Нейромедиатор высвобождается из пресинаптического нерва через экзоцитоз. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или каким-либо образом изменяющем ее метаболизм. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.[5]
(A) пирамидная ячейка, интернейрон и форма волны короткой длительности (Axon), наложение трех средних форм волны;
(B) Средняя и стандартная ошибка времени прохождения пика для интернейронов пирамидных клеток и предполагаемых аксонов;
(C) График разброса отношения сигнал / шум для отдельных единиц от времени пика для аксонов, пирамидных клеток (PYR) и интернейронов (INT).
Внеклеточные записи потенциал действия распространение в аксонах было продемонстрировано у свободно перемещающихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно перемещающихся животных, таких как разместить клетки, аксональная активность в обоих белый и серое вещество также могут быть записаны. Внеклеточные записи распространения потенциала действия аксона отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую продолжительность пика и спада (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.[19]
Фактически, поколение потенциалы действия in vivo носит последовательный характер, и эти последовательные всплески составляют цифровые коды в нейроны. Хотя предыдущие исследования указывают на аксональное происхождение одиночного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.[20][21]
В дополнение к распространению потенциалов действия к окончанию аксона, аксон способен усиливать потенциалы действия, что гарантирует безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, напряжение-управляемые натриевые каналы в аксонах обладают нижними порог и короче период отражения в ответ на кратковременные импульсы.[22]
Развитие и рост
Разработка
Развитие аксона к его цели — один из шести основных этапов в общей развитие нервной системы.[23] Исследования проведены на культивированных гиппокамп нейроны предполагают, что нейроны изначально производят несколько невриты которые эквивалентны, но только одному из этих нейритов суждено стать аксоном.[24] Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот,[25] хотя недавние свидетельства указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. После того, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, а все остальные нейриты, включая исходный аксон, превратятся в дендриты.[26] Воздействие внешней силы на нейрит, заставляющее его удлиниться, превращает его в аксон.[27] Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелет динамика.
Внеклеточные сигналы, распространяющиеся через внеклеточный матрикс окружающие нейроны играют важную роль в развитии аксонов.[28] Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6) секретируемый белок, участвующий в образовании аксонов. Когда UNC-5 рецептор нетрина мутирован, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон выходит вперед.[29][30][31][32] Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор головного мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов и связываются с Рецепторы Trk.[33]
В ганглиозид -превращающий фермент ганглиозид плазматической мембраны сиалидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.[34]
Внутриклеточная передача сигналов
Во время развития аксонов активность PI3K увеличивается на конце предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к образованию фосфатидилинозит (3,4,5) -трисфосфат (PtdIns), которые могут вызывать значительное удлинение нейрита, превращая его в аксон. Таким образом, чрезмерное проявление фосфатазы что дефосфорилирование PtdIns приводит к нарушению поляризации.[28]
Цитоскелетная динамика
Неврит с самым низким актин содержимое филамента станет аксоном. Концентрация PGMS и f-актин содержание обратно коррелировано; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина существенно снижается.[34] Кроме того, воздействие препаратов, деполимеризующих актин, и токсина B (который инактивирует Rho-сигнализация ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет способствовать превращению ее нейрита в аксон.[35]
Рост
Аксон девятидневной мыши с видимым конусом роста
Растущие аксоны перемещаются в окружающей среде через конус роста, который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиум которые содержат выступы, называемые филоподия. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует окружающую среду. Актин играет важную роль в мобильности этой системы. Среды с высоким уровнем молекулы клеточной адгезии (CAM) создают идеальную среду для роста аксонов. Похоже, что это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают: N-CAM, ТЕГ-1 — аксональный гликопротеин —[36]-и МАГ, все из которых являются частью иммуноглобулин надсемейство. Другой набор молекул называется внеклеточный матрикс -молекулы адгезии также обеспечивают липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин, и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, действуют как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь эффекты длительного действия.
Ячейки называются клетки-указатели помочь в руководство роста аксонов нейронов. Эти клетки, которые помогают управление аксоном, как правило, другие нейроны, которые иногда незрелые. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до пяти раз, в зависимости от скорость проведения требуется.[37]
В ходе исследований также было обнаружено, что если аксоны нейрона были повреждены, то до тех пор, пока сома (тело клетки нейрон ) не повреждается, аксоны регенерируют и восстанавливают синаптические связи с нейронами с помощью клетки-указатели. Это также называется нейрорегенерация.[38]
Ного-А это тип компонента, ингибирующего рост нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов в центральной нервной системе взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях.[39] Недавнее исследование также показало, что макрофаги активируется специфическим воспалительным путем, активируемым Дектин-1 рецепторы способны способствовать восстановлению аксонов, однако также вызывают нейротоксичность в нейроне.[40]
Регулировка длины
Аксоны в значительной степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что должен существовать механизм регулирования длины клетки, позволяющий нейронам ощущать длину своих аксонов и соответственно контролировать их рост. Было обнаружено, что моторные белки играют важную роль в регулировании длины аксонов.[41] Основываясь на этом наблюдении, исследователи разработали четкую модель роста аксонов, описывающую, как моторные белки могут влиять на длину аксона на молекулярном уровне.[42][43][44][45] Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, концентрация которых колеблется во времени с частотой, зависящей от длины.
Классификация
Аксоны нейронов человека периферическая нервная система могут быть классифицированы по их физическим характеристикам и свойствам проводимости сигнала. Известно, что аксоны имеют разную толщину (от 0,1 до 20 мкм).[3] и считалось, что эти различия связаны со скоростью, с которой потенциал действия может перемещаться по аксону — его скорость проводимости. Эрлангер и Гассер доказали эту гипотезу и идентифицировали несколько типов нервных волокон, установив связь между диаметром аксона и его скорость нервной проводимости. Они опубликовали свои открытия в 1941 году, дав первую классификацию аксонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна в три основные группы, используя буквы A, B и C. группа А, группа B, и группа C включают оба сенсорных волокна (афференты ) и двигательные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторные нейроны различных моторных волокон были нижние двигательные нейроны – альфа двигательный нейрон, бета мотонейрон, и гамма мотонейрон с нервными волокнами Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, которая включала только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние двигательные нейроны имеют два вида волокон:
Типы моторных волокон
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин | Проведение скорость (м / с) |
Связанный мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | да | 80–120 | Экстрафузионные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | да | 4–24[46][47] | Внутрифузионные мышечные волокна |
Сенсорный
Разные Рецепторы чувств иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторы сенсорными волокнами II и III типов и ноцицепторы и терморецепторы сенсорными волокнами III и IV типа.
Типы сенсорных волокон
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин | Проведение скорость (м / с) |
Связанный Рецепторы чувств | Проприоцепторы | Механоцепторы | Ноцицепторы и терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Я | Aα | 13-20 | да | 80–120 | Первичные рецепторы мышечное веретено (аннулоспиральное окончание) | ✔ | ||
| Ib | Aα | 13-20 | да | 80–120 | Орган сухожилия Гольджи | |||
| II | Aβ | 6-12 | да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей). Все кожные механорецепторы |
✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давления Ноцицепторы из боковой спиноталамический тракт Холодный терморецепторы |
✔ | ||
| IV | C | 0.2-1.5 | Нет | 0.5-2.0 | Ноцицепторы из передний спиноталамический тракт Рецепторы тепла |
Автономный
В автономная нервная система имеет два вида периферических волокон:
Типы волокон
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин[48] | Проведение скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | да | 3–15 |
| постганглионарные волокна | C | 0.2–1.5 | Нет | 0.5–2.0 |
Клиническое значение
В порядке степени тяжести повреждение нерва можно описать как неврапраксия, аксонотмезис, или же невротмезис.Сотрясение считается легкой формой диффузное повреждение аксонов.[49] Аксональное повреждение также может вызвать центральный хроматолиз. Нарушение функции аксонов нервной системы является одной из основных причин многих наследственных заболеваний. неврологические расстройства которые влияют как на периферические, так и на центральные нейроны.[5]
Когда аксон раздавлен, активный процесс дегенерация аксонов происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как Валлеровское вырождение.[50] Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, это известно как дегенерация, подобная валлеровской.[51] Исследования показывают, что дегенерация происходит в результате действия аксонального белка. NMNAT2, будучи не в состоянии достичь всего аксона.[52]
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация это аномальное образование миелиновой оболочки. Это связано с несколькими лейкодистрофии, а также в шизофрения.[53][54][55]
Суровый травматическое повреждение мозга может привести к обширным поражениям нервных путей, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к стойкое вегетативное состояние.[56] Это было показано в исследованиях на крыса такое повреждение аксонов в результате единичного легкого черепно-мозгового повреждения может оставить восприимчивость к дальнейшему повреждению после повторных легких черепно-мозговых травм.[57]
А нервный проводник является искусственным средством направления роста аксонов, чтобы нейрорегенерация, и является одним из многих методов лечения, используемых для различных видов повреждение нерва.
История
Немецкий анатом Отто Фридрих Карл Дайтерс обычно приписывают открытие аксона, отличив его от дендритов.[5] Швейцарский Рюдольф Альберт фон Кёлликер и немецкий Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Келликер назвал аксон в 1896 году.[58] Луи-Антуан Ранвье был первым, кто описал бреши или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлы Ранвье. Сантьяго Рамон-и-Кахаль, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции.[5] Джозеф Эрлангер и Герберт Гассер ранее разработали систему классификации периферических нервных волокон,[59] на основе скорости аксональной проводимости, миелинизация, размер волокна и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциал действия, что привело к формулировке Модель Ходжкина – Хаксли. Ходжкин и Хаксли были награждены совместно Нобелевская премия для этой работы в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхойзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает много деталей об отдельных ионные каналы.
Другие животные
Аксоны в беспозвоночные были широко изучены. В Прибрежный кальмар, часто используется как модельный организм имеет самый длинный из известных аксонов.[60] В Гигантский кальмар имеет самый большой аксон известен. Его размер варьируется от половины (обычно) до одного миллиметра в диаметре и используется для управления его реактивный двигатель система. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических Креветки Penaeid[61] и обычный диапазон составляет от 90 до 200 м / с.[62] (ср 100–120 м / с для аксона самого быстрого миелинизированного позвоночного.)
В других случаях, как показали исследования на крысах, аксон происходит от дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона.[63] У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны.[1] Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы протяженным бугорком аксона.[63]
Смотрите также
- Электрофизиология
- Ганглионарное возвышение
- Гигантская аксональная нейропатия
- Нейрональная трассировка
- Пионерский аксон
Рекомендации
- ^ а б Triarhou LC (2014). «Аксоны, исходящие из дендритов: филогенетические последствия с оттенками Кахаля». Границы нейроанатомии. 8: 133. Дои:10.3389 / fnana.2014.00133. ЧВК 4235383. PMID 25477788.
- ^ Яу К.В. (декабрь 1976 г.). «Рецептивные поля, геометрия и проводящий блок сенсорных нейронов центральной нервной системы пиявки». Журнал физиологии. 263 (3): 513–38. Дои:10.1113 / jphysiol.1976.sp011643. ЧВК 1307715. PMID 1018277.
- ^ а б c Сквайр, Ларри (2013). Фундаментальная нейробиология (4-е изд.). Амстердам: Elsevier / Academic Press. С. 61–65. ISBN 978-0-12-385-870-2.
- ^ а б c Людерс Э., Томпсон П.М., Тога А.В. (август 2010 г.). «Развитие мозолистого тела в мозгу здорового человека». Журнал неврологии. 30 (33): 10985–90. Дои:10.1523 / JNEUROSCI.5122-09.2010. ЧВК 3197828. PMID 20720105.
- ^ а б c d е Дебанн Д., Кампанак Е., Бяловас А., Карлье Е., Алькарас Г. (апрель 2011 г.). «Аксонная физиология» (PDF). Физиологические обзоры. 91 (2): 555–602. Дои:10.1152 / Physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Нельсон А.Д., Дженкинс П.М. (2017). «Аксональные мембраны и их домены: сборка и функция начального сегмента аксона и узла Ранвье». Границы клеточной неврологии. 11: 136. Дои:10.3389 / fncel.2017.00136. ЧВК 5422562. PMID 28536506.
- ^ Летерье С., Клерк Н., Руэда-Борони Ф, Монтерсино А., Дарджент Б., Кастетс Ф (2017). «Мембранные партнеры Ankyrin G стимулируют создание и поддержание начального сегмента Axon». Границы клеточной неврологии. 11: 6. Дои:10.3389 / fncel.2017.00006. ЧВК 5266712. PMID 28184187.
- ^ Летерье С (февраль 2018 г.). «Начальный сегмент аксона: обновленная точка зрения». Журнал неврологии. 38 (9): 2135–2145. Дои:10.1523 / jneurosci.1922-17.2018. ЧВК 6596274. PMID 29378864.
- ^ Расбанд М.Н. (август 2010 г.). «Начальный сегмент аксона и поддержание полярности нейронов». Обзоры природы. Неврология. 11 (8): 552–62. Дои:10.1038 / nrn2852. PMID 20631711. S2CID 23996233.
- ^ а б c d Джонс С.Л., Свиткина Т.М. (2016). «Цитоскелет начального сегмента аксона: архитектура, развитие и роль в полярности нейронов». Нейронная пластичность. 2016: 6808293. Дои:10.1155/2016/6808293. ЧВК 4967436. PMID 27493806.
- ^ Кларк Б.Д., Голдберг Е.М., Руди Б. (декабрь 2009 г.). «Электрогенная настройка начального сегмента аксона». Нейробиолог. 15 (6): 651–68. Дои:10.1177/1073858409341973. ЧВК 2951114. PMID 20007821.
- ^ а б Ямада Р., Куба Х (2016). «Структурная и функциональная пластичность в начальном сегменте аксона». Границы клеточной неврологии. 10: 250. Дои:10.3389 / fncel.2016.00250. ЧВК 5078684. PMID 27826229.
- ^ а б Сусуки К., Куба Х (март 2016 г.). «Активно-зависимая регуляция возбудимых аксональных доменов». Журнал физиологических наук. 66 (2): 99–104. Дои:10.1007 / s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ а б c d е Альбертс Б. (2004). Essential Cell Biology: введение в молекулярную биологию клетки (2-е изд.). Нью-Йорк: Гарленд. стр.584–587. ISBN 978-0-8153-3481-1.
- ^ а б Альбертс Б. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк: Гарленд. С. 979–981. ISBN 978-0-8153-4072-0.
- ^ Озген, Н; Барон, W; Hoekstra, D; Кахья, Н. (сентябрь 2016 г.). «Динамика олигодендроглиальной мембраны в связи с биогенезом миелина». Клеточные и молекулярные науки о жизни. 73 (17): 3291–310. Дои:10.1007 / s00018-016-2228-8. ЧВК 4967101. PMID 27141942.
- ^ Сэдлер, Т. (2010). Медицинская эмбриология Лангмана (11-е изд.). Филадельфия: Липпинкотт Уильям и Уилкинс. п.300. ISBN 978-0-7817-9069-7.
- ^ Гесс А., Янг Дж. З. (ноябрь 1952 г.). «Узлы Ранвье». Труды Лондонского королевского общества. Серия B, Биологические науки. Серия Б. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. Дои:10.1098 / rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Роббинс А.А., Фокс С.Е., Холмс Г.Л., Скотт Р.К., Барри Дж. М. (ноябрь 2013 г.). «Кратковременные сигналы, записанные внеклеточно у свободно движущихся крыс, представляют активность аксонов». Границы в нейронных цепях. 7 (181): 181. Дои:10.3389 / fncir.2013.00181. ЧВК 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian и Jin-Hui Wang * (2011) Molecular Brain 4 (19), 1 ~ 11
- ^ Rongjing Ge, Hao Qian, Na Chen и Jin-Hui Wang * (2014) Molecular Brain 7 (26): 1-16
- ^ Чен Н, Ю Дж, Цянь Х, Ге Р, Ван Дж Х (июль 2010 г.). «Аксоны усиливают соматические неполные спайки до однородных амплитуд в пирамидных нейронах коры головного мозга мышей». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO … 511868C. Дои:10.1371 / journal.pone.0011868. ЧВК 2912328. PMID 20686619.
- ^ Вольперт, Льюис (2015). Принципы развития (5-е изд.). С. 520–524. ISBN 978-0-19-967814-3.
- ^ Флетчер Т.Л., Банкир Г.А. (декабрь 1989 г.). «Установление полярности нейронами гиппокампа: взаимосвязь между стадией развития клетки in situ и ее последующим развитием в культуре». Биология развития. 136 (2): 446–54. Дои:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Цзян Х., Рао Й. (май 2005 г.). «Формирование аксона: судьба против роста». Природа Неврология. 8 (5): 544–6. Дои:10.1038 / nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Гослин К., Банкир Г. (апрель 1989 г.). «Экспериментальные наблюдения за развитием полярности нейронов гиппокампа в культуре». Журнал клеточной биологии. 108 (4): 1507–16. Дои:10.1083 / jcb.108.4.1507. ЧВК 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (ноябрь 2002 г.). «Механическое напряжение может определять судьбу аксонов в нейронах гиппокампа». Журнал клеточной биологии. 159 (3): 499–508. Дои:10.1083 / jcb.200207174. ЧВК 2173080. PMID 12417580.
- ^ а б Аримура Н., Кайбути К. (март 2007 г.). «Полярность нейронов: от внеклеточных сигналов к внутриклеточным механизмам». Обзоры природы. Неврология. 8 (3): 194–205. Дои:10.1038 / номер 2056. PMID 17311006. S2CID 15556921.
- ^ Нейроглия и пионерные нейроны express UNC-6 для предоставления глобальных и локальных сетевых сигналов для управления миграциями в C. elegans
- ^ Серафини Т., Кеннеди Т.Э., Галко М.Дж., Мирзаян С., Джессел Т.М., Тесье-Лавин М. (август 1994 г.). «Нетрины определяют семейство белков, способствующих отрастанию аксонов, гомологичных C. elegans UNC-6». Клетка. 78 (3): 409–24. Дои:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Хонг К., Хинк Л., Нишияма М., Пу М.М., Тесье-Лавин М., Штейн Э. (июнь 1999 г.). «Управляемая лигандом ассоциация между цитоплазматическими доменами рецепторов семейства UNC5 и DCC превращает индуцированное нетрином притяжение конуса роста в отталкивание». Клетка. 97 (7): 927–41. Дои:10.1016 / S0092-8674 (00) 80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (январь 1990 г.). «Гены unc-5, unc-6 и unc-40 управляют периферической миграцией первичных аксонов и мезодермальных клеток по эпидермису C. elegans». Нейрон. 4 (1): 61–85. Дои:10.1016 / 0896-6273 (90) 90444-К. PMID 2310575. S2CID 23974242.
- ^ Хуанг Э.Дж., Райхардт Л.Ф. (2003). «Рецепторы Trk: роли в передаче сигнала нейронов». Ежегодный обзор биохимии. 72: 609–42. Дои:10.1146 / annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ а б Да Силва Дж. С., Хасегава Т., Мияги Т., Дотти К. Г., Абад-Родригес Дж. (Май 2005 г.). «Активность асимметричной мембранной ганглиозидной сиалидазы определяет судьбу аксонов». Природа Неврология. 8 (5): 606–15. Дои:10.1038 / nn1442. PMID 15834419. S2CID 25227765.
- ^ Брадке Ф., Дотти К.Г. (март 1999 г.). «Роль локальной нестабильности актина в формировании аксонов». Наука. 283 (5409): 1931–4. Bibcode:1999Научный … 283.1931B. Дои:10.1126 / science.283.5409.1931. PMID 10082468.
- ^ Ферли А.Дж., Мортон С.Б., Манало Д., Карагогеос Д., Додд Дж., Джессел Т.М. (апрель 1990 г.). «Аксональный гликопротеин TAG-1 является членом суперсемейства иммуноглобулинов с активностью, способствующей росту нейритов». Клетка. 61 (1): 157–70. Дои:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Альбертс, Брюс (2015). Молекулярная биология клетки (Шестое изд.). п. 947. ISBN 9780815344643.
- ^ Куник Д., Дион С., Одзаки Т., Левин Л.А., Константино С. (2011). «Лазерная пересечение одного аксона для исследований повреждения и регенерации аксонов с высоким содержанием аксонов». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO … 626832K. Дои:10.1371 / journal.pone.0026832. ЧВК 3206876. PMID 22073205.
- ^ Schwab ME (февраль 2004 г.). «Регенерация ног и аксонов». Текущее мнение в нейробиологии. 14 (1): 118–24. Дои:10.1016 / j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Гензель Дж. К., Накамура С., Гуан З., ван Ройен Н., Анкени Д. П., Попович П. Г. (март 2009 г.). «Макрофаги способствуют регенерации аксонов с одновременной нейротоксичностью». Журнал неврологии. 29 (12): 3956–68. Дои:10.1523 / JNEUROSCI.3992-08.2009. ЧВК 2693768. PMID 19321792.
- ^ Майерс К.А., Баас П.В. (сентябрь 2007 г.). «Кинезин-5 регулирует рост аксона, действуя как тормоз на его массив микротрубочек». Журнал клеточной биологии. 178 (6): 1081–91. Дои:10.1083 / jcb.200702074. ЧВК 2064629. PMID 17846176.
- ^ Ришал И., Кам Н., Перри Р. Б., Шиндер В., Фишер Е. М., Скьяво Г., Файнзильбер М. (июнь 2012 г.). «Механизм с приводом от двигателя для измерения длины клетки». Отчеты по ячейкам. 1 (6): 608–16. Дои:10.1016 / j.celrep.2012.05.013. ЧВК 3389498. PMID 22773964.
- ^ Карамчед Б.Р., Бресслофф ПК (май 2015 г.). «Модель отсроченной обратной связи для измерения длины аксонов». Биофизический журнал. 108 (9): 2408–19. Bibcode:2015BpJ … 108.2408K. Дои:10.1016 / j.bpj.2015.03.055. ЧВК 4423051. PMID 25954897.
- ^ Бресслов П.С., Карамчед Б.Р. (2015). «Механизм частотно-зависимого декодирования для определения длины аксона». Границы клеточной неврологии. 9: 281. Дои:10.3389 / fncel.2015.00281. ЧВК 4508512. PMID 26257607.
- ^ Фольц Ф., Веттманн Л., Мориджи Г., Круз К. (май 2019 г.). «Звук роста аксона». Физический обзор E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. Дои:10.1103 / PhysRevE.99.050401. PMID 31212501.
- ^ Эндрю Б.Л., часть Нью-Джерси (апрель 1972 г.). «Свойства быстрых и медленных двигательных единиц в мышцах задних конечностей и хвоста крысы». Ежеквартальный журнал экспериментальной физиологии и когнитивных медицинских наук. 57 (2): 213–25. Дои:10.1113 / expphysiol.1972.sp002151. PMID 4482075.
- ^ Рассел Нью-Джерси (январь 1980 г.). «Скорость аксональной проводимости изменяется после тенотомии мышц или деафферентации во время развития у крысы». Журнал физиологии. 298: 347–60. Дои:10.1113 / jphysiol.1980.sp013085. ЧВК 1279120. PMID 7359413.
- ^ Покок Г., Ричардс С.Д. и др. (2004). Физиология человека (2-е изд.). Нью-Йорк: Издательство Оксфордского университета. С. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 августа 2017 г.). «Травматическая травма головного мозга (ЧМТ) — определение, эпидемиология, патофизиология». Medscape. В архиве с оригинала 12 июня 2018 г.. Получено 14 июля 2018.
- ^ Травма и валлеровская дегенерация В архиве 2 мая 2006 г. Wayback Machine, Калифорнийский университет в Сан-Франциско
- ^ Coleman MP, Freeman MR (1 июня 2010 г.). «Валлеровское вырождение, мир (а) и сущность». Ежегодный обзор нейробиологии. 33 (1): 245–67. Дои:10.1146 / annurev-neuro-060909-153248. ЧВК 5223592. PMID 20345246.
- ^ Джилли Дж., Член парламента Коулмана (январь 2010 г.). «Эндогенный Nmnat2 является важным фактором выживания для поддержания здоровья аксонов». PLOS Биология. 8 (1): e1000300. Дои:10.1371 / journal.pbio.1000300. ЧВК 2811159. PMID 20126265.
- ^ Кремер-Альберс Е.М., Гериг-Бургер К., Тиле С., Троттер Дж., Наве К.А. (ноябрь 2006 г.). «Нарушенные взаимодействия мутантного протеолипидного белка / DM20 с холестерином и липидными рафтами в олигодендроглии: последствия для дисмиелинизации при спастической параплегии». Журнал неврологии. 26 (45): 11743–52. Дои:10.1523 / JNEUROSCI.3581-06.2006. ЧВК 6674790. PMID 17093095.
- ^ Маталон Р., Михалс-Маталон К., Сурендран С., Тайринг С.К. (2006). «Болезнь Канавана: исследования на нокаутной мыши». N-ацетиласпартат. Adv. Exp. Med. Биол. Успехи экспериментальной медицины и биологии. 576. С. 77–93, обсуждение 361–3. Дои:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Ткачев Д., Миммак М.Л., Хаффакер С.Дж., Райан М., Bahn S (август 2007 г.). «Дальнейшие доказательства изменения биосинтеза миелина и глутаматергической дисфункции при шизофрении». Международный журнал нейропсихофармакологии. 10 (4): 557–63. Дои:10.1017 / S1461145706007334. PMID 17291371.
- ^ «Травма головного мозга, травматическая». Медциклопедия. GE. Архивировано из оригинал 26 мая 2011 г.
- ^ Райт Д.К., Брэди Р.Д., Камнакш А., Трезизе Дж., Сан М., Макдональд С.Дж. и др. (Октябрь 2019 г.). «Повторные легкие черепно-мозговые травмы вызывают стойкие изменения белков плазмы и биомаркеров магнитно-резонансной томографии у крыс». Научные отчеты. 9 (1): 14626. Дои:10.1038 / с41598-019-51267-ш. ЧВК 6787341. PMID 31602002.
- ^ Палец S (1994). Истоки нейробиологии: история исследований функций мозга. Издательство Оксфордского университета. п. 47. ISBN 9780195146943. OCLC 27151391.
Келликер дал название аксону в 1896 году.
- ^ Грант G (декабрь 2006 г.). «Нобелевские премии 1932 и 1944 годов по физиологии и медицине: награды за новаторские исследования в области нейрофизиологии». Журнал истории неврологии. 15 (4): 341–57. Дои:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Хелье, Дженнифер Л. (16 декабря 2014 г.). Мозг, нервная система и их болезни [3 тома]. ABC-CLIO. ISBN 9781610693387. В архиве из оригинала 14 марта 2018 г.
- ^ Хсу К., Теракава С. (июль 1996 г.). «Фенестрация в миелиновой оболочке нервных волокон креветки: новый узел возбуждения для скачкообразной проводимости». Журнал нейробиологии. 30 (3): 397–409. Дои:10.1002 / (SICI) 1097-4695 (199607) 30: 3 <397 :: AID-NEU8> 3.0.CO; 2- #. PMID 8807532.
- ^ Зальцер Дж. Л., Залц Б. (октябрь 2016 г.). «Миелинизация». Текущая биология. 26 (20): R971 – R975. Дои:10.1016 / j.cub.2016.07.074. PMID 27780071.
- ^ а б Хёффлин Ф., Джек А., Ридель С., Мак-Бухер Дж., Роос Дж., Корчелли С. и др. (2017). «Неоднородность начального сегмента аксона в интернейронах и пирамидных клетках зрительной коры грызунов». Границы клеточной неврологии. 11: 332. Дои:10.3389 / fncel.2017.00332. ЧВК 5684645. PMID 29170630.
внешняя ссылка
- Гистологическое изображение: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг «
| Аксон | |
|---|---|

Аксон многополярного нейрона |
|
| Идентификаторы | |
| MeSH | D001369 |
| Анатомическая терминология
[редактировать в Викиданных ] |
An аксон (от греч. ἄξων áxōn, ось), или нервное волокно (или же нерв волокно: видеть орфографические различия ), представляет собой длинный тонкий выступ нервной клетки, или нейрон, у позвоночных, который обычно проводит электрические импульсы, известные как потенциалы действия подальше от тело нервной клетки. Функция аксона — передавать информацию различным нейронам, мышцам и железам. В определенных сенсорные нейроны (псевдоуниполярные нейроны ), например аксоны прикосновения и тепла, аксоны называются афферентные нервные волокна и электрический импульс проходит по ним от периферия к телу клетки и от тела клетки к спинному мозгу по другой ветви того же аксона. Дисфункция аксонов является причиной многих наследственных и приобретенных неврологических расстройств, которые могут поражать как периферические, так и центральные нейроны. Нервные волокна классифицированный на три типа — нервные волокна группы А, нервные волокна группы B, и нервные волокна группы C. Группы A и B являются миелинизированный, и группа C немиелинизированы. Эти группы включают как сенсорные волокна, так и двигательные волокна. Другая классификация группирует только сенсорные волокна как Тип I, Тип II, Тип III и Тип IV.
Аксон — это один из двух типов цитоплазматический выступы из тела клетки нейрона; другой тип — это дендрит. Аксоны отличаются от дендритов несколькими особенностями, включая форму (дендриты часто сужаются, в то время как аксоны обычно имеют постоянный радиус), длину (дендриты ограничены небольшой областью вокруг тела клетки, в то время как аксоны могут быть намного длиннее) и функцию (дендриты получают сигналы, тогда как аксоны передают их). Некоторые типы нейронов не имеют аксона и передают сигналы от своих дендритов. У некоторых видов аксоны могут исходить из дендритов, известных как дендриты, несущие аксоны.[1] Ни у одного нейрона никогда не бывает более одного аксона; однако у беспозвоночных, таких как насекомые или пиявки, аксон иногда состоит из нескольких областей, которые функционируют более или менее независимо друг от друга.[2]
Аксоны покрыты мембраной, известной как аксолемма; цитоплазма аксона называется аксоплазма. Большинство аксонов разветвляются, в некоторых случаях очень обильно. Концевые ветви аксона называются телодендрия. Распухший конец телодендрона известен как терминал аксона который присоединяется к дендрону или телу клетки другого нейрона, образуя синаптическое соединение. Аксоны контактируют с другими клетками — обычно с другими нейронами, но иногда с клетками мышц или желез — в соединениях, называемых синапсы. В некоторых случаях аксон одного нейрона может образовывать синапс с дендритами того же нейрона, что приводит к autapse. В синапсе мембрана аксона близко примыкает к мембране клетки-мишени, а специальные молекулярные структуры служат для передачи электрических или электрохимических сигналов через промежуток. Некоторые синаптические соединения появляются вдоль аксона по мере его расширения — они называются мимоходом («попутно») синапсов и может быть сотнями или даже тысячами вдоль одного аксона.[3] Другие синапсы выглядят как терминалы на концах аксональных ветвей.
Отдельный аксон со всеми его ветвями, взятыми вместе, может иннервировать несколько частей мозга и генерируют тысячи синаптических окончаний. Связка аксонов делает нервный тракт в Центральная нервная система,[4] и пучок в периферическая нервная система. В плацентарные млекопитающие самый большой белое вещество тракт в головном мозге мозолистое тело, образованный примерно из 200 миллионов аксонов в человеческий мозг.[4]
Анатомия
Типичный миелинизированный аксон
Аксоны — это основные линии передачи нервная система, и как пучки они образуют нервы. Некоторые аксоны могут достигать одного метра и более, а другие — всего лишь один миллиметр. Самые длинные аксоны в человеческом теле — аксоны седалищный нерв, которые идут от основания спинной мозг к большому пальцу каждой стопы. Диаметр аксонов также варьируется. Большинство отдельных аксонов микроскопические в диаметре (обычно около одного микрометр (мкм) в поперечнике). Самые большие аксоны млекопитающих могут достигать в диаметре до 20 мкм. В гигантский аксон кальмара, который специализируется на очень быстром проведении сигналов, близок к 1 миллиметр в диаметре, размером с грифель карандаша. Количество аксональных телодендрий (разветвленных структур на конце аксона) также может отличаться от одного нервного волокна к другому. Аксоны в Центральная нервная система (ЦНС) обычно показывают несколько телодендрий с множеством синаптических конечных точек. Для сравнения: гранулярная клетка мозжечка аксон характеризуется одним Т-образным узлом ветви, от которого два параллельные волокна продлевать. Продуманное ветвление позволяет одновременно передавать сообщения большому количеству целевых нейронов в одной области мозга.
Есть два типа аксонов в нервная система: миелинизированный и немиелинизированный аксоны.[5] Миелин представляет собой слой изолирующего жирового вещества, который образован двумя типами глиальные клетки Клетки Шванна и олигодендроциты. в периферическая нервная система Шванновские клетки образуют миелиновую оболочку миелинизированного аксона. в Центральная нервная система олигодендроциты образуют изолирующий миелин. Вдоль миелинизированных нервных волокон пробелы в миелиновой оболочке, известные как узлы Ранвье происходят через равные промежутки времени. Миелинизация обеспечивает особенно быстрый режим распространения электрических импульсов, называемый скачкообразное проведение.
Миелинизированные аксоны из корковые нейроны образуют основную часть нервной ткани, называемой белое вещество в мозгу. Миелин придает белому цвету ткань в отличие от серое вещество коры головного мозга, содержащей тела нейрональных клеток. Аналогичное расположение можно увидеть на мозжечок. Связки миелинизированных аксонов составляют нервные пути в ЦНС. Там, где эти тракты пересекают среднюю линию мозга и соединяют противоположные области, они называются комиссур. Самый крупный из них — мозолистое тело что соединяет два полушария головного мозга, а это около 20 миллионов аксонов.[4]
Видно, что структура нейрона состоит из двух отдельных функциональных областей или компартментов — тела клетки вместе с дендритами в качестве одной области и аксональной области в качестве другой.
Аксональная область
Аксональная область или компартмент включает бугорок аксона, начальный сегмент, остальную часть аксона и телодендрии аксона, а также терминалы аксона. Он также включает миелиновую оболочку. В Тела Nissl которые продуцируют нейрональные белки, отсутствуют в аксональной области.[3] Белки, необходимые для роста аксона и удаления отходов жизнедеятельности, нуждаются в транспортном каркасе. Этот аксональный транспорт обеспечивается в аксоплазме за счет расположения микротрубочки и промежуточные нити известный как нейрофиламенты.
Аксонный бугорок
Деталь, показывающая микротрубочки на бугорке аксона и начальном сегменте.
В аксональный бугорок это область, образованная клеточным телом нейрона по мере того, как она расширяется, чтобы стать аксоном. Он предшествует начальному сегменту. Полученные потенциалы действия, которые подведены в нейроне передаются на бугорок аксона для генерации потенциала действия из начального сегмента.
Начальный сегмент
В аксональный начальный сегмент (AIS) представляет собой структурно и функционально отдельный микродомен аксона.[6][7] Одна из функций начального сегмента — отделить основную часть аксона от остальной части нейрона; другая функция — помочь инициировать потенциалы действия.[8] Обе эти функции поддерживают нейрон полярность ячейки, в котором дендриты (а в некоторых случаях сома ) нейрона получают входные сигналы в базальной области, а в апикальной области аксон нейрона обеспечивает выходные сигналы.[9]
Начальный сегмент аксона немиелинизирован и содержит специализированный комплекс белков. Его длина составляет примерно от 20 до 60 мкм, и он функционирует как место инициации потенциала действия.[10][11] Как положение на аксоне, так и длина AIS могут изменяться, показывая степень пластичности, которая может точно настроить вывод нейронов.[10][12] Более длинный AIS связан с большей возбудимостью.[12] Пластичность также проявляется в способности AIS изменять свое распределение и поддерживать активность нейронных схем на постоянном уровне.[13]
AIS узкоспециализирована для быстрого проведения нервные импульсы. Это достигается за счет высокой концентрации напряжение-управляемые натриевые каналы в начальном сегменте, где возникает потенциал действия.[13] Ионные каналы сопровождаются большим количеством молекулы клеточной адгезии и каркасные белки, которые прикрепляют их к цитоскелету.[10] Взаимодействие с Анкирин Г важны, так как это главный организатор в САИ.[10]
Аксональный транспорт
В аксоплазма эквивалентен цитоплазма в клетка. Микротрубочки образуются в аксоплазме на бугорке аксона. Они расположены по длине аксона в перекрывающихся участках и все направлены в одном направлении — к окончанию аксона.[14] Об этом говорят положительные окончания микротрубочек. Такое перекрывающееся расположение обеспечивает маршруты транспортировки различных материалов из тела клетки.[14] Исследования аксоплазмы показали движение многочисленных пузырьков всех размеров, которые можно увидеть вдоль цитоскелетных филаментов — микротрубочек и нейрофиламенты, в обоих направлениях между аксоном и его окончаниями и телом клетки.
Исходящий антероградный транспорт из тела клетки по аксону переносит митохондрии и мембранные белки, необходимые для роста, к концу аксона. Входящий ретроградный транспорт переносит отходы клетки от терминала аксона к телу клетки.[15] Исходящие и входящие треки используют разные наборы моторные белки.[14] Исходящий транспорт обеспечивает кинезин, а входящий обратный трафик обеспечивается динеин. Динеин направлен на минус-конец.[15] Существует множество форм моторных белков кинезина и динеина, и считается, что каждая из них несет свой груз.[14] Исследования транспорта в аксоне привели к названию кинезина.[14]
Миелинизация
ТЕМ миелинизированного аксона в поперечном сечении.
В нервной системе аксоны могут быть миелинизированный, или немиелинизированные. Это обеспечение изолирующего слоя, называемого миелиновой оболочкой. Миелиновая мембрана уникальна своим относительно высоким соотношением липидов к белку.[16]
В периферической нервной системе аксоны миелинизируются глиальные клетки известный как Клетки Шванна. В центральной нервной системе миелиновую оболочку представляют глиальные клетки другого типа, олигодендроцит. Клетки Шванна миелинизируют единственный аксон. Олигодендроцит может миелинизировать до 50 аксонов.[17]
Состав миелина у этих двух типов разный. В ЦНС основным белком миелина является протеолипидный белок, а в ПНС это основной белок миелина.
Узлы Ранвье
Узлы Ранвье (также известен как щели миелиновой оболочки) — короткие немиелинизированные сегменты миелинизированный аксон, которые находятся периодически вкраплениями между сегментами миелиновой оболочки. Следовательно, в точке узла Ранвье аксон уменьшается в диаметре.[18] Эти узлы являются областями, где могут быть созданы потенциалы действия. В скачкообразное проведение электрические токи, возникающие в каждом узле Ранвье, передаются с небольшим затуханием к следующему узлу в линии, где они остаются достаточно сильными, чтобы генерировать другой потенциал действия. Таким образом, в миелинизированном аксоне потенциалы действия эффективно «прыгают» от узла к узлу, минуя миелинизированные участки между ними, в результате чего скорость распространения намного выше, чем может выдержать даже самый быстрый немиелинизированный аксон.
Терминалы Axon
Аксон может делиться на множество ветвей, называемых телодендриями (греч. Конец дерева). В конце каждого телодендрон является аксонный терминал (также называемый синаптическим бутоном или терминальным бутоном). Терминалы Axon содержат синаптические везикулы которые хранят нейротрансмиттер для выпуска в синапс. Это делает возможными множественные синаптические связи с другими нейронами. Иногда аксон нейрона может синапсировать с дендритами того же нейрона, когда он известен как autapse.
Потенциалы действия
| Структура типового химический синапс |
|---|
|
Постсинаптический Напряжение- Синаптический Нейротрансмиттер Рецептор Нейротрансмиттер Аксон терминал Синаптическая щель Дендрит |
Большинство аксонов несут сигналы в виде потенциалы действия, которые представляют собой дискретные электрохимические импульсы, которые быстро проходят по аксону, начиная с тела клетки и заканчивая в точках, где аксон производит синаптический контакт с клетками-мишенями. Определяющей характеристикой потенциала действия является то, что он действует по принципу «все или ничего» — каждый потенциал действия, который генерирует аксон, по существу имеет одинаковый размер и форму. Эта характеристика «все или ничего» позволяет передавать потенциалы действия от одного конца длинного аксона к другому без какого-либо уменьшения размера. Однако есть некоторые типы нейронов с короткими аксонами, которые несут ступенчатые электрохимические сигналы переменной амплитуды.
Когда потенциал действия достигает пресинаптического терминала, он активирует процесс синаптической передачи. Первый шаг — это быстрое открытие каналов для ионов кальция в мембране аксона, позволяя ионам кальция проходить внутрь через мембрану. Возникающее в результате повышение концентрации внутриклеточного кальция вызывает синаптические везикулы (крошечные контейнеры, окруженные липидной мембраной), заполненные нейротрансмиттер химикат, чтобы сливаться с мембраной аксона и выводить их содержимое во внеклеточное пространство. Нейромедиатор высвобождается из пресинаптического нерва через экзоцитоз. Затем химический нейротрансмиттер диффундирует к рецепторам, расположенным на мембране клетки-мишени. Нейромедиатор связывается с этими рецепторами и активирует их. В зависимости от типа активируемых рецепторов действие на клетку-мишень может заключаться в возбуждении клетки-мишени, ее подавлении или каким-либо образом изменяющем ее метаболизм. Вся эта последовательность событий часто происходит менее чем за тысячную долю секунды. После этого внутри пресинаптического терминала новый набор везикул перемещается в положение рядом с мембраной, готовых к высвобождению при достижении следующего потенциала действия. Потенциал действия — это последний электрический шаг в интеграции синаптических сообщений в масштабе нейрона.[5]
(A) пирамидная ячейка, интернейрон и форма волны короткой длительности (Axon), наложение трех средних форм волны;
(B) Средняя и стандартная ошибка времени прохождения пика для интернейронов пирамидных клеток и предполагаемых аксонов;
(C) График разброса отношения сигнал / шум для отдельных единиц от времени пика для аксонов, пирамидных клеток (PYR) и интернейронов (INT).
Внеклеточные записи потенциал действия распространение в аксонах было продемонстрировано у свободно перемещающихся животных. В то время как внеклеточные соматические потенциалы действия использовались для изучения клеточной активности у свободно перемещающихся животных, таких как разместить клетки, аксональная активность в обоих белый и серое вещество также могут быть записаны. Внеклеточные записи распространения потенциала действия аксона отличаются от соматических потенциалов действия по трем причинам: 1. Сигнал имеет более короткую продолжительность пика и спада (~ 150 мкс), чем у пирамидных клеток (~ 500 мкс) или интернейронов (~ 250 мкс). 2. Изменение напряжения трехфазное. 3. Активность, записанная на тетроде, видна только на одном из четырех проводов записи. В записях от свободно движущихся крыс аксональные сигналы были изолированы в трактах белого вещества, включая альвеус и мозолистое тело, а также серое вещество гиппокампа.[19]
Фактически, поколение потенциалы действия in vivo носит последовательный характер, и эти последовательные всплески составляют цифровые коды в нейроны. Хотя предыдущие исследования указывают на аксональное происхождение одиночного спайка, вызванного кратковременными импульсами, физиологические сигналы in vivo запускают инициирование последовательных спайков в телах клеток нейронов.[20][21]
В дополнение к распространению потенциалов действия к окончанию аксона, аксон способен усиливать потенциалы действия, что гарантирует безопасное распространение последовательных потенциалов действия к окончанию аксона. Что касается молекулярных механизмов, напряжение-управляемые натриевые каналы в аксонах обладают нижними порог и короче период отражения в ответ на кратковременные импульсы.[22]
Развитие и рост
Разработка
Развитие аксона к его цели — один из шести основных этапов в общей развитие нервной системы.[23] Исследования проведены на культивированных гиппокамп нейроны предполагают, что нейроны изначально производят несколько невриты которые эквивалентны, но только одному из этих нейритов суждено стать аксоном.[24] Неясно, предшествует ли спецификация аксона удлинению аксона или наоборот,[25] хотя недавние свидетельства указывают на последнее. Если разрезать не полностью развитый аксон, полярность может измениться, и другие нейриты потенциально могут стать аксоном. Это изменение полярности происходит только в том случае, если аксон сокращен как минимум на 10 мкм короче, чем другие нейриты. После того, как разрез будет сделан, самый длинный нейрит станет будущим аксоном, а все остальные нейриты, включая исходный аксон, превратятся в дендриты.[26] Воздействие внешней силы на нейрит, заставляющее его удлиниться, превращает его в аксон.[27] Тем не менее, развитие аксонов достигается за счет сложного взаимодействия между внеклеточной передачей сигналов, внутриклеточной передачей сигналов и цитоскелет динамика.
Внеклеточные сигналы, распространяющиеся через внеклеточный матрикс окружающие нейроны играют важную роль в развитии аксонов.[28] Эти сигнальные молекулы включают белки, нейротрофические факторы, внеклеточный матрикс и молекулы адгезии. Нетрин (также известный как UNC-6) секретируемый белок, участвующий в образовании аксонов. Когда UNC-5 рецептор нетрина мутирован, несколько нейритов нерегулярно проецируются из нейронов, и, наконец, один аксон выходит вперед.[29][30][31][32] Нейротрофические факторы — фактор роста нервов (NGF), нейротрофический фактор головного мозга (BDNF) и нейротрофин-3 (NTF3) также участвуют в развитии аксонов и связываются с Рецепторы Trk.[33]
В ганглиозид -превращающий фермент ганглиозид плазматической мембраны сиалидаза (PMGS), который участвует в активации TrkA на кончике нейтритов, требуется для удлинения аксонов. PMGS асимметрично распределяется по кончику нейрита, которому суждено стать будущим аксоном.[34]
Внутриклеточная передача сигналов
Во время развития аксонов активность PI3K увеличивается на конце предназначенного аксона. Нарушение активности PI3K тормозит развитие аксонов. Активация PI3K приводит к образованию фосфатидилинозит (3,4,5) -трисфосфат (PtdIns), которые могут вызывать значительное удлинение нейрита, превращая его в аксон. Таким образом, чрезмерное проявление фосфатазы что дефосфорилирование PtdIns приводит к нарушению поляризации.[28]
Цитоскелетная динамика
Неврит с самым низким актин содержимое филамента станет аксоном. Концентрация PGMS и f-актин содержание обратно коррелировано; когда PGMS становится обогащенным на кончике нейрита, содержание в нем f-актина существенно снижается.[34] Кроме того, воздействие препаратов, деполимеризующих актин, и токсина B (который инактивирует Rho-сигнализация ) вызывает образование множественных аксонов. Следовательно, разрыв актиновой сети в конусе роста будет способствовать превращению ее нейрита в аксон.[35]
Рост
Аксон девятидневной мыши с видимым конусом роста
Растущие аксоны перемещаются в окружающей среде через конус роста, который находится на кончике аксона. Конус роста имеет широкое пластинчатое расширение, называемое ламеллиподиум которые содержат выступы, называемые филоподия. Филоподии — это механизм, с помощью которого весь процесс прикрепляется к поверхностям и исследует окружающую среду. Актин играет важную роль в мобильности этой системы. Среды с высоким уровнем молекулы клеточной адгезии (CAM) создают идеальную среду для роста аксонов. Похоже, что это обеспечивает «липкую» поверхность для роста аксонов. Примеры CAM, специфичных для нейронных систем, включают: N-CAM, ТЕГ-1 — аксональный гликопротеин —[36]-и МАГ, все из которых являются частью иммуноглобулин надсемейство. Другой набор молекул называется внеклеточный матрикс -молекулы адгезии также обеспечивают липкий субстрат для роста аксонов. Примеры этих молекул включают ламинин, фибронектин, тенасцин, и перлекан. Некоторые из них поверхностно связаны с клетками и, таким образом, действуют как аттрактанты или репелленты ближнего действия. Другие являются диффундирующими лигандами и, следовательно, могут иметь эффекты длительного действия.
Ячейки называются клетки-указатели помочь в руководство роста аксонов нейронов. Эти клетки, которые помогают управление аксоном, как правило, другие нейроны, которые иногда незрелые. Когда аксон завершит свой рост в месте его соединения с мишенью, диаметр аксона может увеличиться до пяти раз, в зависимости от скорость проведения требуется.[37]
В ходе исследований также было обнаружено, что если аксоны нейрона были повреждены, то до тех пор, пока сома (тело клетки нейрон ) не повреждается, аксоны регенерируют и восстанавливают синаптические связи с нейронами с помощью клетки-указатели. Это также называется нейрорегенерация.[38]
Ного-А это тип компонента, ингибирующего рост нейритов, который присутствует в миелиновых мембранах центральной нервной системы (обнаружен в аксоне). Он играет решающую роль в ограничении регенерации аксонов в центральной нервной системе взрослых млекопитающих. В недавних исследованиях, если Nogo-A заблокирован и нейтрализован, можно вызвать регенерацию аксонов на большом расстоянии, что приводит к усилению функционального восстановления у крыс и спинного мозга мыши. Этого еще предстоит сделать на людях.[39] Недавнее исследование также показало, что макрофаги активируется специфическим воспалительным путем, активируемым Дектин-1 рецепторы способны способствовать восстановлению аксонов, однако также вызывают нейротоксичность в нейроне.[40]
Регулировка длины
Аксоны в значительной степени различаются по длине от нескольких микрометров до метров у некоторых животных. Это подчеркивает, что должен существовать механизм регулирования длины клетки, позволяющий нейронам ощущать длину своих аксонов и соответственно контролировать их рост. Было обнаружено, что моторные белки играют важную роль в регулировании длины аксонов.[41] Основываясь на этом наблюдении, исследователи разработали четкую модель роста аксонов, описывающую, как моторные белки могут влиять на длину аксона на молекулярном уровне.[42][43][44][45] Эти исследования предполагают, что моторные белки переносят сигнальные молекулы от сомы к конусу роста и наоборот, концентрация которых колеблется во времени с частотой, зависящей от длины.
Классификация
Аксоны нейронов человека периферическая нервная система могут быть классифицированы по их физическим характеристикам и свойствам проводимости сигнала. Известно, что аксоны имеют разную толщину (от 0,1 до 20 мкм).[3] и считалось, что эти различия связаны со скоростью, с которой потенциал действия может перемещаться по аксону — его скорость проводимости. Эрлангер и Гассер доказали эту гипотезу и идентифицировали несколько типов нервных волокон, установив связь между диаметром аксона и его скорость нервной проводимости. Они опубликовали свои открытия в 1941 году, дав первую классификацию аксонов.
Аксоны подразделяются на две системы. Первый, введенный Эрлангером и Гассером, сгруппировал волокна в три основные группы, используя буквы A, B и C. группа А, группа B, и группа C включают оба сенсорных волокна (афференты ) и двигательные волокна (эфференты ). Первая группа A была разделена на альфа, бета, гамма и дельта волокна — Aα, Aβ, Aγ и Aδ. Моторные нейроны различных моторных волокон были нижние двигательные нейроны – альфа двигательный нейрон, бета мотонейрон, и гамма мотонейрон с нервными волокнами Aα, Aβ и Aγ соответственно.
Позже другие исследователи обнаружили две группы волокон Aa, которые были сенсорными волокнами. Затем они были введены в систему, которая включала только сенсорные волокна (хотя некоторые из них были смешанными нервами, а также двигательными волокнами). Эта система называет сенсорные группы Типами и использует римские цифры: Тип Ia, Тип Ib, Тип II, Тип III и Тип IV.
Мотор
Нижние двигательные нейроны имеют два вида волокон:
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин | Проведение скорость (м / с) |
Связанный мышечные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 | да | 80–120 | Экстрафузионные мышечные волокна |
| β | Aβ | ||||
| γ | Aγ | 5-8 | да | 4–24[46][47] | Внутрифузионные мышечные волокна |
Сенсорный
Разные Рецепторы чувств иннервируют разные типы нервных волокон. Проприоцепторы иннервируются сенсорными волокнами типа Ia, Ib и II, механорецепторы сенсорными волокнами II и III типов и ноцицепторы и терморецепторы сенсорными волокнами III и IV типа.
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин | Проведение скорость (м / с) |
Связанный Рецепторы чувств | Проприоцепторы | Механоцепторы | Ноцицепторы и терморецепторы |
|---|---|---|---|---|---|---|---|---|
| Я | Aα | 13-20 | да | 80–120 | Первичные рецепторы мышечное веретено (аннулоспиральное окончание) | ✔ | ||
| Ib | Aα | 13-20 | да | 80–120 | Орган сухожилия Гольджи | |||
| II | Aβ | 6-12 | да | 33–75 | Вторичные рецепторы мышечное веретено (окончание цветочно-спрей). Все кожные механорецепторы |
✔ | ||
| III | Aδ | 1-5 | Тонкий | 3–30 | Свободные нервные окончания прикосновения и давления Ноцицепторы из боковой спиноталамический тракт Холодный терморецепторы |
✔ | ||
| IV | C | 0.2-1.5 | Нет | 0.5-2.0 | Ноцицепторы из передний спиноталамический тракт Рецепторы тепла |
Автономный
В автономная нервная система имеет два вида периферических волокон:
| Тип | Эрлангер-Гассер Классификация |
Диаметр (мкм) |
Миелин[48] | Проведение скорость (м / с) |
|---|---|---|---|---|
| преганглионарные волокна | B | 1–5 | да | 3–15 |
| постганглионарные волокна | C | 0.2–1.5 | Нет | 0.5–2.0 |
Клиническое значение
В порядке степени тяжести повреждение нерва можно описать как неврапраксия, аксонотмезис, или же невротмезис.Сотрясение считается легкой формой диффузное повреждение аксонов.[49] Аксональное повреждение также может вызвать центральный хроматолиз. Нарушение функции аксонов нервной системы является одной из основных причин многих наследственных заболеваний. неврологические расстройства которые влияют как на периферические, так и на центральные нейроны.[5]
Когда аксон раздавлен, активный процесс дегенерация аксонов происходит в части аксона, наиболее удаленной от тела клетки. Эта дегенерация происходит быстро после травмы, когда часть аксона блокируется мембранами и разрушается макрофагами. Это известно как Валлеровское вырождение.[50] Отмирание аксона также может иметь место при многих нейродегенеративных заболеваниях, особенно при нарушении транспорта аксонов, это известно как дегенерация, подобная валлеровской.[51] Исследования показывают, что дегенерация происходит в результате действия аксонального белка. NMNAT2, будучи не в состоянии достичь всего аксона.[52]
Демиелинизация аксонов вызывает множество неврологических симптомов, обнаруженных при заболевании рассеянный склероз.
Дисмиелинизация это аномальное образование миелиновой оболочки. Это связано с несколькими лейкодистрофии, а также в шизофрения.[53][54][55]
Суровый травматическое повреждение мозга может привести к обширным поражениям нервных путей, повреждая аксоны в состоянии, известном как диффузное повреждение аксонов. Это может привести к стойкое вегетативное состояние.[56] Это было показано в исследованиях на крыса такое повреждение аксонов в результате единичного легкого черепно-мозгового повреждения может оставить восприимчивость к дальнейшему повреждению после повторных легких черепно-мозговых травм.[57]
А нервный проводник является искусственным средством направления роста аксонов, чтобы нейрорегенерация, и является одним из многих методов лечения, используемых для различных видов повреждение нерва.
История
Немецкий анатом Отто Фридрих Карл Дайтерс обычно приписывают открытие аксона, отличив его от дендритов.[5] Швейцарский Рюдольф Альберт фон Кёлликер и немецкий Роберт Ремак были первыми, кто идентифицировал и охарактеризовал начальный сегмент аксона. Келликер назвал аксон в 1896 году.[58] Луи-Антуан Ранвье был первым, кто описал бреши или узлы, обнаруженные на аксонах, и за этот вклад эти аксональные особенности теперь обычно называют узлы Ранвье. Сантьяго Рамон-и-Кахаль, испанский анатом, предположил, что аксоны были выходными компонентами нейронов, описывая их функции.[5] Джозеф Эрлангер и Герберт Гассер ранее разработали систему классификации периферических нервных волокон,[59] на основе скорости аксональной проводимости, миелинизация, размер волокна и т. д. Алан Ходжкин и Эндрю Хаксли также использовали гигантский аксон кальмара (1939), а к 1952 году они получили полное количественное описание ионной основы потенциал действия, что привело к формулировке Модель Ходжкина – Хаксли. Ходжкин и Хаксли были награждены совместно Нобелевская премия для этой работы в 1963 году. Формулы, описывающие аксональную проводимость, были распространены на позвоночных в уравнениях Франкенхойзера-Хаксли. Понимание биохимической основы распространения потенциала действия продвинулось дальше и включает много деталей об отдельных ионные каналы.
Другие животные
Аксоны в беспозвоночные были широко изучены. В Прибрежный кальмар, часто используется как модельный организм имеет самый длинный из известных аксонов.[60] В Гигантский кальмар имеет самый большой аксон известен. Его размер варьируется от половины (обычно) до одного миллиметра в диаметре и используется для управления его реактивный двигатель система. Самая быстрая зарегистрированная скорость проводимости 210 м / с обнаружена в заключенных в оболочку аксонах некоторых пелагических Креветки Penaeid[61] и обычный диапазон составляет от 90 до 200 м / с.[62] (ср 100–120 м / с для аксона самого быстрого миелинизированного позвоночного.)
В других случаях, как показали исследования на крысах, аксон происходит от дендрита; такие аксоны, как говорят, имеют «дендритное происхождение». Некоторые аксоны с дендритным происхождением аналогичным образом имеют «проксимальный» начальный сегмент, который начинается непосредственно в источнике аксона, в то время как другие имеют «дистальный» начальный сегмент, заметно отделенный от источника аксона.[63] У многих видов некоторые из нейронов имеют аксоны, которые исходят из дендрита, а не из тела клетки, и они известны как дендриты, несущие аксоны.[1] Во многих случаях аксон берет свое начало от бугорка аксона на соме; такие аксоны, как говорят, имеют «соматическое происхождение». Некоторые аксоны соматического происхождения имеют «проксимальный» начальный сегмент, прилегающий к бугорку аксона, в то время как другие имеют «дистальный» начальный сегмент, отделенный от сомы протяженным бугорком аксона.[63]
Смотрите также
- Электрофизиология
- Ганглионарное возвышение
- Гигантская аксональная нейропатия
- Нейрональная трассировка
- Пионерский аксон
Рекомендации
- ^ а б Triarhou LC (2014). «Аксоны, исходящие из дендритов: филогенетические последствия с оттенками Кахаля». Границы нейроанатомии. 8: 133. Дои:10.3389 / fnana.2014.00133. ЧВК 4235383. PMID 25477788.
- ^ Яу К.В. (декабрь 1976 г.). «Рецептивные поля, геометрия и проводящий блок сенсорных нейронов центральной нервной системы пиявки». Журнал физиологии. 263 (3): 513–38. Дои:10.1113 / jphysiol.1976.sp011643. ЧВК 1307715. PMID 1018277.
- ^ а б c Сквайр, Ларри (2013). Фундаментальная нейробиология (4-е изд.). Амстердам: Elsevier / Academic Press. С. 61–65. ISBN 978-0-12-385-870-2.
- ^ а б c Людерс Э., Томпсон П.М., Тога А.В. (август 2010 г.). «Развитие мозолистого тела в мозгу здорового человека». Журнал неврологии. 30 (33): 10985–90. Дои:10.1523 / JNEUROSCI.5122-09.2010. ЧВК 3197828. PMID 20720105.
- ^ а б c d е Дебанн Д., Кампанак Е., Бяловас А., Карлье Е., Алькарас Г. (апрель 2011 г.). «Аксонная физиология» (PDF). Физиологические обзоры. 91 (2): 555–602. Дои:10.1152 / Physrev.00048.2009. PMID 21527732. S2CID 13916255.
- ^ Нельсон А.Д., Дженкинс П.М. (2017). «Аксональные мембраны и их домены: сборка и функция начального сегмента аксона и узла Ранвье». Границы клеточной неврологии. 11: 136. Дои:10.3389 / fncel.2017.00136. ЧВК 5422562. PMID 28536506.
- ^ Летерье С., Клерк Н., Руэда-Борони Ф, Монтерсино А., Дарджент Б., Кастетс Ф (2017). «Мембранные партнеры Ankyrin G стимулируют создание и поддержание начального сегмента Axon». Границы клеточной неврологии. 11: 6. Дои:10.3389 / fncel.2017.00006. ЧВК 5266712. PMID 28184187.
- ^ Летерье С (февраль 2018 г.). «Начальный сегмент аксона: обновленная точка зрения». Журнал неврологии. 38 (9): 2135–2145. Дои:10.1523 / jneurosci.1922-17.2018. ЧВК 6596274. PMID 29378864.
- ^ Расбанд М.Н. (август 2010 г.). «Начальный сегмент аксона и поддержание полярности нейронов». Обзоры природы. Неврология. 11 (8): 552–62. Дои:10.1038 / nrn2852. PMID 20631711. S2CID 23996233.
- ^ а б c d Джонс С.Л., Свиткина Т.М. (2016). «Цитоскелет начального сегмента аксона: архитектура, развитие и роль в полярности нейронов». Нейронная пластичность. 2016: 6808293. Дои:10.1155/2016/6808293. ЧВК 4967436. PMID 27493806.
- ^ Кларк Б.Д., Голдберг Е.М., Руди Б. (декабрь 2009 г.). «Электрогенная настройка начального сегмента аксона». Нейробиолог. 15 (6): 651–68. Дои:10.1177/1073858409341973. ЧВК 2951114. PMID 20007821.
- ^ а б Ямада Р., Куба Х (2016). «Структурная и функциональная пластичность в начальном сегменте аксона». Границы клеточной неврологии. 10: 250. Дои:10.3389 / fncel.2016.00250. ЧВК 5078684. PMID 27826229.
- ^ а б Сусуки К., Куба Х (март 2016 г.). «Активно-зависимая регуляция возбудимых аксональных доменов». Журнал физиологических наук. 66 (2): 99–104. Дои:10.1007 / s12576-015-0413-4. PMID 26464228. S2CID 18862030.
- ^ а б c d е Альбертс Б. (2004). Essential Cell Biology: введение в молекулярную биологию клетки (2-е изд.). Нью-Йорк: Гарленд. стр.584–587. ISBN 978-0-8153-3481-1.
- ^ а б Альбертс Б. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк: Гарленд. С. 979–981. ISBN 978-0-8153-4072-0.
- ^ Озген, Н; Барон, W; Hoekstra, D; Кахья, Н. (сентябрь 2016 г.). «Динамика олигодендроглиальной мембраны в связи с биогенезом миелина». Клеточные и молекулярные науки о жизни. 73 (17): 3291–310. Дои:10.1007 / s00018-016-2228-8. ЧВК 4967101. PMID 27141942.
- ^ Сэдлер, Т. (2010). Медицинская эмбриология Лангмана (11-е изд.). Филадельфия: Липпинкотт Уильям и Уилкинс. п.300. ISBN 978-0-7817-9069-7.
- ^ Гесс А., Янг Дж. З. (ноябрь 1952 г.). «Узлы Ранвье». Труды Лондонского королевского общества. Серия B, Биологические науки. Серия Б. 140 (900): 301–20. Bibcode:1952RSPSB.140..301H. Дои:10.1098 / rspb.1952.0063. JSTOR 82721. PMID 13003931. S2CID 11963512.
- ^ Роббинс А.А., Фокс С.Е., Холмс Г.Л., Скотт Р.К., Барри Дж. М. (ноябрь 2013 г.). «Кратковременные сигналы, записанные внеклеточно у свободно движущихся крыс, представляют активность аксонов». Границы в нейронных цепях. 7 (181): 181. Дои:10.3389 / fncir.2013.00181. ЧВК 3831546. PMID 24348338.
- ^ Rongjing Ge, Hao Qian и Jin-Hui Wang * (2011) Molecular Brain 4 (19), 1 ~ 11
- ^ Rongjing Ge, Hao Qian, Na Chen и Jin-Hui Wang * (2014) Molecular Brain 7 (26): 1-16
- ^ Чен Н, Ю Дж, Цянь Х, Ге Р, Ван Дж Х (июль 2010 г.). «Аксоны усиливают соматические неполные спайки до однородных амплитуд в пирамидных нейронах коры головного мозга мышей». PLOS ONE. 5 (7): e11868. Bibcode:2010PLoSO … 511868C. Дои:10.1371 / journal.pone.0011868. ЧВК 2912328. PMID 20686619.
- ^ Вольперт, Льюис (2015). Принципы развития (5-е изд.). С. 520–524. ISBN 978-0-19-967814-3.
- ^ Флетчер Т.Л., Банкир Г.А. (декабрь 1989 г.). «Установление полярности нейронами гиппокампа: взаимосвязь между стадией развития клетки in situ и ее последующим развитием в культуре». Биология развития. 136 (2): 446–54. Дои:10.1016/0012-1606(89)90269-8. PMID 2583372.
- ^ Цзян Х., Рао Й. (май 2005 г.). «Формирование аксона: судьба против роста». Природа Неврология. 8 (5): 544–6. Дои:10.1038 / nn0505-544. PMID 15856056. S2CID 27728967.
- ^ Гослин К., Банкир Г. (апрель 1989 г.). «Экспериментальные наблюдения за развитием полярности нейронов гиппокампа в культуре». Журнал клеточной биологии. 108 (4): 1507–16. Дои:10.1083 / jcb.108.4.1507. ЧВК 2115496. PMID 2925793.
- ^ Lamoureux P, Ruthel G, Buxbaum RE, Heidemann SR (ноябрь 2002 г.). «Механическое напряжение может определять судьбу аксонов в нейронах гиппокампа». Журнал клеточной биологии. 159 (3): 499–508. Дои:10.1083 / jcb.200207174. ЧВК 2173080. PMID 12417580.
- ^ а б Аримура Н., Кайбути К. (март 2007 г.). «Полярность нейронов: от внеклеточных сигналов к внутриклеточным механизмам». Обзоры природы. Неврология. 8 (3): 194–205. Дои:10.1038 / номер 2056. PMID 17311006. S2CID 15556921.
- ^ Нейроглия и пионерные нейроны express UNC-6 для предоставления глобальных и локальных сетевых сигналов для управления миграциями в C. elegans
- ^ Серафини Т., Кеннеди Т.Э., Галко М.Дж., Мирзаян С., Джессел Т.М., Тесье-Лавин М. (август 1994 г.). «Нетрины определяют семейство белков, способствующих отрастанию аксонов, гомологичных C. elegans UNC-6». Клетка. 78 (3): 409–24. Дои:10.1016/0092-8674(94)90420-0. PMID 8062384. S2CID 22666205.
- ^ Хонг К., Хинк Л., Нишияма М., Пу М.М., Тесье-Лавин М., Штейн Э. (июнь 1999 г.). «Управляемая лигандом ассоциация между цитоплазматическими доменами рецепторов семейства UNC5 и DCC превращает индуцированное нетрином притяжение конуса роста в отталкивание». Клетка. 97 (7): 927–41. Дои:10.1016 / S0092-8674 (00) 80804-1. PMID 10399920. S2CID 18043414.
- ^ Hedgecock EM, Culotti JG, Hall DH (январь 1990 г.). «Гены unc-5, unc-6 и unc-40 управляют периферической миграцией первичных аксонов и мезодермальных клеток по эпидермису C. elegans». Нейрон. 4 (1): 61–85. Дои:10.1016 / 0896-6273 (90) 90444-К. PMID 2310575. S2CID 23974242.
- ^ Хуанг Э.Дж., Райхардт Л.Ф. (2003). «Рецепторы Trk: роли в передаче сигнала нейронов». Ежегодный обзор биохимии. 72: 609–42. Дои:10.1146 / annurev.biochem.72.121801.161629. PMID 12676795. S2CID 10217268.
- ^ а б Да Силва Дж. С., Хасегава Т., Мияги Т., Дотти К. Г., Абад-Родригес Дж. (Май 2005 г.). «Активность асимметричной мембранной ганглиозидной сиалидазы определяет судьбу аксонов». Природа Неврология. 8 (5): 606–15. Дои:10.1038 / nn1442. PMID 15834419. S2CID 25227765.
- ^ Брадке Ф., Дотти К.Г. (март 1999 г.). «Роль локальной нестабильности актина в формировании аксонов». Наука. 283 (5409): 1931–4. Bibcode:1999Научный … 283.1931B. Дои:10.1126 / science.283.5409.1931. PMID 10082468.
- ^ Ферли А.Дж., Мортон С.Б., Манало Д., Карагогеос Д., Додд Дж., Джессел Т.М. (апрель 1990 г.). «Аксональный гликопротеин TAG-1 является членом суперсемейства иммуноглобулинов с активностью, способствующей росту нейритов». Клетка. 61 (1): 157–70. Дои:10.1016/0092-8674(90)90223-2. PMID 2317872. S2CID 28813676.
- ^ Альбертс, Брюс (2015). Молекулярная биология клетки (Шестое изд.). п. 947. ISBN 9780815344643.
- ^ Куник Д., Дион С., Одзаки Т., Левин Л.А., Константино С. (2011). «Лазерная пересечение одного аксона для исследований повреждения и регенерации аксонов с высоким содержанием аксонов». PLOS ONE. 6 (11): e26832. Bibcode:2011PLoSO … 626832K. Дои:10.1371 / journal.pone.0026832. ЧВК 3206876. PMID 22073205.
- ^ Schwab ME (февраль 2004 г.). «Регенерация ног и аксонов». Текущее мнение в нейробиологии. 14 (1): 118–24. Дои:10.1016 / j.conb.2004.01.004. PMID 15018947. S2CID 9672315.
- ^ Гензель Дж. К., Накамура С., Гуан З., ван Ройен Н., Анкени Д. П., Попович П. Г. (март 2009 г.). «Макрофаги способствуют регенерации аксонов с одновременной нейротоксичностью». Журнал неврологии. 29 (12): 3956–68. Дои:10.1523 / JNEUROSCI.3992-08.2009. ЧВК 2693768. PMID 19321792.
- ^ Майерс К.А., Баас П.В. (сентябрь 2007 г.). «Кинезин-5 регулирует рост аксона, действуя как тормоз на его массив микротрубочек». Журнал клеточной биологии. 178 (6): 1081–91. Дои:10.1083 / jcb.200702074. ЧВК 2064629. PMID 17846176.
- ^ Ришал И., Кам Н., Перри Р. Б., Шиндер В., Фишер Е. М., Скьяво Г., Файнзильбер М. (июнь 2012 г.). «Механизм с приводом от двигателя для измерения длины клетки». Отчеты по ячейкам. 1 (6): 608–16. Дои:10.1016 / j.celrep.2012.05.013. ЧВК 3389498. PMID 22773964.
- ^ Карамчед Б.Р., Бресслофф ПК (май 2015 г.). «Модель отсроченной обратной связи для измерения длины аксонов». Биофизический журнал. 108 (9): 2408–19. Bibcode:2015BpJ … 108.2408K. Дои:10.1016 / j.bpj.2015.03.055. ЧВК 4423051. PMID 25954897.
- ^ Бресслов П.С., Карамчед Б.Р. (2015). «Механизм частотно-зависимого декодирования для определения длины аксона». Границы клеточной неврологии. 9: 281. Дои:10.3389 / fncel.2015.00281. ЧВК 4508512. PMID 26257607.
- ^ Фольц Ф., Веттманн Л., Мориджи Г., Круз К. (май 2019 г.). «Звук роста аксона». Физический обзор E. 99 (5–1): 050401. arXiv:1807.04799. Bibcode:2019PhRvE..99e0401F. Дои:10.1103 / PhysRevE.99.050401. PMID 31212501.
- ^ Эндрю Б.Л., часть Нью-Джерси (апрель 1972 г.). «Свойства быстрых и медленных двигательных единиц в мышцах задних конечностей и хвоста крысы». Ежеквартальный журнал экспериментальной физиологии и когнитивных медицинских наук. 57 (2): 213–25. Дои:10.1113 / expphysiol.1972.sp002151. PMID 4482075.
- ^ Рассел Нью-Джерси (январь 1980 г.). «Скорость аксональной проводимости изменяется после тенотомии мышц или деафферентации во время развития у крысы». Журнал физиологии. 298: 347–60. Дои:10.1113 / jphysiol.1980.sp013085. ЧВК 1279120. PMID 7359413.
- ^ Покок Г., Ричардс С.Д. и др. (2004). Физиология человека (2-е изд.). Нью-Йорк: Издательство Оксфордского университета. С. 187–189. ISBN 978-0-19-858527-5.
- ^ Dawodu ST (16 августа 2017 г.). «Травматическая травма головного мозга (ЧМТ) — определение, эпидемиология, патофизиология». Medscape. В архиве с оригинала 12 июня 2018 г.. Получено 14 июля 2018.
- ^ Травма и валлеровская дегенерация В архиве 2 мая 2006 г. Wayback Machine, Калифорнийский университет в Сан-Франциско
- ^ Coleman MP, Freeman MR (1 июня 2010 г.). «Валлеровское вырождение, мир (а) и сущность». Ежегодный обзор нейробиологии. 33 (1): 245–67. Дои:10.1146 / annurev-neuro-060909-153248. ЧВК 5223592. PMID 20345246.
- ^ Джилли Дж., Член парламента Коулмана (январь 2010 г.). «Эндогенный Nmnat2 является важным фактором выживания для поддержания здоровья аксонов». PLOS Биология. 8 (1): e1000300. Дои:10.1371 / journal.pbio.1000300. ЧВК 2811159. PMID 20126265.
- ^ Кремер-Альберс Е.М., Гериг-Бургер К., Тиле С., Троттер Дж., Наве К.А. (ноябрь 2006 г.). «Нарушенные взаимодействия мутантного протеолипидного белка / DM20 с холестерином и липидными рафтами в олигодендроглии: последствия для дисмиелинизации при спастической параплегии». Журнал неврологии. 26 (45): 11743–52. Дои:10.1523 / JNEUROSCI.3581-06.2006. ЧВК 6674790. PMID 17093095.
- ^ Маталон Р., Михалс-Маталон К., Сурендран С., Тайринг С.К. (2006). «Болезнь Канавана: исследования на нокаутной мыши». N-ацетиласпартат. Adv. Exp. Med. Биол. Успехи экспериментальной медицины и биологии. 576. С. 77–93, обсуждение 361–3. Дои:10.1007/0-387-30172-0_6. ISBN 978-0-387-30171-6. PMID 16802706. S2CID 44405442.
- ^ Ткачев Д., Миммак М.Л., Хаффакер С.Дж., Райан М., Bahn S (август 2007 г.). «Дальнейшие доказательства изменения биосинтеза миелина и глутаматергической дисфункции при шизофрении». Международный журнал нейропсихофармакологии. 10 (4): 557–63. Дои:10.1017 / S1461145706007334. PMID 17291371.
- ^ «Травма головного мозга, травматическая». Медциклопедия. GE. Архивировано из оригинал 26 мая 2011 г.
- ^ Райт Д.К., Брэди Р.Д., Камнакш А., Трезизе Дж., Сан М., Макдональд С.Дж. и др. (Октябрь 2019 г.). «Повторные легкие черепно-мозговые травмы вызывают стойкие изменения белков плазмы и биомаркеров магнитно-резонансной томографии у крыс». Научные отчеты. 9 (1): 14626. Дои:10.1038 / с41598-019-51267-ш. ЧВК 6787341. PMID 31602002.
- ^ Палец S (1994). Истоки нейробиологии: история исследований функций мозга. Издательство Оксфордского университета. п. 47. ISBN 9780195146943. OCLC 27151391.
Келликер дал название аксону в 1896 году.
- ^ Грант G (декабрь 2006 г.). «Нобелевские премии 1932 и 1944 годов по физиологии и медицине: награды за новаторские исследования в области нейрофизиологии». Журнал истории неврологии. 15 (4): 341–57. Дои:10.1080/09647040600638981. PMID 16997762. S2CID 37676544.
- ^ Хелье, Дженнифер Л. (16 декабря 2014 г.). Мозг, нервная система и их болезни [3 тома]. ABC-CLIO. ISBN 9781610693387. В архиве из оригинала 14 марта 2018 г.
- ^ Хсу К., Теракава С. (июль 1996 г.). «Фенестрация в миелиновой оболочке нервных волокон креветки: новый узел возбуждения для скачкообразной проводимости». Журнал нейробиологии. 30 (3): 397–409. Дои:10.1002 / (SICI) 1097-4695 (199607) 30: 3 <397 :: AID-NEU8> 3.0.CO; 2- #. PMID 8807532.
- ^ Зальцер Дж. Л., Залц Б. (октябрь 2016 г.). «Миелинизация». Текущая биология. 26 (20): R971 – R975. Дои:10.1016 / j.cub.2016.07.074. PMID 27780071.
- ^ а б Хёффлин Ф., Джек А., Ридель С., Мак-Бухер Дж., Роос Дж., Корчелли С. и др. (2017). «Неоднородность начального сегмента аксона в интернейронах и пирамидных клетках зрительной коры грызунов». Границы клеточной неврологии. 11: 332. Дои:10.3389 / fncel.2017.00332. ЧВК 5684645. PMID 29170630.
внешняя ссылка
- Гистологическое изображение: 3_09 в Центре медицинских наук Университета Оклахомы — «Слайд 3 Спинной мозг «
Распространение потенциала действия по аксону
Нейрон состоит из одного аксона, тела и нескольких дендритов
Аксон — (AX) — (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Потенциа́л де́йствия аксона — волна возбуждения, перемещающаяся по биологической мембране живой клетки в виде кратковременного изменения мембранного потенциала на небольшом участке возбудимой клетки (нейрона, в результате которого наружная поверхность этого участка становится отрицательно заряженной по отношению к соседним участкам мембраны, в то время, как в покое она заряжена положительно. Потенциал действия является физиологической основой проведения нервного импульса, например, светового сигнала фоторецепторов сетчатки глаза в мозг.
Строение нейрона[править | править код]
| Аксоны
(Свет снизу) |
|---|
|
Рис. A.[1]
Стрелка и пунткирна линия — внешняя пограничная мембрана
|
Нейрон состоит из одного аксона (см. Ax рис.A), тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная (гладкая) эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[2]
Анатомия[править | править код]
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[3]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология[править | править код]
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня.[4]
Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в материале — например, волокна автономной нервной системы
Двигательная функция[править | править код]
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[5][6] | Intrafusal muscle fibers |
Сенсорная функция[править | править код]
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция[править | править код]
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[7] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона[править | править код]
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История[править | править код]
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана[править | править код]
-
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [8].
См. также[править | править код]
- Сенсорные нервы
- Сенсорный рецептор
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания[править | править код]
- ↑ https://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Retina_layers.svg
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Савельев А. В. Моделирование логики самоорганизации активности нервного пучка эфаптическими взаимодействиями аксонного уровня // сб.: Моделирование неравновесных систем. — Институт вычислительного моделирования СО РАН, Красноярск, 2004. — С. 142-143.
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
|
Шаблон: п·о·и Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома • Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны • Псевдополярные нейроны • Мультиполярные нейроны • Пирамидальный нейрон • Клетка Пуркинье • Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA • GVA • SSA • SVA • Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE • GVE • SVE • Верхний моторный нейрон • Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс | Нейропиль • Синаптический пузырек • Нервно-мышечный синапс • Электрический синапс • Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор | Чувствительное тельце Мейснера • Нервное окончание Меркеля • Тельца Пачини • Окончание Руффини • Нервномышечное веретено • Свободное нервное окончание • Обонятельный нейрон • Фоторецепторные клетки • Волосковые клетки • Вкусовая луковица |
| Нейроглия | Астроциты (Радиальная глия) • Олигодендроглиоциты • Клетки эпендимы (Танициты) • Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна • Невролемма • Перехват Ранвье/Межузловой сегмент • Насечка миелина |
| Соединительная ткань | Эпиневрий • Периневрий • Эндоневрий • Нервные пучки • Оболочки мозга |
| ∘ ∘ ∘ |
https://ru.wikipedia.org/wiki/%D0%90%D0%BA%D1%81%D0%BE%D0%BD
Нейрон состоит из одного аксона, тела и нескольких дендритов,
Аксон (греч. ἀξον — ось) — нервное волокно, длинная, вытянутая часть нервной клетки (нейрона), отросток или нейрит, элемент, который проводит электрические импульсы далеко от тела нейрона (сомы).
Строение нейрона
Нейрон состоит из одного аксона, тела и нескольких дендритов, в зависимости от числа которых нервные клетки делятся на униполярные, биполярные, мультиполярные. Передача нервного импульса происходит от дендритов (или от тела клетки) к аксону. Если аксон в нервной ткани соединяется с телом следующей нервной клетки, такой контакт называется аксо-соматическим, с дендритами — аксо-дендритический, с другим аксоном — аксо-аксональный (редкий тип соединения, встречается в ЦНС, участвует в обеспечении тормозных рефлексов).
В месте соединения аксона с телом нейрона находится аксонный холмик — именно здесь происходит преобразование постсинаптического потенциала нейрона в нервные импульсы, для чего требуется совместная работа натриевых, кальциевых и как минимум трех типов калиевых каналов.
Питание и рост аксона зависят от тела нейрона: при перерезке аксона его периферическая часть отмирает, а центральная сохраняет жизнеспособность. При диаметре в несколько микрон длина аксона может достигать у крупных животных 1 метра и более (например, аксоны, идущие от нейронов спинного мозга в конечности). У многих животных (кальмаров, рыб, кольчатых червей, форонид, ракообразных) встречаются гигантские аксоны толщиной в сотни мкм (у кальмаров — до 2-3 мм). Обычно такие аксоны отвечают за проведение сигналов к мышцам. обеспечивающим «реакцию бегства» (втягивание в норку, быстрое плавание и др.). При прочих равных условиях с увеличением диаметра аксона увеличивается скорость проведения по нему нервных импульсов.
В протоплазме аксона — аксоплазме — имеются тончайшие волоконца — нейрофибриллы, а также микротрубочки, митохондрии и агранулярная(гладкая)эндоплазматическая сеть. В зависимости от того, покрыты ли аксоны миелиновой (мякотной) оболочкой или лишены её, они образуют мякотные или безмякотные нервные волокна.
Миелиновая оболочка аксонов имеется только у позвоночных. Её образуют «накручивающиеся» на аксон специальные шванновские клетки, между которыми остаются свободные от миелиновой оболочки участки — перехваты Ранвье. Только на перехватах присутствуют потенциал-зависимые натриевые каналы и заново возникает потенциал действия. При этом нервный импульс распространяется по миелинизированным волокнам ступенчато, что в несколько раз повышает скорость его распространения.
Концевые участки аксона — терминали — ветвятся и контактируют с другими нервными, мышечными или железистыми клетками. На конце аксона находится синаптическое окончание — концевой участок, контактирующий с клеткой-мишенью. Вместе с постсинаптической мембраной клетки-мишени синаптическое окончание образует синапс. Через синапсы передаётся возбуждение.[1]
Анатомия
Аксоны — в действительности первичные линии передачи сигналов нервной системы, и как связки они помогают составлять нервные волокна. Индивидуальные аксоны являются микроскопическими в диаметре (типично 1 мкм в сечении), но могут достигать нескольких метров. Самые длинные аксоны в человеческом теле, например, аксоны седалищного нерва, которые простираются от позвоночника к большому пальцу ноги. Эти волокна единственной ячейки седалищного нерва могут увеличиться до метра или еще длинее.[2]
У позвоночных животных, аксоны многих нейронов вложены в ножны в миелине, который сформирован любым из двух типов глиальных ячеек: Ячейки Schwann ensheathing периферийные нейроны и oligodendrocytes изолирование таковых из центральной нервной системы. По myelinated волокнам нерва, промежутки в ножнах, известных, поскольку узлы Ranvier происходят в равномерно-раздельных интервалах. Myelination имеют очень быстрый способ электрического распространения импульса, названного скачкообразным. Demyelination аксоны, который вызывает множество неврологических признаков, типичных для заболевания под названием «рассеянный склероз». Аксоны некоторой ветви нейронов, формирующие имущественные залоги аксона, могут быть разделены на множество меньших ветвей, названных telodendria. По ним bifurcated импульс распространяются одновременно, для сигнализиции больше, чем одной ячейки другую ячейку.
Физиология
Физиология может быть описана Моделью Hodgkin-Huxley, распространённой на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Периферийные волокна нерва могут быть классифицированы на основанные, на аксонально-скоростные проводимости, mylenation, размеры волокна и т.д. Например, есть медленное проведение unmyelinated С fibers волокна и более быстрое проведение myelinated Aδ fibers волокна. Более сложное математическое моделирование проводится сегодня. Есть несколько типов сенсорных — таких как motorfibers. Другие волокна, не упомянутые в матеоиале — например, волокна автономной нервной системы
Двигательная функция
В таблице паказаны моторные нейроны, которые имеют два вида волокон:
| Тип | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные мускульные волокна |
|---|---|---|---|---|---|
| α | Aα | 13-20 мкм | Yes | 80-120 m/s | Extrafusal muscle fibers |
| γ | Aγ | 5-8 мкм | Yes | 4-24 m/s[3][4] | Intrafusal muscle fibers |
Сенсорная функция
Различные сенсорные рецепторы возбуждаются различными типами волокон нерва. Proprioceptors возбуждены типом Ia, Ib и II сенсорными волокнами, механорецепторы — типом II и III сенсорными волокнами и типом nociceptors и thermoreceptors.
| Типы | Классификация | Диаметр | Миелин | Скорость проводимости | Связанные сенсорные рецепторы |
|---|---|---|---|---|---|
| Ia | Aα | 13-20 мкм | Yes | 80-120 m/s | Primary receptors of muscle spindle |
| Ib | Aα | 13-20 мкм | Yes | 80-120 m/s | Golgi tendon organ |
| II | Aβ | 6-12 мкм | Yes | 33-75 m/s | Secondary receptors of muscle spindle All cutaneous mechanoreceptors |
| III | Aδ | 1-5 мкм | Thin | 3-30 m/s | Free nerve endings of touch and pressure Nociceptors of neospinothalamic tract Cold thermoreceptors |
| IV | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s | Nociceptors of paleospinothalamic tract Warmth receptors |
Автономная функция
Автономная нервная система имеет два вида периферийных волокон:
| Typы | Классификация | Диаметр | Миелин[5] | Скорость проводимости |
|---|---|---|---|---|
| preganglionic fibers | B | 1-5 мкм | Yes | 3-15 m/s |
| postganglionic fibers | C | 0.2-1.5 мкм | No | 0.5-2.0 m/s |
Рост и развитие аксона
Нейрон
Рост аксонов происходит через их окружающую среду, в виде конуса роста, который находится в наконечнике аксона. Конус роста имеет широкий лист как расширение, названное lamellipodia, которое содержат выпячивания, названные filopodia. Filopodia — механизм, представляющий процесс придержки поверхностей. Он анализирует ближайшую окружающую среду. Актин играет главную роль в подвижности этой системы. Окружающие среды с высокими уровнями молекул прилипания ячейки или «КУЛАКА» создают идеальную окружающую среду для аксонального роста. Это, кажется, обеспечивает «липкую» поверхность для аксонов, для раста вперед. Примеры КУЛАКА, определенного для нервных систем включают: N-КУЛАК, neuroglial КУЛАК или NgCAM, ПОМЕТЬТЕ 1, МЭГ, и DCC, все из которых — часть суперсемьи иммуноглобулина. Другой набор молекул звонковый, внеклеточные матричные молекулы прилипания также обеспечивают липкое основание для аксонов, чтобы расти вперед. Примеры этих молекул включают laminin, fibronectin, tenascin, и perlecan. Некоторые из них — поверхность, привязанная к ячейкам и таким образом действуют, как короткие аттрактанты диапазона или repellents. Другие — difusible лиганды и таким образом могут долго сохранять эффекты диапазона.
Ячейки звонковые, ячейки указательного столба помогают в руководстве ростом аксона нейронала. Эти ячейки — типично другой, иногда незрелый, нейроны.
История
Часть первой внутриклеточной регистрации в нервной системе была сделана в конце 1930-ых учёными K. Капуста и H. Куртис. Алан Ходгкин и Эндрю Хакслей также использовали аксон гиганта кальмара (1939), и в 1952 они получили полное количественное описание действия ионного основания потенциала, введя формулировку Модели Hodgkin-Huxley. Ходгкину и Хакслей, были предтавлены совместно на паолучение Нобелевской премии по этой работе в 1963. Формулы, детализирующие аксональную проводимость были расширены на позвоночных животных в уравнениях Frankenhaeuser-Huxley. Erlanger и Gasser ранее развивали систему классификации для периферийного[5] волокна нерва, основанные на аксональной скорости проводимости, myelination, размере волокна и т.д. Даже и сейчас наше понимание биохимического процесса распространения действия потенциала продвинулось, и теперь он включает много деталей об индивидуальных каналах иона.
Рана
Основная статья: Рана
На серьёзном уровне, рана нерва может быть описана как neuropraxia, axonotmesis, или neurotmesis. Сотрясение мозга считают умеренной формой разбросанной аксональной раны [6].
См. также
- Сенсорные нервы
- Сенсорный рецептор
- Нейрон
- Аксональный поиск пути
- Аксональный транспорт
- Аксон-рефлекс
- Конус роста
- Дендрит
- Валлерова дегенерация — при разрыве аксона
Примечания
- ↑ http://en.wikipedia.org/wiki/Axon
- ↑ DNA From The Beginning, section 6: Genes are real things., «Amination» section, final slide
- ↑ Andrew BL, Part NJ (1972) Properties of fast and slow motor units in hind limb and tail muscles of the rat. Q J Exp Physiol Cogn Med Sci 57:213-225.
- ↑ Russell NJ (1980) Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat. J Physiol 298:347-360.
- ↑ pp.187-9 ISBN 0-19-858527-6
- ↑ eMedicine — Traumatic Brain Injury: Definition, Epidemiology, Pathophysiology : Article by Segun T Dawodu, MD, FAAPMR, FAANEM, CIME, DipMI(RCSed)
Гистология: Нервная ткань |
|
|---|---|
| Нейроны (Серое вещество) |
Сома · Аксон (Аксонный холмик, Терминаль аксона, Аксоплазма, Аксолемма, Нейрофиламенты) Дендрит (Вещество Ниссля, Дендритный шипик, Апикальный дендрит, Базальный дендрит) типы: Биполярные нейроны · Псевдополярные нейроны · Мультиполярные нейроны · Пирамидальный нейрон · Клетка Пуркинье · Гранулярная клетка |
| Афферентный нерв/ Сенсорный нерв/ Сенсорный нейрон |
GSA · GVA · SSA · SVA · Нервные волокна (Мышечные веретёна (Ia), Нервно-сухожильное веретено, II or Aβ, Aδ-волокна, C-волокна) |
| Эфферентный нерв/ Моторный нерв/ Моторный нейрон |
GSE · GVE · SVE · Верхний моторный нейрон · Нижний моторный нейрон (α мотонейроны, γ мотонейроны) |
| Синапс |
Нейропиль · Синаптический пузырек · Нервно-мышечный синапс · Электрический синапс · Интернейрон (Клетки Реншоу) |
| Сенсорный рецептор |
Чувствительное тельце Мейснера · Нервное окончание Меркеля · Тельца Пачини · Окончание Руффини · Нервномышечное веретено · Свободное нервное окончание · Обонятельный нейрон · Фоторецепторные клетки · Волосковые клетки · Вкусовая луковица |
| Нейроглия |
Астроциты (Радиальная глия) · Олигодендроглиоциты · Клетки эпендимы (Танициты) · Микроглия |
| Миелин (Белое вещество) |
CNS: Олигодендроцит PNS: Клетки Шванна · Невролемма · Перехват Ранвье/Межузловой сегмент · Насечка миелина |
| Соединительная ткань |
Эпиневрий · Периневрий · Эндоневрий · Нервные пучки · Оболочки мозга |