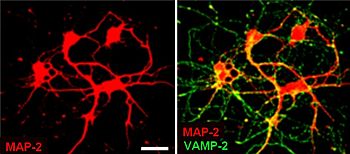
Нервная ткань — основная ткань, формирующая нервную систему и создающая условия для реализации ее многочисленных функций. Нервная ткань имеет эктодермальное происхождение, не принято делить нервную ткань на какие-либо виды тканей. Обладает двумя основными свойствами: возбудимостью и проводимостью.
Нейрон
Структурно-функциональной единицей нервной ткани является нейрон (от др.-греч. νεῦρον — волокно, нерв) — клетка с одним
длинным отростком — аксоном (греч. axis — ось), и одним/несколькими короткими — дендритами (греч. dendros — дерево).
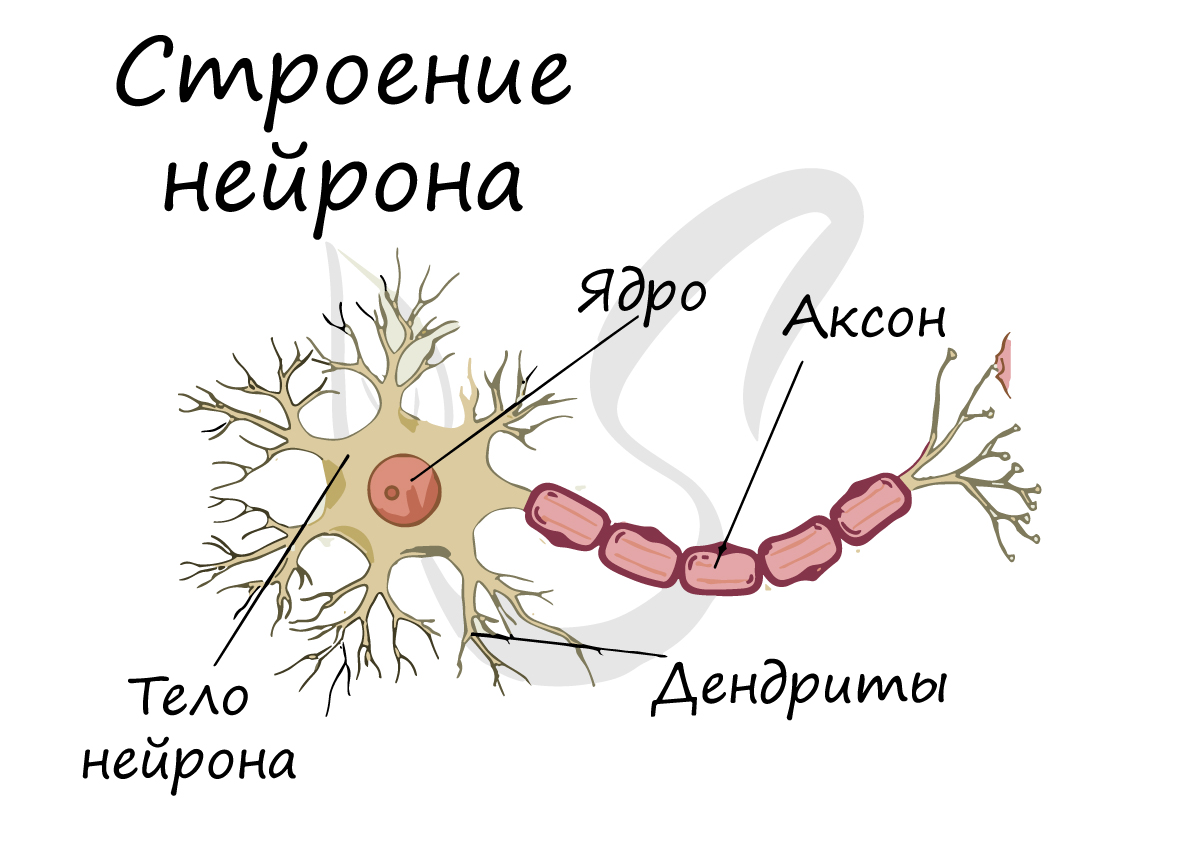
Спешу сообщить, что представление, будто короткий отросток нейрона — всегда дендрит, а длинный — всегда аксон, в корне неверно. С точки
зрения физиологии правильнее дать следующие определения: дендрит — отросток нейрона, по которому нервный импульс перемещается к телу нейрона, аксон — отросток нейрона, по которому импульс перемещается от тела нейрона.
Нейроны обладают 4 свойствами:
- Рецепция (лат. receptio — принятие) — способны воспринимать поступающие сигналы (дендриты)
- В ответ на сигналы способны переходить в состояние возбуждения или торможения
- Проведение возбуждения (от дендрита к телу нейрона, затем — к концу аксона)
- Передача сигнала другим объектам — нейрону или эффекторному органу
В физиологии эффекторным (от лат. efferes — выносящий) органом часто называют исполнительный орган или орган-мишень воздействия (мышцы, железы). Орган-эффектор выполняет те или иные «приказы» ЦНС (центральной нервной системы) или эндокринных желёз
Отростки нейронов проводят нервные импульсы и передают их другим нейронам, эффекторам, благодаря чему
мышцы сокращаются или расслабляются, а секреция желез усиливается или уменьшается.
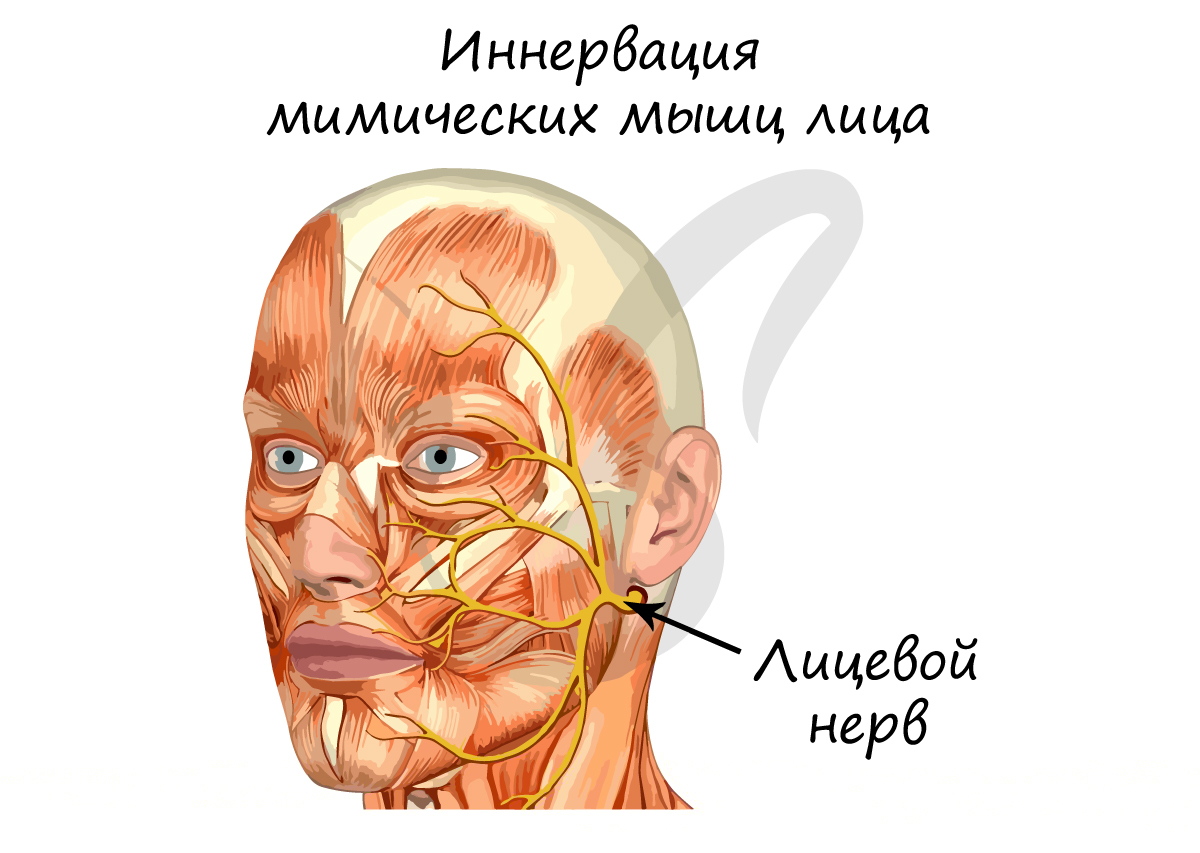
Миелиновая оболочка
Нервные волокна подразделяются на миелиновые и безмиелиновые. Нервное волокно — это один или несколько отростков нейронов (могут быть как аксоны, так и дендриты) с окружающей оболочкой.
Безмиелиновые нервные волокна находятся преимущественно в составе вегетативной нервной системы (скорость проведения 1-2 м/c). Миелиновые — образуют белое вещество головного и спинного мозга, нервные волокна соматической нервной системы (5-120 м/с).
В миелиновых нервных волокнах отростки нейронов покрыты миелиновой оболочкой (на 70-75% состоит из липидов (жиров)), которая обеспечивает изолированное проведение нервного
импульса по нерву. Если бы не было миелиновой оболочки (вообразите!) нервные импульсы распространялись бы хаотично, и,
когда мы хотели сделать движение рукой, то вместе с рукой двигалась бы нога.
Существует болезнь при которой собственные антитела уничтожают миелиновую оболочку нервных волокон головного и спинного мозга (случаются и такие сбои в работе организма). Эта
болезнь — рассеянный склероз, по мере прогрессирования приводит к разрушению не только миелиновой оболочки, но и нервов — а значит,
происходит атрофия мышц и человек постепенно становится обездвиженным.

Миелиновый слой представлен несколькими слоями мембраны глиальной клетки (леммоцит, шванновская клетка), которые закручиваются вокруг осевого цилиндра (отростка нейрона). Это закручивание хорошо видно на картинке, где изображен здоровый нерв, чуть выше 
Миелиновый слой оболочки волокна регулярно прерывается в местах стыка соседних леммоцитов — перехваты Ранвье. Миелиновая оболочка обеспечивает изолированное и более быстрое проведение возбуждения (сальтаторный тип, лат. salto — скачу, прыгаю).

Нейроглия (греч. νεῦρον — волокно, нерв + γλία — клей)
Вы уже убедились, насколько значимы нейроны, их высокая специализация приводит к возникновению особого окружения — нейроглии.
Нейроглия (глиальные клетки, глиоциты) — вспомогательная часть нервной системы, которая выполняет ряд важных функций:
- Опорная — поддерживает нейроны в определенном положении
- Регенераторная (лат. regeneratio — возрождение) — в случае повреждения нервных структур нейроглия способствует регенерации
- Трофическая (греч. trophe — питание) — с помощью нейроглии осуществляется питание нейронов: напрямую с кровью нейроны не контактируют
- Электроизоляционная — леммоциты (шванновские клетки) закручиваются вокруг отростков нейронов и формируют миелиновую оболочку
- Барьерная и защитная — изолируют нейроны от тканей внутренней среды организма
- Некоторые глиоциты секретируют цереброспинальную (спинномозговую) жидкость — ликвор (от лат. liquor — жидкость)
В состав нейроглии входят разные клетки, их в десятки раз больше чем самих нейронов. В периферическом отделе нервной
системы миелиновая оболочка, изученная нами, образуется именно из нейроглии — шванновских клеток (леммоцитов). Между ними хорошо
заметны перехваты Ранвье — участки, лишенные миелиновой оболочки, между двумя смежными шванновскими клетками.
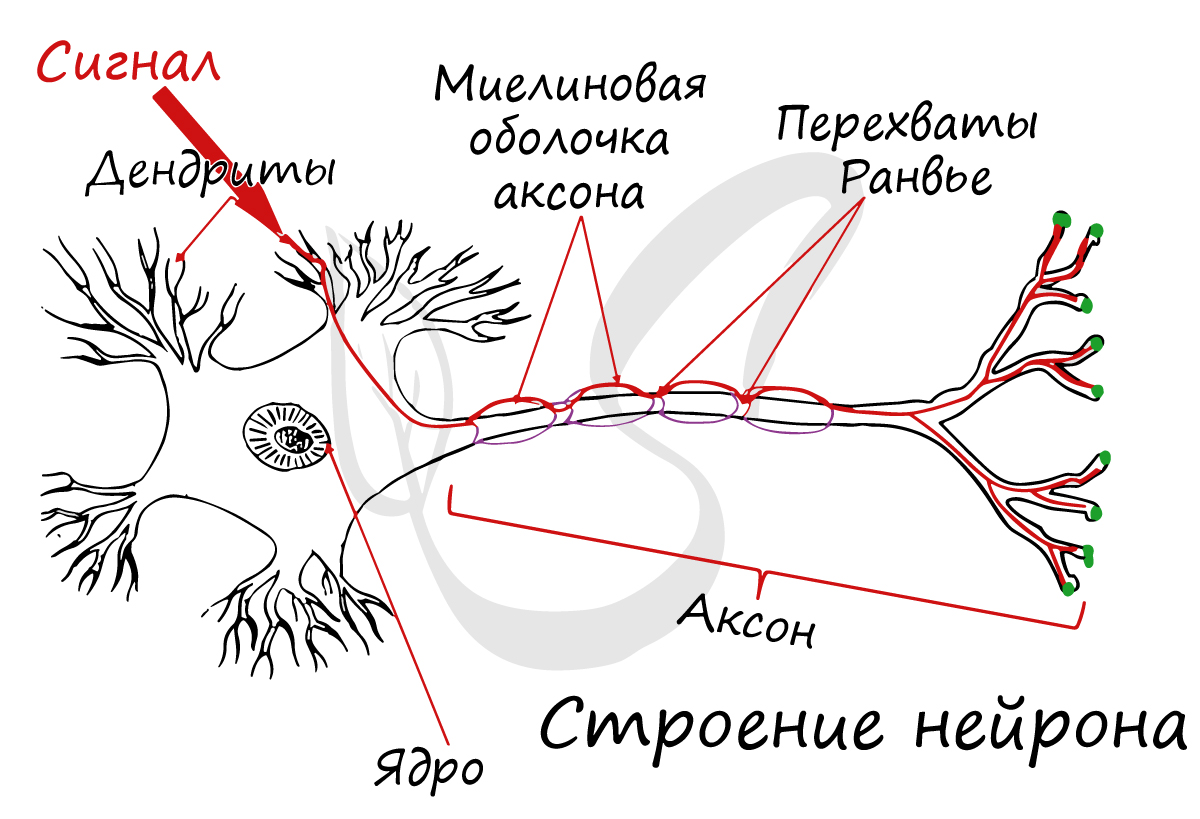
Классификация нейронов
Нейроны функционально подразделяются на чувствительные, двигательные и вставочные.
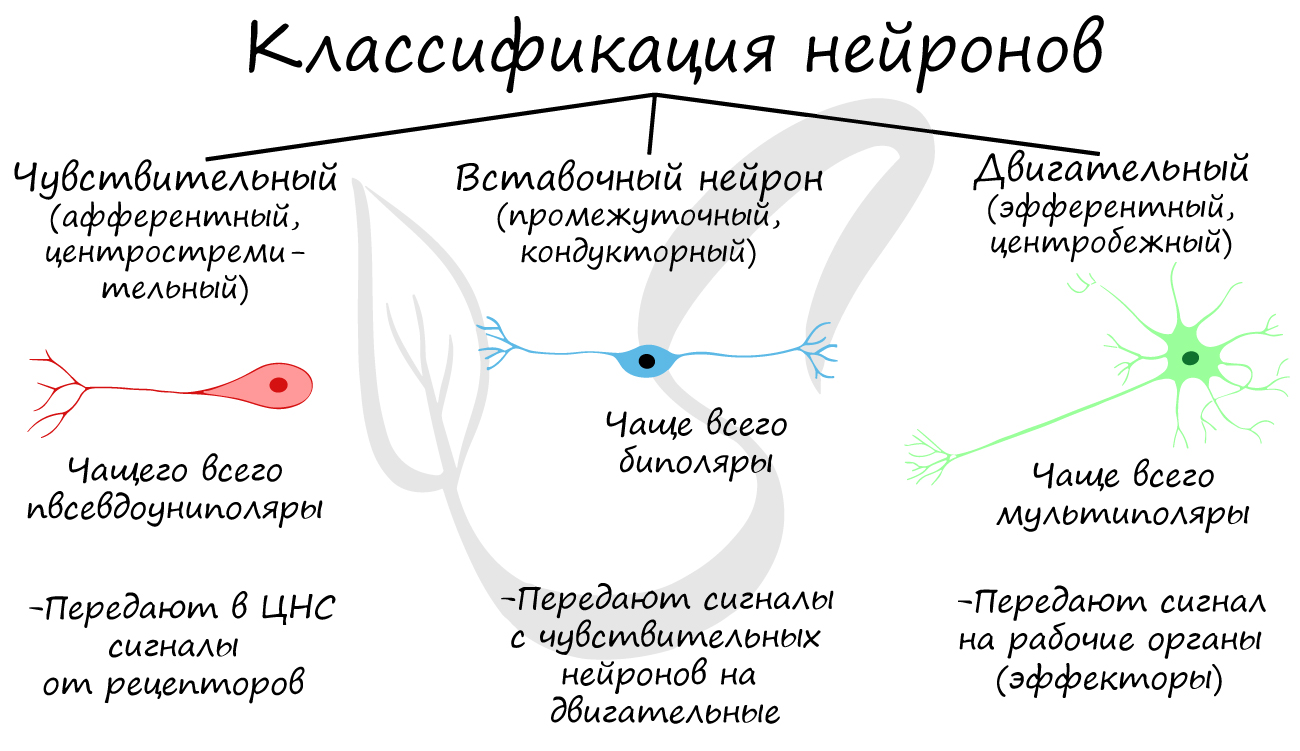
Чувствительные нейроны также называются афферентные, центростремительные, сенсорные, воспринимающие — они воспринимают раздражения, преобразуют их в нервные импульсы и передают в ЦНС. Рецептором называют концевое окончание чувствительных нервных
волокон, воспринимающих раздражитель.
Вставочные нейроны также называются промежуточные, ассоциативные — они обеспечивают связь между чувствительными и двигательными
нейронами, передают возбуждение в различные отделы ЦНС, участвуют в обработке информации и выработке команд.
Двигательные нейроны по-другому называются эфферентные, центробежные, мотонейроны — они передают нервный импульс (возбуждение) на
эффектор (рабочий орган). Наиболее простой пример взаимодействия нейронов — коленный рефлекс (однако вставочного нейрона
на данной схеме нет). Более подробно рефлекторные дуги и их виды мы изучим в разделе, посвященном нервной системе.
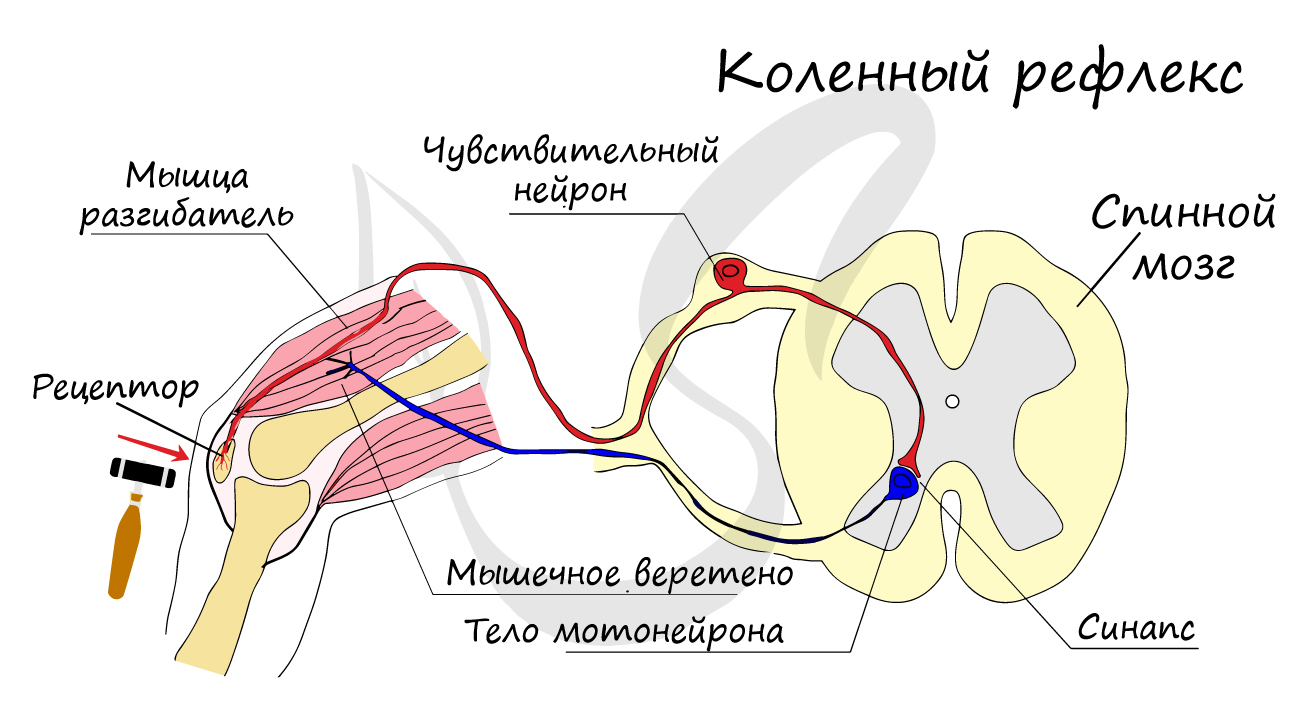
Синапс
На схеме выше вы наверняка заметили новый термин — синапс (греч. sýnapsis — соединение). Синапсом называют место контакта между двумя нейронами или между
нейроном и эффектором (органом-мишенью). В синапсе нервный импульс «преобразуется» в химический: происходит выброс особых
веществ — нейромедиаторов (наиболее известный — ацетилхолин) в синаптическую щель.
Разберем строение синапса на схеме. Его составляют пресинаптическая мембрана аксона, рядом с которой расположены везикулы (лат. vesicula — пузырек) с
нейромедиатором внутри (ацетилхолином). Если нервный импульс достигает терминали (окончания) аксона, то везикулы начинают
сливаться с пресинаптической мембраной: ацетилхолин поступает наружу, в синаптическую щель.
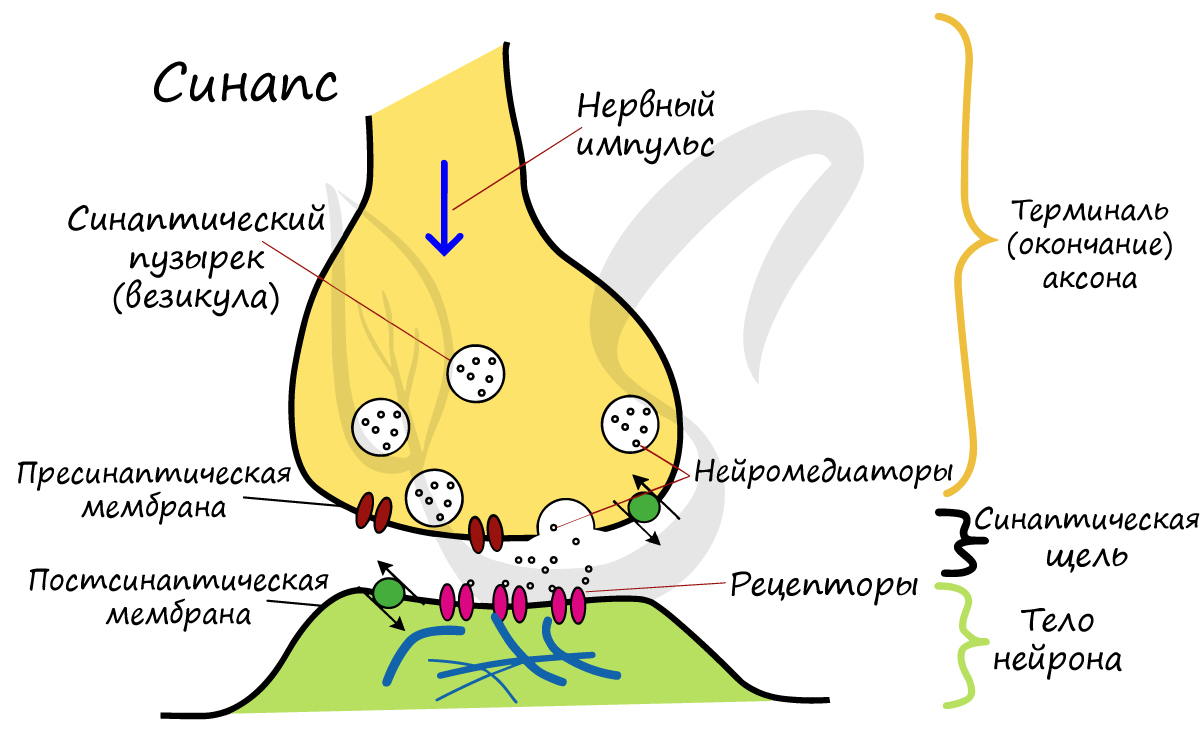
Попав в синаптическую щель, ацетилхолин связывается с рецепторами на постсинаптической мембране, таким образом, возбуждение (нервный импульс)
передается другому нейрону. Так устроена нервная система: электрический путь передачи сменяется
химическим (в синапсе).
Яд кураре
Гораздо интереснее изучать любой предмет на примерах, поэтому я постараюсь как можно чаще радовать вас ими 
историю о яде кураре, который используют индейцы для охоты с древних времен.
Этот яд блокирует ацетилхолиновые рецепторы на постсинаптической мембране, и, как следствие, химическая передача возбуждения с
одного нейрона на другой становится невозможна. Это приводит к тому, что нервные импульсы перестают поступать к эффекторам,
в том числе к дыхательным мышцам (межреберным, диафрагме), вследствие чего дыхание останавливается и наступает смерть животного.

Нервы и нервные узлы
Собираясь вместе, отростки нейронов (нервные волокна) образуют пучки нервных волокон. Нервные пучки объединяются в нервы, которые покрыты соединительнотканной оболочкой.
В случае, если тела нейронов концентрируются в одном месте за пределами центральной нервной системы, их скопления
называют нервным узлом — или ганглием (от др.-греч. γάγγλιον — узел).
В случае сложных соединений между нервными волокнами говорят о нервных сплетениях. Одно из наиболее известных —
плечевое сплетение.
Болезни нервной системы
Неврологические болезни могут развиваться в любой точке нервной системы: от этого будет зависеть клиническая картина. В случае повреждения
чувствительного пути пациент перестает чувствовать боль, холод, тепло и другие раздражители в зоне иннервации пораженного нерва, при этом
движения сохранены в полном объеме.
Если повреждено двигательное звено, движение в пораженной конечности будет
невозможно: возникает паралич, но чувствительность может сохраняться.
Существует тяжелое мышечное заболеванием — миастения (от др.-греч. μῦς — «мышца» и ἀσθένεια — «бессилие, слабость»), при
котором собственные антитела разрушают мотонейроны (двигательные нейроны).

Постепенно любые движения мышцами становятся для пациента все труднее,
становится тяжело долго говорить, повышается утомляемость. Наблюдается характерный симптом — опущение верхнего века.
Болезнь может привести к слабости диафрагмы и дыхательных мышц, вследствие чего дыхание становится невозможным.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
From Wikipedia, the free encyclopedia
| Synaptic vesicle | |
|---|---|

Neuron A (transmitting) to neuron B (receiving). |
|
| Details | |
| System | Nervous system |
| Identifiers | |
| Latin | vesicula synaptica
|
| MeSH | D013572 |
| TH | H2.00.06.2.00004 |
| Anatomical terms of microanatomy
[edit on Wikidata] |
In a neuron, synaptic vesicles (or neurotransmitter vesicles) store various neurotransmitters that are released at the synapse. The release is regulated by a voltage-dependent calcium channel. Vesicles are essential for propagating nerve impulses between neurons and are constantly recreated by the cell. The area in the axon that holds groups of vesicles is an axon terminal or «terminal bouton». Up to 130 vesicles can be released per bouton over a ten-minute period of stimulation at 0.2 Hz.[1] In the visual cortex of the human brain, synaptic vesicles have an average diameter of 39.5 nanometers (nm) with a standard deviation of 5.1 nm.[2]
Structure[edit]
Synaptic vesicles are relatively simple because only a limited number of proteins fit into a sphere of 40 nm diameter. Purified vesicles have a protein:phospholipid ratio of 1:3 with a lipid composition of 40% phosphatidylcholine, 32% phosphatidylethanolamine, 12% phosphatidylserine, 5% phosphatidylinositol, and 10% cholesterol.[4]
Synaptic vesicles contain two classes of obligatory components: transport proteins involved in neurotransmitter uptake, and trafficking proteins that participate in synaptic vesicle exocytosis, endocytosis, and recycling.
- Transport proteins are composed of proton pumps that generate electrochemical gradients, which allow for neurotransmitter uptake, and neurotransmitter transporters that regulate the actual uptake of neurotransmitters. The necessary proton gradient is created by V-ATPase, which breaks down ATP for energy. Vesicular transporters move neurotransmitters from the cells’ cytoplasm into the synaptic vesicles. Vesicular glutamate transporters, for example, sequester glutamate into vesicles by this process.
- Trafficking proteins are more complex. They include intrinsic membrane proteins, peripherally bound proteins, and proteins such as SNAREs. These proteins do not share a characteristic that would make them identifiable as synaptic vesicle proteins, and little is known about how these proteins are specifically deposited into synaptic vesicles. Many but not all of the known synaptic vesicle proteins interact with non-vesicular proteins and are linked to specific functions.[4]
The stoichiometry for the movement of different neurotransmitters into a vesicle is given in the following table.
| Neurotransmitter type(s) | Inward movement | Outward movement |
|---|---|---|
| norepinephrine, dopamine, histamine, serotonin and acetylcholine | neurotransmitter+ | 2 H+ |
| GABA and glycine | neurotransmitter | 1 H+ |
| glutamate | neurotransmitter− + Cl− | 1 H+ |
Recently, it has been discovered that synaptic vesicles also contain small RNA molecules, including transfer RNA fragments, Y RNA fragments and mirRNAs.[5] This discovery is believed to have broad impact on studying chemical synapses.
Effects of neurotoxins[edit]
Some neurotoxins, such as batrachotoxin, are known to destroy synaptic vesicles. The tetanus toxin damages vesicle-associated membrane proteins (VAMP), a type of v-SNARE, while botulinum toxins damage t-SNARES and v-SNARES and thus inhibit synaptic transmission.[6] A spider toxin called alpha-Latrotoxin binds to neurexins, damaging vesicles and causing massive release of neurotransmitters.[citation needed]
Vesicle pools[edit]
Vesicles in the nerve terminal are grouped into three pools: the readily releasable pool, the recycling pool, and the reserve pool.[7] These pools are distinguished by their function and position in the nerve terminal. The readily releasable pool are docked to the cell membrane, making these the first group of vesicles to be released on stimulation. The readily releasable pool is small and is quickly exhausted. The recycling pool is proximate to the cell membrane, and tend to be cycled at moderate stimulation, so that the rate of vesicle release is the same as, or lower than, the rate of vesicle formation. This pool is larger than the readily releasable pool, but it takes longer to become mobilised. The reserve pool contains vesicles that are not released under normal conditions. This reserve pool can be quite large (~50%) in neurons grown on a glass substrate, but is very small or absent at mature synapses in intact brain tissue.[8][9]
Physiology[edit]
The synaptic vesicle cycle[edit]
The events of the synaptic vesicle cycle can be divided into a few key steps:[10]
- 1. Trafficking to the synapse
Synaptic vesicle components are initially trafficked to the synapse using members of the kinesin motor family. In C. elegans the major motor for synaptic vesicles is UNC-104.[11] There is also evidence that other proteins such as UNC-16/Sunday Driver regulate the use of motors for transport of synaptic vesicles.[12]
- 2. Transmitter loading
Once at the synapse, synaptic vesicles are loaded with a neurotransmitter. Loading of transmitter is an active process requiring a neurotransmitter transporter and a proton pump ATPase that provides an electrochemical gradient. These transporters are selective for different classes of transmitters. Characterization of unc-17 and unc-47, which encode the vesicular acetylcholine transporter and vesicular GABA transporter have been described to date.[13]
- 3. Docking
The loaded synaptic vesicles must dock near release sites, however docking is a step of the cycle that we know little about. Many proteins on synaptic vesicles and at release sites have been identified, however none of the identified protein interactions between the vesicle proteins and release site proteins can account for the docking phase of the cycle. Mutants in rab-3 and munc-18 alter vesicle docking or vesicle organization at release sites, but they do not completely disrupt docking.[14] SNARE proteins, now also appear to be involved in the docking step of the cycle.[15]
- 4. Priming
After the synaptic vesicles initially dock, they must be primed before they can begin fusion. Priming prepares the synaptic vesicle so that they are able to fuse rapidly in response to a calcium influx. This priming step is thought to involve the formation of partially assembled SNARE complexes. The proteins Munc13, RIM, and RIM-BP participate in this event.[16] Munc13 is thought to stimulate the change of the t-SNARE syntaxin from a closed conformation to an open conformation, which stimulates the assembly of v-SNARE /t-SNARE complexes.[17] RIM also appears to regulate priming, but is not essential for the step.[citation needed]
- 5. Fusion
Primed vesicles fuse very quickly in response to calcium elevations in the cytoplasm. This fusion event is thought to be mediated directly by the SNAREs and driven by the energy provided from SNARE assembly. The calcium-sensing trigger for this event is the calcium-binding synaptic vesicle protein synaptotagmin. The ability of SNAREs to mediate fusion in a calcium-dependent manner recently has been reconstituted in vitro. Consistent with SNAREs being essential for the fusion process, v-SNARE and t-SNARE mutants of C. elegans are lethal. Similarly, mutants in Drosophila and knockouts in mice indicate that these SNARES play a critical role in synaptic exocytosis.[10]
- 6. Endocytosis
This accounts for the re-uptake of synaptic vesicles in the full contact fusion model. However, other studies have been compiling evidence suggesting that this type of fusion and endocytosis is not always the case.[citation needed]
Vesicle recycling[edit]
Two leading mechanisms of action are thought to be responsible for synaptic vesicle recycling: full collapse fusion and the «kiss-and-run» method. Both mechanisms begin with the formation of the synaptic pore that releases transmitter to the extracellular space. After release of the neurotransmitter, the pore can either dilate fully so that the vesicle collapses completely into the synaptic membrane, or it can close rapidly and pinch off the membrane to generate kiss-and-run fusion.[18]
Full collapse fusion[edit]
It has been shown that periods of intense stimulation at neural synapses deplete vesicle count as well as increase cellular capacitance and surface area.[19] This indicates that after synaptic vesicles release their neurotransmitter payload, they merge with and become part of, the cellular membrane. After tagging synaptic vesicles with HRP (horseradish peroxidase), Heuser and Reese found that portions of the cellular membrane at the frog neuromuscular junction were taken up by the cell and converted back into synaptic vesicles.[20] Studies suggest that the entire cycle of exocytosis, retrieval, and reformation of the synaptic vesicles requires less than 1 minute.[21]
In full collapse fusion, the synaptic vesicle merges and becomes incorporated into the cell membrane. The formation of the new membrane is a protein mediated process and can only occur under certain conditions. After an action potential, Ca2+ floods to the presynaptic membrane. Ca2+ binds to specific proteins in the cytoplasm, one of which is synaptotagmin, which in turn trigger the complete fusion of the synaptic vesicle with the cellular membrane. This complete fusion of the pore is assisted by SNARE proteins. This large family of proteins mediate docking of synaptic vesicles in an ATP-dependent manner. With the help of synaptobrevin on the synaptic vesicle, the t-SNARE complex on the membrane, made up of syntaxin and SNAP-25, can dock, prime, and fuse the synaptic vesicle into the membrane.[22]
The mechanism behind full collapse fusion has been shown to be the target of the botulinum and tetanus toxins. The botulinum toxin has protease activity which degrades the SNAP-25 protein. The SNAP-25 protein is required for vesicle fusion that releases neurotransmitters, in particular acetylcholine.[23] Botulinum toxin essentially cleaves these SNARE proteins, and in doing so, prevents synaptic vesicles from fusing with the cellular synaptic membrane and releasing their neurotransmitters. Tetanus toxin follows a similar pathway, but instead attacks the protein synaptobrevin on the synaptic vesicle. In turn, these neurotoxins prevent synaptic vesicles from completing full collapse fusion. Without this mechanism in effect, muscle spasms, paralysis, and death can occur.[citation needed]
«Kiss-and-run»[edit]
The second mechanism by which synaptic vesicles are recycled is known as kiss-and-run fusion. In this case, the synaptic vesicle «kisses» the cellular membrane, opening a small pore for its neurotransmitter payload to be released through, then closes the pore and is recycled back into the cell.[18] The kiss-and-run mechanism has been a hotly debated topic. Its effects have been observed and recorded; however the reason behind its use as opposed to full collapse fusion is still being explored. It has been speculated that kiss-and-run is often employed to conserve scarce vesicular resources as well as being utilized to respond to high-frequency inputs.[24] Experiments have shown that kiss-and-run events do occur. First observed by Katz and del Castillo, it was later observed that the kiss-and-run mechanism was different from full collapse fusion in that cellular capacitance did not increase in kiss-and-run events.[24] This reinforces the idea of a kiss-and-run fashion, the synaptic vesicle releases its payload and then separates from the membrane.
Modulation[edit]
Cells thus appear to have at least two mechanisms to follow for membrane recycling. Under certain conditions, cells can switch from one mechanism to the other. Slow, conventional, full collapse fusion predominates the synaptic membrane when Ca2+ levels are low, and the fast kiss-and-run mechanism is followed when Ca2+ levels are high.[citation needed]
Ales et al. showed that raised concentrations of extracellular calcium ions shift the preferred mode of recycling and synaptic vesicle release to the kiss-and-run mechanism in a calcium-concentration-dependent manner. It has been proposed that during secretion of neurotransmitters at synapses, the mode of exocytosis is modulated by calcium to attain optimal conditions for coupled exocytosis and endocytosis according to synaptic activity.[25]
Experimental evidence suggests that kiss-and-run is the dominate mode of synaptic release at the beginning of stimulus trains. In this context, kiss-and-run reflects a high vesicle release probability. The incidence of kiss-and-run is also increased by rapid firing and stimulation of the neuron, suggesting that the kinetics of this type of release is faster than other forms of vesicle release.[26]
History[edit]
With the advent of the electron microscope in the early 1950s, nerve endings were found to contain a large number of electron-lucent (transparent to electrons) vesicles.[27][28] The term synaptic vesicle was first introduced by De Robertis and Bennett in 1954.[29] This was shortly after transmitter release at the frog neuromuscular junction was found to induce postsynaptic miniature end-plate potentials that were ascribed to the release of discrete packages of neurotransmitter (quanta) from the presynaptic nerve terminal.[30][31] It was thus reasonable to hypothesize that the transmitter substance (acetylcholine) was contained in such vesicles, which by a secretory mechanism would release their contents into the synaptic cleft (vesicle hypothesis).[32][33]
The missing link was the demonstration that the neurotransmitter acetylcholine is actually contained in synaptic vesicles. About ten years later, the application of subcellular fractionation techniques to brain tissue permitted the isolation first of nerve endings (synaptosomes),[34] and subsequently of synaptic vesicles from mammalian brain. Two competing laboratories were involved in this work, that of Victor P. Whittaker at the Institute of Animal Physiology, Agricultural Research Council, Babraham, Cambridge, UK and that of Eduardo de Robertis at the Instituto de Anatomía General y Embriología, Facultad de Medicina, Universidad de Buenos Aires, Argentina.[35] Whittaker’s work demonstrating acetylcholine in vesicle fractions from guinea-pig brain was first published in abstract form in 1960 and then in more detail in 1963 and 1964,[36][37] and the paper of the de Robertis group demonstrating an enrichment of bound acetylcholine in synaptic vesicle fractions from rat brain appeared in 1963.[38] Both groups released synaptic vesicles from isolated synaptosomes by osmotic shock. The content of acetylcholine in a vesicle was originally estimated to be 1000–2000 molecules.[39] Subsequent work identified the vesicular localization of other neurotransmitters, such as amino acids, catecholamines, serotonin, and ATP. Later, synaptic vesicles could also be isolated from other tissues such as the superior cervical ganglion,[40] or the octopus brain.[41] The isolation of highly purified fractions of cholinergic synaptic vesicles from the ray Torpedo electric organ[42][43] was an important step forward in the study of vesicle biochemistry and function.
See also[edit]
- Vesicular monoamine transporter
- Synapsins
- Vesicle fusion
- Synaptosome
References[edit]
- ^ Ikeda, K; Bekkers, JM (2009). «Counting the number of releasable synaptic vesicles in a presynaptic terminal». Proc Natl Acad Sci U S A. 106 (8): 2945–50. Bibcode:2009PNAS..106.2945I. doi:10.1073/pnas.0811017106. PMC 2650301. PMID 19202060.
- ^ Qu, Lei; Akbergenova, Yulia; Hu, Yunming; Schikorski, Thomas (March 2009). «Synapse-to-synapse variation in mean synaptic vesicle size and its relationship with synaptic morphology and function». The Journal of Comparative Neurology. 514 (4): 343–352. doi:10.1002/cne.22007. PMID 19330815. S2CID 23965024. Archived from the original on 2013-01-05.
- ^ Tonna, Noemi; Bianco, Fabio; Matteoli, Michela; Cagnoli, Cinzia; Antonucci, Flavia; Manfredi, Amedea; Mauro, Nicolò; Ranucci, Elisabetta; Ferruti, Paolo (2014). «A soluble biocompatible guanidine-containing polyamidoamine as promoter of primary brain cell adhesion and in vitro cell culturing». Science and Technology of Advanced Materials. 15 (4): 045007. Bibcode:2014STAdM..15d5007T. doi:10.1088/1468-6996/15/4/045007. PMC 5090696. PMID 27877708.
- ^ a b Benfenati, F.; Greengard, P.; Brunner, J.; Bähler, M. (1989). «Electrostatic and hydrophobic interactions of synapsin I and synapsin I fragments with phospholipid bilayers». The Journal of Cell Biology. 108 (5): 1851–1862. doi:10.1083/jcb.108.5.1851. PMC 2115549. PMID 2497105.
- ^ Li, Huinan; Wu, Cheng; Aramayo, Rodolfo; Sachs, Matthew S.; Harlow, Mark L. (2015-10-08). «Synaptic vesicles contain small ribonucleic acids (sRNAs) including transfer RNA fragments (trfRNA) and microRNAs (miRNA)». Scientific Reports. 5: 14918. Bibcode:2015NatSR…514918L. doi:10.1038/srep14918. PMC 4597359. PMID 26446566.
- ^ Kandel ER, Schwartz JH, Jessell TM, eds. (2000). «Transmitter Release». Principles of Neural Science (4th ed.). New York: McGraw-Hill. ISBN 978-0-8385-7701-1.
- ^ Rizzoli, Silvio O; Betz, William J (January 2005). «Synaptic vesicle pools». Nature Reviews Neuroscience. 6 (1): 57–69. doi:10.1038/nrn1583. PMID 15611727. S2CID 7473893.
- ^ Rose, Tobias; Schoenenberger, Philipp; Jezek, Karel; Oertner, Thomas G. (2013). «Developmental Refinement of Vesicle Cycling at Schaffer Collateral Synapses». Neuron. 77 (6): 1109–1121. doi:10.1016/j.neuron.2013.01.021. PMID 23522046.
- ^ Xue, Lei; Sheng, Jiansong; Wu, Xin-Sheng; Wu, Wei; Luo, Fujun; Shin, Wonchul; Chiang, Hsueh-Cheng; Wu, Ling-Gang (2013-05-15). «Most Vesicles in a Central Nerve Terminal Participate in Recycling». Journal of Neuroscience. 33 (20): 8820–8826. doi:10.1523/jneurosci.4029-12.2013. PMC 3710729. PMID 23678124.
- ^ a b Südhof, T. C. (2004). «The Synaptic Vesicle Cycle». Annual Review of Neuroscience. 27: 509–547. doi:10.1146/annurev.neuro.26.041002.131412. PMID 15217342. S2CID 917924.
- ^ Tien, N. W.; Wu, G. H.; Hsu, C. C.; Chang, C. Y.; Wagner, O. I. (2011). «Tau/PTL-1 associates with kinesin-3 KIF1A/UNC-104 and affects the motor’s motility characteristics in C. Elegans neurons». Neurobiology of Disease. 43 (2): 495–506. doi:10.1016/j.nbd.2011.04.023. PMID 21569846. S2CID 9712304.
- ^ Arimoto, M.; Koushika, S. P.; Choudhary, B. C.; Li, C.; Matsumoto, K.; Hisamoto, N. (2011). «The Caenorhabditis elegans JIP3 Protein UNC-16 Functions As an Adaptor to Link Kinesin-1 with Cytoplasmic Dynein». Journal of Neuroscience. 31 (6): 2216–2224. doi:10.1523/JNEUROSCI.2653-10.2011. PMC 6633058. PMID 21307258.
- ^ Sandoval, G. M.; Duerr, J. S.; Hodgkin, J.; Rand, J. B.; Ruvkun, G. (2006). «A genetic interaction between the vesicular acetylcholine transporter VAChT/UNC-17 and synaptobrevin/SNB-1 in C. Elegans». Nature Neuroscience. 9 (5): 599–601. doi:10.1038/nn1685. PMID 16604067. S2CID 11812089.
- ^ Abraham, C.; Bai, L.; Leube, R. E. (2011). «Synaptogyrin-dependent modulation of synaptic neurotransmission in Caenorhabditis elegans». Neuroscience. 190: 75–88. doi:10.1016/j.neuroscience.2011.05.069. PMID 21689733. S2CID 14547322.
- ^ Hammarlund, Marc; Palfreyman, Mark T; Watanabe, Shigeki; Olsen, Shawn; Jorgensen, Erik M (August 2007). «Open Syntaxin Docks Synaptic Vesicles». PLOS Biology. 5 (8): e198. doi:10.1371/journal.pbio.0050198. ISSN 1544-9173. PMC 1914072. PMID 17645391.
- ^ Kaeser, Pascal S.; Deng, Lunbin; Wang, Yun; Dulubova, Irina; Liu, Xinran; Rizo, Josep; Südhof, Thomas C. (2011). «RIM Proteins Tether Ca2+ Channels to Presynaptic Active Zones via a Direct PDZ-Domain Interaction». Cell. 144 (2): 282–295. doi:10.1016/j.cell.2010.12.029. PMC 3063406. PMID 21241895.
- ^ Lin, X. G.; Ming, M.; Chen, M. R.; Niu, W. P.; Zhang, Y. D.; Liu, B.; Jiu, Y. M.; Yu, J. W.; Xu, T.; Wu, Z. X. (2010). «UNC-31/CAPS docks and primes dense core vesicles in C. Elegans neurons». Biochemical and Biophysical Research Communications. 397 (3): 526–531. doi:10.1016/j.bbrc.2010.05.148. PMID 20515653.
- ^ a b Breckenridge, L. J.; Almers, W. (1987). «Currents through the fusion pore that forms during exocytosis of a secretory vesicle». Nature. 328 (6133): 814–817. Bibcode:1987Natur.328..814B. doi:10.1038/328814a0. PMID 2442614. S2CID 4255296.
- ^ Heuser, J. E.; Reese, T. S. (1973). «Evidence for Recycling of Synaptic Vesicle Membrane During Transmitter Release at the Frog Neuromuscular Junction». The Journal of Cell Biology. 57 (2): 315–344. doi:10.1083/jcb.57.2.315. PMC 2108984. PMID 4348786.
- ^ Miller, T. M.; Heuser, J. E. (1984). «Endocytosis of synaptic vesicle membrane at the frog neuromuscular junction». The Journal of Cell Biology. 98 (2): 685–698. doi:10.1083/jcb.98.2.685. PMC 2113115. PMID 6607255.
- ^ Ryan, T. A.; Smith, S. J.; Reuter, H. (1996). «The timing of synaptic vesicle endocytosis». Proceedings of the National Academy of Sciences of the United States of America. 93 (11): 5567–5571. Bibcode:1996PNAS…93.5567R. doi:10.1073/pnas.93.11.5567. PMC 39287. PMID 8643616.
- ^ Xu, H.; Zick, M.; Wickner, W. T.; Jun, Y. (2011). «A lipid-anchored SNARE supports membrane fusion». Proceedings of the National Academy of Sciences. 108 (42): 17325–17330. Bibcode:2011PNAS..10817325X. doi:10.1073/pnas.1113888108. PMC 3198343. PMID 21987819.
- ^ Foran, P. G.; Mohammed, N.; Lisk, G. O.; Nagwaney, S.; Lawrence, G. W.; Johnson, E.; Smith, L.; Aoki, K. R.; Dolly, J. O. (2002). «Evaluation of the Therapeutic Usefulness of Botulinum Neurotoxin B, C1, E, and F Compared with the Long Lasting Type A. BASIS FOR DISTINCT DURATIONS OF INHIBITION OF EXOCYTOSIS IN CENTRAL NEURONS». Journal of Biological Chemistry. 278 (2): 1363–1371. doi:10.1074/jbc.M209821200. PMID 12381720.
- ^ a b Harata, N. C.; Aravanis, A. M.; Tsien, R. W. (2006). «Kiss-and-run and full-collapse fusion as modes of exo-endocytosis in neurosecretion». Journal of Neurochemistry. 97 (6): 1546–1570. doi:10.1111/j.1471-4159.2006.03987.x. PMID 16805768. S2CID 36749378.
- ^ Alvarez De Toledo, G.; Alés, E.; Tabares, L. A.; Poyato, J. M.; Valero, V.; Lindau, M. (1999). «High calcium concentrations shift the mode of exocytosis to the kiss-and-run mechanism». Nature Cell Biology. 1 (1): 40–44. doi:10.1038/9012. PMID 10559862. S2CID 17624473.
- ^ Zhang, Q.; Li, Y.; Tsien, R. W. (2009). «The Dynamic Control of Kiss-And-Run and Vesicular Reuse Probed with Single Nanoparticles». Science. 323 (5920): 1448–1453. Bibcode:2009Sci…323.1448Z. doi:10.1126/science.1167373. PMC 2696197. PMID 19213879.
- ^
Palay, Sanford L.; Palade, George E. (1954). «Electron microscope study of the cytoplasm of neurons». The Anatomical Record (Oral presentation). 118: 336. doi:10.1002/ar.1091180211. - ^ Eduardo D. P., De Robertis; Stanley, Bennett, H. (January 25, 1955). «Some Features of the Submicroscopic Morphology of Synapses in Frog and Earthworm». The Journal of Biophysical and Biochemical Cytology. 1 (1): 47–58. doi:10.1083/jcb.1.1.47. JSTOR 1602913. PMC 2223594. PMID 14381427.
- ^ De Robertis EDP, Bennett HS (1954). «Submicroscopic vesicular component in the synapse». Fed Proc. 13: 35.
- ^ Fatt, P.; Katz, B. (7 October 1950). «Some Observations on Biological Noise». Nature. 166 (4223): 597–598. Bibcode:1950Natur.166..597F. doi:10.1038/166597a0. PMID 14780165. S2CID 9117892.
- ^ Fatt, P.; Katz, B. (May 28, 1952). «Spontaneous subthreshold activity at motor nerve endings» (PDF). The Journal of Physiology. 117 (1): 109–128. doi:10.1113/jphysiol.1952.sp004735. PMC 1392564. PMID 14946732. Retrieved 1 February 2014.
- ^ Del Castillo JB, Katz B (1954). «Quantal components of the endplate potential». J. Physiol. 124 (3): 560–573. doi:10.1113/jphysiol.1954.sp005129. PMC 1366292. PMID 13175199.
- ^ Del Castillo JB, Katz B (1954). «Biophysical aspects of neuromuscular transmission». Prog Biophys Biophys Chem. 6: 121–170. PMID 13420190.
- ^ Gray EG, Whittaker VP (1962). «The isolation of nerve endings from brain: an electron microscopic study of cell fragments derived from homogenization and centrifugation». J Anat. 96: 79–88. PMC 1244174. PMID 13901297.
- ^ Zimmermann, Herbert (2018). «The discovery of the synaptosome and its implications». Neuromethods. 141: 9–26. doi:10.1007/978-1-4939-8739-9_2.
- ^ Whittaker VP, Michaelson IA, Kirkland RJ (1963). «The separation of synaptic vesicles from disrupted nerve ending particles». Biochem Pharmacol. 12 (2): 300–302. doi:10.1016/0006-2952(63)90156-4. PMID 14000416.
- ^ Whittaker VP, Michaelson IA, Kirkland RJ (1964). «The separation of synaptic vesicles from nerve ending particles (‘synaptosomes’)». Biochem J. 90 (2): 293–303. doi:10.1042/bj0900293. PMC 1202615. PMID 5834239.
- ^ De Robertis E, Rodriguez de Lores Arnaiz G, Salganicoff GL, Pellegrino de Iraldi A, Zieher LM (1963). «Isolation of synaptic vesicles and structural organization of the acetylcholine system within brain nerve endings». J Neurochem. 10 (4): 225–235. doi:10.1111/j.1471-4159.1963.tb05038.x. PMID 14026026. S2CID 33266876.
- ^ Whittaker VP, Sheridan MN (1965). «The morphology and acetylcholine content of isolated cerebral cortical synaptic vesicles». J Neurochem. 12 (5): 363–372. doi:10.1111/j.1471-4159.1965.tb04237.x. PMID 14333293. S2CID 5746357.
- ^ Wilson WS, Schulz RA, Cooper JR (1973). «The isolation of cholinergic synaptic vesicles from bovine superior cervical ganglion and estimation of their acetylcholine content». J Neurochem. 20 (3): 659–667. doi:10.1111/j.1471-4159.1973.tb00026.x. PMID 4574192. S2CID 6157415.
- ^ Jones DG (1970). «The isolation of synaptic vesicles from Octopus brain». Brain Res. 17 (2): 181–193. doi:10.1016/0006-8993(70)90077-6. PMID 5412681.
- ^ Israël M, Gautron J, Lesbats B (1970). «Subcellular fractionation of the electric organ of Torpedo marmorata«. J Neurochem. 17 (10): 1441–1450. doi:10.1111/j.1471-4159.1970.tb00511.x. PMID 5471906. S2CID 8087195.
- ^ Whittaker VP, Essman WB, Dowe GH (1972). «The isolation of pure cholinergic synaptic vesicles from the electric organs of elasmobranch fish of the family Torpidinidae». Biochem J. 128 (4): 833–846. doi:10.1042/bj1280833. PMC 1173903. PMID 4638794.
External links[edit]
- Synaptic Vesicles – Cell Centered Database
Любая небольшая сферическая органелла, заполненная жидкостью, заключенная в мембрану 
В клеточной биологии везикула представляет собой структуру внутри или снаружи клетки , состоящей из жидкости или цитоплазмы, заключенной в липидный бислой. Везикулы образуются естественным образом во время процессов секреции (экзоцитоз ), поглощения (эндоцитоз ) и транспорта материалов внутри плазматической мембраны. Альтернативно, они могут быть получены искусственно, и в этом случае они называются липосомами (не путать с лизосомами ). Если имеется только один фосфолипидный бислой, они называются однослойными липосомами везикулами; в противном случае их называют многослойными. Мембрана, охватывающая везикулу, также имеет пластинчатую фазу, аналогичную мембране плазматической мембраны, и внутриклеточные везикулы могут сливаться с плазматической мембраной, высвобождая свое содержимое за пределы клетки. Везикулы также могут сливаться с другими органеллами внутри клетки. Везикула, высвобождаемая из клетки, известна как внеклеточная везикула.
. Везикулы выполняют множество функций. Поскольку он отделен от цитозоля, внутренняя часть везикулы может отличаться от цитозольной среды. По этой причине везикулы являются основным инструментом, используемым клеткой для организации клеточных веществ. Везикулы участвуют в метаболизме, транспорте, контроле плавучести и временном хранении пищи и ферментов. Они также могут действовать как камеры химических реакций.
Нобелевская премия 2013 года в области физиологии и медицины разделяли Джеймс Ротман, Рэнди Шекман и Томас Зюдхоф за их роль в разъяснении (основываясь на более ранних исследованиях, некоторые из них их наставниками) состав и функцию клеточных везикул, особенно у дрожжей и людей, включая информацию о частях каждой везикулы и способах их сборки. Считается, что дисфункция везикул способствует развитию болезни Альцгеймера, диабета, некоторых трудно поддающихся лечению случаев эпилепсии, некоторых видов рака и иммунологических расстройств, а также определенных нейроваскулярных состояний.
Содержание
- 1 Типы везикулярных структур
- 1.1 Вакуоли
- 1.2 Лизосомы
- 1.3 Транспортные везикулы
- 1.4 Секреторные везикулы
- 1.4.1 Типы
- 1.5 Внеклеточные везикулы
- 1.5.1 Типы
- 1.6 Другие типы
- 2 Образование и транспорт
- 2.1 Оболочка везикул и молекулы груза
- 2.2 Стыковка везикул
- 2.3 Слияние везикул
- 2.4 Подавление рецептора In
- 2.5 Подготовка
- 2.5.1 Изолированные везикулы
- 2.6 Искусственные пузырьки
- 3 См. Также
- 4 Ссылки
- 5 Дополнительная литература
- 6 Внешние ссылки
Типы везикулярных структур
вакуоли
Vacules — это клеточные органеллы, которые содержат в основном воду.
- Растительные клетки имеют большую центральную вакуоль в центре клетки, которая используется для осмотического контроля и хранения питательных веществ.
- Сократительные вакуоли являются найдены у некоторых протистов, особенно у представителей типа Ciliophora. Эти вакуоли забирают воду из цитоплазмы и выводят ее из клетки, чтобы избежать разрыва из-за осмотического давления.
.
Лизосомы
- Лизосомы участвуют в пищеварении клеток. Пища может поступать извне клетки в пищевые вакуоли с помощью процесса, называемого эндоцитозом. Эти пищевые вакуоли сливаются с лизосомами, которые расщепляют компоненты, чтобы их можно было использовать в клетке. Эта форма клеточного питания называется фагоцитоз..
- Лизосомы также используются для разрушения дефектных или поврежденных органелл в процессе, называемом аутофагией. Они сливаются с мембраной поврежденной органеллы, переваривая ее.
Транспортные везикулы
- Транспортные везикулы могут перемещать молекулы между местами внутри клетки, например, белки из грубого эндоплазматического ретикулума в Аппарат Гольджи.
- Связанные с мембраной и секретируемые белки образуются на рибосомах, обнаруженных в шероховатом эндоплазматическом ретикулуме. Большинство этих белков созревают в аппарате Гольджи перед тем, как попасть в конечный пункт назначения, которым могут быть лизосомы, пероксисомы или вне клетки. Эти белки перемещаются внутри клетки внутри транспортных пузырьков.
Секреторные везикулы
Секреторные везикулы содержат материалы, которые должны быть выведены из клетки. У клеток есть много причин для выделения материалов. Одна из причин — избавиться от отходов. Другая причина связана с функцией клетки. В более крупном организме некоторые клетки специализируются на производстве определенных химических веществ. Эти химические вещества хранятся в секреторных пузырьках и высвобождаются при необходимости.
Типы
- Синаптические везикулы расположены в пресинаптических окончаниях в нейронах и хранят нейротрансмиттеры. Когда сигнал идет по аксону, синаптические везикулы сливаются с клеточной мембраной, высвобождая нейромедиатор, так что он может быть обнаружен молекулами рецептора на следующей нервной клетке.
- У животных эндокринные ткани выделяют гормоны в кровоток. Эти гормоны хранятся в секреторных пузырьках. Хорошим примером является эндокринная ткань, обнаруженная в островках Лангерганса в поджелудочной железе. Эта ткань содержит множество типов клеток, которые определяются тем, какие гормоны они производят.
- Секреторные пузырьки содержат ферменты, которые используются для создания клеточных стенок растения, простейшие, грибы, бактерии и клетки архей, а также внеклеточный матрикс животные клетки.
- Бактерии, археи, грибы и паразиты выделяют мембранные везикулы (МВ), содержащие различные, но специализированные токсичные соединения и биохимические сигнальные молекулы, которые транспортируются к клеткам-мишеням, чтобы инициировать процессы в пользу микроб, которые включают инвазию клеток-хозяев и уничтожение конкурирующих микробов в одной и той же нише.
Внеклеточные везикулы
Внеклеточные везикулы (EV) — это частицы, ограниченные липидным бислоем, производимые всеми доменами жизни, включая сложные эукариоты, как грамотрицательные, так и грамположительные бактерии, микобактерии и грибы.
Типы
- Эктосомы / микровезикулы выделяются непосредственно из пл. asma и может иметь размер от примерно 30 нм до более микрона в диаметре). Они могут включать крупные частицы, такие как апоптотические пузырьки, высвобождаемые умирающими клетками, высвобождаемые некоторыми раковыми клетками, или «,», описанные в культуре нейрональных клеток.
- Экзосомы : мембранные везикулы эндоцитарного происхождения ( 30-100 нм в диаметре).
Различные типы ЭМ могут быть разделены на основе плотности (с помощью градиентного дифференциального центрифугирования ), размера или маркеров поверхности. Однако подтипы EV имеют перекрывающиеся диапазоны размеров и плотности, и уникальные для подтипа маркеры должны устанавливаться для каждой ячейки. Следовательно, трудно точно определить путь биогенеза, который вызвал конкретный EV после того, как он покинул клетку.
У человека эндогенные внеклеточные везикулы, вероятно, играют роль в коагуляции, межклеточной передаче сигналов и управлении отходами. Они также вовлечены в патофизиологические процессы, связанные с множеством заболеваний, включая рак. Внеклеточные везикулы вызвали интерес как потенциальный источник открытия биомаркеров из-за их роли в межклеточной коммуникации, высвобождения в легкодоступные жидкости организма и сходства их молекулярного содержания с таковым из высвобождающих клеток. Внеклеточные везикулы (мезенхимальных) стволовых клеток, также известные как секретом стволовых клеток, исследуются и применяются в терапевтических целях, преимущественно дегенеративных, аутоиммунные и / или воспалительные заболевания.
У грамотрицательных бактерий ЭВ производятся путем отщипывания наружной мембраны; однако, как ЭВ избегают толстых клеточных стенок грамположительных бактерий, микобактерий и грибов, все еще неизвестно. Эти электромобили содержат разнообразный груз, включая нуклеиновые кислоты, токсины, липопротеины и ферменты, и играют важную роль в физиологии микробов и патогенезе. Во взаимодействиях хозяин-патоген грамотрицательные бактерии продуцируют везикулы, которые играют роль в создании ниши колонизации, переносе и передаче факторов вирулентности в клетки-хозяева и модулировании защиты и реакции хозяина.
Ocean цианобактерии имеют было обнаружено, что везикулы, содержащие белки, ДНК и РНК, непрерывно высвобождаются в открытый океан. Везикулы, несущие ДНК различных бактерий, многочисленны в образцах морской воды прибрежных районов и открытого океана.
Другие типы
Газовые везикулы используются архей, бактериями и планктонных микроорганизмов, возможно, для контроля вертикальной миграции путем регулирования содержания газа и, таким образом, плавучести, или, возможно, для размещения элемента для максимального сбора солнечного света. Эти везикулы обычно представляют собой трубочки лимонной или цилиндрической формы, сделанные из белка; их диаметр определяет прочность пузырька, более крупные — более слабые. Диаметр пузырька также влияет на его объем и на то, насколько эффективно он может обеспечивать плавучесть. У цианобактерий естественный отбор работал над созданием везикул максимально возможного диаметра, при этом оставаясь структурно стабильными. Белковая оболочка проницаема для газов, но не для воды, что предохраняет везикулы от наводнения.
Везикулы матрицы расположены во внеклеточном пространстве или матриксе. С помощью электронной микроскопии они были независимо открыты в 1967 году Х. Кларком Андерсоном и Эрманно Бонуччи. Эти полученные из клеток везикулы специализируются на инициировании биоминерализации матрикса в различных тканях, включая кость, хрящ и дентин. Во время нормальной кальцификации основной приток ионов кальция и фосфата в клетки сопровождает клеточный апоптоз (генетически детерминированное самоуничтожение) и образование матричных пузырьков. Нагрузка кальцием также приводит к образованию комплексов фосфатидилсерин : кальций: фосфат в плазматической мембране, частично опосредованного белком, называемым аннексинами. Везикулы матрикса зачаток от плазматической мембраны в местах взаимодействия с внеклеточным матриксом. Таким образом, везикулы матрикса переносят во внеклеточный матрикс кальций, фосфаты, липиды и аннексины, которые участвуют в зародышеобразовании минералов. Эти процессы точно скоординированы, чтобы вызвать в нужном месте и в нужное время минерализацию тканевого матрикса, если только Гольджи не существуют.
Мультивезикулярное тельце, или MVB, представляет собой мембранно-связанную везикулу, содержащую ряд более мелких везикул.
Образование и транспорт
| Биология клетки |
|---|
| животная клетка |
 Компоненты типичной животной клетки: Компоненты типичной животной клетки:
|
Некоторые везикулы образуются, когда часть мембраны защемляется от эндоплазматического ретикулума или комплекса Гольджи. Другие образуются, когда объект вне клетки окружен клеточной мембраной.
Оболочка везикулы и молекулы груза
«Оболочка» везикул представляет собой набор белков, которые служат для формирования кривизны донорной мембраны, формируя округлую форму везикулы. Белки оболочки также могут связываться с различными трансмембранными рецепторными белками, называемыми грузовыми рецепторами. Эти рецепторы помогают выберите, какой материал подвергается эндоцитозу рецептор-опосредованного эндоцитоза или внутриклеточного транспорта.
Существует три типа оболочки везикул: клатрин, COPI и COPII. Различные типы белков оболочки помогают в сортировке пузырьков до их конечного пункта назначения. Клатриновые оболочки обнаруживаются на везикулах, перемещающихся между Гольджи и плазматической мембраной, эндосомами Гольджи и и плазматической мембраной и эндосомами. Везикулы, покрытые COPI, ответственны за ретроградный транспорт от Гольджи к ER, тогда как везикулы, покрытые COPII, ответственны за антероградный транспорт из ER в Golgi.
Предполагается, что оболочка клатрина собирается в ответ на регуляторный G-белок. Белковая оболочка собирается и разбирается благодаря белку фактора рибозилирования АДФ (ARF).
стыковка везикул
Поверхностные белки, называемые SNARE, идентифицируют груз везикул, а дополнительные SNARE на мембране-мишени действуют, вызывая слияние везикулы и мембраны-мишени. Предполагается, что такие v-SNARES существуют на мембране везикул, в то время как дополнительные на мембране-мишени известны как t-SNAREs.
Часто SNARE, связанные с везикулами или мембранами-мишенями, вместо этого классифицируются как SNARE Qa, Qb, Qc или R из-за большей вариабельности, чем просто v- или t-SNARE. Множество различных комплексов SNARE можно увидеть в разных тканях и субклеточных компартментах, 36 изоформ в настоящее время идентифицированы у людей.
Регуляторные Rab белки, как полагают, инспектируют соединение SNARE. Белок Rab является регуляторным GTP-связывающим белком и контролирует связывание этих комплементарных SNARE в течение достаточно длительного времени, чтобы белок Rab гидролизовал связанный с ним GTP и закрепил везикулу на мембране.
Слияние везикул
Слияние везикул может происходить одним из двух способов: полное слияние или слияние типа «поцелуй и беги». Fusion требует, чтобы две мембраны были расположены на расстоянии 1,5 нм друг от друга. Для этого вода должна быть вытеснена с поверхности мембраны везикул. Это энергетически невыгодно, и данные свидетельствуют о том, что для этого процесса требуются АТФ, GTP и ацетил-коА. Слияние также связано с бутонизацией, поэтому и появился термин «бутонизация» и «слияние».
При подавлении рецепторов
Мембранные белки, служащие рецепторами, иногда помечаются для подавления путем присоединения убиквитина. После прибытия в эндосому по пути, описанному выше, везикулы начинают формироваться внутри эндосомы, унося с собой мембранные белки, предназначенные для деградации; Когда эндосома созревает и становится лизосомой, или соединяется с ней, везикулы полностью разрушаются. Без этого механизма только внеклеточная часть мембранных белков достигла бы просвета лизосомы, и только эта часть была бы разрушена.
Именно из-за этих везикул эндосома иногда является известен как мультивезикулярное тело. Путь к их образованию до конца не изучен; в отличие от других везикул, описанных выше, внешняя поверхность везикул не контактирует с цитозолем.
Препарат
Изолированные везикулы
Производство мембранных везикул является одним из способов исследовать различные мембраны клетки. После того, как живая ткань измельчается в суспензию, различные мембраны образуют крошечные закрытые пузырьки. Большие фрагменты раздробленных клеток могут быть отброшены низкоскоростным центрифугированием, а затем фракция известного происхождения (плазмалемма, тонопласт и т. Д.) Может быть выделена точным высокоскоростным центрифугирование в градиенте плотности. Используя осмотический шок, можно временно открыть везикулы (заполнить их необходимым раствором), а затем снова центрифугировать и ресуспендировать в другом растворе. Применение ионофоров, таких как валиномицин, может создавать электрохимические градиенты, сравнимые с градиентами внутри живых клеток.
Везикулы в основном используются в двух типах исследований:
- для поиска и последующего выделения мембранных рецепторов, которые специфически связывают гормоны и различные другие важные вещества.
- Для исследования транспорта различных ионов или других веществ. вещества через мембрану данного типа. В то время как транспорт может быть более легко исследован с помощью методов патч-зажим, везикулы также могут быть изолированы от предметов, для которых патч-зажим не применим.
Искусственные везикулы
Фосфолипидные везикулы также были изучал биохимию. Для таких исследований можно приготовить гомогенную суспензию фосфолипидных везикул путем экструзии или обработки ультразвуком, инъекции раствора фосфолипида в мембраны из водного буферного раствора. Таким образом, водные растворы везикул могут быть приготовлены из различных фосфолипидных составов, а также из везикул разного размера.
См. Также
- Bleb (клеточная биология)
- Интерфейс хозяина и патогена
- Мембранные контактные участки
- Мембранные нанотрубки
- Транспортировка мембранных пузырьков
- Мицеллы
- Микросома
- Protocell
- Spitzenkörper, структура из множества мелких пузырьков, обнаруженных в гифах грибов
Ссылки
Дополнительная литература
- Alberts, Bruce; и другие. (1998). Эссенциальная клеточная биология: введение в молекулярную биологию клетки. Гарленд Паб. ISBN 978-0-8153-2971-8 .
Внешние ссылки
- Липиды, мембраны и обмен везикул — Виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии