Российский государственный медицинский университет;
НИИ цереброваскулярной патологии и инсульта, Москва
Стаховская Л.В.
ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Сердюк А.В.
ФГБОУ ВО «Российский национальный медицинский исследовательский университет им. Н.И. Пирогова», Москва, Россия
Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний
Авторы:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В.
Как цитировать:
Ковражкина Е.А., Стаховская Л.В., Разинская О.Д., Сердюк А.В. Ингибиторы регенерации центральной нервной системы, их физиологическая роль и участие в патогенезе заболеваний. Журнал неврологии и психиатрии им. С.С. Корсакова.
2018;118(5):143‑149.
Kovrazhkina EA, Stakhovskaya LV, Razinskaia OD, Serdyuk AV. Inhibitors of CNS regeneration, their physiological role and participation in pathogenesis of diseases. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2018;118(5):143‑149. (In Russ.)
https://doi.org/10.17116/jnevro201811851143

Функциональное восстановление ЦНС после повреждений ограничено неспособностью нейронов и аксонов к регенерации. При этом аксоны периферической нервной системы (ПНС) регенерируют достаточно хорошо и полно, аксоны ЦНС — в минимальной степени [1—3]. Необратимая дегенерация аксонов нейронов головного и спинного мозга — ведущая причина неизлечимости тяжелых повреждений ЦНС, а также нейродегенеративных заболеваний.
Дегенерация аксонов является анатомической основой патогенеза многих заболеваний ЦНС и ПНС, с ней связан неврологический дефицит, а его регресс — с возможностью регенерации осевых цилиндров. Вторичная демиелинизация развивается как типовая реакция на повреждение нервной ткани и способствует углублению аксонального повреждения. Демиелинизированные аксоны еще хуже проводят нервный импульс, т. е. вторичная демиелинизация ухудшает течение аксонопатии и способствует углублению неврологического дефицита. Однако миелин ЦНС и ПНС различен: в ЦНС это продукт клеток олигодендроглии, в ПНС — шванновских. Различаются и регенераторные возможности: если периферические нервы относительно быстро и полно регенерируют, то проводящие пути ЦНС (например, кортикоспинальные тракты) восстанавливаются медленно и неполно. Одна из причин этого — наличие в ЦНС ингибиторов аксонального роста, связанных с миелином, глией и межклеточным матриксом. Молекулы-ингибиторы аксонального роста играют важную роль в эмбриогенезе и развитии ЦНС млекопитающих, но у взрослых препятствуют регенерации аксонов. В настоящее время молекулы-ингибиторы аксонального роста являются объектом углубленного изучения, разрабатываются лекарственные препараты, нейтрализующие эти влияния.
Известно, что неспособностью к регенерации обладают только аксоны ЦНС взрослых высших млекопитающих, у более примитивных животных, а также на ранних стадиях онтогенеза у плодов эта способность сохранена [2, 4, 5]. Хорошей нейропластичностью после повреждений и заболеваний ЦНС обладают дети, причем тем лучшей, чем в более раннем возрасте получено данное повреждение. Потеря способности аксонов ЦНС к регенерации совпадает по времени с дифференцировкой клеток глии [2, 5]. Непосредственное окружение нейронов и аксонов (олигодендро- и астроцитарная глия, а также миелин) содержат молекулы-ингибиторы роста аксонов, к которым относятся миелинассоциированные ингибиторы роста аксонов [6] и сульфатированные сахара экстрацеллюлярного матрикса [7].
Настоящий обзор посвящен ингибиторам роста аксонов в ЦНС, их роли в норме и при различных видах патологии.
Rho-ROCK сигнальный путь
Аксональная регенерация в ЦНС ограничена множеством ингибиторных молекул, связанных с глией и миелином. Эти ингибиторы стимулируют внутриклеточный сигнальный Rho-механизм — единый путь торможения регенерации аксонов в ЦНС, «запускаемый» повреждениями аксонов и глии [8, 9]. Все ингибиторные молекулы действуют именно через этот механизм.
RhoA — малая ГТФаза, активированная форма которой представляет собой серин/тирозинпротеинкиназу (RhoA-киназа, ROCK). Rho-ROCK-механизм связан с такими функциями нейронов, как миграция, рост дендритов и аксонов, нейропластичность, причем оказывает на них именно тормозящее действие. Этот механизм играет важную роль в патогенезе повреждений спинного и головного мозга, а также нейродегенеративных заболеваний [8—10].
В последние годы проясняется физиологическая роль Rho-ROCK [11], связанная с локомоциями клеток. Локомоция клеток осуществляется посредством псевдоподиальной активности и представляет собой координированный циклический процесс, включающий выпячивание (протрузия) псевдоподий на переднем крае клетки, их прикрепление к внеклеточному матриксу, центростремительное натяжение прикрепившихся псевдоподий, освобождение от контактов с матриксом задней (хвостовая) части клетки. Движущаяся клетка приобретает «локомоторный фенотип»: она сильно поляризована, ее передняя часть имеет вид широкой и тонкой пластинки, по краю которой непрерывно образуются псевдоподии, противоположная часть клетки ретрактирована. Образование псевдоподий обусловлено полимеризацией актиновых микрофиламентов на концах, обращенных к плазматической мембране клетки, наращивание которых создает толкающую силу, «выпячивающую» участок мембраны в виде широкой ламеллоподии или нитевидной филоподии. Важную роль в локомоции клеток выполняют также микротрубочки, по ним к псевдоподии транспортируются вещества, необходимые для роста актиновых микрофиламентов, они также способствуют «разбору» слишком увеличившихся в размерах фокальных контактов, что позволяет мигрирующим клеткам ликвидировать старые участки прикрепления [12].
Для передвижения клеток необходимо воздействие специфических цитокинов — факторов роста и связывания интегриновых рецепторов с внеклеточным матриксом. Передача сигналов от рецепторов факторов роста и интегринов контролирует не только пролиферацию клеток, но и их локомоцию, поэтому многие факторы роста являются митогенами-мотогенами. К митогенам-мотогенам относятся тромбоцитарный и эпидермальный факторы роста (PDGF и EGF), фактор роста фибробластов (FGF), «рассеивающий» фактор (scatter factor, HGF/SF) и др. Связывание митогенов-мотогенов со своими рецепторами включает как митогенную Ras-Raf-МАР-киназную сигнальную цепь, так и «морфогеную» сигнальную цепь от активированного Ras, в которой сигнал передается через фосфатидилинозит-3-киназу (PI3K) на группу белков, играющих ключевую роль в контроле над организацией и динамикой цитоскелетных систем, актиновых микрофиламентов и микротрубочек. Это G-белки, или малые ГТФазы, семейства Rho, действующие как молекулярные «двусторонние переключатели», попеременно то переходя в активное состояние при связывании с ГТФ, то теряя активность в результате гидролиза ГТФ до ГДФ. В активном состоянии G-белки семейства Rho участвуют в передаче сигналов от рецепторов факторов роста и интегриновых. Активация малых ГТФаз стимулирует сборку актиновых микрофиламентов, усиливает их контрактильность, способствует формированию стресс-фибрилл и связанных с ними фокальных контактов (белок Rho), стимулирует полимеризацию актина на плюс-концах разветвляющихся микрофиламентов, что создает толкающую силу, формирующую ламеллоподию (белок Racl) [12—14].
Таким образом, суперсемейство малых ГТФаз является одним из ключевых регуляторов множества сигнальных путей у эукариот [15]. К нему относится и семейство Rho ГТФаз, играющих важную роль в эмбриогенезе и регенерации ЦНС. К настоящему времени в семействе Rho насчитывают 20 белков, разделяемых на восемь подсемейств. Rho ГТФазы участвуют в различных физио- и патологических процессах — эмбрио-, митогенезе, росте и дифференцировке клеток, фокальных контактах регенерации, контракции. Соответственно высока клиническая важность изучения Rho ГТФазы — с их функционированием связаны гипертонус гладких и скелетных мышц (при артериальной и хронической легочной гипертензии, вариантной стенокардии, глаукоме и др.), нарушения клеточной дифференцировки (при новообразованиях), проблемы регенерации клеток (в частности, при повреждениях нервной ткани и нейродегенеративных заболеваниях) [16, 17]. При повреждениях ЦНС и нейродегенерациях активация RhoA и ROCK является ключевым элементом прекращения роста аксонов, тормозит элонгацию конуса аксона, блокирует спратинг нейритов [18]. Экспериментально доказано [19], что химическая блокада Rho-ROCK-механизма меняет ингибиторные эффекты ROCK in vitro и способствует аксональной регенерации in vivo.
Миелинассоциированные протеины
Рост аксонов осуществляется конусами роста — расширениями терминалей нервных волокон. Их ультраструктура отличается очень высокой концентрацией ряда органелл (микротрубочки, микрофиламенты, митохондрии, гранулярный ретикулум, лизо- и рибосомы), включает многочисленные вакуоли, что является показателем активного пиноцитоза экзогенных белков. Направление роста аксонов определяется процессом узнавания, который реализуется посредством избирательного адгезивного взаимодействия между конусами роста и окружающим их субстратом. Узнавание обеспечивают молекулы адгезии, которые встроены в плазмолемму ламелло- и филоподий и взаимодействуют с комплементарными молекулами во внеклеточном матриксе. Рост аксонов происходит по градиенту концентрации специфических химических факторов, вырабатываемых в органах-мишенях. Соответственно рост аксонов направляется и регулируется в том числе молекулами экстрацеллюлярного матрикса [19].
В 1985 г. М. Schwab и Н. Thoenen [20] изучали различия в процессах восстановления: культивировали симпатические и сенсорные нейроны в обогащенной ростовыми факторами среде и регистрировали рост отростков нейритов. Они зафиксировали рост волокон седалищного (принадлежат ПНС), но не зрительного (относятся к ЦНС) нерва. Авторы предположили, что в ЦНС содержатся ингибиторные молекулы, тормозящие регенерацию аксонов. М. Schwab и D. Bartholdi [21] продолжили поиски молекул, ингибирующих рост аксонов в ЦНС, учитывая, что наиболее ярким отличием повреждений ЦНС от ПНС является активация астро- и олигодендроцитов с формированием глиального рубца, в состав которого входят потенциально ингибиторные молекулы (например, NG2-хондроитин-сульфат-протеогликан).
В 1988 г. Р. Caroni и М. Schwab [22] обнаружили ген Nogo, продуктом которого является белок, ингибирующий регенерацию аксонов. Белок Nogo существует в трех изоформах, но только Nogo-A, экспрессируемый олигодендроцитами, связан с миелином ЦНС. Nogo-A имеет молекулярную массу 220—250 кД, является нормальным компонентом миелина олигодендроцитов и играет в норме ведущую роль в направлении аксонального роста в процессе онтогенеза и подавлении нейропластичности. Структурно-функциональные особенности Nogo-A включают два ингибиторных домена: N-терминальный, отсутствующий у изоформ Nogo-B и -C, и 66-аминокислотный конец (Nogo-66), присутствующий у всех трех изоформ. Оба этих сегмента белка Nogo-A потенциально могут участвовать в ингибировании аксонального роста, но Nogo-66 работает именно при повреждении миелина и олигодендроцитов [21, 23—25]. У нокаутных по Nogo-A мышей одни авторы [26] обнаружили «драматический» эффект регенерации аксонов, однако другие [27, 28] — не выявили подобного эффекта. Это заставило предполагать, что Nogo-A является не единственным ингибитором роста аксонов.
В дополнение к Nogo-A были выделены еще два миелинассоциированных ингибитора роста аксонов — миелинассоциированный гликопротеин (myelin-associated glycoprotein — MAG) и олигодендроцит-миелиновый гликопротеин (oligodendrocyte-myelin glycoprotein — OMgp). MAG был выделен в 1994 г. независимо в лабораториях M. Filbin и L. McKerracher [29—31]; он очень активно ингибирует рост аксонов in vitro, но нокаутные по MAG мыши также не показывают значимый регенерации аксонов [32—34].
Важным моментом в понимании механизмов регенерации аксонов стало обнаружение рецептора Nogo-66 (NgR) А. Fournier и соавт. [35, 36]. NgR располагается на поверхности аксонов, дополнительно поддерживается трансмембранными белками, например трансмембранный протеин p75 является рецептором для семейства нейротрофинов и специфически взаимодействует с NgR [23, 34, 35]. NgR, p75 и Lingo-1 (еще один трансмембранный протеин) формируют рецепторный комплекс для ингибиторной активности компонентов миелина. Три основные связанные с миелином молекулы, ингибирующие рост аксонов (Nogo-A, MAG и ОМ гликопротеины), действуют через этот рецепторный комплекс [32—34]. Его сигнальный эффект активирует малую ГТФазу Rho (через Nogo-66 рецептор NgR и трансмембранные рецепторы нейротрофинов). Через этот рецепторный комплекс миелинассоциированные протеины, другие ингибиторные молекулы экстрацеллюлярного матрикса и сам компактный миелин стимулируют экспрессию генов, вызывают активацию MAP-киназы и ROCK [36]. Результатом является влияние на цитоскелет аксона и торможение роста аксонального конуса [6, 11].
Ингибиторные молекулы межклеточного матрикса
В дальнейшем, помимо миелинассоциированных протеинов, были идентифицированы и другие ингибиторные молекулы экстрацеллюлярного матрикса, обладающие свойством ограничивать рост нейритов: эфрины, семафорины, протеогликаны и др. [34]. На торможение роста аксонов и элонгацию аксонального конуса влияют и сам миелин, и сульфатированные сахара — хондроитин- и кератансульфатные протеогликаны [6]. Остатки миелина и протеогликаны являются основными компонентами глиальных рубцов [7, 18]. Их биологическое действие также осуществляется через Rho-ROCK-сигнальный путь.
Физиологическая роль ингибиторов регенерации ЦНС
Роль миелинассоциированных ингибиторов роста аксонов в патологии, особенно при травмах и повреждениях спинного мозга, изучена в многочисленных экспериментальных исследованиях — на культурах клеток и животных моделях. Физиологическая роль миелинассоциированных протеинов и Rho-ROCK-сигнального пути только начинает проясняться. Ингибиторы регенерации в ЦНС регулируют развитие миелина, электрическую и механическую стабильность аксонов, способствуют организации нейронных сетей, лимитируют синаптические контакты [11]. Миелинассоциированные ингибиторы также ограничивают обусловленную опытом пластичность, спраутинг нейритов и установление новых межнейронных связей в здоровой взрослой ЦНС, т. е. ограничивают анатомические изменения в ЦНС в норме и патологии, что делает их ведущими в фундаментальных исследованиях нейропластичности [8]. Нарушение функции миелинассоциированных ингибиторов связано с проблемами развития мозга, нейропсихиатрическими расстройствами, нейропатической болью [6, 11, 37].
Миелин обеспечивает быстрое и точное проведение нервного импульса по длинным аксонам, осуществляет метаболическую поддержку аксонов и обладает нейропротективными свойствами [38]. Недавние исследования [39, 40] показывают, что существуют механизмы регуляции активности нейронов, влияющие на степень миелинизации ЦНС. Предполагают, что адаптивная миелинизация является еще недостаточно изученной формой зависимой от активности пластичности нервной системы.
В процессе развития молекулы окружения аксонов участвуют в образовании сложных нейронных сетей. После своего образования нейронные сети «настраиваются» в течение короткого периода повышенной пластичности («критический период»), по окончании которого приобретают зрелую форму. Синаптические контакты в зрелом мозге стабильны в течение длительного времени, но имеет место и ограниченное структурное ремоделирование, что формирует клеточную основу обучения, памяти и нейропластичности [41]. Зависящая от активности модификация синаптических контактов может быть достигнута посредством динамической регуляции окружения аксонов. Ингибиторы регенерации ЦНС укрепляют нейронную архитектуру в конце критических периодов [42, 43]. Так, получены доказательства [44] вовлечения Nogo-A в ограничение нейрональной пластичности в зрительной системе грызунов. Важная физиологическая функция ингибиторов регенерации ЦНС заключается в консолидации нейронной архитектуры, созданной в конце критического периода.
Ингибиторы регенерации ЦНС экспрессируются глией и нейронами. Nogo-A, OMgp, NgR1-рецептор для Nogo-66, хондроитинсульфатные протеогликаны присутствуют в пре- и постсинаптических фракциях, выделенных из гиппокампа [29, 42, 45]. Ингибиторы регенерации ЦНС влияют на структуру и плотность синапсов [46]. В гиппокампе нокаутных мышей NgR1-дендритные шипы имеют менее зрелый профиль распределения, чем у мышей «дикого» типа, по-видимому, NgR1 необходим для правильного развития зрелых шипов [47]. Исследования показали, что потеря всех трех членов семейства NgR (NgR1, NgR2 и NgR3) увеличивает синаптическую плотность в молодом гиппокампе, указывая на то, что NgR функционируют как отрицательные регуляторы синаптогенеза. В недавних исследованиях[6] показано, что NgR1 является ключевой молекулой для ограничения ветвления дендритов в соматосенсорной коре взрослых мышей и пирамидальных нейронах гиппокампа.
Взаимодействие между ингибиторами регенерации ЦНС и факторами роста (например, BDNF) обеспечивает нейрональную пластичность и стабильность нейронных сетей после завершения критических периодов [45]. Многие нейропсихиатрические расстройства связаны с дефектами структуры или функции синапсов и могут быть вызваны сдвигом в возбуждающем/ингибиторном балансе. Учитывая, что ингибиторы регенерации ЦНС играют важную роль в регуляции этих процессов, их измененная экспрессия может способствовать развитию нарушений в работе мозга. В старческом мозге экспрессия в гиппокампе нескольких ингибиторов регенерации ЦНС увеличивается и коррелирует с дефицитом пространственного обучения и памяти, что показано в экспериментах на трансгенных животных [48, 49]. При этом крысы с пониженной экспрессией Nogo-A демонстрируют нарушения в социальном поведении [50]. Интересно, что мутации в NgR1 и Nogo-A у человека связаны с шизофренией [51].
Спинальная травма
Наиболее изучена роль миелинассоциированных ингибиторов роста и Rho-ROCK-механизма при спинальных повреждениях. Эффективность лечения этой патологии невелика. В недавнем обзоре P. Stahel и соавт. [52] перечислены все существующие терапевтические подходы: применение стероидов в острейшем периоде и стабилизация повреждений позвоночника в ближайшие 24 ч после травмы помогают ограничить вторичные повреждения; поддержание жизненно важных функций (дыхание, артериальное давление, борьба с кровопотерей) в острейшем и остром периодах и как можно более ранняя мобилизация пациента также позволяют предотвратить осложнения. Однако наибольшую надежду в плане именно восстановления неврологического дефицита сейчас возлагают на экспериментальные препараты, блокирующие молекулы — ингибиторы роста аксонов [52].
Аксональную регенерацию после спинальных травм блокируют окружающие место повреждения ткани. Аксональные контакты и восстановление в ЦНС блокируют остатки миелина, нейровоспаление и клеточная гибель в месте повреждения. Хондроитинсульфатные протеогликаны экстрацеллюлярного матрикса образуют глиальный рубец и периневральный барьер для аксонального роста и спрутинга [53—55]. Соответственно спонтанное восстановление после спинальной травмы, небольшие степени которого все же наблюдаются в клинике и эксперименте, зависит от присутствия миелинассоциированных протеинов-ингибиторов роста, воспалительного компонента в поврежденной нервной ткани, гиперактивации сигнального Rho-пути [56].
На экспериментальных животных моделях было показано [57, 58], что после селективного пересечения волокон кортикоспинального тракта на среднем грудном уровне терапевтическое введение антител против ингибиторного протеина Nogo-A способствует более быстрому и полному восстановлению двигательных функций, при этом отдаленная регенерация поврежденных аксонов отмечена только после Nogo-нейтрализации. Также после двустороннего пересечения кортикоспинального тракта в присутствии Nogo-A-нейтрализующих антител было показано увеличение коллатералей руброспинального тракта, иннервирующих шейный отдел спинного мозга, что коррелировало с клиническим улучшением и демонстрировало возможность для параллельных, анатомически обособленных систем по меньшей мере частично компенсировать повреждение другой системы [58].
В экспериментальных работах показана значимая роль в данной патологии миелинассоциированного протеина Nogo-A [56], липидов миелина [54], хондроитинсульфатных протеогликанов [53]. На культурах клеток в среде, лишенной этих молекул, аксонотомированные нейроны демонстрировали элонгацию аксонального конуса, животные нокаутных по генам миелинассоциированных протеинов линий лучше восстанавливались после экспериментальных спинальных повреждений. В экспериментах обнаружены динамические изменения экспрессии гена и синтеза Nogo-A после повреждения спинного мозга (низкая через 24 ч после травмы, продолжает понижаться далее до 3 дней, затем быстро повышается до пика около 7 дней, и постепенно снова снижается после 14 дней) [59], а также роль относительно сохранных надсегментарных проводников при спонтанном восстановлении у нокаутных по Rho-ROCK животных — имеет значение сохранность руброфугальных и руброспинальных путей с образованием de novo связей между красным ядром и ядром шва [56]. Эти данные очень важны для реабилитации пациентов со спинальными повреждениями, но наибольший интерес вызывают препараты — блокаторы ингибиторных молекул.
Нейродегенерации
Компонент аксональной дегенерации очень важен в патогенезе нейродегенеративных заболеваний. Сами зрелые нейроны практически не способны к регенерации (за исключением отдельных зон ЦНС), но аксоны обладают способностью к спраутингу и элонгации. На развернутых стадиях большинства нейродегенеративных заболеваний потеря тел нейронов всегда сопровождается потерей аксонов и нарушением способности к нейропластичности. Проблеме соотношения между дегенерацией тел нейронов и аксонов посвящен один из недавних обзоров, показавший, что молекулярные механизмы дегенерации аксонов различны с таковыми для тел нейронов, что делает воздействия на аксональный компонент нейродегенерации одним из возможных терапевтических подходов к данной патологии [60].
Гиперактивация Rho-ROCK-механизма описана при болезни Паркинсона, боковом амиотрофическом склерозе, спинальных амиотрофиях [60—64]. Особенно много внимания исследователей в последнее время привлечено к роли микроглиального окружения в дегенерации нейронов ЦНС. Важная роль астро- и микроглии и активации глиальной ROCK показана при боковом амиотрофическом склерозе [64] и болезни Паркинсона [62], особенно серьезное нейротоксическое и провоспалительное действие оказывает глиальное окружение нейронов на поздних стадиях нейродегенераций. Показано также [61], что активация ROCK усиливает присущую нейродегенеративным заболеваниям абнормальную белковую агрегацию (например, α-синуклеин при болезни Паркинсона), а препараты — ингибиторы ROCK могут ее понижать.
Другие заболевания
Гиперактивация Rho-ROCK-сигнального пути под воздействием миелинассоциированных ингибиторов влияет и на восстановление после инсульта [65, 66]. Миелинассоциированные протеины — ингибиторы роста аксонов синтезируются также некоторыми субпопуляциями клеток сетчатки и оказывают влияние на восстановление после повреждений зрительных нервов [67].
Ингибиторы RhoA и другие потенциальные лекарственные средства
Учитывая значительную роль Rho-ROCK-сигнального пути и «миелинассоциированных ингибиторов в торможении регенерации аксонов ЦНС, в последние годы велик интерес исследователей к поиску потенциальных терапевтических агентов — веществ, блокирующих Rho-ROCK-механизм и усиливающих нейропротекцию и стимуляцию регенерации. Особое значение приобретает поиск таких потенциальных лекарств для пациентов со спинальными повреждениями и нейродегенеративными заболеваниями.
В настоящее время выделен класс веществ — ингибиторов RhoA (C3-exoenzmye, fasudil, Y-27632, ibuprofen, siRhoA, p21), активно изучаемых в экспериментах на клеточных культурах и моделях животных [8, 9, 53, 55, 68, 69]. Ингибиторы RhoA селективно блокируют ее без влияния на другие ГТФ (С3-трансферазы), к веществам этой группы относится, например, активно сейчас изучаемый (проходит I/IIa фазы клинических испытаний) cethrin [55, 68]. Существуют и другие химические агенты, селективно «связывающие» RhoA, например collapsing response mediator protein 4 (CRMP4), образующий комплекс CRMP4b/RhoA и блокирующий тормозящий эффект на рост аксонов; блокируют Rho-ROCK-механизм и антагонисты АТФ-рецепторов P2Y12 и P2Y13 [37].
Исследования на животных показывают терапевтическую эффективность ингибиторов RhoA. Большинство подобных испытаний проведено на моделях спинальной травмы. Так, в одном из недавних исследований [9] 120 крыс разделили на три группы: 40 — ложно оперированные (только ламинэктомия, без рассечения спинного мозга), 40 — ламинэктомия и спинальная, получение физиологического раствора, 40 — ламинэктомия и спинальная транссекция, введение лекарства. Показано достоверно лучшее восстановление у животных, получавших fasudil (по шкале Basso—Beattie—Bresnahan), а также достоверное снижение экспрессии RhoA мРНК в ткани спинного мозга животных опытной группы. Выявлены положительное влияние ингибитора RhoA Y-27632 на элонгацию аксонального конуса в обогащенной протеогликанами среде [18] и регресс неврологического дефицита у перенесших рассечение спинного мозга на уровне СIV—СV позвонков крыс [8], положительное влияние ингибиторов АТФ-рецепторов P2Y12 и P2Y13 на нейропатическую боль при спинальных повреждениях [37].
Тем не менее в большинстве экспериментальных исследований на животных с ингибиторами RhoA не доказана их эффективность. В недавнем крупном метаанализе [69] изучалась эффективность различных PhoA/ROCK-ингибиторов на моделях животных повреждения спинного мозга (геми-, транссекция, контузия). Работы, опубликованные в базах PubMed, EMBASE, Web of Science и соответствующие критериям включения (экспериментальная спинальная торакальная травма, лечение ингибиторами PhoA/ROCK, оценка двигательного восстановления по протоколам Basso, Beattie, and Bresnahan score или Basso Mouse Scale for Locomotion), оценивались двумя независимыми исследователями по девяти пунктам. Метаанализ включил 30 работ (всего 725 животных) и обнаружил эффективность ингибиторов PhoA/ROCK в 15% случаев. В некоторых работах, сообщавших об эффективности ингибиторов PhoA/ROCK, было обнаружено нарушение методологии; эти данные не включались в окончательный анализ.
Ингибиторы PhoA/ROCK (facudil) показали свою эффективность на моделях церебрального инсульта и нейродегенеративных заболеваний [61, 66]. Так, ингибитор RhoA facudil изучался на мышиной СОД1-модели бокового амиотрофического склероза (линия G93A), где вызывал торможение дегенерации мотонейронов и замедление прогрессирования заболевания. Препарат предотвращал гибель мотонейронов у G93A мышей, подавлял нарастание ROCK-активности, редуцировал фосфорилирование актина, индуцированное СОД1. В другом исследовании in vivo [63] у G93A-мышей при пероральном приеме facudil также удлинялись сроки выживания и улучшались двигательные функции, а применение facudil in vitro увеличивало выживаемость поврежденных мотонейронов. Facudil исследовался и на модели болезни Паркинсона, показав положительное влияние на выживаемость нейронов черной субстанции и даже уменьшение патологической агрегации α-синуклеина [61].
С целью возможного терапевтического влияния на рост и регенерацию аксонов изучали антагонисты к рецептору Nogo-66 (NgR1) [70], ингибитор гликозилирования хондроитинсульфатных протеогликанов PTPσ [53], моноклональные антитела против миелинассоциированных протеинов-ингибиторов аксонального роста. В недавнем исследовании [65] эффект моноклонального антитела GSK249320 против миелинассоциированного гликопротеина (MAG) показан на модели кортикального ишемического инсульта: у приматов, получавших GSK249320, к 16-му дню заболевания функциональное восстановление было достоверно лучше, чем в контрольной группе. Важно, что функциональное преимущество опытной группы было получено не за счет периинфарктной области и прилегающей премоторной зоны, что было продемонстрировано нейрофизиологическим — картированием двигательных зон (представительство вентральной премоторной зоны в экспериментальной группе было меньше, чем в контроле).
Таким образом, ингибиторную активность миелина ЦНС можно нейтрализовать с помощью антител к миелинассоциированным протеинам (например, анти Nogo-A), делеции генов Nogo, MAG и OMgp, введения растворимых NgR-фрагментов и NgR-блокирующих пептидов, торможения поступления кальция во внутриклеточное пространство, использования высоких концентраций цАМФ, применения ингибиторов RhoA или ROCK [71]. In vivo показаны нейтрализующий эффект моноклональных IgM-антител к Nogo (IN-1), умеренно выраженное, но достоверное улучшение восстановления после спинального повреждения у нокаутных по Nogo-A мышей, эффективность пептидов, взаимодействующих с активным 66-аминокислотным С-концом Nogo (например, NEP1−40), связывающихся с Nogo, но не активирующих его. Активно изучаются и нейтрализующие эффекты вторичных мессенджеров ингибиторной активности миелина: инактивирующих Rho-энзимов (например, С3-трансфераза), ингибиторов ROCR (например, Y27632,), эффекты нейтрализации активности Nogo и MAG продемонстрированы при инфузии in vivo аналогов цАМФ, а также медиатора p75 [71—73]. Представленный подход к управлению регенерацией аксонов кажется физиологически обоснованным и потенциально эффективным, однако решение данной проблемы далеко от завершения, необходимы дальнейшие исследования.
В заключение еще раз отметим, что ингибиторы регенерации ЦНС, работающие через Rho-ROCK-сигнальный путь, играют важную физиологическую роль не только в развитии ЦНС, но и по окончании критических периодов — в стабилизации нейронных сетей, ограничении ветвления дендиритов, структуре и функционировании синаптических контактов, работая в противоположном факторам роста направлении. Нестабильное функционирование нейронных сетей является основой многих нейропсихиатрических заболеваний. При повреждениях ЦНС, травмах, нейродегенеративных заболеваниях, старении избыточная экспрессия связанных с миелином ингибиторов регенерации ЦНС тормозит рост аксонов, играет отрицательную роль для реабилитационного потенциала. Изучение аксон-миелиновых отношений, роли окружения аксонов в их дегенерации и регенерации важно для развития подходов к лечению ряда заболеваний и повреждений ЦНС.
Авторы заявляют об отсутствии конфликта интересов.
*e-mail: elekov2@yandex.ru
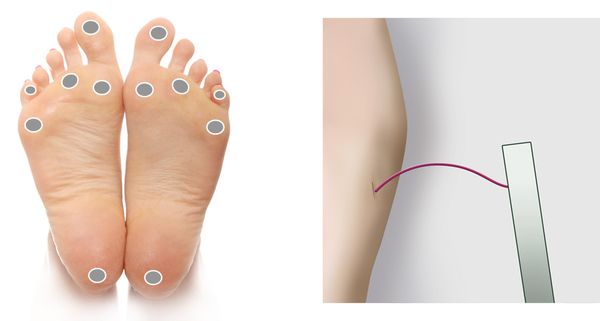
Полинейропатия — это патология периферической нервной системы, которая развивается в результате диффузного повреждения периферических нервов и их аксонов. Отсюда и название болезни. В ее основе — генерализованное поражение осевого цилиндра периферических нервов.
Что такое аксональная полинейропатия
Полиневропатия (второе название — полиневрит) — это клинический синдром, который возникает из-за ряда факторов, влияющих на периферическую нервную систему, и отличается размытыми патогенетическими изменениями. Заболевание занимает одно из лидирующих мест в перечне недугов периферической нервной системы, уступая первенство только вертеброгенной патологии, превосходящей по сложности клинической картины и последствиям, развивающимся из-за нее.
Аскональная полинейропатия считается междисциплинарной проблемой, с ней часто сталкиваются доктора различных специализаций. В первую очередь с данным заболеванием обращаются к неврологу. Частота возникающего синдрома неизвестна, так как отсутствуют статистические данные.
На данный момент известны всего три важных патоморфологических механизма, которые лежат в истоках формирования полинейропатии:
- валлеровская дегенерация;
- первичная демиелинизация;
- первичная аксонопатия.
В соответствии с иммунологической теорией полинейропатия является результатом перекрестного образования иммунных глобулинов, уничтожающих собственные клетки, в результате чего возникает некроз тканей и мышечное воспаление.
Исследователи выдвигают ряд гипотез возникновения и проблем течения аксональной полинейропатии:
- Сосудистая. Базируется на вовлечении в процесс сосудов, по которым кислород и питательные вещества поступают в периферические нервы. Изменяются характеристики крови по качественному и количественному составу, что может привести к ишемии нервных окончаний.
- Теория оксидативного стресса. Позиционирует формирование болезни со стороны нарушения обмена оксида азота, вследствие чего изменяются калий-натриевые механизмы, лежащие в основе формирования нервного возбуждения и проведения импульсов по нервам.
- Теория деактивации факторов роста нерва. Говорит о том, что болезнь возникает из-за недостатка аксонального транспорта с последующим развитием аксонопатии.
- Иммунологическая. Объясняет развитие заболевания в результате перекрестного образования антител к структурам периферической нервной системы, которое сопровождается аутоиммунным воспалением, а затем и некрозом нервов.
Даже при использовании ультрасовременных методов диагностики сложно найти достоверную причину патологии, выяснить ее получается только у 50-70% пострадавших.
Факторов возникновения полинейропатии нижних конечностей по аксональному типу очень много. Однако даже инновационные способы исследования не позволяют установить истинную этиологию заболевания.
Мнение эксперта
Автор: Алексей Владимирович Васильев
Руководитель НПЦ болезни двигательного нейрона/БАС, кандидат медицинских наук, врач высшей категории
Аксональная полинейропатия — это одно из самых опасных неврологических заболеваний, сопровождающееся поражением периферической нервной системы. При болезни разрушаются периферические нервные волокна.
Причин возникновение аксональной полинейропатии несколько. Самые распространенные:
- Сахарный диабет нарушает структуру крови, питающей нервы, в свою очередь происходит сбой в обменных процессах.
- Длительный дефицит витаминов В. Именно они максимально важны для правильной работы нервной системы, поэтому долгая нехватка способна привести к аксональной полинейропатии.
- Воздействие токсинов на организм. К ним относят разнообразные отравляющие вещества, например, алкоголь, а также ВИЧ. При отравлении опасными веществами заболевание может развиться уже через несколько дней.
- Наследственный фактор.
- Синдром Гийена-Барре.
- Различные травмы, к которым также относится длительное сдавливание нервов, которое характерно при грыже или остеохондрозе.
Лечение аксональной полинейропатии обязательно должно быть комплексным, иначе нужного эффекта достичь не удастся. Категорически запрещается заниматься самолечением и при возникновении первых же симптомов нужно срочно обратиться к доктору. Врачи Юсуповской больницы подбирают лечение индивидуально для каждого пациента. В зависимости от тяжести патологии и симптоматики назначается комплексное лечение под наблюдением опытных специалистов.
Причины
Самые распространенные причины возникновения аксональной полинейропатии нижних конечностей:
- истощение организма;
- длительный недостаток витаминов группы В;
- недуги, ведущие к дистрофии;
- острые инфекции;
- токсическое поражение ртутью, свинцом, кадмием, угарным газом, спиртными напитками, метиловым спиртом, фосфорорганическими соединениями, медицинскими препаратами, принимаемыми без согласования с врачом;
- болезни сердечно-сосудистой, кроветворной, кровеносной и лимфатической систем;
- эндокринологические патологии, в том числе инсулинозависимость.
Главными факторами, которые провоцируют развитие моторной или сенсомоторной аксональной полинейропатии, являются:
- эндогенная интоксикация при почечной недостаточности;
- аутоиммунные процессы, протекающие в организме;
- амилоидоз;
- вдыхание токсических веществ или паров.
Также болезнь может быть обусловлена наследственностью.
Нехватка в организме витаминов группы В, а в особенности пиридоксина и цианокобаламина, крайне негативно воздействует на проводимость нервных и моторных волокон и может вызывать сенсорную аксональную полинейропатию нижних конечностей. Это же происходит при хронической алкогольной интоксикации, глистной инвазии, заболеваниях желудочно-кишечного тракта, которые ухудшают скорость всасывания.
Токсическое отравление лекарственными препаратами, аминогликозидами, золотыми солями и висмутом занимают большой процент в структуре факторов аксональной невропатии.
У пациентов с сахарным диабетом нарушена функция периферических нервов из-за нейротоксичности кетоновых тел, то есть метаболитов жирных кислот. Происходит это из-за невозможности организма использовать глюкозу как главный источник энергии. Поэтому вместо нее окисляются жиры.
При аутоиммунных заболеваниях, протекающих в организме, иммунная система человека атакует собственные нервные волокна, воспринимая их как источник опасности. Это происходит из-за провокации иммунитета, возникающей при неосторожном приеме иммуностимулирующих медикаментов и нетрадиционных методик лечения. Поэтому у людей, которые склонны к возникновению аутоиммунных заболеваний, пусковыми факторами аксональной полинейропатии являются:
- иммуностимуляторы;
- вакцины;
- аутогемотерапия.
При амилоидозе в организме накапливается такой белок, как амилоид. Именно он нарушает основные функции нервных волокон.
Первые признаки
Заболевание обычно начинает развиваться с поражения толстых или тонких нервных волокон. Зачастую аксональная полинейропатия имеет дистальное симметричное распределение на кисти или стопы. Нейропатия чаще всего сначала поражает нижние конечности, а затем симметрично распространяется вверх по телу. К самым частым первичным симптомам поражения относят:
- мышечную слабость;
- болевой синдром в конечностях;
- жжение;
- ощущение ползания мурашек;
- онемение кожных покровов.
Симптоматика ярче всего проявляется в вечернее и ночное время суток.
Симптомы
Врачи подразделяют хроническое, острое и подострое течение аксональной полинейропатии. Заболевание подразделяется на два вида: первично-аксональный и демиелинизирующий. В ходе течения болезни к ней присовокупляется демиелинизация, а затем и вторично аксональный компонент.
К основным проявлениям недуга относятся:
- вялость в мышцах ног или рук;
- спастический паралич конечностей;
- чувство подергивания в мышечных волокнах;
- головокружение при резкой перемене положения тела;
- отек конечностей;
- жжение;
- покалывание;
- ощущение ползания мурашек;
- снижение чувствительности кожных покровов к высокой или низкой температуре, боли и касаниям;
- нарушение ясности речи;
- проблемы с координацией.
Вегетативными признаками сенсомоторной полинейропатии асконального типа считаются следующие симптомы:
- учащенный или, напротив, замедленный сердечный ритм;
- неумеренное потоотделение;
- чрезмерная сухость кожи;
- изменение цвета кожных покровов;
- нарушение эякуляции;
- эректильная дисфункция;
- проблемы с мочеиспусканием;
- сбой двигательных функций желудочно-кишечного тракта;
- повышенное слюнотечение или, наоборот, сухость во рту;
- расстройство аккомодации глаза.
Заболевание проявляется в нарушениях функций поврежденных нервов. Именно периферические нервные волокна отвечают за двигательные функции мышечной ткани, чувствительность, а также оказывают вегетативное воздействие, то есть регулируют сосудистый тонус.
Для нарушения функции проводимости нервов характерны расстройства чувствительности, например:
- чувство ползания мурашек;
- гиперестезия, то есть увеличение чувствительности кожи к внешним раздражителям;
- гипестезия, то есть уменьшение чувствительности;
- отсутствие ощущения собственных конечностей.
Когда поражены вегетативные волокна, то из-под контроля выходит регуляция сосудистого тонуса. При аксонально-демиелинизирующей полинейропатии наступает сдавление капилляров, из-за чего ткани отекают. Нижние, а затем и верхние конечности из-за скапливания в них жидкости существенно увеличиваются в размерах. Так как при полинейропатии нижних конечностей основное количество крови накапливается именно в пораженных областях тела, то у пациента возникает стойкое головокружение при принятии вертикального положения. Из-за того, что пропадает трофическая функция, могут возникнуть эрозивно-язвенные поражения нижних конечностей.
Аксональная моторная полинейропатия проявляется в двигательных нарушениях верхних и нижних конечностей. Когда моторные волокна, отвечающие за движения рук и ног, повреждены, то наступает полный или частичный паралич мышц. Обездвиживание может проявляться совершенно нетипично — может ощущаться как скованность мышечных волокон, так и чрезмерная их расслабленность. При средней степени поражения ослаблен мышечный тонус.
В ходе течения заболевания могут быть усилены или ослаблены сухожильные и надкостничные рефлексы. В редких случаях доктор-невролог их не наблюдает. При болезни часто могут быть поражены черепные нервы, которые проявляются следующими нарушениями:
- глухотой;
- онемением подъязычных мышц и мускулатуры языка;
- невозможностью проглотить еду или жидкость из-за проблем с глотательным рефлексом.
Когда поражен тройничный, лицевой или глазодвигательный нерв, изменяется чувствительность кожных покровов, развиваются параличи, возникает асимметрия лица и подергивание мышц. Иногда при диагностированной аксонально-демиелинизирующей полинейропатии поражения верхних или нижних конечностей могут быть асимметричными. Такое случается при множественной мононейропатии, когда коленные, ахилловы и карпорадиальные рефлексы несимметричны.
Диагностика
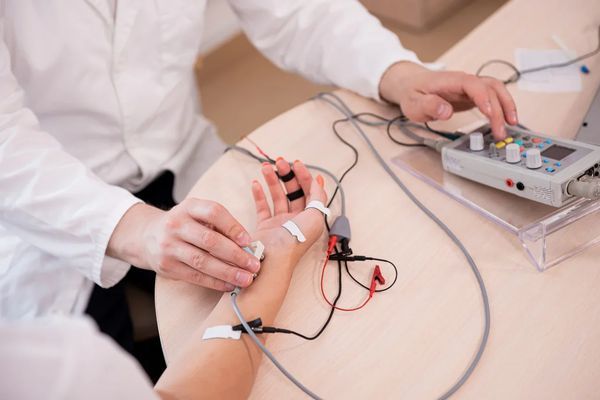
Главной методикой исследования, которая позволяет обнаружить локализацию патологического процесса и степень пораженности нервов, является электронейромиография.
Чтобы определить причину заболевания, врачи назначают следующие анализы:
- определение уровня сахара в плазме крови;
- токсикологические тесты;
- полный анализ мочи и крови;
- выявление уровня холестерина в организме.
Нарушение нервных функций устанавливается при помощи определения температурной, вибрационной и тактильной чувствительности.
При первичном осмотре применяется зрительная методика исследования. То есть врач, к которому обратился с жалобами пострадавший, осматривает и анализирует такие внешние симптомы, как:
- уровень давления крови в верхних и нижних конечностях;
- чувствительность кожных покровов к прикосновениям и температуре;
- наличие всех необходимых рефлексов;
- диагностика отечности;
- изучение внешнего состояния кожи.
Выявить аксональную полинейропатию можно при помощи следующих инструментальных исследований:
- магнитная резонансная томография;
- биопсия нервных волокон;
- электронейромиография.
Лечение аксональной полинейропатии
Лечение аксональной полинейропатии должно быть комплексным и направленным на причину развития заболевания, его механизмы и симптоматику. Гарантией эффективной терапии является своевременное выявление болезни и лечение, которое сопровождается абсолютным отказом от сигарет, алкоголя и наркотических веществ, ведением здорового образа жизни и соблюдением всех рекомендаций врача. В первую очередь проводятся следующие терапевтические мероприятия:
- избавление от токсического воздействия на организм, если оно присутствует;
- антиоксидантная терапия;
- прием препаратов, которые воздействуют на тонус кровеносных сосудов;
- восполнение дефицита витаминов;
- регулярный контроль концентрации глюкозы в плазме крови.
Отдельное внимание уделяется лечению, направленному на купирование острого болевого синдрома.
Если присутствуют периферические парезы, то есть существенное снижение мышечной силы с многократным уменьшением амплитуды движений, то в обязательном порядке показана лечебная физкультура и специальные физические упражнения, направленные на возвращение тонуса мышечным тканям и предотвращение образования различных контрактур. Особенно важна регулярная психологическая поддержка, которая не дает пациенту впасть в депрессию, сопровождающуюся расстройством сна и чрезмерной нервной возбудимостью.
Лечение аксональной полинейропатии — это продолжительный процесс, так как нервные волокна восстанавливаются долго. Поэтому не стоит ожидать моментального выздоровления и возвращения к привычному образу жизни. Медикаментозная терапия включает такие препараты, как:
- обезболивающее;
- глюкокортикоиды;
- витамины группы В;
- антиоксиданты;
- сосудорасширяющие;
- средства, ускоряющие метаболизм и улучшающие микроциркуляцию крови.
Терапия лекарственными препаратами направлена на восстановление функций нервов, улучшение проводимости нервных волокон и скорости передачи сигналов центральной нервной системе.
Лечение следует проводить длительными курсами, которые не стоит прерывать, хоть и эффект от них проявляется не сразу. Чтобы устранить болевые ощущения и расстройство сна, назначают следующие медикаменты:
- антидепрессанты;
- противосудорожные;
- препараты, купирующие аритмию;
- обезболивающие.
Для избавления от боли используют нестероидные противовоспалительные препараты. Но стоит помнить, что применять их можно только короткий промежуток времени, так как длительное употребление может привести к повреждению слизистой оболочки желудочно-кишечного тракта.
К физиотерапевтическим методам лечения аксональной полинейропатии относятся:
- терапия магнитными волнами;
- грязелечение;
- электростимуляция;
- иглоукалывание;
- лечебный массаж;
- физкультура;
- ультрафонофорез;
- гальванотерапия.
Именно лечебная физкультура позволяет сохранить работоспособность мышечных тканей и поддерживать конечности в нужном положении. Регулярные занятия спортом вернут мышцам тонус, гибкость и увеличат амплитуду движений до нормальной.
Прогноз
Если заболевание обнаружено на ранней стадии и комплексно лечится квалифицированными специалистами, то прогноз для жизни и здоровья пациента более чем благоприятный. Стоит вести правильный образ жизни, рацион должен быть богат витаминами и минералами, необходимыми для правильного функционирования организма.
Если долгое время игнорировать болезнь и не предпринимать никаких действий, результат будет плачевным вплоть до полного паралича.
Профилактика
Пациент в обязательном порядке должен совершать профилактические мероприятия, которые помогут избежать рецидива или возникновения опасного заболевания. Они включают в себя обогащение рациона витаминами, регулярный контроль уровня сахара в крови, полный отказ от табакокурения, наркотических веществ и алкогольных напитков.
В целях профилактики болезни рекомендуется:
- носить удобную обувь, которая не пережимает стопу, ухудшая кровоток;
- регулярно осматривать обувь, чтобы избежать образования грибка;
- исключить пешие прогулки на длительные расстояния;
- не стоять долгое время на одном месте;
- мыть ноги прохладной водой или делать контрастные ванночки, что помогает улучшить циркуляцию крови в организме.
Пострадавшим в стадии ремиссии категорически запрещается принимать лекарственные препараты без согласования с лечащим врачом. Важно своевременно лечить воспалительные заболевания, соблюдать меры предосторожности при работе с токсическими веществами, которые оказывают пагубное воздействие на организм, регулярно выполнять лечебные физические упражнения.
Р.Ф. МАСГУТОВ, А.А. РИЗВАНОВ, А.А. БОГОВ (мл.), А.Р. ГАЛЛЯМОВ, А.П. КИЯСОВ, А.А. БОГОВ
Республиканская клиническая больница МЗ РТ, г. Казань
Казанский (Приволжский) федеральный университет
Масгутов Руслан Фаридович
старший научный сотрудник Травматологического центра
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. 8-950-314-02-93, е-mail: [email protected]
В обзоре освещены современные методы терапии травмы периферических нервов в сочетании с классическими хирургическими способами лечения данной патологии. Представлены потенциальные стимуляторы посттравматической регенерации периферических нервов, ключевыми из которых являются сосудистый эндотелиальный фактор роста и основной фактор роста фибробластов, играющих роль узловых молекул в патофизиологии нейрорегенерации.
Ключевые слова: травма периферического нерва, нейротрофические факторы.
R.F. MASGUTOV, A.A. RIZVANOV, A.A. BOGOV (JR.), A.R. GALLYAMOV, A.P. KIYASOV, A.A. BOGOV
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Kazan (Volga region) Federal University
Current trends for treatment of peripheral nerves injuries
The review describes current treatment methods of peripheral nerve injuries in combination with classical surgical treatments of this pathology. Are presented potential stimulators of posttraumatic regeneration of peripheral nerves, where the key stimulators are vascular endothelial growth factor and basic fibroblast growth factor, which are basic molecules in the pathophysiology of neuroregeneration.
Key words: peripheral nerve injury, neurotrophic factors
Повреждения периферических нервов остаются одной из актуальных проблем современной травматологии и составляют 3-10% от всех травм опорно-двигательного аппарата [1]. Между тем травмы и заболевания периферической нервной системы приводят к стойкой утрате трудоспособности у 60-63% пациентов, более того, почти 80% этой группы составляют лица молодого трудоспособного возраста [2]. Повреждения периферических нервов оказывают существенное влияние на качество жизни в связи с потерей функции и повышения риска развития вторичной инвалидности от падений, переломов и других травм.
В представленном обзоре литературе дан анализ исследований последних лет, которые открывают новую страницу в понимании патофизиологии посттравматической регенерации периферического нерва и направляют как специалистов фундаментальных направлений, так и практикующих врачей на изучение и возможности клинического применения ростовых факторов, которые непосредственно принимают участие в восстановлении периферического нерва после его травмы.
Патогенез травмы периферического нерва
При повреждении нерва основным звеном патогенеза является деструкция нейронов.
Нейроны, формирующиеся в процессе развития, соединены в сложные коммуникационные сети для передачи информации от периферических рецепторов сенсорных нейронов в ЦНС (головного и спинного мозга), а также для передачи команд из центральной нервной системы на эффекторные органы, такие как скелетные мышцы, иннервируемые мотонейронами.
Периферический нерв состоит из аксона нейрона, Шванновских клеток, фибробластов, а также элементов кровоснабжения нерва. Соединительная ткань известная как эндоневрий окружает периферические аксоны. В периферических нервах аксоны сгруппированы в фасцикулы, окруженные соединительной тканью. Ключевой клеткой для периферических нервов является Шванновская клетка. Шванновские клетки образуют осевые цилиндры, их мембрана богата липидами, которые покрывают аксон и называется миелиновой оболочкой. Шванновские клетки с миелиновой оболочкой аксонов поддерживают и направляют аксоны во время регенерации нерва после его травмы. Тело нервной клетки является местом синтеза практически всех белков и органелл в клетке. Сложный процесс, известный как антероградный транспорт, непрерывно транспортирует вещества из тела клетки нейрона через аксон к его периферическому концу — в синапс. Эти транспортируемые вещества включают нейротрансмиттеры, которые обеспечивают связь между нейроном и тканями органа по узкой синаптической щели или, как в случае иннервации двигательных нейронов мышц, нервно-мышечном синапсе. С другой стороны, клетки-мишени, например, миоциты, экспрессируют вещества, которые действуют как нейротрофические факторы. Некоторые из этих веществ упаковываются и передаются путем ретроградного транспорта от синапса через аксон к телу нейрона. Таким образом, нейрон и его клетка-мишень постоянно информированы о статусе связи между ними. Было высказано предположение, что информация от клеток-мишеней принимает форму факторов, которые поддерживают существующие соединения нейронов и способствуют регенерации поврежденных нервных клеток. Несмотря на регенерацию, обширные травмы периферического нерва могут привести к параличам всей конечности или дистальных отделов конечностей. Прогноз восстановления при травмах периферических нервов лучше там, где повреждение Шванновских клеток минимально [3].
Нейротрофические факторы в механизме регенерации периферического нерва
За полвека исследований выявлено, что нейротрофические факторы способствуют выживанию и процессу роста нейронов. Восстановление нейрона критически зависит от количества нейротрофического фактора. После травмы нервов, периферическая нервная система млекопитающих реагирует путем экспрессии нейротрофических факторов, которые доступны из аутокринных или паракринных источников. Известны три основные группы нейротрофических факторов: 1) нейротрофины; 2) нейротрофические факторы семейства GDNF (англ. Glial cell line-derived neurotrophic factor) и 3) нейротрофические цитокины [4].
Повреждение периферического нерва вызывает ретроградную дегенерацию спинальных ганглиев, что сказывается преимущественно на кожных нейронах малого диаметра. Результаты исследований показывают, что кожные нейроны более чувствительны к повреждениям периферического нерва, чем мышечные, но их регенеративные способности не отличаются друг от друга [5].
Выживаемость нейронов после аксотомии является необходимым условием для регенерации, которой способствуют множество трофических факторов из нескольких источников, в том числе нейротрофины, нейропоэтические цитокины, инсулиноподобный фактор роста (англ. Insulin Growth Factor, IGF), факторы из глиальных клеток — семейства GDNF и др.
Так, после перерезки нерва увеличивается количество нейронов, экспрессирующих м-РНК мозгового нейротрофического фактора (англ. Brain Derived Neurotrophic Factor [6]. Выработка м-РНК BDNF в ответ на травму нерва показана не только в нейронах, но и в клетках-сателлитах [7].
После лигирования спинномозговых нервов уровень м-РНК фактора роста нервов (англ. Nerve Growth Factor, NGF) в спинальных ганглиях возрастает в 4 раза и поддерживается в течение 3 недель [8]. При этом подъем уровня м-РНК BDNF длится не более трех суток и менее выражен по сравнению с NGF.
Трансформирующий фактор роста β (TGFβ) служит митогеном для шванновских клеток и нейротрофическим фактором для некоторых дифференцирующихся нейронов. В интактных спинальных ганглиях TGFβ и его рецептор экспрессируются преимущественно в малых нейронах и в клетках-сателлитах, окружающих средние и большие нейроны [7]. После повреждения седалищного нерва крысы в эксперименте в клетках-сателлитах увеличивается экспрессия TGFβ, что сопровождается возрастанием уровня экспрессии его рецепторов практически во всех субпопуляциях нейронов [7].
In vitro GDNF стимулирует рост аксонов чувствительных нейронов, преимущественно малых, не экспрессирующих рецепторы нейротрофинов и выявляемых при помощи изолектин-B4 [9]. Эти авторы установили, что в той же культуре GDNF поддерживает выживание чувствительных нейронов, но не выявили их принадлежности к конкретным субпопуляциям (табл. 1).
Таблица 1.
Влияние нейротрофических факторов на выживание чувствительных нейронов в постнатальном периоде
|
Нейротрофический фактор |
Наличие (+) или отсутствие (–) эффекта |
Авторы |
|
NGF |
+ – |
Horie, Akahori, 1994;Lindsay, 1996 |
|
BDNF |
– + |
Lindsay, 1996;Acheson et al., 1995 |
|
NT-3 |
+ |
Acheson et al., 1995 |
|
GDNF |
+ |
Leclere et al., 1997 |
Установлено, что часть нейронов, экспрессирующих trkA и реагирующих, таким образом, на NGF, в конце эмбрионального и в постнатальном периоде перепрограммируется на действие другого нейротрофического фактора, а именно GDNF. В нейронах этой субпопуляции начинают экспрессироваться оба компонента рецептора GDNF — GFRa и тирозинкиназа c-ret [10]. Происходит ли подобное перепрограммирование при регенерации чувствительных нейронов, остается неясным.
Регенераторный рост центральных отростков нейронов различного фенотипа поддерживают конкретные нейротрофические факторы. Так, рост аксонов, экспрессирующих NF200 и принадлежащих субпопуляции больших проприоцептивных нейронов, стимулирует только один представитель семейства нейротрофинов — нейротрофин-3 (NT-3) [11] (табл. 2). Из тех же нейротрофинов только NGF поддерживает рост аксонов пептидергических ноцицептивных нейронов. И только один нейротрофический фактор является универсальным стимулятором роста аксонов больших, малых пептидергических и малых непептидергических нейронов. Этим фактором является GDNF [11].
Таблица 2.
Экспрессия нейротрофинов и их рецепторов нейронами спинальных ганглиев (по результатам экспериментов на нокаутных мышах [12]
|
Нейротрофин/ Рецептор |
Численность популяции нейронов в % |
Модальность |
|
NGF |
80 |
Ноцицепторы, терморецепторы, низкопороговые механорецепторы |
|
trkA |
80 |
Ноцицепторы, терморецепторы, низкопороговые механорецепторы |
|
trkB |
30 |
Механорецепторы (Майсснера) |
|
NT-3 |
60 |
Проприорецепторы, рецепторы волос и механорецепторы |
|
trkC |
20-30 |
Проприорецепторы |
После перерезки седалищного нерва усиливается экспрессия рецептора GDNF, но количество нейронов, реагирующих на этот нейротрофический фактор, не изменяется [13]. При этом объем популяции нейронов, содержащих trkA и отвечающих на действие NGF, после перерезки нерва уменьшается. Эти данные указывают на различный характер регуляции активности генов рецепторов нейротрофических факторов в субпопуляциях нейронов спинальных ганглиев в ответ на аксотомию.
Для судьбы отдельных нейронов важно присутствие нейротрофических факторов, которые способны активировать антиапоптозные внутриклеточные пути [14]. В списке факторов, влияющих на регенерацию нервных волокон, важное место занимают цитокины. Имеются данные о нейропротекторном действии интерлейкина-1b в отношении нейронов коры, которое может реализоваться через влияние этого цитокина на выработку нейротрофических факторов, например, NGF [15]. С другой стороны, in vitro показано, что интерлейкин-1b не влияет на выживание нейронов спинальных ганглиев, но ускоряет рост их отростков [16] и вместе с оксидом азота поддерживает в пептидергических нейронах экспрессию циклооксигеназы-2, что усиливает секрецию вещества «Р» [17]. Высказано предположение, что данный цитокин стимулирует секрецию нейротрофических факторов ненервными (Шванновскими) клетками [16], расположенными в потенциальном пространстве роста аксонов.
Представление об активации интерлейкином-1b регенерации нервных проводников основано на данных о стимулирующем влиянии продуцируемого макрофагами интерлейкина-1 на образование NGF шванновскими клетками in vitro и in vivo. Шванновские клетки in vitro и в регенерирующем нерве сами синтезируют интерлейкины и экспрессируют их рецепторы, что свидетельствует о возможной аутокринной регуляции. Нейроны также способны синтезировать цитокины. У интактных крыс до 80% нейронов спинального ганглия экспрессируют интерлейкин-1b [18]. Это преимущественно большие и средние нейроны. Данный цитокин экспрессируется в незначительной части малых пептидергических нейронов. Присутствие рецепторов интерлейкина-1 выявлено в большинстве нейронов спинального ганглия, а также в окружающих нейроны клетках-сателлитах [18], что свидетельствует об участии интерлейкина-1b в ауто/паракринной регуляции функции чувствительных нейронов.
Травмированные нейроны должны перейти от режима передачи к режиму роста и начать продуцировать белки, такие как, например, GAP-43 (англ. Growth Associated Protein), тубулин и актин, а также другие нейропептиды и цитокины, которые имеют потенциал для стимуляции аксональной регенерации. Аксоны должны достигать дистального отрезка нерва при условии, когда поддержка их роста осуществляется в достаточной степени. Шванновские клетки в дистальном отрезке нерва проходят через фенотипические изменения, которые должны быть благоприятны для аксональной регенерации. Шванновские клетки играют незаменимую роль в содействии регенерации за счет увеличения ими синтеза поверхностных молекул клеточной адгезии, таких как N-CAM (англ. Neural Cell Adhesion Molecule), Ng-CAM/L1 (англ. Neuron Glia Cell Adhesion Molecule), N-кадгерин и L2/HNK-1, путем изменения базальной мембраны, которая содержит многие белки внеклеточного матрикса, таких как ламинин, фибронектин и тенасцин. Аксональной регенерации могут способствовать факторы, которые повышают потенциал роста аксонов нейронов и оптимизируют регенерацию дистального конца нерва в сочетании с его оперативным лечением [19].
Основные методы лечения повреждения нервов являются: нейрорафия, нейрорафия с последующей дистракцией нерва, аутонервная пластика, эндопротезирование биодеградирующими материалами (например: neuragen® nerve guide).
Перспективными потенциальными стимуляторами регенерации периферических нервов являются сосудистый эндотелиальный фактор роста (англ. Vascular Endothelial Growth Factor, VEGF), основной фактор роста фибробластов (англ. basic Fibroblast Growth Factor, bFGF или FGF2) и NGF.
Эффект NGF иллюстрирует исследование по трансплантации в поврежденный седалищный нерв крысы микрокапсул, содержащих NGF в чистом виде. В группе с NGF количество восстановленных аксонов было большим, расположение нервных волокон было более упорядоченным, проводимость нерва восстанавливалась в разы быстрее, чем в контрольной группе. Также в сравнении с контрольной группой животных было отмечено, что в послеоперационном периоде раны заживали значительно быстрее [20].
Основной фактор роста фибробластов считается мощным средством для улучшения восстановления после повреждения нейронов, однако экзогенно применяемый bFGF неэффективен из-за кратковременного эффекта. Для усиления эффекта в естественных условиях разработана новая система доставки потенциальных стимуляторов путем внедрения bFGF в желатин гидрогель, который медленно биодеградирует. В этом исследовании эффекты bFGF-гидрогеля при травматическом повреждении лицевого нерва были исследованы на морских свинках. Лицевой нерв был обнажен и зажат в вертикальной части с использованием микрощипцов. Животные были подвергнуты одной из следующих трех процедур: группа А — контроль, без введения bFGF; группа В, одноразовое введение bFGF в нерв; группа С, применение bFGF-гидрогеля. Шесть недель спустя функции лицевого нерва были оценены тремя тестами: наблюдения за мимикой, электрофизиологические тестирования и гистологические исследования. Результаты показали, что одноразовое применение bFGF не влияло посттравматическое восстановление нерва. В группе с применением гидрогеля достигнуты лучшие результаты во всех тестах [21].
Местное применение VEGF индуцирует, по крайней мере, два события: пролиферацию Шванновских клеток и образование новых сосудов, которые играют важную роль в процессе регенерации нервов. Однако результаты показывают, что эффект от предварительной обработки факторами роста является локальным и ограниченным и не влияет на синтез нейропептидов [22].
Преодоление диастаза периферического с помощью биодеградирующией трубки из политетрафторэтилена (ПТФЭ) является относительно новым, но хорошо зарекомендовавшим хирургическим подходом для восстановления дефектов нервных стволов до 4 см между его концами на разных уровнях верхней конечности [23].
Восстановление периферического нерва с помощью трубки из ПТФЭ и введением факторов роста фибробластов также подтверждается в другом исследовании. В данном исследовании bFGF был помещен в эндопротез для седалищного нерва крысы. Кроме того, в послеоперационном периоде, животные системно получали 1 мг/кг/сут FK506 (такролимус) — мощный иммунодепрессант с нейротрофическими свойствами. Регенерация нерва оценивалась с помощью стандартных двигательных (индекс седалищного нерва) тестов и тестов на чувствительность, начиная со 2-й недели после операции. Животные, которые получали bFGF и FK506, показали значительно более быстрое восстановление после травмы, чем у контрольной группы [24].
После повреждения периферического нерва Шванновские клетки начинают экспрессировать bFGF, что нехарактерно для интактного нерва. Данный фактор рассматривается в качестве узловой молекулы в патофизиологии травмы периферических нервов [25].
В исследовании по восстановлению лицевого нерва после его перерезки и дальнейшего сшивания на крысах было показано, что у животных с введением bFGF восстановление нерва произошло раньше, а количество миелинизированных волокон было большим, чем у животных без введения bFGF [26].
Кроме того, на модели преодоления диастаза седалищного нерва крысы при помощи аутонервной вставки показано, что введение мультицистронной плазмиды pBUD-VEGF-FGF2 (Рис 1), экспрессирующей клонированные гены VEGF и bFGF человека, в центральный и периферический отрезки нерва, а также непосредственно в аутонервную вставку стимулирует реваскуляризацию и регенерацию периферического нерва. В эксперименте с аутонервной вставкой введение pBUD-VEGF-FGF2 в область повреждения нерва приводит к двукратному увеличению количества S100-иммунопозитивных (Шванновских) клеток в прилежащих к диастазу участке периферического отрезка нерва [27, 28].
Рисунок 1.
Плазмида, содержащая сосудистый эндотелиальный фактор роста (VEGF) и основной фактор роста фибробластов (FGF2).
Масгутов Р.Ф. и др., Клеточная трансплантология и тканевая инженерия, 2011
Заключение
Таким образом, сочетание классических хирургических способов восстановления нервных стволов и методов прямой терапии ростовыми факторами ускоряет аксональный рост, стимулирует реваскуляризацию нерва, что подтверждается многочисленными экспериментальными исследованиями и, в итоге, улучшает результаты посттравматического восстановления функции реиннервации поврежденного органа или ткани.
Благодарность
Выполнение данного научного исследования финансируется за счет темы государственного автономного учреждения здравоохранения «Республиканская клиническая больница Министерства здравоохранения Республики Татарстан» «Усовершенствование и разработка новых методов лечения у больных с повреждением плечевого сплетения и периферических нервов».
ЛИТЕРАТУРА
1. Берснев В.П. Хирургия позвоночника, спинного мозга и периферических нервов / Е.А. Давыдов, Е.Н. Кондаков // Специальная литература. — СПб, 1998. — С. 368.
2. Кубицкий А.А. Хирургическое лечение повреждений периферических нервов верхней конечности методами тракционного удлинения и аутонервной пластики: автореф. дис. … канд. мед. наук / А.А. Кубицкий. — Казань, 2002. — 24 с.
3. Massing M.W., Robinson G.A., Marx C.E., Alzate O., Madison R.D. Frontiers in Neuroscience. Alzate O., editor // Source Neuroproteomics. — Boca Raton (FL): CRC Press; 2010. — Chapter 15.
4. Boyd J.G., Gordon T. Neurotrophic factors and their receptors in axonal regeneration and functional recovery after peripheral nerve injury // Mol Neurobiol. — 2003 Jun. — Vol. 27, № 3. — Р. 277-324.
5. Welin D., Novikova L.N., Wiberg M., Kellerth J.O., Novikov L.N. Survival and regeneration of cutaneous and muscular afferent neurons after peripheral nerve injury in adult rats // Exp Brain Res. — 2008 Mar. — Vol. 186, № 2. — Р. 315-23.
6. Zhou X.F. et al. Injured primary sensory neurons switch phenotype for brain-derived neurotrophic factor in the rat // Neuroscience. — 1999. — Vol. 92, № 3. — P. 841 853.
7. Zhou X.F. et al. Satellite-cell-derived nerve growth factor and neurotrophin-3 are involved in noradrenergic sprouting in the dorsal root ganglia following peripheral nerve injury in the rat // Eur. J. Neurosci. — 1999. — Vol. 11, № 5. — P. 1711 1722.
8. Shen H., Chung J., Chung K. Expression of neurotrophin mRNAs in the dorsal root ganglion after spinal nerve injury // Brain Res. Mol. — 1999. — Vol. 64. — P. 186 192.
9. Leclere P. et al. Effects of glial cell line-derived neurotrophic factor on axonal growth and apoptosis in adult mammalian sensory neurons in vitro. Neuroscience. — 1997. — Vol. 5. — P. 545 558.
10. Molliver D.C. et al. IB4 binding DRG neurons switch from NGF to GDNF dependence in early postnatal life // Neuron. — 1997. — Vol. 19, № 4. — P. 4849 4861.
11. Ramer M., Priestley J., McMahon S. Functional regeneration of sensory axons into adult spinal cord // Nature. — 2000. — Vol. 403. — P. 312 316.
12. Farinas I., Cano-Jaimeza M., Bellmunta E., Soriano M. Regulation of neurogenesis by neurotrophins in developing spinal sensory ganglia // Brain Research Bulletin. — 2002. — Vol. 57, № 6. — P. 809 816.
13. Kashiba H., Hyon B., Senba E. Glial cell line-derived neurotrophic factor and nerve growth factor receptor mRNAs are expressed in distinct subgroups of dorsal root ganglion neurons and are differentially regulated by peripheral axotomy in the rat // Neuroscience Letters. — 1998. — Vol. 4. — P. 107 110.
14. Mattson M.P., Lindvall O. Neurotrophic factor and cytokine signaling in the aging brain // Greenwich. JAI Press. — 1997. — P. 299 345.
15. Strijbos P., Rothwell N. Interleukin-1 beta attenuates excitatory amino acid-induced neurodegeneration in vitro: Involvement of nerve growth factor // J. Neurosci. — 1995. — Vol. 15, № 5. — P. 3468 3474.
16. Horie H., Sakai I., Akahori Y., Kadoya T. IL-1 beta enhances neurite regeneration from transected-nerve terminals of adult rat DRG // Neuroreport. — 1997. — Vol. 8, № 8. — P. 1955-1959.
17. Morioka N. et al. Nitric oxide synergistically potentiates interleukin-1 beta-induced increase of cyclooxygenase-2 mRNA levels, resulting in the facilitation of substance P release from primary afferent neurons: involvement of cGMP-independent mechanisms // Neuropharmacology. — 2002. — Vol. 43, № 5 10. — P. 868 876.
18. Copray J.C. et al. Expression of interleukin-1 beta in rat dorsal root ganglia // Neuroimmunology. — 2001. — Vol. 118, № 8. — P. 203 211.
19. Fu S.Y., Gordon T. The cellular and molecular basis of peripheral nerve regeneration // Mol Neurobiol. — 1997. — Vol. 1-2. 67-116.
20. Song M., Chen S.Z., Han H., Xiong Y. An experimental study on repair of peripheral nerve injury by transplantation of microcapsulated NGF-expressing NIH 3T3 cells // Zhonghua Zheng Xing Wai Ke Za Zhi. — 2005. — Vol. 1. — Р. 53-7.
21. Komobuchi H., Hato N., Teraoka M., Wakisaka H., Takahashi H., Gyo K., Tabata Y., Yamamoto M. Basic fibroblast growth factor combined with biodegradable hydrogel promotes healing of facial nerve after compression injury: an experimental study // Acta Otolaryngol. — 2010. — Vol. 130, № 1. — Р. 173-8.
22. Sondell M., Lundborg G., Kanje M. Vascular endothelial growth factor stimulates Schwann cell invasion and neovascularization of acellular nerve grafts // Brain Res. — 1999 Nov 6. — Vol. 846, № 2. — Р. 219-28.
23. Stanec S., Stanec Z. Reconstruction of upper-extremity peripheral-nerve injuries with ePTFE conduits // J Reconstr Microsurg. — 1998 May. — Vol. 14, № 4):227-32.
24. Lanzetta M., Gal A., Wright B., Owen E. Effect of FK506 and basic fibroblast growth factor on nerve regeneration using a polytetrafluoroethylene chamber for nerve repair // Int Surg. 2003. — Vol. 88, № 1. — Р. 47-51.
25. Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. — 2010 Apr. — Vol. 31, № 3. — Р. 498-505.
26. Toledo R.N., Borin A., Cruz O.L., Ho P.L., Testa J.R., Fukuda Y. The action of topical basic fibroblast growth factor in facial nerve regeneration // Otol Neurotol. 2010. — Vol. 31, № 3. — Р. 498-505.
27. Масгутов Р.Ф., Салафутдинов И.И., Богов А.А. (мл.), Трофимова А.А., Ханнанова И.Г., Муллин Р.И., Исламов Р.Р., Челышев Ю.А., Богов А.А., Ризванов А.А. Стимуляция посттравматической регенерации седалищного нерва крысы с помощью плазмиды, экспрессирующей сосудистый эндотелиальный фактор роста фибробластов. Клеточная трансплантология и тканевая регенерация. — 2011. — Т. VI, № 3.
28. Челышев Ю.А., Мухамедшина Я.О., Шаймарданова Г.Ф., Николаев С.И. Прямая доставка терапевтических генов для стимулирования посттравматической нейрорегенерации // Неврологический вестник. — 2012. — T. XLIV, вып. 1. — С. 76-83.
Дата публикации 30 сентября 2022Обновлено 30 сентября 2022
Определение болезни. Причины заболевания
Периферическая нейропатия (Peripheral neuropathy) — это патология нервной системы, которая поражает нервы за пределами головного и спинного мозга: периферические нервы, спинномозговые корешки, спинномозговые нервы и сгруппированные из них сплетения, а также черепные нервы.
Распространённость периферической нейропатии
Существуют разные виды заболевания. Среди них более всего распространена диабетическая полинейропатия. Она возникает у 90 % пациентов, страдающих сахарным диабетом 2-го типа. В последующем у пациентов также развивается диабетическая стопа [5].
Алкогольная полинейропатия составляет 40 % от всех нейропатий и встречается у 10–50 % пациентов, злоупотребляющих алкоголем [5].
От нейропатии срединного нерва часто страдают офисные работники. Такая нейропатия медленно прогрессирует и долго остаётся незамеченной. При ней также развивается синдром запястного канала, при котором большой, указательный и средний пальцы кисти слабеют и немеют [11].
Причины периферической нейропатии
Причинами поражения периферической нервной системы могут быть:
- травма нерва — одна из самых благоприятных причин, и чем дальше травмированный нерв от головного и спинного мозга, тем выше шансы на восстановление, однако полный разрыв нерва можно устранить только с помощью своевременной операции, которая редко проходит успешно [11][12];
- тропные инфекции — те, чьи возбудители легче всего прикрепляются к нервам (например, опоясывающий лишай, грипп, корь, COVID-19, бруцеллёз, сифилис);
- наследственный фактор (например, атаксия Фридрейха);
- вакцины — некоторые препараты могут вызывать поствакцинальную нейропатию (случается редко) [13];
- лекарства (например, Изониазид и др.);
- алкоголь;
- работа на вредных производствах (например, с мышьяком, ртутью или свинцом).
Часто нейропатии становятся проявлением других болезней:
- дисметаболическая нейропатия — возникает при амилоидозе, гипотиреозе и сахарном диабете [4][5][8];
- паранеопластическая полинейропатия — при новообразованиях;
- полинейропатия при болезни соединительной ткани — сопровождает аутоиммунные нарушения, например васкулит, ревматоидный артрит, системную красную волчанку, склеродермию;
- моно- и полинейропатия при заболеваниях крови — развивается у пациентов с анемией или лейкозом.
Также встречаются компрессионно-ишемические нейропатии, например после сдавливания нерва в запястном канале.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы периферической нейропатии
Проявления болезни зависят от причины и количества поражённых волокон.
Симптомы мононейропатии
При поражении одного нерва, одного корешка или отдельного сплетения клиническая картина включает:
- слабость той мышцы, за которую отвечает повреждённый нерв, вплоть до плегии (полного отсутствия движений);
- снижение чувствительности;
- снижение мышечного тонуса и развитие мышечной атрофии;
- фасцикуляции, т. е. спонтанные сокращения мышцы при спокойном состоянии (развиваются не всегда);
- сухость и истончение кожи, ломкость ногтей, отёчность и депигментацию в той зоне, которую питает повреждённый нерв;
- боль над зоной поражения, отдающую в дальнюю зону иннервации, там же могут появиться «мурашки» (в зависимости от повреждённого волокна боли может не быть).
Симптомы множественной мононейропатии
При поражении нескольких одиночных нервов симптомы похожи на проявления обычной мононейропатии, только они появляются в разных нервных стволах, например одновременно поражается лучевой нерв левой и локтевой нерв правой руки.
Множественная мононейропатия часто встречается при гипотиреозе, васкулите и диабетической микроангиопатии, так как в начале этих болезней повреждаются сосуды, питающие нерв, после чего развивается ишемия и нейропатия.
Симптомы полинейропатии
Полинейропатию диагностируют при рассеянном и синхронном поражении периферических нервов. Часто оно начинается с длинных нервных волокон, поэтому симптомы нарастают от пальцев ног и рук вверх. Это проявляется:
- фасцикуляцией, крампи (судорогами в икроножных мышцах) и тремором, далее развивается мышечная слабость вплоть до парезов и атрофии;
- болью, повышением чувствительности, покалыванием, «мурашками» и атаксией (человек будто ходит по вате, появляется неуверенность при ходьбе, особенно в темноте);
- сухостью кожи, долго незаживающими ранками, постоянно холодными отекающими руками и ногами, которые приобретают синюшный оттенок.
Признаки поражения вегетативной нервной системы при полинейропатиях:
- нарушения сердечно-сосудистой системы — тахикардия в спокойном состоянии, ортостатическая гипотензия (давление резко снижается, когда человек встаёт на ноги);
- желудочно-кишечного тракта — ночная диарея, нарушение глотания, чувство переполнения желудка, изжога;
- мочеполовых органов — эректильная дисфункция, недержание или задержка мочи;
- трофических функций — повышенное потоотделение стоп или его отсутствие, отёки, безболезненные язвы [4][5][8][9].
Симптомы при поражении плечевого сплетения зависят от того, какой именно пучок пострадал:
- патология верхнего пучка сплетения (корешки С5–С6) — сопровождается слабостью мышц центральных отделов руки, пациент не может сгибать локоть, отводить и выворачивать плечо наружу, над дельтовидной мышцей и боковой поверхностью предплечья нарушается чувствительность, развивается вялый паралич двуглавой мышцы плеча (паралич Эрба — Дюшена);
- патология нижнего пучка сплетения (корешки С8–Th1) — проявляется слабостью кисти, невозможностью согнуть пальцы, нарушением чувствительности в области локтя, предплечья и кисти (паралич Дежерин — Клюмпке);
- патология пояснично-крестцового сплетения — характеризуется слабостью мышц таза и ног, из-за болей в пояснице, ягодице и тазобедренном суставе снижается чувствительность ноги, её рефлексы становятся более слабыми, также возможно развитие тазовых нарушений, но только при двустороннем поражении крестцового сплетения;
- патология нервных корешков (радикулопатия) — как правило, сопровождается снижением чувствительности, простреливающей или жгучей болью в спине, которая усиливается при натуживании и кашле, иногда выступает как осложнение васкулита или сахарного диабета.
Патогенез периферической нейропатии
Периферическая нервная система включает в себя спинномозговые корешки, периферические, черепные и спинномозговые нервы, из которых группируются спинномозговые сплетения.
Периферические нервы связывают центральную нервную систему со всеми органами и тканями организма. Они передают нервные импульсы и переносят макромолекулы из центральной нервной системы.
Нервный ствол формируется из совокупности нервных волокон, покрытых оболочками, которые изолируют один пучок от другого. Эти оболочки образованы из сетей мелких сосудов (vasa nervorum), которые питают нервное волокно и защищают от чужеродных белков. После повреждения оболочка определяет направление роста аксона и активно участвует в обмене веществ, чтобы ускорить восстановление нервных стволов.
Выделяют 3 типа повреждения нервных волокон:
- Валлеровское повреждение — травма с поперечным пересечением нерва. Регенерация начинается сразу после повреждения, но протекает медленно: с восстановления аксона и миелиновой оболочки. Чем дальше от центра был повреждён нерв, тем лучше прогноз, например если нерв повредиться дальше от ЦНС, то будет болеть только палец, а если ближе, то целая рука.
- Аксональная дегенерация — под влиянием токсических веществ аксону тяжелее переправлять различные вещества, а митохондриям выделять энергию. Далее нарушается миелиновая оболочка. Этот процесс можно прекратить, если устранить причину (например, при диабетической полинейропатии необходимо скорректировать уровень сахара в крови). Свободные радикалы и проблемы с тканевым дыханием также нарушают метаболизм в митохондриях.
- Демиелинизация — повреждение миелина, после которого импульсы медленнее движутся по нерву. Часто наблюдается при аутоиммунных заболеваниях, например при рассеянном склерозе, так как аутоиммунные реакции воздействуют на антигены миелина. Миелин также разрушается при наследственных болезнях или при миелинопатиях.
Также существуют другие механизмы повреждения:
- Дефицитарные полинейропатии — связаны с дефицитом витаминов группы В, которые участвуют в окислительно-восстановительных процессах организма. Могут быть следствием хронической патологии ЖКТ, при которой нарушается процесс всасывания (например, при неспецифическом язвенном колите, панкреатите, атрофическом гастрите и др.).
- Компрессионно-ишемические нейропатии — поражение периферического нерва в анатомических сужениях, где проходит нерв (например, отверстие в связке, костно-фиброзный канал и т. д.). Также возможно при длительном внешнем сдавливании нерва, например при определённых профессиях (работе с компьютерной мышкой) или привычных позах (например, сидеть нога на ногу).
- Синдром Гийена — Барре — острая воспалительная аутоиммунная полирадикулоневропатия. Возникает в результате воздействия провоцирующего фактора, обычно инфекции, поэтому за 1–6 недель до появления первых симптомов возникают признаки дыхательной или желудочно-кишечной болезни (грипп, герпес, корь, гепатит В и др.). Пусковым фактором также могут быть вакцины против гриппа, кори или краснухи. Встречаются разные формы, объединяющие черты демиелинизирующего и аксонального вариантов с соответствующими симптомами.
Классификация и стадии развития периферической нейропатии
По количеству вовлечённых нервных стволов различают:
- мононейропатию — поражение одного нерва;
- радикулопатию — поражение спиномозгового корешка;
- ганглионеврит — поражение ганглия (нервного узла);
- плексопатию — поражение сплетения;
- множественную мононейропатию — одновременное или последовательное асимметричное поражение отдельных нервов;
- полинейропатию — одновременное симметричное поражение разных нервов.
В зависимости от патологии нервного ствола можно выделить:
- аксонопатию — поражение отростков нервных клеток;
- миелинопатию — разрушение миелина;
- смешанные нейропатии [3][4][5][8].
Осложнения периферической нейропатии
Если не лечить мононевропатию, развивается мышечная слабость вплоть до атрофии мышц и плегии, когда пациент не может шевелить руками и становится инвалидом.
Осложнением диабетической полинейропатии является развитие диабетической стопы. Сначала стопы становятся менее чувствительными, и пациенты не обращают на это внимание, однако при малейшем повреждении раны заживают очень долго. Из-за сниженного иммунитета организм плохо реагирует на инфекции, что влечёт присоединение болезнетворной флоры и образование язвы. Рана нагнаивается и развивается гангрена, после чего стопу ампутируют [4][5].
Нарушение чувствительности искажает охранные реакции организма и замедляет рефлексы, из-за чего человек с полинейропатией может не чувствовать боль или изменение температуры, поэтому падения, травмы и ожоги относят к осложнениям.
Пациент также не замечает инфекционные воспалительные осложнения, в ходе которых развиваются незаживающие язвы не только на стопах.
Синдром Гийена — Барре может сопровождаться слабостью дыхательных мышц, что вызывает дыхательную недостаточность с возможным летальным исходом.
Если нейропатия возникла в детстве или подростковом возрасте, это может привести к недоразвитости ноги или руки.
Диагностика периферической нейропатии
В процессе диагностики важно выявить причину полинейропатии, так как от этого зависит тактика лечения. Для этого врач уточняет историю жизни пациента и этапы развития болезни, а также использует дополнительные методы обследования: исследования ликвора (при подозрении на синдром Гийена — Барре), электронейромиографию и общий анализ крови.
Сбор анамнеза и неврологический осмотр
В первую очередь врач проводит опрос пациента. Он уточняет:
- когда появились первые симптомы;
- что им предшествовало;
- менялась ли клиническая картина;
- присоединялась ли дополнительная симптоматика;
- как болезнь прогрессировала;
- где работал пациент;
- контактировал ли с токсичными химическими веществами.
Важно сообщить врачу о сопутствующих хронических болезнях (например, диабете или гипотиреозе). Это повлияет на прогноз и лечение симптомов со стороны периферической нервной системы.
После опроса врач определяет поверхностную и глубокую чувствительность, анализирует силу мышц и живость рефлексов. Если доктор замечает отклонения от нормы, он проводит специфические тесты, чтобы определить местоположение повреждённых нервов:
- поражение срединного нерва («кисть проповедника») — пациент не может собрать пальцы в кулак, противопоставить большой палец, согнуть большой и указательный пальцы;
- поражение лучевого нерва («свисающая кисть») — пациент не может разгибать пальцы и кисть с обращённой вниз ладонью;
- поражение локтевого нерва («когтеобразная кисть») — пальцы разогнуты в основных фалангах и согнуты в концевых, напоминая когти, большой палец не может удерживать предметы, развивается атрофия межкостных мышц кисти;
- поражение малоберцового нерва — ослабевают мышцы, разгибающие стопы и пальцы, снижается чувствительность по боковой поверхности голени и тыльной стороне стопы, стопа «свисает» и слегка повёрнута внутрь, пальцы немного согнуты;
- поражение большеберцового нерва — паралич мышц стопы и пальцев.
Инструментальная диагностика
Чтобы определить место повреждения, также используют тесты:
- Исследование с помощью монофиламента (моноволокна из пластика) — определяет тактильную чувствительность больших пальцев стоп, тыльной поверхности стопы и подошвы. Монофиламент держат перпендикулярно телу и в течение 1,5 секунд давят нитью на кожу. Оценка результатов теста простая: пациент либо чувствует, либо не чувствует прикосновения монофиламента.
- Исследование с нейротипс — определяет болевую чувствительность тыльной поверхности стоп и в области концевых фаланг больших пальцев с помощью укола тупой неврологической иглы.
- Исследование с помощью тип-терм — определяет температурную чувствительность с помощью специального термического цилиндра, один конец которого сделан из металла, а другой — из пластика. В норме прикосновение двух наконечников ощущается по-разному.
- Исследование с помощью камертона — определяет вибрационную чувствительность. Единственный способ, который позволяет установить диагноз на ранней стадии болезни. Порог вибрационной чувствительности оценивают с помощью неврологического градуированного камертона с частотой 128 Гц [13].
При периферической нейропатии также проводят электронейромиографию (ЭНМГ) и ультразвуковое исследование (УЗИ) нерва. ЭНМГ регистрирует электрические потенциалы, возникающие в мышцах при сокращении, и передаёт их на экран. В зависимости от показателей и сопутствующей клинической картины определяют очаг поражения. С помощью ЭНМГ также диагностируют характер двигательных нарушений и дифференцируют их между собой, уточняют уровень поражения нерва и выявляют стадию заболевания. Различают стимуляционную (электроды прикрепляют к коже) и игольчатую электромиографию (электроды вводят непосредственно в мышцу, после чего анализируют мышечное поражение) [14].
УЗИ оценивает анатомическую целостность нервного ствола, его структуру, чёткость контуров нерва и состояние окружающих тканей. С помощью УЗИ можно определить вид повреждения (полное или частичное), зону и степень сдавливания нервного ствола (отмечают уменьшение диаметра нерва), а также его причину.
В некоторых случаях проводят МРТ или КТ, например при подозрении на дискогенную радикулопатию пациент проходит МРТ.
Лабораторная диагностика
Пациент сдаёт общий анализ крови, а также, в зависимости от сопутствующих болезней, проверяет уровень глюкозы, гормонов щитовидной железы и т. д. [2][4][6][9] Например, при сахарном диабете может быть повышен уровень сахара в крови.
Дифференциальная диагностика
Периферическую нейропатию дифференцируют со следующими патологиями:
- злокачественными опухолями — диагноз устанавливают после сбора анамнеза и инструментального исследования (МРТ и КТ), которое исключает онкопроцесс;
- поражением спинного мозга — нарушаются сухожильные рефлексы, мышцы рук и ног слабеют, диагноз подтверждают с помощью МРТ;
- миастенией — это аутоиммунная болезнь, при которой пациент чувствует эпизодическую слабость в мышцах, диагноз подтверждает ЭНМГ и специфическая прозериновая проба (0,05%-й раствор Прозерина временно устраняет нарушение нервно-мышечной передачи, тем самым увеличивая амплитуду мышечных ответов);
- хронической окклюзией артерий ног — сопровождается утомлением и ноющими болями в икроножных мышцах при ходьбе, которые почти полностью проходят в спокойном состоянии (перемежающая хромота), диагноз исключают после ангиографии брюшной аорты и подвздошных артерий [7][8][9][10];
- боковым амиотрофическим склерозом (БАС) — обычно характеризуется слабостью в кистях и предплечьях, неловкостью при выполнении «тонких движений» пальцами и неконтролируемыми сокращениями мышц, реже — слабостью в верхних отделах рук и плечевом поясе; несмотря на схожесть БАС с полинейропатией, при неврологическом осмотре болезнь можно заподозрить благодаря патологическим рефлексам рук на фоне атрофии, обычно БАС развивается у людей старше 35 лет [11][12].
Лечение периферической нейропатии
Различают этиологическую, патогенетическую и симптоматическую терапию, при этом тактику лечения определяет только врач.
Этиологическая терапия
Направлена на причину болезни. Например, при токсической нейропатии необходимо исключить контакт с токсинами. Иногда применяют специфические антидоты:
- этилендиаминтетрауксусную кислоту (ЭДТА) и Пеницилламин при отравлении свинцом;
- Пеницилламин или Димеркапрол при отравлении ртутью;
- Унитиол, ЭДТА и Пеницилламин при отравлении мышьяком.
Лечение алкогольной полинейропатии основывается на исключении алкоголя и курса Тиамина (витамина В1).
Нейропатия на фоне гипотиреоза требует нормализации уровня тиреотропных гормонов с помощью заместительной гормонотерапии L-тироксином.
Постгерпетическая невралгия появляется после развития вируса герпеса, поэтому пациенту назначают противовирусную терапию: Ацикловир или Валацикловир в таблетках. При этом местные противогерпетические средства не эффективны.
При мононейропатиях исключают травмирующий фактор. Например, пациенту с нейропатией срединного нерва рекомендуют модифицировать рабочее место (подобрать компьютерную мышь с меньшей высотой подъёма кисти и перегиба в запястье) или отказаться от работы с мышкой. Важно временно снизить активность в суставе, которая усугубляет раздражение поражённого нерва [5].
Патогенетическая терапия
Направлена на устранение патологических процессов, возникших под воздействием различных причин, и включает в себя как приём препаратов, так и физиотерапию [5][7].
Медикаментозное лечение:
- Альфа-липоевая кислота (тиоктовая кислота) — внутренний антиоксидант, связывающий свободные радикалы. Назначают курсами с переходом от инъекционной формы на таблетированную. Показана при обменных нарушениях в комплексной терапии.
- Витамины группы В (В1, В6, В12) — улучшают обменные процессы в нейроэпителии и частично работают как антиоксидант. Обычно начинают терапию с инъекционных форм и далее переходят на таблетки.
- Препараты с уридинмонофосфатом — улучшают обменные процессы и регенерацию миелиновой оболочки в нервной ткани.
- Ингибитор холинэстеразы (с содержанием ипидакрина) — увеличивает содержание ацетилхолина и влияет на блокаду калиевых каналов в мембране клетки, что улучшает нервно-мышечную передачу.
- Препараты с содержанием пентоксифиллина (Трентал или Вазонит), никотиновая кислота — улучшают периферическое кровоснабжение.
Физиотерапия:
- Иглорефлексотерапия — метод лечебного воздействия на организм с помощью иглоукалывания биологически активных точек.
- Физиопроцедуры:
- Электрофорез — введение лекарств с помощью постоянного электрического тока. Эффект от процедуры отсроченный, так как в коже и тканях создаётся лекарственное «депо».
- Ультрафонофорез — введение лекарств осуществляется под воздействием ультразвука.
- Дарсонвализация — воздействие переменным импульсным высокочастотным током. Метод используют для обезболивания, снижения чувствительности нервных окончаний к болевым раздражителям, улучшения кровообращения и снабжения тканей кислородом.
- Электростимуляция — воздействие импульсного электрического тока, который поддерживает работу мышц и нервов, а также усиливает кровообращение и мышечный тонус.
- Диадинамотерапия — воздействие диадинамических импульсных электрических токов. Рекомендована при хронических нейропатических болях.
- Магнитотерапия (транскраниальная магнитная стимуляция) — применение статического или переменного магнитного поля. Оказывает противовоспалительный, обезболивающий и противоотёчный эффекты.
- Лечебная физкультура — назначают на раннем этапе восстановления.
Чтобы снизить нагрузку, при нейропатии срединного нерва пациент также носит ортез на лучезапястном суставе.
Симптоматическая терапия
Направлена на устранение симптомов, в первую очередь боли.
Чтобы снять болевой синдром, используют разные группы препаратов в зависимости от типа нейропатии, например нестероидные противовоспалительные средства, наркотические анальгетики, противосудорожные перепараты, антидепрессанты, транквилизаторы, а также пластыри с Лидокаином [1][5][7][10].
При мононейропатиях применяют лечебные блокады — введение в область нервов, сплетений и узлов анестетика, который прерывает передачу нервных импульсов от источника боли. В зависимости от симптомов и сопутствующих болезней блокады могут содержать один компонент либо быть многокомпонентными [1]. Блокаду используют при плексопатиях и радикулопатиях, которые сопровождаются сильной болью и ограничением движений рук или ног. Её также применяют, когда таблетки не приносят результата.
Пациент может получить больничный, если периферическая полинейропатия не позволяет заниматься привычными делами дома и на работе.
Прогноз. Профилактика
Прогноз при мононейропатии благоприятный, если нет сопутствующих болезней, тормозящих восстановление.
Полностью вылечить полинейропатию сложно, так как обычно она возникает на фоне хронической патологии, поэтому главная цель лечения заключается в том, чтобы избавлять пациента от симптомов так долго, насколько это возможно.
При наследственных поражениях периферической нервной системы прогноз часто неблагоприятный.
По результатам медико-социальной экспертизы (МСЭ) пациенту могут выдать справку об инвалидности. Показания для направления на МСЭ:
- парезы и паралич, стойкий болевой синдром, нарушение походки и координации движений (сенситивная атаксия), выраженные нарушения питания и работы внутренних органов, сосудов и различных желёз организма, существенно влияющей на жизнь пациента;
- длительная временная нетрудоспособность при плохом или сомнительном прогнозе в отношении восстановления двигательных и иных функций;
- прогрессирующее течение и рецидивы болезни с учётом её причин;
- невозможность вернуться к работе по специальности в связи с двигательным дефектом и/или противопоказанными условиями труда, которые не могут быть устранены по заключению врачебной комиссии.
При нейропатии освобождают от службы в армию, но при необходимости могут призвать [15].
Профилактика периферической нейропатии
Предупредить нейропатию, вызванную системной патологией, можно с помощью ежегодной диспансеризации, в течение которой врачи смогут выявить болезнь на раннем этапе [5]. Профилактика остальных форм нейропатии зависит от причин их появления.
Неврит лицевого нерва — это разновидность острого функционального расстройства. Паралич Белла — это диагноз, который используется для описания периферического неврита лицевого нерва. Паралич Белла, по сути, является диагнозом исключения периферической невропатии лицевого нерва. Если причины паралича не могут быть определены и подтверждены, диагноз будет «паралич Белла».
Паралич Белла может иметь множество причин происхождения, включая местное переохлаждение лица, головы и шеи из-за холода, ветра, кондиционирования воздуха, сквозняков. Дополнительными факторами риска являются стресс, гипертония и последние недели беременности. При параличе Белла повреждается только лицевой нерв. Мышцы лица, при классическом неврите лицевого нерва, если не было никаких травм, остаются здоровыми и функциональными. Повреждения при неврите приводит к неспособности лицевого нерва передавать сигналы лицевым мышцам. То, что вы можете испытывать, например, лицевые боли, контрактуры лицевых мышц, напряжение или слабость мышц, синкинезию и другие неудобства после паралича Белла, — это осложнения и остаточные явления, которые развиваются в течение длительного периода восстановления. Они не являются параличом Белла сами по себе, это всего лишь осложнения, которые развиваются в результате длительного выздоровления.
Давайте подробнее рассмотрим, как происходит невропатия лицевого нерва и её восстановление. Примечание: в дальнейшем я использую названия неврит лицевого нерва, невропатия лицевого нерва и паралич Белла как синонимы одного недуга.
Содержание
- Повреждение лицевого нерва при неврите лицевого нерва
- Ветви лицевого нерва и мышцы которые они иннервируют:
- Три стадии повреждения лицевого нерва при параличе Белла
- 1 стадия: повреждение путем сдавливания или нарушения кровоснабжения.
- 2 стадия: развитие блока проведения (потеря оболочки и разъединение)
- 3 стадия: происходит дегенерация аксонов (разъединение)
- Восстановление лицевого нерва после паралича Белла
- Как долго может длиться восстановительный процесс при невропатии лицевого нерва?
- Какие мышцы вероятнее всего начнут двигаться первыми?
Повреждение лицевого нерва при неврите лицевого нерва
Наш лицевой нерв имеет 5 основных ветвей. Они иннервируют различные мускулы мимики. В большинстве случаев повреждение лицевого нерва во время неврита лицевого нерва происходит в узком костном канале сразу за ухом. Это место, где все пять ветвей еще соединены в одну «трубку».
Ветви лицевого нерва и мышцы которые они иннервируют:
• Височная ветвь — лобная мышца, верхняя часть круговой мышцы глаза, мышца гордецов, мышца, сморщивающая бровь
• Скуловая ветвь — нижняя часть круговой мышцы глаза, носовые мышцы, мышца поднимающая верхнюю губу, скуловые мышцы
• Щечная ветвь — верхняя часть круговой мышцы рта, мышца поднимающая угол рта, щечная мышца, мышца смеха
• Краевая нижнечелюстная ветвь — мышца опускающая угол рта, мышца опускающая нижнюю губу, подбородочная мышца
• Шейная ветвь — поверхностная мышца шеи – платизма
При нетравматическом неврите лицевого нерва, все ветви повреждаются в результате механического сдавления отечными тканями (как правило, в канале пирамиды височной кости) или вследствие нарушения кровоснабжения ствола нерва. Скорость регенерации поврежденных нервных волокон (аксонов) не одинакова для разных ветвей нерва. По этой причине восстановление функций лицевых мышц также происходит неравномерно. Иногда первым возвращается способность закрывать глаз, иногда это могут быть движения угла рта или способность приподнимать бровь.
Давайте взглянем подробнее как происходит повреждение нерва.
Три стадии повреждения лицевого нерва при параличе Белла
1 стадия: повреждение путем сдавливания или нарушения кровоснабжения.
Как мы знаем из предыдущего поста о строении нерва, нервное волокно (аксон) является частью живой клетки. Поэтому оно может повреждаться при механическом сдавлении или нарушениях местной микро циркуляции крови.
Периферический паралич лица, как правило, развивается в течение нескольких часов, иногда в течение нескольких дней. На этом этапе чрезвычайно важно приложить все усилия для активной борьбы с повреждающим фактором – вирусной инфекцией, отеком тканей или сосудистым спазмом.
2 стадия: развитие блока проведения (потеря оболочки и разъединение)
В течение первых трех дней компрессии или ишемии нерва, погибают так называемые «клетки Шванна», которые обеспечивают электроизоляцию аксона при помощи специального белка миелина, входящего в состав их мембран. Проведение мимических сигналов от головного мозга к мышцам лица прерывается и наступает «блок проведения». На этом этапе повреждение нерва все еще минимально, и если незамедлительно провести правильное лечение с целью убрать повреждающий фактор, то клетки Шванна регенерируют и восстановят электроизоляцию аксонов. Само тело аксона остается неповрежденным. В таких случаях полное спонтанное восстановление происходит в течение 3-5 недель.
3 стадия: происходит дегенерация аксонов (разъединение)
Если повреждающий фактор продолжает действовать дольше 4-6 дней, то аксоны нерва (проводящие волокна нервных клеток – мотонейронов) погибают и развивается аксональная дегенерация. Теперь больше нет прямого физического соединения мозга с мимическими мышцами. Аксонам придется регенерировать от точки повреждения до мышц лица. Обычно это расстояние в 9-10 сантиметров. При самых лучших условиях скорость аксональной регенерации не превышает 1 миллиметра в сутки. Поэтому может проходить до трех месяцев, прежде чем вернутся первые мимические движения.
Восстановление лицевого нерва после паралича Белла
Как только произошло повреждение лицевого нерва, организм немедленно начинает регенеративный процесс. Ему требуется «отрастить» около 7000 аксонов («проводов» или нервных волокон), а также восстановить их электрическую изоляцию (миелиновую оболочку). По мере того, как аксоны отрастают и начинают присоединяться к лицевым мышцам, мы начинаем чувствовать подрагивание, покалывание, вибрацию мышечных волокон, или похожие ощущения. Это все – хорошие признаки. Вскоре после их появления, начинают возвращаться мимические движения.
Задолго до возвращения первых мимических движений, восстанавливается тонус мышц. После возвращения тонуса, лицо в нейтральном состоянии (без движений) – практически симметрично. Асимметрия проявляется лишь при разговоре или проявлении эмоций.
Как долго может длиться восстановительный процесс при невропатии лицевого нерва?
Нервные волокна отрастают медленно – около 1мм в день. Иногда регенерация отдельных волокон останавливается на полпути и они не подключаются обратно к своим мышцам-целям. В этом случае мышца восстанавливает свои функции лишь частично. Результатом такого неполного восстановления становится с одной стороны, слабость данной мышцы, а с другой – формирование ее контрактуры из-за «переработки» той части мышечных волокон, которые все же восстановили связь с мозгом.
Очень важно практиковать МЯГКИЙ массаж лица несколько раз в день в течение всего восстановительного периода. Массаж стимулирует регенерацию нерва и предотвращает образование контрактур. Взгляните на наши рекомендации, что делать, чтобы улучшить восстановление.
Другое осложнение, которое формируется при медленном восстановлении после невропатии лицевого нерва – это патологические синкинезии. Синкинезии – это непроизвольные сокращения тех мимических мышц, которые в норме не участвуют в данном мимическом движении. Например, это непроизвольное сужение глазной щели на пораженной стороне при разговоре или улыбке. Другой распространенный вид синкинезий – это непроизвольное движение угла рта при моргании или зажмуривании.
Какие мышцы вероятнее всего начнут двигаться первыми?
Сложно заранее точно сказать, функция какой мышцы и какие движения восстановятся в первую очередь. Часто закрывание глаза и небольшие движения угла рта возвращаются раньше, чем другие мимические движения. По моему опыту, у большинства пациентов дольше всего восстанавливается способность поднимать брови (лобная мышца). Причина мне неизвестна.
Одновременно с процессом денервации, возникшей при повреждении нерва, начинаются восстановительные процессы, которые могут идти по трем направлениям.
(1) Регенерация нерва: проксимальная культя формирует аксональные выросты (наплывы аксоплазмы, или «колбы роста»), которые начинают продвигаться дистально и врастать в эндоневральные трубки (разумеется, лишь в тех случаях, когда последние сохранили свою целостность). Миелиновая оболочка вновь образующегося волокна формируется из тяжей леммоцитов. Скорость регенерации аксонов составляет приблизительно 1.5–2 мм в день. Отдельные нервные проводники имеют различную способность к регенерации: среди периферических нервов особенно хорошо восстанавливается функция лучевого и мышечно-кожного нервов, а наихудшими регенеративными способностями обладают локтевой и малоберцовый нервы. Для достижения хорошего восстановления растущие аксоны должны подключиться к дистальной культе нерва до того, как в ней наступят выраженные пери- и эндоневральные рубцовые сращения. В случаях формирования по ходу прорастающего волокна соединительнотканного рубца часть аксонов не распространяется в дистальном направлении, а беспорядочно отклоняется в стороны, формируя травматическую неврому. При полном анатомическом повреждении нервного ствола через 2–3 недели после травмы на центральном конце образуется ампутационная неврома. Регенерация нервного ствола может происходить гетерогенно: часть двигательных волокон врастает в оболочки чувствительных, а одноименные — в пучки, иннервирующие разноименные участки конечности.
(2) В случаях, когда в нервном стволе поражаются не все, а лишь часть нервных волокон, восстановление функции мышц возможно за счет разветвления сохранившихся аксонов и «захвата» ими тех мышечных волокон, которые иннервировались погибшими аксонами; при этом происходит укрупнение двигательных единиц мышцы. За счет этого механизма мышца может сохранять свою работоспособность в случаях утраты до 50 % иннервировавших ее аксонов (а для мышц, не развивающих значительных усилий — даже до 90 %), однако для полного завершения процесса компенсаторной иннервационной перестройки требуется около года.
(3) В ряде случаев (обычно при травме нервного ствола типа ушиба) восстановление или улучшение функций связано с обратимостью некоторых патоморфологических процессов: с исчезновением реактивных воспалительных явлений, с рассасыванием мелких кровоизлияний и т. д. При нетяжелых травмах проводимость нерва, даже после полной ее потери, восстанавливается в течение первых дней или недель.
К основным факторам, определяющим при периферических невропатиях и плексопатиях скорость и степень спонтанного восстановления нарушенных функций (и, следовательно, объем и направленность лечебных вмешательств), относятся следующие:
‒ степень повреждения нервного проводника;
‒ уровень поражения;
‒ характер повреждающего агента.
Реабилитологи чаще всего определяют степень повреждения нерва по 3 категориям согласно классификации H.Seddon. Иногда используют также классификацию S.Sunderland, выделяющего 5 степеней повреждения нервов; эта классификация основана на классификации H.Seddon, детализируя ее. Согласно классификации H.Seddon, все локальные повреждения нервных стволов делят, в зависимости от сохранности аксона и соединительнотканных структур, на три группы:
‒ нейрапраксия;
‒ аксонотмезис;
‒ нейротмезис.
Нейрапраксия (neurapraxia, англ.) — это повреждение нерва, не приводящее к гибели аксона. Часто наблюдается при компрессии нерва (например, «ночной субботний паралич» вследствие компрессии лучевого нерва), при легкой травме нерва. Клинически характеризуется снижением вибрационной, проприоцептивной, иногда тактильной чувствительности. Болевая чувствительность страдает реже. Часто наблюдаются двигательные нарушения и парестезии. Блок проведения нервного импульса, наблюдающийся вследствие локального повреждения миелиновой оболочки, носит преходящий характер и регрессирует по мере восстановления миелина. Восстановление двигательных и чувствительных функций может продолжаться до 6 месяцев.
Аксонотмезис (axonotmesis, англ.) — повреждение нерва, приводящее к гибели аксона при сохранности эпиневрия, периневрия, эндоневрия и шванновских клеток. Нередко наблюдается при закрытых переломах либо вывихах костей конечностей, а также при сдавлениях нервных стволов. Нарушаются двигательные, чувствительные и судомоторные функции нерва. Восстановление функций происходит за счет регенерации аксона. Скорость и степень восстановления зависит от уровня поражения, возраста (у молодых регенерация происходит быстрее) и общего состояния больного. В случаях, когда прорастание аксона происходит медленно, может произойти рубцевание эндоневральной трубки, в которую прорастает аксон, и восстановление не наступает. По этой же причине неблагоприятный прогноз имеется в случаях, когда дефект нервного ствола имеет значительную длину. При благоприятных условиях происходит постепенная невротизация дистального отдела поврежденного нерва, которая продолжается в течение многих месяцев, иногда год и более. Наблюдается восстановление утраченных функций, но не всегда полное.
Нейротмезис (neurotmesis, англ.) — разрыв нерва с пересечением аксона и соединительнотканных оболочек нерва. Из-за того, что повреждаются эндоневральные трубки, невозможным становится прорастание в них аксонов, регенерация аксонов приводит к образованию травматической невромы. Прогноз восстановления неблагоприятный.
Данная классификация основана на микроскопических изменениях в нервном стволе. Макроскопически различить степень повреждения практически невозможно. Диагностика основана на динамическом клиническом и электрофизиологическом наблюдении. В связи с этим при закрытых травмах нервных стволов нередко применяют иную классификацию, основанную на выделении следующих 4 форм поражения нервного ствола:
‒ сотрясение
‒ ушиб
‒ сдавление
‒ тракция
Сотрясение не сопровождается морфологическими изменениями в нерве, нарушения функции нерва кратковременны (не более 1–2 недель) и полностью обратимы.
Ушиб нерва характеризуется возникновением мелких кровоизлияний, участков размозжения нервных волокон и пучков, что приводит к полному либо частичному нарушению проводимости, длительным и стойким выпадением функций.
При сдавлении нерва степень нарушения проводимости зависит в первую очередь от длительности сдавления: при своевременном удалении сдавливающих нерв субстратов (гематома, инородное тело, отломок кости и т. д.) может наблюдаться быстрое и полное восстановление проводимости, тогда как при длительном сдавлении в нервном стволе развиваются дегенеративные изменения. Отсутствие восстановления функции в течение 2–3 месяцев является критерием полного анатомического перерыва нерва.
Тракция (например, тракдия ветвей плечевого сплетения при вправлении вывиха плеча) обычно сопровождается частичным нарушением функции, однако восстановление проводимости по нерву происходит достаточно длительно (в течение нескольких месяцев).
Чем проксимальнее поражение нервного ствола или сплетения (т. е. чем больше расстояние от места повреждения до периферических окончаний), тем хуже прогноз восстановления функции, поскольку тем больший срок требуется для прорастания нервного волокна и тем больше вероятность развития в эндоневральной трубке периферического отрезка нерва необратимых рубцовых изменений. Так, например, по данным С. И. Карчикяна, при ранениях седалищного нерва в верхней трети бедра первые движения стопы и пальцев появляются лишь спустя 15–20 месяцев и позже после наложения нервного шва, а при ранениях этого же нерва в нижней трети бедра — через 10–15 месяцев после оперативного вмешательства. Наихудший прогноз отмечается при повреждениях на корешковом уровне, поскольку корешки спинальных нервов не регенерируют и не могут быть восстановлены хирургическим путем. Поражение корешков (обычно — отрыв корешка на шейном уровне), в отличие от поражения сплетения, характеризуется следующими признаками:
‒ интенсивная жгучая боль, иррадиирущая вдоль соответствующего дерматома;
‒ парализация паравертебральных мышц, иннервируемых задними ветвями спинальных нервов;
‒ паралич мышц лопатки вследствие нарушения функции коротких нервов плечевого пояса (крыловидная лопатка);
‒ синдром Горнера (при поражении С8-ты корешков);
‒ трофические нарушения и быстро прогрессирующая мышечная атрофия с грубыми вторичными контрактурами.
Периферические невропатии и плексопатии могут иметь самую различную этиологию. В мирное время наиболее частой формой поражений периферических нервов являются туннельные невропатии, составляя около 30–40 % от всех заболеваний периферической нервной системы. Туннельная невропатия — это локальное поражение нервного ствола, обусловленное его компрессией и ишемией в анатомических каналах (туннелях) или вследствие внешнего механического воздействия. Предрасполагающие к развитию туннельных невропатий факторы включают генетически обусловленную узость естественных вместилищ нерва, приобретенную узость этих вместилищ вследствие отеков и гиперплазии соединительной ткани при различных заболеваниях (например, сахарном диабете, гипотиреозе, коллагенозах), длительное перенапряжение мышечно-связочного аппарата у лиц определенных профессий, последствия трав, мышечно-тонические и нейро-дистрофические нарушения при рефлекторных синдромах остеохондроза позвоночника, ятрогенные травмирующие воздействия (неправильное наложение гипсовой повязки, кровоостанавливающего жгута). Нарушение функции нерва происходит вследствие как демиелинизации, так и поражения аксона (ухудшение нейротрофического контроля в связи с недостаточностью аксонального транспорта). Туннельные поражения нервов проявляются в первую очередь болью, чувствительными и вегетативными расстройствами. Двигательные нарушения развиваются лишь у одной трети больных и заключаются, как правило, в снижении мышечной силы, гипотрофии мышц, развитии контрактур. Прогноз восстановления функций при рано начатом лечении обычно благоприятный, однако это восстановление может происходить достаточно длительно, до нескольких месяцев. Кроме того, прогноз зависит от основного заболевания, на фоне которого развилась невропатия, от того, сохраняются ли профессиональные перегрузки конечности. В 30–40 % случаев туннельные невропатии рецидивируют.
На втором месте по частоте находятся травматические невропатии. Среди причин травматических невропатий прогностически наиболее благоприятными являются резаные ранения, при которых своевременное оперативное вмешательство обеспечивает хороший исход.
Тракционные и огнестрельные травмы имеют худший прогноз, поскольку при них нередко измененными оказываются центральный отрезок нерва и нейрон спинномозговых центров, что существенно затрудняет регенерацию нерва. Разрушение нервного ствола на большом протяжении может наблюдаться также при электротравме, при химическом повреждении (случайное введение в нерв различных лекарственных веществ). Весьма неблагоприятно сопутствующее повреждению нерва нарушение кровообращения в конечности (кровотечение либо длительное наложение кровоостанавливающего жгута, тромбоз магистральной артерии), которое может приводить к развитию в мышцах, сухожилиях, суставных сумках, коже и подкожной клетчатке атрофирующего склерозирующего процесса с образованием контрактур. Препятствовать восстановлению движений могут также вторичные изменения в суставах и сухожилиях, которые развиваются вследствие растяжения связок и суставных сумок при пассивном свешивании конечностей в случае вялого паралича или пареза. При невро- и плексопатиях, развившихся на фоне соматических заболеваний, вследствие иммунных, неопластических, инфекционных, токсических поражений и воздействий прогноз зависит от характера течения основного заболевания либо процесса.
Литература:
- Диагностика повреждения периферических нервов С. М. Рассел издательство: Бином Год: 2009 Страниц:251
- Неврология и нейрохирургия. Том 1. 4-е издание
- Автор: Гусев Е. И., Коновалов А. Н., Скворцова В. И.
- http://www.medicport.ru/doctors/stati_dlya_vrachej/materialy/lechenii_zabolevanij_perifericheskih_nervnyh_stvolov_i_spletenij/
- http://vse-zabolevaniya.ru/bolezni-nejrohirurgii/porazhenija-nervnoj-sistemy.html
- http://aupam.narod.ru/pages/medizina/reab_ruk_rbsdn_t2/page_28.htm
Основные термины (генерируются автоматически): нервный ствол, повреждение нерва, нерв, невропатия, гибель аксона, кровоостанавливающий жгут, миелиновая оболочка, нарушение функции нерва, основное заболевание, травматическая неврома.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Тутуров А.О.
1
1 СамГМУ
Исследование современных технологий в восстановлении протяжённых дефектов нервов является важной фундаментальной задачей нейрохирургии и травматологии. Данные повреждения дифференцируются по сумме вовлеченных в патологический процесс окружающих тканей и компонентов нерва. Наиболее сложного, объёмного и, часто, безрезультатного лечения требуют именно травмы, приводящие к формированию больших диастазов, нервов. Причиной этому служит сочетание сразу нескольких ключевых деталей: полное пересечение нервного ствола, потеря направляющего канала для регенерации, и, в дальнейшем, создание условий для образования посттравматической невромы. Тотальный разрыв всей полости, иначе говоря, невротмезис, приводит к утрате сообщения между нервными волокнами проксимального и дистального участка нерва, нарушает целостность миелиновой оболочки и соединительнотканных элементов. Вследствие разобщения волокон , потери направляющего канала – эпиневрия и утраты его внутренней среды регенерация не наступает. Все эти процессы приводят к образованию соединительнотканных колбовидных утолщений – невром, что указывает на терминальную стадию повреждения нерва – прекращения его функционирования в дистальном отделе. Исходя из анатомического обоснования сформированного диастаза ушивание дефекта эпиневральными швами не возможно, так как это неминуемо приведет к его перенатяжению или расслоению. Начиная с 1910-ых годов, многие нейрохирурги поставили перед собой задачу лечения данных травм. Развитие технологий направило исследования на создание кондуитов — искусственных проводников, помещаемых в диастаз нерва и создающих необходимые условия для регенерации нервных волокон в заданном направлении, за счет искусственной внутренней среды. С тех пор восстановление протяженных дефектов нервов стало возможным и получило широкое применение и развитие по всему миру. В обзоре проанализированы различные варианты кондуитов с их уникальной внутренней средой, а также смежные с ними разработки, показывающие использование регенераторного потенциала нервной ткани, для выявления наиболее верного направления в развитии технологий восстановления протяжённых дефектов нервов.
невротмезис
повреждение нерва
протяженные дефекты
кондуиты
регенераторный потенциал.
1. Берснев В.П. Хирургия позвоночника, спинного мозга и периферических нервов / Е.А. Давыдов, Е.Н. Кондаков // Специальная литература. — СПб, 1998. — С. 368.
2. Кубицкий А.А. Хирургическое лечение повреждений периферических нервов верхней конечности методами тракционного удлинения и аутонервной пластики: автореф. дис. … канд. мед. наук / А.А. Кубицкий.— Казань, 2002. — 24 с.
3. Козлов А. В., Афанасьев Л. М., Якушин О. А., Молочков Е. В. Хирургическая тактика лечения больных с повреждениями нервов // III съезд нейрохирургов России : материалы съезда. – СПб., 2002. – С. 526–527.
4. Бабаханов, Ф.Х. Микрохирургические реконструктивно-восстановительные операции при массивных повреждениях периферических нервов / Ф.Х.Бабаханов, А.К.Муминов, Д.Б.Якубов, Б.А.Абдушукуров // Материалы III съезда нейрохирургов России. М., 2002. — С. 52.
5. Патент РФ № 2153295. Способ аутонейропластики.
6. Патент РФ № 2179828. Способ выделения и отсечения икроножного нерва с образующими его ветвями и инструмент для его осуществления
7. Патент РФ №2154431. Способ лечения обширных повреждений лучевого нерва на плече.
8. Патент РФ №99107088/14. Способ восстановления чувствительности на стопе.
9. Борода Ю.И. Хирургия дефектов нервных стволов конечностей / Ю.И. Борода, В.П. Берснев // Мат. III съезда нейрохирургов России СПб, 2002. — С. 524525.
10.BY №10011. Способ восстановления нервного ствола.
11.Патент РФ №2471435. Способ восстановления поврежденного нерва при дефектах на большом протяжении.
12. Патент РФ №2176482. Способ пластики дефекта нервного ствола.
13. Senoglu M., Nacitarhan V., Kurutas E.B. Intraperitoneal Alpha-Lipoic Acid to prevent neural damage after crush injury to the rat sciatic nerve / M. Senoglu [etc.] // J Brachial Plex Peripher Nerve Inj. — 2009. — P. 22.
14. Патент РФ №2347539. Способ лечения повреждения периферического нерва.
15. SU №1204197. Способ восстановления нервного ствола.
16. Foramitti C. Zur technik der nervennaht / C. Foramitti [etc.] // Arch Klin Chir. — 1904. — P. 643–648.
17. Tang J.B., Gu Y.Q., Song Y.S. Repair of digital nerve defect with autogenous vein graft during flexor tendon surgery in zone 2 / J. B. Tang [etc.] // J Hand Surg Br. — 1993. — P. 449-453.
18. Chiu D.T., Strauch B. A prospective clinical evaluation of autogenous vein grafts used as a nerve conduit for distal sensory nerve defects of 3 cm or less / D.T. Chiu [etc.] // Plast Reconstr Surg. — 1990. — P. 928-934.
19. Walton R.L., Brown R.E., Matory W.E. Autogenous vein graft repair of digital nerve defects in the finger: a retrospective clinical study / R.L. Walton[etc.] // Plast Reconstr Surg. – 1989. – P. 944-949.
20.Pateman C. J., Harding A. J., Glen A. Nerve guides manufactured from photocurable polymers to aid peripheral nerve repair / C. J. Pateman [etc.] // Biomaterials. – 2015. — Vol. 49. – Р. 77-89.
21.Yamanaka T., Hosoi H., Murai T. Regeneration of the Nerves in the Aerial Cavity with an Artificial Nerve Conduit -Reconstruction of Chorda Tympani Nerve Gaps / T. Yamanaka [etc.] // PLOS ONE. – 2014. – Vol. 9, №4. — P. 1-7.
22. Rotshenker S. Wallerian degeneration: the innate-immune response to traumatic nerve injury / S. Rotshenker [etc.] // J Neuroinflammation. — 2011. — P. 109.
23. Wilson A.D., Hart A., Brännström T. Delayed acetyl-L-carnitine administration and its effect on sensory neuronal rescue after peripheral nerve injury / A.D. Wilson [etc.] // J Plast Reconstr Aesthet Surg. — 2007. – P. 114-118.
24. Dokkaew J. Vitamin E reduces sensory neuronal loss and improves nerve regeneration after sciatic nerve injury / J. Dokkaew [etc.] // Asian Biomed. — 2013. — P. 649-655.
25. Azizi S., Heshmatian B., Amini K. Alpha-lipoic acid loaded in chitosan conduit enhances sciatic nerve regeneration in rat / S. Azizi [etc.] // Iran J Basic Med Sci. — 2015. — Vol. 18, №3. –– Р. 229-234.
26. Leighton J., Mansukhani S., Estes L. Decalcifiied eggshell membrane, a supporting substrate for electron microscopic cross sections of monolayers of epithelial cell line MDCK / J. Leighton [etc.] // In Vitro. – 1971 – P. 251-252.
27. Ruff K.J., Winkler A., Jackson R.W. Eggshell membrane in the treatment of pain and stiffness from osteoarthritis of the knee: a randomized, multicenter, double-blind, placebo-controlled clinical study / K.J. Ruff [etc.] // Clin Rheumatol. – 2009. – P. 907-914.
28. Cordeiro C.M., Hincke M.T. Recent patents on eggshell: shell and membrane applications / C.M. Cordeiro [etc.] // Recent Pat Food Nutr Agric. – 2011. – P. 1-8.
29. Jia J., Duan Y.Y., Yu J. Preparation and immobilization of soluble eggshell membrane protein on the electrospun nanofibers to enhance cell adhesion and growth // J. Jia [etc.] // J Biomed Mater Res A. – 2008. – P. 346-373.
30. Arias J.I., Gonzalez A., Fernandez Ms. Eggshell membrane as a biodegradable bone regeneration inhibitor / J.I. Arias [etc.] // J Tissue Regen Med. – 2008, — P. 228-235.
31.Farjah Gh, Heshmatian B, Karimipour M, Saberi A. Using Eggshell Membrane as Nerve Guide Channels in Peripheral Nerve Regeneration / Gh.Farjah [etc.] // Iran J Basic Med. — 2013. Sci. Vol.16, №8. – P. 901-905.
32. United States Patent №20120150205 A1. Silk nanofiber nerve conduit and method for producing thereof.
33. United States Patent №20050013844 A1. Neural regeneration conduit.
34. Zhang J., Sheng L., Jin C. Liquid Metal as Connecting or Functional Recovery Channel for the Transected Sciatic Nerve / J. Zhang [etc.] // Beijing, China. – 2014.
http://medicalxpress.com/news/2014-04-beijing-explore-liquid-metal-reconnect.html
35. Патент РФ №2471435. Способ восстановления поврежденного нерва при дефектах на большом протяжении.
36. United States Patent №20120109167 A1. Nerve guide conduit containing carbon nanotubes.
37. United States Patent №20030176876 A1. Multi-channel bioresorbable nerve regeneration conduit and process for preparing the same.
1. Введение
Проблема лечения больных с повреждениями периферических нервов является одной из ведущих в травматологии и нейрохирургии. Нарушения целостности нервов сопровождают 3-10% от всех травм опорно-двигательного аппарата и приводят к стойкой утрате трудоспособности у 60-63% пациентов, более того, почти 80% этой группы составляют лица молодого трудоспособного возраста [1, 2]. В большинстве случаев травма нервов, вследствие специфики анатомо-топографических взаимоотношений, редко бывает изолированной [3].
Рубцовые изменения, а так же дополнительные повреждения нервов при неквалифицированном хирургическом вмешательстве, ущемления между костными отломками и другие обстоятельства приводят к возникновению большого диастаза между фрагментами поврежденного нерва. К их числу чаще относятся травмы в диафизарных отделах конечностей, где различные методы сгибания соответствующих суставов с целью уменьшения натяжения нерва при его сшивании не дают результатов [4].
Современные методы восстановления протяженных дефектов нервов, можно разделить на три большие группы, дифференцированные по виду хирургического вмешательства и особенностей его технологии:
1- Аутотрансплантация нерва;
2- Аутотрансплантация тканей для создания направления регенерации нерва;
3- Создание искусственных проводников и (или) ксенотрансплантатов для создания направления регенерации нерва
Выбор оптимального вида реконструктивного вмешательства по восстановлению непрерывности нервного ствола должен базироваться не только на величине дефекта нерва, но также учитывать совокупность факторов, среди которых локализация повреждения, способ сближения его концов и объективная оценка степени натяжения в зоне шва.
2. Аутотрансплантация нервов и тканей для создания направления регенерации нерва.
В связи с решением перечисленных вопросов разработаны многие методики, являющиеся смежными по отношению к основной теме обзора. Например, способ сшивания концов нерва, позволяющий уменьшить натяжение в зоне шва, с помощью эпиневральных лоскутов. Данный способ аутопластики дефекта нервного ствола заключается в расположении трансплантатов между концами нерва с учетом их анатомического строения, сближении и фиксации концов нерва за эпиневральные лоскуты к подлежащим тканям, а также обкладывании трансплантатов фрагментами подкожно-жировой клетчатки на сосудистой ножке [5]. Трансплантаты готовятся с помощью специальных устройств, позволяющих выделять и отсекать участки икроножного нерва с образующими его ветвями [6]. Широко применяется метод лечения повреждений нервов посредством восстановления их функций за счёт подшивания повреждённого нерва через аутотрансплантат к нормально функционирующим нервам той же части конечности [7-9].
Довольно интересной считается методика[10], по мнению авторов которой сшивание концов нерва с наложением поперечных насечек эпиневрия и периневрия в шахматном порядке или циркулярно, позволяет обеспечить зону восстановления нерва необходимыми трофическими ресурсами.
Известен способ пластики дефекта нервного ствола [11], который заключается в том, что в сосудисто-нервный комплекс с манжетой из выкроенного из подлежащей собственной фасции голени фасциально-клетчаточного островкового лоскута включают икроножный нерв с малой подкожной веной в одном блоке. Таким образом, за счет перемещения целой системы тканей в посттравматический диастаз, можно говорить о создании сложного кондуита. Данную разработку практически повторяет метод [12], в котором, как проводник используется выделенный трансплантат в виде сосудисто-нервного комплекса из икроножного нерва с малой подкожной веной в одном блоке, перенесенный в дефект нерва.
Но, не смотря на вышеперечисленные работы, при травме с дефектом длины нервных стволов, а также при реконструкции по поводу застарелых повреждений, для сближения концов требуется: 1) значительное его натяжение; 2) сгибание в смежных суставах; и как альтернатива — 3) аутонервная пластика. Частыми осложнениями аутопластики являются: натяжение нерва, приводящее к «прорезыванию швов»; сгибание в смежных суставах, вследствие которого развиваются контрактуры в послеоперационном периоде и вторичное повреждение нервов при разработке движений; ротация нервных волокон в различных плоскостях, что препятствует их обособлению в пучки. Более того, при аутонервной пластике приходится использовать нерв с другого участка тела, что приводит к излишней анестезии в зоне иннервации, формированию дополнительной полости с возможными осложнениями, а также затрате времени на хирургическое вмешательство. Все это значительно ухудшает результаты восстановления функции нервного ствола, причем регенераторный потенциал в вышеперечисленных методиках используется не полностью.[13]
3. Создание искусственных проводников и (или) ксенотрансплантатов для создания направления регенерации нерва
Одной из исследовательских работ, оказавших влияние на развитие создания искусственных проводников, на наш взгляд, может стать способ лечения повреждения периферического нерва [14], который заключается в формировании изолирующего кондуита, выполненного из тонкостенной силиконовой трубки. Длину силиконовой трубки выбирают такой, чтобы она была на 4-5 см больше размера восстановленного дефекта нервного ствола. После восстановления целостности поврежденного нерва, а именно ушивания дефекта, изолирующую муфту продвигают проксимально до перекрытия изолирующей муфтой на 4-5 см места соединения проксимального и дистального концов нерва. В данном исследовании нет указания на использование силикона, как кондуита, помещенного в диастаз посттравматического нерва для направления регенерации, но идея использования трубки из инородной ткани, как изолятор для регенерации сшитого нерва, может считаться первой ступенью на пути к дальнейшему развитию нового направления в восстановительной медицине.
Совершенно новым методом восстановления протяженных дефектов нервных стволов является замещение диастаза нерва проводником, содержащим внутреннюю среду, повторяющую естественные условия регенерации.
Одним из прорывных трудов в развитии данного направления стал “Способ восстановления нервного ствола” [15], который заключается в соединении проксимального и дистального концов повреждённого нерва с трансплантированным сосудом. С целью ускорения восстановления целостности и достижения полноты регенерации, в качестве трансплантата авторы использовали артериальный сосуд донора, заполненный гомогенатом леммоцитов. В просвет трансплантата с двух сторон вводили концы нервного ствола и соединяли биоклеем их эпиневральные оболочки с краями трансплантата. Клетки Шванна обеспечивают направленных рост регенерирующих аксонов перерезанного нерва от проксимального конца к дистальному. Они образуют, так называемые “мостики регенерации”, по которым и происходит продвижение регенераторного процесса.
В современной врачебной практике в качестве транплантата между отрезками нерва более широкое применение получили – венозные проводники [16]. Удовлетворительные функциональные результаты были получены в случае лечения дистальных чувствительных нервных дефектов до 3 мм. Выявлены несколько преимуществ использования вены, как проводника между концами пересечённого нерва (Chiu etc. 1982): базальная мембрана, которая образует эндотелий вены, богата ламинином, а адвентиция состоит в основном из коллагена; стенки вен являются достаточно упругими, чтобы действовать в качестве барьера против рубцового разрастания и имеют проницаемость, чтобы обеспечить диффузию питательных веществ внутрь (Wang etc., 1993; Tseng etc. 2003). Сторонники данного вида проводников отмечают достаточный запас для выбора венозных шунтов из многих областей тела, низкой стоимости и относительно малой степенью дополнительного повреждения в сравнении с нервными трансплантатами. Кроме того, вены неиммуногенны, практически не вызывают воспалительную реакцию, и доступны в широком разнообразии размеров. Они могут обеспечить механическую поддержку регенерирующих аксонов, предлагая защищенную биохимическую среду, вдали от окружающих тканей (Allet др., 2003).
Но венозные кондуиты имеют и существенные недостатки. В течение процесса регенерации, они оказались нестойкими, что приводило к перегибам или распадам стенки трубки [17-19]. По этой причине их использование становится невозможным при восстановлении больших промежутков диастаза нерва. Чиу с соавторами были проведены исследования, доказавшие тот факт, что вена, как проводник, может использоваться лишь при немногих травмах нервов, в частности, при диастазах длиной менее 3 мм [18].
В настоящее время развивается совершенно новое направление в восстановлении протяженных дефектов нервов, а именно создание искусственных проводников. Это направление исследований считается более перспективным, чем аутотрансплантация, поскольку их результатом станет разработка метода восстановления протяжённых повреждений нервного ствола. Исследования направлены на разработку новых возможностей при конструировании кондуита, в которые входят подборка индивидуального диаметра и анатомической формы под стать поврежденному нерву, использование биоразлагаемых материалов, применение всякого рода направляющих борозд в его стенке для более точного сопоставления нервных волокон и контроля регенераторных процессов.
Ученые Университета Шеффилда разработали и испытали метод изготовления проводника с помощью микростереолитографии. Это технология 3D-печати, позволяющая точно воссоздать микроструктуру нерва. Испытание изготовленного устройства было проведено на мышах со значительной травмой нерва: животному восстановили нервное волокно длиной около 3 мм за 21 день. Для изготовления устройства был использован полиэтиленгликоль, который одобрен для клинического использования. Материал не является биоразлагаемым, что создаёт некоторые трудности при применении данного типа кондуита. Стоит упомянуть о двух важных особенностях, а именно: наличие на внутренней поверхности стенки проводника особых насечек, которые способствуют более точному направлению нервных волокон в трубке, и свойстве данного материал проводить нервный импульс, что даёт право отнести его к биоинертным[20].
Итак, как отмечено выше, для создания направляющих кондуитов лучше всего подойдут биоразлагаемые материалы. Наиболее перспективным представляется использование коллагена, полигликолевой кислоты (ПГК) и их конгломерата.
Очень интересным не только с точки зрения конструкции кондуита, но и его содержимого является сочетание данных материалов. База трубки была изготовлена из цилиндрически тканой ПГК сетки, внешняя и внутренняя поверхности которой были покрыты аморфным слоем коллагена. Просвет трубки был наполнен 3D-губчатой коллагеновой матрицей. Губчатый коллаген обеспечивает благоприятную микросреду для восстановления нерва (регенерации аксонов, клеточной пролиферации и заживления тканей). Несмотря на то, что коллаген имеет тенденцию растворяться в организме, ПГК-кондуит позволяет сохранять его форму в течение достаточно долгого времени для полной регенерации нерва.
ПГК-коллаген трубка была 30 мм в длину и 0,7 мм в диаметре, что позволило перекрыть дефект нерва с небольшим запасом для наложения эпиневральных швов нерв-кондуит.[21]
Как было сказано выше, коллаген является хорошим материалом не только для создания направляющей трубки при повреждениях нерва, но и искусственных условий регенерации нервной ткани, т.е. внутренней среды для кондуита. Кроме него целесообразным считается использование альфа-липоевой кислоты(АЛК).
Известно, что повреждение нерва связано с окислительным стрессом. Увеличение уровня свободных радикалов кислорода и снижение деятельности ферментов антиоксидантной защиты наблюдаются после травмы нерва. Антиоксиданты, такие как ацетил-L-карнитин, витамин Е, АЛК успешно используются в лечении экспериментального пересечения нерва. Однако, эффект АЛК в регенерации периферических нервов до конца не выяснены.[22-24]
Совсем недавно исследовали два совершенно новых материала для создания кондуитов. Это хитозан и мембрана яичной скорлупы.
Хитозан – это аминосахар, производное линейного полисахарида, одним из источников получения которого служат панцири ракообразных. Успешным применением данного материала служит исследование с заполнением просвета хитозанового проводника альфа-липоевой кислотой (обоснование её использования указаны выше)[25].
Мембрана яичной скорлупы оказалась невероятно подходящим материалом для формирования трубки. Путём многократной обработки яичной скорлупы: сделав отверстие в скорлупе, вынуть содержимое; промыть изнутри, погрузить в 5% уксусную кислоту на 8 дней, далее в фосфатно-солевой буфер ph 7.4 на 30 минут; надеть на тефлоновую трубку; высушить 37 градусов 24 часа в стерильном ламинарном боксе; [26] была получена тонкая пленка. Данная мембрана сохраняет белок и предотвращает проникновение бактерий. Мембрана яичной скорлупы является естественным источником комбинированных глюкозамина, хондроитина и гиалуроновой кислоты, [27] имеют высокое содержание биологически активных компонентов, а также способности к удержанию влаги, которые имеют потенциальную пользу.[28] Мембрана яичной скорлупы является нетоксичной [29] и биологически разлагаемой [30]. Это может иметь большой потенциал для восстановления нервов в исследованиях регенерации аксонов в периферической нервной системе [28].
Положительным результатом использования мембраны послужили следующие факты: отсутствие послеоперационных смертей, клинических признаков раневой инфекции. Операции были хорошо перенесены животными. Нет клинических признаков инфекции, болей или дискомфорта во время регенеративного периода. [31]
3.1. Кондуиты для восстановления повреждений многопучковых нервов
Развитие создания проводников из искусственных материалов привело исследователей к мысли о восстановления многопучковых нервов, например, седалищного. Идея заключается в помещении не одного кондуита, общего для всех нервных пучков, в диастаз нерва, а именно, нескольких пучковых проводников, заключенных в одну общую муфту. Также, как оказалось, вышеперечисленные материалы не являются финальной точкой в исследованиях, например, появился способ восстановления нервного ствола с помощью кондуита из шелковых нановолокон. Кондуит создавали путем электроформования волокнистого прядильного раствора в цилиндре, смазанного изнутри полиэтиленоксидом. Электроформование — это процесс создания волокон, который отличается определенной гибкостью, позволяющей задавать конечные характеристики и структуру нановолокнам под стать параметрам нервного ствола.[32]
Говоря о параметрах и структуре изготавливаемых кондуитов, нельзя не упомянуть о способе восстановления нерва с помощью кондуита, имеющего спиралевидную геометрию.[33] Регенерация при выполнении данной методики осуществляется благодаря наличию различных клеток и биовеществ на каждом из слоёв скрученного из плоского листа кондуита, что также направляет разобщенные нервные волокна.
Немного другим подходом к решению поставленной задачи воспользовались авторы способа восстановления нерва [34] с помощью установки кондуита из жидкого сплава селена, галия и индия с формированием микроканальной структуры для направленного продвижения нервных волокон. К сожалению, наличие жидкого металла в структуре нерва отрицательно сказывается на его физиологии. Учтя это, выдвинули свои методы и другие группы ученых. Итогом исследований стало создание способа восстановления поврежденного нерва при дефектах на большом протяжении.[35] Восстановление происходит путём имплантации электропроводящих элементов из металла или полимерного токопроводящего материала, которые вводят в пучок нерва на 3-4 мм в оба конца диастаза нерва, далее весь диастаз укрывают кондуитом. Данная разработка чем-то напоминает взгляды на регенерацию нерва китайских исследователей, но использование кондуита выводит разработку российских авторов на качественно новый уровень.
На наш взгляд, способ восстановления нервного волокна [36], который заключается в создании проводника, имеющего две поверхности: внешнюю – силиконовую, и внутреннюю – из углеродных нанотрубок, мог бы стать вершиной восстановления нервов посредством кондуитов, но способ восстановления нервного ствола [37], который заключается в создании кондуита из пористого многоканального биоразлагаемого кондуита, помещаемого вместо диастаза нерва, внес свою весомую лепту в историю развития проводников между проксимальными и дистальными концами поврежденных нервов. По нашему мнению, данная форма кондуита универсальна и наиболее физиологична для восстановления нервного ствола. Остается только подобрать нужную ткань для его создания.
Безусловно, направление каждого пучка отдельно от других является наиболее верным методом восстановления повреждённого нерва и, определенно, через некоторое время он вытеснит все вышеперечисленные варианты использования регенераторного потенциала нерва.
Заключение
Итого, регенераторный потенциал нервного волокна можно использовать в искусственной среде, направляя и стимулируя его процессы.
В дальнейшем, технологию восстановления протяженных дефектов нервов с помощью биоразлагаемого кондуита можно направить и на восстановление спинного мозга, а, возможно, и — головного. К примеру, одно из самых частых осложнений при операции по удалению менингиомы — доброкачественной опухоли головного мозга, является повреждение обонятельного нерва, проходящего вблизи опухоли. При успехе данного метода, можно свести на нет один из рисков данной операции. И это лишь один из многих примеров прямого участия данного способа восстановления нервов.
В заключении хотелось бы сказать, что данная методика восстановления протяженных дефектов нервных волокон является прорывом в современной медицине и может найти широкое применение не только в нейрохирургии, но и травматологии, трансплантологии и других отраслях медицины
Библиографическая ссылка
Тутуров А.О. СОВРЕМЕННЫЕ ТЕНДЕНЦИИ В ВОССТАНОВЛЕНИИ ПРОТЯЖЁННЫХ ДЕФЕКТОВ НЕРВОВ. РАЗВИТИЕ ТЕХНОЛОГИЙ ИСПОЛЬЗОВАНИЯ РЕГЕНЕРАТОРНОГО ПОТЕНЦИАЛА НЕРВНЫХ ВОЛОКОН, ИХ СУЩНОСТЬ, НЕДОСТАТКИ И ПРЕИМУЩЕСТВА. // Международный студенческий научный вестник. – 2017. – № 1.
;
URL: https://eduherald.ru/ru/article/view?id=16825 (дата обращения: 03.04.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)


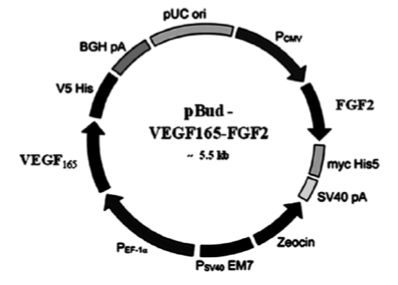
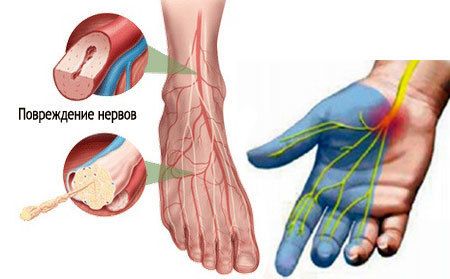
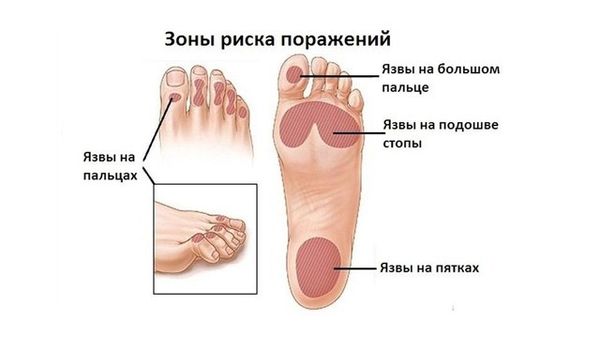
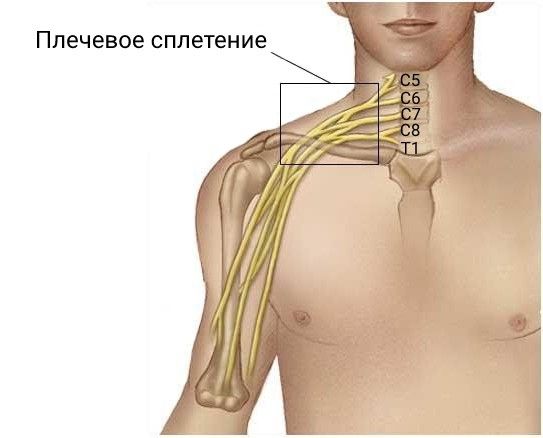
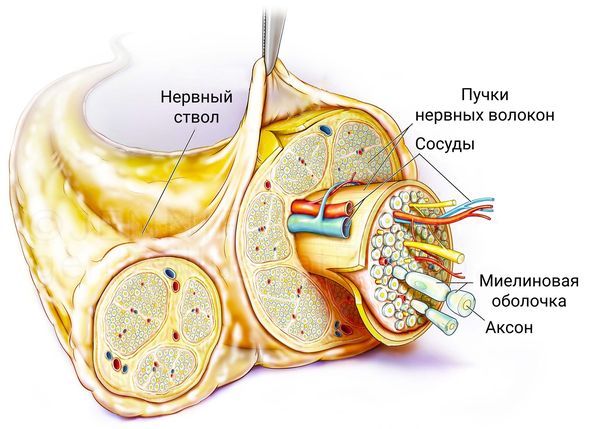
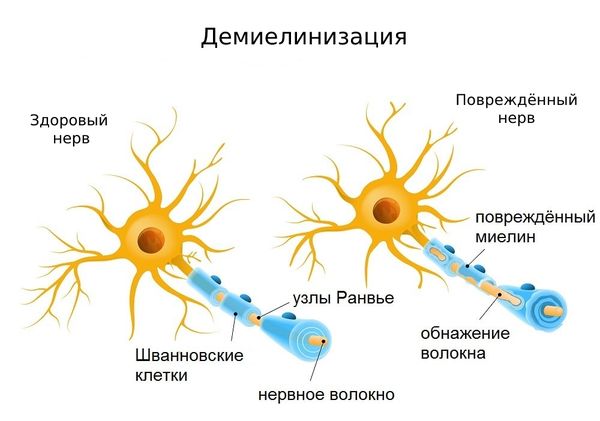
![Диабетическая стопа [16] Диабетическая стопа [16]](https://probolezny.ru/media/bolezny/perifericheskaya-nyayropatiya/diabeticheskaya-stopa-16_s_Xk5wOOg.jpeg)
![Когтеообразная кисть [17] Когтеообразная кисть [17]](https://probolezny.ru/media/bolezny/perifericheskaya-nyayropatiya/kogteoobraznaya-kist-17_s.jpeg)